58
Lampiran 3. Gambar Tanaman Pepaya dan Daun Pepaya
Tanaman pepaya
59
60
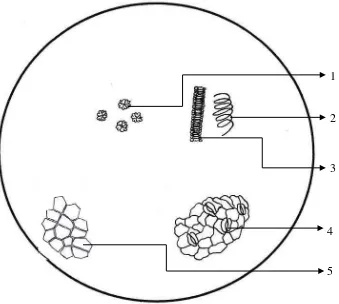
Lampiran 4. Hasil Pemeriksaan Mikroskopik Serbuk Simplisia Daun Pepaya
1
2
3
4
5
Gambar Mikroskopik Serbuk Simplisia Daun Pepaya
(pembesaran 10 x 40)
Keterangan :
1. Kristal kalsium oksalat bentuk roset
2. Berkas pengangkut dengan penebalan spiral 3. Berkas pengangkut dengan penebalan tangga 4. Stomata tipe anomositik
61 Skrining Fitokimia Daun Pepaya
Daun pepaya
Skrining fitokimia karakterisasi
Simplisia daun pepaya
Di cuci dari pengotor sampai bersih Ditiriskan
Ditimbang berat basahnya
Dirajang dan dikeringkan dalam lemari pengering
Ditimbang berat keringnya
Dihaluskan dengan blender
Disimpan dalam wadah yangtertutup rapat sebelum digunakan
- Penetapan kadar air - Penetapan kadar sari larut
air
- Penetapan kadar sari larut etanol
- Penetapan kadar abu total - Penetapan kadar abu tidak
larut asam
7. Pemeriksaan glikosida 8. Pemeriksaan flavonoid 9. Pemeriksaan alkaloid 10.Pemeriksaan saponin 11.Pemeriksaan tanin
12.Pemeriksaan steroid/triterpenoid Serbuk simplisia
62
Dicuci ampas dengan etanol 96% Disaring dengan kertas saring hingga diperoleh 100 bagian Dimasukkan ke dalam sebuah bejana Ditambahkan pelarut etanol 96% sebanyak 75 bagian
Direndam selama 5 hari terlindung dari cahaya, sambil sering diaduk
Disaring dengan kertas saring
Dipindahkan kedalam bejana tertutup Dibiarkan ditempat sejuk dan terlindung cahaya selama 2 hari
Dienap tuangkan atau saring
Dipekatkan dengan rotary evaporator pada suhu 40o C dan dikeringkan dengan
hairdryer
Lampiran 6. Bagan Alur Pembuatan Ekstrak EtanolDaun Pepaya
maserat I
Serbuk simplisia daun pepaya
ampas
maserat II
maserat
63
Dikondisikan selama 2 minggu untuk adaptasi Ditimbang dan ditandai dengan spidol
Dipuasakan selama 10 – 16 jam hanya diberi air minum
Dimasukkan ke dalam restrainer untuk menahan ekor
Dibersihkan dengan alkohol
Diambil darah dari pembuluh vena dengan cara digunting
Disentuhkan pada test strip pada alat glukometer Dilihat angka yang tertera pada alat glukotest
Kadar glukosa darah puasa pada
64
Dikondisikan selama 2 minggu untuk adaptasi Ditimbang dan ditandai dengan spidol
Dipuasakan selama 10 – 16 jam hanya diberi air minum
Diberikan perlakuan selama 2 minngu dihitung dari hari ke- 3
Kelompok 1 : Na-CMC 0,5 %
Kelompok 2 : Ekstrak Etanol Daun Pepaya 200 mg/kgBB Kelompok 3 : Ekstrak Etanol Daun Pepaya 400 mg/kgBB Kelompok 4 : Ekstrak Etanol Daun Pepaya 600 mg/kgBB Kelompok 5 : Metformin 45 mg/kgBB
Diukur KGD pada hari ke- 3, 5, 7, 9, 11,13 dan 15.
Lampiran 8. Bagan Alur Pengujian Efek Penurunan KGD Tikus yang Diinduksi Aloksan
Kadar glukosa darah Tikus
65
Glucometer (GlucoDrTM)
Wadah strip GlucoDrTM Glucotest strip (GlucoDrTM strip test)
66
Lampiran 10. Perhitungan Hasil Penetapan Kadar Air Serbuk Simplisia Daun Pepaya
Kadar air = volume air (ml)
berat sampel (g)
x
100%1. Sampel 1
Berat sampel = 5,009 g Volume air = 0,2 ml Kadar air = 0,2
5,009x100%
= 3,993 % 2. Sampel 2
Berat sampel = 5,002 g Volume air = 0,2 ml Kadar air = 0,2
5,002
x100%
= 3,998 % 3. Sampel 3
Berat sampel = 5,005 g Volume air = 0,2 ml Kadar air = 0,2
5,005 x100%
= 3,996 %
Kadar air rata – rata = 3,993%+3,998%+3,996%
3
67
2. Kadar sari yang larut dalam air II
Berat cawan = 43,2787 g
Berat cawan + berat sari = 43,5861 g
Berat sampel = 5,0007 g
Berat sari = 0,3074 g
Kadar sariyang larut dalam air = 0,3074
5,0007
x
10020
x 100% = 30,735 %
3. Kadar sari larut dalam air III
Berat cawan = 37,6660 g Kadar sari yang larutdalam air = berat sari
berat simplisia
x
100
68
Lampiran 12. Perhitungan Hasil Penetapan Kadar Sari Larut Etanol Serbuk Simplisia Daun Pepaya
1. Kadar sarilarut etanol I
Berat cawan = 43,1006 g
Berat cawan + Berat Sari = 43,267 g
Berat sampel = 5,0009 g
Berat sari = 0,1664 g Kadar sari larut etanol = 0,1664
5,0009
x
10020
x
100%= 16,637 %
2. Kadar sari larutetanol II
Berat cawan = 45,1668g
3. Kadar sari larut etanol III
Berat cawan = 43,0914 g
Berat cawan + Berat Sari = 43,2446 g
Berat sampel = 5,0006 g
Berat sari = 0,1532 g Kadar sari larut etanol =0,1532
5,0006
x
Kadar sari larut etanol=
berat sariberat simplisia
x
10069 Daun Pepaya
1. Kadar abu total I
Berat kurs kosong = 41,1931 g Berat kurs setelah dipijar = 41,4233 g
Berat sampel = 2,007 g
Berat abu = 0,2302 g
Kadar abu total = 0,2302 g
2,007 g x 100%
= 11,469 %
2. Kadar abu total II
Berat kurs kosong = 38,7767 g Berat kurs setelah dipijar = 39,0197 g
Berat sampel = 2,005 g
Berat abu = 0,2430 g
Kadar abu total = 0,2430 g
2,005 gx 100%
= 12,119 %
3. Kadar abu total III
Berat kurs kosong = 41,134 g Berat kurs setelah dipijar = 41,3681 g
Berat sampel = 2,006 g
Berat abu = 0,2341 g
Kadar abu total = 0,2341 g
2,006 g x 100%
= 11,669 %
Kadar abu total rata-rata = 11,469%+12,119%+11,669%
3
= 11,752 % Kadar abu total = berat abu
70
Lampiran 14. Perhitungan Hasil Penetapan Kadar Abu Tidak Larut Asam Serbuk Simplisia Daun Pepaya
Kadar abu tidak larut asam = Berat abu
Berat sampel x 100% 1. Kadar abu tidak larut asam I
Berat sampel = 2,007 g
Berat abu = 0,0174 g
Kadar abu tidak larut asam = 0,0174 g
2,007 g x 100%
= 0,866 %
2. Kadar abu tidak larut asam II
Berat sampel = 2,005 g
Berat abu = 0,0185 g
Kadar abu tidak larut asam = 0,0185 g
2,005 g x 100%
= 0,922 %
3. Kadar abu tidak larut asam III
Berat sampel = 2,006 g
Berat abu = 0,0168 g
Kadar abu tidak larut asam = 0,0168 g
2,006 g x 100%
= 0,837%
Kadar abu tidak larut asam = 0,866 %+ 0,922 %+ 0,837%
3
71
Tabel Konversi Dosis Antara Jenis Hewan Dengan Manusia (Harmita dan Radji, 2008)
1. Perhitungan Dosis Ekstrak Etanol Daun Pepaya
- Dosis suspensi ekstrak daun pepaya yang akan dibuat adalah 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bb. Berarti dosis 200 mg,
400 mg dan 600 mg tersebut diberikan untuk hewan dengan 1 kg berat badan. Karena 1
100 x 1 kg = 1
100 x 1000 g = 10 ml. Maka tiap dosis dilarutkan dalam 10,0 ml suspensi Na-CMC.
- Cara pembuatan suspensi ekstrak daun pepaya :
Timbang 200 mg, 400 mg, dan 600 mg ekstrak etanol daun pepaya, kemudian masing-masing dilarutkan dalam 10,0 ml suspensi Na-CMC. - Volume suspensi ekstrak daun pepaya yang diberika kepada tikus
adalah 1
100 x BB. Misal BB tikus = 200 g. Maka suspensi yang diberikan 1
72 2. Perhitungan Dosis Metformin
- Dosis manusia (BB = 70 kg) = 500 mg/hari (Nolte dan Karam, 2010) - Dosis tikus (BB = 200 g) = 500 mg x 0,018 x 1000 g
200 g = 45 mg/kg bb - Menurut FI edisi III, penetapan kadar tablet = 20 tablet, maka diambil
20 tablet Metformin, digerus dan ditimbang berat totalnya = 10.792 mg - Berat bahan aktif Metformin-HCl dalam 20 tablet Metformin adalah
= 500 mg/tab x 20 tab = 10.000 mg. - Serbuk tablet Metfomin yang digunakan :
45 10000 mg =
X
10792 mg X = 48,564 mg ≈ 50 mg - Cara pembuatan suspensi Metformin :
Timbang 50 mg serbuk tablet Metformin dilarutkan dalam 10,0 ml suspensi Na-CMC.
- Volume yang diberikan = 1
100 x BB Misal BB tikus = 200 g
Maka volume suspensi Metformin yang diberikan 1
100 x 200 g = 2 ml.
3. Perhitungan Dosis Glibenklamid
- Dosis manusia (BB = 70 kg) = 5 mg/hari (Nolte dan Karam, 2010) - Dosis tikus (BB = 200 g) = 5 mg x 0,018 x 1000 g
200 g = 0,45 mg/kg bb - Menurut FI edisi III, penetapan kadar tablet = 20 tablet, maka diambil
20 tablet Metformin, digerus dan ditimbang berat totalnya = 4002,5 mg - Berat bahan aktif Metformin-HCl dalam 20 tablet Metformin adalah
73 0,45
100 mg = X
4002 ,5 mg X = 18,01 mg ≈ 18 mg - Cara pembuatan suspensi Glibenklamid :
Timbang 18 mg serbuk tablet Glibenklamid dilarutkan dalam 10,0 ml suspensi Na-CMC.
- Volume yang diberikan = 1
100 x BB Misal BB tikus = 200 g
Maka volume suspensi Metformin yang diberikan 1
100 x 200 g = 2 ml.
4. Perhitungan Larutan Aloksan untuk Diinjeksi Secara Intraperitoneal (i.p) - Dosis aloksan untuk tikus = 150 mg/kg bb (i.p)
74
Lampiran 16. Data Pengukuran Kadar Glukosa Darah (KGD) Tikus Metode Induksi Aloksan 1. KGD tikus setelah pemberian suspensi Na-CMC 0,5 % b/v sebanyak 1 % bb
No Hewan
BB Hewan
KGD sebelum diinduksi
aloksan (mg/dL)
KGD setelah diinduksi
aloksan (mg/dL)
KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 173,7 98 377 303 351 423 348 327 230 259
2 166,2 93 362 485 354 334 370 219 272 206
3 163,9 98 249 551 211 329 246 449 427 200
4 155,2 95 413 437 431 381 272 296 268 474
5 154,3 88 352 459 437 344 486 398 292 228
Rata-rata 94,4 350,6 447 356,8 362,2 344,4 337,8 297,8 273,4
75
2. KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 200 mg/kg bb
No Hewan
BB Hewan
KGD sebelum diinduksi
aloksan (mg/dL)
KGD setelah diinduksi
aloksan (mg/dL)
KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 166,8 91 464 446 384 376 172 164 90 88
2 163,1 93 368 304 283 170 140 117 95 93
3 162,1 103 366 311 216 184 124 91 84 75
4 158,5 103 325 326 253 174 150 87 84 81
5 166,2 94 460 326 298 116 108 102 94 84
Rata-rata 96,8 396,6 460 286.8 204 138,8 112,2 89,4 84,2
76 Lampiran 16. (lanjutan)
3. KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 400 mg/kg bb
No Hewan
BB Hewan
KGD sebelum diinduksi
aloksan (mg/dL)
KGD setelah diinduksi
aloksan (mg/dL)
KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 171,7 83 463 422 432 265 151 116 107 106
2 164,7 81 474 345 310 251 184 172 125 120
3 165 87 350 298 209 147 118 144 119 104
4 151,2 95 321 345 245 194 120 115 117 106
5 179,5 101 398 298 303 295 185 143 129 106
Rata-rata 89,4 401,2 341,6 299,8 230,4 151,6 138 119,4 108,4
77
4. KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 600 mg/kg bb
No Hewan
BB Hewan
KGD sebelum diinduksi
aloksan (mg/dL)
KGD setelah diinduksi
aloksan (mg/dL)
KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 160 88 335 217 278 155 135 115 112 83
2 154,8 87 484 361 312 120 122 128 106 81
3 156 80 350 286 186 137 117 127 107 96
4 160 78 414 446 322 157 146 121 113 94
5 165,7 87 325 404 312 189 158 169 126 115
Rata-rata 84 381,6 342,8 282 151,6 135,6 132 112,8 93,8
78 Lampiran 16. (lanjutan)
5. KGD tikus setelah pemberian suspensi metformin 45 mg/kg bb
No Hewan
BB Hewan
KGD sebelum diinduksi
aloksan (mg/dL)
KGD setelah diinduksi
aloksan (mg/dL)
KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 160,1 93 460 389 361 230 102 99 85 82
2 167,4 95 562 387 340 206 126 113 105 102
3 158,8 98 494 429 354 330 123 126 102 99
4 160,7 88 571 452 375 352 147 102 99 77
5 159,8 95 543 499 363 413 137 119 79 75
Rata-rata 93,8 526 431,2 358,6 306,2 127 111,8 94 87
79
1. Persen penurunan KGD tikus setelah pemberian suspensi Na-CMC 0,5 % b/v sebanyak 1 % bb
No Hewan BB Hewan
Persen penurunan KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 173,7 19,62 6,89 -12,20 7,69 13,26 38,99 31,29
2 166,2 -33,97 2,20 7,73 -2,20 39,50 24,86 43,09
3 163,9 -121,28 15,26 -32,12 1,20 -80,32 -71,48 19,67
4 155,2 -5,81 -4,35 7,74 34,14 28,32 35,10 -14,76
5 154,3 -30,39 -24,14 2,27 -38,06 -13,06 17,04 35,22
Rata-rata -34,36 -0,82 -5,31 0,55 -2,45 8,90 22,90
80 Lampiran 17. (lanjutan)
2. Persen penurunan KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 200 mg/kg bb
No Hewan BB Hewan
Persen penurunan KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 166,8 3,87 17,24 18,96 62,93 64,65 80,60 81,03
2 163,1 17,39 23,09 53,80 61,95 68,20 74,18 74,72
3 162,1 15,02 40,98 49,72 66,12 75,13 77,04 79,50
4 158,5 -0,30 22,15 46,46 53,84 73,23 74,15 75,07
5 166,2 29,13 35,21 74,78 76,52 77,82 79,56 81,73
Rata-rata 13,02 27,73 48,74 64,27 71,81 77,11 78,41
81
3. Persen penurunan KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 400 mg/kg bb
No Hewan BB Hewan
Persen penurunan KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 171,7 8,85 6,69 42,76 67,38 74,94 76,88 77,10
2 164,7 27,21 34,59 47,04 61,18 63,71 73,62 74,68
3 165 14,85 40,28 58,00 66,28 58,85 66,00 70,28
4 151,2 -7,47 23,67 39,56 62,61 64,17 63,55 66,97
5 179,5 25,12 23,86 25,87 53,51 64,07 67,58 73,36
Rata-rata 13,71 25,82 42,65 62,19 65,15 69,53 72,48
82 Lampiran 17. (lanjutan)
4. Persen penurunan KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 600 mg/kg bb
No Hewan BB Hewan
KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 160 35,22 17,01 53,73 59,70 65,67 66,56 75,22
2 154,8 25,41 35,53 75,20 74,79 73,55 78,09 83,26
3 156 18,28 46,85 60,85 66,57 63,71 69,42 72,57
4 160 -7,72 22,22 62,07 64,73 70,77 72,70 77,29
5 165,7 -24,30 4,00 41,84 51,38 48,00 61,23 64,61
Rata-rata 9,37 25,12 58,74 63,43 64,34 69,60 74,59
83
5. Persen penurunan KGD tikus setelah pemberian suspensi metformin 45 mg/kg bb
No Hewan BB Hewan
Persen penurunan KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 160,1 15,43 21,52 50,00 77,82 78,47 81,52 82,17
2 167,4 31,13 39,50 63,34 77,58 79,89 81,31 81,85
3 158,8 13,15 28,34 33,19 75,10 74,49 79,35 79,95
4 160,7 20,84 34,32 38,35 74,25 82,13 82,66 86,51
5 159,8 8,10 33,14 23,94 74,76 78,08 85,45 86,18
Rata-rata 17,73 31,36 41,76 75,90 78,61 82,06 83,33
84
Lampiran 18. Data Persen Penurunan Kadar Glukosa Darah (KGD) Tikus Perbandingan Antar Kelompok Metode Induksi Aloksan 1. Persen penurunan KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 200 mg/kg bb
No Hewan BB Hewan
Persen penurunan KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 166,8 -47,19 -9,40 11,11 50,57 49,84 60,86 66,02
2 163,1 37,31 20,05 49,10 62,16 46,57 65,07 54,85
3 162,1 43,55 -2,36 44,07 49,59 79,73 80,32 62,50
4 158,5 25,40 41,29 54,33 44,85 70,60 68,65 82,91
5 166,2 28,97 31,80 66,27 77,77 74,37 67,80 63,15
Rata-rata 17,61 16,27 44,97 56,99 64,22 68,54 65,88
85
2. Persen penurunan KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 400 mg/kg bb
No Hewan BB Hewan
Persen penurunan KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 171,7 -39,27 -23,07 37,35 67,38 64,52 53,47 59,07
2 164,7 28,86 12,42 24,85 61,18 21,46 54,04 41,74
3 165 45,91 0,94 55,31 66,28 67,92 72,13 48,00
4 151,2 21,05 43,15 49,08 62,61 61,14 56,34 77,63
5 179,5 35,07 30,66 14,24 53,51 64,07 55,82 53,50
Rata-rata 18,32 12,82 36,16 62,19 55,82 58,36 55,99
86 Lampiran 18. (lanjutan)
3. Persen penurunan KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 600 mg/kg bb
No Hewan BB Hewan
Persen penurunan KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 160 28,38 20,79 63,35 61,20 64,83 51,30 67,95
2 154,8 25,56 11,86 64,07 67,02 73,55 61,02 60,67
3 156 48,09 11,84 58,35 52,43 63,71 74,94 52,00
4 160 -2,05 25,29 58,79 46,32 70,77 57,83 80,16
5 165,7 11,98 28,60 45,05 67,48 48,00 56,84 49,56
Rata-rata 22,39 19,68 57,92 58,89 64,17 60,39 62,07
87
4. Persen penurunan KGD tikus setelah pemberian suspensi metformin 45 mg/kg bb
No Hewan BB Hewan
Persen penurunan KGD setelah perlakuan (mg/dL) Hari ke-
3 5 7 9 11 13 15
1 160,1 -28,38 -2,84 83,91 70,68 69,72 63,04 68,33
2 167,4 20,20 3,95 62,13 65,94 48,40 61,39 50,48
3 158,8 22,14 -67,77 -0,30 50,00 71,93 76,11 50,50
4 160,7 -3,43 12,99 8,23 45,95 65,54 63,05 83,75
5 159,8 -8,71 16,93 -16,70 71,81 70,10 72,94 67,10
Rata-rata 0,36 -7,34 27,45 60,88 65,14 67,31 64,03
88
Lampiran 19. Data Hasil Selisih (Delta) KGD Tikus Metode Induksi Aloksan 1. KGD tikus setelah pemberian suspensi Na-CMC 0,5 % b/v sebanyak 1 % bb
No
89
2. KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 200 mg/kg bb
No
90 Lampiran 19. (lanjutan)
3. KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 400 mg/kg bb
No
91
4. KGD tikus setelah pemberian ekstrak etanol daun pepaya dosis 600 mg/kg bb
No
92 Lampiran 19. (lanjutan)
5. KGD tikus setelah pemberian suspensi metformin 45 mg/kg bb
No
93 Kel.
94
Lampiran 21. Signifikansi Persentase Penurunan KGD Rata-Rata Antar Kelompok Tikus yang Diinduksi Aloksan
Kel.
95 Kel.
Δ (Induksi
–awal)
52
DAFTAR PUSTAKA
American Diabetes Association (ADA). (2008). Diagnosis and Classification of Diabetes Mellitus. Diabetes Care, 35 (1). care.diabetesjournals.org.
Cheng, A.Y.Y., dan Fantus, G.I. (2005). Oral Antihyperglicemic Therapy for Type 2 Diabetes Mellitus. Canadian Medical Association or its Licensors. 172(2) : 213-226.
Depkes RI. (1986). Sediaan Galenik. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman. 1-2, 6-7, 12.
Depkes RI. (1989). Materia Medika Indonesia. Jilid V. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 116-117.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 322-355.
Depkes RI. (2005).Pharmaceutical Care untuk Penyakit Diabetes Mellitus. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 35-45. Depkes RI.(2010). Suplemen Farmakope Herbal Indonesia. Jakarta: Kementerian
Kesehatan Republik Indonesia. Halaman 134-136, 140, 141, 146-149. Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen
Kesehatan Republik Indonesia.Halaman 7
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan pertama. Jakarta: Departemen Kesehatan RI. Halaman 10-11, 14, 16-17. Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen
Kesehatan Republik Indonesia. Halaman 33.
Fransworth, N.R. (1966). Biologycal And Phytochemical Screening of Plants.. Chicago: Reheis Chemical Company. Journal of Pharmaceutical Science 55(3): 262-265.
Harborne, J.B. (1987). Metode Fitokimia. Penerjemah : Kosasih Padwaminata dan Iwang Soediro. Bandung : Penerbit ITB. Halaman 152.
Harmita., dan Radji, M. (2008). Buku Ajar Analisis Hayati. Edisi III. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 66.
Ismawan,B., dan Syariefa, E. (2013). 100 Plus Herbal Indonesia Bukti Ilmiah dan Racikan. Volume 11. Depok: PT. Trubus Swadaya. Halaman480-484.
53
Halaman 209.
Malviya, N., Sanjay, J., dan Sapna, M. (2010). Antidiabetic Potential of Medicina; Plants. Acta Poloniae Pharmaceutica-Drugs Research. 67(2) : 113-118, 2010.
Manaf, A. (2010). Insulin: Mekanisme Sekresi Dan Aspek Metabolisme. Editor: Sudoyo, A.W., Setiyohadi, B., Alwi, I., Simadibrata, K.M., dan Setiati S. (2010). Buku Ajar Ilmu Penyakit Dalam. Edisi keempat. Jilid ketiga. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia. Halaman 1896-1897.
Muhtadi, A., Hendriani, R., dan Mustarichie, R. (2013). Pharmacological Screening of Various Indonesian Herbals Potentially Used as Antidiabetic. International Research Journal of Pharmaceutical and Applied Science (IRJPS). 3(1) : 90-95.
Nolte, M. S., dan Karam, J. H.. (2010). Hormon Pankreas & Obat Antidiabetes. Editor: Katzung, B. G. Farmakologi Dasar dan Klinik. Jakarta: Penerbit Buku kedokteran EGC. Halaman: 704-709.
Patil, S., Shetty, S., Bhide, R., dan Narayanan, S. (2013). Evaluation of Platelet Augmentation Activity of Carica papaya Leaf Aqueous Extract in Rats. Journal of Pharmacognosy and Phytochemistry. 1(5) : 57-60, 2013.
Patil, T., Patil, S., Patil, A., dan Patil, S. (2014). Carica papaya Leaf Extracts – An Ethnomedicinal Boon.International Journal of Pharmacognosy and Phytochemical Research. 6(2) : 260-265.
Prameswari, O.M., dan Wijdanarko, S.B. (2014). Uji Efek Air Daun Pandan Wangi terhadap Penurunan Kadar Glukosa Darah dan Histopatologi Tikus Diabetes Mellitus. Jurnal Pangan dan Agrobisnis. 2(2): 16-27. Purnamasari, D. (2010). Diagnosis dan Klasifikasi Diabetes Melitus. Editor:
Sudoyo, A.W., Setiyohadi, B., Alwi, I., Simadibrata, K.M., dan Setiati S. (2010). Buku Ajar Ilmu Penyakit Dalam. Edisi keempat. Jilid ketiga. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia. Halaman 1880-1881.
Rohilla, A., dan Ali, S. (2012). Alloxan Induced Diabetes : Mechanisms and Effects. International Journal of Reseacrh in Pharmaceutical and Biomedic Sciences. 3(2) ; 819-823
54
Sagnia, B., Fedeli, D., Casetti, R., Montesano, C., Falcioni, G., dan Colizzi, V. (2014). Antioxidant and Anti-Inflammatory Activities of Extracts from Cassia alata, Eleusine indica, Eremomastax speciosa, Carica papaya and Polyscias fulva Medicinal Plants Collected in Cameroon. 9(8) : 1-10.
Sholhah, F.A., Tjandrakirana, dan Qomariyah, N. (2013). Pengaruh Pemberian Kombinasi Rebusan Biji Alpukat (Persea americana) dan Biji Pepaya (Carica papaya) terhadap Kadar Glukosa Darah Mencit. LenteraBio Berkala Ilmiah Biologi. 2(1) : 191-195.
Soegondo, S. (2010). Farmakoterapi Pada Pengendalian Glikemia Diabetes Melitus Tipe 2. Editor: Sudoyo, A.W., Setiyohadi, B., Alwi, I., Simadibrata, K.M., Setiati S. (2010). Buku Ajar Ilmu Penyakit Dalam. Edisi keempat. Jilid ketiga. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia. Halaman 1844-1890.
Sudhakar, N., dan Vidhya, R.M.T. (2014). Potential Medicinal Properties of Carica papaya Linn. International Journal of Pharmacy and Pharmacuetical Sciences. 6(2) : 168-173.
Suharmiati. (2003). Pengujian Bioaktifitas Anti Diabetes Mellitus Tumbuhan Obat.
Cermin Dunia Kedokteran. (140): 8-13.
Suyono, S. (2010). Diabetes Melitus di Indonesia. Editor: Sudoyo, A.W., Setiyohadi, B., Alwi, I., Simadibrata, K.M., Setiati S. (2010). Buku Ajar Ilmu Penyakit Dalam. Edisi keempat. Jilid ketiga. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia. Halaman 1877.
Syamsuhidayat, S. S., dan Hutapea, J. R. (2000). Inventaris Tanaman Obat Indonesia (I). Jakarta: Departemen Kesehatan dan Kesejahteraan Sosial Republik Indonesia. Halaman 51-52.
Szkudelski, T.. (2001). The Mechanism Of Alloxan And Streptozotocin Action in β Cells Of The Rat pancreas. Physiol Res 50. Halaman 536-546.
Tan, H.J., dan Rahardja, K. (2007). Obat-Obat Penting. Edisi keenam. Jakarta: PT Elex Media Komputindo. Halaman 738-749.
Tandra, H. (2015a). Diabetes Bisa Sembuh : Petunjuk Praktis Mengalahkan dan Menyembuhkan Diabetes. Jakarta: PT. Gramedia. Halaman 2.
Tandra, H. (2015b). Strategi Mengalahkan Komplikasi Diabetes dari Kepala sampai Kaki. Jakarta: PT. Gramedia. Halaman 1.
55
C.J. (2013). Effect of Extraction Condotions on Total Phenolic Compounds and Antioxidant Activities of Carica papaya Leaf Aqueous Extracts. Journal of Herbal Medicine. 3 : 104-111.
Vuong, Q.V., Hirun, S., Chuen, T.L.K., Goldsmith, C.D., Murchie, S., Bowyer, M.C., et al.(2015). Antioxidant and Anticancer Capacity of Saponin-enriched Carica papaya Leaf Extracts. International Journal of Food Science and Technology. 50 : 169-177,2015.
World Health Organization (WHO). (2014). Diabetes. Tanggal diakses 17 September
World Health Organization (WHO). (2015). Diabetes. Tanggal diakses 17 September
World Health Organization (WHO). (1998). Quality Control Methods For Medicinal Plant Materials. England: WHO. Halaman 28.
17 BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan dengan metode eksperimental yang meliputi pengumpulan sampel, identifikasi sampel, pengolahan sampel, pemeriksaan karakteristik simplisia, skrining fitokimia simplisia, pembuatan ekstrak etanol daun pepaya, penyiapan hewan percobaan, pengujian efek ekstrak etanol daun pepaya terhadap penurunan kadar glukosa darah (KGD) tikus dengan metode toleransi glukosa dan induksi aloksan. Data hasil penelitian dianalisis
dengan one way ANOVA (Analysis of variance) dan dilanjutkan dengan uji Tukey HSD untuk melihat perbedaan nyata antar perlakuan menggunakan
program SPSS (Statistical Product and Service Solution) versi 19.0. Penelitian dilakukan di Laboratorium Farmakognosi dan Laboratorium Farmakologi Fakultas Farmasi Sumatera Utara pada bulan Maret sampai dengan Agustus 2015.
3.1 Alat dan Bahan 3.1.1 Alat – alat
Alat-alat yang digunakan pada penelitian ini meliputi lemari pengering,
blender (National), oven (Memmert), neraca listrik (Mettler Toledo), neraca hewan (GW-1500), mikroskop, desikator, penangas air, rotary evaporator (Heidolph WB-2000), Glucometer (GlucoDrTM) dan Glucotest strip
(GlucoDrTM strip test), spuit, oral sonde, spatula, mortir dan stamfer,
18
Bahan yang digunakan pada penelitian ini adalah daun pepaya. Bahan kimia yang digunakan berkualitas pro analisa kecuali dinyatakan lain adalah kloral hidrat, toluen, kalium iodida, bismuth nitrat, asam nitrat, iodium, α-naftol, besi (III) klorida, timbal (II) asetat, serbuk seng, serbuk magnesium, asam asetat anhidrida, isopropanol, natrium hidroksida, asam klorida pekat, asam sulfat pekat, kloroform, n-heksan, metanol, etanol 96%, larutan fisiologis NaCl 0,9%, aloksan (Sigma Aldrich), tablet metformin (Hexapharm Jaya), tablet glibenklamid (Indofarma), Na-CMC dan air suling (teknis).
3.2 Penyiapan Sampel 3.2.1 Pengumpulan Sampel
Sampel yang digunakan adalah daun pepaya muda yang telah dipisahkan dari tangkainya. Pengumpulan sampel dilakukan secara purposif yaitu tanpa membandingkan dengan sampel dari daerah lain. Sampel diambil di Pasar 10 Tuntungan, Desa Sukarende, Kecamatan Kutalimbaru, Kabupaten Deli Serdang, Sumatera Utara.
3.2.2 Identifikasi Sampel
Identifikasi sampel daun pepaya dilakukan di Herbarium Bogo-riense, Bidang Botani Pusat Penelitian Biologi-LIPI Bogor. Hasil identitifikasi sampel dapat dilihat pada Lampiran 1, halaman 56.
3.2.3 Pengolahan Sampel
19
dipisahkan dari tangkainya, dicuci bersih di bawah air mengalir, ditiriskan, dan ditimbang berat basahnya (diperoleh berat basah sebesar 4,2 kg). Daun pepaya selanjutnya dirajang untuk mempermudah proses pengeringan
kemudian dikeringkan di lemari pengering sampai daun kering (ditandai bila diremas daun rapuh), kemudian ditimbang berat keringnya (diperoleh berat kering sebesar 1,3 kg). Simplisia yang telah kering diblender menjadi serbuk dan disimpan dalam wadah plastik yang tertutup rapat di tempat yang terlindung dari cahaya.
3.3 Pembuatan Pereaksi 3.3.1 Pereaksi Bouchardat
Larutkan 2 gram iodium P dan 4 gram kalium iodida P dalam air secukupnya hingga 100 ml (Depkes, RI., 1995).
3.3.2 Pereaksi Dragendorff
Campur 20 ml larutan bismut nitrat P 40% b/v dalam asam nitrat P dengan 50 ml larutan kalium iodida P 54,5% b/v, diamkan sampai memisah sempurna. Ambil larutan jernih dan encerkan dengan air secukupnya hingga 100 ml (Depkes, RI., 1995).
3.3.3 Pereaksi Mayer
Campurkan 60 ml larutan raksa (II) klorida P 2,266% b/v dan 10 ml
20
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N dan ditambahkan air suling hingga 100 ml (Depkes, RI., 1995).
3.3.5 Pereaksi Timbal (II) Asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air bebas karbondioksida hingga 100 ml (Depkes, RI., 1995).
3.3.6 Pereaksi Asam Klorida 2 N
Sebanyak 7,293 g asam klorida pekat diencerkan dengan air suling sampai 100 ml (Depkes, RI., 1995).
3.3.7 Pereaksi Asam Sulfat 2 N
Larutan asam sulfat pekat sebanyak 9,8 ml ditambahkan air suling sampai 100 ml (Depkes, RI., 1995).
3.3.8 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 bagian volume asam sulfat P dengan 50 bagian volume etanol 95% P. Tambahkan hati-hati 5 bagian volume asam asetat anhidrid ke dalam campuran tersebut, dinginkan (Depkes, RI., 2010).
3.3.9 Larutan Kloralhidrat
Larutkan 50 g kloralhidrat ditimbang lalu dilarutkan dalam 20 ml air suling (Depkes, RI., 2010).
3.4 Pemeriksaan Karakteristik Simplisia
21
larut dalam asam. Bagan alur pembuatan simplisia, pemeriksaan karakteristik dan skrining fitokimia daun pepaya dapat dilihat pada Lampiran 5, halaman 61.
3.4.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, warna, rasa dan ukuran dari daun pepaya.
3.4.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik untuk serbuk simplisia dilakukan sebagai berikut : sejumlah serbuk simplisia diletakkan merata di atas objek glass yang
telah ditetesi larutan kloralhidrat, ditutupi dengan kaca penutup dan dilihat di bawah mikroskop pada berbagai perbesaran.
3.4.3 Penetapan Kadar Air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi toluen). Alat terdiri dari labu alas bulat 500 ml, pendingin, tabung penyambung, tabung penerima 5 ml berskala 0,05 ml, alat penampung dan pemanas listrik. Cara kerja :
1. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, lalu didestilasi selama 2 jam. Toluen dibiarkan mendingin selama 30 menit, dan dibaca volume air pada tabung penerima dengan ketelitian 0,05 ml (WHO, 1998).
2. Penetapan kadar air simplisia
22
tetesan dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO,1998).
3.4.4 Penetapan Kadar Sari Larut Dalam Air
Sebanyak 5 g serbuk simplisia yang telah dikeringkan di udara, dimaserasi selama 24 jam dalam 100 ml air-kloroform P (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105°C sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes, RI., 1995).
3.4.5 Penetapan Kadar Sari Larut Dalam Etanol
Sebanyak 5 g serbuk simplisia serbuk simplisia yang telah dikeringkan di udara, dimaserasi selama 24 jam dalam 100 ml etanol (95%) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama dibiarkan selama
23
Kadar sari larut dalam etanol dihitung terhadap bahan yang telah dikeringkan di udara (Depkes, RI., 1995).
3.4.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk simplisia yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600oC selama 3 jam. Kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes, RI., 2010; WHO, 1998).
3.4.7 Penetapan Kadar Abu Tidak Larut Dalam Asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan dengan 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring dengan kertas saring, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bobot yang dikeringkan di udara (Depkes, RI., 2010).
3.5 Skrining Fitokimia 3.5.1 Pemeriksaan Glikosida
24
pada temperatur tidak lebih dari 50oC. Larutkan sisa dengan 2 ml metanol. Larutan tersebut digunakan untuk percobaan berikut: 0,1 ml larutan percobaan dimasukan dalam tabung reaksi dan diuapkan diatas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molisch, kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan adanya ikatan gula (reaksi Molisch) (Depkes, RI., 1995).
3.5.2 Pemeriksaan Flavonoid
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas. Filtrat yang diperoleh diambil 5 ml, ditambahkan 0,1 g serbuk magnesium, 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966). 3.5.3 Pemeriksaan Alkaloid
Serbuk simpilisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama
2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk tes alkaloid. Diambil 3 tabung reaksi, lalu ke dalamnya dimasukkan 0,5 ml filtrat. Pada masing-masing tabung reaksi :
25
Alkaloid positif jika terjadi endapan pada dua dari tiga percobaan diatas (Depkes, RI., 1995).
3.5.4 Pemeriksaan Saponin
Sebanyak 0,5 g serbuk simplisia dimasukan ke dalam tabung reaksi, ditambahkan 10 ml air panas, dinginkan kemudian dikocok kuat-kuat selama 10 detik, jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N
menunjukan adanya saponin (Depkes, RI., 1995). 3.5.5 Pemeriksaan Tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling, disaring
lalu filtratnya diencerkan dengan air suling sampai hampir tidak berwarna.
Diambil 2 ml larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1 %. Terjadi warna biru atau hijau kehitaman menunjukkan
adanya tanin (Farnsworth, 1966).
3.5.6 Pemeriksaan Steroid / Triterpenoid
Sebanyak 1 g sampel dimaserasi dengan 20 ml n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan beberapa tetes pereaksi Liebermann-Burchard. Timbulnya warna biru atau biru hijau menunjukan adanya steroid, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.6 Penyiapan Hewan Percobaan
26
terlebih dahulu tikus dikondisikan selama 2 minggu dalam kandang yang baik untuk menyesuaikan dengan lingkungannya.
3.7 Pembuatan Ekstrak Etanol Daun Pepaya (EEDP)
Serbuk simplisia diekstraksi dengan cara maserasi dengan menggunakan pelarut etanol 96%. Menurut Farmakope Indonesia edisi III, (1979) caranya adalah sebagai berikut :
Sebanyak 10 bagian (500 g) serbuk simplisia dimasukkan ke dalam sebuah bejana, dituangi dengan 75 bagian (3,75 liter) cairan penyari (etanol 96%), ditutup, dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk,
kemudian diserkai, diperas. Ampas diremaserasi dengan cairan penyari (etanol 96%) secukupnya hingga diperoleh 5 liter (100 bagian). Pindahkan ke
bejana tertutup, dibiarkan di tempat sejuk, terlindung dari cahaya selama 2 hari. Enap tuangkan atau saring. Pemekatan ekstrak dilakukan dengan alat rotary evaporator pada suhu 400C. Bagan alur pembuatan ekstrak etanol daun pepaya dapat dilihat pada Lampiran 6, halaman 62.
3.8 Pengujian Efek Penurunan Kadar Glukosa Darah 3.8.1 Pembuatan Suspensi Na-CMC 0,5%
Sebanyak 0,5 g Na-CMC 0,5% ditaburkan dalam lumpang yang berisi ± 10 ml air suling panas. Didiamkan selama 15 menit hingga diperoleh massa
27
dimasukkan ke labu tentukur 100 ml, dicukupkan volumenya dengan air suling hingga 100 ml.
3.8.2 Pembuatan Suspensi Metformin Dosis 45 mg/kg bb
Dosis metformin untuk manusia 500 mg/hari (Nolte dan Karam, 2010), maka dosis untuk tikus (BB = 200 g) dikonversikan = 500 mg x 0,018 = 9 mg.
Dosis per kg berat badan = 1000 g/200 g x 9 mg = 45 mg/kg bb. Timbang tablet metformin setara 45 mg , dimasukkan ke dalam lumpang dan ditambahkan suspensi Na-CMC 0,5% sedikit demi sedikit sambil digerus sampai homogen, volume dicukupkan hingga 10 ml. Perhitungan dosis suspensi metformin dapat dilihat pada Lampiran 15, halaman 72.
3.8.3 Pembuatan Suspensi Glibenklamid Dosis 0,45 mg/kg bb
Dosis glibenklamid untuk manusia 5 mg/hari (Nolte dan Karam, 2010), maka dosis untuk tikus (BB = 200 g) dikonversikan = 5 mg x 0,018 = 0,09 mg. Dosis per kg berat badan = 1000 g/200 g x 0,09 mg = 0,45 mg/kg bb. Timbang tablet glibenklamid setara 0,45 mg, dimasukkan dalam lumpang dan ditambahkan suspensi Na-CMC 0,5% sedikit demi sedikit sambil digerus sampai homogen, volume dicukupkan hingga 10 ml. Perhitungan dosis suspensi glibenklamid dapat dilihat pada Lampiran 15, halaman 72.
3.8.4 Pembuatan Suspensi Ekstrak Daun Pepaya (EEDP)
28
(EEDP)dapat dilihat pada Lampiran 15, halaman 71. 3.8.5 Pembuatan Larutan Aloksan 150 mg/kg bb
Aloksan monohidrat 150 mg dilarutkan dalam larutan fisiologis NaCl 0,9% b/v dalam labu tentukur 10 ml. Larutan selalu dibuat baru setiap
pengujian. Perhitungan aloksandapat dilihat pada Lampiran 15, halaman 73. 3.8.6 PenggunaanBlood Glucose Test Meter “GlucoDrTM ”
Kadar glukosa darah diukur dengan alat glucometer menggunakan tes strip yang bekerja secara enzimatis. Alat yang digunakan untuk mengukur kadar glukosa darah adalah GlucoDrTM. Glucometer ini secara otomatis akan hidup ketika test strip dimasukkan dan akan mati setelah beberapa menit test strip dicabut. GlucoDrTMcheck strip dimasukkan ke alat GlucoDrTM sehingga glucometer ini akan hidup secara otomatis, kemudian dicocokkan kode nomor
yang muncul pada layar dengan yang ada pada vial GlucoDrTMtest strip. Tes strip yang dimasukkan pada glucometer pada bagian layar akan tertera angka yang harus sesuai dengan kode vial GlucoDrTMtest strip, kemudian pada layar monitor glucometer muncul tanda siap untuk diteteskan darah. Caranya dengan
menyentuhkan darah yang keluar ke tes strip dan ditarik sendirinya melalui aksi kapiler. Ketika wadah terisi penuh oleh darah, alat mulai mengukur kadar glukosa darah.
3.8.7 Pengukuran Kadar Glukosa Darah (KGD)
29
mengambil darah tikus melalui pembuluh darah vena ekor. Darah disentuhkan pada strip test yang telah terpasang pada alat glucometer. Angka yang tampil pada layar dicatat sebagai kadar glukosa darah dalam satuan mg/dL.
3.8.8 Pengujian Aktivitas Antidiabetes Ekstrak Etanol Daun Pepaya (EEDP) dengan Metode Toleransi Glukosa
Tikus sebanyak 25 ekor dengan berat badan 150-200 g yang telah dipuasakan ditimbang berat badannya, diukur kadar glukosa darah (KGD) puasa, dikelompokkan secara acak menjadi 5 kelompok yang terdiri dari 5 ekor tikus yaitu :
Kelompok I : suspensi Na-CMC 0,5%
Kelompok II : suspensi EEDP dosis 200 mg/kg bb Kelompok III : suspensi EEDP dosis 400 mg/kg bb Kelompok IV : suspensi EEDP dosis 600 mg/kg bb
Kelompok V : suspensi glibenklamid dosis 0,45 mg/kg bb
Setiap kelompok yang telah diberikan sediaan uji, 30 menit kemudian diberikan larutan glukosa 50% dengan dosis 5 g/kg bb. Setelah pemberian glukosa dilakukan pengukuran KGD pada menit ke-30, 60, 90 dan 120 dengan menggunakan alat ukur glucometer.
3.8.9 Pengujian Aktivitas Antidiabetes Ekstrak Etanol Daun Pepaya (EEDP) dengan Metode Induksi Aloksan
Tikus yang telah digunakan pada pengujian aktivitas antidiabetes dengan metode toleransi glukosa dikondisikan selama 1 minggu terlebih dahulu. Sebelum ditentukan kadar glukosa darah puasa, tikus dipuasakan dan ditimbang berat
30
pada hari ke-3 hingga hari berikutnya hingga menunjukkan kenaikan kadar glukosa darah tikus untuk digunakan dalam pengujian. Tikus dianggap diabetes apabila kadar glukosa darah puasa ≥ 200 mg/dL dan telah dapat digunakan untuk pengujian. Selanjutnya disebut sebagai tikus diabetes.
Tikus diabetes dikelompokkan secara acak menjadi 5 kelompok yang terdiri dari 5 ekor tikus yaitu :
Kelompok I : suspensi Na-CMC 0,5%
Kelompok II : suspensi EEDP dosis 200 mg/kg bb Kelompok III : suspensi EEDP dosis 400 mg/kg bb Kelompok IV : suspensi EEDP dosis 600 mg/kg bb Kelompok V : suspensi metformin dosis 45 mg/kg bb
Kelima kelompok diberi perlakuan selama 2 minggu berturut-turut, selanjutnya pengukuran kadar glukosa darah diukur pada hari ke-3, 5, 7, 9, 11, 13, dan ke-15 menggunakan alat ukur glucometer.
3.9 Analisis Data
Data hasil penelitian dianalisis dengan one way ANOVA (Analysis of variance) dan dilanjutkan dengan uji Tukey HSD untuk melihat perbedaan
31 BAB IV
HASIL DAN PEMBAHASAN
4.1 Indentifikasi Sampel
Hasil identifikasi yang dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi LIPI-Bogor adalah sampel daun pepaya yang digunakan
sebagai bahan uji termasuk suku Caricaceae, jenis Carica papaya Linn. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1, halaman56.
4.2 Karakterisasi Simplisia 4.2.1 Pemeriksaan Makroskopik
Hasil pemeriksaan makroskopik daun pepaya yaitu daun tunggal, bentuk daun menyerupai telapak tangan menjari 5 – 9 bagian. Daun pepaya bertulang daun menjari, bagian atas daun berwarna hijau tua dan permukaan bawah berwarna hijau muda, berasa sangat pahit. Garis tengah helaian daun 25 – 75 cmHasil pemeriksaan dapat dilihat pada pada Lampiran 3, halaman 58.
4.2.2 Pemeriksaan Mikroskopik
Hasil pemeriksaan mikroskopik serbuk daun pepaya memperlihatkan adanya kristal kalsium oksalat berbentuk roset, berkas pengangkut dengan penebalan spiral, berkas pengangkut dengan penebalan tangga, dan stomata tipe anomositik. Hasil pemeriksaan dapat dilihat pada Lampiran 4, halaman 60.
4.2.3Pemeriksaan Karakteristik Serbuk Simplisia
32
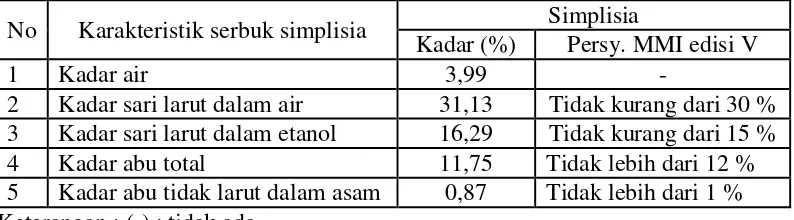
No Karakteristik serbuk simplisia Simplisia
Kadar (%) Persy. MMI edisi V
1 Kadar air 3,99 -
2 Kadar sari larut dalam air 31,13 Tidak kurang dari 30 % 3 Kadar sari larut dalam etanol 16,29 Tidak kurang dari 15 % 4 Kadar abu total 11,75 Tidak lebih dari 12 % 5 Kadar abu tidak larut dalam asam 0,87 Tidak lebih dari 1 % Keterangan : (-) : tidak ada
Hasil penetapan kadar air dari simplisia daun pepaya yaitu 3,99%, yang menunjukkan bahwa kadar air simplisia memenuhi persyaratan yaitu tidak melebihi dari 10% (Depkes, RI., 1995). Penetapan kadar air dilakukan untuk memberi batasan atau rentang besarnya kandungan air di dalam simplisia, karena tingginya kandungan air dapat mempercepat pertumbuhan jamur (Ditjen POM., 2000).
Kadar sari larut air simplisia daun pepaya 31,13% dan kadar sari larut etanol simplisia daun pepaya 16,29%. Penetapan kadar sari yang larut air untuk mengetahui kadar senyawa kimia bersifat polar yang terkandung dalam daun pepaya, sedangkan kadar sari yang larut etanol dilakukan untuk mengetahui kadar senyawa yang larut dalam etanol, baik senyawa polar maupun non polar (Depkes, 1986).
33
1998). Penetapan kadar abu pada simplisia daun pepayamenunjukkan kadar abu total sebesar 11,75% dan kadar abu tidak larut dalam asam sebesar 0,87%. Hasil perhitungan karakterisasi simplisia daun pepaya dapat dilihat pada Lampiran10, halaman 66.
4.3 Ekstraksi
Hasil ekstraksi 500 gram simplisia dengan cara maserasi menggunakan pelarut etanol 96%, bertujuan untuk mengekstraksi senyawa yang terdapat pada simplisia daun pepaya, baik bersifat polar maupun non polar, diperoleh ekstrak etanol daun pepaya sebanyak 59,43 g ( % rendemen : berat ekstrak / berat simplisia x 100%: 59,43 g /500 g x 100% : 11,88 %).
4.4 Skrining Fitokimia
Penentuan golongan senyawa kimia serbuk simplisia daun pepaya untuk mendapatkan informasi golongan senyawa metabolit sekunder yang ada didalamnya. Hasil skrining fitokimia serbuk simplisiadaun pepaya dapat dilihat pada Tabel 4.2
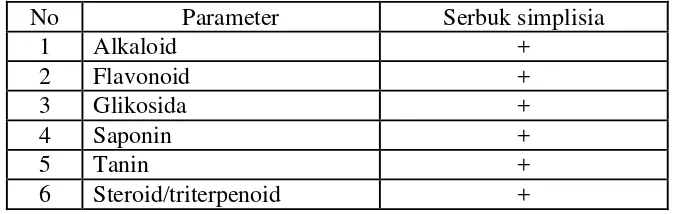
Tabel 4.2Hasil skrining fitokimia serbuk simplisiadaun pepaya
No Parameter Serbuk simplisia
1 Alkaloid +
2 Flavonoid +
3 Glikosida +
4 Saponin +
5 Tanin +
6 Steroid/triterpenoid +
Keterangan:
34
senyawa alkaloid, flavonoid, glikosida, saponin, tanin dansteroid/triterpenoid. Golongan alkaloid terindentifikasi pada serbuk simplisia ditandai dengan adanya endapan putih atau putih kekuningan setelah ditambahkan pereaksi Mayer, endapan cokelat-cokelat kehitaman setelah ditambahkan pereaksi Bouchardat dan endapan kuning jingga setelah ditambahkan pereaksi Dragendroff (Depkes, RI., 1995). Steroid/triterpenoid memberikan hasil positifdenganterbentuknya warna hijau biru setelah ditambahkan pereaksi Liebermann-Burchard (Harborne, 1987). Golongan flavonoid memberikan hasil yang positif ditandai dengan penambahan serbuk magnesium dengan HCl pekat terjadi warna kuning atau jingga. Uji identifikasi tanin menunjukkan hasil positif dengan penambahan pereaksi FeCl3
1% terjadi warna biru kehitaman (Farnsworth, 1966). Adanya glikosida ditandai terbentuknya cincin ungu dengan pereaksi Molisch. Pada uji identifikasi saponin memberikan hasil positif dengan terbentuknya busa setelah dikocok kuat-kuat selama 10 menit dan dengan penambahan1 tetes HCl 2N buih/busa tidak hilang (Depkes, RI., 1995).
4.5 Pengujian Aktivitas Antidiabetes Ekstrak Etanol Daun Pepaya (EEDP) Pada penelitian ini menggunakan tikus jantan yang telah dilakukan uji
orientasi penurunan KGD dengan pemberian EEDP dosis 100 mg/kg bb, 200 mg/kg bb, 400 mg/kg bb, 600 mg/kg bb, 800 mg/kg bb dan 1000 mg/kg bb.
35
bermakna. Dengan demikian ditetapkan dosis untuk pengujian selanjutnya digunakan EEDP dosis 200 mg/kg bb, 400 mg/kg bb, dan 600 mg/kg bb.
4.5.1 Pengujian Aktivitas Antidiabetes dengan Metode Uji Toleransi Glukosa Sebelum percobaan dilakukan, tikus dipuasakan (tidak diberi makan tetapi
tetap diberi minum) selama 10-16 jam, lalu ditimbang berat badan tikus masing-masing dan diberi tanda pada ekor. Kemudian masing-masing tikus diukur
KGD puasa tikus menggunakan alat glucometerGlucoDrTMuntuk mengetahui KGD awal.
36 Kelompok Uji
Rata- rata % penurunan KGD (mg/dL) ± SEM Menit
* : berbeda signifikan dengan kelompok Glibenklamid # : berbeda signifikan dengan kelompok Na-CMC
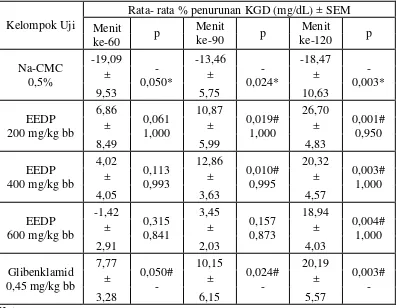
Ekstrak etanol daun pepaya dosis 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bb menunjukkan penurunan KGD dimulai dari menit ke- 60, 90 dan 120 jika dibandingkan dengan kelompok kontrol Na-CMC. Hasil analisis persentase penurunan KGD menunjukkan bahwa pemberian EEDP dosis 200 mg/kg bb dan 400 mg/kg bb menunjukkan perbedaan yang signifikan pada menit ke-90 dan 120
jika dibandingkan dengan kelompok kontrol Na-CMC 0,5%, p = 0,019 dan p = 0,010. Pemberian EEDP dosis 600 mg/kg bb menunjukkan perbedaan yang
signifikan pada menit ke-120 jika dibandingkan dengan kelompok kontrol Na-CMC 0,5%, p = 0,004. Berdasarkan hasil analisis semua sediaan uji dan
37
0,05 yang menunjukkan terdapat perbedaan yang signifikan antara kelompok uji dengan kelompok kontrol. Hasil analisis juga menunjukkan bahwa pemberian EEDP dosis 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bb tidak terdapat perbedaan persentase penurunan KGD yang signifikan dengan nilai signifikan berturut-turut 0,095; 1,000 dan 1,000atau memiliki efek yang sama dengan kelompok pembanding glibenklamid dosis 0,45 mg/kg bb. Berdasarkan hasil tersebut maka EEDP dosis 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bb menunjukkan aktivitas antidiabetes.
4.5.2 Pengujian Aktivitas Antidiabetes Ekstrak Etanol Daun Pepaya (EEDP) dengan Metode Induksi Aloksan
Tikus uji dikelompokkan secara acak menjadi 5 kelompok perlakuan yang terdiri dari 5 ekor tikus dan diberi perlakuan secara oral yaitu kelompok kontrol yang diberi suspensi Na-CMC 0,5%, kelompok uji dengan 3 variasi dosis perlakuan yaitu suspensi EEDP dosis 200 mg/kg bb, EEDP 400 mg/kg bb, EEDP 600 mg/kg bb, dan suspensi metformin dosis 45 mg/kg bb.
Sebelum pengujian dilakukan, tikus dipuasakan (tidak diberi makan tetapi tetap diberi minum) selama 10-16 jam, lalu ditimbang berat badan tikus masing-masing dan diberi tanda pada ekor. Kemudian masing-masing-masing-masing tikus diukur KGD puasa tikus menggunakan alat glucometerGlucoDrTMuntuk mengetahui KGD awal.
38 aloksan dosis 150 mg/kg bb
Hasil tes homogenitas diperoleh nilai signifikan (0,057) pada α : 0,05 yang menunjukkan tidak terdapat perbedaan yang signifikan di antara kelompok kontrol, kelompok uji dan kelompok pembanding. Hal ini menunjukkan bahwa hewan coba yang digunakan dalam kondisi fisiologis yang homogen, yakni dalam kadar glukosa darah normal sehingga dapat digunakan sebagai hewan uji.
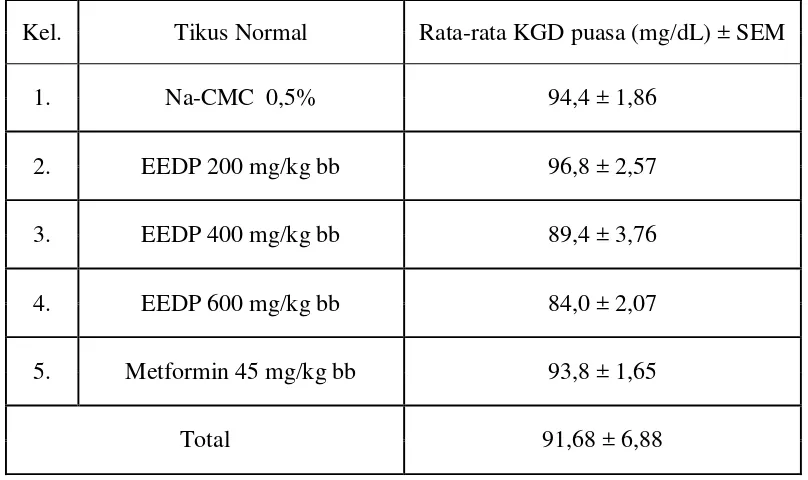
Tikus diinduksi dengan aloksan dosis 150 mg/kg bb secara intraperitoneal, diamati tingkah laku dan bobot badan, serta diukur KGD pada hari ke-3 hingga hari berikutnya sampai menunjukkan kenaikan KGD dan tikus mulai dapat mulai digunakan dalam pengujian. Tikus yang telah memiliki KGD ≥ 200 mg/dL disebut tikus diabetes Hasil rata-rata dari peningkatan KGD ditunjukkan pada Tabel 4.5
Kel. Tikus Normal Rata-rata KGD puasa (mg/dL) ± SEM
1. Na-CMC 0,5% 94,4 ± 1,86
2. EEDP 200 mg/kg bb 96,8 ± 2,57
3. EEDP 400 mg/kg bb 89,4 ± 3,76
4. EEDP 600 mg/kg bb 84,0 ± 2,07
5. Metformin 45 mg/kg bb 93,8 ± 1,65
39
Tabel 4.5 Hasil pengukuran KGDtikus rata-rata setelah diinduksi aloksan dosis 150 mg/kg bb
Kel. Tikus Normal Rata-rata KGD puasa (mg/dL) ± SEM
1. Na-CMC 0,5% b/v 350,6 ± 27,42
2. EEDP 200 mg/kg bb 396,6 ± 27,78
3. EEDP 400 mg/kg bb 401,2 ± 30,15
4. EEDP 600 mg/kg bb 381,6 ± 29,92
5. Metformin 45 mg/kg bb 526,0 ± 21,20
Total 411,0 ± 16,62
Berdasarkan Tabel 4.5 terlihat bahwa pemberian aloksan dosis 150 mg/kg bb untuk semua hewan percobaan menghasilkan kadar glukosa darah rata-rata 411,0 mg/dL. Hasil tes homogenitas diperoleh p = 0,858 pada α : 0,05 yang menunjukkan tidak terdapat perbedaan yang signifikan di antara kelompok kontrol, kelompok uji dan kelompok pembanding. Hal ini menunjukkan bahwa hewan coba yang digunakan dalam kondisi fisiologis yang homogen, yakni tikus sudah dalam kondisi diabetes sehingga dapat digunakan sebagai hewan uji. Pemberian perlakuan dimulai setelah tikus positif diabetes (hari ke-1), setiap hari diberi sediaan uji selama 2 minggu, dan dilakukan pengukuran KGD pada hari ke-3, 5, 7, 9, 11, 1ke-3, dan 15.
40
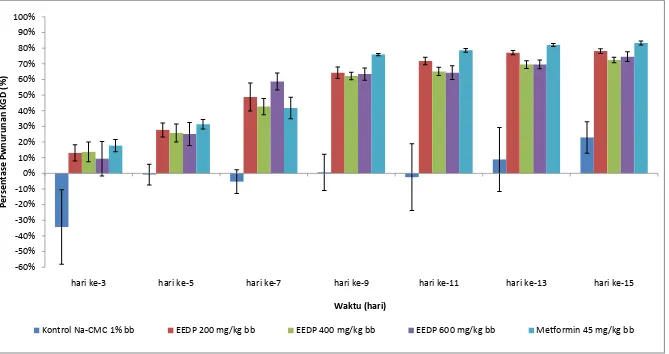
persentase penurunan KGD rata-rata antar individu tikus setelah diinduksi aloksandapat dilihat pada Tabel 4.6dan Gambar 4.1.
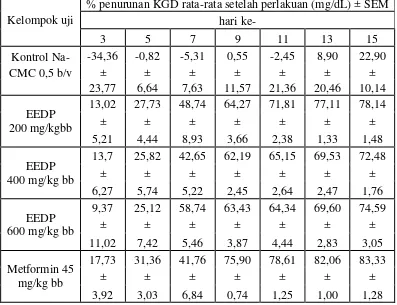
Tabel 4.6 Hasil persentase penurunan KGD rata-rata antar individu tikus setelah diinduksi aloksan
Kelompok uji
% penurunan KGD rata-rata setelah perlakuan (mg/dL) ± SEM hari ke-
41
kelompok kontrol yang hanya diberikan Na-CMC 0,5%.Hasil analisis statistik penurunan KGD sudah menunjukkan perbedaan yang signifikan mulai hari ke-5 dan terjadi sampai hari ke-15 jika dibandingkan kelompok Na-CMC.Pada hari ke-15, EEDP dosis 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bb menunjukkan penurunan KGDdengan masing-masing persentase penurunan yaitu 78,14%; 72,48% dan 74,59 %. Berdasarkan hasil analisis statistik pada hari ke-15, EEDP dosis 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bb menunjukkan perbedaan yang signifikan dengan nilai signifikan ketiganya 0,000 dibandingkan dengan hewan kelompok kontrol yang diberi Na-CMC 0,5%.Hal ini menyatakan bahwa terjadi perbedaan penurunan KGD yang signifikan antara kelompok yang diberi EEDP dan yang hanya diberi Na-CMC.
42
Gambar 4.1 Grafik hasil presentase penurunan KGD rata-rata antar individu tikus setelah diinduksi aloksan
-60%
hari ke-3 hari ke-5 hari ke-7 hari ke-9 hari ke-11 hari ke-13 hari ke-15
P
43
Data KGD (mg/dL) pada masing-masing tikus pada semua kelompok perlakuan juga dilakukan perhitungan persen penurunan KGD antar kelompok, kemudian dianalisis secara statistik menggunakan ANOVA lalu dilanjutkan uji Post Hoc Tukey HSD untuk melihat perbedaan nyataantar perlakuaan. Hasil
persentase penurunan KGD rata-rata tikus antar kelompok tikus setelah diinduksi aloksandapat dilihat pada Tabel 4.7dan Gambar 4.2.
Tabel 4.7 Hasil persentase penurunan KGD rata-rata antar kelompok tikus setelah diinduksi aloksan
Kelompok uji
% penurunan KGD rata-rata setelah perlakuan (mg/dL) ± SEM
44
45
Gambar 4.2 Grafik hasil persentase penurunan KGD rata-rata antar kelompok tikus setelah diinduksi aloksan
-30%
hari ke-3 hari ke-5 hari ke-7 hari ke-9 hari ke-11 hari ke-13 hari ke-15
P
46
perlakuan juga dilakukan perhitungan delta (selisih) KGD setelah diinduksi dikurangi dengann KGD awal, kemudian dianalisis secara statistik menggunakan ANOVA lalu dilanjutkan uji Post Hoc Tukey HSD untuk melihat perbedaan nyataantar perlakuaan. Hasil delta (selisih) KGD rata-rata tikus tikus setelah diinduksi aloksandapat dilihat pada Tabel 4.8 dan Gambar 4.3.
Tabel 4.8 Hasil selisih (delta) KGD rata-rata tikus setelah diinduksi aloksan
Kel
Δ (Induksi
-awal)
KGD setelah perlakuan (mg/dL) ± SEM
47
Gambar 4.3 Grafik hasil selisih (delta) KGD rata-rata tikus setelah diinduksi aloksan
-100 0 100 200 300 400 500
Δ (Induksi-awal) Δ (hari 3-awal) Δ (hari 5-awal) Δ (hari 7-awal) Δ (hari 9-awal) Δ (hari 11-awal) Δ (hari 13-awal) Δ (hari 15-awal)
K
G
D (
m
g/
d
L)
Waktu (hari)
48
dengan KGD awal pada kelompok tikus yang diberi suspensi Na-CMC 0,5%menunjukkan KGD yang tinggi sampai hari ke-15 dibandingkan kelompok yang diberi EEDP dan metformin. Hasil analisa statistik selisih (delta) KGD tikus pada kelompok 200 mg/kg bb, dan 400 mg/kg bb menunjukkan perbedaan yang signifikan dibandingkan selisih (delta) KGD tikus pada kelompok diberi Na-CMC pada hari ke- 7, p = 0,011 dan p =0,011. Pada hari ke-9, seluruh tikus yang diberi EEDP 200 mg/kg bb, 400 mg/kg bb, 600 mg/kg bb dan metformin 45 mg/kg bb dengan nilai signifikan ketiganya 0,000 menunjukkan perbedaan selisih (delta) KGD yang signifikan dibandingkan tikus pada kelompok yang diberi Na-CMC 0,5% dosis1 % bb. Hasil analisa statistik menunjukkan perbedaan selisih (delta) KGD yang signifikan mulai dari hari ke- 7 sampai hari ke-15 pada semua tikus yang diberi EEDP dan metformindibanding tikus pada kelompok yang hanya diberi Na-CMC.
Pada hari ke-15, EEDP dosis 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bb menunjukkanpenurunan yaitu -12,6% , 19% dan 9,8%. Hasil analisis statistik persentasepenurunan KGDpada hari ke-15,EEDP dosis 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bb dengan nilai signifikan ketiganya 0,000menunjukkan perbedaan signifikan dibandingkan dengan kelompok kontroldibandingkan dengan hewan kelompok kontrol yang diberi Na-CMC 0,5%. Hal ini menyatakan bahwa pemberian EEDP dosis 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bbmempunyai efek dapat menurunkan KGD tikus yang diinduksi aloksan.
49
yang diberi EEDP 400 mg/kg bb dan 600 mg/kg bb. Hasil analisa statistik dengan nilai signifikanberturut-turut 0,102; 0,405; dan 0,037 menunjukkan tidak adanya perbedaan yang signifikanselisih (delta) KGD tikus pada kelompok yang diberi EDDP 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bb. Peningkatan pemberian dosis EEDP belum dapat menunjukkan peningkatann efek penurunan KGD tikus yang diinduksi aloksan. Peningkatan dosis obat seharusnya akan meningkatkan respon sebanding dengan dosis yang ditingkatkan. Namun, peningkatan dosis menyebabkan menurunnya peningkatan respon. Hal ini terjadi karena sudah tercapainya dosis obat yang tidak dapat meningkatkan respon (Zastrow, 2001).
Grafik 4.3 menunjukkan pada hari ke-15, selisih (delta) KGD tidak terlihat pada kelompok yang diberi EEDP dosis 200 mg/kg bb, 600 mg/kg bb dan metformin dosis 45 mg/kg bb. Pada hari ke-15, Grafik 3.3 hanya menunjukkan selisih (delta) KGD pada kelompok yang diberi Na-CMC dan EEDP 400 mg/kg bb. Hasil analisa statistik dengan nilai signifikan 0,102; 0,405; dan 0,037 menunjukkan tidak terdapat perbedaan yang signifikan di antara kelompok yang diberi EEDP 200, 400 dan 600 mg/kg bb. Hal ini menunjukkan bahwa pemberian EEDP 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kg bbpada tikus yang diinduksi aloksan memberikan efek penurunan KGD seperti ditunjukkan pada tikus kelompok yang diberi metformin dosis 45 mg/kg bb.Nilai signifikan hasil selisih (delta) KGD rata-rata tikus dapat dilihat padaLampiran 22, halaman 95.
50
superoxidase radicals penghasil radikal bebas dan juga meningkatkan konsentrasi
ion Ca2+ di sel beta sehingga menyebabkan kerusakan sel beta pulau pankreas (Rohilla dan Ali, 2012). Ekstrak etanol daun pepaya yang kaya akan saponin menunjukkan aktivitas antioksidan dan penangkal radikal bebas (Vuong, et al., 2015). Penelitian terdahulu juga menunjukkan senyawa kimia seperti alkaloid, saponin, tanin dan flavonoid berpotensi sebagai antioksidan (Sagnia, et al., 2014).Aktivitas antioksidan dapat menurunkan oxidative stress yang terjadi pada penyakit diabetes. Dengan demikian efek antidiabetes dari ekstrak daun pepaya disebabkan adanya senyawa kimia yang bertanggungjawab sebagai aktivitas antioksidan (Rojop, et al., 2012).
51 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa :
a. golongan senyawa kimia yang terdapat pada simplisia daun pepaya menunjukkan adanya alkaloid, glikosida, flavonoid, saponin, tanin, dan steroid /triterpenoid.
b. karakteristik simplisia daun pepaya memenuhi persyaratan yang tertera pada Materia Medika Indonesia edisi V.
c. ekstrak etanol daun pepaya dosis 200 mg/kg bb, 400 mg/kg bb dan 600 mg/kgbb dapat menurunkan kadar glukosa darah tikus yang diinduksi
aloksan dengan masing- masing persentase penurunan yaitu 78,14%, 72,48%, 74,59 % dan menunjukkan perbedaansignifikan terhadap Na-CMC 0,5% dengan nilai signifikan ketiganya 0,000.
5.2 Saran
6
TINJAUAN PUSTAKA
2.1 Uraian Tanaman
Pepaya adalah tanaman asli Meksiko dan Amerika Tengah, tumbuh di daerah hangat, berlimpah cahaya matahari dan terlindung dari angin hingga
ketinggian 1.500 m di atas permukaan laut. Tanaman ini kemudian menyebar ke belahan dunia lain, termasuk Indonesia. Tanaman pepaya membentuk pohon kecil setinggi 2-10 m. Bentuk batang bulat berongga, tegak lurus dan tidak bercabang. Daun tunggal, bulat, ujung runcing, tepi bergerigi, diameter 25-75 cm, pertulangan menjari, panjang tangkai 25-100 cm. Pepaya termasuk tanaman monoecious atau dioecious, ada yang berumah tunggal dan berumah dua. Jika bunga jantan dan betina berada dalam satu pohon disebut monoecious. Jika pada tanaman berbeda disebut dioecious. Jenis kelamin bunganya yaitu jantan, betina dan hermaprodit. Warna buah berwarna hijau berubah menjadi
paduan kemerahan, kuning dan jingga ketika matang. Buah memiliki rongga di bagian tengah berisi banyak biji kecil. Biji berwarna hitam keabu-abuan dan diselimuti lapisan seperti lendir (Ismawan, 2013).
2.1.1 Sistematika Tanaman Pepaya
Sistematika tanaman pepaya dapat diklasifikasikan sebagai berikut (Syamsuhidayat dan Hutapea, 2000) :
7 Ordo : Cistales
Famili : Caricaceae Genus : Carica
Spesies : Carica papaya L.
2.1.2 Nama Daerah
Pepaya disebut juga puete (Aceh), botik (Batak), kates (Palembang), kalikih (Minangkabau), kunti kayu (Lampung), gedang (Sunda, Bali), ketela
gantung (Jawa), bua medung (Kalimantan), kapalay (Sulawesi), kampaya (Bima), kalujawa (Sumba), padu (Flores), popaino (Ambon), unti jawa (Makassar), sempanin (Papua) (Latief, 2009 ; Ismawan, 2013). 2.1.3 Nama Asing
Pepaya juga mempunyai nama asing yaitu : meloenboom (Belanda), pawpaw (Inggris, Amerika), mammon (Spanyol), papayer (Prancis), papaiya (Jepang), betek (Malaysia), dudu (Vietnam), maloko (Thailand), fanmugua (China) (Latief, 2009 ; Ismawan, 2013).
2.1.4 Kandungan Kimia
Daun pepaya mengandung alkaloid, flavonoid, glikosida , komponenfenol, saponin, tanin dan steroid/triterpenoid (Patil, et al., 2013 ; Vuong, et al., 2013). 2.1.5 Khasiat Tanaman
8 2014).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Hasil dari ekstraksi disebut dengan ekstrak. Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Ditjen, POM., 1995).
Ada dua cara metode ekstraksi mengunakan pelarut yaitu cara dingin (seperti : maserasi, perkolasi), dan cara panas (seperti : refluks, sokletasi, digesti, infundasi dan dekoktasi).
a. Cara dingin, yaitu : i. Maserasi
Maserasi adalah proses pengekstraksian simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Remaserasi berarti melakukan pengulangan penambahan pelarut setelah dilakukan penyarian maserat pertama,dan seterusnya (Depkes, RI., 2000).
ii. Perkolasi
9
perkolasi sebenarnya (penetesan / penampungan ekstrak) terus menerus sampai diperoleh ekstrak (perkolat) (Depkes, RI., 2000).
b. Cara panas, yaitu : i. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas relatif konstan dengan adanya pendingin balik (Depkes, RI., 2000).
ii. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Depkes, RI., 2000). iii. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan, umumnya dilakukan pada suhu 40-500C (Depkes, RI., 2000).
iv. Infundasi
Infundasi adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih), temperatur terukur 96-980C selama waktu tertentu (15-20 menit) (Depkes, RI., 2000).
v. Dekoktasi
10
Diabetes mellitus (DM) adalah penyakit kronis yang terjadi ketika pankreas tidak menghasilkan insulin yang cukup atau ketika tubuh tidak dapat secara efektif menggunakan insulin yang dihasilkan. Insulin adalah hormon yang mengatur kadar glukosa darah. Hal ini menyebabkan peningkatan kadar glukosa darah (hiperglikemia) (WHO, 2015). Diabetes mellitus (DM) mempunyai
sindroma klinik yang ditandai adanya poliuria, polidipsia, dan polifagia, disertai peningkatan kadar glukosa darah atau hiperglikemia (kadar glukosa puasa ≥ 126 mg/ dL atau postprandial ≥ 20 0 mg/dL atau glukosa sewaktu ≥ 200 mg/ dL) (Triplitt, et al., 2008).
2.4 Klasifikasi Diabetes Mellitus
Klasifikasi Diabetes mellitus (DM) berdasarkan etiologinya menurut American Diabetes Association (2008) meliputi:
a. DM tipe 1 adanya destruksi sel β langerhans pada pankreas, umumnya
menjurus ke defisiensi insulin absolut, akibat kelainan autoimun (antibodi sel islet, antibodi insulin, dan antibodi asam glutamat dekarboksilase) atau idiopatik.
b. DM tipe 2, bervariasi mulai dari yang predominan resistensi insulin disertai defisiensi insulin relatif sampai yang predominan gangguan sekresi insulin bersama resistensi insulin.
c. DM tipe lain, akibat defek genetik fungsi sel β, defek genetik kerja insulin,