ii
ABSTRAK
SILVIKASARI. Aktivitas Antibakteri Ekstrak Kasar Flavonoid Daun Gambir
(
Uncaria gambir
Roxb). Dibimbing oleh LAKSMI AMBARSARI dan
SURYANI.
ABSTRACT
SILVIKASARI. Antibacterial Activities of Crude Extract of flavonoids in Gambir
Leaves (
Uncaria gambir
Roxb
.
) Under the direction of LAKSMI AMBARSARI
and SURYANI.
1 1
PENDAHULUAN
Penyakit infeksi merupakan salah satu masalah dalam bidang kesehatan yang semakin berkembang. Infeksi dapat disebabkan oleh bakteri, jamur, virus dan parasit. Staphylococcus aureus adalah salah satu patogen pada manusia yang dapat menyebabkan infeksi. Infeksi oleh S.aureus
pada kulit ditandai dengan gejala peradangan, nekrosis, dan pembentukan abses (Jawetz et al. 2001). Bakteri lain yang paling sering menyebabkan infeksi ialah
Eschericia coli. Bakteri ini bersifat patogen dan dapat menimbulkan kebusukan pada makanan. Infeksi yang sering terjadi ialah infeksi pada saluran pencernaan, infeksi saluran kemih, dan meningitis (Todar 1997). Pencegahan terhadap serangan infeksi dapat dilakukan dengan penggunaan antibiotik. Antibiotik adalah zat kimia yang dihasilkan oleh fungi dan bakteri tanah yang memiliki kemampuan mematikan atau menghambat pertumbuhan mikrob sedangkan toksisitasnya terhadap manusia relatif kecil. Penggunaan antibiotik secara besar-besaran adalah faktor utama terjadinya resistensi (Suwandi 1991).
Pola kepekaan S. aureus terhadap enam jenis antibiotika di wilayah Jakarta Timur menunjukkan bahwa bakteri ini telah resisten terhadap tetrasiklin 2.7%, streptomisin 44.8%, kloramfenikol 23.6%, ampisilin 18.1%, eritromisin 6.6%, dan penisilin 4.2% (Kadarwati 1990). Resistensi
S. aureus terhadap nafsilin pada tahun 1970 di Denmarksebesar 40% isolat. Resistensi S. aureus terhadap nafsilin pada tahun 1990 mencapai 20-30% isolat (Jawetz et al. 2001). Strain E.coli yang ditemukan di Rumah Sakit Fatmawati Jakarta, telah mengalami resistensi terhadap ampisilin 100%, penisilin 94.5%, amoksilin 86.2%, kloramfenikol 83.9%, tetrasiklin 83.9%, dan sulbenisilin 79.4% (Refdanita et al. 2004).
Seiring dengan meningkatnya resistensi bakteri harus diimbangi dengan penemuan obat baru. Hal ini mendorong ditemukannya sumber antibakteri baru yang lebih efektif melawan infeksi mikrob patogen, lebih murah, memiliki efek samping yang lebih kecil, dan tersedia dalam jumlah besar sehingga resistensi dapat diatasi.
Pemanfaatan tanaman obat di Indonesia menurut data dari BPS (2003) menunjukkan bahwa persentase penduduk sakit di pedesaan yang menggunakan obat tradisional untuk pengobatan sebanyak
29.65%. Kecenderungan masyarakat menggunakan obat tradisional ataupun tanaman obat karena dinilai memiliki efek samping yang lebih kecil daripada obat sintetik. Pramono dan Katno (2002) menyatakan obat tradisional dan tanaman obat memiliki lebih dari satu efek farmakologis sehingga penggunaannya harus tepat dan benar (dosis, waktu, cara, penggunaan, dan pemilihan bahan alam yang sesuai indikasi penyakit). Kekeliruan dalam penggunaan obat tradisional ataupun tanaman obat dapat berbahaya bagi kesehatan. Oleh karena itu diperlukan informasi ilmiah yang lengkap untuk menghindari hal tersebut.
Salah satu tanaman yang dapat dimanfaatkan sebagai obat adalah Gambir (Uncaria gambir Roxb). Tanaman gambir tumbuh melimpah di wilayah Sumatera Barat bahkan menjadi komoditi ekspor terbesar di wilayah tersebut yang mampu memberikan sumbangan besar pada Produk Domestik Regional Bruto (PDRB) daerah dan devisa untuk negara. Volume ekspor tanaman gambir pada tahun 2000 sebesar 6.633 ton dan meningkat pada tahun 2004 menjadi 12.438 ton. Hal ini menunjukkan terjadi peningkatan volume ekspor sebesar 87,49% selama kurun waktu lima tahun (Bapeda 1997).
Tanaman gambir sering dimanfaatkan oleh masyarakat tradisional sebagai obat sakit gigi, obat luka, obat diare, dan sebagai bahan pelengkap menyirih yang dipercaya mampu menguatkan gigi (Nazir 2000). Bukti ilmiah mengenai khasiat tanaman gambir ialah pestisida nabati yang berasal dari daun gambir terbukti mampu mengendalikan
Fusarium oxysporium Licopersici penyebab penyakit layu pada tanaman tomat (Nasrun 2001). Pestisida nabati yang berasal dari daun gambir juga dapat menghambat pertumbuhan jamur Phytopthora cinnamomi
penyebab kanker batang pada tanaman kayu manis (Idris et al. 1997).
Setiawan et al. 2010). Tingginya flavonoid pada daun gambir diduga berpotensi sebagai antibakteri yang mampu menghambat pertumbuhan bakteri S. aureus dan E. coli.
Penelitian mengenai potensi tanaman gambir di Indonesia belum banyak dilakukan. Penelitian ini bertujuan mengetahui aktivitas antibakteri ekstrak kasar flavonoid daun gambir dan memperoleh karakteristik sifat antibakteri terhadap S.aureus dan E. coli. Hipotesis penelitian ini adalah flavonoid yang terkandung di dalam ekstrak air daun gambir memiliki aktivitas antibakteri. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai potensi daun gambir sebagai sumber alternatif antibakteri baru.
TINJAUAN PUSTAKA
Gambir
Berdasarkan taksonomi gambir termasuk ke dalam kingdom Plantae, kelas Angeospermae, sub kelas Monokotiledonae, ordo Rubiales, Famili Rubiceae, Genus Uncaria, dan spesies Uncaria gambir Roxb (Dhalimi 2006).
Tumbuhan gambir memiliki daun berbentuk oval dengan ujung meruncing, permukaan daun licin, bunganya tersusun majemuk, kelopak bunga pendek, benang sari berjumlah lima, dan buah berupa kapsula. Tumbuhan gambir diperlihatkan pada Gambar 1. Tumbuhan perdu setengah merambat ini tumbuh subur pada lahan ketinggian 900 m di atas permukaan laut. Tanaman ini membutuhkan cahaya matahari penuh dan curah hujan merata sepanjang tahun. Umumnya panen atau pemangkasan daun gambir dilakukan setelah tanaman berumur 1.5 tahun (Zamarel 1991).
Gambar 1 Gambir (Uncaria gambir Roxb) (Zamarel 1991).
Komponen fitokimia pada tanaman gambir meliputi asam kateku tannat (20%), katekin (7-33%), dan pirokatekol (20-30%), (Thorper dan Whiteley 1990). Menurut Lucida et al.(2007) komponen fitokimia gambir terdiri atas flavonoid (katekin 50%), pirokatekol 20-30%, gambirin 1-3%, kateku merah 3-5%, quersetin 2-4%, zat lilin 1-2%, dan alkaloid (2-5%). Komponen kimia utama pada daun gambir ialah senyawa katekin yang merupakan kelompok senyawa flavonoid. Katekin pada daun gambir sekitar 40-50% (Hayani 2003 dan Lucida et al
2007).
Kandungan flavonoid yang tinggi pada daun gambir menyebabkan filtrat rebusan daun gambir dimanfaatkan masyarakat tradisional di Indonesia sebagai pewarna pakaian karena tahan terhadap cahaya matahari (Risfaheri et al. l995). Gambir juga sering digunakan sebagai pelengkap menyirih yang memberikan efek warna merah pada gigi serta dipercaya mampu menguatkan gigi dan gambir juga sering digunakan oleh masyarakat sebagai obat penyembuh luka (Nazir 2000). Negara importir gambir seperti Malaysia, Taiwan, Jepang, dan Singapura memanfaatkan daun gambir sebagai obat luka bakar, penetralisir nikotin, bahan baku permen yang melegakan kerongkongan bagi perokok dan tunasnya digunakan sebagai obat diare, obat disentri serta obat kumur-kumur pada sakit kerongkongan (Suherdi 1991).
Secara ilmiah telah dibuktikan bahwa ekstrak daun gambir berfungsi sebagai anti nematoda Bursapeleucus xyphylus (Alen et al. 2004). Gambir juga dapat dimanfaatkan sebagai bahan infus untuk mengatasi gangguan pada pembuluh darah (Sukati dan Kusharyono 2004), bahan antifeedan terhadap hama Spodoptera litura Fab.
(Handayani et al. 2004), sebagai obat tukak lambung (Tika et al. 2004), perangsang sistem saraf otonom (Kusharyono 2004), dan sebagai antioksidan (Kresnawaty et al.
2009). Menurut Nasrun et al. (1997) gambir dapat menghambat pertumbuhan jamur
Phytophthora cinnamomi.
Flavonoid
2 2
Setiawan et al. 2010). Tingginya flavonoid pada daun gambir diduga berpotensi sebagai antibakteri yang mampu menghambat pertumbuhan bakteri S. aureus dan E. coli.
Penelitian mengenai potensi tanaman gambir di Indonesia belum banyak dilakukan. Penelitian ini bertujuan mengetahui aktivitas antibakteri ekstrak kasar flavonoid daun gambir dan memperoleh karakteristik sifat antibakteri terhadap S.aureus dan E. coli. Hipotesis penelitian ini adalah flavonoid yang terkandung di dalam ekstrak air daun gambir memiliki aktivitas antibakteri. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai potensi daun gambir sebagai sumber alternatif antibakteri baru.
TINJAUAN PUSTAKA
Gambir
Berdasarkan taksonomi gambir termasuk ke dalam kingdom Plantae, kelas Angeospermae, sub kelas Monokotiledonae, ordo Rubiales, Famili Rubiceae, Genus Uncaria, dan spesies Uncaria gambir Roxb (Dhalimi 2006).
Tumbuhan gambir memiliki daun berbentuk oval dengan ujung meruncing, permukaan daun licin, bunganya tersusun majemuk, kelopak bunga pendek, benang sari berjumlah lima, dan buah berupa kapsula. Tumbuhan gambir diperlihatkan pada Gambar 1. Tumbuhan perdu setengah merambat ini tumbuh subur pada lahan ketinggian 900 m di atas permukaan laut. Tanaman ini membutuhkan cahaya matahari penuh dan curah hujan merata sepanjang tahun. Umumnya panen atau pemangkasan daun gambir dilakukan setelah tanaman berumur 1.5 tahun (Zamarel 1991).
Gambar 1 Gambir (Uncaria gambir Roxb) (Zamarel 1991).
Komponen fitokimia pada tanaman gambir meliputi asam kateku tannat (20%), katekin (7-33%), dan pirokatekol (20-30%), (Thorper dan Whiteley 1990). Menurut Lucida et al.(2007) komponen fitokimia gambir terdiri atas flavonoid (katekin 50%), pirokatekol 20-30%, gambirin 1-3%, kateku merah 3-5%, quersetin 2-4%, zat lilin 1-2%, dan alkaloid (2-5%). Komponen kimia utama pada daun gambir ialah senyawa katekin yang merupakan kelompok senyawa flavonoid. Katekin pada daun gambir sekitar 40-50% (Hayani 2003 dan Lucida et al
2007).
Kandungan flavonoid yang tinggi pada daun gambir menyebabkan filtrat rebusan daun gambir dimanfaatkan masyarakat tradisional di Indonesia sebagai pewarna pakaian karena tahan terhadap cahaya matahari (Risfaheri et al. l995). Gambir juga sering digunakan sebagai pelengkap menyirih yang memberikan efek warna merah pada gigi serta dipercaya mampu menguatkan gigi dan gambir juga sering digunakan oleh masyarakat sebagai obat penyembuh luka (Nazir 2000). Negara importir gambir seperti Malaysia, Taiwan, Jepang, dan Singapura memanfaatkan daun gambir sebagai obat luka bakar, penetralisir nikotin, bahan baku permen yang melegakan kerongkongan bagi perokok dan tunasnya digunakan sebagai obat diare, obat disentri serta obat kumur-kumur pada sakit kerongkongan (Suherdi 1991).
Secara ilmiah telah dibuktikan bahwa ekstrak daun gambir berfungsi sebagai anti nematoda Bursapeleucus xyphylus (Alen et al. 2004). Gambir juga dapat dimanfaatkan sebagai bahan infus untuk mengatasi gangguan pada pembuluh darah (Sukati dan Kusharyono 2004), bahan antifeedan terhadap hama Spodoptera litura Fab.
(Handayani et al. 2004), sebagai obat tukak lambung (Tika et al. 2004), perangsang sistem saraf otonom (Kusharyono 2004), dan sebagai antioksidan (Kresnawaty et al.
2009). Menurut Nasrun et al. (1997) gambir dapat menghambat pertumbuhan jamur
Phytophthora cinnamomi.
Flavonoid
daun muda umumnya belum terlalu banyak mengandung flavonoid (Harborne 1987). Sebagian besar senyawa flavonoid di alam ditemukan dalam bentuk glikosid. Glikosida adalah kombinasi antara suatu gula dan suatu alkohol yang saling berikatan melalui ikatan glikosida. Gula yang terikat pada flavonoid cenderung menyebabkan flavonoid akan larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformamida, dan air (Lenny 2006). Aglikon yang kurang polar seperti isoflavon, flavanon, dan flavon serta flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Harborne 1993).
Flavonoid merupakan deretan senyawa C6-C3-C6, artinya kerangka karbonnya terdiri
atas dua gugus C6 (cincin benzena) yang
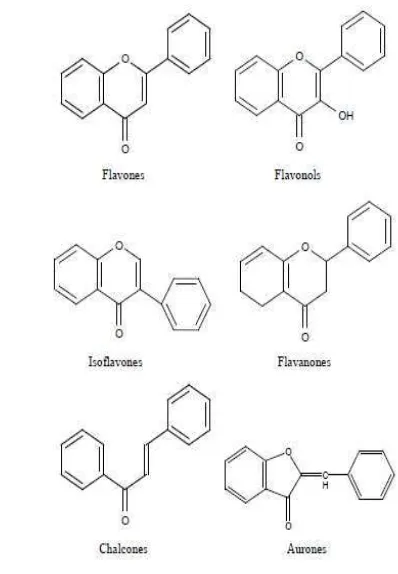
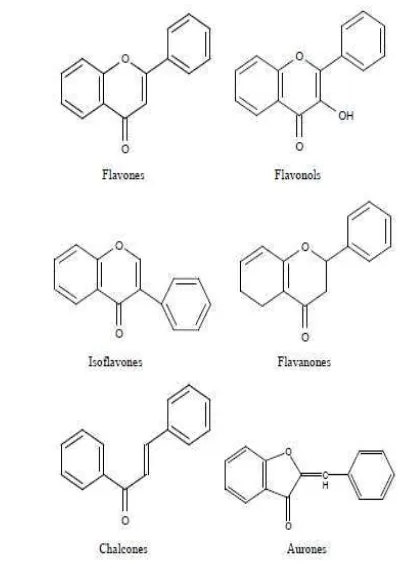
dihubungkan oleh rantai alifatik tiga karbon. Kelas yang berlainan dalam golongan flavonoid dibedakan berdasarkan cincin heterosiklik-oksigen tambahan dan gugus hidroksil yang tersebar menurut pola yang berlainan. Berdasarkan penambahan rantai oksigen dan perbedaan distribusi dari gugus hidroksilnya flavonoid digolongkan menjadi enam jenis, yaitu flavon, isoflavon, flavonol, flavanon, kalkon, dan auron (Gambar 2) (Grotewold 2005).
Gambar 2 Jenis-Jenis Flavonoid
Senyawa golongan flavonoid dari beberapa bahan alam dilaporkan memiliki aktivitas antibakteri. Aglikon epigenin, quersetin, kaempferol, dan luteolin-7,3-O’diglukosida pada tanaman Mentha Longifolia dilaporkan mampu menghambat pertumbuhan bakteri Gram positif (Akroum
et al 2009). Katekin dari Elaeagnus glabra
dilaporkan mampu menghambat
Staphylococcus epidermidis penyebab penyakit kulit. Mekanisme kerja flavonoid diduga mendenaturasi protein sel bakteri dan merusak membran sel (Nishino et al. 1987).
Antibakteri
Aktivitas mikroorganisme dapat dikendalikan dengan penghambatan secara fisik maupun kimia. Bahan antimikrob adalah penghambat mikroorganisme secara kimia yang mengganggu aktivitas metabolisme mikrob. Antibakteri adalah zat yang menghambat pertumbuhan bakteri. Berdasarkan cara kerjanya, antibakteri dibedakan menjadi bakterisidal dan bakteriostatik. Bakteriostatik adalah zat yang bekerja menghambat pertumbuhan bakteri sedangkan bakterisidal adalah zat yang bekerja mematikan bakteri. Beberapa zat antibakteri bersifat bakteriostatik pada konsentrasi rendah dan bersifat bakterisidal pada konsentrasi tinggi (Chomnawang et al
2005)
Mekanisme kerja antibakteri secara umum adalah merusak dinding sel (seperti penisilin; sefalosporin; dan vankomisin), mengganggu permeabilitas sel (seperti penisilin; sefalosporin; vankomisin), dan menghambat sintesis protein dan asam nukleat (seperti kloramfenikol; rifampisin; dan asam). Efektivitas kerja antibakteri dipengaruhi oleh beberapa faktor di antaranya konsentrasi antibakteri, jumlah bakteri, spesies bakteri, bahan organik, suhu, dan pH lingkungan (Cowan 1999).
Sifat antibakteri dapat berbeda satu dengan yang lainnya. Antibakteri termasuk ke dalam jenis spektrum luas bila menghambat atau membunuh bakteri Gram negatif dan Gram positif. Antibakteri termasuk ke dalam jenis spektrum sempit bila menghambat atau membunuh bakteri Gram negatif atau Gram positif saja (Jones 2000).
4 4
menghambat ataupun membunuh mikrob patogen yang diujikan. Pemilihan antibiotik yang tepat dapat memberikan gambaran mengenai daya kerja senyawa aktif hasil isolasi. Antibiotik dengan spektrum luas pada uji aktivitas antibakteri lebih baik daripada antibiotik spektrum sempit (Dewi 2008).
Kloramfenikol merupakan antibiotik yang diisolasi dari Streptomyces venezuelae. Senyawa ini bekerja dengan cara menghambat sintetis protein yakni mengganggu aktivitas peptidil transferase melalui pengikatan pada subunit ribosom 70S bakteri. Kloramfenikol tidak mempengaruhi sintesis protein pada sel-sel mamalia karena subunit ribosom yang dimiliki oleh sel-sel mamalia adalah subunit 80S (Recse 1988).
Bakteri Uji
Bakteri merupakan protista bersel tunggal yang berukuran sangat kecil (mikroskopis). Sel-sel bakteri berbentuk bola (kokus), batang atau (basilus), dan spiral (spirilium). Pola penataan sel berbentuk tunggal, berpasangan, gerombol, rantai, dan filamen (Pelczar & Chan 1998).
Bakteri dapat memperbanyak diri dengan beberapa cara, yakni pembelahan biner dan fragmentasi. Waktu yang dibutuhkan sel untuk membelah diri menjadi dua kali lipat disebut waktu generasi. Waktu generasi masing-masing spesies bakteri tidak sama bergantung kondisi dan nutrisi (Pelczar & Chan 1998).
Dinding sel merupakan komponen utama yang memberikan bentuk serta kekuatan pada sel prokariot. Berdasarkan komposisi dan struktur dinding selnya, bakteri dibedakan menjadi dua jenis, yaitu bakteri Gram positif dan bakteri Gram negatif (Pelczar & Chan 1998). Perbedaan antara bakteri Gram positif dan bakteri Gram negatif diperlihatkan pada Tabel 2.
Bakteri uji yang dipilih ialah S.aureus
(Gram positif) dan E.coli (Gram negatif).
S.aureus tergolong bakteri Gram positif, berbentuk kokus dengan diameter 0.7-0.9 µ m, dapat hidup secara aerob maupun anaerob fakultatif, dinding sel mengandung peptidoglikan dan asam teikoat, tidak membentuk spora, dan pola penataan sel bergerombol (seperti buah anggur). Pembentukan kelompok ini karena pembelahan sel-sel cenderung berada di dekat sel induknya (Gupte 1990). Koloni
bakteri ini berwarna putih sampai kuning keemasan. Tumbuh optimum pada suhu 37ºC dan pH 7.0-7.5 (Todar 1997). S. aureus
umumnya ditemukan pada hidung manusia (Fournier dan Phillpot 2005). Bakteri ini memiliki kemampuan melakukan pembelahan, dan mampu memproduksi bahan ekstraseluler seperti katalase, koagulase, eksotoksin, lekosidin, toksin eksfoliatif, dan enterotoksin (Brooks et al
2001).
E. coli merupakan mikroba dari famili
Enterobactericeae yang normal terdapat di saluran pencernaan hewan dan manusia. Bakteri ini berbentuk batang berukuran 2-6 µ m, bersifat anaerob fakultatif dan tergolong bakteri Gram negatif. Bakteri ini tumbuh optimum pada suhu 37ºC dan pH 7.0-7.5, serta pada suhu 44ºC E. coli mampu melakukan fermentasi laktosa (Pelczar dan Chan 1988). Beberapa strain E.coli
menyebabkan diare yaitu Enterophatogenic E.coli (EPEC) dan Enterotoxigenic E.coli
(ETEC). Strain yang menyebabkan diare akut yaitu Enteroagregative E. coli (EAEC) sedangkan Enteroinvasive E. coli (EIEC) menyebabkan penyakit shigellosis (Brooks
et al. 2001).
Tabel 2 Perbedaan antara bakteri Gram positif dan bakteri Gram negatif Ciri-ciri Perbedaan
Gram positif Gram negatif Struktur
dinding sel
Tebal (5-80 nm) dan berlapis tunggal (mono)
Tipis (10-15 nm) dan berlapis tiga (multi) Komposisi
dinding sel
Kandungan lipid rendah (1-4%), peptidoglikan berlapis tunggal dan komponen utama lebih besar dari 50% berat kering
Kandungan lipid tinggi (11-21%), peptidoglikan di dalam lapisan kaku, jumlah sedikit (10% berat kering)
Kerentanan terhadap penisilin
Lebih rentan Kurang rentan Resisten terhadap gangguan fisik Lebih resisten Kurang resisten
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini terdiri atas bahan untuk ekstraksi flavonoid dan bahan uji aktivitas antibakteri. Bahan untuk ekstraksi flavonoid terdiri atas metanol, akuades, heksana, kloroform, NH4OH, H2SO4, NaOH, etanol,
eter, butanol, dan HCl. Bahan untuk penentuan aktivitas antibakteri terdiri atas bakteri uji (E.coli dan S. aureus), alkohol 70%, spirtus, media pertumbuhan bakteri
Nutrient Agar (NA) dan Nutrient Broth
(NB), serta kloramfenikol.
Alat-alat yang digunakan terdiri atas peralatan untuk ekstraksi flavonoid dan uji aktivitas antibakteri. Alat yang digunakan untuk ekstraksi flavonoid di antaranya blender, rotary evaporator, oven, inkubator bergoyang, vakum, penangas air, corong pisah, neraca analitik, dan kertas saring Whatman 20. Alat-alat yang digunakan untuk uji antibakteri di antaranya cawan Petri, tabung reaksi, bunsen, tip, labu Erlenmeyer, autoklaf, oven, inkubator 37˚C, pipet mikro, dan mistar.
Metode Penelitian
Persiapan Sampel (Harborne 1987)
Daun gambir yang digunakan diperoleh dari kebun gambir di Payakumbuh, Sumatera Barat. Daun yang dipilih adalah daun yang sudah tua (siap panen). Sebelum digunakan daun dikeringkan selama seminggu, pengeringan dilakukan sekitar jam 8-11 pagi. Kemudian daun dioven pada suhu 50°C hingga kadar air kurang dari 10% dan dilakukan penggilingan dengan blender lalu serbuk disaring sehingga diperoleh serbuk berukuran 80 mesh.
Ekstraksi Flavonoid (Sukadana 2010)
Ekstraksi flavonoid dilakukan dengan metode maserasi bertingkat, yaitu modifikasi dari metode Markham 1998. Serbuk daun gambir dimaserasi dengan 200 mL larutan metanol:air (9:1) selama 3 kali. Setelah itu dilakukan penyaringan. Residunya dimaserasi kembali dengan 200 mL metanol:air (1:1) selama tiga kali. Maserasi dilakukan selama 24 jam disertai dengan pengadukan yang teratur pada 200 rpm. Seluruh filtrat yang diperoleh dipekatkan dengan rotary evaporator pada suhu 40ºC. Selanjutnya ekstrak dipartisi berturut-turut
dengan heksana dan kloroform masing-masing 250 mL. Partisi dilakukan dengan menggunakan corong pisah. Lapisan metanol:air dipisahkan dari lapisan heksana dan kloroform. Ekstrak metanol:air kemudian diuapkan hingga pelarut organik hilang sehingga diperoleh tiga jenis ekstrak yaitu ekstrak heksana, ekstrak kloroform, dan ekstrak air (Lampiran 2).
Pembuatan Media Nutrient Agar (NA) (Kusumaningjati 2009)
Media NA dibuat dengan konsentrasi 2%. Sebanyak 2 gram media NA dilarutkan dalam 100 mL akuades. Kemudian diaduk dengan magnetik stirer dengan pemanasan pada suhu 70°C. Kemudian 28 mL media ini ditempatkan ke dalam tabung reaksi masing-masing 7 mL untuk agar miring dan sisanya untuk agar cawan. Media selanjutnya di sterilisasi menggunakan autoklaf pada suhu 121 °C selama 15 menit. Media untuk agar miring diletakan pada papan miring hingga beku dan diinkubasi selama 24 jam. Media agar cawan dituang secara aseptis ke dalam cawan Petri steril dan diinkubasi selama 24 jam (Lampiran 3).
Pembuatan Media Nutrient Broth (NB) (Kusumaningjati 2009)
Media ini dibuat dengan konsentrasi 2%. Sebanyak 2 gram media NB dilarutkan dalam 100 mL akuades. Kemudian diaduk dengan magnetik stirer disertai dengan pemanasan pada suhu 70°C. Media ini disterilisasi menggunakan autoklaf pada suhu 121 °C selama 15 menit.
Regenerasi Bakteri (Dwidjoseputro 1994)
Sebanyak satu ose biakan bakteri dari stok digoreskan ke cawan dengan metode kuadran dan diinkubasi pada suhu 37°C selama 24 jam. Koloni terpisah yang masih berada pada goresan diinokulasi ke media agar miring dengan metode kuadran dan diinkubasi pada suhu 37°C selama 24 jam. Selanjutnya sebanyak satu ose koloni dari agar miring diinokulasikan ke media NB cair steril, dan dinkubasi pada inkubator bergoyang pada kecepatan 200 rpm, suhu 37°C selama 24 jam.
Pengukuran Optical Density (OD) (Volekova et al. 2001)
6 6
dari 1 maka volume bakteri yang diinokulasikan sebanyak 50 µL.
Analisis Fitokimia (Harborne 1987) Uji alkaloid. Sebanyak 0.1 gram serbuk hasil ekstraksi flaonoid dilarutkan dengan 3 mL kloroform dan 5 tetes amoniak (NH4OH). Ekstrak kloroform dipisahkan dan
ditambahkan 5 tetes H2SO4 2M. Ekstrak
H2SO4 diambil, kemudian ditambahkan
pereaksi Dragendorf, Meyer, dan Wagner. Uji positif terhadap alkaloid ditandai dengan terbentuknya endapan putih pada pereaksi Meyer, endapan merah pada pereaksi Dragendorf, dan endapan coklat pada endapan Wagner.
Uji flavonoid dan senyawa fenolik.
Sebanyak 0.1 gram serbuk hasil ekstrak flavonoid dilarutkan dengan 1 mL metanol dan dididihkan selama 1 menit. Terbentuknya, warna merah pada filtrat
setelah penambahan 3 tetes H2SO4
menunjukkan adanya flavonoid sedangkan Warna merah yang terbentuk setelah penambahan 3 tetes NaOH 10% (b/v). menunjukkan adanya senyawa fenolik hidrokuinon.
Uji triterpenoid. Sebanyak 0.1 gram serbuk hasil ekstraksi flavonoid dilarutkan dengan 5 mL etanol lalu dipanaskan pada suhu 50°C dan disaring. Filtratnya diuapkan lalu ditambah 5 tetes eter. Lapisan eter ditambah pereaksi Liebermen Buchard (3 tetes asam pekat lalu 1 tetes H2SO4 pekat).
Warna merah menunjukkan adanya triterpenoid sedangkan warna hijau menunjukkan kandungan steroid.
Uji tanin. Sebanyak 0.1 gram serbuk hasil ekstraksi flavonoid dilarutkan dengan 5 mL air, dididihkan selama 1 menit dan disaring. Filtrat ditambah 3 tetes FeCl3 1%
(b/v). Warna hijau tua menunjukkan adanya tanin.
Uji Konsentrasi Hambat Tumbuh Minimum (KHTM) (Kusumaningjati 2009)
Penentuan KHTM dilakukan terhadap tiga jenis ekstrak, yaitu ekstrak heksana, ekstrak kloroform, dan ekstrak air pada konsentrasi 1%. Kontrol positif yang digunakan adalah kloramfenikol 1% dan kontrol negatif yang digunakan adalah akuades untuk ekstrak air, sedangkan kontrol negatif untuk heksana dan kloroform menggunakan campuran air dengan DMSO (Dimetil Sulfo Oksida). Sebanyak 50 µL dari konsentrasi sampel dimasukan ke dalam
lubang pada media NA yang sebelumnya telah diinokulasikan dengan bakteri uji. Selanjutnya diinkubasi pada suhu 37°C selama 24 jam. Diameter zona bening yang terbentuk diukur dan dinilai sebagai aktivitas antibakteri (Lampiran 3). Diameter zona bening terkecil pada konsentrasi tertentu dinilai sebagai konsentrasi minimum ekstrak yang mampu menghambat pertumbuhan E. coli dan S. aureus .
Penentuan Bakteriostatik
Penentuan bakteriostatik dilakukan terhadap ekstrak yang memiliki aktivitas antibakteri berdasarkan hasil uji pendahuluan KHTM. Ekstrak dibuat menjadi beberapa konsentrasi yaitu 1%, 3%, 5%, 7%, dan 9%. Akuades steril digunakan sebagai kontrol negatif sedangkan kloramfenikol 1% sebagai kontrol positif. Aktivitas antibakteri ditandai dengan terbentuknya zona bening yang tidak ditumbuhi bakteri selama 24 jam inkubasi pada suhu 37°C (Lampiran 4). Daya hambat antibakteri dinilai dari ukuran zona bening yang terbentuk (Yadav dan Bishe 2004).
Penentuan Bakterisidal
Konsentrasi Bunuh Minimum (KBM) dilakukan dengan cara, zona bening hasil KHTM dari setiap konsentrasi dikulturkan ke dalam media NB cair steril lalu diinkubasi selama 18 jam pada suhu 37°C. Media NB cair steril digunakan sebagai blanko. Nilai OD dari kultur tersebut diukur pada panjang gelombang 600 nm secara duplo. Nilai absorban dari setiap konsentrasi kultur yang sama dengan blanko menunjukkan tidak ada pertumbuhan bakteri dan dinilai sebagai bakteriostatik (Vollekova
et al. 2001; Usman et al. 2007; dan Reuben
et al. 2008).
HASIL DAN PEMBAHASAN
Ekstraksi Flavonoid
dari 1 maka volume bakteri yang diinokulasikan sebanyak 50 µL.
Analisis Fitokimia (Harborne 1987) Uji alkaloid. Sebanyak 0.1 gram serbuk hasil ekstraksi flaonoid dilarutkan dengan 3 mL kloroform dan 5 tetes amoniak (NH4OH). Ekstrak kloroform dipisahkan dan
ditambahkan 5 tetes H2SO4 2M. Ekstrak
H2SO4 diambil, kemudian ditambahkan
pereaksi Dragendorf, Meyer, dan Wagner. Uji positif terhadap alkaloid ditandai dengan terbentuknya endapan putih pada pereaksi Meyer, endapan merah pada pereaksi Dragendorf, dan endapan coklat pada endapan Wagner.
Uji flavonoid dan senyawa fenolik.
Sebanyak 0.1 gram serbuk hasil ekstrak flavonoid dilarutkan dengan 1 mL metanol dan dididihkan selama 1 menit. Terbentuknya, warna merah pada filtrat
setelah penambahan 3 tetes H2SO4
menunjukkan adanya flavonoid sedangkan Warna merah yang terbentuk setelah penambahan 3 tetes NaOH 10% (b/v). menunjukkan adanya senyawa fenolik hidrokuinon.
Uji triterpenoid. Sebanyak 0.1 gram serbuk hasil ekstraksi flavonoid dilarutkan dengan 5 mL etanol lalu dipanaskan pada suhu 50°C dan disaring. Filtratnya diuapkan lalu ditambah 5 tetes eter. Lapisan eter ditambah pereaksi Liebermen Buchard (3 tetes asam pekat lalu 1 tetes H2SO4 pekat).
Warna merah menunjukkan adanya triterpenoid sedangkan warna hijau menunjukkan kandungan steroid.
Uji tanin. Sebanyak 0.1 gram serbuk hasil ekstraksi flavonoid dilarutkan dengan 5 mL air, dididihkan selama 1 menit dan disaring. Filtrat ditambah 3 tetes FeCl3 1%
(b/v). Warna hijau tua menunjukkan adanya tanin.
Uji Konsentrasi Hambat Tumbuh Minimum (KHTM) (Kusumaningjati 2009)
Penentuan KHTM dilakukan terhadap tiga jenis ekstrak, yaitu ekstrak heksana, ekstrak kloroform, dan ekstrak air pada konsentrasi 1%. Kontrol positif yang digunakan adalah kloramfenikol 1% dan kontrol negatif yang digunakan adalah akuades untuk ekstrak air, sedangkan kontrol negatif untuk heksana dan kloroform menggunakan campuran air dengan DMSO (Dimetil Sulfo Oksida). Sebanyak 50 µL dari konsentrasi sampel dimasukan ke dalam
lubang pada media NA yang sebelumnya telah diinokulasikan dengan bakteri uji. Selanjutnya diinkubasi pada suhu 37°C selama 24 jam. Diameter zona bening yang terbentuk diukur dan dinilai sebagai aktivitas antibakteri (Lampiran 3). Diameter zona bening terkecil pada konsentrasi tertentu dinilai sebagai konsentrasi minimum ekstrak yang mampu menghambat pertumbuhan E. coli dan S. aureus .
Penentuan Bakteriostatik
Penentuan bakteriostatik dilakukan terhadap ekstrak yang memiliki aktivitas antibakteri berdasarkan hasil uji pendahuluan KHTM. Ekstrak dibuat menjadi beberapa konsentrasi yaitu 1%, 3%, 5%, 7%, dan 9%. Akuades steril digunakan sebagai kontrol negatif sedangkan kloramfenikol 1% sebagai kontrol positif. Aktivitas antibakteri ditandai dengan terbentuknya zona bening yang tidak ditumbuhi bakteri selama 24 jam inkubasi pada suhu 37°C (Lampiran 4). Daya hambat antibakteri dinilai dari ukuran zona bening yang terbentuk (Yadav dan Bishe 2004).
Penentuan Bakterisidal
Konsentrasi Bunuh Minimum (KBM) dilakukan dengan cara, zona bening hasil KHTM dari setiap konsentrasi dikulturkan ke dalam media NB cair steril lalu diinkubasi selama 18 jam pada suhu 37°C. Media NB cair steril digunakan sebagai blanko. Nilai OD dari kultur tersebut diukur pada panjang gelombang 600 nm secara duplo. Nilai absorban dari setiap konsentrasi kultur yang sama dengan blanko menunjukkan tidak ada pertumbuhan bakteri dan dinilai sebagai bakteriostatik (Vollekova
et al. 2001; Usman et al. 2007; dan Reuben
et al. 2008).
HASIL DAN PEMBAHASAN
Ekstraksi Flavonoid
7 7
Gambar 3 Ekstrak kasar flavonoid (A), ekstrak heksana (H), dan ekstrak kloroform (K). Berdasarkan data yang diperoleh ekstrak air memiliki persentase rendemen paling tinggi diantara ekstrak lainnya. Hal ini mengindikasikan bahwa fitokimia yang terkandung pada ekstrak air daun gambir lebih dominan daripada ekstrak lainnya. Ekstrak air memiliki warna orange kemerahan dan berbentuk kristal yang larut di dalam air. Hal ini kemungkinan akibat adanya kelompok senyawa fenol. Sriningsih
et al. (2008) menyatakan bahwa senyawa fenol cenderung mudah larut di dalam air karena umumnya senyawa ini mudah berikatan dengan gula sebagai glikosida. Adapun senyawa yang tergolong ke dalam kelompok senyawa fenol diantaranya flavonoid, hidrokuinon, katekol, dan kelompok asam fenolat (Grotewold 2005). Secara ilmiah telah diketahui bahwa keberadaan flavonoid di dalam daun gambir paling dominan yaitu sekitar 40-50% (Lucida et al 2007; Hayani 2008). Berdasarkan hasil yang diperoleh diduga bahwa ekstrak tersebut mengandung flavonoid lebih tinggi dibandingkan kelompok senyawa fenol lainnya.
Pengamatan terhadap ekstrak kloroform diperoleh bahwa ektrak ini berwarna hijau pekat dan berbentuk padatan yang menggumpal serta sukar larut di dalam air. Hal ini diduga akibat adanya senyawa golongan terpenoid. Lenny (2006) menyatakan bahwa terpenoid dapat larut dan terekstrak dengan baik pada pelarut eter dan kloroform. Senyawa yang tergolong ke dalam kelompok terpenoid diantaranya triterpenoid, sterol, serta pigmen tumbuhan. Warna hijau pekat pada ekstrak ini kemungkinan disebabkan adanya pigmen tumbuhan seperti klorofil dan adanya triterpenoid. Hal ini karena triterpenoid adalah senyawa berwarna yang sangat larut
di dalam kloroform. Triterpenoid yang bersifat sukar menguap kemungkinan menjadi penyebab bentuk koloidal pada ekstrak ini. Pengamatan terhadap ekstrak heksana diketahui bahwa ekstrak ini berbentuk kental yang tidak larut air dan berwarna hijau kecokelatan. Hal ini kemungkinan karena adanya minyak atsiri.
Berdasarkan hasil yang diperoleh, ekstraksi dengan cara maserasi bertingkat dapat memisahkan komponen fotokimia berdasarkan kepolarannya. Sukadana (2010) menyatakan ekstraksi dengan maserasi bertingkat dapat mengekstrak hampir 90% komponen fitokimia. Penggunaan tiga jenis pelarut yang berbeda kepolarannya pada teknik ini menyebabkan komponen fitokimia yang berbeda kepolarannya akan larut di dalam pelarut tersebut.
Pelarut metanol:air 9:1 digunakan selama tiga kali perendaman pada tahap awal ekstraksi yang dilanjutkan dengan pelarut metanol:air 1:1 selama tiga kali perendaman. Proses maserasi dilakukan pada temperatur kamar dan terlindung dari cahaya agar komponen bioaktif tidak teroksidasi (Sukadana2010). Selama proses ini akan terjadi peristiwa difusi. Pelarut akan diabsorbsi ke dalam sel melewati dinding sel. Adanya perbedaan konsentrasi antara larutan di dalam sel dengan di luar sel menyebabkan isi sel akan larut. Proses ini menyebabkan larutan yang konsentrasinya tinggi akan terdesak keluar dan diganti oleh cairan dengan konsentrasi rendah. Peristiwa tersebut berlangsung secara berulang hingga terjadi keseimbangan konsentrasi antara di luar sel dan di dalam sel (Amborowati 2003). Akhir dari proses ini adalah komponen fitokimia tumbuhan yang bersifat non polar hingga yang bersifat polar akan terekstrak. Pemisahan komponen fitokimia berdasarkan kepolarannya dilakukan dengan teknik partisi menggunakan corong pisah.
dilakukan analisis fitokimia. Analisis fitokimia juga berfungsi sebagai tahap evaluasi terhadap keberhasilan ekstraksi flavonoid.
Komponen Fitokimia Ekstrak Kasar Daun Gambir
Hasil uji fitokimia menunjukkan ekstrak air hanya mengandung flavonoid, ekstrak kloroform hanya mengandung triterpenoid, dan ekstrak heksana hanya mengandung tannin. Uji alkaloid dan fenolik memberikan hasil negatif pada ketiga ekstrak (Tabel 2). Berdasarkan hasil ini ekstrak air disebut sebagai ekstrak kasar flavonoid.
Dugaan adanya kelompok senyawa fenolik pada ekstrak air telah terbukti melalui teridentifikasinya flavonoid. Hasil uji yang negatif terhadap fenol hidrokuinon mengindikasikan kelompok senyawa fenolik yang mendominasi ekstrak air adalah flavonoid (Lampiran 5). Hal ini karena flavonoid pada tumbuhan berada dalam bentuk aglikon yang terikat gula sehingga larut dalam air (Lenny 2006). Dugaaan adanya kelompok senyawa terpenoid pada ekstrak kloroform dibuktikan melalui teridentikasinya triterpenoid. Senyawa ini bersifat nonpolar sehingga menjadi penyebab bentuk ekstrak seperti padatan yang menggumpal dan sukar larut di dalam air. Warna hijau pekat kemungkinan disebabkan oleh adanya klorofil. Diketahui pula pada ekstrak heksana teridentifikasi tanin. Secara kualitatif warna yang dihasilkan pada uji tannin adalah hijau pudar. Kemungkinan kandungan tannin pada ekstrak ini konsentrasinya rendah. Bentuk ekstrak yang tidak larut di dalam air, diduga terdapat minyak atsiri dan pigmen tumbuhan yang bersifat nonpolar seperti kuinon isoterpenoid (Harborne 1993).
Tabel 2 Komponen fitokimia ekstrak kasar
Keterangan:
+ : mengandung fitokimia uji - : tidak mengandung fitokimia uji
Proses ekstraksi flavonoid dengan metode maserasi bertingkat memberikan hasil yang baik. Komponen fitokimia terpisah berdasarkan kepolaran dan sifat kimianya. Komponen yang bersifat polar larut di dalam air (polar), komponen yang bersifat semipolar larut di dalam kloroform (semipolar), dan komponen yang bersifat nonpolar larut di dalam heksana (non polar).
Konsentrasi Hambat Tumbuh Minimum (KHTM) Ekstrak Kasar Daun Gambir
Hasil uji terhadap ketiga jenis ekstrak menunjukkan hanya ekstrak kasar flavonoid yang memiliki aktivitas antibakteri (Lampiran 7 dan Lampiran 8). Aktivitas antibakteri pada ketiga ekstrak terlihat dari terbentuknya zona bening (Gambar 4 dan Gambar 5) dan daya hambat kloramfenikol 1% (Gambar 6).
Gambar 4 Aktivitas antibakteri ekstrak kasar flavonoid (A), ekstrak kloroform (K), dan ekstrak heksana (H) terhadap S.aureus
9 9
Gambar 6 Zona hambat kloramfenikol 1% terhadap S.aureus (A) dan terhadap E.coli (B).
Ekstrak klorofom yang mengandung triterpenoid dan ekstrak heksana yang mengandung tannin tidak memiliki aktivitas antibakteri pada konsentrasi sampel 1%. Hal ini kemungkinan disebabkan oleh senyawa antibakteri yang terdapat pada setiap ekstrak dengan konsentrasi 1% belum mampu menghambat pertumbuhan bakteri. Kemungkinan konsentrasi tersebut terlalu rendah bagi senyawa antibakteri untuk bekerja optimal sehingga pembentukan kompleks protein dengan senyawa antibakteri terjadi melalui ikatan yang lemah dan segera mengalami penguraian. Akibatnya senyawa antibakteri belum mampu mengkoagulasikan protein serta melisiskan sel bakteri. Jika konsentrasi sampel ditingkatkan kemungkinan kedua ekstrak tersebut mampu menghambat pertumbuhan bakteri E.coli dan S.aureus. Hal ini karena tanin dan senyawa golongan terpenoid seperti minyak atsiri memiliki aktivitas antibakteri (Juliantana 2006). Mekanisme antibakteri tanin ialah dengan mengganggu permeabilitas membran sel bakteri (Ajizah 2004), dan diduga pula tannin dapat melakukan presipitasi protein dan menginaktifasi kerja enzim pada sel bakteri (Masduki 1996). Juliantina (2006) menyatakan bahwa minyak atsiri yang mengandung gugus fungsi hidroksil (-OH) dan karbonil memiliki aktivitas antibakteri.
Berdasarkan uji pendahuluan KHTM memperlihatkan ekstrak kasar flavonoid mampu menghambat pertumbuhan E.coli
dan S.aureus pada konsentrasi yang rendah. Kemampuannya sebagai antibakteri diperlihatkan melalui zona bening yang tidak ditumbuhi oleh bakteri akibat adanya senyawa bioaktif.
Tingkat kekuatan antibakteri ekstrak kasar falvonoid daun gambir dalam menghambat pertumbuhan bakteri ditentukan dari ukuran diameter zona hambat. Yadav dan Bishe (2004) menyatakan daya hambat tergolong sangat
kuat (>20 mm), kuat (10-20 mm), sedang (5-10 mm), dan tergolong lemah (<5 mm).
Zona bening yang terbentuk pada ekstrak kasar falvonoid sebesar 5 mm terhadap
E.coli dan 3 mm terhadap S.aureus. Hal ini menunjukkan ekstrak kasar falvonoid dengan konsentrasi 1% memiliki daya hambat yang tergolong lemah dalam menghambat pertumbuhan kedua jenis bakteri tersebut. Kloramfenikol 1% yang berperan sebagai kontrol positif memberikan daya penghambatan yang tergolong sangat kuat dengan diameter hambat 30 mm terhadap E.coli dan 25 mm terhadap
S.aureus. Menurut (Resce 1988) antibiotik ini bekerja dengan cara menghambat sintesis protein sel bakteri. Penggunaan kloramfenikol sebagai kontrol positif karena antibiotik ini dapat menghambat pertumbuhan bakteri Gram positif maupun Gram negatif.
Uji pendahuluan ini menunjukkan bahwa ekstrak kasar falvonoid memiliki aktivitas antibakteri lebih tinggi daripada senyawa fitokimia lainnya yang terkandung di dalam ekstrak heksana maupun ekstrak kloroform. Data ini selaras dengan hasil penelitian beberapa literatur yang menyebutkan bahwa senyawa fenol memiliki aktivitas antibakteri dimana flavonoid adalah salah satu kelompok senyawa polifenol (Sukadana 2010; Asih & Setiawan 2008; dan Juliantina
et al 2006).
Flavonoid yang terkandung pada ekstrak air daun gambir merupakan salah satu dari kelompok senyawa polifenolik, dengan jenis terbanyak adalah aglikon. Senyawa aglikon merupakan flavonoid dalam tumbuhan yang terikat pada gula sebagai glikosida, dan bersifat menghambat pertumbuhan bakteri secara kuat (Asih & Setiawan 2008). Menurut Grotewold (2005), flavonoid merupakan senyawa fenol dan diketahui bahwa senyawa fenol bersifat koagulator protein.
Konsentrasi Bakteriostatik Ekstrak Kasar Flavonoid Daun Gambir
Pemberian ekstrak kasar falvonoid daun gambir dengan variasi konsentrasi (1%, 3%, 5%, 7%, dan 9%) terhadap S.aureus dan
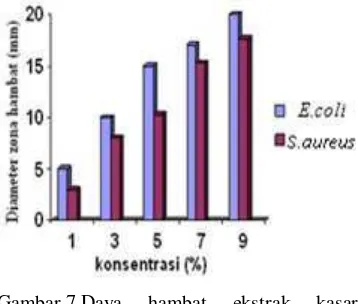
E.coli menunjukkan adanya aktivitas antibakteri melalui terbentuknya zona bening (Lampiran 6). Daya hambat ekstrak kasar falvonoid daun gambir pada konsentrasi 1% tergolong lemah terhadap
pada konsentrasi 3% tergolong kuat terhadap
E.coli (10 mm) namun tergolong sedang terhadap S.aureus (8 mm). Daya hambat ekstrak kasar falvonoid daun gambir tergolong kuat pada konsentrasi 5%, 7%, dan 9% untuk kedua jenis bakteri uji dengan diameter hambat antara 15-20 mm (Gambar 7).
Secara umum daya hambat ekstrak kasar falvonoid terhadap S.aureus lebih kecil daripada E.coli (Lampiran 9 dan Lampiran 10). Hal ini disebabakan oleh dinding sel bakteri Gram negatif (E.coli) lebih tipis (5-80 nm) dibandingkan dengan Gram positif (10-15 nm) sehingga bakteri Gram negatif lebih mudah untuk dihambat aktivitasnya dengan cara merusak dinding sel (Pelczar & Chan 1998).
Berdasarkan hasil yang diperoleh diketahui bahwa konsentrasi minimum antibakteri ekstrak kasar falvonoid yang mampu mengambat pertumbuhan bakteri uji berada pada konsentrasi 1%. Selanjutnya kemampuan antibakteri dalam membunuh bakteri uji dapat ditentukan melalui uji Konsentrasi Bunuh Minimum (KBM).
Gambar 7 Daya hambat ekstrak kasar flavonoid terhadap S.aureus dan
E.coli pada berbagai konsentrasi.
Konsentrasi Bakterisidal Ekstrak Kasar Flavonoid Daun Gambir
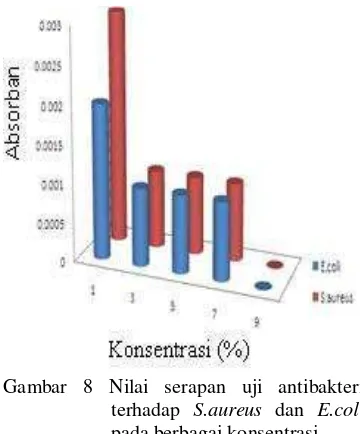
Hasil pengukuran biomassa sel bakteri menghasilkan ekstrak kasar falvonoid bekerja secara bakterisidal pada konsentrasi 9% sedangkan konsentrasi 1%, 3%, 5%, dan 7% masih memiliki aktivitas bakteri (Gambar 8). Hal ini terlihat melalui terukurnya biomassa sel bakteri pada keempat konsentrasi sedangkan pada konsentrasi 9% memiliki nilai absorban yang sama dengan blanko (Lampiran 11 dan Lampiran 12). Hal ini mengindikasikan tidak ada aktivitas sel bakteri.
Gambar 8 Nilai serapan uji antibakteri terhadap S.aureus dan E.coli
pada berbagai konsentrasi. Aktivitas pertumbuhan bakteri pada konsentrasi 1%, 3%, 5%, dan 7% kemungkinan karena rendahnya kadar antibakteri pada konsentrasi tersebut sehingga zat antibakteri belum mampu melisiskan sel bakteri secara sempurna. Hasil uji memperlihatkan daya hambat antibakteri ekstrak kasar falvonoid daun gambir semakin bertambah dengan meningkatnya konsentrasi. Menurut Akiyama et al. (2001) beberapa antimikrob yang bersifat bakteriostatik dapat bersifat bakterisidal jika digunakan dalam dosis tinggi. Cowan (1999) menyatakan mekanisme antibakteri flavonoid ialah dengan cara mengganggu aktivitas transpeptidase peptidoglikan sehingga pembentukan dinding sel terganggu dan sel mengalami lisis. Penelitian ini membuktikan secara ilmiah bahwa ekstrak kasar falvonoid daun gambir berpotensi sebagai sumber alternatif antibakteri baru. Daya hambat antibakteri terhadap E.coli lebih tinggi daripada S.aureus. Ekstrak kasar falvonoid daun gambir pada konsentrasi 9% memiliki spektrum luas terhadap kedua bakteri uji.
SIMPULAN DAN SARAN
Simpulan
10 10
pada konsentrasi 3% tergolong kuat terhadap
E.coli (10 mm) namun tergolong sedang terhadap S.aureus (8 mm). Daya hambat ekstrak kasar falvonoid daun gambir tergolong kuat pada konsentrasi 5%, 7%, dan 9% untuk kedua jenis bakteri uji dengan diameter hambat antara 15-20 mm (Gambar 7).
Secara umum daya hambat ekstrak kasar falvonoid terhadap S.aureus lebih kecil daripada E.coli (Lampiran 9 dan Lampiran 10). Hal ini disebabakan oleh dinding sel bakteri Gram negatif (E.coli) lebih tipis (5-80 nm) dibandingkan dengan Gram positif (10-15 nm) sehingga bakteri Gram negatif lebih mudah untuk dihambat aktivitasnya dengan cara merusak dinding sel (Pelczar & Chan 1998).
Berdasarkan hasil yang diperoleh diketahui bahwa konsentrasi minimum antibakteri ekstrak kasar falvonoid yang mampu mengambat pertumbuhan bakteri uji berada pada konsentrasi 1%. Selanjutnya kemampuan antibakteri dalam membunuh bakteri uji dapat ditentukan melalui uji Konsentrasi Bunuh Minimum (KBM).
Gambar 7 Daya hambat ekstrak kasar flavonoid terhadap S.aureus dan
E.coli pada berbagai konsentrasi.
Konsentrasi Bakterisidal Ekstrak Kasar Flavonoid Daun Gambir
Hasil pengukuran biomassa sel bakteri menghasilkan ekstrak kasar falvonoid bekerja secara bakterisidal pada konsentrasi 9% sedangkan konsentrasi 1%, 3%, 5%, dan 7% masih memiliki aktivitas bakteri (Gambar 8). Hal ini terlihat melalui terukurnya biomassa sel bakteri pada keempat konsentrasi sedangkan pada konsentrasi 9% memiliki nilai absorban yang sama dengan blanko (Lampiran 11 dan Lampiran 12). Hal ini mengindikasikan tidak ada aktivitas sel bakteri.
Gambar 8 Nilai serapan uji antibakteri terhadap S.aureus dan E.coli
pada berbagai konsentrasi. Aktivitas pertumbuhan bakteri pada konsentrasi 1%, 3%, 5%, dan 7% kemungkinan karena rendahnya kadar antibakteri pada konsentrasi tersebut sehingga zat antibakteri belum mampu melisiskan sel bakteri secara sempurna. Hasil uji memperlihatkan daya hambat antibakteri ekstrak kasar falvonoid daun gambir semakin bertambah dengan meningkatnya konsentrasi. Menurut Akiyama et al. (2001) beberapa antimikrob yang bersifat bakteriostatik dapat bersifat bakterisidal jika digunakan dalam dosis tinggi. Cowan (1999) menyatakan mekanisme antibakteri flavonoid ialah dengan cara mengganggu aktivitas transpeptidase peptidoglikan sehingga pembentukan dinding sel terganggu dan sel mengalami lisis. Penelitian ini membuktikan secara ilmiah bahwa ekstrak kasar falvonoid daun gambir berpotensi sebagai sumber alternatif antibakteri baru. Daya hambat antibakteri terhadap E.coli lebih tinggi daripada S.aureus. Ekstrak kasar falvonoid daun gambir pada konsentrasi 9% memiliki spektrum luas terhadap kedua bakteri uji.
SIMPULAN DAN SARAN
Simpulan
Saran
Berdasarkan hasil penelitian diketahui bahwa ekstrak kasar flavonoid daun gambir berpotensi sebagai sumber alternatif antibakteri baru namun perlu dilakukan pemurnian senyawa bioaktif golongan flavonoid yang memiliki aktivitas antibakteri sehingga dapat dibandingkan daya antibakterinya serta penelitian mengenai potensi antibakteri flavonoid daun gambir terhadap Streptococcus mutans penyebab karises (plak) pada gigi.
DAFTAR PUSTAKA
Ajizah A. 2004. Sensitivitas Salmonella typhimurium terhadap ekstrak daun
Psidium guajava . Bioscientiae 1: 31-8.
Akiyama H, Fujii K, Yamasaki O, dan Iwatsuki T. 2001. Antibacterial action of several tannins agains
Staphylococcus aureus. Journal of Antimicrobial Chemotherapy
48:487-91.
Akroum S, Bendjeddou D, dan Satta D.. 2009. Antibacterial activity and acute toxicity effect of flavonoids extracted from Mentha longifolia.
Journal of Scientific Research 2: 93-96.
Alen Y, Rahmayuni, dan Bakhtiar A. 2004. Isolasi senyawa bioaktif antinematoda Bursaphelencchus xylophilus dari ekstrak gambir.
Seminar Nasional. Tumbuhan Tanaman Obat Indonesia XXVI.
Padang, 7-8 september 2004. Amborowati TH. 2003. Teknik
ekstraksi..http://www.chemistry.org /metode-pemisahan standar [23 Januari 2010].
Asih I dan Setiawan A. 2008. Senyawa golongan flavonoid pada ekstrak n -butanol kulit batang bungur (Lagerstroemia speciosa). J. Kimia
2: 111-116.
Bapeda TK 1 Sumbar. 1997. Kebijakan dan program pemerintah daerah untuk memacu ekspor komoditi hortikultura. Makalah seminar pengembangan produk hortikultura
dengan orientasi pasar bebas. Padang, 27 November 1997. BPS. 2003. Statistika Kesejahteraan Rakyat.
Jakarta: Badan Pusat Satistik. Brooks GF, Janet SB, Stephen AM. 2001.
Mikrobiologi Kedokteran. Jakarta: Salemba Medika.
Chomnawang MT, Surasno S, dan Gristanapan. 2005. Antimicrobial effects of Thai medicinal plants against acneinducing bacteria.
Jethnopharmacol 101: 330-333. Cowan MM. 1999. Plant products as
antimicrobial agents. Clinical Microbiology Reviews 12: 564–82.
Dewi PR. 2008. Pengaruh pemberian kombinasi tolak angin dan kloramfenikol terhadap mencit balb/c yang diinfeksi Salmonella typhimurium [Skripsi]. Semarang: Fakultas Kedokteran, Universitas Diponogoro.
Dhalimi A. 2006. Permasalahan gambir di Sumatera Barat dan alternatif pemecahannya. Journal of Education. 5: 46-59.
Dwidjoseputro D. 1994. Dasar-Dasar Mikrobiologi. Jakarta: Djambatan. Fournier dan Philpott. 2005. Recognition of
Staphylococcus aureus by the innate immun system. Clin. Microbial. 3: 21-40.
Grotewold E. 2005. The Science of Flavonoids. USA: Sprinmger. Gupte, S. 1990, Mikrobiologi Dasar. Ed.3.
Jakarta: Bina Aksara.
Handayani D R, Ranova, Farlian, dan Arneti. 2004. Pengujian efek anti feedan dari ekstrak dan fraksi daun gambir (Uncaria gambir Roxb) terhadap hama Spedoptera litura Fab. Seminar Nasional. Tumbuhan Tanaman Obat Indonesia XXVI. Padang, 7-8 September 2004.
AKTIVITAS ANTIBAKTERI EKSTRAK KASAR FLAVONOID
DAUN GAMBIR (
Uncaria gambir
Roxb)
SILVIKASARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Saran
Berdasarkan hasil penelitian diketahui bahwa ekstrak kasar flavonoid daun gambir berpotensi sebagai sumber alternatif antibakteri baru namun perlu dilakukan pemurnian senyawa bioaktif golongan flavonoid yang memiliki aktivitas antibakteri sehingga dapat dibandingkan daya antibakterinya serta penelitian mengenai potensi antibakteri flavonoid daun gambir terhadap Streptococcus mutans penyebab karises (plak) pada gigi.
DAFTAR PUSTAKA
Ajizah A. 2004. Sensitivitas Salmonella typhimurium terhadap ekstrak daun
Psidium guajava . Bioscientiae 1: 31-8.
Akiyama H, Fujii K, Yamasaki O, dan Iwatsuki T. 2001. Antibacterial action of several tannins agains
Staphylococcus aureus. Journal of Antimicrobial Chemotherapy
48:487-91.
Akroum S, Bendjeddou D, dan Satta D.. 2009. Antibacterial activity and acute toxicity effect of flavonoids extracted from Mentha longifolia.
Journal of Scientific Research 2: 93-96.
Alen Y, Rahmayuni, dan Bakhtiar A. 2004. Isolasi senyawa bioaktif antinematoda Bursaphelencchus xylophilus dari ekstrak gambir.
Seminar Nasional. Tumbuhan Tanaman Obat Indonesia XXVI.
Padang, 7-8 september 2004. Amborowati TH. 2003. Teknik
ekstraksi..http://www.chemistry.org /metode-pemisahan standar [23 Januari 2010].
Asih I dan Setiawan A. 2008. Senyawa golongan flavonoid pada ekstrak n -butanol kulit batang bungur (Lagerstroemia speciosa). J. Kimia
2: 111-116.
Bapeda TK 1 Sumbar. 1997. Kebijakan dan program pemerintah daerah untuk memacu ekspor komoditi hortikultura. Makalah seminar pengembangan produk hortikultura
dengan orientasi pasar bebas. Padang, 27 November 1997. BPS. 2003. Statistika Kesejahteraan Rakyat.
Jakarta: Badan Pusat Satistik. Brooks GF, Janet SB, Stephen AM. 2001.
Mikrobiologi Kedokteran. Jakarta: Salemba Medika.
Chomnawang MT, Surasno S, dan Gristanapan. 2005. Antimicrobial effects of Thai medicinal plants against acneinducing bacteria.
Jethnopharmacol 101: 330-333. Cowan MM. 1999. Plant products as
antimicrobial agents. Clinical Microbiology Reviews 12: 564–82.
Dewi PR. 2008. Pengaruh pemberian kombinasi tolak angin dan kloramfenikol terhadap mencit balb/c yang diinfeksi Salmonella typhimurium [Skripsi]. Semarang: Fakultas Kedokteran, Universitas Diponogoro.
Dhalimi A. 2006. Permasalahan gambir di Sumatera Barat dan alternatif pemecahannya. Journal of Education. 5: 46-59.
Dwidjoseputro D. 1994. Dasar-Dasar Mikrobiologi. Jakarta: Djambatan. Fournier dan Philpott. 2005. Recognition of
Staphylococcus aureus by the innate immun system. Clin. Microbial. 3: 21-40.
Grotewold E. 2005. The Science of Flavonoids. USA: Sprinmger. Gupte, S. 1990, Mikrobiologi Dasar. Ed.3.
Jakarta: Bina Aksara.
Handayani D R, Ranova, Farlian, dan Arneti. 2004. Pengujian efek anti feedan dari ekstrak dan fraksi daun gambir (Uncaria gambir Roxb) terhadap hama Spedoptera litura Fab. Seminar Nasional. Tumbuhan Tanaman Obat Indonesia XXVI. Padang, 7-8 September 2004.
12 12
Harborne JB. 1993. Phytochemistry. London: Academic Press.
Hayani E. 2003. Analisis kadar katekin dari gambir dengan berbagai metode.
Buletin Teknik Pertanian 8: 31-32. Idris H, Nasrun, dan Syamsu H. 1997.
Pemanfaatan daun gambir sebagai pestisida nabati untuk pengendalian penyakit kanker batang pada tanaman kayu manis. Prosiding Kongres Nasional XIV ; Palembang, 27-29 Oktober 1997. Palembang: Perhimpunan Fitopatologi Indonesia. hlm 480-482.
Jawetz et al. 2001. Mikrobiologi Kedokteran. Surabaya: Salemba Medical.
Jones N. 2000. The impact of antimicrobial resistance: changing epidemiology of community acquired respiratory-tract infection. Journal of Health system Pharmacy 56: 4-11.
Juliantina F, Citra M, dan Nirwani B. 2007. Manfaat sirih merah (Piper crocatum) sebagai agen anti bakterial terhadap bakteri Gram positif dan Gram negatif. JKKI 10: 1-10.
Kadarwati U. 1990. Pola resistensi
Staphylococcus aureus terhadap antibiotika aminoglikosida. Cermin Dunia Kedokteran 56: 45-48. Kresnawaty I, Zainuddin A. 2009. Aktivitas
antioksidan dan antibakteri dari derivat metil ekstrak etanol daun gambir (Uncaria gambir). Jurnal Littri 15: 145-151.
Kusharyono. 2004. Efek infus gambir (Uncaria gambir Roxb) yang diperoleh dari pasar terhadap sistem syaraf otonom mencit jantan.
Seminar Nasional. Tumbuhan Tanaman Obat Indonesia XXVI. Padang, 7-8 September 2004. Kusumaningjaty F. 2009. Potensi antibakteri
kitosan sebagai pengawet tahu. [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Lenny S. 2006. Senyawa flavonoida, fenil
propanoid, dan alkaloid. [Skripsi]. Medan: Fakultas Matematika dan
Ilmu Pengetahuan Alam, Universitas Sumatera Utara. Lucida H, Bachtiar A, dan Putri WA. 2006.
Formulasi sediaan antiseptik mulut dari katekin gambir [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Masduki I, 1996. Efek Antibakteri ekstrak biji pinang (Areca catechu) terhadap S. aureus dan E. coli.
Cermin Dunia Kedokteran 109:21-4.
Nasrun. 2001. Pemanfaatan katekin ekstrak daun gambir sebbagai fungisida nabati dalam pengendalian penyakit layu tanaman tomat. Stigma 1:54-57.
Nazir M. 2000. Budidaya Gambir, Pengolahan, dan Prospek Diversifikasinya. Padang: Yayasan Hutanku.
Nishino C, Enoki N, dan Tawata. 1987. Antibacterial activity of flavonoids againsts Staphylococcus epidermidis a skin bacterium. Agric Biochem 51-139-143.
Pelczar MJ dan Chan ECS. 1998. Dasar-dasar Mikrobiologi. Jakarta: UI Pr. Pramono S dan Katno. 2002. Tingkat
manfaat dan keamanan tanaman obat dan obat tradisional. Seminar
Sehari “Reevaluasi dan
Reformulasi Obat Tradisional
Indonesia”. Yogyakarta: Fakultas Farmasi UGM. hlm 1-14.
Recse RE. 1988. Handbook of Antibiotics. Boston: Little Brown and Company.
Refdanita, Maksum, Nurgani A, dan Endang P. 2004. Pola kepekaan bakteri terhadap antibiotika di ruang rawat intensif rumah sakit Fatmawati Jakarta Timur tahun 2001-2002.
Makara Kesehatan 8: 41-48. Reuben KD, Abdulrahman FI, Akan JC,
Risfaheri dan Yanthi L. 1993. pengaruh ketuaan dan penanganan daun sebelum pengempaan terhadap rendemen dan mutu gambir. Buletin Penelitian Rempah dan Obat 1 : 46-51.
Setiawan DM, Masria S, dan Chrysanti. 2010. Daya antibakteri dan waktu kontak infusa teh hijau (Camellia sinensis) terhadap Salmonella typhi
secara in vitro. MKB 42: 51-55. Sriningsih et al. 2008. Analisa senyawa
golongan flavonoid herba Tempuyung (Sonchus arvensis l.).
J.Kimia 6: 115-120.
Suherdi A, Denian dan Syamsu H. 1991. Budidaya dan pasca panen gambir serta permasalahannya. Padang: Biro Bina Pengembangan Sarana Perekonomian.
Sukadana IM. 2010. Aktivitas Antibakteri senyawa flavonoid dari kulit akar Awar-Awar (Ficus Septica).
J.Kimia 1:63-70.
Sukati K dan Kusharyono. 2004. Efek infuse gambir (Uncaria gambir Roxb) yang diperoleh dari pasar terhadap parameter onset dan durasi waktu tidur thiopental pada mencit jantan.
Seminar Nasional. Tumbuhan Tanaman Obat Indonesia XXVI. Padang, 7-8 September 2004. Susanti DY. 2008. Efek suhu pengeringan
terhadap kandungan fenolik dan kandungan katekin ekstrak daun kering gambir. Prosiding Seminar Nasional Teknik Pertanian; Yogyakarta, 18-19 November 2008. Yogyakarta: UGM. hlm 1-11
Suwandi U. 1991. Resistensi mikrob terhadap antibiotik. Cermin Dunia Kedokteran 70:46-48.
Thorpe JF & Whiteley MA. 1990. Thorpe’s Dictionary of Applied Chemistry. Fourth edition. Longmans Green and Co 2:434-438.
Tika FH, Mukhtar H, dan Bakhtiar A. 2004. Efek katekin dari gambir terhadap tukang lambung tikus betina.
Seminar Nasional. Tumbuhan Tanaman Obat Indonesia XXVI. Padang, 7-8 September 2004. Todar K. 1997. The Control of Microbial
Growth. Wincosin: University of Wincosin.
Usman H, Abdulrahman FI, and Ladan AH. 2007. Phytochemical and antimicrobial evaluation of Tribulus terrestris.(Zygophylaceae) Growing in Negeria. J.Bio. Sci. 2: 244-247. Vollekova AD, Kostalova, and Sochora R.
2001. Isoquinoline alkaloids from
Mahonia aquifolium stem bark is active against Malassezia sp. Folia Microbiol 46:107-111.
Yadav AV, Bishe SB. 2002. Chitosan: A potential biomaterial affective against typhoid. Current Sci 9: 1176-1178.
Yuliani SE, Hayani, Supriadi. 1999. Pemeriksaan kandungan kimia aktif antimikrob gambir. Seminar PERHIPBA. Jakarta: Universitas Pancasila. hlm 9-11.
AKTIVITAS ANTIBAKTERI EKSTRAK KASAR FLAVONOID
DAUN GAMBIR (
Uncaria gambir
Roxb)
SILVIKASARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SILVIKASARI. Aktivitas Antibakteri Ekstrak Kasar Flavonoid Daun Gambir
(
Uncaria gambir
Roxb). Dibimbing oleh LAKSMI AMBARSARI dan
SURYANI.
iii
ABSTRACT
SILVIKASARI. Antibacterial Activities of Crude Extract of flavonoids in Gambir
Leaves (
Uncaria gambir
Roxb
.
) Under the direction of LAKSMI AMBARSARI
and SURYANI.
AKTIVITAS ANTIBAKTERI EKSTRAK KASAR FLAVONOID
DAUN GAMBIR (
Uncaria gambir
Roxb)
SILVIKASARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
v
Judul Skripsi : Aktivitas Antibakteri Ekstrak Kasar Flavonoid Daun Gambir
(
Uncaria gambir
Roxb)
Nama
: Silvikasari
NIM
: G84060684
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarasari, MS
Dr. Suryani, M.Sc
Ketua Anggota
Diketahui
Dr. Ir. I Made Artika, M. App Sc.
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis panjatkan atas kehadirat Allah SWT yang telah
melimpahkan rahmat dan karunia-Nya sehingga karya ilmiah ini dapat
diselesaikan. Topik penelitian
yang dipilih penulis adalah ”
Aktivitas Antibakteri
Ekstrak Kasar Flavonoid Daun Gambir (
Uncaria gambir
Roxb
)”
. Penelitian
dilakukan sejak tanggal 1 April sampai dengan 31 Juni 2010 di Laboratorium
Penelitian Biokimia, FMIPA IPB.
Penulis menyadari bahwa kelancaran dari penelitian ini tidak lepas dari
kontribusi beberapa pihak. Terima kasih penulis sampaikan kepada keluarga atas
doa dan dukungannya. Terima kasih juga penulis sampaikan kepada Dr. Laksmi
Ambarsari, MS selaku pembimbing utama dan Dr. Suryani, M.Sc sebagai
pembimbing kedua yang telah memberikan saran dan kritik selama penelitian.
Penulis juga berterima kasih kepada Direktorat Jenderal Pendidikan Tinggi
(DIKTI) yang telah memberikan bantuan finansial dalam penelitian ini dan
kepada Nuri Izzatil Wafa yang telah membantu secara teknis selama penelitian.
Karya ilmiah ini mungkin masih jauh dari kesempurnaan. Kritik dan saran
yang membangun akan penulis jadikan pelajaran yang berharga untuk perbaikan
di masa mendatang. Semoga karya ilmiah ini bermanfaat bagi para pembaca.
Bogor, Januari 2011
vii
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR GAMBAR ...
ix
DAFTAR LAMPIRAN ...
x
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Gambir (
Uncaria gambir
Roxb) ...
2
Flavonoid ...
3
Antibakteri ...
3
Bakteri Uji ...
4
BAHAN DAN METODE
Bahan dan Alat ...
5
Metode ...
5
HASIL DAN PEMBAHASAN
Ekstraksi Flavonoid ...
7
Komponen Fitokimia Ekstrak Kasar Daun Gambir ...
8
Konsentrasi Hambat Tumbuh Minimum ...
8
Konsentrasi Bakteriostatik Ekstrak Kasar Flavonoid ...
9
Konsentrasi Bakterisidal Ekstrak Kasar Flavonoid ...
10
SIMPULAN DAN SARAN ...
10
DAFTAR PUSTAKA ...
11
ix
DAFTAR GAMBAR
Halaman
1
Gambir (
Uncaria gambir
Roxb) ...
2
2
Jenis-jenis flavonoid ...
3
3
Hasil ekstraksi flavonoid ...
7
4
Hasil uji pendahuluan KHTM terhadap
Eschericia coli
...
9
5
Hasil uji pendahuluan KHTM terhadap
Staphylococcus aureus
...
9
6
Zona
hambat
kloramfenikol
terhadap
Eschericia
coli
dan
Staphylococcus aureus
...
9
7
Zona hambat ekstrak kasar flavonoid terhadap
Eschericia coli
dan
Staphylococcus aureus
...
10
DAFTAR LAMPIRAN
Halaman
1
Strategi penelitian ...
16
2
Proses ekstraksi flavonoid... ....
17
3
Prosedur pembuatan media pertumbuhan bakteri ...
18
4
Prosedur uji aktivitas antibakteri ...
19
5
Analisis fitokimia ...
20
6
Bakteriostatik ekstrak kasar flavonoid terhadap
E.coli
dan
S.aureus
…
...
21
7
Daya hambat ekstrak kasar hasil ekstraksi flavonoid terhadap
E.coli
...
22
8
Daya hambat ekstrak kasar hasil ekstraksi flavonoid terhadap
S.aureus
... ...
22
9
Daya hambat ekstrak kasar flavonoid terhadap
E.coli
...
22
10
Daya hambat ekstrak kasar flavonoid terhadap
S.aureus
...
22
11
Serapan uji antibakteri ekstrak kasar flavonoid terhadap
E.coli
...
22
1 1
PENDAHULUAN
Penyakit infeksi merupakan salah satu masalah dalam bidang kesehatan yang semakin berkembang. Infeksi dapat disebabkan oleh bakteri, jamur, virus dan parasit. Staphylococcus aureus adalah salah satu patogen pada manusia yang dapat menyebabkan infeksi. Infeksi oleh S.aureus
pada kulit ditandai dengan gejala peradangan, nekrosis, dan pembentukan abses (Jawetz et al. 2001). Bakteri lain yang paling sering menyebabkan infeksi ialah
Eschericia coli. Bakteri ini bersifat patogen dan dapat menimbulkan kebusukan pada makanan. Infeksi yang sering terjadi ialah infeksi pada saluran pencernaan, infeksi saluran kemih, dan meningitis (Todar 1997). Pencegahan terhadap serangan infeksi dapat dilakukan dengan penggunaan antibiotik. Antibiotik adalah zat kimia yang dihasilkan oleh fungi dan bakteri tanah yang memiliki kemampuan mematikan atau menghambat pertumbuhan mikrob sedangkan toksisitasnya terhadap manusia relatif kecil. Penggunaan antibiotik secara besar-besaran adalah faktor utama terjadinya resistensi (Suwandi 1991).
Pola kepekaan S. aureus terhadap enam jenis antibiotika di wilayah Jakarta Timur menunjukkan bahwa bakteri ini telah resisten terhadap tetrasiklin 2.7%, streptomisin 44.8%, kloramfenikol 23.6%, ampisilin 18.1%, eritromisin 6.6%, dan penisilin 4.2% (Kadarwati 1990). Resistensi
S. aureus terhadap nafsilin pada tahun 1970 di Denmarksebesar 40% isolat. Resistensi S. aureus terhadap nafsilin pada tahun 1990 mencapai 20-30% isolat (Jawetz et al. 2001). Strain E.coli yang ditemukan di Rumah Sakit Fatmawati Jakarta, telah mengalami resistensi terhadap ampisilin 100%, penisilin 94.5%, amoksilin 86.2%, kloramfenikol 83.9%, tetrasiklin 83.9%, dan sulbenisilin 79.4% (Refdanita et al. 2004).
Seiring dengan meningkatnya resistensi bakteri harus diimbangi dengan penemuan obat baru. Hal ini mendorong ditemukannya sumber antibakteri baru yang lebih efektif melawan infeksi mikrob patogen, lebih murah, memiliki efek samping yang lebih kecil, dan tersedia dalam jumlah besar sehingga resistensi dapat diatasi.
Pemanfaatan tanaman obat di Indonesia menurut data dari BPS (2003) menunjukkan bahwa persentase penduduk sakit di pedesaan yang menggunakan obat tradisional untuk pengobatan sebanyak
29.65%. Kecenderungan masyarakat menggunakan obat tradisional ataupun tanaman obat karena dinilai memiliki efek samping yang lebih kecil daripada obat sintetik. Pramono dan Katno (2002) menyatakan obat tradisional dan tanaman obat memiliki lebih dari satu efek farmakologis sehingga penggunaannya harus tepat dan benar (dosis, waktu, cara, penggunaan, dan pemilihan bahan alam yang sesuai indikasi penyakit). Kekeliruan dalam penggunaan obat tradisional ataupun tanaman obat dapat berbahaya bagi kesehatan. Oleh karena itu diperlukan informasi ilmiah yang lengkap untuk menghindari hal tersebut.
Salah satu tanaman yang dapat dimanfaatkan sebagai obat adalah Gambir (Uncaria gambir Roxb). Tanaman gambir tumbuh melimpah di wilayah Sumatera Barat bahkan menjadi komoditi ekspor terbesar di wilayah tersebut yang mampu memberikan sumbangan besar pada Produk Domestik Regional Bruto (PDRB) daerah dan devisa untuk negara. Volume ekspor tanaman gambir pada tahun 2000 sebesar 6.633 ton dan meningkat pada tahun 2004 menjadi 12.438 ton. Hal ini menunjukkan terjadi peningkatan volume ekspor sebesar 87,49% selama kurun waktu lima tahun (Bapeda 1997).
Tanaman gambir sering dimanfaatkan oleh masyarakat tradisional sebagai obat sakit gigi, obat luka, obat diare, dan sebagai bahan pelengkap menyirih y