PURIFIKASI PARSIAL DAN KARAKTERISASI ENZIM
PROTEASE DARI ISOLAT B19 KUB BPPT CC
SARAH FITRIANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Purifikasi Parsial dan Karakterisasi Enzim Protease dari Isolat B19 KUB BPPT CC adalah benar karya saya denganarahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2013
Sarah Fitriani
ABSTRAK
SARAH FITRIANI. Purifikasi Parsial dan Karakterisasi Enzim Protease dari Isolat B19 KUB BPPT CC. Dibimbing oleh SURYANI dan SISWA SETYAHADI.
Ketidakmampuan dari protease yang berasal dari tumbuhan dan hewan untuk memenuhi kebutuhan enzim dunia saat ini telah menginisiasi peningkatan penggunaan protease mikrobial. Tujuan penelitian ini untuk memurnikan dan mengkarakterisasi protease mikrobial dari isolat B19 KUB BPPT CC. Isolat ditumbuhkan pada media yang mengandung kalsium kaseinat agar 0.5%, urea 0.5%, dan ekstrak khamir 0.05%. Protease ekstraseluler dari isolat B19 KUB BPPT CC dipurifikasi dengan menggunakan presipitasi amonium sulfat dan dialisis. Fraksinasi amonium sulfat pada kejenuhan 60%berhasil meningkatkan kemurnian enzim hingga 8.37 kali. Protease termofilik alkalin ini memiliki pH optimum 9.0 dan suhu optimum pada 60 °C. Fenilmetansulfonil-fluor (PMSF) menginhibisi aktivitas enzim ini secara sempurna, sehingga enzim tergolong dalam kelas protease serin. Pengujian pengaruh terhadap ion logam menunjukkan ion Na+ dapat meningkatkan aktivitas enzim ini hingga 119.93%. Nilai Km dan
Vmaks enzim dengan kasein sebagai substrat adalah 0.021 mM dan 90.91 U/mg. Estimasi berat molekul enzim berdasarkan hasil zimografi kasein adalah 33.8 kDa dan 19.7 kDa. Protease ini memiliki kemampuan untuk menghidrolisis berbagai susbtrat seperti serum albumin (BSA), gelatin, hemoglobin, kasien, dan kolagen.
Kata kunci: isolat B19 KUB BPPT CC, karakterisasi, protease serin-alkalin purifikasi parsial
ABSTRACT
SARAH FITRIANI. Partial Purification and Characterization of Protease Enzyme from B19 KUB BPPT CC isolate. Supervised by SURYANI and SISWA SETYAHADI.
The inability of the plant and animal proteases to meet current world demands has led to an increased interest in microbial proteases. The purpose of this research was to purify and characterize microbial protease from B19 KUB BPPT CC isolate. The isolate were grown in media containing calcium caseinate agar 0.5%, urea 0.5%, and yeast extract 0.05%. Extracelluler protease from B19 KUB BPPT CC isolate was purified using amonium sulfate precipitation and dialysis. The protease was purified 8.37 fold with a recovery by 60% amonium sulfate precipitation. This thermophilic alkaline protease showed a pH optimum of 9.0 and optimum temperature was 60 °C. Phenylmethanesulfonyl-fluoride (PMSF) completely inhibited the enzyme activity suggesting that it was serine protease. Among metal ions, the Na+ ions enhanced activity up to 119.93%. The Km and Vmax values exhibited by purified protease were 0.021 mM and 90.91 U/mgusing casein as substrate. The molecular weight was estimated to be 33.8 kDa and 19.7 kDa on casein zymography. In addition, this enzyme was capable of hydrolyzing bovine serum albumin (BSA), gelatin, hemoglobin, casein, and collagen.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PURIFIKASI PARSIAL DAN KARAKTERISASI ENZIM
PROTEASE DARI ISOLAT B19 KUB BPPT CC
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul Skripsi: Purifikasi Parsial dan Karakterisasi Enzim Protease dari Isolat B19 KUB BPPT CC
Nama : Sarah Fitriani NIM : G84090013
Disetujui oleh
Dr Suryani, S.P, M.Sc Pembimbing I
Dr Ir Siswa Setyahadi, M.Sc Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, M.App.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan Januari 2013 ini adalah Purifikasi Parsial dan Karakterisasi Enzim Protease dari Isolat B19 KUB BPPT CC.
Terima kasih penulis ucapkan kepada Ibu Dr Suryani, S.P M.Sc dan Bapak Dr Ir Siswa Setyahadi, M.Sc selaku pembimbing, serta Kak Ruby Setiawan yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Djamil S.Si, M.Si selaku Kepala Laboratorium Teknologi Bioindustri, Laboratorium Pengembangan Teknologi Agroindustri dan Biomedika (LAPTIAB), Badan Pengkajian dan Penerapan Teknologi, beserta staf Divisi Biokatalis, yang telah membantu selama pengumpulan data penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat, terutama untuk pengembangan ilmu biokimia.
Bogor, Juni 2013
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan 2
Alat 2
Prosedur Analisis Data 2
HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 9
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 13
LAMPIRAN 16
DAFTAR GAMBAR
1 Pengaruh suhu (A) dan pH (B) pada aktivitas protease 5 2 Hubungan ln [aktivitas] protease isolat B19 KUB BPPT CC dialisat terhadap
waktu pemanasan pada suhu 50 °C (■) dan 70 °C (▲) 6 3 Pengaruh penambahan ion logam terhadap aktivitas protease isolat B19KUB
BPPT CC pada suhu dan pH optimum 6 4 Pengaruh inhibitor terhadap aktivitas protease isolat B19KUB BPPT CC pada
suhu dan pH optimum 7 5 Hasil analisis bobot molekul SDS-PAGE dan zimografi denganperangkat
lunak PhotoCap (a)marker LMW, (b)ekstrak kasar protease, (c) dialisat 60%,
dan (d) zimogram kasein 0.1% 7 6 SDS-PAGE produk hasil hidrolisis enzim protease dialisat isolat B19 KUB
BPPT CC (a) BSA , (a') BSA terhidrolisis, (b) gelatin, (b’)gelatinterhidrolisis, (c)hemoglobin, (c’) hemoglobin terhidrolisis, (d)kasein,(d’) kasien
terhidrolisis, (e) kolagen, dan (e’) kolagen terhidrolisis 8 7 Pengaruh konsentrasi substrat terhadap aktivitas spesifik enzim (A) dan kurva
Lineweaver – Burk (B) 8
DAFTAR LAMPIRAN
1 Aktivitas protease fraksi pemurnian 16
2 Pengaruh suhu 17
3 Pengaruh pH 18
4 Stabilitas terhadap panas 19
5 Pengaruh ion logam dan inhibitor 20
PENDAHULUAN
Enzim merupakan biokatalisator yang diproduksi oleh makhluk hidup untuk mengkatalisis dan mengendalikan reaksi kimia yang penting dalam tubuh makhluk hidup tersebut. Berbeda dengan katalisator biasa, enzim mempunyai spesifitas katalitik yang tinggi yang ditentukan oleh gugus fungsi pada situs aktifnya (Nelson dan Cox 2007). Kemajuan dalam teknologi fermentasi, rekayasa genetika, dan teknologi aplikasi enzim menyebabkan penggunaan enzim dalam dunia industri semakin meluas. Kunci kemajuan ini terletak pada kemampuan enzim untuk bekerja secara spesifik dengan akurasi yang tinggi sebagai biokatalis. Keunggulan-keunggulan ini menyebabkan enzim menjadi katalis hayati yang jauh lebih unggul daripada katalis kimiawi (Sutandi 2003).
Protease merupakan enzim proteolitik yang sangat penting dan banyak digunakan secara luas dalam aplikasi industri melalui reaksi sintesis dan hidrolisis. Protease digunakan dalam aplikasi industri seperti detergen, farmasi, produk kulit, pengempukkan daging, produk-produk makanan, hidrolisat protein, dan proses pengolahan limbah industri (Martin dan Nascimento 2006). Enzim ini menguasai lebih dari 65% total penjualan enzim dunia (Chu 2007). Protease komersial diproduksi oleh mikroba, hewan, dan tumbuhan. Protease mikrobial saat ini banyak diproduksi sejalan dengan permintaan dunia industri yang terus meningkat (Rao et al. 1998). Protease ini (EC: 3.4.111-19) mewakili satu dari tiga grup besar penjualan enzim dunia (Dias et al 2008) dan menguasai 40% total dari penjualan enzim dunia dengan produsen utama perusahaan Novozymes di Denmark (Rao et al. 1998). Mikroba dipilih sebagai sumber enzim yang menjanjikan karena memiliki keragaman biokimia yang luas dan kemungkinan untuk dimanipulasi secara genetik (Rao et al. 1998).
Sebagian besar enzim mikroba yang dihasilkan secara komersial adalah enzim ekstraseluler yang diproduksi di dalam sel dan dikeluarkan ke cairan lingkungan sekitar tempat sel itu tumbuh. Hal ini menjadi salah satu kelebihan mikroba dibandingkan dengan hewan dan tumbuhan yang membutuhkan proses penghancuran sel untuk mendapatkan enzim yang diinginkan (Sutandi 2003). Pada penelitian ini protease ekstrasel diisolasi dari isolat B19 KUB BPPT CC yang dihasilkan dari penapisan pada kulit udang yang difermentasi. Protease komersial dari bakteri terutama genus dari Bacillusyang paling banyak diproduksi adalah protease netral dan protease alkalin. Protease alkalin saat ini paling banyak digunakan dalam industri enzim karena memiliki beberapa keunggulan. Karakteristik protease alkalin dari bakteri adalah aktivitasnya yang tinggi pada kisaran pH 10 dan suhu optimalnya mencapai 60 °C, karakter inilah yang menyebabkan protease ini cocok untuk diaplikasikan pada industri detergen (Rao
et al. 1998).
2
KUB BPPT CC memiliki aktivitas spesifik yang tinggi setelah mengalami purifikasi parsial, selain itu didapatkan berbagai karakter yang menopang kondisi optimum bekerjanya enzim, dan diperoleh nilai Km dan Vmaksnya. Penelitian ini diharapkan dapat menghasilkan enzim protease yang telah dipurifikasi dan dikarakterisasi dari isolat lokal yang potensial, sehingga dapat dimanfaatkan dalam skala aplikasi lebih lanjut. 0.5% kalsium kaseinat agar, 0.05% ekstrak khamir, dan 0.5% urea. Bahan untuk uji aktivitas enzim adalah larutan TCA Amano, larutan kasein 0.6%, standar tirosin, bufer fosfat 0.5 M, larutan Na2CO30.55 M, air Milli-Q, dan reagen Folin Ciocalteu. Kolagen, serum albumin (BSA), hemoglobin, dan gelatin untuk uji spesifitas substrat. EDTA (Ethylenediaminetetraaceticacid), PMSF (Phenylmethanesulfonyl fluoride), reagen Lowry, ion logam, untuk karakterisasi enzim, standar protein SDS-PAGE, dan membran tubing selulosa D9777 (Sigma-Aldrich).
Alat
Alat-alat yang digunakan dalam penelitian ini adalah autoklaf, magnetic stirer, inkubator bergoyang, lemari pendingin, oven, laminar air flow, sentrifugator, thermo mixer, UV-Vis spektrofotometer, hotplate, tabung vial (Eppendorf), pipet mikro,tip plastik, labu ukur, gelas piala, labu Erlenmeyer, alat
vortex, BECKMAN φ 34 pH meter, dan perangkat elektroforesis SDS-PAGE.
Prosedur Analisis Data Produksi Enzim Protease
Kultur isolat B19 KUB BPPT CC agar miring diambil 1-2 ose dan diinokulasikan dalam dua tahap masing-masing ke dalam 10 mL kemudian 90 mL media Luria Bertani cair sebagai media starter, pada tiap tahap dilakukan inkubasi dalam inkubator bergoyang pada suhu 37 ºC dengan kecepatan 150 rpm selama 6 jam. Kultur pada media inokulum 100 mL dimasukkan ke dalam media produksi 900 mL, lalu diinkubasi pada suhu 37 ºC dengan kecepatan 150 rpm selama 24 jam. Enzim diisolasi dengan sentrifugasi pada kecepatan 13000 rpm selama 5 menit pada suhu 4 ºC, kemudian supernatan diambil sebagai filtrat enzim (Wahyuntari dan Hendrawati et al. 2012 ; Guangrong et al. 2006 ; Sezonov G et al. 2007).
Uji Aktivitas Enzim Protease dengan Metode Amano Termodifikasi
3
ditambahkan 625 µL larutan TCA Amano dan diinkubasi selama 10 menit pada suhu 37º C. Setelah itu disentrifugasi pada kecepatan 10000 rpm selama 5 menit. Filtrat hasil sentrifugasi kemudian diambil sebanyak 300 µL dan ditambahkan 750 µL larutan Na2CO3 0.55 M serta pereaksi Folin 1:2 sebanyak 150 µL. Kemudian diinkubasi selama 10 menit pada suhu 37º C dengan thermo mixer. Absorbansi diukur pada panjang gelombang 660 nm (Amano Inc 2013).
Pengukuran Konsentrasi Enzim
Larutan standar divariasikan konsentrasinya dengan larutan RO. Sebanyak 20 µL larutan dari masing-masing konsentrasi direaksikan 180 µL larutan PBS dan 2 mL reagen Lowry lalu divorteks dan diinkubasi selama 10 menit pada 37 ºC. Kemudian ditambahkan pereaksin Folin-Ciocalteu 200 µL dan diinkubasi 30 menit hingga terjadi perubahan warna dari bening menjadi biru. Setelah itu, campuran larutan divorteks dan diukur absorbansinya pada panjang gelombang 750 nm. Penentuan protein dilakukan dengan metode Lowry dan diukur dengan spektrofotometer pada 750 nm. Sebanyak 20 µL enzim kasar direaksikan dengan 180 µL larutan PBS dan 2 mL reagen Lowry lalu divorteks dan diinkubasi selama 10 menit pada 37 ºC. Kemudian ditambahkan pereaksi Folin Ciocalteu 200 µL dan diinkubasi 30 menit hingga terjadi perubahan warna dari bening menjadi biru. Setelah itu campuran larutan divorteks dan diukur absorbansinya pada panjang gelombang 750 nm (Lowry et al. 1951).
Presipitasi Amonium Sulfat dan Dialisis
Purifikasi parsial dilakukan dengan menggunakan amonium sulfat pada kejenuhan 25%-80%. Pengendapan dilakukan dengan menambahkan garam amonium sulfat ke dalam supernatan (ekstrak kasar) sedikit demi sedikit, dicampurkan selama 1 jam pada kondisi dingin, dan disentrifugasi pada 3.000 rpm selama 10 menit. Presipitat dilarutkan dalam 0.05 M bufer fosfat pada pH 7.5 dengan perbandingan 1:2 (b/v). Dialisis dilakukan dengan membran tubing
selulosa D9777 dengan ukuran molecular weight cut off (MWCO) 12.4 kDa. Sebelum digunakan, membran diproses untuk menghilangkan kontaminan seperti gliserol, ion logam berat, atau komponen mikro mengandung sulfur. Persiapan membran dimulai dengan membran dicuci dengan air RO. Enzim yang telah diendapkan, dilarutkan dengan larutan bufer fosfat 0.05 M pH7.5 dengan kondisi sama seperti pada awal enzim diekstrak. Larutan kemudian dimasukkan ke dalam kantong dialisis dan disuspensikan dalam bufer fosfat 0.05 M pH 7.5, didialisis selama 12-18 jam pada kondisi dingin dengan penggantian bufer setiap 6 jam (Baehaki 2012).
Penentuan Suhu Optimum
Penentuan suhu optimum dilakukan dengan melakukan uji aktivitas enzim protease metode Amano termodifikasi pada suhu 40-65 °C dengan rentang interval 5 °C (Baehaki 2012).
Penentuan pH Optimum
Penentuan pH optimum dilakukan dengan mereaksikan enzim dan substrat pada pH 6-10 (rentang 1 nilai pH) pada suhu optimum dan diuji kuantitatif dengan metode Amano termodifikasi. Pada pH 6-8 bufer digunakan bufer Na-fostat, untuk pH 9 menggunakan bufer Tris-HCl, dan pH 10 menggunakan bufer karbonat-bikarbonat (Baehaki 2012).
Stabilitas terhadap Waktu Pemanasan
4
memanaskan enzim hasil dialisis pada suhu 50 dan 70 ºC masing-masing selama 20, 40, dan 60 menit. Selanjutnya aktivitas enzim dianalisis dengan metode Amano termodifikasi (Baehaki 2012).
Pengaruh Ion Logam dan Inhibitor pada Aktivitas Protease
Ion logam yang digunakan adalah CaCl2, MnCl2, MgCl2, ZnSO4, NaCl, dan KCl dengan konsentrasi 1 mM dan 5 mM, sedangkan inhibitor yang diuji adalah PMSF dan EDTA dengan konsentrasi 2 mM dan 5 mM. Enzim diinkubasi dengan ion logam dan inhibitor selama 1 jam pada suhu ruang, kemudian dilakukan uji aktivitas enzim dengan metode Amano termodifikasi (Baehaki 2012 ; Wahyuntari dan Hendrawati 2012).
Penentuan Berat Molekul dengan SDS-PAGE
Standar protein berat molekul rendah (LMW) yang digunakan adalah fosforilase b (97 kDa), BSA (bovine serum albumin) (66 kDa), ovalbumin (45 kDa), carbonic anhydrous (29 kDa), inhibitor tripsin (21.5 kDa), dan α -laktalbumin (14.4 kDa). Gel terdiri atas dua jenis, yaitu 12% gel pemisah dan 4% gel penahan. Gel dielektroforesis dengan tegangan 150 V dan 100 A selama 1.5 jam. Setelah proses running dilakukan gel diwarnai dengan PageBlue selama 30 menit, kemudian dicuci dengan air RO selama 1 jam (Laemmli 1970).
Zimografi Kasein0.1%
Zimografi kasein dilakukan dengan komposisi gel penahan 4% dan gel pemisah 12%. Gel akrilamid 12% dikopolimerisasi dengan substrat kasein 0.1%. Sebanyak 4 μL enzim dialisat dicampurkan dengan 16 μL sampel bufer, kemudian dielektroforesis dengan tegangan 150 V dan 100 A selama 1.5 jam. Kemudian gel direndam dengan Triton X-100 2.5% selama 1 jam dan dilakukan inkubasi dalam bufer Tris-HCl 10 mM, pH 9 selama 4 jam pada suhu 60 °C. Deteksi zimogram dilakukan dengan pewarnaan PageBlue selama 30 menit. Kelebihan warna dikurangi dengan merendam gel dalam larutan peluntur (5.0% metanol + 7.5% asam asetat) sampai diperoleh pita-pita protein yang berwarna bening berlatarbelakang biru (Baehaki 2012 ; Jamilah 2011).
SDS-PAGE Spesifitas Substrat
Substrat yang digunakan adalah serum albumin, kasein, gelatin, kolagen, dan hemoglobin. Kasien, albumin, dan gelatin dilarutkan dalam bufer Tris-HCl pH 9.0. Kolagen dan hemoglobin dilarutkan pada 1% b/v urea di dalam 0.1 N NaOH dan pH disesuaikan pada pH 9 menggunakan 0.1 N HCl. Sebanyak 800 µL
1% suspensi protein ditambah 200 μL dan direaksikan di dalam tabung vial,
kemudian enzim diinkubasi pada 60 °C selama 1 jam. Reaksi dihentikan dengan pemanasan pada 100 °C selama 1 menit di penangas air. Aktivitas hidrolitik diuji melalui SDS-PAGE dengan membandingkan pita protein yang terhidrolisis dengan kontrol substrat yang tidak direaksikan dengan enzim (Wahyuntari dan Hendrawati 2012).
Kinetika Kimia Enzim Protease
5
HASIL DAN PEMBAHASAN
HasilProtease Hasil Fraksinasi Amonium Sulfat dan Dialisis
Ekstrak kasar enzim protease dari isolat B19 KUB BPPT CC diendapkan dengan fraksinasi amonium sulfat dari kejenuhan 25% sampai 80% (rentang interval 20%). Purifikasi dilanjutkan dengan dialisis menggunakan membran
tubing selulosa. Tabel 1 menunjukkan bahwa protein total dan aktivitas total tertinggi terdapat pada fraksi dengan kejenuhan 60%, masing-masing sebesar 0.42 mg dan 69.26 U. Aktivitas spesifik tertinggi juga terdapat pada fraksi dengan kejenuhan 60% sebesar 164.92 U/mg dengan yield 0.31% dan kemurnian naik hingga 8.37 kali. Aktivitas total, aktivitas spesifik, dan tingkat kemurnian terendah terdapat pada fraksi dengan kejenuhan 25%.
Tabel 1 Aktivitas protease pada tiap fraksi pemurnian
Fraksi Aktivitas
Kasar 26.60 1.35 850.00 22 610.00 1 147.00 19.71 100.00 1.00
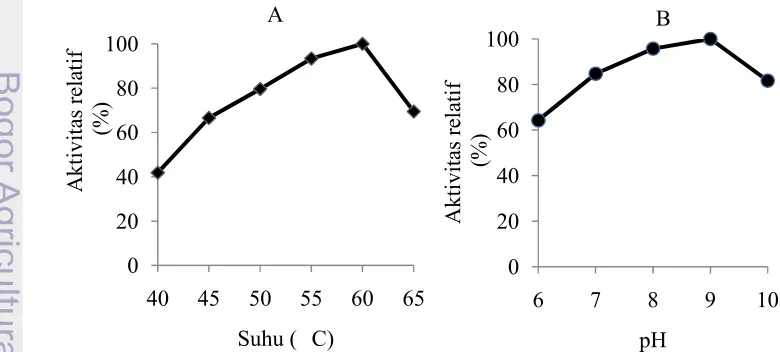
A.s 25% (D) 4.20 0.20 2.00 8.40 0.40 21.18 0.04 1.07 melangsungkan reaksi enzimatis adalah pada pH 9 dan suhu 60 °C (Gambar 1).
6
Stabilitas terhadap Waktu Pemanasan
Nilai konstanta (k) laju deaktivasi protease isolat B19 KUB BPPT CC untuk suhu 50 °C dan 70 °C masing-masing sebesar 0.004/menit dan 0.147/menit (Gambar 2). Waktu paruh enzim pada suhu 50 °C dan 70 °C diperoleh dengan menurunkan rumus kinetika deaktivasi enzim, masing-masing sebesar 173 menit dan 4.7 menit.
Gambar 2 Hubungan aktivitas protease isolat B19 KUB BPPT CC dialisat terhadap waktu pemanasan pada suhu 50 °C (■) dan 70 °C (▲)
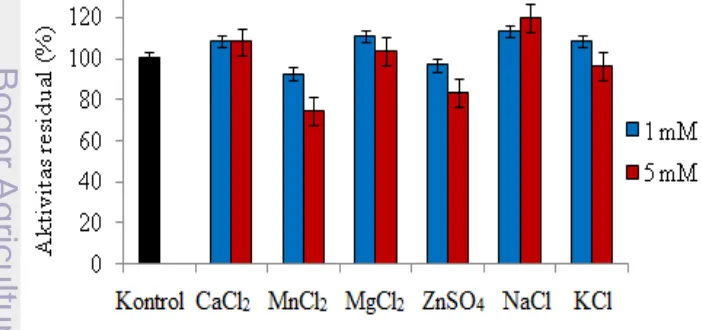
Pengaruh Ion Logam dan Senyawa Inhibitor
Aktivitas fraksi dialisat 60% protease meningkat terhadap penambahan ion logam Ca2+, Mg2+, Na+, dan K+. Ion logam Na+dengan konsentrasi sebesar 5 mM memberikan peningkatan aktivitas residual tertinggi sebesar 119.93%. Ion logam MgCl2 sebesar 1 mM juga meningkatkan aktivitas residual enzim ini sebesar 110.52%. Akan tetapi, ion logam Zn2+ dan Mn2+ dengan konsentrasi 5 mM menurunkan aktivitas residual enzim masing-masing sebesar 83.44% dan 74.25% (Gambar 3).
Gambar 3 Pengaruh penambahan ion logam terhadap aktivitas protease isolat B19KUB BPPT CC pada suhu dan pH optimum
PMSF sebagai inhibitor
CC pada suhu dan pH optimum
Hasil Analisis Berat Molekul dengan SDS
Ekstrak kasar enzim memi
sebagai inhibitor untuk protease serin menurunkan aktivitas drastis. PMSF sebesar 5 mM menurunkan aktivitas residual e
EDTA sebagai inhibitor untuk metaloprotease menurunkan protease menjadi sepertiganya. EDTA sebesar 2 mM dan vitas residual enzim menjadi 40.11% dan 34.85% (Gambar 4).
inhibitor terhadap aktivitas protease isolat B19 KUB pada suhu dan pH optimum
Berat Molekul dengan SDS-PAGE dan Zimografi Kasein
kasar enzim memiliki empat pita dengan berat molekul sebe 29.5 kDa, sedangkan dialisat 60% memiliki tiga pita sebesar
kDa (Gambar 5). Berat molekul protease dikonfirmasi kasein 0.1% yang menghasilkan dua pita, yakni 33.8 kDa dan
analisis bobot molekul SDS-PAGE dan zimografi perangkat lunak PhotoCap(a) marker LMW, (b)ekstrak
(c) dialisat 60%, dan (d) zimogram kasein 0.1%
Kontrol PMSF EDTA s residual enzim menjadi 40.11% dan 34.85% (Gambar 4).
8
SDS-PAGE Spesifitas Substrat Sebanyak lima jenis substrat BPPT CC, kemudian hasilnya pita peptida hasil hidrolisis enzim pada Gambar 6. Dialisat 60%
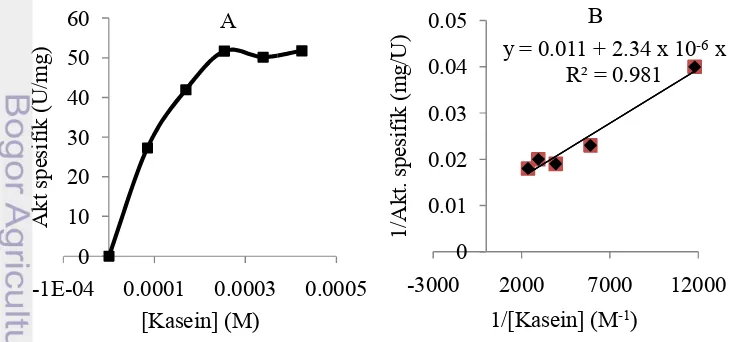
Pengaruh konsentrasi substrat diilustrasikan dengan menggunakan Gambar 7. Nilai Km dan vmaks
jenis substrat direaksikan dengan protease isolat B19 KUB hasilnya dianalisis dengan menggunakan SDS-PAGE. Pola hidrolisis enzim proetase isolat B19 KUB BPPT CC terlihat Dialisat 60% enzim ini mampu menghidrolisis substrat, seperti BSA, gelatin, hemoglobin, kasein, dan kolagen dalam kondisi alkalin pada 60
produk hasil hidrolisis enzim protease dialisat isolat B19 CC (a) BSA , (a') BSA terhidrolisis, (b) gelatin, (b’) terhidrolisis, (c) hemoglobin, (c’) hemoglobin terhidrolisis, (d’) kasien terhidrolisis, (e) kolagen, dan (e’) kolagen
Protease
konsentrasi substrat kasein terhadap aktivitas spesifik enzim menggunakan kurva Lineweaver-Burk dapat dilihat pada
maks dari protease isolat B19 KUB BPPT CC fraksi menggunakan kasein masing-masing sebesar 0.021 mM dan 90.91
konsentrasi substrat terhadap aktivitas spesifik enzim kurva Lineweaver – Burk (B) m kondisi alkalin pada 60 °C.
9
Pembahasan
Protease Hasil Fraksinasi Amonium Sulfat dan Dialisis
Fraksinasi dengan amonium sulfat merupakan salah satu cara pemurnian protein melalui proses pengendapan (Rosenberg 2005). Pengendapan terjadi oleh adanya peningkatan kekuatan ion dengan penambahan garam amonium sulfat (Solihati 2006). Fraksinasi amonium sulfat bertingkat yang digunakan dalam penelitian ini dilakukan untuk memisahkan protein enzim dari protein yang lain, sehingga diperoleh tingkat kemurnian protein pada setiap fraksi, sedangkan dialisis protein adalah suatu proses penghilangan garam organik dan pertukaran dengan bufer. Metode penggunaan kantung dialisis akan menghilangkan molekul berbobot molekul rendah yang tidak diinginkan dan menggantikanya dengan bufer. (Rosenberg 2005). Membran dialisis yang digunakan dalam penelitian ini memilki nilai cut off sebesar 12.4 kDa yang mampu menahan protease agar tidak keluar selama dialisis karena protease memiliki berat molekul antara 15 hingga 126 kDa (Shankar 2010 ; Rao et al. 1998). Berdasarkan hasil yang diperoleh diketahui bahwa konsentrasi amonium sulfat yang paling sesuai untuk mengendapkan protease dari isolat B19 KUB BPPT CC adalah amonium sulfat dengan konsentrasi 60%. Pada larutan, sejumlah besar molekul air terikat dengan ion sulfat (SO42-) dan akan mengurangi jumlah air yang berikatan dengan molekul protein. Pada konsentrasi amonium sulfat 60%, molekul air yang tidak berikatan akan terpisah dari protein enzim ini, sehingga menyebabkan presipitasi bagi enzim (Rosenberg 2005). Aktivitas yang dihasilkan setelah pengendapan oleh 60% amonium sulfat dan dialisis adalah 34.63 U/ml dengan aktivitas spesifik 164.92 U/mg dengan peningkatan kemurnian 8.37 kali dari aktivitas ekstrak kasar 26.60 U/ml dengan aktivitas spesifik 19.71 U/mg. Beberapa protease juga mengendap dengan baik pada konsentrasi amonium sulfat antara 60-70%, misalnya pada protease dari Bacillus alcalophilus TCCC11004 dan Bacillus licheniformis UV-9 (Cheng et al.2010 ; Nadeem et al. 2013).
Suhu dan pH Optimum
Dialisat protease isolat B19 KUB BPPT CC aktif bekerja pada suhu 40 sampai 65 °C dengan suhu optimum pada 60 °C. Berdasarkan suhu optimumnya protease ini tergolong protease termofilik artinya bekerja aktif pada suhu yang tinggi. Protein yang bersifat termofilik memiliki karakteristik yang berbeda pada strukturnya dibandingkan protein mesofilik. Protein termofilik memiliki lebih banyak struktur jembatan garam ditambah dengan keberadaan rantai utama ikatan hidrogen yang berlimpah jika dibandingkan dengan protein mesofilik. Selain itu, protein ini memiliki residu asam amino yang bersifat hidrofobik lebih banyak dibandingkan protein mesofilik. Hal ini akan menaikkan titik didih dari protein tersebut (Sadeghi et al. 2006). Pada suhu 50 °C aktivitas residual enzim ini sebesar 79.66% dan 93.36% pada 55 °C, serta menunjukkan penurunan aktivitas residual sampai 69.46% pada suhu 65 °C (Gambar 1). Hal ini dikarenakan adanya denaturasi protein pada suhu yang lebih tinggi (Shankar 2010). Suhu optimum protease dari Bacillus licheniformisUV-9 pada pH 11 adalah 60 °C (Nadeem et al.
10
MN1 juga memiliki suhu optimum pada 60 °C (Banerjee et al. 1999 ; Beg et al.
2003 ; Martins dan Nascimento 2006 ; Khosravi-Darani et al. 2008; Olajuyigbe dan Ajele 2008). Dialisat protease isolat B19 KUB BPPT CC memiliki pH optimum 9.0 pada suhu 60 °C dengan substrat kasein, sehingga protease ini termasuk dalam golongan protease alkalin (Gambar 1). Protease alkalin akan bekerja dengan baik pada kondisi basa (Rao et al. 1998). Enzim ini memiliki aktivitas residual sebesar 84.70% pada pH 7.0 dan 95.72% pada pH 8.0. Protease
B .licheniformis LHSB-05 juga memiliki pH optimum 9.0. Beberapa protease dari genus Bacillus lainnya memiliki pH optimum berkisar antara 9.0-10.0 (Johnvesly dan Naik 2001; Yu et al. 2006; Olajuyigbe dan Ajele 2008).
Stabilitas terhadap Waktu Pemanasan
Kestabilan terhadap waktu pemanasan protease dialisat diuji pada suhu 50 °C dan 70 °C pada pH dan suhu optimum. Protease isolat B19 KUB BPPT CC relatif stabil terhadap pemanasan pada suhu 50 °C dengan nilai konstanta laju deaktivasi sebesar 0.004/menit, sedangkan untuk suhu 70 °C aktivitas menurun jauh dengan konstanta laju deaktivasi sebesar 0.147/menit (Gambar 2). Hal ini dikarenakan semakin tinggi suhu maka konstanta deaktivasi enzim akan semakin tinggi (Baehaki 2012). Waktu paruh (t1/2) enzim ini pada suhu 50 °C dan 70 °C masing-masing sebesar 173 menit dan 4.7 menit, artinya pemanasan dengan suhu tersebut selama 173 menit atau 4.7 menit aktivitas protease dialisat akan menjadi setengahnya. Hal ini memperlihatkan enzim ini cukup stabil terhadap pemanasan pada 50 °C. Protease serin alkalin dari Bacillus subtilis PE-11 memiliki waktu paruh 250 menit dan 50 menit pada suhu 70 dan 80 °C (Adinarayana et al. 2003). Protease termostabil dari Bacillus sp. Strain GX6638 memiliki waktu paruh 200 menit pada suhu 50 °C dan 22 menit pada 60 °C. Protease komersial subtilisin Carlsberg serta subtilisin BPN memiliki waktu paruh 3.4 dan 2.4 menit pada suhu 50 °C (Durham et al.1987).
Pengaruh Ion Logam dan Senyawa Inhibitor
Beberapa ion logam diuji pengaruhnya terhadap aktivitas protease dialisat pada konsentrasi 2 mM dan 5 mM (Gambar 3). Hasil pengujian menunjukkan 5 mM NaCl dapat meningkatkan aktivitas protease isolat B19 KUB BPPT CC menjadi 119.93% dari aktivitas semula (100%). Pengaruh 5 mM NaCl memperlihatkan enzim ini termasuk enzim yang peka terhadap penambahan garam yakni, enzim yang peka terhadap perubahan polaritas larutan dan sisi aktifnya kaya akan ikatan hidrogen (Paada 2004). Ion logam 5 mM MnCl2 menurunkan aktivitasnya menjadi 74.25% dan 5 mM ZnSO4 menurunkan aktivitas residual enzim ini menjadi 83.44%. Pada uji pengaruh ion logam
11
kecepatan reaksi enzim. Ion logam umumnya berikatan dengan residu asam amino yang bersifat negatif seperti aspartat dan glutamat (Paada 2004). Pengaruh inhibitor terhadap aktivitas protease terlihat pada Gambar 3. Inhibitor PMSF sebagai inhibitor bagi protease serin sebesar 5 mM menurunkan aktivitasnya menjadi hanya 4.06%, sedangkan EDTA sebagai pengkelat logam (inhibitor metaloprotease) 5 mM menurunkan aktivitasnya menjadi sepertiganya, yakni 34.85% (Gambar 4). Hal ini menunjukkan bahwa protease ini tergolong protease serin (Wahyuntari dan Hendrawati 2012). PMSF merupakan inhibitor ireversibel bagi protease serin. PMSF akan terikat secara kovalen dan menyerang sisi aktif enzim protease yang memiliki residu serin di dalamnya, sehingga enzim akan kehilangan kemampuan katalitiknya (James 1978). Pengaruh 2 mM Na2.EDTA dan 2 mM PMSF pada protease Thermophilic bacillus strain HS08 menurunkan aktivitas relatifnya menjadi masing-masing 6% dan 4% (Guangrong et al. 2006).
Hasil Analisis Berat Molekul dengan SDS-PAGE dan Zimografi Kasein
Elektroforesis adalah teknik untuk memisahkan molekul berdasarkan muatan dan berat molekul (Bintang 2010). Jenis elektroforesis yang akan digunakan adalah jenis elektroforesis gel yang tersusun atas poliakrilamid. SDS-PAGE (Poly Acrilamide Gel Electrophoresis) merupakan metode yang banyak digunakan untuk analisis sampel biologis, karena kemampuannya dalam memisahkan campuran protein yang kompleks (Mikkelsen dan Corton 2004). Zimografi bertujuan menganalisis aktivitas proteolitik dengan menambahkan substrat protein pada gel pemisah. Substrat yang umum digunakan dalam zimografi antara lain kasein, gelatin, dan fibrin (Paada 2004). Hasil visualisasi SDS-PAGE menunjukkan terdapat empat pita protein pada ekstrak kasar dengan estimasi berat molekul masing-masing sebesar 89.0, 41.5, 33.0, dan 29.5 kDa. Pada fraksi dialisat 60% terdapat tiga pita protein dengan estimasi berat molekul 33.2, 30.8, dan 28.1 kDa. Zimogram kasein 0.1% menunjukkan pita protease yang memiliki aktivitas proteolitik dengan estimasi berat molekul sebesar 33.8 kDa dan 19.7 kDa (Gambar 5). Pengujian pengaruh inhibitor dan penentuan pH optimum menyatakan bahwa enzim ini tergolong pada protease serin alkalin, protease jenis ini biasanya memiliki berat molekul rendah antara 15 sampai 35 kDa (Rao et al. 1998 ; Gupta et al. 2002). Serin alkalin protease lainya dari Bacillus sp. SSR1 berdasarkan analisis SDS-PAGE memiliki bobot molekul 29 dan 35 kDa (Singh et al. 2001). Selain itu, serin alkalin protease dari Bacillus subtilis PE-11 memiliki bobot molekul sebesar 15 kDa (Adinarayana et al.2003).
SDS-PAGE Spesifitas Substrat
12
industri detergen dan produk kulit (Gupta et al. 2002). Hal ini membuka kemungkinan aplikasi lebih lanjut dari enzim ini pada industri detergen dan penyamakan kulit. Protease lain dari bakteri Bacilllus megaterium DSM-319 juga dapat menghidrolisis kelima substrat tersebut dan telah diuji aplikasinya pada penyamakan kulit sapi (Wahyuntari dan Hendrawati 2012).
Kinetika Kimia Enzim Protease
Hubungan antara kecepatan reaksi enzimatis dengan konsentrasi substrat bergantung pada afinitas enzim terhadap substrat tersebut (Ahmed et al. 2011). Protease alkalin biasanya memiliki afinitas yang tinggi terhadap substrat kasein (Adinarayana et al. 2003). Nilai Km dan Vmaks dari protease serin alkalin isolat B19 KUB BPPT CC fraksi dialisat dengan menggunakan kasein masing-masing sebesar 0.021 mM dan 90.91 U/mg (Gambar 7). Konsentrasi kasein sebesar 0.021 mM merupakan jumlah kasein yang dibutuhkan untuk mencapai setengah kecepatan reaksi maksimumnya. Nilai Vmaksyang tinggi menunjukkan laju reaksi juga semakin cepat (Yuningsih 2006). Nilai Km yang dimiliki enzim ini relatif kecil, hal ini menunjukkan afinitas enzim yang tinggi terhadap substrat kasein. Protease dari Bacillus subtilis memiliki nilai Km dan Vmaks sebesar 58μM dan 148 U/mL pada substrat kasein (Ahmed et al.2011).Bilangan putaran dapat ditentukan dengan terlebih dahulu mengetahui berat molekul suatu enzim. Bilangan putaran merupakan jumlah molekul substrat yang diubah menjadi produk per satuan waktu pada satu molekul enzim saat enzim tersebut jenuh oleh substrat (Triana 2012). Berat molekul enzim ini diasumsikan sebesar 33.8 kDa, maka nilai kcat enzim fraksi dialisat adalah sekitar 50 s-1 . Nilai bilangan putaran ini akan menentukan kecepatan reaksi katalisis suatu enzim (Ibrahim et al.2012).
SIMPULAN DAN SARAN
Simpulan
Aktivitas spesifik tertinggi bagi protease ini terdapat pada fraksi amonium sulfat 60% sebesar 164.92 U/mg. Protease ini tergolong protease alkalin termofilik karena memiliki pH optimum 9.0 dan suhu optimum 60 °C, serta tergolong dalam protease serin. Protease ini juga relatif stabil terhadap pemanasan pada suhu 50 °C. Ion logam Na+ 5 mM merupakan aktivator kuat bagi protease ini. Berat molekul protease ini melalui analisis zimografi kasien masing-masing sebesar 33.8 kDa dan 19.7 kDa. Nilai Kmdan Vmaksenzim dengan kasein sebagai substrat adalah 0.021 mM dan 90.91 U/mg. Protease ini juga memiliki spesifitas substrat yang luas yang menambah keunggulanya.
Saran
13
DAFTAR PUSTAKA
Adinarayana K, Ellaiah P, Prasad DS .2003. Purification and partial characterization of thermostable serine alkaline protease from a newly isolated
Bacillus subtilis PE-11 AAPS. Pharm Sci Tech 4(4):440-448. doi: 10.1208/pt040456.
Ahmed I, Zia MA, Iqbal HMN. 2011. Purification and kinetic parameters characterization of an alkaline protease produced from Bacillus subtilis through submerged fermentation technique. World Applied Sciences Journal 12(6):751-757.
[Amano Inc] Amano Enzyme Inc. 2013. Protease[internet]. [diacu 2013 Maret 6]. Tersedia dari: http://www.amano-enzyme.co.jp/
Baehaki A. 2012. Kolagenase Bacillus licheniformis F11 asal Palembang dan aplikasinya pada pembuatan peptida kolagen bioaktif.[tesis]. Bogor (ID) :Institut Pertanian Bogor.
Banerjee UC, Sani RK, Azmi W, Soni, R. 1999. Thermostablealkaline protease from Bacillus brevis andits characterization as a detergent additive. Process Biochemistry. 35(1-2):213-219.doi:10.1016/S0032-9592(99)00053-9
Beg QK, Saxena RK, Gupta R. 2002. De-repression and subsequent induction of protease synthesis by Bacillus mojavensis under fed-batch operations.Process Biochem.37: 1103–1109.doi:10.1016/S0032-9592(01)00320-X
Bintang M. 2010. Biokimia – Teknik Penelitian. Jakarta (ID) : Erlangga.
Cheng K, Lu FP, Li M, Liu LL, Liang XM. 2010. Purification and biochemical characterization of a serine alkaline protease TC4 from a new isolated Bacillus alcalophilus TCCC11004 in detergent formulations. African Journal of Biotechnology9(31): 4942-4953. doi: 10.5897/AJB09.1651
Chu WH. 2007. Optimization of extracellular alkaline protease production from species of Bacillus. Journal of Industrial Microbiology Biotechnology34: 241-245. doi: 10.1007/s10295-006-0192-2
Copeland RA.2000. Enzymes : A Practical Inroduction to Structure, Mechanism, and Data Analysis. New York (US) : J Wiley.
Dias DR, Vilela DM, Silvestre MPC, Schwan RF. 2008. Alkaline protease from
Bacillus sp. isolated from coffee bean grown on cheese whey. World Journal of Microbiology and Biotechnology 24: 2027-2034. doi: 10.1007/s11274-008-9706-6
Durham DR, Stewardt DB, Stellwagt J.1987. Novel alkaline- and heat-stable serine proteases from alkalophilic Bacillus sp. Strain GX6638 JB-99 in a chemically defined medium.J Bacteriol169 (6): 2762-2768. doi: PMC212182 Guangrong H, Tiejing Y, Po H, Jiaxing J. 2006 .Purification and characterization
of a protease from Thermophilic bacillus strain HS08. African Journal of Biotechnology5(24):2433-2438.
Gupta R, Beg QK, Lorenz P. 2002. Bacterial alkaline proteases: molecular approachesand industrial applications. Appl Microbiol Biotechnol 59:15-32. doi :10.1007/s00253-002-0975-y
14
James G. 1978. Inactivation of the protease inhibitor phenylmethylsulfonyl fluoride in bufers.Analytical Biochemistry 86(2):574-576. doi :10.1016/0003-2697(78)90784-4.
Jamilah I. 2011. Penapisan Bacillus dan karakterisasi protease dan amilase ekstraseluler yang dihasilkan untuk degradasi sisa pakan pada budi daya udang.[tesis]. Bogor (ID) :Institut Pertanian Bogor.
Johnvesly B dan Naik GR.2001. Studies on production of thermostablealkaline protease from thermophilic and alkalophilic Bacillus sp JB-99 in a chemically defined medium. Process Biochem 37:139-144. doi: http://dx.doi.org/10.1016/S0032-9592(01)00191-1
Khosravi-Darani K, Falahatpishe HR, Jalai M. 2008.Alkaline protease production on date waste by analkalophillic Bacillus sp. 2-5 isolated from soil. African Journal of Biotechnology7(10):1536-1542. doi: 10.5897/AJB07.885
Laemmli UK. 1970. Cleavege of structural protein during the assembly of the head of bacteriophage T4. Nature 227: 680-685. doi: 10.1038/227680a0
Lowry OH, Roserbrough NJ, Farr AL, Randall R. 1951. Protein measurement with Folin Phenol Reagent. Journal of Biological Chemistry. 193: 265-275. doi :10.1074/jbc.270.46.27489
Martin MLL dan Nascimento WCA. 2006. Studies on stability of protease from
Bacillussp and its compatibility with commercial detergent. Brazilia Microbiol
37: 307-311. doi: http://dx.doi.org/10.1590/S1517-83822006000300020 Mikkelsen dan Corton. 2004. Bioanalytical Chemistry. New Jersey (US) : J Wiley Nadeem M, Qazi JI, Syed Q, Gulsher M. 2013. Purification and characterization
of an alkaline protease from Bacillus licheniformis UV-9 for detergent formulations [internet]. [diacu 20013 Maret 30]; 35(2): 187-195. Tersedia dari: http://www.sjst.psu.ac.th.
Nelson DL dan Cox MM. 2007. Principles of Biochemistry Fifth Edition. New York(US) : WH Freeman
Olajuyigbe FM dan Ajele JO. 2008. Some properties ofextracellular protease from Bacillus licheniformis Lbb1-11 isolated from “iru” a tradionally fermented African locus bean condiment. Global Journal of Biotechnologyand Biochemistry3:42-46.
Paada MY. 2004. Pemurnian dan karakterisasi enzim protease serin dari Bacillus subtilis rekombinan R1.[tesis]. Bogor (ID) :Institut Pertanian Bogor.
Rao MB, Tanksale AM, Ghatge MS, Desphande VV. 1998. Molecular and biotechnological aspects of microbial proteases. Mol Biol Rev 62(3):597-635. doi : PMC98927
Rosenberg IM. 2005. Ptotein Analysis and Purification : Benchtop techniques.
New York (US). Springer Publishing.
Sadeghi M, Manesh HN, Zarrabi M, Ranjbar B. 2006. Effective factors in thermostability of thermophilic proteins. Biophysical Chemistry 119(3):256-270. doi :http://dx.doi.org/10.1016/j.bpc.2005.09.018
Sezonov G, Joseleau-Petit D, D’Ari R. 2007. Escherichia coli physiology in
Luria-Bertanibroth.J Bacteriol189: 8746-9. doi:10.1128/JB.01368-07.
15
Singh J, Batra N, Sobti RC.2001. Serine alkaline protease from a newly isolated
Bacillus sp. SSR1. Process Biochem 36(8) : 781-785. doi : 10.1016/S0032-9592(00)00275-2
Solihati . 2006. Pemurnian dan pencirian protease dari ekstrak jamur merang [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Sutandi C. 2003. Potensi Enzim Protease Lokal [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Triana R. 2012. Pemurnian dan karakterisasi enzim glukosa oksidase dari isolat lokal Aspergillus niger (IPBCC.08.610).[skripsi]. Bogor (ID) :Institut Pertanian Bogor.
Wahyuntari B dan Hendrawati H.2012.Properties of an Extracellular Protease of
Bacillus megaterium DSM 319 as Depilating Aid of Hides. Microbiology Indonesia 6(2). doi : 10.5454/mi.6.2.4.
Yu J, Jin H, Choi W, Yoon M .2006. Production and characterization of an alkaline protease from Bacillus licheniformis MH31.Agric Chem Biotechnol
49(4): 135-139.
16
Lampiran 1 Aktivitas protease fraksi pemurnian
Fraksi Aktivitas
(U/mL)
[Protein] (mg/mL)
Volume (mL)
Aktivitas total (U)
Protein total (mg)
Aktivitas spesifik (U/mg)
Aktivitas spesifik rata-rata (U/mg)
26.55 23364.00 20.37
Enzim 26.21 1.35 850.00 22278.00 1147.00 19.42 19.94
Kasar 27.05 22992.00 20.04
5.04 10.08 25.20
Am Sulfat 3.29 0.20 2.00 6.58 0.40 17.00 21.18
25% (D) 4.27 8.54 21.35
11.84 23.68 65.77
Am. Sulfat 11.91 0.18 2.00 23.82 0.36 66.16 67.85
40% (D) 12.89 25.78 71.61
33.21 66.42 158.14
Am. Sulfat 35.59 0.21 2.00 71.18 0.42 169.47 164.92
60% (D) 35.10 70.20 167.14
18.49 36.98 123.26
Am. Sulfat 17.16 0.15 2.00 34.32 0.30 114.40 121.24
17
Lampiran 2 Pengaruh suhu Suhu Aktivitas (U/mL)
[Protein] (mg/mL)
Volume (mL)
Aktivitas Total (U)
Protein Total (mg)
Aktivitas Spesifik
(U/mg)
Aktivitas Spesifik rata-rata (U/mg)
Aktivitas Relatif (%)
35.73 4.46 168.42
40º C 0.21 0.125 0.03 168.28 41.86
35.31 4.41 168.14
55.21 6.90 262.90
45º C 0.21 0.125 0.03 267.90 66.63
57.31 7.16 272.90
67.26 8.41 320.28
50º C 0.21 0.125 0.03 320.28 79.66
67.26 8.41 320.28
80.56 10.07 383.62
55º C 0.21 0.125 0.03 376.24 93.36
77.46 9.68 368.86
82.40 10.30 392.38
60º C 0.21 0.125 0.03 402.05 100
86.46 10.81 411.71
57.59 7.19 274.24
65º C 0.21 0.125 0.03 279.26 69.46
18
Lampiran 3 Pengaruh pH pH Aktivitas
(U/mL)
[Protein] (mg/mL)
Volume (mL)
Aktivitas total (U)
Protein total (mg)
Aktivitas spesifik (U/mg)
Aktivitas spesifik rata-rata (U/mg)
Aktivitas relatif (%)
58.16 7.27 276.95
6 0.21 0.125 0.03 280.28 64.23
59.56 7.44 283.62
79.87 9.98 380.33
7 0.21 0.125 0.03 369.66 84.70
75.39 9.42 359.00
87.73 10.97 417.76
8 0.21 0.125 0.03 417.76 95.72
87.73 10.97 417.76
91.65 11.46 436.43
9 0.21 0.125 0.03 436.43 100
91.65 11.46 436.43
74.13 9.27 353.00
10 0.21 0.125 0.03 356.33 81.65
19
Lampiran 4 Stabilitas terhadap panas Perlakuan Aktivitas Enzim
(U/mL)
Aktivitas Enzim Rata-rata
(U/mL)
Aktivitas Enzim Kontrol Negatif
(U/mL)
Aktivitas Residual (%)
82.68
50°C, 20 menit 82.82 91.65 90.37
82.96 76.23
50°C, 40 menit 76.58 91.65 83.56
76.93 68.95
50°C, 60 menit 70.07 91.65 76.46
71.19 0.91
70°C, 20 menit 0.81 91.65 0.89
0.70 0.21
70°C, 40 menit 0.25 91.65 0.28
20
Lampiran 5 Pengaruh ion logam dan inhibitor Perlakuan Aktivitas
1 mM ZnSO4 48.06 49.78 96.55
5 mM ZnSO4 78.90 94.56 83.44
1 mM NaCl 57.32 113.15
2 mM EDTA 31.53 78.62 40.11
31.46 26.77
5 mM EDTA 27.40 78.62 34.85
21
Lampiran 6 Kinetika kimia [Kasein]
(M)
AS AK FP Aktivitas
(U/mL)
[Protein] (mg/mL)
Volume (mL)
Aktivitas Total (U)
Protein Total (mg)
Aktivitas Spesifik (U/mg)
Aktivitas Spesifik rata-rata (U/mg)
0.730 0.071 1 46.17 5.77 27.48
8.47 x 10-5 0.21 0.125 0.03 27.32
(0.2%) 0.720 0.069 1 45.61 5.70 27.15
0.552 0.047 2 70.77 8.85 42.14
1.69 x 10-4 021 0.125 0.03 41.93
(0.4%) 0.550 0.050 2 70.07 8.76 41.71
0.664 0.044 2 86.88 10.86 51.71
2.54 x 10-4 0.21 0.125 0.03 51.71
(0.6%) 0.665 0.045 2 86.88 10.86 51.71
0.684 0.083 2 84.36 10.55 50.23
3.39 x 10-4 0.21 0.125 0.03 50.19
(0.8%) 0.610 0.070 2 84.22 10.53 50.14
0.671 0.052 2 86.74 10.84 51.61
4.24 x 10-4 0.21 0.125 0.03 51.76
22
Lampiran 6 Lanjutan
[Kasein] (M) 1/[Kasein] (M-1) V(U mg-1) 1/V (U-1mg) 8.47 x 10-5
1.69 x 10-4
11,800.80 5,900.05
27.32 41.93
0.040 0.023
2.54 x 10-4 3,933.33 53.14 0.019
3.39 x 10-4 2,950.02 52.31 0.020
4.24 x 10-4 2,360.05 55.55 0.018
y = 0.011 + 2.34x 10-6x
1 Vo=
Km Vmaks
1 [kasein]+
1 Vmaks 1
Vmaks 0.011
Vmaks = 90.91 U/mg
Km
Vmaks 2.34x 10-6
Km= 2.127 x 10-4M = 0.021 mM
[Et]= μg enzim/mL
bobot molekul enzim (molμg )
Asumsi bobot molekul = 33.8 kDa = 33.8 x 10-3μg/mL
[Et] 0.21 x 10
-3 μg/mL
33.8 x 10-3 μg/μmol 0.00636 μmol mL-1
Bilangan putaran =Vmaks[Et] 90.91 μmol menit
-1 mg-1 x 0.21 mg ml-1 0.00636 μmol ml-1
23