ADSORPSI SURFAKTAN ANIONIK
PADA BERBAGAI pH MENGGUNAKAN KARBON AKTIF
TERMODIFIKASI ZINK KLORIDA
DYAH PRATAMA PUSPITASARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DYAH PRATAMA PUSPITASARI. Adsorpsi Surfaktan Anionik pada Berbagai pH Menggunakan Karbon Aktif Termodifikasi Zink Klorida. Dibimbing oleh TETTY
KEMALA dan AHMAD SJAHRIZA.
Tempurung kelapa dapat dimanfaatkan sebagai karbon aktif untuk mengadsorpsi bahan pencemar dengan aktivasi kimia menggunakan ZnCl2 5%. Karakteristik yang dapat
mempengaruhi adsorpsi adalah kadar air, abu, zat mudah menguap, dan karbon terikat. Bahan pencemar yang dijerap adalah detergen yang mengandung surfaktan anionik linear alkyl benzena sulfonat (LAS). Jumlah LAS yang teradsorpsi dilakukan pada pH 3, 6, 7, dan 12, Pengkondisian asam dan basa menggunakan HCl dan NaOH. Sebelum adsorpsi, panjang gelombang maksimum, kurva standar, waktu optimum ditentukan. Isoterm adsorpsi yang digunakan meliputi Freundlich dan Langmuir dengan pengolahan data menggunakan Data Fit versi 8.1.69. Berdasarkan analisis, kadar air 5.04%, abu 4.90%, zat mudah menguap 19.01%, dan karbon terikat 76.09%. Panjang gelombang maksimum sebesar 222 nm. Waktu optimumnya adalah 35 menit. Nilai efisiensi dan kapasitas yang dilakukan pada konsentrasi LAS 15 ppm menghasilkan efisiensi tertinggi pada pH 3 sebesar 87.15% dan terendah pada pH 12 sebesar 33.84%. Kapasitas tertinggi pada pH 3 sebesar 3.2761 mg/g dan terendah pada pH 12 sebesar 2.2588 mg/g. Nilai k, n yang didapat pada isoterm Freundlich, dan nilai k1, k2 pada persamaan Langmuir menurun dari
pH rendah ke tinggi. Berdasarkan linearitasnya, adsorpsi dapat menggunakan kedua persamaan tersebut tetapi isoterm yang lebih sesuai adalah Freundlich.
ABSTRACT
DYAH PRATAMA PUSPITASARI. Adsorption of Anionic Surfactant on Various pH Using Zinc(II)Chloride Modified Active Carbon. Surpervised by TETTY KEMALA and AHMAD SJAHRIZA.
Coconut shell could be utilized as active carbon to adsorb pollutans through chemical activation using zink(II)chloride. Characteristics that may influence adsorption are water content, ash content, volatile matter, and fixed carbon. Pollutant that was adsorbed was detergent that contain anionic surfactant of linear alkyl benzene sulfonate (LAS). Amount of LAS adsorbed was carried out on pH of 3, 6, 7, and 12. Conditioning of acid and base were accomplished using hydrochloride acid and sodium hydroxide, respectively. Before adsorption, maximum wavelength, standard curve, and optimum time were determined. Isotherm of adsorption that was occupied was Freundlich and Langmuir using Data Fit 8.1.69. Base on analysis, water content was 5.04%, ash content 4.90%, volatile matter 19.01%, and fixed carbon 76.09%. Maximum wavelength was 222 nm. Optimum time was 35 minutes. The highest efficiency on pH 3 was 87.15% (concentration of 15 ppm) and the lowest on pH 12 was 33.84% (concentration of 15 ppm). The highest capacity on pH 3 was 3.2761 mg/g (concentration of 15 ppm) and the lowest on pH 12 was 2.2588 mg/g (concentration of 15 ppm). k value and n that were achieved via Freundlich isotherm and k1and k2 values on Langmuir equation decreased from low to high pH. Base
ADSORPSI SURFAKTAN ANIONIK
PADA BERBAGAI pH MENGGUNAKAN KARBON AKTIF
TERMODIFIKASI ZINK KLORIDA
DYAH PRATAMA PUSPITASARI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Adsorpsi Surfaktan Anionik pada Berbagai pH Menggunakan Karbon Aktif Termodifikasi Zink Klorida
Nama : Dyah Pratama Puspitasari NIM : G44201038
Disetujui
Pembimbing I Pembimbing II
Tetty Kemala, S.Si, M.Si Drs. Ahmad Sjahriza
NIP 132 232 787 NIP 131 842 413
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, M.S NIP 131 473 999
PRAKATA
Alhamdulillahirabbil’alamin, puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat, kasih sayang, dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian ini. Karya ilmiah ini disusun berdasarkan penelitian yang dilakukan pada bulan Desember 2005 sampai April 2006 di Laboratorium Kimia, Fisik, Analitik, Anorganik, dan Organik Institut Pertanian Bogor dengan judul Adsorpsi Surfaktan Anionik Pada Berbagai pH Menggunakan Karbon Aktif Termodifikasi Zink Klorida.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu penyelesaian karya ilmiah ini, antara lain keluarga (Bapak Subarkah, Mama Suryani, kedua adik Anggit dan Imam) atas segala doa, cinta, semangat, pengorbanan, dan dorongan di setiap langkah penulis, Ibu Tetty Kemala S.Si, M.Si, Bapak Drs. Ahmad Sjahriza selaku pembimbing dan Kak Budi Arifin S.Si yang telah banyak memberi saran dalam penyusunan karya ilmiah ini, beserta seluruh staf Laboratorium Kimia Fisik Analitik Universitas Indonesia.
Ungkapan terima kasih juga penulis sampaikan kepada Mas Herry dan semua laboran setiap laboratorium (Pak Nano, Pak Mail, Ibu Ai, Om Eman, Pak Mul, Pak Syawal, Pak Cha-cha, Pak Sabur, Ibu Yenny) yang telah membantu penelitian, teman satu penelitian (Eka dan Amir), sahabat (Rahma, Atik, Dian, Daeng, Mas Duo, Dwi, Kadoet, Riki, Ian) serta teman-teman kimia 38 atas segala persahabatan yang terjalin selama ini.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Juli 2006
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 16 Februari 1983 sebagai anak pertama dari tiga bersaudara, anak dari pasangan Subarkah dan Suryani Hartati.
Pendidikan formal penulis sampai dengan tingkat SMU diselesaikan di Jakarta. Pada tahun 2001 penulis lulus dari SMU Yadika 5 Jakarta dan pada tahun yang sama lulus seleksi masuk IPB jalur Undangan Seleksi Masuk IPB di Program Studi Kimia, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA). Bidang yang diminati penulis ialah kimia anorganik.
DAFTAR ISI
Halaman
DAFTAR TABEL... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Karbon Aktif ... 1
Adsorpsi ... 2
Isoterm Adsorpsi ... 2
Surfaktan ... 3
Surfaktan Anionik ... 3
BAHAN DAN METODE Bahan dan Alat... 4
Metode ... 4
HASIL DAN PEMBAHASAN Analisis Proksimat Karbon Aktif ... 5
Panjang Gelombang Maksimum ... 6
Pembuatan Kurva Standar... 7
Penentuan Waktu Optimum ... 7
Efisiensi Adsorpsi ... 7
Isoterm Adsorpsi ... 8
SIMPULAN DAN SARAN ... 9
DAFTAR PUSTAKA ... 9
DAFTAR TABEL
Halaman
1 Sifat fisik dan kimia LAS ... 4
2 Analisis proksimat karbon aktif... 6
3 Nilai konstanta k dan n menggunakan isoterm Freundlich... 8
DAFTAR GAMBAR
Halaman 1 Struktur grafit karbon aktif... 12 Karbon aktif tempurung kelapa ... 2
3 Molekul surfaktan... 3
4 Surfaktan anionik ... 4
5 Hubungan antara konsentrasi dan absorbans... 7
6 Hubungan antara waktu dan kapasitas adsorpsi ... 7
7 Hubungan antara konsentrasi dan efisiensi ... 8
8 Hubungan antara konsentrasi dan kapasitas adsorbsi pada pH 3 dengan isoterm Freundlich ... 8
DAFTAR LAMPIRAN
Halaman 1 Bagan alir penelitian... 132 Data kadar air ... 13
3 Data kadar abu... 13
4 Data kadar zat mudah menguap ... 14
5 Data kadar karbon terikat ... 14
7 Kurva adsorpsi pada penentuan panjang gelombang maksimum... 15
8 Data absorbans pada konsentrasi dan pH berbeda untuk pembuatan kurva standar ... 15
9 Nilai kapasitas adsorpsi pada konsentrasi LAS 40 ppm dan pH yang berbeda untuk penentuan waktu optimum ... 16
10 Nilai efisiensi adsorpsi LAS pada konsentrasi dan pH berbeda ... 16
11 Nilai linearitas pada isoterm Langmuir dan Freundlich ... 17
12 Nilai k1 dan k2 pada persamaan isoterm Langmuir ... 17
13 Kurva isoterm adsorpsi Freundlich dan Langmuir pada pH 6... 17
14 Kurva isoterm adsorpsi Freundlich dan Langmuir pada pH 7 ... 18
PENDAHULUAN
Karbon aktif dapat dibuat dari bahan yang mengandung karbon dalam jumlah cukup tinggi. Salah satu bahan baku karbon aktif yang potensial adalah tempurung kelapa. Pemanfaatannya sebagai bahan baku karbon aktif selain karena harganya yang murah juga karena dapat mengurangi limbah pertanian. Penggunaan karbon aktif di Indonesia mulai berkembang dengan pesat, yang dimulai dari pemanfaatannya sebagai adsorben untuk pemurnian pulp, air, minyak, gas, dan katalis. Namun, mutu karbon aktif domestik masih rendah (Harfi & Kusuma 1994), dengan demikian perlu ada peningkatan mutu karbon aktif tersebut.
Peningkatan mutu karbon aktif dapat menggunakan bahan kimia seperti zink klorida (ZnCl2) sebagai pengaktifnya. Hal ini
pernah dilakukan oleh Fernandez & Delgado (1994) yang menyatakan bahwa karbon aktif hasil pengaktifan kimiawi dengan ZnCl2
memiliki kapasitas adsorpsi lebih tinggi terhadap I2 dibandingkan dengan hasil
pengaktifan uap, bahkan lebih tinggi dari karbon aktif komersial. Selain itu, Rahman dan Saad (2003) mengatakan bahwa pengaktifan karbon aktif tanpa penambahan bahan kimia akan menghasilkan karbon aktif yang tidak maksimal dalam proses adsorbsinya dibandingkan dengan pengaktifan menggunakan bahan kimia seperti ZnCl2. Ini
terlihat pada jumlah adsorbat yang teradsorpsi, pada karbon aktif teraktifkan dengan ZnCl2 dapat mengadsorpsi sebesar
98%, sedangkan tanpa bahan kimia 50%. Proses adsorpsi menggunakan karbon aktif juga telah dilakukan oleh Sibelzor (2004), tetapi tanpa pengaktifan menggunakan ZnCl2.
Sibelzor menggunakan karbon aktif untuk mengadsorpsi surfaktan anionik pada pH yang berbeda. Contoh surfaktan anionik yang digunakan adalah dodesil benzena sulfonat (DBS) dan jenis karbon aktif yang digunakan tidak dipaparkan dengan jelas. Berdasarkan penelitiannya, karbon aktif dapat mengadsorpsi DBS sebesar 99.60% pada pH 3 dan 75.42% pada pH 12.
Surfaktan anionik merupakan salah satu bahan dasar pembuat detergen. Penggunaan detergen dari tahun ke tahun yang semakin meningkat membuat perairan semakin tercemar oleh detergen
,
contoh detergennya adalah linear alkilbenzena sulfonat (LAS atau LABS). Surfaktan anionik tanpa didukung oleh enzim dalam suatu detergen dapatmenghambat pendegradasiannya. Oleh karena itu, jenis surfaktan tersebut harus dihilangkan dari perairan. Masyarakat umumnya hanya melihat sifat murah dan mudah berbusanya dari detergen tanpa memandang bahayanya terhadap lingkungan sekitar. Pada umumnya, detergen digolongkan sebagai zat yang berbahaya terhadap alga pada konsentrasi 9.1 ppm, ikan pada 3.5 ppm, dan invertebrata pada 4.1 ppm (HERA 2002), sehingga harus dilakukan pengurangan kadar detergen dalam sungai, salah satunya dengan adsorpsi.
Surfaktan dan bahan kimia yang sejenis serta polusi air yang diakibatkannya dapat diminimumkan dengan degradasi biologi dan adsorpsi. Pada proses adsorpsi, surfaktan anionik atau bahan organik yang sejenis diamati dengan sistem adsorpsi menggunakan karbon aktif. Faktor-faktor yang memengaruhi adsorpsi surfaktan pada permukaan adalah struktur permukaan dan lebar pori bahan pengadsorpsi, struktur molekul dan lebar pori surfaktan (ionik atau tidak, rantai hidrofobiknya panjang atau pendek, cabangnya linear, alifatik atau aromatik), serta fase larutan (konsentrasi, suhu, dan pH) (Holmberg 2003).
Penelitian ini bertujuan mengukur pengaruh pH terhadap adsorpsi surfaktan anionik menggunakan karbon aktif termodifikasi ZnCl2.
TINJAUAN PUSTAKA
Karbon Aktif
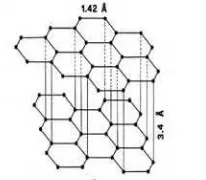
Arang adalah padatan berpori hasil pembakaran bahan yang mengandung karbon. Arang tersusun dari atom-atom karbon yng berikatan secara kovalen membentuk struktur heksagonal datar dengan sebuah atom C pada setiap sudutnya (Gambar 1). Susunan kisi-kisi heksagonal datar ini tampak seolah-olah seperti pelat-pelat datar yang saling bertumpuk dengan sela-sela di antaranya.
Sebagian pori-pori yang terdapat dalam arang masih tertutup oleh hidrokarbon, ter, dan senyawa organik lainnya. Komponen arang ini meliputi karbon terikat, abu, air, nitrogen, dan sulfur (Djatmiko et al. 1985
dalam Januar Ferry 2002).
Gambar 2 Karbon aktif tempurung kelapa.
Karbon aktif merupakan padatan amorf yang mempunyai luas permukaan dan jumlah pori sangat banyak (Baker 1997). Manes (1998) mengatakan bahwa karbon aktif adalah bentuk umum dari berbagai macam produk yang mengandung karbon yang telah diaktifkan untuk meningkatkan luas permukaannya. Karbon aktif berbentuk kristal mikro karbon grafit yang pori-porinya telah mengalami pengembangan kemampuan untuk mengadsorpsi gas dan uap dari campuran gas dan zat-zat yang tidak larut atau yang terdispersi dalam cairan (Roy 1985).
Luas permukaan, dimensi, dan distribusi karbon aktif bergantung pada bahan baku, pengarangan, dan proses aktivasi. Berdasarkan ukuran porinya, ukuran pori karbon aktif diklasifikasikan menjadi 3, yaitu mikropori (diameter <2 nm), mesopori (diameter 2–50 nm), dan makropori (diameter >50 nm) (Baker 1997).
Setyaningsih (1995) membedakan karbon aktif menjadi 2 berdasarkan fungsinya, yaitu Karbon adsorben gas (gas adsorbent carbon): Jenis arang ini digunakan untuk mengadsorpsi kotoran berupa gas. Pori-pori yang terdapat pada karbon aktif jenis ini tergolong mikropori yang menyebabkan molekul gas akan mampu melewatinya, tetapi molekul dari cairan tidak bisa melewatinya. Karbon aktif jenis ini dapat ditemui pada karbon tempurung kelapa. Selanjutnya adalah karbon fasa cair (liquid-phase carbon). Karbon aktif jenis ini digunakan untuk mengadsorpai kotoran atau zat yang tidak diinginkan dari cairan atau larutan. Jenis pori-pori dari karbon aktif ini adalah makropori yang memungkinkan molekul berukuran besar untuk masuk. Karbon jenis ini biasanya berasal dari batu bara, misalnya ampas tebu dan sekam padi.
Aktivasi adalah perubahan fisik berupa peningkatan luas permukaan karbon aktif dengan penghilangan hidrokarbon. Ada dua
macam proses aktivasi, yaitu aktivasi kimia dan aktivasi fisika. Aktivasi kimia dilakukan dengan merendam karbon dalam H3PO4,
ZnCl2, NH4Cl, dan AlCl3 sedangkan aktivasi
fisika menggunakan gas pengoksidasi seperti udara, uap air atau CO2.
Adsorpsi
Adsorpsi merupakan proses pengikatan atau penggabungan molekul adsorbat pada permukaan adsorben oleh gaya elektrik lemah yang disebut gaya Van Der Waals. Adsorpsi terjadi karena gaya tarik-menarik antara molekul adsorbat dan tapak-tapak yang aktif di permukaan adsorben (Setyaningsih 1995). Adsorpsi akan terkonsentrasi pada tapak permukaan yang memiliki energi lebih tinggi. Aktivasi adsorben akan menaikkan energi pada permukaannya sehingga dapat meningkatkan tarikan terhadap molekul adsorbat (Jason 2004).
Suatu zat dapat digunakan sebagai adsorben untuk tujuan pemisahan apabila mempunyai daya adsorpsi yang selektif, dengan luas permukaan per satuan massa yang besar, serta memiliki daya ikat yang kuat terhadap zat yang hendak dipisahkan secara fisik atau kimia. Pembesaran luas permukaan dapat dilakukan dengan pengecilan partikel adsorben. Proses adsorpsi pada karbon aktif terjadi melalui tiga tahap dasar, yaitu zat teradsorpsi pada karbon aktif bagian luar, zat bergerak menuju pori-pori karbon aktif, dan zat teradsorpsi ke dinding bagian dalam dari karbon aktif.
Faktor-faktor yang mempengaruhi adsorpsi adalah ciri-ciri fisik dan kimia adsorben, seperti luas permukaan, ukuran pori, komposisi kimia; ciri-ciri fisik dan kimia adsorbat, seperti ukuran molekul dan komposisi kimianya; konsentrasi adsorbat dalam fase cair, ciri-ciri fase cair, yaitu pH dan suhu; kondisi operasi adsorpsi.
Isoterm Adsorpsi
Isoterm Freundlich
Menurut Atkins (1994), pada proses adsorpsi zat terlarut oleh permukaan padatan diterapkan isoterm Freundlich yang diturunkan secara empiris dengan bentuk persamaan
Q kCn
1 =
Apabila dilogaritmakan, persamaan akan menjadi per satuan bobot adsorben (mg/g)
C = konsentrasi keseimbangan adsorbat dalam larutan setelah adsorpsi (ppm)
k, n = tetapan
Isoterm Freundlich menganggap bahwa pada semua tapak permukaan adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm Freundlich tidak mampu memperkirakan adanya tapak-tapak pada permukaan yang mampu mencegah adsorpsi pada saat kesetimbangan tercapai, dan bahwa hanya beberapa tapak aktif saja yang mampu mengadsorpsi molekul zat terlarut (Jason 2004).
Isoterm Langmuir
Isoterm Langmuir diturunkan berdasarkan teori dengan persamaan
C
Persamaan Langmuir dapat diturunkan dengan memperkirakan kesetimbangan antara molekul yang diadsorpsi dan molekul yang masih bebas. Persamaan Langmuir menjadi
C
Q = jumlah adsorbat per satuan adsorben (mg/g)
C = konsentrasi adsorbat dalam larutan (ppm)
k1, k2 = tetapan
Surfaktan
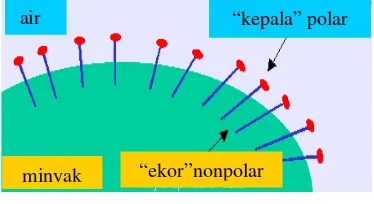
Surfaktan merupakan molekul ampifilik yang terdiri atas bagian kepala hidrofilik yang mempunyai afinitas tinggi terhadap air, dan bagian hidrofobik yang mempunyai afinitas tinggi terhadap minyak (Dickinson & Mc Clements 1996). Gugus hidrofilik dari surfaktan anionik dapat berupa gugus karboksilat, sulfat, sulfonat, dan fosfat, sedangkan gugus hidrofobiknya berupa rantai hidrokarbon alifatik, aromatik, atau gabungan keduanya.
Gambar 3 Molekul surfaktan
(ARCRCP 2003).
Menurut Salager (1999), surfaktan dibagi menjadi beberapa kelompok penting dan digunakan secara meluas pada hampir semua sektor industri modern. Berdasarkan sifat gugus hidrofiliknya, surfaktan terbagi menjadi surfaktan kationik, anionik, nonionik, dan amfoterik (Rosen 2004).
Surfaktan kationik mempunyai ekor hidrofobik melekat pada kepala hidrofilik yang bermuatan positif. Surfaktan nonionik dalam media berair tidak bermuatan. Kehidrofilikannya disebabkan oleh ikatan hidrogen antara molekul surfaktan dengan molekul-molekul air. Surfaktan amfoterik mempunyai rantai hidrofobik melekat pada gugus hidrofilik yang mengadung muatan positif dan negatif.
Surfaktan anionik mempunyai ekor hidrofobik melekat pada kepala hidrofilik yang bermuatan negatif. Gugus-gugus bermuatan negatif pada surfaktan anionik biasanya berupa karboksilat, sulfonat, sulfat, atau fosfat, sedangkan gugus hidrofobiknya berupa rantai hidrokarbon alifatik, aromatik, atau gabungan keduanya. (Kosswig et al.
1994). Surfaktan anionik digunakan dalam sabun, detergen, sampo, dan bubuk pembersih.
Salah satu surfaktan anionik yang banyak digunakan ialah linear alkilbenzena sulfonat (LAS; Gambar 4) yang sifat fisik dan kimianya ditunjukkan pada Tabel 1.
“kepala” polar air
SO3
Na
CH3(CH2)xCH(CH2)yCH3
Gambar 4 Alkilbenzena sulfonat linear.
Tabel 1 Sifat fisik dan kimia LAS (HERA 2002)
Sifat LAS Nilai Satuan
Bobot molekul 342.4 g/mol
Sifat-sifat surfaktan adalah mampu menurunkan tegangan permukaan, meningkatkan kestabilan partikel yang terdispersi, dan mengontrol sistem emulsi misalnya o/w atau w/o.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan antara lain larutan LAS 1000 ppm, ZnCl2 5%, HCl 0.1 N
dan 1 N, NaOH 0.1 N dan 1 N, akuades, serta akuabides. Alat-alat yang digunakan antara lain oven, pengaduk magnetik, pH meter, spektrofotometer UV Genesys UV 10, dan alat-alat kaca.
Metode
Pengujian Kualitas Arang Aktif
Penentuan Kadar Air (ASTM 1999b)
Contoh sebanyak 1 gram karbon aktif (bobot kering udara) ditempatkan di dalam cawan yang telah diketahui bobot keringnya. Cawan yang telah berisi contoh tersebut dipanaskan di dalam oven bersuhu 105 °C
selama 3 jam. Pemanasan dan penimbangan selanjutnya dilakukan setiap 1 jam sampai bobotnya konstan. Penentuan kadar air menggunakan persaman berikut.
Kadar air (%)= − ×100%
a b a
a = bobot contoh sebelum pemanasan (g)
b = bobot contoh setelah pemanasan (g)
Penentuan Kadar Abu (ASTM 1999a)
Contoh kering sebanyak 1 gram karbon aktif dimasukkan ke dalam cawan yang telah ditentukan bobot keringnya. Selanjutnya contoh dipanaskan di dalam tanur pada suhu 750 °C selama 6 jam. Setelah itu, didinginkan di dalam desikator selama 1 jam dan ditimbangi. Pemanasan dan penimbangan diulang hingga diperoleh bobot yang konstan. Waktu pemanasan cukup 1 jam selama pengulangan. Penentuan kadar abu menggunakan persamaan berikut.
Kadar abu (%)= ×100%
a b
a = bobot contoh sebelum pemanasan (g)
b = bobot contoh setelah pemanasan (g)
Penentuan Kadar Zat Mudah Menguap (ASTM 1999d)
Contoh kering sebanyak 1 gram dimasukkan ke dalam cawan yang telah ditentukan bobot keringnya. Selanjutnya contoh dipanaskan dalam tanur pada suhu 950 °C selama 10 menit, kemudian didinginkan dalam desikator selama 1 jam dan ditimbang. Cawan ditutup serapat mungkin. Penentuan kadar zat mudah menguap menggunakan persamaan berikut.
Kadar zat mudah menguap (%)
%
a = bobot contoh sebelum pemanasan (g)
b = bobot contoh setelah pemanasan (g)
Penentuan Kadar Karbon Terikat (SNI 1995)
Karbon terikat diasumsikan sebagai semua zat, selain abu (zat anorganik) dan senyawa atsiri yang masih teradsorpsi dalam pori-pori, yang terdapat dalam fraksi padat x + y = n,
hasil pirolisis. Penentuan kadar karbon terikat menggunakan persamaan berikut.
Kadar karbon terikat (%) )
Pengaktifan Karbon Aktif
Karbon aktif yang digunakan diaktivasi kembali dengan cara mengayak karbon aktif tersebut dengan ayakan ukuran 100 mesh, merendamnya dalam air deionisasi, menyaring dan memanaskannya pada suhu 105 °C, lalu merendamnya kembali dalam larutan ZnCl2
5% selama 2×24 jam. Setelah didekantasi, karbon aktif dipanaskan pada suhu 700 °C selama 1 jam, dicuci dengan HCl dan air deionisasi, lalu dipanaskan kembali pada suhu 105 oC selama semalam.
Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang dilakukan terhadap konsentrasi larutan LAS 20 ppm, pada panjang gelombang 200–240 nm. Data yang diperoleh berupa kurva serapan yang menghubungkan konsentrasi dengan absorbans.
Pembuatan Kurva Standar
Semua perlakuan dikondisikan pada pH 3, 6, 7, dan 12 dengan menambahkan larutan HCl 0.1 N, 1 N dan NaOH 0.1 N, 1 N.
Larutan stok LAS 1000 ppm dipipet sebanyak 0.25 mL dan diencerkan dengan akuabides dalam labu takar 25 mL untuk memperoleh konsentrasi 10 ppm. Kemudian pengenceran dilakukan lagi untuk memperoleh konsentrasi 20, 30, 40, 50, 60, dan 70 ppm. Data yang diperoleh berupa kurva hubungan antara konsentrasi dan absorbans.
Penentuan Waktu Optimum
Sebanyak 0.1 gram karbon aktif dimasukkan dalam erlenmeyer kemudian ditambahkan larutan LAS sebanyak 25 mL, digoyang dengan kecepatan tetap, dengan selang waktu 0, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50 menit, 1, 1.5, 2, 2.5, 3, 4, 6 jam, saring dan filtratnya diukur dengan spektrofotometer
UV. Konsentrasi larutan LAS yang digunakan adalah 40 ppm. Data yang diperoleh berupa kurva hubungan waktu dan kapasitas adsorpsi.
Pengukuran efisiensi Adsorpsi dan Isoterm Adsorpsi
Sebanyak 0.1 gram karbon aktif ditambahkan pada setiap 25 mL larutan LAS dengan konsetrasi 15, 30, 45, dan 60 ppm. Larutan LAS tersebut diaduk dengan kecepatan tetap. Adsorpsi LAS dilakukan pada waktu yang didapat dari waktu adsorpsi optimum. Absorbansi larutan LAS akhir diukur dengan menggunakan spektrofotometer UV. Data yang dihasilkan berupa kurva hubungan konsentrasi (ppm) dan persen efisiensi (%). Penentuan efisiensi adsorpsi menggunakan persamaan berikut.
Efisiensi (%)= − ×100%
Ca= konsentrasi akhir (ppm)
Kapasitas adsorpsi (Q) dan tetapan isoterm adsorpsi (k) dihitung dengan model isoterm adsorpsi Langmuir dan Freundlich. Pengolahan data menggunakan Data Fit versi 8.1.69. Penentuan kapasitas adsorpsi menggunakan persamaan berikut.
Q =
m C C V( o− a)
Q = kapasitas adsorpsi per bobot adsorben (mg/g)
V = volume larutan (L)
Co = konsentrasi awal (ppm)
Ca = konsentrasi akhir (ppm)
M = massa adsorben (g)
HASIL DAN PEMBAHASAN
Karbon Aktif
Karbon aktif yang digunakan dimodifikasi dengan menggunakan ZnCl2
karena diduga akan menghasilkan kapasitas adsorpsi yang tinggi (Rahman dan Saad 2003). Penggunaan ZnCl2 sebagai bahan
dapat tertarik oleh ZnCl2 dan membuka
tapak-tapak dari karbon aktif yang semula tertutup, dengan demikian akan lebih banyak tapak-tapak aktif yang terdapat pada karbon aktif. Sebelum direndam dengan larutan ZnCl2,
arang tersebut direndam dengan menggunakan air deionisasi dengan tujuan agar permukaan karbon aktif bersih dari ion-ion pengganggu, setelah itu dilakukan pemanasan dengan tujuan mengaktifkan tapak-tapak aktif dari karbon aktif sehingga dapat terbuka dan menguapkan bahan yang bersifat volatil. Kemudian dilakukan perendaman dengan larutan ZnCl2 sehingga tapak-tapak karbon
aktif bersifat lebih mesoporous (Yang 2003) dan membuka tapak-tapak karbon aktif yang awalnya tertutup. Pencucian menggunakan HCl merupakan tahap selanjutnya dalam pengaktifan karbon aktif, hal ini bertujuan untuk memperluas permukaan karbon aktif sehingga dapat mengadsorpsi zat pencemar. Pemanasan yang dilakukan pada suhu 700 oC dilakukan agar menghilangkan pengotor yang bersifat volatil yang ada pada karbon aktif (Yang 2003). Setelah selesai aktivasi arang aktif tersebut disimpan dalam tempat yang kedap udara dan setiap akan digunakan dipanaskan terlebih dahulu pada suhu 105 oC selama 1 jam agar tapak dari karbon aktif tersebut aktif.
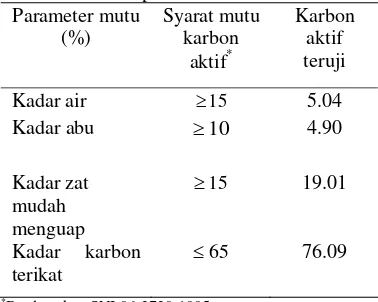
Hasil analisis proksimat karbon aktif diperlihatkan pada Tabel 2.
Tabel 2 Analisis proksimat karbon aktif Parameter mutu
*Berdasarkan SNI 06-3730-1995
Kadar Air
Perhitungan kadar air karbon aktif didasarkan pada bobot kering ovennya. Kadar air yang didapat sebesar 5.04% berdasarkan rerata dari tiga kali ulangan (Lampiran 2). Hal ini berarti karbon aktif yang digunakan memenuhi syarat mutu karbon aktif, yaitu kurang dari 15%. Nilai kadar air yang tinggi lebih dari 15% akan menurunkan mutu karbon
aktif karena air atau senyawa-senyawa atsiri yang teradsorpsi pada pori-pori arang aktif akan menurunkan kapasitas dan daya adsorpsinya terhadap gas maupun cairan.
Kadar Abu
Kadar abu yang dihasilkan sebesar 4.90% berdasarkan rerata dari tiga kali ulangan (Lampiran 3). Merujuk pada standar SNI 06-3730-1995, karbon aktif yang digunakan telah memenuhi syarat untuk kadar abu karena tidak melebihi 25%. Kadar abu yang tinggi akan mengurangi daya adsorpsi karbon aktif terhadap gas atau larutan karena oksida dari mineral Na, K, Mg, dan Ca menyebar dan menutupi pori-pori karbon aktif
Kadar Zat Mudah Menguap
Kadar zat mudah menguap yang dihasilkan masih di bawah standar yaitu sebesar 19.01% (Lampiran 4) dan telah memenuhi syarat yang dikeluarkan oleh SNI yaitu sebesar 25%. Kadar zat mudah terbang yang tinggi dapat menurunkan mutu karbon aktif karena adanya air atau senyawa-senyawa atsiri yang teradsorpsi pada pori-pori karbon aktif akan menurunkan kapasitas dan daya adsorpsi terhadap gas maupun cairan.
Kadar Karbon Terikat
Kadar karbon terikat yang didapat sebesar 76.09% (Lampiran 5) yang menunjukkan bahwa karbon aktif telah memenuhi standar. Kadar zat mudah menguap lebih besar daripada nilai kadar abu, ini berarti bahwa pengaruh kadar karbon mudah menguap lebih dominan dibandingkan dengan kadar abu.
Panjang Gelombang dengan Serapan Maksimum
Panjang gelombang dengan serapan maksimum (λmaks) untuk pengukuran larutan
LAS dengan metode spektrofotometri adsorpsi sinar UV diperoleh pada panjang gelombang 222 nm (Lampiran 6 dan 7), karena itu, pengukuran selanjutnya dilakukan pada panjang gelombang ini. Pengukuran serapan pada λmaks dapat mengurangi galat
serapan yang cukup besar untuk perbedaan konsentrasi yang kecil (Suradikusumah 2004).
Pembuatan Kurva Standar
Kurva standar larutan LAS yang diukur pada panjang gelombang 222 nm (Lampiran 6 dan 7), memiliki linearitas yang tinggi. Hal ini ditunjukkan oleh nilai r2yang mendekati satu (Gambar 5).
Dari grafik pada pH 3, 6, 7, dan 12 secara berurutan diperoleh persaman garis y = 0.0194x + 0.0065 dengan r2= 98.33%,
Gambar 5 Hubungan antara konsentrasi dan absorbans.
Penentuan Waktu Optimum
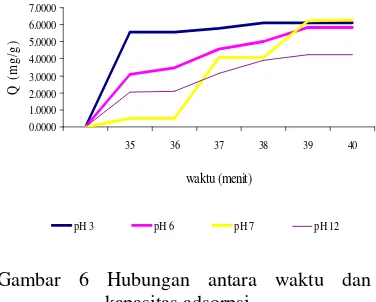
Pengaruh waktu adsorpsi dapat dilihat dari nilai kapasitas adsorpsi (Q) (Lampiran 9). Nilai Q akan naik hingga mencapai titik optimum kemudian stabil atau sedikit menurun setelah melewati waktu kesetimbangannya (Gambar 6). Turunnya nilai Q dikarenakan karbon aktif telah mencapai titik jenuhnya.
Waktu optimum pH 3 terjadi pada 35 menit dengan kapasitas sebesar 5.5457 mg/g. Hal ini terlihat nilai Q yang meningkat pada waktu tersebut dan mulai stabil sampai waktu 40 menit. Kejadian ini dikarenakan pada pH 3 permukaan karbon aktif bermuatan positif sehingga jumlah adsorbat yang diadsorpsi lebih banyak, dengan demikian pada pH rendah akan lebih cepat mengalami penjenuhan.
Lain halnya untuk pH yang lebih tinggi, terlihat pada pH 6, 7, dan 12. Pada waktu 35 menit, Q mengalami kenaikan, namun pada waktu 39–40 menit nilai Q naik kembali sampai stabil pada waktu tersebut. Walaupun
waktu optimum pada pH tersebut hampir sama, namun nilai Q yang didapat untuk mencapai kejenuhan berbeda-beda. Nilai Q
pada pH 6 sebesar 3.0954 mg/g. pH 6 cenderung lebih cepat jenuh dan mencapai Q
maksimum dibandingkan pH 7 dan 12. Hal ini dikarenakan permukaan karbon aktif yang bermuatan positif pada pH 6, sedangkan pada pH 12 permukaan karbon aktif bermuatan negatif yang menyebabkan adsorbat lebih sulit teradsorpsi dan mencapai kejenuhan pada waktu dan kapasitas maksimum. Waktu optimum yang digunakan untuk proses adsorpsi digunakan waktu 35 menit, karena waktu tersebut adsorpsi berlangsung maksimum walaupun pada pH yang lebih tinggi mengalami sedikit kenaikan Q pada waktu yang lebih lama.
0.0000
Gambar 6 Hubungan antara waktu dan kapasitas adsorpsi.
Efisiensi Karbon Aktif
Jumlah LAS yang dapat diadsorpsi oleh karbon aktif pada pH dan konsentrasi LAS berbeda dapat dilihat pada Gambar 7 dan Lampiran 10. Pada gambar terlihat bahwa jumlah LAS yang diadsorpsi semakin meningkat dengan menurunnya pH (Sibelzor 2004). Pada pH rendah, permukaan karbon aktif yang awalnya tidak bermuatan menjadi lebih bermuatan positif oleh tambahan proton dari kondisi asam tersebut (Yang 2003), sehingga dapat mengadsorpsi LAS yang bermuatan negatif. Muatan negatif berasal dari gugus hidrofilik LAS, yaitu SO3-.
LAS bersifat basa atau bermuatan negatif dan mempunyai pH 7-10 (HERA, 2002) sehingga akan sulit terjadi adsorpsi LAS karena persamaan muatan tersebut.
0.00
Gambar 7 Hubungan antara konsentrasi dan efisiensi.
Peningkatan konsentrasi pada semua pH menyebabkan penurunan jumlah adsorbat yang teradsorpsi hal ini di duga karena karbon aktif mencapai kapasitas yang jenuh. Selain itu, pada konsentrasi tinggi, molekul LAS mempunyai kecenderungan untuk membentuk dua lapisan (bilayer) karena terjadi reaksi hidrofobik antara rantai hidrokarbon pada lapisan tersebut dan LAS lain sehingga gugus polar masuk ke fase cair akibat desorpsi. Interaksi ini menunjukkan bahwa, pada konsentrasi tinggi kekuatan tolakan antara molekul LAS yang teradsorpsi pada permukaan adsorben dengan larutan lebih efektif, maksudnya gaya tarik terhadap adsorbat oleh fluida lebih besar.
Isoterm Adsorpsi
Linearitas isoterm Freundlich dan Langmuir pada adsorpsi LAS menggunakan karbon aktif menunjukkan nilai yang tinggi (Lampiran 11). Isoterm yang lebih tepat dapat dipilih dari yang lebih tinggi nilai linearitasnya (Atkins 1994). Linearitas isoterm Freundlich lebih tinggi pada proses adsorpsi LAS ini. Isoterm Freundlich mengasumsikan terjadinya fisisorpsi, yaitu ikatan lemah antara adsorbat dengan adsorben yang hanya melibatkan interaksi van der Waals. Lemahnya ikatan karbon aktif dengan LAS ini dapat disebabkan oleh adsorpsi yang bersifat
bilayer karena pada lapisan kedua mempunyai
energi lebih kecil daripada yang pertama, sehingga mudah terlepas dari permukaan adsorben.
Pembuatan isoterm adsorpsi Freundlich dilakukan pada pH yang berbeda yaitu 3
(Gambar 8), 6 (Lampiran 13a), 7 (Lampiran 14a), dan 12 (Lampiran 15a). Sedangkan nilai
k1, k2 pada isoterm Langmuir terlihat pada
Lampiran 12 dan kurva isoterm Langmuir pH 6 (Lampiran 13 b), 7 (Lampiran 14 b), dan 12 (Lampiran 15 b). Tabel 3 menunjukkan nilai k
dan n yang didapat dengan menggunakan persamaan isoterm Freundlich. Nilai n lebih besar dari 1 dapat mengindikasikan bahwa adsorpsi LAS oleh karbon aktif berlangsung baik (Sibelzor 2004). Dapat dilihat bahwa semakin besar pH, maka nilai k maupun n
akan semakin menurun.
Tabel 3 Nilai konstanta k dan n menggunakan persamaan isoterm Freundlich
pH k n
3 2.6565 5.7398
6 1.6963 2.9488
7 0.6080 1.5540
12 0.4479 2.1567
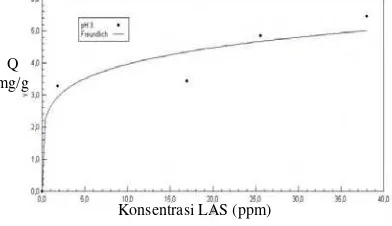
Gambar 8 memperlihatkan kurva isoterm Freundlich pada pH 3, terlihat bahwa semakin besar konsentrasi LAS, maka kapasitas adsorpsinya akan semakin meningkat juga. Kapasitas adsorpsi LAS tertinggi terjadi pada pH 3, yaitu sebesar 2.6565 mg/g.
Gambar 8 Hubungan antara konsentrasi LAS dan kapasitas adsorpsi pada pH 3 dengan Isoterm Freundlich.
Tetapan k pada persamaan Freundlich digunakan untuk menentukan kapasitas adsoprsi sedangkan nilai n merupakan energi yang dikeluarkan oleh permukaan karbon aktif. Semakin banyak adsorbat yang teradsorpsi dalam karbon aktif, energi yang dikeluarkan karbon aktif untuk mengadsorpsi juga semakin besar. Tetapan k pada pH 3 mempunyai nilai yang paling besar yaitu 2.6565 sedangkan pada pH basa sebesar
Konsentrasi LAS (ppm) Q
0.4479 berati karbon aktif pada pH asam dapat mengadsorpsi adsorbat lebih banyak dibandingkan dengan pH basa.
SIMPULAN DAN SARAN
Simpulan
Analisis proksimat karbon aktif mempunyai kadar air 5.04%, abu 4.90%, zat mudah menguap 19.01%, dan karbon terikat 76.09%. Waktu optimum adsorpsi LAS menggunakan karbon aktif adalah 35 menit. Waktu optimum diarahkan untuk aplikasi karbon aktif sebagai adsorpsi LAS. Nilai efisiensi dan kapasitas dilakukan pada konsentrasi LAS 15 ppm. Efisiensi tertinggi pada pH 3 sebesar 87.15% dan terendah pada pH 12 sebesar 33.84%. Kapasitas adsorpsi tertinggi terjadi pada pH 3 sebesar 3.2761 mg/g dan terendah pada pH 12 sebesar 2.2588 mg/g.
Saran
Pembuatan karbon aktif dilakukan dari awal, dimulai dengan proses pengarangan dan aktivasi sehingga akan menghasilkan karbon aktif yang sesuai. Pengaktifan karbon aktif menggunakan konsentrasi ZnCl2 yang lebih
variatif, sehingga dapat diketahui konsentrasi ZnCl2 yang dapat mengadsorpsi maksimum
LAS. Ukuran karbon aktif perlu dilakukan pada ukuran kurang dari 100 mesh dan lebih
besar dari 100 mesh.
DAFTAR PUSTAKA
[ARCRCP] Australian Research Council’s Research Centres Program. 2003. Surfactant. www.kcpc.usyd.edu.html [10 April 2006].
[ASTM] American Society for Testing Material. 1999a. ASTM D 2866-94:
Standard Test Methode for Total Ash Content of Activated Carbon.
Philadelphia: American Society for Testing and Material.
[ASTM] American Society for Testing Material. 1999b. ASTM D 2866-99:
Standard Test Methode for Moisture
of Activated Carbon. Philadelphia:
American Society for Testing and Material.
[ASTM] American Society for Testing Material. 1999d. ASTM D 5832-98:
Standard Test Methode for Volatile
Matter Content of Activated Carbon.
Philadelphia: American Society for Testing and Material.
Atkins PW. 1994. Kimia Fisik Jilid 2. Ed ke-4. Jakarta: Erlangga.
Baker FS, Miller CE, Repik AJ, Tollens ED. 1997. Activated Carbon. New York: J Wiley.
Dickinson E, Mc Clements. 1996. Advance in
Food Colloids. New York: Chapman
and Hall.
Fernandes EC, Delgado TS. 1994. Chorcoal and activated carbon from coconut husk. J Philipp Tecnol 19:59–65.
Ferry J. 2002. Pembuatan arang aktif dari serbuk gergajian kayu campuran sebagai adsorben pada pemurnian minyak goreng bekas [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Harfi R, Kusuma I. 1994. Peningkatan Mutu Proses Arang Batok Kelapa Sebagai Komoditi Ekpor dengan
Menggunakan Kiln Drum. Jakarta:
Jurusan Mesin Fakultas Teknologi Industri, Institut Sains dan Teknologi Nasional.
[HERA] Human and Environmental Risk Assessment. 2002. Linear alkylbenzene sulfonate (LAS). J
Phys chem. www.heraproject.com.
[18 Feb 2006].
Holmberg K, Jonsson B, Kronberg B, Lindman B. 2003. Surfactants and
Polymers in Aquenous Solution. Ed
Jason PP. 2004. Activated carbon and some application for the remediation of soil and groundwater pollution. http://www.cee.vt.edu/program_area. [28 Jun 2005].
Kosswig K, Huls AG, Marl. 1994.
Surfactants. Volume ke-A25,
Ullmann’s Encyclopedia of Industrial Chemistry. New York: Federal Republic of Germany.
Manes M. 1998. Activated Carbon Adsorption
Fundamental. Di dalam: R.A.
Meyers (Penyunting). Encyclopedia of Environmental Analysis and
Remediation, Volume 1. New York:
J Wiley.
Rahman IA, Saad B. 2003. Utilization of guana seeds as a source of activated carbon for removal of methylene blue from aqueous solution. J Malay
of Chem 5:008–014.
Rosen MJ. 2004, Surfacts and Interfacial
Phenomena. Ed. Ke-3. New York: J
Wiley.
Roy GM. 1985. Activated Carbon Aplication in tho Food and Pharmaceutucal Industries. Lancaster: Tanchnomic.
Salager JL. 1999. Surfactants-Types and Uses. Merida, Venezuela: Laboratario FIRP Escuela de Ingeneira Quimica, Universidad de Los Andes.
Setyaningsih H. 1995. Pengolahan limbah batik dengan proses kimia dan adsorpsi karbon aktif [tesis]. Jakarta: Program Pascasarjana, Universitas Indonesia.
Sibelzor. 2004. Investigation of the adsorption of anionic surfactants at different pH values by means of active carbon and the kinetics of adsorption. J Serb
Chem Soc 69(1) 25–32.
merve@kou.edu.tr. [28 Juni 2005].
[SNI] Standar Nasional indonesia.1995. SNI 06-3730-1995: Arang Aktif Teknis. Jakarta: Dewan Standardisasi Nasional.
Suradikusumah E. 2004. Spektroskopi I. Bogor: Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
The LAB Sulfonic Acid Coalition. 2003. Assessment plan for the linear alkylbenzene (LAB) sulfonic acid
category. Washington: Science@weinberggroup.com.
[22 Feb 2006].
Yang RT. 2003, Adsorbents: Fundamentals
and Aplications. New York: J
Lampiran 1 Bagan alir penelitian
Lampiran 2 Nilai kadar air
Ulangan Bobot awal (g) Bobot akhir (g) Kadar air (%)
1 1.0013 0.9504 5.08
2 1.0027 0.9527 5.02
3 1.0013 0.9509 5.03
Rerata 5.04
Lampiran 3 Nilai kadar abu
Ulangan Bobot awal (g) Bobot akhir (g) Kadar abu (%)
1 1.0001 0.9521 4.80
2 1.0007 0.9507 5.00
3 1.0008 1.0498 4.90
Rerata 4.90
Pengaktifan karbon aktif
Penentuan panjang gelombang maksimum
Pembuatan kurva standar
standar
Penentuan waktu maksimum
j
Penentuan efisiensi dan isoterm adsorpsi
Lampiran 4 Nilai kadar zat mudah menguap
Ulangan Bobot awal (g) Bobot akhir (g) Kadar zat mudah menguap (%)
1 1.0001 0.8155 18.46
2 1.0007 0.8042 19.64
3 1.0017 0.8122 18.92
Rerata 19.01
Lampiran 5 Nilai kadar karbon terikat Kadar zat mudah menguap
(%)
Kadar abu (%)
Kadar karbon terikat (%)
19.01 4.90 76.09
Lampiran 6 Penentuan panjang gelombang maksimum LAS pada konsentrasi 20 ppm
Panjang gelombang
(nm)
Absorbans
200 0.082
202 0.082
204 0.083
206 0.085
208 0.087
210 0.088
212 0.090
214 0.092
216 0.094
218 0.096
220 0.097
222 0.098
224 0.097
226 0.092
228 0.090
Lampiran 7 Kurva adsorpsi pada penentuan panjang gelombang maksimum LAS 20 ppm
190 200 210 220 230 240 250
panjang gelombang (nm)
Lampiran 8 Data absorbans pada konsentrasi dan pH berbeda untuk pembuatan kurva standar
pH Konsentrasi
(ppm) 3 6 7 12
0 0.0000 0.0000 0.0000 0.0000
10 0.2470 0.1810 0.1390 0.2630
Lampiran 9 Nilai kapasitas adsorpsi pada konsentrasi LAS 40 ppm dan pH yang berbeda untuk
penentuan waktu optimum
pH
0 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000
35 0.1005 17.7062 5.5457 0.1117 26.1696 3.0954 0.1003 38.0761 0.4795 0.1009 31.6989 2.0568
36 0.1008 17.6546 5.5420 0.1011 25.9522 3.4737 0.1006 38.0217 0.9163 0.1012 31.4301 2.1171
37 0.1004 16.8299 5.7695 0.1009 21.4304 4.6010 0.1012 23.4022 4.1003 0.1101 26.1075 3.1545
38 0.1006 15.4896 6.0911 0.1012 19.6478 5.0277 0.1112 21.7717 4.0981 0.1007 24.1720 3.9295
39 0.1010 15.3351 6.1052 0.1102 14.2565 5.8402 0.1009 14.9239 6.2131 0.1008 22.8817 4.2456
Lampiran 10 Nilai efisiensi adsorpsi LAS pada konsentrasi dan pH berbeda
pH
3 6 7 12 Konsentrasi
awal (ppm) Konsentrasi akhir (ppm)
Efisiensi (%)
Konsentrasi akhir (ppm)
Efisiensi (%)
Konsentrasi akhir (ppm)
Efisiensi (%)
Konsentrasi awal (ppm)
Efisiensi (%) 0 0.0000 0.00 0.0000 0.00 0.0000 0.00 0.0000 0.00 15 1.8299 87.80 6.0826 59.45 6.3913 57.39 9.9247 33.84 30 16.9627 80.15 9.6913 67.69 19.2717 53.88 22.4516 25.16 45 25.5928 43.13 23.8217 47.06 24.7065 45.10 34.1720 24.06 60 38.0155 36.64 38.0826 36.53 39.3261 16.34 49.3871 17.65
Lampiran 11 Nilai linearitas pada isoterm Freundlich dan Langmuir
pH Linearitas (r2) Isoterm Freundlich
(%)
Linearitas (r2) Isoterm Langmuir
(%)
3 93.40 89.40
6 94.26 91.37
7 82.73 82.14
12 99.61 99.39
Lampiran 12 Nilai k1dan k2 pada persamaan isotherm Langmuir
pH k1 k2
3 4.8010 1.0350
6 6.9574 0.1220
7 0.0951 3.9876
12 0.0382 4.7365
Lampiran 13 Kurva isoterm adsorpsi Freundlich(a) dan Langmuir (b) pada pH 6
(a)
Konsentrasi LAS (ppm) Q
Lanjutan Lampiran 13
(b)
Lampiran 14 Kurva isoterm adsorpsi Freundlich (a) dan Langmuir (b) pada pH 7
(a)
(b)
Konsentrasi LAS (ppm)
Konsentrasi LAS (ppm)
Konsentrasi LAS (ppm) Q
(mg/g)
Q (mg/g)
Lampiran 15 Kurva isoterm adsorpsi Freundlich (a) dan Langmuir (b) pada pH 12
(a)
(a)
(b)
Konsentrasi LAS (ppm) Q