ADSORPSI SENYAWA RESIDU KLORIN PADA
KARBON AKTIF TERMODIFIKASI ZINK KLORIDA
EKA RAHMAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
EKA RAHMAWATI. Adsorpsi Senyawa Residu Klorin pada Karbon Aktif Termodifikasi ZnCl2. Dibimbing oleh TETTY KEMALA dan AHMAD SJAHRIZA.
Klorin merupakan zat kimia yang sering digunakan sebagai disinfektan air. Tingginya kandungan klorin menimbulkan bau khas yang akan berpengaruh pada kesehatan konsumen. Karbon aktif banyak digunakan pada sistem penjernihan air untuk mengurangi kandungan residu klorin yang berlebihan dalam air. Karbon aktif yang digunakan adalah yang dimodifikasi oleh ZnCl2 (ZCAC) dan hasil pencucian dengan air deionisasi (DWAC), sementara sumber residu klorin yang digunakan adalah larutan kaporit. Studi adsorpsi kedua jenis karbon aktif terhadap residu klorin dilakukan pada karbon aktif berukuran 100 mesh dan konsentrasi larutan 0.5, 1.0, 1.5, 2.0, 2.5, dan 3.0 ppm, dengan waktu pengamatan 15, 30, 45, 60, 75, 90, 120, dan 150 menit. Pengukuran konsentrasi residu klorin yang terjerap dilakukan dengan titrasi iodometri tak langsung. Penentuan waktu optimum adsorpsi menunjukkan bahwa penjerapan residu klorin oleh karbon aktif berlangsung cepat, hanya dalam waktu 15−60 menit. Efisiensi adsorpsinya pun tinggi. Persentase residu klorin yang terjerap per gram adsorben meningkat pada karbon aktif termodifikasi ZnCl2. Kapasitas adsorpsi residu klorin per gram adsorben pada larutan kaporit 2.0 ppm sebesar 83.9566 μg/g untuk ZCAC dan 66.6683 μg/g untuk DWAC. Mekanisme adsorpsi karbon aktif terhadap residu klorin berlangsung secara fisisorpsi, dengan linearitas di atas 95% untuk isoterm Freundlich.
ABSTRACT
EKA RAHMAWATI. Residual Chlorine Adsorption in Zinc(II) Chloride-Modified Active Carbon. Supervised by TETTY KEMALA and AHMAD SJAHRIZA.
ADSORPSI SENYAWA RESIDU KLORIN PADA
KARBON AKTIF TERMODIFIKASI ZINK KLORIDA
EKA RAHMAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Adsorpsi Senyawa Residu Klorin pada Karbón Aktif Termodifikasi Zink Klorida
Nama : Eka Rahmawati NIM : G44201017
Disetujui
Pembimbing I Pembimbing II
Tetty Kemala, S.Si, M.Si. Drs. Ahmad Sjahriza
NIP 132232787 NIP 131842413
Diketahui
Dekan Fakultas Matematika dan Ilmu pengetahuan Alam Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat dan hidayah-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih penulis dalam penelitian yang dilaksanakan sejak bulan Desember 2005 sampai April 2006 ini ialah Adsorpsi Senyawa Residu Klorin pada Karbon Aktif Termodifikasi Zink Klorida. Penelitian ini dilakukan di Laboratorium Kimia Fisik dan Lingkungan, Departemen Kimia, FMIPA-IPB.
Terima kasih penulis ucapkan kepada Ibu Tetty Kemala, S.Si, M.Si. dan Bapak Drs. Ahmad Sjahriza, selaku pembimbing, Budi Arifin S.Si yang telah banyak memberi saran dan arahan. Di samping itu, penghargaan juga penulis sampaikan kepada Mas Heri, Pak Mail, Pak Nano, Bu Ai, Pak Sawal, Pak Mul, Pak Caca, Pak Sabur, Bu Yenni, Mbak Nur, Bu Nena, dan Mas Toni. Penulis juga mengucapkan terima kasih dan rasa hormat kepada keluarga tercinta, Alm. Bapak dan Almh. Ibu, Mama, Papi, dan adik-adik tercinta (Yuni, Yosie, Rizal, Rosa) atas doa, cinta, dan kasih sayang yang senantiasa diberikan. Ungkapan terima kasih juga disampaikan kepada rekan penelitian (Dyah dan Amir) atas bantuan dan kerja sama, sahabat-sahabatku tercinta (Melinda, Mbak Ucrit, Mbak Nila, Mbak Eli, Dian, Rahma, Wiji, Ira, Atik, Amel, Emil, Husnul, Woro, Riki, Mas Bayu, Gie, Mas Duo, Yayan, Dwi, dan Nazer) atas semangat, bantuan, inspirasi, doa, dan persahabatan yang indah, seluruh teman Kimia-38, warga kosan C-22 terima kasih untuk kebersamaannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2006
RIWAYAT HIDUP
Penulis dilahirkan di Probolinggo, Jawa Timur pada tanggal 28 Februari 1983 sebagai putri pertama dari dua bersaudara, dari ayah Alm T. Abidin dan ibu Almh Sukarmiani.
Tahun 2001 penulis lulus dari SMUN 1 Probolinggo dan pada tahun yang sama diterima di Departemen Kimia, Institut Pertanian Bogor, melalui jalur Undangan Seleksi Masuk IPB (USMI). Tahun 2004, penulis melaksanakan praktik kerja lapangan di Laboratorium Mikrobiologi Lingkungan, LIPI-Juanda Bogor dan pada tahun 2005, penulis melaksanakan penelitian tugas akhir di Laboratorium Kimia Fisik dan Lingkungan, Kimia Anorganik, Institut Pertanian Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL... viii
DAFTAR GAMBAR... viii
DAFTAR LAMPIRAN... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Karbon Aktif... 1
Pembuatan dan Penggunaan Karbon Aktif ... 2
Adsorpsi ... 3
Isoterm Adsorpsi ... 3
Klorin ... 4
BAHAN DAN METODE Bahan dan Alat... 4
Metode ... 4
HASIL DAN PEMBAHASAN Modifikasi Karbon Aktif... 6
Analisis Proksimat ... 6
Titrasi Residu Klorin oleh Na2S2O3 ... 7
Waktu Adsorpsi... 7
Adsorpsi Residu Klorin... 7
Isoterm Adsorpsi ... 8
SIMPULAN DAN SARAN ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Standar kualitas karbon aktif menurut SNI... 6
2 Kapasitas dan efisiensi adsorpsi ZCAC dan DWAC terhadap residu klorin pada air minum ... 8
3 Nilai k1 dan k2 pada isoterm Langmuir ... 9
4 Nilai k dan n pada isoterm Freundlich ... 10
DAFTAR GAMBAR
Halaman
1 Struktur grafit dari karbon aktif ... 22 Karbon aktif berbentuk granul... 2
3 Proses adsorpsi pada karbon aktif... 3
4 Waktu adsorpsi residu klorin ... 7
5 Kapasitas adsorpsi ZCAC dan DWAC terhadap residu klorin ... 8
6 Efisiensi adsorpsi ZCAC dan DWAC terhadap residu klorin... 8
7 Isoterm adsorpsi Langmuir residu klorin oleh ZCAC... 9
8 Isoterm adsorpsi Freundlich residu klorin oleh ZCAC ... 9
9 Isoterm adsorpsi Langmuir residu klorin oleh DWAC ... 9
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 13
2 Kadar air karbon aktif ... 14
3 Kadar abu karbon aktif... 14
4 Kadar zat mudah menguap karbon aktif. ... 14
5 Kadar karbon terikat pada karbon aktif... 14
6 Standardisasi Na2S2O3 oleh KIO3... 14
7 Kapasitas dan efisiensi adsorpsi ZCAC pada penentuan waktu optimum adsorpsi... 15
8 Kapasitas dan efisiensi adsorpsi DWAC pada penentuan waktu optimum adsorpsi... 15
9 Kapasitas dan efisiensi adsorpsi ZCAC... 16
10 Kapasitas dan efisiensi adsorpsi DWAC... 16
11 Kapasitas dan efisiensi adsorpsi karbon aktif terhadap air PDAM Tirta Pakuan... 16
12 Kapasitas dan efisiensi adsorpsi karbon aktif terhadap air Kampus Darmaga IPB... 16
PENDAHULUAN
Air merupakan sumber daya alam yang diperlukan oleh semua makhluk hidup. Air merupakan kebutuhan yang sangat vital bagi kehidupan manusia, terutama untuk air minum. Salah satu cara memproduksi air layak-minum adalah dengan mengolah air tanah atau air permukaan menjadi air yang memenuhi syarat kesehatan. Sistem pengolahan air bersih terdiri atas beberapa tahapan proses, yaitu penyaringan awal, koagulasi, flokulasi, sedimentasi, aerasi, filtrasi, dan disinfeksi.
Sistem disinfeksi yang sering digunakan adalah cara klorinasi. Bahan yang umum dipakai sebagai disinfektan adalah kaporit karena harganya yang murah dan masih mempunyai daya disinfeksi sampai beberapa jam setelah pembubuhannya. Dalam instalasi pengolahan air, air yang dihasilkan selalu mengandung residu klorin. Kandungan klorin di dalam air bersih yang disyaratkan oleh Permenkes No. 416/Menkes/Per/IX/1990
adalah 0.1−1.2 ppm (Akademi Teknik Tirta
Wiyata 2003). Tingginya kandungan residu klorin menimbulkan bau khas yang banyak dikeluhkan pelanggan. Selain itu, klorin cenderung berikatan dengan senyawa organik untuk membentuk klorinamina dan hal ini meningkatkan risiko kanker yang akan merusak hati, paru-paru, dan ginjal serta sistem saraf pusat (Jaguaribe 2005).
Sehubungan dengan hal tersebut, salah satu cara untuk mengurangi tingginya kandungan residu klorin adalah dengan menggunakan bahan penjerap, misalnya karbon aktif. Karbon aktif banyak digunakan sebagai adsorben untuk pemurnian pulp, pemurnian air, pemurnian minyak, pemurnian gas, katalis dan sebagainya (Lynch 1990). Salah satu bahan baku karbon aktif yang potensial adalah tempurung kelapa. Pemanfaatannya sebagai bahan baku selain karena harganya murah juga sekaligus dapat mengurangi dampak buruk ke lingkungan karena tempurung kelapa merupakan hasil samping dalam pembuatan kopra.
Prinsip kerja karbon aktif adalah adsorpsi, dengan karbon aktif sebagai adsorben. Modifikasi dengan garam mineral seperti zink
klorida (ZnCl2) merupakan cara paling umum
yang digunakan untuk mengaktivasi karbon aktif sehingga efisiensi penjerapannya lebih besar dibanding tanpa modifikasi (Prawirakusuma & Utomo 1970). Modifikasi
ZnCl2 terhadap karbon tempurung kelapa
mengarah pada pembukaan pori-pori karbon yang terikat secara kovalen dalam suatu pelat heksagonal (Smith 1992). Pembukaan pori-pori karbon mampu meningkatkan jumlah tapak aktif, sehingga dapat memperbesar kemampuan menjerap adsorbat.
Penelitian yang telah banyak dilakukan membuktikan bahwa karbon aktif merupakan salah satu adsorben yang efektif pada pengolahan air. Karbon aktif tempurung kelapa tanpa modifikasi dapat digunakan sebagai adsorben pada sistem penjernihan air (Sriwahyuni 2002). Karbon aktif tempurung
kelapa termodifikasi gas CO2 diketahui dapat
menghilangkan sampai 70% residu klorin dari
air (Jaguaribe et al. 2005). Karbon aktif hasil
pengaktifan dengan ZnCl2 memiliki kapasitas
adsorpsi yang tinggi sehingga dapat memurnikan air (Fernandez & Delgado 1994). Oleh karena itu, dalam penelitian ini akan diuji kapasitas karbon aktif tempurung kelapa
termodifikasi ZnCl2 dalam mengadsorpsi
residu klorin pada air.
Penelitian ini bertujuan menentukan
kapasitas karbon aktif termodifikasi ZnCl2
terhadap residu klorin dalam air, kemudian menentukan isoterm adsorpsi yang sesuai.
Karbon aktif termodifikasi ZnCl2 diperkirakan
mempunyai kapasitas adsorpsi yang lebih besar dibandingkan dengan karbon aktif hasil pencucian dengan air deionisasi (tanpa
modifikasi ZnCl2). Kapasitas adsorpsi karbon
aktif dipengaruhi oleh proses aktivasi dan waktu adsorpsi. Hasil penelitian ini diharapkan dapat bermanfaat bagi pengembangan industri karbon aktif dan bagi instansi pengolahan air bersih yang menggunakan klorin dalam proses produksinya.
TINJAUAN PUSTAKA
Karbon Aktif
mengalami desorpsi (Roy 1995). Sifat ini menguntungkan untuk aplikasi industri karena karbon aktif dapat dipakai ulang melalui proses regenerasi.
Karbon aktif berbentuk kristal mikro karbon grafit yang pori-porinya telah mengalami proses pengembangan kemampuan untuk menjerap gas dan uap dari campuran gas dan zat-zat yang tidak larut atau terdispersi dalam cairan (Roy 1995). Karbon aktif adalah arang yang telah mengalami proses aktivasi untuk meningkatkan luas permukaannya dengan jalan membuka pori-porinya sehingga daya adsorpsinya meningkat.
Pola difraksi sinar-X menunjukkan bahwa karbon aktif berbentuk grafit, amorf. Karbon aktif tersusun dari atom-atom karbon berikatan secara kovalen membentuk struktur heksagonal datar. Susunan kisi-kisi heksagonal datar ini tampak seperti pelat-pelat datar yang saling bertumpuk dengan sela-sela diantaranya. Setiap kristal karbon aktif biasanya tersusun dari 3 atau 4 lapisan atom
karbon dengan sekitar 20−30 atom karbon
heksagonal pada tiap lapisan (Jankowska 1991) (Gambar 1).
Gambar 1 Struktur grafit dari karbon aktif.
Pembuatan dan Penggunaan Karbon Aktif
Karbon aktif pada dasarnya dapat dibuat dari berbagai bahan yang mengandung karbon. Tulang, kulit biji, kayu keras dan lunak, kulit kayu, tongkol jagung, serbuk gergaji, sekam padi, dan tempurung kelapa ialah beberapa contoh yang umum digunakan. Bahan-bahan lain yang juga dapat digunakan ialah limbah kilang minyak, tanah gambut, batu bara, limbah ubi kayu, dan serat sayuran (Roy 1995). Pembuatan karbon aktif mencakup dua tahapan utama, yaitu proses
karbonisasi bahan baku pada suhu 600−700
°C, dan proses aktivasi bahan terkarbonisasi tersebut pada suhu lebih tinggi. Karbonisasi merupakan proses penguraian selulosa organik menjadi unsur karbon dengan disertai
Aktivasi karbon aktif dapat dilakukan dengan 2 cara, yaitu proses aktivasi gas da
pengeluaran unsur-unsur non-karbon, yang
berlangsung pada suhu sekitar 600−700 °C.
n pros senyawa kimia sebe n, dim
Gam ar 2 k granul.
lah digunakan secara luas dalam industri pangan, misa
es aktivasi kimia. Prinsip aktivasi gas
adalah pemberian uap air atau gas CO2 kepada
arang yang telah dipanaskan. Arang yang telah halus dimasukkan ke dalam tungku
aktivasi lalu dipanaskan pada suhu 800−1000
°C. Selama pemanasan, dialirkan uap air atau
gas CO2. Pada suhu di bawah 800 °C, aktivasi
dengan uap air ataupun gas CO2 berlangsung
sangat lambat sedangkan pada suhu di atas 1000 °C dapat terjadi kerusakan susunan kisi heksagonal karbon aktif.
Sementara itu, prinsip aktivasi kimia ialah perendaman arang dalam
lum dipanaskan. Arang direndam dalam larutan pengaktif selama 24 jam lalu ditiriskan
dan dipanaskan pada suhu 600−900°C selama
1−2 jam. Pada suhu ini bahan pengaktif
masuk di antara sela-sela lapisan heksagonal karbon aktif dan selanjutnya membuka permukaan yang tertutup. Bahan-bahan kimia
yang dapat digunakan antara lain H3PO4,
ZnCl2, NH4Cl, AlCl3, HNO3, KOH, NaOH,
H3BO3, KMnO4, SO2, H2SO4, dan K2S.
Penggunaan karbon aktif sebagai adsorben ditentukan oleh luas permukaa
ensi, dan distribusinya, yang bergantung pada bahan baku, kondisi pengarangan, dan proses pengaktifan yang digunakan. Menurut IUPAC, karbon aktif diklasifikasikan berdasarkan ukuran porinya menjadi mikropori (diameter <2 nm), mesopori
(diameter 2−50 nm), dan makropori (diameter
>50 nm) (Baker 1997). Karbon aktif pengadsorpsi gas berbentuk granul, keras, dan rapatannya tinggi (Gambar 2), sedangkan pengadsorpsi cairan berbentuk serbuk, lunak, dan rapatannya rendah (Fernandez & Delgado 1994).
b Karbon aktif berbentu
Sekarang ini, karbon aktif te
Adsorpsi
Adsorpsi a ses terjadinya
perpindahan massa ad orbat dari fase gerak (flui
terbentuk multilapisan pada tekanan ting
bagai berikut. Molekul adsorbat berd
a, zat terje
dalah pro s
da pembawa adsorbat) ke permukaan adsorben. Dalam proses adsorpsi, terjadi tarik-menarik antarmolekul adsorbat (zat teradsorpsi) serta antara molekul-molekul adsorbat dan tapak-tapak aktif pada permukaan adsorben (pengadsorpsi). Perpindahan massa terjadi jika gaya tarik adsorben lebih kuat (Setyaningsih 1995). Berdasarkan jenis gaya tarik ini, dikenal adsorpsi fisik (fisisorpsi) yang melibatkan gaya van der Waals, dan adsorpsi kimia (kimisorpsi) yang melibatkan reaksi kimia.
Adsorpsi fisik memiliki ΔH adsorpsi jauh
lebih kecil daripada adsorpsi kimia (Bird 1985).
Adsorpsi fisik akan terus berlangsung sampai
gi, tetapi pada tekanan rendah dan suhu tinggi dapat berbalik menjadi desorpsi (Alberty & Silbey 1992). Sebaliknya, adsorpsi kimia hanya membentuk lapisan tunggal, dan prosesnya semakin cepat pada suhu tinggi (Bird 1995).
Mekanisme peristiwa adsorpsi dapat diterangkan se
ifusi melalui suatu lapisan batas ke permukaan luar adsorben, disebut difusi eksternal. Sebagian ada yang teradsorpsi di permukaan luar, tetapi sebagian besar berdifusi lebih lanjut ke dalam pori-pori adsorben (difusi internal). Bila kapasitas adsorpsi masih sangat besar, sebagian besar adsorbat akan teradsorpsi dan terikat di permukaan. Namun, bila permukaan sudah jenuh atau mendekati jenuh oleh adsorbat, dapat terjadi dua hal: (1) terbentuk lapisan adsorpsi kedua dan seterusnya di atas adsorbat yang telah terikat di permukaan; gejala ini disebut adsorpsi multilapisan, atau sebaliknya (2) tidak terbentuk lapisan kedua sehingga adsorbat yang belum teradsorpsi berdifusi keluar pori dan kembali ke arus fluida.
Proses adsorpsi pada karbon aktif terjadi melalui tiga tahap dasar. Pertama-tam
rap pada karbon aktif bagian luar, lalu bergerak menuju pori-pori karbon aktif, selanjutnya terjerap ke dinding bagian dalam dari karbon aktif (Gambar 3).
Gambar 3 Proses adsorpsi pada karbon aktif.
Faktor-faktor yang memengaruhi adsorpsi antara lain sifat fisik dan kimia adsorben (luas permukaan, ukuran pori, dan komposisi kimia), sifat fisik dan kimia adsorbat (ukuran, kepolaran, dan komposisi kimia molekul), konsentrasi adsorbat dalam fasa cair, karakteristik fase cair (pH dan suhu), dan kondisi operasional adsorpsi. Suatu zat dapat digunakan sebagai adsorben untuk tujuan pemisahan bila mempunyai daya adsorpsi selektif, berpori (mempunyai luas permukaan per satuan massa yang besar), dan mempunyai daya ikat yang kuat terhadap zat yang hendak dipisahkan secara fisik ataupun kimia. Pembesaran luas permukaan dapat dilakukan dengan pengecilan partikel adsorben (Ferry 2002). Akan tetapi, dalam berbagai pemakaian, ukuran partikel harus memenuhi syarat lainnya, seperti tidak boleh terbawa serta dalam aliran fluida, sehingga terdapat aturan pada ukuran partikel.
Isoterm Adsorpsi
Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan dalam permukaan adsorben, pada suhu tetap. Kesetimbangan terjadi saat laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya.
Ada dua jenis isoterm adsorpsi yang umum digunakan untuk menjelaskan adsorpsi cairan pada permukaan padatan, yaitu isoterm Freundlich dan Langmuir (Bird 1995).
Isoterm Freundlich
Isoterm Freundlich merupakan persamaan yang biasa digunakan untuk menjelaskan proses adsorpsi cairan pada permukaan zat padat. Isoterm ini merupakan persamaan empiris dengan bentuk sebagai berikut:
n 1
C k
Apabila kedua ruas pada persamaan (1) dilogaritmakan akan diperoleh
C n k Q log 1log
log = + ...(2)
Q adalah jumlah adsorbat teradsorpsi per
satuan bobot adsorben, C adalah konsentrasi
kesetimbangan adsorbat dalam larutan setelah
adsorpsi, sementara k dan n adalah tetapan
empiris (Bird 1985).
Isoterm Langmuir
Isoterm ini sering digunakan untuk menjelaskan adsorpsi zat terlarut dalam suatu larutan. Isoterm Langmuir biasanya digunakan untuk menggambarkan proses kimisorpsi satu-lapisan sehingga sistem yang menjalani tipe isoterm ini akan terus melakukan adsorpsi sampai terbentuk lapisan tunggal. Persamaan untuk isoterm Langmuir ialah
C k C k k Q 2 2 1 1+
= ... (3)
Persamaan Langmuir dapat diturunkan dengan memperkirakan kesetimbangan antara molekul yang diadsorpsi dan molekul yang masih bebas. Bentuk linear persamaan Langmuir adalah C k k k Q C 1 2 1 1 1 +
= ... (4)
Klorin
Klorin merupakan unsur halogen pertama yang berhasil diisolasi. Gas klorin pertama kali dibuat di laboratorium pada tahun 1774 oleh C. W. Scheele berdasarkan reaksi
4NaCl(aq) + 2H2SO4(aq) + MnSO2(s)
2Na2SO4(aq) + MnCl2(aq) + 2H2O(l) + Cl2 (g)
Gas klorin memiliki kereaktifan yang tinggi sehingga gas ini tidak pernah ditemukan dalam bentuk bebas di alam. Senyawa klorin yang banyak dijumpai ialah natrium klorida, yang lazim digunakan dalam kehidupan sehari-hari.
Klorin merupakan gas yang korosif dan beracun, berwarna kuning kehijauan dengan bau yang khas. Klorin merupakan salah satu bahan pengoksidasi dan membentuk senyawaan dengan logam dan nonlogam yang
bervalensi −1 dan +7 (Chang 1988).
Sumber klorin dapat berasal dari kaporit
(Ca(OCl)2), gas klorin (Cl2), klorin dioksida
(ClO2) dan natrium hipoklorit (NaOCl).
Klorinasi merupakan cara yang memuaskan untuk disinfeksi air dengan kontaminasi yang tidak terlalu berat (Tchobanoglous & Burton
1991). Penggunaan klorin untuk mematikan bakteri yang terdapat di dalam air dirintis oleh John L. Leal dengan menggunakan kaporit untuk mendisinfeksi air ledeng.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan antara lain
adalah karbon aktif, kaporit (Ca(OCl)2),
Na2S2O3, HCl, KI, KIO3, ZnCl2, larutan
amilum 1%, air deionisasi, dan akuades. Alat-alat yang digunakan antara lain adalah tanur
listrik, oven, eksikator, homogenizer, shaker,
neraca analitik, cawan porselen, perangkat titrasi, dan alat-alat kaca.
Metode Penelitian
Pengaktifan kembali karbon aktif
dilakukan dengan menggunakan ZnCl2 5%
(b/v). Selanjutnya dilakukan analisis karbon aktif yang meliputi kadar air, kadar abu, kadar zat mudah menguap, dan kadar karbon terikat. Setelah dianalisis, kemampuan karbon aktif dikaji dengan menentukan kapasitas dan efisiensi adsorpsinya terhadap residu klorin. Mekanisme penjerapannya juga dikaji dengan menggunakan isoterm adsorpsi Freundlich dan Langmuir (Lampiran 1). Pengolahan data isoterm dilakukan dengan menggunakan Data Fit versi 8.1.69.
Pencucian Karbon dengan Air Deionisasi
Sebanyak 100 g karbon aktif berukuran 100 mesh dimasukkan ke dalam gelas piala 1 L, dan ditambah air deionisasi sebanyak 660 mL. Campuran dikocok selama 20 menit kemudian didekantasi. Pencucian diulangi sebanyak dua kali, selanjutnya dikeringkan dalam oven pada suhu 50 °C selama 24 jam (Marshall 1999). Karbon aktif yang dihasilkan selanjutnya disebut karbon aktif dengan pencucian menggunakan air deionisasi (DWAC).
Pengaktifan Karbon dengan ZnCl2
Sebanyak 10 g karbon aktif berukuran
100 mesh direndam di dalam larutan ZnCl2
5% (b/v) selama 48 jam. Setelah didekantasi,
karbon aktif dipanaskan pada suhu 700 oC
dikeringkan dalam oven pada suhu 105 oC selama 24 jam (Rahman 2003). Sampel yang dihasilkan selanjutnya disebut karbon aktif
dengan modifikasi ZnCl2 (ZCAC).
Analisis Kadar Air
Sebanyak 1 g karbon aktif ditempatkan dalam cawan petri yang telah diketahui bobot keringnya. Cawan yang berisi sampel dikeringkan dalam oven pada suhu 105 °C selama beberapa jam sampai bobotnya konstan dan didinginkan di dalam eksikator lalu ditimbang. Pengeringan dan penimbangan diulangi setiap 1 jam sampai diperoleh bobot konstan (ASTM 1999b). Analisis dilakukan triplo. Perhitungan kadar air menggunakan persamaan:
Kadar air (%) = x10000
a b a−
dengan
a = bobot sampel sebelum pemanasan (g)
b = bobot sampel sesudah pemanasan (g)
Analisis Kadar Abu
Sebanyak 1 g karbon aktif ditempatkan dalam cawan porselen yang telah dikeringkan dalam oven dan diketahui bobot keringnya. Cawan yang berisi sampel dipanaskan dahulu di atas bunsen sampai tak berasap kemudian dipanaskan dalam oven pada suhu 750 °C selama beberapa jam. Setelah itu, didinginkan di dalam eksikator dan ditimbang. Pengeringan dan penimbangan diulangi setiap 1 jam sampai diperoleh bobot konstan (ASTM 1999a). Analisis dilakukan triplo. Perhitungan kadar abu menggunakan persamaan:
Kadar abu (%) = x10000
a b
dengan
a = bobot awal sampel (g)
b = bobot sisa sampel (g)
Analisis Kadar Zat Mudah Menguap
Sebanyak 1 g sampel dimasukkan ke dalam cawan porselen yang telah diketahui bobot keringnya. Selanjutnya sampel dipanaskan dalam tanur 950 °C selama 10 menit, kemudian didinginkan dalam eksikator dan ditimbang. Cawan ditutup serapat mungkin (ASTM 1999d). Analisis dilakukan triplo. Perhitungan kadar zat mudah menguap menggunakan persamaan:
Kadar zat mudah menguap (%)
= x10000
a b a−
dengan
a = bobot sampel sebelum pemanasan (g)
b = bobot sampel sesudah pemanasan (g)
Analisis Kadar Karbon Terikat
Karbon dalam arang adalah zat yang terdapat pada fraksi padat hasil pirolisis, selain abu (zat anorganik) dan zat-zat atsiri yang masih terdapat pada pori-pori arang. Definisi ini hanya berupa pendekatan (SNI 1995). Perhitungan kadar karbon terikat menggunakan persamaan:
Kadar karbon terikat (%) = 100% - (b + c)
dengan
b = kadar zat mudah menguap (%)
c = kadar abu (%)
Standardisasi Na2S2O3 oleh KIO3
Sebanyak 10 mL larutan KIO3 0.2015.10
-4
N, ditambah 10 mL KI 0.2015.10-4 N dan 2.5
mL HCl 0.0001 N lalu segera dititrasi dengan
Na2S2O3 0.2015.10-4 N sampai warnanya
menjadi kuning muda sekali. Setelah itu, diberi 1 mL larutan amilum 1% dan titrasi dilanjutkan sampai warna biru tua mendadak lenyap. Standardisasi dilakukan triplo (Harjadi 1986).
Penentuan Waktu Optimum Adsorpsi
Karbon aktif hasil pencucian dengan air deionisasi (DWAC) dan hasil modifikasi
dengan ZnCl2 (ZCAC) masing-masing
sebanyak 1 gram dimasukkan ke dalam 50 mL larutan kaporit dengan konsentrasi 2.0 ppm. Adsorpsi dilakukan dengan variasi waktu 15, 30, 45, 60, 75, 90, 120, dan 150 menit. Selanjutnya campuran disaring dan diambil 10 ml filtrat. Kedalamnya ditambahkan 10 mL KI
0.2015.10-4 N, dan 2.5 mL HCl 0.0001 N, lalu
segera dititrasi dengan Na2S2O3 0.2015.10-4 N
Adsorpsi Residu Klorin oleh Karbon Aktif
Masing-masing sebanyak 1 g ZCAC dan DWAC dimasukkan ke dalam 50 mL larutan kaporit pada beberapa konsentrasi: 0.5, 1.0, 1.5, 2.0, 2.5, dan 3.0 ppm. Campuran dikocok dengan pengaduk magnet pada suhu kamar selama 30 menit untuk ZCAC dan 60 menit untuk DWAC, kemudian disaring. Diambil 10 ml filtrat lalu ditambahkan 10 mL KI
0.2015.10-4 N, 2.5 mL HCl 0.0001 N, dan
segera dititrasi dengan Na2S2O3 0.2015.10-4 N
sampai warnanya menjadi kuning muda sekali. Setelah itu, diberi 1 mL larutan amilum dan titrasi dilanjutkan sampai warna biru tua mendadak lenyap. Adsorpsi juga dilakukan pada sampel air minum PDAM Tirta Pakuan dan air minum Kampus IPB Darmaga. Tetapan adsorpsi dihitung dengan model isoterm Freundlich dan Langmuir menggunakan Data Fit versi 8.1.69. Kapasitas adsorpsi dihitung dengan rumus:
m ) C (C V
Q= o− a
sedangkan efisiensi adsorpsi dihitung dengan rumus:
Efisiensi = x100%
o a o C C C −
Q = kapasitas adsorpsi per bobot karbon aktif
(μg/g karbon aktif)
V = volume larutan (mL)
Co = konsentrasi awal larutan (ppm)
Ca = konsentrasi akhir larutan (ppm)
m = massa karbon aktif (g)
HASIL DAN PEMBAHASAN
Modifikasi Karbon Aktif
Karbon aktif yang dipakai dalam penelitian ini ada dua jenis, yaitu karbon aktif
termodifikasi ZnCl2 (ZCAC) dan karbon aktif
hasil pencucian dengan air deionisasi tanpa
modifikasi dengan ZnCl2 (DWAC). Karbon
aktif berasal dari tempurung kelapa yang telah diarangkan. Sebelumnya, karbon aktif dicuci terlebih dahulu dengan menggunakan air deionisasi agar pengotor-pengotor yang ada pada permukaan karbon aktif hilang. Setelah itu, dilakukan pemanasan pada suhu 105 °C untuk menguapkan bahan-bahan yang bersifat atsiri sehingga membuka pori-pori karbon aktif. Selanjutnya dilakukan modifikasi
karbon aktif dengan ZnCl2. Modifikasi ini
bertujuan meningkatkan kapasitas dan efisiensi adsorpsi dari karbon aktif dengan membuka pori-pori karbon yang masih tertutup dan menambah jumlah tapak aktif pada permukaan karbon aktif. Unsur-unsur
mineral ZnCl2 masuk di antara pelat-pelat
heksagonal dari karbon dan memisahkan permukaan yang mula-mula tertutup sehingga jumlah luas permukaan yang aktif bertambah. Setelah itu, karbon aktif dicuci dengan HCl yang bertujuan untuk menghilangkan sisa-sisa
ZnCl2 yang dapat menutupi pori-pori karbon
aktif dan juga mengubah karakter muatan dari permukaan karbon aktif. Selanjutnya dilakukan pencucian dengan menggunakan air deionisasi kembali untuk menghilangkan sisa kelebihan asam.
Analisis Proksimat (Kadar Air, Kadar Abu, Kadar Zat Mudah Menguap, Kadar
Karbon Terikat)
Rerata kadar air yang diperoleh dengan metode gravimetri sebesar 4.99% (Lampiran 2). Nilai yang diperoleh ini memenuhi standar SNI (1995) (Tabel 1).
Tabel 1 Standar mutu karbon aktif menurut
SNI 06-3730-1995
Parameter mutu (%)
Standar mutu serbuk
Kadar air ≤ 15
Kadar zat mudah menguap ≤ 25
Kadar abu ≤ 10
Kadar karbon terikat ≥ 65
Kadar air yang tinggi akan menurunkan mutu karbon aktif karena air yang teradsorpsi pada pori-pori karbon aktif akan menurunkan kapasitas dan daya adsorpsi terhadap cairan maupun gas.
Nilai kadar abu karbon aktif, yaitu 4.90% (Lampiran 3), memenuhi standar SNI (1995). Kadar abu yang tinggi akan mengurangi daya adsorpsi karbon aktif terhadap cairan atau gas karena oksida dari mineral yang terkandung di dalam karbon aktif seperti Na, K, Mg, dan Ca akan menutupi pori-pori arang.
daya jerap karbon aktif tersebut karena senyawa-senyawa atsiri akan teradsorpsi pada pori-pori karbon.
Karbon terikat diasumsikan sebagai semua zat, selain abu (zat anorganik) dan senyawa atsiri yang masih teradsorpsi dalam pori-pori, yang terdapat dalam fraksi padat hasil aktivasi karbon aktif. Jadi, kadar karbon
terikat ialah [100% − (kadar zat mudah
menguap + kadar abu)], dan nilai standarnya ialah minimal 65% (SNI 1995) untuk karbon aktif berupa serbuk. Nilai karbon terikat yang dihasilkan sebesar 75.71% (Lampiran 5). Nilai tersebut memenuhi standar SNI. Jadi, berdasarkan parameter mutu, karbon aktif yang dipakai memenuhi standar SNI (1995).
Titrasi Residu Klorin oleh Na2S2O3
Konsentrasi larutan Na2S2O3 dibuat
0.2015.10-4 N atau setara 5.0 ppm, tetapi
konsentrasi yang terukur berdasarkan
standardisasi sebesar 0.1988.10-4 N atau setara
dengan 4.9340 ppm (Lampiran 6). Reaksi yang terjadi pada titrasi larutan kaporit oleh
Na2S2O3 yaitu,
OCl- + 2I- + 2H+ Cl-+ I2 + H2O
2S2O32- + I2 S4O62- + 2I
-Waktu Adsorpsi
Karbon aktif dari tempurung kelapa hasil pencucian dengan air deionisasi (DWAC) dan
hasil modifikasi dengan ZnCl2 (ZCAC)
digunakan untuk menjerap senyawa residu klorin dari air. Konsentrasi larutan kaporit yang dipakai sebesar 2.0 ppm karena kaporit dengan dosis ini berpotensi sebagai disinfektan dan dianggap menghasilkan residu klorin melebihi kisaran syarat mutu air bersih dari Permenkes (0.1–1.2 ppm). Lamanya proses adsorpsi ditentukan berdasarkan kapasitas adsorpsinya selama rentang waktu
15−150 menit. Lamanya proses adsorpsi
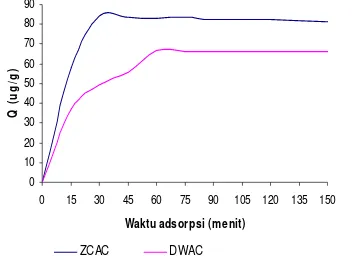
untuk mencapai kapasitas adsorpsi maksimum ditetapkan sebagai waktu optimum adsorpsi (Gambar 4). Data selengkapnya diberikan pada Lampiran 7 dan 8.
Adsorpsi maksimum residu klorin terjadi pada rentang waktu 15–60 menit, selanjutnya stabil pada nilai maksimum atau cenderung menurun sampai menit ke-150. Waktu adsorpsi residu klorin dengan karbon aktif ZCAC relatif lebih cepat dibanding dengan karbon aktif DWAC. Adsorpsi dengan ZCAC hanya memerlukan waktu 30 menit untuk mencapai kapasitas maksimumnya yaitu
sebesar 83.9566 μg/g sedangkan adsorpsi
dengan DWAC optimum pada menit ke-60 dengan kapasitas adsorpsi maksimumnya
sebesar 66.6683 μg/g (Gambar 4).
Setelah waktu optimum adsorpsi,
kapasitas adsorpsi (Q) cenderung tetap dan
bahkan sedikit menurun. Hal ini disebabkan oleh menjadi jenuhnya tapak aktif adsorben. Pori-pori telah terisi penuh oleh adsorbat sehingga dapat terjadi desorpsi.
0 10 20 30 40 50 60 70 80 90
0 15 30 45 60 75 90 105 120 135 150
Waktu adsorpsi (menit)
Q
(
ug/
g)
ZCAC DWAC
Gambar 4 Waktu adsorpsi residu klorin.
Penjerapan yang lebih cepat pada ZCAC berkaitan dengan konsep pembukaan pori-pori dan pertambahan tapak aktif permukaan karbon aktif dan juga adanya perubahan karakter muatan permukaan karbon aktif
akibat modifikasi oleh ZnCl2 dan pencucian
dengan HCl. Makin terbukanya pori-pori dan bertambahnya jumlah tapak aktif yang dimiliki suatu adsorben sudah tentu akan meningkatkan kecepatan adsorpsi.
Adsorpsi Residu Klorin
Kapasitas adsorpsi terhadap residu klorin dilakukan berdasarkan waktu optimum yang telah diperoleh. Residu klorin dalam larutan kaporit dijerap dengan adsorben karbon aktif ZCAC selama 30 menit, sedangkan adsorpsi dengan karbon aktif DWAC berlangsung selama 60 menit. Setelah diperoleh waktu optimum, konsentrasi residu klorin sebelum dan setelah adsorpsi diukur untuk menentukan kapasitas dan efisiensi adsorpsinya (Lampiran 9 dan 10).
Karbon aktif ZCAC memiliki kapasitas dan efisiensi adsorpsi yang lebih tinggi daripada karbon aktif DWAC. Modifikasi
dengan ZnCl2 (ZCAC) terbukti mampu
oleh ZnCl2 akan meningkatkan penjerapan
adsorbat sehingga kapasitas adsorpsinya menjadi lebih tinggi.
0.0000 20.0000 40.0000 60.0000 80.0000 100.0000 120.0000 140.0000
0 0.5 1 1.5 2 2.5 3 3.5
Konsentrasi aw al (ppm)
Q
(
ug/
g)
ZCAC DWAC
Gambar 5 Kapasitas adsorpsi ZCAC dan DWAC terhadap residu klorin yang ditetapkan pada waktu optimum.
0 10 20 30 40 50 60 70 80 90
0 0.5 1 1.5 2 2.5 3 3.5
Konsentrasi aw al (ppm )
E fisien s i ad so rp si (% ) ZCAC DWAC
Gambar 6 Efisiensi adsorpsi ZCAC dan DWAC terhadap residu klorin yang ditetapkan pada waktu optimum.
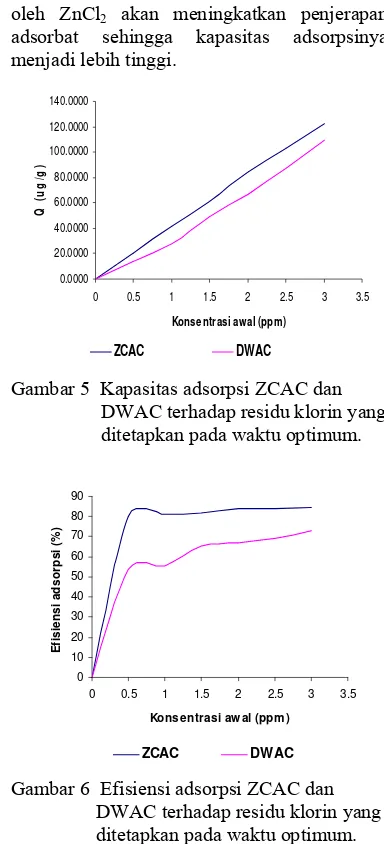
Dari Gambar 5 dan 6, dapat dilihat pula pengaruh konsentrasi awal residu klorin terhadap kapasitas dan efisiensi adsorpsi karbon aktif. Kapasitas adsorpsi residu klorin oleh ZCAC meningkat dari 20.0450 hingga
126.4512 μg/g sementara efisiensinya
meningkat dari 80.22% ke 84.38%. Demikian pula kapasitas adsorpsi residu klorin oleh DWAC meningkat juga, yaitu dari 13.6459
hingga 109.2185 μg/g sejalan dengan
meningkatnya efisiensi dari 54.60% sampai 72.86%, dengan variasi konsentrasi awal 0.5 hingga 3.0 ppm.
Kapasitas dan efisiensi adsorpsi meningkat seiring dengan kenaikan konsentrasi awal residu klorin. Semakin besar konsentrasi, semakin banyak jumlah molekul dalam larutan, sehingga interaksi antara molekul adsorbat dan adsorben akan meningkat. Interaksi yang semakin besar ini
akan meningkatkan adsorpsi di antara mereka. Jadi, peningkatan kapasitas adsorpsi disebabkan adanya penambahan ion residu klorin yang terikat pada tapak aktif permukaan karbon aktif.
Setelah diujikan pada kaporit, kemampuan adsorpsi ZCAC dan DWAC diujikan pada air minum PDAM Tirta Pakuan dan air minum di Kampus IPB Darmaga. Konsentrasi awal residu klorin di dalam air minum PDAM Tirta Pakuan sebesar 0.5427 ppm sedangkan untuk air minum di Kampus IPB Darmaga mencapai 1.0559 ppm (Lampiran 11 dan 12). Konsentrasi awal residu klorin pada kedua jenis air minum tersebut memenuhi syarat standar mutu air bersih Permenkes, yaitu
sebesar 0.1−1.2 ppm. Kapasitas dan efisiensi
adsorpsi kedua karbon aktif terhadap residu klorin dalam kedua sampel air minum disajikan pada Tabel 2.
Tabel 2 Kapasitas dan efisiensi adsorpsi karbon aktif (ZCAC dan DWAC) terhadap residu klorin pada air minum
Sampel Air
Adsorben Q
(μg/g)
Efisiensi (%)
PDAM ZCAC 22.1833 81.78
Tirta Pakuan
DWAC 14.7956 54.54
Kampus ZCAC 45.3859 85.98 IPB
Darmaga
DWAC 29.3541 55.61
Dari Tabel 2, terlihat bahwa ZCAC memiliki kapasitas dan efisiensi adsorpsi yang lebih tinggi pada kedua sampel air. Sebagaimana dijelaskan sebelumnya, hal ini terjadi karena ZCAC memiliki tapak aktif lebih banyak dibandingkan dengan DWAC. Nilai kapasitas dan efisiensi adsorpsi karbon aktif terhadap residu klorin dalam sampel air minum tidak jauh berbeda dengan kapasitas dan efisiensi adsorpsinya terhadap residu klorin dalam larutan kaporit. Hal ini membuktikan bahwa ZCAC dan DWAC selektif untuk menjerap ion residu klorin.
Isoterm Adsorpsi
Adsorpsi residu klorin oleh ZCAC memberikan linearitas yang tinggi untuk kedua tipe isoterm: 98.79% untuk isoterm Langmuir (Gambar 7) dan 98.94% untuk isoterm Freundlich (Gambar 8). Adsorpsi residu klorin oleh ZCAC dianggap mengikuti tipe isoterm Freundlich, karena linearitas untuk tipe isoterm ini sedikit lebih besar (Atkins 1999).
Gambar 7 Isoterm adsorpsi Langmuir residu klorin oleh ZCAC.
Gambar 8 Isoterm adsorpsi Freundlich residu klorin oleh ZCAC.
Dari Gambar 7 dapat dilihat bahwa dengan bertambahnya konsentrasi residu klorin, nilai kapasitas adsorpsi semakin meningkat. Konsentrasi yang tinggi tampaknya meningkatkan jumlah klorin dalam larutan sehingga klorin yang teradsorpsi juga semakin besar. Dari persamaan (3) dihasilkan
nilai k1 dan k2 berturut-turut sebesar 723.1789
dan 0.3683. Tetapan k1 dapat digunakan untuk
menentukan entalpi adsorpsi sedangkan k2
menggambarkan mutu adsorpsi yang berhubungan dengan kekuatan adsorben dalam mengikat adsorbat.
Dengan menggunakan isoterm Freundlich (Gambar 8), juga dapat dilihat bahwa semakin besar konsentrasi klorin, jumlah yang
diadsorpsi akan semakin banyak. Tetapan k
dan n yang diperoleh dari persamaan (1)
berturut-turut adalah 211.2816 dan 1.1036.
Tetapan k digunakan untuk menentukan
nilai kapasitas adsorpsi sedangkan n
merupakan gaya yang dikeluarkan oleh permukaan karbon aktif saat menjerap residu klorin.
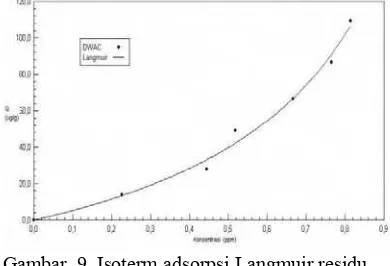
Gambar 9 dan 10 berturut-turut merupakan model isoterm adsorpsi Langmuir dan Freundlich residu klorin dalam larutan kaporit yang terjerap pada DWAC. Linearitas kedua isoterm juga tinggi, yaitu 98.44% untuk isoterm Langmuir (Gambar 9), dan 98.93% untuk isoterm Freundlich (Gambar 10). Dari linearitas yang sedikit lebih tinggi, adsorpsi residu klorin oleh DWAC juga dianggap mengikuti tipe isoterm Freundlich.
Gambar 9 Isoterm adsorpsi Langmuir residu klorin oleh DWAC.
Gambar 10 Isoterm adsorpsi Freundlich residu klorin oleh DWAC.
Tetapan yang diperoleh pada persamaan
isoterm Langmuir adalah k1 = 63.4891 dan k2
= − 0.7700. Sementara tetapan yang diperoleh
pada persamaan isoterm Freundlich adalah k =
154.0941 dan n = 0.5183. Perbandingan nilai
k1 dan k2 isoterm Langmuir pada kedua karbon
aktif dapat dilihat pada Tabel 3.
Tabel 3 Nilai k1 dan k2 pada isoterm Langmuir
Karbon Aktif k1 k2
ZCAC 723.1789 0.3683
DWAC 63.4891 −0.7700
Dari Tabel 3, dapat dilihat bahwa nilai k1
dan k2 pada isoterm Langmuir yang dihasilkan
ini menunjukkan bahwa entalpi adsorpsi (k1)
yang digunakan oleh permukaan karbon aktif ZCAC untuk mengikat residu klorin lebih besar. Hal ini sejalan dengan pembahasan terdahulu bahwa jumlah tapak aktif ZCAC lebih banyak daripada DWAC sehingga interaksi adsorbat dengan permukaan adsorben lebih banyak. Semakin meningkat interaksi antara adsorbat dengan adsorben, semakin besar pula entalpi adsorpsi pada permukaan adsorben.
Nilai k2 yang besar pada ZCAC
menunjukkan bahwa mutu adsorpsinya juga jauh lebih baik daripada DWAC. Mutu adsorpsi yang semakin baik berarti semakin meningkat pula kekuatan adsorben dalam mengikat adsorbat. Hal ini juga disebabkan oleh bertambahnya jumlah tapak aktif akibat
modifikasi ZnCl2. Tetapan k2 pada karbon
aktif DWAC bernilai negatif. Hal ini menggambarkan terjadinya desorpsi oleh permukaan DWAC akibat pori-pori permukaan karbon yang terisi penuh oleh adsorbat.
Akhirnya, perbandingan nilai k dan n
isoterm Freundlich pada kedua karbon aktif diberikan pada Tabel 4.
Tabel 4 Nilai k dan n pada isoterm Freundlich
Karbon Aktif k n
ZCAC 211.2816 1.1036
DWAC 154.0941 0.5183
Dari Tabel 4, dapat dilihat bahwa kapasitas
adsorpsi (k) dan gaya tarik adsorben dalam
menjerap residu klorin (n) pada ZCAC lebih
besar daripada DWAC. Hal ini terjadi karena
pengaruh modifikasi ZnCl2 yang dapat
meningkatkan jumlah tapak aktif pada permukaan karbon.
Adsorpsi berlangsung secara kimisorpsi monolayer jika tipe isoterm yang dianut adalah isoterm Langmuir. Jika isoterm yang dianut adalah isoterm Freundlich maka adsorpsi
terjadi secara fisisorpsi multilayer.
Berdasarkan tingginya nilai linearitas yang diperoleh, pola isoterm pada kedua bentuk karbon aktif dalam menjerap residu klorin dapat dikatakan mengikuti pola isoterm Freundlich. Hal ini berarti mekanisme fisisorpsi lebih dominan dibandingkan dengan kimisorpsi dan tapak aktif pada permukaan karbon aktif adalah heterogen, adsorpsi dapat
terjadi secara multilayer. Mekanisme fisisorpsi
memungkinkan terjadinya interaksi tarik-menarik antar residu klorin yang terdapat dalam larutan kaporit, selain ikatannya dengan
karbon aktif. Kedua ikatan tersebut lemah karena hanya terikat oleh gaya van der Waals.
SIMPULAN DAN SARAN
Simpulan
Karbon aktif termodifikasi ZnCl2
dapat digunakan untuk menjerap residu klorin dalam air. Parameter yang mempengaruhi adsorpsi adalah jenis pengaktifan karbon aktif, konsentrasi larutan, dan waktu adsorpsi. Waktu optimum adsorpsi untuk karbon aktif ZCAC selama 30 menit dengan kapasitas
adsorpsi 83.9566 μg/g dan efisiensi 83.97%
pada larutan kaporit 2.0 ppm. Sedangkan waktu optimum adsorpsi untuk karbon aktif DWAC selama 60 menit dengan kapasitas
adsorpsi 66.6683 μg/g dan efisiensi 66.70%
pada larutan kaporit 2.0 ppm. Adsorpsi terhadap residu klorin oleh karbon aktif ZCAC dan DWAC berlangsung secara fisisorpsi, dengan linearitas di atas 95% untuk isoterm Freundlich.
Saran
Berdasarkan hasil penelitian ini, maka tahapan selanjutnya yang perlu dilakukan adalah mengkarakterisasi lebih lanjut karbon aktif, seperti menentukan jumlah dan ukuran pori, kapasitas desorpsi setiap karbon aktif.
Modifikasi konsentrasi larutan ZnCl2 dan
pengukuran pH larutan kaporit juga perlu dilakukan untuk meningkatkan kapasitas adsorpsi karbon aktif.
DAFTAR PUSTAKA
Alberty RA, Silbey RJ. 1992. Physical
Chemistry. Ed ke-1. New York: J Wiley.
Akademi Teknik Tirta Wiyata. 2003. Materi
Training: Kualitas Air. Magelang:
Akademi Teknik Tirta Wiyata.
[ASTM] American Society for Testing and Material. 1999a. ASTM D 2866-94: Standard Test Method for Total Ash
Content of Activated Carbon.
Philadelphia: American Society for Testing and Material
Standard Test Method for Moisture of
Activated Carbon. Philadelphia:
American Society for Testing and Material.
[ASTM] American Society for Testing and Material. 1999d. ASTM D 5832-98: Standard Test Method for Volatile Matter
Content of Activated Carbon.
Philadelphia: American Society for Testing and Material
Atkins PW. 1999. Kimia Fisika Jilid 2. Ed
ke-4. Jakarta: Erlangga.
Baker FS, Miller CE, Repik AJ, Tollens ED.
1997. Activated Carbon. New York: J
Wiley.
Bird T. 1985. Kimia Fisik untuk Universitas.
Jakarta: Gramedia Pustaka Utama.
Chang R, Wayne T. 1988. The Top Industrial
Chemicals. New York: Random House.
Fernandes EC, Delgado TS. 1994. Charcoal and activated carbon from coconut husks. J Philipp Technol 19:59-65.
Ferry J. 2002. Pembuatan arang aktif dari serbuk gergajian kayu campuran sebagai adsorben pada pemurnian minyak goreng bekas [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Harjadi W. 1986. Ilmu Kimia Analitik Dasar.
Jakarta: Gramedia.
Jaguaribe EF, Medeiros LL, Barreto MCS, Araujo LP. 2005. The Performance of activated carbons from sugarcane bagasse, babassu, and coconut shells in
removing residual chlorine. Brazillian J
of Chem Eng 22:41-47.
http://www.abeq.org.br/bjche/vol22.html
[28 November 2005].
Jankowska H, Andrzes S, Jerzy C. 1991. Active Carbon. Ed ke-1. New York: Ellis Horwood.
Lynch CT. 1990. Practical Handbook of
Material Science. Ed ke-2. New York: CRC Press.
Marshall WE, Wartelle LH, Boler DE. 1999. Enhanced metal adsorption by soybean
hulls modified with citric acid. J Biores
Technol 69:263-268.
Prawirakusuma S, Utomo C. 1970.
Pembuatan Karbon Aktif. Bandung:
Lembaga Kimia Nasional, Lembaga Ilmu Pengetahuan Indonesia.
Rahman IA, Saad B. 2003. Utilization of guava seeds as a source of activated carbon for removal of methylene Blue
from aqueous solution. Malay J Chem
5:008-114.
Roy GM. 1985. Activated Carbon
Applications in the Food and Pharmaceutical Industries. Lancaster: Tachnomic.
Setyaningsih H. 1995. Pengolahan limbah batik dengan proses kimia dan adsorpsi karbon aktif [tesis]. Jakarta: Program Pascasarjana, Universitas Indonesia.
Smith H. 1992. Pengaruh ukuran partikel arang dan nilai banding larutan aktivator terhadap sifat arang aktif tempurung kelapa. BIAM Tahun IX No. 22
[SNI] Standar Nasional Indonesia. 1995. SNI
06-3730-1995: Arang Aktif Teknis.
Jakarta: Dewan Standardisasi Nasional
Sriwahyuni W. 2002. Efektivitas adsorben dan koagulan-flokulan pada penjernihan air wilayah Marunda [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Tchobanoglous G, Burton FL. 1991. Waste
Water Engineering. New York: McGraw-Hill.
Yang RT. 2003. Adsorbents: Fundamentals
Lampiran 1 Bagan alir penelitian
Keterangan :
DWAC : Karbon aktif pencucian air deionisasi (tanpa modifikasi ZnCl2) (Deionized Water Activated Carbon)
ZCAC : Karbon aktif termodifikasi ZnCl2 (Zinc Chloride Activated
Carbon)
Pencucian dengan air deionisasi
(tanpa modifikasi ZnCl2)
(DWAC)
Modifikasi dengan ZnCl2
(ZCAC)
Karbon aktif
Pencucian dengan air deionisasi
Standardisasi Na2S2O3 oleh KIO3
Penentuan waktu optimum adsorpsi
Adsorpsi senyawa residu klor
Isoterm adsorpsi
Analisis proksimat (Kadar
air,Kadar Abu, Kadar Zat
Lampiran 2 Kadar air karbon aktif
Ulangan Bobot sampel (g) Kadar air
Bobot basah Bobot kering (%)
1 1.0003 0.9508 4.95
2 1.0004 0.9503 5.01
3 1.0006 0.9504 5.02
rataan 4.99
Lampiran 3 Kadar abu karbon aktif
Ulangan Bobot sampel (g) Kadar abu
Bobot awal Bobot sisa (%)
1 0.9997 0.0470 4.70 2 1.0013 0.0511 5.10 3 0.9995 0.0490 4.90
rataan 4.90
Lampiran 4 Kadar zat mudah menguap pada karbon aktif
Ulangan Bobot sampel (g) Kadar zat mudah
Bobot awal Bobot akhir menguap (%)
1 1.0007 0.8042 19.64
2 1.0017 0.8122 18.92
3 1.0004 0.8041 19.62
rataan 19.39
Lampiran 5 Kadar karbon terikat pada karbon aktif
Kadar zat mudah menguap (%) Kadar karbon terikat (%)
1 19.39 75.71
Lampiran 6 Standardisasi Na
2S
2O
30.2015.10
-4N oleh KIO
30.2015.10
-4N
Ulangan Meniskus Na2S2O3 (ml) Volume [Na2S2O3]
Awal Akhir Na2S2O3 (ml) x 10-4 (N)
1 0.00 10.10 10.10 0.1995
2 10.10 20.25 10.15 0.1985
3 20.30 30.45 10.15 0.1985
Cara konversi normalitas (N) ke ppm :
ppm
4.9340
ml
1000
L
1
x
ml
500
mg
2.4670
L
mg
ppm
mg
2.4670
g
2.4670.10
m
ml
500
ml
1000
x
g/ekivalen
248.17
m
0.1988.10
larutan
volume
ml
1000
x
BE
m
normalitas
3 4
=
=
=
=
=
=
=
− −
Lampiran 7 Kapasitas adsorpsi (Q) dan efisiensi karbon aktif termodifikasi
ZnCl
2(ZCAC) pada penentuan waktu optimum adsorpsi residu klor
Waktu Bobot Konsentrasi Volume Konsentrasi Q Efisiensi
adsorpsi adsorben (g) awal (ppm) titran (ml) akhir (ppm) (μg/g) (%)
0 1.0001 2.0000 4.05 2.0000 0.0000 0.00
15 1.0000 2.0000 1.70 0.8388 58.0600 58.06
30 1.0001 2.0000 0.65 0.3207 83.9566 83.97
45 1.0001 2.0000 0.67 0.3306 83.4616 83.46
60 1.0001 2.0000 0.67 0.3306 83.4616 83.46
75 1.0001 2.0000 0.68 0.3355 83.2167 83.22
90 1.0002 2.0000 0.70 0.3454 82.7135 82.71
120 1.0002 2.0000 0.72 0.3552 82.2236 82.22 150 1.0002 2.0000 0.75 0.3701 81.4787 81.48
Lampiran 8 Kapasitas adsorpsi (Q) dan efisiensi karbon aktif pencucian air
deionisasi (DWAC) pada penentuan waktu optimum adsorpsi residu
klor
Waktu Bobot Konsentrasi Volume Konsentrasi Q Efisiensi
adsorpsi adsorben (g) awal (ppm) titran (ml) akhir (ppm) (μg/g) (%)
0 1.0007 2.0000 4.05 2.0000 0.0000 0.00
15 1.0007 2.0000 2.55 1.2582 37.0641 37.09
30 1.0005 2.0000 2.05 1.0115 49.4003 49.43
45 1.0004 2.0000 1.80 0.8881 55.5728 55.60
60 1.0001 2.0000 1.35 0.6661 66.6683 66.70
75 1.0006 2.0000 1.37 0.6760 66.1603 66.20
90 1.0006 2.0000 1.37 0.6760 66.1603 66.20
Lampiran 9 Kapasitas adsorpsi (Q) dan efisiensi karbon aktif termodifikasi
ZnCl
2(ZCAC)
Bobot Konsentrasi Volume Konsentrasi Konsentrasi Q Efisiensi
adsorben (g) awal (ppm) titran (ml) akhir (ppm) terjerap (ppm) (μg/g) (%)
1.0005 0.5000 0.20 0.0989 0.4011 20.0450 80.22 1.0002 1.0000 0.38 0.1875 0.8125 40.6169 81.25 1.0000 1.5000 0.56 0.2763 1.2237 61.1850 81.58 1.0004 2.0000 0.65 0.3207 1.6793 83.9314 83.97 1.0006 2.5000 0.81 0.3996 2.1004 104.9570 84.02 1.0009 3.0000 0.95 0.4687 2.5313 126.4512 84.38
Lampiran 10 Kapasitas adsorpsi (Q) dan efisiensi karbon aktif hasil pencucian
dengan air deionisasi (DWAC)
Bobot Konsentrasi Volume Konsentrasi Konsentrasi Q Efisiensi
adsorben (g) awal (ppm) titran (ml) akhir (ppm) terjerap (ppm) (μg/g) (%)
1.0003 0.5000 0.46 0.2270 0.2230 13.6459 54.60 1.0001 1.0000 0.90 0.4441 0.5559 27.7922 55.59 1.0001 1.5000 1.05 0.5181 0.9819 49.0901 65.46 1.0002 2.0000 1.35 0.6661 1.3339 66.6817 66.70 1.0004 2.5000 1.55 0.7648 1.7352 86.7253 69.41 1.0007 3.0000 1.65 0.8141 2.1859 109.2185 72.86
Lampiran 11 Kapasitas adsorpsi (Q) dan efisiensi karbon aktif air minum
PDAM Tirta Pakuan
Adsorben Bobot [awal] Volume [akhir] [terjerap] Q Efisiensi
adsorben (g) (ppm) titran (ml) (ppm) (ppm) (μg/g) (%)
ZCAC 1.0003 0.5427 0.20 0.0989 0.4438 22.1833 81.78 DWAC 1.0003 0.5427 0.50 0.2467 0.2960 14.7956 54.54
Lampiran 12 Kapasitas adsorpsi (Q) dan efisiensi karbon aktif air minum
Kampus IPB Darmaga
Adsorben Bobot [awal] Volume [akhir] [terjerap] Q Efisiensi
adsorben (g) (ppm) titran (ml) (ppm) (ppm) (μg/g) (%)