RIZOBAKTERIA BACILLUS SP. ASAL TANAH RIZOSFER
KEDELAI YANG BERPOTENSI SEBAGAI PEMACU
PERTUMBUHAN TANAMAN
RINA PUJI ASTUTI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul Rizobakteria Bacillus sp. asal tanah rizosfer kedelai yang berpotensi sebagai pemacu pertumbuhan tanaman, adalah hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis.
Bogor, November 2007
Rina Puji Astuti
ABSTRACT
RINA PUJI ASTUTI. Rhizobacteria Bacillus sp. Belonging to Rhizosphere of Soybean that Potential for Plant Growth Promotion. This thesis is advised by ARIS TRI WAHYUDI and ANJA MERYANDINI.
Plant growth promoting rhizobacteria (PGPR) belonging to Bacillus sp. were isolated from the rhizosphere of soybean plant. The aims of this study were to isolate and caracterize Bacillus sp. from the rhizosphere of soybean plant that potential for promoting of plant growth. 118 isolates that were comfirmed as
Bacillus sp., 90 isolates among them positively produced indole acetic acid (IAA), that 3.58 ppm was the lower, 19.18 ppm was moderate and the highest concentration was 67.29 ppm. 12 isolates significantly induced elongation of primary root, numerous of lateral root and shoot growth. 76 isolates were able to solubilize phosphate and 77 isolates produced siderophore. Isolat Bacillus sp. Cr-55 produced antifungal compound that inhibited growth of Sclerotium rolsfii. There were 18 isolates of Bacillus sp., include Cr-55, that inhibited Fusarium oxysporum. There were 5 characters of PGPR observed of this study: IAA synthesis, phosphat solubelizing, siderophore production, biocontrol and promoting of soybean growth significantly. The result showed that 3 isolates of
Kedelai yang Berpotensi sebagai Pemacu Pertumbuhan Tanaman. Dibimbing oleh ARIS TRI WAHYUDI dan ANJA MERYANDINI.
Plant Growth Promoting Rhizobacteria (PGPR) merupakan bakteri tanah di sekitar perakaran. PGPR berpotensi meningkatkan produktivitas dan pertumbuhan tanaman. PGPR dapat memberi keuntungan bagi pertumbuhan tanaman dengan menggunakan kemampuannya dalam memproduksi hormon pertumbuhan, seperti asam indol asetat, asam giberelin, sitokinin dan etilen. Selain itu beberapa rizobakteria juga memiliki kemampuan dalam menambat N2,
menekan pertumbuhan mikroorganisme fitopatogen dengan cara memproduksi siderofor, β-1-3-glukanase, kitinase, antibiotik dan sianida serta kemampuannya dalam melarutkan fosfat. Kemampuan tersebut bermanfaat bagi tumbuhan untuk memenuhi kebutuhan ketersediaan fosfat, sedangkan siderofor yang diproduksi oleh rizobakteria dapat memacu pertumbuhan tanaman dengan cara mengikat besi (Fe3+) yang jumlahnya terbatas di daerah rizosfer untuk berkompetisi dengan mikrob fitopatogen.
Bacillus sp. dapat menghasilkan fitohormon yang digunakan tumbuhan untuk membantu pertumbuhan baik pemanjangan akar, perkecambahan biji maupun meningkatkan perkembangan tajuk dan pembungaan. Peran Bacillus sp. dalam memproduksi asam indol asetat telah diteliti, namun informasi tentang kesatuan karakter Bacillus sp. sebagai pemacu pertumbuhan tanaman belum banyak dilaporkan. Untuk mengatasi masalah tersebut maka pada penelitian ini akan difokuskan pada isolasi beserta karakterisasi Bacillus sp. baik produksi IAA dan karakter lain yang berkaitan dengan pemacuan pertumbuhan tanaman.
Penelitian ini dikerjakan dengan mengisolasi Bacillus sp. Sebanyak 0.5 gram sampel tanah rizosfer kedelai asal Cirebon dimasukkan ke dalam 4.5 ml akuades steril yang sudah terlarut NaCl 0.85 % di dalamnya. Sampel divortek dan dipanaskan 80 oC selama 10 menit, untuk menyeleksi Bacillus sp. dari mikroorganisme lain yang tidak membentuk endospora. Sampel selanjutnya diencerkan berseri hingga pengenceran 10-6. Sebanyak 100 µl dari suspensi pengenceran disebar di atas media cawan nutrien agar-agar dengan komposisi (8 gr Nutrient Broth (NB), 20% bacto agar dalam 1 liter akuades) menggunakan batang penyebar. Cawan selanjutnya diinkubasi selama 24 jam. Koloni yang tumbuh kemudian dimurnikan dengan menggunakan media yang sama. Pewarnaan Gram, pewarnaan endospora dan uji katalase dilakukan mengikuti
Bergey’s Manual of Determinative Bacteriology untuk menentukan isolat tersebut termasuk ke dalam kelompok Bacillus sp.
Produksi IAA dilakukan dengan menggunakan metode standar yaitu dengan mengkulturkan terlebih dahulu 1 lup penuh isolat Bacillus sp. pada media NB dengan penambahan L-Trp dan diinkubasi selama 48 jam. Tiap 1 jam dilakukan pengukuran kadar IAAnya. Pengukuran IAA ini digunakan untuk mengetahui waktu produksi IAA yang paling maksimal.
IAA yang diproduksi oleh Bacillus diukur dengan metode kolorimetri dengan menggunakan reagen Salkowski yang mengandung 150 ml H2SO4 pekat,
kedalam 10 ml media Nutrient Broth yang telah ditambahkan L-triptofan 0.2 mM dan kedalam 10 ml media Nutrient Broth tanpa penambahan L-triptofan. Kultur diinkubasi dan dikocok (150 rpm) pada suhu ruang selama 24 jam. Sebanyak 3 ml kultur dari tiap perlakuan dimasukkan kedalam 2 tabung mikro untuk kemudian disentrifugasi (10.000 rpm) selama 15 menit. Sebanyak 2 ml filtrat yang diperoleh dimasukkan ke dalam tabung reaksi steril dan ditambahkan 2 ml reagen
Salkowski.Suspensi kemudian diinkubasi selama 60 menit dalam ruang gelap dan pada suhu ruang. Hal ini dilakukan sebelum diukur serapan IAA nya dengan menggunakan spektrometer (spectronic 20) pada panjang gelombang 510 nm.
Telaah pemacuan pertumbuhan kecambah dilakukan dengan menumbuhkan isolat Bacillus sp. dalam agar-agar nutrien pada suhu ruang selama 24 jam. Inokulan yang akan diuji disiapkan dengan meresuspensikan sel dari cawan agar-agar tersebut ke dalam NB, untuk mencapai konsentrasi sel kira-kira 6.109 sel/ml. Sebanyak 9 kecambah yang telah berukuran 2-3 mm diletakkan di atas media agar-agar 1%. Tiap kecambah diinokulasikan dengan 100 μl suspensi bakteri dan dilakukan sebanyak 3 kali ulangan. Sebagai kontrolnya dengan perlakuan yang sama menggunakan NB saja. Setelah 7 hari perlakuan, kemudian diamati dan diukur pertumbuhannya yang meliputi panjang batang, panjang akar utama dan jumlah akar lateral kemudian dibandingkan dengan kontrol. Hasil pengukuran dianalisis secara statistik dengan one-way Analysis of Variance (ANOVA) dan diuji lanjut dengan Duncan menggunakan software SAS.
Kemampuan melarutkan fosfat merupakan salah satu karakter PGPR. Uji ini dilakukan dengan menggunakan metode standar yaitu menggunakan medium Pikovskaya, dengan komposisi glukosa 10 g, Ca3HPO4 5 g, (NH4)2SO4 0.5 g, KCl
0.2 g, MgSO4.7H2O 0.1 g, ekstrak khamir 0.5 g, MnSO4 25 mgdanFeSO4 25 mg,
serta agar-agar Bacto 20 g dalam 1L akuades. Koloni bakteri uji digoreskan pada media tersebut, zona bening yang dihasilkan disekitar koloni setelah diinkubasi selama 1 sampai 7 hari menunjukkan adanya aktivitas bakteri dalam melarutkan fosfat.
Produksi siderofor merupakan salah satu strategi Bacillus sp. dalam menekan pertumbuhan fitopatogen, yakni dengan mekanisme kompetisi dalam mendapatkan Fe3+. Produksi siderofor oleh Bacillus sp. diuji dengan metode
Chrome Azurol Sulfonat (CAS) agar, dengan modifikasi larutan garam. Larutan 1 (larutan indikator Fe-CAS) mengandung 10 ml (1mM FeCl3.6H2O didalam 10
mM HCL), 50 ml larutan CAS (1.21 mg ml-1), dan 40 ml larutan hexadecyl-trimetylammonium bromide (HDTMA) (1.82 mg ml-1). Larutan 2 merupakan larutan buffer, disiapkan dengan melarutkan 30.24 g PIPES (peperazine-N,N’-bis[2-ethanesulfonic acid]) kedalam 750 ml larutan garam (3 gr KH2PO4, 5 g
NaCl, 10 g NH4Cl, 20 mM MgSO4, 1 mM CaCl2). Akuades ditambahkan untuk
mencapai volume larutan 800 ml sebelum diukur pH nya hingga 6.8 dengan 50% KOH, kemudian 20 g agar-agar bacto ditambahkan sebelum diautoklaf. Larutan 3 mengandung 2 g glukosa, 2 g manitol dan mikro elemen ( 493 mg MgSO4.7H2O,
11 mg CaCl2, 1.17 mg MnSO4.H2O, 1.4 mg H3BO3, 0.04 mg CuSO4.5H2O, 1.2 mg
ZnSO4.7H2O dan 1.0 mg NaMoO4.2H2O) didalam 70 ml akuades. Larutan 4
sampai 72 jam.
Bacillus sp. memiliki sifat biokontrol yang dapat membantu meningkatkan pertumbuhan tanaman yakni dengan menekan pertumbuhan mikroorganisme fitopatogen. Sclerotium rolsfii dan Fusarium oxysporum merupakan fungi fitopatogenik. Uji antagonis dilakukan dengan menggunakan metode standar kultur ganda. Isolat Bacillus sp. digores pada medium Potato Dextros Agar (PDA) dalam cawan petri berdiameter 9 cm, berjarak 3 cm dari kultur fungi Sclerotium rolsfii atau Fusarium oxysporum. Kultur cendawan ditumbuhkan ditengah cawan petri. Kultur dan biakan cendawan diinkubasi selama 4 hari untuk S. rolfsii dan 7 hari untuk F. oxysporum dan diamati perkembangannya. Adanya interaksi antagonis ditandai dengan terbentuknya zona penghambatan antara isolat Bacillus
dengan fungi. Besarnya penghambatan dihitung dalam persen penghambatan menggunakan rumus 1-(a/b) x 100%, dimana a menunjukan jarak antara titik pusat cendawan kearah isolat Bacillus sp., b menunjukan jarak antara titik pusat fungi ke daerah kosong tanpa isolat Bacillus sp.
Hasil penelitian menunjukkan bahwa sebanyak 118 isolat Bacillus sp. yang berasal dari rizosfer kedelai asal Cirebon telah berhasil diisolasi. Isolat-isolat ini memiliki karakteristik parsial Gram positif, bentuk sel batang dengan ukuran dan penataan yang berbeda-beda, dan membentuk endospora dengan bentuk dan letak yang bervariasi. Sebanyak 90 isolat Bacillus sp. memiliki kemampuan mensintesis IAA dengan konsentrasi yang beragam. Konsentrasi IAA pada kultur
Bacillus sp. yang ditumbuhkan pada media dengan penambahan L-Trp umumnya lebih tinggi dari pada konsentrasi IAA pada kultur yang ditumbuhkan pada media tanpa penambahan L-Trp. Salah satu Isolat Bacillus sp., Cr-4 mulai memproduksi IAA pada fase log dan berpotensi maksimal dalam memproduksi IAA pada jam ke-25, pada fase stasioner.
Dari 90 isolat tersebut selain memiliki kemampuan mensintesis IAA, beberapa diantaranya juga memiliki kemampuan lain dalam memacu pertumbuhan tanaman melalui pemacuan perpanjangan akar primer, batang, dan akar lateral. Sebanyak 76 isolat Bacillus sp. dari 90 isolat Bacillus sp. tersebut memiliki kemampuan melarutkan fosfat yang terlarut di dalam media Pikovskaya. 77 isolat Bacillus sp. diketahui mampu mengkelat besi dalam media Chrome Azurol Sulfonate (CAS). 18 isolat Bacillus sp. memiliki kemampuan menekan pertumbuhan F. oxysporum dan 1 isolat Bacillus sp. diantaranya mampu menekan pertumbuhan S. rolsfii.
Hak cipta milik IPB tahun 2007 Hak cipta dilindungi undag-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
PERTUMBUHAN TANAMAN
RINA PUJI ASTUTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Biologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Rizobakteria Bacillus sp. asal tanah rizosfer kedelai yang berpotensi sebagai pemacu pertumbuhan tanaman Nama : Rina Puji Astuti
NRP : G 351050031
Disetujui Komisi Pembimbing
Dr. Aris Tri Wahyudi, M.Si Dr. Anja Meryandini, MS Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dedy Duryadi, DEA. Prof. Dr. Ir.Khairil Anwar Notodiputro, MS
RIZOBAKTERIA BACILLUS SP. ASAL TANAH RIZOSFER
KEDELAI YANG BERPOTENSI SEBAGAI PEMACU
PERTUMBUHAN TANAMAN
RINA PUJI ASTUTI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul Rizobakteria Bacillus sp. asal tanah rizosfer kedelai yang berpotensi sebagai pemacu pertumbuhan tanaman, adalah hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis.
Bogor, November 2007
Rina Puji Astuti
ABSTRACT
RINA PUJI ASTUTI. Rhizobacteria Bacillus sp. Belonging to Rhizosphere of Soybean that Potential for Plant Growth Promotion. This thesis is advised by ARIS TRI WAHYUDI and ANJA MERYANDINI.
Plant growth promoting rhizobacteria (PGPR) belonging to Bacillus sp. were isolated from the rhizosphere of soybean plant. The aims of this study were to isolate and caracterize Bacillus sp. from the rhizosphere of soybean plant that potential for promoting of plant growth. 118 isolates that were comfirmed as
Bacillus sp., 90 isolates among them positively produced indole acetic acid (IAA), that 3.58 ppm was the lower, 19.18 ppm was moderate and the highest concentration was 67.29 ppm. 12 isolates significantly induced elongation of primary root, numerous of lateral root and shoot growth. 76 isolates were able to solubilize phosphate and 77 isolates produced siderophore. Isolat Bacillus sp. Cr-55 produced antifungal compound that inhibited growth of Sclerotium rolsfii. There were 18 isolates of Bacillus sp., include Cr-55, that inhibited Fusarium oxysporum. There were 5 characters of PGPR observed of this study: IAA synthesis, phosphat solubelizing, siderophore production, biocontrol and promoting of soybean growth significantly. The result showed that 3 isolates of
Kedelai yang Berpotensi sebagai Pemacu Pertumbuhan Tanaman. Dibimbing oleh ARIS TRI WAHYUDI dan ANJA MERYANDINI.
Plant Growth Promoting Rhizobacteria (PGPR) merupakan bakteri tanah di sekitar perakaran. PGPR berpotensi meningkatkan produktivitas dan pertumbuhan tanaman. PGPR dapat memberi keuntungan bagi pertumbuhan tanaman dengan menggunakan kemampuannya dalam memproduksi hormon pertumbuhan, seperti asam indol asetat, asam giberelin, sitokinin dan etilen. Selain itu beberapa rizobakteria juga memiliki kemampuan dalam menambat N2,
menekan pertumbuhan mikroorganisme fitopatogen dengan cara memproduksi siderofor, β-1-3-glukanase, kitinase, antibiotik dan sianida serta kemampuannya dalam melarutkan fosfat. Kemampuan tersebut bermanfaat bagi tumbuhan untuk memenuhi kebutuhan ketersediaan fosfat, sedangkan siderofor yang diproduksi oleh rizobakteria dapat memacu pertumbuhan tanaman dengan cara mengikat besi (Fe3+) yang jumlahnya terbatas di daerah rizosfer untuk berkompetisi dengan mikrob fitopatogen.
Bacillus sp. dapat menghasilkan fitohormon yang digunakan tumbuhan untuk membantu pertumbuhan baik pemanjangan akar, perkecambahan biji maupun meningkatkan perkembangan tajuk dan pembungaan. Peran Bacillus sp. dalam memproduksi asam indol asetat telah diteliti, namun informasi tentang kesatuan karakter Bacillus sp. sebagai pemacu pertumbuhan tanaman belum banyak dilaporkan. Untuk mengatasi masalah tersebut maka pada penelitian ini akan difokuskan pada isolasi beserta karakterisasi Bacillus sp. baik produksi IAA dan karakter lain yang berkaitan dengan pemacuan pertumbuhan tanaman.
Penelitian ini dikerjakan dengan mengisolasi Bacillus sp. Sebanyak 0.5 gram sampel tanah rizosfer kedelai asal Cirebon dimasukkan ke dalam 4.5 ml akuades steril yang sudah terlarut NaCl 0.85 % di dalamnya. Sampel divortek dan dipanaskan 80 oC selama 10 menit, untuk menyeleksi Bacillus sp. dari mikroorganisme lain yang tidak membentuk endospora. Sampel selanjutnya diencerkan berseri hingga pengenceran 10-6. Sebanyak 100 µl dari suspensi pengenceran disebar di atas media cawan nutrien agar-agar dengan komposisi (8 gr Nutrient Broth (NB), 20% bacto agar dalam 1 liter akuades) menggunakan batang penyebar. Cawan selanjutnya diinkubasi selama 24 jam. Koloni yang tumbuh kemudian dimurnikan dengan menggunakan media yang sama. Pewarnaan Gram, pewarnaan endospora dan uji katalase dilakukan mengikuti
Bergey’s Manual of Determinative Bacteriology untuk menentukan isolat tersebut termasuk ke dalam kelompok Bacillus sp.
Produksi IAA dilakukan dengan menggunakan metode standar yaitu dengan mengkulturkan terlebih dahulu 1 lup penuh isolat Bacillus sp. pada media NB dengan penambahan L-Trp dan diinkubasi selama 48 jam. Tiap 1 jam dilakukan pengukuran kadar IAAnya. Pengukuran IAA ini digunakan untuk mengetahui waktu produksi IAA yang paling maksimal.
IAA yang diproduksi oleh Bacillus diukur dengan metode kolorimetri dengan menggunakan reagen Salkowski yang mengandung 150 ml H2SO4 pekat,
kedalam 10 ml media Nutrient Broth yang telah ditambahkan L-triptofan 0.2 mM dan kedalam 10 ml media Nutrient Broth tanpa penambahan L-triptofan. Kultur diinkubasi dan dikocok (150 rpm) pada suhu ruang selama 24 jam. Sebanyak 3 ml kultur dari tiap perlakuan dimasukkan kedalam 2 tabung mikro untuk kemudian disentrifugasi (10.000 rpm) selama 15 menit. Sebanyak 2 ml filtrat yang diperoleh dimasukkan ke dalam tabung reaksi steril dan ditambahkan 2 ml reagen
Salkowski.Suspensi kemudian diinkubasi selama 60 menit dalam ruang gelap dan pada suhu ruang. Hal ini dilakukan sebelum diukur serapan IAA nya dengan menggunakan spektrometer (spectronic 20) pada panjang gelombang 510 nm.
Telaah pemacuan pertumbuhan kecambah dilakukan dengan menumbuhkan isolat Bacillus sp. dalam agar-agar nutrien pada suhu ruang selama 24 jam. Inokulan yang akan diuji disiapkan dengan meresuspensikan sel dari cawan agar-agar tersebut ke dalam NB, untuk mencapai konsentrasi sel kira-kira 6.109 sel/ml. Sebanyak 9 kecambah yang telah berukuran 2-3 mm diletakkan di atas media agar-agar 1%. Tiap kecambah diinokulasikan dengan 100 μl suspensi bakteri dan dilakukan sebanyak 3 kali ulangan. Sebagai kontrolnya dengan perlakuan yang sama menggunakan NB saja. Setelah 7 hari perlakuan, kemudian diamati dan diukur pertumbuhannya yang meliputi panjang batang, panjang akar utama dan jumlah akar lateral kemudian dibandingkan dengan kontrol. Hasil pengukuran dianalisis secara statistik dengan one-way Analysis of Variance (ANOVA) dan diuji lanjut dengan Duncan menggunakan software SAS.
Kemampuan melarutkan fosfat merupakan salah satu karakter PGPR. Uji ini dilakukan dengan menggunakan metode standar yaitu menggunakan medium Pikovskaya, dengan komposisi glukosa 10 g, Ca3HPO4 5 g, (NH4)2SO4 0.5 g, KCl
0.2 g, MgSO4.7H2O 0.1 g, ekstrak khamir 0.5 g, MnSO4 25 mgdanFeSO4 25 mg,
serta agar-agar Bacto 20 g dalam 1L akuades. Koloni bakteri uji digoreskan pada media tersebut, zona bening yang dihasilkan disekitar koloni setelah diinkubasi selama 1 sampai 7 hari menunjukkan adanya aktivitas bakteri dalam melarutkan fosfat.
Produksi siderofor merupakan salah satu strategi Bacillus sp. dalam menekan pertumbuhan fitopatogen, yakni dengan mekanisme kompetisi dalam mendapatkan Fe3+. Produksi siderofor oleh Bacillus sp. diuji dengan metode
Chrome Azurol Sulfonat (CAS) agar, dengan modifikasi larutan garam. Larutan 1 (larutan indikator Fe-CAS) mengandung 10 ml (1mM FeCl3.6H2O didalam 10
mM HCL), 50 ml larutan CAS (1.21 mg ml-1), dan 40 ml larutan hexadecyl-trimetylammonium bromide (HDTMA) (1.82 mg ml-1). Larutan 2 merupakan larutan buffer, disiapkan dengan melarutkan 30.24 g PIPES (peperazine-N,N’-bis[2-ethanesulfonic acid]) kedalam 750 ml larutan garam (3 gr KH2PO4, 5 g
NaCl, 10 g NH4Cl, 20 mM MgSO4, 1 mM CaCl2). Akuades ditambahkan untuk
mencapai volume larutan 800 ml sebelum diukur pH nya hingga 6.8 dengan 50% KOH, kemudian 20 g agar-agar bacto ditambahkan sebelum diautoklaf. Larutan 3 mengandung 2 g glukosa, 2 g manitol dan mikro elemen ( 493 mg MgSO4.7H2O,
11 mg CaCl2, 1.17 mg MnSO4.H2O, 1.4 mg H3BO3, 0.04 mg CuSO4.5H2O, 1.2 mg
ZnSO4.7H2O dan 1.0 mg NaMoO4.2H2O) didalam 70 ml akuades. Larutan 4
sampai 72 jam.
Bacillus sp. memiliki sifat biokontrol yang dapat membantu meningkatkan pertumbuhan tanaman yakni dengan menekan pertumbuhan mikroorganisme fitopatogen. Sclerotium rolsfii dan Fusarium oxysporum merupakan fungi fitopatogenik. Uji antagonis dilakukan dengan menggunakan metode standar kultur ganda. Isolat Bacillus sp. digores pada medium Potato Dextros Agar (PDA) dalam cawan petri berdiameter 9 cm, berjarak 3 cm dari kultur fungi Sclerotium rolsfii atau Fusarium oxysporum. Kultur cendawan ditumbuhkan ditengah cawan petri. Kultur dan biakan cendawan diinkubasi selama 4 hari untuk S. rolfsii dan 7 hari untuk F. oxysporum dan diamati perkembangannya. Adanya interaksi antagonis ditandai dengan terbentuknya zona penghambatan antara isolat Bacillus
dengan fungi. Besarnya penghambatan dihitung dalam persen penghambatan menggunakan rumus 1-(a/b) x 100%, dimana a menunjukan jarak antara titik pusat cendawan kearah isolat Bacillus sp., b menunjukan jarak antara titik pusat fungi ke daerah kosong tanpa isolat Bacillus sp.
Hasil penelitian menunjukkan bahwa sebanyak 118 isolat Bacillus sp. yang berasal dari rizosfer kedelai asal Cirebon telah berhasil diisolasi. Isolat-isolat ini memiliki karakteristik parsial Gram positif, bentuk sel batang dengan ukuran dan penataan yang berbeda-beda, dan membentuk endospora dengan bentuk dan letak yang bervariasi. Sebanyak 90 isolat Bacillus sp. memiliki kemampuan mensintesis IAA dengan konsentrasi yang beragam. Konsentrasi IAA pada kultur
Bacillus sp. yang ditumbuhkan pada media dengan penambahan L-Trp umumnya lebih tinggi dari pada konsentrasi IAA pada kultur yang ditumbuhkan pada media tanpa penambahan L-Trp. Salah satu Isolat Bacillus sp., Cr-4 mulai memproduksi IAA pada fase log dan berpotensi maksimal dalam memproduksi IAA pada jam ke-25, pada fase stasioner.
Dari 90 isolat tersebut selain memiliki kemampuan mensintesis IAA, beberapa diantaranya juga memiliki kemampuan lain dalam memacu pertumbuhan tanaman melalui pemacuan perpanjangan akar primer, batang, dan akar lateral. Sebanyak 76 isolat Bacillus sp. dari 90 isolat Bacillus sp. tersebut memiliki kemampuan melarutkan fosfat yang terlarut di dalam media Pikovskaya. 77 isolat Bacillus sp. diketahui mampu mengkelat besi dalam media Chrome Azurol Sulfonate (CAS). 18 isolat Bacillus sp. memiliki kemampuan menekan pertumbuhan F. oxysporum dan 1 isolat Bacillus sp. diantaranya mampu menekan pertumbuhan S. rolsfii.
Hak cipta milik IPB tahun 2007 Hak cipta dilindungi undag-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
PERTUMBUHAN TANAMAN
RINA PUJI ASTUTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Biologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Rizobakteria Bacillus sp. asal tanah rizosfer kedelai yang berpotensi sebagai pemacu pertumbuhan tanaman Nama : Rina Puji Astuti
NRP : G 351050031
Disetujui Komisi Pembimbing
Dr. Aris Tri Wahyudi, M.Si Dr. Anja Meryandini, MS Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dedy Duryadi, DEA. Prof. Dr. Ir.Khairil Anwar Notodiputro, MS
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT, karena atas limpahan belas kasih, kemudahan dan petunjuk-Nya semata, penulis dapat menyelesaikan Tesis ini. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari sampai September 2007 ini ialah PGPR, dengan judul Rizobakteria
Bacillus sp. asal tanah rizosfer tanaman kedelai yang berpotensi sebagai pemacu pertumbuhan tanaman.
Terima kasih penulis sampaikan kepada Dr. Aris Tri Wahyudi, M.Si dan Dr. Anja Meryandini, MS selaku dosen pembimbing atas bimbingan dan arahan yang diberikan. Kepada Dr. Ir. Giyanto, M.Si dari Departemen Proteksi Tanaman selaku penguji luar komisi kami juga mengucapkan terima kasih atas saran yang diberikan. Penelitian ini didanai dari program Intensif Penelitian Dasar dari Kementrian Negara Riset dan Teknologi Indonesia kepada Dr. Aris Tri Wahyudi,M.Si untuk itu kami mengucapkan terima kasih. Terima kasih kepada pengelola Laboratorium Mikrobiologi, Departemen Biologi F MIPA IPB atas segala fasilitas dan penggunaan alat pengujian.
Ucapan terima kasih juga disampaikan kepada Bapak dan ibu, suami dan keluarga atas segala do’a, curahan kasih sayang dan pengertiannya. Penulis ucapkan terima kasih kepada mbak Widya dan teman-teman di Laboratorium Mikrobiologi atas diskusi, saran, dukungan dan bantuannya. Ucapan terima kasih pada semua pihak yang telah membantu sehingga dapat terselesaikannya tesis ini.
Selama menjadi mahasiswa, kami berkesempatan mempresentasikan sebagian hasil penelitian ini pada forum nasional yaitu pada ”Seminar Nasional yang dibiayai Hibah Kompetitif” di Departemen Agronomi dan Hortikultura IPB 1-2 Agustus 2007.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2007
DAFTAR ISI
Halaman DAFTAR TABEL... xiii
DAFTAR GAMBAR ... xiii
PENDAHULUAN
Latar Belakang ... 1 Tujuan ... 2
TINJAUAN PUSTAKA
Plant Growth Promotion Rhizobacteria... 3 Rizobakteria Bacillus spp. ... 4 Mekanisme PGPR dalam Memacu Pertumbuhan Tanaman ... 6 Karakteristik Plant Growth Promoting Rhizobacteria... 7
Indole Acetic Acid ... 7 Kelarutan Fosfat... 10 Biokontrol Fitopatogen. ... 12
BAHAN DAN METODE
Isolasi dan Karakterisasi Fisiologi secara Parsial Bacillus spp... 16 Pengukuran Indole Acetic acid... 16 Tela Pemacuan Pertumbuhan Tanaman... 17 Uji Kelarutan Fosfat ... 17 Produksi Siderofor. ... 18
Uji Antagonis Fitopatogen. ... 18
HASIL
Isolasi dan Karakterisasi Fisiologi secara Parsial Bacillus spp... 20 Pengukuran Indole Acetic acid... 20 Telaah Pemacuan Pertumbuhan Tanaman ... 24 Uji Kelarutan Fosfat... 25 Produksi Siderofor ... 29 Uji Antagonis Fitopatogen Sclerotium rolsfii... 30 Uji Antagonis Fitopatogen Fusarium oxysporum... 30
PEMBAHASAN
Pembahasan... 34
KESIMPULAN DAN SARAN
Kesimpulan ... 43 Saran ... 43
Halaman 1. Sintesis indole acetic acid (IAA) oleh isolat Bacillus sp... 22 2. Pengaruh Inokulasi isolat Bacillus sp. terhadap pertumbuhan akar
primer, batang, dan jumlah akar lateral kecambah kedelai kultivar Slamet... . 26 3. Kemampuan isolat Bacillus sp. dalam melarutkan fosfat,
memproduksi siderofor, dan menghambat fungi Sclerotium rolsfii dan
Fusarium oxysporum. ... 31
DAFTAR GAMBAR
Halaman 1. Lintasan sintesis IAA bergantung triptofan ... 8 2. Penampilan sel dan endospora Bacillus sp... 20
3. Koloni isolat Bacillus sp. Cr-4 pada media Nutrient agar.... 21
4. Kurva pertumbuhan dan produksi IAA isolat Cr-4. ... 22
5. Penampilan kecambah kedelai yang diinokulasi dengan Bacillus sp. (Cr-69) dan dengan NB. ... 25
6. Zona bening disekitar koloni Bacillus sp. pada uji kelarutan fosfat. .... 25
7. Zona oranye di sekitar koloni isolat Bacillus sp. Cr-79 pada media agar-agar CAS . ... 30
8. Penghambatan pertumbuhan Sclerotium rolsfii oleh isolat Bacillus
sp. Cr-55. ... 32
9. Penghambatan pertumbuhan Fusarium oxysporum oleh isolat
Bacillus sp. Cr-45... 33
PENDAHULUAN
Latar Belakang
Plant Growth Promoting Rhizobacteria (PGPR) merupakan bakteri tanah di sekitar perakaran. PGPR berpotensi meningkatkan produktivitas dan pertumbuhan tanaman. Terdapat berbagai mekanisme PGPR dalam menstimulasi pertumbuhan tanaman. Mekanisme ini dikelompokkan menjadi dua yaitu secara langsung dan tidak langsung. Secara tak langsung rizobakteria terkait dengan produksi metabolit seperti antibiotik dan siderofor, yang dapat berfungsi menurunkan pertumbuhan fitopatogen. Secara langsung PGPR mampu memproduksi zat pengatur tumbuh dan meningkatkan pengambilan nutrisi oleh tumbuhan (Patten & Glick 2002; Kloepper 1993).
PGPR dapat memberi keuntungan bagi pertumbuhan tanaman dengan menggunakan kemampuannya dalam memproduksi hormon pertumbuhan, seperti asam indol asetat, asam giberelin, sitokinin dan etilen. Selain itu beberapa rizobakteria juga memiliki kemampuan dalam menambat N2, menekan
pertumbuhan mikroorganisme fitopatogen dengan cara memproduksi siderofor,
β-1-3-glukanase, kitinase, antibiotik dan sianida serta kemampuannya dalam melarutkan fosfat. Kemampuan tersebut bermanfaat bagi tumbuhan untuk memenuhi kebutuhan ketersediaan fosfat, sedangkan siderofor yang diproduksi oleh rizobakteria dapat memacu pertumbuhan tanaman dengan cara mengikat besi (Fe3+) yang jumlahnya terbatas di daerah rizosfer dalam rangka berkompetisi dengan mikrob fitopatogen. Pseudomonas sp. dan Bacillus sp. dikenal sebagai PGPR. Bakteri ini dapat berperan sebagai pupuk hayati yang mampu meningkatkan pertumbuhan tanaman (Benizri et al. 1989; Husen 2003; Haas & Défago 2005).
mengatasi masalah tersebut maka pada penelitian ini akan difokuskan pada isolasi beserta karakterisasi Bacillus sp. baik produksi IAA dan karakter lain yang berkaitan dengan pemacuan pertumbuhan tanaman. Karakterisasi parsial dalam penelitian ini akan dilakukan menggunakan metode standar untuk pewarnaan Gram, pewarnaan endospora, dan uji katalase. Karakterisasi PGPR dilakukan dengan uji produksi IAA menggunakan metode kolorimetri Salkowski dan dilanjutkan dengan uji pemacuan pertumbuhan tanaman, serta uji kelarutan fosfat. Karakterisasi Bacillus sp. sebagai agen pengendali hayati dilakukan dengan uji antagonis fitopatogen menggunakan cendawan Sclerotium rolfsii dan Fusarium oxysporum dan produksi siderofor.
Tujuan
TINJAUAN PUSTAKA
Plant Growth-Promoting Rhizobacteria
Plant Growht-Promoting Rhizobacteria (PGPR) pertama kali didefinisikan oleh Kloepper dan Schroth (1978) sebagai bakteri disekitar perakaran tanaman yang memiliki kemampuan meningkatkan pertumbuhan tanaman. PGPR dilaporkan dapat meningkatkan pertumbuhan tanaman dengan berbagai mekanisme diantaranya: fiksasi nitrogen, produksi siderofor sebagai pengkelat besi, dan sintesis fitohormon (Kloepper dan Schroth 1978). PGPR ini juga dapat mempengaruhi pertumbuhan tanaman dengan cara meningkatkan fiksasi nitrogen, giberelin, sitokinin, etilen, kelarutan fosfat dan oksidasi sulfur, meningkatkan ketersediaan nitrat, produksi antibiotik ekstraseluler, enzim litik, asam hidrosianik dan meningkatkan permeabilitas akar, kompetisi dalam nutrisi dan letak akar (Enebak et al. 1998; Mello 2000).
Egamberdiyeva (1997) melaporkan bahwa ketidakcocokan penerapan pupuk bagi produksi kapas di Uzbekistan menyebabkan pencemaran tanah pertanian. Dengan mengunakan metode biologis, selain dapat meningkatkan produksi tanaman juga tidak merusak lingkungan. PGPR juga dilaporkan sebagai elemen kunci untuk menyeimbangkan tanaman pada kondisi tekanan nutrisi dan dapat mereduksi dampak penggunaan pupuk kimia serta mendukung produksi pertanian yang ramah lingkungan.
Rhizosfer dalam ekosistem tanah yang sehat dihuni oleh organisme yang menguntungkan dan dapat memanfaatkan substrat organik atau eksudat akar tanaman sebagai sumber energi dan nutrisinya. Mikroba tanah berperan dalam proses penguraian bahan organik, melepaskan nutrisi yang diperlukan tanaman dan mereduksi residu toksik. Selain itu mikroba juga berperan sebagai agen pemacu pertumbuhan tanaman (PGP Agent) yang memproduksi berbagai hormon tumbuh, vitamin dan berbagai asam organik yang berperan penting dalam merangsang pertumbuhan bulu-bulu akar (Hindersah dan Simarmata 2004). IAA yang dikeluarkan di dalam tanah direspon oleh tumbuhan secara bervariasi, tergantung pada spesies tanaman dan konsentrasi IAA yang dikeluarkan oleh bakteri (Beyeler et al. 1997 diacu dalam Husen dan Saraswati 2003).
menurunkan infeksi pada tanaman akibat serangan fitopatogen. Konsep PGPR dipertahankan dengan mengisolasi beberapa bakteri yang memenuhi setidaknya dua kriteria yaitu kemampuan dalam mengkolonisasi akar tanaman, mampu memacu pertumbuhan tanaman dan memiliki sifat sebagai biokontrol (Weller 2002; Haas & Défago 2005).
Terdapat tiga komponen berbeda di dalam rizosfer, tetapi saling berinteraksi. Ketiga komponen tersebut adalah rizosfer (tanah), rizoplen, dan akar. Rizosfer merupakan zona atau areal disekitar perakaran yang terpengaruh oleh substrat yang dikeluarkan akar, yang berpengaruh terhadap aktivitas mikroba. Rizoplen merupakan permukaan akar, termasuk yang melekat kuat dengan partikel tanah. Akar sendiri merupakan bagian dari sistem, karena mikroorganisme tertentu dan endofit mampu mengkolonisasi jaringan akar. Mikroba yang mengkolonisasi rizoplen dan atau endofit diketahui sebagai pengkolonisasi akar. Mikroba yang mengkolonisasi di tanah karena pengaruh akar disebut pengkolonisasi rizosfer (Barea et al. 2005).
Rizobakteria Bacillus sp.
Rizosfer merupakan habitat PGPR, volume tanah seringkali mempengaruhi sistem perakaran tanaman. Di dalam rizosfer, sekresi senyawa organik yang dikeluarkan oleh tumbuhan dapat mengaktifkan populasi mikroba. PGPR yang diinokulasikan kepada tanaman, utamanya Pseudomonas, Serratia,
Azospirillum dan Bacillus dapat meningkatkan pertumbuhan dan sistem perakaran serta menurunkan pertumbuhan fitopatogen. Mekanisme pemacuan sangat tergantung pada bakteria dan tanaman inang. Pada beberapa kasus pada proses interaksi antara bakteria dan tanaman ditemukan adanya sintesis hormon pengatur tumbuh IAA, siderofor dan biokontrol bakteria terhadap fitopatogen atau induksi respon pertahanan diri (Montesinos et al. 2002).
5
yang diaplikasikan dalam tanah pertanian (Liu dan Sinchair 1993; Bai et al. 2003).
Endospora Bacillus berada di dalam sel vegetatif induk dan memiliki morfologi ultrastruktur yang kompleks. Endospora tahan terhadap panas, kekeringan, radiasi dan kondisi lingkungan yang tak menguntungkan. Dari sisi akademik Bacillus memiliki peranan penting terutama karena kompleksitas sistem regulasinya dalam mengendalikan sporulasi, kompeten, motilitas, dan pembentukan antibiotik. Kemampuannya dalam mensekresi enzim ekstraselular secara langsung ke dalam medium membuat B. subtilis sebagai bakteri yang sistem ekspresi gen heterolognya paling banyak dipelajari. Bacillus OSU 142
berpotensi dalam meningkatkan hasil panenan pohon Apricot. Hal ini telah diteliti pada tahun 2000 sampai dengan 2001 yaitu mengenai efek penyemprotan suspensi
Bacillus OSU 142 terhadap pertumbuhan dan komposisi elemen nutrien pada daun Apricot kultivar Hacihaliloglu. Pada saat perbungaan dan pada 30 dan 60 hari setelah pembungaan di lahan pertanian provinsi Matalya Turki. Penelitian ini menghasilkan perbedaan yang nyata pada hasil panenan, panjang tunas dan komposisi elemen nurtrisi ( N, P, K, Ca, dan Mg) pada daun, yaitu lebih tinggi dengan menggunakan perlakuan Bacillus OSU 142 pada fase pembungaan dari pada tanaman kontrol (Estiken et al. 2002).
Berbagai macam mikroorganisme yang terdapat di dalam rizosfer dapat mempengaruhi pertumbuhan tanaman. Secara umum jumlah bakteri lebih banyak dalam tanah dari pada jumlah cendawan. Beberapa genus bakteri seperti
Pseudomonas, Agrobacterium, Azotobacter, Mycobacter, Flavobacter,
Cellulomonas, Micrococcus, dan Bacillus dilaporkan jumlahnya melimpah di dalam rizosfer. Bakteri-bakteri ini memiliki pengaruh yang signifikan terhadap pertumbuhan tanaman. Bakteri gram positif berpotensi sebagai biological solution, karena ketahanannya terhadap panas dan kemampuannya membentuk endospora. Pertumbuhan tanaman dapat ditingkatkan melalui kolonisasi akar oleh galur Bacillus dan Paenibacillus (Broadbent et al. 1977; Timmusk & Wagner 2001 ; Idriss 2002). Bakteri di dalam rizosfer secara tidak langsung berpengaruh terhadap pertumbuhan tanaman yaitu sebagai agen pengendali hayati. Bakteri
Mekanisme PGPR dalam Memacu Pertumbuhan Tanaman Rizobakteri pemacu pertumbuhan tanaman memiliki kemampuan dalam memproduksi hormon pertumbuhan atau senyawa lain yang dapat merangsang pertumbuhan tanaman. Indole acetic acid yang diproduksi oleh rizobakteria berpengaruh langsung terhadap pertumbuhan tanaman. Senyawa lainnya yang berfungsi sebagai pengatur pertumbuhan tanaman seperti giberelic acid,
cytokinins dan etylene juga diproduksi oleh rizobakteri ini (Kloepper 1993; Ryu et al. 2003).
Nodulasi dan fiksasi nitrogen merupakan mekanisme pemacuan pertumbuhan secara langsung oleh rizobakteri khususnya bakteri endofitik seperti
Rhizobium, Bradyrhizobium japonicum dan Azospirillum brasilense. Nodul yang dibentuk oleh bakteri tersebut membantu tanaman leguminose dalam memfiksasi nitrogen melalui aktivitas nitrogenase (Zhang et al. 1996). Kemampuan dalam melarutkan fosfat juga merupakan karakter PGPR. Dengan kemampuan ini, P inorganik yang terlarut di daerah rizosfer dapat tersedia bagi tanaman. Ketersediaan hormon pengatur tumbuh dan nutrisi ini membantu secara langsung dalam memacu perkembangan tanaman. Hasil panenan yang meningkat merupakan pengaruh PGPR disamping kemampuannya dalam memacu pertumbuhan tanaman (Datta et al. 1982).
7
Karakteristik Plant Growth Promoting Rhizobacteria Indole Acetic Acid
Indole acetic acid merupakan hormon utama yang berperan dalam
mengkontrol beberapa proses fisiologi tumbuhan, termasuk perkembangan dan pembelahan sel dan diferensiasi jaringan tumbuhan serta merespon terhadap cahaya dan grafitasi. IAA yang disintesis oleh jenis bakteri tertentu merupakan salah satu faktor penyebab terjadinya peningkatan pertumbuhan tanaman. Akar merupakan salah satu organ tanaman yang sangat sensitif terhadap jumlah IAA. Tanaman merespon IAA dengan mekanisme pemanjangan akar utama, pembentukan akar lateral dan akar adventif (Leveau 2005). Kemampuan Bacillus
sp. dalam memproduksi IAA berpengaruh secara langsung terhadap pertumbuhan tanaman. Kemampuan tersebut merupakan dasar untuk dikaji potensinya dalam peningkatan pertumbuhan kecambah kacang hijau, pengukuran panjang kecambah dan penghitungan jumlah cabang akar kecambah secara kuantitatif berkorelasi positif dengan aktivitas IAA (Aryantha et al. 2004). IAA berperan aktif pada semua tanaman dan berperan penting dalam meningkatkan pertumbuhan, seperti menginisiasi pemanjangan akar, perluasan sel, diferensiasi vaskuler, dan menginisiasi pembungaan (Brandl et al. 1996).
tryptamine pada Agrobacterium tumefaciens dan melalui indole-3-acetonitrile
(IAN) pada Alcaligenesfaecalis dan pada A.tumefaciens (Zakhrova et al. 1999).
Manulis et al. (1998) mengemukakan bahwa IAM dan IPyA merupakan lintasan utama pada semua bakteri. IAM merupakan lintasan pada semua bakteri pembentuk bintil, (Bradyrhizobium japonicum, Rhizobium fredii, Azospirillum brasilense dan Streptomyces). Menurut Brandl et al. (1996) biosintesis IAA melalui IpyA dijumpai pada tanaman tingkat tinggi dan beberapa jenis bakteri meliputi Rhizobium spp., Azospirillum spp., Ralstonia solanacearum dan
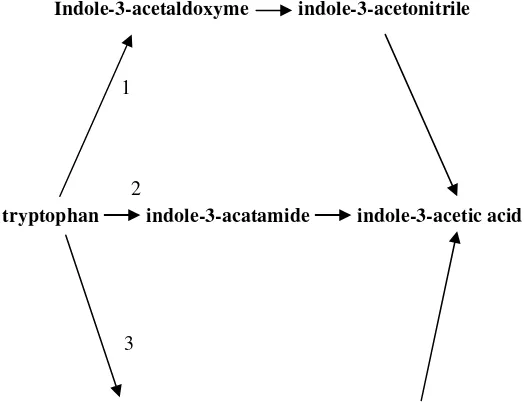
[image:32.595.200.465.146.348.2]Enterobacter cloacae.
Gambar 1 Lintasan sintesis IAA yang bergantung Triptofan1. melalui Indole-3-acetonitrile (IAN), 2. melalui Indole-3-acetamide (IAM) dan 3. melalui
Indole-3-pyruvic acid (IPyA) (Zakhrova 1999).
Indole-3-acetaldoxyme indole-3-acetonitrile
tryptophan indole-3-acatamide indole-3-acetic acid
Indole-3-pyruvic acid indole-3-acetaldehyde 3
1
2
9
Tien et al. (1979) mengamati bahwa produksi IAA meningkat sesuai dengan peningkatan konsentrasi triptofan dari 1-100 μg/ml. Konsentrasi IAA juga
meningkat seiring dengan umur kultur sampai bakteri mencapai fase stasioner. Pengocokan lebih disukai untuk memproduksi IAA, terutama pada media yang mengandung nitrogen.
Menurut Patten dan Glick (2002) tanaman yang diinokulasi dengan bakteri mutan yang memproduksi IAA berlebihan akan menghambat pertumbuhan tanaman. Penghambatan ini terjadi oleh karena pada bakteri mutan terjadi over produksi IAA. Bakteri penghasil IAA dalam jumlah yang lebih banyak menyediakan IAA lebih banyak pula untuk tanaman. Produksi IAA tidak berfungsi nyata sebagai hormon dalam sel bakteri. Hormon ini dimungkinkan terdapat di dalam sel bakteri, dikarenakan berperan penting untuk berinteraksi antara bakteri dan tanaman. Pada penelitian yang dilakukan Patten dan Glick (2002) diperoleh bahwa bakteri yang memproduksi IAA menstimulasi pertumbuhan sistem perakaran inang. Asosiasi tanaman dengan bakteri memberikan keuntungan bagi tumbuhan. Metabolit sekunder seperti IAA yang disuplai oleh bakteri digunakan sebagai pengganti hilangnya sebagian hasil fotosintesis berupa eksudat akar yang dikeluarkan tanaman ke rhizosfer (Martens
et al. 1994; Patten dan Glik 2002).
Tanaman umumnya tumbuh dengan satu atau lebih akar utama, akar lateral muncul dari pembelahan sel perisikel. Akar adventif merupakan tipe dari akar lateral yang bukan berasal dari jaringan akar seperti jaringan yang berada pada dasar batang atau pada batang yang dipotong. Akar lateral dan adventif diinduksi oleh konsentrasi IAA yang tinggi, sedangkan akar utama relatif diinduksi IAA pada tingkat yang rendah, antara 10-9-10-12 M. Akar tersebut terhambat pertumbuhannya oleh konsentrasi IAA yang tinggi, melalui induksi etilen oleh IAA (Patten & Glick 2002).
Kelarutan Fosfat
hanya 0.1% dari total P tersedia bagi tanaman dikarenakan P tersebut terjerat atau terikat dan rendah kelarutannya. Tumbuhan hanya dapat menggunakan fosfat dalam jumlah yang kecil pada penggunaan pupuk fosfat kimiawi, karena terjadinya reaksi antara P dan tanah dan hanya sedikit P yang terlarut. Pada kondisi keterbatasan fosfat, mikroorganisme merupakan agen yang dapat mengatasi masalah tersebut, yakni dengan kemampuannya melarutkan P inorganik sehingga tersedia bagi tanaman. Cendawan dan bakteri merupakan mikroorganisme pelarut fosfat, yang dapat tumbuh pada media yang mengandung trikalsium, besi dan aluminium fosfat, hidroksiapatit, batuan fosfat, dan senyawa terikat fosfat sebagai sumber fosfat. Sebagian mikroba tidak hanya mengasimilasi fosfat namun juga mengeluarkan P terlarut dalam jumlah banyak sebagai efek samping dari kebutuhannya sendiri akan fosfat. Terdapat beberapa genus bakteri yang sangat mampu melarutkan fosfat, diantaranya Bacillus dan Pseudomonas
dan cendawan Aspergillus dan Penicillium. Bacillus brevis, B. cereus, B. circulan. B. firmus, B. licheniformis, B. megaterium, B. mesentricus, B. polymyca,
B. pumilis, B. pulvifaciens, dan B. subtilis merupakan spesies Bacillus pelarut P yang berasal dari rizosfer polong-polongan, padi dan jagung. Pseudomonas striata, P. cissicola, P. flourescens, P. phinophillum, P. putida, P. syringae, P. aeruginosa, P. putrefasciens dan P. stutzeri merupakan spesies Pseudomonas
pelarut P yang berasal dari rizosfer Brassica, chikpea, jagung, kedelai dan tanaman pertanian lainnya (Tilak et al. 2005).
Mikro dan makro nutrisi di dalam tanah mengalami kesetimbangan kelarutan yang dinamik, dipengaruhi oleh pH dan mikroflora. Kondisi ini berpengaruh terhadap tanaman dalam menyerap nutrisi tersebut. Fosfor merupakan nutrisi yang jumlahnya sedikit pada kebanyakan tanah, walaupun di dalam tanah fosfat terikat dengan besi dan aluminium pada tanah asam (pH lebih rendah dari pada 5.0) atau kalsium pada tanah alkalin (pH sekitar 7.0). Namun kalsium fosfat dapat dilarutkan dan disediakan bagi tanaman oleh mikroorganisme melalui mekanisme pengeluaran asam organik (Cunningham & kuiak 1992; Golstein 1995; Altomere et al. 1999).
11
asam amino di dalam rizosfer melalui kelarutan fosfat dan pengikatan N. Fosfat ditingkatkan jumlahnya dengan mekanisme mobilisasi fosfat terikat sebagai polifosfat inorganik atau fitat. Sejumlah PGPR memiliki potensi sebagai fitostimulator, biofertilizer dan sebagai agen biokontrol (Richardson et al. 2001 dan Bloemberg & Lughtenberg 2001; Idriss et al.2002).
Tanaman memiliki sejumlah mekanisme untuk meningkatkan ketersediaan fosfor. Pemanfaatan fosfor fitat di dalam rizosfer sangat terbatas oleh karena aktivitas fitase yang tersedia didalam rizosfer sangat rendah. Akar Arabidopsis
hanya menyumbang 0.5% dari total aktivitas fosfomonoesterase dan tidak terdapat aktivitas fitase ekstraseluler dari tanaman yang terdeteksi. Pada umumnya, fosfatase tidak mampu menghidrolisis fitat. Namun pada organisme prokariot dan eukariot, fosfomonoesterase mampu menghidrolisis fitat menjadi myo-inositol dan fosfat yang merupakan turunan ester fosfat. Disamping kemampuan beberapa bakteri termasuk Bacillus dalam mengkolonisasi akar, bakteri tersebut juga mampu menyediakan fitat fosfor bagi tanaman pada kondisi kekurangan fosfat di dalam tanah (Reddy et al. 1989 dan Wodzinski & Ullah 1996; Idriss et al. 2002).
Di dunia ini banyak dijumpai tanah yang memiliki kadar P rendah, karena konsentrasi fosfor bebas sekalipun di tanah yang subur umumnya tidak lebih tinggi dari 10 μM, walaupun pada pH 6.5 dimana fosfor sangat mudah terlarut.
Mikroorganisme tanah sangat potensial dalam memecah fosfat di dalam tanah. Pupuk hayati dalam bentuk mikroorganisme dapat membantu meningkatkan ketersediaan dan mengakumulasi fosfat untuk pertumbuhan tanaman melalui mekanisme kelarutan. Penerapan fosforit bersama bakteri pelarut fosfat dapat meningkatkan pengambilan P dan hasil panenan pada tumbuhan. Kemampuan tersebut mengindikasikan bahwa bakteri pelarut fosfat tersebut mampu melarutkan dan menggerakkan fosfat untuk tanaman termasuk kedelai (Galal et al. 2001; Egamberdiyeva et al. 2006).
Egamberdiyeva et al. (2006) juga melaporkan hasil penelitiannya bahwa teknologi pupuk hayati dapat meminimalkan biaya produksi dan pada waktu yang bersamaan dapat menurunkan kerusakan lingkungan. Strain Bacillus,
positif terhadap pemanjangan tanaman, panjang akar yang ditingkatkan oleh bakteri tersebut mencapai 53%. Pseudomonas rathonis PsR47 dan Bacillus amyloliquefaciens BcA27 mampu meningkatkan pertumbuhan akar sebesar 20% dibandingkan dengan tanaman kontrol. Kombinasi dua galur dengan fosforit memiliki pengaruh yang rendah pada pertumbuhan tanaman jika dibandingkan dengan inokulasi menggunakan bakteri tunggal.
Biokontrol fitopatogen
Selain dapat memacu pertumbuhan tanaman, Bacillus sp. juga diketahui mampu mengendalikan beberapa patogen tular tanah. Bacillus sp dapat menghasilkan antibiotik yang mampu menekan pertumbuhan berbagai patogen tanaman. Bacillus sp. yang ditemukan pada tanaman putri malu mampu menghambat R. Solanacacerum penyebab penyakit layu bakteri pada tembakau secara in vitro. Hasil pengujian Bacillus sp. yang berasal dari rizosfer nilam di laboratorium menunjukkan bahwa beberapa isolat Bacillus sp. dapat menghambat pertumbuhan koloni R. solanacacerum dengan membentuk zona hambat 23-45 mm (Arwiyanto 1997; Nasrun & Nuryani 2007).
Interaksi mikroorganisme yang antagonis terhadap berbagai macam patogen tanaman memiliki peranan penting dalam keseimbangan mikroorganisme di dalam tanah, serta memberikan kontribusi sebagai agen biokontrol penyakit tanaman. Biokontrol tanaman bermanfaat dalam menurunkan dampak buruk pada tanaman akibat penggunaan bahan kimiawi seperti pestisida. Penggunaan fungisida dapat menyebabkan polusi lingkungan dan dimungkinkan menginduksi resistensi pada patogen. Bahan kimia ini juga dapat menyebabkan klorosis dan kelayuan pada semaian muda ( Jones RK 1985; Lim et al. 1991).
13
menginfeksi bermacam-macam inang. Infeksi tersebut menyebabkan berbagai macam penyakit, diantaranya: layu batang, kerdil tanaman, busuk akar, dan kematian masal pada kecambah. Adanya lapisan bening pada permukaan daun muda tanaman dan gugur daun pada daun tua merupakan gejala umum yang sering dijumpai pada tanaman yang telah terinfeksi oleh F. oxysporum. Pada tingkat semaian, setelah tanaman menunjukkan gejala tersebut diatas, tanaman akan layu dan mati dengan segera. Pada tanaman yang telah tua gejala ini ditunjukkan dengan adanya lapisan bening pada daun yang diikuti dengan kekerdilan, daun bawah menguning, pembentukan akar adventif, layu daun dan batang, gugur daun, nekrosis pada daun yang masih tersisa dan akhirnya terjadi kematian tanaman (Gonsalves et al. 1993).
Fusarium oxysporum dapat di kulturkan pada media potato dextrose agar
(PDA). Cendawan ini memperlihatkan penampakan yang berbeda yaitu pertama kali miselium aerial berwarna putih, dan kemudian berubah warna menjadi berbagai warna antara violet, abu-abu gelap tergantung pada galurnya. Ketika jumlah spora melimpah, cendawan ini akan berwarna krem atau oranye (Smith et al.1988; Gonsalves et al. 1993). F. oxysporum memproduksi tiga tipe spora aseksual: mikrokonidia, makrokonidia dan klamidospora. Cendawan ini menyerang tanaman pada bagian akar tanaman dengan menggunakan pembuluh saporangia dan miseliumnya. Serangan tersebut terjadi melalui ujung akar, luka pada akar atau melalui akar lateral. F. oxysporum menyebar melalui irigasi dan kontaminan dari peralatan pertanian, sedangkan pada jarak jauh penyebarannya melalui cangkokan tanaman yang terinfeksi (Agrios 1988; Gonsalves et al. 1993).
Telah banyak dilakukan penelitian tentang peran mikroorganisme yang menguntungkan misalnya Pseudomonas flourescent sebagai biokontrol terhadap
Fusarium sp. pada tanaman tomat. Streptomyces halstedii (K122) dan S. coloicolor (K139) berperan dalam menghambat cendawan, termasuk Oomycetes, Zigomycetes, Deuteromycetes, Ascomycetes dan Basidiomycetes (Frandberg & Schneur 1998). Bacillus subtilis memiliki kemampuan dalam menekan mikroorganisme fitopatogenik (Phae et al. 1990; Dikin et al. 2006). B. cepacia
rizosfer pisang sama-sama memiliki kemampuan menyerang F. oxysporum f. sp
cubense yang menginfeksi tanaman tersebut. B. cepacia menyerang cendawan tersebut dengan mengkolonisasi permukaan hifa dan makrospora (Pan et al. 1997; Dikin et al. 2006).
Terdapat sejumlah mikroorganisme yang mampu melawan Sclerotium rolfsii, diantaranya Trichoderma harzianum, T. Viride, Bacillus subtilis,
Penicillium spp dan Glicodium virens. Bacillus sp. selain mampu menghambat pertumbuhan F. oxysporum, juga mampu menghambat Sclerotium rolfsii. Cendawan ini menyebabkan busuk akar pada tanaman. Layu pada pucuk tanaman akibat adanya kerusakan ujung akar merupakan gejala infeksi oleh S. rolfsii. Fitopatogen ini dicirikan dengan pertumbuhan miselia yang menyerupai kapas dan adanya bulatan sklerotia berwarna coklat muda dan menjadi coklat gelap yang dihasilkan ketika tua. S. rolsfii menyerang tanaman pada kondisi tanah lembab dan pada kisaran temperatur 25 oC sampai 35 oC, serangan ini terjadi pada semaian. Terdapat sekitar 200 jenis tanaman yang merupakan inang dari cendawan ini, termasuk kedelai. Penyakit oleh S. rolfsii ini sulit dikontrol, penurunan pertumbuhannya bergantung pada kombinasi kultur yang digunakan sebagai biokontrolnya atau dengan metode kimia.
Rizobakteria merupakan kelompok penting dari PGPR yang memiliki aktivitas pemacuan pertumbuhan berbagai tanaman, diantaranya produksi IAA, dan siderofor, kelarutan fosfat serta sebagai agen biokontrol terhadap fitopatogen.
Macrophomins phaseolina, Fusarium oxysporum, F. solani, Rhizoctonia solani,
Pythium spp. merupakan fitopatogen yang pertumbuhannya dihambat oleh rizobakteria dengan memproduksi metabolit sekunder seperti antibiotik, siderofor, HCN dan fitoalexin ( Kumar et al. 2006).
Antibiotik merupakan dasar dari mekanisme biokontrol pada bakteri termasuk Bacillus sp.. Oligomycin A, kanosamine, zwittermicin A dan
xanthobaccin merupakan antibiotik yang diproduksi oleh Bacillus, Streptomycin
dan Stenothropomonas spp.. Senyawa amphisin, 2,4-diacetilploroglucinol
(DAPG), hydrogen cynide, oomycin A, phenazine, pyloluteorin, pyrrolnitrin,
15
cendawan. Kitinase yang diproduksi oleh Serratia marcescens digunakan untuk melawan Sclerotium rolsfii. Kitinase dan laminarinase yang disintesis oleh
Pseudomonas stutzeri berfungsi menghancurkan dan melisis miselia Fusarium solani. β-1,3-glukanase disintesis oleh Paenibacillus sp. galur 300 dan
Streptomyces sp. galur 385 yang melisis dinding sel Fusarium oxysporum f. Sp.
cucumerinum. Bacillus cepacia mensintesis β-1,3-glukanase untuk
menghancurkan dinding sel Rizoctonia solani, S. rolsfii, dan Pythium ultimum
(Chompant et al. 2005).
Besi merupakan elemen esensial bagi pertumbuhan semua organisme. Pada kondisi keterbatasan besi, bakteri memproduksi senyawa berberat molekul rendah yang disebut sebagai siderofor. Setiap jenis bakteri pemacu pertumbuhan tanaman memiliki siderofor dengan kemampuan yang berbeda-beda dalam mengkelat besi, pada umumnya bakteri tersebut mampu mengalahkan cendawan patogenik yang memiliki afinitas rendah terhadap besi. Biosintesis siderofor umumnya diatur oleh protein Fur yang memiliki sensitivitas terhadap besi. Faktor lingkungan seperti pH, tingkat ketersediaan besi, ketersediaan trace element, dan pasokan karbon, nitrogen dan fosfat yang memadai merupakan faktor lingkungan yang berpengaruh terhadap sintesis siderofor (Compant et al. 2005).
BAHAN DAN METODE
Isolasi dan Karakterisasi fisiologi Bacillus sp. secara Parsial
Sebanyak 0.5 gram sampel tanah rizosfer kedelai asal Cirebon dimasukkan ke dalam 4.5 ml akuades steril yang sudah terlarut NaCl 0.85% di dalamnya. Sampel divortek dan dipanaskan 80 oC selama 10 menit, sampel selanjutnya diencerkan berseri hingga pengenceran 10-6. Sebanyak 100 µl dari suspensi pengenceran disebar diatas media cawan agar-agar nutrien dengan komposisi (8 g NB, 20% agar-agar bacto dalam 1 liter akuades), menggunakan batang penyebar. Cawan selanjutnya diinkubasi selama 24 jam. Koloni yang tumbuh kemudian dimurnikan dengan menggunakan media yang sama.
Pewarnaan Gram, pewarnaan endospora dan uji katalase dilakukan mengikuti Bergey’s Manual of Determinative Bacteriology untuk menentukan isolat tersebut termasuk ke dalam kelompok Bacillus sp. Pewarnaan Gram menggunakan pereaksi ungu kristal, iodium, etanol 95% dan safranin sebagai pewarna tandingan. Pewarnaan endospora menggunakan pereaksi malakit hijau dan safranin. Hasil pewarnaan diamati bentuk sel dan warnanya dengan menggunakan mikroskop dengan perbesaran 1000 kali. Uji katalase dilakukan dengan menggunakan pereaksi hidrogen peroksida 3%. Ketiga uji tersebut dilakukan dengan menggunakan metode standar (Hadioetomo 1993).
Pengukuran Indole Acetic Acid (IAA)
Produksi IAA dilakukan dengan menggunakan metode standar yaitu dengan mengkulturkan terlebih dahulu 1 lup penuh isolat Bacillus sp. pada media
Nutrient Broth (NB) dengan penambahan L-Trp dan diinkubasi selama 48 jam. Tiap 1 jam dilakukan pengukuran kadar IAAnya. Pengukuran IAA ini digunakan untuk mengetahui waktu produksi IAA yang paling maksimal.
IAA yang diproduksi oleh Bacillus diukur dengan metode kolorimetri dengan menggunakan reagen Salkowski (Gordon & Weber 1951; Patten & Glick 2002) yang mengandung 150 ml H2SO4 pekat, 250 ml Aquades, 7.5 ml FeCl3.6
yang telah ditambahkan L-triptofan 0.2 mM dan kedalam 10 ml media Nutrient Broth tanpa penambahan L-triptofan. Kultur diinkubasi dan dikocok (150 rpm) pada suhu ruang selama 24 jam. Sebanyak 3 ml kultur dari tiap perlakuan dimasukkan kedalam 2 tabung mikro untuk kemudian disentrifugasi (10.000 rpm) selama 15 menit. Sebanyak 2 ml filtrat yang diperoleh dimasukkan ke dalam tabung reaksi steril dan ditambahkan 2 ml reagen Salkowski. Suspensi kemudian diinkubasi selama 60 menit dalam ruang gelap dan pada suhu ruang. Hal ini dilakukan sebelum diukur serapan IAA nya dengan menggunakan spektrometer (spectronic 20) pada panjang gelombang 510 nm.
Telaah Pemacuan Pertumbuhan Tanaman
Isolat Bacillus ditumbuhkan dalam agar-agar nutrien pada suhu ruang selama 24 jam. Inokulan yang akan diuji disiapkan dengan meresuspensikan sel dari cawan agar-agar tersebut ke dalam NB, untuk mencapai konsentrasi sel kira-kira 6.109 sel/ml. Sebanyak 9 kecambah yang telah berukuran 2-3 mm diletakkan di atas media agar-agar 1%. Tiap kecambah diinokulasikan dengan 100 μl
suspensi bakteri dan dilakukan sebanyak 3 kali ulangan. Sebagai kontrolnya dengan perlakuan yang sama menggunakan NB saja. Setelah 7 hari perlakuan, kemudian diamati dan diukur pertumbuhannya yang meliputi panjang batang, panjang akar utama dan jumlah akar lateral kemudian dibandingkan dengan kontrol (Dey at al. 2004). Hasil pengukuran dianalisis secara statistik dengan
one-way Analysis of Variance (ANOVA) dan diuji lanjut dengan Duncan
menggunakan software SAS.
Uji Kelarutan Fosfat
Uji ini dilakukan dengan menggunakan metode standar yaitu menggunakan medium Pikovskaya (Subba Rao & Shinta 1963; Subba Rao 1999), dengan komposisi glukosa 10 g, Ca3HPO4 5 g, (NH4)2SO4 0.5 g, KCl 0.2 g,
MgSO4.7H2O 0.1 g, ekstrak khamir 0.5 g, MnSO4 25 mgdanFeSO4 25 mg, serta
18
Produksi Siderofor
Produksi siderofor oleh Bacillus sp. diuji dengan metode Chrome Azurol Sulfonate (CAS) agar (Alexander & Zuberer 1999; Husen 2003) dengan modifikasi larutan garam. Larutan 1 (larutan indikator Fe-CAS) mengandung 10 ml (1mM FeCl3.6H2O didalam 10 mM HCl), 50 ml larutan CAS (1.21 mg ml-1),
dan 40 ml larutan hexadecyl-trimetylammonium bromide (HDTMA) (1.82 mg ml
-1
). Larutan 2 merupakan larutan buffer, disiapkan dengan melarutkan 30.24 g PIPES (peperazine-N,N’-bis[2-ethanesulfonic acid]) kedalam 750 ml larutan
garam (3 gr KH2PO4, 5 g NaCl, 10 g NH4Cl, 20 mM MgSO4, 1 mM CaCl2).
Akuades ditambahkan untuk mencapai volume larutan 800 ml sebelum diukur pH nya hingga 6.8 dengan 50% KOH, kemudian 20 g agar-agar bacto ditambahkan sebelum diautoklaf. Larutan 3 mengandung 2 g glukosa, 2 g manitol dan mikro elemen ( 493 mg MgSO4.7H2O, 11 mg CaCl2, 1.17 mg MnSO4.H2O, 1.4 mg
H3BO3, 0.04 mg CuSO4.5H2O, 1.2 mg ZnSO4.7H2O dan 1.0 mg NaMoO4.2H2O)
didalam 70 ml akuades. Larutan 4 berupa 30 ml 10% (w:v) cassamino acid yang disteril dengan membran milipor 0.45 µm. Media ini dibuat dengan
mencampurkan larutan 2 dan 4 pada suhu 50 οC setelah sterilisasi, kemudian ditambahkan larutan 3 dan larutan 1 secara perlahan-lahan dan dilakukan homogenisasi dengan menggunakan stirer. Isolat yang telah diremajakan terlebih dahulu, diuji dengan cara ditotol atau digores pada media agar CAS dengan dua ulangan. Isolat yang mampu memproduksi siderofor akan menghasilkan zona berwarna oranye disekitar koloni setelah diinkubasi selama 24 sampai 72 jam.
Uji Antagonis Fitopatogen
HASIL
Isolasi dan Karakterisasi Fisiologi secara Parsial
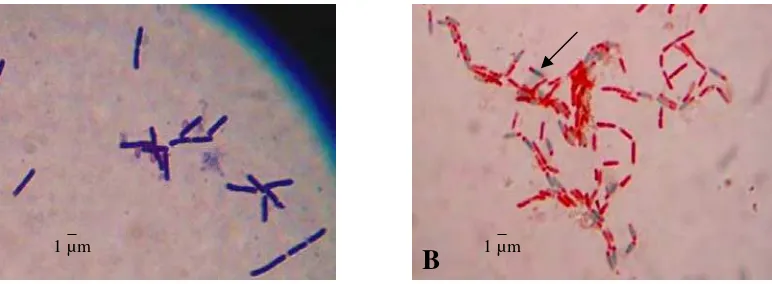
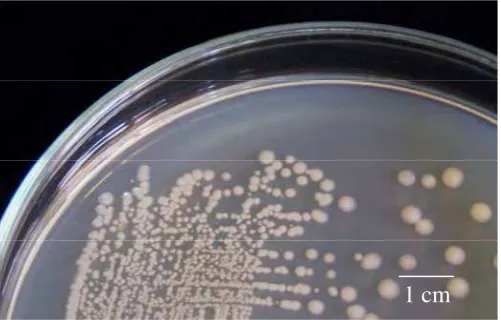
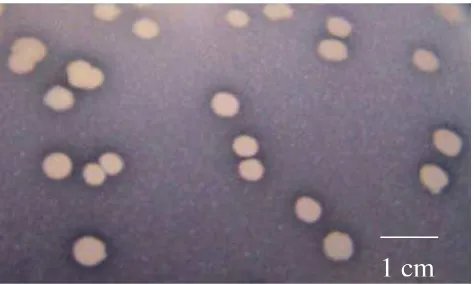
Sebanyak 118 isolat Bacillus sp. yang berasal dari rizosfer kedelai asal Cirebon, Jawa Barat telah berhasil diisolasi. Isolat-isolat ini memiliki karakteristik parsial Gram positif, bentuk sel batang dengan ukuran dan penataan yang berbeda-beda, dan membentuk endospora dengan bentuk dan letak yang bervariasi (Gambar 2) serta menunjukkan reaksi katalase positif. Koloni isolat Bacillus sp. ini memiliki bentuk bervariasi antara bulat sampai bundar tak beraturan dengan tepian licin, berlekuk dan berombak, dengan elevasi datar, cembung, timbul dan berbukit. Koloni memiliki warna putih, krem muda sampai krem tua seperti ditunjukkan pada Gambar 3.
−
1 µm
A
B
−
[image:45.595.127.513.353.495.2]1 µm
Gambar 2 Penampilan sel Bacillus sp. menunjukkan (A) Gram positif berbentuk batang pada perbesaran 1000 kali, (B) Endospora (hijau, anak panah)
Bacillus sp. pada perbesaran 1000 kali.
Pengukuran Indole Acetic Acid (IAA)
rata-rata konsentrasi IAA sedang 19,12 ppm, dan rata-rata konsentrasi IAA tinggi mencapai 67.29 ppm.
[image:46.595.193.444.139.299.2]1 cm
Gambar 3 Penampilan koloni isolat Bacillus sp. Cr-4 pad media Nutrien agar yang diinkubasi pada suhu ruang selama 24 jam.
Pada media kultur tanpa penambahan L-Trp, rata-rata konsentrasi IAA tertinggi 13.05 ppm, rata-rata konsentrasi IAA sedang 6.47 ppm dan 0.165 ppm merupakan rata-rata konsentrasi IAA terendah. Isolat Bacillus sp. Cr-4 diketahui menghasilkan IAA tertinggi yaitu 86.82 ppm pada media kultur yang ditambah L-Trp. Konsentrasi IAA pada kultur Bacillus sp. yang ditumbuhkan pada media dengan penambahan L-Trp umumnya lebih tinggi dari pada konsentrasi IAA pada kultur yang ditumbuhkan pada media tanpa penambahan L-Trp. Pengukuran IAA dilakukan berdasarkan perubahan warna supernatan setelah ditambah reagen Salkowski dan diinkubasi. Perubahan warna terjadi dari kuning menjadi warna merah muda sampai kecoklatan. Isolat Bacillus sp. (Cr-4) mulai mensintesis IAA pada fase log dan berpotensi maksimal dalam memproduksi IAA pada jam ke-25, pada fase stasioner (Gambar 4).
22
Gambar 4 Kurva pertumbuhan dan produksi Indole acetic acid isolat Bacillus sp. Cr-4. 0 50 100 150 200 250 300 350 400
0 10 20 30 40
Waktu (jam) J u m la h s el ( se l/m l) .1 0 ^ 6 0 2 4 6 8 10 12 14 16 18 K o n se n tr a si I A A (p p m )
: Pertumbuhan Cr-4 di dalam media NB dengan penambahan L-Trp, : Produksi Indole acetic acid oleh Cr-4 di dalam media NB dengan
penambahan L-Trp.
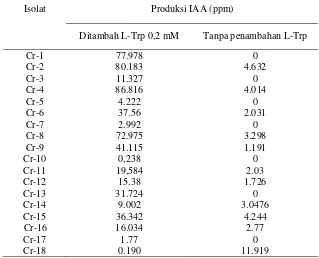
Tabel 1 Produksi Indole acetic acid (IAA) oleh isolat Bacillus sp. asal rizosfer kedelai
Isolat Produksi IAA (ppm)
Ditambah L-Trp 0,2 mM Tanpa penambahan L-Trp
Cr-1 77.978 0
Cr-2 80.183 4.632
Cr-3 11.327 0
Cr-4 86.816 4.014
Cr-5 4.222 0
Cr-6 37.56 2.031
Cr-7 2.992 0
Cr-8 72.975 3.298
Cr-9 41.115 1.191
Cr-10 0,238 0
Cr-11 19,584 2.03
Cr-12 15.38 1.726
Cr-13 31.724 0
Cr-14 9.002 3.0476
Cr-15 36.342 4.244
Cr-16 16.034 2.77
Cr-17 1.77 0
[image:47.595.146.465.499.757.2]Tabel 1 (Lanjutan)
Isolat Produksi IAA (ppm)
Ditambah L-Trp 0,2 mM Tanpa penambahan L-Trp
Cr-19 0.331 2.364
Cr-20 15.740 16.117
Cr-21 2.320 0,165
Cr-22 3.776 1,283
Cr-23 2.792 11.521
Cr-24 0.516 1.854
Cr-25 4.904 1,462
Cr-26 1.681 14.271
Cr-27 12.414 9.050
Cr-28 1.476 12.903
Cr-29 0.371 12.705
Cr-30 5.002 3.031
Cr-31 4.583 0
Cr-32 0.367 0.277
Cr-33 0.607 11.931
Cr-34 7.195 2.426
Cr-35 3.185 7.085
Cr-36 13.827 13.132
Cr-37 18.625 1.258
Cr-38 9.960 1.567
Cr-39 3.368 3.079
Cr-40 15.764 4.693
Cr-41 0.371 0.208 Cr-42 8.860 3.397
Cr-43 5.496 3.964
Cr-44 1.521 0
Cr-45 1.751 1.558
Cr-46 11.126 4.672
Cr-47 4.671 2.061
Cr-48 9.687 0
Cr-49 3.659 0
Cr-50 6.378 0
Cr-51 4.723 0
Cr-52 5.197 0
Cr-53 10.417 0
Cr-54 18.367 1.567
Cr-55 44.662 5.035
Cr-56 0.441 1.271
Cr-57 0.148 0
Cr-58 13.560 0.994
Cr-59 1.733 1.733
Cr-60 0.975 0
Cr-61 4.317 3.682
Cr-62 2.259 1.344
Cr-63 3.429 1.704
Cr-64 7.560 0
Cr-65 4.324 5.902
Cr-66 3.022 2.381
Cr-67 0.814 0.416
Cr-68 0.865 1.124
Cr-69 4.317 0.385
Cr-70 0.692 1.730
Cr-71 9.630 4.318
[image:48.595.144.470.107.756.2]24
Tabel 1 (Lanjutan)
Isolat Produksi IAA (ppm)
Ditambah L-Trp 0,2 mM Tanpa penambahan L-Trp
Cr-74 2.173 4.631
Cr-75 13.014 2.415
Cr-76 9.228 3.140
Cr-77 10.507 3.410
Cr-78 32.837 1.258
Cr-79 1.818 0
Cr-80 18.440 3.493
Cr-81 6.440 6.200
Cr-82 9.420 0
Cr-83 2.504 0
Cr-84 30.295 3.280
Cr-85 1.428 1.634
Cr-86 12.818 5.602
Cr-87 3.342 0
Cr-88 6.37 1.038
Cr-89 0.238 0
Cr-90 22.787 4.010
Cr-91 20.321 3,41
Telaah Pemacuan Pertumbuhan Tanaman
Dari 90 isolat Bacillus sp. tersebut diatas, selain memiliki kemampuan mensintesis IAA beberapa diantaranya memiliki kemampuan dalam memacu pertumbuhan tanaman melalui pemacuan perpanjangan akar primer, batang, dan akar lateral (Tabel 1). Penampilan kecambah tanaman kedelai yang diinokulasi dengan salah satu isolat Bacillus sp., yaitu Cr-69 yang secara signifikan memacu pemanjangan akar primer dan jumlah akar lateral, terlihat pada Gambar 5.
[image:49.595.140.465.96.323.2]Gambar 5 Penampilan kecambah kedelai berumur 7 hari dari hasil inokulasi dengan Bacillus sp. Cr-69 (A) dan tanpa inokulasi dengan Cr-69 (kontrol hanya diinokulasi dengan NB) (B).
A
B
Uji Kelarutan Fosfat
Sebanyak 76 isolat Bacillus sp. mampu melarutkan fosfat yang terlarut di dalam media Pikovskaya. Media ini berwarna putih, zona bening di sekitar koloni sebaran maupun totolan isolat Bacillus sp. menunjukkan adanya aktivitas melarutkan fosfat seperti pada Gambar 6. Pada hari ke-4 zona ini sudah dapat diamati dengan jelas, semakin lama waktu inkubasi zona terlihat semakin jelas dan lebar.
[image:50.595.204.441.539.681.2]1 cm
26
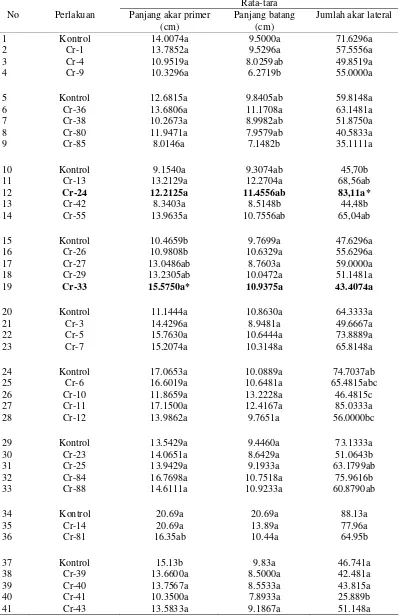
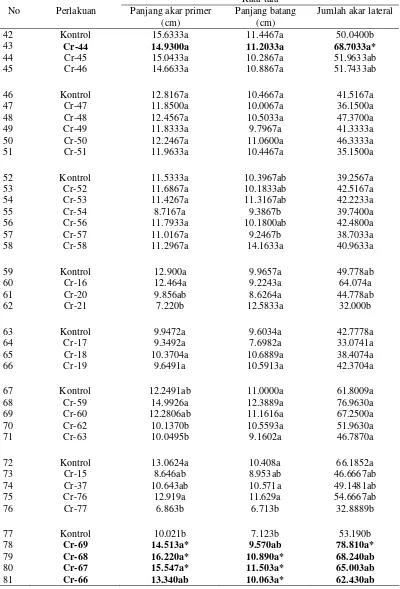
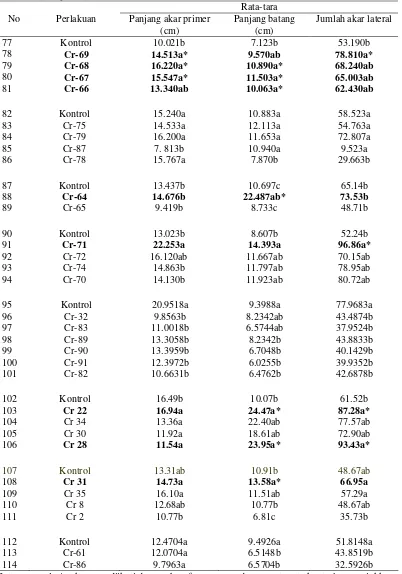
Tabel 2 Pengaruh inokulasi Bacillus sp. dalam memacu pertumbuhan akar primer, batang, dan jumlah akar lateral kecambah kedelai kultivar Slamet
Rata-tara No Perlakuan Panjang akar primer
(cm)
Panjang batang (cm)
Jumlah akar lateral
1 Kontrol 14.0074a 9.5000a 71.6296a 2 Cr-1 13.7852a 9.5296a 57.5556a 3 Cr-4 10.9519a 8.0259ab 49.8519a 4 Cr-9 10.3296a 6.2719b 55.0000a
5 Kontrol 12.6815a 9.8405ab 59.8148a 6 Cr-36 13.6806a 11.1708a 63.1481a 7 Cr-38 10.2673a 8.9982ab 51.8750a 8 Cr-80 11.9471a 7.9579ab 40.5833a 9 Cr-85 8.0146a 7.1482b 35.1111a
10 Kontrol 9.1540a 9.3074ab 45,70b 11 Cr-13 13.2129a 12.2704a 68,56ab
12 Cr-24 12.2125a 11.4556ab 83,11a*
13 Cr-42 8.3403a 8.5148b 44,48b 14 Cr-55 13.9635a 10.7556ab 65,04ab
15 Kontrol 10.4659b 9.7699a 47.6296a 16 Cr-26 10.9808b 10.6329a 55.6296a 17 Cr-27 13.0486ab 8.7603a 59.0000a 18 Cr-29 13.2305ab 10.0472a 51.1481a
19 Cr-33 15.5750a* 10.9375a 43.4074a
20 Kontrol 11.1444a 10.8630a 64.3333a 21 Cr-3 14.4296a 8.9481a 49.6667a 22 Cr-5 15.7630a 10.6444a 73.8889a 23 Cr-7 15.2074a 10.3148a 65.8148a
24 Kontrol 17.0653a 10.0889a 74.7037ab 25 Cr-6 16.6019a 10.6481a 65.4815abc 26 Cr-10 11.8659a 13.2228a 46.4815c 27 Cr-11 17.1500a 12.4167a 85.0333a 28 Cr-12 13.9862a 9.7651a 56.0000bc
29 Kontrol 13.5429a 9.4460a 73.1333a 30 Cr-23 14.0651a 8.6429a 51.0643b 31 Cr-25 13.9429a 9.1933a 63.1799ab 32 Cr-84 16.7698a 10.7518a 75.9616b 33 Cr-88 14.6111a 10.9233a 60.8790ab
34 Kontrol 20.69a 20.69a 88.13a 35 Cr-14 20.69a 13.89a 77.96a 36 Cr-81 16.35ab 10.44a 64.95b
Tabel 2 (Lanjutan)
Rata-tara No Perlakuan Panjang akar primer
(cm)
Panjang batang (cm)
Jumlah akar lateral
42 Kontrol 15.6333a 11.4467a 50.0400b
43 Cr-44 14.9300a 11.2033a 68.7033a*
44 Cr-45 15.0433a 10.2867a 51.9633ab 45 Cr-46 14.6633a 10.8867a 51.7433ab
46 Kontrol 12.8167a 10.4667a 41.5167a 47 Cr-47 11.8500a 10.0067a 36.1500a 48 Cr-48 12.4567a 10.5033a 47.3700a 49 Cr-49 11.8333a 9.7967a 41.3333a 50 Cr-50 12.2467a 11.0600a 46.3333a 51 Cr-51 11.9633a 10.4467a 35.1500a
52 Kontrol 11.5333a 10.3967ab 39.2567a 53 Cr-52 11.6867a 10.1833ab 42.5167a 54 Cr-53 11.4267a 11.3167ab 42.2233a 55 Cr-54 8.7167a 9.3867b 39.7400a 56 Cr-56 11.7933a 10.1800ab 42.4800a 57 Cr-57 11.0167a 9.2467b 38.7033a 58 Cr-58 11.2967a 14.1633a 40.9633a
59 Kontrol 12.900a 9.9657a 49.778ab 60 Cr-16 12.464a 9.2243a 64.074a 61 Cr-20 9.856ab 8.6264a 44.778ab 62 Cr-21 7.220b 12.5833a 32.000b
63 Kontrol 9.9472a 9.6034a 42.7778a 64 Cr-17 9.3492a 7.6982a 33.0741a 65 Cr-18 10.3704a 10.6889a 38.4074a 66 Cr-19 9.6491a 10.5913a 42.3704a
67 Kontrol 12.2491ab 11.0000a 61.8009a 68 Cr