PENGARUH AERASI TERHADAP PRODUKSI BIOPESTISIDA OLEH Pseudomonas putida MENGGUNAKAN SUBSTRAT LIMBAH CAIR TAHU
Oleh Nunung Hartati
F34052921
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PENGARUH AERASI TERHADAP PRODUKSI BIOPESTISIDA OLEH Pseudomonas putida MENGGUNAKAN SUBSTRAT LIMBAH CAIR TAHU
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian bogor
Oleh
NUNUNG HARTATI F34052921
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
JUDUL SKRIPSI :PENGARUH AERASI TERHADAP PRODUKSI BIOPESTISIDA OLEH Pseudomonas putida
MENGGUNAKAN SUBSTRAT LIMBAH CAIR TAHU
NAMA : NUNUNG HARTATI
NRP : F34052921
Menyetujui, Bogor, April 2010
Mengetahui, Kepala Departemen
Prof.Dr.Ir. Nastiti Siswi Indrasti NIP : 19621009198903 2 001
Tanggal Lulus : 25 Maret 2010 PEMBIMBING I
Prof.Dr.Ir. Khaswar Syamsu, MSc. NIP :19630817198803 1 003
PEMBIMBING II
Nunung Hartati F34052921. Pengaruh Aerasi terhadap Produksi Biopestisida oleh Pseudomonas putida Menggunakan Substrat Limbah Cair Tahu. Di bawah Bimbingan Khaswar Syamsu dan Rita Harni. 2010.
RINGKASAN
Biopestisida adalah pestisida yang mengandung mikroorganisme seperti bakteri, virus dan jamur. Biopestisida sudah banyak digunakan untuk mengendalikan hama dan penyakit tanaman, salah satu diantaranya adalah bakteri endofit untuk mengendalikan nematoda peluka akar Pratylenchus brachyurus pada nilam. Bakteri endofit adalah bakteri yang hidup mengkolonisasi jaringan bagian dalam tanaman tanpa menyebabkan gangguan pada tanaman tersebut. Diantara bakteri endofit yang telah digunakan sebagai biopestisida adalah Pseudomonas putida yang dikenal dapat menghasilkan antibiotika dan siderofor, yang mampu menekan pertumbuhan patogen tular-tanah.
Bahan yang digunakan sebagai media kultivasi P. putida adalah limbah cair tahu, karena limbah cair tahu masih mengandung bahan organik seperti protein, lemak, dan karbohidrat. Bahan-bahan tersebut dibutuhkan oleh bakteri untuk pertumbuhannya. Selain komponen medium, kultivasi sangat ditentukan oleh kelarutan oksigen (aerasi). Fungsi utama aerasi untuk memasok kebutuhan oksigen bagi aktivitas metabolisme mikroba dan mengaduk mikroba supaya tersuspensi secara homogen di dalam media.
Tujuan penelitian ini adalah memproduksi biopestisida dari P. putida
menggunakan substrat limbah cair tahu, dan menentukan pengaruh aerasi terhadap bobot biomassa dalam produksi biopestisida.
Metode penelitian dimulai dengan persiapan media kultivasi, persiapan inokulum pada media TSA dan TSB, kemudian inokulum tersebut di kultivasi pada substrat limbah cair tahu pada bioreaktor kolom gelembung dengan laju yang berbeda-beda. Laju aerasi yang digunakan pada penelitian ini adalah 0,5, 1, 1,5 vvm. Selama proses kultivasi, dilakukan pengukuran pH, optical density, bobot kering biomassa, dan kadar gula sisa. Setelah itu, pada akhir kultivasi dilakukan uji toksisitas terhadap nematoda P. brachyurus. Rancangan percobaan adalah rancangan acak lengkap dengan satu faktor yaitu laju aerasi.
Nunung Hartati F34052921. Aeration Effect to Biopesticide Production from Pseudomonas putida Using Tofu Waste Substrate. Supervised by Khaswar Syamsu and Rita Harni. 2010.
SUMMARY
Biopesticides is pesticide containing microorganism like bacteria, viruses, and fungal that are used to control pest. Biopesticides from endophitic bacteria are used to control nematode P. brachyurus. Endophitic bacteria are bacteria that colonize plant tissue without disturbing the plant. Pseudomonas putida is one of the endophitic bacteria that have the potency to control soil borne pathogen with antibiotics and siderophore from their activities.
One of substrates that can be used as cultivation media is tofu waste. This waste come from filtration of soybean extract to make tofu through protein fractionation of soybean extract. This substrate contain organic material such as protein, fat, carbohydrate, and others which are useful for bacteria growth. One of the important factors for aerobic cultivation is aeration. The main function of aeration is as oxygen source to bacterial metabolism and homogenity on the medium.
The objectives of this research are to produce biopesticides from
Pseudomonas putida using tofu waste as substrate, and to determine aeration effect to bacteria biomass on production of biopesticides.
The first step of this research is cultivation of medium test. The second step is preparation of inoculums using TSA (Tryptic soybean agar) and TSB (Tryptic soybean broth). After that the inoculums are cultivated on tofu waste substrate using bubble column bioreactor with aeration of 0,5, 1, 1,5 vvm. The parameters from this research are pH, OD (optical density), bacteria biomass dry weight, and residual sugar. The last step is toxicity test to nematode P. brachyurus. Completely randomized factorial design test with aeration as factor is used in this research
The result showed that tofu waste can be used as substrate to P. putida
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi yang berjudul “PENGARUH AERASI TERHADAP PRODUKSI BIOPESTISIDA OLEH Pseudomonas putida MENGGUNAKAN SUBSTRAT LIMBAH CAIR TAHU“ adalah karya asli saya sendiri, dengan arahan dosen pembimbing akademik, kecuali yang dengan jelas ditujukan rujukannya.
Bogor, April 2010
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Ciamis tanggal 23 Maret 1987. Penulis anak ketiga dari tiga bersaudara dengan Ayah bernama S.Sutarso dan Ibu bernama Titi Sumiati.
Penulis mulai menempuh pendidikan pada tahun 1992-1994 di TK.PGRI, kemudian melanjutkan pendidikannya di SD. CIBODAS tahun 1994-1999. Penulis kembali melanjutkan pendidikannya di SLTP 1 Banjar tahun 1999-2002, kemudian melanjutkan pendidikannya di SMU 1 Banjar tahun 2002-2005. Pada tahun 2005 penulis diterima di Institut Pertanian Bogor ( IPB ) melalui jalur USMI ( Ujian Seleksi Masuk IPB ).
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allat SWT, yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “PENGARUH AERASI PADA PRODUKSI BIOPESTISIDA OLEH Pseudomonas putida MENGGUNAKAN SUBSTRAT LIMBAH CAIR TAHU“. Skripsi ini disusun berdasarkan hasil penelitian yang penulis lakukan selama 4 bulan sejak bulan September sampai Desember 2009.
Selama melakukan penelitian sampai tersusunnya skripsi ini, penulis banyak mendapat bimbingan, petunjuk dan bantuan dari berbagai pihak. Pada kesempatan ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Bapak, Ibu dan Kakak-kakakku tercinta yang telah memberikan kasih sayang dan dorongan selama penulis melakukan penelitian dan penyusunan skripsi ini.
2. Prof. Dr. Ir. Khaswar Syamsu, MSc., dan Dra. Rita Harni, MSi., Selaku dosen pembimbing penulis yang telah memberikan bimbingan, pengarahan dan saran selama penelitian dan penyusunan skripsi ini.
3. Drs. Purwoko,MSi selaku dosen penguji atas saran dan masukannya.
4. Ibu Rini yang telah banyak membantu penulis dalam menyelesaikan skripsi. 5. Mbak Pepi, Mbak Emi, Mbak Nia, Mbak Ara, Pa Asep, Pa Yanto, Pa Iri, Ibu
Ika, Ibu Enny dan teman-teman di RBP ( mbak Yhaya, Mbak Fatma, Mas Daud, dan Prima) yang telah banyak membantu dan setia menemani penulis selama penelitian.
10. Teh Rini, Nidia (Dugong), Mbak Iffan, Puput, Juli, dan teman-teman di Pondok Ami atas bantuannya terhadap penulis.
11. Mbak Didi, Mbak Herma, Lea, Nova, Dita dan semua teman-teman yang ada di Wisma Padasuka.
Saran, kritik dan tanggapan dari semua pihak sangat penulis harapkan. Semoga karya ini dapat bermanfaat bagi pihak yang membutuhkan.
DAFTAR ISI
II. TINJAUAN PUSTAKA ... 3
A. BIOPESTISIDA ... 3
B. LIMBAH CAIR TAHU ... 4
C. Pseudomonas putida ... 6
D. NEMATODA Pratylenchus brachyurus ... 8
E. AERASI DAN BIOREAKTOR KOLOM GELEMBUNG ... 12
F. KINETIKA FERMENTASI ... 13
III. METODOLOGI PENELITIAN ... 16
A. ALAT DAN BAHAN ... 16
B. WAKTU DAN TEMPAT PENELITIAN ... 16
C. METODE PENELITIAN ... 16
1. Persiapan Medium Fermentasi ... 16
2. Persiapan Inokulum ... 17
3. Proses kultivasi Produksi Biopestisida ... 17
4. Pengambilan Contoh ( Sampling )... 18
C. ANALISIS PARAMETER ... 18
D. RANCANGAN PERCOBAAN ... 19
IV. HASIL DAN PEMBAHASAN ... 20
A. PENGUJIAN AWAL MEDIA KULTIVASI ... 20
B. PENGARUH LAJU AERASI ... 20
1. Pola Perubahan pH ... 20
3. Uji Toksisitas ... 25
C. KINETIKA FERMENTASI ... 26
V. KESIMPULAN DAN SARAN ... 28
A. KESIMPULAN ... 28
B. SARAN ... 28
DAFTAR PUSTAKA ... 29
DAFTAR TABEL
Tabel 1. Komposisi Limbah Cair Tahu ...6
Tabel 2. Karakteristik Fisika Limbah Cair Tahu ...6
Tabel 3. Klasifikasi Bakteri Pseudomonas putida ...7
Tabel 4. Klasifikasi Bakteri P. brachyurus ...9
Tabel 5. Kombinasi Perlakuan ...18
Tabel 6. Kadar karbon dan kadar nitrogen dalam limbah cair tahu...20
DAFTAR GAMBAR
Gambar 1. Diagram Alir Pembuatan Tahu ... 5
Gambar 2. Gambar Pseudomonas putida ... 7
Gambar 3. Pratylenchus brachyurus ... 10
Gambar 4. Siklus Hidup Pratylenchus brachyurus ... 11
Gambar 5. Bioreaktor Kolom Gelembung (swarancang) ... 13
Gambar 6. Diagram Alir Proses Persiapan Medium Fermentasi... 17
Gambar 7. Diagram Alir Persiapan Inokulum ... 17
Gambar 8. Diagram Alir Proses Fermentasi ... 19
Gambar 9. Grafik Hubungan Antara pH dan Waktu Fermentasi ... 21
Gambar 10. Grafik Hubungan Antara Biomassa dan Total Gula Sisa ... 22
Gambar 11. Grafik Efisiensi Penggunaan Substrat Pada Saat Biomassa Maksimum (Xmax)PadaSemua Perlakuan...24
DAFTAR LAMPIRAN
Lampiran 1. Metode Analisis Pra-Kultivasi ... 33
Lampiran 2. Metode Analisa Selama Kultivasi ... 35
Lampiran 3. Uji Toksisitas Biopestisida ... 38
Lampiran 4. Rekapitulasi Data pH Rata-rata Selama Kultivasi ... 39
Lampiran 5. Rekapitulasi Data Bobot Kering Biomassa (g/l) Rata-rata Selama Kultivasi ... 40
Lampiran 6. Rekapitulasi Data Total Gula Sisa (g/l) Selama Kultivasi ... 41
Lampiran 7. Rekapitulasi Data Uji Toksisitas ... 42
Lampiran 8. Hasil Analisa Ragam Uji F dan Uji Lanjut Duncan Terhadap Nilai pH (α= 0,05)...43
Lampiran 9. Hasil Analisa Ragam Uji F dan Uji Lanjut Duncan Terhadap Nilai Bobot Kering Biomassa (α=0,05)...45
I. PENDAHULUAN
A. LATAR BELAKANG
Biopestisida adalah pestisida yang mengandung mikroorganisme seperti bakteri, virus dan jamur. Biopestisida tidak menimbulkan resistensi terhadap hama target, bersifat alami dan relatif aman bagi lingkungan, manusia dan hama non target. Biopestisida dapat digunakan untuk mengendalikan nematoda peluka akar
Pratylenchus brachyurus pada tanaman nilam. Serangan nematoda P. brachyurus
pada tanaman nilam menyebabkan pertumbuhan tanaman terhambat, warna daun merah atau kekuning-kuningan dan menyebabkan luka nekrosis pada akar rambut dan kadang-kadang akar membusuk ( Mustika et al.,1995 ).
Salah satu biopestisida yang digunakan untuk pengendalian P. brachyurus
adalah bakteri endofit. Bakteri endofit adalah bakteri yang hidup mengkolonisasi jaringan bagian dalam tanaman tanpa menyebabkan gangguan pada tanaman tersebut. Harni et al (2007) melaporkan, bahwa bakteri endofit yang berasal dari perakaran nilam dapat mengendalikan nematoda P. brachyurus 73,9% pada tanaman nilam di rumah kaca.
Limbah cair tahu yaitu hasil samping proses pembuatan tahu yang masih mengandung karbon dan nitrogen. Limbah cair tahu ini dapat dimanfaatkan sebagai substrat pembuatan biopestisida karena masih mengandung nutrisi seperti bahan organik berupa protein, lemak, karbohidrat dan bahan an organik (Ca, Fe, Cu, Na, N, P, K, Cl, Mg) yang dapat digunakan untuk pertumbuhan mikroba. Menurut Winarno (2002) dari 0,45 kg kedelai dapat menghasilkan 3,6 kg tahu dan limbah cair tahu sebanyak 3,78 l. Menurt BPS (2001) jumlah anggota produsen tahu di Indonesia sebanyak 10094, setiap anggota membutuhkan kedelai 5000 ton per tahunnya, sehingga dapat diperkirakan jumlah limbah cair tahu dalam setiap tahun menghasilkan 40000 m3. Hal tersebut menjadi salah satu alasan pemanfaatan limbah cair tahu sebagai media kultivasi.
mikroba, juga untuk mengaduk mikroba supaya tersuspensi secara homogen di dalam media (Gumbira-Said, 1987).
B. Tujuan
Penelitian ini bertujuan untuk :
1. Memproduksi biopestisida dari Pseudomonas putida menggunakan substrat limbah cair tahu
II. TINJAUAN PUSTAKA
A. BIOPESTISIDA
Biopestisida adalah pestisida yang mengandung mikroorganisme seperti bakteri, virus dan jamur. Biopestisida tidak menimbulkan kekebalan atau resistensi terhadap hama target, aman bagi lingkungan, manusia dan hama non target. Berbagai biopestisida telah dilaporkan dapat mengendalikan hama dan penyakit tanaman, diantaranya :
1. Insektisida biologi (Bioinsektisida)
Berasal dari mikroba yang digunakan sebagai insektisida. Mikroorganisme yang menyebabkan penyakit pada serangga tidak dapat menimbulkan gangguan terhadap hewan-hewan lainnya maupun tumbuhan. Jenis mikroba yang akan digunakan sebagai insektisida harus mempunyai sifat yang spesifik artinya harus menyerang serangga yang menjadi sasaran dan tidak pada jenis-jenis lainnya.
Pada saat ini insektisida biologi sudah digunakan dan diperdagangkan secara luas. Mikroba yang berpotensi sebagai insektisida biologi salah satunya adalah
Bacillus thuringiensis. B. thuringiensis var. kurstaki telah diproduksi sebagai insektisida biologi dan diperdagangkan dalam berbagai nama seperti Dipel, Sok-Bt, Thuricide, Certan dan Bactospeine. Sedangkan B. thuringiensis var. israelensis
dengan nama dagang Bactimos, BMC, Teknar dan Vektobak. Insektisida ini efektif untuk membasmi larva nyamuk dan lalat (Sastroutomo, 1992).
Jenis insektisida biologi yang lain adalah yang berasal dari protozoa, Nosema locustae, yang telah dikembangkan untuk mengendalikan belalang dan jengkerik. Nama dagangnya adalah NOLOC, Hopper Stopper, sdangkan nematoda yang pertama kali didaftarkan sebagai insektisida ialah Neoplectana carpocapsae, yang diperdagangkan dengan nama Spear, Saf-T-Shield. Insektisida ini digunakan untuk membunuh rayap (Sastroutomo, 1992).
2. Herbisida biologi (Bioherbisida)
mengendalikan Morrenia odorata, gulma pada tanaman jeruk. Bioherbisida yang kedua dengan menggunakan Colletotrichum gloeosporioides yang diperdagangkan dengan nama Collego dan digunakan pada tanaman padi dan kedelai di Amerika (Sastroutomo, 1992).
3. Fungisida biologi (Biofungisida)
Biofungisida yang dipakai untuk mengendalikan penyakit jamur. Beberapa biofungisida yang telah digunakan adalah spora Trichoderma sp. untuk mengendalikan penyakit akar putih pada tanaman karet dan layu fusarium pada cabai dengan merek dagang Saco P dan Biotri P (Novizan, 2002).
Biofungisida lainnya menurut Novizan (2002), yaitu kelompok Gliocladium yaitu G. roseum dan G. virens. Produk komersialnya dengan merek dagang Ganodium P yang direkomendasikan untuk mengendalikan busuk akar pada cabai akibat serangan jamur Sclerotium rolfsii dan B. subtilis untuk mengendalikan serangan jamur Fusarium sp. pada tanaman tomat. Bakteri ini telah diproduksi secara masal dengan merek dagang Emva dan Harmoni BS (Novizan, 2002).
B. LIMBAH CAIR TAHU
Gambar 1. Diagram alir pembuatan tahu (Moertinah dan Djarwanti, 2003)
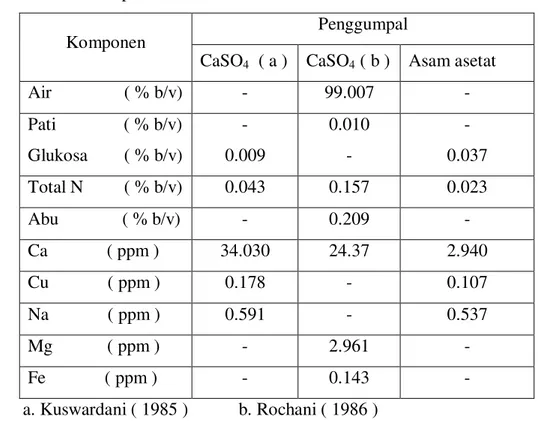
Tabel 1. Komposisi limbah cair tahu
Tabel 2. Karakteristik fisika limbah cair tahu
No Karakteristik Hasil Pengukuran
1 Suhu 37-45°C
2 Padatan terendap 175-190 mg/l
3 Padatan tersuspensi 635-660 mg/l
4 Padatan total 810-850 mg/l
5 Warna 2225-2250 Pt.co
6 Amonia-Nitrogen 23,3-23,5 mg/l
7 Nitrit-Nitrogen 3,5-4,0 mg/l
8 Nitrat-Nitrogen 32-40 mg/l
9 pH 4-6
10 Kebutuhan oksigen biologi (BOD) 6000-8000 mg/l 11 kebutuhan oksigen kimia (COD) 7500-14000 mg/l ( Nurhasan,1987)
C. Pseudomonas putida
kelompok gamma, bersama P. aeroginosa, P. putida, dan P. syringae yang disebut subkelompok flourescens. Pada penelitian ini menggunakan Pseudomonas putida
untuk memproduksi biopestisida.
Bakteri antagonis P. putida termasuk ke dalam genus Pseudomonas, yang berbentuk lengkung batang atau ramping berukuran ( 0,5-1,0) x ( 1,5-5,0 ) µm dan bergerak dengan satu atau beberapa flagelum polar. Bakteri ini bersifat gram negatif, aerob, berjenis metabolisme respirasi dengan oksigen sebagai penerima elektron akhir. Golongan bakteri antagonis ini tidak mempunyai fase istirahat, tidak fermentasi, katalase positif, dan mempunyai pigmen hijau, biru, ungu, merah muda, atau kuning yang menyebar terutama pada medium kaya zat besi, dan beberapa spesies tidak berpigmen. Bakteri juga bersifat kemolitotrof fakultatif, menggunakan CO2 dan bahan organik sebagai sumber energi bagi pertumbuhannya ( Soesanto,
2008 ). Klasifikasi bakteri Pseudomonas putida dapat dilihat pada Tabel 3.
Tabel 3. Klasifikasi bakteri Pseudomonas putida
Kingdom Eubacteria
Phylum Proteobacteria
Class Gamma Proteobacteria
Ordo Pseudomonadales
Family Pseudomonadaceae
Genus Pseudomonas
Species putida
Bakteri P. putida mempunyai habitat ekologi yang mirip dengan bakteri antagonis lainnya, khususnya dari genus Pseudomonas. Kondisi dengan kelembaban tinggi dan kaya bahan organik, terutama rizosfer dan rizoplan, sangat disukainya. Bakteri mempunyai kemampuan mengoloni akar secara agresif, sehingga dikenal dengan istilah rhizobakteri. Kemampuannya yang tinggi tersebut disebabkan oleh tingkat pertumbuhan yang tinggi, pergerakannya dan ketertarikan terhadap bahan kimia atau kemotaksis, terutama terhadap eksudat akar, yang menyediakan unsur nutrisi seperti C, N, dan Fe (Soesanto, 2008).
Bakteri antagonis Pseudomonas putida dikenal dapat menghasilkan antibiotika dan siderofor, yang mampu menekan pertumbuhan tular-tanah. Selain itu, bakteri dapat berperan sebagai rhizobakteri pemacu pertumbuhan tanaman (PGPR). Antibiotika yang dihasilkan antara lain pyrolnitrin, pyocyanin, asam pseudomonat, floroglusinol, dan fenazin. Siderofor diproduksi secara luar sel yang mempunyai daya ikat sangat kuat terhadap besi (III) dan berperan sebagai penghambat pertumbuhan patogen, faktor pertumbuhan tanaman, dan sebagai antibiotika. Selain itu, bakteri antagonis ini juga mempunyai kemampuan bersaing yang tinggi sebagai salah satu mekanisme antagonisnya. Persaingan dilakukan terhadap nutrisi dan tempat infeksi. Persaingan terhadap ion besi (III) dengan mikroba tular-tanah lainnya dapat menekan infeksi patogen (Soesanto, 2008).
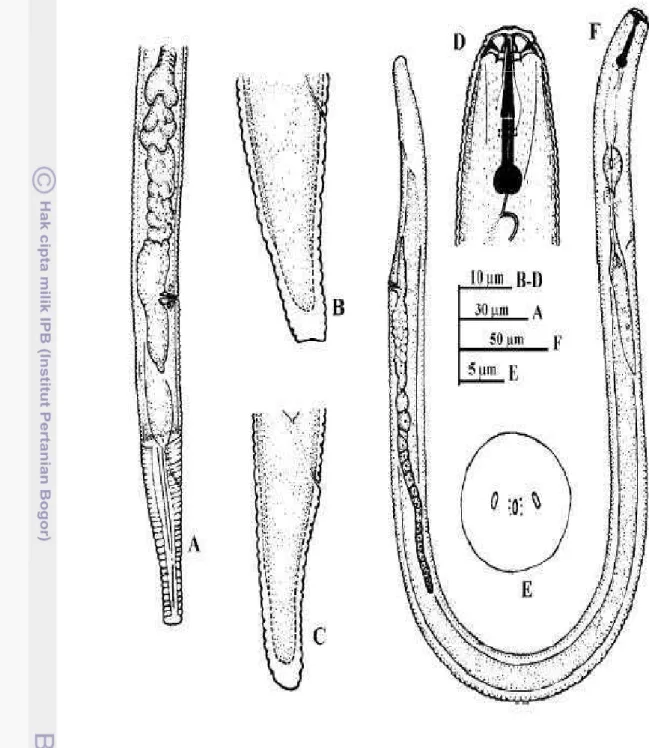
D. Nematoda Pratylenchus brachyurus
Pratylenchus brachyurus adalah salah satu spesies nematoda parasit yang sangat merusak pertanaman nilam di Indonesia. Serangan P. brachyurus pada tanaman nilam menyebabkan pertumbuhan tanaman terhambat, warna daun merah atau kekuning-kuningan dan menyebabkan luka nekrosis pada akar rambut dan kadang-kadang akar membusuk (Mustika et al. 1995; Harni & Mustika 2000). Selain menghambat pertumbuhan tanaman, infeksi P. brachyurus juga mampu menurunkan kandungan klorofil dan kadar minyak, baik pada kultivar rentan maupun agak tahan (Sriwati 1999). Kerusakan akibat serangan nematoda tersebut pada tanaman nilam dapat menurunkan hasil sampai 85% (Mustika et al. 1995). Klasifikasi P. brachyurus
Tabel 4. Klasifikasi bakteri P. brachyurus
Kingdom Animalia
Phylum Nematoda
Class Adenophorea
Subclass Diplogasteria
Ordo Tylenchida
Superfamily Tylenchoidea
Family Pratylenchidae
Subfamily Pratylenchinae
Genus Pratylenchus
Species P. brachyurus
(Thorne,1961)
Pratylenchus brachyurus mempunyai dua anul pada daerah bibir dan panjang tubuh antara 0,45 – 0,75 mm. Stilet kelihatan agak kaku dengan panjang
17-22 µm, kekar dan berkembang dengan baik serta memiliki knop. Jantan jarang
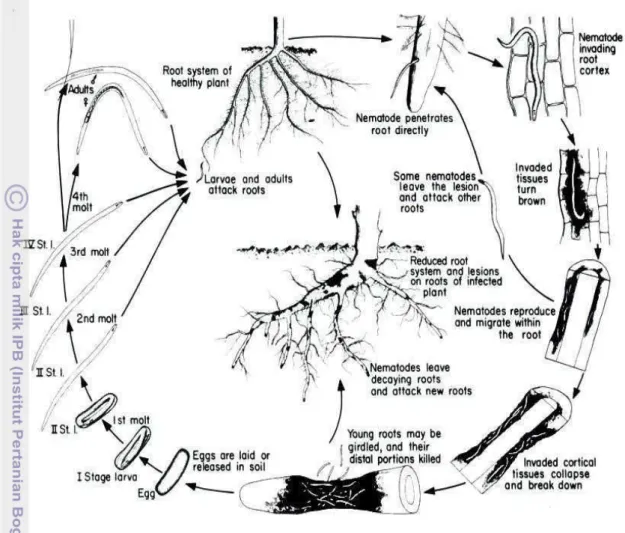
Gambar 4. Siklus Hidup Pratylenchus brachyurus (Singh dan Sitaramaiah,1993)
E. AERASI DAN BIOREAKTOR KOLOM GELEMBUNG
Mikroorganisme membutuhkan oksigen yang berbeda-beda. Pada proses fermentasi aerob, campuran mikroorganisme, nutrien dan udara merupakan hal yang penting dan utama. Untuk memperoleh hal tersebut, perlu dilakukan agitasi dan aerasi secara terus menerus selama proses fermentasi. Hal ini penting apabila kultur ditumbuhkan dalam tangki atau labu (Vandekar dan Dulmage, 1982).
Agitasi dan aerasi merupakan metode penyediaan dan pemasokan oksigen yang sesuai untuk kebutuhan mikroorganisme di dalam bioreaktor dan untuk mempertahankan kondisi aerobik serta membuang gas karbondioksida yang dihasilkan selama fermentasi ( Hartoto, 1991 ).
Tujuan utama aerasi adalah memberikan oksigen yang cukup untuk kebutuhan metabolisme mikroorganisme pada kultur terendam ( Standbury and Whitaker, 1984 ). Bioreaktor yang digunakan pada penelitian ini adalah bioreaktor kolom gelembung ( bubble column ). Bioreaktor kolom gelembung merupakan bioreaktor yang berbentuk kolom yang dilengkapi dengan pemasok udara dari bagian bawah dan tanpa pengadukan mekanis. Pada biorektor ini, pencampuran semata-mata bergantung pada sirkulasi udara yang dimasukkan ( Crueger, 1987 ).
Bioreaktor kolom gelembung merupakan biorektor yang mempunyai konstruksi sederhana, mudah perawatannya, mempunyai sistem pencampuran, sistem pindah panas maupun pindah massa yang sangat baik ( Deckwer, 1990 ). Selain itu, bioreaktor jenis ini membutuhkan pasokan energi kurang dari 1,0 KW/m3, sedangkan bioreaktor tangki berpengaduk membutuhkan energi 1,0-2,0 KW/m3. Hartoto (1991) menyebutkan bahwa bila dibandingkan dengan bioreaktor teragitasi secara mekanis, bioreaktor kolom gelembung dapat menghasilkan biomassa dan yield metabolit sekunder yang lebih tinggi.
F. KINETIKA KULTIVASI
Kinetika fermentasi menggambarkan pertumbuhan dan pembentukan produk oleh mikroorganisme. Kinetika fermentasi juga menggambarkan kegiatan sel-sel istirahat dan mati karena banyak produk komersial yang diproduksi setelah pertumbuhan sel terhenti (Gumbira-Said, 1987) selanjutnya Judoamidjojo et al.,
(1989) mengemukakan pula bahwa kinetika fermentasi secara umum dikaji berdasarkan laju penggunaan substrat, laju pertumbuhan biomassa dan laju pembentukan produk.
Ciri-ciri pertumbuhan mikrobial adalah waktu yang dibutuhkan untuk menggandakan massa atau jumlah sel. Waktu ganda massa sel dapat berbeda dengan waktu ganda jumlah sel karena massa sel dapat meningkat tanpa peningkatan jumlah sel (Gumbira-Said, 1987).
Pertumbuhan mikroorganisme pada fase eksponensial dapat dinyatakan dalam persamaan sebagai berikut :
...(1)
Pada umumnya pertumbuhan sel diukur dengan peningkatan massa sel,
sehingga µxdapat digunakan. Nilai besaran µxX adalah laju pertumbuhan volumetrik (produktivitas volumetrik) dalam g/l.jam. pengintegralan keseimbangan (1) memberikan :
...(3)
atau
LnXt = Ln Xo + µ ∆t ...(5)
Keseimbangan (4) dapat diselesaikan untuk kasus dimana ∆ =td, yaitu waktu yang dibutuhkan untuk mendapatkan massa sel dua kali jumlah massa sel semula, Xt = 2Xo, sehingga :
td = ...(6)
Menurut Wang et al.,(1978), koefisien hasil sel terhadap sumber karbon dinyatakan sebagai Y x/s, sedangkan koefisien konversi nutrien dalam substrat menjadi produk pada periode tertentu dinyatakan sebagai Yp/s. Perhitungannya menggunakan persamaan berikut:
Yx/s = ...(7)
Yp/s = ...(8)
Koefisien konversi nutrien dalam substrat berhubungan dengan efisiensi penggunaan substrat. Perhitungan untuk menghitung efisiensi penggunaan substrat adalah sebagai berikut :
% penggunaan substrat = ...(9) Ln 2
µ
Δ Δ Δ Δ
III. METODOLOGI PENELITIAN
A. ALAT DAN BAHAN
Alat-alat utama yang digunakan pada proses produksi adalah bioreaktor kolom gelembung, rotary shaking incubator, autoclave, pemanas listrik, pH-meter, labu erlenmeyer, sentrifuse, loop inkubasi, tabung reaksi, pipet, lemari pendingin, spektrofotometer, timbangan analitik, gelas piala, kertas saring, bunsen, keranjang tabung, ependorf, tabung film, tabung ulir, pipet mekanik, oven, tanur, desikator, serta alat gelas lainnya.
Mikroorganisme yang digunakan adalah isolat Pseudomonas putida yang didapatkan dari koleksi Balai Penelitian Tanaman Obat dan Aromatik . Bahan baku yang digunakan sebagai substrat dalam penelitian ini adalah limbah cair tahu yang didapatkan dari produsen tahu di Bojonggede, Bogor. Bahan kimia yang digunakan terdiri atas Tryptic Soy Agar (TSA), Tryptic SoyBroth ( TSB ), HCl, NaOH, glukosa, H2SO4 pekat, etanol 95%, fenol 5 %, air suling, dan spirtus. Mineral ( trace element )
yang digunakan meliputi, MgSO4.7H2O 0,3%, MnSO4.7H2O 0,02%, FeSO4.7H2O
0,02%, dan ZnSO4.7H2O 0,02% yang berfungsi sebagai sumber mineral dan CaCO3.
B. WAKTU DAN TEMPAT PENELITIAN
Penelitian ini dilakukan di laboratorium Rekayasa Bioproses ( PAU ) dan laboratorium penunjang lainnya di Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Pelaksanaan penelitian dilakukan mulai bulan September sampai Desember 2009.
C. METODE PENELITIAN
Langkah-langkah yang harus dilakukan dalam fermentasi Pseudomonas putida untuk memproduksi biopestisida adalah sebagai berikut :
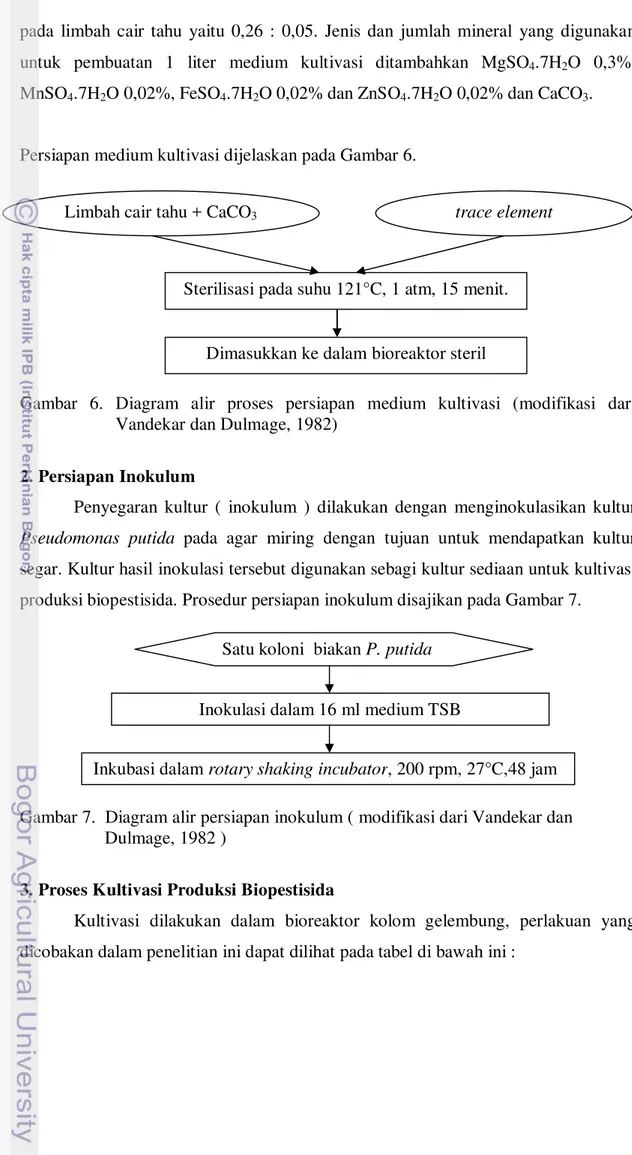
1. Persiapan Medium Kultivasi
pada limbah cair tahu yaitu 0,26 : 0,05. Jenis dan jumlah mineral yang digunakan untuk pembuatan 1 liter medium kultivasi ditambahkan MgSO4.7H2O 0,3%,
MnSO4.7H2O 0,02%, FeSO4.7H2O 0,02% dan ZnSO4.7H2O 0,02% dan CaCO3.
Persiapan medium kultivasi dijelaskan pada Gambar 6.
Gambar 6. Diagram alir proses persiapan medium kultivasi (modifikasi dari Vandekar dan Dulmage, 1982)
2. Persiapan Inokulum
Penyegaran kultur ( inokulum ) dilakukan dengan menginokulasikan kultur
Pseudomonas putida pada agar miring dengan tujuan untuk mendapatkan kultur segar. Kultur hasil inokulasi tersebut digunakan sebagi kultur sediaan untuk kultivasi produksi biopestisida. Prosedur persiapan inokulum disajikan pada Gambar 7.
Gambar 7. Diagram alir persiapan inokulum ( modifikasi dari Vandekar dan Dulmage, 1982 )
3. Proses Kultivasi Produksi Biopestisida
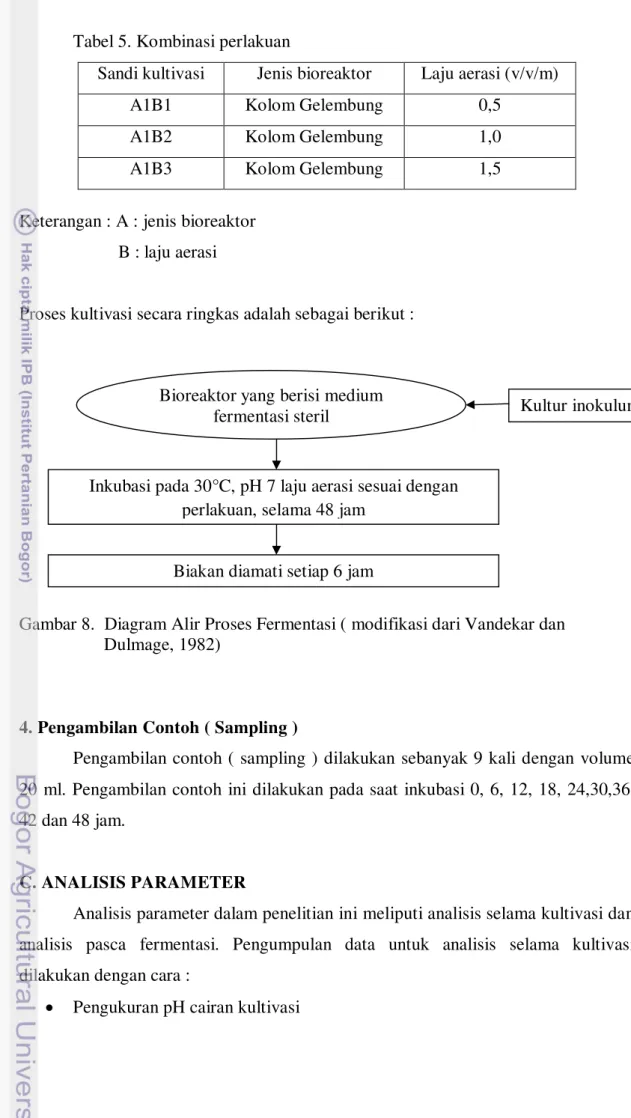
Kultivasi dilakukan dalam bioreaktor kolom gelembung, perlakuan yang dicobakan dalam penelitian ini dapat dilihat pada tabel di bawah ini :
Limbah cair tahu + CaCO3 trace element
Sterilisasi pada suhu 121°C, 1 atm, 15 menit.
Dimasukkan ke dalam bioreaktor steril
Inkubasi dalam rotary shaking incubator, 200 rpm, 27°C,48 jam Satu koloni biakan P. putida
Tabel 5. Kombinasi perlakuan
Sandi kultivasi Jenis bioreaktor Laju aerasi (v/v/m)
A1B1 Kolom Gelembung 0,5
A1B2 Kolom Gelembung 1,0
A1B3 Kolom Gelembung 1,5
Keterangan : A : jenis bioreaktor B : laju aerasi
Proses kultivasi secara ringkas adalah sebagai berikut :
Gambar 8. Diagram Alir Proses Fermentasi ( modifikasi dari Vandekar dan Dulmage, 1982)
4. Pengambilan Contoh ( Sampling )
Pengambilan contoh ( sampling ) dilakukan sebanyak 9 kali dengan volume 20 ml. Pengambilan contoh ini dilakukan pada saat inkubasi 0, 6, 12, 18, 24,30,36, 42 dan 48 jam.
C. ANALISIS PARAMETER
Analisis parameter dalam penelitian ini meliputi analisis selama kultivasi dan analisis pasca fermentasi. Pengumpulan data untuk analisis selama kultivasi dilakukan dengan cara :
Pengukuran pH cairan kultivasi
Kultur inokulum 2 % Bioreaktor yang berisi medium
fermentasi steril
Inkubasi pada 30°C, pH 7 laju aerasi sesuai dengan perlakuan, selama 48 jam
Pengukuran pertumbuhan sel dengan menggunakan metode perhitungan
optical density.
Pengukuran pertumbuhan sel dengan menggunakan metode langsung
( pengukuran bobot kering biomassa )
Pengukuran kadar gula sisa dengan menggunakan metode fenol.
Analisis pasca kultivasi dilakukan dengan cara menentukan toksisitasnya terhadap nematoda.
Langkah-langkah pengerjaan analisis selama kultivasi dapat dilihat pada lampiran 2. Analisis pasca kultivasi dilakukan dengan cara menguji produk biopestisida untuk semua jenis perlakuan dengan menentukan toksisitas biopestisida terhadap nematoda P. brachyurus yang dinyatakan dalam persen mortalitas. Langkah-langkah penentuan aktivitas biopestisida dapat dilihat pada lampiran 3.
D. RANCANGAN PERCOBAAN
Rancangan percobaan yang digunakan adalah rancangan acak lengkap dengan satu faktor yaitu laju aerasi.
= µ + Ai + ij
µ = rata-rata
Ai = pengaruh perlakuan laju aerasi ( i : 0,5, 1, 1,5)
ij = galat perlakuan (i) pada ulangan ke-j A = laju aerasi 0,5 vvm
IV. HASIL DAN PEMBAHASAN
A. PENGUJIAN AWAL MEDIA KULTIVASI
Banyak bahan yang dapat digunakan sebagai media kultivasi salah satunya limbah cair tahu. Limbah cair tahu merupakan cairan yang berasal dari sari kedelai yang disaring dalam proses menjadi tahu melalui proses pengumpalan protein sari kedelai. Sebelum digunakan sebagai media kultivasi perlu diketahui terlebih dahulu komposisi karbon, nitrogen dan mineral pada limbah cair tahu oleh karena itu dilakukan analisis pra kultivasi. Kadar karbon dan kadar nitrogen dalam limbah cair tahu sebagai substrat kultivasi dapat dilihat pada Tabel 6.
Tabel 6. Kadar karbon dan nitrogen dalam limbah cair tahu
No Komponen Kadar ( % b/b) Kadar (g/l) dan 0,05 persen. Hasil ini lebih tinggi dari yang dilaporkan oleh Kuswardani (1985) pada Tabel 1 dan limbah cair tahu ini dapat digunakan sebagai substrat untuk pertumbuhan P. putida.
B. PENGARUH LAJU AERASI 1. Pola Perubahan pH
Gambar 9. Grafik hubungan antara pH dan waktu kultivasi
Berdasarkan Gambar 9, memperlihatkan bahwa pH cairan kultivasi berkisar antara 7,22 – 8,81. Kisaran pH ini masih berada pada kisaran pH pertumbuhan P. putida yaitu pH 4 – 8 (Moat,1979). Menurut Judoamidjojo (1992) derajat keasaman (pH) merupakan parameter yang mempengaruhi pertumbuhan dan pembentukan produk karena protein mempunyai gugusan yang dapat terionisasi, sehingga perubahan pH akan berpengaruh terhadap katalitik dan konformasi enzim.
2. Pertumbuhan Pseudomonas putida dan Total Gula Sisa
Pengukuran bobot kering biomassa dilakukan untuk mengetahui pertumbuhan sel dan menghitung laju pertumbuhan maksimum P. putida selama kultivasi. Hasil pengukuran bobot kering biomassa menunjukkan bahwa dari semua perlakuan mempunyai pola pertumbuhan yang hampir sama yaitu fase awal, fase eksponensial, dan fase stasioner. Ketiga fase yang terbentuk ini sesuai dengan apa yang dinyatakan Wang, et al., (1978), yaitu bahwa pertumbuhan mikroorganisme mempunyai tiga fase, yaitu fase awal, eksponensial, stasioner dan penurunan.
( c )
Gambar 10. Grafik hubungan antara biomassa dan total gula sisa (a) : laju aerasi 0,5 vvm, (b) laju aerasi 1 vvm, (c) laju aerasi 1,5 vvm
Berdasarkan Gambar 10 (a,b,c), pada laju aerasi 1 vvm dan 1,5 vvm fase eksponensial pertumbuhan P. putida dimulai pada jam ke-6 sedangkan pada laju aerasi 0,5 vvm fase eksponensial terjadi pada jam ke- 24. Perbedaan waktu fase eksponensial ini dapat terjadi karena pada laju aerasi 0,5 vvm konsentrasi oksigen terlarut lebih kecil dari pada laju aerasi 1 dan 1.5 vvm.
Bobot kering biomassa tertinggi diperoleh pada laju aerasi 0,5 vvm dan 1,5 vvm pada jam ke-30, sedangkan pada laju aerasi 1,0 vvm bobot kering biomassa tertinggi pada jam ke-36. Berdasarkan hasil analisis sidik ragam, pada laju aerasi 1,0 vvm bobot kering biomassa pada jam ke 36 tidak berbeda nyata dengan bobot kering biomasa pada jam ke- 30. Sehingga dapat disimpulkan bahwa waktu optimun dari seluruh perlakuan adalah pada jam ke-30. Oleh karena itu untuk menghemat waktu, proses kultivasi dapat dilakukan hanya sampai jam ke-30.
Pada akhir kultivasi (jam ke-48), bobot kering biomassa yang dihasilkan bervariasi dari 1,147 g/l sampai 1,228 g/l. Berdasarkan data yang diperoleh dapat disimpulkan bobot kering biomassa yang tinggi terdapat pada laju aerasi 1 vvm yaitu 1,228 g/l (Gambar 10b, Lampiran 9). Hal ini menunjukan bahwa pada sistem tersebut proses transfer oksigen ke dalam sel berlangsung secara optimal untuk pertumbuhan.
Penambahan laju aerasi ternyata dapat menurunkan perolehan bobot kering biomassa, begitu juga apabila laju aerasinya dikurangi. Jika konsentrasi oksigen terlarut lebih kecil dari konsentrasi oksigen kritis, maka metabolisme sel akan terganggu (Rachman, 1989). Pada laju aerasi yang lebih tinggi, jumlah oksigen yang dimasukkan lebih banyak dan menyebabkan oksigen cenderung pada fase gas dan gelembung gas ini akan cepat pecah kembali sebelum terjadi pelarutan oksigen ke dalam kultur ( Stanbury & Whitaker, 1984). Menurunnya jumlah oksigen terlarut di dalam kultur menyebabkan berkurangnya oksigen yang dikonsumsi oleh sel. Pasokan oksigen ke dalam kultur harus seimbang dengan laju konsumsi oksigen.
Pada proses kultivasi, sel memerlukan sumber karbon yang akan dikonversi menjadi biomassa dan produk. Pada penelitian ini sumber karbon berasal dari glukosa yang terdapat pada limbah cair tahu. Hal ini ditandai dengan berkurangnya konsentrasi glukosa yang ditunjukkan dengan total gula sisa. Tinggi rendahnya total gula sisa dalam medium kultivasi dipengaruhi oleh kemampuan sel dalam mengkonversi substrat dari glukosa menjadi biomassa dan produk. Selain itu juga dipengaruhi oleh kondisi lingkungan, misalnya suhu dan pH. Berdasarkan Gambar 10 (a,b,c), total gula sisa secara umum memperlihatkan nilai yang menurun pada semua perlakuan. Hal ini menunjukkan glukosa tersebut digunakan oleh sel untuk dikonversi menjadi biomassa.
Perbedaan penggunaan glukosa pada setiap perlakuan akan lebih terlihat pada efisiensi penggunaan substrat yang terlihat pada Gambar 11. Berdasarkan data dari gambar 11, nilai efisiensi penggunaan substrat ((So-St)/So) pada saat Xmax untuk laju
aerasi 1,0 dan 1,5 vvm besarnya hampir sama yaitu 0,414 (41%) dan 0,418 (42%), sedangkan yang paling rendah terjadi pada kultivasi dengan laju aerasi 0,5 vvm yaitu sebesar 0,361( 36%). Penggunaan substrat pada laju aerasi 1,0 dan 1,5 vvm lebih efisien daripada penggunaan substrat pada laju aerasi 0,5 vvm.
3. Uji Toksisitas
Uji toksisitas digunakan untuk menentukan aktivitas bahan aktif dari biopestisida terhadap nematoda P. brachyurus. Tingkat keefektifan biopestisida mikrobial ditentukan berdasarkan kemampuan bahan aktif biopestisida membunuh nematoda target yang ditunjukkan oleh tingkat mortalitas nematoda yang tinggi.
Gambar 12. Grafik hasil uji toksisitas semua perlakuan
Berdasarkan Gambar 12 tingkat mortalitas tertinggi diperoleh pada laju aerasi 1 vvm. Pendugaan tingginya tingkat mortalitas nematoda pada laju aerasi 1 vvm disebabkan oleh banyaknya jumlah metabolit yang dihasilkan dibandingkan dengan jumlah metabolit pada laju aerasi 0,5 dan 1,5 vvm. Hal ini sesuai dengan yang dikemukakan oleh Harni (2005), perlakuan kultur filtrat Pseudomonas E26, Bacillus
NA22 dan Bacillus NJ46 memberikan pengaruh tinggi terhadap mortalitas nematoda. Tingginya mortalitas pada P. brachyurus diduga karena P. putida menghasilkan metabolit sekunder seperti enzim kitinase yang merupakan toksin terhadap P brachyurus. Enzim kitinase merupakan enzim penting yang dihasilkan P. putida, karena enzim ini dapat mendegradasi kutikula nematoda (Tian et al., 2000).
C. KINETIKA KULTIVASI
Judoamidjojo et al., (1989) mengemukakan bahwa kinetika kultivasi secara umum dikaji berdasarkan laju penggunaan substrat, laju pertumbuhan biomassa dan laju pembentukan produk. Kinetika pertumbuhan sel dan pembentukan produk dipengaruhi oleh kemampuan sel (Gumbira-Sa’id, 1987). Menurut Mangunwidjaja dan Suryani (1994), hubungan kinetika pertumbuhan sel dan pembentukan produk tergantung pada peranan produk tersebut dalam metabolisme sel. Pertumbuhan
Pseudomonas putida dapat dicirikan dengan waktu yang digunakan untuk menggandakan jumlah atau massa sel dan konversi substrat menjadi biomassa. Hasil perhitungan kinetika kultivasi adalah Tabel 7.
Tabel 7. Hasil Perhitungan parameter kinetika kultivasi
Parameter Kinetika Laju Aerasi 0,5 vvm Laju aerasi 1 vvm Laju Aerasi 1,5 vvm X-max (g/l) 1,191 (jam ke-30) 1,608 (jam ke-36) 1,352 (jam ke-30)
µxmax (jam-1) 0,111 (jam ke-30) 0,160 (jam ke-12) 0,156 (jam ke-12)
Td (jam) 6,245 4,332 4,453
(So-St)/So pada Xmax 0,361 0,414 0,418
Yx/s pada Xmax 1,401 1,442 1,227
tertinggi yaitu 1,608 g/l. Tingginya laju pertumbuhan dapat dipengaruhi oleh substrat yang terdapat pada media dan lamanya mikroorganisme menyesuaikan diri terhadap lingkungannya. Selain substrat, laju pertumbuhan sangat dipengaruhi oleh temperatur, pH, aerasi dan agitasi.
Nilai µx-maks digunakan untuk menghitung waktu yang dibutuhkan oleh sel memperbanyak diri dua kali massa sel semula. Hasil perhitungan menunjukkan bahwa waktu ganda sel tercepat berdasarkan massanya (td) sebesar 4,332 jam terdapat pada laju aerasi 1 vvm. Semakin cepat sel menggandakan jumlah massanya menunjukkan semakin baik laju pertumbuhannya.
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Hasil penelitian menunjukkan bahwa limbah cair tahu dapat digunakan sebagai substrat bagi pertumbuhan Pseudomonas putida untuk memproduksi biopestisida.
Perolehan bobot kering biomassa tertinggi dicapai pada kultivasi dengan laju aerasi 1 vvm setelah kultivasi berlangsung selama 36 jam, yaitu sebesar 1,608 g/l. Berdasarkan hasil perhitungan kinetika fermentasi, dapat diketahui bahwa laju
pertumbuhan spesifik berdasarkan bobot kering biomassa (µx) dan efisiensi pengubahan substrat menjadi biomassa (Yx/s) tertinggi dicapai pada kultivasi dengan laju aerasi 1 vvm, yaitu sebesar 0,160/jam dan 1,442 g sel/g substrat.
Hasil uji toksisitas terhadap nematoda P. brachyurus, produk yang dihasilkan pada kultivasi dengan aerasi 1 vvm memperlihatkan tingkat mortalitas nematoda tertinggi yaitu 99 persen.
B. SARAN
Berdasarkan penelitian yang telah dilakukan ada beberapa hal yang perlu disarankan, diantaranya :
1. Perlu diteliti lebih lanjut untuk mengetahui bahan aktif yang terkandung pada P. putida yang dapat mengendalikan nematoda.
DAFTAR PUSTAKA
AOAC. 1984. Official Methods of Analysis of Association of Official Agricultural Chemist. Washington, DC.
BPS. 2001. Statistical Year Book of Indonesia. BPS, Jakarta.
Corbett, D.C.M. (1976). Pratylenchus brachyurus. CIH Descriptions of plant-parasitic nematodes, Set 6, No. 89. Farnham Royal, UK, Commonwealth Agricultural Bureaux, 4 pp.
Crueger, W. 1987. Physical Aspect of Bioreactor Performance. Dechema. Frankfrut. Deckwer, W.D. 1990. Bubble Column Reactor. Fachbereich Chemie, Fachgebiet
technishe, Universiat Oldenburg, Oldenburg.
Gumbira-Said, E. 1987. Bioindustri. Penebar Swadaya, Jakarta.
Harni, R. 2005. Potensi Bakteri Endofit untuk Pengendalian Nematoda Peluka Akar (Pratylenchus brachyurus (Godfrey) Filipjev & Stekhoven) Pada Tanaman Nilam. Tesis. IPB, Bogor.
Harni R, Munif A, Mustika I, Supramana. 2007. Pemanfaatan Bakteri Endofit untuk Mengendalikan Nematoda Peluka Akar (Pratylenchus brachyurus) pada Tanaman Nilam. Jurnal Hayati 14 (1) : 7-12
Harni R. dan Mustika I. 2000. Pengaruh Infestasi Pratylenchus brachyurus, Meloidogyne incognita dan Radopholus similis pada Tanaman Nilam. Buletin Balitro Vol XI No.2 p. 47-54
Hartoto, L. 1991. Petunjuk Laboratorium Teknologi Fermentasi. Departemen Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Tinggi. PAU Bioteknologi-IPB, Bogor.
Judoamidjojo. R.M.,Gumbira-Sa’id, E., dan Hartoto,L. 1989. Biokonversi. PAU Bioteknologi-IPB, Bogor.
Judoamidjojo, R.M., A. Aziz Darwis dan Gumbira-Said, E. 1992. Teknologi Fermentasi. Rajawali Pers, Jakarta.
Kuswardani, I. 1985. Mempelajari Pemanfaatan Limbah Cair Tahu sebagai Media Pertumbuhan Mikroba Penghasil Enzim Pemecah Pati Menjadi Glukosa. Skripsi. FATETA-IPB, Bogor.
Mangunwidjaja, D. Dan A. Suryani. 1994. Teknologi Bioproses. Penebar Swadaya, Jakarta.
Moertinah, Sri dan Djarwanti. 2003. Penelitian Identifikasi Pencemaran Industri Kecil Tahu-Tempe di Kelurahan Debong Tengah Kota Tegal dan Konsep Pengendaliannya. Laporan Penelitian. Badan Penelitian dan Pengembangan Industri Semarang
Mustika, I., Rahmat A., Suyanto. 1995. Pengaruh Pupuk, Pestisida dan Bahan Organik Terhadap pH Tanah, Populasi Nematoda dan Produksi Nilam. Medkom. Penelitian dan Pengembangan Tantri. 15: 70-74.
Nurhasan. 1987 . Pengolahan Air Buangan Industri Tahu. Suatu Pedoman Praktis Diterbitkan atas Kerjasama Yayasan Bina Harta Lestari dengan Wahana Lingkungan Hidup Indonesia.
Novizan. 2002. Membuat dan Memanfaatkan Pestisida Ramah Lingkungan. Agro Media Pustaka, Jakarta.
Pons, A, L.G. Dussap dan J. B. Gross. 1987. Comparison of Bubble Column and Stirred Tank Fermentor perpormance for Xanthan Gum Production. Prod 4th, European Congress of Biotechnology.
Rachman, A. 1989. Pengantar Teknologi Fermentasi. PAU Pangan dan Gizi IPB, Bogor.
Rochani, R. 1986. Aktivitas Protease dari Bacillus subtilis pada Media Limbah Cair Tahu. Skripsi. Jurusan Teknologi Pangan dan Gizi. FATETA-IPB, Bogor.
Sastroutomo. (1992). Dasar-Dasar Pestisida dan Dampak Penggunaanya. PT. Gramedia Pustaka Utama Jakarta
Singh, R.S., dan Sitaramaiah, K. 1993. Plant Pathogens The Nematodes. International Science Publisher, New York.
Soesanto, L. 2008. Pengendalian Hayati Penyakit Tanaman. PT Raja Grafindo Persada, Jakarta.
Sriwati, R. 1999. Ketahanan Beberapa Kultivar Nilam (Pogostemon cablin Benth.) terhadap Pratylenchus brachyurus (Godfrey) Filipjev & Stekhoven. Tesis. Program Pascasarjana Institut Pertanian Bogor.
Standburry, P.F. dan A. Whitaker. 1984. Principles of Fermentation Technology. Pergamon Press, Oxford.
Thorne, G. 1961. Principles of Nematology. McGraw-Hill Book Company, INC, New York.
Vandekar, M dan H.T. Dulmage. 1982. Guidelines for Production Bacillus thuringiensis H-14. Proceeding of a Consultation held in Geneva, Switzerland.
Wang, D.I.C., C.L. Cooney, A. L. Demain, P. Dunhill, A.E., Humphrey and M.D. Lilly. 1978. Fermentation and Enzyme Technology. John Wiley ang Sons, New York.
Winarno, F.G. 2002. Produksi Tahu Cina Tradisional. MBRIO Press, Bogor.
Lampiran 1. Metode Analisis Pra-Kultivasi
a. Kadar Air (AOAC,1984)
Cawan aluminium kosong yang sudah dipanaskan dalam oven pada suhu 105 oC selama 15 menit, kemudian didinginkan dalam desikator selama 30 menit dan ditimbang. Prosedur pengeringan cawan ini diulang sampai di dapatkan bobot tetap. Contoh sebanyak 4-5 gram di timbang dalam cawan tersebut, kemudian di panaskan dalam oven pada suhu 105 oC selama 3-5 jam. Setelah itu cawan dikeluarkan dari oven dan didinginkan, diulangi sampai didapatkan bobot tetap bahan. Persentase kadar air di hitung dengan rumus bobotnya konstan. Dibakar sampai tak berasap di atas bunsen denagn api kecil, kemudian dimasukkan ke dalam tanur pada suhu 600 oC sampai menjadi abu. Cawan didinginkan dalam desikator selama 15 menit kemudian ditimbang. Pengabuan diulangi dengan cara dimasukkan kembali dalam tanur pada suhu 600 oC selama 1 jam sampai didapat bobot tetap. Persentase kadar abu dapat dihitung dengan menggunakan rumus :
1. Prosedur Pengukuran pH
Pengukuran pH cairan kultur dilakukan dengan menggunakan pH-meter yang telah dikalibrasi dengan menggunakan larutan buffer standar (4 dan 7). Sampel cairan kultur langsung diukur dengan pH-meter tanpa dilakukan pengenceran terlebih dulu.
2. Pengukuran Optical Density
Prosedur pengerjaan pengukuran pertumbuhan sel dengan perhitungan OD sebagai berikut : Sebanyak 10 ml sampel diambil untuk mengetahui jumlah biomassa dari Pseudomonas putida. Pengukuran jumlah biomassa ini dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 600 nm. Diagram alirnya sebagai berikut :
Masukkan 10 ml sampel cairan kultur ke dalam tabung ulir
Lanjutan Lampiran 2. Metode Analisa Selama Kultivasi
3. Pengukuran Bobot Kering Biomassa
Bobot kering biomassa dapat dihitung dengan menggunakan rumus : Tabung eppendorf kosong dikeringkan
pada suhu 70°C selama 1 jam
Dinginkan dalam desikator selama 30 menit
1,5 ml sampel cairan kultur kultivasi dimasukkan ke tabung eppendorf
Sentrifuge dengan kecepatan 10000 rpm selama 15 menit
Pisahkan filtrat dan endapan, filtrat digunakan untuk pengujian kadar gula sisa
Endapan yang terdapat pada tabung eppendorf dipanaskan dalam oven pada suhu 80°C selama 4-5 jam ( sampai berat konstan)
Dinginkan dalam desikator selama 30 menit dan timbang
Lanjutan Lampiran 2. Metode Analisa Selama Kultivasi
4. Penentuan Kadar Gula Sisa Metode fenol a. Pembuatan Kurva Standar
larutan glukosa dengan konsentrasi 0, 10, 20, 30, 40, 50 dan 60 mg/l, diambil sebanyak dua ml dan masing-masing dimasukkan ke dalam tabung reaksi, ditambahkan 1 ml larutan fenol 5% dan ditambahkan H2SO4 pekat sebanyak 5 ml.
Setelah itu biarkan selama 10 menit, larutan dipanaskan dalam penangas air selama 15 menit. Larutan diukur absorbansinya pada λ = 490 nm.
Kadar Gula(mg/l) Absorbansi 490 nm
0 0
Gambar 9. Grafik Kurva Standar Glukosa
Lanjutan Lampiran 2. Metode Analisa Selama Kultivasi
b. Penetapan Sampel
Ditambah 1 ml larutan fenol 5 %
Ditambah 5 ml H2SO4 pekat biarkan
selama 10 menit
Kocok dan tempatkan pada penangas air selama 15 menit
Diukur absorbansinya pada λ = 490 nm
Lampiran 3. Uji Toksisitas Biopestisida ( Modifikasi dari Yamamoto et al., 1983)
Sentrifuge hasil akhir kultivasi kemudian saring menggunakan
millipore
Masukkan nematoda Pratylenchus brachyurus
ke dalam cawan hitung sebanyak 20 ekor yang masih hidup
Masukkan 5 ml cairan kultivasi yang tadi sudah disaring ke dalam cawan hitung yang berisi nematoda
Lampiran 4. Rekapitulasi Data pH Rata-rata Selama Kultivasi
Jam Laju Aerasi 0,5 v/v/m Laju Aerasi 1 v/v/m Laju Aerasi 1,5 v/v/m
0 7,22 7,23 7,27
6 7,28 7,40 7,46
12 7,70 7,91 7,67
18 8,05 8,11 7,82
24 8,24 8,04 7,83
30 8,62 8,22 7,89
36 8,77 8,51 8,05
42 8,68 8,63 8,40
Lampiran 5. Rekapitulasi Data Bobot Kering Biomassa (g/l) Rata-rata Selama Kultivasi
Jam Laju Aerasi 0,5 v/v/m Laju Aerasi 1 v/v/m Laju Aerasi 1,5 v/v/m
0 0,113 0,320 0,295
6 0,149 0,545 0,430
12 0,337 1,425 1,094
18 0,549 1,472 1,053
24 0,613 1,542 1,282
30 1,191 1,500 1,352
36 1,171 1,608 1,276
42 1,155 1,462 1,247
Lampiran 6. Rekapitulasi Data Total Gula Sisa (g/l) Selama Kultivasi
Jam Laju Aerasi 0,5 v/v/m Laju Aerasi 1 v/v/m Laju Aerasi 1,5 v/v/m
0 2,130 2,157 2,061
6 1,866 1,814 1,818
12 1,827 1,538 1,537
18 1,515 1,416 1,515
24 1,478 1,366 1,369
30 1,361 1,308 1,201
36 1,098 1,263 1,162
42 1,045 1,227 1,096
Lampiran 7. Rekapitulasi Data Uji Toksisitas
laju aerasi (vvm) ulangan jumlahhidup jumlah mati
0,5 1 6 14
2 7 13
3 6 14
4 6 14
5 4 16
1 1 20
2 20
3 1 19
4 20
5 20
1,5 1 20
2 1 19
3 20
4 3 17
5 20
kontrol 1 20
2 20
3 20
4 20
Lampiran 8. Hasil Analisa Ragam Uji F dan Uji Lanjut Duncan Terhadap Nilai pH
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = ,011.
a. Uses Harmonic Mean Sample Size = 2,000.
Pada jam ke-36
Tests of Between-Subjects Effects Dependent Variable:pH
Source
Type III Sum
of Squares df Mean Square F Sig. Corrected
Model
.524a 2 .262 6.013 .089
Intercept 427.402 1 427.402 9810.289 .000
aerasi .524 2 .262 6.013 .089
Error .131 3 .044
Total 428.056 6
Corrected Total .655 5
Lampiran 9. Hasil Analisa Ragam Uji F dan Uji Lanjut Duncan Terhadap Nilai
Means for groups in homogeneous subsets are displayed.
Based on observed means.
Keterangan :
Lampiran 10. Hasil Analisa Ragam Uji F dan Uji Lanjut Duncan Terhadap Nilai
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = ,001.
a. Uses Harmonic Mean Sample Size = 2,000.
Pada jam ke-36
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = ,000.
a. Uses Harmonic Mean Sample Size = 2,000.
I. PENDAHULUAN
A. LATAR BELAKANG
Biopestisida adalah pestisida yang mengandung mikroorganisme seperti bakteri, virus dan jamur. Biopestisida tidak menimbulkan resistensi terhadap hama target, bersifat alami dan relatif aman bagi lingkungan, manusia dan hama non target. Biopestisida dapat digunakan untuk mengendalikan nematoda peluka akar
Pratylenchus brachyurus pada tanaman nilam. Serangan nematoda P. brachyurus
pada tanaman nilam menyebabkan pertumbuhan tanaman terhambat, warna daun merah atau kekuning-kuningan dan menyebabkan luka nekrosis pada akar rambut dan kadang-kadang akar membusuk ( Mustika et al.,1995 ).
Salah satu biopestisida yang digunakan untuk pengendalian P. brachyurus
adalah bakteri endofit. Bakteri endofit adalah bakteri yang hidup mengkolonisasi jaringan bagian dalam tanaman tanpa menyebabkan gangguan pada tanaman tersebut. Harni et al (2007) melaporkan, bahwa bakteri endofit yang berasal dari perakaran nilam dapat mengendalikan nematoda P. brachyurus 73,9% pada tanaman nilam di rumah kaca.
Limbah cair tahu yaitu hasil samping proses pembuatan tahu yang masih mengandung karbon dan nitrogen. Limbah cair tahu ini dapat dimanfaatkan sebagai substrat pembuatan biopestisida karena masih mengandung nutrisi seperti bahan organik berupa protein, lemak, karbohidrat dan bahan an organik (Ca, Fe, Cu, Na, N, P, K, Cl, Mg) yang dapat digunakan untuk pertumbuhan mikroba. Menurut Winarno (2002) dari 0,45 kg kedelai dapat menghasilkan 3,6 kg tahu dan limbah cair tahu sebanyak 3,78 l. Menurt BPS (2001) jumlah anggota produsen tahu di Indonesia sebanyak 10094, setiap anggota membutuhkan kedelai 5000 ton per tahunnya, sehingga dapat diperkirakan jumlah limbah cair tahu dalam setiap tahun menghasilkan 40000 m3. Hal tersebut menjadi salah satu alasan pemanfaatan limbah cair tahu sebagai media kultivasi.
mikroba, juga untuk mengaduk mikroba supaya tersuspensi secara homogen di dalam media (Gumbira-Said, 1987).
B. Tujuan
Penelitian ini bertujuan untuk :
1. Memproduksi biopestisida dari Pseudomonas putida menggunakan substrat limbah cair tahu
II. TINJAUAN PUSTAKA
A. BIOPESTISIDA
Biopestisida adalah pestisida yang mengandung mikroorganisme seperti bakteri, virus dan jamur. Biopestisida tidak menimbulkan kekebalan atau resistensi terhadap hama target, aman bagi lingkungan, manusia dan hama non target. Berbagai biopestisida telah dilaporkan dapat mengendalikan hama dan penyakit tanaman, diantaranya :
1. Insektisida biologi (Bioinsektisida)
Berasal dari mikroba yang digunakan sebagai insektisida. Mikroorganisme yang menyebabkan penyakit pada serangga tidak dapat menimbulkan gangguan terhadap hewan-hewan lainnya maupun tumbuhan. Jenis mikroba yang akan digunakan sebagai insektisida harus mempunyai sifat yang spesifik artinya harus menyerang serangga yang menjadi sasaran dan tidak pada jenis-jenis lainnya.
Pada saat ini insektisida biologi sudah digunakan dan diperdagangkan secara luas. Mikroba yang berpotensi sebagai insektisida biologi salah satunya adalah
Bacillus thuringiensis. B. thuringiensis var. kurstaki telah diproduksi sebagai insektisida biologi dan diperdagangkan dalam berbagai nama seperti Dipel, Sok-Bt, Thuricide, Certan dan Bactospeine. Sedangkan B. thuringiensis var. israelensis
dengan nama dagang Bactimos, BMC, Teknar dan Vektobak. Insektisida ini efektif untuk membasmi larva nyamuk dan lalat (Sastroutomo, 1992).
Jenis insektisida biologi yang lain adalah yang berasal dari protozoa, Nosema locustae, yang telah dikembangkan untuk mengendalikan belalang dan jengkerik. Nama dagangnya adalah NOLOC, Hopper Stopper, sdangkan nematoda yang pertama kali didaftarkan sebagai insektisida ialah Neoplectana carpocapsae, yang diperdagangkan dengan nama Spear, Saf-T-Shield. Insektisida ini digunakan untuk membunuh rayap (Sastroutomo, 1992).
2. Herbisida biologi (Bioherbisida)
mengendalikan Morrenia odorata, gulma pada tanaman jeruk. Bioherbisida yang kedua dengan menggunakan Colletotrichum gloeosporioides yang diperdagangkan dengan nama Collego dan digunakan pada tanaman padi dan kedelai di Amerika (Sastroutomo, 1992).
3. Fungisida biologi (Biofungisida)
Biofungisida yang dipakai untuk mengendalikan penyakit jamur. Beberapa biofungisida yang telah digunakan adalah spora Trichoderma sp. untuk mengendalikan penyakit akar putih pada tanaman karet dan layu fusarium pada cabai dengan merek dagang Saco P dan Biotri P (Novizan, 2002).
Biofungisida lainnya menurut Novizan (2002), yaitu kelompok Gliocladium yaitu G. roseum dan G. virens. Produk komersialnya dengan merek dagang Ganodium P yang direkomendasikan untuk mengendalikan busuk akar pada cabai akibat serangan jamur Sclerotium rolfsii dan B. subtilis untuk mengendalikan serangan jamur Fusarium sp. pada tanaman tomat. Bakteri ini telah diproduksi secara masal dengan merek dagang Emva dan Harmoni BS (Novizan, 2002).
B. LIMBAH CAIR TAHU
Gambar 1. Diagram alir pembuatan tahu (Moertinah dan Djarwanti, 2003)
Tabel 1. Komposisi limbah cair tahu
Tabel 2. Karakteristik fisika limbah cair tahu
No Karakteristik Hasil Pengukuran
1 Suhu 37-45°C
2 Padatan terendap 175-190 mg/l
3 Padatan tersuspensi 635-660 mg/l
4 Padatan total 810-850 mg/l
5 Warna 2225-2250 Pt.co
6 Amonia-Nitrogen 23,3-23,5 mg/l
7 Nitrit-Nitrogen 3,5-4,0 mg/l
8 Nitrat-Nitrogen 32-40 mg/l
9 pH 4-6
10 Kebutuhan oksigen biologi (BOD) 6000-8000 mg/l 11 kebutuhan oksigen kimia (COD) 7500-14000 mg/l ( Nurhasan,1987)
C. Pseudomonas putida
kelompok gamma, bersama P. aeroginosa, P. putida, dan P. syringae yang disebut subkelompok flourescens. Pada penelitian ini menggunakan Pseudomonas putida
untuk memproduksi biopestisida.
Bakteri antagonis P. putida termasuk ke dalam genus Pseudomonas, yang berbentuk lengkung batang atau ramping berukuran ( 0,5-1,0) x ( 1,5-5,0 ) µm dan bergerak dengan satu atau beberapa flagelum polar. Bakteri ini bersifat gram negatif, aerob, berjenis metabolisme respirasi dengan oksigen sebagai penerima elektron akhir. Golongan bakteri antagonis ini tidak mempunyai fase istirahat, tidak fermentasi, katalase positif, dan mempunyai pigmen hijau, biru, ungu, merah muda, atau kuning yang menyebar terutama pada medium kaya zat besi, dan beberapa spesies tidak berpigmen. Bakteri juga bersifat kemolitotrof fakultatif, menggunakan CO2 dan bahan organik sebagai sumber energi bagi pertumbuhannya ( Soesanto,
2008 ). Klasifikasi bakteri Pseudomonas putida dapat dilihat pada Tabel 3.
Tabel 3. Klasifikasi bakteri Pseudomonas putida
Kingdom Eubacteria
Phylum Proteobacteria
Class Gamma Proteobacteria
Ordo Pseudomonadales
Family Pseudomonadaceae
Genus Pseudomonas
Species putida
Bakteri P. putida mempunyai habitat ekologi yang mirip dengan bakteri antagonis lainnya, khususnya dari genus Pseudomonas. Kondisi dengan kelembaban tinggi dan kaya bahan organik, terutama rizosfer dan rizoplan, sangat disukainya. Bakteri mempunyai kemampuan mengoloni akar secara agresif, sehingga dikenal dengan istilah rhizobakteri. Kemampuannya yang tinggi tersebut disebabkan oleh tingkat pertumbuhan yang tinggi, pergerakannya dan ketertarikan terhadap bahan kimia atau kemotaksis, terutama terhadap eksudat akar, yang menyediakan unsur nutrisi seperti C, N, dan Fe (Soesanto, 2008).
Bakteri antagonis Pseudomonas putida dikenal dapat menghasilkan antibiotika dan siderofor, yang mampu menekan pertumbuhan tular-tanah. Selain itu, bakteri dapat berperan sebagai rhizobakteri pemacu pertumbuhan tanaman (PGPR). Antibiotika yang dihasilkan antara lain pyrolnitrin, pyocyanin, asam pseudomonat, floroglusinol, dan fenazin. Siderofor diproduksi secara luar sel yang mempunyai daya ikat sangat kuat terhadap besi (III) dan berperan sebagai penghambat pertumbuhan patogen, faktor pertumbuhan tanaman, dan sebagai antibiotika. Selain itu, bakteri antagonis ini juga mempunyai kemampuan bersaing yang tinggi sebagai salah satu mekanisme antagonisnya. Persaingan dilakukan terhadap nutrisi dan tempat infeksi. Persaingan terhadap ion besi (III) dengan mikroba tular-tanah lainnya dapat menekan infeksi patogen (Soesanto, 2008).
D. Nematoda Pratylenchus brachyurus
Pratylenchus brachyurus adalah salah satu spesies nematoda parasit yang sangat merusak pertanaman nilam di Indonesia. Serangan P. brachyurus pada tanaman nilam menyebabkan pertumbuhan tanaman terhambat, warna daun merah atau kekuning-kuningan dan menyebabkan luka nekrosis pada akar rambut dan kadang-kadang akar membusuk (Mustika et al. 1995; Harni & Mustika 2000). Selain menghambat pertumbuhan tanaman, infeksi P. brachyurus juga mampu menurunkan kandungan klorofil dan kadar minyak, baik pada kultivar rentan maupun agak tahan (Sriwati 1999). Kerusakan akibat serangan nematoda tersebut pada tanaman nilam dapat menurunkan hasil sampai 85% (Mustika et al. 1995). Klasifikasi P. brachyurus
Tabel 4. Klasifikasi bakteri P. brachyurus
Kingdom Animalia
Phylum Nematoda
Class Adenophorea
Subclass Diplogasteria
Ordo Tylenchida
Superfamily Tylenchoidea
Family Pratylenchidae
Subfamily Pratylenchinae
Genus Pratylenchus
Species P. brachyurus
(Thorne,1961)
Pratylenchus brachyurus mempunyai dua anul pada daerah bibir dan panjang tubuh antara 0,45 – 0,75 mm. Stilet kelihatan agak kaku dengan panjang
17-22 µm, kekar dan berkembang dengan baik serta memiliki knop. Jantan jarang
Gambar 4. Siklus Hidup Pratylenchus brachyurus (Singh dan Sitaramaiah,1993)
E. AERASI DAN BIOREAKTOR KOLOM GELEMBUNG
Mikroorganisme membutuhkan oksigen yang berbeda-beda. Pada proses fermentasi aerob, campuran mikroorganisme, nutrien dan udara merupakan hal yang penting dan utama. Untuk memperoleh hal tersebut, perlu dilakukan agitasi dan aerasi secara terus menerus selama proses fermentasi. Hal ini penting apabila kultur ditumbuhkan dalam tangki atau labu (Vandekar dan Dulmage, 1982).
Agitasi dan aerasi merupakan metode penyediaan dan pemasokan oksigen yang sesuai untuk kebutuhan mikroorganisme di dalam bioreaktor dan untuk mempertahankan kondisi aerobik serta membuang gas karbondioksida yang dihasilkan selama fermentasi ( Hartoto, 1991 ).
Tujuan utama aerasi adalah memberikan oksigen yang cukup untuk kebutuhan metabolisme mikroorganisme pada kultur terendam ( Standbury and Whitaker, 1984 ). Bioreaktor yang digunakan pada penelitian ini adalah bioreaktor kolom gelembung ( bubble column ). Bioreaktor kolom gelembung merupakan bioreaktor yang berbentuk kolom yang dilengkapi dengan pemasok udara dari bagian bawah dan tanpa pengadukan mekanis. Pada biorektor ini, pencampuran semata-mata bergantung pada sirkulasi udara yang dimasukkan ( Crueger, 1987 ).
Bioreaktor kolom gelembung merupakan biorektor yang mempunyai konstruksi sederhana, mudah perawatannya, mempunyai sistem pencampuran, sistem pindah panas maupun pindah massa yang sangat baik ( Deckwer, 1990 ). Selain itu, bioreaktor jenis ini membutuhkan pasokan energi kurang dari 1,0 KW/m3, sedangkan bioreaktor tangki berpengaduk membutuhkan energi 1,0-2,0 KW/m3. Hartoto (1991) menyebutkan bahwa bila dibandingkan dengan bioreaktor teragitasi secara mekanis, bioreaktor kolom gelembung dapat menghasilkan biomassa dan yield metabolit sekunder yang lebih tinggi.
F. KINETIKA KULTIVASI
Kinetika fermentasi menggambarkan pertumbuhan dan pembentukan produk oleh mikroorganisme. Kinetika fermentasi juga menggambarkan kegiatan sel-sel istirahat dan mati karena banyak produk komersial yang diproduksi setelah pertumbuhan sel terhenti (Gumbira-Said, 1987) selanjutnya Judoamidjojo et al.,
(1989) mengemukakan pula bahwa kinetika fermentasi secara umum dikaji berdasarkan laju penggunaan substrat, laju pertumbuhan biomassa dan laju pembentukan produk.
Ciri-ciri pertumbuhan mikrobial adalah waktu yang dibutuhkan untuk menggandakan massa atau jumlah sel. Waktu ganda massa sel dapat berbeda dengan waktu ganda jumlah sel karena massa sel dapat meningkat tanpa peningkatan jumlah sel (Gumbira-Said, 1987).
Pertumbuhan mikroorganisme pada fase eksponensial dapat dinyatakan dalam persamaan sebagai berikut :
...(1)
Pada umumnya pertumbuhan sel diukur dengan peningkatan massa sel,
sehingga µxdapat digunakan. Nilai besaran µxX adalah laju pertumbuhan volumetrik (produktivitas volumetrik) dalam g/l.jam. pengintegralan keseimbangan (1) memberikan :
...(3)
atau
LnXt = Ln Xo + µ ∆t ...(5)
Keseimbangan (4) dapat diselesaikan untuk kasus dimana ∆ =td, yaitu waktu yang dibutuhkan untuk mendapatkan massa sel dua kali jumlah massa sel semula, Xt = 2Xo, sehingga :
td = ...(6)
Menurut Wang et al.,(1978), koefisien hasil sel terhadap sumber karbon dinyatakan sebagai Y x/s, sedangkan koefisien konversi nutrien dalam substrat menjadi produk pada periode tertentu dinyatakan sebagai Yp/s. Perhitungannya menggunakan persamaan berikut:
Yx/s = ...(7)
Yp/s = ...(8)
Koefisien konversi nutrien dalam substrat berhubungan dengan efisiensi penggunaan substrat. Perhitungan untuk menghitung efisiensi penggunaan substrat adalah sebagai berikut :
% penggunaan substrat = ...(9) Ln 2
µ
Δ Δ Δ Δ