PRODUKSI BIOINSEKTISIDA DARI Bacillus thuringiensis subsp.
aizawai MENGGUNAKAN LIMBAH INDUSTRI TAHU SEBAGAI
SUBSTRAT
Oleh :
MUHAMMAD SYUKUR SARFAT
F34060127
2010
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
PRODUKSI BIOINSEKTISIDA DARI Bacillus thuringiensis subsp.
aizawai MENGGUNAKAN LIMBAH INDUSTRI TAHU SEBAGAI
SUBSTRAT
Oleh :
MUHAMMAD SYUKUR SARFAT F34060127
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANAN TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
2010
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
JUDUL SKRIPSI : PRODUKSI BIOINSEKTISIDA DARI Bacillus thuringiensis subsp. aizawai MENGGUNAKAN LIMBAH INDUSTRI TAHU SEBAGAI SUBSTRAT
NAMA : MUHAMMAD SYUKUR SARFAT
NRP : F34060127
Menyetujui, Bogor, Agustus 2010
Dosen Pembimbing I Dosen Pembimbing II
Drs. Purwoko, M.Si Dr. Ir. Mulyorini Rahayuningsih, M.Si NIP : 19590710 197903 1 001 19640810 198803 2 002
Mengetahui, Ketua Departemen
Prof. Dr. Ir. Nastiti Siswi Indrasti 19621009 198903 2 001
MUHAMMAD SYUKUR SARFAT. F34060127. Produksi Bioinsektisida Dari
Bacillus thuringiensis subsp. aizawai Menggunakan Limbah Industri Tahu Sebagai Substrat. Di Bawah Bimbingan Purwoko dan Mulyorini Rahayuningsih. 2010.
RINGKASAN
Bioinsektisida merupakan salah satu dari beberapa jenis pestisida yang digunakan untuk mengendalikan hama berupa serangga. Bioinsektisida dapat dibedakan menjadi dua, yaitu ovisida dan larvisida. Ovisida khusus digunakan untuk mengendalikan telur serangga, sedangkan larvisida khusus digunakan untuk mengendalikan larva serangga. Bioinsektisida memanfaatkan bakteri, cendawan, jamur, nematoda untuk membunuh hama serangga. Mikroorganisme yang sering digunakan dalam memproduksi insektisida mikroba adalah Bacillus thuringiensis (Bt). Bt merupakan spesies bakteri dari genus Bacillus yang tergolong dalam kelompok bakteri gram positif. Penggunaan bioinsektisida sebagai pembasmi hama serangga merupakan alternatif yang dianggap tidak resisten terhadap serangga sasaran dan ramah lingkungan. Oleh karena itu, kajian ini adalah memproduksi bioinsektisida yang dihasilkan oleh Bacillus thuringiensis subsp. aizawai berbahan baku produk samping (limbah) industri tahu yang murah sebagai bahan baku utama. Pemilihan limbah industri tahu (ampas tahu dan air tahu) dikarenakan kedua komponen tersebut mengandung nutrisi, vitamin, dan mineral yang dibutuhkan mikroorganisme dalam pertumbuhannya.
Penelitian ini bertujuan untuk mendapatkan formulasi media terbaik yang menghasilkan bioinsektisida dari Bacillus thuringiensis subsp. aizawai dan mengkaji tingkat toksisitas terhadap larva Croccidolomia binotalis (ulat kubis).
Formulasi media menggunakan ampas tahu dan air tahu dengan perbandingan 20 : 80, 30 : 70, dan 40 : 60 serta jumlah starter yang ditambahkan 10, 15, dan 20 (% v/w). Pengamatan dilakukan pada jam ke-0, jam ke-30, dan jam ke-48 waktu fermentasi yang meliputi pH, total gula sisa, jumlah sel hidup, dan jumlah spora hidup. Uji toksisitas dilakukan terhadap larva Croccidolomia binotalis (ulat kubis).
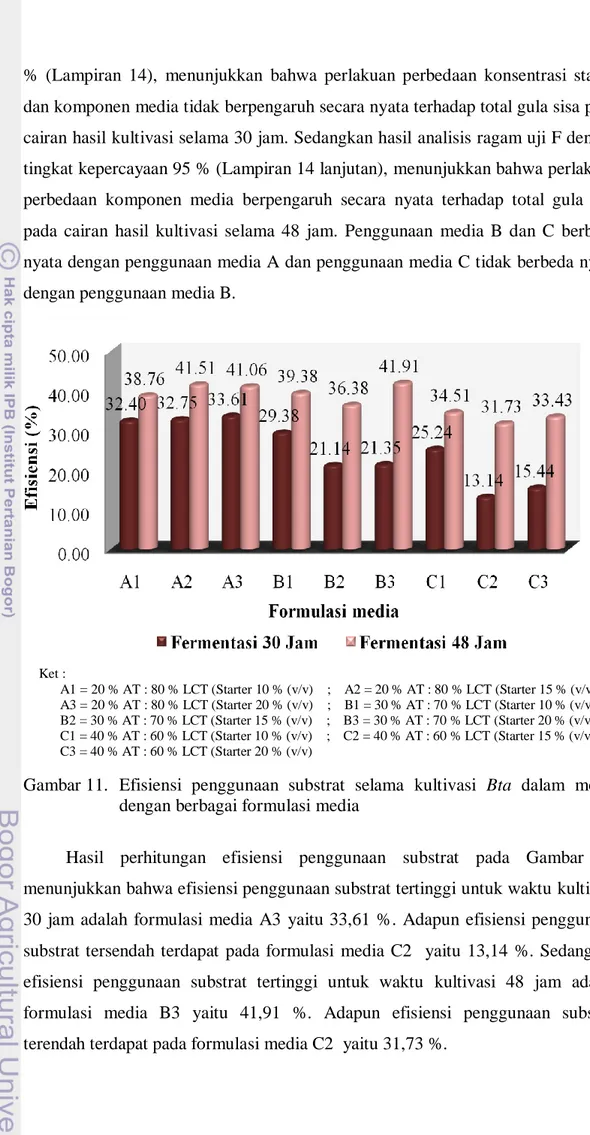
Pada analisis bahan baku diperoleh kadar karbon pada ampas tahu dan air tahu sebesar 5,64 % (bb) dan 0,27 % (bb), sedangkan kadar nitrogennya sebesar 0,42 % (bb) dan 0,02 % (bb). Selama fermentasi berlangsung, nilai pH pada cairan fermentasi mengalami peningkatan sedangkan total gula mengalami penurunan. Nilai pH cairan kultur berkisar antara 7,27 sampai 8,21. Efisiensi penggunaan substrat untuk fermentasi selama 30 jam berkisar antara 13,14 % (C2) sampai 33,61 % (A3) dan untuk fermentasi selama 48 jam berkisar antara 31,73 % (C3) sampai 41,91 % (B3).
Jumlah sel hidup tertinggi pada penelitian ini dihasilkan oleh formula media B3 (2,14 x 108 sel/ml) dengan waktu fermentasi selama 48 jam, sedangkan jumlah sel hidup terendah pada penelitian ini dihasilkan oleh formula media A3 (1 x 107 sel/ml) dengan waktu fermentasi selama 48 jam.
Jumlah spora hidup tertinggi pada penelitian ini dihasilkan oleh formula media B2 (2,95 x 107 spora/ml) dengan waktu fermentasi selama 48 jam, sedangkan total spora hidup terendah pada penelitian ini dihasilkan oleh formula media A1 (1,25 x 106 spora/ml) dengan waktu fermentasi selama 48 jam.
Perbedaan formulasi media berpengaruh secara nyata terhadap nilai pH, pertumbuhan Bta, dan pembentukan spora, namun tidak berpengaruh secara nyata terhadap total gula sisa.
Tingkat toksisitas tertinggi untuk fermentasi selama 30 jam diperoleh pada formula media A1 (1,34 mg/L) dan tingkat toksisitas terendah diperoleh pada formula media C3 (174,16 mg/L). Sedangkan tingkat toksisitas tertinggi untuk fermentasi selama 48 jam diperoleh pada formula media A2 (7,44 mg/L) dan tingkat toksisitas terendah diperoleh pada formula media C3 (45636,00 mg/L). Pada kontrol (air suling + prostiker) yang tidak diberi cairan produk bioinsektisida, tidak terdapat larva C. binotalis yang mati, sedangkan pada produk komersial (Bactospeine) diperoleh toksisitas sebesar 0,05 mg/L dengan potensi produk 16000 UI/mg.
MUHAMMAD SYUKUR SARFAT. F34060127. Production of Bioinsectiside
From Bacillus thuringiensis subsp. aizawai Using Waste of Industrial Tofu As Substrate. Supervised by : Purwoko and Mulyorini Rahayuningsih. 2010.
ABSTRACT
This research was to obtain the best media formulation oftions for bioinsectisides production using Bacillus thuringiensis subsp. aizawai and to asses the level of toxicity against larvae Crocidolomia binotalis (cabbage worms).
Media formulation oftions using tofu waste and tofu waste water, with a ratio of 20: 80, 30: 70, and 40: 60 and the amount of starters added 10, 15, and 20 (% v /v). Observations done at 0, 30, and 48 hours of the cultivation time which include pH, total residual sugar, the total plate count, and the viable spore count. Toxicity tests were conducted by bioassay using larvae Crocidolomia binotalis (cabbage worms).
The analysis of raw materials obtained on the carbon content of tofu waste and tofu waste water at 5.64% (wb) and 0.27% (wb), while the nitrogen content of 0.42% (wb) and 0.02% (wb). During the cultivation, the pH in the cultivation liquid was increased while total sugars is decreased. The pH values during cultivation was ranging from 7.27 to 8.21. Efficient use of substrate for cultivation 30 hours ranged from 13.14% (C2) to 33.61% (A3) and for cultivation 48 hours ranged from 31.73% (C3) to 41.91% (B3).
The highest total plate count in this research is media formulation of B3 (2.14 x 108 cells/ml) with cultivation time during the 48 hours, whereas the lowest total plate count in this research is media formulation of A3 (1 x 107 cells/ml) with cultivation time during the 48 hours.
The highest amount of viable spore count in this research is the media formulation of B2 (2.95 x 107 spores/ml) with cultivation time during the 48 hours, whereas the lowest viable spore count in this research is the media formulation of A1 (1.25 x 106 spores/mL) with cultivation time during the 48 hours.
Cultivation during 30 hours using media formula A1 produces crystal protein in high toxicity to Croccidolomia binotalis larva. This is indicated by the highest toxicity level from bioassay test which shown by medium formulae of A1, which was 1,34 mg/L, and the lowest toxicity level was shown by media formulae of C3, which was 174,16 mg/L. Whereas cultivation during 48 hours using media formulation of A2 produces crystal protein in high toxicity to Croccidolomia binotalis larva. This is indicated by the highest toxicity level from bioassay test which shown by medium formulae of A1, which was 7,44 mg/L, and the lowest toxicity level was shown by media formulae of C3, which was 45636,00 mg/L. In the control (distilled water + prostiker) who were not given fluids bioinsectiside products not found of C. binotalis larva is dead, while in the commercial product (Bactospeine) toxicity was obtained at 0.05 mg / L with potential products 16 000 UI / mg.
PERNYATAAN
Saya menyatakan sebenar-benarnya bahwa skripsi yang berjudul “Produksi
Bioinsektisida Dari Bacillus thuringiensis subsp. aizawai Menggunakan Limbah Industri Tahu Sebagai Substrat” adalah hasil karya saya sendiri dengan arahan
dosen pembimbing, kecuali yang dengan jelas ditunjukkan rujukannya.
Bogor, Agustus 2010
MUHAMMAD SYUKUR SARFAT F34060127
BIODATA PENULIS
Muhammad Syukur Sarfat dilahirkan di Kendari pada tanggal 20 Oktober 1987. Putra pertama dari tujuh bersaudara ini menyelesaikan pendidikan dasar di SD Lahontohe tahun 1994 – 2000, Sekolah Lanjutan Tingkat Pertama di SLTP N 1 Tongkuno, tahun 2000 – 2003, dan Sekolah Menengah Atas di SMA N 1 Tongkuno tahun 2003 – 2006.
Pada tahun 2006, penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Pada Bulan Agustus 2010, penulis dinyatakan lulus dari perguruan tinggi tersebut setelah menyelesaikan tugas akhir yang berjudul “Produksi Bioinsektisida Dari Bacillus thuringiensis subsp. aizawai Menggunakan Limbah Industri Tahu Sebagai Substrat”.
i
KATA PENGANTAR
Segala puji dan syukur saya panjatkan atas kehadirat Tuhan Yang Maha Kuasa atas segala rahmat-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Produksi Bioinsektisida Dari Bacillus thuringiensis subsp. aizawai Menggunakan Limbah Industri Tahu Sebagai Substrat”. Skripsi ini disusun
berdasarkan penelitian yang dilakukan dari Bulan Maret 2010 sampai dengan Bulan Juli 2010.
Dalam pelaksanaannya, telah melibatkan banyak pihak yang turut serta ikut membantu saya sehingga skripsi ini dapat terselesaikan dengan baik. Oleh karena itu, saya ingin mengucapkan terima kasih kepada :
1. Kedua orang tua dan keluarga saya yang telah memberikan dukungan yang besar bagi saya.
2. Drs. Purwoko, M.Si dan Dr. Ir. Mulyorini Rahyuningsih, M.Si, staf pengajar pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, sebagai dosen Pembimbing Akademik.
3. Dr. Ir. Suprihatin selakku dosen penguji atas saran dan masukannya.
4. Ir. Djoko Priyono, M Agr., Bapak Agus, dan saudari Febri di Laboratorium Fisiologi dan Toksin Departemen Hama dan Penyakit Tanaman IPB, atas larva ulat Crocidolomia binotalis.
Saran, kritik, dan tanggapan dari semua pihak sangat penulis harapkan. Semoga karya ini dapat bermanfaat bagi pihak yang membutuhkan.
Bogor, Agustus 2010
Penulis
ii
UCAPAN TERIMAKASIH
Penelitian dan penyusunan skripsi yang berjudul “Produksi Bioinsektisida
Dari Bacillus thuringiensis subsp. aizawai Menggunakan Limbah Industri Tahu Sebagai Substrat” tidak terlepas dari bantuan berbagai pihak. Oleh karena itu,
penulis menyampaikan rasa terimakasih yang sebesar-besarnya kepada :
1. Laboran di Departemen TIN : Ibu Rini Purnawati, Ibu Egnawati Sari, Ibu Sri Mulyati, Bapak Edi Sumantri, Bapak Gunawan, Bapak Sugiardi, Bapak Yogi Suprayogi atas bantuan, keramahan, dan keleluasan selama penelitian.
2. Seluruh staf perpustakaan TIN, FATETA, PAU, Biologi, HPT, dan LSI atas bantuannya dalam mencari berbagai literatur.
3. Tim Bioinsektisida (Erlin, Bagus, dan Ibu Ai), Tim Gambir (Echa, Mita, Okta, dan Santi), Tim Rempah-Rempah (Yos dan Cis), Tim RSM (Riska, Sandra, dan Mita), Tim Karet (Syahrun dan Syafiq), Tim Bioetanol (Law-Law, Mumun, Oni, dan Martin), Tim Minuman (Nidia, Dian, dan Dadin), Tim Tepung-tepungan (Muthi dan Karo), Juliando, Pangeran, Yulia, dan Cucu atas bantuan dan motivasinya selama penelitian.
4. Sahabat-sahabat Kost Budarjo yang telah memberi bantuan, semangat, dan motivasi.
iii
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
UCAPAN TERIMAKASIH ... ii
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
II. TINJAUAN PUSTAKA ... 3
A. BIOINSEKTISIDA ... 3
B. LIMBAH INDUSTRI TAHU ... 3
C. Bacillus thuringiensis SEBAGAI BIOINSEKTISIDA ... 5
1. Bacillus thuringiensis (Bt) ... 5
2. Bacillus thuringiensis subsp. aizawai (Bta) Sebagai Bahan Aktif Bioinsektisida ... 7
3. KRISTAL PROTEIN (δ-endotoksin) Bacillus thuringiensis ... 8
4. PROSES TOKSISITAS DAN INFEKSI Bacillus thuringiensis... 10
D. FERMENTASI Bacillus thuringiensis subsp. aizawai DAN KONDISINYA ... 12
1. Media Pertumbuhan Dan Fermentasi ... 12
2. Kondisi Fermentasi... 14
3. Pemanenan (Recovery) ... 15
4. Penentuan Aktivitas Insektisida Mikroba ... 15
E. LARVA Croccidolomia binotalis (Ulat Kubis) SEBAGAI SERANGGA SASARAN Bacillus thuringiensis subsp. aizawai... 16
III. METODOLOGI PENELITIAN ... 18
A. BAHAN DAN ALAT ... 18
1. Bahan ... 18
iv
B. METODE PENELITIAN ... 18
1. Penelitian Pendahuluan ... 18
2. Penelitian Utama ... 19
3. Rancangan Percobaan ... 21
IV HASIL DAN PEMBAHASAN ... 23
A. HASIL ANALISIS KIMIA BAHAN BAKU ... 23
B. PERUBAHAN pH CAIRAN KULTUR ... 24
C. PERTUMBUHAN Bacillus thuringiensis subsp. aizawai SELAMA KULTIVASI ... 26
D. PENGGUNAAN SUBSTRAT SELAMA KULTIVASI ... 28
E. JUMLAH SPORA HIDUP (VSC) DALAM CAIRAN HASIL KULTIVASI ... 31
F. UJI TOKSISITAS BIOINSEKTISIDA ... 33
V. KESIMPULAN DAN SARAN ... 37
A. KESIMPULAN ... 37
B. SARAN ... 38
DAFTAR PUSTAKA ... 39
v
DAFTAR TABEL
Halaman
Tabel 1. Kandungan kimia limbah ampas tahu dan limbah cair tahu ... 5
Tabel 2. Kandungan Mineral Limbah Ampas Tahu ... 5
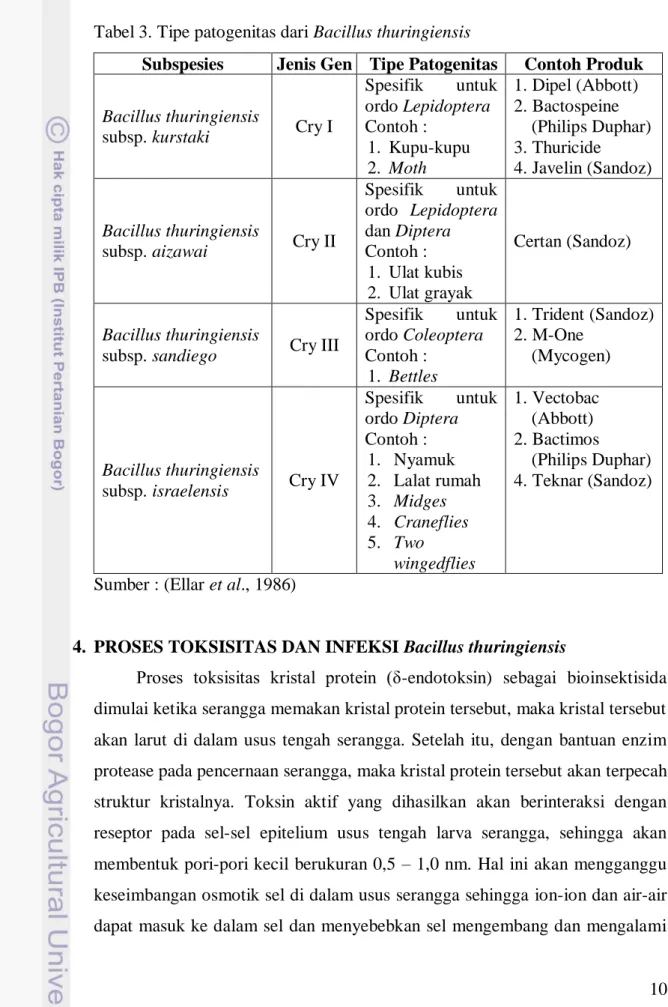
Tabel 3. Tipe patogenitas dari Bacillus thuringiensis ... 10
Tabel 4. Perbandingan Medium Kultivasi ... 19
Tabel 5. Perlakuan pada kultivasi Bta ... 20
Tabel 6. Hasil analisis kimia ampas tahu (AT) dan limbah cair tahu (LCT) ... 23
Tabel 7. Hasil perhitungan penambahan urea untuk memperoleh C/N ratio 7:1 23 Tabel 8a. Tingkat mortalitas larva Croccidolomia binotalis (instar II) terhadap produk bioinsektisida (kultivasi selama 30 jam) ... 34
Tabel 8b. Tingkat mortalitas larva Croccidolomia binotalis (instar II) terhadap produk bioinsektisida (kultivasi selama 48 jam) ... 34
Tabel 9. Perbandingan antara LC50 dan potensi produk untuk masing-masing perlakuan (kultivasi 30 jam dan 48 jam) serta produk komersial... 35
vi
DAFTAR GAMBAR
Halaman
Gambar 1. Sel Bacillus thuringiensis ... 6
Gambar 2. Spora dan kristal protein Bacillus thuringiensis di dalam sel vegetatifnya ... 7
Gambar 3. Bentuk kristal protein Bacillus thuringiensis berbentuk bipiramida .. 9
Gambar 4. Proses toksisitas Bacillus thuringiensis pada larva ulat ... 11
Gambar 5. Larva, Kepompong, dan telur Croccidolomia binotalis ... 17
Gambar 6. Diagram Alir Pembiakan Inokulum ... 19
Gambar 7. Diagram alir proses produksi bioinsektisida ... 21
Gambar 8. Perubahan pH cairan kultivasi selama kultivasi Bta dalam media dengan berbagai formulasi media ... 25
Gambar 9. Pengaruh kombinasi media terhadap jumlah sel ... 27
Gambar 10. Penggunaan substrat selama kultivasi Bta dalam media dengan berbagai formulasi media ... 29
Gambar 11. Efisiensi penggunaan substrat selama kultivasi Bta dalam media dengan berbagai formulasi media ... 30
vii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Metode Analisis Pada Penelitian ... 46 Lampiran 2. Perhitungan Susunan Medium Kultivasi ... 52 Lampiran 3. Rekapitulasi Data pH Rata-Rata Media Kultivasi Pada Jam Ke-0,
Jam Ke-30, dan Jam Ke-48 (dua kali ulangan) ... 54 Lampiran 4. Rekapitulasi Data Log Jumlah Sel Hidup (TPC) Rata-Rata Media
Kultivasi Pada Jam Ke-0, Jam Ke-30, dan Jam Ke-48 (dua kali ulangan) ... 55 Lampiran 5. Rekapitulasi Data Total Gula Rata-Rata Media Kultivasi Pada
Jam Ke-0, Jam Ke-30, dan Jam Ke-48 (dua kali ulangan) ... 56 Lampiran 6. Rekapitulasi Data Log Jumlah Spora Hidup (VSC) Rata-Rata
Media Kultivasi Pada Jam Ke-0, Jam Ke-30, dan Jam Ke-48 (dua kali ulangan)... 57 Lampiran 7. Contoh Penentuan LC50 Menggunakan Program Probit Quant .... 58 Lampiran 8. Hasil Analisis Ragam Uji F dan Uji Beda Nyata Terkecil Terhadap
Perbedaan Formulasi Media, Perbedaan Waktu Kultivasi, Serta Interaksi Antara Keduanya Terhadap Jumlah Sel Hidup Pada Cairan Kultivasi (α = 0.05) ... 59 Lampiran 9. Hasil Analisis Ragam Uji F dan Uji Beda Nyata Terkecil Terhadap
Perbedaan Formulasi Media, Perbedaan Waktu Kultivasi, Serta Interaksi Antara Keduanya Terhadap Jumlah Spora Hidup Pada Cairan Kultivasi (α = 0.05) ... 62 Lampiran 10. Hasil Analisis Ragam Uji F dan Uji Beda Nyata Terkecil Terhadap
Perbedaan Formulasi Media, Perbedaan Waktu Kultivasi, Serta Interaksi Antara Keduanya Terhadap Total Gula Pada Cairan Kultivasi (α = 0.05) ... 65 Lampiran 11. Hasil Analisis Ragam Uji F dan Uji Beda Nyata Terkecil Terhadap
Perbedaan Formulasi Media, Perbedaan Waktu Kultivasi, Serta Interaksi Antara Keduanya Terhadap Nilai pH Pada Cairan Kultivasi (α = 0.05) ... 67 Lampiran 12. Hasil Analisis Ragam Uji F dan Uji Beda Nyata Terkecil Terhadap
Perbedaan Konsentrasi Media, Perbedaan Konsentrasi Starter, Serta Interaksi Antara Keduanya Terhadap Jumlah Sel Hidup Pada Cairan Kultivasi (α = 0.05) ... 69 Lampiran 13. Hasil Analisis Ragam Uji F dan Uji Beda Nyata Terkecil Terhadap
viii Serta Interaksi Antara Keduanya Terhadap Jumlah Spora Hidup Pada Cairan Kultivasi (α = 0.05) ... 73 Lampiran 14. Hasil Analisis Ragam Uji F dan Uji Beda Nyata Terkecil Terhadap
Perbedaan Konsentrasi Media, Perbedaan Konsentrasi Starter, Serta Interaksi Antara Keduanya Terhadap Total Gula Pada Cairan Kultivasi (α = 0.05) ... 77 Lampiran 15. Hasil Analisis Ragam Uji F dan Uji Beda Nyata Terkecil Terhadap
Perbedaan Konsentrasi Media, Perbedaan Konsentrasi Starter, Serta Interaksi Antara Keduanya Terhadap Nilai pH Pada Cairan Kultivasi (α = 0.05) ... 82 Lampiran 16. Konsentrasi Pengenceran Untuk Pengamatan Tingkat Toksisitas
(Bioassay) Hasil Kultivasi ... 86 Lampiran 17. Dokumentasi Penelitian ... 87
1
I. PENDAHULUAN
A. LATAR BELAKANG
Bioinsektisida merupakan salah satu dari beberapa jenis pestisida yang digunakan untuk mengendalikan hama berupa serangga. Bioinsektisida dapat dibedakan menjadi dua, yaitu ovisida dan larvisida. Ovisida khusus digunakan untuk mengendalikan telur serangga, sedangkan larvisida khusus digunakan untuk mengendalikan larva serangga. Bioinsektisida memanfaatkan bakteri, cendawan, jamur, nematoda untuk membunuh hama serangga. Bioinsektisida juga merupakan insektisida generasi baru dan sangat dianjurkan untuk digunakan dalam PHT (Pengendalian Hama Terpadu) (Djojosumarto, 2008).
Mikroorganisme yang sering digunakan dalam memproduksi insektisida mikroba adalah Bacillus thuringiensis (Bt). Bt merupakan spesies bakteri dari genus Bacillus yang tergolong dalam kelompok bakteri gram positif. Bt diisolasi pertama kali pada tahun 1902, yang ditemukan di dalam larva ulat sutra (Bombyx mori) yang mati. Bt juga merupakan patogen (penyebab penyakit) bagi berbagai jenis serangga yang sangat spesifik. Saat sporulasi, bakteri menghasilkan kristal protein yang mengandung senyawa insektisida δ-endotoksin yang bekerja merusak sistem pencernaan serangga sehingga menyebabkan serangga akan berhenti makan dan mati dalam 1 – 4 hari (Djojosumarto, 2008). Sampai saat ini, semua formulasi komersial insektisida Bt merupakan campuran antara bahan aktif bakteri dengan bahan pembawa. Bahan aktif tersebut merupakan campuran antara spora dan kristal protein.
Secara umum, produksi Bt sebagai bioinsektisida dapat dilakukan dengan dua cara, yaitu fermentasi semi padat (semi solid cultivation) dan fermentasi terendam (subsmerged cultivation). Fermentasi berarti pemberian makanan mikroba dengan menghasilkan suatu yang bermanfaat atau produk akhir yang berharga dari metabolismenya (Vandekar dan Dulmage, 1982).
Produk Bt yang beredar di pasaran terdiri dari beberapa varietas atau subspesies Bt, masing-masing dengan berbagai strain, serotype, dan sebagainya. Namun pada penelitian ini, bioinsektisida yang akan diproduksi adalah Bacillus
2 thuringiensis subsp. aizawai. Bakteri ini sangat efektif dalam mengendalikan larva Lepidoptera, utamanya ulat daun kubis dan hama-hama sayuran lainnya. Produk komersial Bt telah beredar di pasaran dengan merek dagang Bactospeine/Duphar, Dipel/Abbott, dan Thuricide/Sandoz yang masih diimpor dari luar negeri. Oleh karena itu, perlu dilakukan upaya untuk memproduksi sendiri bioinsektisida tersebut dari bahan yang ada di dalam negeri sehingga dapat menghindari ketergantungan akan bahan-bahan impor.
Banyak media yang digunakan berasal dari bahan-bahan yang tersedia di alam yang mengandung karbon, nitrogen, dan mineral seperti bahan-bahan yang mengandung karbohidrat misalnya jagung, pati, molases, atau padi-padian sebagai sumber C (karbon) dan bahan-bahan yang mengandung protein seperti tepung biji kapas, corn steep liquor sebagai sumber N (nitrogen) (Couch dan Ross, 1980).
Dalam penelitian ini, ampas tahu dan limbah cair tahu digunakan sebagai substrat dalam fermentasi. Kondisi perbandingan sumber karbon dan sumber nitrogen dalam media yang digunakan mengacu pada hasil penelitian Wicaksono (2002) dan pernyataan Dulmage et al. (1990), yaitu 7 : 1. Untuk memperoleh rasio C/N yang sesuai, maka perlu ditambahkan urea. Alasan menggunakan ampas tahu dan limbah cair tahu sebagai substrat karena keduanya memiliki nutrisi, vitamin, dan mineral yang baik untuk pertumbuhan mikroba. Selain itu, penelitian ini mencoba memanfaatkan limbah hasil pertanian sebagai substrat dalam memproduksi bioinsektisida Bt secara fermentasi semi padat dan kedua bahan tersebut mudah didapatkan dengan harga yang relatif murah.
B. TUJUAN
Tujuan penelitian secara umum adalah memanfaatkan ampas tahu dan limbah cair tahu untuk produksi bioinsektisida dari Bacillus thuringiensis subsp. aizawai. Sedangkan tujuan penelitian secara khusus adalah untuk mengetahui pengaruh perbandingan ampas tahu dan limbah cair tahu terhadap produksi bioinsektisida Bta.
3
II. TINJAUAN PUSTAKA
A. BIOINSEKTISIDA
Bioinsektisida (insektisida mikrobial) merupakan produk yang dihasilkan oleh mikroorganisme yang dapat membunuh hama serangga dan vektor pembawa penyakit. Insektisida mikrobial didefinisikan juga sebagai racun biologis yang dihasilkan oleh mikroorganisme yang dapat membunuh serangga (entomopathogen). Sebagai entomopathogen, insektisida mikrobial dapat dikembangkan dari bakteri, virus, fungi, dan protozoa (Ignoffo dan Anderson, 1979). Adapun bakteri yang paling banyak digunakan untuk memproduksi bioinsektisida adalah Bcillus. Bakteri ini mampu membentuk δ-endotoksin yang bersifat toksin terhadap larva serangga (Bravo, 1997).
Penggunaan bioinsektisida ditujukan untuk menggantikan insektisida kimia yang banyak digunakan selama ini. Menurut Behle et al. (1999), bioinsektisida memiliki beberapa keunggulan dibandingkan dengan insektisida kimia. Keunggulan tersebut adalah sifat dari bioinsektisida yang spesifik terhadap hama serangga sehingga tidak membahayakan organisme non target lainnya, penggunaannya aman, dan bersifat ramah lingkungan karena tidak menyebabkan terjadinya penumpukan residu pada hasil pertanian dan dalam tanah. Menurut Becker dan Margalit (1993), penggunaan insektisida kimia dengan dosis dan frekuensi yang tinggi menjadikan serangga vektor penyakit menjadi resisten terhadap insektisida kimia tersebut dan menyebabkan terganggunya keseimbangan ekosistem.
B. LIMBAH INDUSTRI TAHU
Proses produksi tahu menghasilkan 2 jenis limbah, yaitu limbah padat dan limbah cairan. Pada umumnya, limbah padat dimanfaatkan sebagai pakan ternak dan dibuat kerupuk, sedangkan limbah cair dibuang langsung ke lingkungan. Limbah cair pabrik tahu ini memiliki kandungan senyawa organik yang tinggi. Tanpa proses penanganan dengan baik, limbah tahu menyebabkan dampak negatif
4 seperti polusi air, sumber penyakit, bau tidak sedap, meningkatkan pertumbuhan nyamuk, dan menurunkan estetika lingkungan sekitar (Anonim, 2009).
Ampas tahu merupakan hasil samping dalam proses pembuatan tahu yang diperoleh dari hasil penyaringan susu kedelai. Ampas tahu masih mengandung protein yang relative tinggi, karena pada proses pembuatan tahu tidak semua bagian protein bisa diekstrak, terutama jika menggunakan proses penggilingan sederhana & tradisional. Menurut Nurdjannah dan Usmiati (2009), kadar protein ampas tahu cukup tinggi yakni sekitar 6%. Pada umumnya ampas tahu dimanfaatkan untuk pakan ternak atau campuran oncom dan tempe gembus. Ampas tahu mempunyai peluang untuk digunakan dalam pembuatan tepung kaya serat dan protein yang dapat diaplikasikan untuk berbagai produk pangan, dan sebagai media tumbuh dan perkembangan jamur.
Proses pembuatan tahu tradisional hanya mampu mengekstrak sebagian protein kedelai, protein yang tidak terekstrak tetap bersama-sama matriknya dalam ampas tahu. Ampas tahu segar mempunyai tekstur yang lembek dengan kadar air yang tinggi serta memiliki daya tahan yang tidak lebih dari 24 jam dalam keadaan terbuka karena dapat terjadi kebusukan akibat timbulnya NH3. Cara pengawetan ampas tahu adalah melalui pengeringan dengan oven menggunakan panas 45 – 50 0C selama 24 – 48 jam (Prabowo et al, 1985).
Ampas tahu yang dihasilkan oleh tiap-tiap pabrik tahu mempunyai komposisi yang tidak sama. Perbedaan ini disebabkan karena perbedaan penggunaan bahan dasar campuran, peralatan maupun proses pengolahan yang dijalankan. Pada pengolahan tahu masih banyak protein yang tertinggal dalam ampas tahu. Kandungan kimia limbah ampas tahu dan limbah cair tahu dapat dilihat pada Tabel 1. Sedangkan kandungan mineral limbah ampas tahu dapat dilihat pada Tabel 2.
5 Tabel 1. Kandungan kimia limbah ampas tahu dan limbah cair tahu
Komponen Jumlah (% berat basis kering1 dan basis basah2)
Limbah ampas tahu1 Limbah limbah cair tahu2
Air 13,83* 99,34*** Abu 3,36* 0,11*** Protein 15,75* 1,73**** Lemak 12,10* 0,6300**** Nitrogen 2,52* 0,05*** Serat 19,4700** -
Sumber :* (Debby, et al., 2005) ** (Ridawati, 1993) *** (Hartati, 2010) **** (Nuraida ,dkk, 1996)
Tabel 2. Kandungan Mineral Limbah Ampas Tahu
Komponen Jumlah (ug/g)
Ca 890,750 Mg 358,520 Fe 124,660 Cu 5,550 Pb 2,288 Zn 0,490 Sumber : (Ridawati, 1993)
C. Bacillus thuringiensis SEBAGAI BIOINSEKTISIDA
1. Bacillus thuringiensis (Bt)
Bt merupakan bakteri yang berbentuk batang dengan ukuran 3 – 5 µm dan lebar 1,0 – 1,2 µm ketika tumbuh pada media. Bakteri ini tergolong kedalam kelas Schizomycetes, ordo Eubacteriales, dan famili Bacillaceae. Bakteri ini bersifat gram positif, aerob tetapi umumnya aerob fakultatif, dan berflagelum. Bakteri ini dapat membentuk spora secara aerobik dan selama masa sporulasi juga dapat membentuk kristal protein yang toksik. Kristal protein ini dikenal dengan nama δ-endotoksin (Shieh, 1994). Dulmage (1981) menyatakan bahwa selain menghasilkan δ-endotoksin, bakteri ini juga mampu menghasilkan α-eksotoksin, β-eksotoksin, dan faktor kutu. α-eksotoksin memiliki sifat yang tidak tahan terhadap panas dan larut di dalam air. β-eksotoksin memiliki sifat yang tahan terhadap panas, larut di dalam air, dan
6 sangat beracun terhadap larva beberapa jenis lalat. β-eksotoksin diproduksi pada masa pertumbuhan sel vegetatif dan terdiri atas adenine, ribose, glukosa, dan asam allaric dengan sekelompok fosfat. Sel-sel vegetatif yang dihasilkan dapat membentuk suatu rantai yang terdiri dari lima sampai enam sel. Bakteri Bacillus thuringiensis dapat dilihat pada Gambar 1.
Gambar 1. Sel Bacillus thuringiensis dalam perbesaran 1000 kali [spora intraseluler (terang) dan kristal protein (gelap)]
(hpt://www.textbookofbacteriology.net)
Bt merupakan bakteri yang paling penting secara ekonomi dan terbanyak digunakan untuk produksi bioinsektisida, sehingga bioinsektisida komersial Bt digunakan secara luas untuk mengendalikan larva hama serangga (Feitelson, et al., 1992). Selain itu, menurut de Barjac dan Frachon (1990), Bt mempunyai sifat yang spesifik, aman terhadap lingkungan, dan bersifat entomopatogenik.
Spora Bt berbentuk oval, letaknya subterminal, berwarna hijau kebiruan, dan berukuran 1,0 – 1,3 µm. Pembentukan spora terjadi dengan cepat pada suhu 35 – 37 0C. Spora tersebut relatif tahan terhadap pengaruh fisik dan kimia. Spora ini mengandung asam dipikolinik (DPA), merupakan 10 – 15 % dari berat kering spora. Asam ini bisa terdapat dalam bentuk kombinasi dengan unsur kalsium. Spora dan kristal Bacillus thuringiensis dapat dilihat pada Gambar 2.
Spora
7 Gambar 2. Spora dan kristal protein Bacillus thuringiensis di dalam sel
vegetatifnya
(http://www.gmo-safety.eu/en/maize/bt-concept/552.docu.html)
2. Bacillus thuringiensis subsp. aizawai (Bta) Sebagai Bahan Aktif Bioinsektisida
Bacillus thuringiensis subsp. aizawai (Bta) pertama kali ditemukan oleh Aizawa pada tahun 1962 (Dulmage, 1981). Bakteri ini mempunyai endospora subterminal berbentuk oval dan selama masa sporulasi menghasilkan satu kristal protein dalam setiap selnya. Kristal protein ini dikenal juga sebagai δ-endotoksin yang merupakan komponen utama yang menyebabkannya bersifat insektisidal. Menurut Faust dan Bulla (1982), δ-endotoksin tersebut bersifat termolabil karena dapat terdenaturasi oleh panas (walaupun lebih stabil dibandingkan eksotoksin yang terlarut) dan tidak larut dalam pelarut organik namun larut dalam pelarut alkalin.
Sebagai organisme mesofilik, kisaran suhu pertumbuhannya ialah 15 – 45 0C dengan suhu optimum 26 – 30 0C . Kisaran pH pertumbuhannya ialah 5,5 – 8,5 dengan pH optimum 6,5 – 7,5 (Benhard dan Utz, 1993).
Bta dapat membentuk endospora yang berbentuk elips di bagian subterminal sel. Seperti halnya pada Bacillus thuringiensis lain, selama masa sporulasi, Bta membentuk tubuh paraspora berupa kristal protein yang disebut juga δ-endotoksin (Sneath, 1986).
Kristal protein Bta berbentuk bipiramida yang bersifat insektisida terhadap larva serangga yang tergolong dalam ordo Lepidoptera dan Diptera (Lereclus et al., 1993).
8 Sifat insektisida Bta berhubungan dengan gen penyandi kristal protein yang disebut gen cry. Menurut klasifikasi terbaru, dikenali ada 22 gen cry dan 2 gen cyt. Gen cry yang dimiliki Bta meliputi cry1A(a), cry1A(b), cry1C(a), cry1D(a) (Crickmore et al., 1998). Protein cry1C(a) menyandikan protein yang toksik terhadap Spodoptera litura, sedangkan protein cry1 lain yang dimiliki Bta, yaitu cry1A(a), cry1A(b), cry1D(a) kurang toksik terhadap Spodoptera litura, tetapi dapat memberikan pengaruh sinergis pada protein cry1C(a) sehingga dapat meningkatkan keampuhannya (Muller et al., 1996). Sedangkan menurut Liu et al (1998), pada beberapa kasus, spora ternyata secara sinergis dapat meningkatkan toksisitas kristal protein. Pada Bta, sinergisme yang terjadi adalah antara spora dengan protein cry1C(a) tetapi tidak dengan protein cry1 yang lain.
3. KRISTAL PROTEIN (δ-endotoksin) Bacillus thuringiensis
Menurut Aronson et al. (1986) dan Gill et al. (1992), komponen utama penyusun kristal protein pada sebagian besar Bt adalah polipeptida dengan berat molekul (BM) berkisar antara 130 sampai 140 kilodalton (kDa). Polipeptida ini adalah protoksin yang dapat berubah menjadi toksin dengan BM yang bervariasi dari 30 sampai 80 kDa, setelah megalami hidrolisis pada kondisi pH alkali dan adanya protease dalam saluran pencernaan serangga. Aktivitas insektisida tersebut akan menghilang jika BM lebih rendah dari 30 kDa.
Kristal protein ini terbentuk bersamaan dengan pembentukan spora, yaitu pada waktu sel mengalami sporulasi. Kristal tersebut merupakan komponen protein yang mengandung toksin (δ-endotoksin) yang terbentuk di dalam sel selama 2 – 3 jam setelah akhir fase eksponensial dan baru keluar dari sel pada waktu sel mengalami autolisis setelah sporulasi sempurna. Sekitar 95 % dari keseluruhan komponen kristal terdiri dari protein dengan asam amino (umumnya terdiri dari asam glutamat, asam aspartat, dan arginin), sedangkan 5 % sisanya terdiri dari karbohidrat yaitu mannosa dan glukosa (Bulla et al., 1977).
9 Kristal protein Bt mempunyai beberapa bentuk, diantaranya bentuk bulat pada subsp. israelensis yang toksik terhadap Diptera, bentuk kubus yang toksis terhadap Diptera tertentu dan Lepidoptera, bentuk pipih empat persegi panjang (flat rectangular) pada subsp. tenebriosis yang toksis terhadap Coleoptera, bentuk piramida pada subsp. kurstaki yang toksik terhadap Lepidoptera (Shieh, 1994).
Sedangkan menurut Trizelia (2001), kristal protein memiliki beberapa bentuk. Ada hubungan nyata antara bentuk kristal dengan kisaran daya bunuhnya. Varietas yang memiliki daya bunuh terhadap serangga ordo Lepidoptera memiliki kristal protein yang berbentuk bipiramida dan jumlahnya hanya satu tiap sel, sedangkan yang berbentuk kubus, oval, dan amorf umumnya bersifat toksik terhadap serangga ordo Diptera dan jumlahnya dapat lebih dari satu tiap sel. Kristal yang memiliki daya bunuh terhadap serangga ordo Coleoptera berbentuk empat persegi panjang dan datar atau pipih. Bentuk kristal protein Bacillus thuringiensis dapat dilihat pada Gambar 3.
Gambar 3. Bentuk kristal protein Bacillus thuringiensis berbentuk bipiramida (http://ejournal.vudat.msu.edu/index.php/mmg445/issue/view/1)
Hofte dan Whiteley (1989) menjelaskan bahwa terdapat 14 gen penyandi kristal protein, 13 diantaranya disebut gen Cry (kristal protein) dan satu gen disebut dengan gen Cyt (sitolitik). Ke 13 gen Cry tersebut dikelompokkan ke dalam empat kelas berdasarkan kesamaan struktur asam-asam amino dan spektrum aktivitas insektisidanya. Masing-masing kelas mempunyai toksisitas yang spesifik terhadap jenis serangga tertentu. Berdasarkan tipe
10 patogenitasnya, Bacillus thuringiensis dapat dikelompokkan seperti terlihat pada Tabel 3.
Tabel 3. Tipe patogenitas dari Bacillus thuringiensis
Subspesies Jenis Gen Tipe Patogenitas Contoh Produk
Bacillus thuringiensis
subsp. kurstaki Cry I
Spesifik untuk ordo Lepidoptera Contoh : 1. Kupu-kupu 2. Moth 1. Dipel (Abbott) 2. Bactospeine (Philips Duphar) 3. Thuricide 4. Javelin (Sandoz) Bacillus thuringiensis
subsp. aizawai Cry II
Spesifik untuk ordo Lepidoptera dan Diptera Contoh : 1. Ulat kubis 2. Ulat grayak Certan (Sandoz) Bacillus thuringiensis
subsp. sandiego Cry III
Spesifik untuk ordo Coleoptera Contoh : 1. Bettles 1. Trident (Sandoz) 2. M-One (Mycogen) Bacillus thuringiensis
subsp. israelensis Cry IV
Spesifik untuk ordo Diptera Contoh : 1. Nyamuk 2. Lalat rumah 3. Midges 4. Craneflies 5. Two wingedflies 1. Vectobac (Abbott) 2. Bactimos (Philips Duphar) 4. Teknar (Sandoz)
Sumber : (Ellar et al., 1986)
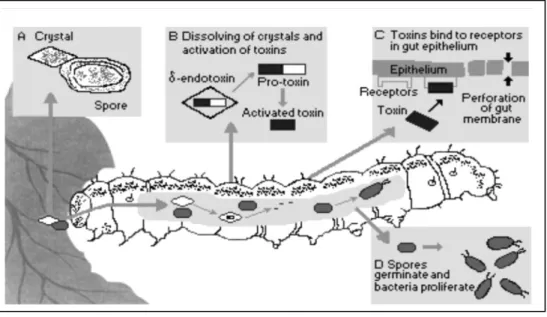
4. PROSES TOKSISITAS DAN INFEKSI Bacillus thuringiensis
Proses toksisitas kristal protein (δ-endotoksin) sebagai bioinsektisida dimulai ketika serangga memakan kristal protein tersebut, maka kristal tersebut akan larut di dalam usus tengah serangga. Setelah itu, dengan bantuan enzim protease pada pencernaan serangga, maka kristal protein tersebut akan terpecah struktur kristalnya. Toksin aktif yang dihasilkan akan berinteraksi dengan reseptor pada sel-sel epitelium usus tengah larva serangga, sehingga akan membentuk pori-pori kecil berukuran 0,5 – 1,0 nm. Hal ini akan mengganggu keseimbangan osmotik sel di dalam usus serangga sehingga ion-ion dan air-air dapat masuk ke dalam sel dan menyebebkan sel mengembang dan mengalami
11 lisis (hancur). Larva akan berhenti makan dan akhirnya mati (Hofte dan Whiteley, 1989; Gill et al., 1992).
Kristal protein yang bersifat insektisida ini sebenarnya hanya protoksin yang jika larut dalam usus serangga akan berubah menjadi polipeptida yang lebih pendek (27 – 147 kDa). Pada umumnya, kristal protein di alam bersifat protoksin karena adanya aktivitas proteolisis dalam sestem pencernaan serangga yang mengubah Bt protoksin menjadi polipeptida yang lebih pendek dan bersifat toksin. Toksin yang telah aktif berinteraksi dengan sel-sel epitelium di usus tengah serangga sehingga menyebabkan terbentuknya pori-pori di sel membran saluran pencernaan serangga (Bahagiawati, 2002). Proses toksisitas Bacillus thuringiensis pada larva ulat dapat dilihat pada Gambar 4.
Gambar 4. Proses toksisitas Bacillus thuringiensis pada larva ulat (http://www.inchem.org/documents/ehc/ehc/ehc217.htm)
Kristal protein Bta yang tersusun atas protein cry1A(a) (32%), cry1A(b) (38%), cry1C(a) (26%), cry1D(a) (5%) (Wright et al., 1997) dengan berat molekul 130 – 140 kDa, apabila terserap dalam suasana basah, saluran pencernaan tengah serangga yang rentan akan terlarut dan terhidrolisis untuk menghasilkan protein toksin. Selama aktivitas proteolitiknya tersebut, protease akan mengubah polipeptida tersebut menjadi fragmen toksin aktif berukuran 60 – 70 kDa. Protein cry1A(a dan cry1A(b) akan berikatan dengan reseptor spesifik yang berukuran 210 kDa pada membran mikrofili apical sel epithelium
12 usus tengah serangga, sementara protein cry1C(a) berikatan dengan reseptor lainnya yang berukuran 40 kDa (Maagd et al., 1996). Ikatan antara toksin dengan reseptornya itu akan menginduksi perubahan konformasi toksin yang diikuti dengan penyisipan toksin pada membran sehingga terjadi oligomerisasi toksin berupa lubang pada pori membran (Bravo, 1997). Fenomena tersebut mengakibatkan system pompa ion K+ pada membran aplikasinya tidak berfungsi sehingga mengganggu keseimbnagan osmotik yang berakibat lisisnya sel. Akhirnya, larva akan berhenti makan dan mati karena gejala septisemia setelah satu atau tiga hari (Aronson et al., 1986 ; Hofte and Whiteley, 1989 ; Prieto-Samsonov et al., 1997).
Aktivitas toksin dari kristal protein ini tergantung pada sifat intrinsik dari usus serangga, seperti pH dari sekresi enzim proteolitik dan kehadiran spora bakteri secara terus menerus beserta kristal protein yang termakan (Burgerjon dan Martouret, 1971). Selain itu, efektifitas dari toksin tertentu dipengaruhi oleh kelarutan, afinitas tehadap reseptor yang ada serta pemecahan proteolitik ke dalam toksin. Cara kerja kristal protein sebagai toksin dari Bt dapat dipengaruhi oleh dua faktor, yaitu faktor spesifikasi dari mikroorganisme dan kerentanan dari serangga sasaran (Milne et al., 1990). Selain itu, umur dari serangga merupakan salah satu faktor yang menentukan toksisitas dari Bt. Jentik serangga yang lebih muda lebih rentan jika dibandingkan dengan jentik yang lebih tua (Swadener, 1994).
D. FERMENTASI Bacillus thuringiensis subsp. aizawai DAN KONDISINYA
1. Media Pertumbuhan Dan Fermentasi
Faktor yang mempengaruhi fermentasi Bt adalah komponen medium dan kondisi fermentasi untuk pertumbuhan seperti pH, kelarutan oksigen, dan temperatur (Dulmage dan Rhodes, 1971). Dalam pertumbuahan mikroorganisme membutuhkan sumber air, karbon, nitrogen, unsur mineral, dan faktor pertumbuhan dalam medium pertumbuahannya (Vandekar dan Dulmage, 1982). Medium basal untuk pertumbuhan Bt terdiri dari garam, glukosa, dan asam amino, seperti asam glutamat, asam aspartat, dan alanin
13 dalam konsentrasi yang cukup untuk mendukung pertumbuhan dan sporulasi Bt (Dulmage et al., 1990).
Pearson dan Ward (1988) mengemukakan bahwa komposisi medium berpengaruh pada produk bioinsektisida yang dihasilkan. Beberapa formula medium menghasilkan jumlah sel maksimum dan waktu terjadinya lisis sel yang berbeda-beda. Hal ini didukung juga oleh pendapat Mummigatti dan Raghunathan (1990) bahwa komposisi medium berpengaruh terhadap pertumbuhan, toksisitas, dan potensi produk Bt.
Menurut Dulmage dan Rhodes (1971), karbon adalah bahan utama untuk mensintesis sel baru atau produk sel. Beberapa sumber karbon yang dapat digunakan untuk memproduksi bioinsektisida Bt dengan fermentasi terendam adalah glukosa, sirup jagung, dekstrosa, sukrosa, laktosa, pati, minyak kedelai, dan molases dari bit dan tebu. Dalam penentuan sumber karbon, konsentrasi yang digunakan harus dipilih secara hati-hati. Hal ini disebabkan karena semua galur Bt yang telah diteliti sejauh ini dapat memproduksi asam dari metabolisme glukosa. Menurut Rehm dan Reed (1981), jika konsentrasi glukosa terlalu tinggi, yaitu 50 g/l, pH medium akan turun lebih rendah dari 5,6 – 5,8 dan keasaman yang terlalu tinggi akan menghambat dan menghentikan pertumbuhan Bt. Akan tetapi, jika konsentrasi gula terlalu rendah, menurut Vandekar dan Dulmage (1982), akan dapat menghentikan pertumbuhan Bt dengan segera, sehingga biomassa yang dihasilkan akan kurang baik karena dapat memperlambat proses sporulasi yang menyebabkan proses fermentasi menjadi lebih lama.
Nitrogen yang dibutuhkan oleh mikroorganisme biasanya dipenuhi oleh garam amonium. Dalam hal ini, sering nitrogen organik harus disediakan dalam bentuk asam amino tunggal atau bahan kompleks termasuk asam nukleat dan vitamin. Beberapa sumber nitrogen yang sering digunakan dalam memproduksi bioinsektisida Bt adalah tepung kedelai, tepung biji kapas (proflo), corn steep, gluten jagung, ekstrak khamir, pepton kedelai, tepung ikan, tripton, tepung indosperma, dan kasein.
Selain sumber karbon dan nitrogen, mikroorganisme juga memerlukan mineral untuk pertumbuhan dan pembentukan produk metabolit. Kebutuhan
14 mineral bervariasi tergantung pada jenis mikroorganisme yang ditumbuhkan. Menurut Dulmage dan Rhodes (1971), garam-garam organik yang dibutuhkan untuk pertumbuhan mikroorganisme meliputi K, Mg, P, S, dan yang diperlukan dalam jumlah yang sedikit seperti Ca, Zn, Fe, Co, Cu, Mo, dan Mn. Dalam medium fermentasi Bt ditambahkan 0,3 g/l MgSO4.7H2O, 0,02 g/l MnSO4. H2O, 0,02 g/l ZnSO4.7 H2O, 0,02 g/l FeSO4.7 H2O, dan 1,0 g/l CaCO3.
Menurut Dulmage dan Rhodes (1971), Ca selain berperan dalam pertumbuhan dan produksi δ-endotoksin juga berfungsi untuk menjaga kestabilan spora terhaap panas. Penambahan ion Mg2+, Mn2+, Zn2+, dan Ca2+ ke dalam medium perlu dipertimbangkan, karena berperan dalam pertumbuhan dan sporulasi Bt (Vandekar dan Dulmage, 1982).
2. Kondisi Fermentasi
Kondisi fermentasi Bt dalam labu kocok dilakukan pada suhu 28 – 32 0C, pH awal medium diatur sekitar pH 6,8 – 7,2, agitasi 142 – 340 rpm, dan dipanen pada waktu inkubasi 24 – 48 jam. Sedangkan fermentasi Bt dalam fermentor dilakukan pada kondisi suhu 28 – 32 0C, pH awal medium sekitar 6,8 – 7,2, volume medium sekitar setengah sampai dua per tiga dari kapasitas volume fermentor, agitasi 400 – 700 rpm, aerasi 0,5 – 1,5 volume udara/volume medium/menit (v/v/m), dan dipanen pada waktu inkubasi 40 – 72 jam (Vandekar dan Dulmage, 1982; Pearson dan Word, 1988; dan Sikdar et al., 1993).
Pertumbuhan optimum sebahagian bakteri terjadi pada pH sekitar 7. Nilai pH awal medium fermentasi sering kali diatur dengan menggunakan larutan penyangga atau dengan penambahan alkali atau asam steril. Nilai pH awal untuk medium fermentasi Bacillus ditentukan pada kisaran 6,8 – 7,2. Selama fermentasi pH dapat berubah dengan cepat tergantung pada penggunaan karbohidrat dan protein. Penggunaan karbohidrat yang terlalu banyak daripada protein dapat menurunkan pH, sedangkan penggunaan protein yang terlalu banyak daripada karbohidrat dapat menaikan pH. Nilai pH dapat dikendalikan dengan memelihara keseimbangan antara senyawa gula dan nitrogen (Quinlan dan Lisansky, 1985).
15 Menurut Vandekar dan Dulmage (1982), tiap mikroorganisme akan berbeda-beda dalam hal kebutuhan oksigen, dan kebutuhan ini akan berubah-ubah selama fase pertumbuhan yang berbeda. Dalam kondisi fermentasi yang aerob, penting untuk memperoleh campuran yang sesuai antara mikroorganisme, nutrien, dan udara. Untuk memperoleh hal tersebut harus dilakukan agitasi secara terus-menerus terhadap cairan fermentasi selama proses fermentasi. Hal ini penting apabila kultur ditumbuhkan dalam tabung atau labu. Agitasi dan aerasi tidak praktis jika dilakukan terhadap setiap labu secara sendiri-sendiri, maka aerasi dilakukan di atas mesin kocok.
Aerasi dibutuhkan untuk pertumbuhan sel bakteri. Tujuan aerasi adalah memperoleh O2 untuk fermentasi pada kecepatan yang akan memenuhi kebutuhan mikroorganisme untuk pertumbuhannya. Kecepatan aerasi yang digunakan dalan sebahagian besar fermentasi adalah kira-kira 1,0 volume udara/volume medium/menit (v/v/m). Sedangkan agitasi bergantung pada ukuran fermentor dan diameter baling-baling. Jadi semakin besar fermentor maka semakin lambat kecepatan baling-baling. Sebagai contoh, pada fermentor 14 liter kecepatan agitasi 700 rpm dan pada fermentor 200 liter kecepatan agitasi 400 rpm (Vandekar dan Dulmage, 1982).
3. Pemanenan (Recovery)
Bahan aktif insektisida Bt dapat dipanen dengan sentrifugasi, filtrasi, presipitasi, spray drying, atau kombinasi dari proses-proses tersebut. Bahan aktif insektisida tersebut kemudian dapat diformulasikan menjadi sebuah produk tergantung pada tipe fermentasi, segi ekonomi dari proses, dan kebutuhan formulasi tertentu (Quinlan dan Lisansky, 1985).
4. Penentuan Aktivitas Insektisida Mikroba
Terdapat perbedaan pengukuran aktivitas mikroba antara insektisida kimia dengan bioinsektisida. Pada insektisida kimia prosedur yang dilakukan untuk memonitor produksi relatif sederhana. Hal ini disebabkan karena produk yang digunakan adalah produk murni yang telah dievaluasi dan aktivitas insektisidanya telah diketahui sebelumnya. Sedangkan pada bioinsektisida, aktivitas insektisida dari mikroorganisme tidak dapat diukur secara kimia,
16 melainkan dengan bioassay. Bioassay merupakan salah satu cara untuk menentukan serbuk bahan aktif yang dihasilkan oleh mikroorganisme. Pada insektisida kimia, bioassay hanya digunakan sebagai pelengkap (Vandekar dan Dulmage, 1982).
Insektisida mikroba ditentukan aktivitasnya dengan menghitung jumlah spora hidup dan melalui bioassay untuk menentukan kadar letal (LC50) dan
International Unit (IU) (Vandekar dan Dulmage, 1982) atau dosis letal (LD50),
Diet Dillution Unit (DDU50) dan IU (Dulmage dan Rhodes, 1971). LC50, LD50, DDU50 sebenarnya hanya menunjukkan potensi relatif produk, karena potensi produk insektisida mikroba (Bacillus thuringiensis) dinyatakan dalam satuan internnasional (SI) dengan cara pengukuran sebagai berikut :
E. LARVA Croccidolomia binotalis (Ulat Kubis) SEBAGAI SERANGGA SASARAN Bacillus thuringiensis subsp. aizawai
Croccidolomia binotalis (C. binotalis) tergolong dalam famili Pyralidae, ordo Lepidoptera, filum Arthropoda, genus Croccidolomia, dan kelas Insecta (Kalshoven, 1981). Dalam siklus hidupnya, ulat ini mengalami metamorfosis sempurna yang melewati empat stadium, yaitu telur, larva, pupa, dan imago (Suyanto, 1994).
C. binotalis merupakan hama utama pada tanaman kubis-kubisan seperti kubis, sawi, lobak, petsai, dan brokoli (Kalshoven, 1981). Daerah persebaran hama ini cukup luas mencakup Afrika selatan, Asia Tenggara, Australia, dan Kepulauan Pasifik. Di Pulau Jawa, hama ini ditemukan di daratan rendah maupun daratan tinggi. Ulat C. binotalis dapat dilihat pada Gambar 5.
Kerusakan yang disebabkan C. binotalis dapat menurunkan hasil baik kualitas maupun kuantitas, karena menyebabkan kerusakan krop kubis bahkan kubis tidak dapat membentuk krop (Uhan, 1993). Kehilangan hasil akibat serangan C. binotalis dapat mencapai 65,8 %.
17 Gambar 5. Larva, Kepompong, dan Dewasa Croccidolomia binotalis
Larva yang baru keluar dari telur akan hidup berkelompok, memakan daun dari permukaan bawah karena menghindari cahaya. Bekas daun yang dimakan kelompok larva instar I biasanya berupa bercak putih yang merupakan lapisan epidermis daun yang tidak ikut dimakan dan berlubang bila epidermis mengering. Apabila serangga terjadi pada saat kubis sudah membentuk krop, larva yang telah mencapai instar III akan menggerek ke dalam krop dan merusak bagian ini, sehingga menurunkan nilai ekonomi. Pembusukan pada krop yang sudah rusak dapat terjadi karena munculnya serangan sekunder eleh cendawan dan bakteri (Sastrosiswojo dan Setiawati, 1993).
Larva C. binotalis melewati empar instar. Larva instar I berkelompok pada permukaan bawah daun, berwarna krem dengan kepala hitam kecoklatan, berukuran 2,1 – 2,7 mm dengan stadium rata-rata 2 hari. Larva instar II bewarna hijau terang, berukuran 5,5 – 6,1 mm dengan stadium rata-rata 2 hari. Larva instar III berwarna hijau, berukuran 1,1 – 1,3 mm, stadium rata-rata 1,5 hari. Larva instar IV berwarna hijau dengan tiga garis putih pada bagian dorsal dan satu pada bagian lateral tubuh, stadium rata-rata 3,2 hari.
Dua hari setelah ganti kulit, warna kulit larva instar IV berubah menjadi coklat, larva menjadi tidak aktif, dan tidak banyak makan. Setelah 24 jam, larva akan masuk ke dalam tanah dan membentuk pupa. Pupa berwarna kecoklatan dan ukuran tubuhnya 9 – 10 mm (Prijono dan Hassan, 1992). Masa pupa berlangsung selama 9 – 13 hari (Othman, 1982) dan rata-rata 11,4 hari pada brokoli (Prijono dan Hassan, 1992).
18
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
1. Bahan
Bahan yang digunakan dalam penelitian ini adalah kultur Bacillus thuringiensis subsp. aizawai yang diperoleh dari IPB Culture Collection (IPBCC) pada medium agar miring. Substrat yang digunakan adalah ampas tahu dan limbah cair tahu yang diperoleh dari Industri Tahu Cibanteng. Kubis yang digunakan diperoleh dari pasar-pasar tradisional dan super market. Serta larva ulat Croccidolomia binotalis (ulat kubis) yang diperoleh dari Laboratorium Fisiologi dan Toksin Departemen Hama dan Penyakit Tanaman, Fakultas Pertanian, IPB. Mineral yang digunakan adalah MgSO4.7H2O, MnSO4. H2O, ZnSO4.7H2O, FeSO4.7H2O, CaCO3, dan urea. Bahan-bahan yang digunakan untuk analisa adalah nutrien agar (NA), nutrien broth (NB), HCl, NaOH, CH3COOH, H2SO4 pekat, fenil, garam fisiologis, etanol 95 %, aqua destilata, Pro-Stiker, dan spiritus.
2. Alat
Alat yang digunakan dalam penelitian ini meliputi autoklaf, pH-meter, oven, lemari es, inkubator, neraca analitik, desikator, spektrofotometer, freezer, loop inokulasi, dan alat-alat gelas lainnya seperti labu erlenmeyer, tabung reaksi, pipet, bunsen, cawan petri, dan gelas piala.
B. METODE PENELITIAN
1. Penelitian Pendahuluan a. Analisa Bahan Baku
Analisa ini bertujuan untuk mengetahui komposisi kimia ampas tahu dan limbah cair tahu yang digunakan, yaitu analisis kadar air, kadar abu, kadar lemak, kadar serat, kadar nitrogen, dan kadar karbon. Prosedur analisis tercantum pada Lampiran 1.
19
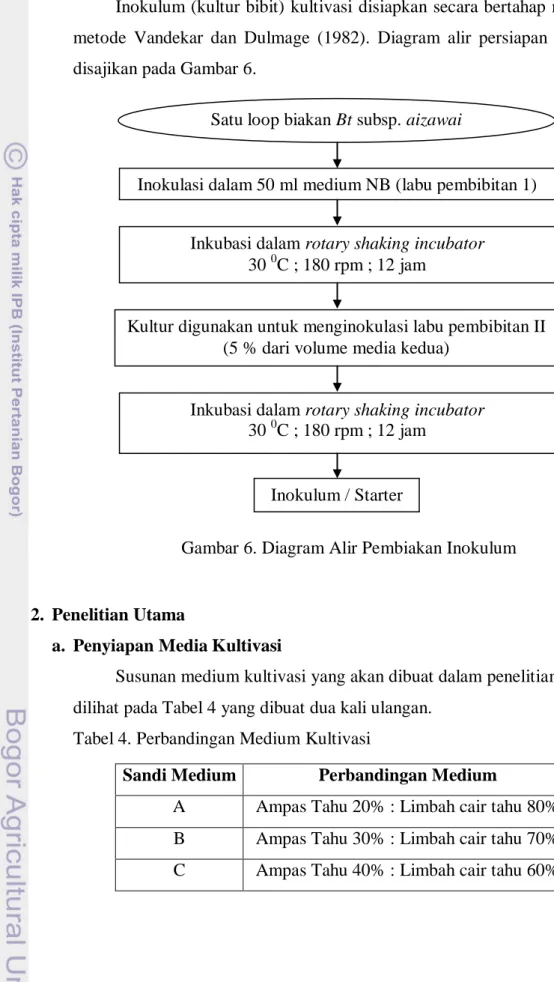
b. Penyiapan Inokulum Bacillus thuringiensis subsp. aizawai
Inokulum (kultur bibit) kultivasi disiapkan secara bertahap mengikuti metode Vandekar dan Dulmage (1982). Diagram alir persiapan inokulum disajikan pada Gambar 6.
Gambar 6. Diagram Alir Pembiakan Inokulum
2. Penelitian Utama
a. Penyiapan Media Kultivasi
Susunan medium kultivasi yang akan dibuat dalam penelitian ini dapat dilihat pada Tabel 4 yang dibuat dua kali ulangan.
Tabel 4. Perbandingan Medium Kultivasi
Sandi Medium Perbandingan Medium
A Ampas Tahu 20% : Limbah cair tahu 80% B Ampas Tahu 30% : Limbah cair tahu 70% C Ampas Tahu 40% : Limbah cair tahu 60%
Inokulum / Starter
Inkubasi dalam rotary shaking incubator 30 0C ; 180 rpm ; 12 jam
Satu loop biakan Bt subsp. aizawai
Inokulasi dalam 50 ml medium NB (labu pembibitan 1)
Inkubasi dalam rotary shaking incubator 30 0C ; 180 rpm ; 12 jam
Kultur digunakan untuk menginokulasi labu pembibitan II (5 % dari volume media kedua)
20 Jenis dan jumlah mineral yang digunakan dalam penelitian ini sesuai dengan yang digunakan oleh Dulmage dan Rhodes (1971), yaitu 0,3 g/l MgSO4.7H2O, 0,02 g/l MnSO4. H2O, 0,02 g/l ZnSO4.7 H2O, 0,02 g/l FeSO4.7 H2O, dan 1,0 g/l CaCO3.
Pembuatan media kultivasi yang dilakukan adalah sebagai berikut : ampas tahu dan CaCO3 disterilkan secara terpisah dari urea, limbah cair tahu, dan trace alement. Bahan-bahan medium yang lain dicampur diatas pemanas berpengaduk. Setelah itu didinginkan sampai ± 50 0C dan pH diatur hingga 7,2. Kemudian medium dibagi-bagi dalam beberapa labu erlenmeyer. Ampas tahu + CaCO3 dan limbah cair tahu disterilkan dalam autoklaf pada suhu 121 0C selama 15 menit. Setelah steril dan dingin, ampas tahu + CaCO3 dan limbah cair tahu dicampurkan menjadi satu sesuai formulasi yang ditentukan kemudian ditambahkan bahan-bahan lain secara aseptik.
b. Kultivasi
Kultivasi Bt subsp. aizawai dilakukan secara curah dengan kondisi kultivasi sebagai berikut : kultivasi dilakukan dalam labu erlenmeyer 250 ml pada suhu 28 – 32 0C, pH awal medium diatur pada 6,5 – 7,5, volume medium fermenntasi 50 ml, diinkubasi menggunakan rotary shaking incubator dengan kecepatan 180 rpm, dan dipanen pada waktu inkubasi 30 jam dan 48 jam. Kultivasi dilakukan dua kali ulangan dengan kondisi kultivasi yang sama antara ulangan I dan ulangan II.
Tabel 5. Perlakuan pada kultivasi Bta
Sandi Medium
Sandi Medium Kultivasi
Jumlah Stater yang Ditambahkan A A1 A2 A3 10 % (v/w) 15 % (v/w) 20 % (v/w) B B1 B2 B3 10 % (v/w) 15 % (v/w) 20 % (v/w) C C1 C2 C3 10 % (v/w) 15 % (v/w) 20 % (v/w)
21
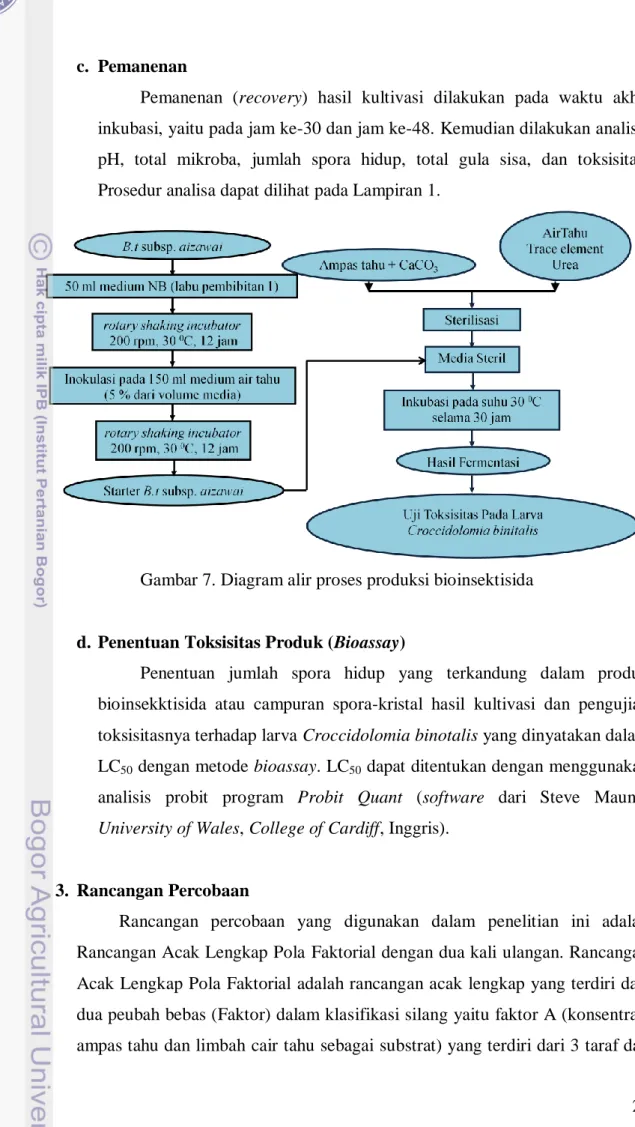
c. Pemanenan
Pemanenan (recovery) hasil kultivasi dilakukan pada waktu akhir inkubasi, yaitu pada jam ke-30 dan jam ke-48. Kemudian dilakukan analisis pH, total mikroba, jumlah spora hidup, total gula sisa, dan toksisitas. Prosedur analisa dapat dilihat pada Lampiran 1.
Gambar 7. Diagram alir proses produksi bioinsektisida
d. Penentuan Toksisitas Produk (Bioassay)
Penentuan jumlah spora hidup yang terkandung dalam produk bioinsekktisida atau campuran spora-kristal hasil kultivasi dan pengujian toksisitasnya terhadap larva Croccidolomia binotalis yang dinyatakan dalam LC50 dengan metode bioassay. LC50 dapat ditentukan dengan menggunakan analisis probit program Probit Quant (software dari Steve Maund, University of Wales, College of Cardiff, Inggris).
3. Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap Pola Faktorial dengan dua kali ulangan. Rancangan Acak Lengkap Pola Faktorial adalah rancangan acak lengkap yang terdiri dari dua peubah bebas (Faktor) dalam klasifikasi silang yaitu faktor A (konsentrasi ampas tahu dan limbah cair tahu sebagai substrat) yang terdiri dari 3 taraf dan
22 faktor B (konsentrasi starter yang digunakan) yang terdiri dari 3 taraf dan kedua faktor tersebut diduga saling berinteraksi. Saling berinteraksi dimaksudkan bahwa pengaruh suatu faktor tergantung dari taraf faktor yang lain, dan sebaliknya jika tidak terjadi interaksi berarti berarti pengaruh suatu faktor tetap pada setiap taraf faktor yang lain. Jadi bila tidak terjadi interaksi antar taraf-taraf suatu faktor saling sejajar satu sama lainnya, sebaliknya bila ada interaksi tidak saling sejajar
Model rancangan percobaan pada penelitian utama menggunakan dua faktor yaitu faktor konsentrasi substrat yang terdiri dari 3 taraf, yaitu perbandingan ampas tahu dan limbah cair tahu 20 : 80, 30 : 70, dan 40 : 60 serta faktor konsentrasi starter yang terdiri dari 3 taraf, yaitu 10, 15, 20 % (v/v) dan kedua faktor tersebut diduga saling berinteraksi. Model yang digunakan adalah sebagai berikut :
Yij = µ + αi + βj + αi βj + εij (Hanafiah, 2005)
Keterangan :
Yij = Variabel respon karena pengaruh faktor konsentrasi gula taraf ke i dan faktor konsentrasi starter taraf ke j
µ = Efek rata-rata yang sebenarnya αi = Efek dari taraf ke i konsentrasi gula βj = Efek dari taraf ke j konsentrasi starter
εij = Efek dari interaksi antara taraf ke i konsentrasi gula dan taraf ke j konsentrasi starter
Data yang diperoleh dari pengukuran parameter, masing-masing dianalisis menggunakan analisis ragam uji F. Apabila hasilnya menunjukkan perbedaan yang nyata, maka analisis dilanjutkan dengan uji beda nyata terkecil (LSD).
23
IV
HASIL DAN PEMBAHASAN
A. HASIL ANALISIS KIMIA BAHAN BAKU
Hasil analisis kimia bahan baku dapat dilihat pada Tabel 6.
Tabel 6. Hasil analisis kimia ampas tahu (AT) dan limbah cair tahu (LCT)
Pada Tabel 5 dapat dilihat bahwa ampas tahu dan limbah cair tahu mengandung senyawa-senyawa yang dibutuhkan oleh mikroorganisme, seperti air, karbon, dan nitrogen (Vandekar dan Dulmage, 1982).
Rasio karbon (C) dan nitrogen (N) yang digunakan dalam penelitian ini adalah 7 : 1. Hal ini didasarkan pada hasil penelitian yang pernah dilakukan oleh Wicaksono (2002) yang menyatakan bahwa tingkat toksisitas tertinggi dihasilkan dari perbandingan karbon dan nitrogen (C/N ratio) adalah 7 : 1. Contoh perhitungan untuk mendapatkan nisbah C/N 7 : 1 dapat dilihat pada Lampiran 2.
Tabel 7. Hasil perhitungan penambahan urea untuk memperoleh C/N ratio 7 : 1
Media C/N Ratio sebelum Penambahan Urea Jumlah urea yang ditambahkan (g/L) C/N Ratio setelah Penambahan Urea Total Karbon (C) g/L Total Nitrogen (N) g/L A (20 % AT : 80 % LCT) 13,41 : 1 2,07 7 : 1 13,88 1,98 B (30 % AT : 70 % LCT) 13,32 : 1 2,91 7 : 1 19,41 2,77 C (40 % AT : 60 % LCT) 13,34 : 1 3,75 7 : 1 24,93 3,56
Komponen Jumlah (% berat dalam basis basah) Urea
(%)
Limbah ampas tahu Limbah cair tahu
Air 89,75 99,00 - Abu 5,20 0,43 - Protein 2,63 0,13 - Nitrogen (N) 0,42 0,02 46,67 Karbon (C) 5,64 0,27 20,00 Lemak 0,53 0,79 - Serat 2,21 0,01 - Karbohidrat by different 2,31 - -
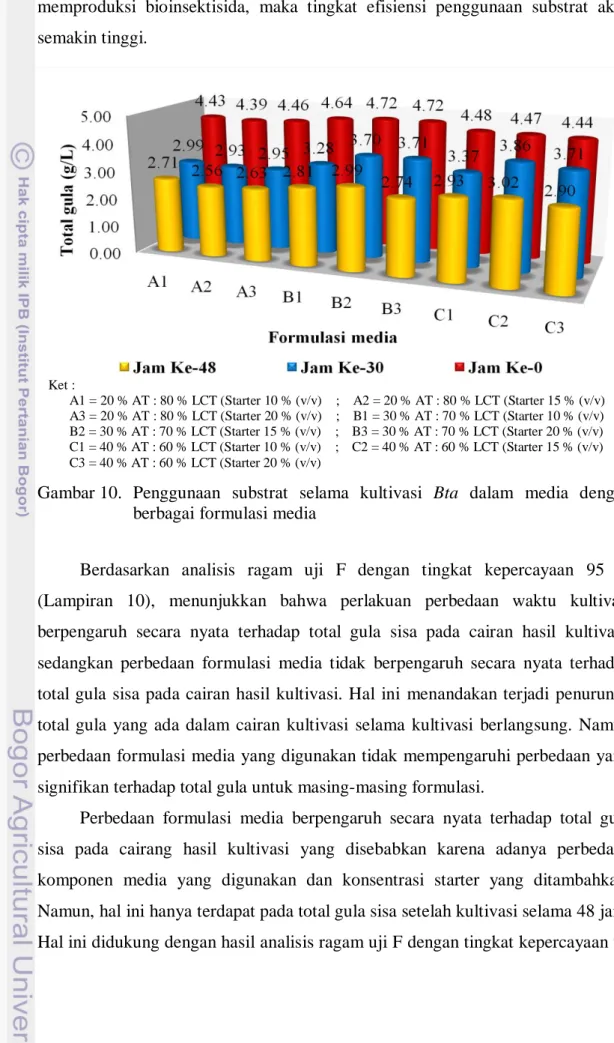
24 Menurut Vandekar dan Dulmage (1982), konsentrasi glukosa yang terlalu tinggi, yaitu 50 g/L, dengan nilai total karbon sebesar 20 g/L menyebabkan pH media turun lebih rendah dari 5,6 – 5,8. Namun hal ini berbeda dengan hasil penelitian yang telah dilakukan, dimana pada konsentrasi karbon 24,926 g/L (media C) tidak menyebabkan pH media menurun, melainkan naik dari pH awal (Gambar 8).
Penambahan urea dalam penelitian ini didasarkan pada rasio karbon dan nitrogen dari ampas tahu dan limbah cair tahu yang tidak sesuai dengan rasio yang diinginkan yaitu 13 : 1. Urea merupakan sumber nitrogen yang sesuai untuk pertumbuhan mikroorganisme karena kemampuannya untuk mempertahankan pH, tetapi penggunaannya cenderung tidak stabil sehingga perlu dibatasi (Stanburry dan Whitaker, 1984)
Selain sumber karbon dan nitrogen, mikroorganisme juga memerlukan mineral untuk pertumbuhan dan pembentukan produk metabolit. Kebutuhan mineral bervariasi tergantung pada jenis mikroorganisme yang ditumbuhkan. Menurut Dulmage dan Rhodes (1971), garam-garam organik yang dibutuhkan untuk pertumbuhan mikroorganisme meliputi K, Mg, P, S, dan yang diperlukan dalam jumlah yang sedikit seperti Ca, Zn, Fe, Co, Cu, Mo, dan Mn. Pada penelitian ini, medium kultivasi Bta ditambahkan 0,3 g/l MgSO4.7H2O, 0,02 g/l MnSO4. H2O, 0,02 g/l ZnSO4.7 H2O, 0,02 g/l FeSO4.7 H2O, dan 1,0 g/l CaCO3.
Wakisaka et al. (1982) di dalam Dulmage et al.(1990) menunjukkan bahwa ion K+ menstimulasi produksi δ-endotoksin. Ion organik lainnya seperti Ca2+ dan Mn2+ juga menstimulir sporulasi. Menurut Bernhard dan Utz (1993), garam-garam fosfat pada umumnya ditambahkan dalam jumlah besar, karena sekaligus berfungsi sebagai larutan penyangga pH.
B. PERUBAHAN pH CAIRAN KULTUR
Pengukuran pH cairan kultivasi bertujuan untuk mengamati perubahan pH cairan selama kultivasi. Pengukuran pH dilakukan pada jam ke-0, jam ke-30, dan jam ke-48 waktu kultivasi.
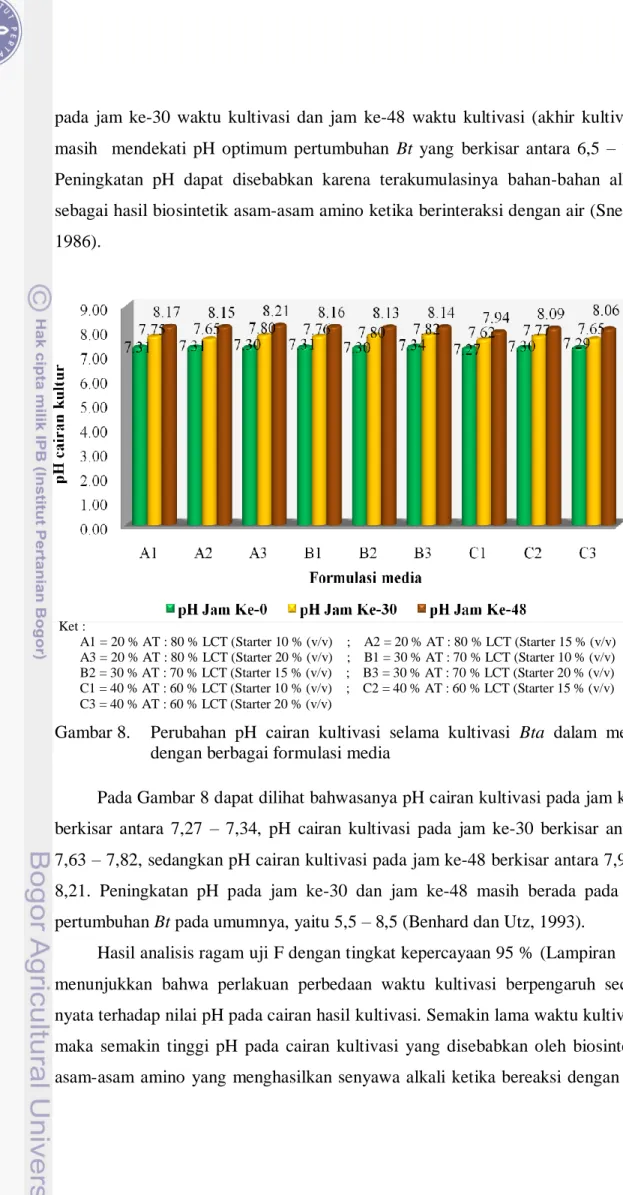
Hasil pengukuran pH cairan kultur (Gambar 8) menunjukkan bahwa secara umum pH cairan kultur mengalami peningkatan selama kultivasi. Peningkatan pH
25 pada jam ke-30 waktu kultivasi dan jam ke-48 waktu kultivasi (akhir kultivasi) masih mendekati pH optimum pertumbuhan Bt yang berkisar antara 6,5 – 7,5. Peningkatan pH dapat disebabkan karena terakumulasinya bahan-bahan alkali sebagai hasil biosintetik asam-asam amino ketika berinteraksi dengan air (Sneath, 1986).
Gambar 8. Perubahan pH cairan kultivasi selama kultivasi Bta dalam media dengan berbagai formulasi media
Pada Gambar 8 dapat dilihat bahwasanya pH cairan kultivasi pada jam ke-0 berkisar antara 7,27 – 7,34, pH cairan kultivasi pada jam ke-30 berkisar antara 7,63 – 7,82, sedangkan pH cairan kultivasi pada jam ke-48 berkisar antara 7,94 – 8,21. Peningkatan pH pada jam ke-30 dan jam ke-48 masih berada pada pH pertumbuhan Bt pada umumnya, yaitu 5,5 – 8,5 (Benhard dan Utz, 1993).
Hasil analisis ragam uji F dengan tingkat kepercayaan 95 % (Lampiran 11), menunjukkan bahwa perlakuan perbedaan waktu kultivasi berpengaruh secara nyata terhadap nilai pH pada cairan hasil kultivasi. Semakin lama waktu kultivasi, maka semakin tinggi pH pada cairan kultivasi yang disebabkan oleh biosintesis asam-asam amino yang menghasilkan senyawa alkali ketika bereaksi dengan air.
Ket : A1 = 20 % AT : 80 % LCT (Starter 10 % (v/v) ; A2 = 20 % AT : 80 % LCT (Starter 15 % (v/v) A3 = 20 % AT : 80 % LCT (Starter 20 % (v/v) ; B1 = 30 % AT : 70 % LCT (Starter 10 % (v/v) B2 = 30 % AT : 70 % LCT (Starter 15 % (v/v) ; B3 = 30 % AT : 70 % LCT (Starter 20 % (v/v) C1 = 40 % AT : 60 % LCT (Starter 10 % (v/v) ; C2 = 40 % AT : 60 % LCT (Starter 15 % (v/v) C3 = 40 % AT : 60 % LCT (Starter 20 % (v/v)
26 Kestabilan pH pada cairan kultivasi dipengaruhi oleh konsentrasi nitrogen di dalam media. Pada metabolism dengan sumber media yang konsentrasi nitrogennya lebih kecil akan menghasilkan zat alkali yang lebih sedikit, sehingga tidak dapat menetralisis asam-asam organik, seperti asam piruvat, asam sitrat, asam laktat, dan aseton yang dihasilkan dari proses degradasi gula (Sukmadi, et al., 1996).
Dari Gambar 8 dapat dilihat pula bahwa secara umum, perbedaan formula media tidak berpengaruh secara nyata terhadap nilai pH pada cairan hasil kultivasi, kecuali formula media C2 yang berbeda secara nyata dengan formula media lainnya. Hal tersebut didukung dengan hasil uji beda nyata terkecil yang menunjukkan nilai selisih antar media lebih besar dari nilai beda nyata terkecil (LSD).
C. PERTUMBUHAN Bacillus thuringiensis subsp. aizawai SELAMA
KULTIVASI
Pertumbuhan sel Bta dapat diukur dengan menggunakan metode Total Plate Count (TPC). Berdasarkan hasil pengamatan jumlah sel hidup (Gambar 9) diperoleh hasil untuk waktu kultivasi selama 30 jam, jumlah sel hidup tertinggi terdapat pada formulasi media B2 yaitu 1,79 x 108 sel/ml, sedangkan jumlah sel hidup terendah terdapat pada formulasi media C3 yaitu 3,08 x 107 sel/ml. Untuk waktu kultivasi selama 48 jam, jumlah sel hidup tertinggi terdapat pada formulasi media B3 yaitu 2,14 x 108 sel/ml, sedangkan jumlah sel hidup terendah terdapat pada formulasi media A3 yaitu 107 sel/ml. Hal ini menandakan bahwa jumlah sel hidup tertinggi pada penelitian ini dihasilkan oleh formulasi media B3 dengan waktu kultivasi selama 48 jam, sedangkan jumlah sel hidup terendah pada penelitian ini dihasilkan oleh formulasi media A3 dengan waktu kultivasi selama 48 jam. Namun, jumlah sel hidup yang diperoleh dalam penelitian ini masih lebih rendah dari hasil penelitian Rumiyantie (1999) yang menyatakan bahwa konsentrasi sel berkisar antara 2,15 x 109 sel/L sampai 2,53 x 109 sel/L untuk waktu kultivasi selama 48 jam.
27 Gambar 9. Pengaruh kombinasi media terhadap jumlah sel
Dari dambar 9 dapat dilihat bahwa secara umum, jumlah sel setelah kultivasi selama 30 jam dan 48 jam berbeda nyata dengan jumlah sel sebelum kultivasi. Sedangkan jumlah sel setelah kultivasi selama 30 jam tidak berbeda nyata dengan jumlah sel setelah kultivasi selama 48 jam. Hal ini didukung dengan hasil analisis ragam uji F dengan tingkat kepercayaan 95 % (Lampiran 8), menunjukkan bahwa perlakuan perbedaan formulasi media dan perbedaan waktu kultivasi berpengaruh secara nyata terhadap jumlah sel (TPC) pada cairan hasil kultivasi.
Perbedaan formulasi media berpengaruh secara nyata terhadap jumlah sel pada cairang hasil kultivasi disebabkan karena adanya perbedaan komponen media yang digunakan dan konsentrasi starter yang ditambahkan. Berdasarkan hasil analisis ragam uji F dengan tingkat kepercayaan 95 % (Lampiran 12), menunjukkan bahwa perlakuan perbedaan konsentrasi starter berpengaruh secara nyata terhadap jumlah sel (TPC) pada cairan hasil kultivasi selama 30 jam. Penggunaan konsentrasi starter 15 % (v/v) berbeda nyata dengan penggunaan konsentrasi starter 10 % (v/v), penggunaan konsentrasi starter 20 % (v/v) tidak
Ket : A1 = 20 % AT : 80 % LCT (Starter 10 % (v/v) ; A2 = 20 % AT : 80 % LCT (Starter 15 % (v/v) A3 = 20 % AT : 80 % LCT (Starter 20 % (v/v) ; B1 = 30 % AT : 70 % LCT (Starter 10 % (v/v) B2 = 30 % AT : 70 % LCT (Starter 15 % (v/v) ; B3 = 30 % AT : 70 % LCT (Starter 20 % (v/v) C1 = 40 % AT : 60 % LCT (Starter 10 % (v/v) ; C2 = 40 % AT : 60 % LCT (Starter 15 % (v/v) C3 = 40 % AT : 60 % LCT (Starter 20 % (v/v)

![Gambar 1. Sel Bacillus thuringiensis dalam perbesaran 1000 kali [spora intraseluler (terang) dan kristal protein (gelap)]](https://thumb-ap.123doks.com/thumbv2/123dok/4378325.3193881/22.893.312.722.316.580/gambar-bacillus-thuringiensis-perbesaran-intraseluler-terang-kristal-protein.webp)