PROSES PRODUKSI BIOINSEKTISIDA Bacillus thuringiensis
ISOLAT LOKAL MENGGUNAKAN LIMBAH AGROINDUSTRI
PADA KULTIVASI MEDIA PADAT
RINI PURNAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Proses Produksi Bioinsektisida Bacillus thuringiensis Isolat Lokal Menggunakan Limbah Agroindustri pada Kultivasi Media Padat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Rini Purnawati
RINGKASAN
RINI PURNAWATI. Proses Produksi Bioinsektisida Bacillus thuringiensis Isolat Lokal Menggunakan Limbah Agroindustri pada Kultivasi Media Padat. Dibimbing oleh TITI CANDRA SUNARTI, KHASWAR SYAMSU dan MULYORINI RAHAYUNINGSIH
Meningkatnya kesadaran akan perlunya insektisida yang aman, maka sekarang penggunaan bioinsektisida semakin diminati oleh petani yang ingin memproduksi sayur dan buah yang aman untuk dikonsumsi. Begitu juga dalam mengendalikan larva nyamuk yang dapat menjadi vektor beberapa penyakit berbahaya, penggunaan insektisida yang aman sangat diperlukan agar tidak mencemari tanah, perairan maupun mahluk hidup yang lain. Keunggulan menggunakan bioinsektisida mikrobial adalah aman, ramah lingkungan, spesifik terhadap hama serangga tertentu, tidak berbahaya bagi binatang peliharaan, tidak mengakibatkan residu pada hasil pertanian dan tanah.
Tujuan penelitian ini adalah untuk mengembangkan proses produksi bioinsektisida (Bacillus thuringiensis) menggunakan isolat lokal dengan starter dan media kultivasi menggunakan hasil samping agroindustri, dengan cara kultivasi media padat, sehingga diperoleh bioinsektisida yang murah dan mudah untuk diproduksi. Adapun tujuan masing-masing tahapan adalah didapat karakteristik isolat yang cocok untuk kultivasi media padat dan cocok dengan lingkungan iklim di Indonesia, pengembangan starter dari limbah agroindustri, merancang kondisi proses produksi kultivasi media padat menggunakan limbah agroindustri, dan evaluasi dan analisis efikasi pada serangga sasaran.
Tahapan penelitian dimulai dari isolasi isolat dari bangkai ulat Attacus atlas
dan Bombyx mori. Isolat yang diperoleh selanjutnya dikarakterisasi dan diidentifikasi hingga diperoleh B. thuringiensis, dari keduaisolat yang diperoleh, dipilih salah satu yang paling cocok untuk kultivasi media padat. Tahap berikutnya adalah pemilihan media starter dari limbah agroindustri, dilanjutkan dengan produksi bioinsektisida menggunakan media campuran ampas sagu dan ampas iles-iles dengan cara kultivasi media padat. Bioinsektisida yang dihasilkan dikarakterisasi kadar asam amino, profil protein dan kemampuan toksisitas terhadap larva A. aegepty dan larva C. pavonana
Isolat terpilih dari kedua isolat untuk produksi bioinsektisida dengan kultivasi media padat adalah yang berasal dari A. atlas. Pemilihan isolat berdasarkan pada sifat motilitas lebih tinggi, pertumbuhan sel, jumlah spora yang dihasilkan, dan toksisitasnya terhadap serangga uji.
Media starter dipilih dengan melihat pertumbuhan B. thuringiensis pada media limbah cair tahu, limbah cair tahu ditambah urea, air kelapa, dan nutrient broth. Diperoleh hasil tertinggi pada limbah cair tahu dengan jumlah sel maksimum sebesar 10.51 (Log CFU/mL), jumlah spora maksimum sebesar 8.67 (Log CFU/mL), dan laju pertumbuhan sel maksimum 0.052 jam-1. Media starter menggunakan limbah cair tahu cocok digunakan sebagai media starter B. thuringiensis.
Selama kultivasi ketebalan media dan pemberian aerasi berpengaruh terhadap pH, pertumbuhan sel, jumlah spora, dan konsumsi substrat. Bertambahnya ketebalan substrat menyebabkan pH media semakin rendah dan jumlah sel serta spora yang dihasilkan semakin rendah. Begitu juga kemampuan toksisitas semakin menurun. Pemberian aerasi memberi pengaruh yang lebih baik karena dapat meningkatkan jumlah sel, jumlah spora dan asam amino yang terbentuk.
Toksisitas terhadap larva nyamuk A. aegepty maupun larva C. pavonana
tidak dipengaruhi oleh jumlah sel, sedangkan jumlah spora memperlihatkan semakin tinggi spora semakin tinggi nilai toksisitasnya. Berarti pembentukan spora sejalan dengan pembentukan protein kristal. Bioinsektisida yang dihasilkan memiliki daya toksisitas terhadap larva C. pavonana (golongan Lepidoptera) dan larva nyamuk A. aegepty (golongan Diptera), tetapi lebih efektif terhadap larva A. aegepty. Kemampuan toksisitas tertinggi terhadap larva nyamuk A. aegepty
sebesar LC50 0.03 mg/mL dan terhadap larva C. pavonana sebesar LC50 0.33 mg/mL.
SUMMARY
RINI PURNAWATI. Production Process of Bioinsecticide Bacillus thuringiensis
Local Isolates Production using Agroindustry Waste by Solid-state Cultivation. Supervised by TITI CANDRA SUNARTI, KHASWAR SYAMSU and MULYORINI RAHAYUNINGSIH
Due to increased awareness of the need for safe insecticide, currently the use of bioinsecticide is increasingly in demand by farmers who want to produce vegetables and fruits safe for consumption. Also, it is used in the control of mosquito larvae that can be vectors of several dangerous diseases. The use of safe insecticides is needed, so as not to pollute the soil, water and other living creatures. The advantages of using microbial bioinsecticide are safe, environmentally friendly, specific to certain insect pests, not harmful to pets, do not result in residues on crops and soil.
The purpose of this research was to develop the production process of bioinsecticide (Bacillus thuringiensis) using local isolates with starter and cultivation media of agroindustrial by products, using solid state cultivation, in order to obtain bioinsecticide that is cheap and easy to produce. The purpose of each stage are to obtained isolate characteristics suitable with the solid state cultivation and suitable with climatic environment in Indonesia, development of starter from agroindustrial waste, design the condition of solid state cultivation production process using agroindustrial waste, and for evaluation and analysis of efficacy in the target insects.
The stages of research began from isolate isolation from Attacus atlas and Bombyx mori caterpillar carrions. Isolates further obtained were then characterized and identified to obtain B. thuringiensis, from both isolates obtained, it was then selected one of the most suitable for solid state cultivation. The next stage was the selection of starter medium from agroindustrial waste, followed by a bioinsecticide production using the mixed media of sago lees and iles-iles lees by solid state cultivation. Bioinsecticide produced was characterized by amino acid content protein profiles and toxicity ability against A. aegepty larvae dan C. pavonana larvae.
B. thuringiensis producing endotoxins that served as a bioinsecticide active ingredient could be isolated from A. atlas and B. mori caterpillar carrions from Bogor, Indonesia. The isolate characteristics of A. atlas caterpillar are the bacteria belonging to Gram-positive, having flagella, punctiform shaped colonies, slimy, white, rod-shaped vegetative cells with a length of approximately 1700 nm and a width of about 830 nm. The protein crystals yielded are spherical, with a diameter of 470-770 nm, and diameter of spore of 550-750 nm. The isolate characteristics of B. mori caterpillar are, belonging to Gram-positive bacteria, motile, circular, white and slimy, long and round vegetative cells with a length approximately of 3900-9500 nm and a width approximately of 830 nm. The protein crystals yielded are spherical, bipyramid and cuboid with a size of 300-700 nm, and diameter of spore of 500-750 nm. Philogenetic tree reconstruction showed that both isolates are in the same cluster with B. thuringiensis.
higher motility characteristic, cell growth, the number of spores produced and their toxicity against the test insects.
Starter media is selected based on the growth parameters of B. thuringiensisin tofu whey media, tofu whey plus urea, coconut water, and nutrient broth. It is obtained the highest results in tofu whey with the maximum number of cells of 10.51 (log CFU/mL), the maximum number of spores of 8.67 (log CFU/mL), and the maximum cell growth rate of 0.052 hour-1. Starter media uses
tofu whey suitable to be used as the starter media of B. thuringiensis.
During cultivation, media thickness and aeration provision effect pH, cell growth, the number of spores, and substrate consumption. increasing thickness of substrate causes pH decrease, and resulting decrease in cell growth, spores and substrate consumption. Like wise, the ability toxicity is decreasing. Aeration provision gives a better effect because it can increase the number of cells, the number of spores and amino acids formed.
Toxicity to mosquito larvae and caterpillar larvae are not affected by the number of cells, where as the number of spores shows that the higher the spore is the higher the toxicity value is. It means that the formation of spores is in line with the formation of crystalprotein. Bioinsecticide produced has a toxicity against C. pavonanalarvae (Lepidoptera group) and A. aegypti (Diptera groups), but it is more effective against A. aegypti larvae. The ability of the highest toxicity against A. aegypti larvae is equal to LC50 0.03 mg/mL and against C. pavonana is equal
to LC50 0.33 mg/mL.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Teknologi Industri Pertanian
PROSES PRODUKSI BIOINSEKTISIDA Bacillus thuringiensis
ISOLAT LOKAL MENGGUNAKAN LIMBAH AGROINDUSTRI
PADA KULTIVASI MEDIA PADAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Penguji pada Ujian Tertutup: Dr Ir Moh Yani, M Eng Dr Ir Liesbetini Hartoto, MS
Penguji pada Ujian Terbuka: Prof Dr Ir Dadang, MSc
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2011 hingga Desember 2014 ialah Proses Produksi Bioinsektisida Bacillus thuringiensis Isolat Lokal Menggunakan Limbah Agroindustri pada Kultivasi Media Padat.
Banyak pihak telah membantu penulis dalam penyelesaian karya ilmiah ini, untuk itu penulis menyampaikan penghargaan dan ucapan terima kasih yang tulus kepada:
1. Dr Ir Titi Candra Sunarti, MSi, Prof Dr Ir Khaswar Syamsu, MScSt. dan Dr Ir Mulyorini Rahayuningsih, MSi yang telah memberi bimbingan dan arahan sejak awal penyusunan proposal penelitian hingga penulisan karya ilmiah ini.
2. Dr Ir Liesbetini Haditjaroko, MS dan Dr Ir Mohammad Yani, M Eng yang telah berkenan selaku penguji dalam ujian tertutup. Prof Dr Ir Dadang, MSc dan Prof (R) Dr Ir Nur Richana, MSi yang telah berkenan selaku penguji dalam ujian terbuka.
3. Rektor IPB, Dekan FATETA, Ketua Departemen Teknologi Industri Pertanian FATETA atas ijin untuk melanjutkan pendidikan dan dukungan berupa moril maupun materiil kepada penulis hingga penulis bisa menyelesaikan pendidikan. 4. Tenaga kependidikan FATETA khususnya dari Departemen TIN atas dorongan
semangat dan bantuan kepada penulis sehingga penulis bisa menyelesaikan pendidikan.
5. Kedua orangtuaku yang selalu berdoa dan melimpahkan kasih sayangnya buat penulis. Kepada anak-anakku tersayang Fatih Anantamukhta dan Maulana Fatah Purbawisesa terima kasih atas kerelaannya berbagi waktu, perhatian dan doa selama penyelesaian studi. Kepada adik-adiku Arif Setiawan, Triza Pahala Setianto, Indria Wahyu Mulsanti, serta seluruh keluarga besar terima kasih atas doa dan kasih sayangnya.
6. Tidak lupa kepada teman-teman TIP-S3-2009 (Andes, Ade, Dwi, Fakih, Ida, Ike, Indri, Meilita, Mersi, Rahman, Sidik, Sugiarto, Suharman, Syarifudin, Vina dan Wiwin) semoga kebersamaan dan kekompakan kita tidak berhenti dengan selesainya pendidikan S3 ini.
7. Serta kepada semua pihak yang tidak dapat disebutkan satu persatu yang sudah membantu penulis menyelesaikan penelitian hingga karya tulis ini terwujud.
Akhir kata, semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiv
DAFTAR ISI vi
1 PENDAHULUAN 1
1. 1Latar Belakang 1
1. 2Perumusan Masalah dan Klaim Kebaruan 3
1. 3Tujuan Penelitian 4
1. 4Manfaat Penelitian 4
1. 5Ruang Lingkup Penelitian 4 2 TINJAUAN PUSTAKA 6 2.1 Bacillus thuringiensis (Bt.) 6 2.2 Kristal Protein 7 2.3 Kultivasi Substrat Padat 8 2.4 Media Kultivasi Bacillus thuringiensis 9 2.5 Kondisi Kultivasi Bacillus thuringiensis 10 3 METODE 11 3.1 Kerangka Pemikiran 11 3.2 Metodologi Penelitian 11 3.3 Bahan 12 3.4 Alat 13 3.5 Tahapan Penelitian 13 3.6 Analisis Nilai Tambah Ampas Sagu dan Ampas Iles-iles sebagai Media Tumbuh Bacillus thuringiensis 20
4 HASIL DAN PEMBAHASAN 22 4.1 Karakteristik dan Identitas Isolat 22 4.2 Penapisan Isolat 30 4.3 Media untuk Produksi Inokulum (Starter) 32 4.4 Produksi Bioinsektisida Menggunakan Ampas Sagu dan Ampas Iles-iles 39 4.5 Karakteristik Produk 49 4.6 Potensi Aplikasi Bioinsektisida 55 4.7 Analisis Nilai Tambah Limbah Cair Tahu, Ampas Sagu dan Ampas Iles-iles sebagai Media Starter dan Media Kultivasi 56 SIMPULAN DAN SARAN 58 DAFTAR PUSTAKA 59 LAMPIRAN 67
DAFTAR TABEL
1 Subspesies Bacillus thuringiensisuntuk kelompok serangga sasaran 8
2 Model Perhitungan Nilai Tambah 21
3 Hasil BLAST sekuen gen 16S rRNA isolat A dan B 29 4 Komposisi proksimat nutrient broth, limbah cair tahu dan air kelapa 33 5 Kandungan karbon dan nitrogen pada media starter 33
6 Komposisi mineral media starter 34
7 Parameter kinetika kultivasi B. thuringiensis padaberbagai media limbah 38 8 Komposisi kimia dan sifat fisik ampas sagu dan ampas iles-iles 39 9 Kandungan mineral pada ampas sagu dan ampas iles-iles 40 10 Parameter kinetika kultivasi produksi bioinsektisida pada beberapa
ketebalan 46
11 Kadar asam amino hasil kultivasi tanpa aerasi dan dengan aerasi 50 12 Toksisitas produk bioinsektisida terhadap larva nyamuk A. aegepty 52 13 Toksisitas produk bioinsektisida terhadap larva Crocidolomia pavonana 52 14 Toksisitas B. thuringiensis yang dihasilkan dari berbagai media kultivasi
dan serangga sasaran yang berbeda 53
15 Hasil perhitungan nilai tambah limbah cair tahu, ampas sagu dan ampas
iles-iles 57
DAFTAR GAMBAR
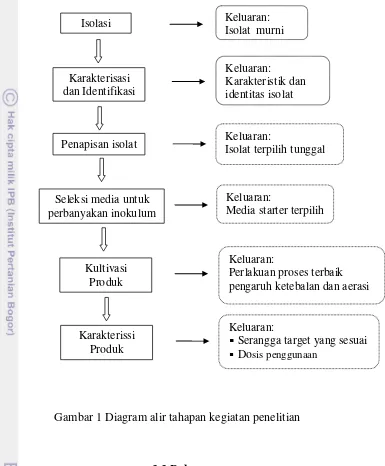
1 Diagram alir tahapan kegiatan penelitian 12
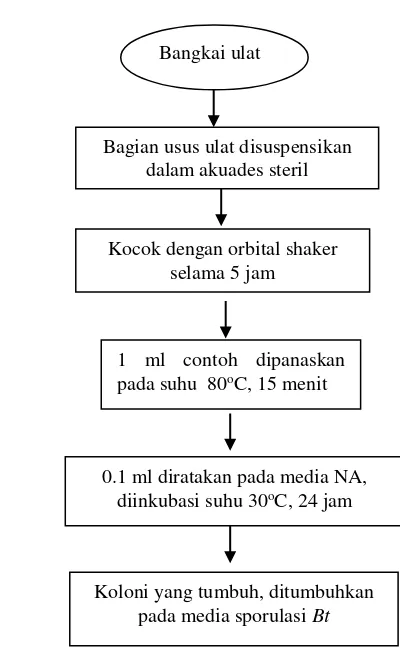
2 Diagram alir isolasi mikroba 14
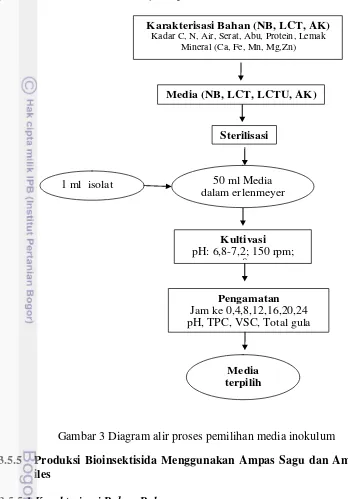
3 Diagram alir proses pemilihan media inokulum 16
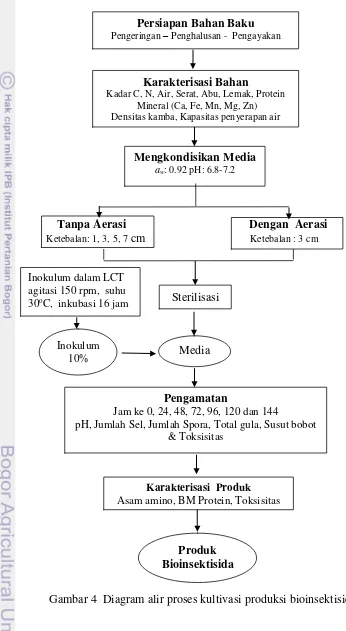
4 Diagram alir proses kultivasi produksi bioinsektisida 17
5 Bioreaktor untuk kultivasi tanpa aerasi 18
6 Bioreaktor untuk kultivasi dengan aerasi 19
7 (a) Koloni isolat A dan (b) Koloni isolat B pada media nutrient agar 22
8 Isolat A 23
9 Isolat B 23
10 (a) Kristal protein isolat A (b) Kristal protein Bti Federici et al.(2010) 24 11 (a) Kristal protein isolat B (b) Kristal protein Btk Federici et al.(2010) 24 12 Profil protein isolat A (lajur A), isolat B (lajur B) dan marker bobot
molekul (lajur M) 25
13 Hasil pewarnaan Gram isolat A (a) dan isolat B (b) 26 14 Hasil isolasi DNA isolat A (lajurA), isolat B (lajur B), Produk komersial
Bactospeine WP (lajur C) dan marker DNA ladder (lajur M) 27 15 Produk PCR isolat A (lajur A) dan isolat B (lajur B) 27 16 Urutan nukleotida fragmen DNA 16S rRNA isolat A 28 17 Urutan nukleotida fragmen DNA 16S rRNA isolat B 28 18 Pohon filogenetik gen 16S rRNA isolat A dan isolat B 29
19 Pertumbuhan sel isolat A dan isolat B 31
20 Jumlah spora hidup isolat A dan isolat B 31
22 Perubahan Total gula selama kultivasi pada media nutrient broth, limbah
cair tahu dan limbah cair tahu dengan urea. 36
23 Pertumbuhan sel selama kultivasi pada media nutrient broth, limbah cair tahu, limbah cair tahu dengan urea dan air kelapa 36 24 Produksi spora selama kultivasi pada media nutrient broth, limbah cair
tahu dan limbah cair tahu dengan urea 37
25 Hubungan kadar air dengan aktivitas air pada media campuran ampas
sagu dan ampas iles-iles 40
26 Pengaruh ketebalan media terhadap perubahan pH selama kultivasi 41
27 Pertumbuhan sel selama kultivasi 42
28 Hubungan pertumbuhan sel dengan ketebalan media 43 29 Hubungan pembentukan spora dengan lama kultivasi 44
30 Hubungan jumlah spora dengan ketebalan media 44
31 Hubungan kadar gula dengan lama kultivasi 45
32 Perubahan bobot sisa selama kultivasi 45
33 Hubungan bobot sisa dengan ketebalan media pada jam ke-144 46 34 Perubahan pH selama kultivasi pada kultivasi tanpa aerasi (TA) dan
dengan aerasi(DA) 47
35 Perubahan suhu substrat selama kultivasi pada kultivasi tanpa aerasi(TA)
dan dengan aerasi (DA) 48
36 Pertumbuhan sel selama kultivasi pada kultivasi tanpa aerasi(TA) dan
dengan aerasi (DA) 48
37 Pembentukan spora selama kultivasi pada kultivasi tanpa aerasi(TA) dan
dengan aerasi(DA) 49
1 Prosedur analisis karakterisasi dan identifikasi mikroba 67
2 Prosedur analisa hasil kultivasi 72
3 Prosedur analisa komposisi bahan baku 75
4 Hasil analisis Anova pengaruh lama kultivasi dan ketebalan substrat
terhadap jumlah sel hidup 79
5 Hasil analisis Anova pengaruh lama kultivasi dan ketebalan substrat
terhadap jumlah spora 80
6 Hasil analisis Anova pengaruh lama kultivasi dan ketebalan substrat
terhadap sisa total gula 81
1
PENDAHULUAN
1. 1 Latar Belakang
Pestisida kimia yang digunakan untuk mengendalikan hama dapat membahayakan jiwa manusia karena residu pestisida dalam sayur dan buah dapat menyebabkan berbagai penyakit, serangga non target akan terkena dampaknya, dan hama menjadi resisten. Meningkatnya kesadaran akan perlunya insektisida yang aman, menyebabkan penggunaan bioinsektisida semakin diminati oleh petani yang ingin memproduksi sayur dan buah yang aman untuk dikonsumsi. Begitu juga dalam mengendalikan larva nyamuk yang dapat menjadi vektor beberapa penyakit berbahaya, penggunaan insektisida yang aman sangat diperlukan agar tidak mencemari tanah, perairan maupun mahluk hidup yang lain. Keunggulan menggunakan bioinsektisida mikrobial adalah aman, ramah lingkungan, spesifik terhadap hama serangga tertentu, tidak berbahaya bagi binatang peliharaan, tidak mengakibatkan residu pada hasil pertanian dan tanah (Ellis, 2004).
Keberhasilan aplikasi bioinsektisida mikrobial tergantung pada spesies mikroorganisme, sifat serangga sasaran, serta potensi untuk dapat diproduksi dalam skala besar menggunakan formulasi yang tepat dan bersifat ekonomis (Dulmage et al.1990). Produksi bioinsektisida dipengaruhi oleh komposisi media dan Menurut Mumigati dan Raghunathan (1990) komposisi media berpengaruh terhadap pertumbuhan dan toksisitas Bacillus thuringiensis.
B. thuringiensis merupakan bioinsektisida mikrobial yang cukup banyak digunakan dibandingkan yang berasal dari miroba yang lain. Bakteri ini adalah bakteri Gram positif, berbentuk batang, dan memiliki kemampuan menghasilkan kristal protein selama masa sporulasinya. Sebagai pengendali hayati, spora dan kristal protein ini dapat bersifat racun pada sistem pencernaan serangga (Valicente dan Maurao 2008).
Produk komersial Bt telah beredar di pasaran dengan merk dagang Agritol, Vectobac, Dipel, Thuricide dari USA, Bathurin dari Cheko, Biosphor dari Jerman, Aquabac, Teknar, Bactimos dan lain-lain. Semua produk ini masih impor sehingga diperlukan devisa yang cukup besar untuk membelinya. Oleh sebab itu perlu dilakukan upaya untuk memproduksi sendiri bioinsektisida tersebut, sehingga dapat menghindari ketergantungan akan bahan-bahan impor.
Sebenarnya industri bioinsektisida cukup potensial untuk dikembangkan di Indonesia. Hal ini didukung oleh adanya galur lokal dan bahan media tumbuh berbasis agroindustri yang melimpah dan murah. Sesuai pendapat Devi dan Rao (2005) hasil samping produk pertanian adalah bahan yang dapat dimanfaatkan sebagai media pertumbuhan mikroba karena merupakan bahan organik dan juga mengandung trace element yang dibutuhkan untuk pertumbuhan sel.
2
jerami dan batang pohon, serta lokasi yang berbeda, dengan tujuan untuk memperoleh strain B. thuringiensis yang baru dengan potensi daya toksisitas tinggi dan serangga sasaran yang lebih luas (Apaydin 2004; Maheswaran et al.
2010 dan Patel et al. 2009).
Pada penelitian ini isolat mikroba diisolasi dari larva Attacus atlas dan
Bombyx mory yang mati. Pemilihan sumber isolat dari bangkai ulat A. atlas karna ulat tersebut memiliki ukuran yang cukup besar dengan panjang larva sekitar 3 cm dan ulat dewasa mencapai 17 cm. Ulat tersebut pemakan daun sirsak, Daun sirsak diketahui bisa dimanfaatkan sebagai bioinsektisida. Mikroba yang dapat mematikan ulat yang cukup tahan tersebut, diharapkan mampu juga mematikan ulat atau serangga yang lain. Bangkai ulat B. mory dipilih berdasarkan lokasi, dari daerah dataran tinggi. Kedua bangkai ulat dipilih yang berwarna hitam, sesuai ciri khas B. thuringiensis apabila menginfeksi ulat akan berwarna hitam, sehingga diharapkan isolat yang diperoleh adalah B. thuringiensis.
Media untuk kebutuhan industri perlu dicari media semurah mungkin, untuk menekan biaya produksi. Alternatif yang dapat dipilih sebagai media murah adalah limbah agroindustri. Limbah cair industri tahu dapat menjadi alternatif untuk media perbanyakan inokulum (starter) B. thuringiensis, karena memiliki komposisi kimia dengan kandungan air 98.63%, nitrogen 0.02%, karbon 0.27% dan mineral 0.43% (Nelly, 2012). Air kelapa memiliki kandungan gizi yang cukup bagus, menurut Hasbullah (2001) air kelapa mengandung air 95.5%, protein 0.2%, lemak 1.0%, karbohidrat 3.8%, dan kalsium 0.015%. Bahan-bahan tersebut diperlukan pada pertumbuhan sel baru, spora dan endotoksin (Valicente dan Mourao 2008). Ampas sagu dan ampas iles-iles mengandung pati yang tinggi. Ampas sagu masih mengandung pati 51.53% (Asben et al. 2012) dan ampas iles-iles masih mengandung pati 34 % (Syaefullah 1990). Pati yang terkandung pada kedua bahan tersebut dapat dimanfaatkan sebagai sumber karbon. Protein dapat dimanfaatkan sebagai sumber nitrogen, sedangkan mineral akan membantu pertumbuhan sel dan pembentukan endotoksin, serta kandungan serat sebesar 14% pada ampas sagu (Awg-Adeni et al. 2010) akan memberikan sifat porus pada media, sehingga akan memperbaiki kondisi kultivasi media padat.
Penelitian tentang penggunaan produk samping industri pertanian sebagai sumber karbon untuk memproduksi bioinsektisida B. thuringiensis telah banyak dilakukan di Indonesia, tetapi pada umumnya menggunakan media cair atau semi padat (Syamsu et al. 2007, Susanti dan Blondin 2013, Nelly 2012). Untuk penerapan di industri bila akan dilakukan kultivasi substrat cair dibutuhkan modal yang cukup besar dan teknologi yang tidak sederhana.
Produksi bioinsektisida secara komersial sangat penting. Dalam rangka meningkatkan produksi diperlukan sumber daya manusia, teknologi peralatan produksi, ketersediaan bahan baku yang murah, serta mikroorganisme yang mudah beradaptasi. Hal ini akan mengurangi biaya produksi dan meningkatkan jumlah produk yang dihasilkan sehingga berpengaruh baik untuk kepentingan pertanian dan program kesehatan (Devi dan Rao 2005)
3 sehingga mengurangi biaya proses membuat produk menjadi lebih murah (Bhargav et al. 2008) Beberapa penelitian menunjukan B. thuringiensis dapat tumbuh pada kultivasi media padat menggunakan berbagai media, baik pada media produk pertanian maupun bila menggunakan limbah pertanian, limbah industri maupun limbah rumah tangga (Capablo et al. 2001, Devi dan Rao 2005, Zuang et al. 2011, Zang et al. 2013)
1. 2 Perumusan Masalah dan Klaim Kebaruan
Bioinsektisida yang dijual di pasaran masih merupakan produk impor. Oleh sebab itu agar dapat diproduksi sendiri perlu dicari teknologi proses produksi bioinsektisida yang mudah, sederhana dan murah. Menurut Dulmage dan Rhodes (1971) keberhasilan produksi bioinsektisida terutama dipengaruhi oleh galur bakterinya dan medium kultivasi yang digunakan, metode pemanenan (recovery) produk, serta faktor lingkungan yang mempengaruhi proses kultivasi.
Perbanyakan inokulum dari nutrient agar sebelum diinokulasi ke medium kultivasi menggunakan nutrient broth (Foda et al. 2010; Capablo et al. 2001; Dulmage et al. 1990). Pada industri umumnya digunakan glukosa. Penggunaan media komersial nutrient broth harganya cukup mahal, begitu pula glukosa, sirup jagung dan lain-lain, meskipun lebih murah dari NB masih relatif mahal, sehingga perlu dicari alternatif bahan lain yang relatif lebih murah agar dapat menekan biaya produksi.
Limbah agroindustri cukup melimpah dan belum seluruhnya termanfaatkan sehingga dapat menyebabkan pencemaran lingkungan. Limbah cair tahu, ampas sagu dan ampas iles-iles mengandung karbon, nitrogen dan mineral yang dapat dimanfaatkan sebagai media tumbuh Bt. sehingga pemanfaatan bahan tersebut dapat menekan biaya produksi
Produksi bioinsektisida pada umumnya menggunakan kultivasi substrat kultur cair, bila akan dikembangkan pada skala industri, dibutuhkan modal yang cukup besar dan teknologi yang tidak sederhana, sehingga investor di Indonesia cenderung tidak tertarik untuk membangun industri tersebut.
Setiap bioisektisida memiliki toksisitas yang spesifik. Informasi mengenai karakteristik bioinsektisida yang dihasilkan dari isolat lokal dengan cara kultivasi media padat menggunakan campuran ampas sagu dan iles-iles perlu diamati.
Kebaruan dari penelitian ini adalah digunakannya isolat lokal yang baru dari bangkai ulat A. Atlas. Isolat tersebut tergolong galur yang baru, berbeda dengan galur yang sudah ada pada bank Gen. Media perbanyakan inokulum (starter) menggunakan limbah cair tahu, karena limbah cair tahu mengandung karbon, nitrogen dan trace element yang dibutuhkan untuk pertumbuhan sel dan sporulasi
4
media padat. Cara produksi menggunan teknologi yang sederhana sehingga akan mudah untuk dibuat meskipun oleh industri skala rumah tangga.
1. 3 Tujuan Penelitian
Tujuan akhir penelitian ini adalah untuk mengembangkan proses produksi bioinsektisida (B. thuringiensis) menggunakan isolat lokal dengan starter dan media kultivasi menggunakan hasil samping agroindustri, dengan cara kultivasi media padat, sehingga diperoleh bioinsektisida yang murah dan mudah untuk diproduksi tetapi kualitasnya cukup baik. Agar dapat tercapai tujuan penelitian akhir, maka dilakukan beberapa tahapan penelitian dengan tujuan masing-masing adalah:
a. Mendapatkan karakteristik isolat lokal yang toksik dan dapat digunakan untuk tujuan produksi dengan cara kultivasi media padat.
b. Mendapatkan media starter yang lebih baik dari limbah agroindustri.
c. Mendapatkan rancangan kondisi proses produksi kultivasi media padat menggunakan limbah agroindustri, dengan melihat pengaruh ketebalan media dan aerasi terhadap pertumbuhan dan produk yang dihasilkan.
d. Mendapatkan produk yang potensial melalui evaluasi dan analisis efikasi pada serangga sasaran.
1. 4 Manfaat Penelitian
Keuntungan menggunakan bioinsektisida diantaranya, menjaga kesuburan tanah dan meningkatkan bahan organik tanah, spesies tertentu yang digunakan aman baik sebagai musuh alami dan organisme non target, bioinsektisida tidak terlalu beracun seperti insektisida kimia sehingga aman untuk lingkungan, bioinsektisida mengandalkan senyawa biokimia potensial yang disintesis oleh mikroba, hanya dibutuhkan dalam jumlah terbatas, dan mudah membusuk sehingga dapat mengurangi pencemaran. Penggunaan Bioinsektisida dapat membantu hasil produk pertanian dalam penerapan Good Agricultural Practices
(GAP) dan kesehatan masyarakat, khususnya mencegah penyakit yang disebabkan oleh nyamuk sebagai vektornya.
Limbah industri tahu, limbah air kelapa, limbah industri pati sagu dan limbah industri glukomanan masih belum dimanfaatkan seluruhnya, sehingga dapat menyebabkan pencemaran lingkungan. Pemanfaatan limbah tersebut berkontribusi dalam mengatasi masalah lingkungan, disamping itu memberi nilai tambah pada limbah agroindustri tersebut.
1. 5 Ruang Lingkup Penelitian
Ruang lingkup dari penelitian agar dapat dicapai tujuan sesuai yang diharapkan yaitu :
5 b) Media untuk perbanyakan inokulum (starter) adalah limbah cair dari industri
tahu pada skala rumah tangga dan limbah air kelapa.
c) Substrat yang digunakan sebagai media tumbuh bakteri adalah campuran ampas sagu dan ampas iles-iles.
d) Kultivasi media padat dilakukan menggunakan wadah dari plastik dengan volume 4400 mL.
6
2 TINJAUAN PUSTAKA
Bioinsektisida adalah insektisida yang berasal dari mahluk hidup, diantaranya yang berbasis mikrobial. Bioinsektisida mikrobial mengandung bahan aktif yang berasal dari bakteri, virus atau kapang. Bioinsektisida yang cukup banyak diproduksi saat ini adalah dari bakteri. Bakteri-bakteri tersebut dapat menghasilkan endotoksin yang dapat meracuni serangga hama tanaman tertentu. Mikroba yang telah sukses dan berpotensi sebagai insektisida biologi salah satunya adalah B. thuringiensis. Menurut Federici et al. (2010) endotoksin yang dihasilkan oleh B. thuringiensis dapat mematikan serangga kelas Lepidoptera, Diptera dan Coleoptera.
2.1 Bacillus thuringiensis (Bt.)
Bacillus thuringiensis (Bt.) pertama kali diisolasi oleh Ishiwata dari larva sutra pada tahun 1901 di Jepang. Ishiwata berpendapat bahwa yang menjadi penyebab matinya larva tersebut adalah bakteri dan diberi nama B. satto. Pada tahun 1911, Berliner menemukan bakteri yang sama di provinsi Thuringia, Jerman. Bakteri ini telah membunuh kupu-kupu Mediterania, Anagasta kuehniella. Berliner menamakan bakteri tersebut dengan nama B. thuringiensis
(Dulmage et al. 1990). Bioinsektisida Bt. pertama kali digunakan sebagai pembasmi serangga secara komersial di Perancis pada tahun 1938, kemudian di AS pada tahun 1950 (Neppl 2000).
Setelah tahun 1976, Bt. telah tersedia dipasaran untuk mengontrol golongan lepidoptera seperti kupu-kupu dan ngengat. Pada tahun 1980, gen pengkode protein yang beracun berhasil diaplikasikan pada tanaman. Tanaman transgenik pertama yang berhasil mengekspresikan toksin B. thuringiensis adalah tembakau dan tomat (Van Frankenhuyzen 1993). Setelah berkembangnya teknologi rekombinan DNA, sudah banyak dikembangkan tanaman transgenik Bt. Tanaman transgenik utama meliputi jagung, kapas, kentang dan beras, yang telah dikomersialisasikan secara luas di Kanada, Jepang, Meksiko, Argentina, Australia dan Amerika Serikat (Frutos et al. 1999). Meskipun demikian penggunaan formulasi Bt. dengan cara semprot masih banyak digunakan.
B. thuringiensis (Bt.) adalah bakteri yang bersifat Gram positif, berbentuk batang, fakultatif anaerob dan mampu membentuk spora (Valicente et al., 2010). Bakteri ini mempunyai sel-sel vegetatif, berbentuk batang lurus dengan ukuran panjang 3 – 5 m dan lebar 1.0 -1.2 m jika ditumbuhkan pada medium cair standar (Stahly et al. 1992). Pada medium padat, koloni B. thuringiensis (Bt.)
berbentuk bulat dengan dengan tepian berkerut, berwarna putih, elevasi timbul dan permukaan koloni kasar (Bucher 1981; Maheswaran et al. 2010).
7 kebanyakan bakteri, ketika Bt. membentuk spora juga membentuk protein kristal yang merupakan komponen toksik bagi serangga. Sel vegetatif Bt. lebarnya
B. thuringiensis juga dapat menghasilkan enzim urease, fosfolipase, lesitinase, amylase, selulase, protease dan kitinase (Martin et al. 2010; Ling Lin et al. 2012; Tyagi et al. 2002; Driss et al. 2005). Selain enzim juga menghasilkan asam yang diproduksi dari salisin dan sukrosa (Martin et al. 2010).
Banyak manfaat yang telah diperoleh dengan ditemukannya B. thuringiensis
adalah salah satu agen hayati, yang mampu menghasilkan endotoksin yang bersifat racun terhadap serangga tertentu. Kemampuan meracuni dari bakteri tersebut dapat dimanfaatkan untuk membantu meningkatkan produktifitas hasil pertanian dengan mengendalikan organisme pengganggu tanaman. Juga pemanfaatannya pada kesehatan dalam mengendalikan serangga sebagai vektor penyakit yang berbahaya bagi manusia.
B. thuringiensis sangat beragam baik dari segi morfologi maupun kemampuan reaksi biokimianya. Hal ini karena metabolit sekunder yang dihasilkan, seperti jenis enzim dan protein kristal yang dihasilkan cukup bervariasi. Beberapa galur B. thuringiensis dapat menghasilkan beberapa jenis enzim yang berbeda. Begitu pula dengan protein kristal dihasilkan cukup bervariasi jenis cry dan cyt yang dikandungnya.
B. thuringiensis telah diisolasi di banyak negara dan dari berbagai habitat, tetapi pencarian isolat baru masih terus dilakukan, seiring dengan bertambahnya hama serangga yang harus dikendalikan, disamping perlunya menyiapkan galur baru apabila terjadi resistensi terhadap toksin yang selama ini sudah digunakan.
2.2Kristal Protein
Patogenitas Bt. berkaitan erat dengan toksin yang dihasilkannya dan sampai saat ini telah diketahui ada 4 jenis toksin yaitu eksotoksin alpha, eksotoksin beta, eksotoksin gamma dan endotoksin delta. Eksotoksin alfa dan gamma tidak banyak dibicarakan karena bukan merupakan komponen yang aktif merusak tubuh organisme induk semang Eksotoksin beta ini terbukti merupakan toksin terhadap larva serangga pada fase pergantian kulit atau selama proses metamorfosa, namun sebaliknya tidak toksin terhadap serangga dewasa (Burgerjon dan Martouret 1971).
B. thuringiensis memproduksi lebih dari satu kristal protein, dan setiap subspesies memiliki kombinasi yang spesifik dan efektifitas kerja toksin spesifik untuk setiap kombinasinya. Tabel 1 menunjukan setiap subspesies B. thuringiensis menghasilkan kombinasi endotoksin target serangga sasaran yang tertentu.
Menurut Tokcaer (2003) bentuk struktur protein kristalnya menyebabkan
kristal ini disebut sebagai protein kristal (Cry) atau δ-endotoksin. Gen yang
8
stasionernya. Protein kristal terakumulasi di dalam sel induk dan dilepaskan setelah masa sporulasi selesai.
Hasil penelitian tentang bioinsektisida dari B. thuringiensis dari banyak peneliti, telah menghasilkan data yang cukup memadai tentang hubungan yang kompleks antara struktur, mekanisme kerja, dan genetika dari protein kristal bioinsektisida. Beberapa penelitian lain berfokus pada peran ekologis dari protein kristal B. thuringiensis, kinerjanya pada pertanian maupun dunia kesehatan, dan evolusi mekanisme resistensi hama sasaran.
Penelitian toksisitas dengan protein murni tunggal menunjukan bahwa setiap protein kristal yang dijelaskan ditandai dengan sangat spesifik dan kadang-kadang terbatas hanya pada serangga tertentu. Ekspresi gen protein kristal dipengaruhi sejumlah faktor, yaitu pada beberapa tahap sporulasi dan ekspresi protein kristal pada tingkat pasca-translasi (Tokcaer 2003).
2.3 Kultivasi Substrat Padat
Kultivasi substrat padat merupakan suatu proses dimana pertumbuhan mikroorganisme pada bahan padat dalam kondisi air bebas sangat sedikit. Aktivitas biologis menurun bila kandungan air substrat sekitar 12%. Substrat yang paling banyak digunakan dalam kultivasi substrat padat adalah biji-bijian serealia, kacang-kacangan, sekam gandum, bahan yang mengandung lignoselulosa, dan berbagai bahan lain yang berasal dari tanaman dan hewan. Senyawaan tersebut selalu berupa molekul primer, tak larut atau sedikit larut dalam air, tetapi murah, mudah diperoleh dan merupakan sumber hara yang tinggi.
Jenis mikroorganisme yang tumbuh baik dibawah kondisi kultivasi substrat padat ditentukan terutama oleh faktor aktivitas air (aw). Nilai aw substrat secara kuantitatif menyatakan banyaknya air yang dibutuhkan bagi aktivitas mikroba. Selama proses kultivasi akan terjadi variasi perubahan kadar air, tetapi tidak akan menghambat pertumbuhan maupun pembentukan spora Bt., karena pada kadar air 55% masih menghasilkan aw yang baik untuk pertumbuhan Bt (Capablo et al.
2001).
Beberapa parameter dapat mempengaruhi selama kultivasi media padat. Variabel-variabel yang mempengaruhi adalah ukuran partikel dan bentuk sustrat, banyaknya substrat padat, kadar air awal, kelembaban udara, kecepatan agitasi,
Tabel 1 Subspesies Bacillus thuringiensisuntuk kelompok serangga sasaran
Subspesies Protein endotoksin
(Bobot dalam kDa) Serangga sasaran
Kurstaki Cry1Aa(133),Cry1Ab(131), Morrisoni Cry3Aa, Cry3Bb(73) Coleoptera Israelensis Cry4Aa(134),Cry4Ab(128),
Cry11Aa(72), Cyt1Aa(27)
Diptera
9 laju aerasi dan takaran inokulum spora. Fungsi-fungsi fisik adalah pergerakan mekanis substrat padat dan suhu substrat. Serta aktifitas fisiologi adalah pertumbuhan, pembentukan produk, konsumsi oksigen, evolosi karbondioksida, evolusi panas metabolik, produk air metabolik dan kontaminan (Rahman 1990)
Pada kultivasi media padat, ukuran partikel menentukan banyaknya ruang dalam massa media yang dapat ditempati oleh udara (ruang kosong). Hampir semua kultivasi melibatkan mikroorganisme aerobik dan transpor oksigen kedalam ruang kosong merupakan parameter kritis yang mengendalikan perkembangan pertumbuhan dan pembentukan produk. Pemindahan oksigen ke dalam ruang kosong berkaitan erat dengan tingkat kadar air bahan karena tingkat kadar air bebas yang tinggi yang ditimbulkan oleh pembuangan udara keluar menyebabkan ruang kosong yang rendah.
Keunggulan menggunakan kultivasi media padat adalah biaya dapat lebih rendah karena biasanya menggunakan media sederhana dari hasil samping produk pertanian, proses sederhana, peralatan sederhana, hemat ruang, menghasilkan limbah cair sedikit, kondisi pertumbuhan sama dengan di alam, dan kontrol kontaminasi lebih mudah (Devi dan Rao 2005).
Salah satu kelemahan teknik kultivasi media padat adalah kesulitan untuk melakukan analisis kuantitatif dan analisis sifat-sifat fisik seperti pertumbuhan biomassa, konsumsi substrat dan yield produk (Rahman 1990, Bhargav et al.
2008). Selain itu untuk mendapatkan produk murni menjadi sulit karena produk biasanya ada bersama media, terutama bila menggunakan media yang tidak inert.
Kunci dari penggunaan media padat adalah pemilihan media yang tepat, memiliki sifat tidak larut dan mengandung nutrisi yang dapat menunjang pertumbuhan. Selain itu pertimbangan pemilihan media adalah nilai tambah bahan dan berhubungan dengan tujuan menghasilkan produk tertentu dari media yang sesuai.
2.4 Media Kultivasi Bacillus thuringiensis
Faktor-faktor yang sangat mempengaruhi kultivasi Bt adalah komposisi medium, kondisi untuk pertumbuhan mikroba seperti pH, oksigen terlarut dan temperatur (Dulmage dan Rhodes 1971). Karbon adalah bahan utama untuk mensintesis sel baru dan produk sel. Sementara banyak sumber karbon yang dapat dimanfaatkan sebagai media tumbuh diantaranya gula jagung, beras, dedak gandum, dedak beras, lumpur aktif atau limbah rumah tangga (Valicente et al.
10
Selain karbon dan nitrogen, mikroorganisme juga membutuhkan mineral untuk pertumbuhan dan pembentukan produk metabolit. Kebutuhan mineral tergantung jenis mikroorganisme yang ditumbuhkan. Menurut Dulmage dan Rhodes (1971), unsur-unsur mineral yang diperlukan untuk pertumbuhan dan sporulasi meliputi K, Mg, P, S, serta Ca, Zn, Fe, Co, Cu, Mo, dan Mn juga diperlukan meski dalam jumlah yang sangat sedikit.
Jenis nutrisi yang dibutuhkan untuk pertumbuhan B. thuringiensis umumnya ada pada bahan-bahan lignoselulosa. Lignuselulosa mengandung serat seperti selulosa, hemiselulosa dan lignin yang dapat memberi sifat porus pada media sekaligus juga sebagai sumber karbon. Selain serat sumber C yang lain juga masih ada seperti pati dan gula. Kandungan protein yang ada dapat dimanfaatkan sebagai sumbar N. Pada kultivasi media padat dibutuhkan jumlah substrat yang relatif banyak jika dibandingkan media cair, sehingga pemanfaatan limbah lignuselulosa akan menghemat biaya produksi, mengatasi pencemaran dan memberi nilai tambah.
2.5Kondisi Kultivasi Bacillus thuringiensis
Selain komposisi medium, kondisi pertumbuhan juga mempengaruhi produksi bioinsektisida B. thuringiensis, karena B. thuringiensis adalah bakteri yang bersifat anaerob fakultatif, maka aerasi merupakan salah satu faktor yang berpengaruh terhadap pertumbuhan, sporulasi maupun produksi bioinsektisida (Rahayuningsih 2003).
Faktor-faktor yang berpengaruh pada pertumbuahan mikroorganisme menurut Bhargav et al. (2008) bila menggunakan kultivasi media padat diantaranya adalah kadar air, aktifitas air (Aw), transfer massa, suhu dan transfer panas.
Kultivasi B. thuringiensis secara normal dilakukan pada temperatur 27-330C dengan temperatur optimal pada 300C. Nilai pH awal medium ditetapkan pada pH 6.8 – 7.2. Selama kultivasi nilai pH dapat berubah dengan cepat tergantung pada penggunaan karbohidrat dan protein. Penggunaan karbohidrat dapat menurunkan pH, sedangkan penggunaan protein dapat menaikkan pH. Nilai pH dapat dikendalikan dengan menjaga kesetimbangan antara senyawa gula dan protein (Quinlan dan Lisansky 1985).
11
3 METODE
3.1 Kerangka Pemikiran
Dalam rangka mencari sumber bahan aktif untuk membuat bioinsektisida mikrobial yang dapat mematikan/mengurangi populasi hama serangga kelas Lepidoptera dan Diptera, maka perlu dicari mikroorganisme yang dapat mematikan serangga tersebut. Ulat mati yang bukan disebabkan oleh pemberian insektisida, bisa disebabkan oleh tumbuhnya mikroorganisme. Pada penelitian ini dilakukan isolasi mikroba dari ulat yang mati bukan disebabkan oleh insektisida. Diharapkan penyebab kematian ulat tersebut dapat juga bersifat toksin terhadap serangga dari kelas yang sama.
Nutrient Broth merupakan media komersial yang biasa digunakan untuk perbanyakan inokulum pada produksi bioinsektisida. Untuk menurunkan biaya produksi perlu dicari media perbanyakan inokulum yang cocok untuk menggatikan media komersial. Hasil samping dari pengolahan tahu, yaitu limbah cairnya memiliki kandungan nutrisi karbon, nitrogen, dan mineral (Ca, Fe, Mg dan Zn) yang berpotensi digunakan untuk pertumbuhan Bt.
Ampas iles-iles adalah hasil samping industri pengolahan glukomanan yang memiliki kandungan pati yang tinggi, sehingga dapat dimanfaatkan sebagai sumber karbon bagi pertumbuhan B. thuringiensis. Bahan tersebut yang belum banyak dimanfaatkan karena mengandung kalsium oksalat yang dapat menimbulan rasa gatal pada kulit. Ion Ca dapat dimanfaatkan untuk membantu proses sporulasi pada B. thuringiensis, sedangkan glukomanan yang tersisa di pati iles-iles dapat meningkatkan ketersediaan air karena sifatnya sebagai hidrokoloid mampu menyerap air dengan baik, dan memiliki kemapuan pengikatan air yang kuat, sehingga bisa mensuplai kebutuhan air yang dapat mendukung kondisi kultivasi. Ampas sagu masih mengandung pati, protein dan mineral yang dapat mendukung pertumbuhan Bt. disamping itu mengandung serat yang tinggi, serat yang terkandung akan memberikan difusi lalu lintas O2, panas dan lain-lain lebih baik pada media sehingga akan mengoptimalkan pertumbuhan bakteri.
Proses kultivasi akan menggunakan kultivasi media padat. Agar diperoleh hasil yang optimum perlu dilihat interaksi bahan dan komponen yang terkandung dalam bahan untuk meningkatkan aplikasi dalam membantu pertumbuhan B. thuringiensis menghasilkan bioinsektisida. Hasil penelitian ini diharapkan dapat diperoleh teknik produksi bioinsektisida (B. thuringiensis) yang murah, mudah dan efisien untuk mengendalikan larva C. pavonana dan larva nyamuk A. aegepty.
3.2 Metodologi Penelitian
12
Isolasi Keluaran:
Isolat murni
Keluaran:
Karakteristik dan identitas isolat
Keluaran:
Perlakuan proses terbaik pengaruh ketebalan dan aerasi Karakterisasi
dan Identifikasi
Penapisan isolat
Seleksi media untuk perbanyakan inokulum
Kultivasi Produk
Karakterissi Produk
Keluaran:
Isolat terpilih tunggal
Keluaran:
Serangga target yang sesuai
Dosis penggunaan
Keluaran:
Media starter terpilih
Gambar 1 Diagram alir tahapan kegiatan penelitian
3.3 Bahan
Mikroorganisme yang digunakan adalah bakteri yang diisolasi dari ulat A. atlas yang mati di peternakan FAPET IPB Kampus IPB Darmaga dan ulat B. mori
13 merupakan hasil samping ekstraksi pati sagu dari empulur batang sagu (Metroxylon sp) dari industri kecil di Cimahpar-Bogor.
Bahan kimia yang digunakan untuk proses adalah Nutrient Agar, Nutrient Broth, urea, CaCO3, MgSO4.7H2O, MnSO4.7H2O, FeSO4.7H2O, ZnSO4.7H2O. Bahan kimia untuk analisis adalah NaCl, akuades, pati terlarut, Iod, potasium sodium tartrat, CuSO4, NaOH, Folin ciocalteu, sodium dodencyl sulfat, tris-ammonium persulfat, TEMED, Commasie brilliant blue R-250, bromophenol blue, metanol, asam asetat, etanol, SDS, APS, standard protein molecular weight,
cetyl trimethyl ammonium bromide (CTAB), -mercaptoethanol, kloroform, isoamilalkohol, natrium asetat, etanol 70%, buffer Tris-EDTA, primer forward
63, primer reverse 1387R spiritus, etanol teknis, agristick (Alkilaril poliglikol eter), H2SO4, phenol dan buffer standard pH 4, 7, dan 9.
3.4 Alat
Alat-alat yang digunakan adalah incubator cabinet, incubator shaker, pH-meter, sentrifusi, mikroskop medan terang dan fase kontras CarlZeis dengan program Matrox II, Scanning electron microscope (Merek PhenomX), Mini Protein SDS PAGE Kit, vorteks, PCR, UV transiluminator, Geldoc, micropipette,
pinset, jarum Ose, autoclave, cleanbench, waterbath, incubator, rotary shaker incubator, spectrofotometri UV-Vis, spektrofotometri serapan atom, neraca analitik, serta alat-alat gelas untuk menunjang proses.
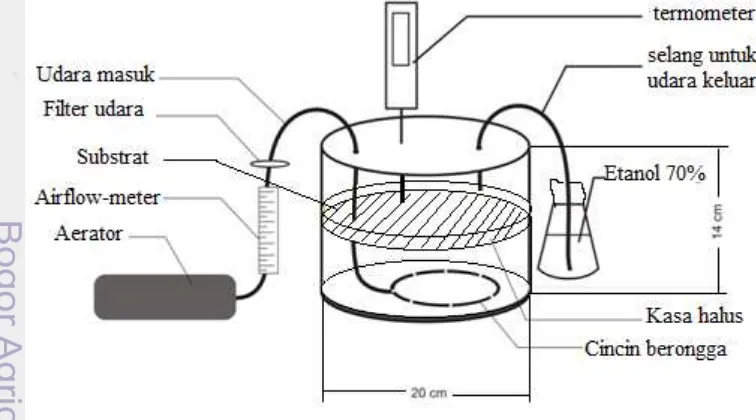
Kultivasi dilakukan menggunakan tempat dari plastik berbentuk silinder (Gambar 5 dan 6) dengan diameter 20 cm dan tinggi 14 cm. Perlakuan tanpa aerasi tempat dilengkapi dengan termometer. Perlakuan menggunakan aerasi tempat dilengkapi dengan termometer, aerator, airflow, sparjer dan filter udara.
3.5 Tahapan Penelitian
3.5.1 Isolasi, Karakterisasi dan Identifikasi
14
Karakterisasi dilakukan untuk mengobservasi bakteri hasil isolasi. Karakterisasi dapat dilakukan berdasarkan sifat morfologi (mencakup sifat-sifat koloni seperti ukuran, bentuk, warna dan tepian), sifat sitologi (bentuk sel, spora, protein kristal, gerak atau motilitas, dan sifat Gram), dan sifat fisiologi (uji hidrolisis pati), serta profil proten yang dihasilkan. Sifat morfologi mencakup sifat-sifat koloni seperti ukuran, bentuk, warna dan tepian, pengamatan dengan cara menumbuhkan isolat pada media nutrient agar dalam cawan petri dan pertumnuhannya diamati secara visual. Bentuk sel, bentuk spora, bentuk kristal, dan ukurannya diamati menggunakan mikroskop medan terang dan Scanning electron microscope (SEM). Uji motilitas berperan dalam mengetahui pergerakan bakteri menggunakan metode tetes menggantung yang digunakan oleh Eswarapriya et al. (2010). Pewarnaan Gram mengikuti metoda yang digunakan oleh Preston dan Morel (1962). Uji fisiologis bakteri dilakukan untuk mengidentifikasi bakteri berdasarkan aktivitas selnya, diantaranya dengan melihat aktivitas amilolitik bakteri, yaitu melihat bakteri menghasilkan enzim amilase yang dapat mengubah pati menjadi molekul-molekul gula sederhana (Kaur et al.
2012). Profil protein kristal yang dihasilkan diamati menggunakan metode sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS-PAGE) menurut Laemmli (1970), Prosedur lengkap untuk analisis dapat dilihat pada Lampiran 1.
Identifikasi mikroba dimulai dengan tahap ekstraksi DNA bakteri dengan
cetyl trimethyl ammonium bromide (CTAB) mengikuti metode Sambrook dan Gambar 2 Diagram alir isolasi mikroba
Bangkai ulat
Bagian usus ulat disuspensikan dalam akuades steril
Kocok dengan orbital shaker selama 5 jam
1 ml contoh dipanaskan pada suhu 80oC, 15 menit
0.1 ml diratakan pada media NA, diinkubasi suhu 30oC, 24 jam
15 Russel (2001). Tahap berikutnya yaitu hasil isolasi DNA dielektroforesis dilajutkan dengan Polymerase Chain Reaction (PCR) (Marchesi et al. 1998), Urutan DNA penyusun gen 16S dianalisis menggunakan DNA sequencer ABI Prism model 310 versi 3.7. Selanjutnya hasil sekuensing dianalisis dan ditentukan homologinya dengan spesies-spesies yang telah ada di Bank Gen menggunakan program Clustal W Bioedit dan Basic Local Aligment Search Tools (BLAST) dengan bantuan situs NCBI (http://www.nebi.nlm.nih.gov/blast) (Altschul et al.
1997). Pohon filogenetik dibuat dengan menggunakan program MEGA 5.05 (Tamura et al. 2011). Prosedur lengkap tersaji pada Lampiran 1.
3.5.3 Penapisan Isolat
Isolat hasil isolasi dari bangkai ulat A. atlas dan B. mori dipilih untuk digunakan pada penelitian pada kultivasi media padat. Pemilihan isolat disesuaikan dengan tujuan dapat isolat mampu tumbuh di media padat lebih baik dan mempunyai kemampuan toksisitas. Pemilihan isolat berdasarkan kriteria berikut:
a. Sifat motilitas sel
Uji motilitas dilakukan dengan metoda tusuk agar pada media nutrient agar dan metoda tetes gantung
b. Jumlah sel hidup
Jumlah sel hidup diamati dengan metoda TPC (Total Plate Count). c. Jumlah spora hidup
Jumlah spora hidup diamati dengan metoda VSC (Viable Spore Count). d. Kemampuan toksisitas.
Toksisitas diuji dari hasil kultivasi pada media campuran ampas sagu dan ampas iles-iles, dengan lama kultivasi 24 jam. Pengujian dilakukan terhadap larva C. pavonana instar 2.
Prosedur selengkapnya sifat motilitas sel dapat dilihat pada Lampiran 1. Jumlah sel hidup, jumlah spora hidup dan kemampuan toksisitas prosedur selengkapnya dapat dilihat pada Lampiran 2.
3.5.4 Media untuk Produksi Inokulum (Starter)
Bahan yang digunakan untuk media tumbuh B. thuringiensis (starter) dilakukan karakterisasi. Bahan yang digunakan sebagai media starter adalah limbah cair tahu (LCT), limbah cair tahu ditambah urea (LCTU), air kelapa (AK) dan Nutrient broth (NB). Karakterisasi yang dilakukan meliputi analisa kadar karbon, kadar nitrogen, kadar air, kadar abu, kadar lemak, kadar protein (AOAC 2005) dan kadar mineral (Fe, Mg, Mn, Zn, dan Ca) (APHA 2012). Prosedur analisa selengkapnya ada pada Lampiran 2. Karakterisasi bahan diperlukan untuk formulasi media starter, yaitu ketersediaan mineral minimum disesuaikan dengan
nutrient broth. Penambahan urea pada LCTU diformulasi dengan melihat rasio C/N pada nutrient broth yaitu 1.68:1.
16
(TPC) dan jumlah spora hidup Viable Spore Count (VSC) (Zhuang et al 2011). Prosedur analisa selengkapnya ada pada Lampiran 2. Diagram alir proses pemilihan media inokulum disajikan pada Gambar 3.
Karakterisasi Bahan (NB, LCT, AK)
Kadar C, N, Air, Serat, Abu, Protein, Lemak Mineral (Ca, Fe, Mn, Mg,Zn)
Media (NB, LCT, LCTU, AK)
Sterilisasi
50 ml Media dalam erlenmeyer
250 ml 1 ml isolat
Kultivasi pH: 6,8-7,2; 150 rpm;
300C
Pengamatan Jam ke 0,4,8,12,16,20,24 pH, TPC, VSC, Total gula
Media terpilih
Gambar 3 Diagram alir proses pemilihan media inokulum
3.5.5 Produksi Bioinsektisida Menggunakan Ampas Sagu dan Ampas Iles-iles
3.5.5.1 Karakterisasi Bahan Baku
17
al. 1998). Analisis sifat fisik meliputi densitas kamba dan kapasitas penyerapan air. Prosedur lengkap analisa dapat dilihat pada Lampiran 3. Diagram alir proses kultivasi produksi bioinsektisida disajikan pada Gambar 4.
Tanpa Aerasi Dengan Aerasi
Ketebalan: 1, 3,5, 7 cm Ketebalan : 3 cm
Gambar 4 Diagram alir proses kultivasi produksi bioinsektisida
Persiapan Bahan Baku
Pengeringan – Penghalusan - Pengayakan
Karakterisasi Bahan
Kadar C, N, Air, Serat, Abu, Lemak, Protein Mineral (Ca, Fe, Mn, Mg, Zn) Densitas kamba, Kapasitas penyerapan air
Mengkondisikan Media
aw: 0.92 pH: 6.8-7.2
Inokulum
10% Media
Pengamatan
Jam ke 0, 24, 48, 72, 96, 120 dan 144
pH, Jumlah Sel, Jumlah Spora, Total gula, Susut bobot & Toksisitas
Karakterisasi Produk Asam amino, BM Protein, Toksisitas
Sterilisasi Inokulum dalam LCT
agitasi 150 rpm, suhu 30oC, inkubasi 16 jam
18
3.5.5.2Pengaruh Ketebalan pada Proses Kultivasi
Produksi bioinsektisida diawali dengan penyegaran isolat, dilanjutkan dengan persiapan inokulum medium kultivasi. Satu lup biakan B. thuringiensis
diinokulasi dalam 50 mL media limbah cair tahu diinkubasi dalam rotary shaking incubator, dengan kecepatan agitasi 150 rpm, suhu 28-32 oC, selama 16 jam. Sebanyak 10% kultur selanjutnya digunakan untuk menginokulasi media kultivasi.
Kultivasi media padat menggunakan metode Capablo et al. (2001) yang dimodifikasi. Media menggunakan campuran ampas sagu dengan ampas iles-iles dengan perbandingan 1 : 2. Konsentrasi elemen mikro disesuaikan dengan kondisi minimum yang dipergunakan oleh (Valicente dan Mourao 2008) yaitu 1 g/L CaCO3, 0.3 g/L MgSO4.7H2O, 0.02 g/L MnSO4.7H2O, 0.02 g/L FeSO4.7H2O dan 0.02 g/L ZnSO4.7H2O. Kelembaban bahan diatur hingga nilai aw mencapai 0.92, kondisi pH awal diatur pada pH 6.8 – 7.2, dan inkubasi pada suhu 30oC.
Proses kultivasi tanpa aerasi menggunakan bioreaktor dengan diameter 20 cm dan tinggi 14 cm, pengamatan suhu dengan termometer digital (Gambar 5). Alat disterilisasi dengan cara disemprot menggunakan etanol 95% dan dilanjutkan dengan penyinaran menggunakan UV. Media disterilisasi secara terpisah menggunakan autoclave pada suhu 121 oC selama 20 menit, setelah dingin baru diinokulasi dengan inokulum sebanyak 10 % (v/b).
Penelitian ini mempelajari pengaruh empat tingkat ketebalan yaitu 1 cm, 3 cm, 5 cm, dan 7 cm terhadap keasaman (nilai pH), jumlah sel dengan cara Viable Plate Count (TPC), jumlah spora hidup Viable Spore Count (VSC) dan konsumsi substrat dengan mengamati total gula sisa serta susut bobot sisa media (Lampiran 2). Pengamatan dilakukan pada jam ke-0, 24, 48, 72, 96, 120 dan 144. Parameter kinetika kultivasi yang diukur untuk menentukan efisiensi dan produktivitas proses produksi adalah jumlah sel (N), jumlah spora hidup (P), jumlah substrat yang dikonsumsi dengan melihat kadar gula (S), laju pertumbuhan spesifik maksimum (maks), efisiensi penggunaan substrat (1 – St/So) (Rahayuningsih 2003).
19 Rancangan percobaan yang digunakan untuk menganalisa pengaruh ketebalan media dan lama kultivasi, terhadap jumlah sel, jumlah spora dan total gula adalah Rancangan Acak Lengkap Faktorial, yang terdiri dua faktor dengan dua kali ulangan, mengikuti persamaan berikut (Hanafiah 2005):
Yijk = + Ai + Bj + ABij + kij) Keterangan :
Yij = nilai variabel respon unit percobaan yang dikenai taraf ke-i faktor ketebalan pada jam pengamatan ke-j.
= nilai rata-rata pengamatan yang sesungguhnya. Ai = Pengaruh faktor ketebalan taraf ke-i
Bj = Pengaruh faktor lama kultivasi taraf ke-j
ABij = Pengaruh interaksi faktor A taraf ke-i dengan faktor B taraf ke-j. kij) = pengaruh galat dari satuan percobaan ke-k yang memperoleh
kombinasi perlakuan.
Data yang diperoleh dari pengukuran parameter, masing-masing dianalisis menggunakan ragam uji F. Apabila hasilnya menunjukan pengaruh yang nyata dilanjutkan dengan uji Duncan.
3.5.5.3Pengaruh Aerasi pada Proses Kultivasi
Kultivasi menggunakan komposisi media dan kondisi proses yang sama dengan perlakuan pengaruh ketebalan. Ketebalan substrat yang digunakan 3 cm. Aerasi menggunakan aerator dengan laju alir 2 vvm. Aerasi dialirkan pada bagian bawah media (Gambar 6). Pengamatan dilakukan pada jam ke-0, 24, 48, 72, 96, 120 dan 144, melihat pengaruh aerasi terhadap keasaman (nilai pH), jumlah sel yang terbentuk, jumlah spora dan konsumsi substrat.
Gambar 6 Bioreaktor untuk kultivasi dengan aerasi
20
karakteristik produk adalah dengan melihat toksisitas produk terhadap larva nyamuk dan larva ulat, kandungan asam amino, dan pola protein.
Pengujian kemampuan bioinsektisida dengan melihat toksisitas produk dari hasil kultivasi 96 jam. Pengujian kemampuan toksisitas dilakukan terhadap larva nyamuk A. aegepty dan larva C. pavonana. Pengujian kemampuan toksisitas terhadap larva nyamuk A. aegepty dilakukan dengan menggunakan metode seperti yang dilakukan oleh Rahayuningsih (2013). Pengujian kemampuan toksisitas terhadap larva C. pavonana dilakukan dengan menggunakan metode residu pada daun seperti yang dilakukan oleh Dono et al. (2010). Prosedur lengkap dapat dilihat pada Lampiran 2.
Analisis kandungan asam amino diawali terlebih dahulu dengan dilakukan preparasi sampel, yaitu dengan mendekstrusi triptofan agar tidak terdeteksi ketika analisa. Selanjutnya dilakukan derivatisasi menggunakan orthophtaldehyda), kemudian contih dianalisa menggunakan HPLC. Prosedur lengkap dapat di lihat pada Lampiran 3.
Profil protein yang dihasilkan diamati menggunakan metode sodium dodencyl sulphate polyacrylamide gel electrophoresis (SDS-PAGE). Analisis
Sodium dodencyl sulphate polyacrylamide gel electrophoresis (SDS-PAGE) umumnya digunakan untuk membandingkan profil protein isolat Bt. dari galur yang berbeda maupun membandingkan profil isolat dari pengaruh faktor media kultivasi yang berbeda. Prinsip analisis SDS-PAGE yaitu pemisahan protein berdasarkan ukuran molekul dengan menggunakan perbedaan tegangan listrik. Sebelum protein dimasukkan pada gel, diberikan suatu reduktor, mercaptoethanol berfungsi membantu dalam denaturasi protein dengan mengurangi ikatan disulfida. Protein yang terdenaturasi sempurna akan mengikat SDS dalam jumlah yang setara dengan berat molekul protein tersebut (Dunn,1989), dimana SDS memecah area hidrofobik dan menyelimuti protein dengan muatan negatif. Sampel‐sampel protein yang diinjeksikan ke dalam sumur gel diberi warna dengan bromphenol biru yang dapat terionisasi. Fungsi pewarna adalah untuk membantu memonitor jalannya elektroforesis. Berat molekul protein dapat diketahui dengan membandingkan Rf protein dengan protein standar yang berat molekulnya telah diketahui (Wilson dan Walker 2010). Prosedur lengkap untuk analisis dapat dilihat pada Lampiran 3.
3.6 Analisis Nilai Tambah Ampas Sagu dan Ampas Iles-iles sebagai Media Tumbuh Bacillus thuringiensis
21
Tabel 2 Model Perhitungan Nilai Tambah
No Variabel Perhitungan
I Output,input dan harga
1. Output (kg/produksi) a
2. Bahan baku (kg/produksi) b 3. Tenaga kerja (HOK/produksi) c 4. Faktor konversi (1:2) d = a/b 5. Koefisien tenaga kerja (HOK/kg) e = c/b
6. Harga output (Rp/kg) f
7. Upah rata-rata tenaga kerja (Rp/HOK) g II Pendapatan dan keuntungan
1. Harga bahan baku (Rp/kg) h 2. Sumbangan input lain (Rp/kg) i
3. Nilai output (Rp/kg) j = d x f 4. Nilai tambah (Rp/kg) k = j - i - h 5. Nisbah nilai tambah (%) l = k/j x 100% 6. Imbalan tenaga kerja (%) m = e x g
7. Bagian tenaga kerja (%) n = m/k x 100%
8. Keuntungan (Rp/kg) o = k - m
9. Tingkat keuntungan (%) p = o/j x 100% III Balas jasa pemilik faktor produksi
Marjin keuntungan q = j - h
22
(a) (b)
Gambar 7 (a) Koloni isolat A dan (b) Koloni isolat B pada media nutrient agar
4 HASIL DAN PEMBAHASAN
4.1 Karakteristik dan Identitas Isolat
Isolat bakteri hasil isolasi dari bangkai ulat Attacus atlas diberi kode isolat A dan isolat dari ulat Bombyx mori diberi kode isolat B. Koloni yang tumbuh pada nutrient agar, isolat A memiliki ciri-ciri dengan bentuk koloni punctiform, berwarna putih dan berlendir, sedangkan koloni isolat B memiliki ciri-ciri bentuk
circular, bertepi tidak rata, berwarna putih dan berlendir (Gambar 7). Dari dua sumber isolat yang berbeda ternyata menghasilkan bakteri dengan bentuk koloni yang berbeda. Menurut Apaydin (2004) koloni dari B. thuringiensis sangat bervariasi warna koloninya ada yang berwarna putih ada yang berwarna kuning. Kecerahan juga bervariasi ada yang buram, kurang cerah dan cerah. Bentuk koloni bulat ada yang berukuran kecil, sedang dan besar dengan tepi ada yang rata dan bergelombang. Begitu pula pendapat Xavier et al. (2010) morfologi, ukuran, dan jumlah protein kristal sangat bervariasi pada setiap galur B. thuringiensis.
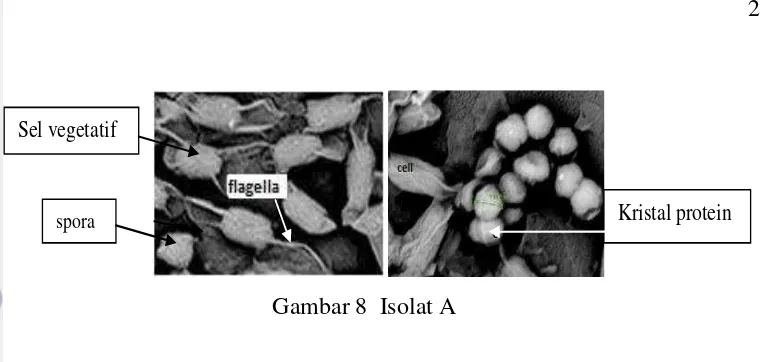
Pengamatan siifat sitologi sel menggunakan Scanning electron microscope
(SEM) drngan perbesaran 20 000 kali. Hasil pengamatan dengan SEM (Gambar 8) menunjukan Sel vegetatif isolat A berbentuk batang, dengan panjang sekitar 1700 nm dan lebar sekitar 830 nm, memiliki flagella lebih dari satu pada setiap sel vegetatif, seperti hasil penelitian Maheswaran et al. (2010) B. thuringiensis
23
.
Isolat B merupakan sel vegetatif berbentuk batang tidak memiliki flagela, dengan panjang bervariasi yaitu 3900 nm - 9500 nm dan lebar sekitar 830 nm. Kristal yang dihasilkan lebih dari satu dengan bentuk yang beragam, yaitu berbentuk bulat, bipiramid, dan kubus. Ukuran Kristal berkisar 300 nm – 700 nm. Pengamatan menggunakan SEM diperlihatkan pada Gambar 9. Kristal parasporal dapat berbentuk kubik. bipiramidal, ovoid ataupun amorph, setiap sel bakteri dapat menghasilkan 2 sampai 3 kristal parasporal (Tyrell et al. 1981; Maheswaran
et al. 2010).
Setiap bentuk kristal berhubungan dengan kode gen Cry gen dan gen Cyt. Ada lima jenis bentuk kristal protein yang masing-masing dikode oleh gen yang berbeda pula untuk kristal bipiramid berhubungan dengan protein Cry1, kristal kubus berhubungan dengan protein Cry2, kristal bulat dan komposit berhubungan dengan protein Cry4 dan protein Cyt, kristal persegi berhubungan dengan protein Cry3, kristal berbentuk batang berhubungan dengan protein Cry4D (Lopez-Meza dan Ibra 1996; Schnepf et al. 1998).
Bentuk kristal isolat A menunjukan kemiripan dengan kristal dari B. thuringiensis subsp. israelensis (Gambar 10), sedangkan isolat B kristal yang dihasilkan memiliki kemiripan bentuk dengan B. thuringiensis subsp. kurstaki
(Gambar 11) Federici et al.(2010).
Gambar 9 Isolat B
Gambar 8 Morfologi sel isolat A
spora
Sel vegetatif
Kristal protein
Sel vegetatif Kristal protein
Spora
24
Kedekatan karakteristik kristal protein yang dihasilkan dengan kristal protein B. thuringiensis subsp. israelensis maupun B. thuringiensis subsp.
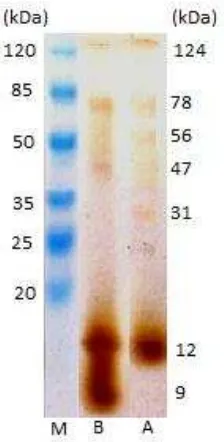
kurstaki diperkuat dengan data bobot molekul proteinnya. Kedua isolat dari B. thuringiensis menghasilkan jenis kristal protein yang berbeda, ditunjukan dengan hasil profil pita protein yang berbeda dari kedua isolat tersebut (Gambar 12). Isolat A menghasilkan protein bengan BM 124 kDa, 78 kDa, 56 kDa, 31 kDa, dan 12 kDa. Sedangkan isolat B menghasilkan protein dengan BM 124 kDa, 78 kDa, 47 kDa, 12 kDa, dan 9 kDa. Kedua isolat menunjukkan menghasilkan Cyt protein dan Cry protein sebagaimana diperlihatkan pada profil pita protein hasil elektroforesis SDS-PAGE yang disajikan pada Gambar 12.
Bila dilihat dari bentuk kristal isolat A (Gambar 10) ditengahnya ada garis tebal seperti yang dicirikan oleh Cry11Aa dimana Cry11Aa adalah protein dengan BM 72 kDa dan isolat A pemiliki protein dengan BM yang mendekati, yaitu 78 kDa. Begitu pula dengan Cyt 1 Aa dengan BM 27 kDa, isolat A memiliki BM 31 kDa. Kristal dari isolat A dilihat dari bentuk dan BM proteinnya memang memiliki kemiripan walaupun tidak sama persis.
Kristal isolat B ada yang berbentuk bipiramid dan kubus. Bentuk kubus merupakan Cry2Aa yang memiliki BM 72kDa isolat B memiliki BM yang mendekati, yaitu 78 kDa, tetapi BM protein yang lain tidak ada yang mendekati dengan BM Cry yang dimiliki B. thuringiensis subsp. kurstaki dimana cenderung memiliki BM tinggi yaitu sekitar 131 kDa dan 133 kDa. Sedangkan keristal isolat B secara kualitatif tampak lebih dominan protein dengan BM rendah. Ditunjukan oleh pita protein pada BM rendah tampak lebih tebal (Gambar 12). Hal ini menunjukan isolat B tidak sama dengan B. thuringiensis subsp. kurstaki.
(a) (b)
Gambar 11 (a) Kristal protein isolat B (b) Kristal protein
Btk Federici et al.(2010)
(a) (b)
Gambar 10 (a) Kristal protein isolat A (b) Kristal protein