EKSPRESI GEN KETAHANAN Fusi Gen (
cry
1B–
cry
1Aa)
TERHADAP
Sciporphaga interculas
Wlk.
PADA
Oryza sativa
L. KULTIVAR ROJOLELE
IQBAL HIKMATUROHMI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
IQBAL HIKMATUROHMI. Ekspresi Gen Ketahanan Fusi Gen (
cry
1B-
cry
1Aa)
terhadap
Sciporphaga interculas
Wlk. pada
Oryza sativa
L Kultivar Rojolele.
Dibimbing oleh DJAROT SASONGKO dan AMY ESTIATI.
Penggunaan varietas padi tahan hama melalui rekayasa genetika adalah salah
satu alternatif potensial dalam menanggulangi hama penggerek batang padi
(
Sciporphaga interculas
Wlk). Penelitian ini bertujuan untuk mendapatkan galur padi
transgenik generasi ke-4 (T
3) homozigot yang mengandung gen ketahanan terhadap
serangga penggerek batang kuning (fusi gen (
cry
1B–
cry
1Aa)) berdasarkan analisis PCR
dan bioasai pada skala rumah kaca (
Biosafety Containment
).
Pola segregasi pada fusi gen
cry
1B-
cry
1Aa dan seleksi homozigot ditentukan
berdasarkan hasil konfirmasi PCR. Uji ekspresi dilakukan pada semua galur padi
transgenik kultivar Rojolele melalui bioasai pada fase vegetatif yang diinfeksi dengan 6
ekor larva serangga penggerek batang kuning per anakan.
Hasil analisis PCR menggunakan
±
30 tanaman per galur menunjukan 4 dari 5
galur padi transgenik Rojolele generasi ke -4 mengandung fusi 2 gen
cry
(
cry
IB-
cry
IAa)
(galur RFz 3.3.2 1-6; RFz 4.2.2 1-27; RFz 3.3.2.A 11-25; Rjl 04 2.2.4 25-22)
bersegregasi 3 : 1 mengikuti ratio Mendel yaitu 3:1. Hanya 1 galur transgenik (galur
RFz 4.2.3 28-15) yang diidentifikasi sebagai galur homozigot.
ABSTRACT
IQBAL HIKMATUROHMI. Expression Resistance Gene Fusion Gene(
cry
1B-
cry
1Aa)
to
Sciporphaga interculas
Wlk. at
Oryza sativa
L Kultivar Rojolele. Under direction of
DJAROT SASONGKO and AMY ESTIATI.
The use of pest resistant varieties rice obtain by genetic enginering is one of the
alternative ways for crops protection. The aim of this research was to obtaine d
homozygote transgenic lines 4
thgeneration (T
3) harboring yellow stem borer resistance
gene (gene fusion
cry
1B-
cry
1Aa) based on PCR analysis and bioassay at
Biosafety
Containment
.
The Segregation pattern of (
cry
1B-
cry
1Aa) gene fusion in the progenies and
homozygos ity were determined based on PCR. Expression test was conducted to all
transgenic rice lines (cultivar Rojolele) harbouring resistance gene, through bioassays at
vegetative rice growth stage which infected with 6 yellow stem borer larvae phase per
tiller.
Result of PCR analysis using at least 30 plants per line showed that 4 of 5
transgenic rice lines 4
thgeneration (T
3) containing (
cry
1B-
cry
1Aa) gene fusion (RFz
3.3.2 1-6; RFz 4.2.2 1-27; RFz 3.3.2.A 11-25; Rjl 04 2.2.4 25-22 lines) were segregated
in 3 : 1 ratios following Mendelian segregation. Only one transgenic line (RFz 4.2.3
28-15 ) was identified as homozygote line. Positive corellation were founded between
bioassay and PCR results.
EKSPRESI GEN KETAHANAN Fusi Gen (
cry
1B–
cry
1Aa)
TERHADAP
Sciporphaga interculas
Wlk.
PADA
Oryza sativa
L. KULTIVAR ROJOLELE
IQBAL HIKMATUROHMI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Ekspresi Gen Ketahanan Fusi Gen (
cry
1B-
cry
1Aa) terhadap
S
ciporphaga Interculas
Wlk. pada
Oryza sativa
L. Kultivar Rojolele
Nama
: Iqbal Hikmaturohmi
NIM
: G44102013
Disetujui
Komisi Pembimbing
Drs. Djarot Sasongko H, M.S.
Ketua
Dr. Amy Estiati
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Allah SWT, Rabb yang
menguasai seluruh ilmu. Atas segala nikmat dan karunia yang diberikan sehingga
karya ilmiah ini berhasil diselesaikan. Rekayasa genetika terhadap tanaman padi
dipilih sebagai tema dalam penelitian yang dilakukan sejak bulan Maret hingga
Agustus 2006 di Kelompok Penelitian Padi, Laboratorium Biologi Molekuler
Puslit Bioteknologi LIPI Cibinong. Karya ilmiah ini berjudul Ekspresi Gen
Ketahanan Fusi Gen (
cry
1B-
cry
1Aa) terhadap
Sciporphaga Interculas
Wlk. pada
Oryza Sativa
L. Kultivar Rojolele.
Penulis mengucapkan terima kasih kepada Drs. Djarot Sasongko H, M.S
dan Dr. Amy Estiati selaku pembimbing yang telah dengan sabar memberikan
bimbingan, arahan serta sema ngat selama penelitian dan penulisan karya ilmiah
ini. Di samping itu, penghargaan penulis sampaikan kepada rekan kerja Bugi,
Anang, Dyah Ayu, Mba’ Fatimah, Mba’ Yuli, Budi, Opik, Mba’ Sri, Mba’ Dwi
dan semua staf di Kelompok Penelitian Padi, Puslit Biotek LIPI Cibinong atas
segala bantuan teknis dan non-teknis serta segala bentuk kerjasama selama
penelitian. Ucapan terima kasih tak terhingga juga disampaikan kepada Ayah, Ibu,
Adik-adikku atas doa, kasih sayang, dan dukungannya selama penelitian.
Penulis berharap semoga karya ilmiah ini bermanfaat bagi penulis maupun
semua pihak demi kemajuan ilmu pengetahuan.
Bogor, Oktober 2006
ii
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 27 Maret 1984 sebagai anak
pertama dari empat bersaudara dari pasangan Drs. Ohim Abdurrohim dan
Dra. Hilmiatul Asna. Tahun 2002, penulis lulus dari SMU Negeri 1 Ciamis dan
pada tahun yang sama berhasil lulus seleksi mahasiswa IPB melalui jalur
Undangan Saringan Masuk IPB (USMI) pada Program Studi Biokimia,
Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA).
iii
DAFTAR ISI
Halaman
DAFTAR TABEL ...
DAFTAR GAMBAR ...
DAFTAR LAMPIRAN ...
PENDAHULUAN ...
TINJAUAN PUSTAKA
Oryza sativa
L ...
Pemuliaan Tanaman ...
Ketahanan Tanaman ...
Bacillus thuringiensis
...
Gen Fusi (
cry
1B
– cry
1Aa) ...
Penggerek Batang Padi Kunin g (
Scirophaga interculas
Wlk.) ...
Polymerase Chain Reaction
(PCR) ...
Bioasai Tanaman Padi ...
BAHAN DAN METODE
Bahan dan Alat ...
Metode ...
HASIL DAN PEMBAHASAN
Analisis PCR ...
Seleksi Galur Homozigot ...
Analisis Segregasi Galur Heterozigot ...
Ekspresi Ketahananan Galur Padi Transgenik Terhadap Penggerek
Batang Padi Kuning ...
Korelasi Analisis PCR dan Hasil Bioasai ...
SIMPULAN DAN SARAN
Simpulan ...
Saran ...
DAFTAR PUSTAKA ...
LAMPIRAN ...
ii
ii
iii
1
1
2
2
3
3
4
5
5
6
6
8
8
9
9
11
11
11
11
DAFTAR TABEL
Halaman
1
Primer oligonukleotida yang digunakan dalam analisis PCR ... 6
2
Hasil Uji Khi-kuadrat pada Analisis Segregasi Monohibrida Padi
Rojolele Transgenik ... 9
3
Konversi Nilai % Gejala Sundep ke Nilai D dan Skala Kerentanan 0-9 .... 10
DAFTAR GAMBAR
Halaman
1 Proses Evolusi Dua Spesies Padi
O. sativa
dan
O.
Glaberrima
...
2
2
Bacillus thuringiensis
... 3
3 Serangga Penggerek Batang Kuning ...
4
4 Serangan Serangga Penggerek Batang Kuning ... 4
5 Salah Satu Hasil PCR Gen Fusi (
cry
1B-
cry
1Aa) pada padi transgenik
Kultivar Rojolele ... 8
6 Hasil Pengamatan Gejala Sundep ... 10
7 Hasil Pengamatan Terhadap Serangga Yang Telah Mengkonsumsi
DAFTAR LAMPIRAN
Halaman
1
Tahapan Penelitian ... 15
2
Analisis PCR (Van Heusdeun
et al
. 2000) ... 16
3
Seleksi Homozigot dan Analisis Segregasi (Sedcole 1997) ... 17
4
Uji Ketahanan (B ioasai) (Heindrich
et al.
1998) ... 18
5
Alat dan Reagen Isolasi DNA (Sambrook 2001) ... 19
6
Kondis i PCR (Roche 1999) ... 20
7
Perbandingan Morfologik dan Fisiologik Beberapa Ras
O. Sativa
. (Katayama,
1993) ... 21
8
Perbandingan Karakter Pertumbuhan Padi Subspesies Indika, Javanika,
Japonika (Purseglove 1972) ... 21
9
Klasifikasi Kristal Protein (
cry
) Berdasarkan Virulensinya terhadap
Serangga dan Nematoda (Rajamohan dan Dean, 1995) ... 21
10
Konstruksi Plasmid Gen Fusi
cry
1B-
cry
1Aa (Puslit Biotek LIPI) ... 19
11 Hasil Uji PCR Padi Rojolele Transgenik Generasi Ke-4 (T
3) ... 23
12 Hasil Bioasai Tanaman Padi Transgenik ... 26
13 Hasil Pengamatan Sundep pada 14 dan 28 HSI ... 27
PENDAHULUAN
Cekaman biotik, dalam hal ini gangguan tanaman oleh hama telah menjadi kendala dalam p emenuhan produksi padi nasional. Penggerek batang padi (Scirpophaga spp., Lepidoptera) merupakan salah satu hama utama yang menyebabkan penurunan produksi padi di Indonesia. Ledakan hama penggerek batang kuning (Scirpophaga interculas Wlk) pada tahun 1996-1997 dapat menyebabkan penurunan produksi padi rata-rata 25 % (BPS 1996-1997). Pada tahun 2001 hasil statistik Badan P usat Statistik juga menunjukkan bahwa hama penggerek batang padi telah menyerang areal persawahan di Indonesia dengan luas daerah seranga n mencapai 97.370 ha pada tahun 1999 dan meningkat pada tahun 2000 hingga 122.131 ha.
Penggunaan insektisida merupakan alternatif yang dapat digunakan, akan tetapi hal tersebut masih dapat memberikan efek samping yang cukup berat diantaranya peningkatan biaya produksi, pencemaran lingkungan dan kerusakan ekosistem. Alternatif potensial yang dirasa ramah lingkungan, ekonomis dan efisien dalam peningkatan produksi padi di Indonesia adalah penggunaan varietas padi tahan hama penggerek baik secara konvensional maupun rekayasa genetika.
Penggunaan varietas padi tahan hama penggerek secara konvensional sangat sulit dilakukan karena gen ketahanan inang tidak terdapat pada genom padi (Breitler et al.
2000). Persilangan antara 2 tetua yang tidak memiliki hubungan kekerabatan mustahil dilakukan dengan menggunakan metode pemuliaan secara konvensional. Sehingga alternatif yang paling mudah dilakukan adalah melalui rekayasa genetika. Melalui teknologi rekayasa genetika, transfer gen antar spesies yang tidak berkerabat memungkinkan untuk dilakukan. Prinsip dari teknologi ini adalah memindahkan satu atau beberapa gen yaitu potongan DNA yang m enyandikan sifat tertentu, dari satu makhluk hidup ke makhluk hidup lainnya (Slamet-Loedin 2000).
Telah diketahui bahwa gen cry dari
Bacillus thuringiensis (Bt) menghasilkan protein yang toksik terhadap Lepidoptera namun aman bagi manusia (Breitler et al.
2000). Gen ini telah terbukti efektif dalam menekan serangan penggerek batang terhadap tanaman padi. Bt adalah bakteri gram positif yang menghasilkan kristal protein yang
bersifat seperti insektisida, biodegradable, aman bagi manusia serta tidak berdampak negatif bagi serangga yang menguntungkan (ISB 2000; Schnepf et al. 1998; dalam SOA
LIPI 2005). Jika gen penyandi toksin bt ini di introduksi ke dalam genom tanaman padi dan diekspresikan dalam jaringan tanaman maka hal tersebut terbukti lebih efektif daripada penggunaan pestisida.
Keberhasilan dalam suatu tanaman trans genik adalah dengan diperolehnya ekspresi gen introduksi terseb ut dan munculnya fenotipe baru yang diinginkan (Koziel et al. 1996 dalam Dewi 2003). Konfirmasi keberadaan gen yang dintroduksi dalam genom tanaman, dapat dilakukan dengan menggunakan analisis PCR. Sementara uji ekspresi dilakukan dengan cara bioasai tanam an terhadap penggerek batang tersebut. Bioasai perlu dilakukan karena keberadaan gen introduksi dalam genom tanaman tidak menjamin gen tersebut dapat diekspresikan.
Penelitian ini bertujuan untuk mendapatkan galur padi transgenik homozigot yang mengandung gen ketahanan terhadap hama penggerek batang kuning (cry) berdasarkan analisis PCR dan uji ekspresi gen dengan cara bioasai pada skala rumah kaca.
Hasil penelitian ini diharapkan dapat bermanfaat untuk menekan serangan hama penggerek batang kuning pada pertanaman padi. Hipotesis penelitian yang diharapkan yaitu galur padi transgenik homozigot untuk gen cry pada generasi ke empat (T3) berdasarkan
analisis PCR yang terbukti efektif terhadap serangan hama penggerek batang kuning.
TINJAUAN PUSTAKA
Oryza sativa L
Padi merupakan tanaman pokok yang makanan pokok yang digunakan lebih dari setengah populasi penduduk di dunia pada total 100 juta hektar lahan, dari 90 persen berada di Asia bagian timur dan selatan (Purseglove 1972). Klasifikasi botani tanaman padi termasuk pada:
Divisi : Spermatophyta Sub-Divisi : Angiospermae
Familia : Gramineae (Poaceae) Genus : Oryzae,
Spesies : Oryza spp.
Akan tetapi berdasarkan klasifikasi baru Gould mengelompokkan padi kedalam subfamili Oryzoideae, suku (tribe) Oryzeae.
Sampai saat ini di dunia tersebar kurang lebih 20 spesies Oryza. Spesies yang dibudidayakan di Asia adalah Oryza sativa
(L) sedangkan dari 20 spesies lainnya yang termasuk ke dalam genus Oryzae Oryza glaberrima (Steund) merupakan salah satu jenis yang dibudidayakan di Afrika. Lu dan Chang (1986) menyimpulkan bahwa Oryza sativa dan Oryza glaberrima berasal dari leluhur yang sama, yaitu Oryza perenis
Moench, dengan Gondwanaland sebagai habitat asalnya (Katayama 1993). Berdasarkan proses evolusi (Gambar 1) dari spesies Oryza sativa, terdapat 3 sub spesies ekogeografik (Lampiran 7 dan 8), yaitu Indica, Japonica, dan Javanica (Katayama 1993).
Pada penelitian ini digunakan padi varietas rojolele. Rojolele merupakan varietas lokal yang dikembangkan dari subspesies
Javanica. Padi rojolele merupakan varietas unggul padi sawah aromatik, yang memiliki umur tanaman 115 hari, serta peka terhadap wereng coklat (IRRI 2004).
Gambar 1 Proses evolusi dua spesies padi O.
sativa dan O. Glaberrima
(Watanabe 1993)
Pemuliaan Tanaman
Proses pemuliaan tanaman dengan tujuan memperbaiki sifat tanaman dapat dilakukan dengan menggunakan metode konvensional maupun teknologi rekayasa genetika. Pemulian secara konvensional dapat terjadi melalui proses alami seperti perantaraan angin, serangga penyerbuk atau atas bantuan manusia dengan membantu memindahkan serbuk sari tanaman ke kepala
putik tanaman lain. Pemuliaan konvensional memiliki keterbatasan yang cukup menjadi kendala bagi pemulia antara lain karena proses ini akan sangat bergantung pada kedekatan kekerabatan individu yang akan disilangkan (Adiwilaga 2000).
Rekayasa genetika dapat dilakukan dengan tujuan menanggulangi kendala tersebut. Prinsip teknologi ini adalah memindahkan satu atau beberapa gen, yaitu potongan DNA yang menyandikan sifat khusus yang menguntungkan, dari makhluk hidup satu ke makhluk hidup lain baik yang memiliki kekerabatan yang sama ataupun tidak (Slamet -Loedin 2000). Dengan teknologi ini akan sangat banyak kemungkinan perbaikan sifat tanaman terutama dalam peningkatan sifat ketahanan terhadap cekaman biotik dan abiotik serta peningkatan kualitas gizi dan nutrisi yang dikandung tanaman. Salah satu contoh peningkatan sifat tahan terhadap cekaman biotik adalah pemindahan gen yang mengendalikan sifat tahan terhadap hama penggerek dari bakteri Bacillus thuringiensis
ke dalam genom tanaman yang rentan terhadap serangan (Adiwilaga 2000).
Rekayasa genetika telah dilakukan terhadap padi kultivar Rojolele (Slamet-Loedin et al. 1998 dalam Satoto 2003) dengan mempertimbangkan keunggulan dalam hal daya regenerasi sel yang baik, aromatik dan memiliki nilai ekonomi yang cukup tinggi akan tetapi rentan terhadap hama penggerek batang kuning.
Keta hanan Tanaman
Ketahan tanaman adalah sifat tanaman yang dapat diwariskan yang mempengaruhi tingkat kerusakan tanaman oleh serangga (Panda & Khush 1995). Berdasarkan mekanismenya, ketahanan tanaman dikelompokan menjadi 3 yaitu: 1. Non- preferensi, tanaman yang memiliki sifat sifat yang tidak disukai oleh serangga sehingga tanaman tidak dpilih sebagai tempat bertelur, tempat makan atau habitatnya, 2. Antibiosis, tanaman dipilih serangga sebagai tempat bertelur, dan hidup tetapi tanaman memiliki pengaruh negatif terhadap pertumbuhan dan kelangsungan hidupnya, 3. Toleran, tanaman dipilih sebagai tempat hidup serangga dapat menyokong kehidupan serangga tetapi kerusakan yang diakibatkan oleh serangga tidak mengurangi hasil tanaman (Panda & Khush 1995). O. sativa Japonica Javanica Indica Afrika Asia Selatan dan
Tenggara
Oryza perenis
Moench O. glaberrima
Ketahanan tanaman juga dapat didefinisikan berdasarkan aspek interaksi serangga-tanaman yaitu sebagai sifat tanaman yang dapat mengurangi keberhasilan serangga untuk menggunakan atau memanfaatkan tanaman tersebut. Pada tanaman yang tahan, serangga tidak dapat tum buh dan berkembang dengan baik, sehingga kerusakan yang ditimbulkan tidak parah dan hasil tanaman masih dapat dipanen (Satoto 2003). Jadi pada tanaman resisten, jumlah telur yang diletakkan serangga akan sedikit, pertumbuhan dan perkembangan serangga buruk serta kerusakan tanaman rendah.
Bacillus thuringiensis
Bacillus thuringiensis (Bt) adalah jenis bakteri tanah gram positif berbentuk batang. Bakteri ini merupakan famili bakteri yang memproduksi kristal protein pada saat bersporulasi (Gambar 2) (Bahagiawati 2002; Gatehouse & Gatehouse 2001). Bt hidup pada fase vegetatif jika lingkungannya kaya akan nutrient. Namun bila suplai makanannya menurun maka Bt akan membentuk spora dorman yang memiliki beberapa jenis kandungan kristal yang memiliki efek insekt isidal dan dikenal sebagai toksin Bt
(Bahagiawati 2002). Kristal tersebut mengandung protein dengan ukuran sekitar 130-140 kDa yang masih berupa protoksin (Deacon 2000).
Protoksin hanya akan bersifat larut dan aktif menjadi toksin pada kondisi pH tinggi (pH 9-10), dan bersifat sangat tidak larut dalam kondisi asam. Kondisi basa ini merupakan kondisi yang sama pada pencernaan yang dimiliki oleh serangga jenis Lepidoptera, Coleoptera,dan Diptera, ((Li et al. diacu dalam Deacon 2000; Gatehouse dan Gatehouse 2001). Sehingga toksin Bt akan bereaksi dengan selektif dan tidak berbahaya bagi mamalia. (Rajamohan dan Dean 1995).
Toksin aktif hasil hidrolisis enzimatik pada pencernaan usus dinamakan d-endotoksin~60kDa. Protoksin akan mengalami proteolisis oleh protease pada pencernaan serangga. Pemecahan protoksin akan membangkitkan aktivitas d-endotoksin (N-terminal dari protoksin). Kemudian terjadi kompleks ikatan antara domain II d-endotoksin dengan reseptor glikoprotein spesifik yang melekat pada permukaan membran epitel sel usus serangga. Domain I menciptakan kanal ionik di dalam sel membrannya sehingga memudahkan kompleks toksin untuk masuk ke dalam usus.
Terbebasnya ion-ion penting dari usus melalui lubang tersebut dapat menyebabkan lisis dan disfungsi usus serangga sehingga serangga akan mengalami kematian. (Choma et al.
1990 dalam Gatehouse & Gatehouse 2001). Secara komersial toksin bt sudah sangat dikenal sebagai bioinsektisida pada sebagian besar petani (Scimat.com 2001). Sekitar 90-95% bioinsektisida bt dari bioinsektisida yang dikomersialkan dimanfaatkan oleh petani di berbagai negara (Bahagiawat i 2002). Dengan kemajuan teknologi, Bt dapat diisolasi dan diklon sehingga membuka kemungkinan untuk diintroduksikan ke dalam tanaman. Kristal protein yang berperan sebagai protoksin telah diketahui disandikan oleh gen
cry (crystal)
Sampai saat ini telah diisolasi gen Bt
yang dimasukkan ke dalam 8 kelas cry
(Rajamohan & Dean 1995). Klasifikasi tersebut didasarkan pada tingkat spesifitas virulensinya. Toksin yang berbeda memiliki spesifitas yang berbeda untuk serangga yang berbeda (Lampiran 9), misalnya cr y1 spesifik untuk hama ordo Lepidoptera, cry2 untuk lepidoptera dan diptera cr y3 untuk Coloeoptera, cry 4 untuk Diptera, (Maqbool et al. 1998 dalam Satoto 2003).
Gambar 2. Bacillus thuringiensis (Scimat.com 2001) A. Visualisasi Bt melalui mikroskop fase kontras, sel vegetatif mengandung endospora (fase terang). B.Kristal Protein dan endospora mikroskop elektron. C.
Visualisasi dengan menggunakan mikroskop elektron
Gen Fusi (cry1B- cry1Aa)
Dalam pemuliaan suatu tanaman baik secara konvensional (persilangan) maupun secara rekayasa genetik, ketahanan suatu tanaman terhadap serangan hama dapat dipatahkan. Oleh karena itu, dalam upaya menghambat laju resistensi terhadap toksin bt
pada tanaman transgenik, kelompok penelitian padi Puslit Bioteknologi LIPI telah menggunakan beberapa pendekatan. Pendekatan yang dilakukan antara lain adalah transformasi dua gen cry (cry1B–cry1Aa)
B
yang berbeda binding site di dalam pencernaan larva serangga, serta transformasi gen cry1B di bawah kendali promoter terinduksi pelukaan yaitu promoter dari gen maize proteinase inhibitor (mpi) (SOA LIPI 2005).
Gen cry1B adalah gen ketahanan terhadap serangga penggerek batang kuning.. Sedangkan gen fusi (cry1B –cry1Aa) merupakan fusi 2 gen ketahanan cry1B dan gen cry1Aa yang memiliki ekspresi protein dengan binding site target yang berbeda pada pencernaan larva serangga. Gen ini memiliki promoter konstitutif ubiquitin yang akan terekspresi secara terus menerus. Akan tetapi dengan 2 binding site yang berbeda, frekuensi mutasi dari 2 gen yang berbeda secara bersamaan akan jarang terjadi. Berdasarkan hasil penelitian kelompok penelitian padi Puslit Bioteknologi pada tahun 2003–2004 telah diper oleh 6 galur padi transgenik kultivar Rojolele yang mengandung fusi dua gen cry potensial tahan hama penggerek batang kuning masing masing pada generasi keempat (SOA LIPI 2005).
Pada penelitian ini digunakan galur padi transgenik yang ditransformasi dari plasmid pCAMBIA 1303 dan pCAMBIA 1304 (Lampiran 10) yang telah disisipi gen sintetik fusi (cry1B–cry1Aa) dengan promoter gen ubiquitin.
Penggerek Kuning Batang Padi (Scirophaga interculas)
Penggerek batang kuning Scirophaga interculas (WLk) (Gambar 3) merupakan salah satu serangga penggerek selain serangga penggerek batang putih Scirpophaga innotata, penggerek batang bergaris Chilo suprealis dan penggerek batang merah jambu (Sesamia inferens) (Harahap & Tjahjono 1989).
Secara umum serangga penggerek batang kuning memiliki 4 stadia hidup, yaitu stadia telur, larva, pupa dan imago. Pada stadia telur penggerek batang kuning untuk setiap induk dapat menghasilkan sekitar 50 -250 butir/ kelompok, telur ditutupi rambut halus berwarna coklat kekuningan dan masa tetas sekitar 6-7 hari. Larva penggerek batang kuning (Gambar 3) memiliki panjang maksimum 25 mm, berwarna putih kekuningan memiliki masa stadium 28-35 hari (IRRI 2005).
Stadia pupa penggerek batang kuning, berupa selaput benang berwarna putih atau kekuning–kuningan, memiliki panjang 12–15
mm dan memiliki stadium 6-23 hari. Fase imago penggerek batang padi kuning memiliki ciri, ngengat jantan berbintik gelap pada bagian depan sayapnya dengan panjang 14 mm sedang betina berwarna kuning dengan bintik hitam dibagian tengah sayap dengan panjang tubuh 17 mm. Lama hidup ngengat 5–10 hari dengan siklus hidup 39-58 hari (IRRI 2005 ).
Penggerek batang padi kuning memiliki karakteristik gejala serangan (Gambar 4) berupa lubang–lubang kecil di daerah batang. Hal semacam ini terjadi ketika serangga berada pada stadia larva. Dampak serangan terhadap tanaman bergantung pada fase pertumbuhan tanaman padi. Fase pertumbuhan tanaman padi terdiri dari 3 fase yakni fase vegetatif (pembibitan sampai pembentukan malai atau panicle (tangkai pada batang tempat munculnya padi), fase reproduktif (generatif) dan fase pematangan. Gejala serangan yang terjadi pada fase vegetatif disebut sebagai sundep (deadheart). Ciri–cirinya daun termuda atau pucuk tanaman layu dan kuning karena larva memakan titik tumbuh. Sedangkan gejala serangan yang terjadi pada fase generatif disebut beluk (white, yaitu malai mengering, mudah dicabut dan bulir padi hampa. Hal ini disebabkan karena adanya penghambatan aliran nutrisi dari batang ke malai, sehingga pengisian malai terganggu. (IRRI 2005).
Gambar 3 Serangga penggerek batang kuning (IRRI 2003) A. Fase Ngengat . B Fase Larva
Gambar 4 Gejala serangan hama penggerek batang (IRRI 2003). A. Gejala sundep pada fase vegetatif; B.Gejala beluk pada fase generatif
B
A
Polymerase Chain Reaction (PCR) Teknik PCR merupakan salah satu teknik amplifikasi molekul DNA berupa reaksi in vitro dengan menggunakan sepasang oligonukleotida spesifik sebagai primer yang membatasi fragmen DNA tertentu melalui serangkaian tahap reaksi denaturasi, penempelan, dan pemanjangan yang akan menghasilkan peningkatan jumlah fragmen secara eksponensial yakni 2n dengan n adalah jumlah siklus (Sambrook & Russell 2001).
Secara prinsip PCR merupakan bentuk adaptasi sintetik terhadap proses replikasi DNA secara biologis. Pada replikasi DNA secara in vitro ini kinerja enzim DNA polimerase diganti oleh Taq polymerase yang stabil pada reaksi PCR yang memiliki pergantian suhu ekstrim pada tiap tahapnya.
Taq Polymerase dapat stabil pada suhu panas karena dihasilkan oleh bakteri thermofilik
Thermus aquaticus. Taq polymerase akan mensintesis DNA utas tunggal dari 5’ ke 3’ dengan sepasang primer oligonukleotida sintetik sebagai inisiator dan deoksinukleotida trifosfat atau dNT Ps (dATP, dGTP, dCTP, dTTP) sebagai substrat.
Teknik PCR memerlukan beberapa komponen yang esensial untuk dapat bekerja dan menghasilkan suatu produk PCR. Selain sepasang primer (primer forward dan
reverse), enzim Taq Polymerase dan dNTPs diperlukan juga bufer PCR, MgCl2, serta
DNA target (Sambrook & Russell 2001). Reaksi PCR dilakukan untuk seri denaturasi-penempelan primer-sintesis (n siklus) yang berlangsung secara otomatis. Tahap pertama DNA didenaturasi, umumnya pada suhu 95oC . Pada saat denaturasi, DNA yang semula utas ganda terurai menjadi utas tungga Tahap ke dua suhu diturunkan, sehingga primer menempel (annealing) pada DNA cetakan (target). Tahap terakhir suhu dinaikkan lagi sampai 72oC untuk mengaktifkan enzim Taq Polymerase dan mensintesis utas DNA (Muladno 2002).
Ketiga tahap ini akan terjadi secara berulang-ulang (20-40 siklus), karena setiap produk suatu siklus merupakan DNA cetakan bagi siklus selanjutnya, sehingga pada akhirnya akan diperoleh produk PCR berupa fragmen DNA spesifik dengan konsentrasi yang tinggi. Akan tetapi setiap aplikasi PCR umumnya memerlukan suatu optimasi sesuai dengan kondisi yang diselaraskan dengan keperluan (Innis & Gelfand 1990).
Informasi kestabilan sifat suatu gen ketahanan yang terintegrasi pada tanaman transgenik dari satu generasi ke generasi selanjutnya dapat diketahui dari pola pewarisan dan segregasi gen yang dapat diperkirakan dengan menggunakan hasil analisis PCR (Satoto 2003). Reaksi polimerasi berantai secara in vitro pada PCR memungkinkan analisis sampel dalam jumlah banyak dan waktu yang singkat untuk mengetahui keberadaan gen yang diintroduksi tetapi tidak dapat membedakan integrasi ekstra-kromosomal dan kromosomal serta juga tidak dapat digunakan untuk mendeteksi kejadian transformasi yang berbeda (Casas et al. 1995). Analisis PCR pada penelitian ini menggunakan primer gen target fusi 2 gen cry
dengan kondisi yang sudah dioptimasi pada penelitian sebelumnya.
Bioasai Tanaman Padi
Casas (1995) menyebutkan bahwa pewarisan gen terhadap turunannya merupakan bukti stabilitas transformasi, dan pewarisan tersebut dibawa melalui gamet jantan dan betina. Rasio positif dan negatif dari gen yang diwariskan berdasarkan PCR dapat digunakan untuk menduga lokus gen yang terintegrasi pada genom transgenik. Kesesuaian ratio tersebut dengan model genetik Mendel dihitung dengan uji Khi-Kuadrat. Sedangkan evaluasi keefektifan ekspresi gen tersebut dapat diketahui melalui bioasai terhadap tanaman transgenik yang utuh (Dewi et al 2002; Satoto 2003).
Ekspresi gen yang disisipkan pada tanaman transgenik dapat duji secara langsung melalui bioasai. Bioasai adalah cara tepat dalam melihat fenotipe yang muncul pada tanaman transgenik (Dewi et al. 200 3). Berbagai teknik bioasai dilakukan untuk melihat ketahanan tanaman terhadap serangga dengan berbagai skala pengujian. Skala pengujian rumah kaca, laboratorium, maupun skala lapangan (Satoto 2003).
BAHAN DAN METODE
Bahan dan Alat Bahan Analisis PCR
Bahan yang digunakan untuk isolasi DNA genomik tanaman padi adalah daun tanaman padi kultivar Rojolele transgenik generasi ke- 4 (T3), nitrogen cair, bufer
isolasi, DNA genomik tanaman ((Cetyltrymethylammonium bromide (CTAB), Sarkosil, Sorbitol , EDTA, NaCl, Tris-H Cl pH 7.5 ) Kloroform, dH2O steril, etanol 70 %,
Tris-EDTA (TE). Kloroform : Isoamilalkohol 24:1, Isopropanol.
Bahan yang digunakan dalam teknik PCR meliputi DNA genomik padi transgenik kultivar Rojolele, oligonukleotida primer (Tabel 1) untuk gen internal gos-5 dan primer spesifik fusi gen(cry1B-cry1A a), enzim taq polymerase, dNTPs, DNA target, bufer PCR 10x (Lampiran 6), gel agarosa 1 %, bufer Tris Bor ic Acid EDTA (TBE) 0.5 %.
Tabel 1. Primer oligonukleotida yang digunakan dalam analisis PCR Primer Urutan Basa
gos-5 reverse : 5`-GCC GAG CAG CAG
GAA CTT GAG CAG G-3`
forward 5`-CGA CCT CGA GGA CAT CGG CAA CAC -3`
fusi cry 1B-cry1Aa
reverse : 5`-CGA TGT CGA GAA CTG TGA GG-3`
forward : 5` -GCC CAA GAA GCT AAG GC-3`
Alat Analisis PCR
Alat yang digunakan antara lain, perangkat elektroforesis, tabung sentrifuse mikro (1500µl) dan tabung PCR (200µl), mikropipet Eppendorf, mikrosentrifus Sorval, penggerus plastik, inkubator 65oC, freezer -40
oC, -20oC, 4oC, penangas kering, vortex,
rotator, seperangkat alat foto gel (Gel Doc UV) alat PCR Biometra, m icrowave, autoklaf serta alat – alat gelas.
Fasilitas dan Bahan Bioasai
Bioasai tanaman dilakukan di rumah kaca transgenik (Biosafety Containment) di Puslit Bioteknologi LIPI . Bahan bioasai antara lain benih 5 galur tanaman padi transgenik kultivar Rojolele generasi keempat (T3).
Kontrol menggunakan galur isogenik Rojolele non-transgenik, galur peka TN1 serta galur tahan Rathu Heenati. Bahan hama serangga penggerek batang kuning Sciporphaga interculas , fase telur yang dikoleksi dari
lapangan 2-5 hari sebelum infestasi.. Telur hama dipelihara dirumah kaca sampai menghasilkan larva instar 1
Metode
Seleksi Homozigot dan Analisis Segregasi dengan Analisis PCR (Sedcole 1977)
Galur padi transgenik generasi T3 yang
dipilih dari tetua positif T2 mengandung gen
fusi gen cry (cry1B-cry1A a). Benih padi transgenik generasi keempat (T3) yang
digunakan dipilih secara acak dari 5 galur padi Rojolele transgenik. Setiap galur ditanam ± 30 benih pada wadah penyemaian, ditumbuhkan ± 3 minggu .
Seleksi galur padi homozigot didasarkan pada keberadaan gen yang diidentifikasi dari hasil uji PCR terhadap 11 individu tanaman T3 zuriat T2 yang positif fusi
cry1B-cry1Aa. Berdasarkan Sedcole (1977) jumlah tanaman yang harus diambil untuk mendapatkan satu tanaman pembawa resesif (peluang ¼) adalah sebelas, dengan selang kepercayaan 95%.
Analisis segregasi terhadap hasil PCR menggunakan model genetik mendel dengan uji statistik Khi-kuadrat sebagai berikut :
x2 : S (O-E)2 / E O : data yang diamati E : data yang diharapkan
Tanaman positif uji PCR dipindahkan ke pot besar dan ditumbuhkan serta dilanjutkan dengan bioasai.
Isolasi DNA untuk PCR (Van Heusden et al. 2000)
Isolasi DNA genom dilakukan dengan metode Van Heusden et al. (2000) dengan modifikasi yang memiliki tahapan reaksi lebih mudah dan sederhana tetapi memiliki hasil kemurnian yang cukup untuk analisis PCR. Isolasi DNA genomik tanaman padi diawali dengan pengambilan daun tanaman sebanyak 10 cm per tanaman. Daun segar digunting. Kemudian daun hasil potong dimasukkan ke dalam tabung sentrifus (1,5 ml). Ke dalam sentrifus dituang N2 cair dan digerus dengan
Setelah diinkubasi, campuran daun dan bufer ditambahkan dengan larutan kloroform : isoamil alkohol (24:1), di bolak -balik secara perlahan sampai terbentuk emulsi. Kemudian tabung berisi emulsi di sentrifus pada 12000 rpm selama 5 menit sampai terbentuk 2 lapisan cairan. Lapisan atas (supernatan) diambil dan dipindahkan ke tabung sentrifus baru, selanjutnya ditambah isopropanol dingin sebanyak 400 µl, dibolak-balik secara perlahan, kemudian disentrifus pada 12000 rpm selama 6 menit. Supernatan dibuang dan pelet yang dihasilkan dibilas dengan etanol 70% dan disentrifus kembali pada 12000 rpm selama 3 menit. Buang etanol dan dikeringkan dengan membiarkan tabung sentrifus terbuka pada suhu ruangan. Setelah kering ke dalam tabung sentrifus ditambahkan TE sebanyak 50µl kemudian disimpan dalam freezer -20oC.
Polimerase Chain Reaction (Roche 1999) Larutan PCR yang terdiri dari bufer PCR 10x; MgCl2 2,5 mM; primer-primer gen
spesifik dan gos-5 masing-masing 2,5 ng/µl; enzim taq polimerase 0,05 Unit/µl; dNTPs 0,05 mM; dan DNA target 0,1 µl dimasukan ke tabung PCR, kemudian ditambah aquades sampai volume reaksi sebanyak 25 µl. Seluruh reaksi dalam tube PCR dihomogenkan kemudian dimasukkan ke dalam mesin PCR (BIOMETRA) dengan kondisi PCR (Lampiran 6) suhu 95oC (selama 5 menit untuk gen cry
IB sedangkan fusi 2 gen selama 3 menit), dan suhu ekstensi 72oC selama 1 menit sementara suhu annealing sesuai dengan gen yang diamplifikasi sebanyak 40 siklus ( untuk gen
cry IB suhu pada 62oC selama 1 menit sedangkan untuk fusi gen (cry1B–cry1Aa) pada suhu 60oC selama 1 menit). Hasil amplifikasi kemudian dipisahkan pada gel agarose 1 %, menggunakan bufer TBE 0.5 x. dengan kondisi 100 volt, 150 mA selama 45 menit. Selanjutnya keberadaan DNA diamati dibawah Gel Doc UV (Roche 1999 dengan modifikasi).
Bioasai serangga pada tanaman hidup Metode bioasai mengikuti metode Heinrich et.al (1985) yang dimodifikasi. Bibit padi berumur 21 hari ditanam di dalam pot sebanyak 1 bibit per pot. Masing–masing 10 ulangan untuk setiap galur transgenik dan varietas Rojolele non transgenik sebagai varietas isogenik. Rancangan untuk penempatan pot mengikuti pola rancangan acak kelompok.
Bioasai fase vegetatif dilakukan dengan cara menginfestasikan larva penggerek batang berumur 1 hari pada tanaman berumur 45 hari setelah tanam. Masing–masing tanaman diinfestasikan 2 larva. Selanjutnya masing– masing tanaman dikurung dengan menggunakan plastik milar untuk menghindari perpindahan larva antarpot.
Pengamatan dilakukan dengan mengamati pertumbuhan batang padi dan gejala sundep . Selanjutnya dilakukan skoring ketahanan terhadap hama dihitung berdasarkan persentase intensitas serangan. Intensitas serangan hama diamati pada saat 14 dan 28 HSI (Hari Setelah Infestasi) untuk melihat gejala sundep pada setiap tanaman transgenik dan kontrol.
Skoring ketahanan terhadap hama dihitung berdasarkan persentase intensitas serangan. Intensitas serangan sundep menurut Satoto (2003) diamati dengan menggunakan rumus sebagai berikut :
S sundep pada galur yang diamati x 100 % S anakan dari galur yang sama
Persentase serangan sundep dikonversi ke dalam nilai D (kerentanan). D diperoleh dengan perhitungan sebagai berikut
D = % sundep dari galur yang diuji x 100% % sundep dari varietas pembanding rentan
Nilai D ditransformasikan ke dalam skala 0-9 ( 0 = 0%, 1 = 1-20%, 3 = 21-40%, 5 = 41-60%, 7 = 61-80%, 9 = 81-100%). Tanaman tahan terhadap hama penggerek dikategorikan sebagai nilai D apabila berada pada sk ala 0,1,3 dan 5. Kat egori rentan pada skala 7 dan 9, kategori skala kerentanan yaitu: Sangat tahan : nilai D = 0
HASIL DAN PEMBAHASAN
Analisis PCR
Pada penelitian berikut bahan tanaman yang digunakan adalah galur padi transgenik hasil rekayasa genetika pada tanaman padi varietas Rojolele. Tanaman transgenik kultivar Rojolele generasi ke-3 (T2)
diketahui mengandung gen ketahanan terhadap hama penggerek kuning batang padi
Sciporphaga interculas (Slamet-Loedin et al.
2003). Seleksi homozigot, pola pewarisan dan segregasi generasi ke-4 (T3) dikonfirmasi
melalui analisis PCR. Kemudian dilanjutkan bioasai pada tanaman hidup untuk evaluasi ekspresi tanaman.
Konfirmasi keberadaan fusi (cry1B -cry1Aa) pada individu padi transgenik cv. Rojolele dianalisis dengan amplifikasi PCR oleh primer spesifiknya . Pada penelitian ini amplifikasi gen ketahanan dilakukan terhadap 5 galur padi Rojolele transgenik generasi ke-4 (T3) yang diduga mengandung gen fusi
(cry1B-cry1Aa) masing–masing galur ditanam
± 30 individu sehingga mencapai total tanaman ± 150 individu (Lampiran 10). Amplifikasi gen dilakukan dengan kondisi PCR 95oC (3’), 60oC (1’), 72oC (5’). Hasil amplifikasi fusi gen (cry1B-cry1Aa) kemudian sampel dielektroforesis pada gel agarosa 1% dan dilihat melalui alat GEL DOC menghasilkan pita dengan jumlah pasang basa 785 bp.
Sebagai marka digunakan marker ? yang dipotong dengan H ind III. Kontrol positif berupa plasmid yang mengandung gen spesifik dan tanaman positif transgenik yang telah dianalisis sebelumnya sedangkan kontrol negatif berupa tanaman negatif transgenik dan
aquades sebagai pengganti DNA. Selain itu juga digunakan kontrol internal untuk mengetahui keberhasilan PCR dengan menggunakan primer gen gos-5 yang berukuran 231 bp yang merupakan gen internal pada padi (Mayer et al. 1992).
Hasil analisis PCR terhadap beberapa galur tanaman transgenik yang mengandung gen spesifik fusi 2 gen cry (cry1B-cry1Aa) (Gambar 5) menunjukkan bahwa PCR terhadap tanaman yang memiliki fusi 2 gen
cry akan mengamplifikasi gen target sebesar 785 bp. Selain dilihat dari kontrol positif dan negatifnya. Kontrol gen gos-5 231 bp yang ada pada setiap tanaman padi membuktikan adanya DNA genom pada PCR sehingga keberhasilan PCR dapat terdeteksi.
T anaman yang terbukti positif memiliki gen fusi (cry1B-cry1Aa) yaitu sampel nomor 1-7, 9-10 hal ini berdasarkan penampakan pita DNA pada kisaran 785 bp. Pada sampel no. 8 hasilnya negatif (tidak terlihat pita sebesar 785 bp). Pita gen gos-5
281 bp menunjukkan adanya DNA genom sehingga hasil negatif tersebut bukan imbas dari kesalahan isolasi dan PCR, tetapi karena tidak adanya gen fusi (cry1B-cry1Aa) dalam genomnya.
Gambar 5. Salah satu hasil PCR gen fusi (cry1B-cryIAa) pada padi transgenik kultivar Rojolele. Keterangan : M : Marka ? HindIII, P : fragmen gen fusi (cry1B-cry1Aa) pada plasmid 1303, (+) : tanaman positif transgenik, (-) : tanaman negatif transgenik., 1-7 : Sampel tanaman transgenik kultivar Rojolele.
Seleksi Galur Homozigot
Seleksi homozigot dilakukan terhadap 11 tanaman yang dianalisis bertahap. Pada tahap awal digunakan 5 tanaman, apabila ke-lima tanaman tersebut menunjukkan positif
cry, maka pengujian dilanjutkan untuk 6 tanaman berikutnya. A pabila dari enam tanaman yang dicoba semuanya menunjukkan positif cry, maka dapat disimpulkan bahwa tetua dari tanaman tersebut adalah homozigot untuk gen target. Sementara itu, apabila 5 tanaman sampel pada tahap awal, salah satunya menunjukkan negatif cry maka dapat disimpulkan bahwa tetua dari tetua dari tanaman tersebut adalah heterozigot untuk gen target. Sehingga analisis PCR tidak perlu dilakukan untuk tanaman lainnya. Sebelas individu tanaman tersebut dipilih untuk memenuhi jumlah minimal tanaman yang harus diuji agar paling sedikit satu fenotipe padi yang tidak dikehendaki muncul dengan peluang 95% untuk karakter yang dikendalikan oleh 1 alel resesif (Sedcole 1977, Hartana 1992 ).
Pada galur heterozigot, untuk mengetahui galur tersebut bersegregasi mengikuti ratio mendel 3:1, maka pengujian
M P (+) (-) A 1 2 3 4 5 6 7 8 9 10
gos-5 231 bp Fusi (cryIB- IAa)
dilanjutkan pada 19 tanaman lainnya, sehingga total tanaman yang diuji PCR per galur adalah 30 tanaman. Hasil seleksi galur homozigot didapatkan 1 galur transgenik homozigot (RFz 4.2.3 No.28-15) dan 4 galur lainnya (galur RFz 3.3.2 1-6; RFz 4.2.2 1-27; RFz 3.3.2.A 11-25; Rjl 04 2.2.4 25-22) masih dalam kondisi heterozigot.
Analisis Segregasi Galur Heterozigot Analisis segragasi dilakukan terhadap galur yang dinyatakan heterozigot . Dari setiap galur, benih yang ditanam masing-masing galur berjumlah 30 individu akan tetapi pada proses pertumbuhannya tanaman masih berhasil hidup adalah rata rata 27 -28 tanaman per galur (Lampiran 11). Hal demikian terjadi akibat terjadi keterlambatan pemindahan benih beberapa galur ke dalam pot besar sehingga diduga terjadi kompetisi pemakaian unsur hara pada bak pembenihan.
Berdasarkan konfirmasi melalui hasil PCR yang dilakukan terhadap generasi ke-4 terlihat (lampiran 14) bahwa terdapat pewarisan gen ketahanan dari generasi T2 ke generasi T3.
Ratio antara hasil positif dengan hasil negatif PCR dari gen yang diwariskan dapat menduga jumlah lokus gen yang terintegrasi pada genom tanaman transgenik. Kesesuaian tanaman ratio dengan model genetik Mendel diuji dengan uji statistik Khi-kuadrat. Hasil analisis uji khi-kuadrat pada 4 galur tanaman transgenik mengandung gen fusi (cry1B
-cry1Aa) terlihat pada Tabel 2.
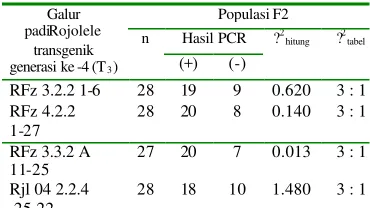
Hasil uji khi kuadrat terhadap beberapa galur transgenik menunjukkan nilai ?2
hitung
pada4 galur transgenik (galur RFz 3.3.2 1-6; RFz 4.2.2 1-27; RFz 3.3.2.A 11 -25; Rjl 04 2.2.4 25-22) lebih kecil dari nilai ?2 tabel
sehingga disimpulkan galur-galur tersebut masih bersegregasi 3:1.
Tabel 2. Hasil uji Khi-kuadrat pada analisis segregasi monohibrida padi Rojolele transgenik.
Keterangan :
Ho = data yang diamati sesuai dengan nisbah 3 : 1
H1 = data yang diamati tidak sesuai dengan nisbah
3 : 1.Jika nilai ?2 hitung < ?2 tabel ( db = 1; a =
0.05; ?2= 3.84)
Ekspresi Ketahanana n Galur Padi Transgenik terhadap Penggerek Batang Padi Kuning.
Uji ekspresi ketahanan galur padi tranagenik hanya dilakukan terhadap tanaman yang memiliki hasil positif cry. Hal demikian dilakukan agar dapat terlihat galur -galur yang memiliki potensi mengekspresikan gen cry
secara nyata. Jika terdapat korelasi positif antara hasil uji PCR dengan bioassai maka galur tersebut memiliki gen ketahanan serta gennya dapat terekspresi secara normal.
Pada uji ketahanan ini digunakan sebanyak 5 galur tanaman padi transgenik. Galur heterozigot diikutkan pada uji ketahanan dengan pertimbangan bahwa pada kondisi heterozigot sifat tahan akan terekspresi jika sifat tersebut dikendalikan oleh gen dengan alel dominan (Satoto 2003). Bioasai tanaman transgenik kultivar Rojolele ini dilakukan dirumah kaca transgenik (Biosafety Containment)
Sebagai varietas pembanding, digunakan 3 pembanding, satu galur tanaman padi Rojolele non transgenik sebagai kontrol isogenik, satu galur padi TN1 sebagai pembanding rentan (peka) dan satu galur Rathu Heenati sebagai pembanding tahan (Heinrich et al. 1985) (Lampiran 13). Dari masing–masing tanaman baik galur transgenik dan kontrol ditanam 5 tanaman dalam hal ini 1 tanaman dianggap sebagai 1 ulangan.
Sundep (deadheart) (G ambar 6) adalah salah satu gejala utama pada serangan penggerek batang padi. Serangan pada fase vegetatif merusak pertumbuhan anakan padi. Larva akan menyerang dan menggerek batang yang dicirikan dengan bagian pucuk paling muda akan tampak layu kekuningan dan mudah dicabut. Pada penelitian ini tanaman padi transgenik diinfestasi dengan larva berumur 1-2 hari. Masing–masing tanaman diinfestasi pada bagian pucuk termuda dengan masing-masing anakan 6 ekor larva.
Galur padiRojolele
transgenik generasi ke -4 (T3)
Populasi F2 n Hasil PCR ?2
hitung ?2tabel (+) (-)
RFz 3.2.2 1-6 28 19 9 0.620 3 : 1 RFz 4.2.2
1-27
28 20 8 0.140 3 : 1
RFz 3.3.2 A 11-25
27 20 7 0.013 3 : 1
Rjl 04 2.2.4 25-22
Gambar 6 Hasil Pengamatan Gejala Sundep A. Perbandingan galur kontrol yang terserang dengan galur transgenik. B. Gejala sundep pada tanaman kontrol.
Pengamatan terhadap gejala sundep (fase vegetatif) dilakukan pada 14 dan 28 HSI (hari setelah infestasi) (Lampiran 13). Pengamatan 14 HSI pada semua Rojolele transgenik menunjukkan adanya bekas gigitan pada setiap batang yang diinfeksikan, akan tetapi gejala sundep pada Rojolele transgenik adalah 0 % untuk setiap galur. Sedangkan varietas pembanding isogenik, rentan dan tahan menunjukkan gejala sundep masing–masing bernilai 20 %, 41,66 % dan 6.6 % (Tabel 3). Pada hari pengamatan ke-28 setelah infestasi, semua sampel tanaman transgenik yang diuji menunjukkan 0 % gejala sundep, 20 % gejala pada Isogenik, dan 44 % gejala varietas rentan dan 2.858 % persentase sundep varietas tahan (Tabel 3).
Tabel 3. Konversi nilai % gejala sundep ke dalam nilai D dan skala kerentanan 0-9
Galur
Variabel
% sundep Nilai D 0-9
I II I II I II
RFz 4.2.3
28-15 0 0 0 0 0 0
RFz 3.2.2
1-6 0 0 0 0 0 0
RFz 4.2.2
1-27 0 0 0 0 0 0
RFz 3.3.2
A 11-25 0 0 0 0 0 0
Rjl 04
2.2.4 25-22 0 0 0 0 0 0
Isogenik 20.00 20.00 48.00 45.50 5 5
Peka 41.66 44.00 - - - -
Tahan 6.66 2.86 15.99 0.07 1 0
Keterangan :
I : 14 HSI, II : 28 HSI, 0-9 : skala kerentanan 0-9
Secara umum penentuan galur padi tahan penggerek batang padi berdasarkan nilai rata-rata bukan cara yang baik (Heindrich et al. 1995) dengan demikian Satoto (2002) mengkonversikan persentase sundep ke dalam
nilai D yang kemudian dimasukkan ke dalam skala 0-9 (Tabel 3).
Konversi persentase sundep ke skala kerentanan (0-9) berdasarkan tabel 2 dapat dilihat 5 galur transgenik memiliki nilai skala kerentanan 0 (sangat tahan) pada 14 dan 28 HSI. Persentase kontrol pada isogenik dihasilkan skala 5 (rentan) sedangkan pada kontrol tahan menunjukkan kisaran skala 0 dan 1 (sangat tahan dan tahan).
Kontrol isogenik tidak berada pada nilai skala 7-9 (rentan -sangat rentan) karena diduga kondisi biologis larva ketika infestasi tidak dalam kondisi optimal. Namun dengan hasil demikian sudah dapat disimpulkan bahwa padi Rojolele transgenik telah memiliki ketahanan yang lebih baik dibandingkan dengan kontrol peka, kontrol tahan serta kontrol isogeniknya.
Berdasarkan hasil pengamatan uji ketahanan galur transgenik terhadap hama penggerek batang kun ing disimpulkan bahwa tanaman Rojolele transgenik memiliki ekspresi gen yang baik pada galur homozigot maupun heterozigot, terbukti dengan tidak adanya gejala sundep pada 14 dan 28 HSI pada setiap galurnya. Tidak adanya gejala pada tanaman transgenik menurut Satoto (2003) antara lain disebabkan oleh larva diinfeksikan ditemukan langsung mati setelah mengkonsumsi jaringan tanaman transgenik yang mengandung toksin fusi gen (cry
1B-cry1Aa) (Gambar 7).
Gambar 7 Hasil pengamatan terhadap serangga yang telah mengkonsumsi tanaman transgenik A. Larva mati dengan tubuh larva berwarna kehitaman; B. Larva yang mengkonsumsi tanaman kontrol dapat bertahan sampai akhir pengamatan sundep dilakukan.
A
B
Korelasi analisis PCR dan hasil bioasai Korelasi positif terjadi antara hasil PCR dengan hasil bioasai. Tanaman yang berdasarkan analisis PCR terbukti mengandung fusi gen (cry1B-cry1Aa) ternyata tahan terhadap serangan hama penggerek batang kuning, dengan skala kerentanan 0 (Lampiran 13).
Adanya ekspresi pada semua galur homozigot dan heterozigot juga menandakan bahwa gen yang mengatur sifat tahan ini di atur oleh gen dengan alel yang dominan
Ketidakstabilan ekspresi gen, yang biasa disebut sebagai pembungkaman gen (gene silencing), dapat terjadi pada tanaman -tanaman transgenik (Meyer 1995). Berdasarkan hasil pengamatan bioasai pada penelitian ini fenomena pembungkaman gen tidak terjadi karena semua tanaman mengekspresikan gen ketahanan yang ditandai dengan adanya sifat tahan terhadap hama
SIMPULAN DAN SARAN
Simpulan
Hasil analisis PCR terhadap 5 galur padi transgenik Rojolele generasi ke-4 mengandung fusi 2 gen cry (cry1B-cry1Aa) bersegregasi mengikuti ratio Mendel yaitu 1:1 (galur RFz 4.2.3 28-15) dan 3 : 1 (galur galur RFz 3.3.2 1-6; RFz 4.2.2 1-27; RFz 3.3.2.A 11-25; Rjl 04 2.2.4 25-22)
Terdapat korelasi positif terjadi antara hasil PCR dan Bioasai. Tanaman transgenik yang diuji tahan terhadap serangan hama penggerek batang kuning mengandung fusi 2 gen cry (cry1B-cry1Aa). Ekspresi gen cry dalam padi transgenik efektif mematikan larva serangga penggerek batang kuning.
Saran
Bioasai pada fase generatif perlu dilakukan untuk mengetahui serangan penggerek pada fase generatif (beluk). Fluktuasi serangan penggerek batang kuning di lapangan perlu dipelajari dalam melakukan bioasai, karena ketersediaan penggerek tergantung pada populasi telur di lapangan. Hal ini disebabkan oleh serangga penggerek batang kuning belum dapat diperbanyak di laboratorium.
DAFTAR PUSTAKA
Adiwilaga K. 2000. Isu keamanan pangan dan lingkungan tanaman hasil rekayasa genetika. Warta Biotek LIPI. 14 : 4 - 9
Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. 2002. Molecular Biology of the Cell, Ed ke-4. New York : Garland Publishing
Anonim. 2001. Bt toxin. http;//www.scimat.com//bacils [14 Agustus 2005]
Bahagiawati. 2002. Penggunaan Bacillus thuringiensis sebagai bioinsektisida.
Buletin Agrobio BALITBIO. 5(1):21-8
[BPS] Badan Pusat Statistik. 1996. Survey Pertanian : Luas dan Intensitas Serangan Organisme Pengganggu Tanaman dan Bencana Alam Padi, Palawija dan Sayuran. Jakarta : BPS
[BPS] Badan Pusat Statistik. 2001. Survey Pertanian : Luas dan Intensitas Serangan Organisme Pengganggu Tanaman dan Bencana Alam Padi, Palawija dan Sayuran. Jakarta : BPS
Breitler JC et al. 2000. Ekspression of a
Bacillus thuringiensis cry 1B synthetic gene protects mediterian rice againts the striped stem borer. Plant Cell Rep
19 : 1195-1202
Casas AM, Breesen RA, Hasegawa PM. 1995. Cereal transformation through particle bombardment. Di dalam: J J anick, editor. Plant Breeding Rev. Otawa: Joohn Willey and Sons
Dewi IS, Ida HS, Damayanti D, Apriana A, Santoso TJ. 2003. Bioasai lanjutan tanaman padi transgenik putatif
cryIA(b) generasi T1, T2, dan T3.
Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman.
23-24 Sept 2003 Bogor : Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian
University of Durham. UK [terhubung berkala]. http/silverserver.dur.ac.uk /Teaching/GM-Insect Resistant Plant [14 Agustus 2005]
Harahap IS, Tjahyono B. 1989. Pengendalian Hama Penyakit Padi. Jakarta : Penebar Swadaya
Harian Umum Pelita. 2005. Akibat Tekanan Lingk ungan, Hama dan Penyakit, Setiap Tahun, 200 Juta Ton Produksi Padi Hilang. http://www. Pelita. Com/archive. [14 Agustus 2005]
Hartana A. 1992. Genetika Tumbuhan. Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Tinggi. Pusat Antar Universitas Ilmu Hayat. Bogor : IPB Heinrich EA, Medrano FG, Papuas HR. 1985.
Genetic Evaluation for Insect Resistance in Rice. Los Banos: International. Rice Research Institute
Herman M 1 Maret 2000. Pandangan seorang peneliti terhadap tanaman hasil rekayasa genetika. Warta Biotek LIPI.
14 :10-17
Innis MA, Gelfand DH, Sninsky JJ, White TJ. 1990. PCR Protocols: A Guide to Methods and Applications. San Diego : Academic Press
[IRRI] International Rice Research Institute. 2003. Masalah lapang: hama, penyakit dan hara pada tanaman padi. http:\\www.knowledgebank.irri.org\reg ionalSites\indonesia\docs\bukletHama3 RIR.pdf [14 Agustus 2005]
[IRRI] International Rice Research Institute. 2004. Varietas unggul padi sawah yang dilepas sejak 1943 -2004. http:\\www.knowledgebank.irri.org\reg ionalSites\indonesia\docs\padisawah. pdf [18 Februari 2006]
[IRRI] International Rice Research Institute. 2005. Intregated Pest Management . http:\\www.knowledgebank.irri.org
\
IPM \stemborers\Stemborers.htm [25 Maret 2006]
Katayama TC. 1993. Morphological and taxonomical characters of cultivated rice (Oryza sativa L.) Di dalam; Y. Matsuo dan K. Hoshikawa (penyunting). Science of the rice plant Morphology. Vol. 1. Tokyo : Food and Agricultural Policy Research Center.
Li J, Carroll J, Ellar DJ. 1991. Nature 353, 815-821 Di dalam Deacon, 2002.
Bacillus thuringiensis . Edinburgh : Institute of Cell and Molecular Biology.
Mayer A, Zondag GB, Hensgens LAM. 1992 A simple screening method for transgenic rice tissue based on PCR.
Rice Genetic Newsl. 8: 161-165
Meyer P. 1995. Understanding and controlling transgene expression. TibTech. 13 : 332-337
Muladno.2002. Teknologi Rekayasa Genetika. Bogor : Pustaka Wira Usaha.
Nayak P et al. 1996. Transgenic elite indica rice plants expressing cry 1Ac d-endotoxin of Bacillus thuringiensis are resistant againts yellow stem borer (Scirpophaga interculas). Proc. Natl. Acad. Sci. Agricultural Sciences. USA. 94 : 2111-2116.
Panda, Khush GS. 1995. Host Plant Resistance to Insects. International Rice Research Institute–IRRI .Manila : IRRI.
Purseglove JW. 1972. Tropical Crops : Monocotyledons 1. London : Longman
[Puslit Bioteknologi LIPI] Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia. 2005. State of The Art LIPI: Aplikasi Teknologi DNA Untuk Ketahanan Terhadap Hama Penggerek Pada Padi. Bogor : LIPI
[Roche] Roche Molecular Biochemicals. 1999. PCR Aplications Manual
2nd
Edition. Mannheim, Germany : Roche Diagnostics gmbh.
Safari D. 2000. Analisis sekuens DNA gen apositokrom b untuk studi hubungan evolusi dari tiga subspesies Oryza sativa : Indica, Javanica, dan Japonica [Skripsi]. Bogor: FMIPA IPB.
Satoto 2003. Kestabilan, pola pewarisan, dan keefektifan gen gna dan cry IA terhadap wereng batang coklat dan penggerek batang kuning pada padi rojolele transgenik [Tesis]. Bogor: Program Pasca Sarjana IPB
Sambrook J, Fritsch, Maniatis T. 2001.
Molecular Cloning: A Laboratory Manual, Ed ke2. New York : Cold -Spring Harbor Laboratory Press.
Silviana A. 2005. Analisis molekuler tanaman padi transgenik mengandung gen cry
[Skripsi]. Depok : FMIPA UI.
Slamet-Loedin IH et al. 2003. Inheritance of
cryIA(b) and snowdrop lectin gna
genes in transgenic javanica rice progenies and bioasai for resistance to brown planthopper and yellow stemborer. Di dalam GS Khush, DS
Brar, B Hardy editor. Los Banos Philipines : IRRI
Slamet-Loedin IH. 2000. Tanaman pangan transgenik : persfektif dan tantangan di masa mendatang bagi Indonesia. Warta Biotek LIPI. 14 : 1 – 3
Sedcole JR. 1997. Number of plants necessary to recover to trait. Crop Sci. 17 : 667-668
Van Heusden AW et al. 2000. A genetic map of an interspesific cross in alium based on Amplified Fragment Length Polymorphism (AFLP TM) marker.
Theoritical and Applied Genetics .100 : 118 -126
Watanabe Y. 1993. Classification and morphological characters of plants in genus Oryza. Di dalam; Y. Matsuo dan K. Hoshikawa (penyunting). Science of the rice plant Morphology. Vol. 1. Tokyo : Food and Agricultural Policy Research Center.
Lampiran 1 Tahapan penelitian
Galur Roj olele t ransgenik T
3Anal i si s PCR
Sel eksi gal ur homozigot dan/ at au het er ozi got
Anal i si s Segr egasi (Khi Kuadrat ) rat io 3 : 1
Het erozigot
BIOASAI Masing – masing
galur dipilih 5 individu posit if
cr y berdasarkan
Lampiran 2 Analisis PCR (Van Heusdeun
et al
. 2000)
ISOLASI DNA
Amplifikasi DNA spesifik dengan PCR (fusi gen (cry1B- cry1A a))
Elektroforesis Gel Agarosa 1 %
Negatif gen spesifik (tidak ada pita DNA)
Lampiran 3 Seleksi homozigot dan analisis segregasi (Sedcole 1997)
UJI SEGREGASI :
Di hi t ung à x2 : S (O- E)2 / E O : dat a yang di amat i E : dat a yang diharapkan
X2hit ung < x2 t abel (db : 1 , a : 0. 05 , x2 : 3. 84 ) 30 Sampel t anaman
per galur t ransgenik
Isol asi DNA dan PCR
5 sampel awal 6 sampel
sel anj ut nya
11 posit if
Lampiran 4 Uji ketahanan (Bioasai) (Heindrich
et al.
1998)
5 individu per gal ur Tersel eksi Homozigot dan/ at au Het erozigot
Pembeni han 21 har i
Pem i ndahan ke Pot Besar masing – masing 1 t anaman / pot , Tanam +/ - 45 hari
Masa t anam +/ - 45 Hari diinf est asi Larva
Gej ala Sundep, pengamat an 14 Hari Set elah Inf est asi (HSI) dan 28 HSI
Lampiran 5 Alat dan reagen isolasi DNA (Sambrook 2001)
Alat
Keterangan :
1. Thermoflask
2. Tube 1.5 ml, Pipet mikro, tabung pencuci
3. MikroSentrifus
Sorval
Reagen
•
Sarkosil 5%
•
Bufer Lisis
Bahan [stok] [final] Tris HCl pH 7.5 1 M 0.2 M
EDTA pH 7.5 0.5 M 0.05 M
NaCl 5 M 2 M
CTAB 10 % 10 % 2 %
dH2O steril
•
Bufer Ekstraksi
Bahan [stok] [final]
Tris HCl pH 7.5 1 M 0.2 M
EDTA pH 7.5 0.5 M 0.05 M
Sorbitol 0.7 M 0.35 M
dH2O steril
Perbandingan komposisi reagen Bufer Ekstraksi : Bufer Lisis : Sarkosil = 1:2:1
3 2
Lampiran 6 Kondisi PCR (Roche 1999)
Alat
Keterangan :
1.
Seperangkat alat gel elektroforesis
2.
Seperangkat
Gel Doc
A. Monitor
B.
Panel
Gel Doc
3. Mesin
PCR Biometra
Reagen
Bahan [stok] [final] H2O
10 x reaksi bufer PCR 10 x 1x
dNTPs 20mM 0.05 mM
Primer forward gen c r y 1B 25 ng/ µl 25 ng/ µl Primer reverse gen cry 1B 25 ng/ µl 25 ng/ µl
Taq Polimerase 5 µ 0.05 U
DNA Target
Kondisi Amplifikasi
Ampl if ikasi dengan menggunakan primer spesif ik f usi 2 gen (cr y IB – cr y IAa)
95o C 95o C
3’ 1’ 72oC 72oC 62oC
1’ 5’ 1’
4oC 40 putaran ∞
Lampiran 7 Perbandingan morfologik dan fisiologik beberapa ras
O. Sativa
.
(Katayama 1993)
Komponen Indika Japonika Javanika Daun Lebar,berwarna hijau Sempit, warna hijau tua Lebar,kaku,hijau muda Gabah Panjang-pendek,agak pipih Pendek dan agak bulat Panjang-lebar Tebal Anakan Banyak Sedang Sedikit
Jaringan Lunak Keras Keras Batang Sedang-tinggi Sedang-pendek Tinggi Kerontokan Mudah rontok Sedikit rontok Sedikit rontok Amilosa 23-31% 10-24% 20-25%
Lampiran 8 Perbandingan karakter pertumbuhan padi subspesies indika, javanika,
japonika (Purseglove 1972)
Karakteristik Indika Japonika Javanika Iklim pertumbuhan Monsoon tropis Rata-rata Ekuatorial Periode vegetatif Panjang Pendek Sangat Panjang Respon pematangan Rendah Tinggi Rendah
Lampiran 9 Klasifikasi kristal protein (
cry
) berdasarkan virulensinya terhadap
serangga dan Nematoda (Rajamohan dan Dean 1995)
No Kelas cry Sub kelas Contoh Golongan serangga atau nematode 1.
2.
3.
4. 5.
6. 7. 8.
I
II
III
IV V
VI IX X
A - G
A B C A B C A - D
-
- - -
cry IAa, cry I Ab, cry IAc,
cry ICb
cry IIA
cry IIB
cry IIC
cry IIIA
cry IIIB
cry IIIC
cry IVB, cry IVC
cry V
cry VI
cry IX
cry X
Lepidoptera
Lepidoptera Lepidoptera Lepidoptera Coleoptera Coleoptera Coleoptera Diptera
Lepidoptera dan Coleoptera
Lampiran 10 Konstruksi Plasmid gen fusi
cry
1B-
cry
1Aa (Puslit Biotek LIPI)
Peta Retriksi gen
cry
1 B-
cry
1 Aa :
Multiple Cloning Site (mcs):
Keterangan : mcs disisipkan ke dalam plasmid pCAMBIA 1303 dan pCAMBIA 1304
Lampiran 11 Hasil uji PCR Padi Rojolele Transgenik Generasi Ke-4 (T
3)
pBKS ubicry
IB-cryI A a nos
5
’ubi
gen
cry
IB -
cry
IAa sintetik
3 ’nos
-Hin
dIII
Hin
dIII
2 Kb 3,9 Kb 0,3 Kb
pBKS ubicry
IB-cryI A a nos
5
’ubi
gen
cry
IB -
cry
IAa sintetik
3 ’nos
-Hin
dIII
Hin
dIII
2 Kb 3,9 Kb 0,3 Kb
ubi cry1B cry1Aa t-nos
RB GUS LB HPT
K
p
n
l B
am
H
l
Sp
H
1
H
in
d
II
I Wh
eI
S
p
H
1 NC
o
l
S
p
H
1
N
C
o
l
B
a
m
H
l
K
p
n
l
H
p
a
l
H
in
d
II
Galur RFz 4.2.3 28-15
Individu t anaman yang diuj i Isolasi DNA cr y Bioassai goss
1 v + v +
2 v + v +
3 v + v +
4 v + v +
5 v + v +
6 v + +
7 v + +
8 v + +
9 v + +
10 v + +
11 v + +
12 v + +
13 v + +
14 v + +
15 v + +
16 v + +
17 v + +
18 v + +
19 v + +
20 v + +
21 v + +
22 v + +
23 v - +
24 v + +
25 v + +
26 v + +
27 v + +
28 v + +
29 v + +
30 v + +
Galur RFz 3.2.2 1-6
Individu t anaman yang diuj i Isolasi DNA cr y Bioassai goss
1 v + v +
2 v + v +
3 v - +
4 v - +
5 v - +
6 v - +
7 v + v +
8 v - +
9 v + v +
10 v + v +
11 v + +
12 v + +
13 v + +
14 v + +
15 v + +
16 v + +
17 v + +
18 v + +
19 v + +
20 v + +
21 v - +
22 v + +
23 v + +
24 v - +
25 v - +
26 v - +
27 v + +
28 v + +
29 v
30 v
Galur RFz 4.2.2 1-27
Individu t anaman yang diuj i Isolasi DNA cr y Bioassai goss
1 v + v +
2 v + v +
3 v + v +
4 v - +
5 v - +
6 v + v +
7 v + v +
8 v + +
9 v - +
10 v + +
11 v + +
12 v + +
13 v + +
14 v + +
15 v + +
16 v + +
17 v + +
18 v + +
19 v + +
20 v + +
21 v - +
22 v + +
23 v + +
24 v + +
25 v - +
26 v - +
27 v - +
28 v - +
29 v
30 v
Galur Rjl 04 2.2.4 25-22
Individu t anaman yang diuj i Isolasi DNA cr y Bioassai goss
1 v + v +
2 v - +
3 v + v +
4 v - +
5 v + v +
6 v + v +
7 v + v +
8 v + +
9 v + +
10 v + +
11 v + +
12 v + +
13 v + +
14 v + +
15 v + +
16 v + +
17 v + +
18 v + +
19 v + +
20 v + +
21 v - +
22 v - +
23 v + +
24 v - +
25 v + +
26 v - +
27 v - +
28 v
29 v
30
Galur RFz 3.3.2A 11-25
Individu t anaman yang diuj i Isolasi DNA cr y Bioassai goss
1 v + v +
2 v + v +
3 v - +
4 v - +
5 v + v +
6 v - +
7 v + v +
8 v + v +
9 v - +
10 v - +
11 v + +
12 v + +
13 v + +
14 v + +
15 v + +
16 v + +
17 v + +
18 v + +
19 v + +
20 v + +
21 v + +
22 v - +
23 v - +
24 v - +
25 v + +
26 v - +
27 v - +
28 v + +
29 v
30 v
Individu yang dipilih :
T3 RFz 4. 2. 3 28- 15- 1 T3 RFz 3. 2. 2 1-6- 1 T3 RFz 3. 3. 2A 11- 25-1 T3 RFz 4. 2. 3 28- 15- 2 T3 RFz 3. 2. 2 1-6- 2 T3 RFz 3. 3. 2A 11- 25-2 T3 RFz 4. 2. 3 28- 15- 3 T3 RFz 3. 2. 2 1-6- 7 T3 RFz 3. 3. 2A 11- 25-5 T3 RFz 4. 2. 3 28- 15- 4 T3 RFz 3. 2. 2 1-6- 9 T3 RFz 3. 3. 2A 11- 25-7 T3 RFz 4. 2. 3 28- 15- 5 T3 RFz 3. 2. 2 1-6- 10 T3 RFz 3. 3. 2A 11- 25-8
T3 RFz 4. 2. 2 1-27-1 T3 Rj l Fz 2. 2. 4 25- 22- 1 T3 RFz 4. 2. 2 1-27-2 T3 Rj l Fz 2. 2. 4 25- 22- 3 T3 RFz 4. 2. 2 1-27-3 T3 Rj l Fz 2. 2. 4 25- 22- 5 T3 RFz 4. 2. 2 1-27-6 T3 Rj l Fz 2. 2. 4 25- 22- 6 T3 RFz 4. 2. 2 1-27-7 T3 Rj l Fz 2. 2. 4 25- 22- 7
Tanaman
Jumlah Anakan t erserang/
Jumlah Anakan % sundep Nilai D Skala 0-9
14 HSI 28 HSI 14 HSI 28 HSI 14 HSI 28 HSI 14 HSI 28 HSI
T3 RFz 3.3.2A 11- 25 -1 0/ 4 0/ 4 0 0
-2 0/ 5 0/ 5 0 0
-3 0/ 1 0/ 1 0 0
-4 0/ 1 0/ 1 0 0
-5 0/ 3 0/ 3 0 0
Rat a -rat a 0 0 0 0 0 0
T3 RFz 3. 2. 2 1-6-1 0/ 4 0/ 4 0 0
-2 0/ 4 0/ 4 0 0
-3 0/ 2 0/ 2 0 0
-4 0/ 1 0/ 1 0 0
-5 0/ 2 0/ 2 0 0
Rat a -rat a 0 0 0 0 0 0
T3 RFz 4.2.3 28-15-1 0/ 4 0/ 5 0 0
-2 0/ 7 0/ 9 0 0
-3 0/ 4 0/ 4 0 0
-4 0/ 7 0/ 7 0 0
-5 0/ 6 0/ 6 0 0
Rat a -rat a 0 0 0 0 0 0
T3 RFz 4.2.2 1-27-1 0/ 4 0/ 4 0 0
-2 0/ 2 0/ 3 0 0
-3 1/ 3 1/ 4 0 0
-4 0/ 2 0/ 2 0 0
-5 0/ 2 0/ 2 0 0
Rat a -rat a 0 0 0 0 0 0
T3 Rj l Fz 2.2.4 25-22-1 0/ 6 0/ 6 0 0
-2 0/ 1 0/ 1 0 0
-3 0/ 3 0/ 3 0 0
-4 0/ 1 0/ 1 0 0
-5 0/ 2 0/ 2 0 0
Rat a -rat a 0 0 0 0 0 0
Roj olele Isogenik 1 1/ 1 1/ 1 100 100
-2 0/ 1 0/ 1 0 0
-3 0/ 1 0/ 1 0 0
-4 0/ 1 0/ 1 0 0