PERFORMA PERTUMBUHAN DAN KOMPOSISI NUTRIEN
TUBUH BENIH IKAN MAS
Cyprinus carpio
TRANSGENIK
HORMON PERTUMBUHAN GENERASI KETIGA
KURDIANTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Performa Pertumbuhan dan Komposisi Nutrien Tubuh Benih Ikan Mas Cyprinus carpio Transgenik Hormon Pertumbuhan Generasi Ketiga” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Kurdianto
RINGKASAN
KURDIANTO. Performa Pertumbuhan dan Komposisi Nutrien Tubuh Benih Ikan Mas Cyprinus carpio Transgenik Hormon Pertumbuhan Generasi Ketiga. Dibimbing oleh ALIMUDDIN dan MIA SETIAWATI.
Ikan mas merupakan salah satu spesies penting dalam budidaya air tawar di Indonesia. Di bidang akuakultur, perbaikan pertumbuhan merupakan salah satu kunci untuk meningkatkan produksi perikanan. Transfer gen penyandi hormon pertumbuhan merupakan metode yang cepat dan efektif dalam meningkatkan pertumbuhan ikan. Peningkatan pertumbuhan yang cepat dalam waktu yang singkat menjadikan ikan transgenik berpotensi besar untuk dikembangkan dan dijadikan sumber pangan manusia. Informasi status nutrisi dan komposisi tubuh ikan transgenik masih sedikit dilaporkan, padahal data komposisi tubuh ikan transgenik menjadi pertimbangan dalam evaluasi kualitas pangan. Penelitian ini bertujuan untuk mengevaluasi performa pertumbuhan dan komposisi tubuh ikan mas transgenik hormon pertumbuhan ikan nila (tiGH) generasi ketiga (G3).
Ikan mas transgenik (TG) G3 diproduksi dengan menyilangkan antara ikan TG G2 jantan yang memiliki ekspresi tiGH tertinggi dengan ikan betina non-transgenik (NT), sedangkan ikan mas kontrol dibuat dengan menyilangkan ikan betina NT dan jantan NT. Ikan TG diidentifikasi menggunakan metode PCR dengan primer spesifik tiGH. Benih ikan mas yang digunakan dalam uji performa pertumbuhan memiliki bobot awal 1,53±0,03 gam dan panjang total 4,6±0,45 cm. Ikan dipelihara selama 60 hari dalam akuarium berukuran 1005050 cm3 dengan kepadatan 25 ekor/akuarium yang dilengkapi dengan top filter dan aerasi. Ikan TG dan NT masing-masing dibuat 3 akuarium sebagai ulangan. Pergantian air sebanyak 30% dilakukan setiap sore hari untuk mempertahankan kualitas air. Ikan diberi pakan komersial (protein 36%) dengan frekuensi 3 kali sehari secara at satiation. Sampling bobot tubuh dan kelangsungan hidup ikan dilakukan setiap 20 hari sekali. Parameter uji yang diukur pada penelitian ini meliputi pertambahan bobot dan panjang, kelangsungan hidup (KH), laju pertumbuhan spesifik (LPS), efisiensi pakan (EP), kandungan proksimat, retensi lemak (RL) dan protein (RP), kadar glukosa darah, indeks hepatosomatik (IHS), tingkat ekskresi amonia (TAN), dan ekspresi gen GH tiGH pada organ hati.
Analisis proksimat pakan dan total tubuh ikan uji dilakukan pada awal dan akhir penelitian, mengikuti metode Takeuchi (1988). Kadar glukosa diukur menggunakan metode enzimatik kolorimetri dengan uji glucosa liquicolor meggunakan test kit Human mbH (Jerman). Pengukuran TAN dilakukan menggunakan metode spektrofotometri, diadopsi dari Kobayashi et al. (2007). Analisis ekspresi mRNA tiGH dianalisis menggunakan metode RT-PCR. Data dianalisis menggunakan independent samples t-test dengan bantuan software
SPSS 16.0.
ikan TG lebih tinggi (P<0,05), sementara itu kandungan lemak tubuh dan glukosa darah lebih rendah (P<0,05) dibandingkan ikan mas NT. Ikan TG juga memiliki ekskresi total amonia 51,78% lebih rendah (P<0,05) dibandingkan ikan NT. Dengan demikian, budidaya ikan mas transgenik sangat berpotensi memiliki produktivitas tinggi, lebih efisien, dan lebih ramah lingkungan.
SUMMARY
KURDIANTO. Growth Performance and Body Composition of Juvenile Growth Hormone Transgenic Common Carp Cyprinus carpio Third Generation. Supervised by ALIMUDDIN and MIA SETIAWATI.
Common carp is one of important freshwater aquaculture species in Indonesia. In aquaculture, growth improvement is a key to increase fisheries production. Transfer of gene encoding growth hormone is considered as fast and effective method to increase fish growth. Growth improvement in a relatively short time makes transgenic fish highly potential to be developed as human food source. Few information about nutrition status and body composition of transgenic fish had been reported, whereas these data could be a consideration for evaluation of food quality. The purpose of this study was to evaluate growth performance and body composition of Nile tilapia growth hormone (tiGH) transgenic common carp third generation (G3).
The third generation transgenic (TG) common carp was produced through cross-breeding between male TG G2 with highest tiGH expression level and non-transgenic females (NT), while control fish was produced through cross-breeding between NT male and female. TG fish was identified using PCR method. The initial body weight and length of common carp juvenile used for performance evaluation was 1.53±0.03 gram and 4.6±0.45 cm. Fish were reared for 60 days in 1005050 cm3 sized aquarium with stocking density of 25 fishes/aquarium equipped top filter and aeration. Three aquariums were provided for TG and NT as replication, repectivelly. Thirty percent of water in each aquarium was changed daily in the afternoon to maintain water quality. Fishes were fed with commercial diet (36% crude protein) 3 times a day at apparent satiation. Sampling of body weight and survival rate was performed every 20 days. Observed parameters in this study included weight and length growth, survival rate (SR), specific growth rate (SGR), feed efficiency (FE), proximate content, lipid (LR) and protein retention (PR), blood glucose level, hepatosomatic index (HSI), ammonia excretion level (TAN), and tiGH expression in the liver.
conclusion, transgenic common carp is highly potential for high productivity, more efficient and more environmental-friendly aquaculture.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PERFORMA PERTUMBUHAN DAN KOMPOSISI NUTRIEN
TUBUH BENIH IKAN MAS
Cyprinus carpio
TRANSGENIK
HORMON PERTUMBUHAN GENERASI KETIGA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi : Prof. Dr. Ir. Muhammad Zairin Junior, MSc
Judul Tesis : Performa Pertumbuhan dan Komposisi Nutrien Tubuh Benih Ikan Mas Cyprinus carpio Transgenik Hormon Pertumbuhan Generasi Ketiga
Nama : Kurdianto NIM : C151140636
Disetujui oleh Komisi Pembimbing
Dr Alimuddin, SPi, MSc Ketua
Dr Ir Mia Setiawati, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MscAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wata’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2014 ini ialah transfer gen, dengan judul “Performa Pertumbuhan dan Komposisi Nutrien Tubuh Benih Ikan Mas Cyprinus carpio Transgenik Hormon Pertumbuhan Generasi Ketiga”. Penelitian ini dilaksanakan pada bulan Desember 2014 - April 2015 di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Jawa Barat dan Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi.
Dalam kesempatan kali ini, penulis mengucapkan terima kasih kepada : 1. Bapak Dr. Alimuddin S.Pi M.Sc dan Ibu Dr. Ir. Mia Setiawati M.Si selaku
dosen pembimbing yang telah banyak memberikan bimbingan selama pengerjaan penelitian ini.
2. Ibu Nurly Faridah S.Pi M.Si; Nurlatifa Khairun Nisa S.Pi, dan Dwi Hany Yanti S.Pi dari BBPBAT Sukabumi, Jawa Barat.
3. Jasmadi S.Pi; Darmawan S, S.Pi, M.Si; Rangga G S.Pi; Steven Michail Sutiono SPi, Upmal Deswira S.Pi, M.Si, dan seluruh anggota Laboratorium Reproduksi dan Genetika Organisme Akuatik atas segala bantuan dan bimbingannya.
4. Direktorat Jenderal Pendidikan Tinggi (DIKTI) atas beasiswa Fresh Graduate yang telah diberikan selama masa studi berlangsung.
5. Suhirno (alm) dan Carliem orang tuaku tercinta serta seluruh keluarga besar yang senantiasa memberikan dukungan, do‟a, moril, dan nasehatnya. 6. Ina Walia Fathonah, S.Pi istriku tercinta yang selalu memberikan
dukungan dan semangat untuk menyelesaikan studi
7. Teman-teman Ilmu Akuakultur 2013 atas dukungan dan persahabatan selama ini, serta semua pihak yang telah memberikan dukungan, baik secara langsung maupun tidak langsung.
Semoga karya ilmiah ini bermanfaat bagi berbagai pihak.
Bogor, September 2015
DAFTAR ISI
Halaman
DAFTAR TABEL iv
DAFTAR GAMBAR iv
DAFTAR LAMPIRAN v
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan dan Manfaat 2
2 BAHAN DAN METODE 2
Waktu dan Tempat 2
Ikan Uji 2
Uji Performa Pertumbuhan 3
Parameter Uji 4
Analisis Data 7
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 12
4 SIMPULAN 15
DAFTAR PUSTAKA 15
LAMPIRAN 19
DAFTAR TABEL
1 Pertambahan bobot dan panjang, laju pertumbuhan spesifik, jumlah konsumsi pakan, kelangsungan hidup, efisiensi pakan, retensi lemak, dan retensi protein benih ikan mas yang dipelihara selama 60 hari di
akuarium 8
2 Komposisi proksimat tubuh (% bobot kering) benih ikan mas transgenik dan non-transgenik hormon pertumbuhan generasi ketiga 9 3 Kadar hematokrit, hemoglobin, dan aktivitas fagositik benih ikan mas
pada akhir pemeliharaan 9
DAFTAR GAMBAR
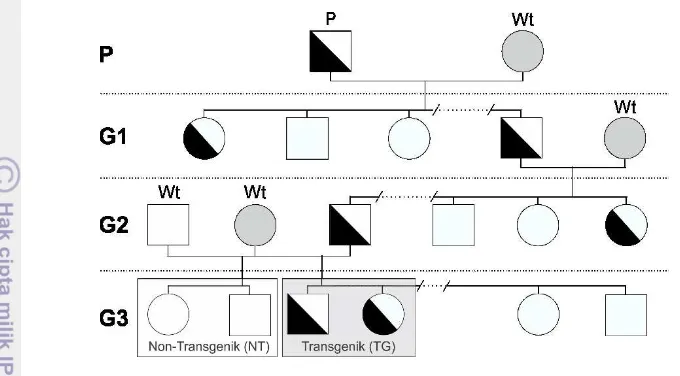
1 Skema produksi ikan mas transgenik hormon pertumbuhan generasi kesatu (G1), kedua (G2), dan ketiga (G3). P adalah induk parental. Simbol berwarna putih, putih dan hitam, dan abu-abu secara berturut-turut menunjukkan ikan non-transgenik, transgenik, dan ikan wild-type
(Wt). Simbol kotak adalah jantan, sedangkan bulat adalah betina 3 2 Bobot rata-rata benih ikan mas transgenik hormon pertumbuhan ( )
dan non-transgenik ( ) yang dipelihara selama 60 hari di akuarium 8 3 Kadar glukosa darah benih ikan mas transgenik (TG) dan
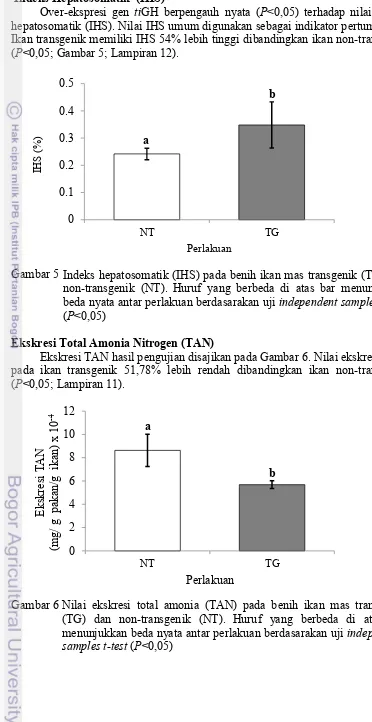
non-transgenik (NT) pada 0, 6, 12 dan 24 jam setelah pemberian pakan 10 4 Ekspresi tilapia growth hormone (tiGH) (gambar atas) dan β-aktin
(gambar bawah) yang dianalisis dengan metode reverse transcriptase
PCR. M: Marker DNA (KAPPA Universal DNA Ledder, KAPPA BIOSCIENCE), Dt: Produk PCR dengan templat cDNA ikan mas transgenik, Dn: cDNA ikan mas non-transgenik, Rt: RNA total ikan mas transgenic, Rn: RNA total ikan mas non-transgenik, N: Produk PCR tampa templat cDNA, dan P: Produk PCR dengan templat plasmid pmBA-tiGH. Target produk PCR adalah 250 bp (tiGH) dan 300 bp (β
-aktin) 10
5 Indeks hepatosomatik (IHS) pada ikan mas transgenik (TG) dan non-transgenik (NT). Huruf yang berbeda di atas bar menunjukkan beda nyata antar perlakuan berdasarakan uji independent samples t-test
(P<0,05) 11
6 Nilai ekskresi total amonia (TAN) pada ikan mas transgenik (TG) dan non-transgenik (NT). Huruf yang berbeda di atas bar menunjukkan beda nyata antar perlakuan berdasarakan uji independent samples t-test
(P<0,05) 11
7 Kadar glikogen hati benih ikan mas transgenik (TG) dan ikan non-transgenik (NT) pada saat dipuasakan (0 jam) dan setelah 24 jam
DAFTAR LAMPIRAN
1 Prosedur ekstraksi DNA dengan DNA purification kit (Puregene,
Minneapolis USA) 19
2 Prosedur ekstraksi RNA total dan sintesis cDNA 20 3 Prosedur analisis proksimat sampel (Takeuchi 1988) 22
4 Komposisi proksimat pakan perlakuan 25
5 Hasil analisis statistik pertambahan bobot dengan independent samples
t-test (SPSS 16.0) 26
6 Hasil analisis statistik pertambahan panjang dengan independent
samples t-test (SPSS 16.0) 27
7 Hasil analisis statistik jumlah konsumsi pakan dengan independent
samples t-test (SPSS 16.0) 28
8 Hasil analisis statistik laju pertumbuhan spesifik dengan independent
samples t-test (SPSS 16.0) 29
9 Hasil analisis statistik kelangsungan hidup dengan independent samples
t-test (SPSS 16.0) 30
10 Hasil analisis statistik efisiensi pakan dengan independent samples
t-test (SPSS 16.0) 31
11 Hasil analisis statistik ekskresi total amonia dengan independent
samples t-test (SPSS 16.0) 32
12 Hasil analisis statistik indeks hepatosomatik dengan independent
samples t-test (SPSS 16.0) 33
13 Hasil analisis statistik kadar glukosa darah dengan independent samples
t-test (SPSS 16.0) 34
14 Hasil analisis statistik retensi lemak dan protein dengan independent
samples t-test (SPSS 16.0) 35
15 Hasil analisis statistik proksimat tubuh dengan independent samples
t-test (SPSS 16.0) 36
16 Hasil analisis statistik parameter hematologi dengan independent
1
1
PENDAHULUAN
Latar Belakang
Produksi akuakultur dunia meningkat secara cepat pada sepuluh tahun terakhir. Setiap tahunnya hampir 50% dari total ikan dan seafood yang dikonsumsi manusia berasal dari produk akuakultur (Subasinghe et al. 2009). Ikan mas merupakan salah satu spesies penting dalam budidaya ikan air tawar di Indonesia. Selama 10 tahun terakhir, masih sedikit penelitian mengenai peningkatan pertumbuhan pada ikan mas (Ariyanto dan Subagyo 2004). Di bidang akuakultur, perbaikan pertumbuhan merupakan kunci utama untuk meningkatkan produksi perikanan (Raven et al. 2008). Selanjutnya, peningkatan pertumbuhan juga memberikan banyak manfaat seperti memperpendek waktu produksi, meningkatkan efisiensi pakan, meningkatkan produksi, dan mengontrol ketersediaan produk (Devlin et al. 2004; Lu et al. 2009).
Transfer gen merupakan metode cepat dan efektif dalam meningkatkan pertumbuhan dan produktivitas ikan (Devlin et al. 2004; Lu et al. 2009). Sejak ikan transgenik pertama diproduksi (Zhu et al. 1989), teknik transfer gen telah digunakan untuk menghasilkan berbagai spesies ikan cepat tumbuh, seperti ikan salmon Atlantik (Salmo salar) (Du et al. 1992), salmon coho (Oncorhynchus kisutch) (Devlin et al. 2004), mud loach (Misgurnus mizolepis) (Nam et al. 2002), ikan nila (Oreochromis sp.) (Kobayashi et al. 2007). Di Indonesia penelitian mengenai peningkatan performa pertumbuhan menggunakan tehnik transfer gen sudah dimulai sejak tahun 2011 (Alimuddin et al. 2012).
Selain memacu pertumbuhan, over-ekspresi gen GH juga dapat mempengaruhi tingkat metabolisme (McKenzie et al. 2003), kemampuan berenang (Lee et al. 2003), ketahanan terhadap penyakit (Jhingan et al. 2003), tingkat konsumsi pakan dan kebiasan makan (Stevens dan Devlin 2005), dan respons terhadap predator (Duan et al. 2010). Perubahan metabolisme nutrien pada ikan transgenik berpengaruh terhadap ekskresi amonia (Kobayashi et al. 2007) dan fosfor (Lu et al. 2009). Selanjutnya, perubahan tingkat konsumsi pakan berpengaruh terhadap efisiensi pakan dan biaya produksi (Lu et al. 2009), dan perubahan dalam resistensi terhadap penyakit berpengaruh terhadap kelangsungan hidup dan biomassa panen (Ling et al. 2009).
2
Perumusan Masalah
Salah satu teknologi yang telah diterapkan untuk meningkatkan pertumbuhan ikan mas adalah teknologi transfer gen. Ikan mas transgenik telah diproduksi menggunakan gen GH ikan nila (tiGH) (Faridah 2012) dengan menghasilkan peningkatan pertumbuhan antara 1,4-1,87 kali lebih baik dibandingkan dengan kontrol non-transgenik pada generasi pertama. Oleh sebab itu evaluasi performa pertumbuhan dan komposisi tubuh ikan mas transgenik generasi selanjutnya diharapkan dapat memberikan informasi yang berguna terkait penggunaan ikan transgenik dalam kegiatan akuakultur.
Tujuan dan Manfaat
Penelitian ini bertujuan untuk mengevaluasi performa pertumbuhan, komposisi tubuh, dan ekspresi gen tiGH pada benih ikan mas transgenik. Hasil penelitian ini diharapkan dapat bermanfaat sebagai salah satu acuan pengembangan ikan transgenik untuk kegiatan budidaya ikan mas di Indonesia.
2 BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Desember 2014 – April 2015, di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Institut Pertanian Bogor, dan Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi, Jawa Barat.
Ikan Uji
Satu induk jantan transgenik GH generasi kedua (G2) dipilih yang memiliki ekspresi tiGH tertinggi, dan disilangkan dengan ikan mas betina non-transgenik untuk menghasilkan generasi ketiga (G3) (Gambar 1). Ikan mas transgenik G2 tersebut merupakan keturunan persilangan antara ikan jantan transgenik G1 yang mengekspresikan gen tiGH dan ikan mas betina non-transgenik (Alimuddin et al. 2012). Sebagai kontrol, dibuat persilangan antara ikan mas jantan dan betina non-transgenik. Ikan betina non-transgenik yang digunakan dalam pembuatan ikan transgenik G3 adalah sama dengan yang digunakan untuk membuat kontrol. Setiap perlakuan TG dan NT diberikan 3 akuarium sebagai ulangan.
3
Skema produksi ikan mas transgenik hormon pertumbuhan generasi kesatu (G1), kedua (G2), dan ketiga (G3). P adalah induk parental. Simbol berwarna putih, putih dan hitam, dan abu-abu secara berturut-turut menunjukkan ikan non-transgenik, transgenik, dan ikan wild-type
(Wt). Simbol kotak adalah jantan, sedangkan bulat adalah betina
penetasan. Setelah menjadi benih (2-3 cm), ikan mas dipelihara dalam hapa (221 m3) yang dipasang di kolam hingga mencapai panjang total 4-5 cm.
Gambar 1
Analisis benih yang membawa gen tiGH dilakukan dengan metode PCR (polymerase chain reaction) menggunakan DNA genom yang diekstrak dari sirip ekor (bobot sekitar 20 mg). Isolasi DNA genom dilakukan menggunakan DNA
purification kit (Puregene, Minneapolis, USA) dengan mengikuti prosedur manual yang sudah ada (Lampiran 1). Pelet DNA yang diperoleh dilarutkan menggunakan ion-exchanged water (IEW) sebanyak 20 μL. Prosedur PCR dilakukan menggunakan 2 set primer spesifik yang bisa membedakan tiGH dengan gen GH endogen ikan mas, yaitu tiGH-1F (5‟-AGA CAG CCA GCG TTT GTT CT-3‟) dan tiGH-1R (5‟CCA GGA CTC AAC CAG TCC AT-3‟) (Kobayashi et al. 2007). Program PCR yang digunakan untuk tiGH ialah 95°C selama 5 menit, 35 siklus (95°C selama 20 detik, 62°C selama 15 detik, 72°C selama 20 detik), dan 72°C selama 5 menit. Sebanyak 1 μL produk amplifikasi PCR digunakan dalam elektroforesis dengan menggunakan 1% gel agarosa.Visualisasi pita DNA dilakukan menggunakan Gel Doc dengan bantuan cahaya ultraviolet.
Uji Performa Pertumbuhan
Benih ikan mas hasil identifikasi yang berukuran panjang total (4,6±0,45 cm) dan bobot (1,53±0,03 gram) dipelihara dalam akuarium berukuran 1005050 cm3 dengan kepadatan 25 ekor/akuarium yang dilengkapi dengan top filter dan aerasi. Pergantian air sebanyak 30% dilakukan setiap sore hari untuk mempertahankan kualitas air dalam keadaan baik. Kualitas air pemeliharaan memiliki kualitas baik dengan nilai pH 7,34-7,67; oksigen terlarut 8,0-8,5 mg/L; suhu 26,5-28,4 C; dan total amonium nitrogen (TAN) 0,021-0,281 mg/L.
4
(pagi, siang, dan sore), dan secara at satiation. Pemeliharaan dilakukan selama 60 hari. Sampling bobot tubuh dan kelangsungan hidup ikan dilakukan setiap 20 hari sekali. Panjang tubuh diukur pada awal dan akhir penelitian.
Parameter Uji
Parameter uji yang diukur pada penelitian ini meliputi pertambahan bobot dan panjang, kelangsungan hidup (KH), laju pertumbuhan spesifik (LPS), efisiensi pakan (EP), kandungan proksimat, retensi lemak dan protein, kadar glukosa darah, kadar glikogen hati, hemoglobin, hematokrit, aktivitas fagositik, indeks hepatosomatik (IHS), tingkat ekskresi amonia (TAN), dan ekspresi gen
tiGH.
Pertambahan Bobot, Panjang, LPS, EP, dan KH
Bobot tubuh ikan diukur setiap 20 hari sampai akhir percobaan, sedangkan panjang tubuh diukur pada awal dan akhir percobaan. Pertambahan bobot (PB) dan panjang (PP) dihitung berdasarkan persamaan:
PB = Bt - B0 dan PP = Pt - P0
Keterangan :
Bt = Bobot rata-rata pada akhir pemeliharaan (g) B0 = Bobot rata-rata pada awal pemeliharaan (g) Pt = Panjang rata-rata pada akhir pemeliharaan (cm) P0 = Panjang rata-rata pada awal pemeliharaan (cm)
Laju pertumbuhan spesifik (LPS) ikan uji dihitung berdasarkan persamaan yang dikemukakan oleh Huisman (1987), yaitu:
LPS =[
√
–
1] x 100
LPS = Laju pertumbuhan spesifik (%)
Wt = Bobot rata-rata ikan pada akhir pemeliharaan (g) Wo = Bobot rata-rata ikan pada awal pemeliharaan (g) t = Lama waktu pemeliharaan (hari)
Kelangsungan hidup (KH) ikan uji dihitung berdasarkan persamaan yang dikemukakan oleh Effendie (1987), yaitu:
KH =
x 100
KH = Kelangsungan hidup ikan (%)
5 Efisiensi pakan (EP) dihitung menggunakan persamaan yang dikemukakan oleh Effendie (1987), yaitu:
EP =
x 100
EP = Efisiensi pakan (%)
Wp = Jumlah pakan yang diberikan selama pemeliharaan (g) Wt = Biomassa ikan pada akhir pemeliharaan (g)
Wd = Biomassa ikan mati selama pemeliharaan (g) Wo = Biomassa ikan pada awal pemeliharaan (g) Analisis Proksimat Pakan dan Tubuh Ikan
Sebanyak 4 ekor (biomassa sekitar 100 gram) masing-masing perlakuan diambil secara acak dan dicacah hingga halus, kemudian dihomogenasi untuk proses analisis proksimat. Analisis proksimat pakan dan tubuh ikan uji dilakukan pada awal dan akhir penelitian, mengikuti metode Takeuchi (1988). Analisis tersebut meliputi kadar protein, lemak, serat, kadar abu, kadar air, dan BETN. Analisis protein dilakukan dengan menggunakan metode Kjeldhal, lemak menggunakan metode ekstraksi dengan metode Folsch, kadar abu melalui pemanasan sampel dalam tanur pada suhu 400°C sampai 600°C, serat kasar menggunakan metode pelarutan sampel dengan asam dan basa kuat serta pemanasan, dan kadar air dengan metode pemanasan dalam oven pada suhu 105-110°C (Lampiran 3).
Retensi Protein dan Retensi Lemak
Nilai retensi protein dihitung berdasarkan persamaan (Takeuchi 1988):
RP =
x 100
RP = Retensi protein (%)
Fp = Jumlah protein tubuh di akhir percobaan (g) I = Jumlah protein tubuh di awal percobaan (g) P = Jumlah protein pakan yang diberikan (g)
Nilai retensi lemak dihitung berdasarkan persamaan (Takeuchi 1988):
RL = x 100 RL = Retensi lemak (%)
Fl = Jumlah lemak tubuh di akhir percobaan (g) I = Jumlah lemak tubuh di awal percobaan (g) L = Jumlah lemak pakan yang diberikan (g) Analisis Kadar Glukosa Darah
Tiga ekor ikan dari setiap perlakuan diambil secara acak sebelum, 6, 12, dan 24 jam setelah pemberian pakan. Ikan dibius terlebih dahulu menggunakan
6
ekor menggunakan syringe TERUMO 1 cc/mL (needle 0,412 mm) yang telah dibilas dengan antikoagulan (natrium sitrat 3,8%), kemudian darah dimasukkan ke dalam tabung mikro 1,5 mL. Pemisahan plasma dilakukan dengan sentrifugasi dengan kecepatan 3.000 rpm selama 15-20 menit. Kadar glukosa diukur menggunakan metode enzimatik kolorimetri dengan uji glucosa liquicolor meggunakan test kit Human mbH (Jerman)
Analisis Kadar Glikogen Hati
Pengukuran glikogen hati dilakukan pada saat ikan dipuasakan (0 jam) dan 24 jam setelah pemberian pakan dengan menggunakan 3 ekor ikan yang diambil secara acak dari setiap perlakuan. Analisis kadar glikogen hati mengacu pada metode Wedemeyer dan Yasutake (1997). Jaringan hati sekitar 100 mg dididihkan dalam 3 mL KOH 30% hingga larut (selama 20-30 menit), kemudian ditambahkan 0,5 mL Na2SO4 jenuh dan 3,5 mL etanol 95%, selanjutnya dipanaskan sampai
mendidih. Setelah dingin, larutan disentrifugasi dan supernatannya dibuang. Glikogen dilarutkan dalam 2 mL air dan diendapkan kembali dengan 2,5 mL etanol 95%. Supernatan dibuang dan glikogen yang mengendap dihidrolisis dengan 2 mL HCl 5 M selama 30 menit dalam waterbath mendidih. Sampel didinginkan dan dinetralkan menggunakan 0,5 M NaOH (digunakan 1 tetes fenolred sebagai indikator) yang diketahui (50-100 mL), bergantung pada glikogen yang diharapkan dan selanjutnya kadar glikogen diukur berdasarkan nilai absorbansi spektrofotometer pada panjang gelombang 620 nm.
Analisis Indeks Hepatosomatik
Lima ekor ikan dari setiap ulangan ikan transgenik dan non-transgenik diambil secara acak pada akhir pemeliharaan. IHS diukur dengan menimbang bobot hati dibandingkan dengan bobot tubuh ikan. IHS dihitung berdasarkan persamaan yang dikemukakan oleh Yang et al. (2002), yaitu:
IHS (%) =
x 100
Analisis Hematologi
Sampel darah diambil pada akhir pemeliharaan sebanyak 3 ekor setiap perlakuan. Sebelum diambil darahnya, ikan terlebih dahulu dibius dengan 3 ml/L
stabilizer (Ocean Free, China). Sampel darah diambil (0,3 ml/ekor) dari pembuluh vena di pangkal sirip ekor menggunakan syringe TERUMO 1 cc/ml (needle 0,412 mm) yang telah dibilas dengan antikoagulan (natrium sitrat 3,8%); dan kemudian dimasukkan ke dalam tabung mikro 1,5 mL. Parameter hematologi yang dianalisis berupa hematokrit, hemoglobin, dan aktivitas fagositik. Kadar hematokrit dan aktivitas fagositik diukur menurut Anderson dan Siwicki (1995), sedangkan kadar hemoglobin diukur menurut metode Sahli (Wedemeyer dan Yasutake 1977).
Analisis Ekskresi Amonia
7 Pengukuran awal dilakukan setelah ikan dipuasakan selama 24 jam, dan media pemeliharaan diisi dengan air baru (kadar TAN: 0,12±0,01 mg/L). Pengukuran akhir dilakukan 24 jam setelah ikan diberi pakan secara at satiation. Konsentrasi TAN dihitung untuk setiap unit pakan yang dikonsumsi per biomassa ikan (mg TAN/g pakan/g ikan). Pengukuran TAN dilakukan menggunakan metode spektrofotometri, diadopsi dari Kobayashi et al. (2007).
Analisis Ekspresi Gen tiGH
Ekspresi mRNA tiGH dianalisis menggunakan metode RT-PCR. RNA total diekstrak dari organ hati, pengambilan sampel dilakukan pada akhir penelitian. RNA total diekstrak menggunakan isogen (Nippon Gen, Japan) sesuai manual prosedur yang diberikan (Lampiran 2). Konsentrasi hasil isolasi RNA total diukur menggunakan GeneQuant pada panjang gelombang 260 dan 280 nm. Sintesis cDNA dilakukan menggunakan kit ready-to-go you-prime first strand beads (GE Healtcare). Hasil cDNA yang terbentuk ditambahkan 50 μL IEW steril dan
disimpan dalam refrigerator hingga digunakan.
Proses PCR dilakukan dengan mengguanakan set primer tiGH-1F forward
(5‟-AGA CAG CCA GCG TTT GTT CT-3‟) dan tiGH-1R reverse (5‟-CCA GGA CTC AAC CAG TCC AT-3‟) dengan target kurang lebih 250 bp (Kobayashi et al.
2007). Program PCR yang digunakan untuk tiGH ialah 95°C selama 5 menit, 35 siklus (95°C selama 20 detik, 62°C selama 15 detik, 72°C selama 20 detik), dan 72°C selama 3 menit. Sebagai kontrol internal dilakukan pengamatan terhadap ekspresi gen β-aktin menggunakan primer β-aktin forward 5‟-ATG GTT ATG GGA CAG AAG GAC-3‟dan β-aktin reverse5‟-CTG TGT CAT CTT TTC CCT GTT GGC-3‟ dengan target kurang lebih 300 bp. Program PCR yang digunakan adalah berjumlah 35 siklus (denaturasi 95°C selama 20 detik, annealing 59ºC selama 20 detik, ekstensi 72°C selama 30 detik), dan ekstensi akhir 72°C selama 10 menit. Pengecekan hasil PCR dilakukan dengan metode elektroforesis menggunakan gel agarosa 1%.
Analisis Data
Pertambahan bobot, panjang, konversi pakan, kelangsungan hidup, laju pertumbuhan spesifik, kadar glukosa darah, proksimat tubuh, retensi lemak dan protein, hemoglobin, hematokrit, aktivitas fagositik, indeks hepatosomatik, dan ekskresi amonia dianalisis dengan metode independent samples t-test
menggunakan SPSS 16.0. Ekspresi gen tiGH dan kadar glikogen hati dianalisis secara deskriptif.
3
HASIL DAN PEMBAHASAN
Hasil Performa Pertumbuhan
8 konsumsi pakan, kelangsungan hidup, dan efisiensi pakan, retensi lemak,
dan retensi protein benih ikan mas yang dipelihara selama 60 hari di akuarium
Bobot rata-rata benih ikan mas transgenik hormon pertumbuhan ( ) dan non-transgenik ( ) yang dipelihara selama 60 hari di akuarium non-transgenik (P<0,05). Namun nilai pertambahan panjang ikan transgenik tidak berbeda dengan ikan non-transgenik (P>0,05; Lampiran 6).
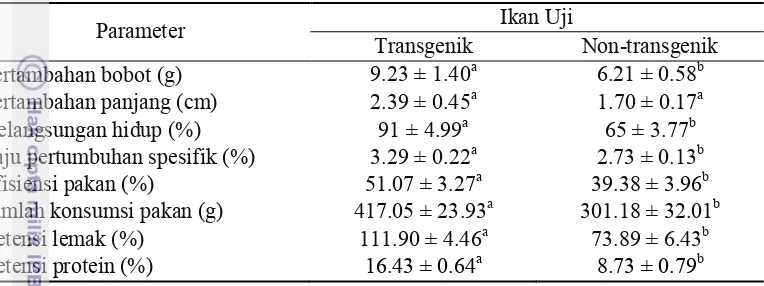
Tabel 1 Jumlah konsumsi pakan (g) 417.05 ± 23.93a 301.18 ± 32.01b Retensi lemak (%) 111.90 ± 4.46a 73.89 ± 6.43b Retensi protein (%) 16.43 ± 0.64a 8.73 ± 0.79b Huruf superskrip yang berbeda pada baris yang sama menunjukkan beda nyata antar perlakuan berdasarkan uji independent samples t-test (P<0,05).
Pada penelitian ini ikan mas transgenik tiGH memiliki pertumbuhan bobot rata-rata 1,49 kali lebih tinggi (P<0,05; Lampiran 5) dibandingkan dengan ikan non-transgenik. Selain itu, laju pertumbuhan spesifik benih ikan mas transgenik 20,38% lebih cepat (P<0,05; Lampiran 8) dibandingkan ikan mas non-transgenik. Kelangsungan hidup ikan transgenik juga lebih tinggi dibandingkan ikan non-transgenik (P<0,05; Lampiran 9), yaitu sebesar 36,73%. Sementara itu, ikan transgenik mengonsumsi pakan 38,47% lebih banyak dibandingkan ikan non-transgenik (P<0,05; Lampiran 7). Ikan transgenik juga memiliki efisiensi pakan, retensi protein, dan retensi lemak lebih tinggi dibandingkan dengan ikan non-transgenik.
9 Komposisi Proksimat Tubuh
Over-ekspresi tiGH berpengaruh nyata (P<0,05; Lampiran 15) terhadap kandungan proksimat tubuh ikan mas. Kandungan proksimat tubuh benih ikan mas yang dipelihara selama 60 hari disajikan pada Tabel 2. Kandungan protein tubuh ikan TG sekitar 11,67% lebih tinggi (P<0,05), tetapi kandungan lemak tubuhnya sekitar 7,29% lebih rendah (P<0,05) dibandingkan ikan mas NT (Tabel 2). Kadar abu dan karbohidrat tidak berbeda antara ikan TG dan ikan NT (P>0,05). Tabel 2 Komposisi proksimat tubuh (% bobot kering) benih ikan mas transgenik
dan non-transgenik hormon pertumbuhan generasi ketiga
Parameter Ikan Uji
Kandungan proksimat dinyatakan dalam bobot kering, dengan kadar air ikan transgenik sebesar 72,04% dan non-transgenik 73,64%. Huruf superskrip yang berbeda pada baris yang sama menunjukkan beda nyata antar perlakuan berdasarakan uji independent samples t-test (P<0,05).
Parameter Hematologi
Over-ekspresi tiGH berpengaruh terhadap parameter hematologi benih ikan mas yang dipelihara (Tabel 3). Ikan mas TG memiliki kadar hemoglobin, hematokrit, dan aktivitas fagositik yang lebih tinggi (P<0,05; Lampiran 16) dibandingkan ikan mas NT pada akhir pemeliharaan.
Tabel 3 Kadar hematokrit, hemoglobin, dan aktivitas fagositik benih ikan mas pada akhir pemeliharaan berdasarkan uji independent samples t-test (P<0,05).
Kadar Glukosa Darah
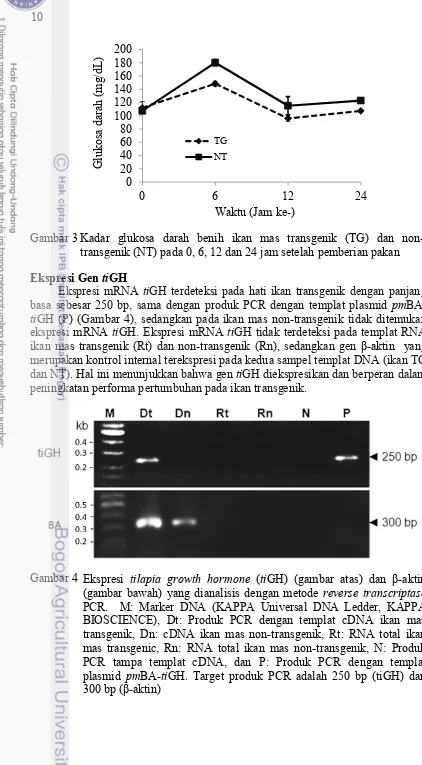
10
Kadar glukosa darah benih ikan mas transgenik (TG) dan non-transgenik (NT) pada 0, 6, 12 dan 24 jam setelah pemberian pakan
Ekspresi tilapia growth hormone (tiGH) (gambar atas) dan β-aktin (gambar bawah) yang dianalisis dengan metode reverse transcriptase
PCR. M: Marker DNA (KAPPA Universal DNA Ledder, KAPPA ekspresi mRNA tiGH. Ekspresi mRNA tiGH tidak terdeteksi pada templat RNA ikan mas transgenik (Rt) dan non-transgenik (Rn), sedangkan gen β-aktin yang merupakan kontrol internal terekspresi pada kedua sampel templat DNA (ikan TG dan NT). Hal ini menunjukkan bahwa gen tiGH diekspresikan dan berperan dalam peningkatan performa pertumbuhan pada ikan transgenik.
11 menunjukkan beda nyata antar perlakuan berdasarakan uji independent
Indeks Hepatosomatik (IHS)
Over-ekspresi gen tiGH berpengauh nyata (P<0,05) terhadap nilai indeks hepatosomatik (IHS). Nilai IHS umum digunakan sebagai indikator pertumbuhan. Ikan transgenik memiliki IHS 54% lebih tinggi dibandingkan ikan non-transgenik (P<0,05; Gambar 5; Lampiran 12).
Gambar 5
Ekskresi Total Amonia Nitrogen (TAN)
Ekskresi TAN hasil pengujian disajikan pada Gambar 6. Nilai ekskresi TAN pada ikan transgenik 51,78% lebih rendah dibandingkan ikan non-transgenik (P<0,05; Lampiran 11).
Gambar 6
a
Indeks hepatosomatik (IHS) pada benih ikan mas transgenik (TG) dan non-transgenik (NT). Huruf yang berbeda di atas bar menunjukkan beda nyata antar perlakuan berdasarakan uji independent samples t-test
(P<0,05)
b
a
12
13 bahwa jumlah lemak yang dikonversi menjadi bagian lemak tubuh yang tersimpan melebihi asupan lemak yang bersumber dari pakan. Nilai retensi menunjukkan tingkat penyimpanan nutrien sebagai sumber energi untuk pertumbuhan. Fu et al. (1998) melaporkan bahwa ikan mas transgenik hGH memiliki efisiensi retensi protein lebih tinggi dibandingkan kontrol. Retensi protein dan lemak yang tinggi pada ikan mas transgenik juga berbanding lurus dengan nilai efisiensi pakan yang lebih tinggi pada ikan mas transgenik (P<0,05; Lampiran 10). Peran GH dalam meningkatkan efisiensi pakan pada ikan transgenik juga telah dilaporkan pada ikan mud loach (Nam et al. 2002), ikan salmon (Devlin et al. 2004), dan ikan nila (Kobayashi et al. 2007). Secara fisiologis, mekanisme pemanfaatan pakan pada ikan transgenik ini belum diketahui dengan jelas, namun kemampun mencerna, menyerap, dan mendistribusikan nutrisi pada ikan transgenik diduga lebih baik (Fu et al. 1998; Stevens et al. 1999; Cook et al. 2000). Ikan mas transgenik juga dilaporkan dapat memanfaatkan low quality food lebih baik dibandingkan kontrolnya (Fu et al. 1998; Raven et al. 2006; Venugopal et al. 2004). Bahkan, ikan salmon coho transgenik dilaporkan memiliki saluran pencernaan yang lebih luas dan lebih banyak, dan lebih panjang dibandingkan ikan non-transgenik, yang memungkinkan peningkatan penyerapan makanan dan mempercepat pertumbuhan (Stevens et al. 1999).
Ikan mas transgenik tiGH memiliki kadar protein tubuh lebih tinggi, sedangkan kandungan lemaknya lebih rendah dibandingkan ikan non-transgenik. Hasil ini sesuai dengan penelitian Chatakondi et al. (1995) dan Fu et al. (1998) pada ikan mas transgenik. Berbeda dengan ikan salmon Atlantik transgenik yang memiliki kandungan lemak dan protein lebih rendah dibandingkan ikan salmon non-transgenik (Cook et al. 2000). Perbedaan komposisi tubuh ikan tersebut dapat diakibatkan oleh komposisi pakan dan nutritional history sebelum perlakuan (kualitas pakan dan feeding rate) (Raven et al. 2006). Kandungan lemak tubuh yang rendah berkaitan erat dengan penggunaan lemak sebagai sumber energi pada ikan transgenik. Kadar lemak yang rendah pada ikan mas transgenik disebabkan oleh kebutuhan energi dan metabolismenya lebih tinggi dibandingkan kontrol (Cook et al. 2000; Guan et al. 2008), sehingga diduga lemak tubuh dimanfaatkan dengan baik oleh ikan TG sebagai sumber energi. Kadar lemak yang rendah pada ikan juga sangat diperlukan secara ekonomi, karena dapat mengurangi kemungkinan ikan menyerap senyawa off-flavor yang dapat merusak aroma daging (Robin et al. 2006).
14
pengamatan menunjukkan bahwa ikan mas transgenik memiliki kemampuan yang lebih baik dalam memanfaatkan dan memobilisasi glukosa darah sebagai sumber energi untuk metabolisme dan pertumbuhannya. Pola yang serupa juga ditunjukkan pada ikan salmon, di mana kadar gkukosa darah mencapai puncaknya pada jam ke-6 setelah injeksi glukosa, sedangkan pada jam ke-24 ikan salmon memiliki kadar glukosa yang lebih rendah. Ikan salmon transgenik juga lebih cepat kembali pada kadar glukosa basal (normal) (Panserat et al. 2014). Rendahnya nilai kadar glukosa darah ikan transgenik pada akhir pemeliharaan diikuti dengan meningkatnya kadar glikogen hati (Gambar 7). Hal ini menunjukkan bahwa glukosa di dalam darah dikonversi menjadi glikogen sebagai cadangan energi. Higgs et al. (2008) melaporkan bahwa ikan salmon transgenik GH memiliki kemampuan yang lebih baik dalam memanfaatkan pakan yang tinggi kadar karbohidrat dan memiliki kemampuan degradasi karbohidrat sebagai sumber energi dan sintesis lipid yang lebih baik dibandingkan ikan non-transgenik (Leggatt et al. 2009).
Pada penelitian ini, ikan mas transgenik mampu meningkatkan retensi protein dan menurunkan ekskresi amonia sebesar 51,78% (Tabel 1). Hasil yang sama juga ditunjukkan pada ikan nila transgenik yang dapat menurunkan ekskresi TAN hingga 69% lebih rendah (Kobayashi et al. 2007). Hal ini menunjukkan ikan mas transgenik lebih efisien dalam memanfaatkan protein yang terdapat dalam pakan, sehingga hasil utama dari proses katabolisme protein berupa limbah nitrogen bisa diminimalkan. Bahkan beberapa studi juga melaporkan bahwa ikan transgenik mampu memanfaatkan lipid (Pérez-Sanchez 2000) dan karbohidrat (Leggatt et al. 2009) sebagai sumber energi. Limbah nitrogen, seperti amonia dan nitrit, dapat bersifat toksik bagi ikan saat konsentrasinya melebihi batas normal (Randall dan Tsui 2002). Selain itu, senyawa nitrogen yang terbuang pada kegiatan akuakultur dapat mengakibatkan eutrofikasi yang berdampak pada timbulnya blooming plankton (Wu 1995).
Sementara itu, nilai IHS pada ikan mas transgenik lebih tinggi 54% dibandingkan ikan non-transgenik (Gambar 5). Hati merupakan pusat metabolisme nutrien dalam tubuh, dan IHS telah umum digunakan sebagai indikator pertumbuhan (Ighwela et al. 2014). Nilai glikogen hati yang lebih tinggi (Gambar 7) pada ikan transgenik juga diduga mengakibatkan peningkatan bobot hati. Peningkatan IHS juga dilaporkan pada ikan salmon transgenik sebesar 30% lebih tinggi dibandingkan kontrol (Leggatt et al. 2009). Peningkatan nilai IHS juga menunjukkan bahwa ukuran hati yang lebih besar sebagai kompensasi pertumbuhan yang cepat.
15 Peningkatan pertumbuhan yang cepat pada ikan mas transgenik pada penelitian ini diakibatkan oleh adanya ekspresi gen tiGH (Gambar 4) yang diwariskan dari ikan mas generasi sebelumnya. Pada ikan mas non-transgenik tidak ditemui ekspresi gen tiGH pada organ uji. Hal ini menunjukkan bahwa gen tiGH pada tubuh ikan mas transgenik dapat terekspresi dengan baik dengan bantuan promoter β-aktin (Gambar 4) dalam memicu laju pertumbuhan ikan target. Gen GH secara normal disekresikan oleh pituitari di bawah kontrol hipotalamus. Gen ini secara umum berfungsi dalam meregulasi pertumbuhan somatik secara langsung maupun melalui induksi insuline like growth factor (Norris 1997).
Kelangsungan hidup ikan TG juga 36,73% lebih tinggi dibandingkan dengan ikan NT (P<0,05). Hasil ini bekorelasi positif dengan parameter hematologi ikan mas transgenik (hematokrit, hemoglobin, dan aktivitas fagositik) yang menunjukkan hasil yang lebih baik dibandingkan ikan non-transgenik (Tabel 3). Status kesehatan yang lebih baik pada ikan mas transgenik diduga mempengaruhi kemampuan ikan dalam beradaptasi dengan lingkungan, sehingga dapat mengurangi nilai mortalitas selama pemeliharaan, baik itu akibat stres maupun serangan penyakit. Hasil yang sama juga dilaporkan oleh Kim et al. (2013) bahwa, ikan salmon transgenik GH memiliki status kesehatan dan sistem imun yang lebih baik, sehingga lebih tahan terhadap serangan penyakit. Wang et al. (2006) juga melaporkan bahwa ikan mas transgenik memiliki aktivitas lisozim, aktivitas serum bakterisida, leukosit dan aktivitas fagositik yang lebih tinggi. Bahkan Ling et al. (2009) melaporkan bahwa ikan mas transgenik lebih tahan terhadap infeksi Ichthyophthirius multifiliis dibandingkan ikan non-transgenik.
Peningkatan performa pertumbuhan dan tingkat kelangsungan hidup pada ikan mas transgenik (Tabel 1) dapat meningkatkan nilai produktivitas pada akhir pemeliharaan. Hal ini sangat menguntungkan bagi kegiatan akuakultur. Dengan demikian, budidaya ikan mas transgenik sangat berpeluang untuk dikembangkan, karena memiliki nilai produktivitas yang tinggi, lebih efisien dan menghasilkan limbah nitrogen yang lebih rendah.
4
SIMPULAN
Performa pertumbuhan benih ikan mas transgenik generasi ketiga lebih baik dan memiliki kandungan protein tubuh lebih tinggi, serta kandungan lemak tubuh lebih rendah.
DAFTAR PUSTAKA
Anderson DP, Siwicki AK. 1995. Basic hematology and serology for fish health programs. Diseases in Asian Aquaculture II. Pillipines (PH): Fish Health Section, Asian Fisheries Society. p 185-202.
16
Ariyanto D, Subagyo. 2004. Variabilitas genetik dan evaluasi heterosis pada persilangan antar galur dalam spesies ikan mas Cyprinus carpio. Zuriat. 15:118 – 124.
Chatakondi N, Lovell RT, Duncan PL, Hayat M, Chen TT, Powers DA, Weete JD, Cummis K, Dunham RA. 1995. Body composition of transgenic common carp
Cyprinus carpio containing rainbow trout growth hormone gene. Aquaculture. 138:99-109.
Cook JT, McNiven MA, Richardson GF, Sutterlin AM. 2000. Growth rate, body composition and feed digestibility conversion of growth-enhanced transgenic Atlantic salmon Salmo salar. Aquaculture. 188:15-32.
Debnanth S. 2010. A review on the physiology of insulin-like growth factor-1 (IGF-1) peptide in bony fishes and its phylogenetic correlation in 30 different taxa of 14 families of teleosts. Adv Environ Biol. 5:31-52.
Devlin RH, Biagi CA, Yesaki TY, Smailus DE, Byatt JC. 2001. Growth of domesticated transgenic fish. Nature. 409:781–782.
Devlin RH, D'Andrade M, Mitchell U, Carlo AB. 2004. Population effects of growth hormone transgenic coho salmon depend on food availability and genotype by environment interactions. PNAS. 25:9303–9308.
Dewi, RRSPS, Alimuddin, Sudrajat AO, Sumantadinata K. 2012. Efektivitas transfer dan ekspresi gen PhGH pada ikan patin siam Pangasianodon hypopthalmus. J Ris Akua. 7:2-2012.
Duan M, Zhang TL, Hu W, Guan B, Wang YP, Li ZJ. 2010. Increased mortality of growth-enhanced transgenic common carp Cyprinus carpio under short-term predation risk. J Appl Ichthyol. 26:908–912.
Duan M, Zhang T, Hu W, Li Z, Sundstrom LF, Zhu T, Zhong C, Zhu Z. 2011. Behavioral alterations in GH transgenic common carp may explain enhanced competitive feeding ability. Aquaculture. 317:175–181.
Effendie M. 1987. Biologi Perikanan. Bag.I Study or natural history. Fakultas Perikanan, Institut Pertanian Bogor, Bogor. 150 hal.
Faridah N. 2012. Introduksi dan ekspresi gen hormon pertumbuhan pada ikan mas transgenik. [Tesis]. Ilmu Akuakultur, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Fu C, Cui Y, Hung S.SO, Zhu Z. 1998. Growth and feed utilization by F4 human growth hormone transgenic carp fed diets with different protein levels. J Fish Biol. 53:115–129.
Fu C, Li D, Hu W, Wang Y, Zhu Z. 2007. Growth and energy budget of F2 „all -fish‟ growth hormone gene transgenic common carp. J Fish Biol. 70:347–361. Guan B, Wei H, Tanglin Z, Yaping W, Zuoyan Z. 2008. Metabolism traits of „all
-fish‟ growth hormone transgenic common carp Cyprinus carpio L. Aquaculture. 284:217–223.
Higgs DA, Sutton JN, Kim H, Oakes JD, Smith J, Biagi C, Rowshandeli M, Devlin RH. 2008. Influence of dietary concentrations of protein, lipid and carbohydrate on growth, protein and energy utilization, body composition, and plasma titres of growth hormone and insulin-like growth factor-1 in non-transgenic and growth hormone non-transgenic coho salmon Oncorhynchus kisutch
Walbaum. Aquaculture. 286:127–137.
17 Ighwela KA, Ahmad AB, Abol-Munafi AB. 2014. The selection of viscerosomatic and hepatosomatic indices for measurement and analysis of Oreochromis niloticus condition fed with varrying diatery maltoses levels. J Fauna Biol Stud. 1(3):18-20.
Jhingan E, Devlin RH, Iwama GK. 2003. Disease resistance, stress response and effects of triploidy in growth hormone transgenic coho salmon. J Fish Biol.
63:806–823.
Kim JH, Bulfry S, Devlin RH. 2013. Disease resistance and health parameters of growth-hormone transgenic and wild-type coho salmon, Oncorhynchus kisutch.
Fish Shellfish Immunol .34:1553-1559.
Kobayashi SI, Alimuddin, Morita T, Miwa M, Lu J, Endo M, Takeuchi T, Yoshizaki G. 2007. Transgenic Nile tilapia Oreochromis niloticus over-expressing growth hormone show reduced ammonia excretion. Aquaculture. 270:427-435.
Lee CG, Devlin RH, Farrell AP. 2003. Swimming performance, oxygen consumption and excess post-exercise oxygen consumption in adult transgenic and ocean-ranched coho salmon. J Fish Biol. 62:753–766.
Leggatt RA, Raven PA, Mommsen TP, Sakhrani D, Higgs D, Devlin RH. 2009. Growth hormone transgenesis influences carbohydrate, lipid and protein metabolism capacity for energy production in coho salmon Oncorhynchus kisutch. Comp Biochem Physiol B Biochem Mol Biol. 154:121–133.
Ling F, Luo Q, Wang J, Wang YP, Wang WB, Gong XN. 2009. Effects of the “all- fish” GH (growth hormone) transgene expression on resistance to
Ichthyophthirius multifiliis infections in common carp, Cyprinus carpio L.
Aquaculture .292:1–5.
Lu J, Li J, Furuya Y, Yoshizaki G, Sun H, Endo M, Haga Y, Satoh S, Takuchi T. 2009. Efficient productivity and lowered nitrogen and phosphorous discharge load from GH-transgenic tilapia Oreochromis niloticus under visual satiation feeding. Aquaculture. 293:241-247.
McKenzie DJ, Martinez R, Morales A, Acosta J, Morales R, Taylor EW. 2003. Effects of growth hormone transgenesis on metabolic rate, exercise performance and hypoxia tolerance in tilapia hybrids. J Fish Biol. 63:398–409. Moav B, Liu Z, Moav NL, Gross ML, Kapuscinski AR, Faras AJ, Guise. 1992.
Expression of heterologous genes in transgenic fish. In: Hew CL, Fletcher GL. Eds.Transgenic Fish. World Scientific, Singapore, pp. 120–141.
Nam YK, Cho YS, Cho HJ, Kim DS. 2002. Accelerated growth performance and stable germ-line transmission in androgenetically derived homozygous transgenic mud loach Misgurnus mizolepis.Aquaculture. 209:257– 270.
Norris DO. 1997. Vertebrate Endocrinology. Academic Press, San Diego, 634 pp. Panserat S, Biju SK, Jeanne F, Elisabeth PJ, Krista W, Robert HD. 2014. Glucose
metabolic gene expression in growth hormone transgenic coho salmon. Comp Biochem Physiol A Mol Integr Physiol. 170:38–45.
Pérez-Sanchez J. 2000. The involvement of growth hormone in growth regulation, energy homeostasis and immune function in the gilthead sea bream Sparus aurata: a short review. Fish Physiolog Biotechnol. 22:135–144.
18
transgenic Nile tilapia containing an exogenous piscine growth hormone gene.
J Fish Biol. 59:62–78.
Randall DJ, Tsui TK. 2002. Ammonia toxicity in fish. Mar Poll Bull. 45:17–23. Raven PA, Devlin RH, Higgs DA. 2006. Influence of dietary digestible energy
content on growth, protein and energy utilization and body composition of growth hormone transgenic and non-transgenic coho salmon Oncorhynchus kisutch. Aquaculture. 54:730–747.
Raven PA, Uh M, Sakhrani D, Beckman BR, Cooper K, Pinter J, Leder EH, Silverstein J, Devlin RH. 2008. Endocrine effects of growth hormone overexpression in transgenic coho salmon. Gen Comp Endocrinol. 159:26–37. Robin J, Jean-Pierre C, Anne H, Cyrille D, Dominique V. 2006. Off flavor
characterization and origin in French trout farming. Aquaculture. 260:128–138. Stevens ED, Wagner GN, Sutterlin AM. 1999. Gut morphology of GH transgenic
salmon. J Fish Biol. 55:517–526.
Stevens ED, Devlin RH. 2005. Gut size in GH-transgenic coho salmon is enhanced by both the GH transgene and increased food intake. J Fish Biol.
66:1633-1648.
Subasinghe R, Soto D, Jia J. 2009. Global aquaculture and its role in sustainable development. Rev in Aqua. 1: 2–9
Suprayudi MA, Setiawati M, Mokoginta I. 1994. Pengaruh rasio protein energi yang berbeda terhadap pertumbuhan ikan gurami Osphronemus goramy L. Bogor (ID): Institut Pertanian Bogor.
Takeuchi T. 1988. Laboratory work cehmical evauation of diatery nutriens. In: Watanabe T, 9ed). Fish Nutrition and Mariculture. Tokyo: Department of Aquatic Bioscience. Tokyo University of Fisheries. JCA, pp.179-226.
Venugopal T, Anathy V, Kirankumar S, Pandian TJ. 2004. Growth enhancement and food conversion efficiency of transgenic fish, Labeo rohita. J Exper Biol. 301A:477–490.
Wang WB, Wang YP, HU W, Li AH, Cai TZ, Zhu ZY, Wang JG. 2006. Effects of the “all-fish” growth hormone transgene expression on non-specific immune functions of common carp, Cyprinus carpio L. Aquaculture. 259:81–87.
Wedemeyer GA, Yasutake WT. 1977. Clinical method for the assessment of the effect of environmental stress on fish health. Tech Pap US Fish Wildl Serv.
Washington DC. 89 p.
Wu RSS. 1995. The environmental impact of marine fish culture: toward a sustainable future. Mar Pollut Bull. 31:159–166.
Yang SD, Liou CH, Liu FG. 2002. Effects of dietary protein level on growth performance, carcass composition and ammonia excretion in juvenile silver perch Bidyanus bidyanus. Aquaculture. 213:363-372.
Zbikowska, HM. 2003. Fish can be first–advances in fish transgenesis for commercial applications. Transgenic Res. 12:379–389.
Zhong C, Yanlong S, Yaping W, Tanglin Z, Ming D,Yongming L, Lanjie L, Zuoyan Z, Wei H. 2013. Increased food intake in growth hormone-transgenic common carp Cyprinus carpio L. may be mediated by upregulating Agouti-related protein (AgRP). Gen Comp Endocrinol.192:81–88.
Zhu Z, Xu K, Xie Y, Li G, He L. 1989. A model of transgenic fish. Science Sin.
19 Lampiran 1 Prosedur ekstraksi DNA dengan DNA purification kit (Puregene,
Minneapolis, USA)
Penghancuran sel (Cell lysis)
1. Sampel sirip ikan ditimbang sebanyak 10 – 20 mg, lalu dimasukkan ke dalam tabung mikro (1,5 mL).
2. Sebanyak 200 µL Cell Lysis Solution dan 1,5 µL Proteinase K dimasukkan ke dalam tabung mikro.
3. Tabung berisi suspensi kemudian diinkubasi pada suhu 55°C dalam
thermoshaker selama 6 jam atau hingga semua sel hancur/lysis. Eliminasi RNA
1. 1,5 µL RNase (4 mg/mL) dimasukkan ke dalam setiap tabung lalu diaduk dengan membolak-balikkan tabung sebanyak 25 kali. Kemudian diinkubasi pada suhu 37°C selama 60 menit.
2. Setelah inkubasi selesai, sampel didinginkan pada suhu ruang. Pengendapan Protein
1. 50 µL Protein Precipitation Solution dimasukkan ke dalam larutan sampel lalu dihomogenasi dengan vortex pada kecepatan tinggi selama 30 detik. 2. Sampel diinkubasi on ice selama 10 - 15 menit.
3. Kemudian sampel disentrifugasi pada kecepatan 13.000 rpm selama 10 menit hingga terbentuk endapan protein dan larutan yang mengandung DNA.
Pengendapan DNA
1. Larutan supernatan yang terbentuk dituangkan dengan hati-hati ke dalam tabung baru yang telah berisi 300 µL isopropanol 100%.
2. Tabung yang berisi larutan DNA ini kemudian diaduk dengan membolak-balikkan tabung sebanyak 50 kali hingga terlihat untaian pita DNA yang berwarna putih.
3. Kemudian tabung tersebut disentrifugasi dengan kecepatan 13.000 rpm selama 10 menit hingga terbentuk pelet DNA di dasar tabung.
4. Larutan supernatan dibuang.
5. 300 µL EtOH 70% dingin, kemudian dimasukkan ke dalam tabung yang berisi pelet DNA. Lalu tabung dibolak-balik beberapa kali untuk membilas sisa-sisa DNA yang berada di dinding tabung.
6. Tabung disentrifugasi pada kecepatan 13.000 rpm selama 10 menit.
7. Kemudian larutan etanol dibuang dengan hati-hati, lalu tabung dikeringkan di atas kertas tissue dan dibiarkan kering udara selama 30 menit.
8. Pelet DNA yang terbentuk dilarutkan kembali dengan menambahkan 20 µL
ion exchange water (IEW) steril ke dalam tabung.
20
Lampiran 2 Prosedur ekstraksi RNA total dan sintesis cDNA Ekstraksi RNA total
1. Hati ikan diambil secara aseptik, kemudian ditimbang sekitar 20-30 mg. 2. Sampel dimasukkan ke dalam tabung mikro yang sudah berisi 200 µL
larutan ISOGEN (on ice)
3. Jaringan digerus hingga hancur menggunakan grinder lalu ditambahkan ISOGEN hingga volumenya mencapai 800 µL
4. Tabung mikro yang berisi jaringan disimpan pada suhu ruang selama 5 menit hingga jaringan terlisis sempurna, lalu ditambahkan 200 µL kloroform.
5. Kemudian suspensi dihomogenasi menggunakan vortex selama 15 detik pada kecepatan sedang, lalu disimpan pada suhu ruang selama 2-3 menit. 6. Tabung mikro disentrifugasi dengan kecepatan 12.000 rpm selama 5 menit
dan supernatan yang terbentuk dimasukkan ke dalam tabung mikro baru yang telah berisi 400 µL isopropanol , dihomogenasi dan kemudian disimpan pada suhu ruang selama 5-10 menit.
7. Tabung mikro disentrifugasi dengan kecepatan 12.000 rpm pada suhu 4°C selama 15 menit.
8. Supernatan yang terbentuk dibuang, lalu ditambahkan 1 mL etanol 70% dingin, disentrifugasi dengan kecepatan 12.000 rpm pada suhu 4°C selama 15 menit.
9. Supernatan dibuang lalu dikering-udarakan.
10. Setelah kering, larutan DEPC ditambahkan sebanyak 50 µL. Kuantifikasi RNA
1. Sebanyak 1 µL larutan RNA dan 79 µL pelarut DEPC dimasukkan ke dalam tabung mikro (600 µL), kemudian dihomogenasi dengan vortex, larutan RNA yang digunakan adalah 80 kali pengenceran.
2. Alat Gene Quant dinyalakan, dan kuvet dikeluarkan dari tempat penyimpanan lalu dibilas dengan akuades.
3. Kalibrasi dilakukan dengan memasukkan 80 µL pelarut (DEPC) ke dalam kuvet. Kemudian kuvet dimasukkan ke dalam alat, lalu tekan tombol “set ref”, hasil pembacaan akan menunjukkan nilai absorbansi 0,000 , dilanjutkan dengan pengukuran konsentrasi RNA.
4. Kuvet yang akan digunakan, dibilas terlebih dahulu dengan akuades. Setelah itu larutan RNA yang akan diukur dimasukkan ke dalam kuvet sebanyak 80 µL.
5. Setelah tombol “sample” ditekan dan konsentrasi larutan sudah terbaca, kuvet dikeluarkan dan dibilas dengan akuades.
21
Sintesis cDNA
1. Sampel RNA dibuat dengan konsentrasi 3 µg/30 µL (30 µL = 3000 ng) 2. Sampel RNA dimasukkan ke dalam tabung mikro 600 µL yang telah
berisi DEPC sesuai hasil perhitungan.
3. Larutan dihomogenasi dengan vortex pelan (2-3 speed), kemudian dipanaskan pada suhu 65°C selama 10 menit.
4. Setelah pemanasan sampel disimpan on-ice selama 2 menit
5. Tube “ready-to-go-you-prime first-strand beads” (white tube) disiapkan, cek terlebih dahulu 2 bola putih dalam tube.
6. Sebanyak 30 µL RNA sampel dimasukkan ke dalam tabung mikro, kemudian ditambahkan 3 µL primer OligodT [1 µg/3 µL], larutan dibiarkan selama 1 menit.
7. Sampel dihomogenasi dengan vortex pelan (2-3 speed), kemudian diinkubasi pada suhu 37°C selama 60 menit.
22
Lampiran 3 Prosedur analisis proksimat sampel (Takeuchi 1988) A. Kadar Protein
Tahap Oksidasi
1. Sampel ditimbang sebanyak 0,5 gram dan dimasukkan ke dalam labu Kjeldahl.
2. Katalis (K2SO4+CuSO4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3 gram
dan dimasukkan ke dalam labu Kjeldahl.
3. 10 ml H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan kemudian labu
tersebut dipanaskan dalam rak oksidasi/digestion pada suhu 400°C selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening.
4. Larutan didinginkan lalu ditambahkan air destilasi 100 ml. Kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 ml. Larutan sampel siap didestilasi.
Tahap Destilasi
1. Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan akuades untuk menghindari kontaminasi oleh amonia dari luar. Kemudian dididihkan selama 10 menit.
2. Erlenmeyer diisi 10 ml H2SO4 0.05 N dan ditambahkan 2 tetes indikator
methyl red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3. 5 mL larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan akuades dan ditambahkan 10 ml NaOH 30%, lalu dimasukkan melalui corong tersebut dan ditutup.
4. Campuran alkalin dalam labu destilasi disuling menjadi uap air selama 10 menit terjadi pengembunan pada kondensor.
5. Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu, di atas permukaan larutan. Kondensor dibilas dengan akuades selama 1-2 menit.
Tahap Titrasi
1. Larutan hasil destilasi ditritasi dengan larutan NaOH 0.05 N. 2. Volume hasil titrasi dicatat.
3. Prosedur yang sama juga dilakukan pada blanko.
Kadar Protein (%) = 0.0007 * x (Vb – Vs) x 6.25 ** x 20 x 100
Keterangan : Vb = Volume hasil titrasi blanko (ml) Vs = Volume hasil titrasi sampel (ml) S = Bobot sampel (gram)
23
B. Kadar Lemak (Metode Folch)
1. Labu silinder dioven terlebih dahulu pada suhu 110ºC selama 1 jam, didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1).
2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas
homogenize dan ditambahkan larutan kloroform / methanol (20xA), sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenizer selama 5 menit setelah itu disaring dengan vacuum pump.
4. Sampel yang telah disaring tersebut dimasukkan dalam labu pemisah yang telah diberi larutan MgCl2 0,03 N(0,2xC), kemudian dikocok dengan kuat
minimal selama 1 menit kemudian ditutup dengan aluminium foil dan didiamkan selama 1 malam.
5. Lapisan bawah yang terdapat dalam labu pemisah disaring ke dalam labu silinder kemudian dievaporator sampai kering. Sisa kloroform/metanol yang terdapat dalam labu ditiup dengan menggunakan vacuum setelah itu ditimbang (X2)
Kadar Lemak (%) = X2 –X1 x 100
C. Kadar Air
1. Cawan dipanaskan dalam oven pada suhu 100°C selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipanaskan dalam oven pada suhu 110ºC selama 4 jam kemudian dimasukkan ke dalam desikator selam 30 menit dan ditimbang (X2)
Kadar Air (%) = (X1+A)-X2 x 100
D. Kadar Abu
1. Cawan dipanaskan dalam oven pada suhu 100ºC selama 1 jam dan kemudian dimasukkan dalam dessikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipanaskan dalam tanur pada suhu 600°C sampai menjadi abu kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2)
Kadar Abu (%) = X2 –X1 x 100
E. Kadar Serat Kasar
24
2. Sampel ditimbang sebanyak 0,5 gram (A) dimasukkan ke dalam erlenmeyer 250 ml
3. H2SO4 0,3 N sebanyak 50 ml ditambahkan ke dalam Erlenmeyer kemudian
dipanaskan di atas pembakar Bunsen selama 30 menit. Setelah itu, NaOH 1,5 N sebanyak 25 ml ditambahkan ke dalam Erlenmeyer dan dipanaskan kembali selama 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. Larutan dan bahan yang ada pada corong Buchner kemudian dibilas secara
berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0.3 N, 50 ml air panas,
dan 25 ml aseton.
6. Kertas saring dan isinya dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven 105-110ºC selama 1 jam kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2)
7. Setelah itu dipanaskan dalam tanur 600°C hingga berwarna putih atau menjadi abu (sekitar 4 jam). Kemudian dimasukkan dalam oven 105-110ºC selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimabang (X3)
25 Lampiran 4 Komposisi proksimat pakan perlakuan
Pakan Komersial
Protein (%) Lemak (%) Kadar Abu (%)
Serat Kasar (%)
BETN (%)
36,23 5,97 7,56 5,23 45,01
26
Lampiran 5 Hasil analisis statistik pertambahan bobot dengan independent samples t-test (SPSS 16.0)
Group Statistics
Perlakuan N Mean Std. Deviation Std. Error Mean
Pertambahan Bobot
1 3 9.2267 1.71448 0.98985
2 3 6.2133 0.71347 0.41192
Independent Samples Test
Levene's Test for
Equality of Variances t-test for Equality of Means
F Sig. t df Sig. (2-tailed) Mean
Difference
Std. Error
Difference
95% Confidence Interval of
the Difference
Lower Upper
Pertambahan Bobot
Equal variances
assumed
2.039 0.227 2.811 4.000 0.048 3.01333 1.07214 0.03659 5.99008
Equal variances not
assumed
27 Lampiran 6 Hasil analisis statistik pertambahan panjang dengan independent samples t-test (SPSS 16.0)
Group Statistics
Perlakuan N Mean Std. Deviation Std. Error Mean
Pertambahan Panjang
1 3 2.3667 0.55076 0.31798
2 3 1.6667 0.20817 0.12019
Independent Samples Test
Levene's Test for
Equality of Variances t-test for Equality of Means
F Sig. t df Sig. (2-tailed) Mean
Difference
Std. Error
Difference
95% Confidence Interval of
the Difference
Lower Upper
Pertambahan Panjang
Equal variances
assumed
1.538 0.283 2.059 4.000 0.109 0.70000 0.33993 -0.24381 1.64381
Equal variances not
assumed
28
Lampiran 7 Hasil analisis statistik jumlah konsumsi pakan dengan independent samples t-test (SPSS 16.0)
Group Statistics
Perlakuan N Mean Std. Deviation Std. Error Mean
Jumlah Konsumsi Pakan
1 3 417.05 29.3057 16.91965
2 3 301.18 39.19453 22.62897
Independent Samples Test
Levene's Test for
Equality of Variances t-test for Equality of Means
F Sig. t df Sig. (2-tailed) Mean
Difference
Std. Error
Difference
95% Confidence Interval of
the Difference
Lower Upper
Jumlah Konsumsi
Pakan
Equal variances
assumed
0.138 0.729 4.101 4.000 0.015 115.87667 28.25500 37.42820 194.32513
Equal variances not
assumed
29 Lampiran 8 Hasil analisis statistik laju pertumbuhan spesifik dengan independent samples t-test (SPSS 16.0)
Group Statistics
Perlakuan N Mean Std. Deviation Std. Error Mean
Laju Pertumbuhan Spesifik
1 3 3.2897 0.27427 0.15835
2 3 2.733 0.15442 0.08915
Independent Samples Test
Levene's Test for
Equality of Variances t-test for Equality of Means
F Sig. t df Sig. (2-tailed) Mean
Difference
Std. Error
Difference
95% Confidence Interval of
the Difference
Lower Upper
Laju Pertumbuhan
Spesifik
Equal variances
assumed
1.180 0.338 3.063 4.000 0.038 0.55667 0.18172 0.05213 1.06121
Equal variances not
assumed
30
Lampiran 9 Hasil analisis statistik kelangsungan hidup dengan independent samples t-test (SPSS 16.0)
Group Statistics
Perlakuan N Mean Std. Deviation Std. Error Mean
Kelangsungan Hidup
1 3 89.3333 4.6188 2.66667
2 3 65.3333 4.6188 2.66667
Independent Samples Test
Levene's Test for
Equality of Variances t-test for Equality of Means
F Sig. t df Sig. (2-tailed) Mean
Difference
Std. Error
Difference
95% Confidence Interval of
the Difference
Lower Upper
Kelangsungan Hidup
Equal variances
assumed
0.000 1.000 6.364 4.000 0.003 24.00000 3.77124 13.52937 34.47063
Equal variances not
assumed
31 Lampiran 10 Hasil analisis statistik efisiensi pakan dengan independent samples t-test (SPSS 16.0)
Group Statistics
Perlakuan N Mean Std. Deviation Std. Error Mean
Kelangsungan Hidup
1 3 51.071 4.029 2.32614
2 3 39.3833 4.85611 2.80368
Independent Samples Test
Levene's Test for
Equality of Variances t-test for Equality of Means
F Sig. t df Sig. (2-tailed) Mean
Difference
Std. Error
Difference
95% Confidence Interval of
the Difference
Lower Upper
Kelangsungan Hidup
Equal variances
assumed
0.059 0.819 3.208 4.000 0.033 11.68767 3.64301 1.57304 21.80229
Equal variances not
assumed