IDENTIFIKASI BAKTERI ASAM LAKTAT DOMINAN
SELAMA FERMENTASI TEMPE DAN EVALUASI
POTENSINYA SEBAGAI PROBIOTIK
KARTIKA SARI TOUW
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Identifikasi Bakteri Asam Laktat Dominan Selama Fermentasi Tempe dan Evaluasi Potensinya Sebagai Proiotik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus2014 Kartika Sari Touw NIM F24100092
ABSTRAK
KARTIKA SARI TOUW. Identifikasi Bakteri Asam Laktat Dominan Selama Fermentasi Tempe dan Evaluasi Potensinya Sebagai Probiotik. Dibimbing oleh LILIS NURAIDA dan SULIANTARI.
ABSTRACT
KARTIKA SARI TOUW. Identification of Dominant Lactic Acid Bacteria During Tempeh Fermentation and Evaluation of their potential as a probiotic. Supervised by LILIS NURAIDA and SULIANTARI.
Tempeh is a traditional Indonesian food made from soybean. In the process of making tempeh, besides Rhizopus sp., yeasts and lactic acid bacteria (LAB) present during tempeh fermentation process. This study aims to know the dominant LAB profile during tempeh fermentation that were made by two industrial household with different methods. SDBR tempeh made with boiling soybean once, and WJB tempeh made by boiling soybean twice, and also to determine their potential to be probiotic. LAB culture isolated from laru of tempeh, after soaking, after the second boiling (tempeh WJB), and fermented tempeh hours 0, 12, 24, 48, and 72. Based on the results of the initial identification, LAB dominant in tempeh SDBR is rod heterofermentatif, whereas LAB dominant at WJB tempeh is coccus homofermentatif, but at the 12th hour of fermentation dominated by rod heterofermentatif and at the 24th hour rod homofermentatif dominated. The results of identification using the API 50 CH kit showed that the dominant LAB during fermentation of tempeh SDBR is Lactobacillus fermentum, but at the end of the fermentation of Lactobacillus plantarum 1 also dominate. LAB dominant at WJB tempe were various at each sampling point, at the beginning of fermentation was dominated by Pediococcus pentosaceus1 and Pediococcus pentosaceus 2, at 12, 24, 48 and 72 hour of fermentation, respectively dominated by Weissella confusa, Lactobacillus plantarum 1, Lactobacillus plantarum 2, Lactobacillus delbrueckii delbrueckii ssp, and Pediococcus pentosaceus 2. Differences LAB profiles in both tempe production is presumably due differences in the method of making tempeh that interacts with environmental sanitation production. LAB isolate Lactobacillus fermentum has the resilience to acid (pH 2.0) and bile salts (oxgall 0.5%), so Lactobacillus fermentum has potential as probiotic.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
IDENTIFIKASI BAKTERI ASAM LAKTAT DOMINAN
SELAMA FERMENTASI TEMPE DAN EVALUASI
POTENSINYA SEBAGAI PROBIOTIK
KARTIKA SARI TOUW
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala rahmat dan karunia-Nya sehingga skripsi ini dapat diselesaikan. Tema yang dipilih dalam penelitian ini adalah mikrobiologi pangan, dengan judul Identifikasi Bakteri Asam Laktat Dominan Selama Fermentasi Tempe dan Evaluasi Potensinya Sebagai Probiotik. Penelitian ini dilaksanakan sejak bulan November 2013 hingga Juli 2014.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Lilis Nuraida, MSc dan Ibu Dr Dra Suliantari, MS selaku dosen pembimbing skripsi, serta Ibu Dr Elvira Syamsir, STp, MSi atas kesediaannya menjadi dosen penguji. Penghargaan penulis sampaikan kepada Direktorat Jenderal Pendidikan Tinggi melalui Hibah Kompetensi atas nama Prof Dr Ir Lilis Nuraida, MSc pada tahun 2013-2014, yang telah mendanai penelitian penulis. Terima kasih kepada Ibu Ari dan Bapak Yerris selaku teknisi laboratorium mikrobiologi SEAFAST Center, staff Departemen Ilmu dan Teknologi Pangan, dan staff SEAFAST Center IPB yang telah membantu penulis selama penelitian. Ungkapan terima kasih tak lupa penulis sampaikan kepada keluarga tercinta, Papa (Ir. Diederik Willem Touw) (alm.), Mama (Larsih Purwanti), Adik (Randa Prabowo Touw), serta seluruh keluarga besar, atas segala do’a, dukungan, dan kasih sayangnya. Terima kasih juga kepada sahabat-sahabat Aulia Frisca, Yessy Niarty, Qonita Muhlisa, Fitri S. Ginting, dan Cony A. Putri, dan teman-teman seperjuangan ITP angkatan 47, serta Hari Prasetyo yang senantiasa selalu memberi do’a, motivasi, dan inspirasi untuk penulis, sehingga penulis dapat menyelesaikan tugas akhir dengan baik.
Semoga skripsi ini bermanfaat untuk perkembangan ilmu pengetahuan dan teknologi di Indonesia.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
METODE 3
Bahan 3
Alat 3
Tahap Penelitian 4
Identifikasi Morfologi, Fisiologi, dan Biokimia Bakteri Dominan Isolat
Tempe SDBR dan WJB 4
Identifikasi Sifat Biokimia Isolat BAL Terpilih dengan Kit API 50 CH 5 Pengujian Ketahanan Isolat BAL terhadap Asam dan Garam Empedu 5
HASIL DAN PEMBAHASAN 6
Identifikasi Morfologi, Fisiologi, dan Biokimia Bakteri Domninan Isolat
Tempe SDBR dan WJB 6
Identifikasi Sifat Biokimia Isolat BAL Terpilih dengan Kit API 50 CH 9 Kemampuan Isolat BAL Menfermentasi Oligosakarida 13 Ketahanan Isolat BAL terhadap Asam dan Garam Empedu 15
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 17
DAFTAR PUSTAKA 17
DAFTAR TABEL
1 Jumlah isolat bedasarkan bentuk sel dan hasil uji produksi CO2
dari gula isolat tempe SDBR 7
2 Jumlah isolat bedasarkan bentuk sel dan hasil uji produksi CO2
dari gula isolat tempe WJB 7
3 Hasil identifikasi isolat BAL SDBR dengan kit API 50 CH 9 4 Hasil identifikasi iosolat BAL WJB dengankit API 50 CH 10 5 Keberadaan BAL selama fermentasi tempe SDBR dan WJB 11 6 Isolat BAL SDBR dan WJB yang dapat menfermentasi oligosakarida 14
DAFTAR GAMBAR
1 Pengaruh asam (pH 2.0) dan garam empedu (oxgall 0.5%)
terhadap pertumbuhan isolat BAL 15
PENDAHULUAN
Latar Belakang
Tempe merupakan salah satu makanan tradisional khas Indonesia yang dihasilkan melalui proses fermentasi dengan mikroorganisme utamanya kapang golongan Rhizopus sp. (Cahyadi 2009). Tempe dapat dibuat dari berbagai macam bahan, namun kedelai merupakan bahan baku yang paling sering digunakan di Indonesia, khususnya di daerah Jawa. Menurut Sarwono (2010), sebagian besar kedelai di Indonesia dikonsumsi dalam bentuk tempe, yaitu 57%, bahkan Indonesia merupakan negara penghasil tempe terbesar di dunia. Hanya sekitar 38% kedelai di Indonesia dikonsumsi dalam bentuk tahu, dan sisanya dikonsumsi dalam bentuk tauco, kecap, kembang tahu, dan lain-lain. Umumnya masyarakat Indonesia mengonsumsi tempe sebagai makanan pendamping. Rata-rata konsumsi tempe per kapita per tahun masyarakat Indonesia pada tahun 2013 mencapai 7.09 kg (Deptan 2013). Tahap pembuatan tempe dimulai dari penyortiran biji kedelai, pencucian pertama, perebusan pertama, perendaman, pengupasan kulit, pencucian kedua, perebusan kedua, penirisan dan pendinginan, pelaruan, pembungkusan, pemeraman, dan tempe segar (Santoso 1993). Tempe umumnya diproduksi dalam skala kecil oleh industri rumah tangga dengan cara yang tradisional. Produksi tempe secara tradisional dengan sanitasi yang kurang baik dan metode pembuatan tempe yang berbeda antar pengrajin tempe menyebabkan mutu dan keamanan tempe yang diproduksi juga berbeda. Padahal dalam pemenuhan kebutuhan makanan bergizi bagi rakyat Indonesia, tempe memiliki potensi dan manfaat yang besar karena tempe merupakan sumber protein yang aman, murah, dan daya cernanya tinggi. Tempe kaya serat pangan, protein, mineral, serta vitamin B, seperti riboflavin, niasin, biotin, asam pantotenat, dan vitamin B6 (Cahyadi 2009). Khamir dan BAL turut hadir dalam proses fermentasi tempe, selain kapang Rhizopus sp. (Dewi dan‘Aziz 2011). Menurut Efriwati et al. (2013), BAL pada tempe sudah ada sejak awal tahap fermentasi tempe, bahkan jumlahnya maksimum saat produksi tempe segar. Populasi BAL pada tempe bervariasi di berbagai tahap proses fermentasi tempe dan jumlahnya tergantung pada tahap pembuatan tempe yang digunakan. BAL memiliki peran besar dalam fermentasi tempe karena keberadaannya dalam fermentasi tempe mempengaruhi kualitas tempe yang dihasilkan, seperti pada saat perendaman, pertumbuhan BAL meningkat tajam menyebabkan terjadinya penurunan pH dalam biji menjadi sekitar 4.5-5.3 (Hidayat et al. 2006). Berdasarkan penelitian Nuraida et al. (2008) total BAL air rendaman pada hari ke-1 sebesar 1.2 x 107 cfu mL-1 dengan pH 4.84. Efriwati et al. (2013) juga menyatakan bahwa total BAL meningkat tajam setelah 18 jam perendaman dan mencapai lebih dari 6 log cfu g-1. Penurunan pH tersebut menyebabkan bakteri-bakteri kontaminan yang bersifat pembusuk terhambat, namun tidak menghambat pertumbuhan kapang Rhizopus sp. Apabila proses pengasaman tidak dilakukan, maka tempe yang diproduksi memiliki resiko tinggi terkontaminasi bakteri penyebab penyakit (Hidayat et al. 2006).
2
Citrobacter diversus, Enterobacter agglomerans, Enterobacter cloacae, Klebsiella pneumonia, dan Klebsiella ozaenae terhambat pertumbuhannya selama perendaman kedelai. Pada tempe Empang (EMP) air rendaman kedelai mengandung Enterobacteria dalam jumlah tinggi dibanding air rendaman kedelai pada proses Warung Jambu (WJB). Pada tempe segar EMP juga mengandung jumlah Enterobacteria lebih tinggi dibanding jumlah Enterobacteria pada tempe segar WJB. Tempe WJB diproduksi dengan merebus kembali kedelai yang sudah direndam, sebelum inokulasi. Jenis Enterobacteria pada tempe EMP adalah Acetobacter indonesiensis, Klebsiella pneumoniae, Bacillus subtilis, dan Flavobacterium sp., sedangkan pada tempe WJB, terdapat jenis Enterobacteria,
yaitu Klebsiella sp., Brevundimonas sp., Bacillus sp., Pseudomonas putida, dan
Acinetobacter sp. Bacillus (Barus et al. 2008). Menurut Seumahu et al. (2013), tempe WJB diproduksi dalam skala kecil, sehingga lebih menerapkan proses pengolahan pada lingkungan yang lebih bersih. Seumahu et al. (2013) meneliti bahwa bakteri yang ada tempe EMP didominasi oleh Acetobacter dan Klebsiella.
Kapang sebagai mikroba utama dalam fermentasi tempe memiliki aktivitas proteolitik menyebabkan adanya deaminasi dan menghasilkan amonia. Amonia tersebut menyebabkan pH naik hingga di atas pH 7.0. Tingginya kadar ammonia dapat menghambat pertumbuhan kapang. Adanya proses fermentasi oleh BAL pada saat perendaman dapat menurunkan pH awal sehingga waktu fermentasi oleh kapang lebih lama (Steinkraus 1995). Pentingnya peranan BAL menyebabkan beberapa produsen tempe menambahkan kedelai dengan BAL pada saat perendaman untuk meningkatkan komposisi mikroba produk akhir (Nout and Kiers 2005). Penggunaan mikroorganisme yang telah diisolasi dan dikarakterisasi dapat menjaga proses fermentasi terkontrol, sehingga produk yang dihasilkan lebih stabil dan sesuai dengan karakteristik yang diinginkan. Tujuan lain penggunaan starter inokulum untuk meningkatkan rasa, aroma, aktivitas proteolitik, aktivitas lipolitik, dan penghambatan mikroba yang tidak diinginkan (Giraffa 2004).
3 aktivitas hidrolase garam empedu. BAL perlu dievaluasi terhadap persyaratannya karena tidak semua BAL bersifat probiotik. Contoh isolat BAL dari hasil fermentasi yang berpotensi sebagai probiotik adalah L. casei yang diisolasi dari sawi asin oleh Halim dan Zubaidah (2013). Sunaryato dan Marwoto (2012) juga mengisolasi L. plantarum dari dadih susu kerbau yang berpotensi sebagai probiotik.
Tujuan Penelitian
Tujuan dari penelitian ini untuk mengetahui profil bakteri asam laktat dominan pada laru dan berbagai tahap produksi tempe, yaitu laru tempe, setelah perendaman kedelai, setelah perebusan kedua (WJB), fermentasi tempe jam ke-0, 12, 24, 48, dan 72, serta mengetahui potensinya sebagai probiotik. Proses produksi tempe SDBR menerapkan satu kali perebusan sebelum perendaman, sedangkan proses produksi tempe WJB dilakukan perebusan kembali setelah perendaman, sebelum inokulasi.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai perbedaan profil bakteri asam laktat yang dominan selama fermentasi tempe yang dibuat oleh industri rumah tangga tempe tradisional SDBR dan WJB, serta informasi mengenai potensi isolat BAL pada kedua tempe tersebut sebagai probiotik.
METODE
Bahan
Bahan-bahan yang digunakan adalah isolat kultur mikroba yang diisolasi dari berbagai tahapan fermentasi, yaitu tempe SBDR 76 isolat dan tempe WJB 66 isolat koleksi SEAFAST center, media MRSA (de Man Rogosa and Sharpe Agar), MRSB (de Man Rogosa and Sharpe Broth), NA (Nutrient Agar), kit API 50 CH, akuades, minyak imersi, susu skim, yeast extract, glukosa, HCl, NaOH, H2O2 3%, pewarna kristal violet, iodin, alkohol 90%, garam oxgall, Phosphate Buffer Saline (PBS), parafin cair, dan safranin.
Alat
4
Tahap Penelitian
Penelitian ini terdiri dari 3 tahap, yaitu 1) identifikasi morfologi, fisiologi, dan biokimia bakteri yang dominan pada berbagai tahap fermentasi tempe SDBR dan WJB; 2) identifikasi menggunakan kit API 50 CH dengan seleksi isolat BAL berdasarkan aktivitas antimikroba terbesar berdasarkan penelitian terdahulu oleh Nuraida (2014) (belum dipublikasikan); 3) mengevaluasi potensi probiotik isolat BAL yang telah diidentifikasi dan mewakili masing-masing spesiesnya, dengan menguji ketahanannya terhadap asam (pH 2.0) dan garam empedu (oxgall 0.5%). Identifikasi Morfologi, Fisiologi, dan Biokimia Bakteri Dominan Isolat Tempe SDBR dan WJB
Identifikasi bakteri asam laktat dilakukan dengan mengamati karakterisitik morfologi, fisiologis, dan biokimia dari kultur isolat bakteri. Uji morfologi meliputi uji pewarnaan gram dibawah mikroskop, uji fisiologis dan biokimia meliputi uji katalase (Pisol et al. 2013), dan uji biokimia lainnya dengan uji produksi CO2 dari glukosa (Wikandari et al. 2012). Kultur isolat tempe SDBR berjumlah 76 isolat, sedangkan kultur isolat tempe WJB berjumlah 66 isolat. Semua kultur isolat tersebut diidentifikasi bentuk, hasil pewarnaan gram, dan sifatnya dalam menfermentasi gula, yaitu heteroferfmentatif atau homofermentatif.
Pewarnaan Gram. Tahap awal identifikasi morfologi bakteri asam laktat dilakukan dengan pewarnaan gram (Nikita and Hemangi 2012). Pengamatannya dilakukan menggunakan mikroskop cahaya dengan lensa objektif minyak imersi, perbesaran 1000x. Tahapan yang dilakukan adalah sebanyak satu loop bakteri yang akan diamati diambil, kemudian diletakkan diatas kaca objek dan diberi sedikit akuades steril. Selanjutnya kaca objek tersebut difiksasi diatas api bunsen dan biarkan dingin. Setelah itu kaca objek ditetesi kristal violet sebagai pewarna utama, tunggu hingga 10-30 detik. Setelah itu kristal violet dicuci dengan air aquades dan hilangkan kelebihannya. Untuk mengeringkannya dapat juga dilakukan dengan menempelkan kertas serap. Kaca objek ditetesi iodine untuk meningkatkan afinitas pewarna utama yaitu kristal violet, biarkan sekitar 2 menit lamanya, kemudian kembali dibilas dengan aquades. Setelah itu kaca objek ditetesi dengan alkohol selama 10 detik, ulangi langkah ini hingga pewarna kristal violet tidak mengalir lagi ketika ditetesi alkohol. Kaca objek kemudian dibilas kembali dengan aquades. Kemudian kaca objek ditetesi dengan pewarna safranin, lalu diamkan salama 30 detik. Setelah itu, kembali dibilas aquades dan dikeringkan dengan kertas serap. Terakhir, kaca objek dapat diamati dengan menggunakan mikroskop perbesaran 1000x yang telah diolesi minyak imersi sebelumnya.
Uji Katalase (Nuryady et al. 2013). Bakteri asam laktat umumnya bersifat
5 Uji Produksi CO2 dari Gula (Pisol et al. 2013). Kultur isolat yang
memiliki ciri-ciri seperti BAL, yaitu gram positif dalam pewarnaan gram dan katalase negatif akan diidentifikasi lanjut produksi CO2 dari fermentasi gula. Media yang digunakan dalam uji ini adalah Gibson’s semi solid yang dibuat sendiri (Harrigan 1998). Kultur isolat yang telah diinokulasi ke media MRSB selama 24 jam, dipindahkan sebanyak 0.5 mL ke media Gibson’s semi solid, lalu divortex. Setelah beberapa saat kemudian NA sebagai cover dituangkan ke dalam media Gibson’s semi solid yang telah diinokulasikan kultur isolat sebanyak 1 mL. Kemudian dilakukan inkubasi selama 2-5 hari pada suhu 30 ⁰C. BAL jenis heterofermentatif ditandai dengan terangkatnya NA cover atau pecahnya media gibson’s semi solid, sedangkan BAL jenis homofermentatif tidak.
Identifikasi Sifat Biokimia Isolat BAL Terpilih dengan Kit API 50 CH
Identifikasi dengan API dilakukan berdasarkan petunjuk pengunaan kit API 50 CH. API 50 CH terdiri atas 50 cupule yang masing-masing cupulenya mengandung berbagai jenis turunan karbohidrat, seperti galaktosa, glukosa, fruktosa, manosa, dan lain-lain. Kultur bakteri yang diinokulasikan ke dalam kit API 50 CH akan menfermentasi gula-gula tertentu, menghasilkan asam-asam organik. Adanya asam akan menurunkan pH dan merubah warna media 50 CHL dari ungu menjadi kuning yang mengandung indikator pH (BioMérieux 2007).
BAL yang diidentifikasi pada tahap sebelumnya diambil beberapa isolat sebagai contoh untuk diidentifikasi dengan API 50 CH. BAL dipilih berdasarkan aktivitas antimikroba terhadap EPEC yang terbesar. BAL terpilih kemudian ditumbuhkan pada medium MRSA dan diinkubasi pada suhu 30 ⁰C selama 24 jam. Kemudian kultur yang telah tumbuh disuspensi ke dalam medium API 50 CHL untuk Lactobacillus spp. dan dihomogenisasi. Sekitar 8 mL air dialirkan ke dalam baki inkubasi kemudian gallery diletakkan pada baki yang berisi air steril sebagai pelembab. Media 50 CHL yang telah diinokulasi dengan kultur BAL kemudian dipipet ke masing-masing cupule dan ditutup dengan parafin cair steril untuk menciptakan suasana anaerob. Selanjutnya baki diinkubasi pada suhu 30 ⁰C selama 2 hari. Hasil dari reaksi biokimia tersebut diamati secara visual dan dianalisis menggunakan software APIwebTM API 50 CHLV5.1 (www. apiweb.biomerieux.com). Kemampuan BAL untuk menfermentasi oligosakarida rafinosa dan inulin dapat diamati pada kit API 50 CH. Hasil positif apabila warna cupule yang berisi rafinosa dan inulin berubah warna dari ungu ke kuning.
Pengujian Ketahanan Isolat BAL terhadap Asam dan Garam Empedu
Uji Ketahanan terhadap pH 2.0 (Nuraida et al. 2011). Pengujian ini
6
Uji Ketahanan terhadap Garam Empedu (Nuraida et al. 2011).
Konsentrasi garam yang digunakan 0.5% sesuai dengan konsentrasi fisiologis garam empedu didalam usus duodenum. Sebanyak 0.1 mL isolat kultur BAL hasil identifikasi API 50 CHdalam MRSB berumur 24 jam dimasukkan ke dalam media 10 mL MRSB sebagai kontrol, dan 10 mL MRSB yang mengandung garam oxgall 0.5% diinkubasi pada suhu 37 ⁰C selama 5 jam. Jumlah BAL dihitung dengan metode hitungan cawan menggunakan medium MRSA, yang diinkubasi pada suhu 37 ⁰C selama 48 jam. Ketahanan BAL terhadap garam empedu dihitung berdasarkan selisih unit log jumlah koloni yang tumbuh pada kontrol dengan perlakuan. Semakin kecil selisihnya, maka semakin tahan kultur BAL tersebut terhadap garam empedu.
HASIL DAN PEMBAHASAN
Identifikasi Morfologi, Fisiologi, dan Biokimia Bakteri Domninan Isolat Tempe SDBR dan WJB
Bakteri asam laktat memiliki ciri-ciri gram positif, tidak membentuk spora, katalase negatif, tidak memiliki sitokrom, bersifat anaerob, toleran terhadap asam, dan menghasilkan asam laktat sebagai produk akhir fermentasinya terhadap gula. Identifikasi awal isolat BAL terdiri atas pewarnaan gram, reaksi katalase, dan fermentasi karbohidrat (Hayes 1995). Bakteri dapat dikelompokkan menjadi dua grup berdasarkan pewarnaan gram, dimana perbedaan tersebut didasarkan pada struktur dinding selnya. Bakteri gram positif dapat mempertahankan warna kristal violet sedangkan bakteri gram negatif tidak mampu mempertahankan warna ungu setelah pemberian alkohol. Kultur bakteri yang memiliki ciri-ciri BAL, yaitu gram positif dan katalase negatif, akan di uji produksi CO2 dari gula. Terdapat dua jenis jalur fermentasi bakteri asam laktat, yaitu homofermentatif dan heterofermentatif. BAL jenis homofermentatif menghasilkan sebagian besar asam laktat (>85%), sedangkan BAL jenis heterofermentatif menghasilkan etanol dan CO2 selain asam laktat (Dennis 2003).
Hasil identifikasi awal diperoleh 67 isolat SDBR diketahui sebagai gram positif dan katalase negatif, sedangkan pada tempe WJB diperoleh 59 isolat yang merupakan gram positif dan katalase negatif. Hasil uji produksi CO2 dari glukosa pada bakteri asam laktat yang diisolasi dari tempe SDBR dan WJB pada laru yang digunakan untuk fermentasi tempe SDBR, pada saat setelah perendaman, dan pada fermentasi tempe jam ke-0, 12, 24, 48, dan 72 dapat dilihat pada Tabel 1 dan Tabel 2.
7 Tabel 1 Jumlah sel bedasarkan bentuk sel dan hasil uji produksi CO2 dari gula
isolat tempe SDBR
Kondisi Proses Jumlah BAL (Buah)
A B C D E F G H
Laru 1 10 - - - -
Setelah perendaman - - 3 - - - 5 -
Fermentasi jam ke-0 - - 5 - 3 1 - -
Fermentasi jam ke-12 - - 7 - 5 - - -
Fermentasi jam ke-24 - - 5 - 2 - - -
Fermentasi jam ke-48 - - 8 - 2 - - -
Fermentasi jam ke-72 - - 2 3 4 1 - -
Keterangan :
A: kokus heterofermentatif E: batang panjang heterofermentatif B: kokus homo homofermentatif F: batang panjang homofermentatif C: batang pendek heterofermentatif G: Oval homofermentatif
D: batang pendek homofermentatif H: Oval heterofermentatif
Tabel 2 Jumlah Isolat bedasarkan bentuk sel dan hasil uji produksi CO2 dari gula isolat tempe WJB
Kondisi Proses Jumlah BAL (Buah)
A B C D E F G H
Setelah Perendaman 1 7 2 - - - - -
Fermentasi jam ke-0 1 8 - - - -
Fermentasi jam ke-12 1 - 12 - - - - -
Fermentasi jam ke-24 1 - - 10 - - - -
Fermentasi jam ke-48 1 3 - - 1 2 - -
Fermentasi jam ke-72 - 9 - - - -
Keterangan:
A: kokus heterofermentatif E: batang panjang heterofermentatif B: kokus homo homofermentatif F: batang panjang homofermentatif C: batang pendek heterofermentatif G: Oval homofermentatif
D: batang pendek homofermentatif H: Oval heterofermentatif
8
tersebut menandakan adanya suksesi dan dinamika jenis BAL selama fermentasi tempe. Selain itu, dalam tempe WJB tidak terdapat isolat BAL setelah perebusan kedua dan di larunya, diduga perebusan kedua menyebabkan BAL yang berasal dari perendaman mati. Penanambahan laru Raprima dari LIPI di kedelai WJB pun tidak menambah jumlah BAL karena laru Raprima mengandung lebih sedikit kontaminan (Lusiawati 2013). Tempe SDBR menggunakan laru Raprima yang dikulturkan kembali di onggok, sehingga diduga onggok berkontribusi pada keberadaan BAL (Nurdini et al. 2013) (belum dipublikasi). Pada proses produksi tempe SDBR, baik setelah perendaman hingga fermentasi ke-72 jam, isolat BAL memiliki bentuk yang serupa, sehingga ada kemungkinan BAL yang berperan dalam fermentasi tempe sama. Bentuk kokus tidak terdapat selama fermentasi tempe SDBR, diduga BAL yang berasal dari laru tidak dominan karena jumlahnya sedikit sekali.
Seumahu et al. (2013) melaporkan beberapa tempe yang berasal dari berbagai produsen tempe mengandung profil mikroba yang berbeda. Jenis kultur starter, proses pengolahan, varietas kedelai yang digunakan, bahan tambahan yang digunakan, dan skala produksi tempe sangat mempengaruhi perbedaan profil mikroba pada tempe. Tahapan proses dan kultur starter yang berbeda akan memberi peluang masuknya mikroba yang berbeda. Perbedaan BAL dominan pada tempe SDBR dan WJB diduga disebabkan perbedaan metode dan lingkungan produksi. Pada tempe SDBR tidak dilakukan perebusan kedua, sehingga memungkinkan BAL yang dominan saat perendaman kedelai ikut terbawa ke tahap fermentasi kapang. Tahapan proses pembuatan Tempe WJB setelah tahap perendaman dilakukan perebusan kedua dengan air rendaman. Perebusan kedua tersebut menyebabkan BAL yang dominan saat perendaman kedelai berkurang jumlahnya dan menjadi tidak dominan selama fermentasi kapang. Efriwati et al. (2011) juga melaporkan pada metode dengan perebusan kedua, jumlah BAL akan berkurang dibanding dengan jumlah BAL dengan metode tanpa perebusan kedua.
BAL yang termasuk dalam genera Carnobacterium, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, dan Pediococcus diketahui dapat menghambat pertumbuhan bakteri patogen (Motarjemi et al. 2014). BAL menghasilkan metabolit yang bersifat antimikroba, seperti asam organik, komponen organik, hidrogen peroksida, dan bakteriosin. Bakteriosin yang dihasilkan BAL termasuk pengawet yang aman, tidak mengubah nilai gizi, efektif pada konsentrasi rendah, dan dipercayai dapat memberi efek kesehatan manusia (Lahtinen et al. 2012). Feng (2006) melaporkan adanya pengasaman oleh BAL menyebabkan bakteri patogen seperti Escherichia coli, Bacillus substilis, Staphylococcus yang diinokulasikan pada pembuatan tempe barley tidak dapat tumbuh dengan baik. Jumlah bakteri Enterobacteriaceae pada tempe WJB cukup tinggi. Pada jam ke-12 fermentasi ditemukan juga adanya bakteri Escherichia coli (Nurdini et al. 2013). Kondisi yang demikian ini mengindikasikan poses sanitasi yang buruk pada produksi tempe dan pengupasan kulit kedelai masih dilakukan secara tradisional.
9 BAL isolat SDBR dan WJB terhadap EPEC dengan metode difusi sumur, diketahui isolat yang digunakan dalam penelitian ini memiliki aktivitas antimikroba yang bervariasi. Isolat SDBR memiliki kisaran diameter penghambatan terhadap EPEC antara 0–8.4 mm, sedangkan isolat tempe WJB memiliki kisaran diameter penghambatan terhadap EPEC antara 3.0-6.7 mm. Hasil dari pengujian aktivitas antimikroba tersebut kemudian dijadikan dasar dalam pemilihan isolat BAL untuk diidentifikasi lanjut menggunakan kit API 50 CH. Isolat dipilih berdasarkan diameter penghambatan terhadap EPEC terbesar di setiap kelompok atau tahapan proses fermentasi tempe. Hasil dari pemilihan tersebut diperoleh 15 isolat BAL SDBR dan 13 isolat BAL WJB.
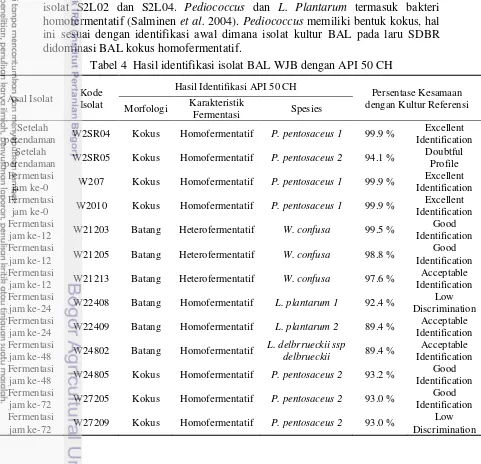
Identifikasi Sifat Biokimia Isolat BAL Terpilih dengan Kit API 50 CH Isolat BAL yang dipilih untuk diidentifikasi lanjut menggunakan kit API 50 CH adalah isolat BAL yang memiliki aktivitas terbesar dan mewakili setiap tahapannya. Pada Tabel 3 disajikan hasil identifikasi 15 isolat BAL SDBR terpilih dengan kit API 50 CH dan pada Tabel 4 disajikan hasil identifikasi 13 isolat BAL WJB dengan kit API 50 CH.
Tabel 3 Hasil identifikasi isolat BAL SDBR dengan kit API 50 CH Asal
Isolat Kode
Isolat
Hasil Identifikasi API 50 CH Persentase Kesamaan dengan Kultur Referensi Morfologi Kriteria Fermentasi Species
Laru S2L02 Kokus Homofermentatif P. acidilactici 99.9 % Doubtful Profile
Laru S2L04 Kokus Homofermentatif P. acidilactici 99.9 % Doubtful Profile
Setelah perendaman
S2SR07 Batang Heterofermentatif L. fermentum 99.4 % Good Identification Setelah
perendaman
S2SR08 Batang Heterofermentatif W. confusa 99.2 % Doubtful Profile
Fermentasi jam ke-0
S201 Batang Heterofermentatif L. fermentum 97.7 % Good Identification Fermentasi
jam ke-0
S206 Batang Heterofermentatif L. fermentum 99.8 % Very Good Identification Fermentasi
jam ke-12
S21204 Batang Heterofermentatif L. fermentum 99.9 % Excellent Identification Fermentasi
jam ke-12
S21207 Batang Heterofermentatif L. fermentum 99.6 % Very Good Identification Fermentasi
jam ke-12
S21209 Batang Heterofermentatif L. fermentum 99.9 % Very Good Identification Fermentasi
jam ke-24
S22402 Batang Heterofermentatif L. fermentum 99.6 % Very Good Identification Fermentasi
jam ke-024
S22411 Batang Heterofermentatif L. fermentum 99.9 % Very Good Identification Fermentasi
jam ke-48
S24805 Batang Heterofermentatif L. fermentum 99.9 % Very Good Identification Fermentasi
jam ke-48
S24807 Batang Heterofermentatif L. fermentum 99.9 % Excellent Identification Fermentasi
jam ke-72
S27202 Batang Homofermentatif L. plantarum 1 99.9 % Excellent Identification Fermentasi
jam ke-72
10
Hasil dari identifikasi lanjut menggunakan kit API 50 CH terhadap 15 isolat BAL SDBR terpilih menunjukkan derajat kesamaan dengan referensi diatas 99%, kecuali isolat kode S201, yaitu 97.7%, namun presentase tersebut masih dapat dikategorikan tinggi. Dari 15 Isolat BAL SDBR yang diidentifikasi, 11 isolat diantaranya teridentifikasi sebagai Lactobaacillus fermentum, yaitu isolat dengan kode S2SR07, S201, S206, S21204, S21207, S21209, S22402, S22411, S24805, S2480, dan S27206. Hal ini menunjukkan bahwa L. fermentum mendominasi tempe SDBR. Kemudian isolat W2SR08 diidentifikasi sebagai Weissella confusa. Menurut Lahtinen et al. (2012), bakteri asam laktat L. fermentum dan W. confusa merupakan bakteri heterofermentatif. Weissella memiliki bentuk batang pendek dengan bulat sudutnya dan Lactobacillus memiliki bentuk batang. Hal ini telah sesuai dengan identifikasi awal, bahwa selama fermentasi tempe SDBR didominasi oleh BAL batang heterofermentatif. Selain itu, ditemukan juga BAL Lactobacillus plantarum 1 dengan kode isolat S27202, dan pada laru SDBR teridentifikasi Pediococcus acidilactici dengan kode isolat S2L02 dan S2L04. Pediococcus dan L. Plantarum termasuk bakteri homofermentatif (Salminen et al. 2004). Pediococcus memiliki bentuk kokus, hal ini sesuai dengan identifikasi awal dimana isolat kultur BAL pada laru SDBR didominasi BAL kokus homofermentatif.
Tabel 4 Hasil identifikasi isolat BAL WJB dengan API 50 CH Asal Isolat Kode
perendaman W2SR04 Kokus Homofermentatif P. pentosaceus 1 99.9 %
Excellent Identification Setelah
perendaman W2SR05 Kokus Homofermentatif P. pentosaceus 2 94.1 %
Doubtful
jam ke-12 W21203 Batang Heterofermentatif W. confusa 99.5 %
Good Identification Fermentasi
jam ke-12 W21205 Batang Heterofermentatif W. confusa 98.8 %
Good Identification Fermentasi
jam ke-12 W21213 Batang Heterofermentatif W. confusa 97.6 %
Acceptable Identification Fermentasi
jam ke-24 W22408 Batang Homofermentatif L. plantarum 1 92.4 %
Low Discrimination Fermentasi
jam ke-24 W22409 Batang Homofermentatif L. plantarum 2 89.4 %
Acceptable Identification Fermentasi
jam ke-48 W24802 Batang Homofermentatif
L. delbrrueckii ssp
delbrueckii 89.4 %
Acceptable Identification Fermentasi
jam ke-48 W24805 Kokus Homofermentatif P. pentosaceus 2 93.2 %
Good Identification Fermentasi
jam ke-72 W27205 Kokus Homofermentatif P. pentosaceus 2 93.0 %
Good Identification Fermentasi
jam ke-72 W27209 Kokus Homofermentatif P. pentosaceus 2 93.0 %
11 Tabel 4 menunjukkan bahwa hasil identifikasi isolat BAL WJB lebih bervariasi dengan presentase kesamaan dengan kultur referensi yang juga bervariasi antara 89.4%-99.9%. Berdasarkan hasil identifikasi lanjut menggunakan kit API 50 CH, ditemukan 3 isolat yang teridentifikasi sebagai Pediococcus pentosaceus 1, yaitu isolat dengan kode W2SR04, W207, dan W2010. Berdasarkan hasil identifikasi API 50 CH, juga ditemukan 4 isolat BAL yang teridentifikasi sebagai Pediococcus pentosaceus 2, yakni isolat dengan kode W2SR05, W24805, W27205, dan W27209. Weissella confusa teridentifikasi pada 3 isolat dalam satu seri kode, yaitu W21203, W21205, dan W21213. Selain itu, diperoleh hasil identifikasi L. plantarum 1 dan L. plantarum 2 pada isolat dalam satu seri kode juga, yaitu W22408 dan W22409. Kemudian isolat dengan kode W24802 diidentifikasi sebagai L. delbrrueckii ssp delbrueckii. Sesuai dengan identifikasi awal bahwa pada awal dan akhir fermentasi tempe WJB didominasi oleh BAL kokus homofermentatif, namun pada jam ke-12 fermentasi kapang didominasi oleh BAL batang heterofermentatif, sedangkan pada jam ke-24 didominasi oleh batang homofermentatif. P. acidilactici dan P. pentosaceus banyak ditemukan pada tanaman, buah-buahan, dan sereal (Lahtinen et al. 2012). Profil BAL tempe WJB lebih beragam dibanding tempe SDBR yang umumnya didominasi oleh L. fermentum. Untuk melihat keberadaan isolat BAL dominan hasil identifikasi kit API 50 CH selama fermentasi tempe SDBR dan selama fermentasi tempe WJB disajikan pada Tabel 5
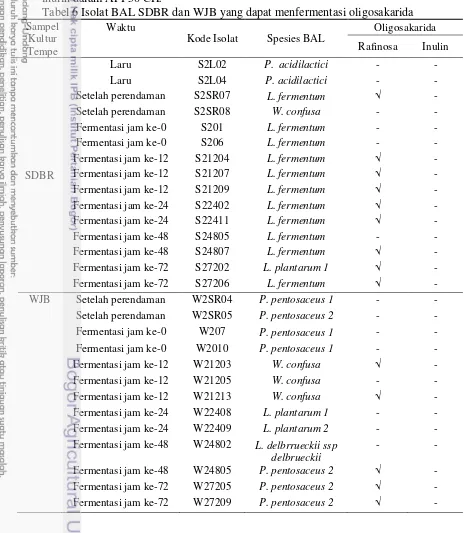
Tabel 5 Keberadaan BAL selama fermentasi tempe SDBR dan WJB Sampel
12
Pada tempe SDBR, spesies BAL yang dominan mulai dari setelah perendaman hingga fermentasi jam ke-0 bahkan hingga fermentasi ke-72 jam adalah L. fermentum. Diduga L. fermentum yang muncul sejak perendaman, terus bertahan dan ikut hadir selama fermentasi kapang. Tempe SDBR tidak melalui perebusan kedua, sehingga BAL yang ada selama perendaman ikut masuk ke tahap fermentasi kapang. Selain L. fermentum, selama perendaman juga terdapat BAL dominan W. confusa, namun pada jam ke-0 fermentasi tidak terdeteksi lagi, sedangkan pada laru SDBR didominasi oleh P. acidilactici, namun BAL ini juga tidak terdeteksi selama fermentasi kapang. Hal ini diduga BAL yang dominan selama fermentasi tempe berasal dari tahap perendaman. Nurdini et al. (2013) (belum dipublikasi) melaporkan jumlah BAL tempe SDBR setelah perendaman hanya turun sedikit, yaitu sekitar 1 log cfu g-1, kemudian jumlahnya naik hingga melebihi 7 log cfu g-1. P. acidilactici yang terdapat di laru SDBR diduga tidak mampu berkompetisi dengan mikroorganisme lain dan jumlahnya yang tidak sebanyak BAL yang berasal dari perendaman, sehingga tidak dominan selama fermentasi kapang. Barus et al. (2008) melaporkan BAL yang muncul pada tahap perendaman tempe EMP yang diproses hampir sama dengan tempe SDBR adalah Lactobacillus dan Acetobacter, kedua jenis bakteri ini diduga memberi rasa asam pada kedelai. Hasil identifikasi BAL selama perendaman pada penelitian ini sesuai dengan hasil identifikasi yang dilakukan Seumahu et al. (2013) bahwa Lactobacillus mendominasi tahap perendaman. Fermentasi kapang jam ke-12, 24, dan 72 tetap didominasi oleh L. fermentum, namun pada jam ke-72 jenis BAL dominan lain muncul, yaitu L. plantarum 1.
Profil BAL dominan selama fermentasi tempe SDBR dan WJB sangat berbeda. Pada tempe WJB, P. pentosaceus 1 dan P. pentosaceus 2 dominan di awal fermentasi, yaitu selama perendaman. P. pentosaceus 1 kemudian ikut terbawa ke fermentasi kapang hingga jam ke-0. P. pentosaceus 2 yang dominan selama perendaman kemudian kembali muncul di akhir fermentasi pada jam ke-48 hingga jam ke-72 fermentasi kapang. P. pentosaceus 2 muncul kembali di akhir fermentasi diduga keberadaannya tetap ada selama fermentasi tempe, namun tidak dominan pada fermentasi kapang jam ke-0, 12 dan 24. Fermentasi ke-12 jam tempe WJB didominasi oleh W. confusa dan fermentasi kapang jam ke-24 didominasi oleh L. Plantarum 1 dan L. Plantarum 2, serta pada jam ke-48 selain P. pentosaceus 2, juga didominasi oleh L. delbrueckii ssp delbrueckii. Munculnya BAL selain P. pentosaceus 1 dan P. pentosaceus 2 selama fermentasi tempe WJB diduga berasal dari lingkungan. Hasil metabolit BAL dominan diduga merangsang pertumbuhan BAL jenis lain. Menurut Katz (2012), bakteri-bakteri dominan dapat mengubah kondisi, seperti pH dan lainnya, menyebabkan bakteri tertentu saja yang dapat tumbuh dengan baik.
13 menyebabkan beragamnya profil bakteri selama fermentasi. Lingkungan fermentasi tempe SDBR yang lebih bersih menyebabkan profil BAL dominannya kurang beragam, sedangkan pada tempe WJB, lingkungan fermentasinya yang kurang bersih menyebabkan profil BAL selama fermentasi lebih beragam.
Penelitian mengenai jenis BAL pada tempe terutama selama proses perendaman sudah banyak dilakukan, namun belum ada yang meneliti jenis BAL dominan pada berbagai tahap fermentasi tempe. Mulyowidarso et al. (1990) berhasil mengidentifikasi BAL dominan selama perendaman kedelai, yaitu Lactobacillus casei dan Enterococcus faecium, jumlahnya pada jam ke-48 fermentasi kapang mencapai 106 - 107 cfu g-1. Hal serupa juga dilaporkan Moreno et al. (2002), dimana ditemukan Enterococcus faecium pada tempe Malaysia selama perendaman. Penelitian berikutnya oleh Seumahu et al. (2013) menunjukkan Acetobacter dan Lactobacillus mendominasi fermentasi tempe EMP.
Penelitian yang dilakukan oleh Muhialdin dan Hassan (2011) yang menguji antifungal BAL isolat tempe Malaysia, menunjukkan BAL yang dominan adalah L. fermentum dan P. pentosaceus. Penelitian lainnya dilakukan oleh Feng (2006) menunjukkan BAL yang dominan pada tempe barley adalah L. reteuri, L. plantarum, dan L. fermentum. Liu et al. (2012) melaporkan bakteri asam laktat pada douchi, yaitu makanan fermentasi kedelai tradisional Cina, didominasi L. plantarum, Pediococcus, dan Weissella. Pada fermentasi berbasis sereal lainnya, yaitu millet (Pennisetum glaucum) juga diidentifikasi dominasi L. fermentum yang kemudian diikuti P. pentosaceus dan L. plantarum (Turpin et al. 2011). Perbedaan hasil identifikasi profil isolat BAL SDBR dan WJB pada penelitian ini diduga dipengaruhi perbedaan metode pembuatan tempe dan kondisi lingkugan produksi tempe.
Kemampuan Isolat BAL Menfermentasi Oligosakarida
Tabel 6 disajikan data isolat BAL yang dapat menfermentasi oligosakaria rafinosa dan inulin, dapat dilihat bahwa tidak ada satu isolat BAL pun yang mampu menfermentasi inulin. Isolat BAL tempe SDBR dengan kode S2SR07, S21204, S21207, S21209, S22402, S22411, S24807, S27202, S27206 dapat menfermentasi rafinosa, yaitu 8 isolat L. fermentum dan 1 isolat L. plantarum 1. Pada tempe WJB, juga tidak ada isolat yang mampu menfermentasi inulin. isolat dengan kode W21203, W21213, W24805, W27205, W27209 dapat menfermentasi rafinosa. Dua isolat tersebut adalah W. confusa, sedangkan tiga lagi adalah P. pentosaceus 2. Lan et al. (2004) melaporkan bahwa oligosakarida pada kedelai dapat meningkatkan populasi BAL genera Lactobacillus, Pediococcus, Weissella, dan Leuconostoc. Hasil data diatas menunjukkan bahwa tidak semua BAL dapat menfermentasi oligosakarida rafinosa dan inulin. Perbedaan tersebut diduga disebabkan pengaruh dari keberadaan enzim α -galactosidase pada masing-masing BAL.
Pada kedelai, oligosakarida utamanya adalah rafnosa dan stakiosa. Wang et al. (2007) mengidentifikasi oligosakarida pada kedelai mentah terdiri dari rafinosa 7.52 g kg-1 dan stakiosa 41.32 g kg-1 (berat kering) pada kedelai. Pada proses awal pembuatan tempe, seperti perendaman, pengupasan, dan penyucian sekitar 50% rafinosa dan lebih dari 55%-60% sukrosa dan stakiosa berkurang.
14
semakin berkurang melebihi 80% stakiosa dan 50% rafinosa. Semakin
berkurangnya oligosakarida pada tahap fermentasi kapang disebabkan hidrolisis
oligosakarida oleh enzim α-galactosidase (Egounlety and Arworh 2003). Oligosakarida pada kedelai dan inulin berpotensi sebagai prebiotik karena dapat merangsang pertumbuhan dan aktivitas mikroflora pada usus dan menurunkan resiko penyakit (Zdunczyk et al. 2011). Pada galeri kit API 50 CH terdapat berbagai macam turunan karbohidrat, termasuk salah satunya oligosakarida, sehingga dapat dilihat kemampuan BAL isolat tempe SDBR dan WJB dalam menfermentasi oligosakarida, namun hanya terdapat oligosakarida rafinosa dan inulin dalam API 50 CH.
Tabel 6 Isolat BAL SDBR dan WJB yang dapat menfermentasi oligosakarida Sampel
Setelah perendaman S2SR07 L. fermentum √ - Setelah perendaman S2SR08 W. confusa - - Fermentasi jam ke-48 W24802 L. delbrrueckii ssp
delbrueckii
- -
15 Ketahanan Isolat BAL terhadap Asam dan Garam Empedu
Isolat BAL yang telah diidentifikasi menggunakan API 50 CH dipilih 8 kultur isolat yang mewakili masing-masing spesiesnya berdasarkan aktivitas antimikrobanya yang tertinggi (Nuraida 2014) (belum dipublikasi). Pada pengujian ini digunakan pH 2.0 dan konsentrasi garam oxgall 0.5%. Konsentrasi garam empedu yang digunakan disesuaikan dengan konsentrasi garam empedu dalam duodenum (Zavaglia et al. 1998). Selain itu, penggunaan pH 2 juga didasarkan oleh nilai asam lambung antara 2-3, dimana kerja enzim pepsin bekerja baik pada pH tersebut (Sumardjo 2009). Derajat keasaman yang tinggi dapat membunuh bakteri karena kondisi pH yang sangat rendah menyebabkan membran sel bakteri rusak sehingga komponen intraselularnya keluar, dan berujung pada kematian sel (Nannen and Hutkins 1991). Garam empedu mampu menembus dan bereaksi pada sisi membran sitoplasma yang bersifat lipofilik, sehingga membran sel menjadi rusak (Singhal et al. 2010)
Gambar 1 Pengaruh asam (pH 2.0) dan garam empedu (oxgall 0.5%) terhadap pertumbuhan isolat BAL
Berdasarkan grafik diatas, L. delbrueckii ssp delbrueckii memiliki ketahanan terhadap asam tertinggi, sedangkan L. plantarum 2 memiliki ketahanan terhadap asam terendah. P. pentosaceus 2 memiliki ketahanan terhadap garam empedu tertinggi dan L. delbrueckii ssp delbrueckii memiliki ketahanan terhadap garam empedu terendah. L. fermentum yang penurunan lognya terhadap asam dan garam empedu tidak melebihi 2 log. Hal tersebut menunjukkan bahwa L. fermentum memiliki resistensi yang cukup baik terhadap asam dan garam empedu. Selain L. fermentum dan L. delbrueckii ssp delbrueckii, spesies BAL lainnya
0 1 2 3 4 5 6 7 8 9 10
0 1 2 3 4 5 6 7 8 9 10
Pe
nu
runan
log
(c
fu/mL)
asam
16
mengalami penurunan diatas 5 log cfu mL-1 akibat asam, namun hampir semua isolat BAL tahan terhadap garam empedu, kecuali W. confusa, P. acidilactici, dan L delbrueckii ssp delbrueckii, dimana penurunannya lebih dari 2 log cfu mL-1.
Dari 8 isolat yang diuji mengalami total penurunan dengan kisaran 3.20– 11.03 log cfu mL-1. Nilai kisaran penurunan akibat perlakuan asam dari ke 8 isolat yang diuji adalah 1.26-8.61 log cfu mL-1, sedangkan nilai kisaran penurunan akibat perlakuan garam empedu adalah 0.97–4.06 log cfu mL-1. Total penurunan menunjukkan jumlah total BAL yang berkurang akibat perlakuan pH 2.0 dan garam oxgall 0.5%. Penurunan log terbesar hingga terkecil bila diurutkan adalah W. confusa, L. plantarum 2, P. acidilactici, P. pentosaceus 1, P. pentosaceus 2, L. plantarum 1, L. delbrueckii ssp delbrueckii, dan terakhir L. fermentum. L. delbrueckii ssp delbrueckii memiliki ketahanan terhadap asam yang paling tinggi, sedangkan P. pentosaceus 2 memiliki ketahanan terhadap garam empedu yang paling tinggi.
L. fermentum berpotensi sebagai probiotik karena resisten terhadap asam dan garam empedu. Syarat sebagai probiotik adalah masih terdapat minimum 106 cfu mL-1 di usus dan diinokulasikan 108-109 cfu mL-1 (Hui et al. 2005). Dari data diatas, L. fermentum memiliki potensi sebagai probiotik karena total penurunannya hanya 3.20 log cfu mL-1, berarti jika dinokulasikan 109 cfu mL-1 bakteri L. fermentum, masih terdapat sekitar 106 cfu mL-1. BAL lainnya selain L. fermentum mengalami penurunan yang sangat tinggi. Banyak penelitian yang dilakukan untuk mengetahui aktivitas probiotik L. fermentum. Pada ASI ditemui L. fermentum dan memiliki potensi sebagai probiotik, L. fermentum tersebut memiliki aktivitas antimikroba terhadap Salmonella thyphimurium CCM 5445, Escherichia coli O157:H7 NCTC, dan Escherichia coli NRRL B-3008 (Yavuzdurmaz 2007). (Klayraung et al. 2008) juga menguji potensi L. fementum yang diisolasi dari makanan tradisional Thailand, yaitu Nham (fermentasi daging) dan Miang (fermentasi teh). L. fementum dari kedua jenis makanan tersebut memiliki ketahanan tehadap pH rendah dan garam empedu. L. fermentum yang diisolasi dari Nham memiliki kemampuan menempel yang lebih tinggi dibanding L. fermentum dari Miang. L. fermentum dari Nham juga memiliki aktivitas antimikroba yang tinggi terhadap S. aureus dan S. typhi, sedangkan L. fementum dari Miang memiliki aktivitas antimikroba yang tinggi terhadap E. coli. L. fermentum RC-14 dan L. rahmnosus GR-1 juga diketahui tergolong probiotik dan dapat mencegah dan mengurangi infeksi urogenital pada wanita (Gardiner et al. 2002).
SIMPULAN DAN SARAN
Simpulan
17 tempe SDBR diduga menyebabkan keberagaman BAL berkurang, sedangkan pada tempe WJB jenis BAL yang mendominasi lebih variatif. Pada awal fermentasi P. pentosaceus 1 dan P. pentosaceus 2 mendominasi fermentasi kapang, kemudian diakhir fermentasi, P. pentosaceus 2 muncul dan kembali mendominasi. Namun, pada fermentasi jam ke-12 didominasi W. confusa, dan pada fermentasi jam ke-24 didominasi oleh L. plantarum 1 dan L. plantarum 2. Pada pengujian potensi probiotik, BAL L. fermetum memiliki potensi sebagai probiotik karena memiliki ketahanan terhadap pH rendah dan garam empedu.
Saran
Perlu penelitian lebih lanjut isolat L. fermentum yang telah diketahui tahan asam dan garam empedu, terhadap persyaratan-persyaratan probiotik lainnya, diantaranya uji kemampuan penempelan pada mukus dan sel epitel manusia, uji kemampuan mengurangi patogen yang menempel pada permukaan vili usus, dan uji akktivitas hidrolase garam empedu.
DAFTAR PUSTAKA
Barus T. 2008. Role bacteria in tempe bitter taste formation: microbiological and molecular biological analysis based on 16SrRNA gene. J microbial Indones. 2(1):17-21
BioMérieux. 2007. API 50 CHL Medium [internet]. [diunduh pada 2014 Maret 7] [Terhubung berkala] http:// www. apiweb.biomerieux.com
Cahyadi W. 2009. Kedelai Khasiat dan Teknologi. Jakarta (ID): Bumi Aksara. Clemente, A. 2012. Probiotics and Prebiotics: An Update from the World
Gastrointestinal Organization (WGO). Eur Food Res Rev. 2(1):24-28 Dennis RH. 2003. Encyclopedia of Agricultural, Food, and Biological
Engineering. USA : Marcel Dekker, Inc.
[Deptan]Departemen Pertanian (ID). 2012. Konsumsi Rata-rata per Kapita Setahun Beberapa Bahan Makanan di Indonesia, 2008-20 [terhubung berkala] http://www.deptan.go.id/Indikator/tabe-15b-konsumsi-rata.pdf (22 September 2013).
Dewi RS, ‘Aziz S. 2011. Isolasi Rhizopus oligosporus pada beberapa inokulum tempe di kabupaten Banyumas. J mikrobiol Indones. 6(2):93-104.
Efriwati, Suwanto A, Rahayu G, Nuraida L. 2013. Population dynamics of yeast and lactic acid bacteria (LAB) during tempeh fermentation. Hayati J Biosci. 20(2):57-64.
18
[FAO/WHO]World Health Organization. 2001. Health and Nutritional Properties of Probiotics in Food Including Powder Milk with Live Lactic Acid Bacteria. Argentina: Cordoba.
[FAO/WHO]World Health Organization. 2002. Guidelines for the Evaluation of Probiotics in Food. Canada: Ontorio.
Feng XM. 2006. Microbial dynamics during barley tempeh fermentation [tesis]. Swedish University of Agricultural Sciences: Uppsala
Gardiner GE, Heinemann C, Bruce AW, Beuerman D, Reid G. Persistence of Lactobacillus fermentum RC-14 and Lactobacillus rhamnosus GR-1 but not L. Rhambosus GG in the human vagina as demonstrated by randomly amplified polymorphic DNA. Clin. Diagn. Lab. Immunol. 9(1):92.
Hayes PR. 1995. Food Microbiology and Hygiene 2nd Edition. London(UK): Chapman and Hall.
Halim CN, Zubaidah E. 2013. Studi kemampuan probiotik isolat bakteri asam laktat peghasil eksopolisakarida tinggi asam sawi asin (Brassica juncea). J Pangan dan Agroindust. 1(1):128-137
Harrigan WF. 1998. Laboratory Methods in Food Microbiology 3rd Edition. California(US): Academic Press.
Hauser SC. 2011. Mayo Clinic Gastoenterology and Hepatology Board Review 4th Edition.New York(US): Oxford University Pr.
Hidayat N, Padaga MC, Suhartini S. 2006. Mikrobiologi Industri. Yogyakarta(ID): Andi Yogyakarta.
Hui YH, Goddick ML, Hansev AS, Josephen J, Nip WK, Stanfield PS, Toldra F. 2005. Handbook of Food and Beverages Fermentation Technology. New York(US): Marcel Dekker.
Hutkins RW. 2006. Microbiology and Technology of Fermented Foods. Lowa(US): Blackwell Publishing.
Katz SE. 2012. The Art Of Fermentation. USA: Chealse Green Publishing.
Klayraung S, Vienstein H, Sirithunyalug J, Okonologi S. 2008. Probiotic properties of Lactobacilli Isolated from Thai Traditional Food. Sci Pharm. 76:485-503
Lahtinen S, Ouwehand AC, Salminen S, Wright AV. 2012. Lactic Acid Bacteria Microbiological and Functional Aspects 4th Edition. Boca Raton: CRC Pr. Lui CJ, Gong F, Li X, Li H, Zhang Z, Feng Y, Nagano H.2012.Natural population
of lactic acid bacteria in douche from Yunna Province, China. J Zhejiang Univ Sci B. Apr. 13(4):298–306.doi:10.1631/jzus.B1100221.
Lusiawati D, Pranitasari WA, Sastrodiharjo S.2013.Pengaruh perbandingan kacang koro (Canavalia ensiformis L. DC) dan kedelai (Glycine max (L.) Merr) pada tempe ditinjau dari kadar protein terlarut dan uji organoleptik. Posiding Seminar Nasional Penelitian, Pendidikan dan Penerapan MIPA Fakultas MIPA, Universitas Negeri Yogyakarta :18 Mei 2013; Yogyakarta, Indonesia, hlm 83-87.
Moreno MRF, Leisner JJ, Tee LK, Ley C, Radu S, Rusul G, Vancanneyt M, de Vuyst. 2002. Microbial analysis of Malaysia tempeh, and characterization of two bacteriocins produced by isolates of Enterococcus faecium. J Appl Microbiol. 92:147-157.doi: 10.1046/j.1365-2672.2002.01509.x.
19 Muhialdin BJ, Hassan Z. Screening of lactic acid bacteria for antifungal activity
against Aspergillus oryzae. 2011. American J Appl Sci. 8(5): 447-451. Mulyowidarso RK, Fleet GH, Buckle KA. 1989. The microbial ecology of
soybean soaking for tempe production. Int J Food Microbiol. 8:35-46. Mulyowidarso RK, Fleet GH, Buckle KA. 1990. Association of bacteria with the
fungal fermentation of soybean tempe. J Appl Microbiol.68:43-47.
Nannen NL and Hutkins RW.1991. Intracellular pH effect in lactic acid bacteria. J Dairy Sci. 74:741-746.
Nikita C, Hemangi D. 2012. Isolation, indetification, and characterization of lactic acid bacteria from dairy sludge sample. J Environ Res Develop. 7(1A):234-244.
Nout MJR, Kiers JL. 2005. Tempe fermentation, innovation and functionality: update into the third millenium. J Appl Microbiol. 98:789-805.
Nout MJR, Rombouts FM. 1990. Recent developments in tempe research. J Appl Bacteriol. 69:609-633.
Nuraida L, Suliantari, Andarwulan N, Adawiyah DR, Noviar R, Agustin D. 2008. Evaluation of soybean varieties on production and quality of tempe. Di dalam: Hardinsyah, Astawan M, Kusumaningrum H, Amalia L, Briawan D, Aries M, editor.Seminar dan Lokakarya (SEMILOKA). Perkembangan Terkini Tentang Tempe: Teknologi, Standardisasi dan Potensinya Dalam Perbaikan Gizi serta Kesehatan; 2008 Agustus 28-29; Bogor, Indonesia. hlm. 1-15.
Nuraida L, Winarti S, Hana, Prangdirmurti E. 2011. Evaluasi in vitro terhadap kemampuan isolat bakteri asam laktat asal air susu ibu untuk mengasimilasi kolesterol dan mendekonjugasi garam empedu. J Teknol dan Indust Pangan. 26(1):47.
Nuryadi Isolasi dan identifikasi bakteri asam laktat asal yoghurt. J UNEJ. 1(5):1-11.
Pisol B, Nuraida L, Abdullah N, Suliantari, Khalid KA.Isolation and characterization of lactic acid from Indonesian soybean.2013 4th International Conference on Biology, IPCBEE . 58(7):32–36. doi:
10.7763/IPCBEE. 2013. V58. 7
Salminen S, Wright AV, Ouwehand A. Lactic Acid Bacteria Microbial and Finctional Aspects Third Edition, Revised and Expanded. New York (US): Marcel Dekker, Inc.
Santoso HB. 1993. Pembuatan Tempe dan Tahu Kedelai, Bahan Makanan Bergizi Tinggi. Yogyakarta(ID): Kanisius (Anggota IKAPI).
Sarwono B. 2012. Usaha Membuat Tempe dan Oncom. Bogor (ID): Penebar Swadaya.
Seumahu C, Suwanto A, Rusmana, Solihin DD. 2013. Bacteria and fungal communities in tempeh as reveal by amplified ribosomal intergenic sequence analysis. J Hayati of Biosci. 20(2):65-71
Singhal, K., Joshi, H., Chaudhary, B.L. 2010. Bile and acid tolerance ability of probiotic lactobacillus strains. J global Pharma Tech. 2(12):17-25.
20
Strompfova V, Marcikanova M, Gancarcikova S, Jonecova Z.Scirankova L, Guba J, Boldizarova K, Laukova A. 2005. New probiotic strain lactobacillus fermentum AD1 and its effect in Japanese quail. J vet. Med. 50(9):415-420. Surmadjo D. 2009. Pengantar Kimia, Buku Panduan Mahasiswa Kedokteran dan
Program Strata I Fakultas Bioeksata. Jakarta(ID): EGC.
Sunaryanto R, Marwoto B. 2012. Isolasi, identifikasi, dan karakterisasi bakteri asam laktat dari dadih susu kerbau. J sains dan teknol Indones. 14(3): 228-233.
Turpin W, Humblot C, Guyot JP. 2011. Genetic screening of functional properties of lactic acid bacteria in a fermented pearl millet slurry and in the metagenome of fermented starchy foods. J Appl Environ Microbiol. 77(24):8722–8734.doi:10.1128/AEM.05988-11.
Wang Q, Ke L, Yang D, Bao B. 2007. Change in oligosaccharides during processing of soybean sheet. Asia Pac J Clin Nutr. 16(1): 89-94.
Wikandari PR, Suparmo, Marsono Y, Rahayu RS. 2012. Karakterisasi bakteri asam laktat proteolitik pada bekasam. J Natur Indonesia. 14(2):120-125. Yavuzdurmaz H. 2007. Isolation, characterization, determination of proboiotic
properties of lactic acid bacteria from human milk [tesis]. Turki: Izmir Institute of Technology.
Zavaglia AG, Kociubinski, Perez P, Antoni GD. 1998. Isolation and characterization of Bifidobacterium strain for probiotics formulation. J Food protect. 61(7):865-873.
21
RIWAYAT HIDUP
Penulis dilahirkan di Bengkalis pada tanggal 6 Januari 1992. Penulis adalah anak dari Bapak Ir Diederik Willem Touw (Alm.) dan Ibu Larsih Purwanti. Penulis merupakan anak pertama dari dua bersaudara. Penulis mengenyam pendidikan di SMP Negeri 4 Pekanbaru pada tahun 2004, kemudian penulis melanjutkan pendidikan ke SMA Negeri 8 Pekanbaru pada tahun 2007. Pada tahun 2010 penulis menyelesaikan pendidikan SMA dan masuk Institut Pertanian Bogor, departemen Ilmu dan Teknologi Pangan, melalui jalur Beasiswa Undangan Daerah (BUD).