EFISIENSI SUPEROVULASI PADA SAPI
MELALUI SINKRONISASI GELOMBANG
FOLIKEL DAN OVULASI
MAIDASWAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Efisiensi
Superovulasi Pada Sapi Melalui Sinkronisasi Gelombang Folikel dan Ovulasi
adalah hasil karya saya sendiri dan belum pernah diajukan dalam bentuk apapun
kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip
dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis
ini.
Bogor, Mei 2007
ABSTRACT
MAIDASWAR. Efficiency of Superovulation in Cattle Throught Synchronization of Follicular Wave and Ovulation. Under supervised by ARIEF BOEDIONO, M. AGUS SETIADI.
Reproductive biotechnology in cattle especially embryo transfer technology has been widely developed. In vivo embryo production from the donor improve the genetic of cattle. Superovulation methods in cattle were designed to obtain the huge number of embryos several. Experiments were carried out to observe the effect of gonadotrophin injection period and GnRH treatments on superovulated
response rate and embryo recovery. Studies were devided into two experiments: a). Injection of gonadotrophin (1000 IU FSH and 1000 IU LH) for 3, 4 and 5 days
(decreasing doses); b). Follicular wave synchronization (WaveSynch) was done by injection of GnRH (86 µg gonadorelin) at 2 days before FSH-LH injection; and combination of follicular wave synchronization followed by ovulation synchronization (Wave-OvSynch) by injection of GnRH at 2 days before FSH-LH (WaveSynch) followed by GnRH at 48 hours after PGF2α injection (OvSynch).
The number of corpus luteum (CL) were examined by rectal palpation on collecting embryo day. Results of the experiments indicated that FSH-LH injection for 4 days FSH-LH treatment tended to be better than 3 and 5 days, with the response rate were (60 % vs 40 % vs 60 %) respectively, average of CL per donor were ( 5.90 vs 2.70 vs 4.20) respectively and the number of embryo-oocytes recovery were (5.20 vs 2.50 vs 2.80) respectively. Superovulation response of WaveSynch treatment tended to be greater than control: response rate were (90 % vs 60 %) respectively, the average of CL were (17.22 vs 9.83) respectively, the average of embryo-oocytes recovery were (18.22 vs 8.67) respectively and the average of transferable embryo were (5.56 vs 4.67) respectively but statistically is not significant different (P>0.05). Number of transferable embryo of the Wave-OvSynch treatment tended to be greater than the WaveSynch treatment, however the number of CL, embryo oosit were higher in the WaveSynch treatment. The WaveSynch could be better to improve the response of superovulated cattle, however of unfertilized oocytes was also increase. The Wave-OvSynch could increase the response of superovulated cattle and decrease the number of unfertilized oocytes. According to breed, the application of the Wave-OvSynch treatment on beef cattle tended to be higher than dairy cattle in the superovulation response. In conclusion, the Wave-OvSynch could improve the in vivo embryo production and as choice for efficiency of the superovulation treatments.
RINGKASAN
MAIDASWAR. Efisiensi Superovulasi Pada Sapi Melalui Sinkronisasi Gelombang Folikel dan Ovulasi. Dibimbing oleh ARIEF BOEDIONO dan M. AGUS SETIADI.
Bioteknologi reproduksi pada sapi khususnya embrio transfer sudah sangat berkembang. Produksi embrio secara in vivo melalui superovulasi hewan donor merupakan salah satu cara yang tepat dalam mempercepat pembentukan bibit unggul. Ternak sapi memiliki potensi ratusan ribu oosit yang secara alami hanya dapat menghasilkan anak sekitar 6-8 ekor sepanjang hidupnya. Potensi oosit yang sangat banyak tersebut dapat dioptimalkan dengan bioteknologi reproduksi antara lain melalui superovulasi. Sampai saat ini, pelaksanaan superovulasi masih dihadapkan kendala antara lain: respon donor yang bervariasi dan hasil perolehan embrio belum maksimal, khususnya permasalahan tingkat kerusakan embrio (degeneratif) dan jumlah oosit yang tidak terbuahi (unfertilized) masih tinggi. Bertolak dari hal tersebut, maka dilakukan penelitian yang bertujuan untuk mengkaji tingkat respon ovarium dan perolehan embrio sapi pada berbagai metode superovulasi, agar didapatkan metode superovulasi yang tepat dan efisien.
Kajian superovulasi ini terdiri atas 2 penelitian yaitu a). Pengaruh pemberian gonadotropin (1000 IU FSH dan 1000 IU LH dalam dosis menurun) selama 3, 4 dan 5 hari yang dimulai pada hari ke-9 setelah estrus (Penelitian I), b). Pengaruh sinkronisasi gelombang folikel (SGF) melalui pemberian GnRH (86 µg gonadorelin) 2 hari sebelum superovulasi dan kombinasi SGF dengan sinkronisasi ovulasi (SGFO) melalui pemberian GnRH1 (86 µg gonadorelin) pada
2 hari sebelum superovulasi dan GnRH2 (86 µg gonadorelin) pada 48 jam setelah
pemberian PGF2α(Penelitian II). Hewan uji yang digunakan adalah sapi donor
perah (FH) non laktasi dan potong (Simmental dan Limousin).
Pengamatan dilakukan dengan melihat jumlah donor yang memberikan respon dan tidak respon berdasarkan jumlah CL pada ovarium, yang dievaluasi secara palpasi rektal dengan bantuan USG. Tingkat perolehan embrio diamati berdasarkan jumlah perolehan embrio dan oosit serta jumlah embrio yang layak dan tidak layak transfer, yang dikoleksi secara teknik non bedah menggunakan kateter Foley. Klasifikasi embrio layak transfer meliputi embrio grade A, B, dan C. Sedangkan yang termasuk embrio tidak layak transfer adalah embrio yang mengalami kerusakan (degeneratif) dan oosit yang tidak terbuahi (unfertilized). Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL). Untuk mengetahui pengaruh perlakuan dilakukan analisa sidik ragam (Anova), selanjutnya untuk mengetahui perbedaan nilai tengah antar perlakuan dilakukan uji Duncan. Untuk data nonparametrik seperti nilai respon dan tidak respon dari donor digunakan uji Kruskal Wallis.
awal gelombang folikel dengan pengaruh gonadotropin untuk perkembangan banyak folikel. Dari hasil ini, pemberian FSH-LH selama 4 hari cenderung memberikan hasil lebih baik dan efisien dalam waktu, tenaga, dana, serta penggunaan donor.
Perlakuan SGF cenderung memberikan hasil lebih baik dari perlakuan tanpa SGF (4 hari FSH-LH) dengan prosentase donor yang respon (90 % vs 60 %) dan rata-rata CL (17.22 vs 9.83), embrio-oosit (18.22 vs 8.67), embrio layak transfer (5.56 vs 4.67). Hal ini membuktikan bahwa metode SGF dengan pemberian GnRH mampu meningkatkan respon donor dan perolehan embrio. Namun pada SGF, didapatkan proporsi embrio layak transfer lebih rendah dibanding embrio tidak layak transfer (30.49 % vs 69.51 %). Embrio layak transfer yang tinggi pada SGF disebabkan oleh jumlah oosit yang tidak terbuahi cukup tinggi (10.00), demikian juga jumlah embrio yang mengalami degenerasi (2.67).
Perlakuan SGFO menunjukkan tingkat respon donor yang sama dengan perlakuan SGF (90 %) dan cenderung lebih tinggi dari kontrol (60 %). Perolehan embrio layak transfer SGFO cenderung lebih baik dari SGF dengan rata-rata (6.00 vs 5.56) dan prosentase (58.06 vs 30.49). Perlakuan SGFO menunjukkan peningkatan dalam perolehan embrio layak transfer dan penurunan jumlah embrio tidak layak transfer (terutama oosit yang tidak terbuahi), yang hal tersebut merupakan tujuan utama dari pengembangan metode superovulasi.
Perlakuan SGFO pada sapi potong memberikan hasil cenderung lebih tinggi dari sapi perah non laktasi dimana respon donor (100 % vs 80%) dengan rata-rata: CL (14.60 vs 11.25), embrio-oosit (12.20 vs 8.00) dan embrio layak transfer (7.40 vs 4.25) namun secara statistik tidak terdapat perbedaan yang signifikan (P>0.05). Prosentase embrio layak transfer pada sapi potong juga lebih tinggi daripada sapi perah non laktasi (60.66 % vs 53.12 %), dan hasil keduanya lebih tinggi dari prosentase embrio tidak layak transfer. Perbedaan hasil pada sapi potong dan sapi perah ini, dapat disebabkan karena perbedaan jenis dan ras serta faktor herediter yang secara fisologis mempengaruhi penampilan reproduksi karena dipengaruhi banyak gen.
Secara umum prinsip utama yang harus diperhatikan dalam aplikasi gonadotropin adalah ketepatan waktu aplikasi dengan awal munculnya gelombang folikel pada ovarium, karena folikel-folikel tersebut yang menjadi target stimulasi gonadotropin. Metode SGFO merupakan metode aplikatif yang bertitik tolak pada prinsip tersebut. Secara ekonomis dengan menambah sedikit input produksi pada SGFO, dapat meningkatkan respon donor dan perolehan embrio. Karena itu, metode SGFO disarankan dapat digunakan sebagai penyempurnaan metode superovulasi konvensional dalam meningkatkan produksi embrio secara in vivo, melalui efisiensi perlakuan superovulasi.
Kata kunci : superovulasi, gelombang folikel, ovulasi, corpus luteum, embrio.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007 Hak cipta dilindungi
EFISIENSI SUPEROVULASI PADA SAPI
MELALUI SINKRONISASI GELOMBANG
FOLIKEL DAN OVULASI
MAIDASWAR
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Efisiensi Superovulasi Pada Sapi Melalui Sinkronisasi Gelombang Folikel dan Ovulasi
Nama : Maidaswar NRP : B 651030021 Program Studi : Biologi Reproduksi
Disetujui
Komisi Pembimbing
drh. Arief Boediono, Ph.D.
Diketahui
Tanggal Ujian : 29 Mei 2007 Tanggal Lulus: 2007 Dr. drh. M. Agus Setiadi
Ketua Anggota
Dekan Sekolah Pascasarjana Ketua Program Studi
Biologi Reproduksi
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas karunia, rahmat
dan maghfirahNya sehingga tesis ini bisa selesai dengan baik. Shalawat dan
salam penulis haturkan kepada junjungan kita Nabi Muhammad SAW atas suri
tauladannya. Penelitian yang dilaksanakan di Balai Embrio Ternak
Cipelang-Bogor ini berjudul Efisiensi Superovulasi Pada Sapi Melalui Sinkronisasi
Gelombang Folikel dan Ovulasi.
Pada kesempatan ini penulis menyampaikan penghargaan dan terima kasih
yang setinggi-tingginya kepada:
1. Komisi Pembimbing: drh. Arief Boediono, Ph.D. sebagai ketua komisi dan
Dr. drh. M. Agus Setiadi sebagai anggota, yang telah banyak membimbing dan
mengarahkan penulis dalam penyelesaian tesis ini.
2. Dr. drh. Tuty L.Yusuf, M.S., Dr. dra. R. Iis Arifiantini, MSi. yang senantiasa
memberikan dukungan dan semangat, juga Dr. drh. Iman Supriatna dan
drh. R. Kurnia Achyadi, MS. atas konsultasi dan curahan ilmunya.
3. Dr. Drh. Sjamsul Bahri, M.S. Direktur Perbibitan Direktorat Jenderal
Peternakan Departemen Pertanian selaku pimpinan penulis yang berkenan
menjadi penguji luar IPB demi kesempurnaan tesis dan pemanfaatannya.
4. Rekan-rekan mahasiswa yang tergabung dalam Forum Mahasiswa
Pascasarjana Biologi Reproduksi (Wacana BIOREP) dan Forum Mahasiswa
Pascasarjana Institut Pertanian Bogor (Wacana IPB) yang senantiasa
memberikan masukan.
5. Drh. Hasan Mardijono selaku Kepala Balai Embrio Ternak
Cipelang-Direktorat Jenderal Peternakan Departemen Pertanian dan rekan-rekan
sekantor (drh. Nurwidayati, drh. M. Arifin Basyir, drh. Winarno, drh. Syamsul
Fikar, drh. Bagyaningtyas, Ir. Sugiono, Ir. Tri Harsi MP., Ir. Slamet
Supriyanto, MP., M. Imron Spt. MSi., Yude Maulana Yusuf Spt., Sugeng
Riyanto, Laelatul Choiriyah, Ilyas Spt., Muslihudin, Agus Jamaludin, Spt.,
Parto Spt., yang turut memberikan dukungan dalam produksi embrio.
6. Kepala Pusat Pengembangan Pendidikan Pertanian Badan Pengembangan
Sumberdaya Manusia Departemen Pertanian, yang telah memberikan
7. Istri tercinta Fuji Mariati SP. dan anak-anak yang sangat menyejukkan hati
Fathiyya Nisatudz Dzikra, Fadlan Rizqon Tsany, Aziz Muhammad Zhafran,
Ahmad Zaid Al Fatih, yang menjadi sumber motivasi dan inspirasi bagi
penulis.
8. Ayahanda Syafiruddin dan Ibunda Sitti Aisyah yang konsisten menanamkan
embrio pencarian keesaan Allah SWT agar tetap istiqomah dijalanNya, atas
dukungan dan doanya yang tak pernah henti, semoga Allah SWT memberikan
balasan setimpal. Demikian juga ucapan terima kasih kepada Bapakanda
Muhamad Soleh dan Ibunda Markumi serta seluruh saudara-saudara atas
pengertian, doa, dan perhatian yang senantiasa diberikan.
Akhir kata penulis berharap semoga penelitian ini dapat bermanfaat bagi
pengembangan ilmu dimasa datang, terutama penerapan bioteknologi reproduksi
embrio transfer dalam menunjang pembangunan peternakan di Indonesia.
Bogor, Mei 2007
RIWAYAT HIDUP
Penulis dilahirkan di Pasaman Sumatera Barat pada tanggal 19 Mei 1967
dari Ayah Syafiruddin dan Ibu Sitti Aisyah. Penulis merupakan putra ketujuh dari
sembilan bersaudara.
Pada tahun 1986 penulis lulus dari Sekolah Menengah Atas Negeri Lubuk
Sikaping. Dengan izin Allah SWT pada tahun yang sama diterima pada Institut
Pertanian Bogor melalui jalur Penelusuran Minat dan Kemampuan (PMDK).
Penulis memilih Fakultas Kedokteran Hewan dan menyelesaikan Sarjana
Kedokteran Hewan pada tahun 1990, serta meraih gelar Dokter Hewan pada tahun
1991.
Setelah menggeluti dunia kajian lingkungan (AMDAL) dengan memperoleh
sertifikasi AMDAL A dan B, serta profesi dokter hewan pada perusahaan
obat-obatan, penulis diterima sebagai Pegawai Negeri Sipil tahun 1994 pada
Departemen Pertanian, tepatnya di Balai Embrio Ternak Cipelang-Bogor,
institusi tempat penulis bekerja sampai sekarang.
Menikah pada tahun 1996 dengan Fuji Mariati, SP. dan dikaruniai empat
orang anak masing-masing Fathiyya Nisatudz Dzikra, Fadlan Rizqon Tsany, Aziz
Muhammad Zhafran dan Ahmad Zaid Al Fatih.
Pada bulan Maret sampai dengan September 1998, penulis berkesempatan
mengikuti kursus “Feed Production and Utilization for Ruminant Animal” di
Jepang atas biaya dari Japan International Corporation Agency (JICA). Pada saat
yang sama penulis memanfaatkan banyak kesempatan dan aktif mempelajari
teknologi embrio transfer di National Livestock Breeding Centre (NLBC)
Fukushima Jepang.
Penulis mendapat kesempatan untuk melanjutkan Magister Sains pada
Program Studi Biologi Reproduksi Sekolah Pascasarjana Institut Pertanian Bogor,
sebagai pegawai tugas belajar yang mendapat beasiswa dari Badan Pengembangan
DAFTAR ISI
Halaman
DAFTAR TABEL ………..… xv
DAFTAR GAMBAR ………..…... xvi
PENDAHULUAN………..…… 1
Latar Belakang ……….……. 1
Kerangka Pemikiran……….….…. 2
Hipotesis ………..……. 4
Tujuan Penelitian ……….….… 4
Manfaat Penelitian ……….……... 4
TINJAUAN PUSTAKA ……….……... 6
Hormon dan Perannya dalam Dinamika Ovari ...……….….. 6
Gelombang Perkembangan Folikel ……….…... 9
Sinkronisasi Gelombang Folikel ……….……….…. 11
Superovulasi pada Sapi Donor ……….……. 12
Sinkronisasi Ovulasi pada Sapi Donor ………. ……….. 13
Pembentukan Corpus luteum ……… 14
MATERI DAN METODE ………..….. 17
Waktu dan Tempat Penelitian ……….…….. 17
Materi Penelitian………..………..……… 17
Metode Penelitian .………..……….. 17
xiv
Penelitian II. Introduksi Sinkronisasi Gelombang Folikel (SGF) dan
kombinasi dengan Sinkronisasi Ovulasi (SGFO) …... 22
Parameter yang diamati …………..……….……….. 25
Evaluasi dan Klasifikasi Embrio... 26
Pengumpulan, Pengolahan dan Analisa Data ……… 28
HASIL DAN PEMBAHASAN ………..……… 30
Respon Superovulasi dengan Pemberian Gonadotropin dengan lama waktu berbeda ………. 30
Introduksi Sinkronisasi Gelombang Folikel (SGF) dan kombinasi dengan Sinkronisasi Ovulasi (SGFO) ………. …... 34
Sinkronisasi Gelombang Folikel (SGF) ………. 34
Sinkronisasi Gelombang Folikel dan Ovulasi (SGFO) …………... 39 Sinkronisasi Gelombang Folikel dan Ovulasi (SGFO) pada Sapi Potong dan Perah Non Laktasi ... 42
SIMPULAN DAN SARAN …..……….… 46
Simpulan ...……….….. 46
Saran ……….…. 46
DAFTAR PUSTAKA ……….... 47
DAFTAR TABEL
Halaman
1 Protokol Aplikasi Gonadotropin FSH-LH pada perlakuan selama
3 hari ……….. 19
2 Protokol Aplikasi Gonadotropin FSH-LH pada perlakuan selama
4 hari………... 20
3 Protokol Aplikasi Gonadotropin FSH-LH pada perlakuan selama
5 hari ……….. 20
4 Protokol Sinkronisasi Gelombang Folikel (SGF) sebelum aplikasi
Gonadotropin ……….. ………. 22
5 Protokol Sinkronisasi Gelombang Folikel dan Ovulasi (SGFO) ……….. 24
6 Klasifikasi embrio berdasarkan kualitas... 27
7 Respon superovulasi dengan pemberian FSH-LH selama 3, 4 dan
5 hari ………. 30
8 Respon superovulasi pada perlakuan kombinasi FSH-LH dengan dengan Sinkronisasi Gelombang Folikel (SGF) serta Sinkronisasi
Gelombang Folikel dan Ovulasi (SGFO) ………... 35
9 Respon superovulasi sapi potong dan sapi perah non laktasi pada kombinasi FSH-LH dengan Sinkronisasi Gelombang Folikel dan
DAFTAR GAMBAR
Halaman
1 Gelombang perkembangan folikel pada sapi ………. ……... 10
2 Respon Ovarium setelah perlakuan superovulasi ………... 16
3 Alur Proses Superovulasi dengan Model Penelitian ………... 18
4 Diagram Penelitian Pemberian FSH-LH selama 3, 4 dan 5 hari ... 21
5 Diagram Penelitian Sinkronisasi Gelombang Folikel (SGF) dan Sinkronisasi Gelombang Folikel-Ovulasi (SGF) …………... 23
6 Teknik panen embrio non bedah menggunakan kateter Foley ... 26
PENDAHULUAN
Latar Belakang
Dalam upaya menjadikan subsektor peternakan sebagai pendorong
kemandirian pertanian Nasional, dibutuhkan terobosan pengembangan sistem
peternakan. Dalam percepatan penciptaan bibit unggul ternak, aplikasi
bioteknologi reproduksi pada taraf rekayasa proses dan rekayasa genetik seperti
MOET (Multiple Ovulations and Embryo Transfer), IVF (In vitro Fertilization),
transfer inti (nuclear transfer) menjadi pilihan strategis yang tepat.
Setelah tiga dasawarsa aplikasi IB dan satu dasawarsa aplikasi TE di
Indonesia, teknologi ini telah memberikan sumbangan yang cukup berarti bagi
peningkatan populasi dan genetik ternak sapi Nasional, meskipun belum
maksimal. Khususnya dalam aplikasi Transfer Embrio (TE) senantiasa dilakukan
pengkajian dan penelitian untuk penyempurnaan di masa datang. Dalam kegiatan
Transfer Embrio masih terus dikembangkan metode produksi embrio maupun
transfer embrio untuk efisiensi produksi bibit unggul, khususnya pada sapi.
Ternak sapi secara alami hanya dapat menghasilkan anak sekitar 6-8 ekor
sepanjang hidupnya, meskipun sebenarnya memiliki puluhan ribu potensi oosit.
Toelihere (1985) menyebutkan bahwa dalam ovarium sapi terdapat sekitar
140.000 oosit sampai sapi mencapai umur empat sampai enam tahun dan
kemudian jumlahnya menurun sampai 25.000 pada umur 10 sampai 14 tahun dan
mendekati nol pada umur 20 tahun.
Potensi oosit sapi yang cukup banyak tersebut dapat dioptimalkan dengan
introduksi bioteknologi reproduksi antara lain melalui superovulasi (SOV),
sehingga sapi unggul dapat menghasilkan anak jauh lebih banyak semasa
hidupnya. Superovulasi adalah upaya stimulasi perkembangan folikel dan induksi
ovulasi ganda dengan penggunaan hormonal seperti gonadotropin.
Dalam pelaksanaannya sampai saat ini, proses produksi embrio melalui
superovulasi pada sapi donor, masih menghadapi beberapa kendala antara lain:
bervariasinya respon donor terhadap perlakuan superovulasi dan perolehan
kerusakan embrio (degeneratif) dan jumlah oosit yang tidak terbuahi
(unfertilized), merupakan fokus penting yang harus diatasi.
Masalah tersebut diatas, secara ekonomis akan meningkatkan biaya
produksi per satuan embrio. Hal ini dapat menjadi kendala dalam penerapan
teknologi transfer embrio, sehingga prospek agribisnis transfer embrio dapat
terkendala. Disisi lain respon peternak cukup tinggi terhadap ternak hasil transfer
embrio karena telah terbukti keunggulannya baik produksi susu (sapi perah)
maupun bobot badan (sapi potong).
Dalam upaya meningkatkan efisiensi proses produksi embrio in vivo, maka
dilakukan penyempurnaan dari metode superovulasi konvensional kepada metode
superovulasi yang lebih maju melalui pengkajian terhadap: model aplikasi
gonadotropin, sinkronisasi gelombang folikel melalui eliminasi folikel dominan,
sinkronisasi ovulasi menyertai sinkronisasi gelombang folikel.
Kerangka Pemikiran
Pada proses produksi embrio secara in vivo, sapi donor merupakan “mesin
produksi” yang sangat penting. Karena itu kondisi donor harus senantiasa prima
dengan didukung oleh kesehatan dan nutrisi yang baik.
Pengenalan siklus ovari ternak donor secara cermat sangat menentukan
keberhasilan kegiatan superovulasi untuk menghasilkan embrio. Pengenalan
siklus ovari yang dimaksud meliputi pengenalan gelombang pertumbuhan folikel
(dinamika folikel), deteksi keberadaan folikel dominan, deteksi keberadaan
korpus luteum, pola ovulasi ganda dan deteksi birahi. Proses pertumbuhan folikel
meliputi tahap rekrutmen folikel primordial, seleksi folikel dan terbentuk folikel
dominan (Johnson & Everit 1995). Dengan pemahanan hal diatas maka dapat
dilakukan aplikasi hormonal (GnRH dan atau gonadotropin) secara tepat untuk
tujuan superovulasi dan sinkronisasi ovulasi agar respon ovarium dan perolehan
embrio meningkat.
Pertumbuhan folikel pada sapi dapat terdiri dari 2 atau 3 gelombang
(follicular waves). Superovulasi akan efektif jika dilakukan pada awal
perkembangan folikel (saat muncul gelombang folikel) yang mempunyai
Sato et al. 2005). Pada saat tersebut, sejumlah folikel dapat tumbuh sampai
mencapai folikel dominan setelah distimulasi dengan hormon gonadotropin, dan
akan lebih efektif jika terlebih dahulu disertai dengan penghilangan (eliminasi)
folikel dominan. Dalam keadaan normal pada setiap gelombang folikel, ada
sebuah folikel yang akan menjadi folikel dominan. Folikel dominan tersebut
menghasilkan inhibin yang mempunyai efek menekan pertumbuhan folikel-folikel
lain serta menghalangi kemunculan gelombang folikel. Dalam kegiatan
superovulasi, dimana dikehendaki lebih banyak folikel yang berkembang, maka
folikel dominan tersebut harus dieliminasi baik secara mekanis maupun hormonal,
untuk selanjutnya diikuti kemunculan gelombang folikel, yang merupakan saat
terbaik dimulai superovulasi untuk mendapatkan hasil yang maksimal
(Rocha 2005).
Dalam kegiatan superovulasi, penggunaan hormon gonadotropin eksogen
berfungsi untuk meningkatkan stimulasi pertumbuhan folikel. Aplikasi
gonadotropin yang tepat baik lama waktu, dosis, jenisnya akan mempengaruhi
respon donor dan perolehan embrio. Waktu optimal aplikasi gonadotropin akan
memberikan hasil yang maksimal, efisiensi waktu, tenaga, biaya dan penggunaan
donor. Induksi gonadotropin menyebabkan sejumlah folikel akan berkembang
menjadi dominan dalam waktu yang hampir bersamaan. Semua folikel dominan
tersebut semestinya mengalami ovulasi dalam rentang waktu yang hampir
bersamaan. Namun pada banyak donor ditemukan kegagalan ovulasi
(anovulation) dari beberapa folikel–folikel dominan atau waktu ovulasi yang
relatif tidak serentak (Putro 1996). Kegagalan ovulasi dan proses ovulasi yang
tidak serentak dapat menurunkan jumlah dan kualitas embrio (Saito 1997).
Solusi dari permasalahan diatas, dalam penelitian ini disamping penggunaan
hormon gonadotropin (FSH-LH) terutama untuk menstimulasi pertumbuhan
folikel, juga dilakukan sinkronisasi gelombang folikel dan sinkronisasi ovulasi
dengan pemberian GnRH. Demikian juga keberadaan korpus luteum (CL) yang
menghasilkan progesteron dieliminasi dengan penyuntikan PGF2α, sehingga
dengan lisisnya CL akan terjadi penurunan kadar progesteron (Senger 1999).
gonadotropin oleh progesteron akan dihilangkan, sehingga gonadotropin endogen
dikeluarkan terutama pelepasan LH sebagai induktor ovulasi.
Hipotesis
Hipotesa terhadap hasil penelitian, adalah sebagai berikut :
1. Perbedaan lama aplikasi gonadotropin akan memberikan pengaruh terhadap
tingkat respon ovarium dan perolehan embrio.
2. Sinkronisasi gelombang folikel akan mempengaruhi respon ovarium dan
perolehan embrio pada perlakuan superovulasi.
3. Sinkronisasi ovulasi menyertai sinkronisasi gelombang folikel pada
superovulasi akan lebih mempengaruhi jumlah perolehan embrio yang layak
transfer.
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengkaji pengaruh lama aplikasi gonadotropin terhadap tingkat respon
ovarium dan perolehan embrio.
2. Mengkaji pengaruh sinkronisasi gelombang folikel terhadap tingkat respon
ovarium dan perolehan embrio.
3. Mengkaji pengaruh sinkronisasi gelombang folikel dan ovulasi terhadap
jumlah perolehan embrio terutama embrio yang layak transfer.
Manfaat Penelitian
Manfaat penelitian ini adalah sebagai berikut :
1. Sebagai bahan masukan dan penyempurnaan dalam proses produksi embrio in
vivo pada sapi donor khususnya di Balai Embrio Ternak Cipelang-Bogor dan
umumnya di Indonesia.
2. Sebagai upaya menuju efisiensi produksi embrio in vivo dan efisiensi
3. Sebagai penyempurnaan aplikasi bioteknologi dalam terobosan percepatan
produksi bibit unggul ternak, untuk mendorong peningkatan populasi ternak
TINJAUAN PUSTAKA
Hormon dan Perannya dalam Dinamika Ovari
Gonadotrophin Releasing Hormone (GnRH). GnRH tidak secara
langsung mempengaruhi ovarium, tetapi hormon yang dihasilkan hipotalamus ini
bekerja menstimulus sintesis dan pelepasan gonadotropin (FSH atau LH) dari
hipofise anterior. Senger (1999) menyatakan hormon GnRH mengatur sekresi
gonadotropin yang juga disebut LH/FSH releasing hormone (LH/FSH-RH).
GnRH telah digunakan secara luas sejak tahun 1970 an untuk mengatasi
kejadian sistik folikel. Penggunaan pada donor untuk produksi embrio ditujukan
untuk sinkronisasi gelombang folikel dan meningkatkan ovulasi. Preparat sintetis
GnRH merupakan dekapeptida, dengan rantai 10 asam amino.
Pemberian GnRH selama siklus estrus menyebabkan regresi dan ovulasi
folikel dominan dan inisiasi segera gelombang folikel baru pada 2.5 hari
kemudian (Pursley et al. 1995). Pemberian GnRH diketahui akan menyebabkan
ovulasi folikel dominan atau regresi folikel sampai atresia tergantung pada status
folikel pada saat pemberian GnRH (Twaqiramungu et al. 1995). Penyuntikan
GnRH akan dapat menginduksi pelepasan LH dan FSH dari hipofise anterior,
yang efeknya tergantung kepada dosis GnRH yang digunakan. Penggunaan dosis
GnRH yang tinggi dapat berpengaruh sebaliknya pada penurunan simpanan LH
dan sensitivitasnya akibat menurunnya jumlah reseptor pada sel-sel pituitary, yang
akhirnya menekan sekresi gonadotropin dari kelenjar hipofise (Ulker et al. 2001)
Twaqiramungu et al. (2002) menyarankan penggunaan GnRH setelah
pemberian PGF2α untuk memastikan ovulasi folikel dominan. Lebih lanjut
dinyatakan pemberian GnRH pada 48 jam setelah pemberian PGF2αmeningkatkan
ovulasi dan diketahui waktu yang tepat untuk inseminasi buatan (24 jam
kemudian). Pemberian GnRH sebelum superovulasi, menginduksi pelepasan LH
dan ovulasi atau luteinisasi folikel dominan yang ada, selanjutnya akan terjadi
gelombang folikel yang baru dalam 2 hari. Pemberian PGF2α untuk menginduksi
regresi CL yang asli dan CL yang terbentuk hasil induksi GnRH. Penyuntikkan
Pentingnya pemberian GnRH kedua telah ditunjukkan dengan tingkat ovulasi
yang lebih tinggi pada sapi yaitu 99 % dibandingkan dengan satu kali pemberian
GnRH yang hanya 77 % (Bergfelt et al.1997).
Twaqiramungu et al. (1995) menyatakan bahwa aplikasi GnRH eksogenous
pada proses produksi embrio ada dua bentuk: pertama: aplikasi sebelum
superovulasi dengan tujuan untuk sinkronisasi gelombang folikel, melalui
eliminasi folikel dominan. Awal gelombang folikel terjadi 3-4 hari setelah
penyuntikan GnRH, yang sangat penting artinya dalam sinkronisasi antar
individu. Penggunaan GnRH untuk sinkronisasi gelombang folikel dilakukan
Martinez et al. (2000) pada sapi perah, Moghaddam et al. (2002) pada sapi
perah dan potong, Fernandez et al. (2002) pada sapi perah induk dan dara.
Aplikasi kedua GnRH bertujuan untuk sinkronisasi ovulasi, diberikan 48 jam
setelah pemberian PGF2α atau 12 jam sebelum IB (Sato et al. 2005) atau saat
pelaksanaan IB (Ptaszynka 2002), yang akan meningkatkan pelepasan LH
sebagai induktor ovulasi. Aplikasi GnRH untuk tujuan sinkronisasi ovulasi telah
banyak dilakukan antara lain oleh Barros et al. (2000) pada sapi potong,
Caravalho et al. (2002) pada kerbau, Dominiguez et al. (2000) pada sapi potong,
Irikura et al. (2002) pada kerbau. Penggunaan GnRH untuk sinkronisasi
gelombang folikel (diawali ovulasi folikel dominan) dan sinkronisasi ovulasi
sangat penting artinya dalam meningkatkan efisiensi reproduksi ternak
(Rajamahendran 2002). Lebih lanjut dijelaskan bahwa superovulasi pada saat ada
folikel dominan memberikan respon yang sangat bervariasi, bahkan tidak
menimbulkan respon.
Berbagai macam GnRH sintetik sering digunakan dalam penelitian.
Martinez et al. (2003) membuktikan bahwa penggunaan gonadorelin diacetate
tetrahydrate, gonadorelin hydrochloride dapat meningkatkan pelepasan LH untuk
menginduksi ovulasi folikel dominan dan segera terjadi gelombang folikel baru.
Peter (2005) menyatakan bahwa GnRH dapat digunakan untuk mencegah
kematian embrio, pengaturan program sinkronisasi perkembangan folikel, induksi
ovulasi pada anestrus setelah partus, dan penanggulangan sistik ovari. Lebih lanjut
dinyatakan GnRH efektif dalam meningkatkan angka kebuntingan, jika diberikan
Folicle Stimulating Hormone (FSH) - Luteinizing Hormone (LH).
Toelihere (1985) menyatakan bahwa hormon utama yang digunakan pada
superovulasi adalah hormon gonadotropin, yaitu FSH dan LH. FSH merupakan
hormon gonadotropin dengan unsur glikopeptida yang memiliki reseptor pada sel
granulosa folikel, berfungsi menstimulasi pertumbuhan folikel, sehingga sangat
diperlukan dalam proses superovulasi. FSH mempunyai berat molekul 32.700
sampai 33.700 kDa pada ternak kambing dan kuda (Kaltenbach & Dunn 1980
dalam Yusuf 1990) dan 29.000 kDa pada babi.
Secara kimiawi FSH mempunyai dua sub unit, rantai α dan rantai β, yang tidak identik dan tidak terdapat ikatan kovalen diantara keduanya. Rantai β terdiri dari 96 asam amino dan dua rantai karbohidrat, sedangkan rantai α terdiri dari 119 asam amino dan satu rantai karbohidrat ( Kaltenbach & Dunn 1980 dalam Yusuf
1990). Salah satu preparat gonadotropin yang dapat digunakan dalam
superovulasi yaitu Pluset® (Laboratorios Callier, S.A., Spain) yang merupakan
ekstraksi hipofise, dimana setiap dosis mengandung 1000 IU FSH dan 1000 IU
LH (Anonim 2002). Hormon gonadotropin ini disusun oleh sub unit α dan sub unit β (BM 27.000 – 34.000 kDa). Lebih lanjut dinyatakan bahwa aplikasi FSH-LH tersebut pada ternak sapi, menunjukkan waktu paruh dari FSH adalah 150
menit dan LH selama 40 menit. LH berfungsi sebagai induksi proses ovulasi,
pematangan akhir folikel dan proses luteinisasi. Pemberian LH harus dalam kadar
yang optimal, karena kelebihan LH dapat menurunkan angka fertilitas disebabkan
proses pematangan oosit yang prematur (Donaldson & Ward 1996).
Progesteron, Estrogen dan Prostaglandin 2 Alpha. Johnson dan Everit
(1995), menyatakan tingginya konsentrasi progesteron yang dihasilkan oleh
korpus luteum pada fase luteal secara alami menghambat terjadinya ovulasi
folikel dominan, sehingga akhirnya folikel tersebut mengalami atresia. Menurut
Senger (1999) ovulasi tidak dapat terjadi dalam kondisi dimana kadar progesteron
dominan, kondisi hormonal yang sesuai untuk perkembangan akhir folikel akan
nyata setelah luteolisis (tanpa CL) dan menurunnya kadar progesteron. Pada
progesteron akibat lisis korpus luteum oleh aplikasi hormon PGF2α. Lebih lanjut
dinyatakan bahwa mekanisme alami stimulasi aktivitas PGF2α endogen diawali
oleh sekresi oxytocin oleh korpus luteum dengan reseptor yang sudah terbentuk
pada dinding uterus. Respon selanjutnya uterus mensekresi PGF2α ke dalam
pembuluh darah sampai mencapai reseptornya di sel luteal besar dari korpus
luteum. Mekanisme kerja dari PGF2α ada dua cara yaitu: melalui mekanisme
apoptosis dari sel luteal dan mekanisme aktivasi protein kinase (PKC) yang
menghambat konversi kolesterol menjadi progesteron.
Estrogen merupakan hormon steroid yang terdapat dalam cairan folikel.
Kegagalan ovulasi menimbulkan tingginya kadar estrogen dalam darah,
keberadaannya pada saat pertumbuhan embrio akan berefek menurunkan kualitas
embrio (Saito 1997).
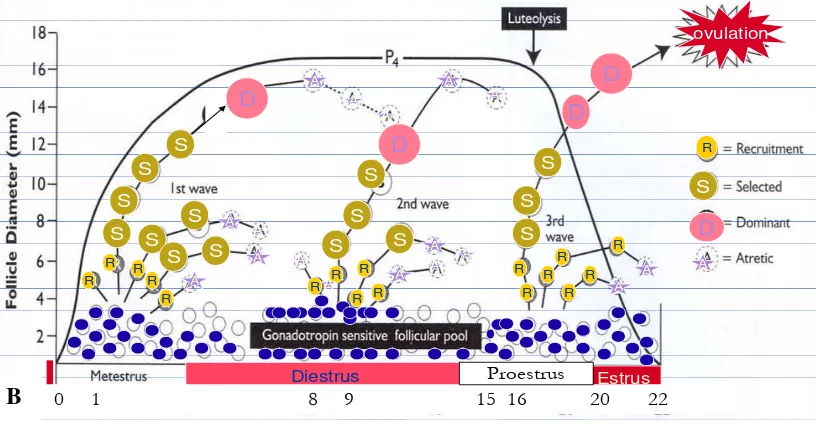
Gelombang Perkembangan Folikel
Perkembangan folikel di dalam ovarium merupakan proses yang
berkesinambungan dan tidak hanya melibatkan satu folikel selama siklus, tetapi
sekelompok folikel sehingga dianalogikan sebagai gelombang folikel (Bo et al.
1995: Senger 1999). Gelombang folikel didefinisikan sebagai perkembangan
folikel dengan diameter 4 sampai 5 mm dalam jumlah besar secara serentak,
diikuti dengan mekanisme seleksi, perkembangan menjadi folikel dominan dan
penekanan/supresi terhadap perkembangan folikel subordinat.
Dalam satu siklus estrus yang normal pada sapi terdapat 2 atau 3 gelombang
pertumbuhan folikel (Lucy et al. 1992; Rajamahendran 2002). Menurut Ooe et
al. (1997) pada tipe dua gelombang, gelombang terjadi umumnya pada satu hari
setelah estrus ( D1) dan hari ke-10 (D10), sedangkan pada tipe 3 gelombang ,
gelombang terjadi pada hari ke-1(D1), hari ke-8 (D8) dan hari ke-15 (D15).
Sedangkan menurut Ginther et al. (1989) gelombang folikel terdeteksi pada hari
estrus (Do) dan hari ke-10 (D10) pada tipe dua gelombang dan pada hari estrus
(Do), hari ke-9 (D9), serta ke-16 (D16) pada tipe tiga gelombang. Lucy et al.
(1992) menyatakan bahwa dari semua awal gelombang folikel tersebut,
gelombang folikel kedua merupakan gelombang yang lebih sensitif terhadap
Gambar 1 Gelombang perkembangan folikel pada sapi. A.Tipe 2 gelombang; B. Tipe 3 gelombang (modifikasi dari Lucy et al. 1992; Ginther et al. 1989).
dalam penentuan waktu yang tepat untuk memulai superovulasi sapi donor.
Apabila superovulasi dimulai pada awal gelombang folikel, maka keberhasilan
akan lebih tinggi. Disisi lain pada hari keenam siklus estrus, dari kedua tipe
yang berdiameter lebih dari 8 mm (Sato et al. 2005). Keberadaan folikel dominan
menurunkan respon superovulasi karena inhibin dan estradiol yang dihasilkan
menghambat perkembangan folikel lain (subordinat) melalui mekanisme umpan
balik negatif terhadap FSH di hipofise anterior (Rajamahendran 2002). Juga
keberadaan sebuah folikel dominan tersebut menghalangi munculnya gelombang
folikel berikutnya (Adam et al. 1994).
Sinkronisasi Gelombang Folikel
Sinkronisasi gelombang folikel merupakan upaya penyerentakan terjadinya
awal gelombang gelombang folikel, yang dapat terjadi setelah penghilangan
folikel dominan baik secara hormonal maupun secara mekanis/aspirasi. Pada
prinsipnya merupakan penghilangan efek penekanan dari folikel dominan
sehingga dapat memunculkan gelombang folikel baru (Bo et al. 1995). Pemberian
GnRH atau aspirasi folikel 2 hari sebelum superovulasi terbukti dapat
meningkatkan respon ovulasi (Kohram et al. 1998). Sato et al. (2005)
menyatakan bahwa penyuntikan GnRH dapat menginduksi ovulasi dan kemudian
menstimulasi peningkatan FSH endogen selanjutnya gelombang folikel terjadi
dalam waktu yang tepat tanpa variasi waktu pada semua sapi. Lebih lanjut
dinyatakan bahwa penyuntikan 25 μg GnRH pada hari ke-6 siklus estrus, (2.5 hari sebelum superovulasi) menghasilkan embrio layak transfer yang lebih tinggi
dibanding perlakuan 50 dan 100 μg GnRH. Ablasi (penghilangan) folikel dominan sebelum superovulasi terbukti dapat meningkatkan perolehan total embrio dan
embrio yang layak transfer pada sapi perah produksi susu tinggi (Amiridis et al.
2006). Bo et al. (1995) melakukan aspirasi semua folikel yang berdiameter lebih
atau sama dengan 5 mm, sebagai sebuah metode ablasi folikel untuk menginduksi
sinkronisasi gelombang folikel dan sinkronisasi ovulasi. Hasilnya adalah sebuah
gelombang folikel baru muncul pada 1.5 hari kemudian, dan setelah pemberian
PGF2α terdeteksi ovulasi yang serentak. Ablasi folikel transvaginal dengan
bantuan USG merupakan suatu metode yang sangat bermanfaat dalam
sinkronisasi gelombang folikel dalam kegiatan superovulasi. Untuk tujuan
sinkronisasi gelombang folikel, Kanitz et al. (2006) melaporkan pemberian
22 ekor diantaranya (81.5 %) mengalami ovulasi antara 27 sampai 33 jam setelah
pemberian GnRH.
Mengenai kapan munculnya gelombang folikel setelah mendapat perlakuan,
ada beberapa pendapat yaitu 3-4 hari setelah pemberian GnRH (Twaqiramungu et
al. 1995); 2-4 hari setelah pemberian GnRH (Pursley et al. 1995); 1.5 hari setelah
aspirasi folikel dan 3-6 hari setelah pemberian Progesteron implant-Estradiol 17β (Bo et al.1995). Sebuah folikel dominan akan terbentuk dalam 2 hari setelah
munculnya gelombang folikel (Ginther et al. 1996) atau dalam 3-4 hari setelah
aplikasi GnRH (Bo et al. 1995). Folikel dominan baru tersebut berkembang
menjadi folikel ovulatory setelah proses luteolisis yang diinduksi dengan PGF2α.
Superovulasi pada Sapi Donor
Ovulasi adalah pecahnya folikel de Graaf dan keluarnya ovum bersama
sel-sel yang menyelubunginya dan sedikit cairan folikel yang terjadi akibat
rangsangan hormon LH (Hafez & Hafez 2000). Secara normal pada sapi,
ovulasi terjadi pada akhir fase estrus yaitu sekitar 12-18 jam sesudah akhir estrus
(Jemmeson 2006) atau 30 jam setelah onset estrus (Whittier & Geary 2007).
Secara alami jumlah oosit yang diovulasikan pada satu kali ovulasi pada sapi
adalah satu oosit (Toelihere 1985). Umumnya hanya folikel dominan yang akan
ovulasi pada akhir siklus estrus meskipun rekruitmen pada gelombang folikel
terjadi beberapa kali dalam satu siklus (Setiadi et al. 2005). Secara normal,
ovulasi dapat terjadi pada setiap situs di permukaan ovarium kecuali pada hilus
(Senger 1999).
Superovulasi pada sapi bertujuan untuk mendapatkan sejumlah besar embrio
yang dapat ditransfer dengan kemungkinan tinggi menghasilkan kebuntingan
(Mapletoft & Pierson 1993). Unsur utama pada superovulasi adalah pemberian
hormon gonadotropin yang dimulai pada hari ke-9 dari siklus birahi untuk sapi
dengan panjang siklus birahi 21-23 hari dan pada hari ke-10 untuk sapi dengan
panjang siklus birahi 18-20 hari (Dielleman & Bevers 1993). Sato et al. (2005)
melaporkan superovulasi dapat dilakukan antara hari ke 8 dan hari ke 12 siklus
estrus atau 2.5 hari setelah pemberian GnRH. Lebih lanjut dinyatakan bahwa
gelombang folikel terjadi atau tanpa keberadaan folikel dominan. Demikian juga
Setiadi et al. (2005) menyatakan bahwa aplikasi hormon gonadotropin pada saat
muncul gelombang folikel dapat meningkatkan respon superovulasi. Beragam
variasi dari respon ovarium terhadap perlakuan superovulasi pada sapi berkaitan
erat dengan beragamnya status perkembangan folikel pada saat perlakuan
(Bo et al. 1995; Rajamahendran 2002; Sato et al. 2005). Respon ovarium lebih
rendah apabila superovulasi dilakukan pada saat kehadiran sebuah folikel
dominan karena adanya inhibin, sebaliknya respon lebih tinggi jika dilakukan saat
keberadaan sejumlah besar folikel-folikel kecil (Romero et al. 1991; Sato et al.
2005). Respon untuk ovulasi terhadap pemberian gonadotropin pada satu hari
sebelum atau pada hari munculnya gelombang folikel, lebih tinggi dari perlakuan
pada satu atau dua hari setelah munculnya gelombang folikel (Bo et al. 1995).
Colenbrander (2004) menyatakan bahwa secara umum periode superovulasi
pada sapi terdiri dari 2 periode perkembangan oosit sampai embrio. Pertama,
periode folikel yang berlangsung 5-6 hari, dimulai sejak pemberian gonadotropin
pada fase luteal sampai dengan ovulasi. Kedua, periode intraoviduk dan intra
uterin, berlangsung 6-7 hari, mulai saat fertilisasi, perkembangan embrio sampai
embrio siap dikoleksi.
Sebelum pelaksanaan superovulasi pada ternak donor, salah satu
pertimbangan yang utama adalah pengenalan siklus estrus, pemeriksaan
ovarium (deteksi awal gelombang folikel, deteksi dan penghilangan folikel
dominan, deteksi korpus luteum). Menurut Hafez dan Hafez (2000) pemeriksaan
kondisi ovarium secara klinis dapat dilakukan dengan cara palpasi rektal dan
menggunakan ultrasonografi.
Sinkronisasi Ovulasi pada Sapi Donor
Sinkronisasi ovulasi merupakan upaya penyerentakan pelepasan oosit
(ovulasi) dari folikel de Graaf. Pada sapi donor sangat dibutuhkan ovulasi
serentak agar dari sekian banyak oosit yang diovulasikan, kesemuanya dapat
terfertilisasi dalam waktu yang relatif bersamaan, sehingga dapat diperoleh
embrio dalam tahap perkembangan yang sama. Melalui sinkronisasi ovulasi,
embrio yang tidak layak transfer (degenerasi) serta oosit tidak terbuahi menurun
(Saito, 1995). Sinkronisasi ovulasi telah demikian berkembang, dengan berbagai
macam protokol dan metode yang dilakukan. Dejarnette dan Marshall (2003)
menyatakan bahwa sinkronisasi ovulasi pada sapi perah laktasi menggunakan
GnRH pada 48 jam setelah pemberian PGF2α atau 12 jam sebelum pelaksanaan
inseminasi terbukti meningkatkan konsepsi. Sedang Kanitz et al. (2006)
melaporkan pemberian PGF2α diikuti GnRH 48 jam kemudian, menyebabkan
81.5 % sapi dara mengalami ovulasi rata-rata 24.4 jam setelah perlakuan GnRH.
Pemberian GnRH setelah gonadotropin pada kegiatan superovulasi dapat
menghasilkan ovulasi yang serentak, kepastian waktu IB yang tepat tanpa
menurunkan jumlah perolehan embrio yang berkualitas (Bo et al. 2006).
Pentingnya GnRH untuk sinkronisasi ovulasi pada sapi dibuktikan dengan angka
ovulasi yang tinggi yaitu 99 % (Bergfelt et al. 1997).
Pembentukan Corpus Luteum
Setelah terjadi ovulasi maka pada situs pelepasan oosit akan terbentuk
Corpus Luteum (CL). Selama awal fase luteal (metestrus), CL dibentuk dari
sel-sel luteal. Pada pertengahan fase luteal (diestrus) sel-sel-sel-sel luteal menghasilkan
sejumlah besar progesteron. Selama akhir fase luteal, CL dilisiskan oleh PGF2α
yang dihasilkan oleh endometrium uterus. Lisis CL diikuti dengan penurunan
kadar progesteron, sehingga mekanisme umpan balik negatif progesteron pada
hypotalamus hilang, mengakibatkan peningkatan GnRH yang menandakan
dimulai fase folikular. Ukuran CL pada hari ke 3 - 5 mulai meningkat ukurannya
sampai maksimal disertai dengan peningkatan produksi progesteron sampai kadar
maksimal sekitar hari ke-10 (Senger 1999). Lebih lanjut dinyatakan bahwa CL
tersusun atas sel-sel luteal yang berperan menghasilkan progesteron. Konsitensi/
kekenyalan badan CL sangat ditentukan oleh jumlah sel-sel luteal dan
vaskuralisasi darah kebagian tersebut. Demikian juga kemampuan CL
memproduksi progesteron tergantung pada tingkat vaskularisasi pada lapisan
seluler. Fungsi CL yang rendah (sintesa dan sekresi progesteron sedikit) diyakini
akan menjadi penyebab penting kegagalan reproduksi, ketidakmampuan uterus
Pada sapi CL dapat diperiksa secara palpasi rektal. Namun status
fungsional CL sulit dikenali secara palpasi rektal sebab ukuran CL tidak selalu
berkaitan dengan kemampuannya memproduksi progesteron. Secara palpasi,
umumnya CL yang fungsional akan teraba karena menonjol pada permukaan
ovarium. Namun tidak semua badan CL selalu muncul dengan jelas pada
permukaan ovarium, kadangkala pada CL yang telah mencapai ukuran maksimal
dan fungsional namun sedikit bagian yang muncul. Hal ini penting diperhatikan
apabila akan menilai keberadaan dan status fungsional CL. Stabenfeld dan Edqvist
(1984) dalam Yusuf (1990) menyatakan bahwa ukuran CL mencapai maksimum
pada hari ke tujuh sampai ke sembilan dari siklus estrus.
Dalam satu siklus estrus, CL harus mengalami lisis agar fase folikular
dimulai. Ovulasi tidak dapat terjadi dalam kondisi dimana kadar progesteron
dominan (Senger 1999). Luteolisis berarti disintengrasi atau dekomposisi dari
CL, yang terjadi 2-3 hari pada akhir fase luteal. Ada dua hormon yang berperan
penting dalam lisis CL yaitu oxytocin yang dihasilkan CL dan hormon PGF2α
yang dihasilkan endometrium uterus.
Pada sinkronisasi gelombang folikel, terutama dengan menggunakan GnRH
pada hari ke 6-7 siklus estrus, sebuah CL baru dapat terbentuk setelah terjadi
ovulasi folikel dominan, sehingga terdapat dua CL pada saat bersamaan
(Jemmeson 2006; Whittier & Geary 2007). Pada kegiatan superovulasi, dimana
terjadi ovulasi sel telur dalam jumlah banyak, maka secara siklus pada bekas
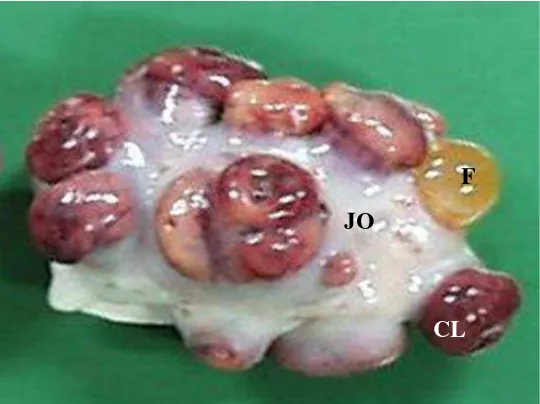
ovulasi akan terbentuk CL dalam jumlah yang sama. Secara morfologi, ovarium
menjadi berukuran lebih besar dari normal dengan permukaan dipenuhi CL
(Gambar 2), yang dapat terdeteksi dengan jelas secara palpasi atau dengan
F
JO
CL
MATERI DAN METODA
Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan April 2005 sampai dengan Januari 2006
bertempat di Laboratorium Produksi Embrio Balai Embrio Ternak
Cipelang-Bogor- Direktorat Jenderal Peternakan Departemen Pertanian.
Materi Penelitian
Materi penelitian terdiri dari lima puluh (50) ekor sapi donor yaitu perah
non laktasi FH (Frissien Holstein) dan potong (Simmental dan Limousin) yang
berumur antara 3 sampai 7 tahun, telah pernah beranak, rata-rata telah 3 kali
dilakukan superovulasi dengan respon baik untuk produksi embrio, nilai BCS
3.0–4.0, kesehatan yang baik dan diberikan pakan yang sesuai standar donor,
dipelihara dalam kandang pada manajemen dan lingkungan yang sama.
Metode Penelitian
Penelitian dilaksanakan dalam 2 (dua) tahap. Penelitian I bertujuan untuk
membandingkan pengaruh lama pemberian (3, 4 dan 5 hari) gonadotropin
terhadap respon ovarium dan jumlah perolehan embrio. Penelitian II untuk
melihat pengaruh sinkronisasi gelombang folikel (SGF) dan kombinasi dengan
sinkronisasi ovulasi (SGFO) terhadap respon ovarium dan jumlah perolehan
embrio. Pada penelitian II, lama waktu superovulasi yang dipakai adalah waktu
terbaik yang diperoleh dari penelitian I. Berikut ini diuraikan secara lengkap
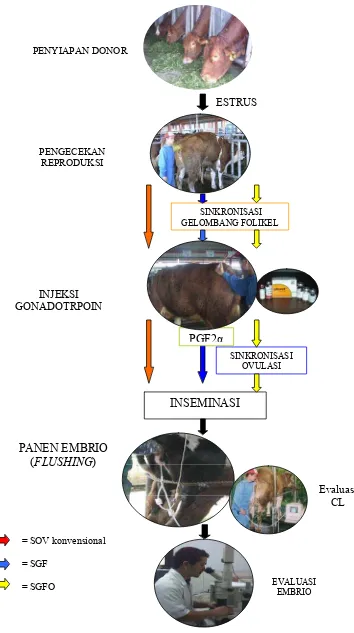
masing-masing langkah penelitian yang meliputi alur proses superovulasi
(Gambar 3) disertai jenis perlakuan, rincian dosis gonadotropin, GnRH dan
prostaglandin yang digunakan (1 sampai 5), serta diagram masing-masing
PENYIAPAN DONOR
ESTRUS
PENGECEKAN REPRODUKSI
SINKRONISASI GELOMBANG FOLIKEL
Gambar 3 Alur proses superovulasi dengan model penelitian
INJEKSI GONADOTRPOIN
INSEMINASI
PANEN EMBRIO (FLUSHING)
EVALUASI EMBRIO SINKRONISASI
OVULASI PGF2α
Evaluasi CL
= SOV konvensional
= SGF
Penelitian I: Respon superovulasi dengan pemberian gonadotropin dengan lama waktu berbeda.
Tiga puluh (30) ekor sapi (perah dan potong) dibagi menjadi 3 grup
perlakuan yang mana kesemuanya pada hari ke 9 setelah estrus diberi perlakuan
superovulasi dua kali sehari dosis menurun dengan gonadotropin (1000 IU FSH
dan 1000 IU LH, Pluset ®, Laboratorios Callier, S.A., Spain): a) selama 3 hari
(grup 1, n = 10) dalam 6 kali injeksi, b) selama 4 hari (grup 2, n = 10) dalam 8
kali injeksi dan c) selama 5 hari (grup 3, n = 10) dalam 10 kali injeksi. Pada hari
ke 11 sore dan 12 pagi diberikan PGF2α masing-masing 25 mg (dinoprost
tromethamine; LutalyseTM , Pharmacia, NV., Belgium). Semua sapi dilakukan
inseminasi buatan pada 12, 24, 36 jam setelah awal estrus atau sekitar 60, 72, 84
jam setelah penyuntikan PGF2α pertama. Pemanenan embrio dilakukan pada hari
ke 7 setelah inseminasi pertama (kira-kira hari ke-20/21 setelah estrus). Secara
rinci waktu dan pembagian dosis aplikasi gonadotropin FSH-LH dalam penelitian
ini adalah sebagai berikut :
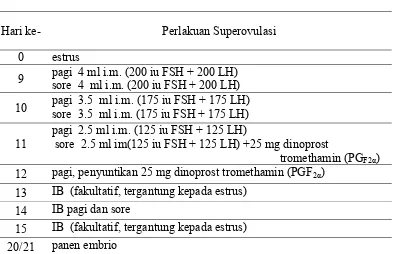
Tabel 1 Protokol aplikasi gonadotropin (1000 IU FSH-1000 IU LH) pada perlakuan selama 3 hari
Hari ke- Perlakuan Superovulasi
0 estrus
9 pagi 4 ml i.m. (200 iu FSH + 200 LH) sore 4 ml i.m. (200 iu FSH + 200 LH)
10 pagi 3.5 ml i.m. (175 iu FSH + 175 LH) sore 3.5 ml i.m. (175 iu FSH + 175 LH)
11
pagi 2.5 ml i.m. (125 iu FSH + 125 LH)
sore 2.5 ml im(125 iu FSH + 125 LH) +25 mg dinoprost
tromethamin (PGF2α)
12 pagi, penyuntikan 25 mg dinoprost tromethamin (PGF2α)
13 IB (fakultatif, tergantung kepada estrus)
14 IB pagi dan sore
15 IB (fakultatif, tergantung kepada estrus)
Tabel 2 Protokol aplikasi gonadotropin (1000 IU FSH-1000 IU LH) pada
13 IB (fakultatif, tergantung kepada estrus)
14 IB pagi dan sore
15 IB (fakultatif, tergantung kepada estrus)
Penelitian II : Introduksi sinkronisasi gelombang folikel (SGF) dan kombinasi dengan sinkronisasi ovulasi (SGFO).
Sinkronisasi gelombang folikel (SGF) dengan GnRH
Sepuluh (10) ekor sapi (perah-potong) pada hari ke 7 setelah estrus diberi
GnRH (86 µg gonadorelin, Fertagyl®, Intervet Inc.Millsboro, Holland).
Selanjutnya pada hari ke 9 dilakukan superovulasi dengan gonadotropin (1000 IU
FSH dan 1000 IU LH, Laboratorios Callier, S.A., Spain) dua kali sehari selama 4
hari dalam 8 dosis menurun. Pemberian PGF2α, inseminasi buatan, pemanenan
embrio dilakukan sama seperti pada penelitian I. Tujuan dari perlakuan ini adalah
untuk sinkronisasi gelombang folikel sebelum superovulasi. Secara rinci waktu
dan pembagian dosis aplikasi gonadotropin FSH-LH dalam penelitian ini adalah
sebagai berikut :
Tabel 4 Protokol sinkronisasi gelombang folikel sebelum aplikasi gonadotropin 1000 IU FSH-1000 IU LH)
Hari ke- Perlakuan Superovulasi
0 estrus
7 Penyuntikan GnRH (86 μg gonadorelin)
9 pagi 4 ml i.m. (200 iu FSH + 200 LH) 13 IB (fakultatif, tergantung kepada estrus)
14 IB pagi dan sore
15 IB (fakultatif, tergantung kepada estrus)
PENELITIAN II
Sinkronisasi gelombang folikel (SGF)
PGF2α (25 mg dinoprost tromethamin) 2 kali ¾¾
ÂÂ ÂÂ ÂÂ ÂÂ ÂÂÂ
GnRH (86 μg gonadorelin)
¾ FSH-LH 8 x dosis menurun IB 3x
0 1 2 3 4 5 6
7
89 1 0 1 1 1 2
131 4 1 5
16 17 18 19 20 21¾ ¾ ¾
Panen Embrio, evaluasi CL
Estrus
Sinkronisasi gelombang folikel dan ovulasi (SGFO)
PGF2α (25 mg dinoprost tromethamin) 2 kali ¾¾
ÂÂ ÂÂ ÂÂ ÂÂ ÂÂÂ
GnRH (86 μg gonadorelin)
¾ FSH-LH 8 x dosis menurun IB 3x
0 1 2 3 4 5 6
7
89 1 0 1 1 1 2
1 3
1 4 1 5
16 17 18 19 20 21¾ ¾ ¾ ¾
Estrus
Gambar 5 Diagram penelitian sinkronisasi gelombang folikel (SGF) dan kombinasi dengan sinkronisasi ovulasi (SGFO) Panen
Embrio, evaluasiCL
GnRH (86 μg gonadorelin)
Estrus
Sinkronisasi gelombang folikel dan ovulasi (SGFO) dengan GnRH.
Pada penelitian ini, perlakuan seperti pada SGF ditambah dengan kombinasi
pemberian GnRH pada hari ke 13 setelah estrus atau 40-48 jam setelah PGF2α
pertama. Lebih rinci adalah sebagai berikut: sepuluh (10) ekor sapi
(perah-potong) pada hari ke 7 setelah estrus diberi GnRH (86 µg gonadorelin, Intervet
Inc.Millsboro, Holland). Pada hari ke 9 dilakukan superovulasi dengan
gonadotropin (1000 IU FSH dan 1000 IU LH,Laboratorios Callier, S.A., Spain)
dua kali sehari selama 4 hari dengan dosis menurun. Pemberian PGF2α,
inseminasi buatan, pemanenan embrio dilakukan sama seperti pada SGF. Tujuan
dari perlakuan ini adalah superovulasi yang dikombinasikan dengan sinkronisasi
gelombang folikel dan sinkronisasi ovulasi. Secara rinci waktu dan dosis aplikasi
gonadotropin FSH-LH adalah sebagai berikut :
Tabel 5 Protokol Sinkronisasi Gelombang Folikel dan Ovulasi serta Aplikasi Gonadotropin (1000 IU FSH-1000 IU LH)
Hari ke- Perlakuan Superovulasi
0 estrus
7 Penyuntikan GnRH (86 μg gonadorelin)
9 pagi 4 ml i.m. (200 iu FSH + 200 LH)
13 Penyuntikan kedua GnRH (86 μg gonadorelin) IB (fakultatif, tergantung kepada estrus) 14 IB pagi dan sore
15 IB (fakultatif, tergantung kepada estrus)
Penelitian sinkronisasi gelombang folikel dan ovulasi (SGFO) juga akan
diamati secara spesifik pada jenis sapi (perah non laktasi atau potong) yang
digunakan, membandingkan tingkat respon dan perolehan embrio diantara kedua
jenis sapi tersebut.
Penelitian dirancang dalam Rancangan Acak Lengkap (RAL). Hasil dari
ketiga eksperimen tersebut dibandingkan berdasarkan parameter yang diamati
menggunakan analisa statistik sidik ragam (Anova), selanjutnya untuk melihat
perbedaan nilai tengah antar perlakuan digunakan uji Duncan. Khusus untuk
tingkat respon juga digunakan uji Kruskal Wallis. Pemeriksaan dan penghitungan
corpus luteum pada ovarium dilakukan secara palpasi rektal dibantu dengan
Ultrasonografi (Aloka SSD 500, Matsushita Electric Co. Tokyo, Japan) pada saat
panen embrio.
Parameter yang diamati
a. Tingkat respon donor :
Donor dianggap memberikan respon bila memiliki jumlah corpus luteum (CL)
lebih besar dari 1 (CL > 1) dan dianggap tidak berespon jika jumlah corpus
luteum kecil atau sama dengan 1 (CL ≤ 1).
b. Tingkat perolehan embrio
Perolehan embrio yang diamati adalah jumlah embrio oosit keseluruhan yang
didapat, jumlah embrio layak transfer (kualitas A,B,C) dan jumlah embrio
tidak layak transfer (embrio yang mengalami degenerasi /Dg serta jumlah oosit
yang tidak terbuahi/Uf), serta proporsi jumlah embrio dengan jumlah CL
(Recovery rate).
Sebelumnya seluruh sapi percobaan diamati waktu estrusnya secara cermat.
Berpijak dari data estrus tersebut setiap donor dilakukan pemeriksaan ovarium
secara palpasi rektal untuk menilai kelayakan dan kesiapan dimulai superovulasi
pada donor tersebut. Pemanenan embrio dilakukan secara non bedah
(Gambar 6). Penghitungan jumlah CL dilakukan sebelum panen embrio, secara
palpasi rektal dan dikonfirmasi dengan USG.
Cairan masuk
Kateter Foley
Cairan keluar
Gambar 6 Teknik panen embrio metode non bedah menggunakan kateter Foley
Evalusi dan klasifikasi embrio
Evaluasi embrio berpedoman kepada klasifikasi embrio menurut Saito
(1997), yang mana embrio dibedakan ke dalam 5 kelompok (grade) yaitu : A, B,
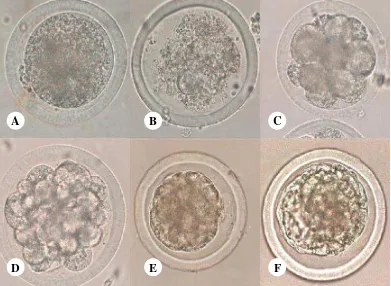
C, Dg (degenerated), Uf (unfertilized), dengan kriteria masing-masing seperti
pada Tabel 6 dan Gambar 7. Secara garis besar klasifikasi tersebut dimasukkan
kedalam kelompok embrio layak transfer (A,B,C) dan embrio tidak layak transfer
(embrio yang mengalami degenerasi, dan oosit yang tidak terbuahi). Klasifikasi
embrio ini secara teknis kualitas tidak berbeda dengan klasifikasi embrio yang
Tabel 6 Klasifikasi embrio berdasarkan kualitas (Saito 1997)
Klasifikasi Grade Penjelasan
Excellent A • Morfologi embrio simetris sempurna, batas tepi jelas dan mulus, blastomer kompak
• Kerusakan blastomer kurang dari 10%
• Tahapan perkembagan embrio sesuai dengan umurnya
Good B • Morfologi embrio baik, blastomer kurang kompak
• Kerusakan blastomer 10 - 20%
• Terkadang bentuknya tidak simetris Fair C • Kerusakan blastomer 20 - 30%
• Batas tepi yang tidak jelas, blastomer kurang kompak
• Terbentuk vesicel-vesicel
Poor Dg • Bentuk tidak normal, blastomer terpisah
• Tahapan perkembangan tidak jelas Unfertilized UF • Oosit tidak mengalami pembelahan
• Badan kutub tidak jelas atau mengalami degenerasi
A B C
D E F
Gambar 7 Klasifikasi embrio berdasarkan kualitas. A. Oosit tidak terbuahi (Uf:
unfertilized), B. Embrio yang mengalami degenerasi (Dg), C dan D. Embrio kualitas C, E. Embrio kualitas B, F. Embrio
Metode pengumpulan, pengolahan dan analisa data
Pengumpulan data dilakukan secara langsung dengan mencatat data primer
hasil penelitian meliputi tingkat respon donor, tingkat perolehan embrio, untuk
selanjutnya dilakukan pengolahan data. Analisa dan interpretasi data dilakukan
untuk dapat menilai setiap parameter yang diamati seperti berikut ini.
Tingkat respon (response rate) yaitu perbandingan jumlah sapi donor yang respon terhadap jumlah sapi donor yang di superovulasi, dengan rumus :
∑ sapi donor yang respon (ekor)
Tingkat respon = ──────────────────── x 100 %
∑ sapi donor yang disuperovulasi (ekor)
Recovery rate yaitu perbandingan jumlah embrio dan ovum yang terkoleksi terhadap jumlah corpus luteum, dengan rumus :
∑ embrio dan oosit yang terkoleksi
Recovery rate = ──────────────────── x 100 % ∑ corpus luteum pada ovarium
Jumlah embrio dan ovum yang terkoleksi yaitu jumlah embrio kualitas A, B, C, Dg (degenerasi) dan Uf ( oosit tidak terbuahi ).
Jumlah corpus luteum yaitu jumlah corpus luteum yang terdapat pada ovarium kiri dan kanan, berdasarkan penghitungan secara palpasi rektal dan USG.
Proporsi embrio layak transfer yaitu perbandingan jumlah embrio layak transfer (A,B,C) terhadap jumlah embrio dan oosit yang terkoleksi (A,B,C,Dg,Uf), dengan rumus :
Proporsi embrio ∑ embrio layak transfer (A,B,C)
Proporsi embrio tidak layak transfer yaitu perbandingan jumlah embrio tidak layak transfer (Dg, Uf) terhadap jumlah embrio dan oosit yang terkoleksi (A,B,C,Dg,UF), dengan rumus :
Proporsi embrio ∑ embrio tidak layak transfer (Dg, Uf)
tidak layak transfer = ──────────────────── x 100 % ∑ embrio dan oosit (A,B,C,Dg,Uf)
Untuk melihat pengaruh dari setiap perlakuan maka data yang diperoleh
dianalisis dengan sidik ragam/Analisa Varian (ANOVA) pola statistika rancangan
acak lengkap/RAL. Model matematika menurut Steel and Torrie sebagai berikut :
+
ε
Yij = µ + Ai ijYij = respon percobaan karena pengaruh perlakuan ke-i dan ulangan ke-j
µ = rataan umum hasil percobaan A = perlakuan ke-i i
ε
ij = kesalahan percobaan perlakuan ke-i pada ulangan ke-jJika hasil penelitian menunjukkan pengaruh yang berbeda maka dilakukan uji
lanjut dengan uji Duncan’s Multiple Range Test. Khusus untuk tingkat respon
HASIL DAN PEMBAHASAN
Kajian superovulasi ini dilakukan dalam dua penelitian yaitu
membandingkan lama waktu (3, 4 dan 5 hari) pemberian gonadotropin FSH-LH
(Penelitian I), dan kajian pengaruh sinkronisasi gelombang folikel/SGF dan
kombinasi dengan sinkronisasi ovulasi/SGFO (Penelitian II) terhadap tingkat
respon ovarium dan perolehan embrio.
Penelitian I: Respon superovulasi dengan pemberian gonadotropin pada periode berbeda.
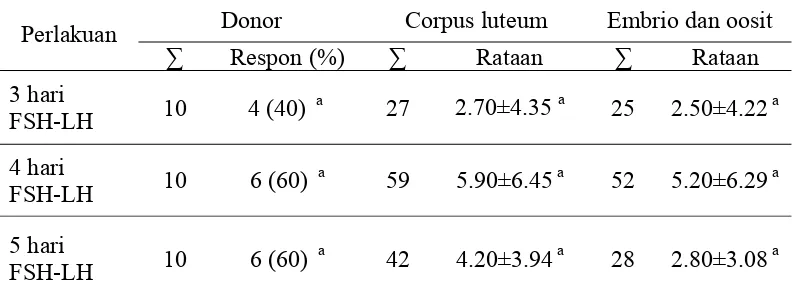
Berdasarkan penelitian ini, perlakuan pemberian FSH-LH selama 4 dan 5
hari menghasilkan respon yang cenderung lebih tinggi dari perlakuan selama 3
hari (60 % vs 60 % vs 40 %) (Tabel 7). Hal ini antara lain dapat disebabkan oleh
waktu aplikasi yang lama memungkinkan bertemunya awal gelombang folikel
baik pada sapi dengan 2 atau 3 tipe gelombang folikel dengan pengaruh
gonadotropin.
Tabel 7 Respon superovulasi dengan pemberian FSH-LH selama 3, 4 dan 5 hari.
Donor Corpus luteum Embrio dan oosit
Perlakuan
∑ Respon (%) ∑ Rataan ∑ Rataan
3 hari
Catatan : Angka dengan superskript yang sama dalam kolom yang sama menunjukkan tidak terdapat perbedaan yang signifikan (P>0.05)
Pada aplikasi gonadotropin yang lebih singkat yaitu 3 hari menghasilkan
respon yang rendah, dapat disebabkan karena pemberian gonadotropin yang
memiliki waktu paruh 150 menit (FSH) dan 40 menit (LH) tidak tepat pada saat
awal kemunculan gelombang folikel atau dosis telah menurun meskipun tepat di
Penyebab lain adalah terdapat sebuah folikel dominan yang menghasilkan inhibin
dengan efek menekan perkembangan folikel subordinat sehingga perlakuan
tersebut kurang memberikan efek terhadap perkembangan folikel pada ovarium
(Adam et al. 1994; Sato et al. 2005).
Jumlah embrio yang ditemukan lebih sedikit dari jumlah CL yang ada, dapat
disebabkan oleh kehilangan embrio karena: a). jatuhnya embrio ke dalam rongga
perut bila cairan pembilas yang dimasukkan terlalu banyak, b). tertinggalnya
embrio di dalam uterus karena pembilasan yang kurang sempurna c). pada uterus
yang besar dan menggantung dapat menyebabkan penutupan oleh balon kateter
kurang sempurna sehingga cairan pembilas dapat merembes ke sisi lain (Yusuf
1990). Pada perlakuan selama 5 hari, terdapat beberapa donor yang menghasilkan
lendir bersama cairan pembilas, hal ini juga menyulitkan penemuan kembali
embrio. Produksi lendir dipengaruhi oleh hormon estrogen yang dihasilkan oleh
sebagian folikel yang belum terovulasi (Saito 1997).
Beragam variasi dari respon ovarium terhadap perlakuan superovulasi pada
sapi berkaitan erat dengan beragamnya status perkembangan folikel pada saat
perlakuan (Bo et al. 1995; Rajamahendran 2002; Sato et al. 2005). Respon
ovarium lebih rendah apabila superovulasi dilakukan pada saat kehadiran sebuah
folikel dominan karena inhibin yang dihasilkan folikel dominan menekan
pertumbuhan folikel-folikel subordinat. Sebaliknya respon lebih tinggi jika
dilakukan saat keberadaan sejumlah besar folikel kecil/sub ordinat (pool follicles)
(Romero et al.1991) yang terjadi pada awal munculnya gelombang folikel.
Pemberian FSH-LH selama 4 hari menunjukkan hasil yang cenderung lebih
baik dari dua perlakuan lain, dengan rata-rata 5.90 CL per donor dan 5.20 embrio
per donor, meskipun secara statistik tidak terdapat perbedaan yang signifikan.
Hasil yang diperoleh pada perlakuan selama 4 hari dapat disebabkan karena
pembagian dosis dalam proporsi yang optimal sesuai dengan waktu paruh FSH
dan LH (Anonimous 2002). Faktor lain adalah perlakuan selama 4 hari merupakan
waktu optimal yang memungkinkan bertemu awal gelombang folikel dengan
pengaruh gonadotropin untuk perkembangan folikel subordinat sampai folikel de
Graaf pada semua tipe gelombang folikel (Romero et al. 1991). Pada perlakuan
penelitian ini ditemukan beberapa donor memiliki folikel de Graaf yang belum
terovulasi, disamping keberadaan CL pada saat panen embrio (hari ke-7)
(Gambar 2). Saito (1997) menyatakan bahwa estrogen merupakan hormon steroid
yang terdapat dalam cairan folikel, yang keberadaannya pada saat pertumbuhan
embrio akan berefek menurunkan kualitas embrio. Lebih lanjut dinyatakan bahwa
kegagalan ovulasi menimbulkan tingginya kadar estrogen dalam darah. Faktor
lain yang juga dapat memberi pengaruh adalah proporsi FSH dan LH. Pemberian
LH harus sesuai dengan fungsi ovarium dan dalam perbandingan yang optimal
dengan FSH, kelebihan LH akan mengurangi respon ovarium. Pemberian LH
eksogen dapat menghambat fertilisasi karena stimulasi prematur terhadap
pematangan ovum sehingga sel telur yang dihasilkan infertil (Donaldson & Ward
1996), hal ini juga dapat terjadi pada perlakuan selama 5 hari.
Model superovulasi yang dilakukan pada penelitian I ini merupakan
superovulasi konvensional, dimana pendekatan superovulasi masih bersifat umum
yang hanya berpatokan pada keberadaan CL dalam fase luteal dan perkiraan
muncul gelombang folikel sesuai tipe gelombang folikel, tanpa
mempertimbangkan keberadaan folikel dominan yang menghasilkan inhibin yang
mempunyai efek supresif terhadap folikel lain. Disamping itu pada superovulasi
konvensional ini, munculnya gelombang folikel pada setiap individu donor yang
dilakukan superovulasi tidak selalu diketahui secara tepat. Apalagi pada kegiatan
superovulasi massal yang dimulai serentak pada beberapa donor, dimana donor
tersebut memiliki variasi gelombang folikel sesuai dengan tipe gelombang folikel
masing-masing, sehingga aplikasi gonadotropin menghasilkan respon ovarium
yang bervariasi. Pada donor yang kemunculan gelombang folikelnya tepat saat
aplikasi gonatropin akan memberikan respon yang baik, tetapi sebaliknya pada
donor yang kemunculan gelombang folikel tidak tepat dengan aplikasi
gonadotropin akan memberikan respon rendah atau malah tidak memberikan
respon (Rajamahendran 2002).
Superovulasi dalam penelitian I dimulai pada hari ke- 9, berdasarkan
pernyataan Dielleman dan Bevers (1993) bahwa superovulasi adalah pemberian
gonadotropin yang dimulai pada hari ke-9 untuk sapi dengan panjang siklus birahi