RESISTENSI
Cronobacter sakazakii
TERHADAPAMPISILIN DAN
HUBUNGANNYA DENGAN STABILITAS DAN EKSPRESI GFPuv
YUSNITA WAHYUNI SILITONGA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Resistensi Cronobacter sakazakiiterhadap Ampisilindan Hubungannya dengan Stabilitas dan Ekspresi GFPuv adalah benar karya saya denganarahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
YUSNITA WAHYUNI SILITONGA.ResistensiCronobacter sakazakiiterhadap Ampisilin dan Hubungannya dengan Stabilitas dan Ekspresi GFPuv. Dibimbing oleh RATIH DEWANTI-HARIYADI dan SITI NURJANAH.
Cronobacter sakazakii merupakan bakteri Gram negatif yang tergolong sebagaiemerging patogen pada pangan. Bakteri ini juga termasuk bakteri patogen oportunistik yang dapat menyebabkan septisimia, radang usus, radang otak bahkan dapat menyebabkan kematian pada bayi. Penelusuran perilaku C. sakazakiidalam bahan pangan sulit dilakukan jika menggunakan galur liar (wild type) sehingga dilakukan pelabelan dengan menggunakan plasmid GFPuv. Plasmid GFPuv dilengkapi dengan gen penyandi resisten ampisilin yang bertujuan untuk mempermudah seleksi. Penelitian sebelumnya menunjukkan bahwa keberadaan gen tersebut menyebabkab C. sakazakii tidak dapat dilabeli dengan pGFPuv, akan tetapi belum diketahui penyebabnya.Tujuan penelitian ini adalah untuk mengetahui kemampuan pelabelan beberapa isolatC. sakazakiiolehpGFPuvdan untuk mengetahui hubungan antara resistensi C. sakazakii terhadap ampisilin dengan keberhasilan konstruksi mutan berdasarkan ekspresi GFPuv dan tingkat kestabilannya
Resistensi C. sakazakii terhadap ampisilin dapat diketahui dengan menumbuhkan bakteri tersebut pada media yang mengandung ampisilin. Pelabelan Cronobacter sakazakiidengan pGFPuv dilakukan dengan metode transformasi CaCl2. Keberhasilan pelabelan dikonfirmasi dengan melihat koloni bakteri di bawah sinar UV dan mikroskop fluoresen, isolat yang berhasil dilabeli oleh pGFPuv menghasilkan koloni berwarna hijau berfluoresen.Hasil pengujian menunjukkan bahwa dari 12 isolat yang diuji terdapat 8 isolat (66.6 %) yang sensitif terhadap ampisilin (FWHc3, FWHb6, FWHb15, YRw3, E2, E4, E6, dan E9), 2 isolat (16.6 %) bersifat intermediat resisten (Desb10, E7) dan 2 isolat (16.6 %) yang resisten terhadap ampisilin yaitu E1 dan FWHd1. Isolat yang sensitif terhadap ampisilin dapat dilabeli oleh pGFPuv bahkan memiliki tingkat kestabilan plasmid yang paling tinggi (E2). Isolat yang resisten terhadap ampisilin tetap terlabel oleh pGFPuv, akan tetapi tidak stabil di dalam sel bahkan tidak diekspresikan. Isolat yang tidak mengekspresikan GFPuv adalah isolat yang tinggi tingkat resistennya yaitu E1 dan FWHd1.Karakterisasi resistensi isolat terhadap antibiotik penanda pada plasmid penting dilakukan untuk menjamin keberhasilan dan kestabilan proses pelabelan bakteri.
SUMMARY
YUSNITA WAHYUNI SILITONGA.Ampicillin Resistance of Cronobacter sakazakii and Its Correlation with the Stability and GFPuv Expression. Supervised byRATIH DEWANTI-HARIYADI dan SITI NURJANAH.
Cronobacter sakazakiiis Gram-negative bacteria considered asan emerging pathogen in foods. The bacteria are also categorized as opportunistic pathogens which cause septicemia, necrotizing enterocolitis,meningitis and could induce infant mortality.Tracking thewild type bacterium in foodstuff could be difficultwhen using a wild strain (wild-type), therefore it need labeling technique by using GFPuv plasmids. GFPuv plasmids are completed with ampicillin resistant gene for easy selection. Previous studies indicated that ampicillin resistant bacteria could not be made into GFPuv mutants, but the reasonwas unknown. The objectives of this study were to investigate the performance of C. sakazakii GFPuv mutants and to understand the correlation between ampicillin resistance traits in the wild types with the success of GFPuv mutants construction based on their stability and GFP expression
C. sakazakii ampicillin resistence was observed by growing the bacteria in a containing ampicillin medium. pGFPuv mutants were obtained using CaCl2transformation method and heat shock.The success of construction process could be known from pGFPuv expression and thestability level of plasmid on mutant cells.Of the 12 isolates studied, 8 isolates (66.6 %) were susceptible ((FWHc3, FWHb6, FWHb15, YRw3, E2, E4, E6, and E9),two (16.66%) had intermediate resistance to ampicillin (Desb10, E7),and the other two (16.6%) were ampicillinresistant (FWHd1, E1). The ampicillin sensitive C. sakazakiicould be labeled with pGFPuv and their plasmid stability were most stable (E2). The ampicillin resistant C. sakazakii isolates also could be labeled with pGFPuv but the resulting mutantswere unstable in the cell and could not express the GFPuv.The high resistance isolate could not express the GFPuv (E7 and FWHd1). Characterization of isolate resistance on antibiotic marker of plasmid is required to assure successfulness and stability of bacteria labelling process.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
RESISTENSI
Cronobacter sakazakii
TERHADAPAMPISILIN DAN
HUBUNGANNYA DENGAN STABILITAS DAN EKSPRESI GFPuv
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Resistensi Cronobacter sakazakiiterhadap Ampisilin dan Hubungannya dengan Stabilitas dan Ekspresi GFPuv Nama : Yusnita Wahyuni Silitonga
NIM : F251130121
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc Ketua
Dr Siti Nurjanah, STP, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2014dengan judul Resistensi Cronobacter sakazakiiterhadap Ampisilin dan Hubungannya dengan Stabilitas dan Ekspresi GFPuv.
Terima kasih penulis ucapkan kepadaProf Dr Ir Ratih Dewanti-Hariyadi, MSc dan Dr Siti Nurjanah, STP MSi selaku pembimbing yang telah banyak memberi arahan dan saranselama penulis melaksanakan penelitian hingga menjadi suatu bentuk karya ilmiah. Terima kasih juga disampaikan kepada orangtua, ayahanda Marahakim Silitonga dan ibunda Alm. Mastinar Rambe atas segala doa dan kasih sayang yang tulus dan tak ternilai harganya kepada penulis. Ungkapan terima kasih penulis sampaikan kepada suami tercinta, Muhammad Nizar Hanafiah SP MP yang telah banyak memberi dukungan dan motivasi dalam menyusun tulisan ini. Terima kasih kepada staf Laboratorium SEAFAST Center IPB atas bantuan dan dukungannya, serta kepada Ditjen Dikti atas pemberian beasiswa selama menjalankan studi di Institut Pertanian Bogor.Penulis juga mengucapkan terima kasih kepada teman-teman yang telah membantu selama penyelesaian tugas akhir ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Uji Resistensi Cronobacter sakazakiiterhadap Ampisilin 15
PelabelanCronobacter sakazakiidengan GFPuv menggunakan metode Transformasi CaCl215 Konfirmasi Mutan secara Fenotip pada Media TSAA 16
Konfirmasi Mutan secara Fenotip dengan Mikroskop Fluoresen16 Deteksi Gen GFP pada sel mutan yang tidak stabil dan terekspresi 16
Uji Stabilitas pGFPuv pada Sel Mutan 17
4 HASIL DAN PEMBAHASAN 18 Resistensi Cronobacter sakazakii terhadap Ampisilin 18 Pelabelan Cronobacter sakazakiidengan GFPuv 19 Hubungan Resistensi Cronobacter sakazakii terhadap Ampisilin dengan Kestabilan dan Ekspresi GFPuv 22
RIWAYAT HIDUP 33
DAFTAR TABEL
1 Isolat bakteri yang digunakan pada penelitian 14
2 Resistensi Cronobacter sakazakii terhadap ampisilin 18 3 Hasil transformasi mutan GFPuv pada sel C. sakazakii 20 4 Kestabilan plasmid GFPuv pada sel mutan Cronobacter sakazakii 24
DAFTAR GAMBAR
1 Diagram alir ruang lingkup penelitian 3
2 Cronobacter spp. 4
3 Struktur ampisilin 6
4 Struktur tiga dimensi GFP 8
5 Mekanisme biosintesis kromofor GFP 8
6 Struktur tiga dimensi GFPuv 9
7 Peta pGFPuv 10
8 Mekanisme transformasi CaCl2 12
9 Sel mutan C. sakazakii GFPuv (E2) dibawah mikroskop fluoresen
(1000x) 21
10 Eksperesi GFPuv pada sel mutan dibawah UV (A) stabil pada isolat E2, (B)tidak stabil pada isolat Desb10, (C) tidak terekspresi pada isolat E1 21 11 Visualisasi DNA hasil amplifikasi gen GFP(A) Desb10(B) YRw3(C)
kontrol dengan DNA GFP,( D) 100 bp DNA ladder, (E) kontrol tanpa
DNA, (F) E9, (G) FWHd1, (H) E1 24
DAFTAR LAMPIRAN
1 Data Resistensi Cronobakter sakazakii terhadap ampisilin 30
2 Data kestabilan pGFPuv pada sel mutan 31
PENDAHULUAN
Latar Belakang
Cronobacter sakazakii merupakan bakteriGram negatif, berbentuk batang dan tidak menghasilkan spora. Bakteri ini berpotensi menginfeksi semua golongan usia terutama pada bayi kelompok tertentu dan golongan dewasa yang memiliki sistem kekebalan rendah. Selama rentang tahun 1959 sampai tahun 2002 diseluruh dunia telah tercatat sekitar dua puluh lima peristiwa infeksi oleh bakteri C. sakazakii yang melibatkan enam puluh bayi (Iversen dan Forsythe 2003). Dari dua puluh lima peristiwa yang terjadi, delapan diantaranya dapat dikaitkan dengan konsumsi susu formula. Selain pada susu formula bayi, Friedemann (2007)juga menemukan C. sakazakii pada potongan buah segar seperti semangka, melon, apel, tomat, produk kacang-kacangan, rempah-rempah dan dari sumber bahan pangan hewani seperti susu, daging, ikan dan produk olahannya. OutbreakC. sakazakii belum pernah dilaporkan di Indonesia, akan tetapi bakteri ini telah berhasil diisolasi dari beberapa bahan pangan kering seperti susu formula (Estuningsih et al. 2006), makanan pendamping ASI (Meutia et al. 2008), gula halus, coklat bubuk, rempah kering (Gitapratiwi et al. 2012), tapioka dan maizena (Hamdani 2012).
C. sakazakii tergolong sebagaiemerging patogen pada pangan yang perlu diwaspadai karena dapat mengakibatkan penyakit melalui makanan (Dewanti-Hariyadi et al. 2010). Bakteri ini juga termasuk bakteri patogen oportunistik yang dapat menyebabkan septisimia, radang usus (necrotizing enterocolis), radang otak (meningitis) bahkan dapat menyebabkan kematian pada bayi. Sejalan dengan adanya cemaran C. sakazakii pada susu formula menyebabkan pemerintah Indonesia pada tahun 2009 mulai memberlakukan SNI 7388-2009 yang menetapkan bahwa cemaran Cronobacter spp. harus negatif pada susu formula.Codex mensyaratkan untuk tiap lot produksi dilakukan pengujian sebanyak 30 sampel masing-masing 10 g dan tidak boleh ada satu sampel pun yang terdeteksi mengandung Cronobacter sakazakii (WHOFAO 2004). Informasi mengenai perilaku C. sakazakii dalam bahan pangan sangat dibutuhkan karena dapat dijadikan sebagai acuan pengendalian bakteri tersebut dalam rangka keamanan pangan.
Penelusuran perilaku bakteridalam bahan pangan sulit dilakukan jika menggunakan galur liar (wild type). Hal tersebut karena sangat sulit untuk membedakan antara bakteri target dan bakteri yang secara alami terdapat padaproduk pangan dengan spesies yang sama. Ma et al. (2011) menyatakan bahwa teknik pelabelan dapat menjadi salah satu alternatif untuk mengetahui perilaku bakteri tanpa menekan pertumbuhan mikroorganisme lain. Salah satu teknik pelabelan yang dapat diaplikasikan adalah dengan menggunakan Green Fluorescent Protein (GFP).
2
yang resisten ampisilin tidak berhasil dikonstruksikan menjadi mutan pGFPuv. Ma et al. (2011) melaporkan bahwa plasmid GFPuv dapat dikonstruksikan pada Listeria sp., Salmonella sp. dan Escherichia coli, akan tetapi dari beberapa strain bakteri tersebut ada yang tidak dikonstruksikan yaitu strain yang resisten ampisilin karena peneliti menyatakan bahwa bakteri yang resisten ampisilin tidak berhasil dilabeli oleh pGFPuv.Nurjanah et al. (2014) melaporkan bahwa pGFPuv dapat disisipkan pada C. sakazakii. Dari 5 isolat lokal yang dikonstruksikan terdapat 1 isolat yang tidak dapat dilabel yaitu isolat yang memiliki sifat resisten terhadap ampisilin, sehingga peneliti menduga bahwa ada hubungan sifat resistensi terhadap ampisilin dengan keberhasilan mutasi.
Perumusan Masalah
Green Fluorescent Protein (GFP) merupakan protein yang dapat digunakan sebagai pelabelan bakteri, akan tetapi pada penelitian Nurjanahet al. (2014) menunjukkan bahwa beberapa strain isolatC. sakazakiikhususnya yang resisten terhadap ampisilin tidak berhasil dilabeli oleh pGFPuv, sehingga dibutuhkan penelitian lebih lanjut untuk mengetahui penyebab isolat tersebut tidak berhasil dilabeli olehpGFPuv.
Tujuan Penelitian
Tujuan penelitian ini adalah :
1. Mengetahui tingkat resistensi beberapa isolat C. sakazakiiterhadap ampisilin.
2. Mengetahui kemampuan pelabelan beberapa isolat C. sakazakii oleh pGFPuv.
3. Mengetahui tingkat kestabilandan ekspresi GFPuv pada sel mutanC. sakazakii
4. Mengetahui pengaruh resistensi C. sakazakii terhadap ampisilin dengan kestabilan dan ekspresi GFPuv pada sel mutan.
Manfaat Penelitian
3
Ruang Lingkup Penelitian
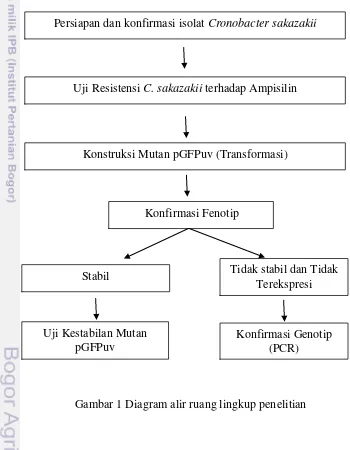
Penelitian ini meliputi 3 tahapan yaitu tahap uji resistensi C. sakazakii terhadap ampisilin yang diawali dengan preparasi dan konfirmasi isolat C. sakazakii. Tahap ke-2 adalah konstruksi mutan pGFPuv dengan metode transformasi CaCl2. Tahapan ini meliputi konfirmasi mutan secara fenotip. Konfirmasi fenotip dilakukan dengan mengamati ekspresi GFPuv pada koloni mutan di bawah lampu UV dan mengamati sel mutan dengan mikroskop fluoresen. Isolat yang tidak stabil dan tidak terekspresi dilanjutkan dengan deteksi gen GFP pada sel mutan dengan menggunakan polimer chain reaction(PCR). Isolat yang stabil dilanjutkan dengan uji kestabilan untuk melihat isolat yang paling tinggi tingkat kestabilannya. Uji kestabilan dilakukan dengan menumbuhkan isolat mutan GFPuv pada media BHI tanpa ampisilin beberapa hari. Kestabilan dapat dilihat dengan membandingkan sel yang berfluoresen dengan total koloni yang tumbuh pada media TSA (Gambar 1)
Gambar 1 Diagram alir ruang lingkup penelitian Persiapan dan konfirmasi isolat Cronobacter sakazakii
Uji Resistensi C. sakazakii terhadap Ampisilin
Konstruksi Mutan pGFPuv (Transformasi)
Konfirmasi Fenotip
Stabil Tidak stabil dan Tidak
Terekspresi
Uji Kestabilan Mutan pGFPuv
4
TINJAUAN PUSTAKA
Karakteristik Cronobacter sakazakii
Cronobacter sakazakii merupakan bakteri Gram negatif,berbentuk batang, motil, tidak menghasilkan spora dan bersifat fakultatif anaerob (Iversen dan Forsythe 2003). Dari laporan Gurtleret al. (2005) semua isolat C. sakazakiiyang diisolasi dari susu formula di Kanada menunjukkan suhu pertumbuhan minimum 5.5oC–8oC dan optimum 25oC–45oC tetapi tidak tumbuh pada 4oC dan 50oC. Pada awalnya, bakteri C. sakazakii hanya dikenal sebagai Enterobacter cloacae yang memiliki pigmen kuning (Yellow pigmented Enterobacter cloacae). Tahun 1980 bakteri ini dipisahkan dari kelompok tersebut berdasarkan genetik penyusunnya, perbedaananalisis hibridasi DNA, reaksi biokimia,dan uji kepekaannya terhadap antibiotika. Bakteri ini selanjutnya dikukuhkan dalam genus Enterobacter sebagai suatu spesies baru yang diberi nama Enterobacter sakazakii untuk menghargai seorang bakteriolog Jepangbernama Riichi Sakazakii (Gurtler et al. 2005).
Gambar 2Cronobacter spp. (Kunkel 2009)
Pada tahun 2007 beberapa peneliti memutakhirkan kriteria taxonomidari E. sakazakii dengan menggunakan cara lebih canggih, yaitu dengan f-AFLP, automated ribotyping, full length 16S rRNA gene sequencing danDNA hybridization. Hasil identifikasi E. sakazakii dengan metode 16S rRNA bahwa sequens DNA E. sakazakii 97.8 % mirip Cirobacter roseri dan 97.0 % mirip dengan E. Cloacae (Gutler et al. 2005). Iversen et al. (2008) menyatakan bahwa E. sakazakiilebih cocok diklasifikasikan dengan genus baru yaitu Cronobacter yang terdiri dari 6 spesies (C. sakazakii, C.malonaticus, C. turicensis, C. muytjensii, dan C. dublinensis). C. sakazakiidapat tumbuh pada medium yang digunakan untuk menumbuhkan bakteri enteric seperti eosin metylen blue (EMB). C. sakazakiijuga dapat tumbuh pada media tryptone soy agar (TSA) yang membentuk koloni dengan diameter 1.5-3 mm setelah diinkubasi selama 1 hari. Dalam media cair seperti BHI C. sakazakiimampu memproduksi banyak sedimen yang mirip dengan gumpalan sel (Nazarowec et al. 2003).
5 rendah, lahir prematur, dan terlahir dari ibu yang mengidap penyakit AIDS (WHO FAO 2004). Selain pada bayi infeksi Cronobacterjuga dapat terjadi pada anak-anak, kelompok lanjut usia, dan orang dewasa yang memiliki daya tahan tubuh rendah (Gurtler et al. 2005). The Internatioanal Commission for Microbiological Specifications for Foods (ICMSF 2002) menempatkan C. sakazakii sebagai cemaran dengan tingkat bahaya parah, menyerang populasi terbatas, mengancam kehidupan atau menyebabkan dampak kronis lanjutan, dan mempengaruhi hidup dalam jangka waktu lama.
C. sakazakii dapat menghasilkan toksin pada selnya (Nurjanah et al. 2013). Kemampuannya dalam memproduksi toksin mempunyai aktivitas merusak sel. Toksin dihasilkan setelah bakteri diinkubasi selama 6 jam dan jumlah maksimum toksin dihasilkan setelah 12 jam, toksin yang dihasilkan bakteri tersebut berukuran 66 kDa (Raghav dan Aggarwal 2007). Toksin C. Sakazakiidapat merusak sel Vero sehingga morfologi sel Vero tersebut berubah.Mangeet al.(2006) menyebutkan bahwa patogenisitas dari C. sakazakii meliputi kesuksesan dalam kolonisasi, penempelan pada permukaan sel inang seperti membran mukosa, lambung, epitelial usus, dan jaringan endotelial pada otak. Penelitian Nurjanah et al. (2013) menunjukkan bahwa 20 sampel C. sakazakii yang diuji, ditemukan hanya 65% yang positif dikonfirmasi sebagai toksik yang menunjukkan bahwa tidak semua strain dari C. sakazakiibersifat toksik.
Cronobacter sakazakiibukan merupakan flora normal pada saluran pencernaan hewan dan manusia. Sumber bakteri ini diduga berasal dari tanah, air, bahkan sumber bahan pangan (Iversen dan Forsythe 2003). Beberapa laporan menyatakan bahwa infeksi yang terkait C. sakazakii terjadi dari susu formula bubuk. Kontaminasi bakteri tersebut dapat terjadi selama pemerahan (milking), penanganan (handling), penyimpanan (storage), dan aktivitas pra-pengolahan lainnya. Pada tahun 2002, Center for Disease Control and Prevention(CDC) melaporkan kasus keracunan pangan disebabkan oleh C. sakazakii. Berdasarkan hasil investigasi C. sakazakii berasal dari susu formula bubuk kaleng yang belum dibuka. Beberapa peneliti juga berhasil mengisolasi C. sakazakiidari berbagai lingkungan dan peralatan pengolahan pangan (Iversen dan Forsythe 2003). C. sakazakii dapat menghasilkan ekstrapolisakarida yang dapat meningkatkan kemampuan bakteri tersebut menempel pada permukaan peralatan sehingga membentuk lapisan biofilm. Peralatan yang digunakan untuk menyiapkan susu formula bayi seharusnya dibersihkan sesering mungkin untuk meminimalkan biofilm sebagai sumber infeksi.
Selain dari susu formula C. sakazakii dapat juga diisolasi dari sumber bahan pangan lain seperti roti yang difermentasi, keju, daging giling, sosis, bubuk rempah-rempah, kacang (Gassemet al. 1999; Iversen dan Forsythe 2004). Bakteri tersebut juga dapat diisolasi dari biji padi (Cottyn et al. 2001), makanan pendamping ASI (Meutia et al. 2008), gula halus, coklat bubuk, rempah kering (Gitapratiwi et al. 2012), tapioka dan maizena (Hamdani 2012). Dari beberapa hasil penelitian tersebut dapat disimpulkan bahwa C. Sakazakiitidak hanya tumbuh pada bahan pangan yang memiliki kadar air dan aw yang tinggi tetapi juga masih ditemukan pada bahan pangan memiliki kadar air dan aw yang rendah seperti tepung, coklat bubuk, dan bubuk rempah-rempah.
6
Ampisilin merupakan asam organik yang berbentuk anhidrat dan trihidrat yang memiliki rumus molekul C16H19N3O4S.3H2O. Ditinjau dari struktur kimianya ampisilin termasuk dalam golongan penisilin yang bekerja pada dinding sel bakteri. Ampisilin terdiri dari satu inti siklik dengan satu rantai samping. Inti siklik terdiri dari cincin tiazolidin dan cincin betalaktam, sedangkan rantai sampingnya merupakan gugus amina bebas yang mengikat satu atom H. Adanya gugus amina pada rantai samping yang bersifat basa menyebabkan ampisilin tahan terhadap asam lambung. Gugus amina ini akan menangkap H+ yang terdapat pada lambung sehingga gugus amina bermuatan positif yang meningkatkan sifat hidrofilik dari ampisilin, akibatnya akan mengurangi jumlah absorbsi ampisilin dilambung (Baraldi et al. 2014).
Gambar 3 Struktur ampisilin (Baraldi et al. 2014).
Ampisilin merupakan kelompok antibiotik β–laktam yang memiliki spektrum antimikroba yang luas. Ampisilin efektif terhadap mikroba Gram positif dan Gram negatif. Ampisilin banyak digunakan untuk mengatasi berbagai infeksi saluran pernapasan, saluran cerna dan saluran kemih yang disebabkan oleh bakteri, tetapi banyak laporan yang menyatakan bahwa beberapa bakteri tersebut telah resisten terhadap ampisilin (Fraqueza 2015). Resistensi bakteri terhadap ampisilin merupakan suatu hal yang alamiah. Namun penggunaan ampisilin yang terus menerus tanpa memperhatikan dosis akan meningkatkan perkembangan resistensi bakteri yang semula sensitif (Lee et al.2012). Bakteri membentuk mekanisme pertahanan diri untuk tetap bertahan hidup. Bakteri yang resisten ampisilin adalah bakteri yang tidak dapat terkontrol atau dihambat dengan ampisilin.
7 terhadap antibiotik yang lain yang memiliki struktur antibiotik dan mekanisme kerja antibiotik yang hampir sama (Fraqueza 2015).
Resistensi C. sakazakii terhadap ampisilin telah banyak dilaporkan. Hasil penelitian Arseni et al. (1987) menunjukkan bahwa beberapa strain E. sakazakii yang diisolasi dari dubur pasien yang terinfeksi bakteri tersebut resisten terhadap ampisilin. Hasil penelitian Kuzina (2001) menunjukkan bahwa ada beberapa strain C. sakazakii yang diisolasi dari usus serangga buah Anastrepha ludens resisten terhadap ampisilin pada konsentrasi 2 µg/mL. Sifat resistensi C. sakazakii terhadap ampisislin tidak hanya ditemukan pada C. sakazakii yang berasal dari usus hewan atau manusia, hasil penelitian sebelumnya menunjukkan bahwa beberapa strain C. sakazakii yang diisolasi dari berbagai produk pangan juga resisten terhadap ampisilin (Li et al. 2014; Kim et al. 2008). Di Indonesia juga telah ada laporan yang menyatakan bahwa beberapa strain C. sakazakii yang berasal dari susu formula bayi resisten terhadap ampisilin pada konsentrasi 10 µg/mL (Noor dan Poelongan 2008).
Green Fluorescent Protein (GFP)
Green Fluorescent Protein (GFP) merupakan produk samping yang ditemukan pertama kali pada Aequorea victoria oleh Osamu Shimomura pada tahun 1961, yang menyebabkan jenis ubur-ubur ini mampu memancarkan cahaya hijau (Shimomura 2008). Pada mulanya penelitian ini dilakukan untuk mengekstrak luciferin dari Cypridinahilgendorfii dan mengkristalkannya. Kemudian dilakukan penelitian lebih lanjut mengenai struktur kimia luciferin dan mekanismenya dalam reaksi luminescene. Beberapa tahun kemudian, Shimomura mendapat penawaran penelitian untuk meneliti bioluminescence namun dari sumber lain yakni ubur-ubur (Aequorea victoria).Penelitian ini mengalami kesulitan dalam mengekstrak komponen bioluminescene, melalui beberapa uji coba proses purifikasi, aequorin berhasil diekstraksi. Pada saat yang sama protein lain dengan warna hijau terang juga ditemukan dan ikut dipurifikasi bersama aequorin. Protein hijau ini yang dikenal sebagai GFP (Shimomura 2008).
8
Gambar 4 Struktur tiga dimensi GFP (Brejc et al. 1997)
Di dalam protein ini ada gugus yang disebut kromofor yang berperan sangat penting dalam proses perpendaran hijau. Kromofor merupakan kelompok tiga residu asam amino di posisi 65 (Serin), 66 (Tirosin), dan 67 (Glisin). Kromofor
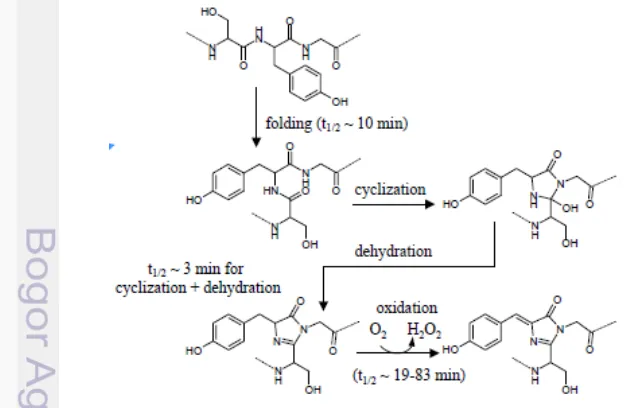
tertempel pada α-heliks dan tersimpan dalam pada pusat geometrik molekul, yang disebut dengan β-can (Tsien 1998). Panjang gelombang cahaya yang diserap dan dipancarkan oleh kromofor bergantung pada karakteristik kimia dan penambahan residu lain pada kromofor yang akan berpengaruh besar pada jenis fluoresens. Ketika dikenai energi cahaya biru atau UV maka pada gugus ini akan terjadi reaksi oksidasi. Energi yang diserap membuat elektron-elektron di dalam gugus ini tereksitasi dan menghasilkan energi yang lebih rendah yang secara otomatis akan mampu memancarkan cahaya hijau (Shimomura 2008).
Pembentukan kromofor fluoresen secara utuh terjadi secara bertahap. Tahap pertama yaitu GFP melakukan pelipatan. Pada tahap kedua, cincin imidazole dibentuk melalui siklikasi residu Serin-65 dan Glisin-67 yang diikuti dengan dehidrasi. Tahap terakhir yaitu molekul oksigen mengoksidasi senyawa antara siklisasi pada residu Tirosin-66 untuk memebentuk struktur kromofor fluoresens phydroxybenzylideneimidazolinone. Mekanisme biosintesis kromofor GFP dapat dilihat pada Gambar 5.
9 Setiap tahap dari pembentukan kromofor bersifat autokatalitik atau menggunakan faktor yang bersifat ada dimana-mana sehingga ekspresi fluoresen GFP memiliki spektrum yang luas untuk berbagai organisme (Chalfie dan Kain 2006). Bahan yang dibutuhkan GFP untuk mengemisikan cahaya tidak tergantung substrat atau kofaktor, protein ini dengan cepat menjadi pilihan yang populer untuk memonitor pengaturan secara luas dari proses biologi, mulai dari ekpresi gen sampai ke pengaturan organel. Analisis mutasi GFP terutama pada bidang fluorofor telah menghasilkan sebuah keragaman isoform GFP dengan karakteristik yang berbeda dari protein asli salah satunya adalah GFPuv (Tsien 1998).
GFPuv mengalami mutasi titik di tiga kodon asam amino pada sekuens DNA GFP asli yaitu Phenilalanin-99 menjadi Serin, Metionin-153 menjadi Threonin, dan Valin-163 menjadi Alanin, namun perubahan struktur tersebut tidak merubah sekuens kromofor akan tetapi pada GFPuv terdapat jarak yang cukup renggang antara β-strand ketujuh dan kedelapan yang terbentuk selama pelipatan
β-barrel seperti terlihat pada gambar 6 (Crameri et al. 1996; Tansila et al. 2007). Seperti halnya GFP, GFPuv memiliki eksitasi maksimum pada panjang gelombang 395 nm dan emisi maksimum pada 509 nm.
Gambar 6 Struktur tiga dimensi GFPuv (Tansila et al. 2007)
Kelebihan GFPuv dibandingkan dengan GFP adalah intensitas pendaran yang lebih tinggi ketika tereksitasi oleh sinar ultraviolet (UV) pada panjang gelombang 395 nm. GFPuv mempunyai intensitas fluoresen 45 kali lipat dibanding GFP. Perubahan intensitas fluoresen dapat terjadi karena protonasi dan deprotonasi residu yang berada di sekitar kromofor (Kneen et al. 1998). Oleh sebab itu, GFPuv cocok untuk digunakan dalam berbagai aplikasi intraseluler, seperti penanda kuantitatif dari ekspresi gen. GFPuv bersifat resisten terhadap perubahan pH. Denaturasi secara lengkap hanya terjadi pada pH ekstrim (1.0 dan 4.0). Ketahanannya terhadap perubahan pH paling utama disebabkan oleh struktur kromofor GFPuv yang terlindungi (Chin et al. 2003).
10
markeryang memungkinkan adanya seleksi biasanya gen yang resisten terhadap antibiotik, dan origin of replication (ori) sehingga mampu mereplikasikan diri tanpa pengaturan DNA kromosom (Clontech 2012). Plasmid dapat melakukan replikasi dan membagi diri menjadi dua bersamaan dengan sel inang ketika membelah. Pembelahan antara inang dengan plasmid sering juga terjadi tidak bersamaan sehingga plasmid hilang atau tidak ditemukan pada keturunan berikutnya (Ma et al. 2011)
Sebagaimana gen lain GFPuv juga dapat disisipkan pada plasmid. Penyisipan GFPuv pada plasmid telah dilakukan oleh Clontech (2012). Sekuens penyandi gen ini berada pada daerah Multiple Cloning Site (5’MCS- 3’MCS),
dengan kodon inisiasi lacZ sehingga protein gabungan β-galactosidase-GFPuv dapat diekpresikan dari lac-promotersecara konstitutif (Gambar 7). Plasmid ini juga mempunyai titik ori (Origin of Replication), sehingga dapat melakukan replikasi secara mandiri tanpa pengaturan dari DNA kromosom. Selain itu, mengandung gen resisten ampisilin (Ampr), yang menyandikan protein β -lactamase yang dapat mendegradasi antibiotik ampisilin sehingga memiliki sifat resisten terhadap ampisilin, jadi bakteri yang tidak berhasil disisipi oleh plasmid akan mati dengan sendirinya (Sambrook dan Russel 2001).
Gambar 7 Peta pGFPuv 3.3 kb (Clontech 2012)
Aplikasi Green Fluorescent Protein (GFP)
11 Theodore et al. (2005) melaporkan bahwa GFP dapat diaplikasikan pada virus West Nile virus (WNV) yang menyebabkan penyakit encephalitis pada hewan dan manusia melalui nyamuk. Virus yang telah mengandung GFP di infeksikan pada sel mamalia secara invitro. Pertumbuhan virus WNV diasumsikan sama dengan peningkatan jumlah GFP pada sel.GFP juga dapat diekspresikan pada virus mosaik untuk mengetahui bagaimana interaksi virus dengan gandum. Dengan memasukkan virus mosaik yang mengekspresikan GFP maka tempat penyebaran virus dapat terpantau dengan cara membawa tanaman ini keruangan gelap dan menyinarinya dengan lampu UV secara periodik (Tatineni et al. 2011). Hasi penelitian tersebut menunjukkan bahwa virus mosaik dapat menginfeksi semua bagian dari tanaman tembakau.
GFP sering diaplikasikan pada bakteri yang bertujuan sebagai penanda agar mudah membedakan dengan bakteri lain. Dengan adanya penanda tersebut maka mempermudah mempelajari perilaku bakteri target pada lingkungan. Ma et al. (2011) telah melaporkan bahwa GFP dapat diaplikasikan pada beberapa bakteri yaitu Salmonella Enteriditis, S. Newport, E. coli dan Listeria monocytogenes. Tujuan dari pelabelan tersebut adalah untuk mengetahui kestabilan GFP sampai 50 generasi. Nurjanah et al. (2014) telah mengaplikasikan GFP yaitu GFPuv pada beberapa isolat Cronobakter sakazakii untuk pelabelan. Pelabelan tersebut bertujuan mempermudah penelusuran bakteri C. sakazakii pada bahan pangan tanpa harus menekan pertumbuhan mikroorganisme lain. Kestabilan plasmid merupakan salah satusyaratdalam pelabelan sel bakteri. Informasi kestabilan plasmid sangat diperlukan ketika mutan diaplikasikan pada proses tertentu. Kestabilan plasmid di dalam mutan dievaluasi dengan cara menghitung perbandingan populasi mutan dan total koloni bakteri yang tumbuh.
Teknik Transformasi CaCl2
Aplikasi GFP pada bakteri dapat dilakukan dengan metode CaCL2.Transformasi dengan metode CaCl2 sering digunakan pada sel bakteri karenalebih mudah dan efektif. Dikatakan mudah dan efektif karena tidak membutuhkan alat khusus akan tetapi peluang masuknya DNA donor cukup tinggi (Ma et al. 2011). Pada populasi bakteri, hanya sel yang kompeten saja yang yang dapat mengambil DNA dari lingkungan. Kultur yang digunakan untuk sel kompeten adalah kultur pada kondisi pertumbuhan awal fase logaritmik karena pada fase ini kultur memiliki kompetensi yang paling baik. Sel bakteri pada fase tersebut mengalami pertumbuhan yang optimal dan aktif membelah sehingga memudahkan introduksi DNA asing.Pada fase ini elastisitas membran bakteri cukup tinggi sedangkan jika telah mencapai fase stasioner bakteri akan membentuk membran sel yang kaku.
12
ke dalam sel.Metode CaCl2 dibantu oleh perlakuan kejut panas (heat shock) pada suhu 42oC selama 60 detik agar membuka pori pada membran sel. Terbukanya pori membran sel menyebabkan DNA rekombinan bisa masuk dengan mudah ke dalam sel (Gambar 8).
Gambar 8 Mekanisme transformasi CaCl2 (NextGen Sciences 2005) Proses transformasi CaCl2 tidak selalu berhasil atau sering mengalami kegagalan. Ada beberapa faktor yang menyebabkan kegagalan dalam proses transformasiCaCl2. Kegagalan tersebut dapat terjadi pada kondisi ataupun karakter inang yang digunakan dan kegagalan bisa juga terjadi karena kesalahan prosedur dalam proses transformasi.
Kultur yang dipanen pada awal fase logaritmik memiliki kompetensi yang paling baik. Sel bakteri pada fase tersebut mengalami pertumbuhan yang optimal dan aktif membelah sehingga memudahkan introduksi DNA asing.Pada fase ini elastisitas membran bakteri cukup tinggi. Bakteri yang sudah mencapai pertumbuhan fase stasioner akan membentuk membran sel yang tidak elastis atau kaku sehingga pori membran akan lebih susah terbuka pada saat tahap heat-shock(Sambrook dan Russell 2001).
Langkah penting dalam proses transformasi adalah preparasi sel kompetendengan metode CaCl2. Cl permeable terhadap membran sel yang menyebabkan sel bakteri membengkak dan membentuk pori pada membran. Ion-ion Ca2+ yang bersifat positif dapat berikatan dengan membran fosfolipid sehingga molekul DNA yang bermuatan negatif dapat menempel dan mempermudah integritas DNA ke dalam sel. Perbandingan konsentrasi antara jumlah CaCl2 dengan kultur yang digunakan sangat mempengaruhi keberhasilan dari proses transformasi. Konsentrasi CaCl2 yang terlalu tinggi menyebabkan lisis atau pecahnya sel bakteri (Brown 2006).
13 bakteri dapat bertahan pada suhu tersebut. Serangkaian gen ini disebut dengan heat-shock genes. Suhu yang optimal untuk heat shock adalah 420C, jika melebihi suhu tersebut maka akan terjadi kerusakan dari sel kompeten. Pada suhu di bawah 42oC, kemampuan bakteri untuk mengambil plasmid atau DNA eksogenus lebih rendah, sedangkan pada suhu ekstrim bakteri akan mati (Li et al. 2010). Menurut Sambrook dan Russel (2001) setelah tahap heat-shock, medium SOC ditambahkan sebagai media recovery dan diinkubasi pada suhu 37oC selama 1 jam. Kemudian disebar pada agar cawan yang mengandung antibiotik dan diinkubasi pada suhu 37oC selama 1 malam.
Selain faktor diatas perbandingan jumlah sel kompeten dan jumlah DNA atau plasmid yang digunakan sangat mempengaruhi keberhasilan transformasi. Efisiensi transformasi CaCl2 berkisar antara 105 - 106sel/mL atau absorbansi OD600 0.4 transforman/μg DNA dan dapat ditingkatkan hingga mencapai efisiensi 108 transforman/μg DNA tergantung kombinasi bahan-bahan kimia yang digunakan dan perlakuan secara fisik pada sel (Sambrook dan Russel 2001).
14
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan September 2014 sampai dengan April 2015 di Laboratorium Mikrobiologi dan Bioteknologi Southeast Asian Foodand Agricultural Science and Technology(SEAFAST) Center Institut Pertanian Bogor
Bahan
Bahan yang digunakan pada penelitian ini adalah 12 isolat Cronobacter sakazakii (Tabel 1) yang diperoleh dari koleksi kultur SEAFAST Center Institut Pertanian Bogor yang di isolasi dari beberapa bahan pangan. Media dan bahan lain yang digunakan adalah plasmid GFPuv (Clontech USA), Luria Bertani (LB) (Difco, Sparks,USA).Brain Heart Infusion (BHI) Druggan-Forsythe-Iversen(DFI), Buffer Water Phosphat (BPW),Tryptic Soy Agar (TSA) (Oxoid, Hampshire, UK).Tryptic Soy Agar + Ampisilin (TSAA), larutanTransformation(TF)yang mengandung 10 mM Tris.HCL, 100 mM CaCl2, Super optimal broth with catabolite repression (SOC) dengan komposisi 20 g/L LB (Difco), 3.6 g/L glukosa dan 0.95 g/L MgCl2, membran filter 0,22 μm. Beberapa bahan yang digunakan untuk isolasi DNA antara lain proteinase K, Sodium Dodecyl Sulphat (SDS), NaCl, CTAB, fenol, kloroform, isoamil alkohol, sodium asetat, isopropanol (Merck, Darmstadt, Jerman).Larutan TE yang terdiri dari Tris dan EDTA, TAE (Tris-Asetat-EDTA), Ethidium Bromide (Amersham Bioscience, Swedia). agarosa (SIGMA, Steinheim, Jerman), etanol 70 % dan HCl.
Alat utama yang digunakan adalah sentrifuse(Hermle Labortechnik, Wehningen, Jerman), water bath shaker(PolyScience, Warrington, USA), lampu UV (Desage Heidelberg Min UVIS), mikroskop fluoresen (Olympus Corporation, Center Valley, USA), PCR(Applied Biosystems),dan Gel Doc XR (Bio Rad). Tabel 1. Isolat bakteri yang digunakan pada penelitian
No Kode isolat/GenBank Sumber Isolat Referensi
1 Desb10/JF800181 tepung jagung Gitapratiwiet al. 2012
15
Persiapan dan Konfirmasi Isolat
Cronobactersakazakiidari stok manik-manik diremajakan dengan cara mengkultur bakteri tersebut pada media BHI (Oxoid) pada suhu 37oC selama 1 malam. Kultur yang telah diremajakan ditumbuhkan pada media agar DFI (Oxoid) untuk memastikan kembali viabilitas dan identitas kultur. Koloni isolat Cronobactersakazakii akan berwarna hijau biru pada media tersebut.
Uji Resistensi Cronobacter sakazakii terhadap Ampisilin
Resistensi Cronobakter sakazakii(wild type) terhadap ampisilin dapat diketahui dengan cara menumbuhkan isolat tersebut pada media yang mengandung ampisilin (Nurjanah et al. 2015). Isolat C. sakazakii ditumbuhkan pada media BHI (Oxoid) selama 1 malam pada suhu 37oC. Sebanyak 0.1 mL inokulum(106CFU/mL) diinokulasikan pada media TSA (Oxoid) yang mengandung ampisilindengan konsentrasi ampisilin 0 μg/mL, 10 μg/mL, 20
μg/mL, 30 μg/mL, dan 40 μg/mL dan 50 μg/mL.Kultur diinkubasi pada suhu 37oC selama 2 hari. Setelah masa inkubasi, pertumbuhan C. sakazakii diamati berdasarkan kepadatan kolonidengan mengikuti standar jumlah maksimal dan minimal koloni bakteri(Standar Plate Count) 25-250 (BAM 2001)
- = tidak ada pertumbuhan koloni
+ = koloni yang tumbuh sangat sedikit (1-25CFU/mL) ++ = koloni yang tumbuh sedikit (26-100CFU/mL)
+++ = koloni yang tumbuh agak banyak (101-175CFU/mL) ++++ = koloni yang tumbuh banyak (176-250CFU/mL) +++++ = koloni yang tumbuh sangat banyak (>250CFU/mL) Resistensi C. sakazakii terhadap ampisilin dapat diklasifikasikan menjadi tiga kelompok yaitu sensitif, intermediat resisten dan resisten(Al-nabulsi 2011) berdasarkan tingkat Minimum Inhibitory Concentrations.Pada penelitian ini resistensi C. sakazakii terhadap ampisilin diklasifikasikan menjadi tiga kelompok berdasarkan tingkat pertumbuhan isolat pada beberapa konsentrasi ampisilin.
Isolat C. sakazakii dikatakan sensitif terhadap ampisilin jika bakteri tersebut tidak tumbuh pada media yang mengandung ampisilin.
Isolat C. sakazakii dikatakan intermediat resisten terhadap ampisilin jika isolat tumbuh pada media yang mengandung ampisilin pada konsentrasi
10 μg/mL.
Isolat C. sakazakii dikatakan resisten terhadap ampisilin jika isolat tumbuh pada media yang mengandung ampisilin pada konsentrasi 20 μg/mL
PelabelanCronobacter sakazakiidengan pGFPuv menggunakan Metode
Transformasi CaCl2
16
(Difco) padawater bath shaker (PolyScience)dengan suhu 37oC selama 3 jam.Sel bakteri dipisahkan dari media pertumbuhannya dengan sentrifugasi (3000 rpm, 4oC, 10 menit). Sel bakteri yang telah terpisah disuspensikan dalam 10 ml larutan TF (10 mM Tris.HCL, 100 mM CaCl2), didiamkan dalam es selama 30 menit, kemudian disentrifugasi kembali pada kondisi yang sama. Pelet disuspensikan dalam 0.3 mL larutan TF (sel kompeten). Trasformasi sel bakteri dilakukan dengan mencampurkan 40 μL sel kompeten dengan 2 μL pGFPuv dalam tabung Eppendorf, didiamkan di dalam es selama 30 menit kemudian diberi kejut panas pada suhu 42oC selama 60 detik. Ditambahkan media recovery SOC sebanyak 450
μL, kemudian diinkubasi pada water bath shaker (37oC, 1 jam) selanjutnya disentrifugasi (4500 rpm, 4oC, 10 menit). Supernatan dibuang dan pelet diresuspensi dengan BPW (Oxoid) sebanyak 100 μL. Produk transformasi ditumbuhkan dalam media TSA + ampisilin (35μg/ml) dan diinkubasi pada suhu 37oC selama 1 malam.
Konfirmasi Mutan secara Fenotip pada Media TSAA
Keberhasilan prosestransformasi dapatdilihat dengan mengamati koloni mutan di bawah sinar UV. Koloni yang berwarna hijau berfluoresen merupakan bakteri yang telah mengandung plasmid GFPuv. Eskpresi GFPuv pada isolat C. sakazakii bervariasi yaitu stabil, tidak stabil, dan tidak diekspresikan.
Ekspresi GFPuv dikatakan stabil jika semua koloni isolat menghasilkan fluoresen atau pendaran hijau.
Ekspresi GFPuv dikatakan tidak stabil jika pendaran hijau yang dihasilkan hanya pada sebagian koloni isolat
Isolat dikatakan tidak dapat mengekspresikan GFPuv jika pendaran hijau tidak dihasilkan pada koloni isolat.
Isolat yang dapat mengekspresikan GFPuv dengan stabil disimpan pada stok kultur pada media BHI (Oxoid) yang mengandung ampisilin ditambah dengan gliserol danmanik-manik.
Konfirmasi Mutan secara Fenotip dengan Mikroskop Fluoresens
Konfirmasi fenotip dilakukan dengan mengamati sel mutanC. sakazakiiyang terekspresi dengan stabil dibawah mikroskop fluoresen(Olympus CH3O) pada gelombang 396 nm. Kultur mutanC. sakazakiidari media BHI (Oxoid) yang mengandung ampisilin diteteskan diatas slide mikroskop. Slide mikroskop yang telah mengandung sel bakteri difiksasi agar sel menempel pada slide kemudian diamati dibawah mikroskop.
Deteksi gen GFP pada Sel Mutan yang Tidak Stabil dan Terekspresi dengan PCR
17 (Gitapratiwiet al. 2012). Isolat ditumbuhkan pada media BHI (Oxoid) yang mengandung ampisilin selama 24 jam. 2 mL kultur bakteri disentrifugasi (18000 rpm selama 3 menit). Pelet diresuspensi dengan 200 μL bufer TE, ditambah 50 μL SDS 10 %, setelah suspensi homogen ditambah dengan 10 μL proitenase-K kemudian diinkubasi pada suhu 37 oC selama 1 jam. Setelah diinkubasi suspensi ditambah dengan 80 μL CTAB/NaCl (10 % CTAB dalam 0.7 M NaCl), kemudian diinkubasi pada suhu 65 oC selama 20 menit. Campuran Phenol : chloroform : isoamilalcohol (25:24:1) ditambahkan pada volume yang sama dengan suspensi sebelumnya. Fase cairan (top layer) setelah disentrifugasi (13500 rpm, 10 menit) dipindahkan ke tabung eppendorf dan ditambah dengan campuran kloroform : isoamilalcohol (24:1) pada volume yang sama. Top layerdipindahkan kembali pada eppendorf yang baru setelah disentrifugasi (13500 rpm, 10 menit) dan ditambah dengan asetat 3 M dan isopropanol dengan volume yang sama, pencampuran dilakukan dengan membolak balik tabung. Tabung diinkubasi pada suhu -20 oC selama 1 jam, kemudian disentrifugasi (13500 rpm, 10 menit). Pelet ditambah dengan 500 μL etanol 70 % dan tabung dibolak-balik, DNA dipresipitasi dengan melakukan sentrifugasi (13500 rpm, 10 menit). Pelet dikering anginkan dan ditambahkan 100 μL TE.
Reaksi amplifikasi dilakukan dengan menggunakan PCRBiosytem 2720 Thermal Cycler (Foster City, California). Primer yang digunakan untuk mengamplifikasi gen GFP yaitu primer forward (5’- AAG CTA TCA ACT TCA AAA TTC GCC-3’) dan reverse (5’- TCA TCC ATG CCA TGT GTA ATC C-3’) yang menghasilkan amplifikasi berukuran 223 pasangan basa (Nurjanah 2014). Kondisi PCR untuk mengamplifikasi GFP adalah predenaturasipada suhu 94oC selama 20 detik, denaturasi 92oC selama 20 detik, annealing 55oC selama 20 detik, elongasi 72oC selama 20 detik dan final elongasi pada suhu 72oC selama 4 menit dengan jumlah siklus 38. Hasil PCR dianalisis diatas gel agarosa 1.5 % (Merck, Germany) pada buffer Tris acetat-EDTA 1x (pH 8.0). Gel diwarnai pada buffer TAE 1x yang mengandung 0.5 μ/mL etidium bromida (Amersham bioscience) selama 30 menit dan divisualisasi dibawah UV Gel Doc XR (Bio Rad).
Uji Stabilitas pGFPuv pada Sel Mutan
Stabilitas plasmid GFPuvdiuji pada media tanpa ampisilin (Nurjanah et al. 2014). Kultur stok mutan diremajakan pada media BHI yang mengandung ampisilin selama 24 jam. Kemudian isolat tersebut diinokulasi pada media BHI (Oxoid) tanpa ampisilin dengan perbandingan rasio kultur dengan media 1 : 1000 ml. Kultur yang telah diinkubasi dipindahkan pada media BHI yang baru selama 5 hari berurutan. Hari pertama sampai hari ke limajumlah koloni dihitung pada media TSA (Oxoid) tanpa ampisilin setelah masa inkubasi selama 24 jam. Stabilitas plasmid dapat dikalkulasikan dengan membandingkan selisih total koloni yang berfluoresen dengan jumlah total koloni yang diperoleh dari media non-ampisilin dalam persentase.
18
HASIL DAN PEMBAHASAN
Resistensi Cronobacter sakazakii terhadap Ampisilin
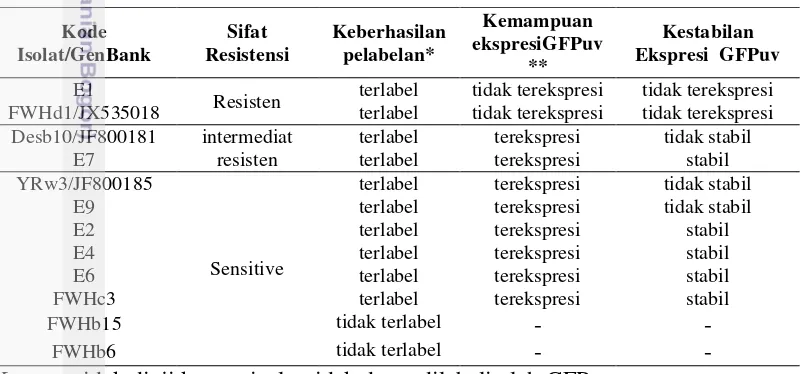
Resistensi C. sakazakii terhadap ampisilin dapat dilihat dari tumbuh atau tidaknya bakteri tersebut pada media TSA yang mengandung ampisilin (TSAA).Pada penelitian ini tingkat resistensi C. sakazakii terhadap ampisilin bervariasi yaitu sensitif, intermediat resisten, dan resisten. Isolat yang tidak tumbuh pada media TSAA digolongkan sebagai isolat yang sensitif terhadap ampisilin. Isolat digolongkan intermediat resisten jika isolat tumbuh pada TSAA dengan konsentrasi ampisilin 10 µg/mL, jika isolat masih tumbuh pada konsentrasi ampisilin20 µg/mLmaka digolongkan sebagai resisten ampisilin.Dari 12 isolat yang diuji terdapat 8 isolat (66.6 %) yang sensitif terhadap ampisilin (FWHc3, FWHb6, FWHb15, YRw3, E2, E4, E6, and E9), 2 isolat (16.6 %) bersifat intermediat resisten (Desb10, E7) dan 2 isolat (16.6 %) yang resisten terhadap ampisilin yaitu E1 dan FWHd1(Tabel 2).
Tabel 2. Tingkat ResistensiCronobacter sakazakii(wild type)terhadap Ampisilin Kode Isolat/GenBank
Intensitas koloni yang tumbuh pada
beberapa konsentrasi ampisilin (µg/ml) Sifat resistensi
0 10 20 30 40 50
+ = koloni yang tumbuh sangat sedikit (1-25 CFU/mL) ++ = koloni yang tumbuh sedikit (26-100 CFU/mL) +++ = koloni yang tumbuh agak banyak (101-175CFU/mL) ++++ = koloni yang tumbuh banyak (176-250CFU/mL) +++++ = koloni yang tumbuh sangat banyak (>250CFU/mL)
19 isolat lokal C. sakazakii yang diuji terdapat 1 isolat yang resisten terhadap ampisilin pada konsentrasi 25 µg/mL yaitu DESc7.
Isolat E1 dan FWHd1 mampu tumbuh hingga konsentrasi ampisilin 20 µg/mL, sedangkan Desb10 dan E7 hanya tumbuh hingga konsentrasi 10 µg/mL. Kuzina et al. (2001) melaporkan bahwaampisilin dengan konsentrasi 2 µg/mL sudah bisa menghambat pertumbuhan C. sakazakii, akan tetapi Noor dan Poeloengan (2008) melaporkan bahwaC. sakazakii masih tumbuh pada media yang mengandung ampisilin pada konsentrasi 10µg/mL.
Faktor yang menentukan sifat resistensi bakteri terhadap ampisilin terdapat
pada elemen yang bersifat genetik yaitu gen penyandi enzim β-laktamase.Enzim ini mampu menghidrolisis ampisilin, sehingga kehadiran ampisilin tidak mengganggu pembentukan ikatan silang pada dinding sel bakteri(Haddix et al. 2000). Lee et al. (2012) menyatakan bahwa perkembangan resistensi juga dipengaruhi oleh intensitas paparan antibiotik yang terlalu tinggi sehingga meningkatkan pola kepekaan atau resistensi bakteri yang semula sensitif. Resistensi C. sakazakii terhadap ampisilin kemungkinan terjadi karena pemberian ampisilin yang berlebihan atau tidak sesuai aturan kepada pasien yang terinfeksi bakteri tersebut.
Sifat resistensi juga dapat terjadi melalui perantaraan plasmid (Ashet al. 2002).Pada umumnya bakteri yang resisten terhadap ampisilin mengandung plasmid yang membawa gen penyandi resisten ampisilin. Sejumlah gen penyandi resistenampisilinpada plasmid dapat dibawa oleh faktor resisten(R). Ashet al. (2002) melaporkan bahwa dari 54 plasmid yang diisolasi dari beberapa jenis bakteri Gram negatifyang diisolasi dari sungai di USA mengandung 38 (70 %) gen penyandi resisten ampisilin. Gen yang berlokasi pada plasmid tidak stabil bila dibandingkan dengan yang berlokasi pada kromosom, oleh karena itu gen resistensi yang berlokasi pada plasmid dapat ditransfer dari satu sel ke sel lain.Sifat resistensi tersebut melibatkan perubahan genetik yang bersifat stabil dan diturunkan dari satu generasi ke generasi berikutnya.
PelabelanCronobacter sakazakiidenganpGFPuv
Pelabelan C. sakazakiidalam penelitian ini dilakukan denganmenggunakan pGFPuv yang mengandung gen penyandi resisten ampisilin sehingga pertumbuhan isolat pada media TSAA pasca pelabelan dapat dijadikan sebagai tahap awal untuk mengetahui keberhasilan mutan.Kemampuan tersebut dapat dijadikan sebagai penanda atau penyeleksi karena mutan GFPuv merupakan sel yang telah mengalami perubahan fenotip yang semula sensitif menjadi resisten ampisilin. Isolat FWHb6 dan FWHb15 tidak tumbuh pada media TSAA yang menunjukkan bahwa isolat tersebut tidak dapat dilabeli oleh plasmid GFPuv akibat dari kegagalan dalam proses transformasi (Tabel 3).
20
kaku sehingga pori membran akan lebih susah terbuka PADA tahapheat shock(Sambrook dan Russell 2001).
Faktor berikutnya adalah tahap preparasi sel kompeten dengan CaCl2. Cl permeable terhadap membran sel yang menyebabkan sel bakteri membengkak dan membentuk pori pada membran. Ion-ion Ca2+ yang bersifat positif dapat berikatan dengan membran fosfolipid sehingga molekul DNA yang bermuatan negatif dapat menempel dan mempermudah integritas DNA ke dalam sel. Perbandingan konsentrasi antara jumlah CaCl2 dengan kultur yang digunakan sangat mempengaruhi keberhasilan dari proses transformasi. Konsentrasi CaCl2 yang terlalu tinggi menyebabkan lisis atau pecahnya sel bakteri (Brown 2006).
Faktor selanjutnya yang mempengaruhi keberhasilan transformasi adalah tahapheat shock, yaitu dengan melakukan perubahan suhu yang cukup tinggi. Kejutan panas dapat membantu DNA dalam melewati dinding sel bakteri.Suhu yang optimal untuk heat shock adalah 420C, jika melebihi suhu tersebut maka akan terjadi kerusakan dari sel kompeten. Pada suhu di bawah 42oC, kemampuan bakteri untuk mengambil plasmid atau DNA eksogenus lebih rendah, sedangkan pada suhu ekstrim bakteri akan mati (Li et al. 2010).
Selain faktor diatas perbandingan jumlah sel kompeten dan jumlah DNA atau plasmid yang digunakan sangat mempengaruhi keberhasilan transformasi. Efisiensi transformasi CaCl2 berkisar antara 105 - 106sel/mL atau absorbansi OD600 0.4 transforman/μg DNA dan dapat ditingkatkan hingga mencapai efisiensi 108 transforman/μg DNA tergantung kombinasi bahan-bahan kimia yang digunakan dan perlakuan secara fisik pada sel (Sambrook dan Russel 2001). Tabel 3. Hasil Transformasi Mutan GFPuv pada Sel C. sakazakii
Kode
Resisten terlabel tidak terekspresi tidak terekspresi
FWHd1/JX535018 terlabel tidak terekspresi tidak terekspresi
Desb10/JF800181 intermediat
Ket - : tidak diuji karena isolat tidak dapat dilabeli oleh GFPuv * : Pertumbuhan koloni pada TSAA
** : Diamati di bawah lampu UV
21 di dalam gugus ini tereksitasi dan menghasilkan energi yang lebih rendah yang secara otomatis mampu memancarkan cahaya hijau (Shimomura 2005). Konfirmasi mutan secara fenotip juga dilihat di bawah mikroskop fluoresen. Gambar 9 menunjukkan bahwa bahwa sel mutan berbentuk batang kehijauan.
Gambar 9Sel mutan C. sakazakii GFPuv (E2) dibawah mikroskop fluoresen (1000x)
Hasil konfirmasi mutan GFPuv di bawah lampu UV menunjukkan hasil yang bervariasi (Gambar 10).Ekspresi GFPuv pada sel C. sakazakii ada yang stabil, tidak stabil bahkan tidak terekspresi ketika diuji pada subkultur ke-2. Ekspresi GFPuv dikatakan stabil jika semua koloni isolat menghasilkan fluoresen atau pendaran hijau. Jika pendaran hijau yang dihasilkan hanya pada sebagian koloni dari isolat dikatakan tidak stabil, sedangkan koloni yang tidak menghasilkan pendaran hijau sama sekali merupakan isolat yang tidak dapat mengekspresikan GFPuv. Ekspresi GFP yang stabil terdapat pada isolat C. sakazakiiE2, E4, E6, E7, dan FWHc3, sedangkan isolat yang tidak mengekspresikan GFP adalah E1 dan FWHd1 (Tabel 3).
(A) (B) (C)
Gambar 10Ekspresi mutan GFPuv dibawah UV (A) stabil pada isolat E2, (B)tidak stabil pada isolat Desb10, (C) tidak terekspresi pada isolat E1
22
segregasi sel inang (Ma et al. 2011;Akasakaet al. 2015).Pembelahan sel merupakan proses dimana sel induk membelah atau membagi dirinya menjadi 2 atau lebih sel anakan. Proses pembelahan diikuti dengan dublikasi materi genetik sehingga sel anakan juga mewarisi sifat dari induknya. Dalam sel juga ditemukan plasmid yang mengandung materi genetik akan tetapi tidak selamanya pembelahan sel induk dan plasmid bersamaan sehingga ada beberapa sel anakan yang tidak mengandung plasmid sebagaimana induknya.
Hwang et al. (2003); Yusuf et al. (2014)menyatakan bahwa kestabilan dan ekspresi gen juga berhubungan erat dengan jumlah kopigen yang terdapat pada setiap sel. Semakin rendah jumlah kopi yang dihasilkan maka kestabilan dan ekspresi gen di dalam sel semakin rendah.Plasmid dapat bereplikasi secara otonom atau independen tidak tergantung pada DNA pada kromosom bakteri, sehingga tingkat pertumbuhan bakteri dapat mempengaruhi jumlah kopian plasmid yang diperoleh di dalam sel. Tingkat pertumbuhan yang rendah menyebabkan bakteri memiliki waktu yang cukup sehingga plasmid melakukan replikasi sebelum terjadi pembelahan sel(Wiley et al. 2008).
Hubungan Resistensi Cronobacter sakazakii terhadap Ampisilin dengan
Kestabilan dan EkspresiGFPuv
Gen GFPuv disisipkan dalam sel C. sakazakii melalui perantara plasmid yang dilengkapi dengan gen penyandi resisten ampisilin yang bertujuan untuk mempermudah seleksi. Beberapa hasil penelitin menunjukkan bahwa keberadaan gen penyandi resisten antibiotik menyebabkan bakteri yang resisten terhadap antibiotik tersebut tidak berhasil ditransformasikan. Ma et al. (2011) melaporkan bahwa plasmid GFPuv dapat dikonstruksikan pada Listeria, Salmonella dan Escherichia coli, akan tetapi dari beberapa strain bakteri tersebut ada yang tidak dikonstruksikan yaitu strain yang resisten ampisilin karena peneliti menyatakan bahwa bakteri yang resisten ampisilin tidak berhasil dilabeli oleh pGFPuv.Nurjanah et al, (2014) melaporkan bahwa pGFPuv dapat disisipkan pada C. sakazakii. Dari 5 isolat lokal yang dikonstruksikan terdapat 1 isolat yang tidak terlabeli yaitu isolat yang memiliki sifat resisten terhadap ampisilin.
Hasil penelitian ini juga menunjukkan bahwa isolat yang bersifat resisten terhadap ampisilin cenderung tidak stabil bahkan tidak mampu mengekspresikan GFPuv (Tabel 3). Sama halnya dengan penelitian Zhang et al.(2013) yang melaporkan bahwa ada beberapa strain bakteri yang tidak mampu mengekspresikan GFP pada selnya, khususnya strain bakteri yang resisten terhadap antibiotik yang dikandung oleh plasmid GFP, walaupun gen tersebut masih teramplifikasi oleh PCR.
23 Gen pada plasmid GFPuv kemungkinan tidak di transkripsi karena proses transkripsi berhubungan dengan tingkat kebutuhan gen di dalam sel.C. sakazakii yang resisten ampisilin telah memiliki gen penyandi resisten ampisilin pada selnya, ketika gen yang sama disisipkan pada sel tersebut maka gen itu tidak disintesis kembali. Yu et al.(2015) menyatakan bahwagen yang dibutuhkandisintesis dalam jumlah yang besar, sedangkan yang lain dalam jumlah yang kecil Oleh karena itu aktivitas semua gen yang dibutuhkan secara khusus diatur dalam satu atau banyak cara agar penggunaan energi yang tersedia dalam sel lebih efisien. Mekanisme pengaturan tersebut dapat terjadi pada tingkat gen itu sendiri dengan mengendalikan proses transkripsi. Pada proses transkripsiDNA ditranskripsi menjadi RNA. Dalam keadaan normal RNA merupakan untaian tunggal, akan tetapi dalam keadaan tertentu RNA dapat menjadi ikatan dupleks. Ikatan dupleks tersebut dapat menghambat ekspresi gen (Malik 2005).
Deteksi gen GFP pada Sel Mutan yang Tidak Stabil dan Terekspresi dengan PCR
Keberadaan gen GFP di dalam sel C. sakazakii diketahui dari proses amplifikasi gen GFPdengan menggunakan primer spesifik GFP yaituforward (5’- AAG CTA TCA ACT TCA AAA TTC GCC-3’) dan reverse (5’- TCA TCC ATG CCA TGT GTA ATC C-3’). Primer spesifik hanya mengamplifikasi gen yang sesuai dengan urutan nukleotida primer dan akan membentuk amplikon dengan ukuran 223 bp (Nurjanah et al. 2014). Gen yang berada dalam sel C. sakazakiiapabila bukan gen GFP maka tidak akan terjadi reaksi PCR dan dapat dipastikan bahwa gen yang divisualisasikan adalah gen GFP.
Hasil PCR divisualisasi dengan menggunakan elektroporesis gel agarosa 1.5% menunjukkan adanya produk PCR berupa pita DNA tunggal yang berukuran 223 bp (Gambar 11). Hal tersebut menunjukkan bahwa semua isolat yang diuji mengandung gen GFP, karena ukuran pita DNA tersebut sesuai dengan ukuran primer GFP yang digunakan. Tebal pita dari beberapa isolat yang diuji berbeda-beda. Pita gen GFP yang dihasilkan oleh isolat EI, FWHd1 lebih tipis dibanding dengan isolat lainnya. Hal ini menunjukkan bahwa jumlah atau konsentrasi gen GFP yang terdapat pada isolat E1 dan FWHd1 lebih sedikit dibandingkan pada isolat yang lain. Sambrook dan Russell (2001) menyatakan bahwa pita yang tipis dipengaruhi oleh nilai kemurnian. Nilai kemurnian dapat diketahui berdasarkan konsentrasi DNA dan keberadaan kontaminan DNA lain maupun protein.
24
Gambar 11 Visualisasi DNA hasil amplifikasi gen GFP(A) Desb10(B) YRw3(C) kontrol dengan DNA GFP,( D) 100 bp DNA ladder, (E) kontrol tanpa DNA, (F) E9, (G) FWHd1, (H) E1
Kestabilan Plasmid GFPuv pada Sel MutanCronobacter sakazakii
Kestabilan plasmid merupakan salah satusyaratdalam pelabelan sel bakteri.Informasi kestabilan plasmid sangat diperlukan ketika mutan diaplikasikan pada pengujian tertentu, dikhawatirkan plasmid hilang sehingga menghasilkan data yang tidak akurat. Kestabilan plasmid pada sel mutan dievaluasi dengan cara menghitung perbandingan populasi mutan dengan total koloni bakteri yang tumbuh.
Semua mutan dari stok kultur atau yang telah disimpan beku mempunyai kestabilan plasmid diatas 90%. Sama halnya setelah melalui subkultur 1 dan 2 tetap memiliki kestabilan plasmid diatas 90%. Akan tetapi pada subkultur berikutnya menunjukkan adanya penurunan tingkat kestabilan plasmid pada sel. Isolat yang paling tinggi kestabilannya adalah E2 (97.0 %), sedangkan yang paling rendah adalah isolat E7 yaitu 73.5 % pada subkultur ke-5 (Tabel 4). Kestabilan plasmid pada sel tergantung dari proses segregasi atau pemisahan plasmid tersebut. Adanya generasi sel bakteri yang tidak mengandung plasmid terjadi karena ketidakseimbangan antara kecepatan pembelahan sel dengan distribusi plasmid sehingga sel anak yang tidak mendapatkan plasmid menjadi sel normal kembali sehingga mengakibatkan perbedaan kandungan plasmid dari sel yang telah direkultur(Akasakaet al. 2015; Ma et al. 2011).
Tabel 4Kestabilan plasmid GFPuvpada sel mutan
Isolat Kestabilan Plasmid (%)
1
Stok kultur Subkulur 1 Subkultur 2 Subkultur 3 Subkultur 4 Subkultur 5
E2 99.2±0.22 98.5±0.42 98.1±0.43 98.4±0.59 97.7±1.09 97.0±0.44
E4 97.5±0.43 96.0±0.28 95.9±1.25 95.7±4.65 90.7±6.12 86.3±8.57
E6 98.8±0.07 98.3±0.31 97.7±0.12 94.9±4.58 88.7±11.94 92.0±7.98
E7 94.3±2.86 93.3±0.14 92.1±0.90 78.1±9.40 80.4±12.63 73.5±15.08
FWHc3 99.3±0.40 99.6±0.29 99.1±0.37 98.2±0.84 96.4±2.87 93.8±6.27
1) Kestabilan plasmid ±SD
223 bp
25
SIMPULAN DAN SARAN
Simpulan
Pelabelan Cronobacter sakazakiidengan pGFPuv dilakukan dengan metode transformasi CaCl2. Keberhasilan pelabelan dikonfirmasi dengan melihat koloni bakteri di bawah sinar UV dan melihat sel bakteri dengan mikroskop fluoresen. Isolat yang berhasil dilabeli pGFPuv menghasilkan koloni dan sel yang berwarna hijau berfluoresen.Hasil pengujian resistensi isolat terhadap ampisilin menunjukkan bahwa dari 12 isolat yang diuji terdapat 8 isolat (66.6 %) yang sensitif terhadap ampisilin (FWHc3, FWHb6, FWHb15, YRw3, E2, E4, E6, dan E9), 2 isolat (16.6 %) bersifat intermediat resisten (Desb10, E7) dan 2 isolat (16.6 %) yang resisten terhadap ampisilin yaitu E1 dan FWHd1. Isolat yang sensitif terhadap ampisilin dapat dilabeli oleh pGFPuv bahkan memiliki tingkat kestabilan plasmid yang paling tinggi(E2). Isolat yang resisten terhadap ampisilin dapat dilabel oleh pGFPuv,tetapi plasmid tidak stabil di dalam sel dan tidak diekspresikan.Isolat yang tidak mengekspresikan GFPuv adalah isolat yang tinggi tingkat resistennya yaitu E1 dan FWHd1. Sifat resistensi terhadap ampisilin berpengaruh pada kestabilan dan ekspresi mutan C. sakazakii.
Saran
26
DAFTAR PUSTAKA
Akasaka N, Astuti W, Ishii Y, Hidese R, Sakoda H, Fujiwara R. 2015. Change in the plasmid copy number in acetic acid bacteria in response to growth phase and acetic acid consentration. J. Biosci. Bioeng. 119(6) 661-668. Al-nabulsi AA, Osaili TM, Elabedeen NOZ. Jaradat ZW, Shaker R, Khaerallah R,
Tarazi YH, Holley AH. 2011. Infact of environmental stress desiccation, acidity, alkalinity, heat or cold on antibiotic susceptibility of Cronobacter sakazakii. Int Food Mirobiol J. 146 : 137-143.
Arseni A, Ladas EM, Koutsia C, Xanthou M, Trikka E. 1987. Outbreak of colinization of neonates with Enterobacter sakazakii. J. Hosp. Infect. 9(2):143-150.
Ash RJ, Mauck B, Morgan M.2002. Antibiotic resistance of Gram-negative bacteria in rivers, United States. Emerg. Infec. Dis. 8(7): 713-716.
Bacteriological Analytical Tethod (BAM). 2001. http://www.cfsan.fda.gov
Baraldi C, Tinti A, Ottani S, Gamberini MC. 2014. Characterization of polymorphic ampicillin forms. J. Pharm. Biomed. Analysis. 100:329-340. Brejc K, Sixma TK, Kitts PA, Kain SR, Tsien RY, Ormo M, Remington SJ. 1997. Structural basis for dual excitation and photoisomerization of the Aequorea victoria Green Fluorescent Protein. Proc. Natl. Acad. Sci 94: 2306-1997.
Brown TA. 2006. Gene cloning and DNA analysis an introduction. England. Blackwell Publishing. Ed ke-5.
Chalfie M, Kain SR. 2006. Green Fluorescent Protein: Properties, Applications and Protocols. New Jersey (US): A John Wiley& Sons, INC, Publication. Ed ke-2.
Cottyn B, Regalado E. Lanoot B, de Cleene M, Mew TW, Swings J. 2001. Bacteria populations associated with rice seed in the tropical environment. Phytopathology. 91: 282-292.
Clontech. Certificate of Analysis pGFPuv. http://www.clontech.com [14 September 2014].
Crameri A, Whitehorn EA, Tate E, Willem PC, Stemmer WPC. 1996. Improved gren fluoresent protein by molecular evolution using DNA shuffling. Nat. Biotechnol. 14:315-319.
Estuningsih S, Kress C, Hassan AA, Akinden O, Schneider E, Usleber E. 2006. Enterobacteriaceae in dehydrated powdered infant formula manufactured in Indonesia and Malaysia. J. Food Protect. 69(12): 3013-3017.
27 Friedemann M. 2007. Review. Enterobacter sakazakii in food and beverages (other than infant formula and milk powder). Int. Food Microbiol. J. 116: 1-10.
Fraqueza MJ. 2015. Antibiotic resistance of lactic acid bacteria isolated from dry-fermented sausages. Int. J. Food Microbiol. 212: 76-88.
Gassem MAA. 1999. Study of the microorganism associated with the fermented bread (khamir) produced from sorghum in Gizan region, Saudi Arabia. J. General Microbiol. 132: 3105-3112.
Gitapratiwi D, Dewanti-Hariyadi R, Hidayat SH. 2012. Genetic relatedness of Cronobacter spp. (Enterobacter sakazakii) isolated from dried food product in Indonesia. J. Int. Food Research. 17(4): 1745-149.
Gurtler, Joshua B., Jeffrey L. Kornacki, Larry R. Beuchat. 2005. Enterobacter sakazakii: A coliform of increased concern to infant health. J.Food Microbio. 104: 1– 34.
Haddix PL, Paulsen ET, Werner TF. 2000. Measurement of mutation to antibiotic resistance: ampicillin resistance in Serratia marcescens. Bioscene 26 (1): 17-21.
Hamdani FW. 2012. Evaluasi keragaman genetika isolat lokal Cronobacter spp. (Cronobacter sakazakii) yang diperoleh dari produk pangan kering [tesis]. Bogor (ID): Institut Pertanian Bogor.
Hwang GL, Rahman MA, Razak SA, Sohm F, Farahmand H, Smith A, Brooks C
and Maclean N. 2003. Isolation and characterisation of tilapia β-actin
promoter and comparison of its activity with carp β-actin promoter. Biochim. Biophys. Acta. 1625 : 11-18.
[ICMSF]Internatioanal Commission for Microbiological Specifications for Foods. 2002. Selection of cases and attributes plans. Microorganisms in Foods 7. Microbiological testing in food safety management. New York (US): Kluwer Academic/Plenum Publisher. hlm 145-165.
Iversen C, Forsythe S. 2003. Risk profile of Enterobacter sakazakii, an emergent pathogen associated with infant milk formula. Trends. Food Sci. Tech. 14: 443-454.
Iversen C, Mullane N, McCardell B, Tall BD, Lehner A, Fanning S, Stephan R,Joosten H. 2008. Cronobacter gen. nov., a new genus to accommodate the biogroups of Enterobacter sakazakii, and proposal of Cronobacter sakazakiigen. nov., comb. nov., Cronobacter malonaticus sp. nov.,
Cronobacter turicensis sp. nov., Cronobacter muytjensii sp. nov.,
Cronobacter dublinensis sp. nov., Cronobacter genomospecies 1, and of three subspecies, Cronobacterdublinensis subsp. dublinensis subsp. nov.,
Cronobacter dublinensis subsp. lausannensis subsp. nov. and
Cronobacter dublinensis subsp. lactaridi subsp. nov.Int.J. Syst. Evol. Micr.58: 1442-1447.
Kendall JM, Badminton MN. 1998. Aequorea victoria bioluminescence moves into an exciting new era. Review. Tibtech May. 16: 216-223.
Kim K, Jang SS, Kim SK, Park JH, Heu S, Ryu S. 2008. Prevalence and genetic diversity of Enterobacter sakazakii in ingredients of infant food. Int. J. Food Microbiol. 122:196-203.