UIN SYARIF HIDAYATULLAH JAKARTA
MODIFIKASI STRUKTUR SENYAWA ASAM
P
-
METOKSISINAMAT MELALUI PROSES AMIDASI
UREA SERTA UJI AKTIVITAS SEBAGAI
ANTIINFLAMASI
SKRIPSI
SUTAR
NIM : 1111102000077
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
MODIFIKASI STRUKTUR SENYAWA ASAM
P
-
METOKSISINAMAT MELALUI PROSES AMIDASI
UREA SERTA UJI AKTIVITAS SEBAGAI
ANTIINFLAMASI
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi
SUTAR
NIM : 1111102000077
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
ABSTRAK
Nama : Sutar Program Studi : Farmasi
Judul : Modifikasi Struktur Senyawa Asam p-metoksisinamat Melalui Proses Amidasi Urea Serta Uji Aktivitas Sebagai Antiinflamasi
Telah dilakukan modifikasi senyawa asam p-metoksisinamat melalui reaksi amidasi urea dengan menggunakan microwave unmodified pada daya 300W selama 15 menit. Reaksi ini menghasilkan senyawa murni para metoksisinamamida (C10H11NO2) dengan rendemen sebesar 20,92%. Aktivitas
antiinflamasi dari senyawa asam p-metoksisinamat dan para metoksisinamamida diuji dengan metode inhibisi denaturasi Bovine Serum Albumin (BSA) yang masing-masing senyawa menghasilkan persentase inhibisi denturasi protein sebesar -0,54% dan 33,17% pada konsentrasi 0,1 ppm, -0,34% dan 37,1% pada konsentrasi 1 ppm, 0,11% dan 41,08% pada konsentrasi 10 ppm, 0,32% dan 81,57% pada konsentrasi 100 ppm. Hasil ini menunjukan bahwa senyawa hasil amidasi etil p-metoksisinamat (para metoksisinamamida) memiliki aktivitas sebagai antiinflamasi yang lebih tinggi dibandingkan senyawa induk asam p-
metoksisinamat sehingga memungkinkan untuk dianalisis lebih lanjut sebagai kandidat antiinflamasi.
ABSTRACT
Name : Sutar Programme study : Pharmacy
Title : Structure Modification p-methoxycinnamate Acid Through Urea Amidation and Antiinflammatoty Assay to the Result of Modification Compound.
Modification of p-methoxycinnamate acid through urea amidation has been carried out using a microwave unmodified at 300 W for 15 minutes. This reaction produce a pure compound of p-methoxycinnamamide (C10H11NO2) with 20.92%
yield. Antiinflammatory activity of p-methoxycinnamate acid and p- methoxycinnamamide was analyzed by using inhibition of bovine serum albumine (BSA) denaturation method. It was found that in concentration 0,1 ppm, 1 ppm, 10 ppm and 100 ppm p-methoxycinnamate acid inhibit denaturation of protein -0.54%, -0.34%, 0.11% and 41.08% whereas p-methoxycinnamamide 33.17%, 37.1%, 41.08% and 81.57%. These result indicate that the compound amidation of
p-methoxycinnamamide have higher antiinflammatory activity than the lead compound p-methoxycinnamate acid thus allowing for further analysis as candidate of antiinflammantory.
KATA PENGANTAR
Puji syukur senantiasa saya panjatkan atas kehadirat Tuhan Yang Maha Esa, Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya, sehingga saya dapat menyelesaikan penulisan skripsi ini. Penulisan skripsi ini dilakukan dalam rangka pemenuhan tugas akhir sebagai salah satu syarat memperoleh gelar Sarjana Farmasi di Fakultas Kedokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta.
Saya menyadari bahwa tanpa bantuan dan bimbingan dari berbagai pihak, yang senantiasa diberikan sejak masa perkuliahan sampai saat penulisan skripsi ini, sangatlah sulit bagi saya untuk menyelesaikan skripsi ini. Oleh karena itu, saya mengucapkan terima kasih kepada :
1. Bapak Dr. H. Arief Sumantri, SKM., M.Kes, selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta
2. Bapak Yardi, M.Si, Apt, Ph.D selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam (UIN) Syarif Hidayatullah Jakarta
3. Ibu Ismiarni Komala, M.Sc., Ph.D., Apt, selaku pembimbing pertama serta Bapak Supandi, M.Si., Apt selaku pembimbing kedua yang telah membantu, membimbing dan memberikan ilmu kepada saya, serta meluangkan waktu, tenaga dan pikiran dari awal penelitian sampai pada penyusunan skripsi ini selesai.
4. Segenap Bapak dan Ibu Dosen yang telah memberikan ilmu dan pengetahuan sehingga penulis dapat menyelesaikan studi di jurusan Farmasi Fakultas Keokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta.
5. Para laboran Laboratorium Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta yang telah membantu dalam hal penggunaan alat dan bahan selama penelitian. 6. Kedua orang tua saya, ayahanda Uher dan ibunda Rohimah serta keluarga
materil dan spiritual hingga skripsi ini dapat diselesaian. Semoga Allah SWT memberikan balasan yang sebaik-baikna atas bantuan kalian.
7. Teman-teman seperjuangan Askandari, Aziz Iqbal Iraqia, Fatiah Yahya, Mida Fahmi, Wina Oktaviana, Nicky Annisiana Fortunita, Ayu Diah Gunardi, Rian Hidayat, Fio Noviany dan Sry Wardiah serta kakak tingkat dan teman-teman penelitian yang tergabung dalam “kingdom kencur”
yaitu Syarifatul Mufidah, Fikri Awluddin, Muhammad Rezza, Nurkhayati Putri Indriani, Muhammad Syahid Ali, Indah Nunik dan Nova Sari Aulia yang telah berbaik hati membantu saya baik itu dalam bentuk material atau pun moril selama penelitian sampai pada penyusunan skripsi.
8. Teman-teman seperjuangan di Laboratorium Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta
yang senantiasa memberikan masukan, semangat dan do’a bagi penulis
dalam menyelesaikan skripsi ini.
9. Teman-teman farmasi angkatan 2011 yang telah berjuang bersama-sama selama 4 tahun untuk menyelsaikan skripsi ini
10. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang turut membantu dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini belum sempurna. Oleh karena itu, kritik dan saran yang membangun sangat penulis harapkan agar tercapainya kesempurnaan skripsi ini. Penulis berharap semoga hasil penelitian ini dapat bermanfaat baik bagi kalangan akademis dan dunia ilmu pengetahuan, khususnya bagi mahasiswa farmasi serta bagi masyarakat pada umumnya
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORSINILITAS ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACK ... vi
KATA PENGANTAR ... vii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI... ix
DAFTAR ISI... x
DAFTAR GAMBAR ... xii
DAFTAR TABEL ... xiv
DAFTAR LAMPIRAN ... xv
BAB 1. PENDAHULUAN ... 1
1.1 Latar Belakang... 1
1.2 Rumusan Masalah ... 2
1.3 Tujuan Penelitian ... 3
1.4 Manfaat Penelitian ... 3
1.5 Hipotesis ... 3
BAB 2. TINJAUAN PUSTAKA ... 4
2.1 Spesifikasi Bahan ... 4
2.1.1. Senyawa Etil p-metoksisinamat... 4
2.1.2. Senyawa Asam p-metoksisinamat ... 6
2.1.3. Urea... 7
2.1.4. Imidazol ... 8
2.2 Hidrolisis Etil p-metoksisinamat ... 8
2.3 Amida ... 10
2.3.1. Reaksi Pembuatan Amida... 11
2.4 Identifikasi ... 12
2.4.1. Kromatografi ... 12
2.4.2. Spektrofotometri ... 16
2.5 Inflamasi ... 20
2.5.2. Antiinflamasi Menghambat Denaturasi Protein ... 21
2.6 Iradiasi Microwave ... 22
BAB 3. METODE PENELITIAN ... 24
3.1 Tempat dan Waktu Penelitian ... 24
3.1.1. Tempat ... 24
3.1.2. Waktu ... 24
3.2 Alat dan Bahan ... 24
3.2.1. Alat ... 24
3.2.2. Bahan ... 24
3.3 Prosedur Penelitian ... 25
3.3.1. Modifikasi Struktur ... 25
3.3.2. Uji Aktivitas Antiinflamasi Secara In Vitro ... 27
BAB 4. HASIL DAN PEMBAHASAN ... 29
4.1 Hidrolisis EPMS Menjadi APMS... 29
4.2. Modifikasi Struktur Asam p-metoksisinamat dengan Amidasi... 35
4.2.1. Identifikasi Senyawa Hasil Amidasi ... 37
4.3. Pengujian Aktivitas Antiinflamasi dan Hubungan Struktur Senyawa Hasil Modifikasi... 48
BAB 5. KESIMPULAN DAN SARAN ... 50
5.1. Kesimpulan ... 50
5.2. Saran ... 50
DAFTAR PUSTAKA ... 51
DAFTAR GAMBAR
Gambar 2.1. Etil p-metoksisinamat... 4
Gambar 2.2. Jalur asam sikhimat dalam biosintesa fenilpropanoid untuk menghasilkan etil p-metoksisinamat ... 5
Gambar 2.3. Struktur Asam p-metoksisinamat ... 6
Gambar 2.4. Struktur Urea ... 7
Gambar 2.5. Struktur Imidazol ... 8
Gambar 2.6. Skema Reaksi Amidasi Urea dengan Katalis Imidazol... 8
Gambar 2.7.Mekanisme Reaksi Hidrolisis Etil p-metoksisisnamat... 9
Gambar 2.8. Mekanisme Reaksi Hidrolisis pada Ester ... 10
Gambar 2.9. Mekanisme Reaksi Hidrolisis Ester dengan Katalis Basa... 10
Gambar 2.10. Struktur Amida ... 10
Gambar 2.11. Sintesis Amida dari Derivat Karboksilat... 10
Gambar 2.12. Skema Kromatografi Lapis Tipis ... 15
Gambar 4.1. KLT Hasil Reaksi Hidrolisis ... 29
Gambar 4.2. Mekanisme Reaksi Hidrolisis Etil p-metoksisinamat ... 30
Gambar 4.3. KLT Hasil Hidrolisis dan Asam p-metoksisinamat Standar ... 31
Gambar 4.4. Senyawa Hasil Hidrolisis ... 32
Gambar 4.5. Waktu Retensi GCMS Senyawa Hasil Hidrolisis ... 32
Gambar 4.6. Spektrum GCMS Senyawa Hasil Hidrolisis ... 33
Gambar 4.7.Pola Fragmentasi GCMS Senyawa Hasil Hidrolisis ... 34
Gambar 4.8. Struktur Senyawa Asam p-metoksisinamat... 34
Gambar 4.9. Mekanisme Reaksi Amidasi Asam p-metoksisinamat dgn Urea ... 35
Gambar 4.10. KLT Senyawa Hasil Reaksi Amidasi ... 36
Gambar 4.11. Hasil Pemisahan Senyawa Amidasi Kromatografi Kolom ... 36
Gambar 4.12. KLT Senyawa EPMS, APMS dan Hasil Amidasi ... 38
Gambar 4.14. Spektrum FTIR Senyawa Hasil Amidasi ... 39
[image:14.596.114.512.134.538.2]Gambar 4.15. Spektrum FTIR Senyawa Etil p-metoksisinamat ... 39
Gambar 4.16. Spektru FTIR Senyawa Asam p-metoksisinamat ... 39
Gambar 4.17. Waktu Retensi GCMS Senyawa Hasil Amidasi ... 41
Gambar 4.18. Spektrum GCMS Senyawa Hasil Amidasi ... 42
Gambar 4.19. Pola Fragmentasi GCMS Senyawa Hasil Amidasi ... 43
Gambar 4.20. Spektrum 1H-NMR Senyawa Hasil Amidasi ... 44
Gambar 4.21. Spektrum 13C-NMR Senawa Hasil Amidasi ... 45
DAFTAR TABEL
[image:15.596.134.493.211.531.2]DAFTAR LAMPIRAN
Lampiran 1. Kerangka Penelitian... 56
Lampiran 2. Skema Identifikasi Senyawa Hasil Modifikasi... 57
Lampiran 3. Perhitungan Bahan dan Rendemen Hasil Hidrolisis serta Amidasi . 58 Lampiran 4. Spektrum GCMS Senawa Asam p-metoksisinamat ... 59
Lampiran 5. Spektrum GCMS Senyawa Hasil Amidasi ... 60
Lampiran 6. Spektrum FTIR Senyawa Hasil Amidasi... 61
Lampiran 7. Spektrum FTIR Senyawa APMS... 62
Lampiran 8. Spektrum FTIR Senyawa EPMS ... 63
Lampiran 9. Spektrum 1H-NMR Senyawa Hasil Amidasi... 64
Lampiran 10. Spektrum 13C-NMR Senyawa Hasil Amidasi ... 70
Lampiran 11. Hasil Uji Aktivitas Antiinflamasi ... 74
BAB 1 PENDAHULUAN 1.1 Latar Belakang
Indonesia adalah negara megabiodiversity yang kaya akan tanaman obat, dan sangat potensial untuk dikembangkan, namun belum dikelola secara maksimal. Kekayaan alam tumbuhan di Indonesia meliputi 30.000 jenis tumbuhan dari total 40.000 jenis tumbuhan di dunia, 940 jenis diantaranya merupakan tumbuhan berkhasiat obat (jumlah ini merupakan 90% dari jumlah tumbuhan obat di Asia). Berdasarkan hasil penelitian, dari sekian banyak jenis tanaman obat, baru 20-22% yang dibudidayakan. Sedangkan sekitar 78% diperoleh melalui pengambilan langsung (eksplorasi) dari hutan. Potensi tanaman obat di Indonesia, apabila dikelola dengan baik akan sangat bermanfaat dari segi ekonomi, sosial-budaya maupun lingkungan (dephut, n.d).
Diantara salah satu potensi alam Indonesia yang bisa digunakan sebagai obat adalah kencur (Kaempferia galanga L.). Kencur merupakan tanaman tropis yang banyak tumbuh di berbagai daerah di Indonesia sebagai tanaman yang dibudidayakan. Biasanya tanaman ini dari umbinya digunakan sebagai ramuan obat tradisional (Hamida, 2007). Rimpang kencur secara empiris telah dimanfaatkan dalam mengobati berbagai penyakit seperti radang lambung, radang anak telinga, influenza pada bayi, masuk angin, sakit kepala, batuk, memperlancar haid, mata pegal, keseleo, diare, menghilangkan darah kotor dan mengusir lelah (Al-Fattah, 2011).
Kandungan metabolit sekunder dalam ekstrak kencur diantaranya ialah asam propionate (4,7%), pentadekan (2,08%), asam tridekanoat (1,81%), 1,21-docosadiene (1,47%), beta-sitosterol (9,88%), dan komponen terbesar adalah etil p-metoksisinamat (80.05%) (Umar et al,.2012)
merupakan hasil hidrolisis dari etil p-metoksisinamat sama sekali tidak memberikan aktivitas sebagai antiinflamasi (Mufidah, 2014). Selain itu modifikasi struktur dari asam p-metoksisinamat dengan proses amidasi masih belum banyak dikembangkan. Oleh karena itu diperlukan pengembangan struktur dari senyawa ini.
Salah satu metode pengembangan struktur adalah dengan penambahan gugus amina yang bertujuan untuk memberikan efek antiinflamasi serta mengurangi efek samping AINS terhadap gastrointesitinal (Kalgutkar et al, 2000). Modifikasi ibuprofen menjadi turunan amida menggunakan amina alifatik atau aromatik yang berbeda menghasilkan peningkatan aktivitas analgesik, gastroprotektif dan aktivitas antiinflamasi (Kumar et al, 2010).
Dalam penelitian ini dilakukan reaksi hidrolisis terlebih dahulu yaitu mereaksikan etil p-metoksisinamat dengan NaOH pada suhu 55-60˚С.
Asam p-metoksisinamat yang merupakan hasil reaksi dari hidrolisis kemudian diamidasi dengan urea dalam microwave unmodified
menggunakan katalis imidazol pada tekanan 300 W selama 15 menit. Produk hasil reaksi yang mengandung gugus amida kemudian diuji aktivitas antiinflamasinya dengan metode BSA (Bovin Serum Albumin). Uji antiinflamasi dilakukan secara in vitro dengan melihat efek denaturasi pada BSA (Bovin Serum Albumin). Pengujian ini dipilih karena mudah, menggunakan sedikit sampel, waktu analisa yang cepat dan merupakan uji pendahuluan yang dilakukan sebagai skrining awal aktivitas antiinflamasi.
1.2 Rumusan Masalah
1. Apakah senyawa asam p-metoksisinamat dapat dimodifikasi menjadi turunan senyawa yang mengandung gugus amin melalui proses amidasi dengan urea menggunakan katalis imidazol?
2. Bagaimana hubungan struktur senyawa hasil amidasi asam
1.3 Tujuan Penelitian
1. Modifikasi struktur senyawa asam p-metoksinamat dengan penambahan gugus amin melalui proses amidasi dengan urea menggunakan katalis imidazol
2. Melakukan uji aktivitas antiinflamasi dari senyawa yang dimodifikasi.
1.4 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai aktivitas antiinflamasi dari senyawa hasil modifikasi struktur amidasi asam p-metoksisinamat serta dapat dijadikan referensi lainnya.
1.5 Hipotesis
1. Reaksi amidasi dari asam p-metoksisinamat akan merubah gugus karboksilat menjadi amida dan dapat menghasilkan senyawa turunan yang mengandung gugus NH2.
2. Penambahan gugus NH2 pada asam p-metoksisinamat dapat
BAB 2
TINJAUAN PUSTAKA 2.1 Spesifikasi Bahan
2.1.1. Senyawa Etil p-metoksisinamat
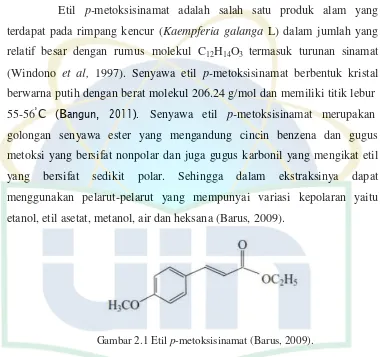
Etil p-metoksisinamat adalah salah satu produk alam yang terdapat pada rimpang kencur (Kaempferia galanga L) dalam jumlah yang relatif besar dengan rumus molekul C12H14O3 termasuk turunan sinamat
(Windono et al, 1997). Senyawa etil p-metoksisinamat berbentuk kristal berwarna putih dengan berat molekul 206.24 g/mol dan memiliki titik lebur 55-56˚C (Bangun, 2011). Senyawa etil p-metoksisinamat merupakan
[image:20.596.135.515.173.530.2]golongan senyawa ester yang mengandung cincin benzena dan gugus metoksi yang bersifat nonpolar dan juga gugus karbonil yang mengikat etil yang bersifat sedikit polar. Sehingga dalam ekstraksinya dapat menggunakan pelarut-pelarut yang mempunyai variasi kepolaran yaitu etanol, etil asetat, metanol, air dan heksana (Barus, 2009).
Gambar 2.1 Etil p-metoksisinamat (Barus, 2009).
Etil p-metoksisinamat mempunyai gugus fungsi yang reaktif sehingga sangat mudah ditransformasikan menjadi gugus fungsi yang lain. Etil p-
metoksisinamat adalah ester alam dimana gugus esternya dapat dihidrolisis menjadi senyawa asam karbooksilat (Mufidah, 2014). Kadar etil p- metoksisinamat dalam simplisia dapat mencapai 80,05 % (Umar et al, 2012) Etil p-metoksisinamat sebelumnya dimanfaatkan sebagai bahan tabir surya (Windono, et al 1997), namun dewasa ini telah diteliti lebih lanjut bahwa etil p-metoksisinamat memiliki aktivitas sebagai antiinflamasi non- selektif menghambat COX-1 dan COX-2 secara in vitro (Umar et al., 2012).
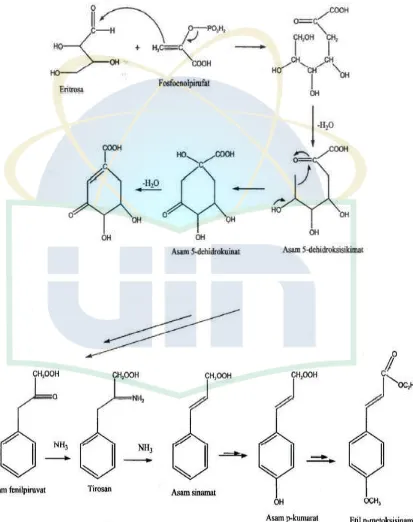
Etil p-metoksisinamat merupakan senyawa turunan asam sinamat sehingga biosintesinya termasuk pada jalur sikhimat. (Gambar 2.2).
Gambar 2.2 Jalur asam sikhimat dalam biosintesa fenilpropanoid untuk menghasilkan etil p-metoksisinamat
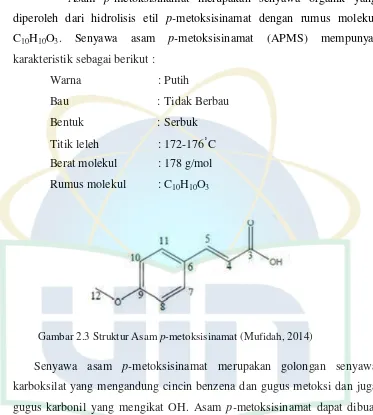
2.1.2. Senyawa Asam p-metoksisinamat
Asam p-metoksisinamat merupakan senyawa organik yang diperoleh dari hidrolisis etil p-metoksisinamat dengan rumus molekul C10H10O3. Senyawa asam p-metoksisinamat (APMS) mempunyai
karakteristik sebagai berikut :
Warna : Putih
[image:22.596.136.509.115.530.2]Bau : Tidak Berbau Bentuk : Serbuk Titik leleh : 172-176˚C Berat molekul : 178 g/mol Rumus molekul : C10H10O3
Gambar 2.3 Struktur Asam p-metoksisinamat (Mufidah, 2014)
2.1.3. Urea
Gambar 2.4 Struktur Urea
( Pubchem, n.d)
Karakteristik urea sebagai berikut : Warna : Putih
Bau : Tidak Berbau Bentuk : Serbuk
Titik leleh : 132.7˚C-135°C Berat molekul : 60.05526 g/mol Rumus molekul : CON2H4
(sumber: pubchem, n.d)
Urea adalah senyawa organik yang tersusun dari unsur karbon, hidrogen, oksigen dan nitrogen dengan rumus kimia CON2H4 atau
(NH2)2CO. Urea juga dikenal dengan nama carbamide yang terutama
2.1.4. Imidazol
Gambar 2.5. Struktur Imidazol ( Sumber : pubchem,n.d )
Karakteristik imidazol sebagai berikut : Warna : Putih Bau : Bau khas Bentuk : Serbuk Titik leleh : 89˚С
Berat molekul : 68.07726 g/mol Rumus molekul : C3H4N2
(sumber: pubchem, n.d.)
Imidazol adalah senyawa organik dengan rumus C3H4N2, yaitu sebuah
aromtik heterosiklik yang diklsifikasikan sebagai diazole atau alkaloid. Imidazol dapat digunakan sebagai katalis dalam pembuatan amida primer karena mempunyai titik leleh yang rendah dan waktu iradiasi yang singkat.
Gambar 2.6 Skema Reaksi Amidasi Urea dengan Katalis Imidazol
( Sumber : Khalafi-Nezhad, 2003 )
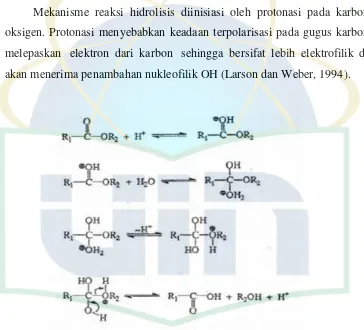
2.2. Hidrolisis Etil P-Metoksisinamat
Gambar 2.7 Mekanisme Reaksi Hidrolisis Etil p-metoksisinamat (Mufidah,
2014)
Mekanisme reaksi hidrolisis diinisiasi oleh protonasi pada karbonil oksigen. Protonasi menyebabkan keadaan terpolarisasi pada gugus karbonil melepaskan elektron dari karbon sehingga bersifat lebih elektrofilik dan akan menerima penambahan nukleofilik OH (Larson dan Weber, 1994).
Gambar 2.8 Mekanisme Reaksi Hidrolisis pada Ester
( Sumber : Larson & Webber, 1994 )
[image:25.596.137.501.227.557.2]Gambar 2.9 Mekanisme Reaksi Hidrolisis Ester dengan Katalis Basa
(Larson and Weber, 1994).
2.3. Amida
Suatu amida ialah senyawa yang mempunyai nitrogen trivalen terikat pada suatu gugus karbonil. Suatu amida diberi nama asam karboksilat induknya, dengan mengubah imbuhan asam ...-oat (atau –at) menjadi amida.
Gambar 2.10 Struktur Amida
(Barus, 2009)
[image:26.596.226.396.562.700.2]Amida disintesis dari derivat asam karboksilat dan ammonia atau amina yang sesuai. Reaksi-reaksinya sebagai berikut :
Gambar 2.11 Sintesis Amida dari Derivat Karboksilat
Seperti asam karboksilat, amida memiliki titik cair dan titik didih yang tinggi karena adanya pembentukan ikatan hidrogen. Amida mampu membentuk ikatan hidrogen intermolekular selama masih terdapat hidrogen yang terikat pada nitrogen. Senyawa ini juga sangat istimewa karena nitrogennya mampu melepaskan elektron dan mampu membentuk suatu ikatan pi dengan karbon karbonil. Pelepasan elektron ini menstabilkan hibrida resonansi (Bresnick,1996).
2.3.1. Reaksi Pembuatan Amida
Pembuatan amida primer dapat dibuat dari karboksilat melalui transformasi sintetis organik. Secara umum pembentukan carboxamide dibuat dari asam karboksilat dengan cara mengaktivasi karbonil menggunakan gugus yang lebih reaktif seperti asil halida, anhidrida campuran, asil azida, ester aktif atau aktivasi dengan reagen kopling, yang paling umum digunakan adalah N, N-disikloheksilkarbodiimida (DCC) (Khalafi-Nezhad, 2003).
Pengunaan tekhnologi microwave dalam kimia organik telah di eksplor akhir dekade ini. Iradiasi menggunakan microwave menurunkan waktu reaksi, meningkatkan hasil, mudah dikerjakan, tidak merusak lingkungan dan dapat meningkatkan regio dan stereoselektivitas reaksi. Pembuatan amida primer secara langsung dapat dilakukan dengan mereaksikan asam karboksilat dan urea dengan adanya imidazol dibawah iradiasi microwave. Imidazol digunakan karena mempunyai titik leleh yang rendah sehingga waktu iradiasi singkat, serta dapat mencampurkan suatu reagen atau reaksi dalam keadaan kering.
primer dengan hasil yang baik dan bebas dari penggunaan pelarut (Khalafi-Nezhad, 2003).
Pengembangan modifikasi senyawa hasil amidasi telah banyak dikembangkan oleh para peneliti seperti modifikasi ibuprofen menjadi turunan amida menggunakan amina alifatik atau aromatik yang berbeda menghasilkan peningkatan aktivitas analgesik, gastroprotektif dan aktivitas inflamasi (Kumar, Manoj et al, 2010). Selain ibuprofen, modifikasi struktur senyawa antiinflamasi dengan penambahan gugus amina juga dilakukan pada indometasin dan asam meclofenamat, dimana turunan amida dari indometasin menghasilkan efek penghambatan selektif COX-2 dan menghilangkan efek samping pada gastrointestinal. Pengembangan senyawa tersebut bertujuan untuk mengurangi efek samping AINS terhadap gastrointesitinal dan meningkakan aktivitas antiinflamasi (Kalgutkar, Amit S. et al, 2000).
2.4 Identifikasi
2.4.1 Kromatografi
Kromatografi didefinisikan sebagai prosedur pemisahan zat terlarut oleh suatu proses migrasi deferensial dinamis dalam sistem yang terdiri dari dua fase atau lebih, salah satu di antaranya bergerak secara berkesinambungan dalam arah tertentu dan di dalamnya zat-zat itu menunjukkan perbedaan mobilitas disebabkan adanya perbedaan dalam adsorpsi, partisi, kelarutan, tekanan uap, ukuran molekul atau kerapatan muatan ion. Dengan demikian, masing-masing zat dapat di identifikasi atau ditetapkan dengan metode analitik (Departemen Kesehatan, 1995).
disebut eluen. Fase diam dapat bertindak sebagai zat penjerap, seperti halnya penjerap alumina yang diaktifkan, silika gel, dan resin penukar ion, atau dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam dan fase gerak. Dalam proses terakhir ini suatu lapisan cairan pada suatu penyangga yang inert berfungsi sebagai fase diam (Departemen Kesehatan,1995).
Jenis-jenis kromatografi yang bermanfaat dalam analisis kualitatif dan kuantitatif yang digunakan dalam penetapan kadar dan pengujian Farmakope Indonesia adalah kromatografi kolom, kromatografi gas, kromatografi kertas, kromatografi lapis tipis, dan kromatografi cair kinerja tinggi. Kromatografi kertas dan kromatografi lapis tipis umumnya lebih bermanfaat untuk tujuan identifikasi, karena mudah dan sederhana. Kromatografi kolom memberikan pilihan fase diam yang lebih luas dan berguna untuk pemisahan masing-masing senyawa secara kuantitatif dari suatu campuran. (Departemen Kesehatan,1995).
a. Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) adalah suatu metode pemisahan komponen menggunakan fasa diam berupa plat dengan lapisan bahan berupa adsorben inert. KLT sering digunakan untuk identifikasi awal karena sederhana dan juga murah. KLT dapat dipakai dengan dua tujuan. Pertama, dipakai selayaknya sebagai metode untuk mencapai hasil kualitatif, kuantitatif atau preparatif. Kedua, dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom atau kromatografi cair kinerja tinggi (Gritter et al, 1991).
yang disebabkan oleh komponen sekunder tidak mungkin terjadi, kebutuhan ruangan minimum, dan penanganannya sederhana (Stahl Egon dalam Khoirunni’mah, 2013).
Gambar 2.12 Skema Kromatografi Lapis Tipis
( Sumber : Mufidah, 2014 )
b. Kromatografi Kolom
Alat-alat yang diperlukan untuk kromatografi kolom sangat sederhana, terdiri dari tabung kromatografi dan sebuah batang pemampat yang diperlukan untuk memadatkan wol kaca atau kapas pada dasar tabung jika diperlukan, serta untuk memadatkan zat penjerap atau campuran zat penjerap dan air secara merata di dalam tabung. Kadang-kadang digunakan cakram kaca berpori yang melekat pada dasar tabung untuk menyangga isinya. Tabung berbentuk silinder dan terbuat dari kaca, kecuali bila dalam monografi, disebutkan terbuat dari bahan lain. Sebuah tabung mengalir dengan diameter yang lebih kecil untuk mengeluarkan cairan yang menyatu dengan tabung atau disambung melalui suatu sambungan anti bocor pada ujung bawah tabung utama (Departemen kesehatan, 1995).
dilengkapi dengan sebuah kran untuk mengatur laju aliran pelarut yang melalui kolom dengan teliti. Batang pemampat merupakan suatu batang silinder, melekat kuat pada sebuah tangkai yang terbuat dari plastik, kaca, baja tahan karat, atau aluminium, kecuali bila dinyatakan lain dalam monografi. Tangkai batang pemampat biasanya mempunyai diameter yang lebih kecil dari kolom dan panjang minimal 5 cm melebihi panjang efektif kolom, batang mempunyai diameter lebih kurang 1 mm lebih kecil dari diameter dalam kolom (Departemen kesehatan, 1995).
Zat penjerap atau fase diam (bisa berupa aluminium oksida yang telah diaktifkan, silika gel, tanah diatome terkalsinasi, atau tanah silika yang dimurnikan untuk kromatografi) dalam keadaan kering atau dalam campuran dengan air, dimampatkan ke dalam tabung kromatografi kaca atau kuarsa. Zat uji yang dilarutkan dalam sejumlah kecil pelarut, dituangkan ke dalam kolom dan dibiarkan mengalir ke dalam zat penjerap. Zat berkhasiat diadsorpsi dari larutan secara kuantitatif oleh bahan penjerap berupa pita sempit pada permukaan atas kolom. Dengan penambahan pelarut lebih lanjut melalui kolom, oleh gaya gravitasi atau dengan memberikan tekanan, masing-masing zat bergerak turun dalam kolom dengan kecepatan tertentu, sehingga terjadi pemisahan dan diperoleh kromatogram (Departemen Kesehatan,1995).
2.4.2 Spektrofotometri
analisis farmasi meliputi spektrofotometri serapan ultraviolet, cahaya tampak, inframerah dan serapan atom (Departemen Kesehatan,1995).
1. Spektrofotometri IR
Spektroskopi IR adalah studi mengenai interaksi antara energi cahaya dan materi, dimana energi yang dipancarkan berasal dari radiasi inframerah dengan panjang gelombang yang lebih panjang dari cahaya tampak, tetapi lebih pendek dari radiasi gelombang mikro. Spektrofotometri IR adalah salah satu teknik analisis yang penting karena dapat mempelajari berbagai jenis sampel, baik identifikasi senyawa organik maupun anorganik (Hendayana, 1994).
Spektrofotometri infra merah merupakan alat untuk merekam spektrum di daerah inframerah yang terdiri dari suatu sistem optik dengan kemampuan menghasilkan cahaya monokromatik di daerah 4000 cm-1
hingga 625 cm-1
(lebih kurang 2,5 πm hingga 16 πm) dan suatu metode untuk mengukur perbandingan intensitas perbandingan cahaya yang ditransmisikan cahaya datang. Spektrum IR digunakan untuk mengidentifikasi gugus fungsi (Departemen Kesehatan, 1995).
2. Spektrofotometri UV-VIS
Spektrofotometri UV-Vis merupakan salah satu teknik analisis spektroskopi yang memakai sumber radiasi eleltromagnetik ultraviolet dekat (190-380 nm) dan sinar tampak (380-780 nm) dengan memakai instrumen spektrofotometer. Spektrofotometri UV-Vis melibatkan energi elektronik yang cukup besar pada molekul yang dianalisis, sehingga spektrofotometri UV- Vis lebih banyak dipakai untuk analisis kuantitatif ketimbang kualitatif (Mulja dan Suharman, 1995: 26).
panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditranmisikan atau yang diabsorpsi. Spektrofotometer tersusun atas sumber spektrum yang kontinyu, monokromator, sel pengabsorpsi untuk larutan sampel atau blangko dan suatu alat untuk mengukur pebedaan absorpsi antara sampel dan blangko ataupun pembanding (Khopkar, 1990: 216).
Spektrofotometer UV-Vis dapat melakukan penentuan terhadap sampel yang berupa larutan, gas, atau uap (Mulja dan Suharman, 1995: 28).
Pengukuran dengan alat spektrofotometer UV-Vis didasarkan pada hubungan antara berkas radiasi elektromagnetik yang ditransmisikan (diteruskan) atau yang diabsorbsi dengan tebalnya cuplikan dengan konsentrasi dari komponen penyerap. Hubungan tersebut dinyatakan dalam Hukum Lambert-Beer (Sastroamidjojo, 1985) :
A = a . b . c Keterangan :
(a) Daya Serap ; (b) Tebal Kuvet ; (c) Konsentrasi larutan; (A) Serapan
Instrumentasi dari spektrofotometer UV-Vis ini dapat diuraikan sebagai berikut :
1) Suatu sumber energi cahaya yang berkesinambungan yang meliputi daerah spektrum yang mana alat tersebut dirancang untuk beroperasi.
2) Suatu monokromator, yakni sebuah piranti untuk memencilkan pita sempit panjang gelombang dari spektrum lebar yang dipancarkan oleh sumber cahaya.
3) Suatu wadah untuk sampel (dalam hal ini digunakan kuvet). 4) Suatu detektor, yang berupa transduser yang merubah energi
5) Suatu amplifier (pengganda) dan rangkaian yang merubah energi cahaya menjadi suatu isyarat listrik.
6) Suatu sistem baca dimana diperagakan besarnya isyarat listrik yang ditangkap. (Mufida, 2014)
3. Spektrofotometri Resonansi Magnetik
Nuclear Magnetic Resonance (NMR) digunakan untuk
menentukan struktur dari komponen alami dan sintetik yang baru, kemurnian dari komponen, dan arah reaksi kimia sebagaimana hubungan komponen dalam larutan yang dapat mengalami reaksi kimia. NMR dapat menentukan jumlah masing-masing jenis yang berbeda dari inti hidrogen serta memperoleh informasi mengenai sifat dasar dari lingkungan terdekat dari masing-masing jenis. Informasi yang sama dapat ditentukan untuk inti karbon. Kombinasi IR dan data NMR seringkali cukup untuk menentukan secara benar struktur molekul yang tidak diketahui (Pavia et al., 2008).
Instrumen NMR terdiri atas komponen-komponen sebagai berikut (Willard et al., 1988) :
a) Magnet untuk memisahkan energi spin nuklir.
b) Paling tidak terdapat dua saluran frekuensi radio, satu untuk stabilisasi medan/frekuensi dan satu untuk memberikan frekuensi radio untuk energi penyinaran. Yang ketiga dapat digunakan untuk masing-masing inti yang akan dipisahkan. c) Probe sampel yang mengandung kumparan untuk kopling
sampel dengan bidang frekuensi radio. d) Detektor untuk memproses sinyal NMR.
e) Generator (sweep generator) untuk menyapu bersih baik medan magnet maupun frekuensi radio melalui frekuensi resonansi sampel.
2.5 Inflamasi
2.5.1 Pengertian Inflamasi
Inflamasi merupakan reaksi lokal pada jaringan vaskular terhadap cedera yang ditandai dengan gejala seperti rubor (kemerahan), kalor (panas), dolor (nyeri), dan turgor (pembengkakan). Respon pertahanan tubuh terhadap invasi benda asing, kerusakan jaringan, atau keduanya disebut inflamasi. Penyebab inflamasi antara lain mikroorganisme, trauma mekanis, zat-zat kimia, dan pengaruh fisika. Apabila jaringan rusak seperti terbakar, teriris atau karena infeksi kuman, maka pada jaringan ini akan terjadi rangkaian reaksi yang memusnahkan agen yang membahayakan jaringan atau yang mencegah agen menyebar lebih luas. Reaksi-reaksi ini kemudian juga menyebabkan jaringan yang cedera diperbaiki atau diganti dengan jaringan baru. Rangkaian reaksi ini disebut inflamasi (Rukmono, 1973)
Tujuan akhir dari respon inflamasi adalah menarik protein plasma dan fagosit ke tempat yang mengalami cedera atau terinvasi agar keduanya dapat mengisolasi, menghancurkan, atau menginaktifkan agen yang masuk, membersihkan debris dan mempersiapkan jaringan untuk proses penyembuhan. Respon inflamasi dapat bersifat akut maupun kronik. Inflamasi akut terjadi segera setelah terjadi cedera, sedangkan inflamasi kronik merupakan inflamasi yang berlangsung lebih dari dua minggu dan dapat timbul setelah inflamasi akut, misalnya karena infeksi yang tidak sembuh (Corwin, 2008).
antiinflamasi sangat efektif menghilangkan rasa nyeri dan inflamasi dengan menekan produksi prostaglandin dan metabolisme asam arakidonat dengan cara penghambatan siklooksigenase. Penekanan prostaglandin sebagai mediator inflamasi pada jaringan menyebabkan kurangnya rasa nyeri dan pembengkakan sehingga fungsi otot dan sendi membaik (Setyarini, 2009).
2.5.2 Antiinflamasi Menghambat Denaturasi Protein
Inflamasi sering dikaitkan dengan rasa sakit dan melibatkan kejadian seperti peningkatan permeabilitas pembuluh darah, peningkatan denaturasi protein dan alterasi membran. Ciri-ciri jaringan yang telah rusak salah satu penyebabnya diakibatkan oleh adanya denaturasi protein (Umapathy et al, 2010).
Salah satu metode in vitro yang menggunakan prinsip denaturasi adalah uji BSA (Bovine Serum Albumin) (William et al., 2008). Denaturasi protein pada jaringan adalah salah satu penyebab penyakit inflamasi dan artritis. Produksi dari antigen-auto pada penyakit artritis dapat mengakibatkan denaturasi protein secara in vivo. Oleh karena itu, penggunaan suatu agen tertentu yang bisa mencegah denaturasi protein akan bermanfaat pada pengembangan obat antiinflamasi (Chatterjee et al., 2012).
Beberapa metode in vitro lain dapat digunakan dalam mengetahui potensi atau aktivitas antiinflamasi dari suatu obat, kandungan kimia dan preparat herbal. Teknik-teknik yang bisa digunakan antara lain adalah pelepasan fosforilasi oksidatif (ATP biogenesis terkait dengan respirasi), stabilisasi membran eritrosit, stabilisasi membran lisosomal, tes fibrinolitik dan agregasi trombosit (Oyedapo et al., 2010). Uji antiinflamasi juga bisa dilakukan dengan melihat efek inhibisi pada siklooksigenase menggunakan kit khusus uji skrining siklooksigenase (Umar et al., 2012).
dipanaskan pada pH patologis yakni 6,2-6,5. Pada uji BSA, jika senyawa sampel menghambat denaturasi dengan persen inhibisi >20% maka dianggap memiliki aktivitas antiinflamasi dan layak untuk dikembangkan lebih lanjut. (Williams et al., 2008).
2.6 Iradiasi Microwave
Microwave adalah gelombang elektromagnetik yang memiliki
panjang gelombang antara 1 milimeter (mm) sampai 1 meter (m) dan frekuensi 0,3-300 GHz. Biasanya pemanfaatan gelombang elektromagnetik digunakan untuk telekomunikasi celluler phone, radar, GPS, telekomunikasi televisi dll. Namun microwave dapat dimanfaatkan sebagai alat pemanas karena teridiri dari dua bagian utama yaitu bagian listrik dan bagian magnetik yang menjadi sumber panas (Yeman, 2002).
Energi dalam bentuk gelombang mikro (microwave) mempunyai peran yang besar dalam proses radiasi suatu zat dimana energi tersebut dapat berpindah kedalam zat yang mengalami iradiasi. Penyerapan energi terjadi ketia molekul (+) dan molekul (-) suatu zat saling berdekatan dengan medan listrik menyebabkan zat tersebut mengalami pemanasan. Pada dasarnya kemampuan suatu zat untuk mengabsorbsi energi tergantung dari dua hal. Pertama efesiensi zat tersebut untuk menyerap energi mikro dan yang kedua adalah tergantung dari efisiensi energi tersebut menjadi panas. Jika sampel mengandung zat polar atau ionik cukup secara efisien menyerap energi gelombang mikro dan menghasilkan panas akan tetapi jika sampel memiliki sifat dielektrik rendah dibutuhkan penambahan senyawa polar atau ionik untuk menghasilkan panas (Deepak et al,.2013).
Sedangkan prinsip dari mekanisme konduksi terjadi pada larutan- larutan yang mengandung ion. Bila suatu larutan yang mengandung partikel bermuatan atau ion diberikatan suatu medan listrik maka ion- ion tersebut akan bergerak. Pergerakan tersebut akan mengakibatkan peningkatan kecepatan terjadinya tumbukan sehingga akan mengubah energi kinetik menjadi energi kalor ( Yeman, 2002).
BAB 3
METODE PENELITIAN 3.1 Tempat Dan Waktu Penelitian
3.1.1 Tempat
Penelitian ini dilaksanakan di Laboratorium Penelitian 1, Laboratorium Penelitian II, Laboratorium Farmakognosi dan Fitokimia dan Laboratorium Analisis Obat dan Pangan Halal Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3.1.2 Waktu
Penelitian ini dimulai pada bulan Februari 2015 sampai Mei 2015
3.2 Alat dan Bahan 3.2.1 Alat
Spektrofotometri ¹H-NMR dan 13C-NMR (500 MHz, JEOL), spektrofotometer UV-Vis (Hitachi), vacuum rotary evaporator (SB- 1000 Eyela), microwave oven ( Samsung, 250 watt, 50 Hz), digital
water bath (SB-100 Eyela), spektrofotometri IR (Shimadzu), GCMS
(Agilent Technologies), alat-alat gelas, hot plate, magnetic stirer, lemari pendingin, Plat aluminium TLC silica gel 60 F254 (Merck),
shacking bath, timbangan analitik, penangas, statif, termometer, pipet
eppendorf, mikropipet, pinset, pengaduk magnetik, kertas saring, kapas, alumunium foil, pH indikator, alu dan mortar.
3.2.2 Bahan
Senyawa etil p-metoksisinamat yang merupakan hasil isolasi dari kencur (Kaempferia galanga L.) didapatkan dari peneliti sebelumnya Mufidah (2014), senyawa asam p-metoksisinamat yang merupakan hasil hidrolisis dari senyawa etil p-metoksisinamat, natrium diklofenak (Sigma-Aldrich), urea Analytical Reagent (Merck), imidazol (Merck), silika gel 60 (Merck), dan Bovine Serum Albumin (Sigma-Aldrich).
Pelarut dan bahan pembantu lain : aquades, etil asesitat, n-heksan, methanol, etanol 95%, HCl 15% dan tris base (Sigma-Aldrich).
3.3 Prosedur Penelitian 3.3.1 Modifikasi Struktur
a. Hidrolisis Etil p-metoksisinamat
Sebanyak 1.500 mg NaOH dilarutkan dengan etanol pro analisis secukupnya dalam gelas kimia, kemudian dipanaskan diatas hot plate
sambil diaduk menggunakan magnetic stirer hingga larut. Setelah itu ditambahkan senyawa etil p-metoksisinamat sebanyak 5.000 mg ke dalamnya, pemanasan dijaga pada suhu 55˚С sampai 60˚C . Hasil reaksi
ditambahkan aquades dan HCl 15% secukupnya sehingga terbentuk endapan putih, kemudian difiltrasi menggunakan corong yang dilapisi kertas saring, filtrat yang didapat ditambahkan kembali HCl 15%. (Apabila masih terdapat endapan putih, filtrat kemudian disaring. Prosedur ini dilakukan berulang kali hingga tidak ada lagi endapan putih yang terbentuk). Residu yang dihasilkan merupakan senyawa hasil hidrolisis, kemudian dikeringkan.
b. Amidasi asam p-metoksisinamat
Sebanyak 1,602 gram (9 mmol) senyawa asam p-metoksisinamat, 2,16 gram (36 mmol) urea dan 0,612 gram (9 mmol) imidazol digerus dalam lumpang sampai tercampur. Kemudian dilakukan iradiasi menggunakan microwave dengan daya 300 W selama 15 menit dalam erlenmeyer tertutup. Kemurnian senyawa hasil reaksi kemudian dicek spotnya menggunakan KLT dengan eluen n-heksan : etil asetat perbandingan 2:3 serta dihitung nilai Rf dari senyawa tersebut kemudian dibandingkan dengan senyawa standar asam p-
metoksisinamat dan etil p-metoksisinamat. Jika masih terdapat spot asam p-metoksisinamat dan etil p-metoksisinamat maka dilakukan fraksinasi dengan kromatografi kolom (Khalafi-Nezhad, 2003).
fase diam. Sedangkan fase gerak yang digunakan menggunakan sistem fase gerak dengan polaritas bertingkat. Senyawa hasil reaksi amidasi dimasukan ke dalam kolom yang mempunyai diameter 2 cm serta panjang 30 cm, selanjutnya dialiri n-heksana (100 ml) terlebih dahulu. Kemudian polaritas fase gerak ditingkatkan menggunakan pelarut n- heksana dan etil asetat sebanyak 100 ml dengan perbandingan 9:1, 8:2, 7:3, 6:4, 5:5, 4:6 dan 3:7 fraksi yang didapatkan ditampung dalam vial. Fraksi tersebut di identifikasi melalui KLT menggunakan plat TLC
Silica gel 60 F254 (E-merck) dengan eluen n-heksana : etil asetat
perbandingan 2:3 kemudian nilai Rf nya dibandingkan dengan nilai Rf asam p-metoksisinamat dan etil p-metoksisiinamat sebagai standar.
c. Identifikasi Senyawa
a) Organoleptis
Senyawa hidrolisis etil p-metoksisinamat dan senyawa hasil amidasi kemudian diidentifikasi warna, bentuk dan juga bau.
b) Identifikasi Senyawa Menggunakan ¹H-NMR dan 13C-NMR
Senyawa hasil amidasi (kira-kira 10 mg), dilarutkan dalam pelarut kloroform bebas proton (DMSO), setelah dilarutkan kemudian dimasukkan ke dalam tabung mikro NMR untuk kemudian dianalisis.
c) Identifikasi senyawa menggunakan FTIR
Sampel (senyawa hasil amidasi) kira-kira 1 - 2 mg diaduk dengan bubuk KBr murni (kira-kira 200 mg) hingga rata. Kemudian sampel yang telah diaduk tadi ditempatkan dalam tempat sampel pada alat spektroskopi inframerah untuk dianalisis.
d) Identifikasi Senyawa Menggunakan GCMS
larut, dimasukan dalam botol kecil kemudian ditempatkan pada alat GCMS. Kolom GCMS yang digunakan adalah HP-5MS (30 m × 0,25 mm ID × 0,25 µ m); suhu awal 70˚C selama 2 menit, dinaikkan ke suhu 2850C dengan kecepatan 20˚C/min selama 20
menit. Suhu MSD 2850C. Kecepatan aliran 1,2 mL/min dengan split 1:100. Parameter scanning dilakukan dari massa paling rendah yakni 35 sampai paling tinggi 550 (Umar et al, 2012).
e) Identifikasi Titik Leleh
Sampel dimasukan kedalam pipa kapiler (1/4 pipa kapiler) kemudian dianalisis menggunakan alat melting point sampai sampel tersebut meleleh.
3.3.2 Uji Aktivitas Antiinflamasi Secara In Vitro
a. Pembuatan reagen untuk uji Antiinflamasi
1) Larutan TBS (Tris Buffer Saline) pH 6.3
Sebanyak 8,7 g natrium klorida dan 1,21 g Tris base dilarutkan dalam 100 mL. Selanjutnya pH diatur dengan penambahan asam asetat glasial sampai pH 6,3 menggunakan (Mohan, 2003).
2) Penyiapan variat konsentrasi Na Diklofenak
Pembuatan larutan induk sebesar 10000 ppm Na dikolfenak yaitu dengan melarutkan 50 mg Na diklofenak dalam 5 ml metanol. Kemudian dilakukan pengenceran menjadi 1000, 100, 10 dan 1 ppm.
100
4) Pembuatan BSA 0,2 % (w/v)Sebanyak 0.2 g (Bovin Serum Albumin) BSA dilarutkan dalam TBS 100 mL. (Williams et al., 2008).
b. Uji in Vitro Antiinflamasi (Williams et al., 2008)
Pengujian aktivitas antiinflamasi dari senyawa hasil modifikasi terhadap denaturasi BSA :
a. Pembuatan Larutan Kontrol Negatif
Larutan kontrol negatif (5 mL) terdiri dari 50 µ L metanol yang kemudian ditambah dengan BSA hingga volume 5 mL.
b. Pembuatan Larutan Uji
Larutan uji (5 mL) terdiri dari 50 µ L larutan sampel yang kemudian ditambah dengan BSA hingga volume 5 mL sehingga didapatkan variat konsentrasi menjadi 100, 10, 1 dan 0.1 ppm. c. Pembuatan Larutan Kontrol Positif
Larutan kontrol positif (5 mL) terdiri dari 50 µ L larutan natrium diklofenak yang kemudian ditambah dengan BSA hingga volume 5 mL sehingga didapatkan variat konsentrasi menjadi 100, 10, 1 dan 0.1 ppm.
Setiap larutan di atas dipanaskan dalam water bath selama 5 menit pada suhu 73˚C. Setelah selesai larutan tersebut diangkat dari water bath, kemudian didinginkan selama 25 menit dan diukur absorbannya dengan spektrofotometer UV (Hitachi) pada panjang gelombang 660 nm. Persentase inhibisi dari denaturasi BSA dikalkulasikan dengan rumus berikut :
% inhbisi =
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hidrolisis Etil p-metoksisinamat Menjadi Asam p-metoksisinamat
Sebanyak 5 g etil p-metoksisinamat dilarutkan dengan etanol pro analisis dalam gelas kimia yang sebelumnya telah ditambahkan 1,5 g NaOH. Penggunaan NaOH sebagai katalis basa akan menghasilkan reaksi
irreversible sehingga hasil reaksi menjadi sempurna serta produk yang
dihasilkan lebih mudah dipisahkan. Kemudian dipanaskan diatas hot plate
pada suhu 55-60°C selama 3 jam disertai pengadukan. Karena etanol mendidih pada suhu 78,37°C sehingga dalam reaksi ini digunakan suhu 55-60°C, apabila digunakan suhu lebih rendah reaksi berjalan lambat. Setelah itu, hasil reaksi ditambahkan aquades secukupnya kemudian di filtrasi menggunakan corong pisah yang dilapisi kertas saring, filtrat yang didapat ditambahkan HCl 15% hingga tidak ada endapan putih yang terbentuk atau pH filtrat mencapai 4. Residu yang didapatkan berupa senyawa hasil reaksi hidrolisis kemudian dikeringanginkan. Setelah didapatkan hasil reaksi, dilakukan pengecekan terhadap nilai Rf menggunakan KLT serta dibandingkan dengan nilai Rf senyawa EPMS menggunakan eluen etil asetat dan n-heksana perbandingan 3:2. Gambar KLT hasil reaksi hidrolisis dapat dilihat pada gambar 4.1.
A B
Gambar 4.1 KLT Hasil Reaksi Hidrolisis dengan eluen etil asetat dan n- heksana perbandingan 3:2 (Visualisasi Uv ƛ245 nm)
Keterangan : A = Senyawa Hasil Hidrolisis
B =Senyawa Etil p-metoksisinamamida
Reaksi hidrolisis dilakukan dengan NaOH sebagai katalis basa dan etanol p.a sebagai pelarut. Mekanisme reaksi hidrolisis diinisiasi oleh protonasi pada karbonil oksigen. Protonasi menyebabkan keadaan terpolarisasi pada gugus karbonil melepaskan elektron dari karbon sehingga bersifat lebih elektrofilik dan akan menerima penambahan nukleofilik OH (Larson dan Weber, 1994).
Pengecekan hasil reaksi dengan KLT dilakukan untuk melihat jumlah spot dari hasil reaksi hidrolisis serta untuk mengidentifikasi ada tidaknya spot etil p-metoksisianamat dalam senyawa tersebut, apabila spot EPMS sudah tidak ada maka reaksi dinyatakan sempurna. Setelah reaksi selesai, dilakukan filtrasi dan pencucian dengan aquades menggunakan corong yang dilapisi kertas saring. Filtrat yang diperoleh ditambahkan HCl 15% untuk mengikat Na+ sehingga terbentuklah endapan putih berupa hasil hidrolisis sampai pH 4 atau tidak lagi terbentuk endapan.
[image:46.596.140.539.200.720.2]Residu yang didapat kembali dicuci dengan aquades untuk menghilangkan garam yang terbentuk kemudian residu dikeringanginkan. Residu yang didapatkan berwarna putih serta tidak berbau. Mekanisme reaksi hidrolisis etil p-metoksisinamat dapat dilihat pada gambar 4.2.
rsa maan b
Reaksi hidrolisis ini bertujuan untuk mengganti gugus ester etil p- metoksisinamat dengan gugus asam sehingga dihasilkan senyawa asam
p-metoksisinamat dengan rendemen sebesar 82,34%. Rendemen dihitung dengan menggunakan pe erikut :
% rendemen hidrolisis = , x 100 % = 82,34 %
[image:47.596.143.510.198.579.2]Senyawa hasil reaksi hidrolisis kemudian dibandingkan dengan dengan senyawa asam p-metoksisinamat standar dari Mufidah (2014). Lihat gambar 4.3.
A B
Gambar 4.3. KLT Hasil Hidrolisis dan APMS Standar dengan eluen etil asetat
dan n-heksan perbandingan 3:2 (Visualisasi Uv ƛ245 nm)
Keterangan : A = Asam p-metoksisinamat Standar
B = Hasil Hidrolisis
Nilai Rf yang didapat sebagai berikut :
Rf asam p-metoksisinamat standar : 0,575 Rf asam p-metoksisinamat hasil reaksi : 0,575
Hasil reaksi hidrolisis yang dihasilkan memiliki karakteristik sebagai berikut :
Warna : Putih
Gambar 4.4. Senyawa Hasil Hidrolisis
Gambar 4.6. Spektrum GCMS Senyawa Hasil Hidrolisis
Gambar 4.7. Pola Fragmentasi GCMS Senyawa Hasil Hidrolisis
Dari data titik leleh, nilai Rf serta analisis menggunakan GCMS, hasil hidrolisis yang diperoleh menunjukan kesamaan seperti yang dilakukan oleh Mufidah (2014). Sehingga diambil kesimpulan bahwa senyawa hasil hidrolisis etil p-metoksisinamat adalah asam p- metoksisinamat.
4.2. Modifikasi Struktur Asam p-metoksisinamat dengan Reaksi Amidasi
Reaksi amidasi asam p-metoksisinamat dilakukan dengan mereaksikan urea serta imidazole dalam microwave unmodified dengan daya 300 W selama 15 menit. Reaksi amidasi merupakan reaksi lambat apabila dilakukan pada suhu rendah, karena –NH2 merupakan gugus pergi (leaving
group) dengan tingkat kereaktifan lebih rendah dibanding gugus lain
seperti –OR, -OC=R dan X- sehingga membutuhkan pemanasan. Metode pemanasan yang telah dieskplor akhir dekade ini dalam kimia organik adalah iradiasi microwave karena memiliki banyak keunggulan, seperti waktu reaksi lebih cepat, produk lebih bersih, selektivitas lebih tinggi, dan hasil yang lebih baik. Hal ini menjadi alternatif utama untuk memperoleh hasil sintesis dari berbagai senyawa organik yang lebih efisien, dengan operasional yang sederhana dan kondisi reaksi yang ringan (Khalafi- Nezhad, 2003).
Amidasi asam p-metoksisinamat dengan urea ini diawali dengan pembebasan amonia (NH3) dari urea oleh imidazole membentuk garam
ammonium karboksilat kemudian dengan pemanasan menghasilkan
[image:51.596.134.517.127.606.2]carboxamide. Reaksinya sebagai berikut :
Gambar 4.9. Mekanisme Reaksi Amidasi Asam p-metoksisinamat dengan Urea
(Khalafi-Nezhad, 2003).
1 2 3
Gambar 4.10. KLT Senyawa Hasil Reaksi Amidasi (Visualisasi Uv ƛ245 nm)
Keterangan : (1) Etil pmetoksisinamat (2) Asam p-metoksisinamat (3) Senyawa
Hasil Amidasi
Dari hasil KLT terlihat ada dua spot yaitu spot senyawa hasil reaksi dan senyawa induk asam p-metoksisinamat. Hasil reaksi selanjutnya dimurnikan menggunakan kromatografi kolom dengan eluen etil asetat dan n-heksan perbandingan 7:3. Kemudian dilakukan pengecekan kembali menggunakan KLT dengan eluen etil asetat dan n-heksan perbandingan 3:2
1 2 3
Gambar 4.11. Hasil Pemisahan Senyawa Amidasi Menggunakan Kromatografi
Kolom (visualisasi UV ƛ 245 nm)
Keterangan : : (1) Etil p-metoksisinamat (2) Asam p-metoksisinamat (3) Senyawa
kan persa maa
10
Dengan pemisahan menggunakan kromatografi kolom didapatkan satu spot senyawa hasil amidasi dengan rendemen sebesar 20,92%. Rendemen dihitung dengan mengguna n berikut :
% inhbisi = , 0
=
20,92%4.2.1. Identifikasi Senyawa Hasil Modifikasi
Identifikasi senyawa hasil modifikasi dilakukan dengan penentuan nilai Rf, uji organoleptik, pengukuran titik leleh serta elusidasi struktur menggunakan IR, GCMS, 1H-NMR dan 13C-NMR.
Identifikasi nilai Rf hasil reaksi amidasi dibandingkan dengan senyawa etil p-metoksisinamat dan asam p-metoksisinamat menggunakan eluen etil asetat dan n-heksan perbandingan 3:2 (Lihat gambar 4.11).
Nilai Rf yang didapatkan adalah sebagai berikut : Rf etil p-metoksisinamat : 0,825
Rf asam p-metoksisinamat : 0,575 Rf Senyawa Hasil Amidasi: 0,225
[image:53.596.132.519.227.572.2]Berdasarkan nilai Rf, dapat diketahui kepolaran dari senyawa modifikasi. Etil p-metoksisinamat memiliki nilai Rf tertinggi 0,825 ini menunjukan bahwa senyawa tersebut memiliki polaritas yang rendah. Senyawa hasil hidrolisis etil p-metoksisinamat yaitu asam p- metoksisinamat memiliki nilai Rf 0,575 lebih polar dibandingkan dengan etil p-metoksisinamat karena ada pengurangan atom karbon pada gugus ester. Kemudian senyawa hasil reaksi amidasi memiliki nilai Rf 0,225 menunjukan bahwa pergantian gugus OH pada asam p-metoksisinamat dengan NH2 dapat meningkatkan polaritas, seperti yang terlihat pada
A B C
Gambar 4.12. KLT Senyawa APMS, EPMS dan Senyawa Hasil Amidasi
Keterangan : A = Asam p-metoksisinamat
B = Etil p-metoksisinamat
C = Senyawa Hasil Reaksi Amidasi
Selanjutnya hasil reaksi amidasi di identifikasi dengan melakukan identifikasi melting point serta uji organoleptik untuk melihat karakteristik dari senyawa tersebut, sehingga didapatkan karakteristik senyawa sebagai berikut :
[image:54.596.135.504.58.651.2]Warna : Putih kekuningan Bau : Tidak berbau Bentuk : Serbuk Titik leleh : 194°C-197°C
Gambar 4.13. Senyawa Hasil Amidasi
3 4 5 8 .5 2 3361.11 3 1 8 3 .6 5 1 7 3 3 .1 2 1 6 7 5 .2 5 1 5 9 8 .0 9 1 5 1 3 .2 2 1 3 8 6 .8 8 1 3 0 4 .9 0 1 2 5 3 .7 8 1 1 7 7 .5 9 1 1 1 2 .9 7 1 0 2 3 .2 8 9 4 0 .3 4 8 2 6 .5 3 7 6 8 .6 7 6 8 9 .5 8 6 1 0 .5 0 5 2 5 .6 2 4 7 8 .3 7 105 %T 90 75 60 45 30
4000 3500 3000 2500 2000 1750 1500 1250 1000 750 500
[image:55.596.138.546.87.681.2]amidasi-urea 1/cm
Gambar 4.14. Spektrum FTIR Senyawa Hasil Amidasi
Gambar 4.15. Spektrum FTIR Senyawa EPMS (Mufidah, 2014)
Pada senyawa hasil amidasi, senyawa etil p-metoksisinamat dan senyawa asam p-metoksisinamat ditemukan pita serapan C-H aromatik pada masing-masing bilangan gelombang v 3183,65cm-1, v 3007,15 cm-1 dan v 2974,36 cm-1. Sedangkan gugus aromatik para ditemukan pada bilangan gelombang v 826,53 cm-1, v 829,43 cm-1 dan v 825,57 cm-1 yang menunjukan bahwa ketiga senyawa tersebut mempunyai gugus aromatik para.
Hal yang membedakan dari ketiga senyawa tersebut adalah bahwa pada senyawa hasil amidasi ditemukannya pita serapan C=O (amida) pada bilangan gelombang v 1675,52 cm-1, pita serapan C-N pada bilangan gelombang v 1253,78 cm-1 dan pita serapan dari gugus NH2 pada
bilangan gelombang 3361,11-3458,52 cm-1. Sedangkan pada senyawa etil
p-metoksisinamat dan asam p-metoksisinamat ditemukan pita serapan C-O (ester dan alkohol) pada masing-masing bilangan gelombang v 1367,59
cm-1 dan v 1316,47 cm-1. Pada senyawa asam p-metoksisinamat
[image:56.596.136.526.214.718.2]ditemukan pita serapan OH (bond) pada bilangan gelombang v 2500-3000 cm-1 sedangkan pada senyawa etil p-metoksinamat tidak ditemukan pita serapan tersebut.
Tabel 4.1 Daftar daerah spektrum IR Senyawa Hasil Amidasi, APMS dan
EPMS
Ikatan
Daerah Absorbansi (v, cm-1) Senyawa Amidasi APMS
(Mufidah, 2014)
EPMS
(Mufidah, 2014)
Aromatik Para 826,53 825,57 829,43
C=O 1675,52 1704,18 1690,68-1679,11
C-H 3183,65 2974,36 3007,15
NH2 3361,11 & 3458,52 -
-C-N 1253,78
C-O (alkohol,ester) - 1316,47 1367,59
Gambar 4.18. Spektrum GCMS Senyawa Hasil Amidasi
Gambar 4.21. Spektrum 13C-NMR Senyawa Hasil Amidasi
Analisa terakhir yang dilakukan adalah dengan 1H-NMR dan 13C-NMR
dimana interpretasinya berupa pergeseran kimia (δ) dalam satuan ppm
spektrum IH-NMR memberikan sinyal pada pergeseran kimia 3,83 ppm (3H) dan muncul berbentuk singlet. Sinyal ini lebih ke arah downfield
karena berikatan dengan oksigen (-OCH3). Kemudian pada pergeseran
kimia 5,54 ppm ditemukan sinyal berbentuk singlet yang merupakan proton dari amida (NH2). Ditemukan juga sinyal pada pergeseran kimia
[image:62.596.137.543.192.684.2]6,33 ppm (1H) berbentuk doublet memiliki hubungan puncak dengan pergeseran kimia 7,62 (1H) berbentuk doublet karena kedua puncak ini memiliki nilai konstanta kopling yang sama yaitu 15,55 Hz. Hal ini menunjukan bahwa bentuk tersebut berupa olefin dengan proton terkonfigurasi trans. Pada pergeseran kimia 6,92 ppm – 7,47 ppm (4H) merupakan proton-proton dari benzen dengan dua subtitusi. Pola sinyal ini menunjukan bahwa 2 proton yang sama terkopling secara ortho dengan 2 proton yang ekivalen lainnya, yang menunjukan bahwa sinyal ini adalah sinyak dari H 6/10 dan 7/9, untuk lebih jelasnya lihat tabel 4.2 dengan panduan gambar 4.18
Tabel 4.2 Data Pergeseran Kimia (δ) spektrum 1
H-NMR senyawa hasil
amidasi (CDCl3, 500 MHz)
Posisi Pergeseran Kimia (δ, ppm)
Asam p-metoksisinamat (Mufidah,2014)
Senyawa Hasil Amidasi
1 - 5,54 (s, 2H)
3 7,63 (d, 1H, J= 16,2) 6,33 (d, 1H, J=15,5) 4 6,34 (d, 1H, J= 16,2) 7,62 (d, 1H, J= 15,55) 6 6,95 (d, 1H, J= 9,1) 6,92 (d, IH, J=6,5) 7 7,47 (d, 1H, J= 9,1) 7,47 ( d, 1H, J= 9,1) 9 7,54 (d, 1H, J= 9,1) 7,47 (d, 1H, J=9,1) 10 6,95 (d, 1H, J= 9,1) 6,92 (d, 1H, J=6,5)
Tabel 4.3. Data Pergeseran Kimia (δ) spektrum 13
C-NMR senyawa hasil amidasi (CDCl3, 500 MHz)
Posisi Pergeseran Kimia (δ, ppm)
Etil p-metoksisinamat (Mufidah, 2014)
Senyawa Hasil Amidasi
1 60,77 dan 14,60 -
2 167,55 168,23
3 116,28 117,05
4 144,13 142,46
5 127,65 127,52
6 130,19 129,74
7 114,77 114,90
8 161,29 161,32
9 114,77 114,90
10 130,19 129,74
11 55,89 55,55
[image:63.596.135.524.127.515.2]Dari data IR, GCMS, 1H-NMR dan 13C-NMR dapat disimpulkan bahwa senyawa yang terbentuk dari reaksi amidasi asam p-metoksisinamat dengan urea adalah senyawa para metoksisinamamida (C10H11NO2)
4.3. Pengujian Aktivitas Antiinflamasi dan Hubungan Struktur Aktivitas Senyawa Hasil Modifikasi
Inflamasi sering dikaitkan dengan rasa sakit dan melibatkan kejadian seperti peningkatan permeabilitas pembuluh darah, peningkatan denaturasi protein dan alterasi membran. Ciri-ciri jaringan yang telah rusak salah satu penyebabnya diakibatkan oleh adanya denaturasi protein (Umapathy et al, 2010). Pada penelitian ini, uji aktivitas antiinflamasi in
vitro dengan prinsip denaturasi (William et al., 2008) dipilih untuk
melakukan skrining awal antiinflamasi pada senyawa hasil modifikasi. Uji aktivitas antiinflamasi dilakukan pada senyawa para metoksisinamamida serta dibandingkan dengan asam p-metoksisinamat dan etil p-metoksisinamat dengan natrium diklofenak sebagai kontrol positif.
Uji inhibisi denturasi protein BSA (Bovin Serum Albumin) dengan rentang uji 50-0,035 pm yang dapat memberikan % inibisi >20% dianggap memiliki aktivitas antiinflamasi yang potensial (Williams et al, 2008). Natrium diklofenak aktif dalam memberikan aktivitas sebagai antiinflamasi dimulai dari konsentrasi 10 ppm dengan persen inhibisi 24,93% dan pada konsentrasi 100 ppm dapat menghambat denaturasi protein sebesar 93,43% (Lihat tabel 4.4).
persen inhibisi 81,57% sedangkan etil p-metoksinamat memiliki persentase inhibisi 54,93%. Hal ini menunjukan bahwa modifikasi struktur yang dilakukan pada gugus OH dari asam p-metoksisinamt menjadi turunan amida dengan urea dapat meningkatkan aktivitas antiinflamasi.
Tabel 4.4 Hasil uji antiinflamasi EPMS, APMS dan Para
Metoksisinamamida
No Sampel Konsentrasi
(ppm)
%inhibisi
1 Natrium Diklofenak
0,1 1,59
1 2,99
10 24,93
100 93,43
2 Etil p-metoksisinamat
0,1 30,90
1 36,46
10 46,76
100 54,93
3 Asam p-
metoksisinamat
0,1 -0,54
1 -0,34
10 0,11
100 0,32
4 Para
Metoksisinamamida
0,1 33,17
1 37,1
10 41,08
BAB 5
KESIMPULAN DAN SARAN 5.1 Kesimpulan
1. Modifikasi struktur gugus fungsi OH dari asam p-metoksisinamat melalui reaksi amidasi dengan urea menghasilkan senyawa para metoksisinamamida (C10H11NO2) dengan berat molekul 177,0 g/mol
2. Hubungan struktur hasil modifikasi asam p-metoksisinamat terhadap antiinflamasi menunjukan pergantian gugus fungsi OH menjadi amida dapat meningkatkan aktivitas antiinflamasi. Senyawa hasil amidasi (para metoksisinamamida) memiliki persentase inhibisi denaturasi protein sebesar 33,17 % pada konsentrasi 0,1 ppm, 37,1% pada konsentrasi 1 ppm, 41,08% pada konsentrasi 10 ppm dan 81,57% pada konsentrasi 100 ppm.
5.2 Saran
DAFTAR PUSTAKA
Afriastini.J.J. 1990. Bertanam Kencur. Wakarta Penebar Swadaya. Jakarta. Al-Fattah, Muhammad Hatta. 2011. Mukjizat Pengobatan Herbal dalam
Al-Qur’an. Mirqat:Jakarta
Backer. C. A. R. C. B. Van den Briak.1968. Flora of Java. Vol 2. Walters Noordhoff.N.V. Groningen. P. 33.
Bangun, Robijanto. 2011. Semi Sintesis N,N-Bis(2-Hidroksietil)-3-(4-Metoksifenil Akrilamida Dari Etil P-Metoksisinamat Hasil Isolasi Rimpang Kencur
(Kaempferia Galanga, L) Melalui Amidasi Dengan Dietanolamin. Medan:
Universitas Sumetra Utara.
Barus, Rosbina. 2009. Amidasi Etil p-Metoksi Sinamat yang Diisolasi dari Kencur
(Kaempferia Galanga, Linn). Medan: Sekolah Pasca Sarjana Universitas
Sumatera Utara.
Basset, J. 1994. Buku Ajar Vogel : Kimia Analisis Kuantitatif Anorganik .Jakarta: EGC Buku Kedoktean
Bresnick, S. M. D. 2004. Intisari Kimia Organik. Jakarta: Penerbit Hipokrates. Chatterjee, Priyanka; Sangita Chandra; Protapaditya Dey; Sanjib Bhattacharya.
2012. Evaluation of Anti-Inflammatory Effects of Green Tea and Black
Tea : A Comparative in vitro Study. J. Adv. Pharm Technol Res Vol 3 (2)
136-138.
Corwin, Elizabeth J. 2008. Buku Saku Patofisiologi . Jakarta: Penerbit Buku Kedokteran EGC.
Departemen Kesehatan RI. 1995. Farmakope Indonesia Edisi IV. Jakarta.
Ernawati Teni, Edi Tjoa, Lia Melawati, Puspita Dewi Lotulung dan LBS Kardono. 2012. Synthesis of a Cnadidate Anti-Cancer Inhibitor Compound:N,N-Diethylcinnamide. Intrnational Confrence and
Fessenden. R. J. Dan J. Fessenden.1999. Kimia Organik. Edisi Ketiga. Jilid 2.Jakarta: Erlangga.
Gritter FJ et al, 1991, Pengantar Kromatografi (terjemahan K. Padmawinata), edisi 2, ITB, Bandung, 107
Hamida L. 2007. Seni Tanaman Rempah Kencur. Penerbit CV Habsa Jaya : Bandung.
Hardiansyah, M., Muhammad. 2014. Amidasi Seyawa Etil p-metoksisinamat yang Diisolasi dari Kencur (Kaemferia galanga Linn) dan Uji Aktivitas
Antiinflamasi in vitro. Jakarta : UIN Syarif Hidayatullah Jakarta
Hendayana, S., Kadarohman, A.A., and Supriatna, A., 1994, Kimia Analitik
Instrumen , IKIP Semarang Press, Semarang.
Hidayati, Nur; SM Widyastuti; Subagus Wahyuono. 2012. Isolasi Dan Identifikasi Senyawa Antifungal Akar Acacia Mangium Dan Aktivitasnya Terhadap
Ganoderma Lucidum. Sekolah Pasca Sarjana : Universitas Gadjah Mada.
Inayatullah. M. S.1997. Standarisasi Rimpang Kencur dengan Parameter Etil
Para Metoksi sinamat. Skripsi Fakultas Farmasi Universitas
Erlangga.Surabaya.
IQWiG (Institute for Quality and Efficiency in Health Care). 2010. Pubmed Health via http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0009852/ Diakses pada tanggal 9 Februari 2015.
Kalgutkar, Amit S.; Brenda C.; Scott W. R.; Alan B. M.; Kevin R. K.; Rory P. R.; Lawrence J. M.. 1999. Biochemically based design of cyclooxygenase-2 (COX-2) inhibitors: Facile conversion of nonsteroidal antiinflammatory
drugs to potent and highly selective COX-2 inhibitors. J. Med . Chem.
2000, 43 , 2860-2870.
Khalafi-Nezhad, Ali; Babak Mokhtari; Mohammad Navid Soltani Rad. 2003.
Direct preparation of primary amides from carboxylic acids and urea
using imidazole under microwave irradiation.Tetrahedron Letters 44
(2003) 7325–7328.
Khoirunni’mah, Zulfa. 2012. Modifikasi Stuktur Senyawa Metil Sinamat Melalui Proses Nitrasi Serta Uji BSLT (Brine Shrimp Lethality Test) Terhadap