ISOLASI, PEMURNIAN, DAN IDENTIFIKASI
SENYAWA ANTI-
β
-LAKTAMASE DARI Streptomyces sp. IVNF1-1
(Penghambat Pertumbuhan Bakteri Penyebab Diare, EPEC K1-1)
WULAN TRI WAHYUNI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
WULAN TRI WAHYUNI. Isolasi, Pemurnian, dan Identifikasi Senyawa Anti-β -laktamase dari Streptomyces sp. IVNF1-1 (Penghambat Pertumbuhan Bakteri Penyebab Diare, EPEC K1-1). Dibimbing oleh LATIFAH K. DARUSMAN dan YULIN LESTARI.
Bakteri penyebab diare (EPEC K1-1) memproduksi β-laktamase, enzim yang memotong cincin β-laktam dan menimbulkan resistensi EPEC K1-1 terhadap antibiotik β -laktam. Dalam penelitian ini, upaya mengatasi resistensi dilakukan melalui isolasi senyawa anti-β-laktamase golongan protein (BLIP) dan asam klavulanat dari Streptomyces sp. IVNF1-1. Upaya ini dilatarbelakangi keragaman mikrob Indonesia yang sangat tinggi dan IVNF1-1 merupakan isolat indigenos potensial yang memberikan hambatan terhadap pertumbuhan EPEC K1-1 dengan diameter zona hambat sebesar 6 mm.
Hambatan protein ekstraselular IVNF1-1 terhadap aktivitas enzim β-laktamase EPEC K1-1 ditentukan dengan metode iodometri yang telah dimodifikasi. Hambatan yang diberikan protein ekstraselular dalam filtrat kultur IVNF1-1 ialah sebesar 84,12%. Pemurnian protein tersebut melalui pengendapan amonium sulfat kejenuhan 80%, dialisis, dan kromatografi filtrasi gel sephadex G-75 menghasilkan BLIP dengan aktivitas hambatan sebesar 11,10%.
ABSTRACT
WULAN TRI WAHYUNI. Isolation, Purification, dan Identification of Anti-β-lactamase Compound from Streptomyces sp. IVNF1-1 (Growth Inhibitor of Bacteria Diarrhea, EPEC K1-1). Supervised by LATIFAH K. DARUSMAN and YULIN LESTARI.
Bacteria of diarrhea (EPEC K1-1) produces β-lactamase, an enzyme which cleaves the β-lactam ring and causes bacterial resistance to β-lactam antibiotics. In this research, the effort to handle bacterial resistance was done through isolation of anti-β-lactamase compounds from Streptomyces sp. IVNF1-1. IVNF1-1 is an indigenous isolate that gives potential inhibition to EPEC K1-1’s growth with 6 mm diameter inhibition zone.
The inhibition of IVNF1-1’s extracellular protein to β-lactamase’s activity was detected by modified iodometric assay method. Inhibition of IVNF1-1 was 84,12%. Purification of protein was done through ammonium sulfate precipitation 80% saturation, dialysis, and chromatography gel filtration using sephadex G-75. The β-lactamase Inhibitory Protein (BLIP) was isolated and it gaves 11,10% inhibition to β-lactamase’s activity.
ISOLASI, PEMURNIAN, DAN IDENTIFIKASI
SENYAWA ANTI-
β
-LAKTAMASE DARI Streptomyces sp. IVNF1-1
(Penghambat Pertumbuhan Bakteri Penyebab Diare, EPEC K1-1)
WULAN TRI WAHYUNI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Isolasi, Pemurnian, dan Identifikasi Senyawa Anti-
β
-laktamase dari
Streptomyces
sp. IVNF1-1 (Penghambat Pertumbuhan Bakteri Penyebab
Diare, EPEC K1-1)
Nama : Wulan Tri Wahyuni
NIM : G44201008
Menyetujui:
Pembimbing I,
Pembimbing II,
Prof. Dr. Ir. Latifah K. Darusman, M.S. Dr. Ir. Yulin Lestari
NIP 130536681
NIP 131779515
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuann Alam
Institut Pertanian Bogor
Dr.Ir. Yonny Koesmaryono, M.S.
NIP 131473999
PRAKATA
Puji syukur penulis haturkan ke hadirat Allah SWT atas segala kemudahan, bimbingan, dan perlindungan-Nya selama penulis menjalani penelitian hingga karya ilmiah ini dapat diselesaikan. Adapun tujuan penelitian yang dilakukan ialah memperoleh senyawa anti-β-laktamase dari isolat Streptomyces sp. IVNF1-1. Lebih lanjut senyawa anti-β-laktamase yang diperoleh diharapkan dapat dimanfaatkan dalam dunia medis untuk mengatasi diare. Penelitian dilaksanakan pada bulan April 2005 sampai Februari 2006 di Laboratorium Mikrobiologi Departemen Biologi dan di Laboratorium Kimia Analitik Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Prof. Dr. Ir. Latifah K. Darusman atas bimbingan, dorongan, dan kesempatan yang diberikan untuk melaksanakan penelitian pada bidang yang baru namun sangat menarik bagi penulis. Kepada Ibu Dr. Ir. Yulin Lestari penulis sampaikan rasa terima kasih yang besar atas kepercayaan dan kesempatan bergabung dengan proyek penelitian yang Ibu pimpin, terima kasih atas diskusi yang sangat berharga mengenai bidang mikrobiologi yang telah banyak menambah pengetahuan penulis dalam bidang tersebut.
Ucapan terima kasih yang dalam penulis sampaikan kepada kedua orang tua dan mamam atas pengorbanan materi, waktu, tenaga, dan dukungan semangat serta doa yang senantiasa menguatkan penulis saat menghadapi berbagai kesulitan selama penelitian. Penulis juga berterima kasih kepada Balai Penelitian BIOGEN atas bantuannya dalam proses pengeringbekuan enzim, kepada Laboratorium Mikrobiologi Hewan & Biomedis, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB) atas koleksi bakteri EPEC K1-1 dan bantuannya dalam proses sonikasi, kepada Laboratorium Terpadu Institut Pertanian Bogor atas bantuannya dalam analisis kromatografi cair kinerja tinggi (HPLC), kepada Pusat Studi Biofarmaka atas bantuannya dalam analisis spektrofotometri inframerah (FTIR). Kepada Om Eman penulis sampaikan ucapan terima kasih yang dalam atas bantuan dan segala kemudahan yang diberikan kepada penulis saat penulis membutuhkan alat dan bahan penelitian. Kepada para staf dan laboran di Laboratorium Kimia Analitik dan laboratorium Mikrobiologi terima kasih atas bantuan selama penelitian dilaksanakan.
Tidak lupa penulis berterima kasih kepada rekan penelitian, Kak Elsie, atas kerjasamanya selama penelitian berlangsung. Untuk De-io yang telah berbagi pengalaman, rekan-rekan di Laboratorium Analitik, rekan-rekan di Laboratorium Mikrobiologi, serta rekan-rekan Kimia angkatan 38 penulis ucapkan terima kasih atas dukungan dan kerjasama yang diberikan.
Semoga karya ilmiah ini dapat bermanfaat bagi dunia ilmu pengetahuan dan dunia medis pada khususnya serta bagi kehidupan umat manusia secara umum. Amin
Bogor, April 2006
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi, Jawa Barat pada tanggal 23 Nopember 1982 sebagai anak ketiga pasangan Bajang Saepudin dan Titi Rohayati. Tahun 2001 penulis menyelesaikan studi di SMU Negeri I Cibadak. Pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN... ii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Penyakit Diare ... 2
EPEC dan β-laktamase ... 2
Senyawa Anti-β-laktamase... 2
Streptomyces... 3
BAHAN DAN METODE Bahan dan Alat ... 3
Metode ... 4
HASIL DAN PEMBAHASAN Peremajaan Isolat IVNF1-1 ... 6
Produksi Filtrat Kultur IVNF1-1 ... 6
Peremajaan dan Penentuan Kurva Tumbuh EPEC K1-1... 7
Konfirmasi Mekanisme Resistensi EPEC K1-1 terhadap Antibiotik β-laktam ... 7
Produksi dan Isolasi β-laktamase dari EPEC K1-1 ... 7
Analisis Daya Hambat IVNF1-1 terhadap β-laktamase EPEC K1-1... 8
Identifikasi Senyawa Anti-β-laktamase dari IVNF1-1 ... 8
SIMPULAN DAN SARAN Simpulan ... 10
Saran ... 11
DAFTAR PUSTAKA ... 11
DAFTAR GAMBAR
Halaman
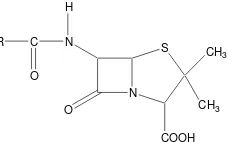
1 Struktur kimia inti penisilin (asam 6-aminopenisilinat)... 2
2 Struktur kimia asam klavulanat... 3
3 Pertumbuhan isolat IVNF1-1 pada media YM ... 6
4 Kurva tumbuh EPEC K1-1 dalam media NB + ampisilin ... 7
5 Deteksi β-laktamase dengan iodometric spot test... 7
6 Bioasai difusi agar filtrat kultur IVNF1-1 terhadap EPEC K1-1 ... 8
7 Kromatogram filtrasi gel protein IVNF1-1 ... 9
8 SDS-PAGE fraksi aktif kromatografi filtrasi gel ... 9
9 Kromatografi lapis tipis filtrat kultur IVNF1-1 ... 9
10 Bioasai difusi agar EPEC K1-1... 10
11 Uji alkaloid filtrat kiltur IVNF1-1 ... 10
DAFTAR LAMPIRAN
Halaman 1 Komposisi media peremajaan dan produksi ... 142 Diagram alir penelitian ... 15
3 Penentuan aktivitas β-laktamase dan daya hambat IVNF1-1 terhadap aktivitas β-laktamase EPEC K1-1 ... 16
4 Pengukuran kadar protein dengan metode Bradford 1976... 17
5 Penentuan asam amino protein IVNF1-1 hasil dialisis dengan kromatografi cair kinerja tinggi (HPLC) ... 21
6 Penentuan aktivitas β-laktamase dan daya hambat kelompok fraksi filtrasi gel ter- hadap aktivitas β-laktamase EPEC K1-1 ... 24
7 Optimasi fase gerak KLT asam klavulanat ... 25
PENDAHULUAN
Latar Belakang
Diare merupakan penyakit yang sering menyebabkan Kondisi Luar Biasa (KLB) dengan tingkat kematian yang tinggi di beberapa negara berkembang, termasuk Indonesia (RSPI-SS 2005). Wabah diare dapat terjangkit dengan cepat dalam waktu yang relatif singkat sehingga sulit untuk diatasi. Hal ini didorong oleh kondisi lingkungan dan gizi masyarakat yang buruk serta prilaku dan tingkat pendidikan sosial ekonomi yang masih rendah. Departemen kesehatan RI melaporkan bahwa di beberapa kabupaten tercatat ribuan kasus diare terjadi. Lebih lanjut beberapa di antaranya berujung pada kematian penderita (PPM & PLP Depkes RI 2004).
Penanganan secara medis terhadap diare sejauh ini dilakukan dengan menggunakan sejumlah antibiotik β-laktam. Antibiotik ini diketahui dapat membunuh agen penyebab diare dari kelompok bakteri Enteropathogenic Escherichia coli (EPEC). β-laktam bekerja menghambat sintesis lapisan peptidoglikan EPEC. Harga yang ekonomis, selektivitas yang tinggi, dan toksisitasnya yang rendah mendorong penggunaan β-laktam secara luas dalam dunia medis (Doran et al. 1990).
Penggunaan β-laktam secara kontinu menyebabkan terjadinya efek samping berupa resistensi EPEC terhadap antibiotik tersebut (Doran et al. 1990; Kang et al. 2000). Mekanisme resistensi yang umum terjadi ialah melalui pembentukan enzim β -laktamase. Enzim ini bekerja memecah cincin β-laktam (Doran et al. 1990) dan menghidrolisis ikatan amida pada cincin tersebut (Kang et al. 2000) sehingga β-laktam kehilangan aktivitasnya.
Upaya mengatasi resistensi terhadap β -laktam telah dilakukan. Di antaranya melalui isolasi senyawa anti-β-laktamase dari bakteri penghasil β-laktamase yang tidak patogen (Reading & Cole 1977; Doran et al. 1990; Kim & Lee 1994; Kang et al. 2000). Upaya lain dilakukan melalui modifikasi kimia terhadap antibiotik β-laktam, serta pencarian senyawa inhibitor yang memiliki bentuk struktur analog dengan struktur transisi hidrolisis antibiotik β-laktam (inhibitor kompetitif) (Chen et al. 1993).
Streptomyces ialah bakteri yang berpotensi besar menghasilkan senyawa anti-β -laktamase. Asam klavulanat, senyawa anti-β -laktamase yang diisolasi dari Streptomyces clavuligerus, telah digunakan secara luas
dalam dunia medis untuk mengatasi resistensi terhadap antibiotik β-laktam. Selain mampu menghasilkan senyawa anti-β-laktamase, Streptomyces juga diketahui merupakan penghasil antibiotik terbesar, lebih dari lima ratus jenis antibiotik telah dihasilkan (Madigan et al. 2000), dan dilaporkan memiliki kemampuan sebagai antibakteri (Ifdal 2003; Andri 2004). Keragaman Streptomyces Indonesia yang sangat tinggi mendukung upaya pencarian senyawa anti-β -laktamase untuk mengatasi resistensi bakteri terhadap antibiotik β-laktam.
Desriani pada tahun 2004 telah melakukan penapisan terhadap beberapa isolat Streptomyces indigenos. Isolat tersebut diperoleh dari beberapa daerah di Indonesia, seperti Bogor, Sukabumi, Kutai, dan Padang. Dalam penelitian tersebut berhasil ditemukan isolat IVNF1-1 yang berpotensi menghasilkan senyawa anti-β-laktamase. Protein aktif yang dikandung diisolasi dan diduga bobot molekulnya melalui elektroforesis poliakrilamida (SDS-PAGE). Bobot molekul protein tersebut berkisar antara 14-45 kDa.
Upaya pemurnian molekul protein dan eksplorasi senyawa nonprotein dengan aktivitas anti-β-laktamase dari isolat berpotensi secara lebih lanjut perlu dilakukan. Diharapkan melalui upaya tersebut diperoleh senyawa anti-β-laktamase yang mampu mengatasi resistensi bakteri terhadap antibiotik β-laktam. Lebih lanjut diharapkan dapat digunakan secara klinis untuk mengatasi penyakit diare.
Tujuan Penelitian
Penelitian yang dilakukan bertujuan memperoleh senyawa anti-β-laktamase dari isolat Streptomyces sp. IVNF1-1 sebagai upaya mengatasi resistensi bakteri EPEC K1-1 terhadap antibiotik β-laktam.
Waktu dan Tempat
Penelitian dilakukan mulai April 2005-Februari 2006 bertempat di Laboratorium Kimia Analitik Departemen Kimia dan Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Hipotesis
TINJAUAN PUSTAKA
Penyakit Diare
Diare merupakan suatu penyakit dengan tanda-tanda adanya perubahan bentuk dan konsistensi tinja, yaitu tinja melembek sampai mencair dan bertambahnya frekuensi buang air besar lebih dari biasanya (tiga kali atau lebih dalam sehari). Diare dapat timbul karena beberapa penyebab, diantaranya akibat bakteri, virus, parasit (jamur, cacing, protozoa), keracunan makanan dan minuman yang disebabkan oleh bakteri maupun bahan kimia, kekurangan gizi, serta alergi terhadap susu (RSPI-SS 2005).
Beberapa jenis bakteri berperan sangat besar dalam timbulnya penyakit diare. Bakteri tersebut meliputi Vibrio cholera 0139 yang ditemukan pada tahun 1992, Vibrio cholera El Tor yang ditemukan pada tahun 1993 (RSPI-SS 2005), dan Enteropathogenic Escherichia coli (EPEC), yaitu bakteri penyebab diare yang sulit dilumpuhkan karena memiliki resistensi terhadap antibiotik β-laktam (Donnenberg & Whittam 2001).
Penyakit diare dapat ditularkan melalui beberapa cara. Di antaranya melalui infeksi oleh agen penyebab penyakit yang ditemukan pada makanan dan minuman yang terkontaminasi, serta melalui tinja dan muntahan penderita (RSPI-SS 2005).
Penanganan terhadap diare di antaranya dilakukan dengan menggunakan antibiotik β -laktam, namun upaya tersebut tidak menjadi solusi apabila kasus diare timbul akibat EPEC. Sejauh ini hanya asam klavulanat yang dapat digunakan untuk menangani kasus diare akibat EPEC (Doran et al. 1990).
EPEC dan β-laktamase
EPEC merupakan bakteri gram negatif dengan habitat alami di dalam saluran pencernaan manusia dan hewan berdarah panas (Donnenberg & Whittam 2001). Bakteri ini diketahui merupakan bakteri fakultatif aerobik penyebab utama diare di negara-negara berkembang (Bettelheim KA 1992; Nataro & Kaper 1998). EPEC bekerja membentuk luka dan menghancurkan mikrofili saluran pencernaan (Donnenberg & Whittam 2001).
Kemampuan EPEC memproduksi senyawa β-laktamase telah menimbulkan resistensi terhadap antibiotik β-laktam (Ogarawa et al. 1999). β-laktamase EPEC merupakan enzim yang bekerja menghidrolisis ikatan amida
pada cincin β-laktam (Bush et al. 1995) sehingga aktivitas antibiotik tersebut hilang.
N S COOH CH3 O N CH3 H C O R
Gambar 1 Struktur kimia inti penisilin (asam 6- aminopenisilinat).
β-laktamase telah mengalami perkembangan dan mutasi yang menyebabkan resistensinya terhadap antibiotik β-laktam semakin kuat. TEM-1 β-laktamase merupakan salah satu contoh β-laktamase hasil mutasi. Dilaporkan bahwa tiga generasi terbaru antibiotik β-laktam mampu dihidrolisis oleh TEM-1 β-laktamase (Kang et al. 2000).
β-laktamase selain ditemukan pada EPEC, juga tersebar secara luas pada bakteri gram positif dan gram negatif, baik yang patogen maupun tidak patogen. Produksi enzim β -laktamase pada bakteri tidak patogen disertai dengan produksi senyawa penghambatnya, contohnya pada Streptomyces. Sebaliknya, bakteri patogen seperti EPEC tidak mampu memproduksi senyawa penghambat β -laktamase tersebut. Bakteri lain yang diketahui mampu menghasilkan enzim β -laktamase ialah Staphylococcus aureus, S. epidermis, Enterobacter faecalis, Pseudomonas aeruginosa, Neisheria gonnorhoe, N. meningitides, dan Bacteroides fragilis (Georgopapadakou 1993).
Aktivitas β-laktamase dalam menghidrolisis dan menginaktifkan antibiotik β-laktam dapat diukur dengan empat pendekatan, yaitu metode asidimetri, iodometri yang dimodifikasi, Kirby-Baeur yang dimodifikasi, dan subtrat-substrat kromogenik.
Senyawa Anti-β-laktamase
Senyawa anti-β-laktamase berfungsi menghambat kerja β-laktamase dalam menghidrolisis antibiotik β-laktam. Senyawa ini umumnya dikombinasikan dengan antibiotik β-laktam yang peka terhadap enzim β-laktamase, misalnya amoksilin, sehingga aktivitas antibiotik tersebut mengalami peningkatan.
-laktamase Inhibitory Protein), yaitu BLIP berbobot molekul 17 kDa yang berhasil diisolasi dari Streptomyces clavuligerus (Doran et al. 1990) serta BLIP I dan BLIP II dengan bobot molekul 48 kDa dan 33 kDa yang diisolasi dari S. exfoliatus SMF 19 (Kim & Lee 1994). Sementara itu, senyawa anti-β -laktamase lainnya diisolasi sebagai senyawaan nonprotein, contohnya asam klavulanat (Reading & Cole 1977), anti-β-laktamase sulbaktam, azobaktam (Vilar et al. 2001), olivanic acid (Butterworth et al. 1979), dan thienamycin (Kahan et al. 1979).
β-laktamase Inhibitory Protein (BLIP)
Senyawa protein dengan kemampuan menghambat aktivitas β-laktamase pertama kali diisolasi dari S. gedaensis, kemudian dikenal sebagai BLIP. BLIP diproduksi Streptomyces secara ekstraselular.
Mekanisme hambatan yang diberikan BLIP terhadap β-laktamase belum diketahui secara pasti, Doran et al. 1990 menyatakan bahwa BLIP menyebabkan degradasi proteolitik β-laktamase. Menurut pendapat lain asam amino BLIP berinteraksi dengan asam amino β-laktamase sehingga merusak kemampuan enzim untuk memotong cincin β -laktam.
Asam Klavulanat
Asam klavulanat sebagai salah satu jenis antibiotik β-laktam memiliki aktivitas antibakteri yang rendah, namun demikian mampu menghambat β-laktamase. Asam klavulanat sering dikombinasikan dengan antibiotik β-laktam lain yang memiliki aktivitas tinggi namun tidak bertahan terhadap serangan β-laktamase. Kombinasi yang telah digunakan di antaranya amoxiclavam, gabungan asam klavulanat dengan amoksilin.
Struktur asam klavulanat sangat mirip dengan penisilin, hanya saja atom S pada cincin tiazolidin penisilin diganti dengan atom O dan struktur asam klavulanat tidak memiliki rantai samping pada posisi 6.
Bahan-bahan yang digunakan ialah isolat IVNF1-1 koleksi Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB, isolat bakteri target (EPEC K1-1) koleksi Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB), satu isolat bakteri kontrol negatif (E. coli DH5α) koleksi Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB, media fermentasi (Kim & Lee 1994), yeast malt agar (YM), yeast malt broth (YMB), nutrient agar (NA), nutrient broth (NB) (Lampiran 1). Bahan lain yang digunakan meliputi benzilpenisilin Gambar 2 Struktur kimia asam klavulanat.
Streptomyces
Streptomyces merupakan bakteri gram positif yang termasuk dalam kelompok Actinomycetes. Bakteri ini hanya dapat tumbuh pada lingkungan beroksigen (obligat aerobik) melalui pembentukan cabang-cabang pada ujung filamen sehingga fase vegetatifnya berbentuk matriks tenunan kompleks. Streptomyces dapat membentuk spora yang disebut konidia (Bettelheim KA 1992; Madigan et al. 2000). Konidia Streptomyces umumnya memiliki pigmen sehingga koloni dewasanya memiliki warna (Madigan et al. 2000).
Habitat yang umum bagi Streptomyces ialah tanah yang bersifat alkali atau netral. Streptomyces lebih menyukai lingkungan dengan kadar air tidak terlalu tinggi, seperti tanah liat berpasir atau tanah yang dilapisi batu kapur. Metabolit yang dihasilkan Streptomyces (geosmin) memberikan wangi khas pada tanah.
Streptomyces dapat diisolasi dari habitat aslinya dan ditumbuhkan pada skala laboratorium. Media tumbuh yang dapat digunakan ialah agar padat atau media cair bersifat basa. Media tersebut dicampurkan dengan berbagai jenis sumber karbon organik (pati, glukosa, gliserol, dan laktat), sumber nitrogen (NH4+, NO3), serta beberapa jenis garam mineral (Bettelheim KA 1992).
Kompetisi Streptomyces dengan organisme lain dalam memperebutkan nutrisi telah mendorong dihasilkannya metabolit sekunder berupa antibiotik. Mekanisme hambatan terhadap pertumbuhan organisme lain tidak lepas dari kemampuan Streptomyces dalam membentuk spora (Madigan et al. 2000).
BAHAN DAN METODE
Bahan dan Alat
N O
O
CH2OH
Sigma, reagen iodin, larutan dapar fosfat pH 7, ampisilin, nistatin, griseofulvin, asam nalidiksat, air suling, etanol, n-butanol, asam asetat glasial, pelat kromatografi lapis tipis (KLT) silika gel Merck, kertas cakram, kantung dialisis Sigma, dan sephadex G-75 Sigma, pereaksi Bradford, akrilamida, metilen bis-akrilamida, coomassie brilliant blue R-250, sodium dodesil sulfat, amonium persulfat, tetraetilmetilendiamina (TEMED), serta dapar elektroforesis.
Alat-alat yang digunakan ialah autoklaf ISOLAB Laborgerate GmbH, neraca analitik, laminarflow MSC 12 Jouan, spektrofotometer spectronic 20D+ Milton Roy, spektrofotometer ultraviolet, alat pemusing berpendingin CR 3i Jouan, pengering beku LABCONCO, shaker OSK, penghancur sel soniprep 150, spektrofotometer inframerah transformasi Fourier(FTIR) tensor 37 Bruker, inkubator suhu 37 °C, inkubator suhu 4 oC, pH meter, perangkat elektroforesis, perangkat kromatografi cair kinerja tinggi (HPLC), vortex, penangas air, kolom kromatografi filtrasi gel, pipet mikro, batang penyebar, jarum ose, serta peralatan gelas.
Metode
Penelitian diawali dengan peremajaan dan produksi isolat IVNF1-1. Filtrat kultur IVNF1-1 diuji daya hambatannya terhadap bakteri EPEC K1-1 melalui metode Kirby-Bauer dan spektrofotometri Sawai et al. 1978. Senyawa anti-β-laktamase diisolasi sebagai β -laktamase inhibitory protein (BLIP) dan asam klavulanat. BLIP diperoleh melalui pengendapan amonium sulfat kejenuhan 80%, dialisis, dan kromatografi filtrasi gel. Sementara itu, asam klavulanat diekstraksi dalam bentuk garamnya dengan metode United States Patent 4140764. Identifikasi asam klavulanat dilakukan melalui KLT, metode Kirby-Bauer, dan spektrofotometri FTIR. Uji alkaloid dilakukan terhadap filtrat kultur IVNF1-1 untuk mengkonfirmasi kemungkinan asam klavulanat tergolong sebagai alkaloid (Lampiran 2).
Peremajaan Isolat IVNF1-1
Isolat IVNF1-1 ditumbuhkan dalam media YMB yang telah diberi antifungi dan antibakteri (nistatin-griseofulvin dan asam nalidiksat) pada suhu ruang dengan kecepatan pengocokan 100 rpm. Setelah terbentuk miselia (±7 hari), isolat dari YMB ditumbuhkan ulang (digores) dengan bantuan
jarum ose pada media YM. Pertumbuhan pada YM berlangsung selama 10 sampai 14 hari pada suhu ruang.
Produksi Filtrat Kultur IVNF1-1
Isolat IVNF1-1 dari media YM ditumbuhkan dalam media fermentasi selama 14 hari pada suhu ruang dengan pengocokan berkecepatan 100 rpm. Pada hari ke-14 isolat dipanen dan dipusing dengan kecepatan 20.000 x g, suhu 4 oC selama 10 menit. Filtrat kultur yang diperoleh diuji aktivitas penghambatannya terhadap pertumbuhan EPEC K1-1.
Peremajaan dan Penentuan Kurva Tumbuh EPEC K1-1
EPEC K1-1 diremajakan pada media NA yang mengandung ampisilin dengan konsentrasi 100 µg/ml. Satu buah koloni tunggal EPEC K1-1 dari media NA diinokulasikan ke dalam media NB + ampisilin 100 µg/ml. Biakan ditumbuhkan dalam inkubator bersuhu 37 oC dengan pengocokan berkecepatan 120 rpm. Setelah 3 jam, 100 µl biakan diinokulasikan ulang (subkultur) ke dalam 20 ml NB + ampisilin (subkultur dibuat dalam beberapa seri ulangan), kemudian subkultur diinkubasi pada kondisi yang identik. Penentuan kurva tumbuh EPEC K1-1 dilakukan dengan membuat hubungan antara absorbansi (OD) biakan EPEC K1-1 dengan waktu secara periodik.
Konfirmasi Mekanisme Resistensi EPEC K1-1 terhadap Antibiotik β-laktam
Konfirmasi mekanisme resistensi EPEC K1-1 dilakukan melalui metode iodometric spot test (Lee & Komarmy 1981).
Produksi dan Isolasi β-laktamase dari EPEC K1-1
dalam larutan dapar fosfat pH 7 kemudian dipecah dengan penghancur soniprep kekuatan 7 (power level 7) selama 5 menit secara kontinu. Sel yang telah dipecah dipusing dengan kecepatan 20.000 x g pada suhu 4 oC selama 10 menit, supernatan yang diperoleh dikeringbekukan untuk memperoleh ekstrak kasar β-laktamase kandidat 2 (enzim intraselular).
Analisis Daya Hambat IVNF1-1terhadap
β-laktamase EPEC K1-1
Metode Kirby- Bauer
Media NA semipadat berisi 100 μl biakan bakteri target dengan konsentrasi minimal 106 sel/ml dituangkan ke dalam media NA padat (cawan overlay). Setelah seluruh media memadat, kertas cakram berdiameter 8 mm yang mengandung 15 µl filtrat kultur IVNF1-1 diletakkan di atas media overlay. Pengamatan terhadap zona bening yang terbentuk dilakukan setelah inkubasi selama 24 jam pada suhu 37 oC.
Metode Spektrofotometri
Aktivitas β-laktamase diukur dengan metode Sawai et al. 1978 yang telah dimodifikasi. Digunakan konsentrasi substrat 0,10 mg/ml, reaksi enzimatis dilakukan selama 20 menit pada suhu 30 oC. Pembacaan absorbansi dilakukan pada panjang gelombang 540 nm setelah penambahan reagen iodin dan inkubasi selama 20 menit pada suhu ruang. Metode yang sama juga digunakan untuk penentuan hambatan IVNF1-1 terhadap β-laktamase. Digunakan IVNF1-1 dengan perbandingan 1:1 terhadap enzim.
Identifikasi Senyawa Anti-β-laktamase dari IVNF1-1
β-laktamaseInhibitory Protein (BLIP)
Penentuan Proteindan Asam Amino
Kadar protein sampel diukur menggunakan metode Bradford 1976. Jenis dan kadar asam amino protein hasil dialisis ditentukan dengan kromatografi cair kinerja tinggi (HPLC) metode OPA (ortoftaldehida) Kolom ultra techspere digunakan sebagai fase diam dan campuran buffer asetat-metanol 95 % sebagai fase gerak (elusi gradien).
Pengendapan Protein dengan Amonium Sulfat
Sebanyak 100 ml filtrat kultur fermentasi IVNF1-1 diendapkan dengan menambahkan amonium sulfat (NH4)2SO4 hingga kejenuhan 80% pada suhu 4 oC. Amonium sulfat ditambahkan ke dalam filtrat kultur sedikit demi sedikit sambil diaduk dengan pengaduk magnet. Setelah seluruh amonium sulfat larut sempurna dalam filtrat kultur, dilakukan inkubasi pada suhu 4 oC selama 20 jam. Pemusingan dengan kecepatan 20.000 x g selama 10 menit dilakukan untuk memisahkan endapan protein yang diperoleh. Endapan protein selanjutnya dilarutkan dalam 10 ml larutan dapar fosfat 0,1 M pH 7.
Dialisis
Sebanyak 3 ml endapan protein dalam larutan dapar fosfat 0,1 M pH 7 didialisis dalam kantong dialisis yang telah diaktivasi. Larutan dapar fosfat konsentrasi 5 mM digunakan sebagai larutan dapar dialisis. Proses dialisis berlangsung selama 20 jam, dengan penggantian larutan dapar dialisis dilakukan pada jam ke-2. Selama proses dialisis berlangsung, larutan dapar dialisis terus menerus diaduk dengan menggunakan pengaduk magnet.
Kromatografi Filtrasi Gel
Protein hasil dialisis sebanyak 2% dari volume kolom (800 μl) dengan konsentrasi 0,0298 mg/ml diaplikasikan ke dalam kolom dan dielusi dengan laju alir fase gerak 0,167 ml/menit. Digunakan sephadex G-75 sebagai fase diam dan larutan dapar fosfat 0,1 M pH 7 sebagai fase gerak pada suhu 4 oC. Fraksi-fraksi yang diperoleh ditampung setiap 5 ml dan diukur serapannya dengan spektrofotometer ultraviolet pada panjang gelombang 280 nm.
Penentuan Fraksi Aktif
Asam Klavulanat
Asam klavulanat diekstraksi dari filtrat kultur IVNF1-1 dalam bentuk garam karboksilat dengan metode United States Patent 4140764.
Kromatografi Lapis Tipis (KLT)
Ekstrak asam klavulanat diaplikasikan pada pelat KLT silika gel 60 Merck dan dielusi pada suhu 20 oC dengan fase gerak hasil optimasi. Keberadaan asam klavulanat ditunjukkan dengan terbentuknya zona berwarna merah tua setelah pelat KLT diberi pereaksi TTC (2,3,5-trifeniltetrazolium klorida) dan dipanaskan. Warna merah tua yang terbentuk akan segera hilang setelah beberapa saat (Reading & Cole 1976).
Metode Kirby- Bauer
Media NA semipadat berisi 100 μl biakan bakteri target dengan konsentrasi minimal 106 sel/ml dituangkan ke dalam media NA padat (cawan overlay). Setelah seluruh media memadat, kertas cakram berdiameter 8 mm yang mengandung 15 µl filtrat diletakkan di atas media. Filtrat dibagi menjadi 3 jenis, nomor 1 ialah filtrat kultur biakan IVNF1-1 tanpa perlakuan, nomor 2 ialah filtrat kultur biakan yang dipanaskan pada suhu 98 oC selama 4 menit, dan nomor 3 ialah ekstrak asam klavulanat. Pengamatan terhadap zona bening yang terbentuk dilakukan setelah inkubasi selama 24 jam pada suhu 37 oC.
Deteksi Gugus Fungsi Ekstrak Asam Klavulanat dengan Spektrofotometri Inframerah Transformasi Fourier (FTIR)
Ekstrak asam klavulanat dalam bentuk garamnya dikeringkan kemudian dianalisis kandungan gugus fungsinya dengan FTIR tensor 37 Bruker.
Identifikasi Asam Klavulanat sebagai Senyawa Alkaloid
Uji alkaloid dilakukan terhadap filtrat kultur IVNF1-1 yang telah dipekatkan menjadi sepersepuluh volume awal dengan rotari evaporator. Ke dalam 1 ml filtrat ditambahkan 1 ml kloroform (CHCl3) dan beberapa tetes amonia (NH4OH) kemudian dikocok. Fraksi kloroform dipisahkan dan ke dalamnya ditambahkan 1 ml asam sulfat
(H2SO4) 2 M. Setelah dikocok, fase asam digunakan untuk pengujian alkaloid dengan menggunakan pereaksi dragendorf, mayer, dan wagner. Daun tapak dara digunakan sebagai kontrol positif, sementara air sebagai kontrol negatif.
HASIL DAN PEMBAHASAN
Peremajaan Isolat IVNF1-1
Sterptomyces sebagai bakteri yang mampu mengurai senyawa kimia organik cukup mudah ditumbuhkan. Pertumbuhannya dapat berlangsung walaupun hanya tersedia sumber karbon organik seperti pati, glukosa, dan gliserol. Namun demikian koloni Sterptomyces membutuhkan waktu panjang (7-14 hari) untuk mencapai koloni dewasanya. Kecepatan tumbuhnya dapat ditingkatkan dengan menambahkan media kompleks kaya nutrisi yang mengandung ekstrak ragi dan ekstrak malt seperti pada YM dan YMB.
Pertumbuhan Streptomyces berlangsung optimal pada suhu ruang karena sebagian besar merupakan organisme mesofilik. Pertumbuhan terjadi melalui fragmentasi ujung filamen membentuk matriks tenunan kompleks miselia aerial (sporosphore). Seperti pada media padat lainnya, pada YM ujung sporosphores membentuk spora yang dikenal sebagai konidia. Setelah dewasa konidia dan sporosphore mengalami pigmentasi sehingga memberikan karakteristik warna terhadap koloni dewasa Streptomyces. Pada media YM, isolat IVNF1-1 mula-mula tumbuh membentuk miselia berwarna putih, namun akan menjadi sedikit merah muda setelah koloni berusia dewasa (Gambar 3).
Gambar 3 Pertumbuhan isolat IVNF1-1 pada media YM.
Produksi Filtrat Kultur IVNF1-1
dilakukan dengan bantuan pengocokan. Pengocokan dilakukan untuk menciptakan aerasi yang baik serta menambah intensitas kontak antara media dengan bakteri.
Habitat asli yang dominan bagi Streptomyces ialah tanah bersifat basa dan netral. Seperti pada habitat aslinya, media cair sintetik yang digunakan untuk produksi dikondisikan bersifat basa atau netral. Sebelum digunakan untuk produksi, derajat keasaman media fermentasi disesuaikan terlebih dahulu dengan menggunakan natrium hidroksida (NaOH) hingga mencapai pH 7,2.
Pertumbuhan IVNF1-1 dalam media fermentasi memperlihatkan pembentukan mikro dan makrokoloni. Kadar sukrosa ikut mempengaruhi pembentukan mikro dan makro koloni tersebut. Karena media fermentasi menggunakan glukosa sebagai sumber karbon, pembentukan mikro dan makrokoloni tidak dapat dihindari.
Peremajaan dan Penentuan Kurva Tumbuh EPEC K1-1
Isolat EPEC K1-1 diisolasi dari feses penderita diare. Berbeda dengan E. coli pada umumnya, pertumbuhan EPEC K1-1 berlangsung dengan sangat pesat. Akhir fase eksponensial pertumbuhan pada media NB (37 oC) yang umumnya dicapai E. coli pada jam ke-16 telah mampu dicapai EPEC K1-1 pada jam ke-5 (Gambar 4). Hal ini terjadi akibat pengaruh faktor genetik (kemampuan DNA EPEC K1-1 dalam bereplikasi) serta pengaruh nutrisi, pH, dan suhu pertumbuhan yang digunakan. Kemampuan EPEC K1-1 tumbuh dan memperbanyak diri sangat tinggi sehingga sangat berbahaya bagi kesehatan.
Gambar 4 Kurva tumbuh EPEC K1-1 dalam media NB + ampisilin.
Konfirmasi Mekanisme Resistensi EPEC K1-1 terhadap Antibiotik β-laktam
Resistensi bakteri gram negatif terhadap antibiotik β-laktam umumnya terjadi melalui
pembentukan β-laktamase. Konfirmasi mekanisme resistensi EPEC K1-1 dilakukan melalui metode iodometric spot test (Lee & Komarmy 1981). β-laktamase dapat memotong cincin β-laktam pada penisilin dan mengubah penisilin menjadi asam penisilat. Asam penisilat dapat mengikat iodin sehingga penambahan pati tidak mampu menghasilkan kompleks biru.
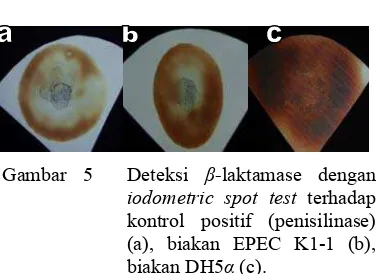
Gambar 5 menunjukkan hasil uji keberadaan β-laktamase pada biakan EPEC K1-1. Penisilinase digunakan sebagai kontrol positif, sementara sebagai kontrol negatif digunakan E. coli yang tidak memiliki resistensi terhadap antibiotik β-laktam(E. coli DH5α). Zona putih yang terbentuk pada bagian tengah kertas uji menunjukkan pati bebas. Hal ini membuktikan bahwa mekanisme resistensi EPEC K1-1 benar-benar terjadi melalui pembentukan β-laktamase. Namun pada tahapan ini belum dapat diketahui apakah β-laktamase EPEC K1-1 diproduksi secara intraselular atau ekstraselular.
Gambar 5 Deteksi β-laktamase dengan iodometric spot test terhadap kontrol positif (penisilinase) (a), biakan EPEC K1-1 (b), biakan DH5α(c).
Produksi dan Isolasi β-laktamase dari EPEC K1-1 -0,1 0 0,1 0,2 0,3 0,4 0,5
0 100 200 300 400
Waktu (menit) R a pa t opt ik ( O D
) β-laktamase diproduksi dan diisolasi dari
kultur biakan EPEC K1-1 pada akhir fase eksponensial kurva tumbuhnya, yaitu pada jam kelima. Persen perolehan untuk β -laktamase ekstraselular ialah sebesar 0,95% (b/v), sementara untuk enzim intraselular sebesar 1,65% (b/v).
Analisis Daya Hambat IVNF1-1 terhadap
β-laktamase EPEC K1-1
Metode Kirby- Bauer
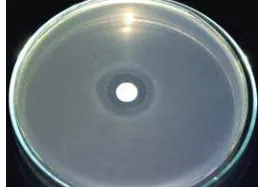
Pertumbuhan isolat IVNF1-1 dalam media fermentasi diduga menghasilkan senyawa anti-β-laktamase dan senyawa metabolit sekunder, termasuk antibiotik, secara ekstraselular. Dibuktikan dengan kemampuan filtrat kultur IVNF1-1 menghambat pertumbuhan EPEC K1-1 melalui metode Kirby-Bauer. Hasil yang diperoleh menunjukkan bahwa isolat IVNF1-1 mampu membentuk zona bening pada biakan EPEC K1-1 dengan diameter sebesar 6 mm (Gambar 6). Kondisi ini sesuai dengan hasil penelitian Desriani 2004 yang menyatakan bahwa IVNF1-1 memiliki kemampuan menghambat pertumbuhan bakteri penyebab diare penghasil β-laktamase.
Gambar 6 Bioasai difusi agar filtrat kultur IVNF1-1 terhadap EPEC K1-1.
Metode Spektrofotometri
Aktivitas hambatan filtrat kultur IVNF1-1 terhadap enzim β-laktamase ekstraselular ialah sebesar 84,12% (Lampiran 3). Lebih dari lima puluh persen aktivitas β-laktamase EPEC K1-1 hilang oleh filtrat kultur biakan IVNF1-1. IVNF1-1 dinilai sebagai isolat berpotensi penghasil senyawa anti-β-laktamase.
Identifikasi Senyawa Anti-β-laktamase dari IVNF1-1
β-laktamaseInhibitory Protein (BLIP)
Penentuan Protein dan Asam Amino
Berdasarkan metode Bradford 1976, filtrat kultur IVNF1-1 memiliki kadar protein yang sangat rendah (Lampiran 4). Hal ini diduga terjadi karena kondisi produksi yang kurang optimal dan waktu panen yang kurang tepat.
Protein hasil pengendapan amonium sulfat memiliki kadar lebih tinggi dibanding protein filtrat kultur. Kondisi ini terjadi karena amonium sulfat tidak seluruhnya membentuk anion divalen (SO42-) saat menyerang dan mengikat molekul air. Sebagian di antaranya masih berada dalam bentuk garam (NH4)2SO4 dan mengotori endapan protein. Akibatnya serapan protein pada pengukuran metode Bradford 1976 menjadi tinggi dan memberikan kesalahan positif.
Proses dialisis terhadap protein hasil pengendapan amonium sulfat membantu menghilangkan garam-garam pengotor. Dengan demikian, kadar protein hasil dialisis dan hasil tahapan pemurnian selanjutnya (kromatografi filtrasi gel) tidak mengalami kesalahan positif pada analisis Bradford 1976.
Kromatografi cair kinerja tinggi (HPLC) terhadap protein IVNF1-1 hasil dialisis menunjukkan kadar aspartat sebesar 0,67% (b/b) dan fenilalanin sebesar 0,26% (b/b) (Lampiran 5). Kang et al. tahun 2000 mengungkapkan bahwa aktivitas hambatan protein anti-β-laktamase terhadap kerja β -laktamase disebabkan oleh keberadaan asam amino aspartat-49 dan fenilalanin-142. Kedua asam amino tersebut berinteraksi dengan serin-70 (gugus aktif β-laktamase) dan merusak gugus aktif enzim.
Kromatografi Filtrasi Gel
Kromatogram filtrasi gel protein IVNF1-1 menunjukkan daerah landaian dan daerah puncak serapan. Daerah landaian menunjukkan kelompok protein dengan nisbah konsentrasi rendah sementara daerah puncak menggambarkan protein dengan nisbah konsentrasi lebih tinggi. Pengelompokan fraksi dilakukan berdasarkan waktu retensi yang dialami setiap fraksi. Fraksi dengan waktu retensi berdekatan diasumsikan memiliki bobot molekul berdekatan. Pengelompokan fraksi yang dibuat ditunjukkan oleh lingkaran berwarna merah (Gambar 7).
Gambar 7 Kromatogram filtrasi gel protein IVNF1-1.
Penentuan bobot molekul BLIP dengan SDS-PAGE dan pewarna coomassie brilliant blue tidak memberikan hasil yang baik
(Gambar 8). Hal ini terjadi karena kadar protein sampel berada di bawah limit deteksi pewarna coomassie brilliant blue. Hanya pita marker protein yang teramati pada gel.
0 0,02 0,04 0,06 0,08 0,1 0,12
Gambar 8 SDS-PAGE fraksi aktif kromatografi filtrasi gel.
Tabel 1 Aktivitas dan kadar protein penghambat β-laktamase (BLIP) dari isolat IVNF1-1
Sampel Total BLIP
(% hambatan aktivitas β -laktamase)
Total protein (x10-1 mg)
Aktivitas spesifik (% hambatan/mg protein)
Filtrat kultur 84,12 6,4612 130,19
Fraksi aktif filtrasi gel
11,10 0,1110 999,46
Asam Klavulanat
Kromatografi Lapis Tipis (KLT)
Keberadaan asam klavulanat dapat ditunjukkan dengan zona berwarna merah gelap pada pelat KLT setelah diberi pereaksi TTC dan dipanaskan (Reading & Cole 1976). Zona merah terbentuk akibat reduksi cincin tetrazolium pada reagen TTC menjadi turunan formazan. Kondisi ini dimanfaatkan untuk menyelidiki keberadaan asam klavulanat dalam filtrat kultur IVNF1-1. Elusi dilakukan dengan menggunakan n-butanol:asam asetat:air (1:5:3) yang diperoleh dari optimasi fase gerak (Lampiran 7).
Kepolaran asam klavulanat akibat keberadaan gugus hidroksil dari alkohol dan gugus karboksil dari asam karboksilat menyebabkan interaksi yang kuat dengan eluen polar. Asam klavulanat bergerak bersama eluen polar di sepanjang fase diam silika gel. Silika gel digunakan karena bersifat asam sehingga interaksi asam basa antara asam klavulanat dengan fase diam dapat dihindari.
Hasil pemisahan yang diperoleh menunjukkan zona merah gelap dengan nilai Rf sebesar 0,6 (Gambar 9). Zona ini
menunjukkan keberadaan asam klavulanat dalam filtrat biakan IVNF1-1.
Gambar 9 Kromatografi lapis tipis filtrat kultur IVNF1-1.
Metode Kirby- Bauer
Asam klavulanat mampu mempertahankan aktivitas anti-β-laktamase pada suhu tinggi, sementara BLIP merupakan senyawaan protein yang dapat terdenaturasi dan kehilangan aktivitasnya pada suhu di atas 60 °C. Filtrat kultur IVNF1-1 yang telah
0,14 16
0 2 4 6 8 10 12
waktu retensi (jam)
A
2
80 n
m
dipanaskan pada suhu 98 oC selama 4 menit diuji kemampuan hambatannya terhadap EPEC K1-1 (Gambar 10). Zona bening terbentuk pada filtrat kultur tanpa perlakuan (cakram nomor 1) dan filtrat kultur dipanaskan (cakram nomor 2) dengan diameter masing-masing 6,5 mm dan 6 mm. Ini menunjukkan bahwa aktivitas hambatan filtrat kultur IVNF1-1 terhadap pertumbuhan EPEC K1-1 tidak mengalami perubahan signifikan akibat pemanasan. Artinya filtrat kultur IVNF1-1 mengandung senyawa yang dapat mempertahankan aktivitas hambatannya pada suhu tinggi. Berdasarkan sifat tahan pada suhu tinggi, diduga IVNF1-1 mengandung asam klavulanat. Dugaan tersebut didukung oleh zona bening dengan diameter 3 mm yang dibentuk ekstrak asam klavulanat filtrat kultur IVNF1-1 (cakram nomor 3). Kondisi ini sesui dengan hasil penelitian Doran et al. tahun 1990 yang mengungkapkan bahwa dalam filtrat kultur Streptomyces dapat ditemukan BLIP juga asam klavulanat sebagai senyawa anti-β-laktamase secara bersamaan.
Gambar 10 Bioasai difusi agar EPEC K1-1, filtrat tanpa perlakuan (1), filtrat dipanaskan pada 98 oC 4 menit (2), ekstrak asam klavulanat (3).
Deteksi Gugus Fungsi Ekstrak Asam Klavulanat dengan Sfektrofotometri Inframerah Transformasi Fourier (FTIR)
Penentuan jenis gugus fungsi dalam estrak asam klavulanat kering dilakukan dengan analisis FTIR. Spektrum yang dihasilkan ( Lampiran 8) memiliki puncak serapan yang lebar pada daerah 3424 cm-1 dan pada daerah sidik jari 1073 cm-1 menunjukkan keberadaan gugus OH alkohol yang mampu berikatan hidrogen. Puncak spektrum yang berurutan pada daerah 1379 cm-1 dan 1073 cm-1 menunjukkan keberadaan alkohol sekunder.
Puncak spektrum pada daerah 2923 cm-1 dan 2859 cm-1 menunjukkan ulur C-H SPP
3
alkana. Spektrum pada daerah 1627 cm-1 menunjukkan ulur C=C. Daerah sidik jari 853
cm-1 menunjukkan gugus fungsi tekuk C-H yang menjadi ciri spesifik gugus .
C
Puncak spektrum pada daerah 1722 cm-1 menunjukkan keberadaan cincin laktam (Brown et al. 1988). Pada daerah 1458 cm-1 terbentuk puncak spektrum yang menunjukkan keberadaa garam (anion) karboksilat (Brown et al.1988).
Gugus fungsi spektrum FTIR ekstrak filtrat kultur IVNF1-1 menunjukkan komponen gugus fungsi struktur asam klavulanat. Diduga filtrat kultur IVNF1-1 mengandung asam klavulanat sebagai senyawa anti-β-laktamase.
Identifikasi Asam Klavulanat sebagai Senyawa Alkaloid
Struktur asam klavulanat (Gambar 2) mengandung nitrogen dalam cincin heterosiklik. Nitrogen tersebut tidak berada sebagai nitro maupun diazo. Kondisi ini menimbulkan dugaan bahwa asam klavulanat merupakan senyawa dari golongan alkaloid.
Hasil uji fitokimia filtrat kultur IVNF1-1 yang telah dipekatkan tidak menunjukkan endapan jingga, putih, dan coklat ketika diberi pereaksi dragendorf, mayer, dan wagner (Gambar 11). Hal ini menunjukkan hasil negatif alkaloid, sehingga asam klavulanat belum dapat dibuktikan sebagai senyawa alkaloid.
Gambar 11 Uji alkaloid filtrat kultur IVNF1-1.
SIMPULAN DAN SARAN
Simpulan
EPEC K1-1 merupakan bakteri patogen penyebab diare yang tumbuh sangat cepat. EPEC K1-1 bersifat resisten terhadap antibiotik β-laktam. Mekanisme resistensi
CH
1
2
EPEC K1-1 terjadi melalui produksi β -laktamase secara ekstraselular.
Filtrat kultur IVNF1-1 mengandung senyawa protein yang mampu mengatasi resistensi EPEC K1-1 terhadap antibiotik β -laktam dengan menghambat aktivitas β -laktamase EPEC K1-1. Nilai hambatan protein filtrat kultur ditentukan melalui metode Sawai et al. sebesar 84,12% dengan konsentrasi protein 0,0646 x 10-1 mg/ml filtrat kultur. Hambatan dapat dipertahankan (tidak hilang) selama proses pemurnian. BLIP hasil pemurnian melalui pengendapan amonium sulfat, dialisis, dan filtrasi gel memberikan hambatan terhadap aktivitas β-laktamase sebesar 11,10% dengan konsentrasi protein sebesar 0,0222 x 10-1 mg/ml.
Selain menghasilkan BLIP, IVNF1-1 juga memproduksi asam klavulanat. Zona merah tua pada pelat KLT, zona bening ekstrak asam klavulanat, dan puncak serapan spektrum FTIR menunjukkan bahwa filtrat kultur IVNF1-1 mengandung asam klavulanat sebagai senyawa anti-β-laktamase.
Uji fitokimia terhadap filtrat kultur IVNF1-1 menunjukkan hasil negatif alkaloid. Artinya asam klavulanat belum dapat dibuktikan sebagai senyawa alkaloid walaupun memiliki nitrogen bukan nitro dan bukan diazo dalam cincin heterosiklik.
Saran
Berkaitan dengan rendahnya kadar BLIP yang dihasilkan, optimasi produksi IVNF1-1 dalam rangka meningkatkan kadar senyawa anti-β-laktamase perlu dilakukan. Optimasi dapat meliputi media, aerasi, dan waktu produksi.
Pencucian protein hasil pengendapan amonium sulfat perlu dilakukan sebelum pengukuran kadar protein Bradford 1976. Hal ini bertujuan menghindari kesalahan positif dalam penentuan kadar protein. Pencucian sebaiknya dilakukan dengan larutan dapar fosfat agar denaturasi protein akibat perubahan pH dapat dihindari.
Upaya penentuan bobot molekul BLIP melalui SDS-PAGE perlu dilakukan dengan pewarnaan perak nitrat. Perak nitrat memiliki limit deteksi lebih baik sehingga kadar protein rendah (nanogram) dapat dideteksi.
Ekstraksi dan deteksi alkaloid dari filtrat kultur IVNF1-1 perlu dilakukan dengan menggunakan metode lain yang lebih sensitif. Hal ini dilakukan agar alkaloid dapat terdeteksi sekalipun berada dalam kadar cukup rendah.
Kajian lebih lanjut berupa uji klinis terhadap senyawa anti-β-laktamase IVNF1-1 perlu dilakukan. Hal ini dimaksudkan untuk mengetahui kemungkinan penggunaan senyawa anti-β-laktamase IVNF1-1 dalam mengatasi penyakit diare.
DAFTAR PUSTAKA
Andri C. 2004. Kajian potensi Streptomyces sp. PS 1-4 sebagai penghasil senyawa bioaktif pengendali bakteri patogen tanaman kedelai. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bettelheim KA. 1992. The Prokaryotes. Volume ke-4. New York: Springer-Verlag.
Bradford M. 1976. A rapid, sensitive method for the quantitation of microgram quantities of protein using the principle of protein-dye binding. Anal Biochem 72:248-254.
Brown DW, Floyd AJ, Sainsbury M. 1988. Organic Spectroscopy. New York: John Wiley & Sons.
Butterworth D, Cole M, Hanscomb G, Rolinson GN. 1979. Olivanic acids, a family of β-lactam antibiotics with β -lactamase inhibitory properties produced by Streptomyces species detection, properties and fermentation studies. J Antibiot 32: 287-294.
Bush K, Jacoby GA, Medeiros AA. 1995. A functional classification scheme for β -lactamases and its correlation with molecular structure. Antimicr Agent Chem 39:1211-1233.
Chen CCH, Rahil J, Pratt RF, Herzberg O. 1993. Structure of a phosphonate-inhibited β-lactamase an analog of the tetrahedral transition state/intermediate of β-lactam hydrolysis. J Mol Biol 234:165-178.
Desriani. 2004. Penapisan isolat Streptomyces spp. penghasil protein penghambat β -laktamase. Hayati 11:88-92.
/enterohemorrhagic Escherichia coli. The J Clin Investig 107:539-548. Doran JL, Leskiw BK, Aippersbach S, Jensen
SE. 1990. Isolation and characterization of a β-lactamase inhibitory protein from Streptomyces clavuligerus and cloning and analysis of the corresponding gene. J Bacteriol 174:4909-4918.
Georgepapadakou NH. 1993. Penicillin-binding proteins and bacterial resistance to β-Lactams. Antimicr Agent Chem 37:2045-2053.
Howard TT. 1979. Beta-lactamase inhibitors and process for their preparation. US Patent 4140764. Copyright 2004-2005 FreePatentsOnline.com. [4 April 2005].
Ifdal. 2003. Interaksi antara Streptomyces sp. dengan Bacillus subtilis, Xantomonas campestris pv glycine, Rhizobia dan Pseudomonas sp. MK 1. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kahan KS, Kahan FM, Goegelman R. 1979. Thienamycin, a new β-lactam antibiotic discovery, taxonomy, isolation and physical properties. J Antibiot 32: 1-12. Kang SG, Park HU, Lee HS, Kim HT, Lee
KJ. 2000. New β-lactamase inhibitory protein (BLIP-1) from Streptomyces exfoliatus SMF 19 and its roles on the morphological differentiation. J Biol Chem 275(22):16851-16856.
Kim MK, Lee KJ. 1994 Characteristics of β -lactamase-inhibiting protein from Streptomyces exfoliatus SMF 19. Appl Environ Microbiol 60:1029-1032.
Lee WS, Komarmy L. 1981. Iodometric spot test for detection of beta-lactamase in Haemophilus influenzae. J Clin Microbiol 13: 224-225.
Madigan MT, Martinko JM, Parker J. 2000. Biology of Microorganisms. New Jersey: Prentice-Hall.
Nataro JP, Kaper JB. 1998. Diarrheagenic Escherichia coli. Clin Microbiol 11: 142-201.
Ogarawa H, Kawamura N, Kudo T, Suzuki KI, Nakase T. 1999. Distribution of β -lactamases in Actinomycetes. Antimicr Agent Chem 43:3014-3017.
[PPM, PLP] Pemberantasan Penyakit Menular Departemen Kesehatan RI. 2004. Diare. [terhubung berkala]. www. Depkes RI.com [1 April 2005].
Reading C, Cole M. 1977. Clavulanic acid: a β-lactamase-inhibiting β-lactam from Streptomyces clavuligerus. Antimicr Agent Chem 11:852-857.
[RSPI-SS] Rumah Sakit Penyakit Infeksi Prof. Dr. Sulianti Saroso. 2004. Diare. [terhubung berkala]. Info@infeksi.com
[29 Jan 2005].
Sawai T, Takahashi I, Yamagishi S. 1978. Iodometric assay method for beta-lactamase with various beta-lactam antibiotics as substrates. Antimicr Agent Chem 13:910-913.
Lampiran 1 Komposisi media peremajaan dan produksi
a. Media Kim & Lee
No. Jenis bahan Jumlah (g) per liter media
1 Glukosa 15
2 NH4Cl 4
3 NaH2PO4 1,5
4 K2HPO4 3,4
5 MgSO4.7H2O 0,23
6 CoCl2 0,0004
7 FeSO4.7H2O 0,007
8 MnCl2.4H2O 0,002
9 CaCl2.2H2 0,011
10 ZnSO4.7H2O 0,02
11 CuSO4.5H2O 0,0004
b. Media yeast malt agar (YM)
No. Jenis bahan Jumlah (g) per liter media
1 Glukosa 4
2 Ekstrak ragi 4
3 Ekstrak malt 10
4 Agar 15
c. Media yeast malt broth (YMB)
No. Jenis bahan Jumlah (g) per liter media
1 Glukosa 4
2 Ekstrak ragi 4
3 Ekstrak malt 10
d. Media nutrient agar (NA) Digunakan media siap pakai.
Lampiran 2 Bagan alir penelitian
Konfirmasi mekanisme resistensi EPEC K1-1
Peremajaan IVNF1-1
Peremajaan dan penentuan kurva tumbuh EPEC K1-1
Produksi IVNF1-1
Produksi dan isolasi β-laktamase
dari EPEC K1-1
Analisis daya hambat IVNF1-1 terhadap β -laktamase EPEC K1-1
Ekstraksi asam klavulanat
Filtrasi gel Dialisis Pengendapan
amonium sulfat
BLIP
KLT
Asam klavulanat Metode
Kirby-Bauer Filtrat
kultur Uji
alkaloid
Penetapan protein dan asam
amino
β-laktamase
Lampiran 3 Penentuan aktivitas β-laktamase dan daya hambat IVNF1-1 terhadap aktivitas β-laktamase EPEC K1-1
Sampel Absorbansi
Blanko A 0,6860
Blanko B 0,7280
β-laktamase ekstraselular 0,6900
β-laktamase:filtrat kultur IVNF1-1 (1:1) 0,7220
Aktivitas β-laktamase (unit/ml)
= Absorbansi blanko B – Absorbansi enzim x 40 x 1 x 1 Absorbansi blanko A F T V
F = konsumsi mol I2 per mol substrat T = waktu reaksi enzimatis (menit) V = volume enzim yang digunakan (ml)
Aktivitas β-laktamase (unit/ml) = 0,7280 – 0,6900 x 40 x 1 x 1 (A) 0,6860 454,55 20 1,25
= 1,94 x 10-4 unit/ml
Aktivitas β-laktamase setelah penambahan filtrat kultur IVNF1-1 (1:1) (unit/ml) (B) = 0,7280 – 0,7220 x 40 x 1 x 1 0,6860 454,55 20 1,25
= 3,08 x 10-5 unit/ml
Penghambatan filtrat kultur IVNF1-1 terhadap aktivitas β-laktamase (%) = A – B x 100%
A
= (1,94 x 10-4 – 3,08 x 10-5) unit/ml x 100% 1,94 x 10-4 unit/ml
Lampiran 4 Pengukuran kadar protein dengan metode Bradford 1976
Jenis sampel Konsentrasi protein
(x10-1 mg/ml)
Kadar protein ( mg)
Filtrat kultur 0,0646 6,4612 x 10-1
Pengendapan amonium sulfat 1,6373 1,6373
Dialisis 0,2983 1,4916 x 10-1
Fraksi aktif 0,0222 1,1106 x 10-2
Filtrat kultur IVNF1-1
Konsentrasi protein (mg/ml) A terkoreksi
0.00 0.0000 0,01 0,0725 0,02 0,1825 0,04 0,2455 0,06 0,3255 0,08 0,3895 0,10 0,4155 Filtrat kultur IVNF1-1 0,0785
y = 4,0859x + 0,0521
0 0,1 0,2 0,3 0,4 0,5
0 0,05 0,1 0,15
Kadar protein (mg/ml)
A
b
s
o
rb
an
si
R = 96,81%
Y = 4,0859X + 0,0521 0,0785 = 4,0859X + 0,0521 X = 6,4612 x 10-3
Konsentrasi protein filtrat kultur IVNF1-1 = 6,4612 x 10-3 mg/ml
Jumlah (kadar) protein filtrat kultur IVNF1-1 = konsentrasi protein x volume filtrat
= 6,4612 x 10-3 mg/ml x 100 ml
Protein hasil pengendapan amonium sulfat
Konsentrasi protein (mg/ml) A terkoreksi
0,00 0,0000 0,01 0,0855 0,02 0,1845 0,04 0,3145 0,06 0,4225 0,08 0,4875 0,10 0,4900 Protein hasil pengendapan amonium sulfat 0,1415
y = 5,0875x + 0,0582
0 0,1 0,2 0,3 0,4 0,5 0,6
0 0,02 0,04 0,06 0,08 0,1 0,12
Konsentrasi protein (mg/ml)
A
b
s
o
rb
an
si
R = 96,24%
Y = 5,0875X + 0,0582 0,1415 = 5,0875X + 0,0582 X = 1,6373 x 10-2 mg/ml
Konsentrasi protein amonium sulfat = 1,6373 x 10-2 mg/ml x fp
= 1,6373 x 10-2 mg/ml x 10
= 1,6373 x 10-1 mg/ml
Kadar protein amonium sulfat = konsentrasi protein x volume filtrat
= 1,6373 x 10-1 mg/ml x 10 ml
= 1,6373 mg
Protein hasil dialisis
Konsentrasi protein (mg/ml) A terkoreksi
y = 4,0796x + 0,0718
0 0,1 0,2 0,3 0,4 0,5 0,6
0 0,05 0,1 0,15
Konsentrasi protein (mg/ml)
A
b
so
rb
an
si
R = 94,33%
Y = 4,0796X + 0,0718 0,1935 = 4,0796X + 0,0718 X = 2,9831 x 10-2
Konsentrasi protein dialisis = 2,9831 x 10-2 mg/ml
Jumlah (kadar) protein dialisis = konsentrasi protein x volume filtrat
= 2,9831 x 10-2 mg/ml x 5 ml
= 1,4916 x 10-1 mg
Fraksi teraktif filtrasi gel (BLIP)
Konsentrasi protein (mg/ml) A terkoreksi
0,00 0,0000 0,01 0,0855 0,02 0,1845 0,04 0,3145 0,06 0,4225 0,08 0,4875 0,10 0,4900 Kelompok fraksi teraktif pemurnian dengan filtrasi gel 0,0695
y = 5,0875x + 0,0582
0 0,1 0,2 0,3 0,4 0,5 0,6
0 0,02 0,04 0,06 0,08 0,1 0,12
Konsentrasi protein (mg/ml)
A
b
so
rb
an
si
R = 96,24%
Konsentrasi protein fraksi aktif = 2,2211 x 10-3 mg/ml
Kadar protein fraksi aktif = konsentrasi protein x volume filtrat
= 2,2211 x 10-3 mg/ml x 5 ml
Lampiran 5 Penentuan asam amino protein IVNF1-1 hasil dialisis dengan kromatografi cair kinerja tinggi (HPLC)
Asam amino standar
No. Jenis asam amino Waktu retensi
(menit)
Luas area
1 Asam aspartat 1,700 477745
2 Asam glutamat 2,275 485073
3 Serina 4,700 582948
4 Histidina 5,817 375199
5 Glisina 6,750 574139
6 Treonina 7,167 540890
7 Arginina 9,533 484624
8 Alanina 10,175 436173
9 Tirosina 11,567 406108
10 Metionina 14,967 280514
11 Valina 15,275 495864
12 Fenilalanina 16,317 331181
13 Isoleusina 17,842 457029
14 Leusina 18,517 392442
15 Triptofan 20,283 92635
16 Lisina 21,125 194843
Kromatogram standar asam amino hidrolisis basa.
Asam amino protein IVNF1-1 hasil dialisis
No. Jenis asam amino Waktu retensi
(menit)
Luas area Konsentrasi (% b/b)
1 Asam aspartat 1,625 33515 0,67
2 Asam glutamat 2,167 40895 0,89
3 Serina 4,417 27680 0,36
4 Histidina 5,492 6923 0,21
5 Glisina 6,408 44805 0,42
6 Treonina 6,842 24146 0,38
7 Arginina 9,250 28571 0,73
8 Alanina 9,908 36117 0,53
9 Tirosina 11,375 6459 0,21
10 Metionina 14,75 4745 0,18
11 Valina 15,092 31880 0,54
12 Fenilalanina 16,117 7485 0,26
13 Isoleusina 17,625 14733 0,30
14 Leusina 18,317 21783 0,52
15 Triptofan 20,493 1913 Tidak terdeteksi
16 Lisina 21,050 9009 0,48
Contoh perhitungan asam amino fenilalanina
Konsentrasi asam amino (μmol/ml) = luas puncak sampel x konsentrasi standar luas puncak standar
= 7485 x 0,5 μmol/ml
331181
= 0,011 μmol/ml
Jumlah asam amino (μmol) = luas puncak sampel x jumlah standar luas puncak standar
= 7485 x 0,5 μmol/ml x 5 ml
331181
Konsentrasi asam amino (% b/b) = μmol AA x BM AA x 100
μg sampel
= 0,056 x 153 x 100
3,29 x 103
= 0,26% b/b
BM AA = Bobot molekul asam amino
Kromatogram sampel protein dengan hidrolisis asam.
Lampiran 6 Penentuan aktivitas β-laktamase dan daya hambat kelompok fraksi filtrasi gel terhadap aktivitas β-laktamase EPEC K1-1
Sampel Absorbansi Aktivitas enzim
(x 10-4 U/ml)
Blanko A 0,6960 -
Blanko B 0,7080 -
β-laktamase 0,6900 0,91
β-laktamase:kelompok fraksi 1 (1:1) 0,6920 0,80 β-laktamase:kelompok fraksi 2 (1:1) 0,6700 1,92 β-laktamase:kelompok fraksi 3 (1:1) 0,6800 1,42 β-laktamase:kelompok fraksi 4 (1:1) 0,6780 1,51 β-laktamase:kelompok fraksi 5 (1:1) 0,6760 1,62 β-laktamase:kelompok fraksi 6 (1:1) 0,6700 1,92 β-laktamase:kelompok fraksi 7 (1:1) 0,6640 2,22
Aktivitas β-laktamase (unit/ml)
= Absorbansi blanko B – Absorbansi enzim x 40 x 1 x 1 Absorbansi blanko A F T V
F = konsumsi mol I2 per mol substrat T = waktu reaksi enzimatis (menit) V = volume enzim yang digunakan (ml)
Aktivitas β-laktamase setelah penambahan protein kelompok fraksi 1(1:1) (unit/ml) (B) = 0,7080 – 0,6920 x 40 x 1 x 1 0,6960 454,55 20 1,25
= 8,09x 10-5 unit/ml
Penghambatan fraksi teraktif filtrasi gel terhadap aktivitas β-laktamase (%) = (9,10 x 10-5 – 8,09 x 10 -5) unit/ml x 100%
Lampiran 7 Optimasi fase gerak KLT asam klavulanat
n-butanol asam asetat n-butanol:as.asetat n-butanol:as.asetat 12 : 3 6 : 3
n-butanol:as.asetat:air n-butanol:as.asetat:air n-butanol:as.asetat:air n-butanol:as.asetat:air 12 : 3 : 5 6 : 3 : 5 3 : 3 : 5 1 :5 : 3
Lampiran 8 Spektrum serapan FTI
N O
O
COOH
CH2OH
C
HC
C
OH
N
O
C O
O
-2HC OH