OLEH Saccharomyces cerevisiae
Oleh :
HENDRO SUBEKTI F34102014
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
OLEH Saccharomyces cerevisiae
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh :
HENDRO SUBEKTI F34102014
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PRODUKSI ETANOL DARI HIDROLISAT FRAKSI SELULOSA TONGKOL JAGUNG
OLEH Saccharomyces cerevisiae
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh:
HENDRO SUBEKTI F34102014
Dilahirkan di Pekalongan, 12 April 1984
Tanggal lulus : 17 November 2006
Disetujui,
Bogor, Desember 2006
ii
RINGKASAN
Jagung merupakan hasil pertanian yang sudah banyak dimanfaatkan untuk memenuhi kebutuhan industri maupun pangan. Produksi jagung di Indonesia pada tahun 2005 mencapai 12.523.894 ton (Anonima, 2006). Namun pemanfaatan jagung terbatas pada bijinya saja, sedangkan bagian-bagian lain seperti tongkol dan kulit (kelobot) belum dimanfaatkan secara optimal.
Tongkol jagung merupakan salah satu limbah lignoselulosik yang mengandung 40 persen selulosa (Irawadi, 1990). Selulosa dapat dimanfaatkan sebagai sumber karbon bagi pertumbuhan mikroorganisme. Kapang Trichoderma viride menghasilkan enzim selulolitik yang dapat mengkonversi selulosa menjadi gula-gula sederhana bagi pertumbuhannya. Selulosa juga berpotensi untuk dijadikan bahan baku dalam memproduksi etanol melalui biokonversi oleh mikroorganisme seperti Saccharomyces cerevisiae. Salah satu kendala dalam memproduksi etanol dari bahan lignoselulosik adalah perlakuan pendahuluan yang mahal seperti delignifikasi, pemisahan selulosa dari bahan lain dan hidrolisis.
Tujuan penelitian ini adalah menentukan keterkaitan penggunaan jenis substrat pada fermentasi etanol terhadap parameter fermentasi seperti pembentukan CO2, biomassa, kadar etanol, total asam dan pH serta menentukan keterkaitan konsumsi substrat terhadap produk atau biomassa pada masing-masing substrat.
Pada penelitian ini, proses delignifikasi dilakukan dengan menggunakan larutan NaOCl 1 persen, sedangkan pemisahan selulosa dari komponen lain seperti hemiselulosa menggunakan pelarut alkali yaitu NaOH 15 persen. Proses hidrolisis fraksi selulosa dilakukan dengan hidrolisis asam dan enzim. Pada hidrolisis asam digunakan HCl 1,5 persen selama 3 jam pada suhu 121°C, sedangkan hidrolisis enzim dilakukan dengan menumbuhkan kapang selulolitik Trichoderma viride ke substrat selulosa dalam bentuk kultivasi media padat. Fermentasi etanol dilakukan terhadap substrat hidrolisat asam dan enzim dengan pembanding sirup glukosa, pada konsentrasi substrat 10 persen dan lama fermentasi 60 jam. Selama fermentasi, dilakukan pengukuran laju pembentukan CO2. Pada awal dan akhir fermentasi dilakukan analisa total gula, gula pereduksi, pH, biomassa, total asam dan kadar ethanol. Selain itu, juga dilakukan perhitungan parameter kinetika fermentasi (Yx/s, Yp/s, and ds/s) pada akhir fermentasi.
iii
meskipun total asam yang terbentuk jauh lebih besar yaitu 0,3 persen yang mengalami penurunan dari 4,8 menjadi 3,41 sedangkan sirup hidrolisat asam yaitu dari 4,8 menjadi 2,59 dengan total asam 0,14 persen. Berdasarkan hasil analisa total gula dan gula pereduksi, diketahui bahwa konsumsi substrat tertinggi terjadi pada fermentasi sirup hidrolisat enzim sedangkan konsumsi substrat terendah terjadi pada fermentasi sirup glukosa. Kadar etanol tertinggi diperoleh dari fermentasi sirup hidrolisat enzim yaitu 14,22 g/l lebih tinggi dari fermentasi sirup glukosa yaitu 8,52 g/l sedangkan kadar terendah diperoleh dari fermentasi menggunakan sirup hidrolisat asam yaitu 2,42 g/l.
iv
SUMMARY
Corn is a crop which is widely used to meet both food and industrial needs. Corn production in Indonesia on 2005 is 12,523,894 ton (Anonima, 2006). Generally, the use of this crop is not maximal yet. It is limited on the use of corn seeds, but corncob and corn stover is not used optimally yet.
Corncob is one of lignocellulotic waste material containing 40 percent of cellulose (Irawadi, 1990). Cellulose can be used as a carbon source in growth process of microorganism. Trichoderma viride produces cellulotic enzyme which has capability to convert cellulose into simple sugars. Cellulose is also potential to be used as a main substrate on ethanol production through bioconversion process by microorganism such Saccharomyces cerevisiae. The obstacle on producing ethanol through that process is costly in the preliminary treatment, such as delignification, cellulose separation from other material, and hydrolysis process.
The objectives of this research are to determine the correlation of using variety substrates for ethanol fermentation process toward the fermentation parameters, such as CO2 formation, biomass, ethanol concentration, total acids and pH. Also to determine the correlation of substrate consumption to the product or biomass formation for each substrate.
On this research, delignification process was conducted by using a percent NaOCl solution. While, cellulose separation from other components, like hemicellulose, using alkali solution that is 15 percents NaOH. The hydrolysis of cellulose fraction was conducted through acid and enzymatic hydrolysis. Acid hydrolysis was conducted by the treatment of 1.5 percent HCl for 3 hours of autoclaving on 121oC and 1 kg/m2 of pressure. Enzymatic hydrolysis was conducted by using Trichoderma viride. This microorganism was grown on the cellulose substrate in solid-stated cultivation. Ethanol fermentation were conducted on submerged cultivation of acid and enzymatic hydrolyzates, and technical glucose fermentations for 60 hours and the CO2 formation rate was measured. Total sugar, reducing sugar, pH, Δbiomass, total acid, ethanol concentration were determined on the initial and final of fermentation stages. Fermentation yields parameters (Yx/s, Yp/s, and ds/s) were determined on the final of fermentation stages.
v
hydrolyzate was dropped from pH 4.8 to pH 2.59 with 0.14 percent of total acid. Total sugar and reducing sugar analysis showed that the highest substrate consumption was on the fermentation of enzymatic hydrolyzate, while the lowest one was on technical glucose. The higher ethanol concentration could be gained from the fermentation of enzymatic hydrolyzate that is 14.22 g/l. while ethanol concentration of technical glucose fermentation was 8.52 g/l. The lowest ethanol concentration was on the fermentation of acid hydrolyzate that is 2.42 g/l.
vi
Saya yang bertanda tangan di bawah ini menyatakan dengan
sebenar-benarnya bahwa skripsi dengan judul “ Produksi Etanol dari Hidrolisat Fraksi Selulosa Tongkol Jagung Oleh Saccharomyces cerevisiae” adalah hasil karya asli saya sendiri dengan arahan dosen pembimbing akademik, kecuali dengan jelas ditunjukkan rujukannya.
Bogor, Desember 2006 Yang membuat pernyataan,
vii
Penulis dilahirkan di Pekalongan, Jawa Tengah pada
tanggal 12 April 1984 dari ayah bernama Kasmuri dan ibu bernama Ruliyah. Penulis merupakan anak terakhir dari enam bersaudara. Riwayat pendidikan penulis dimulai pada tahun 1990 di Sekolah Dasar Negeri Legokclile I dan lulus pada tahun 1996. Pada tahun 1996 sampai 1999 penulis mengikuti pendidikan di Sekolah Lanjutan
Tingkat Pertama (SLTP) Negeri 1 Bojong, kemudian melanjutkan ke Sekolah Menengah Umum (SMU) Negeri 1 Kajen dari tahun 1999 sampai 2002.
Tahun 2002 penulis melanjutkan pendidikannya pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur USMI. Penulis melakukan praktek lapang di Pabrik Gula
viii
Puji syukur penulis panjatkan kehadirat Allah SWT, karena hanya dengan
rahmat-Nya penulis dapat menyelesaikan skripsi yang berjudul “Produksi Etanol dari Hidrolisat Fraksi Selulosa Tongkol Jagung Oleh Saccharomyces cerevisiae” ini dengan baik.
Skripsi ini merupakan salah satu syarat memperoleh gelar Sarjana Teknologi Pertanian pada Departemen Teknologi Industri Pertanian, Fakultas
Teknologi Pertanian, Institut Pertanian Bogor.
Terima kasih tak terhingga penulis tujukan kepada :
1. Dr. Ir. Titi Candra Sunarti, MSi yang telah banyak memberikan bimbingan dan petunjuk.
2. Ir. Andes Ismayana, MT dan Prayoga Suryadarma, STP, MT selaku dosen
penguji dalam ujian skripsi.
3. Bapak dan Ibu yang dengan penuh kasih sayang dan kesabaran memberikan bantuan moril dan materil untuk penyelesaian masa studi penulis.
4. Para laboran Laboratorium Departemen Teknologi Industri Pertanian yang telah banyak membantu.
5. Teman-teman seperjuangan (Ferry, Sita, Juari) yang telah memberikan masukan dan semangat kepada penulis.
6. Teman-teman Ar-rohman (Ipul, Farik, Dede, Arim, Makki, Parmadi, Rohmat, Farhan, Faslur dan sebagainya) yang telah memberikan masukan dan semangat
kepada penulis.
7. Semua pihak yang telah membantu terselenggaranya penelitian dan
penyelesaian skripsi ini.
Penulis sadar bahwa skripsi ini masih jauh dari sempurna, oleh karena itu kritik dan saran yang membangun sangat penulis harapkan demi sempurnanya
skripsi ini.
Bogor, Desember 2006
ix
C. DELIGNIFIKASILIMBAH LIGNOSELULOSA ... 7
D. PEMISAHAN (EKSTRAKSI) HEMISELULOSA ... 8
E. HIDROLISIS ASAM ... 9
F. HIDROLISIS ENZIM ... 12
G. FERMENTASI ETANOL ... 13
III. METODOLOGI PENELITIAN ... 17
A. BAHAN DAN ALAT ... 17
B. METODE PENELITIAN ... 18
1. Tahapan Penelitian ... 18
a. Karakterisasi Substrat ... 18
b.Penentuan Keterkaitan Jenis Substrat Terhadap Parameter Fermentasi ... 20
c. Penentuan Keterkaitan Konsumsi Substrat dengan Produk atau Biomassa ... 21
2. Prosedur Penelitian ... 21
IV. HASIL DAN PEMBAHASAN ... 24
A. KARAKTERISTIK SUBSTRAT ... 24
x
4. Karakteristik Hidrolisat ... 26
B.KETERKAITAN JENIS SUBSTRAT TERHADAP PARAMETER FERMENTASI... 28
1. Laju Pembentukan CO2 ... 29
2. Biomassa ... 33
3. Kadar etanol ... 34
4. Total Asam dan pH ... 34
C.KETERKAITAN KONSUMSI SUBSTRAT DENGAN PRODUK ATAU BIOMASSA ... 36
V. KESIMPULAN DAN SARAN ... . 38
A.KESIMPULAN ... . 38
B. SARAN ... 38
DAFTAR PUSTAKA ... 40
xi
Halaman
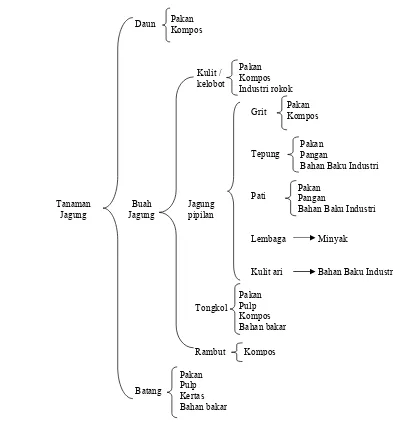
Gambar 1. Tanaman jagung (Zea mays L) ... 3
Gambar 2. Pohon industri jagung ... 4
Gambar 3. Rumus bangun selulosa (Achmadi, 1989) ... 6
Gambar 4. Skema reaksi terbentuknya HMF dari selulosa pada saat hidrolisis asam (Ulbricht et al., 1984) ... 10
Gambar 5. Mekanisme reaksi hidrolisis selulosa oleh asam (Humprey, 1979) .... 11
Gambar 6. Mekanisme reksi hidrolisis selulosa secara enzimatis (Enari, 1983) .. 13
Gambar 7. Skema fermentasi glukosa menjadi alkohol (Embden Meyerhof- Parnas Pathway) (Paturau, 1969) ... 16
Gambar 8. Tahapan penelitian ... 18
Gambar 9. Skema pengukuran laju pembentukan CO2 ... 20
Gambar 10. Diagram alir proses fermentasi etanol ... . 23
Gambar 11. Neraca massa ... 27
Gambar 12. Grafik laju rata-rata pembentukan CO2 selama fermentasi sirup glukosa, hidrolisat asam, dan hidrolisat enzim ... 30
xii
Halaman
Tabel 1. Karakteristik dan komposisi tongkol jagung ... 5 Tabel 2. Hasil analisis proksimat tongkol jagung manis ... 24 Tabel 3. Komposisi kimia tongkol jagung sebelum dan setelah delignifikasi ... 25 Tabel 4. Komposisi kimia tongkol jagung setelah delignifikasi dan setelah
separasi selulosa ... 25 Tabel 5. Hasil analisis total gula dan gula pereduksi ... 26 Tabel 6. Hasil analisis total biomassa, kadar etanol, total asam dan pH pada
xiii
Halaman
Lampiran 1. Prosedur analisis kimia tongkol jagung ... 44 Lampiran 2. Prosedur hidrolisis fraksi selulosa tongkol jagung ... 47 Lampiran 3. Prosedur analisis parameter fermentasi ... 49 Lampiran 4. Diagram alir penelitian proses produksi etanol dari hidrolisat
fraksi selulosa tongkol jagung. ... 52 Lampiran 5. Perhitungan kadar etanol ... 53 Lampiran 6. Hasil pengukuran laju pembentukan CO2 selama fermentasi ... 54 Lampiran 7. Hasil analisis total gula, gula pereduksi, biomassa, total asam
A. LATAR BELAKANG
Indonesia sebagai negara pertanian banyak memproduksi hasil pertanian
untuk tujuan komersial sebagai bahan baku industri. Kegiatan ini menghasilkan banyak limbah yang belum dimanfaatkan secara maksimal. Diantara bahan limbah yang jumlahnya besar adalah limbah lignoselulosik seperti tongkol jagung, sekam, jerami dan sebagainya.
Jagung merupakan hasil pertanian yang sudah banyak dimanfaatkan
untuk memenuhi kebutuhan industri maupun pangan. Produksi jagung di Indonesia pada tahun 2004 mencapai 11.225.243 ton dan meningkat 12.523.894 ton pada tahun 2005 (Anonima, 2006). Menurut Irawadi (1990), buah jagung terdiri dari 30 persen limbah berupa tongkol. Potensi tongkol jagung di Indonesia sebesar 30 persen yaitu 3,757 juta ton pada tahun 2005.
Jumlah ini adalah potensi yang besar dan harus dimanfaatkan secara optimal sehingga dapat meningkatkan nilai tambah limbah tersebut serta tidak menyebabkan pencemaran lingkungan. Tongkol jagung merupakan bagian dari buah jagung yang telah diambil bijinya. Menurut Irawadi (1990) tongkol jagung mengandung 40 persen selulosa, 36 persen hemiselulosa, 16 persen
lignin dan 8 persen zat-zat lain.
Sebagian dari limbah tongkol jagung umumnya dimanfaatkan sebagai pakan ternak dan bahan bakar. Garrote et., al (2002) sudah melakukan penelitian pemanfaatan tongkol jagung untuk produksi bahan pemanis seperti
xilooligosakarida yaitu dengan memanfaatkan fraksi hemiselulosa (xilan). Richana (2002) juga memanfaatkan xilan yang dihasilkan dari ekstraksi tongkol jagung sebagai media tumbuh mikroorganisme untuk produksi xilanase. Selain xilan, ekstraksi ini juga menghasilkan hasil samping berupa fraksi selulosa.
dengan jalan menghidrolisis baik secara asam maupun enzimatis menjadi gula-gula sederhana terutama heksosa (glukosa dan manosa).
Etanol diproduksi dengan memfermentasikan suatu bahan menggunakan
mikroorganisme yang dapat mengkonversi bahan tersebut menjadi alkohol. Salah satu mikroorganisme yang biasa digunakan untuk memproduksi etanol adalah Saccharomyces cerevisiae. Pada umumya kesulitan produksi alkohol dari bahan lignoselulosik seperti tongkol jagung adalah adanya perlakuan awal yang mahal seperti penghilangan lignin, pemisahan komponen dan hidrolisis
sebelum fermentasi. Dengan menggunakan perlakuan hidrolisis yang tepat, glukosa dapat diperoleh dengan tingkat konversi yang lebih tinggi. Dengan demikian proses konversi bahan lignoselulosik menjadi jauh lebih ekonomis (Tsao et al., 1978).
Melihat kondisi bahan baku yang potensial dan pemanfaatan fraksi
selulosa dari tongkol jagung yang kurang optimal serta adanya metode hidrolisis yang berbeda, maka diperlukan penelitian mengenai produksi etanol dari hidrolisat fraksi selulosa tongkol jagung.
B. TUJUAN
Tujuan dari penelitian ini adalah sebagai berikut :
1. Menentukan keterkaitan penggunaan jenis substrat pada fermentasi etanol terhadap parameter fermentasi seperti pembentukan CO2, biomassa, kadar etanol, total asam dan pH.
2. Menentukan keterkaitan konsumsi substrat terhadap pembentukan produk
II. TINJAUAN PUSTAKA
A. TANAMAN JAGUNG
Tanaman jagung (Zea mays L.) termasuk dalam famili rumput-rumputan (Gramineae). Tanaman ini di Indonesia sudah dikenal sejak 400 tahun lalu, yang pertama kali dibawa oleh bangsa Portugis dan Spanyol. Jagung merupakan tanaman penting kedua setelah padi yang sebagian besar ditanam di pulau Jawa, terutama di Jawa Timur.
Gambar 1. Tanaman jagung (Zea mays L)
Klasifikasi tanaman jagung (Zea mays L) Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Monocotyledonae
Bangsa : Graminales
Suku : Graminaeae
Marga : Zea
Jenis : Zea mays L. Deskripsi :
runcing, tepi rata, panjang 35-100 cm, lebar 3-12 cm, berwarna hijau. Bunga majemuk, berumah satu, bunga jantan dan betina berbentuk bulir, bunga terletak di ujung batang dan di ketiak daun, benang sari ungu, bakal buah
berbentuk bulat telur, berwarna putih. Buah berbentuk tongkol, panjang 8-20 cm, hijau kekuningan (Anonimb, 2006).
Jagung mempunyai potensi besar untuk dikembangkan menjadi beragam macam produk. Produk turunan potensial yang bisa dihasilkan dari komoditas jagung disajikan pada Gambar 2.
Garrote et al., (2002), menyatakan bahwa limbah buah jagung yaitu tongkol jagung dapat dimanfaatkan juga sebagai bahan baku industri dengan proses biomass refining berdasarkan separasi fraksi-fraksi kimianya.
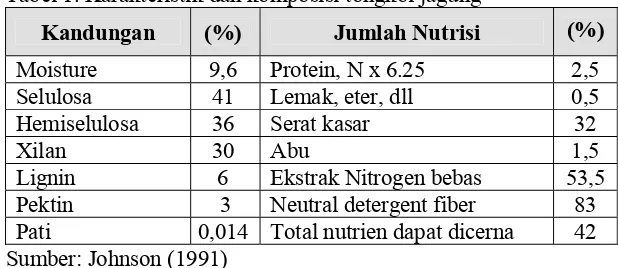
Menurut Irawadi (1990) tongkol jagung mengandung selulosa 40 persen (b.k), hemiselulosa 36 persen (b.k), lignin 16 persen (b.k) dan zat-zat lainnya 8 persen (b.k). Dengan komposisi kimia seperti ini maka tongkol jagung dapat digunakan sebagai sumber energi, bahan pakan ternak dan sebagai sumber karbon bagi pertumbuhan mikroorganisme (Tabel 1).
Selulosa adalah homopolisakarida dengan glukosa sebagai monomernya dan juga merupakan molekul organik yang terdapat pada tumbuhan, sedangkan hemiselulosa merupakan heteropolimer kompleks yang memiliki kandungan utama xilosa dan juga sejumlah arabinosa, manosa, glukosa dan galaktosa (Burchardt dan Ingram, 1992). Fengel dan Wegener (1995)
menyebutkan bahwa selain arabinosa, manosa dan glukosa, beberapa hemiselulosa juga mengandung galaktosa dan senyawa tambahan yaitu asam uronat. Lignin merupakan bahan organik bukan karbohidrat yang berbentuk amorf dan tersusun atas satuan-satuan fenol (Chang et al., 1981).
Salah satu mikroorganisme yang mampu memanfaatkan selulosa untuk
pertumbuhannya adalah kapang Trichoderma viride. Kapang ini menghasilkan enzim selulotik yang sangat efisien, terutama enzim yang mampu mengkatalisis reaksi hidrolisis kristal selulosa (Kosaric et al., 1983). Menurut Novianti (2004), tongkol jagung dari varietas yang berbeda mempunyai
kandungan komponen kimia yang berbeda-beda pula.
Tabel 1. Karakteristik dan komposisi tongkol jagung
Kandungan (%) Jumlah Nutrisi (%)
Pektin 3 Neutral detergent fiber 83
Pati 0,014 Total nutrien dapat dicerna 42
B. SELULOSA
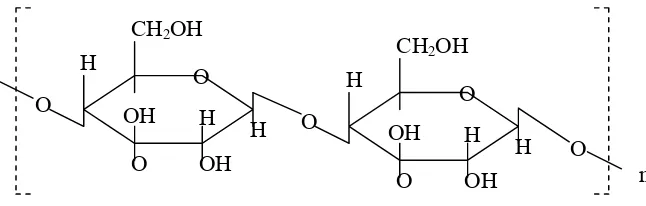
Selulosa adalah polimer glukosa yang membentuk rantai linier dan dihubungkan oleh ikatan -1,4 glikosidik. Struktur yang linier menyebabkan selulosa bersifat kristalin dan tidak mudah larut. Selulosa tidak mudah
didegradasi secara kimia maupun mekanis. Di alam, biasanya selulosa berasosiasi dengan polisakarida lain seperti hemiselulosa atau lignin membentuk kerangka utama dinding sel tumbuhan (Holtzapple, 1993).
Kebanyakan selulosa berasosiasi dengan lignin sehingga sering disebut sebagai lignoselulosa. Selulosa, hemiselulosa dan lignin dihasilkan dari proses
fotosintesis. Pada saat yang sama, komponen-komponen utama penyusun tanaman ini diuraikan oleh aktifitas mikroorganisme. Beberapa mikroorganisme mampu menghidrolisis selulosa untuk digunakan sebagai sumber energi, seperti bakteri dan fungi (Enari, 1983).
Rantai selulosa terdiri dari satuan glukosa anhidrida yang saling
berikatan melalui atom karbon pertama dan keempat. Ikatan yang terjadi adalah ikatan ß-1,4-glikosidik. Rumus bangun selulosa ditunjukkan pada Gambar 3.
Gambar 3. Rumus bangun selulosa (Achmadi, 1989)
Secara alamiah molekul-molekul selulosa tersusun dalam bentuk fibril-fibril yang terdiri dari beberapa molekul selulosa yang dihubungkan dengan
ikatan hidrogen. Fibril-fibril ini membentuk struktur kristal yang dibungkus oleh lignin. Komposisi kimia dan struktur yang demikian membuat kebanyakan bahan yang mengandung selulosa bersifat kuat dan keras. Sifat kuat dan keras yang dimiliki oleh sebagian besar bahan berselulosa membuat
bahan tersebut tahan terhadap peruraian secara enzimatik. Secara alamiah peruraian selulosa berlangsung sangat lambat (Fan et al., 1982).
Selulosa dapat dikonversi menjadi produk-produk bernilai ekonomi
yang lebih tinggi seperti glukosa, etanol dan pakan ternak dengan jalan menghidrolisis selulosa dengan bantuan selulase sebagai biokatalisator atau dengan hidrolisis secara asam/basa (Ariestaningtyas, 1991).
C. DELIGNIFIKASI LIMBAH LIGNOSELULOSA
Limbah lignoselulosik merupakan bahan yang mengandung lignin,
hemiselulosa dan selulosa. Fungsi lignin adalah mengikat sel-sel tanaman satu dengan lainnya dan sebagai pengisi dinding sel sehingga dinding sel tanaman menjadi keras, teguh dan kaku (Dellweg, 1983). Ingram dan Doran (1995) menyatakan bahwa selulosa dan hemiselulosa tidak dapat dikonversi secara langsung karena berasosiasi dengan lignin.
Menurut Fridia (1989), proses delignifikasi merupakan perlakuan pendahuluan terhadap bahan baku sehingga mempermudah pelepasan hemiselulosa. Proses ini berfungsi untuk membersihkan lignin. Berbagai perlakuan pendahuluan atau delignifikasi dapat dilakukan seperti fisik (penggilingan, pemanasan dengan uap, radiasi atau pemanasan dengan udara
kering) dan kimia (pelarut, larutan pengembang, gas SO2). Foody et al., (1999) menyatakan bahwa perlakuan pendahuluan dapat dilakukan dengan mengkombinasikan antara perlakuan fisik dan kimia. Perlakuan fisik seperti penggilingan, tekanan, pengepresan dan sebagainya sedangkan kimia seperti
penggunaan panas, pelarut dan asam.
Hidrolisis bahan lignoselulosik dapat dilakukan dengan asam atau enzim. Perlakuan awal terhadap substrat lignoselulosik diperlukan agar substrat mudah bereaksi dengan asam atau enzim. Perlakuan awal yang efisien harus dapat membebaskan struktur kristal selulosa dengan memperluas daerah
amorf serta membebaskan dari lapisan lignin.
D. PEMISAHAN (EKSTRAKSI) HEMISELULOSA
Ekstraksi adalah metode yang digunakan untuk mengeluarkan suatu komponen campuran dari zat padat atau zat cair dengan bantuan zat cair pelarut. Menurut Hespell (1998) ekstraksi hemiselulosa dapat menggunakan
beberapa pelarut seperti NaOH, NH4OH dan KOH. Di antara ketiga pelarut tersebut, yang paling baik digunakan adalah NaOH. Adapun keuntungannya yaitu xilan yang dihasilkan relatif bersih dari pengotor, mempunyai warna relatif lebih putih dibandingkan dengan pelarut-pelarut lainnya dan mudah larut dalam air (Anggraini, 2003 dan Widyani, 2002).
Hemiselulosa memiliki sifat-sifat yaitu tidak tahan terhadap perlakuan panas, strukturnya amorf dan mudah dimasuki pelarut, dapat diekstraksi menggunakan alkali dan ikatannya lemah sehingga mudah dihidrolisis. Berbeda dengan selulosa yang merupakan homopolisakarida, hemiselulosa merupakan heteropolisakarida (Fengel dan Wegener, 1995).
Ada tiga jenis selulosa yaitu α-selulosa, ß-selulosa dan -selulosa. Alfa selulosa adalah bagian yang tidak larut dalam alkali, ß-selulosa adalah bagian yang larut dalam alkali dan kemudian dapat mengendap jika ditambahkan asam, sedangkan -selulosa adalah bagian yang larut dalam alkali dan tetap larut walaupun ditambahkan asam (Fengel dan Wegener, 1995). Selama
ekstraksi hemiselulosa, sebagian selulosa ada yang larut terutama ß dan -selulosa.
Perlakuan pendahuluan terhadap bahan baku umumnya dapat menggunakan beberapa cara yaitu dengan pengecilan ukuran bahan,
pengeringan atau pelayuan dan fermentasi oleh mikroorganisme. Pengecilan ukuran bertujuan untuk memperluas permukaan bahan. Sabel dan Warren (1994) mengatakan bahwa kehalusan serbuk yang sesuai dapat menyebabkan ekstraksi berlangsung dengan sempurna dan dalam waktu yang singkat. Namun waktu ekstraksi yang terlalu singkat akan memberikan hasil yang
E. HIDROLISIS ASAM
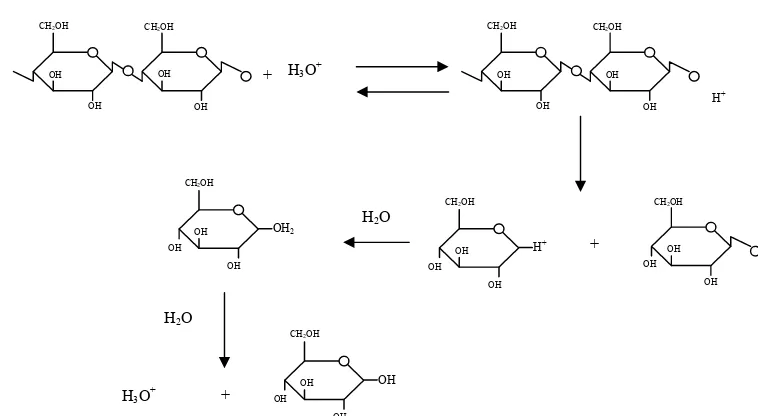
Menurut Grethlein (1978), konversi selulosa menjadi glukosa dapat dilakukan dengan menggunakan hidrolisis secara asam. Hidrolisis asam dapat dilakukan dengan menggunakan asam pekat H2SO4 72 persen atau HCl 42 persen pada suhu ruang. Selain itu juga dapat dilakukan dengan larutan asam 1 persen pada suhu 100°C sampai 120°C selama 3 jam atau lebih.
Menurut Kosaric et al., (1983) hidrolisis asam dapat dikategorikan melalui dua pendekatan umum, yaitu hidrolisis asam konsentrasi tinggi pada suhu rendah dan hidrolisis asam konsentrasi rendah pada suhu tinggi. Namun
karena harga asam kuat cukup mahal, hidrolisis selulosa dengan asam konsentrasi tinggi jarang diterapkan secara komersial. Pemilihan antara dua cara tersebut pada umumnya didasarkan pada beberapa pertimbangan yaitu laju hidrolisis, tingkat degradasi, produk dan biaya total proses produksi.
Hidrolisis asam konsentrasi tinggi akan lebih ekonomis jika asam dapat
diperoleh kembali (recovery). Akan tetapi, asam kuat bersifat korosif, sehingga memerlukan biaya tambahan untuk perawatan alat-alat produksi (Kosaric et al., 1983).
Asam yang biasa digunakan untuk menghidrolisis selulosa adalah asam sulfat, asam klorida, atau asam fosfat. Menurut Tsao et al., (1978), hidrolisis asam biasanya dilakukan dalam dua tahap untuk meminimumkan hasil samping yang tidak diinginkan. Kedua tahap tersebut adalah (1) tahap yang melibatkan asam encer, yaitu 1 persen H2SO4 pada 80-120°C selama 30-240 menit dan (2) tahap yang menggunakan asam lebih keras, yaitu 5-20 persen
H2SO4 dan suhu lebih tinggi mendekati 180°C. Tujuan tahap pertama adalah untuk mengekstrak fraksi hemiselulosa khususnya pentosa, sedangkan tahap kedua dilakukan untuk menghidrolisis selulosa membentuk glukosa. Dengan cara tersebut diusahakan suatu kondisi optimum untuk memaksimalkan hasil glukosa dan meminimumkan hasil samping yang tidak diinginkan.
reaktif, asam kuat juga menyebabkan degradasi glukosa hasil hidrolisis. (Tsao et al., 1978). Dunlop (1948) juga menambahkan bahwa hidrolisis asam terhadap bahan lignoselulosik pada suhu dan tekanan tinggi xilosa akan
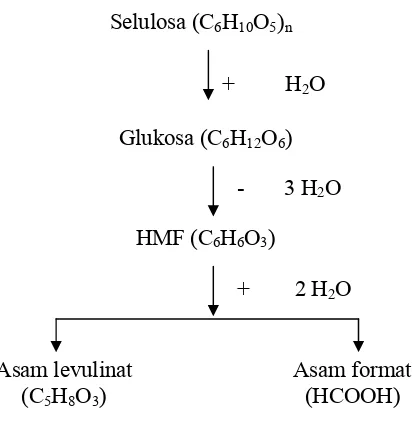
terdegradasi menjadi furfural. Lignin akan terdegradasi menjadi satuan-satuan fenol (Lapierre et al., 1983). Menurut Somaatmadja (1973), hidrolisis asam akan menyebabkan terjadinya perubahan warna sirup menjadi kekuning-kuningan. Hal ini disebabkan terbentuknya 5(hidroksi metil) furfural. Ulbricht et al., (1984) juga menjelaskan bahwa pada hidrolisis selulosa dengan asam untuk menghasilkan gula, 5-hidroksimetil-2-2 furfuraldehida atau disebut juga hidroksimetilfurfural (HMF) akan terbentuk dari penguraian glukosa pada suasana asam, HMF ini akan terus bereaksi membentuk asam-asam organik seperti asam levulinat dan asam format pada suasana asam dan suhu tinggi. Skema rekasi terbentuknya HMF dari selulosa pada saat hidrolisis asam
disajikan pada Gambar 4.
Pada umumnya komponen terlarut yang terdapat pada hasil hidrolisis asam adalah xilosa, glukosa, selobiosa, furfuraldehid, hidroksimetilfurfural dan asam-asam organik seperti asam format, asam levulinat serta asam asetat (Tsao et al., 1978). Mekanisme hidrolisis selulosa secara asam dilukiskan pada Gambar 5.
Gambar 4. Skema reaksi terbentuknya HMF dari selulosa pada saat hidrolisis asam (Ulbricht et al., 1984).
OH
Gambar 5. Mekanisme reaksi hidrolisis selulosa oleh asam (Humprey, 1979) Somaatmadja (1973), melakukan penelitian proses netralisasi sirup invert dengan menggunakan asam khlorida sebagai katalis dan larutan Na2CO3 sebagai bahan penetral. Hasil netralisasi dengan larutan ini menghasilkan
garam NaCl dalam jumlah yang relatif rendah. Oleh karena itu biasanya dibiarkan dalam larutan karena tidak banyak mempengaruhi rasa sirup yang dihasilkan.
Netralisasi yang menggunakan Na2CO3 sebagai bahan penetral menghasilkan garam NaCl yang tetap larut dalam sirup dan menghasilkan
H2CO3 yang selanjutnya terurai menjadi H2O dan CO2. Gas CO2 yang dihasilkan harus segera diuapkan untuk mencegah terbentuknya busa pada permukaan sirup. Penambahan Na2CO3 pada proses netralisasi diatur agar pH tidak melebihi 5,0 karena netralisasi di atas pH 5,0 menghasilkan sirup yang berwarna kuning kecoklatan. Pembentukan warna ini disebabkan oleh
terbentuknya senyawa hidroksi metil furfural (Somaatmadja, 1973).
Proses hidrolisis selulosa secara asam dibagi menjadi lima tahap yaitu pencampuran selulosa dan asam, hidrolisis, netralisasi, pemucatan, penyaringan dan pemekatan.
F. HIDROLISIS ENZIM
Enzim adalah katalis sangat spesifik yang membantu terjadinya reaksi-reaksi kimia dalam sistem biologis. Selulase adalah enzim yang dapat mengkatalis terjadinya reaksi hidrolisis selulosa menjadi glukosa. Keuntungan
hidrolisis enzim dibandingkan hidrolisis asam adalah kondisi reaksi lebih ringan dan tidak terjadi reaksi samping yang berarti. Hidrolisis selulosa dengan enzim merupakan metode yang sangat menarik dan obyek banyak penelitian dalam hal pemanfaatan limbah lignoselulosik (Gong dan Tsao, 1979).
Selulase adalah enzim yang diproduksi oleh banyak mikroorganisme. Trichoderma viride adalah kapang yang diisolasi dari tanah yang aktif dalam proses amonifikasi dan dekomposisi selulosa (Pelczar dan Reid, 1974). Mikroorganisme selulolitik mampu menghasilkan selulase kompleks, yaitu suatu campuran beberapa jenis selulase yang berbeda. Selulase kompleks
mampu menghidrolisis kristal selulosa menjadi gula-gula terlarut secara efisien (Gong dan Tsao, 1979).
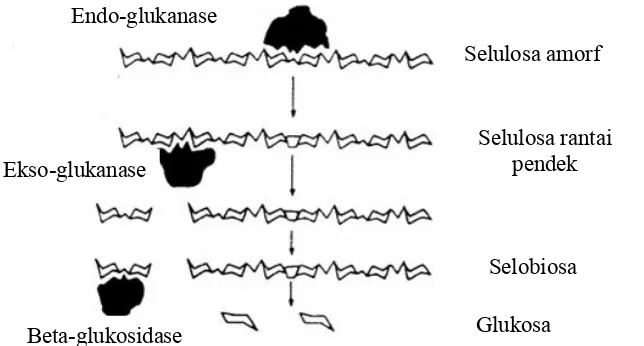
Tiga enzim utama yang terdapat dalam selulase kompleks adalah endoglukanase, eksoglukanase, dan selobiase ( -glukosidase). Endoglukanase menghidrolisis ikatan 1,4-ß-glikosidik secara acak pada daerah amorf selulosa
mengasilkan glukosa, selobiosa dan selodekstrin. Eksoglukanase menghidrolisis selodekstrin dengan memutus unit selobiosa dari ujung rantai polimer, sedangkan selobiase menghidrolisis selobiosa dan selo-oligosakarida menjadi glukosa (Jeewon, 1997). Mekanisme hidrolisis secara enzimatis
dilukiskan pada Gambar 6.
Gambar 6. Mekanisme reksi hidrolisis selulosa secara enzimatis (Enari, 1983).
G. FERMENTASI ETANOL
Fermentasi adalah suatu proses perubahan kimia pada substrat organik, baik karbohidrat, protein, lemak atau lainnya, melalui kegiatan katalis biokimia yang dikenal sebagai enzim dan dihasilkan oleh mikroba spesifik (Prescott dan Dunn, 1981).
Etil alkohol (CH3CH2OH) atau etanol sering disebut sebagai alkohol untuk menunjukkan sumber bahan baku yang digunakan atau tujuan umum penggunaannya. Grain alcohols adalah etanol yang dibuat dari biji-bijian seperti jagung, gandum atau beras, sedangkan Industrial alcohols adalah etanol yang dipakai untuk tujuan-tujuan industri (Prescott dan Dunn, 1981).
Khamir yang sering digunakan pada proses fermentasi etanol secara
industri adalah Saccharomyces cerevisiae, S. uvarum, Schizosaccharomyces sp. dan Kluyveromyces sp. Lachke (2002) menyatakan bahwa sejumlah besar bakteri juga mampu membentuk etanol sebagai produk utama, misalnya Clostridium dan Bacillus (B. macerans).
Khamir mampu mengkonsumsi berbagai substrat gula, tergantung
spesies yang digunakan. Secara umum, mikroorganisme ini dapat tumbuh dan memfermentasi etanol secara efisien pada pH 3,5-6,0 dan suhu 28-35°C. Walaupun laju awal produksi etanol meningkat pada suhu lebih tinggi, produktifitas keseluruhan menurun karena efek penghambatan etanol
Selulosa amorf
Selulosa rantai pendek
Selobiosa
Glukosa Endo-glukanase
Ekso-glukanase
meningkat (Ratledge, 1991). Menurut Paturau (1969), fermentasi etanol memakan waktu 30-72 jam. Frazier dan Westhoff (1978) menambahkan bahwa suhu optimum untuk fermentasi antara 25-30°C dan kadar gula antara
10-18 persen. Jika konsentrasi gula terlalu tinggi, aktivitas khamir dapat terhambat dan waktu fermentasi menjadi lebih lama serta tidak semua gula dapat difermentasi.
Saccharomyces cerevisiae adalah salah satu spesies khamir yang memiliki daya konversi gula menjadi etanol sangat tinggi. Mikroba ini
biasanya dikenal dengan baker’s yeast dan metabolismenya telah dipelajari dengan baik. Produk metabolik utama adalah etanol, CO2 dan air, sedangkan beberapa produk lain dihasilkan dalam jumlah sangat sedikit. Khamir ini bersifat fakultatif anaerobik. Saccharomyces cerevisiae memerlukan suhu 30°C dan pH 4,0-4,5 agar dapat tumbuh dengan baik. Selama proses
fermentasi akan timbul panas. Bila tidak dilakukan pendinginan suhu akan terus meningkat sehingga proses fermentasi terhambat (Oura, 1983).
Di samping kondisi lingkungan seperti suhu dan pH, kebutuhan nutrien dan kofaktor juga memegang peranan penting bagi kehidupan khamir. Sejumlah kecil oksigen harus disediakan pada proses fermentasi oleh khamir
karena oksigen merupakan komponen yang diperlukan dalam biosintesis beberapa asam lemak tidak jenuh. Biasanya diberikan tekanan oksigen 0,05-0,10 mmHg. Lebih besar dari nilai tersebut, konversi akan cenderung ke arah pertumbuhan sel (Kosaric et al., 1983).
Kebutuhan relatif nutrien sebanding dengan komponen utama sel khamir, yaitu mencakup karbon, oksigen, nitrogen dan hidrogen. Pada jumlah lebih rendah, fosfor, sulfur, potasium dan magnesium juga harus tersedia untuk sintesis komponen-komponen minor. Beberapa mineral (Mn, Co, Cu dan Zn) dan faktor pertumbuhan organik (asam amino, asam nukleat dan
komponen tunggal seperti garam amonium dan potasium fosfat atau dari sumber murah seperti corn steep liquor (Kosaric et al., 1983).
Pada permulaan proses, khamir memerlukan oksigen untuk
pertumbuhannya, oleh karena itu perlu diberikan oksigen. Sesudah terjadi
akumulasi CO2 dan reaksi berubah menjadi anaerob, alkohol akan
menghalangi fermentasi lebih lanjut setelah tercapai konsentrasi antara 13-15 persen volume dan biasanya maksimum 13 persen volume. Konsentrasi alkohol akan menghambat fermentasi tergantung pada suhu dan jenis khamir
yang digunakan (Prescott dan Dunn, 1981).
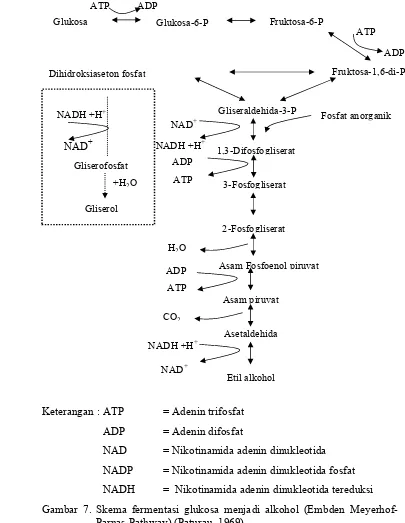
Pada kondisi anaerobik, khamir memetabolisme glukosa menjadi etanol sebagian besar melalui jalur Embden Meyerhof-Parnas. Skema fermentasi glukosa menjadi alkohol jalur (Embden Meyerhof-Parnas) disajikan pada Gambar 7. Secara ringkas pembentukan etanol dari glukosa sebagai berikut.
C6H12O6 2C2H5OH + 2CO2 : H = -31,2 kkal (glukosa) (etanol) (karbondioksida)
Setiap mol glukosa terfermentasi menghasilkan dua mol etanol, CO2 dan ATP. Oleh karena itu, secara teoritis setiap g glukosa memberikan 0,51 g etanol. Pada kenyataannya etanol biasanya tidak melebihi 90-95 persen dari hasil teoritis. Hal ini dikarenakan sebagian nutrisi digunakan untuk sintesa biomassa dan memelihara reaksi. Reaksi samping juga dapat terjadi, yaitu
Keterangan : ATP = Adenin trifosfat
ADP = Adenin difosfat
NAD = Nikotinamida adenin dinukleotida NADP = Nikotinamida adenin dinukleotida fosfat NADH = Nikotinamida adenin dinukleotida tereduksi Gambar 7. Skema fermentasi glukosa menjadi alkohol (Embden
Meyerhof-Parnas Pathway) (Paturau, 1969).
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
1. Bahan
a.Bahan Baku
Bahan baku yang digunakan dalam penelitian ini adalah tongkol jagung manis varietas Hawaii yang diperoleh dari daerah Leuwiliang
sedangkan mikroorganisme yang digunakan adalah Saccharomyces cerevisiae yang diperoleh dari laboratorium Mikrobiologi Pangan FATETA-IPB Bogor dan kapang Trichoderma viride yang berasal dari Balai Penelitian Bioteknologi dan Sumberdaya Genetika, Bogor.
b.Bahan Kimia
1. Bahan kimia untuk isolasi selulosa : NaOH 15 persen dan NaOCl 1 persen
2. Bahan kimia /nutrien untuk pertumbuhan : PDA, PDB, pepton, pupuk NPK dan ZA.
3. Bahan kimia untuk analisa : H2SO4 pekat, fenol 5 persen, NaOH 0,1 N, indikator fenolftalein, larutan DNS dan sebagainya.
2. Alat
B. METODE PENELITIAN
1. Tahapan Penelitian
Gambar 8. Tahapan penelitian
a.Karakterisasi Substrat
Pada tahap ini dilakukan persiapan bahan yang meliputi pembuatan
tepung tongkol jagung, karakterisasi bahan baku, karakterisasi bahan hasil delignifikasi, karakterisasi bahan hasil pemisahan fraksi selulosa, dan karakterisasi hidrolisat, selain itu juga dilakukan perhitungan neraca massa untuk mengetahui jumlah fraksi selulosa yang dapat diperoleh dari
tongkol jagung.
1)Karakterisasi Tongkol Jagung
Pada tahap ini dilakukan pengecilan ukuran tongkol jagung dengan ukuran 40 mesh. Selain itu juga dilakukan analisis proksimat yang meliputi kadar air, kadar abu, kadar serat kasar, kadar protein,
kadar lignin, kadar selulosa dan kadar hemiselulosa. Prosedur analisis proksimat bahan baku dapat dilihat pada Lampiran 1.
Karakterisasi Substrat
Penentuan keterkaitan jenis substrat terhadap parameter pembentukan CO2, biomassa, kadar etanol, total asam dan pH
Penentuan keterkaitan konsumsi substrat dengan produk atau biomassa (Yx/s, Yp/s, ds/s)
Mulai
2)Karakterisasi Bahan Hasil Delignifikasi
Pada tahap ini dilakukan delignifikasi dengan NaOCl 1 persen selama 5 jam pada 28 °C (Anggraini, 2003). Pada tahap ini juga dilakukan analisis bahan hasil delignifikasi yang meliputi kandungan lignin, hemiselulosa dan selulosa. Pengukuran kandungan lignin dilakukan dengan metode (AOAC, 1984) sedangkan hemiselulosa dan
selulosa dianalisa dengan metode Van Soest (Apriyantono et al., 1989). Prosedur analisa disajikan pada Lampiran 1.
3)Karakterisasi Bahan Hasil Pemisahan Fraksi Selulosa
Pada tahap ini dilakukan pemisahan antara selulosa dan hemiselulosa dengan perendaman dalam NaOH 15 persen selama 24
jam pada 28 °C. Analisis bahan hasil pemisahan fraksi selulosa meliputi kandungan hemiselulosa dan selulosa. Pengukuran kandungan hemiselulosa dan selulosa dilakukan dengan metode Van Soest (Apriyantono et al., 1989). Prosedur analisa disajikan pada Lampiran 1.
4)Karakterisasi Hidrolisat
Pada tahap ini dilakukan hidrolisis terhadap fraksi selulosa secara asam dan enzimatis. Metode hidrolisis asam yang digunakan adalah modifikasi metode hidrolisis asam oleh Anonim (1986) sedangkan hidrolisis enzimatis dilakukan dengan menumbuhkan
mikroba penghasil selulase (Trichoderma viride) secara langsung pada media selulosa yaitu dengan memodifikasi media Andreoti (Ariestaningtyas, 1991). Prosedur hidrolisis dapat dilihat pada Lampiran 2.
Pada tahap ini juga dilakukan pengukuran konsentrasi total
gula dan gula pereduksi hasil hidrolisis. Selain itu dilakukan proses penyiapan substrat untuk fermentasi yaitu pembuatan sirup dengan konsentrasi kurang lebih 10 persen dengan cara pemekatan.
Analisis total gula ditetapkan berdasarkan metode fenol sulfat
DNS (Miller, 1959). Prosedur penetapan total gula dan gula pereduksi disajikan dalam Lampiran 3.
b.Penentuan Keterkaitan Jenis Substrat Terhadap Parameter
Fermentasi (Pembentukan CO2, Biomassa, Kadar Etanol, Total
Asam dan pH)
Pada tahap ini dilakukan proses fermentasi menggunakan tiga jenis
substrat dengan tiga kali ulangan yaitu : A = Substrat glukosa
B = Substrat sirup hidrolisis asam C = Substrat sirup hidrolisis enzim
Analisa yang dilakukan meliputi pembentukan CO2, biomassa, kadar etanol, total asam dan pH.
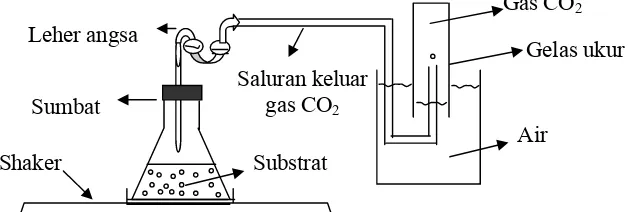
1.Pembentukan CO2
Laju pembentukan CO2, selama fermentasi diukur dengan mengeplotkan jumlah CO2 yang terukur terhadap waktu. Pengukuran dilakukan setiap 6 jam sampai akhir fermentasi jam ke-60. Laju pembentukan CO2 diukur dengan cara labu fermentor ditutup dengan sumbat yang terhubung dengan leher angsa. Leher angsa dihubungkan dengan saluran gas ke dalam gelas ukur berskala yang diletakkan
dalam air, gas CO2 yang terbentuk akan menekan air sehingga dapat dibaca dengan skala yang terdapat pada gelas ukur. Skema pengukuran laju pembentukan CO2 dapat dilihat pada Gambar 9.
Gelas ukur
Gambar 9. Skema pengukuran laju pembentukan CO2
2.Biomassa
Pengukuran biomassa dilakukan dengan menentukan bobot berdasarkan bobot kering pada awal dan akhir fermentasi. Prosedur
pengukuran biomassa dapat dilihat pada Lampiran 3.
3.Kadar Etanol
Pengukuran kadar etanol dilakukan dengan menggunakan Gas
Chromatografi. Prosedur pengukuran kadar etanol dapat dilihat pada Lampiran 3.
4.Total asam dan pH
Total asam diukur untuk menentukan jumlah total asam yang terbentuk selama fermentasi. Pengukuran dilakukan pada awal dan akhir fermentasi. Pengukuran total asam ditentukan dengan cara titrasi dan dinyatakan dalam persen asam laktat (Rinaldy, 1987). Prosedur
pengukuran total asam disajikan pada Lampiran 3. Pengukuran pH dilakukan untuk mengetahui perubahan pH selama fermentasi, pengukuran dilakukan dengan menggunakan pH meter.
c. Penentuan Keterkaitan Konsumsi Substrat dengan Produk atau
Biomassa
Pada tahap ini dilakukan penentuan keterkaitan konsumsi substrat baik terhadap pembentukan produk maupun biomassa pada masing-masing substrat, yaitu dengan menentukan yield baik terhadap produk (Yp/s) dan yield biomassa (Yx/s) selain itu juga dilakukan penentuan
efisiensi pemanfaatan substrat (ds/s).
2. Prosedur Penelitian
30°C sebelum diinokulasikan pada media cair PDB (Potatoe Dextrose Broth).
Sebelum fermentasi dilakukan, terlebih dahulu dilakukan penyiapan
inokulum (starter) dengan media cair PDB (Potatoe Dextrose Broth). Sebanyak 10 ml media cair disterilisasi terlebih dahulu, kemudian ± 3 jarum ose hasil biakan khamir diinokulasikan secara aseptis dan ditumbuhkan secara aerobik selama 24 jam menggunakan inkubator goyang pada 30°C atau suhu kamar.
Substrat fermentasi yaitu sirup glukosa sebanyak 100 ml dimasukkan dalam fermentor (labu Erlenmeyar 300 ml), kemudian ditambahkan pupuk NPK dan ZA masing-masing sebanyak 0,04 g dan 0,15 g, pH cairan substrat diatur 4,8 menggunakan Ca(OH)2 kemudian dipasteurisasi pada suhu 85°C selama 5 menit setelah itu didinginkan hingga 30°C. Starter
sebanyak 10 persen volume substrat ditambahkan. Fermentasi berlangsung pada kondisi anaerob. Labu ditutup dengan sumbat dan leher angsa yang dihubungkan dengan saluran pada gelas ukur dalam air untuk mengukur laju gas CO2 yang dihasilkan dari proses fermentasi. Proses fermentasi dilakukan pada inkubator goyang pada suhu ruang. Hasil fermentasi
Gambar 10. Diagram alir proses fermentasi etanol Penambahan nutrien/pupuk
0,04 g NPK dan 0,15 g ZA Pada 100 ml sirup
Pengaturan pH = 4,8
Pasteurisasi 85 °C, 5 menit
Inokulasi dengan starter
(10 % volume substrat)
Fermentasi
(kondisi anaerobik, suhu kamar)
Pasteurisasi 65 °C, 5 menit
Analisa produk
Kultur khamir pada PDA, inkubasi 48 jam,
aerobik, suhu kamar
Inokulasi pada PDB, 24 jam, aerobik, suhu
kamar Substrat 10%
Starter
IV. HASIL DAN PEMBAHASAN
A.KARAKTERISTIK SUBSTRAT
1.Karakteristik Tongkol Jagung
Karakterisasi bahan baku (analisis proksimat) tongkol jagung meliputi kadar air, kadar abu, kadar protein, kadar lemak dan kadar serat
kasar serta analisis kandungan dan komposisi serat seperti lignin, hemiselulosa dan selulosa. Hasil analisis proksimat tongkol jagung sebagai bahan baku utama penelitian ini dapat dilihat pada Tabel 2.
Tabel 2. Hasil analisis proksimat tongkol jagung manis
Komponen (% b.b) (% b.k)
Air 7,04 -
Abu 1,67 1,80
Lemak 4,68 5,03
Protein 1,82 1,96
Serat kasar 40,65 43,73
Karbohidrat by difference: 44,14 47,48
Keterangan : % b.b = presentase berdasarkan berat basah % b.k = presentase berdasarkan berat basah
Berdasarkan Tabel 2 dapat dilihat bahwa hasil analisis komposisi
kimia tongkol jagung berbeda dengan hasil analisis kimia yang dilakukan oleh Widyani (2002) yang menyatakan bahwa kadar air tongkol jagung 6,43 persen, kadar abu 1,86 persen dan kadar serat 25,43 persen. Perbedaan komposisi kimia tongkol jagung ini dipengaruhi oleh beberapa faktor seperti perbedaan varietas, tempat tumbuh, kelembaban dan cuaca saat
pemanenan.
2.Karakteristik Bahan Hasil Delignifikasi
Tabel 3. Komposisi kimia tongkol jagung sebelum dan setelah delignifikasi
Komponen Sebelum Delignifikasi
(% b.k)
Setelah Delignifikasi (% b.k)
Selulosa 60,04 41,88
Hemiselulosa 18,17 30,18
Lignin 16,14 15,2
Berdasarkan Tabel 3, dapat dilihat kadar lignin sebelum delignifikasi sebesar 16,14 persen sedangkan setelah delignifikasi sebesar 15,2 persen. Hal ini menunjukkan bahwa proses delignifikasi tidak dapat menghilangkan lignin secara keseluruhan. Jumlah lignin yang hilang selama delignifikasi masih sangat kecil jika dibandingkan penelitian yang dilakukan oleh
Widyani (2002) yaitu sebesar 13,68 persen.
3.Karakteristik Bahan Hasil Pemisahan fraksi Selulosa
Hasil analisa komposisi selulosa dan hemiselulosa setelah delignifikasi dan setelah separasi selulosa dapat dilihat pada Tabel 4.
Tabel 4. Komposisi kimia tongkol jagung setelah delignifikasi dan setelah separasi selulosa
Selulosa 41,88 52,53
Hemiselulosa 30,18 16,83
Berdasarkan Tabel 4, diketahui bahwa selulosa yang terbentuk setelah separasi lebih besar dibandingkan sebelum separasi (setelah delignifikasi). Kadar selulosa setelah separasi adalah sebesar 52,53 persen. Kenaikan kadar selulosa setelah separasi terjadi karena hemiselulosa dan
mungkin juga lignin larut dalam larutan NaOH akibatnya ampas/selulosa yang tidak terlarut menjadi lebih murni/bersih dari komponen yang lain (hemiselulosa dan lignin).
jagung. Neraca massa dalam penelitian ini dapat dilihat pada Gambar 11. Berdasarkan neraca massa pada Gambar 11, dapat dihitung bahwa fraksi selulosa yang dapat diperoleh dari tongkol jagung adalah sebesar 41,3
persen. Jumlah fraksi selulosa yang dihasilkan pada penelitian ini tidak jauh berbeda dengan pernyataan Irawadi (1990) yang menyatakan bahwa tongkol jagung terdiri dari 40 persen selulosa, 16 persen lignin, 36 persen hemiselulosa dan 8 persen bahan lainnya.
4.Karakteristik Hidrolisat
Hasil analisis total gula dan total gula pereduksi disajikan pada Tabel 5.
Tabel 5. Hasil analisis total gula dan gula pereduksi
Hidrolisis
Gula pereduksi setelah pemekatan
%b/v
Total gula setelah hidrolisis
%b/v
Hidrolisis asam 61,44 1,72
Hidrolisis enzim 72,20 3,39
Berdasarkan Tabel 5, hasil perhitungan total gula pada sirup hidrolisat enzim didapatkan konsentrasi gula sebesar 3,39 persen sedangkan konsentrasi gula yang dihasilkan dari hidrolisis asam yaitu 1,72 persen. Pada hidrolisis enzim konsentrasi gula lebih besar karena selulase yang dihasilkan oleh mikroba merupakan selulase komplek yang terdiri
dari endoglukanase, eksoglukanase dan selobiase ( -glukosidase), sehingga selulosa tongkol jagung tersebut dapat dihidrolisis dengan sempurna. Selain itu, hidrolisis secara enzimatis bersifat spesifik dan tidak terjadi degradasi produk sehingga konsentrasi gula yang dihasilkan akan lebih tinggi jika dibanding hidrolisis asam pada suhu tinggi. Mekanisme
hidrolisis enzim, selulase kompleks mampu menghidrolisis selulosa menjadi gula pereduksi (glukosa) dengan tingkat konversi yang tinggi. Selulase bersifat spesifik sehingga tidak menghidrolisis komponen yang
lain seperti hemiselulosa dan lignin. Pada hidrolisis secara asam, komponen lain seperti hemiselulosa dan lignin yang masih terdapat pada fraksi selulosa juga ikut terhidrolisis membentuk gula-gula non pereduksi. Asam bersifat tidak spesifik dan memotong secara acak ikatan glikosidik sehingga akan menghasilkan gula yang tidak seragam (monosakarida,
disakarida atau oligosakarida). Hal ini sesuai dengan pernyataan Olsson dan Hahn-Hägerdal (1996), bahwa perlakuan asam pada suhu tinggi terhadap bahan lignoselulosik akan menyebabkan pembentukan dan pelepasan komponennya. Hidrolisis selulosa akan menghasilkan glukosa sedangkan hemiselulosa akan menghasilkan xilosa, manosa, asam asetat,
galaktosa dan glukosa.
Air + Lignin (25426 g) Bubuk tongkol jagung 40
mesh (1000 g, k.a. 7,04%)
Perendaman dalam NaOCl 1% sebanyak 10 l (11165 g) selama 5 jam pada suhu 280C
Pencucian Air
(16000 g)
Penyaringan
Bubuk tongkol jagung terdelignifikasi (1739 g)
Pengeringan pada suhu 500C
selama 48 jam Air ( 833 g)
Bubuk tongkol jagung terdelignifikasi kering (906 g, k.a 7,89%)
Perendaman dalam NaOH 15% ( 3l = 3185 g) selama 24 jam pada suhu 280C
Gambar 11. Neraca massa
B. KETERKAITAN JENIS SUBSTRAT TERHADAP PARAMETER
FERMENTASI
Etanol dapat diproduksi dari selulosa dengan cara melakukan hidrolisis sehingga dihasilkan gula-gula sederhana yang dapat dikonversi oleh mikroorganisme. Salah satu mikroorganisme yang biasa digunakan dalam fermentasi etanol adalah Saccharomyces cerevisiae. Ratledge (1991), menyatakan bahwa Saccharomyces cerevisisae adalah mikroorganisme yang paling banyak digunakan dalam fermentasi heksosa (glukosa dan manosa). Saccharomyces cerevisisae dapat memproduksi etanol dari glukosa dan manosa jika konsentrasi gulanya tinggi dan pada kondisi anaerob.
Pada kondisi anaerob, metabolisme glukosa menjadi etanol melalui
jalur Embden Meyerhof-Parnas yang merupakan reaksi-reaksi fosforilasi dan defosforilasi dengan ATP dan ADP sebagai donor dan aseptor fosfat, rekasi pemecahan C6 menjadi 2 molekul C3 yang terfosforilasi, reaksi oksidasi-reduksi, dan reaksi dekarboksilasi.
Filtrat
Bubuk fraksi selulosa tongkol jagung (574 g)
Pengeringan pada suhu 500C
selama 48 jam Air (182 g)
Bubuk fraksi selulosa tongkol jagung kering (392 g, k.a 2,11%)
Air+NaOH (16815 g)
Glukosa mengalami fosforilasi menjadi glukosa-6-P dan fruktosa-6-P dengan ATP sebagai donor fosfat. Fruktosa-6-P kemudian menjadi fruktosa-1,6-di-P dengan ATP sebagai donor fosfat. Fruktosa-fruktosa-1,6-di-P kemudian
dipecah menjadi 2 molekul C3 yang terfosforilasi yaitu dihidroksiaseton fosfat dan gliseraldehida-3-P. Dihidroksi aseton fosfat selanjutnya teroksidasi menjadi gliserofosfat kemudian menjadi gliserol yang merupakan metabolit sekunder. Gliseraldehida-3-P tereduksi membentuk asam 1,3-di-fosfogliserat kemudian mengalami defosforilasi menjadi 3-P-asam gliserat dengan
melepaskan fosfat dengan aseptor fosfat ADP membentuk ATP. 3-P-asam gliserat selanjutnya membentuk 2-P-asam gliserat kemudian menjadi asam fosfoenol piruvat dengan melepaskan H2O. Asam fosfoenol piruvat kemudian terdefosforilasi menjadi asam piruvat dengan menghasilkan ATP. Dengan reaksi dekarboksilasi asam piruvat akan membentuk asetaldehid dan CO2 yang kemudian akan mengalami reaksi oksidasi menjadi etanol.
Selama proses fermentasi akan dihasilkan metabolit primer yaitu etanol, CO2, dan air dalam jumlah besar selain itu juga dihasilkan ATP yang merupakan energi dalam bentuk panas sedangkan komponen lainnya dalam jumlah yang kecil. Dalam penelitian ini dilakukan pengukuran laju
pembentukan CO2 untuk mengetahui laju fermentasi yang terjadi. Produktifitas etanol selama proses fermentasi tergantung dari komposisi substrat yang digunakan dan adanya zat/bahan inhibitor serta kondisi lingkungan seperti pH dan suhu. Dalam penelitian ini, sirup hidrolisat selulosa dijadikan sumber
karbon sedangkan sumber nutrien yang lain seperti nitrogen, posfor, dan kalium diperoleh dengan penambahan pupuk NPK dan ZA.
1.Laju Pembentukan CO2
Hasil pengukuran laju pembentukan CO2 selama fermentasi
menggunakan substrat sirup glukosa, hidrolisat asam dan hidrolisat enzim
0
Gambar 12. Grafik laju rata-rata pembentukan CO2 selama fermentasi sirup glukosa, hidrolisat asam, dan hidrolisat enzim.
Berdasarkan Gambar 12, dapat dilihat bahwa selama fermentasi terjadi peningkatan dan penurunan laju pembentukan CO2 yang berbeda-beda. Pada enam jam pertama laju pembentukan CO2 lebih lambat jika dibanding dengan enam jam berikutnya. Hal ini menunjukkan bahwa pada awal fermentasi kondisi proses belum sepenuhnya anaerob. Pada awal fermentasi masih terdapat oksigen, sehingga khamir cenderung melakukan asimilasi sel dan proses fermentasi belum sepenuhnya terjadi akibatnya
produk metabolit yang dihasilkan (etanol dan CO2) masih sangat rendah. Sesuai dengan pernyataan Oura (1983), bahwa khamir bersifat fakultatif anaerobik. Pada kondisi oksigen bebas tidak ada sama sekali atau ada dalam jumlah sedikit, terjadi konversi sumber karbon menjadi etanol dan CO2 lebih banyak. Sebaliknya, bila oksigen bebas terdapat dalam jumlah
mencukupi, konversi akan menuju ke arah asimilasi sel dengan pembentukan produk metabolit dan produk antara ditekan rendah.
Pada Gambar 12, dapat dilihat terjadinya penurunan laju pembentukan CO2, yang berarti terjadi penurunan laju fermentasi. Penurunan laju fermentasi ini diduga karena adanya akumulasi produk
pada kondisi pH yang sangat rendah. Clark dan Mackie (1984) juga menyatakan bahwa khamir sangat peka terhadap sifat penghambatan etanol, konsentrasi etanol 1-2 persen (b/v) cukup menghambat pertumbuhan dan
pada konsentrasi etanol 10 persen (b/v) laju pertumbuhan hampir berhenti sama sekali. Frazier dan Westhoff (1978) menambahkan bahwa pH akan mempengaruhi kecepatan fermentasi, pH optimum untuk pertumbuhan khamir adalah 4,0-4,5, untuk menurunkan pH dapat digunakan asam sulfat sedangkan untuk menaikkan pH dapat digunakan natrium benzoat.
Pada fermentasi sirup glukosa, setelah jam ke-24 penurunan laju fermentasi berlangsung cepat sampai jam ke-30 kemudian mengalami penurunan yang lambat dan akhirnya berhenti pada jam ke-60. Hal ini menunjukkan bahwa pada fermentasi substrat sirup glukosa metabolisme masih berlangsung sampai jam ke-60 sehingga laju fermentasi pada sirup
glukosa masih berlangsung sampai jam ke-60 sehingga masih terjadi konversi etanol, sedangkan untuk fermentasi sirup hidrolisat asam dan enzim laju pembentukan CO2 berhenti pada jam ke-42.
Pada Gambar 12, terlihat bahwa pada fermentasi sirup hidrolisat enzim laju pembentukan CO2 setelah jam ke-6 berlangsung lebih tinggi dibanding laju pembentukan CO2 pada fermentasi sirup glukosa dan sirup hidrolisat asam. Kondisi ini menunjukkan bahwa laju fermentasi pada sirup hidrolisat enzim lebih tinggi dibandingkan dengan fermentasi dari sirup glukosa maupun sirup hidrolisat asam. Tingginya laju pembentukan CO2 ini dapat disebabkan oleh jumlah gula pereduksi yang lebih besar. Selain itu dapat juga disebabkan terdapatnya nutrien yang berasal dari media pada saat hidrolisat enzim oleh Trichoderma viride. Nutrien yang lebih kompleks tersebut dimanfaatkan oleh khamir untuk pertumbuhan sehingga menghasilkan biomassa lebih banyak yang dapat diukur pada akhir
nutrien untuk pertumbuhannya terbatas maka biomassa yang terbentuk lebih sedikit sehingga laju pembentukkan CO2 dan fermentasi lebih rendah.
Pada fermentasi dengan substrat sirup hidrolisat asam, laju
pembentukan CO2 sedikit lebih lambat dibanding sirup glukosa. Laju fermentasi yang lebih lambat ini kemungkinan disebabkan adanya bahan-bahan hasil degradasi produk hidrolisat asam yang dapat menghambat proses fermentasi. Asam merupakan bahan kimia yang bersifat korosif, hidrolisis secara asam akan menghasilkan bahan-bahan inhibitor yang dapat
menghambat proses fermentasi. Berbeda dengan hidrolisis secara asam, hidrolisis enzimatis lebih menguntungkan karena reaksinya lebih ringan dan tidak menghasilkan bahan inhibitor. Kondisi ini didukung oleh pernyataan Taherzadeh (1999) dan Ulbricht et al., (1984) yang menyatakan bahwa selama hidrolisis asam, tidak hanya menghasilkan gula tetapi juga
komponen inhibitor seperti furfural, 5-hidroksimetil furfural (HMF), asam karboksilat dan komponen fenol. Boyer et al., (1992) juga menyatakan bahwa lag phase yang berlangsung lama diduga karena adanya proses adaptasi dan sintesis enzim atau koenzim baru oleh mikroorganisme untuk menguraikan furfural.
Pada Gambar 12, juga dapat dilihat bahwa rata-rata laju fermentasi untuk semua substrat diukur dari laju pembentukan CO2, berlangsung lebih tinggi pada kisaran rentang waktu fermentasi antara 18 sampai 30 jam yang kemudian mengalami penurunan pada jam berikutnya sampai akhirnya
berhenti. Laju pembentukan CO2 pada fermentasi substrat hidrolisat asam dan enzim berhenti lebih awal dibanding laju pembentukan CO2 pada substrat glukosa. Laju pembentukan CO2 yang berhenti lebih awal pada fermentasi substrat hidrolisat asam diduga disebabkan adanya peningkatan konsentrasi bahan-bahan inhibitor seperti furfural dan HMF hasil hidrolisis
2.Biomassa
Hasil analisis substrat pada akhir fermentasi yang meliputi biomassa, total asam, pH dan kadar etanol disajikan pada Tabel 6.
Tabel 6. Hasil analisis total biomassa, kadar etanol, total asam dan pH pada akhir fermentasi jam ke-60.
Berdasarkan Tabel 6 dapat dilihat bahwa pembentukan biomassa selama fermentasi berbeda-beda untuk masing-masing substrat.
Pembentukan biomassa paling banyak terjadi pada fermentasi dengan substrat sirup hidrolisat enzim yaitu 1,20 g/l, biomassa pada substrat sirup glukosa yaitu 0,30 g/l sedangkan biomassa pada substrat sirup hidrolisat asam yaitu 0,95 g/l. Perbedaan jumlah biomassa yang dihasilkan selama
fermentasi tergantung kondisi substrat yang digunakan.
Fermentasi dengan substrat hidrolisat enzim menghasilkan biomasa lebih banyak. Hal ini disebabkan pada hidrolisis enzimatis tidak dihasilkan bahan-bahan inhibitor yang dapat menghambat pertumbuhan khamir, selain itu gula yang dihasilkan merupakan glukosa yang dengan mudah dapat
dikonversi oleh khamir. Adanya nutrien yang kompleks dan buffer sitrat pH 4,8 hasil kultivasi oleh Trichoderma viride pada hidrolisat enzim juga menyebabkan khamir dapat tumbuh dengan optimal.
Pada fermentasi substrat glukosa komersial, meskipun komponen gulanya mudah dikonversi oleh khamir akan tetapi biomassa yang
dihasilkan kecil yaitu 0,30 g/l. Hal ini kemungkinan disebabkan karena keterbatasan nutrien sehingga khamir tidak dapat tumbuh dengan optimal. Pada fermentasi substrat hidrolisat asam menghasilkan biomassa sebesar 0,95 g/l lebih besar dari substrat glukosa. Besarnya biomassa ini kemungkinan disebabkan karena adanya patikel kapur hasil penetralan yang
seperti furfural dan HMF sangat besar. Bahan-bahan ini akan menghambat pertumbuhan khamir sehingga jumlah khamir yang dihasilkan seharusnya lebih kecil dari substrat glukosa maupun hidrolisat enzim.
3.Kadar Etanol
Berdasarkan Tabel 6, konsentrasi etanol yang dihasilkan pada fermentasi substrat hidrolisat enzim, asam dan glukosa berturut-turut 14,22 g/l, 2,42 g/l dan 8,52 g/l. Besarnya konsentrasi etanol pada sirup hidrolisat enzim terjadi karena biomassa yang terbentuk pada saat fermentasi juga
banyak sehingga kemampuan khamir untuk melakukan konversi substrat menjadi etanol juga tinggi. Pada fermentasi substrat hidrolisat asam, biomassa yang dihasilkan lebih banyak dibandingkan fermentasi menggunakan substrat glukosa akan tetapi menghasilkan konsentrasi etanol yang lebih kecil. Kondisi ini kemungkinan disebabkan adanya bahan
inhibitor seperti HMF dan furfural yang meningkat konsentrasinya seiring konsumsi substrat. Selain adanya inhibitor, biomassa yang terukur belum tentu biomassa akan tetapi kapur hasil penetralan yang ikut terukur sehingga kemungkinan jumlah biomassa yang sebenarnya lebih kecil, akibatnya konversi gula oleh biomassa menjadi etanol kecil. Adanya proses
penghambatan dapat dilihat dari laju pembentukan CO2 yang kecil dan berhenti lebih awal. Laju pembentukan CO2 ini menunjukkan metabolisme sel khamir yang berhenti lebih awal karena adanya penghambatan oleh bahan inhibitor. Berbeda dengan fermentasi substrat glukosa, pada
fermentasi substrat glukosa laju pembentukan CO2 berlangsung terus sampai jam ke-60, sehingga metabolisme sel khamir berlangsung terus sampai jam ke-60 dan kadar etanol yang dihasilkan lebih tinggi.
4.Total Asam dan pH
Total asam dan pH yang dihasilkan oleh cairan fermentasi berbeda
menunjukkan seluruh asam yang terdapat pada cairan fermentasi. Terdapatnya asam selama fermentasi dikarenakan pada saat fermentasi etanol, konversi gula dilakukan melalui jalur Embden Meyerhof-Parnas
dimana gula diubah menjadi etanol melalui produk-produk seperti asam piruvat, asetaldehid. Selain itu juga terbentuk asam-asam organik seperti asam laktat, asam asetat dan gliserol yang merupakan hasil samping dari fermentasi etanol.
Pada penelitian ini, pH cairan fermentasi juga bervariasi. pH cairan
fermentasi dari substrat glukosa, hidrolisat asam dan hidrolisat enzim masing-masing 2,18, 2,59 dan 3,41. Pada awal fermentasi, pH yang digunakan adalah 4,8 karena pada pH ini khamir dapat tumbuh dengan optimal. Penurunan pH selama fermentasi disebabkan terbentuknya asam. pH yang kecil menyebabkan khamir tidak dapat tumbuh dengan optimal
(terjadi proses penghambatan) bahkan bisa menyebabkan kematian sehingga proses fermentasi berhenti. Secara lebih jelas hubungan antara total asam dan pH dari masing-masing substrat dapat dilihat pada Gambar 13.
0
Hidrolisat asam Hidrolisat enzim Glukosa teknis
pH
Gambar 13. Grafik total asam dan pH cairan fermentasi.
Pada Gambar 13, dapat dilihat bahwa pada fermentasi menggunakan substrat sirup glukosa dan sirup hidrolisat asam, semakin tinggi total asam
Total asam yang terbentuk pada fermentasi sirup hidrolisat asam lebih kecil daripada fermentasi pada sirup glukosa dan sirup hidrolisat enzim. Hal ini disebabkan karena pada fermentasi substrat hidrolisat asam,
metabolisme melalui jalur Embden Meyerhof-Parnas terhambat oleh adanya furfural dan HMF, sehingga konversi glukosa menjadi etanol dan asam-asam organik juga lebih kecil.
Pada fermentasi sirup hidrolisat enzim, meskipun konsentrasi asam yang terbentuk tinggi yaitu 0,30 persen tetapi pH cairan masih tinggi yaitu
3,41. Kondisi ini dikarenakan selain tidak terdapat inhibitor seperti HMF dan furfural, biomassa yang lebih banyak menyebabkan metabolisme glukosa melalui jalur Embden Meyerhof-Parnas oleh sel khmair juga lebih tinggi sehingga dihasilkan konsentrasi etanol dan asam-asam organik yang lebih tinggi. Pada fermentasi menggunakan substrat hidrolisat enzim,
penambahan asam tidak menurunkan pH menjadi jauh lebih kecil. Hal ini dikarenakan media tersebut mengandung buffer sitrat pH 4,8 yang dipakai pada saat hidrolisis enzimatis menggunakan Trichoderma viride.
C.KETERKAITAN KONSUMSI SUBSTRAT DENGAN PRODUK ATAU
BIOMASSA
Berdasarkan hubungan waktu fermentasi dengan konsentrasi etanol,
total gula dan biomassa yang diperoleh dapat dibuat perbandingan parameternya. Perbandingan parameter hasil fermentasi untuk masing-masing substrat dapat dilihat pada Tabel 7.
Tabel 7. Perbandingan parameter akhir fermentasi jam ke-60
Sirup Δ Biomasa
Berdasarkan Tabel 7 dapat dilihat perbandingan parameter akhir fermentasi yaitu jam ke-60. Untuk kadar biomassa, kandungan biomassa
sebesar 1,20 g/l sedangkan biomassa paling sedikit diperoleh dari proses fermentasi menggunakan substrat sirup glukosa sebesar 0,30 g/l. Untuk konsentrasi etanol, kandungan terbesar diperoleh dari proses fermentasi
menggunakan substrat hidrolisat enzim sebesar 14,22 g/l sedangkan konsentrasi terkecil diperoleh dari proses fermentasi menggunakan substrat hidrolisat asam sebesar 2,42 g/l. Sementara untuk konsentrasi gula residu paling banyak terdapat pada proses fermentasi menggunakan substrat sirup glukosa sebesar 61,88 g/l dan konsentrasi gula paling sedikit diperoleh dari
fermentasi menggunakan substrat hidrolisat enzim sebesar 7,92 g/l.
Frazier dan Westhoff (1978) menyatakan bahwa gula untuk fermentasi etanol antara 10-18 persen. Jika konsentrasi gula terlalu tinggi, aktivitas khamir dapat terhambat dan waktu fermentasi menjadi lebih lama serta tidak semua gula dapat difermentasi.
Yield biomassa (Yx/s) adalah rendemen biomassa yang terbentuk per substrat yang dikonsumsi. (Yx/s) terbesar diperoleh pada fermentasi menggunakan hidrolisat asam sebesar 0,017, (Yx/s) terkecil diperoleh pada fermentasi menggunakan substrat sirup glukosa sebesar 0,008 sedangkan (Yx/s) untuk fermentasi substrat hidrolisat enzim sebesar 0,013. Besarnya (Yx/s) untuk substrat hidrolisat asam diduga karena ikut terukurnya endapan kapur hasil penetralan pada saat pengukuran total biomassa.
Yield produk (Yp/s) adalah rendemen produk yang terbentuk per substrat yang dikonsumsi. (Yp/s) terbesar diperoleh pada fermentasi menggunakan sirup glukosa yaitu 0,224, (Yp/s) terkecil diperoleh pada fermentasi menggunakan substrat hidrolisat asam dengan nilai 0,042 sedangkan untuk substrat hidrolisat enzim (Yp/s) sebesar 0,154.
Efisiensi pemanfaatan substrat (ds/s) tertinggi diperoleh dari fermentasi menggunkan substrat sirup hidrolisat enzim sebesar 92,08 persen sedangkan
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Limbah hasil pertanian seperti tongkol jagung dapat dijadikan bahan
dasar produksi etanol melalui proses hidrolisis secara asam atau enzim komponen selulosa sebelum difermentasi oleh khamir. Kondisi parameter fermentasi tergantung dari jenis substrat dan komponen substrat yang digunakan. Fermentasi menggunakan substrat hidrolisat enzim dari kultivasi Trichoderma viride menghasilkan parameter biomassa, kadar etanol dan total asam paling besar masing-masing 1,2 g/l, 14,22 g/l dan 0,3 persen setelah fermentasi selama 60 jam dengan konsentrasi substrat kurang lebih 10 persen. Substrat hidrolisat asam menghasilkan kadar etanol dan total asam paling kecil yaitu 2,42 g/l dan 0,14 persen sedangkan substrat glukosa menghasilkan biomassa, kadar etanol dan total asam masing-masing 0,3 g/l, 8,52 g/l dan
0,17 persen.
Yield biomassa terbesar (Yx/s) terjadi pada fermentasi menggunakan substrat hidrolisat asam dengan nilai 0,017 sedangkan pada hidrolisat enzim (Yx/s) sebesar 0,013 dan (Yx/s) terkecil terjadi pada fermentasi menggunakan substrat glukosa dengan nilai 0,008. Yield produk (Yp/s) terbesar terjadi pada fermentasi menggunakan substrat glukosa dengan nilai 0,224 sedangkan pada substrat hidrolisat enzim (Yp/s) sebesar 0,154 dan (Yp/s) terkecil diperoleh dari fermentasi menggunakan substrat hidrolisat asam dengan nilai 0,042. Efisiensi pemanfaatan substrat (ds/s) tertinggi terjadi pada fermentasi menggunakan
substrat hidrolisat enzim sebesar 92,08 persen sedangkan substrat hidrolisat asam sebesar 56,98 persen dan (ds/s) paling kecil diperoleh dari fermentasi menggunakan sirup glukosa yaitu 38,12 persen.
B. SARAN
Perlu dicari metode yang tepat untuk perlakuan pendahuluan dan
menggunakan enzim dan fermentasi oleh Saccharomyces cerevisiae pada substrat selulosa tongkol jagung.
Penelitian juga dapat dilakukan dengan cara fermentasi kultur
DAFTAR PUSTAKA
Achmadi, 1989. Kimia Kayu. Diktat PAU Ilmu Hayati. Institut Pertanian Bogor.
Anggraini, F. 2003. Kajian Ekstraksi dan Hidrolisis Xilan Dari Tongkol Jagung (Zea Mays L). Skripsi. Fakultas Teknologi Pertanian. Institut Pertanian Bogor. Bogor.
Anonim. 1986. Pembuatan Glukosa dari Sumber Selulosa Jerami Padi. Laporan Penelitian. Himpunan Mahasiswa Teknologi Pertanian. Fateta. IPB. Bogor.
Anonim. 2005. Prospek dan Arah Pengembangan Agribisnis Jagung.
htttp://www.litbang_deptan.go.id/special/komoditas/files/0104-JAGUNG.pdf.
Anonima. 2006. http://www.bps.go.id. 28 Juli 2006.
Anonimb. 2006. http://iptek.apjii.or.id/artikel/ttg_tanaman_obat/depkes/buku1/1-295.pdf. 28 Juli 2006.
AOAC. 1984. Official Methods Analysis The Association of Official Analytical Chemist. 14 th ed. AOAC. Inc. Arlinton. Virginia.
Apriyantono, A., D. Fardiaz, N.L. Puspitasari, Yasin dan S. Budiyanto. 1989. Petunjuk Laboratorium Analisis Pangan. Penerbit Institut Pertanian Bogor. Bogor.
Ariestaningtyas, Y. 1991. Pemanfaatan Tongkol Jagung untuk Produksi Enzim Selulase oleh Trichoderma viride. Skripsi. Departemen Teknologi Pertanian. Fateta IPB. Bogor.
Boyer, L. J., K. Vega, K.T. Klasson, E.C. Clausen dan J.L. Gaddy. 1992. The effects of furfural on ethanol production by Saccharomyces cerevisiae. Biomass Bioeng.3 (1), 41-48.
Burchardt, G dan L.O Ingram. 1992. Conversion of Xylan to Ethanol by Ethalogenic Strains of Escherichia coli and Klebsiella oxytoca. Appl. and Environ. Microbiol. 58:1128-1133.
Casey, J. P. 1952. Pulp and Paper. Chemistry and Chemical Technology. Interscience Publiser. London.
Chang, M. M., T.C. Chon dan G. T. Tsao. 1981. Structure Pretreatment and Hydrolysis Cellulose. Adv. Biochem. Eng. 20: 14-25.
Clark, T. dan K.L Mackie. 1984. Fermentation inhibitors in wood hydrolysates derived from the softwood Pinus radiata. J. Chem. Biotechnol. 34B, 101-110.