OPTIMASI PRODUKSI HIDROLISAT PROTEIN DARI
TEPUNG IKAN MENGGUNAKAN ENZIM BROMELIN
YOHANES EKO ADITYA
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Optimasi Produksi Hidrolisat Protein dari Tepung Ikan Menggunakan Enzim Bromelin adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan PT. Bromelain Enzyme.
Bogor, Februari 2016
Yohanes Eko Aditya
ABSTRAK
YOHANES EKO ADITYA. Optimasi Produksi Hidrolisat Protein dari Tepung Ikan Menggunakan Enzim Bromelin. Dibimbing oleh LIESBETINI HADITJAROKO dan MULYORINI RAHAYUNINGSIH.
Hidrolisat protein ikan sebagai sumber protein fungsional merupakan pemanfaatan hasil pertanian yang bernilai tambah tinggi. Bahan baku yang digunakan adalah tepung ikan rucah yang memiliki protein kasar 71,57 ± 0,20% dan enzim bromelin sebagai protease dengan aktivitas 1289,36 GDU (Gelatin Digestion Unit) / mg. Penggunaan enzim bromelin sebagai penghidrolisis menjadi suatu alternatif protease yang lebih aman terhadap pangan. Optimasi produksi hidrolisat protein ikan ditentukan oleh rasio enzim yang digunakan, suhu hidrolisis, dan lama waktu hidrolisis. Kondisi hidrolisis optimum ditentukan dengan Response Surface Methode (RSM) metode Central Composite Design
(CCD). Nilai center point dari variabel tetap yang digunakan adalah rasio enzim/substrat 2%, suhu hidrolisis 50 oC, dan lama waktu hidrolisis 5 jam. Variabel respon yang diukur sebagai penentu kondisi optimum adalah dry material dan nitrogen recovery. Kondisi optimum yang diperoleh adalah hidrolisis pada rasio enzim/substrat 3%, suhu 55oC, dan waktu hidrolisis 7 jam dengan nilai
dry material 3,20% dan nitrogen recovery 65,42%. Produk hidrolisat protein ikan cair optimum yang dihasilkan memiliki karakteristik protein kasar 4,77%. Hidrolisat Protein Ikan yang dihasilkan dominan pada bobot molekul 37 kDa, 25 kDa, dan <14 kDa. Potensi hidrolisat protein sebagai media pertumbuhan mikroba sangat mendekati produk becto proteose peptone, meskipun sedikit lebih rendah.
Kata Kunci : Hidrolisat protein ikan, enzim bromelin, optimasi, protein recovery, dry material
ABSTRACT
YOHANES EKO ADITYA. Optimization of Hydrolysate Protein Production From Fish Meal Using Bromelain Enzyme. Supervised by LIESBETINI HADITJAROKO and MULYORINI RAHAYUNINGSIH.
7 hours of hydrolysis time with 3,20% of dry material value and 65,42% of nitrogen recovery. Liquid fish protein hydrolysate product was produced have characteristic as follows 4.77% of crude protein and molecule weight 37 kDa, 25 kDa, and < 14 kDa. Potential protein hydrolysate as a medium for microbial growth were close enough from becto proteose peptone product, although slightly lower.
OPTIMASI PRODUKSI HIDROLISAT PROTEIN DARI
TEPUNG IKAN MENGGUNAKAN ENZIM BROMELIN
YOHANES EKO ADITYA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan Syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya karya ilmiah ini berhasil diselesaikan. Judul yang dipilih pada penelitian ini adalah Optimasi Produksi Hidrolisat Protein dari Tepung Ikan Menggunakan Enzim Bromelin. Penelitian ini dilaksanakan di Laboratorium
Quality Analysis, PT. Bromelin Enzyme dan Laboratorium Teknologi Bioindustri, BPPT (Badan Pengkajian dan Penerapan Teknologi) Serpong, mulai bulan April hingga Agustus 2015 dengan pendanaan dari PT. Bromelain Enzyme.
Terima kasih penulis ucapkan kepada Dr Ir Liesbetini Haditjaroko, MS dan Dr Ir Mulyorini Rahayuningsih, M.Si selaku pembimbing akademik yang selalu membimbing dan mengarahkan penulis selama penelitian dan penyusunan skripsi. Penulis juga mengucapkan terima kasih kepada kedua orangtua yang selalu mendukung baik secara moril dan material. Ucapan terima kasih kepada teman-teman TIN 48 yang memberi dukungan dan semangat kepada penulis.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xiv
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
Manfaat Penelitian 2
Ruang Lingkup 2
METODE 3
Alat dan Bahan 3
Waktu dan Tempat Penelitian 3
Prosedur Percobaan 3
Karakterisasi Tepung Ikan dan Analisa Aktivitas Enzim Bromelin 3
Penelitian Pendahuluan 3
Optimasi 5
Karakterisasi Produk 5
Aplikasi Hidrolisat Protein Sebagai Media Pertumbuhan Bakteri 6
HASIL DAN PEMBAHASAN 6
Penelitian Pendahuluan 6
Karakteristik Tepung Ikan dan Aktivitas Enzim bromelin 6
Pengaruh Rasio Enzim/Substrat dan Waktu Terhadap Nitrogen Recovery 7
Optimasi 8
Rancangan Percobaan 8
Analisis Kombinasi Faktor Terhadap Respon Dry Material 9
Analisis Kombinasi Faktor Terhadap Respon Nitrogen Recovery 11
Validasi Model 13
Karakteristik Produk 14
Aplikasi Hidrolisat Protein Sebagai Media Pertumbuhan Bakteri 17
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
DAFTAR TABEL
1 Pengaruh rasio E/S terhadap nitrogen recovery 7
2 Pengaruh waktu hidrolisis terhadap nitrogen recovery 8
3 Desain rancangan percobaan 8
4 Nilai model optimasi untuk respon dry material 9
5 Nilai model optimasi untuk respon nitrogen recovery 11
6 Protein recovery proses hidrolisis dari berbagai sumber 14
7 Hasil proksimat produk hidrolisat protein 15
DAFTAR GAMBAR
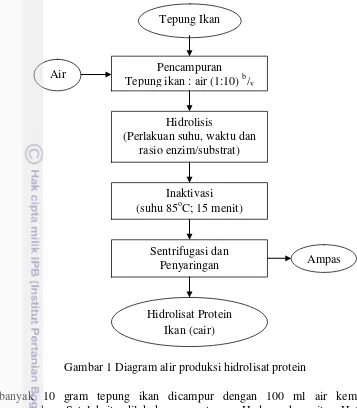
1 Diagram alir produksi hidrolisat protein 4
2 Grafik model pengaruh faktor rasio dan waktu terhadap respon dry material
dalam model kontur (a) dan 3D (b) 10
3 Grafik model pengaruh faktor rasio dan waktu terhadap respon nitrogen
recovery dalam model kontur (a) dan 3D (b) 13
4 Perbandingan asam amino hidrolisat protein ikan dengan BactoProteose
Peptone 16
5 Analisis bobot molekul hidrolisat protein ikan dengan SDS-PAGE 16
6 Kurva pertumbuhan Escherichia coli 17
DAFTAR LAMPIRAN
1 Prosedur analisis proksimat bahan 21
2 Data lengkap hasil rancangan percobaan 23
3 Hasil analisa ANOVA dan respon permukaan dry material 24
PENDAHULUAN
Latar Belakang
Hidrolisat protein didefinisikan sebagai protein yang mengalami pemutusan ikatan melalui proses hidrolisis baik secara enzimatis menggunakan enzim protease ataupun kimia menggunakan asam atau basa menjadi peptida dengan berbagai macam ukuran (Kristinsson dan Rasco 2000). Hidrolisat protein telah diketahui sangat aplikatif pada sektor pangan, farmasi, dan bioteknologi. Aplikasi hidrolisat protein pada sektor pangan tidak lepas dari karakteristik fungsional yang dimilikinya seperti taste (bitterness), kelarutan, viskositas, emulsifikasi,
foaming, gelling, dan allergenicity (Adler-Nissen 1986; Adler-Nissen et al. 1979; Adler-Nissen et al. 1982). Sifat bioaktif peptida hidrolisat protein seperti opioid antagonis, antihipertens, antitrombotik, antimikroba, dan imunostimulan banyak digunakan pada sektor farmasi (Knights 1985; Saxelin et al. 2003). Pada bidang bioteknologi hidrolisat protein menjadi sumber nitrogen sederhana baik skala laboratorium maupun skala besar industri fermentasi sebagai faktor pendukung pertumbuhan mikroorganisme, fermentasi vaksin dan sebagai penstabil vaksin, nutrisi diet, nutrisi hewan dan zat pengatur tumbuh tanaman (Pasupuleti dan Demain 2010). Kebutuhan hidrolisat protein di Indonesia sendiri cukup luas pada bidang bioteknologi yang selama ini masih dipenuhi dengan pepton impor. Selain itu potensinya di Indonesia di bidang pangan, pakan, dan farmasi masih sangat terbuka lebar sehingga hidrolisat protein menjadi produk intermediet yang sangat menjanjikan.
Hidrolisat protein dapat diproduksi secara kimia atau enzimatis. Kedua proses tersebut memiliki keunggulan dan kelemahannya masing-masing. Produksi secara kimia memiliki keunggulan recovery protein yang tinggi, proses singkat dan biaya proses rendah, tetapi dari segi kualitas produk yang dihasilkan sulit homogen, lebih pahit, sifat fungsional rendah, reaksi sulit dikontrol, menghasilkan substansi beracun, mengandung logam korosi dan memiliki kadar garam yang tinggi. Sebaliknya, produksi hidrolisat secara enzimatis telah diketahui memiliki waktu proses lebih lama dan biaya lebih tinggi tetapi memiliki kualitas produk yang sangat baik dari segi nutrisi dan kemampuan fungsionalnya(Krisstinson dan Rasco 2000; Sanmartin et al. 2009). Penelitian mengenai produksi hidrolisat protein itu sendiri telah banyak dilaporkan dari berbagai sumber protein yang digunakan seperti kacang-kacangan, berbagai jenis ikan segar, hasil samping olahan ikan, yang menggunakan berbagai protease seperti tripsin, kimotripsin, pepsin, neutrase, flavorzim, dan alkalase.
2
hidrolisat protein yaitu tidak perlu ada proses pemisahan hidrolisat protein dengan minyak sehingga dapat mempersingkat proses.
Enzim bromelin merupakan alternatif protease murah dan halal yang berasal dari tumbuhan nanas. Indonesia telah mampu memproduksi enzim bromelin yang berasal dari batang nanas yang keseluruhan produknya di ekspor. Pemanfaatan enzim bromelin sebagai penghidrolisis untuk menghasilkan hidrolisat protein akan memberikan nilai tambah yang lebih besar. Produksi hidrolisat protein secara enzimatis memiliki beberapa faktor yang mempengaruhi proses hidrolisis seperti waktu, pH, suhu, dan rasio enzim / substrat (Kirk et al. 1953). Setiap enzim akan aktif pada suhu dan pH tertentu, untuk enzim bromelin sendiri optimal pada suhu 50-60 oC dan rentang pH 5-8. Semua faktor tersebut menjadi penting untuk dikaji karena sangat berkaitan erat dengan aktivitas terbaik enzim, jumlah optimum enzim yang digunakan, dan biaya produksi. Oleh karena itu, produksi hidrolisat protein secara enzimatis perlu diketahui kondisi hidrolisis optimumnya. Pada penelitian ini kondisi hidrolisis yang dikaji adalah waktu, suhu, dan rasio enzim/substrat
Tujuan
Tujuan penelitian ini adalah untuk:
– Mendapatkan kondisi hidrolisis yang optimum untuk menghasilkan hidrolisat protein dengan protein recovery tertinggi. Variabel yang diteliti adalah pengaruh waktu hidrolisis, rasio enzim/substrat, dan suhu hidrolisis;
– Menganalisis karakteristik hidrolisat protein yang dihasilkan meliputi bobot molekul dan kandungan asam amino;
– Mengetahui potensi hidrolisat protein yang dihasilkan sebagai media pertumbuhan mikroba pengganti pepton komersil.
Manfaat Penelitian
Manfaat dari penelitian ini adalah memberikan informasi mengenai kemampuan enzim bromelin sebagai protease, kondisi hidrolisis yang optimum dan kemampuan hidrolisat protein ikan sebagai sumber nitrogen pengganti pepton komersil.
Ruang Lingkup
3
METODE
Alat dan Bahan
Bahan yang digunakan dalam penelitian ini adalah enzim bromelin, tepung ikan, NaOH, dan air reverse osmosis. Enzim bromelin tepung ikan yang digunakan berupa powder atau tepung. Enzim bromelin yang digunakan didapat dari PT. Bromelain Enzyme sedangkan tepung ikan didapat dari tempat produksi
fertilizer PT. Great Giant Pinneapple Company (GGPC). Alat yang digunakan dalam penelitian ini adalah sudip, waterbath, pH meter, labu erlenmeyer 250 ml, kertas Whatman No.1, corong, KjeltecTM 2100 Distillation Unit, oven, neraca analitik.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai April hingga November 2015 di Laboratorium Quality Analysis, PT. Bromelin Enzyme, Laboratorium Teknologi Bioindustri, BPPT (Badan Pengkajian dan Penerapan Teknologi) Serpong dan Laboratorium Bioindustri Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, IPB.
Prosedur Percobaan
Karakterisasi Tepung Ikan dan Analisa Aktivitas Enzim Bromelin
Tepung ikan yang didapatkan dari tempat produksi fertilizer PT. Great Giant Pinneapple Company (GGPC) merupakan tepung ikan rucah. Proses pembuatan tepung ikan secara umum meliputi pemasakan, pengempaan, pemisahan, pengeringan, and penepungan / pengecilan ukuran (Winder and Barlow 1981). Tepung ikan dikarakterisasi dengan uji proksimat yaitu kadar air, kadar abu, protein, lemak, dan karbohidrat (AOAC 2005). Prosedur pengujian dapat dilihat pada Lampiran 1. Protease yang digunakan pada penelitian ini adalah enzim bromelin yang didapatkan dari PT. Bromelain Enzyme. Enzim bromelin yang digunakan dianalisa aktivitasnya dengan substrat kasein dengan satuan Casein Digestion Unit (CDU)/mg. Prinsip analisis Casein Digestion Unit adalah berdasarkan jumlah tirosin yang mampu dibebaskan dari substrat kasein karena dihidrolisis oleh enzim proteolitik.
Penelitian Pendahuluan
4
Gambar 1 Diagram alir produksi hidrolisat protein
Sebanyak 10 gram tepung ikan dicampur dengan 100 ml air kemudian dihomogenkan. Setelah itu dilakukan pengaturan pH dan suhu yaitu pH 6 dan suhu 50oC dan biarkan sampai suhu konstan kemudian campurkan enzim yang telah di timbang bobotnya. Pada penelitian pendahuluan percobaan rasio enzim menggunakan perlakuan 0%, 0,5%, 1%, 2%, dan 5% sedangkan percobaan waktu hidrolisis menggunakan perlakuan 1, 5, 10, dan 15 jam. Setelah proses hidrolisis selesai suhu dinaikan sampai 85oC untuk inaktivasi enzim. Hidrolisat protein yang sudah diinaktivasi proses hidrolisisnya disentrifugasi dan disaring dengan kertas Whatman no.1. supernatan dianalisa total N untuk melihat total N terlarut dan kemudian dibandingkan dengan total N bahan yang hasilnya dinyatakan dalam
Nitrogen Recovery (Nitrogen Total Terlarut / Nitrogen Total Bahan). Berikut perhitungan nilai nitrogen recovery:
Nitrogen Recovery (%) =
x 100%
Analisa total nitrogen menggunakan metode Kjeldahl (AOAC 2005) yang dapat dilihat pada Lampiran 1.
Tepung Ikan
Air Pencampuran
Tepung ikan : air (1:10) b/v
Hidrolisis
(Perlakuan suhu, waktu dan rasio enzim/substrat)
Inaktivasi (suhu 85oC; 15 menit)
Sentrifugasi dan
Penyaringan Ampas
5
Optimasi
Rancangan percobaan untuk mengetahui proses optimal dari hidrolisis tepung ikan menggunakan enzim bromelin ini menggunakan metode RSM (Response Surface Methode) dan ANOVA ( = 0,05). RSM merupakan himpunan metode matematika dan statistika yang digunakan untuk melihat hubungan antara satu atau lebih variabel perlakuan dengan respon dan bertujuan untuk mengoptimalkan respon tersebut (Montgomery 2001). Menurut Myers (1971), kombinasi yang melibatkan strategi eksperimental, metode matematika, dan inferensia statistik memungkinkan untuk membuat eksplorasi yang empiris dan efisien dari sistem yang diinginkan. Rancangan percobaan yang digunakan adalah CCD (Central Composite Dessign) dengan tiga variabel bebas yaitu rasio enzim/substrat, suhu, dan waktu. Variabel respon yang diuji untuk dioptimasi adalah nitrogen recovery yang mewakili seberapa banyak protein yang akan terlarut dan dry material yang mewakili sebarapa banyak bahan yang dapat
A : Berat wadah dan sampel kering / setelah dioven (gram) B : Berat wadah
S : Berat sampel
Penentuan kondisi optimum berdasarkan nilai variabel respon dari faktor-faktor yang telah ditentukan dengan menggunakan Design Expert 7.0.0 untuk menghasilkan model polinomial yang sesuai dengan hasil penelitian, model matematis dan respon permukaannya. Penentuan tipe model yang sesuai berdasarkan nilai Sequential Model Sum of Squares (SMSS), lack of fit, R2 dan
adjusted-R2. Model yang baik adalah model yang memiliki nilai signifikan (P<0.05) terhadap nilai SMSS, nilai lack of fit yang tidak signifikan ((P>0.05), nilai R2 dan adjusted-R2 yang tertinggi dan atau selisih kedua nilai tersebut yang paling kecil (Montgomery 2001).
Karakterisasi Produk
6
Aplikasi Hidrolisat Protein Sebagai Media Pertumbuhan Bakteri
Pada tahap ini, hidrolisat protein yang dihasilkan digunakan sebagai media pertumbuhan bakteri. Fungsi hidrolisat adalah sebagai sumber nitrogen pengganti pepton. Bakteri yang digunakan adalah Escherichia coli.
Biakan bakteri disegarkan terlebih dahulu dalam media cair nutrient broth
selama 24 jam sebelum diinokulasi ke media yang mengandung hidrolisat protein. Medium pertumbuhan dibuat dengan menyiapkan larutan yang mengandung glukosa 0,4% dan NaCl 1,13%. Larutan ini dibuat sebanyak 160 ml ke dalam labu erlenmeyer 250 ml. Hidrolisat protein cair sebanyak 40 ml dimasukan ke dalam larutan tersebut. Media pertumbuhan yang sama tanpa inokulasi dibuat sebagai blanko. Medium ini disterilisasi pada suhu 121oC selama 15 menit sebelum diinokulasi. Inokulasi bakteri dilakukan dengan memasukan 1% v/v kultur
Escherichia coli yang telah disegarkan ke dalam media pertumbuhan steril. Setelah itu, dilakukan inkubasi pada suhu 37oC selama 24 jam. Pengamatan pertumbuhan dilakukan dengan menganalisa OD menggunakan spektrofotometer pada panjang gelombang 600 nm setiap 2 jam.
HASIL DAN PEMBAHASAN
Penelitian Pendahuluan
Karakteristik Tepung Ikan dan Aktivitas Enzim bromelin
Tepung ikan selama ini banyak dimanfaatkan untuk fertilizer dan pakan karena tingginya kandungan nitrogen yang baik bagi pertumbuhan hewan dan tumbuhan. Tepung ikan yang baik memiliki kandungan protein kasar 56-68%, air 5,5-8,5%, serta garam 0,5-3,0% (Boniran 1999). Berdasarkan hasil analisa proksimat tepung ikan yang digunakan memiliki kadar air 10,66 ± 0,06 %, kadar abu 16,23 ± 0,03 % , protein 71,57 ± 0,20 %, lemak 1,35 ± 0,01% , dan karbohidrat 0,19 % yang dihitung berdasarkan by difference. Berdasarkan hasil tersebut terbukti bahwa tepung ikan yang digunakan sudah mengalami pemisahan dari minyak ikan. Komposisi minyak atau lemak ikan yang sangat kecil ini nantinya akan menguntungkan dalam proses karena tidak perlu adanya pemisahan hidrolisat dan minyak setelah hidrolisis.
Enzim bromelin merupakan cystein endoprotease dengan cystein sebagai sisi aktifnya. Terdapat dua jenis enzim bromelin yaitu stem bromelin dan fruit bromelin. Pada fruit bromelin bersifat glucosylated, sedangkan pada stem bromelin bersifat non-glucosylated. Alasan utama penggunaan stem bromelin
pada penelitian ini karena berasal dari bagian tumbuhan nanas yang tidak dimanfaatkan untuk menghasilkan produk bernilai tambah tinggi. Selain itu stem bromelin sudah diproduksi skala industri oleh PT. Bromelin Enzyme. Enzim bromelin yang dihasilkan oleh PT. Bromelin Enzyme diproduksi secara fisika tanpa tambahan bahan kimia sehingga aman dan halal digunakan pada produk pangan.
7
digunakan memiliki karakteristik kadar air 4,98 % dan total N 6,48 %. Enzim bromelin kasar dengan aktivitas sebesar sekitar 1200 GDU merupakan produk enzim yang berada pada level sedang. Enzim bromelin biasa dipasarkan dalam tiga kelompok aktivitas yaitu 600 GDU, 1200 GDU, dan 2400 GDU dengan acuan harga ±$72/kg. Oleh karena itu penggunaan aktivitas 1200 GDU merupakan pilihan yang cukup ekonomis.
Pengaruh Rasio Enzim/Substrat dan Waktu Terhadap Nitrogen Recovery Penelitian pendahuluan ini untuk melihat pengaruh salah satu variabel terhadap respon Nitrogen Recovery yang disajikan dalam bentuk tabel dan diagram garis. Percobaan pengaruh rasio enzim/substrat (E/S) pada Tabel 1 menunjukan bahwa bahwa pada konsentrasi 0-1% mengalami peningkatan yang sangat signifikan sedangkan pada konsentrasi 2-5% ∆ nitrogen recovery yang diperoleh semakin kecil sehingga dapat diperkirakan bahwa pada konsentrasi 1-2% hidrolisis sudah berjalan dengan optimum sedangkan bila menggunakan rasio enzim sampai 3-5% enzim yang ditambahkan tidak sebanding dengan penambahan nitrogen recovery yang diperoleh. Berdasarkan hasil tersebut rasio enzim 2 % akan digunakan sebagai titik tengah pada desain Response Surface Methode.
Tabel 1 Pengaruh rasio E/S terhadap nitrogen recovery*
Rasio E/S (%) Total N (%) Nitrogen
Variabel selanjutnya adalah waktu terhadap Nitrogen Recovery yang ditunjukan pada Tabel 2. Waktu menjadi variabel yang cukup penting karena menyangkut lama produksi sehingga pada skala industri berkaitan dengan biaya energi yang digunakan. Berikut adalah hasil pengaruh variabel waktu terhadap
8 konsentrasi enzim dan semakin lama proses hidrolisis protein recovery yang dihasilkan akan semakin tinggi, tetapi pada titik tertentu akan mencapai titik stasioner atau peningkatan respon semakin tidak signifikan. Hal tersebut disebabkan oleh semakin berkurangnya aktivitas enzim. Penurunan aktivitas enzim ini ditentukan oleh beberapa faktor seperti konsentrasi enzim, konsentrasi substrat, alosterik, kofaktor, koenzim, dan inhibitor (Whitehurst and Oort 2010). Aktivitas enzim bromelin yang digunakan pada penelitian ini adalah aktivitas 1200 GDU/mg (Gelatin Digestion Unit/ mg) yang tegolong cukup rendah sehingga konsentrasi enzim bromelin itu sendiri cukup rendah. Aktivitas yang cukup rendah ini memang menguntungkan pada segi biaya protease yang digunakan akan tetapi akan sangat berpengaruh pada lama waktu hidrolisis yang dibutuhkan. Setelah proses hidrolisis berjalan beberapa waktu peningkatan protein recovery yang didapat semakin tidak signifikan karena pada waktu tersebut konsentrasi substrat yang akan dihidrolisis sudah banyak berkurang atau mulai habis. Aktivitas enzim yang spesifik pada asam amino tertentu membuat aktivitas semakin cepat menurun karena substrat yang mengandung asam amino tersebut sudah habis.
Optimasi
Rancangan Percobaan
Pada penelitian pendahuluan telah didapat titik atau nilai faktor yang diperkirakan akan menjadi kondisi optimum hidrolisis untuk produksi hidrolisat protein. Nilai-nilai yang telah ditentukan pada penelitian pendahuluan digunakan sebagai nilai tengah dari desain rancangan percobaan yang disajikan pada Tabel 3.
9
Analisis Kombinasi Faktor Terhadap Respon Dry Material
Hasil pengujian dry material nilai yang diperoleh berkisar antara 2,75%-3,25% dengan nilai rata-rata sebesar 3,07% dengan standar deviasi 0,12%. Berdasarkan hasil nilai SMSS, Lack of Fit, R2, dan Adjusted R2 pada Tabel 4, model yang sesuai dan disarankan adalah model polinomial kuadratik.
Tabel 4 Nilai model optimasi untuk respon dry material
Model SMSS
Kuadratik 0.0011 0.0002 0,8970 0,8583 Suggested
Kubik 0.6025 < 0.0001 0,9096 0,8508 Aliased
Berdasarkan Tabel 4 dapat dilihat model linier dan kuadratik memiliki nilai SMSS yang signifikan dengan “Prob>F” lebih kecil dari 0.05 yaitu pada model linier dan kuadratik dengan berturut-turut <0,0001 dan 0,0011. Nilai lack of fit
diperoleh “Prob>F” tidak ada yang lebih besar dari 0.05 berarti ada lack of fit.
Nilai lack of fit signifikan menunjukan bahwa adanya ketidaksesuaian data respon
dry material dengan model, oleh karena itu dipilih nilai lack of fit yang terbesar yaitu pada model kuadratik. Nilai R2 untuk model polinomial kuadratik sebesar 0,8970 dan model kubik sebesar 0.9096. Sebenarnya nilai R2 kubik lebih besar akan tetapi lebih disarankan model kuadratik karena model kubik merupakan
aliased. Nilai R2 sebesar 0.8970 mempunyai arti bahwa pengaruh variabel X1, X2 dan X3 terhadap perubahan variabel respon adalah 89,70% sedangkan sisanya sebesar 10,30% dipengaruhi oleh variabel-variabel lain yang tidak diketahui. Berikut adalah persamaan model polinomial quadratic yang diperoleh:
Dry Material (Y) = 2,6633 + 0,1563X1 - 0,0075X2 + 0,1193X3 + 0,0031X1X2 -
Bedasarkan persamaan model diatas, dapat dilihat bahwa nilai intercept
persamaan tersebut adalah 2,66. Intercept artinya nilai respon y saat variabel x=0, sehingga persamaan diatas menjelaskan bahwa ketika hidrolisis terjadi pada suhu kontrol atau tanpa pengaruh dari ketiga variabel diatas maka dry material yang dihasilkan yaitu 2,66%. Pada variabel signifikan diatas menunjukan bahwa rasio enzim/substrat dan waktu berpengaruh meningkatakan respon dry material
10
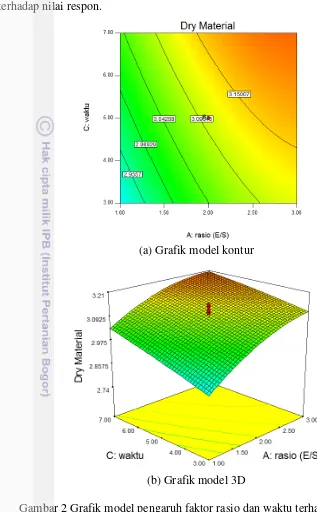
kurva akan semakin landai dan berbelok turun. Selain ketiga variabel itu merupakan variabel yang tidak signifikan sehingga tidak terlalu berpengaruh terhadap nilai respon.
(a) Grafik model kontur
(b) Grafik model 3D
Gambar 2 Grafik model pengaruh faktor rasio dan waktu terhadap respon dry material dalam model kontur (a) dan 3D (b)
Berdasarkan Gambar 2(a) terlihat garis-garis kontur melingkar dengan titik merah berada di antara lingkaran keempat dan kelima terluar. Garis kontur melingkar bagian luar menunjukan nilai respon terbaik dimana dry material yang dihasilkan semakin besar. Angka enam pada titik merah kontur merupakan titik pusat dari rancangan yang dibuat dan dilakukan sebanyak enam kali. Pada respon
dry material nilai yang dicari adalah hidrolisat protein dengan dry material
11
sedangkan nilai tertinggi berada di daerah berwarna merah. Kondisi tersebut menunjukan bahwa nilai respon terbaik akan diperoleh dengan mengkondisikan faktor-faktor tidak pada titik pusat, tetapi bergeser ke arah kanan atas menuju daerah berwarna merah. Respon dry material akan optimum pada rasio enzim/substrat dan waktu yang meningkat.
Pada Gambar 2(b) merupakan 3D respon permukaan dry material hidrolisat protein yang menunjukkan rasio enzim/substrat dan waktu hidrolisis berpengaruh signifikan terhadap dry material yang dihasilkan hidrolisat protein. Grafik yang disajikan hanya pengaruh faktor rasio dan waktu karena merupakan faktor yang berpengaruh signifikan terhadap respon. Analisa dan grafik selengkapnya dapat dilihat pada lampiran. Solusi optimasi yang direkomendasikan program Design Expert 7.0.0 untuk respon tunggal nilai dry material yaitu X1 = 3%, X2 = 55 oC, dan X3= 7 jam dengan prediksi nilai respon dry material 3,20%.
Analisis Kombinasi Faktor Terhadap Respon Nitrogen Recovery
Hasil nitrogen recovery nilai yang diperoleh berkisar antara 57% - 66% dengan nilai rata-rata sebesar 63% dengan standar deviasi 2,2%. Berdasarkan hasil nilai SMSS, Lack of Fit, R2, dan Adjusted R2 pada Tabel 5, model yang sesuai dan disarankan adalah model polinomial kuadratik.
Tabel 5 Nilai model optimasi untuk respon nitrogen recovery
Model SMSS
Kuadratik 0.0002 < 0,0001 0,9168 0,8856 Suggested
Kubik 0.4998 < 0.0001 0,9291 0,8830 Aliased
Berdasarkan Tabel 5 dapat dilihat model linier dan kuadratik memiliki nilai SMSS yang signifikan dengan “Prob>F” lebih kecil dari 0.05 yaitu pada model linier dan kuadratik dengan berturut-turut <0,0001 dan 0,0002. Nilai lack of fit diperoleh “Prob>F” tidak ada yang lebih besar dari 0.05 berarti ada lack of fit. Nilai lack of fit signifikan menunjukan bahwa adanya ketidaksesuaian data respon % nitrogen recovery dengan model. Nilai R2 untuk model polinomial kuadratik sebesar 0,9168 dan model kubik sebesar 0.9291. Sebenarnya nilai R2 kubik lebih besar akan tetapi lebih disarankan model qudratic karena model kubik merupakan
aliased. Nilai R2 sebesar 0.9084 mempunyai arti bahwa pengaruh variabel X1, X2 dan X3 terhadap perubahan variabel respon adalah 91,68% sedangkan sisanya sebesar 8,32% dipengaruhi oleh variabel-variabel lain yang tidak diketahui. Berikut adalah persamaan model polinomial kuadratik yang diperoleh:
12
Bedasarkan persamaan model diatas, dapat dilihat bahwa nilai intercept
persamaan tersebut adalah 55,23. Intercept artinya nilai respon y saat variabel x=0, sehingga persamaan diatas menjelaskan bahwa ketika hidrolisis terjadi pada suhu kontrol atau tanpa pengaruh dari ketiga variabel diatas maka Nitrogen Recovery yang dihasilkan yaitu 55,23%. Pada variabel signifikan diatas menunjukan bahwa rasio enzim/substrat dan waktu berpengaruh meningkatakan respon nitrogen recovery sedangkan kuadrat dari rasio enzim/substrat berpengaruh mengurangi nitrogen recovery. Rasio enzim/substrat yang positif sedangkan kuadrat dari rasio enzim/substrat yang negatif berarti semakin besar rasio enzim/substrat yang ditambahkan maka semakin tinggi nitrogen recovery
yang dihasilkan tetapi kemiringan akan semakin kecil dan akhirnya pada titik tertentu atau titik maksimal maka kurva akan semakin berbelok dan landai.
13
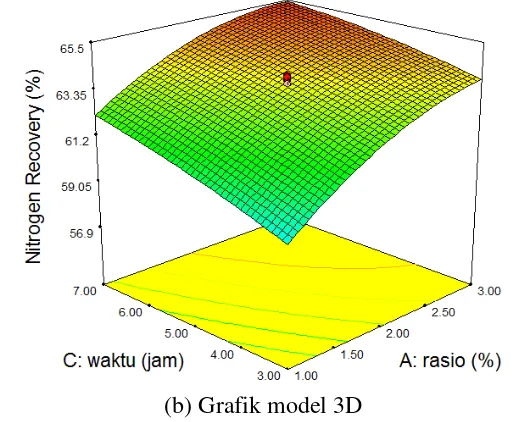
(b) Grafik model 3D
Gambar 3 Grafik model pengaruh faktor rasio dan waktu terhadap respon
nitrogen recovery dalam model kontur (a) dan 3D (b)
Berdasarkan Gambar 3(a) terlihat garis-garis kontur melingkar dengan titik merah berada di antara lingkaran keempat dan kelima terluar. Garis kontur melingkar bagian luar menunjukan nilai respon terbaik dimana nitrogen recovery
yang dihasilkan semakin besar. Angka enam pada titik merah kontur merupakan titik pusat dari rancangan yang dibuat dan dilakukan sebanyak enam kali. Pada respon nitrogen recovery nilai yang dicari adalah hidrolisat protein dengan
nitrogen recovery maksimum. Daerah berwarna biru menunjukkan nilai nitrogen recovery terendah sedangkan nilai tertinggi berada di daerah berwarna merah. Kondisi tersebut menunjukan bahwa nilai respon terbaik akan diperoleh dengan mengkondisikan faktor-faktor tidak pada titik pusat, tetapi bergeser ke arah kanan atas menuju daerah berwarna merah. Respon nitrogen recovery akan optimum pada rasio enzim/substrat dan waktu yang meningkat.
Pada Gambar 3(b) merupakan 3D respon permukaan Nitrogen Recovery
yang menunjukkan rasio enzim/substrat dan waktu hidrolisis berpengaruh signifikan terhadap protein yang berhasil terhidrolisis dan larut dalam air. Grafik yang disajikan hanya pengaruh faktor rasio dan waktu karena merupakan faktor yang berpengaruh signifikan terhadap respon. Analisa dan grafik selengkapnya dapat dilihat pada lampiran. Solusi optimasi yang direkomendasikan program Design Expert 7.0.0 untuk respon tunggal nilai dry material yaitu X1 = 3%, X2 = 55 oC, dan X3= 7 jam dengan prediksi nilai respon nitrogen recovery 65,59%.
Validasi Model
14
optimal yaitu rasio E/S 3%, suhu 53±2 oC, dan waktu 7 jam memberikan nilai aktual pada respon dry material 3,21% dan nitrogen recovery 65,07%.
Hasil aktual yang diharapkan adalah nilai yang sama dengan nilai prediksi atau masih dalam kisaran standar deviasi model. Berdasarkan nilai aktual yang diperoleh sangat mendekati nilai prediksi dari model matematis yang didapat. Respon dry material memiliki standar deviasi 0,119% dan dari setiap hasil verifikasi yang diperoleh masih dalam kisaran standar deviasi pada setiap percobaannya. Respon nitrogen recovery memiliki standar deviasi 2,2% dan dari setiap hasil verifikasi yang diperoleh masih dalam kisaran standar deviasi pada setiap percobaannya. Hal tersebut menunjukan bahwa model matematis yang diperoleh sudah valid untuk proses hidrolisis tepung ikan dengan protease enzim bromelin. Protein recovery hidrolisat protein ikan dari berbagai sumber protein dan berbagai protease juga dapat dilihat pada Tabel 6.
Tabel 6 Protein recovery proses hidrolisis dari berbagai sumber Sumber
protein Protease
Protein
Recovery (%) Sumber pustaka Scad fish Flavorzim 69 Thiansilakulkul et al. 2007
Capelin fish Alkalase 70,5 Shahidi et al. 1995
protein recovery yang berbeda, hal tersebut disebabkan oleh protease yang digunakan berbeda beda. Protein recovery optimum yang didapat dari penelitian ini menggunakan enzim bromelin yaitu 65,07% yang bila dibandingkan dengan hidrolisat protein dengan protease papain lebih tinggi sedangkan bila dibandingkan dengan flavourzyme, neutrase, dan alkalase lebih rendah. Flavorzim, neutrase dan terutama alkalase memang telah banyak dibuktikan merupakan protease yang paling optimum untuk menghasilkan hidrolisat protein dan telah banyak digunakan pada skala industri. Perbedaan kemampuan untuk mendapatkan protein recovery ini karena enzim bekerja secara spesifik. Enzim bromelin bekerja pada amino lisin, arginin, penilalanin, dan tirosin, sedangkan flavourzim, neutrase, dan alkalase bekerja secara broad specificity sehingga lebih efektif dan efisien dalam proses hidrolisis (Whitehurst and Oort 2010).
Karakteristik Produk
15
*) Hidrolisat protein ikan cair skala laboratorium **) Hidrolisat protein ikan cair skala pilot plant
Hidrolisat protein ikan cair optimum memiliki kandungan protein kasar berkisar 4,5% - 4,8%. Hasil kandungan protein tersebut merupakan protein kasar yang menggunakan metode dengan prinsip menghitung jumlah total nitrogen yang kemudian dikalikan dengan faktor konfersi 6,25 (untuk ikan). Nitrogen yang ada dalam tepung ikan tidak semua berasal dari asam amino tetapi juga berasal dari vitamin (niacin, riboflavin, dan B12) serta amoniak sehingga tidak murni seluruhnya protein sedangkan metode pengujian protein menggunakan metode kjeldahl yang mengukur jumlah total nitrogen (Winarno 2008). Produk juga dianalisa asam amino dan bobot molekulnya. Analisa asam amino dilakukan dengan metode HPLC (Performance Liquid Chromatography) . Profil asam amino yang didapat dari sampel produk memiliki asam amino tertinggi yaitu glutamat yang memang merupakan asam amino terbanyak penyusun daging dan ikan. Selain itu asam amino lisin juga banyak terdapat pada hidrolisat tersebut dikarenakan enzim bromelin memotong pada rantai salah satunya adalah lisin sehingga lisin menjadi asam amino bebas yang larut dalam air. Jadi hidrolisat protein ikan yang dihasilkan pada penelitian ini kaya asam amino glutamat, lisin, glisin, leusin, alanin, dan aspartat dengan yang tertinggi glutamat dan lisin. Jika dibandingkan dengan pepton komersil seperti bacto proteose peptone yang merupakan produk meat peptone dari BD Bionutrient, bacto proteose peptone
16
Gambar 4 Perbandingan asam amino hidrolisat protein ikan dengan Bacto Proteose Peptone
Analisa bobot molekul asam amino dilakukan dengan metode SDS PAGE (Sodium Dodecyl Sulfate – Polyacrilamide Gel Electrophoresis). Gambar 5 menunjukan bahwa bobot molekul hidrolisat protein terdiri dari sebagian kecil berukuran 150 kDa, antara 37 – 50 kDa, 25 kDa, dan sebagian besar < 15 kDa. Hal tersebut menunjukan bahwa hidrolisat protein yang dihasilkan memiliki bobot molekul yang sangat kecil, sehingga dapat dikatakan proses hidrolisis berhasil.
Standar Hidrolisat protein
Gambar 5 Analisis bobot molekul hidrolisat protein ikan dengan SDS-PAGE
17
Aplikasi Hidrolisat Protein Sebagai Media Pertumbuhan Bakteri
Hidrolisat protein atau juga sering disebut pepton atau peptida digunakan dalam membuat produk industri fermentasi dan bioteknologi (pasupuleti et al. 2010). Pepton merupakan hidrolisat protein yang banyak digunakan sebagai salah satu komponen nutrisi dalam media pertumbuhan mikroorganisme. Pepton dalam media pertumbuhan mikroba, berfungsi sebagai sumber nitrogen bagi mikroorganisme. Penggunaan pepton sangat luas mencakup penggunaan pada laboratorium mikrobiologi hingga pada industri berbasis bioteknologi.
Gambar 6 menunjukan kurva pertumbuhan Escherichia coli terendah adalah media dengan sumber nitrogen hidrolisat protein. Hal tersebut karena dengan nilai total nitrogen yang sama jumlah asam amino pada hidrolisat protein lebih rendah. Menurut Selvarasu et al. (2008), asam amino jenis serin, aspartat, dan glutamat merupakan asam amino yang sangat dibutuhkan oleh bakteri.
Gambar 6 Kurva pertumbuhan Escherichia coli
Berdasarkan profil asam amino yang diperoleh bila dikaitkan dengan kurva pertumbuhan maka hidrolisat protein dengan nilai total nitrogen yang sama memiliki asam amino yang lebih rendah sehingga pertumbuhan Escherichia coli
dengan hidrolisat protein sedikit lebih rendah dibandingkan bacto proteose peptone. Perbedaan pertumbuhan Escherichia coli dengan sumber nitrogen hidrolisat protein ikan dan bacto proteose peptone tidak terlalu signifikan karena memiliki asam amino dominan yang hampir sama walupun lebih rendah dan memiliki bobot molekul dominan yang sangat kecil yaitu <15 kDa seperti bacto proteose peptone dominan pada bobot molekul <10 kDa (BD 2009). Kemampuan hidrolisat protein lebih rendah karena bahan baku tepung ikan yang digunakan adalah tepung ikan rucah. Hidrolisat protein yang dihasilkan secara kualitas memang sedikit lebih rendah dari pepton komersil seperti becto proteose peptone
18
proses produksi hidrolisat protein juga halal karena hanya menggunakan air dan pengaturan kondisi suhu dan waktu. Oleh karena itu dari segi bahan baku dan proses produksi produk hidrolisat protein ini merupakan produk yang halal.
SIMPULAN DAN SARAN
Simpulan
Hidrolisat protein ikan dapat dihasilkan dengan hidrolisis menggunakan protease enzim bromelin. Pada analisis karakteristik tepung ikan kandungan protein kasar sebesar 71,57%. Hasil hidrolisis menggunakan enzim bromelin dengan aktivitas 1289,36 GDU (Gelatin Digestion Unit)/mg optimum pada rasio enzim/substrat 3%, suhu 55oC , dan waktu 7 jam. Dry material hidrolisat protein ikan yang diperoleh 3,21% dan protein recovery 65,07%. Suhu hidrolisis antara 45-55oC tidak berpengaruh signifikan terhadap protein recovery sedangkan penambahan rasio enzim/substrat dan waktu hidrolisis berpengaruh signifikan terhadap kenaikan protein recovery. Keberhasilan proses hidrolisis juga ditunjukan pada gambar hasil analisa bobot molekul. Hidrolisat protein yang dihasilkan memiliki bobot molekul 37 kDa, 25 kDa, dan yang paling dominan pada <15 kDa. Kemampuan hidrolisat protein ikan yang dihasilkan sebagai media pertumbuhan Escherichia coli sedikit lebih rendah dari pepton komersil. Hidrolisat protein ikan yang dihasilkan dari tepung ikan menggunakan enzim bromelin berpotensi sebagai sumber nitrogen yang murah dan halal pengganti pepton komersil.
Saran
19
DAFTAR PUSTAKA
Adler-Nissen J. 1986. Enzymic hydrolysis of food proteins. New York: Elsevier Applied Science Publishers.
Adler-Nissen J dan Olsen HS. 1979. The influence of peptide chain length of taste and functional properties of enzymatically modified soy protein. Di dalam:
Functionality and Protein Structure (ed A. Pour-El). Washington DC (US): American Chemical Society. hlm 125.
Adler-Nissen J dan Olsen HS. 1982. Taste and taste evaluation of soy protein hydrolysates. Di dalam: Charalambous G dan Inglett GE, editor. Chemistry of Food and Beverages – Recent Developments. New York (US): Academic Press. hlm 149.
[AOAC] Association of Official Agricultural Chemist. 2005. Official methods of analysis. Washington (US): Association of Official Analytical Chemists. [BD] Becton, Dickinson and Company. 2009. BD BionutrientsTM Technical
Manual Advanced Bioprocessing 3rd ed. Sparks (US): BD Diagnostics. Boniran, S. 1999. Quality Control untuk bahan baku dan produk akhir pakan
ternak. Kumpulan Makalah Feed Quality Management Workshop. American Soybean Association dan Balai Penelitian Ternak. Hlm. 2-7. Hall GM. 1992. Fish processing technology. In Ockerman, H.W. ed. Fishery
byproducts, pp. 155-192. New York: VCH publishers.
He S, Zhang W, dan Franco C. 2012. Optimization and physicochemical characterization of enzymatic hydrolysates of proteins from co-products of Atlantic salmon and Yellowtail kingfish. International Journal of Food Science and Technology. 47(11): 2397–2404.
Keller S. 1990. Making profits out of seafood wastes. Di dalam: Jensen NC, editor. Quality fish meal: specifications and use in aquaculture and fur farming. Alaska.
Kirk RW, Othmer DF. 1953. Encyclopedia of Chemical Technology. Volume II. New York (US): The Interscience Publ Inc.
Knights RJ. 1985. Processing and evaluation of the antigenicity of protein hydrolysates. Di dalam: Lifshitz F, editor. Nutrition for Special Need in Infancy. Protein Hydrolysates. New York (US): Marcel Dekker.hlm 105. Kristinsson HG, dan Rasco BA. (2000). Fish Protein Hydrolysates: Production,
Biochemical, and Functional Properties. Critical Reviews in Food Science and Nutrition. 40(1): 43 - 81.
Montgomery DC. 2001. Design and Analysis of Experimental 5th Edition. New York (US): John Wiley & Son.
Myers RH. 1971. Response Surface Method. Boston: Allyn and Bacon Inc.
Pasupuleti VK dan Demain AL. 2010. Protein Hydrolysates in Biotechnology. New York (US) : Springer.
Sanmartin E, Arboleya JC, Villamiel M, dan Moreno J. (2009). Recent advances in the recovery and improvement of functional proteins from fish processing by products: Use of protein glycation as an alternative method.
Comprehensive Reviews in Food Science and Food Safety. 8(4): 332–344. Saxelin M, Korpela R, and M¨ayr¨a-M¨akinen A. 2003. Introduction: classifying
20
editor. Functional Dairy Products. Cambridge (UK): CRC Press Woodhead Publishing Ltd. hlm 1–15.
Selvarasu S, Wei Ow DS, Lee SY, Lee MM, Weng Oh SK, Karimi IA, Lee DY. 2008. Characterizing Escherichia coli DH5α growth and metabolism in a
complex medium using genome-scale flux analysis. Biotechnology and Bioengineering.102: 923-934.
Shahidi FH, Xiao Qing, Synowieeki J, 1995. Production and characteristics of protein hydrolysates from capelin (Mallotus villosus). Food Chemistry.
53:285-293.
Thiansilakul Y, Benjakul S, Shahidi F. 2007. Composition, functional properties and antioxidative activity of protein hydrolysates prepared from round scad (Decapterus maruadsi). Food Chemistry. 103:1385-1394.
Whitehurst RJ dan Oort MV. 2010. Enzymes in Food Technology. Chicester (UK): John Wiley & Sons, Ltd.
Winarno FG. 2008. Kimia Pangan dan Gizi. Bogor: MBrio
21
LAMPIRAN
Lampiran 1 Prosedur analisis proksimat bahan
1. Kadar Air (AOAC 2005)
Cawan aluminium kosong dikeringkan dalam oven pada suhu 1050C selama 15 menit. Cawan lalu diangkat dan didinginkan dalam desikator selama 5 menit. Setelah itu cawan ditimbang dan dicatat beratnya. Sampel sebanyak 5 gram dimasukkan ke dalam cawan dan dikeringkan dalam oven 1050C selama 3 jam atau hingga beratnya konstan (perubahan berat tidak lebih dari 0.003 g). Cawan lalu diangkat, didinginkan dalam desikator, dan ditimbang berat akhirnya. Kadar air dihitung menggunakan persamaan berikut:
Kadar Air =
x 100%
Keterangan:
= berat cawan dan sampel sebelum dikeringkan (g) = berat cawan dan sampel setelah dikeringkan (g) = berat cawan kosong (g)
2. Kadar Abu (AOAC 2005)
Cawan porselin dipanaskan dalam tanur selama 15 menit kemudian didinginkan dalam desikator. Setelah dingin, cawan ditimbang dan dicatat beratnya. Kemudian 5 g sampel dimasukkan ke dalam cawan lalu diabukan di dalam tanur hingga diperoleh abu berwarna putih dan beratnya konstan. Pengabuan dilakukan dalam dua tahap, yaitu tahap 1 bersuhu 4000C lalu dilanjutkan pada suhu 5500C. Cawan lalu diangkat, didinginkan dalam desikator, dan ditimbang. Kadar abu dapat dihitung menggunakan persamaan berikut:
22
Kadar Lemak =
x 100%
Keterangan:
1 = berat sampel (g) 2 = berat lemak (g)
4. Kadar Protein Kasar (AOAC 2005)
Sampel sebanyak ± 0.2 g (kira kira membutuhkan 3-10 mi HCl 0.01N/ 0.02N) ditimbang dan dimasukkan ke dalam labu Kjeldahl 30 ml. Lalu ditambahkan 2 g K2SO4, 50 g HgO, 2 ml H2SO4 pekat, dan batu didih. Sampel kemudian didestruksi selama 1-1.5 jam hingga jernih dan didinginkan. Setelah itu, ditambahkan 2 ml air yang dimasukkan secara perlahan ke dalam labu dan didinginkan kembali. Cairan hasil destruksi (cairan X) dimasukkan ke dalam alat destilasi. Erlenmeyer 125 ml berisi 5 ml H3BO3 dan 2 tetes indikator (Methylen red : Methylen blue = 2:1) diletakkan di ujung kondensor alat destilasi dengan ujung selang kondensor terendam dalam larutan H3BO3 . Cairan X ditambahkan 10 ml NaOH - Na2S2O3 dan destilasi dilakukan hingga larutan dalam erlenmeyer ± 50 ml. Larutan dalam erlenmeyer kemudian dititrasi menggunakan HCl 0.02 N. Titik akhir titrasi ditandai dengan perubahan warna larutan dari hijau menjadi abu-abu. Prosedur yang sama dilakukan juga untuk penetapan blanko. Berikut perhitungan nitrogen dan kadar protein.
Kadar N (%) = x 100%
Kadar Protein = %N x 6,25
Keterangan:
= volume HCl untuk titrasi sampel (ml)
= volume untuk titrasi blanko (ml) = konsentrasi HCl (N)
= berat sampel (mg)
6,25 = koefisien untuk protein ikan
5. Karbohidrat (by difference)
23
Lampiran 2 Data lengkap hasil rancangan percobaan
24
Lampiran 3 Hasil analisa ANOVA dan respon permukaan dry material
1. Sequential Model Sum of Square
Source
Quadratic 0,0455 0,8970 0,8583 0,7847 0,1039 Suggested
25
4. Model Graphics 3D
Lampiran 4 Hasil analisa ANOVA dan respon permukaan nitrogen recovery
1. Sequential Model Sum of Square
Source
Sum of Squares df
Mean
Square F Value
p-value Prob > F
Mean vs Total 134863 1 134863
Linear vs Mean 129,6705 3 43,2235 40,5910 < 0.0001
2FI vs Linear 1,2856 3 0,4285 0,3774 0.7700
Quadratic vs 2FI 17,2092 3 5,7364 10,2353 0.0002
Cubic vs Quadratic 1,9908 4 0,4977 0,8686 0.4998
Residual 11,4600 20 0,5730
26
2. Lack of Fit Test
Source
Sum of
Squares df
Mean
Square F Value
p-value Prob > F
Linear 31,2008 11 2,8364 72,3577 < 0.0001
2FI 29,9153 8 3,7394 95,3926 < 0.0001
Quadratic 12,7061 5 2,5412 64,8266 < 0.0001 Suggested
Cubic 10,7152 1 10,7152 273,3463 < 0.0001 Aliased
Pure Error 0,7448 19 0,0392
3. Model Summary Statistics
Source
Std
Dev. R-Squared
Adjusted R-Squared
Predicted
R-Squared PRESS
Linear 1,0319 0,8023 0,7826 0,7439 41,3848
2FI 1,0656 0,8103 0,7681 0,7387 42,2380
Quadratic 0,7486 0,9168 0,8856 0,8220 28,7653 Suggested
Cubic 0,7570 0,9291 0,8830 0,7576 39,1837 Aliased
27
RIWAYAT HIDUP
Penulis dilahirkan di Bandarlampung pada tanggal 8 Mei 1993 dari ayah Yustinus Suganda dan ibu Lusia Sudarni. Penulis adalah putera pertama dari tiga bersaudara. Tahun 2011 penulis lulus dari SMA Fransiskus Bandarlampung dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) tertulis dan diterima di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian.