PEMBUATAN BIOETANOL SECARA FERMENTASI DARI HIDROLISAT TONGKOL JAGUNG DENGAN
MENGGUNAKAN CAMPURAN Zymomonas mobilis DAN Saccharomyces cerevisiae
SKRIPSI
Oleh
DERALISA GINTING 120405124
SKRIPSI INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN PERSYARATAN MENJADI SARJANA TEKNIK
DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
2017
PERNYATAAN KEASLIAN SKRIPSI
Saya menyatakan dengan sesungguhnya bahwa skripsi dengan judul:
PEMBUATAN BIOETANOL SECARA FERMENTASI DARI HIDROLISAT TONGKOL JAGUNG DENGAN
MENGGUNAKAN CAMPURAN Zymomonas mobilis DAN Saccharomyces cerevisiae
Yang dibuat untuk melengkapi sebagian persyaratan menjadi Sarjana Teknik pada Departemen Teknik Kimia Fakultas Teknik Universitas Sumatera Utara, sejauh yang saya ketahui bukan merupakan tiruan atau duplikasi dan skripsi yang sudah dipublikasikan dan atau pernah dipakai untuk mendapatkan gelar kesarjanaan di lingkungan Universitas Sumatera Utara maupun Perguruan Tinggi atau instansi manapun, kecuali bagian yang sumber informasinya dicantumkan sebagaimana mestinya.
Medan, Januari 2017
Deralisa Ginting NIM: 120405124
PRAKATA
Puji syukur kehadirat Tuhan Yang Maha Esa karena atas rahmat-Nya sehingga skripsi ini dapat diselesaikan. Tulisan ini merupakan skripsi dengan judul “Pembuatan Bioetanol Dari Hidrolisat Tongkol Jagung Secara Fermentasi Dengan Menggunakan Campuran Zymomonas mobilis Dan Saccharomyces cerevisiae”, berdasarkan hasil penelitian yang penulis lakukan di Departemen Teknik Kimia Fakultas Teknik Sumatera Utara. Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar sarjana teknik.
Adapun hal yang dapat diberikan dari hasil penelitian ini adalah membantu pengolahan sampah organik tongkol jagung yang dapat dijadikan sebagai sumber energi alternative yaitu bioetanol dengan menggunakan campuran mikroba Zymomonas mobilis dan Saccharomyces cerevisiae dalam proses fermentasinya.
Selama melakukan penelitian hingga penulisan skripsi ini, penulis banyak mendapatkan bantuan dari berbagai pihak, untuk itu penulis mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada:
1. Dr.Ir.Fatimah, M.T. selaku dosen pembimbing.
2. Ir. Renita Manurung, M.T. selaku koordinator skripsi.
3. Dr. Amir Husin, S.T., M.T. selaku dosen penguiji I atas kritik dan saran yang telah diberikan.
4. Maya Sarah, S.T., M.T., Ph.D selaku dosen penguiji II atas kritik dan saran yang telah diberikan.
5. Staf Pengajar dan Staf Administrasi Fakultas Teknik Departemen Teknik Kimia Universitas Sumatera Utara Medan.
6. Veronica, Christin, Christina, Jonathan, Jefri, Trio, Arius dan teman sejawat 2012 serta abang, kakak senior dan adik-adik stambuk 2015.
Medan, Januari 2017 Penulis,
Deralisa Ginting NIM:120405124
DEDIKASI
Skripsi ini saya persembahkan untuk :
Bapak & Ibu tercinta
Bapak Reken Ginting dan Ibu Arisma Purba
Mereka adalah orang tua hebat yang telah membesarkan, mendidik, dan mendukung dengan penuh kesabaran dan kasih
sayang.
Terima kasih atas pengorbanan, nasehat dan do’a yang tiada hentinya yang telah kelian berikan selama ini.
RIWAYAT HIDUP PENULIS
Nama : Deralisa Ginting NIM : 120405124
Tempat, Tanggal Lahir : Medan, 05 Desember 1994 Nama Orang Tua : Ir. Reken Ginting
Arisma Purba, Spd
Alamat Orang Tua : Jl. Setia Budi No.57, Simpang Selayang, Medan
Asal Sekolah :
TK Katolik Assisi Medan tahun 1998 – 2000
SD Katolik Assisi Medan tahun 2000 – 2006
SMP Putri Cahaya Medan tahun 2006 – 2009
SMA Swasta Cahaya Medan tahun 2009 – 2012 Pengalaman Organisasi:
1. Anggota English Club FT USU Periode 2013/2014.
2. Anggota Himpunan Mahasiswa Teknik Kimia (HIMATEK) FT USU Periode 2012-2017.
3. Anggota Ikatan Mahasiswa Karo FT USU Periode 2012-2016.
Artikel yang akan dipublikasikan dalam jurnal :
Pembuatan Bioetanol Dari Hidrolisat Tongkol Jagung Secara Fermentasi Dengan Menggunakan Campuran Zymomonas mobilis Dan Saccharomyces cerevisiae dalam jurnal Teknik Kimia USU.
ABSTRAK
Penelitian pembuatan bioetanol dari hidrolisat tongkol jagung dengan menggunakan campuran Zymomonas mobilis dan Saccharomyces cerevisiae telah siap dilakukan. Hidrolisat yang digunakan diperoleh dari penguraian tongkol jagung dengan menggunakan mikroba yang telah dilakukan peneliti sebelumnya. Tujuan penelitian ini adalah untuk mempelajari kinerja dari campuran Zymomonas mobilis dan Saccharomyces cerevisiae dalam mengubah hidrolisat (glukosa) menjadi bioetanol pada berbagai variasi waktu. Diperoleh kandungan hidrolisat tongkol jagung (glukosa awal) yaitu sebesar 5,869 g/ml. Fermentasi bioetanol dilakukan dengan variasi waktu fermentasi (1, 3, 5 dan 7 hari) dan dengan perbandingan jumlah mikroba (Zymomonas mobilis : Saccharomyces cerevisiae = 1:1; 1:2 dan 2:1) (%v/v) pada temperatur ruangan. Bioetanol yang diperoleh kemudian dianalisis dengan menggunakan kromatografi gas. Diperoleh yield bioetanol optimum adalah dengan menggunakan perbandingan mikroba 2:1 (Zymomonas mobilis : Saccharomyces cerevisiae) pada waktu fermentasi 3 hari yaitu sebesar 6,31 %.
Kata kunci: Bioetanol, hidrolisat tongkol jagung, Saccharomyces cerevisiae dan Zymomonas mobilis
ABSTRACT
Study on bioethanol production from corn cobs hydrolysis using a mixture of Zymomonas mobilis and Saccharomyces cerevisiae has been conducted. Hydrolysis used were obtained from the decomposition of corn cobs using microbes from preview study. The purpose of this study is to evaluate the conversion of hydrolysis of corn cobs into bioethanol by mixture of Zymomonas mobilis and Saccharomyces cerevisiae.
Glucose of corn cobs hydrolysis is equal to 5,869 g/ml. bioethanol fermentation is carried out at variation fermentation time (1, 3, 5 and 7 days) and combination of number of cultures ( Zymomonas mobilis : Saccharomyces cerevisiae = 1:1; 1:2 and 2:1) (%v/v) at room temperature. Bioethanol obtained from this study investigation using gas chromatography. The optimum bioethanol yield is obtained by using combination of (Zymomonas mobilis : Saccharomyces cerevisiae = 2:1) 3 days is equal to 6,31%.
Keywords: Bioethanol, corn cobs hydrolysis, Saccharomyces cerevisiae and Zymomonas mobilis
DAFTAR ISI
Halaman
PERNYATAAN KEASLIAN SKRIPSI i
PENGESAHAN ii
PRAKATA iii
DEDIKASI iv
RIWAYAT HIDUP PENULIS v
ABSTRAK vi
ABSTRACT vii
DAFTAR ISI viii
DAFTAR GAMBAR xi
DAFTAR TABEL xii
DAFTAR LAMPIRAN xiii
DAFTAR SINGKATAN xiv
BAB I PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Perumusan Masalah 4
1.3 Tujuan Penelitian 4
1.4 Manfaat Penelitian 4
1.5 Ruang Lingkup Penelitian 4
BAB II TINJAUAN PUSTAKA 6
2.1 Tongkol Jagung 6
2.2 Produksi Bioetanol 7
2.3.1 Pretreatment Lignoselulosa 8
2.3.2 Hidrolisis Enzim 8
2.3.3 Fermentasi 9
2.3 Faktor-Faktor yang Mempengaruhi Fermentasi 10
2.4 Mikroorganisme Produksi Bioetanol 11
2.4.1 Zymomonas Mobilis 11
2.4.2 Sacharomyces cerevisiae 12
2.5 Bioetanol 14
2.6 Analisis Gula Reduksi 16
2.7 Perhitungan Jumlah Mikroorganisme 17
BAB III METODOLOGI PENELITIAN 18
3.1 Lokasi Penelitian 18
3.2 Bahan dan Peralatan 18
3.2.1 Bahan Baku 18
3.2.2 Bahan Penunjang 18
3.2.3 Peralatan 18
3.3 Prosedur Percobaan 19
3.3.1 Prosedur Pembenihan Isolat Zymomonas mobilis dan
Sacharomyces cereviae 20
3.3.2 Prosedur Persiapan Inokulum Zymomonas mobilis dan
Sacharomyces cereviae 20
3.3.3 Prosedur Fermentasi Hidrolisat Tongkol Jagung 21
3.3.4 Prosedur Analisis Densitas 21
3.3.5 Prosedur Analisis Viskositas 22
3.3.6 Prosedur Analisis pH 22
3.3.7 Prosedur Analisis Kadar Gula 22
3.3.8 Prosedur Analisis Kadar Etanol 23
3.4 Flowchart Penelitian 24
BAB IV HASIL DAN PEMBAHASAN 33
4.1 Hidrolisat Tongkol Jagung 33
4.2 Pertumbuhan Mikroba 33
4.3 Produksi Bioetanol 34
4.4 Pengaruh Waktu Fermentasi Hidrolisat Tongkol Jagung
Terhadap Yield Bioetanol 35
4.5 Pengaruh Waktu Fermentasi Hidrolisat Tongkol Jagung
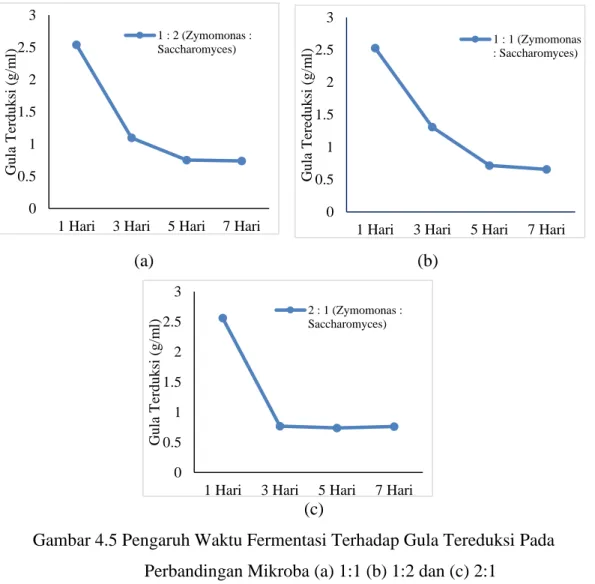
Terhadap Gula Tereduksi 37
4.6 Pengaruh Waktu Fermentasi Hidrolisat Tongkol Jagung
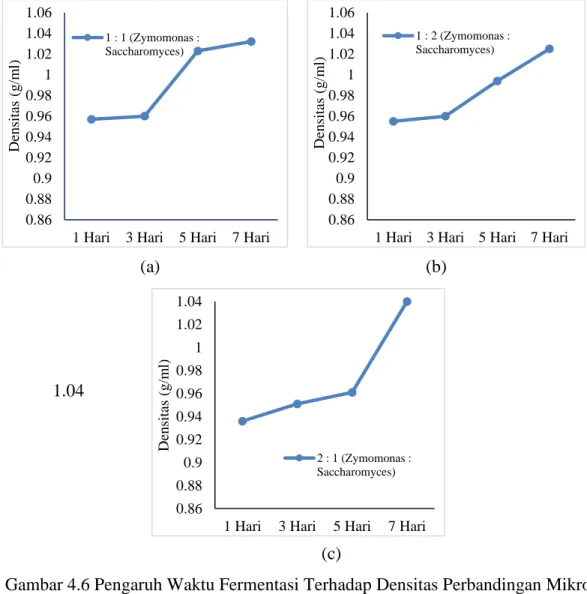
Terhadap Densitas 39
4.7 Pengaruh Waktu Fermentasi Hidrolisat Tongkol Jagung
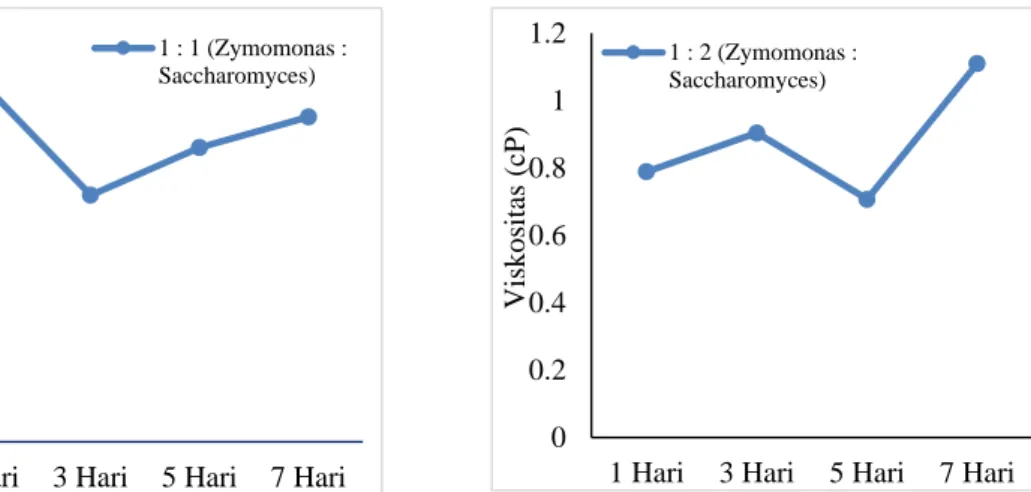
Terhadap Viskositas 41
4.8 Pengaruh Variasi Perbandingan Mikroba Terhadap
Yield Bioetanol 43 4.9 Pengaruh Variasi Perbandingan Mikroba Terhadap
Gula Terduksi 45
4.10 Pengaruh Variasi Perbandingan Mikroba Terhadap
Densitas 48
4.11 Pengaruh Variasi Perbandingan Mikroba Terhadap
Viskositas 50
BAB V KESIMPULAN DAN SARAN 52
5.1 Kesimpulan 52
5.2 Saran 52
DAFTAR PUSTAKA 54
LAMPIRAN A DATA PENELITIAN 58
LAMPIRAN B CONTOH PERHITUNGAN 61
LAMPIRAN C DOKUMENTASI PENELITIAN 63
DAFTAR GAMBAR
Halaman
Gambar 3.1 Diagram Alir Produksi Bioetanol 20
Gambar 3.2 Flowchart Pembenihan Isolat Mikroba 26
Gambar 3.3 Flowchart Persiapan Inokulum Mikroba 27
Gambar 3.4 Flowchart Pembuatan Starter Untuk Proses Fermentasi 30
Gambar 3.5 Flowchart Proses Fermentasi Hidrolisat Tongkol Jagung 31
Gambar 3.6 Flowchart Analisis Densitas 32
Gambar 3.7 Flowchart Analisis Viskositas 33 Gambar 3.8 Flowchart Analisis pH 34 Gambar 3.9 Flowchart Analis Kadar Gula 35
Gambar 3.10 Flowchart Analisis Kadar Etanol 36
Gambar 4.1 Hidrolisat Tongkol Jagung 34
Gambar 4.2 Media PDA Setelah Disterilkan dengan Autoklaf 35
Gambar 4.3 Mikroba Yang Digunakan 36
Gambar 3.10 Flowchart Analisis Kadar Etanol 36 Gambar 4.4 Pengaruh Waktu Fermentasi Hidrolisat Tongkol Jagung
Terhadap Yield Bioetanol 35
Gambar 4.5 Pengaruh Waktu Fermentasi Hidrolisat Tongkol Jagung
Terhadap Gula Tereduksi 37
Gambar 4.6 Pengaruh Waktu Fermentasi Hidrolisat Tongkol Jagung
Terhadap Densitas 39
Gambar 4.7 Pengaruh Waktu Fermentasi Hidrolisat Tongkol Jagung
Terhadap Viskositas 41
Gambar 4.8 Pengaruh Variasi Perbandingan Mikroba Terhadap
Yield Bioetanol 43
Gambar 4.9 Pengaruh Variasi Perbandingan Mikroba Terhadap
Gula Terduksi 45
Gambar 4.10 Pengaruh Variasi Perbandingan Mikroba Terhadap
Densitas 48
Gambar 4.11 Pengaruh Variasi Perbandingan Mikroba Terhadap
Viskositas 50
DAFTAR TABEL
Halaman
Tabel 2.1 Klasifikasi Ilmiah Zymomonas mobilis 11
Tabel 2.2 Klasifikasi Ilmiah Sacharomyces cerevisiae 12 Tabel 2.3 Sifat Fisika dan Kimia Etanol 14
DAFTAR LAMPIRAN
LAMPIRAN A DATA PENELITIAN 58
A.1 Data dan Kurva Kalibrasi Larutan Glukosa Standar 58
A.2 Data Analisis GC Sampel 59
A.3 Data Analisis Spektrofotometer 59
A.4 Data Densitas Fermentasi 60
A.5 Data Viskositas Fermentasi 60
LAMPIRAN B CONTOH PERHITUNGAN 61
B.1 Perhitungan Densitas 61
B.2 Perhitungan Viskositas 61
B.3 Perhitungan Konsentrasi 61
B.4 Perhitungan Yield Bioetanol 62
LAMPIRAN C DOKUMENTASI PENELITIAN 63
C.1 Dokumentasi Hidrolisat Tongkol Jagung 63
C.2 Dokumentasi Proses Pembenihan Isolat 63
C.3 Dokumentasi Hasil Proses Fermentasi 64
C.4 Dokumentasi Hasil Analisis Kadar Glukosa 64
C.5 Hasil Fermentasi Menggunakan Kromatografi Gas 65
DAFTAR SINGKATAN
BPOM Badan Pengawasan Obat dan Makanan
GC Gas Chromatography
PPKS Pusat Penelitian Kelapa Sawit
BAB I
PENDAHULUAN
1.1. Latar Belakang
Konsumsi energi yang semakin meningkat seiring dengan bertambahnya penduduk dan laju pertumbuhan ekonomi menyebabkan terjadinya kenaikan harga bahan bakar. Kenaikan tersebut disebabkan karena menipisnya sumber minyak bumi di Indonesia. Oleh karena itu diperlukan bahan bakar alternatif dengan bahan baku terbarukan. Dalam pengembangan energi terbarukan ini memiliki beberapa kendala, diantaranya adalah ketersediaan bahan, keamanan pasokan, harga, kemudahan penanganan dan penggunaannya [1].
Pemerintah masih mengimpor sebagian BBM untuk memenuhi kebutuhan dalam negeri. Melihat kondisi tersebut, pemerintah telah mengeluarkan Peraturan Presiden Republik Indonesia Nomor 5 Tahun 2006 tentang Kebijakan Energi Nasional untuk mengembangkan sumber energi alternatif sebagai pengganti BBM. Kebijakan tersebut telah menetapkan sumber daya yang dapat diperbaharui seperti bahan bakar nabati sebagai alternatif pengganti BBM. Bahan bakar berbasis nabati diharapkan dapat mengurangi terjadinya kelangkaan BBM, sehingga kebutuhan akan bahan bakar dapat terpenuhi [2].
Bioetanol yang berasal dari biomassa merupakan salah satu bentuk energi biomassa yang memiliki potensi sebagai bahan bakar transportasi yang berkelanjutan [3]. Bioetanol adalah cairan biokimia dari proses fermentasi gula dari sumber glukosa, selulosa, dan pati atau karbohidrat menggunakan bantuan mikroorganisme.
Keuntungan atau kelebihan dari penggunaan bioetanol yaitu dapat diproduksi terus menerus.
Salah satu bahan baku yang dapat dijadikan bioetanol adalah tongkol jagung.
Tongkol jagung mengandung selulosa 48%, pentosan 36%, lignin 10%, abu 4%, dan air 2%. Dilihat dari kandungan selulosa yang cukup tinggi, maka tongkol jagung memungkinkan untuk dimanfaatkan sebagai bahan baku untuk pembuatan bioetanol [4].
Setiap panen jagung diperkirakan jagung yang dihasilkan sekitar 70 %, sementara 30 % dalam bentuk limbah berupa tongkol jagung [4]. Pada industri jagung pipil akan dihasilkan limbah organik antara lain berupa limbah tongkol jagung. Salah satu solusi untuk menangani jumlah limbah berupa tongkol jagung adalah menjadikannya ke dalam bentuk produk yang lebih berharga yaitu bioetanol. Produksi bioetanol dari limbah tongkol jagung dapat dilakukan dengan memanfaatkan teknologi fermentasi [5].
Beberapa penelitian yang telah dilakukan yang berkaitan dengan pemanfaatan limbah lignoselulosa untuk dijadikan sebagai bioetanol. Berdasarkan hasil penelitian bioetanol oleh Yatim, M (2011) yang menggunakan inokulum Zymomonas mobilis dengan bahan baku limbah kulit kopi diperoleh hasil maksimum pada penambahan inokulum sebesar 11% dan waktu fermentasi selama 7 hari didapatkan kadar bioetanol sebesar 9,04 (%v/v) . Sedangkan berdasarkan penelitian Fitria Merina (2011) yang menggunakan inokulum Saccharomyces cerevisiae dan Zymomonas mobilis dengan bahan baku eceng gondok diperoleh hasil maksimum pada penambahan inokulum sebesar 20 % dan waktu fermentasi selama 5 hari didapatkan kadar bioetanol sebesar 5,27% (v/v). Sedangkan berdasarkan hasil penelitian Faizah dan Hadi (2011), kadar bioetanol yang dihasilkaan pada proses fermentasi dengan inokulum Zymomonas mobilis berkisar antara 0,07-9,98%. Sedangkan untuk inokulum ragi tape berkisar antara 0,13-6,30%. Hal ini membuktikan bahwa pembuatan bioetanol dengan menggunakan inokulum Zymomonas mobilis lebih baik dari pada dengan menggunakan ragi tape.
Begitu pula penelitian Dewi Indriany (2013) pembuatan bioetanol dari tongkol jagung yang didahului oleh proses hidrolisis dengan perbandingan konsentrasi asam sulfat 5 : 1 (v/b) dan menggunakan Saccharomyces cerevisiae dengan waktu fermentasi 48 jam diperoleh kadar alkohol sebesar 9 % (v/v). Sementara itu, penelitian Siti Mushlilah (2013) yang menggunakan Zymomonas mobilis dengan bahan baku tongkol jagung diperoleh hasil maksimum pada penggunaan hidrolisis campuran yaitu enzim excekzme, H2SO4 dan HCl pada pH buffer 5 dan waktu fermentasi 3 hari didapatkan kadar etanol 10,48 % (v/v). Dan pada penelitian Zul Fadly Khaira (2014) yang menggunakan Saccharomyces cerevisiae dengan bahan baku tongkol jagung diperoleh hasil maksimum apabila digunakan hidrolisis enzim selulase sebanyak 11 %
(v/v) dan fermentasi secara Simultaneous Saccharification and Fermentasi (SFF) selama 72 jam didapatkan kadar etanol 8 %.
Dari penelitian yang terdahulu oleh Siti Mushlilah (2013), Dewi Indriany (2013) dan Zul Fadly Khaira (2014) dapat dilihat bahwa tongkol jagung berpotensi menjadi bioetanol. Namun, penelitian yang telah dilakukan hanya menggunakan satu jenis mikroorganisme pada saaat proses fermentasi yaitu penggunaan Saccharomyces cerevisiae saja atau Zymomonas mobilis saja. Adapun penelitian terdahulu yang menggunakan dua jenis mikroorganisme pada proses fermentasi yaitu penelitian yang dilakukan oleh Fitria Merina (2011) yang menggunakan eceng gondok sebagai bahan baku. Karena belum adanya penelitian yang menggunakan dua mikroorganisme pada bahan baku tongkol jagung sehingga, penelitian ini akan menggunakan tongkol jagung sebagai bahan baku pembuatan bioetanol dengan menggunakan Zymomonas mobilis dan Saccharomyces cerevisiae secara bersamaan pada proses fermentasi. Oleh sebab itu, diharapkan setelah dikonversi menjadi bioetanol tongkol jagung dengan menggunakan dua mikroorganisme menghasilkan kadar etanol yang tinggi.
Salah satu metode pembuatan etanol yang paling terkenal adalah fermentasi.
Untuk proses fermentasi pada penelitian ini akan menggunakan campuran Zymomonas mobilis dan Saccharomyces cerevisiae. Proses fermentasi dilakukan setelah tahap pretreatment dan hidrolisis. Tahap pretreatment digunakan untuk menghilangkan kadar lignin yang dapat menghambat terbentuknya glukosa. Hidrolisis digunakan untuk memecahkan selulase menjadi glukosa [4].
Proses hidrolisis yang akan dilakukan pada penelitian ini menggunakan hidrolisat dari hidrolisis enzim tongkol jagung. Hidrolisis enzim lebih banyak dikembangkan dibandingkan dengan menggunakan hidrolisis asam (misalnya asam sulfat) karena glukosa yang dihasilkan lebih banyak dibandingkan menggunakan hidrolisis asam. Sehingga proses pembuatan glukosa dari pati – patian sekarang ini lebih banyak menggunakan hidrolisis enzim. Dalam proses konversi karbohidrat menjadi gula (glukosa) dilakukan penambahan air dan enzim kemudian dilakukan proses peragian atau fermentasi gula menjadi etanol dengan menambahkan yeast atau ragi [6].
1.2. Rumusan Masalah
Rumusan masalah utama dalam penelitian ini adalah apakah kombinasi Zymomonas mobilis dan Sacharomyces cerevisiae dapat menghasilkan kadar etanol yang tinggi dari hidrolisat tongkol jagung yang dihasilkan oleh hidrolisis enzim dengan menggunakan Trichormderma dan Aspergillus Niger.
1.3. Tujuan Penelitian
Berdasarkan perumusan masalah yang ada, tujuan penelitian ini adalah sebagai berikut :
1. Mempelajari pembuatan bioetanol dari hidrolisat tongkol jagung menggunakan campuran inokulum Zymomonas mobilis dan Saccharomces cerevisiae.
2. Mengetahui pengaruh waktu fermentasi dan jumlah inokulum terhadap perolehan bioetanol.
1.4. Manfaat Penelitian
Manfaat dari penelitian ini adalah :
1. Memberikan informasi mengenai kadar bioetanol yang dihasilkan dari tongkol jagung dengan menggunakan inokulum Zymomonas mobilis dan Saccharomces cerevisiae secara bersamaan.
2. Memberikan informasi pengolahan pada limbah tongkol jagung.
3. Membantu menguarai pencemaran lingkungan akibat sampah buah.
1.5. Lingkup Penelitian
Penelitian Pembuatan Bioetanol dari Tongkol Jagung menggunakan Saccharomyces cerevisiae dan Zymomonas mobilis ini dilakukan di Laboratorium Mikrobiologi Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara.
Bahan – bahan yang digunakan dalam penelitian ini antara lain tongkol jagung, NaOH, mikroba Saccharomyces cerevisiae, Zymomonas mobilis, hidrolisat campuran enzim, aquadest. Peralatan yang digunakan adalah timbangan elektrik, kertas pH, pipet
tetes, tabung reaksi, spektofotometer, kromotografi gas, oven, incubator, batang pengaduk, peralatan kaca, kawat ose, cawan petri, dan autoclave.
Pada pembuatan bioetanol ini menggunakan hasil hidrolisat enzim yang berfungsi untuk mengubah selulase menjadi glukosa. Kemudian dilakukan proses fermentasi dilakukan dengan variasi waktu fermentasi dan mikroba yang digunakan.
Pada proses fermentasi yang mengubah glukosa menjadi etanol menggunakan campuran Zymomonas mobilis dan Saccharomyces cerevisiae.
Variabel bebas yang dilakukan dalam penelitian ini meliputi : 1. Lama Fermentasi : 1,3, 5 dan 7 hari 2. Perbandingan starter yang
digunakan (%v/v) : 1:1, 2:1 dan 1:2
Variabel tetap yang digunakan dalam penelitian ini adalah:
- Bahan baku : Hidrolisat tongkol jagung sebanyak 50 ml - Suhu Fermentasi : ± 25 oC
- Starter mikroba : 10 % (v/v)
- Starter yang digunaakan : Zymomonas mobilis dan Saccharomyces cerevisiae
Parameter yang dianalisa dan diukur adalah : 1. Pada Hidrolisis :
2. Proses Fermentasi :
3. Hasil Destilasi Etanol :
- Analisa kadar gula akhir
u k u r v o l u m e c a i - Diukur temperatur
- Diukur volume cairan hasil fermentasi - Analisis kadar gula akhir
D iuku r volu me cair an hasi l - Diukur densitas (25 oC)
- Diukur viskositas (25 oC) - Diukur pH (25 oC) - Analisis kadar etanol
BAB II
TINJAUAN PUSTAKA
2.1. Tongkol Jagung
Salah satu limbah pertanian berlignoselulosa yang dapat digunakan sebagai bahan baku pembuatan bioetanol adalah limbah jagung. Limbah jagung meliputi jerami dan tongkol. Penggunaan jerami jagung semakin populer untuk makanan ternak, sedangkan untuk tongkol jagung belum ada pemanfaatan yang bernilai ekonomi [7]. Umumnya jagung mengandung kurang lebih 30 % tongkol jagung, sehingga akan menambah jumlah limbah tidak bermanfaat yang merugikan lingkungan jika tidak ditangani dengan benar [8]. Kelebihan limbah tongkol jagung untuk pembuatan bioetanol antara lain ketersediaannya yang melimpah, dan tidak bersaing dengan sumber makanan [2].
Limbah lignoselulosik adalah limbah pertanian yang mengandung selulosa, hemiselulosa, dan lignin. Tongkol jagung merupakan salah satu limbah lignoselulosik yang banyak tersedia di Indonesia. Produksi jagung dapat bertambah setiap tahunnya.
Pertambahan produksi jagung ini disebakan oleh adanya kenaikan luas panen seluas 16,51 ribu hektar dapat meningkatkan produksi sebanyak 0,43 % serta peningkatan produktivitas sebesar 1,15 kuintal/hektar dapat meningkat sebesar 2,37 % terhadap tumbuhan jagung. Pada tahun 2014 diperoleh sebanyak 19,03 juta ton pipilan kering.
Jumlah ini mengalami kenaikan sebanyak 0,52 juta ton (2,81%) dibandingkan tahun 2013 [9].
Karakteristik kimia dan fisika dari tongkol jagung terdiri dari senyawa kompleks lignin 10 %, hemiselulose 35 %, dan selulose 48 % [9]. Selulosa hampir tidak pernah ditemui dalam keadaan murni melainkan selalu berikatan dengan bahan lain yaitu lignin dan hemiselulosa. Serat selulose alami terdapat di dalam dinding sel tanaman dan material vegetatif lainnya. Selulose murni mengandung 44,4% C; 6,2%
H dan 49,3% O. Rumus empiris selulose adalah (C6H10O5)n, dengan banyaknya satuan glukosa yang disebut dengan derajat polimerisasi (DP), dimana jumlahnya mencapai 1.200 – 10.000 dengan panjang polimer 0,25-5 mikron [10]. Panjang molekul selulose ditentukan oleh jumlah unit 4 glucan di dalam polimer, disebut dengan derajat
polimerisasi. Derajat polimerisasi selulose tergantung pada jenis tanaman dan umumnya dalam kisaran 200-27.000 unit glukosa.
Selulose dapat dihidrolisis menjadi glukosa dengan menggunakan asam atau enzim [11]. Fraksi selulose sebagai komponen terbesar dari tongkol jagung dan merupakan hasil samping ekstraksi hemiselulosa, sebenarnya dapat dijadikan salah satu bahan baku alternatif sebagai sumber karbon untuk memproduksi etanol yaitu dengan cara hidrolisis menggunakan asam menjadi gula-gula sederhana terutama heksosa (glukosa dan manosa) [12].
Hemiselulose terdiri atas 2-7 residu gula yang berbeda, hemiselulose berbeda dengan selulose karena komposisinya teridiri atas berbagai unit gula, disebabkan rantai molekul yang pendek dan percabangan rantai molekul. Unit gula (gula anhidro) yang membentuk hemiselulosa dapat dibagi menjadi kompleks seperti pentosa, heksosa, asam keksuronat dan deoksi-heksosa. Sedangkan, lignin adalah polimer aromatik kompleks yang terbentuk melalui polimerisasi tiga dimensi dari sinamil alkohol (turunan fenil propane) dengan bobot melekul mencapai 11.000. Dengan kata lain, lignin adalah makromolekul dari polifenil. Polimer lignin dapat dikonversi ke monomernya tanpa mengalami perubahan pada bentuk dasarnya. Lignin yang melindungi selulose bersifat tahan terhadap hidrolisis karena adanya ikatan arilalkil dan ikatan eter [13].
2.2. Produksi Bioetanol
Produksi bioetanol dari tanaman yang mengandung lignin dan pati atau karbohidrat, dapat dilakukan melalui konversi karbohidrat menjadi gula atau glukosa dengan beberapa metode diantaranya dengan pretreatment dan hidrolisis secara enzimatis. Glukosa yang diperoleh selanjutnya dilakukan proses fermentasi atau peragian dengan menambahkan yeast atau ragi sehingga diperoleh bioetanol [14].
2.2.1. Pretreatment Lignoselulosa
Pretreatment biomassa lignoselulosa harus dilakukan untuk mendapatkan hasil yang tinggi. Tujuan dari pretreatment adalah untuk meningkatkan kemampuan area permukaan (porositas) selulosa sehingga dapat meningkatkan konversi selulosa menjadi glukosa (gula fermentasi). Faktor-faktor yang mempengaruhi kemampuan enzim menghidrolisis bahan lignoselulosa diantaranya kandungan lignin dan hemiselulosa dan tingkat kekristalan selulosa [4].
2.2.2 Hidrolisis Enzim
Hidrolisis merupakan proses pemecahan polisakarida didalam biomassa lignoselulosa, yaitu selulosa dan hemiselulosa menjadi monomer gula penyusunnya.
Pada hidrolisis sempurna selulosa akan menghasilkan glukosa, sedangkan hemoselulosa menghasilkan beberapa monomer gula pentosa (C5) dan heksosa (C6).
Hidrolis dapat dilakukan secara kimia (asam) atau enzimatik [14].
Enzim merupakan protein sel hidup yang berperan sebagai biokatalisator dalam proses biokimia, baik yang terjadi di dalam sel maupun di luar sel. Selain itu, enzim merupakan katalisator sejati yang dapat meningkatkan kecepatan reaksi kimia spesifik dengan nyata, suatu reaksi kimia akan berlangsung sangat lambat tanpa adanya enzim [15].
Hidrolisis enzim merupakan proses penguraian suatu polimer yang kompleks menjadi monomer penyusunnya dengan menggunakan enzim. Hidrolisis enzimatis memiliki beberapa keuntungan dibandingkan hidrolisis asam, antara lain tidak terjadi degradasi gula hasil hidrolisis, kondisi proses yang lebih lunak (suhu rendah, pH netral), berpotensi memberikan hasil yang tinggi, dan biaya pemeliharaan peralatan relatif rendah karena tidak ada bahan yang korosif [15].
Aplikasi hidrolisis menggunakan enzim secara sederhana dilakukan dengan mengganti tahap hidrolisis asam dengan tahap hidrolisis enzim selulase. Enzim selulase merupakan kumpulan dari beberapa enzim yang bekerja bersama untuk hidrolisis selulosa. Enzim selulase berperan dalam hidrolisis selulosa dengan memecah ikatan β-1,4-D-glikosida untuk menghasilkan oligosakarida maupun glukosa. Berdasarkan aktivitasnya terhadap berbagai substrat, selulase diklasifikasikan
menjadi tiga tipe, yaitu endoglukanase, β-glukosidase dan selobiohidrolase atau eksoglukanase [16].
Menggunakan mikroorganisme tertentu dalam hidrolisis enzim akan menghasilkan partikel yang dinamakan selulosom. Partikel inilah yang akan terdisintegrasi menjadi enzim - enzim, yang secara sinergis mendegradasi selulosa.
Fungi adalah mikroorganisme utama yang dapat memproduksi selulase, meskipun ada beberapa bakteri yang dapat menghasilkan aktivitas selulase. Fungi berfilamen seperti Tricoderma reseii dan Aspergillus niger adalah penghasil enzim selulosa secara komersial yang sangat efisien dalam memproduksi enzim selulase [14].
Fungsi terpenting dari enzim adalah kemampuannya menurunkan energi aktivasi suatu reaksi kimia. Kemampuan enzim dalam mendegradasi substrat dipengaruhi oleh beberapa faktor, antara lain konsentrasi enzim, konsentrasi substrat, pH serta temperatur [15].
2.2.3 Fermentasi
Fermentasi adalah proses terjadinya dekomposisi gula menjadi alkohol dan karbondioksida. Berdasarkan produk yang difermentasi digolongkan menjadi dua macam yaitu sebagai berikut:
1. Fermentasi alkoholis yaitu fermentasi yang menghasilkan alkohol sebagai produk akhir disamping produk lainnya, misalnya pada pembuatan wined dan cider.
2. Fermentasi nonalkoholis yaitu fermentasi yang tidak menghasilkan alkohol sebagai produk akhir selain bahan lainnya, misalnya pada pembuatan tempe, antibiotika dan lain -lain.
Tahap inti dari produksi bioetanol adalah fermentasi gula sederhana, baik yang berupa glukosa, sukrosa, maupun fruktosa dengan menggunakan mikroorganisme terutama Saccharomyces atau Zyomomonas mobilis. Dalam proses ini, gula akan dikonversi menjadi etanol dan gas karbon dioksida [17].
C6H12O6 mikroorganisme
2 C2H5OH + 2 CO2
gula etanol karbondioksida
Menurut Schlegel (1994), produksi alkohol adalah menggunakan ragi, terutama dari stram Saccharomyces cerevisiae atau Zyomomonas mobilis. Ragi-ragi tersebut merupakan organisme yang bersifat anaerobik. Dalam lingkungan terisolasi dari udara,
organisme ini dapat meragikan karbohidrat menjadi etanol dan karbon dioksida.
Dengan mengalirkan udara, maka peragian dapat terhambat. Saccharomyces cerevisiae merupakan khamir yang penting pada fermentasi yang utama dan akhir, karena mampu memproduksi alkohol dalam konsentrat tinggi dan fermenasi sepontan [18]. Ragi Saccharomyces cerevisiae dapat memfermentasikan substrat glukosa, fruktosa, galaktosa dan pati. Sedangkan bakteri Zyomomonas mobilis dapat memfermentasikan glukosa, sukrosa dan pati [9].
Pada umumnya hasil fermentasi adalah bioetanol atau alkohol yang mempunyai kemurnian sekitar 10-12 % dan belum dapat dikategorikan sebagai fuel based etanol.
Agar dapat mencapai kemurnian di atas 95 %, maka alkohol hasil fermentasi harus didistilasi [19].
Distilasi ini adalah tahapan yang sangat penting pada produksi bioetanol dimana proses pemurnian etanol dilakukan dengan pemanasan untuk memisahkan etanol dengan air dengan memperhitungkan perbedaan titik didih kedua bahan tersebut yang kemudian diembunkan kembali, dimana titik didih etanol dan air masing-masing adalah 78,5 dan 100 oC. Mekanismenya yaitu memanaskan campuran etanol-air hingga suhu 78,5 oC, dimana pada suhu tersebut etanol akan mendidih dan menguap meninggalkan air. Uap etanol ditahan dalam wadah, selanjutnya diembunkan kembali menjadi etanol yang lebih murni, yaitu dengan kemurnian ≥ 95 %, sehingga siap untuk digunakan sebagai bahan bakar [20].
2.3. Faktor-faktor yang Mempengaruhi Fermentasi
Ada berbagai faktor yang mempengaruhi pertumbuhan jamur dan ragi yaitu : 1. Nutrisi
Dalam kegiatannya, ragi memerlukan penambahan nutrisi untuk pertumbuhan dan perkembangbiakan, yaitu: Unsur C dari senyawa karbohidrat, Unsur N dan P dari senyawa protein, Mineral, Vitamin.
2. Jumlah sel khamir
Menurut said (1987) jumlah starter optimum pada fermentasi alkohol adalah 2 – 5 % (v/v).
3. Derajat keasaman (pH)
Untuk fermentasi alkohol, ragi memerlukan media dengan suasana asam yaitu antara 4,8 – 6,0. Pengaturan pH dapat dilakukan dengan penambahan asam sulfat encer bila substrat fermentasinya bersifat alkalis dan penambahan natrium bikarbonat jika substratnya terlalu asam.
4. Suhu
Yeast aktif pada kisaran suhu 0 – 50 oC sedangkan suhu optimum pertumbuhan dan aktivitasnya sel adalah 28 – 35 oC.
5. Oksigen
Fermentasi etanol berlangsung anaerobik, dalam kondisi tanpa oksigen tersebut ragi akan menggunakan glukosa sebagai sumber energinya dan membentuk etanol dan karbon dioksida sebagai metabolitnya [21].
2.4. Mikroorganisme Produksi Bioetanol 2.4.1. Zymomonas Mobilis
Zymomonas mobilis adalah bakteri yang berbentuk batang, termasuk dalam bakteri garam negatif, tidak membentuk spora, dan merupakan bakteri yang dapat bergerak. Berikut klasifkasi zymomonas mobilis terdapat pada Tabel 2.1.
Tabel 2.1. Klasifikasi Ilmiah Zymomonas mobilis
Kingdom Bakteri
Phylum Proteobacteria
Class Alpha Proteobacteria
Order Sphingomonadales
Family Sphingomonadaceae
Genus Zymomonas
Spesies Z. mobilis
Bakteri ini banyak digunakan di perusahaan bioetanol karena menghasilkan kemampuan yang dapat melampaui ragi dalam beberapa aspek. Zymomonas Mobilis memiliki beberapa kelebihan dibandingkan dengan Sacharomyces Cerevisieae yaitu:
1. Dapat tumbuh secara anaerob fakultatif (dapat hidup pada kondisi anaerob namun juga toleran terhadap oksigen) serta mempunyai toleransi suhu yang tinggi.
2. Mempunyai kemampuan untuk mencapai konversi yang lebih tinggi.
3. Tahan terhadap kadar etanol yang tinggi dan pH yang rendah.
4. Mampu menghasilkan yield etanol 92% dari nilai teoritisnya.
Bakteri ini awalnya terisolasi dari minuman beralkohol seperti tuak Afrika, Meksiko pulque , dan juga sebagai kontaminan dari sari buah apel dan bir di negara - negara Eropa. Suhu optimum (30oC) proses fermentasi dengan menggunakan Zymomonas mobilis adalah pada kisaran pH 4 – 7. Karakteristik menarik Zymomonas mobilis adalah bahwa perusahaan membran plasma mengandung hopanoid, senyawa pentasiklik mirip dengan eukariotik sterol. Hal ini memungkinkan untuk memiliki toleransi yang luar biasa untuk kondisi lingkungan yang mengandung etanol sekitar 14 – 15 % [22].
Selain itu, bakteri ini mampu sukrosa, glukosa dan fruktosa menjadi etanol, CO2 dan beberapa asam laktat. Penggunaan Zymomonas mobilis dalam fermentasi etanol banyak mengalami keberhasilan. Bakteri ini menunjukkan produktifitas etanol lebih tingggi 3-5 kali lipat dari yeast dengan hasil etanol dari glukosa mencapai nilai maksimum 95-98 % secara teori [22].
Faktor-faktor yang mempengaruhi fermentasi etanol oleh Zymomonas mobilis meliputi : pH, temperatur, sumber karbon, faktor tumbuh, sumber nitrogen, oksigen, dan alkohol. Disamping itu, kondisi inokulum serta kualitas substrat juga mempengaruhi hasil yang diperoleh dan efisiensi fermentasi. Kondisi inokulum tergantung pada faktor-faktor lingkungannya, adanya mikrobia kontaminan akan sangat menghambat fermentasi [22].
2.4.2. Sacharomyces cerevisiae
Saccharomyces berasal dari bahasa latin Yunani yang berarti “gula-jamur”
sedangkan cerevisiae memiliki arti “bir” yang biasa digunakan untuk pembuatan bir dan roti [23].Berikut klasifkasi Sacharomyces cerevisiae terdapat pada Tabel 2.2.
Tabel 2.2. Klasifikasi Ilmiah Sacharomyces cerevisiae
Kerajaan Fungi
Phylum Ascomycota
Subphylum Saccharomycotina
Class Saccharomycetes
Order Saccharomycetales
Family Saccharomycetaceae
Genus Species
Saccharomyces S. cerevisiae
Saccharomyces cerevisiae merupakan salah satu jenis khamir. Khamir adalah fungi uniseluler yang eukariotik. Sel khamir yang termasuk jenis Saccharomyces berbentuk bulat, oval atau memanjang dan dapat membentuk pseudomiselium. Sel Saccharomyces cerevisiae berukuran (3-10) × (4,5-21) μm. Reproduksi Saccharomyces dilakukan dengan membentuk tunas dan spora seksual [14].
Kemampuan ragi ini tergantung pada kondisi apakah sudah dewasa aerobik atau anaerobik. Pertumbuhan ragi mencapai ukuran dewasa pada saat memisahkan sel dari induknya dengan waktu generasi pendek yang membutuhkan waktu mengganda sekitar 1,5-2 jam dengan suhu 30 oC. Saat ini Khamir ini dapat pada kisaran suhu 25 - 30 OC atau 35 - 47 OC serta pH 4 - 4.5 sering digunakan untuk memproduksi etanol secara fermentasi karena dapat menghasilkan etanol dalam jumlah besar dan mempunyai nilai toleransi terhadap alkohol yang tinggi. Khamir ini dapat pada kisaran suhu 25 - 30 OC atau 35 - 47 OC serta pH 4 - 4.5 [14].
Saccharomyces cereviciae merupakan salah satu spesies khamir yang memiliki daya konversi gula menjadi etanol sangat tinggi. Mikroba ini biasanya dikenal dengan baker’s yeast dan metabolismenya telah dipelajari dengan baik. Produk metabolik utama adalah etanol, CO2 dan air sedangkan beberapa produk lain dihasilkan dalam jumlah sangat sedikit. Selama proses fermentasi akan timbul panas, apabila tidak dilakukan pendinginan, suhu akan makin meningkat sehingga proses fermentasi terhambat. Saccharomyces cerevisiae dapat mengubah glukosa, manosa, dan galaktosa menjadi etanol. Khamir ini memiliki daya, tingkat dan rendemen etanol yang tinggi tetapi tidak mampu memfermentasi xilosa yang merupakan jenis gula terbesar kedua di alam [14].
Penyegaran kultur dilakukan pada media padat PDA (Potato Dextrose Agar) yang diinokulasikan secara aseptis kemudian diinkubasi pada suhu 30 OC selama 48 jam. Setelah itu diinokulasikan pada media cair PDB (Potato Dextrose Broth) kemudian diinkubasi menggunakan inkubator goyang pada suhu 30 OC selama 24 jam [14].
2.5. Bioetanol
Etanol (alkohol) adalah nama suatu golongan senyawa organik yang mengandung unsur C, H dan O. Etanol dalam ilmu kimia disebut sebagai etil alko-hol dengan rumus kimia C2H5OH. Rumus umum dari alkohol adalah R-OH. Seacara struktur alkohol sama dengan air, namun salah satu hidrogennya digantikan oleh gugus alkil. Gugus fungsional alkohol adalah gugus hidroksil (OH) [18].
Karakteristik etanol merupakan zat cair, tidak berwarna, berbau spesifik, mudah terbakar dan menguap, dapat bercampur dalam air dengan segala perbandingan.
Penggunaan bioetanol diantaranya adalah sebagai bahan baku industri, minuman, farmasi, kosmetika, dan bahan bakar. Beberapa sifat fisika dan kimia etanol terdapat pada Tabel 2.3.
Tabel 2.3 Sifat Fisika dan Kimia Etanol
Properti Nilai
Berat Molekul (g/mol) 46,1
Titik Beku (0C) -114,1
Titik didih normal (0C) 78,32
Densitas (g/ml) 0,7983
Viskositas pada suhu 20 0C (Cp) 1,17
Panas Pengupan normal (J/Kg) 839,31
Panas Pembakaran pada 25 oC (J/Kg) 2,42 Nilai Oktan
Kelarutan dalam air, pada 20 oC pH
Warna Cairan
106-111 Larut 6,5 – 9,0
Jernih Sumber : Fessenden, 1986
Bioetanol adalah etanol yang diproduksi dengan cara fermentasi gula menggunakan ragi. Bioetanol dapat dibuat dari pati tongkol jagung yang telah diproses menjadi glukosa. Secara teoritis, hidrolisis glukosa akan menghasilkan etanol dan karbondioksida. Perbandingan mol antara glukosa dan etanol dapat dilihat pada reaksi:
C6H12O6 2 C2H5OH + 2 CO2
Satu mol glukosa menghasilkan 2 mol etanol dan 2 mol karbondioksida, atau dengan perbandingan bobot tiap 180 gram glukosa akan menghasilkan 90 gram etanol.
Dengan melihat kondisi tersebut, perlu diupayakan penggunaan substrat yang murah untuk dapat menekan biaya produksi etanol sehingga harganya bisa lebih mudah [20].
Produksi bioetanol (alkohol) dengan bahan baku tanaman yang mengandung pati atau karbohidrat, dilakukan melalui proses konversi karbohidrat menjadi gula
(glukosa) larut air. Glukosa dapat dibuat dari pati – patian, proses pembuatannya dapat dibedakan berdasarkan zat pembantu yabg dipergunaan yaitu hidrolisa asam dan enzim. Berdasarkan kedua jenis hidrolisa tersebut saaat ini hidrolisa enzim lebih banyak dikembangkan, sehingga proses pembuatab glukosa dari pati – patian sekarang ini dipergunakan dengan hidrolisa enzim. Dalam proses konversi karbohidrat menjadi gula (glukosa) larut air dilakukan dengan penambahan air dan enzim, kemudian dilakukan proses peragian atau fermentasi gula menjadi etanol dengan menambahkan yeast atau ragi [20]
Reaksi yang terjadi pada proses produksi bioetanol secara sederhana ditunjukkan pada reaksi berikut:
(C6H10O5)n N C6H12O6 (1) Pati Glukosa
(C6H12O6)n 2 C2H5OH + 2 CO2 (2) Glukosa Etanol
Selain itu bioetanol dapat diproduksi dari bahan baku tanaman yang mengandung pati atau karbohidrat, juga dapat diproduksi dari bahan tanaman yang mengandung selulosa [22]. Bioetanol selain dapat digunakan sebagai bahan bakar pengganti bensin, juga sebagai bahan baku industri turunan alkohol seperti untuk minuman beralkohol, bahan dasar farmasi dan bahan pelarut parfum. Etanol yang digunakan sebagai bahan baku industri memiliki kemurnian antara 90 – 96,5 %, campuran minuman beralkohol dan bahan industri farmasi 96 – 99,5 % dan sebagai bahan pengganti bensin 99,5 – 100 % [23].
H2O Enzim Yeast (ragi)
2.6. Analisis Gula Reduksi
Gula reduksi hasil hidrolisis asam dapat dianalisis secara kualitatif untuk mengidentifikasi apakah sampel mengandung gula reduksi atau tidak dan secara kuantitatif untuk menentukan kadar gula reduksi yang terbentuk. Untuk maksud tersebut, analisis gula reduksi secara kualitatif dapat dilakukan dengan uji Benedict, uji Fehling, uji Barfoed, uji Tollens, dan uji Molisch [15].
Analisis gula reduksi secara kuantitatif dapat dilakukan dengan berbagai cara, antara lain dengan metode Luff Schoorl, Nelson-Somogyi (Woiciechowski et al., 2002) dan DNS. Metode DNS merupakan metode yang paling banyak digunakan untuk menentukan kadar gula reduksi. Dalam metode DNS digunakan reagen dinitro salisilat (DNS). Bahan - bahan kimia yang diperlukan untuk membuat reagen DNS adalah asam 3,5- dinitrosalisilat, NaOH, Na2SO3, Na–K–tartarat, fenol, dan akuades.
DNS merupakan senyawa aromatis yang dapat bereaksi dengan gula reduksi membentuk asam 3-amino-5-nitrosalisilat, suatu senyawa yang mampu menyerap radiasi gelombang elektromagnetik pada panjang gelombang maksimum 540 n.
Semakin tinggi kadar gula reduksi yang terdapat dalam sampel, maka akan semakin banyak pula molekul asam 3 – amino – 5 – nitrosalisilat yang terbentuk, sehingga absorbansi sampel akan semakin tinggi [15].
Reaksi antara gula reduksi dengan DNS merupakan reaksi redoks pada gugus aldehid gula dan teroksidasi menjadi gugus karboksil. Sementara itu, DNS sebagai oksidator akan tereduksi membentuk asam 3-amino dan 5- nitrosalisilat. Reaksi ini berlangsung dalam suasana basa dan suhu tinggi sekitar 90-100 °C. Bila terdapat gula reduksi pada sampel, maka larutan DNS yang awalnya berwarna kuning akan bereaksi dengan gula reduksi sehingga menimbulkan warna jingga kemerahan [15].
Sampel yang telah direaksikan dengan DNS selanjutnya ditentukan kadar gula reduksinya menggunakan spektrofotometer UV–vis. Spektrofotometer UV–vis adalah alat untuk mengukur transmitan atau absorbansi suatu sampel sebagai fungsi panjang gelombang. Alat ini menggunakan dua buah sumber cahaya yang berbeda, yaitu sumber cahaya UV menggunakan lampu Hidrogen atau Deuterium dan sumber cahaya tampak menggunakan lampu Tungsten. Larutan sampel yang akan dianalisis diukur absorbansi sinar ultra violet atau sinar tampaknya. Konsentrasi larutan sampel
yang dianalisis akan sebanding dengan jumlah sinar yang diserap oleh zat yang terdapat dalam larutan tersebut [15]
BAB III
METEDOLOGI PENELITIAN
3.1 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi Teknik Kimia Fakultas Teknik dan Laboratorium Mikrobiologi Farmasi, Fakultas Farmasi Universitas Sumatera Utara, Medan.
3.2 Bahan dan Peralatan
Bahan-bahan yang digunakan dalam penelitian ini meliputi : 3.2.1 Bahan Baku
Bahan baku utama yang digunakan adalah tongkol jagung yang telah dikeringkan, digiling dan diayak sebesar 40 mesh. Tongkol jagung kemudian di hidrolisis dengan enzim sehingga menghasilkan hidrolisat tongkol jagung yang menjadi bahan baku. Mikroorganisme yang digunakan dalam fermentasi adalah Zymomonas mobilis dan Saccharomyces cerevisiae yang diperoleh dari Lab Mikrobiologi IPB.
3.2.2 Bahan Penunjang
Bahan penunjang pada penelitian ini digunakan untuk pembibitan mikroorganisme, analisa dan kalibrasi. Karakterisasi bahan terdiri dari (NH4)2SO4, KH2PO4, PDA (potato dextrose agar), sukrosa, alkohol , asam sitrat, natrium sitrat, H2C2O4, DNS, fenol, Na2SO4, tisu lensa, glukosa, iso-propanol, etanol dan metanol.
Analisis akhir diantaranya analisis gula. Analisis gula dengan aquadest dan larutan DNS.
3.2.3 Peralatan
Peralatan yang digunakan dalam penelitian ini antara lain autoklaf, Inkobator, kapas, pikometer, oven, pH meter, timbangan analitik, peralatan gelas, kromatografi gas, cawan petri, spatula, kertas saring Whatman No.42, batang pengaduk, viskositas oswald, penangas, kawat ose dan spektofotometer.
3.3. Prosedur Penelitian
Penelitian ini terdiri dari beberapa tahapan yang dimulai dari persiapan mikroba, hingga produksi bioetanol dari hasil hidrolisat tongkol jagung dengan metode fermentasi dan menggunakan mikroba. Berikut ini adalah diagram alir produksi bioetanol:
Gambar 3.1 Diagram Alir Produksi Bioetanol
Pembenihan mikroba Zymomonas dan Saccharomyces
Penyiapan Inokulum Cair
Pembuatan starter
Proses Fermentasi
Analisis Bioetanol Mulai
Selesai Hidrolisat tongkol jagung
3.3.1 Prosedur Pembenihan Isolat Zymomonas mobilis dan Saccharomyces cereviae
Prosedur pembenihan isolat Zymomonas mobilis dan Saccharomyces cereviae adalah sebagai berikut :
1. Potato Dextrose Agar (PDA) sebanyak 30 gram dan aquadest 300 ml dimasukkan kedalam erlenmeyer atau beaker glass kemudian dipanaskan sampai larut semua.
2. Disterilkan cawan petri selama 30 menit 3. Dipindahkan kedalam cawan petri yang steril
4. Kawat ose disterilkan dengan alkohol dan api, kemudian kawat dimasukkan ke isolat mikroba
5. Kawat dioleskan kedalam media PDA secara zig – zang 6. Mikroba diinkubasi dalam inkubator pada 30 oC.
3.3.2 Prosedur Persiapan Inokulum Zymomonas mobilis dan Saccharomyces cereviae
Prosedur persiapan inokulum adalah sebagai berikut:
1. Disiapkan seratus ml media cair (sukrosa 22% w/v, (NH4)2SO4 1% w/v, KH2PO4 1% w/v) didalan Erlenmeyer.
2. pH media cair diatur dengan HCl hingga pH = 5.
3. Kawat ose disterilkan dengan alkohol dan api.
4. Kawat dibiarkan mendingin.
5. Kawat dimasukkan ke media PDA berisi mikroorganisme.
6. Kawat dicelupkan beberapa saat pada media cair hingga tampak keruh.
7. Erlenmeyer disegel dengan plastic wrapper.
8. Inokulum diinkubasi pada suhu 30 oC dalam inkubator selama 3 hari.
3.3.3 Prosedur Fermentasi Hidrolisat Tongkol Jagung Proses fermentasi tongkol jagung adalah sebagai berikut:
1. Hasil hidrolisat tongkol jagung dimasukkan kedalam erlenmeyer sebanyak 50 ml pada masing-masing variasi.
2. Dimasukkan starter Zymomonas mobilis dan Saccharomyces cerevisiae secara bersamaan dengan variabel yang telah ditentukan.
3. Ditutup botol fermentasi hingga rapat dan gas dialirkan kedalam botol lain yang berisi air.
4. Dilakukan proses fermentasi sesuai dengan variasi waktu fermentasi yaitu 1, 3, 5 dan 7 hari pada suhu fermentasi.
5. Hasil fermentasi disaring dengan kertas saring.
6. Kemudian diambil hasil fermentasi berupa cairain sebanyak 5 ml untuk dianalisa kadar etanolnya, viskositas, densitas dan kadar gula.
3.3.4 Prosedur Pengukuruan Densitas
Prosedur pengukuran densitas adalah sebagai berikut:
1. Piknometer kosong ditimbang dan dicatat beratnya.
2. Sampel diisi ke dalam piknometer hingga penuh.
3. Sampel dan piknometer ditimbang dan dicatat beratnya.
4. Densitas sampel dikalkulasikan dengan menggunakan air sebagai referensi.
5. Prosedur diulangi sebanyak 2 kali untuk sampel yang sama.
3.3.5 Prosedur Pengukuran Viskositas
Prosedur pengukuran viskositas adalah sebagai berikut:
1. Sebanyak 10 ml (solven) sampel dimasukkan ke dalam viskometer Oswald.
2. Dengan bola hisap, sampel dihisap sampai melewati garis merah atas.
3. Bola hisap dilepas.
4. Waktu yang diperlukan sampel dari garis merah atas sampai melewati garis merah bawah dicatat.
5. Viskositas sampel dikalkulasi dengan menggunakan air sebagai referensi.
6. Prosedur diulangi sebanyak 2 kali untuk sampel yang sama.
3.3.6 Prosedur Pengukuran pH
Prosedur pengukuran pH adalah sebagai berikut:
1. pHmeter dikalibrasi dengan larutan buffer pH 4 dan pH 7.
2. pHmeter diatur agar berada pada mode Nst dan pembacaan pH.
3. Elektroda pHmeter dicuci dan dikeringkan.
4. Elektoda dicelupkan ke sampel dan diayunkan perlahan.
5. Pembacaan pH ditunggu hingga stabil.
6. Nilai pH yang terbaca dicatat.
3.3.7 Prosedur Analisis Kadar Gula
Prosedur analisa kadar gula adalah sebagai berikut:
1. Reagen DNS disiapkan (Na-K-Tartrate; fenol; Na2SO4; NaOH; DNS), H2SO4, PDA, glukosa, alkohol 96%, dan larutan buffer sitrat fosfat)
2. Sebelum dianalisa sampel terlebih dahulu di centrifuge. Sebanyak 5 ml sampel pada kecepatan 300 rpm selama 3 menit.
3. Sebanyak 0,5 ml sampel dimasukkan ke tabung reaksi.
4. Sebanyak 0,5 ml reagen ditambahkan.
5. Campuran dipanaskan pada 90 oC selama 10 menit.
6. Campuran dibiarkan mendingin.
6. Sebanyak 3 ml aquades ditambahkan.
7. Campuran digoyang atau divorteks sampai merata.
8. Cuvet dicuci dengan methanol dan dibiarkan kering.
9. Spektrofotometer disiapkan untuk pembacaan.
10. Campuran dimasukkan ke cuvet.
11. Cuvet dilap dengan tisu lensa dan dimasukkan ke spektrofotometer.
12. Nilai bacaan spektrofotometer dicatat dan dikonversi ke konsentrasi glukosa ekuivalen menggunakan kurva kalibrasi larutan glukosa standar dengan konsentrasi 0 – 10 mg/l.
3.3.8 Prosedur Analisis Kadar Etanol
Prosedur Analisis Kadar Etanol adalah sebagai berikut:
1. Kromatogram gas disiapkan dengan mengatur aliran gas dan kompresor.
2. Suhu kolom awal diatur pada 35 oC selama 3 menit dan ditingkatkan ke 100
oC pada laju 60 oC/menit.
3. Suhu port injeksi dan detector diatur ke 150 oC.
4. Kromatogram dijalankan selama ± 30 menit hingga baseline cukup lurus.
5. Sampel disesuaikan kadar garamnya.
6. Sebanyak 3 ml sampel dimasukkan ke vial berukuran 20 ml.
7. Sebanyak 5 μl (pelarut) atau 10 μl (kaldu) iso-propanol diinjeksikan ke dalam sampel menggunakan micro syringe lalu diratakan.
8. Vial diisolasi dengan 3 lapis aluminium foil dan diikat karet.
9. Sampel dipanaskan sekurang-kurangnya 15 menit pada 60 oC.
10. Kromatogram disiapkan untuk injeksi.
3.4. Flowchart Penelitian
3.4.1 Flowchart Pembenihan Isolat Mikroba
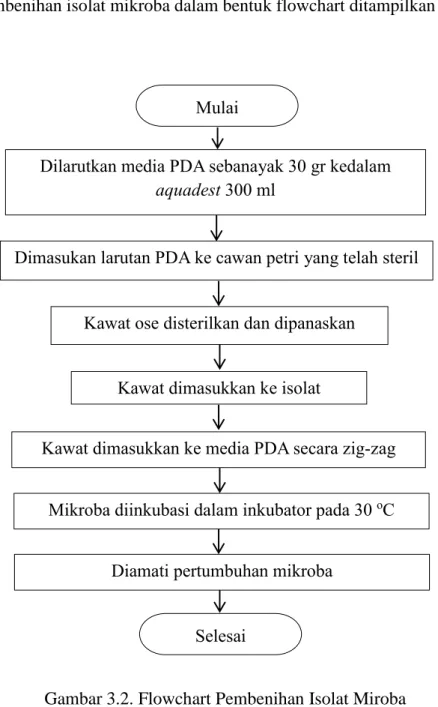
Prosedur pembenihan isolat mikroba dalam bentuk flowchart ditampilkan dalam Gambar 3.2.
Gambar 3.2. Flowchart Pembenihan Isolat Miroba Dilarutkan media PDA sebanayak 30 gr kedalam
aquadest 300 ml
Dimasukan larutan PDA ke cawan petri yang telah steril
Kawat ose disterilkan dan dipanaskan
Kawat dimasukkan ke isolat
Kawat dimasukkan ke media PDA secara zig-zag
Selesai Mulai
Mikroba diinkubasi dalam inkubator pada 30 oC
Diamati pertumbuhan mikroba
3.4.2 Flowchart Persiapan Inokulum Mikroba
Prosedur persiapan inokulum dalam bentuk flowchart ditampilkan dalam Gambar 3.3.
Tidak
Ya
Kedalam erlenmeyer ditambahkan 22 gr sukrosa
Ditambahkan 1 gr ammonium sulfat
Ditambahkan 1 gr monokalium fosfat
Ditambahkan aquadest hinggg 100 ml
Ditetesi HCl Mulai
Apakah pH sudah berkisar 3?
Kawat ose disterilkan dengan alkohol dan api
Kawat dibiarkan mendingin
A
Gambar 3.3. Flowchart Persiapan Inokulum Kawat dioleskan ke isolat
Kawat dicelupkan beberapa saat pada media cair hingga tampak keruh
Erlenyemer disegel dengan plastic wrapper
Selesai
Mikroba diinubasi dalam inkubator pada 30 oC A
Pertumbuhan mikroba ditandai dengan perubahan larutan inoculum yang keruh keputihan
3.4.3 Flowchart Proses Fermentasi Hidrolisat Tongkol Jagung
Prosedur proses fermentasi hidrolisat tongkol jagung dalam bentuk flowchart ditampilkan dalam Gambar 3.4.
Gambar 3.4. Flowchart Fermentasi Hidrolisat Tongkol Jagung Dimasukkan hidrolisat jagung kedalam erlenmeyer
sebanyak 50 ml
Dimasukkan starter secara bersamaan dengan variasi yang ditentukan
Ditutup erlenmeyer hingga rapat dan gas yang dialairkan kedalam wadah berisi air
Diisolasi dan diinkubasi pada suhu ±25 oC selama 1, 3, 5 dan 7 hari
Selesai Mulai
Diukur kadar viskositas, densitas dan kadar etanol
Disaring mengunakan kertas whatman No.1
3.4.4 Flowchart Pengukuran Densitas
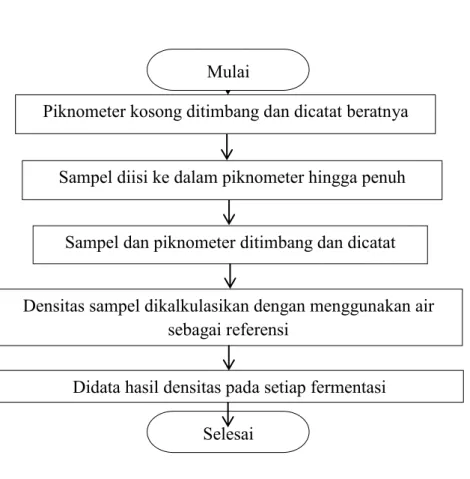
Prosedur Pengukuran densitas dalam bentuk flowchart ditampilkan dalam Gambar 3.5.
Gambar 3.5. Flowchart Pengukuran Densitas Piknometer kosong ditimbang dan dicatat beratnya
Sampel diisi ke dalam piknometer hingga penuh
Sampel dan piknometer ditimbang dan dicatat beratnya
Densitas sampel dikalkulasikan dengan menggunakan air sebagai referensi
Mulai
Selesai
Didata hasil densitas pada setiap fermentasi
3.4.5 Flowchart Pengukuran Viskositas
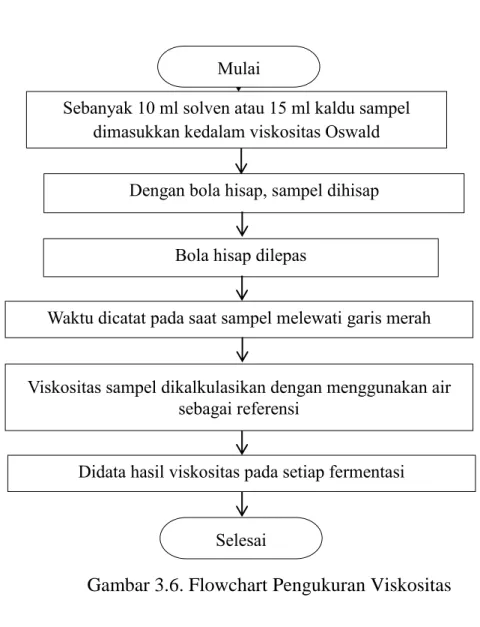
Prosedur pengukuran viskositas dalam bentuk flowchart ditampilkan dalam Gambar 3.6.
Ya
Gambar 3.6. Flowchart Pengukuran Viskositas Sebanyak 10 ml solven atau 15 ml kaldu sampel
dimasukkan kedalam viskositas Oswald
Dengan bola hisap, sampel dihisap
Bola hisap dilepas
Waktu dicatat pada saat sampel melewati garis merah Mulai
Selesai
Viskositas sampel dikalkulasikan dengan menggunakan air sebagai referensi
Didata hasil viskositas pada setiap fermentasi
3.4.6 Flowchart Pengukuran pH
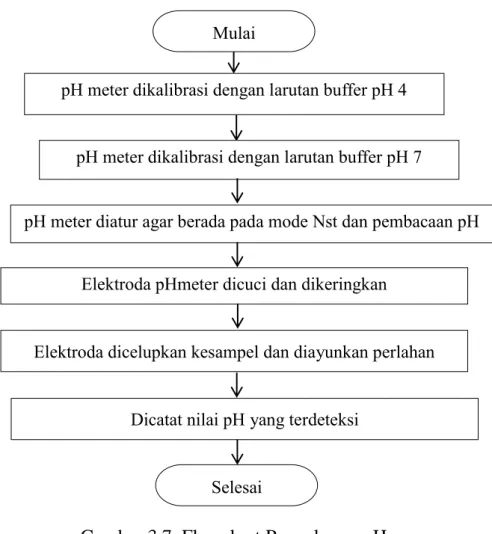
Prosedur pengukuran pH dalam bentuk flowchart ditampilkan dalam Gambar 3.7.
Gambar 3.7. Flowchart Pengukuran pH pH meter dikalibrasi dengan larutan buffer pH 4
pH meter dikalibrasi dengan larutan buffer pH 7
pH meter diatur agar berada pada mode Nst dan pembacaan pH
Elektroda pHmeter dicuci dan dikeringkan Mulai
Selesai
Elektroda dicelupkan kesampel dan diayunkan perlahan
Dicatat nilai pH yang terdeteksi
3.4.7 Flowchart Analisis Kadar Gula
Prosedur analisis kadar gula dalam bentuk flowchart ditampilkan dalam Gambar 3.8
Reagen DNS disiapkan Mulai
Sebanyak 5 ml sampel di centrifuge 300 rpm selama 3 menit
Sebanyak 0,5 ml sampel dimasukkan ke tabung reaksi
Ditambahkan 0,5 ml reagen
Dipanaskan pada 90 oC selama 10 menit
Ditambahkan 3 ml aquadest
Digoyang sampai merata
Cuvet dicuci dengan metanol
Cuvet dibiarkan kering
Spektometer disiapkan untuk pembacaan
Campuran dimasukkan ke cuvet dan dilap dengan tisu lensa
Nilai bacaan spektrotometer dicatat
Selesai
Didata kadar gula yang diperoleh sehingga menghasilkan kurva standart
3.4.8 Flowchart Analisis Kadar Etanol
Prosedur analisis kadar etanol dalam bentuk flowchart ditampilkan dalam gambar 3.9
Kromatografi gas disiapkan dengan mengatur aliran gas Parameter kolom, port injeksi dan detektor disesuaikan
Kromatografi dijalankan selama 30 menit Mulai
Sampel disesuaikan kadar garamnya
Sebnayak 3 ml sampel dimasukkan ke vial berukuran 200 ml
Diinjeksikan 5 µl (solven) iso-propanol
Diisolasi dengan 3 lapis aluminium foil dan diikat karet
Dipanaskan 60 oC selama 15 menit
Kromatogram disiapkan untuk injeksi
Diambil 100 µl gas pada bagian atas vial
Diinjeksikan melalui pori injeksi dan dibaca kromatogram grafik
Selesai
Didata kadar bioetanol sehingga diperoleh dalam bentuk konsentrasi
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hidrolisat Tongkol Jagung
Pada penelitian ini digunakan hidrolisat yang berasal dari tongkol jagung dengan menggunakan metode enzimatis untuk memproduksi enzim selulase oleh Aspergilus niger dan Trichoderma reesei. Hidrolisat tongkol jagung (Gambar 4.1) tersebut digunakan sebagai bahan baku pembuatan bioetanol. Hidrolisat tongkol jagung kemudian dianalisis kadar awal gula reduksi (glukosa) yaitu sebesar 11,7%
(5,869 gr/ml) dan volume hidrolisat yang digunakan dalam penelitian ini sebanyak 50 ml.
Gambar 4.1 Hidrolisat Tongkol Jagung
4.2. Pertumbuhan Mikroba
Mikroba yang digunakan untuk fermentasi bioetanol dalam penelitian ini adalah Zymomonas mobilis dan Saccharomyces cereviseae. Pembibitan mikroorganisme dilakukan dalam media PDA (Potato Dextrose Agar) yang telah disterilkan di dalam autoclave terlebih dahulu. Pertumbuhan mikroba dilihat dari koloni yang menyebar dalam cawan petri dan diamati karakteristik dan mikroba tersebut.
Kultur dalam media PDA diinkubasi selama 3 hari (72 jam) pada temperatur 30 oC. Dalam waktu tersebut spora tumbuh hingga memenuhi cawan petri.
Pertumbuhan Saccharomyces cerevisiae dan Zymomonas mobilis tentu tidak sama, karena kedua mikroba tersebut merupakan mikroba dengan kingdom yang berbeda.
Saccharomyces cerevisiae berasal dari kingdom fungi yang secara morfologi tumbuh berbentuk blastospora berbentuk bulat lonjong, silindris, oval atau bulat telur yang dipengaruhi oleh strainnya. Sedangkan Zymomonas mobilis berasal dari kingdom bakteri yang tumbuh menyebar dan tidak beraturan hingga memenuhi cawan.
Inokulum hasil inkubasi ini siap digunakan pada proses fermentasi bioetanol.
4.3. Produksi Bioetanol
Teknologi produksi bioetanol yang dilakukan pada penelitian ini terdiri dari dua tahap yaitu hidrolisis dan fermentasi. Tahap hidrolisis telah dilakukan oleh peneliti sebelumnya. Metode fermentasi dilakukan dengan metode Simultaneous Hydrolisys and Fermentation (SSF) atau Sakarifikasi dan Fermentasi Serentak (SFS) [26].
Menurut Bries (2008) teknologi SFS adalah teknologi terbaik, tidak hanya dari kualitas bioetanol yang dihasilkan tetapi juga karena menghasilkan rendemen yang besar.
Kelebihan SSF dibandingkan dengan sakarifikasi dan fermentasi terpisah adalah kesempatan kontaminasi lebih rendah, tekanan osmotik lebih rendah karena khamir akan mengurangi konsentrasi glukosa, membutuhkan enzim yang lebih sedikit, dan menggunakan energi yang efisien [27]. Pada prosesnya, fermentasi dapat dipengaruhi oleh penggunaan mikroba, waktu fermentasi, pH dan temperatur fermentasi [28].
Mikroba dalam media PDA diambil dan dibuat sebagai inokulum cair dengan menggunakan kawat ose yang diinokulasikan dalam 100 ml medium Mandel’s.
Suspensi spora ditambahkan ke dalam media fermentasi sebanyak 10% (v/v).
Pertumbuhan mikroba setiap harinya dikontrol untuk mencegah kontaminasi media.
Mikroba yang ditambahkan pada media fermentasi dengan perbandingan Zymomonas mobilis dan Saccharomyces cerevisiae yaitu 1 : 1; 1 : 2 dan 2 : 1 (v/v) dan difermentasikan dengan variasi waktu yaitu 1, 3, 5, dan 7 hari. Kemudian diukur kadar bioetanol pada kedua variasi (mikroba dan waktu fermentasi) tersebut untuk mengetahui pengaruh variasi penambahan mikroba terhadap kadar bioetanol yang dihasilkan.
0 1 2 3 4 5 6 7
1 Hari 3 Hari 5 Hari 7 Hari
YieldBioetanol (%)
1 : 2 (Zymomonas : Saccharomyces)
4.4. Pengaruh Waktu Fermentasi Hidrolisat Tongkol Jagung Terhadap Yield Bioetanol
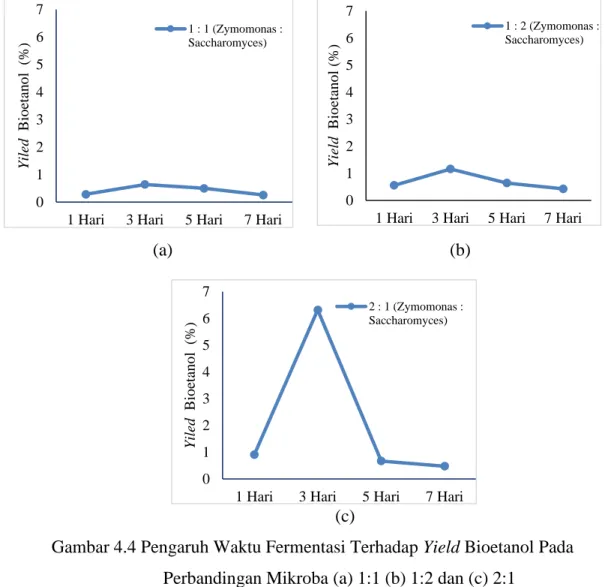
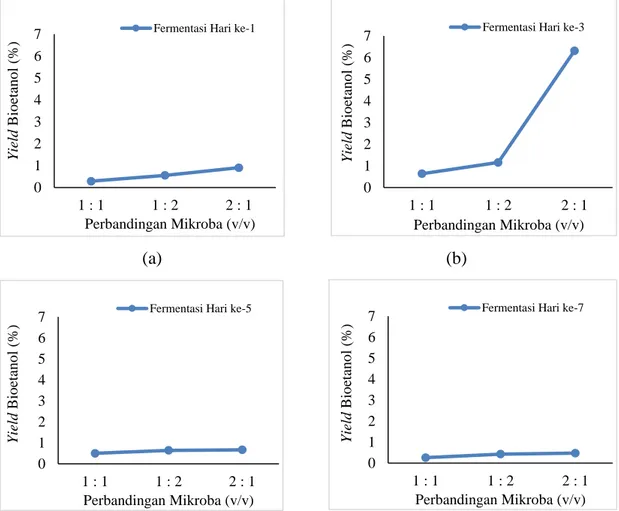
Pada penelitian ini divariasikan waktu fermentasi hidrolisat tongkol jagung yaitu selama 1, 3, 5 dan 7 hari. Ada dua mikroba yang digunakan yaitu Zymomonas mobilis dan Saccharomyces cerevisiae. Kedua mikroba ini digunakan secara bersamaan dengan berbandingan yang berbeda yaitu 1:1, 1:2 dan 2:1 (v/v) (Zymomonas : Saccharomyces) dalam proses fermentasi menghasilkan bioetanol.
Berikut ini adalah grafik hubungan lamanya waktu fermentasi terhadap produksi bioetanol.
(a) (b)
(c)
Gambar 4.4 Pengaruh Waktu Fermentasi Terhadap Yield Bioetanol Pada Perbandingan Mikroba (a) 1:1 (b) 1:2 dan (c) 2:1
Dari gambar 4.4 diatas terlihat bahwa lamanya waktu fermentasi berpengaruh pada jumlah yield bioetanol. Pada gambar 4.4 (a), (b) dan (c) saat waktu fermentasi hari pertama diperoleh yield bioetanol sebesar 0,283 %; 0,55 % dan 0,907 %. Namun, pada waktu fermentasi hari ke-3 produksi bioetanol mengalami peningkatan pada
0 1 2 3 4 5 6 7
1 Hari 3 Hari 5 Hari 7 Hari
YiledBioetanol (%)
1 : 1 (Zymomonas : Saccharomyces)
0 1 2 3 4 5 6 7
1 Hari 3 Hari 5 Hari 7 Hari
Yiled Bioetanol (%)
2 : 1 (Zymomonas : Saccharomyces)
masing-masing gambar. Pada gambar 4.4 (a) mengalami peningkatan yield bioetanol sebesar 56 %, (b) mengalami peningkatan yield bioetanol sebesar 61 % dan pada (c) mengalami peningkatan yield bioetanol sebesar 85 %. Setalah mengalami peningkatan pada waktu fermentasi 3 hari, yield bioetanol kemudian mengalami penurunan pada waktu fermentasi 5 dan 7 hari. Pada waktu fermentasi 5 hari dilihat pada gambar 4.4 (a), (b) dan (c) yield bioetanol mengalami penurunan yaitu sebesar 22 %; 45 % dan 89
%. Dan mengalami penurunan kembali pada waktu fermentasi 7 hari yaitu sebesar 49
% (a) 34 %; (b) dan 29 % (c).
Menurut teori, ada beberapa faktor yang mempengaruhi yield bioetanol diantaranya pengaruh lama fermentasi. Semakin lama fermentasi berlangsung maka etanol yang dihasilkan juga akan semakin bertambah [29]. Dari gambar 4.4 (a), (b) dan (c) terlihat bahwa pada lama fermentasi 3 hari diperoleh yield bioetanol mengalami peningkatan. Hal ini disebabkan karena semakin lama waktu fermentasi semakin banyak pula waktu yang dibutuhkan oleh mikroba untuk mengurai gula menjadi etanol, sehingga etanol yang dihasilkan semakin meningkat [29]. Pada kondisi ini, pertumbuhan mikroba berada pada fase log (pertumbuhan eksponensial). Pada fase log mikroba membelah diri dengan cepat sehingga nutrien didalam medium dapat dimanfaatkan secara optimal oleh mikroba untuk meningkatkan produksi bioetanol [30].
Sedangkan pada lama fermentasi 5 hari dan 7 hari terjadi penurunan produksi bioetanol. Hal ini memungkin gula yang terdapat didalam larutan sebagian besar telah diurai menjadi etanol, sehingga aktivitas mikroba akan berkurang karena kekurangan gula sebagai makanan yang akan diurai menjadi bioetanol [29]. Pada kondisi ini, pertumbuhan mikroba berada pada fase kematian. Fase tersebut sebagian besar populasi mikroba mulai mengalami kematian yang menghambat produksi bioetanol [31]. Pada gambar 4.4 (a), (b) dan (c) diperoleh produksi bioetanol optimum pada waktu fermentasi 3 hari. Hal ini sesuai dengan pendapat Sari et al (2008) yang menyatakan bahwa lama fermentasi yang paling optimum untuk proses pembuatan bioetanol adalah 3 hari. Jika fermentasi dilakukan lebih dari 3 hari maka produksi bioetanol akan mengalami penurunan.