PRODUKSI BIOHIDROGEN OLEH BAKTERI
FOTOSINTETIK
Rhodobium marinum
PADA
PENCAHAYAAN BERBEDA
FATMA HASTUTI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FATMA HASTUTI. Produksi Biohidrogen oleh Bakteri Fotosintetik
Rhodobium
marinum pada Pencahayaan Berbeda. Dibimbing oleh SYAMSUL FALAH dan
DWI SUSILANINGSIH.
ABSTRACT
FATMA HASTUTI. Biohydrogen Production using Photosynthetic Bacteria
Rhodobium marinum by different lighting. Under the direction of SYAMSUL
FALAH and DWI SUSILANINGSIH.
Energy demand that increases continuously and various problems are
found in using fossil fuels motivates searching reneawable alternative energy.
Biohydrogen as a new and renewable energy has a potential in resolving the
energy problems. Hydrogen producing microbe is affected by lighting. This study
concerns with effective wavelength lighting for hydrogen producing. The aim of
this study is to determine effective lighting from UV and visible light (red,
yellow, and blue) for maximum biohydrogen production by photosyntetic bacteria
Rhodobium marinum. Hydrogen gas from photo fermentation was determined
using gas chromatography (GC) with thermal conductivity detector, poropak
column, with temperatur of injector, detector, and column were 150, 250, dan 80
Judul Skripsi
Nama
NIM
:
:
:
Produksi Biohidrogen oleh Bakteri Fotosintetik Rhodobium
marinum pada Pencahayaan Berbeda
Fatma Hastuti
G84061292
Disetujui
Komisi Pembimbing
Dr. Syamsul Falah, S.Hut, M.Si Dr. Dwi Susilaningsih, M.Pharm
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
DAFTAR ISI
Halaman
DAFTAR GAMBAR ...
ix
DAFTAR LAMPIRAN ...
ix
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Biohidrogen ...
2
Fermentasi ...
2
Mikroorganisme Penghasil Gas Hidrogen ...
3
Produksi Biohidrogen ...
3
Enzim Penghasil Hidrogen ...
4
Pengaruh Cahaya pada Produksi Hidrogen ...
5
Pertumbuhan Mikrob ...
5
Kromatografi Gas ...
6
BAHAN DAN METODE
Alat dan Bahan ...
7
Metode ...
7
HASIL DAN PEMBAHASAN
Sumber Pencahayaan ...
9
Kurva Pertumbuhan Rhodobium marinum pada Pencahayaan
Berbeda ...
10
Kandungan Glukosa ...
11
Total Gas dan Analisis Gas Hasil Fermentasi ...
12
Pertumbuhan R. marinum dan Produksi Gas H
2pada Pencahayaan
Berbeda ...
13
SIMPULAN DAN SARAN ...
14
DAFTAR PUSTAKA ...
15
DAFTAR GAMBAR
Halaman
1
Pertumbuhan bakteri R. marinum pada pencahayaan berbeda ...
10
2
Kandungan glukosa media produksi pada pencahayaan berbeda ...
11
3
Jumlah gas hasil fermentasi ...
12
4
Pertumbuhan R. marinum dan produksi gas H
2pada pencahayaan
berbeda ...
14
DAFTAR LAMPIRAN
Halaman
1
Tahapan penelitian produksi gas hidrogen oleh bakteri
fotosintetik R. marinum pada pencahayaan berbeda ...
18
2
Pertumbuhan R. marinum pada pencahayaan berbeda ...
19
3
Kadar glukosa media pada pencahayaan berbeda ...
20
4
Hasil pengukuran gas hidrogen dengan kromatografi gas ...
21
5
Kandungan gas hidrogen standar ...
22
6
Kurva standar glukosa ...
23
PENDAHULUAN
Penggunaan bahan bakar fosil menyebabkan sejumlah persoalan-persoalan seperti: keterbatasan pasokan energi bahan bakar fosil dan emisi karbon hasil pembakaran bahan bakar fosil yang menyebabkan perubahan iklim global, kerusakan lingkungan, dan penurunan kesehatan. Pencarian alternatif energi terbarukan yang ramah lingkungan menjadi salah satu solusi dalam memenuhi kebutuhan energi dan mengatasi persoalan akibat penggunaan bahan bakar fosil.
Beberapa alternatif energi terbarukan yang ramah lingkungan yaitu bioetanol, biodiesel, biobutandiol, dan biohidrogen (Bio-H2).
Biohidrogen merupakan energi masa depan yang menarik banyak perhatian baik dari kalangan ilmuan maupun politisi dunia. Hidrogen merupakan sumber energi yang bersih dan efisien karena proses pembakaran hidrogen di udara hanya menghasilkan uap air dan energi panas (Mahyudin & Koesnandar 2006). Nilai panas yang dihasilkan pada pembakaran hidrogen adalah 282.119 kJ per mol H2O yang dihasilkan. Nilai tersebut lebih
tinggi dari panas hasil pembakaran bahan bakar fosil (Chen et al. 2005).
Hidrogen merupakan energi baru dan dapat diperbaharui. Senyawa hidrogen berada melimpah di alam baik dalam gas maupun dalam bentuk komponen yang mengandung hidrogen seperti: biomasa, bahan bakar fosil, dan air. Hidrogen dapat dihasilkan dari berbagai substrat atau bahan baku yang mengandung hidrogen.
Berbagai metode yang digunakan untuk menghasilkan hidrogen memerlukan sumber energi berupa panas, elektrolitik, dan energi cahaya. Produksi hidrogen secara biologi berbeda dari cara kimia atau elektrokimia, yaitu dapat dilakukan pada tekanan dan suhu normal (Kotay & Das 2008). Produksi hidrogen secara biologis dapat menggunakan limbah organik sebagai substrat fermentasi sehingga membantu dalam menangani limbah-limbah organik dan membuat produksi hidrogen lebih ekonomis.
Sejumlah spesies mikrob dari berbagai taksa dan tipe fisiologi mampu menghasilkan hidrogen, di antaranya adalah sianobakteria,
bakteri anaerob, dan bakteri fotosintetik. Mikrob tersebut memproduksi hidrogen dengan sistem fermentasi dengan bantuan energi cahaya. Proses fermentasi tersebut menggunakan substrat organik dan cahaya untuk membentuk adenosin trifosfat (ATP)
dan ferredoksin tereduksi (Fdred), kemudian
enzim nitrogenase menggunakan ATP dan Fdred untuk menghasilkan hidrogen, sehingga
produksi hidrogen lebih efisen. Jenis fermentasi tersebut dikenal dengan fotofermentasi.
Menurut Koku et al. (2002), bakteri fotosintetik merupakan jenis mikrob yang menguntungkan untuk produksi hidrogen dalam skala besar. Bakteri fotosintetik nonsulfur menghasilkan hidrogen menggunakan senyawa organik dan energi cahaya. Bakteri tersebut memiliki kemampuan tinggi dalam mengkonversi substrat secara efisien dan dapat menggunakan secara luas berbagai susbtrat baik untuk pertumbuhan maupun produksi hidrogen. Efisiensi energi cahaya untuk memproduksi hidrogen oleh bakteri fotosintetik lebih tinggi dibandingkan sianobakteria. Rhodobium marinum (ATCC 35675) merupakan salah satu contoh bakteri fotosintetik ungu nonsulfur yang dapat memproduksi H2 (Hiraishi 1995).
Produksi biohidrogen oleh bakteri fotosintetik ungu nonsulfur melibatkan enzim nitrogenase dan hidrogenase. Namun, sejak produksi hidrogen lebih diutamakan pada nitrogenase, aktivitas hidrogenase ini terabaikan. Aktivitas nitrogenase pada bakteri ini terstimulasi kuat oleh cahaya. Pola iluminasi saat periode terang dan gelap juga berpengaruh besar dalam kestabilan aktivitas nitrogenase. Kerja nitrogenase dalam menghasilkan hidrogen memerlukan sejumlah besar ATP dan energi tereduksi yang didapatkan dari hasil fotosistem bakteri tersebut (Meyer et al. 1978).
Penelitian tentang pengaruh cahaya ultraviolet (UV) dan warna (merah, biru, kuning) terhadap produksi hidrogen oleh
Rhodobium marinum belum dilakukan.
Tujuan penelitian ini adalah menentukan cahaya efektif dari cahaya UV dan warna (merah, biru, kuning) bagi bakteri fotosintetik
R. marinum untuk memproduksi hidrogen
secara maksimum. Hipotesis penelitian ini adalah cahaya UV yang memiliki energi lebih tinggi dibandingkan cahaya tampak atau cahaya tampak (merah, kuning, biru) menjadi panjang gelombang maksimum bagi R.
marinum dalam menghasilkan hidrogen
TINJAUAN PUSTAKA
Biohidrogen
Hidrogen berasal dari bahasa Yunani,
hydro yang berarti air, dan genes yang berarti pembentukan. Hidrogen merupakan unsur terbanyak dari semua unsur yang ada di alam semesta. Unsur ini diperkirakan membentuk komposisi lebih dari 90 % atom-atom di alam semesta. Hidrogen merupakan unsur yang bebas, gas paling ringan, dan dapat berkombinasi dengan elemen lain. Keadaan normal pada suhu ruang, gas hidrogen terdiri dari 25 % para-hidrogen dan 75 % ortho-hidrogen (Mohsin 2004).
Hidrogen dapat dihasilkan melalui: elektrolisis air, reformasi termokatalitik terhadap senyawa organik yang kaya kandungan H2, dan proses biologi. Reformasi
terhadap gas alam, gasifikasi batu bara, dan elektrolisis air membutuhkan energi yang sangat banyak dan tidak ramah lingkungan (Mahyudin & Koesnandar 2006).
Biohidrogen adalah hidrogen yang diproduksi melalui proses biologi dan menggunakan bahan-bahan biologis. Proses produksi hidrogen secara biologi membutuhkan energi lebih sedikit daripada cara kimia atau elektrokimia. Produksi biohidrogen dapat menggunakan mikrob dari berbagai taksa dan tipe fisiologi. Mikrob tersebut dapat memproduksi melalui proses bioteknologi dengan dua cara yaitu proses fermentasi secara anaerobik atau aerobik (Mahyudin & Koesnandar 2006).
Gas hidrogen mempunyai kandungan energi tertinggi di antara beberapa bahan bakar, yaitu 143 Gjton-1 per unitnya (Boyles 1984, diacu dalam Mahyudin & Koesnandar 2006). Pembakaran hidrogen tidak menghasilkan emisi karbon yang memberikan kontribusi pada polusi lingkungan dan perubahan iklim, sehingga tidak menimbulkan efek rumah kaca, penipisan lapisan ozon, atau hujan asam. Hasil pembakaran hidrogen di udara hanya menyisakan uap air dan energi panas (Mahyudin & Koesnandar 2006).
Fermentasi
Fermentasi berasal dari bahasa Latin
“fervere” yang berarti merebus (to boil). Arti kata dari bahasa Latin tersebut dapat dikaitkan dengan kondisi cairan bergelembung atau mendidih. Keadaan ini disebabkan adanya aktivitas ragi pada ekstraksi buah-buahan atau biji-bijian. Gelembung-gelembung karbon-dioksida merupakan hasil katabolisme anaerobik terhadap gula yang terkandung
dalam ekstrak buah-buahan atau biji-bijian. Berdasarkan historinya, fermentasi berasal dari kata ferment, yang merupakan istilah yang digunakan oleh Louis Pasteur untuk menyebutkan senyawa yang berperan dalam proses fermentasi. Ternyata senyawa tersebut adalah enzim yang berperan dalam fermentasi gula menjadi etanol dan karbondioksida (Nelson & Cox 2004). Proses fermentasi pada mulanya diartikan sebagai proses pemecahan karbohidrat menjadi alkohol dan karbondioksida. Tetapi fermentasi tidak selalu menggunakan karbohidrat sebagai susbtrat (Winarno et al. 1980).
Fermentasi memiliki arti yang berbeda bagi ahli biokimia dan mikrobiologi industri. Arti fermentasi pada bidang biokimia dihubungkan dengan pembangkitan energi oleh penguraian senyawa organik. Pada bidang mikrobiologi industri, fermentasi memiliki arti yang lebih luas, yang menggambarkan setiap proses untuk menghasilkan produk dari pembiakan mikroorganisme (Sumarsih 2007). Pada prinsipnya, fermentasi adalah proses perubahan substrat organik yang kompleks menjadi komponen yang lebih sederhana dengan adanya aktivitas enzim dan mikrob dalam keadaan yang terkontrol (Kim & Gadd 2008).
Fermentasi terjadi sebagai hasil metabolisme tipe anaerobik, yang mana mikrob dapat mencerna glukosa sebagai bahan baku energinya tanpa adanya oksigen, dan sebagai hasilnya hanya sebagian glukosa yang dipecah dan menghasilkan sejumlah kecil energi, karbon-dioksida, air, dan produk akhir metabolisme lainnya (Nelson & Cox 2004). Fermentasi dalam proses bioteknologi merupakan bagian penting dari pemanfaatan mikrob untuk mengubah substrat menjadi produk yang diinginkan dengan pengkondisian sistem, seperti temperatur, pH, oksigen terlarut, dan lain-lain (Suwandi 2009).
Tiga jenis sistem fermentasi dalam proses bioteknologi, yaitu sistem diskontinyu (batch), kontinyu, dan semikontinyu (
fed-batch). Sistem fermentasi diskontinyu
secara terus-menerus. Sistem semikontinyu adalah sistem fermentasi yang substratnya ditambahkan secara kontinyu selama fermentasi berlangsung tanpa mengeluarkan sesuatu dari sistem (Suwandi 2009).
Mikroorganisme Penghasil Gas Hidrogen
Mikroorganisme yang dapat menghasilkan hidrogen terdiri atas tiga jenis, yaitu: sianobakteria, bakteri anaerob, dan bakteri fotosintetik. Sianobakteria merupakan mikroorganisme yang memproduksi hidrogen dengan cara fotosintesis, yaitu memecah air menjadi hidrogen dan oksigen. Sianobakteria dapat mengkonversi langsung energi cahaya menjadi energi kimia sehingga tidak membutuhkan akumulasi radiasi bahan bakar atau substansi organik dalam media bakteri (Sirait 2007). Kelemahan organisme ini dalam memproduksi hidrogen adalah proses produksi hidrogen lambat, sistem reaksinya membutuhkan energi yang besar, dan membutuhkan penanganan khusus untuk memisahkan gas hidrogen dan oksigen (Zaborsky et al. 1998).
Bakteri anaerob menggunakan substansi organik sebagai sumber elektron dan energi tunggal, serta mengkonversinya menjadi hidrogen. Reaksinya cepat dan prosesnya tidak memerlukan bahan bakar sehingga membuat bakteri ini berguna bagi skala besar limbah cair. Namun, bakteri ini memiliki kelemahan dalam memproduksi gas hidrogen, yaitu hasil dekomposisi atau penguraian senyawa organik menghasilkan asam-asam organik (asam asetat, asam butirat, dan lain-lain). Asam organik tersebut menimbulkan masalah baru bila tujuan dari produksi adalah untuk menanggulangi limbah (Zaborsky et al. 1998).
Bakteri fotosintetik memiliki sistem di antara bakteri anaerob dengan sianobakteria untuk menghasilkan hidrogen. Bakteri ini memiliki kemampuan dalam mengkonversi substansi organik menjadi hidrogen dengan laju yang cukup tinggi, namun juga menggunakan cahaya dalam membantu reaksi pembentukan hidrogen. Energi cahaya yang dibutuhkan untuk memproduksi hidrogen lebih kecil karena peran senyawa organik. Senyawa organik yang dapat digunakan oleh bakteri ini adalah gula, laktat, asam lemak, tepung, selulosa, limbah organik dan lain-lain. Bakteri fotosintetik yang dapat memproduksi hidrogen antara lain Rhodopseudomonas, Rhodobacter, Anabaena, Chlamydomonas, Chromatium, dan Thiochapsa (Zaborsky et al.
1998).
Rhodobium marinum (ATCC 35675)
merupakan salah satu bakteri fotosintetik yang dapat memproduksi hidrogen.
Rhodopseudomonas marina atau lebih dikenal
dengan nama Rhodobium marinum
merupakan bakteri fotosintetik ungu nonsulfur, yaitu bakteri yang dapat menggunakan sulfida sebagai donor elektron, tetapi tidak bisa tumbuh pada konsentrasi sulfida yang tinggi. Selnya berbentuk batang, gram negatif, bergerak, memproduksi warna pink ke merah, fotoheterotrof fakultatif anaerob dan dapat melakukan reproduksi melalui budding (kuncup). Bakteri ini diisolasi dari air laut pada tahun 1995 (Hiraishi 1995).
Produksi Biohidrogen
Produksi biohidrogen oleh mikrob dapat dilakukan dengan dua cara, yaitu perubahan secara fotobiologis dan teknik fermentasi. Teknik yang pertama hanya dapat dilakukan pada siang hari yaitu ketika adanya matahari. Hal ini dikarenakan mikrob fotosintetik menggunakan energi dari sinar matahari sebagai sumber energi mereka. Teknik yang kedua dapat berlangsung pada siang maupun malam hari (dalam keadaan gelap). Produksi hidrogen yang dilakukan dalam penelitian ini menggunakan teknik fotofermentasi untuk menghasilkan hidrogen yang optimal.
Produksi hidrogen dengan fotofermentasi oleh bakteri fotosintetik membutuhkan energi cahaya dan senyawa organik. Energi cahaya oleh bakteri fotosintetik akan dikonversi menjadi energi potensial elektron kemudian membentuk ATP. Dalam proses berikutnya, elektron dinaikkan atau ditransfer untuk mereduksi feredoksin yang merupakan pembawa elektron ke nitrogenase (enzim yang dapat memproduksi hidrogen). Produk ATP disuplai ke enzim tersebut bersamaan dengan pembawa elektron. Nitrogenase memerlukan ATP dan 2 Fdred untuk
menghasilkan hidrogen. Foton mengaktifkan fotosistem di pusat reaksi untuk memompa proton. Proton ditransfer bersamaan dengan penghasilan ATP. Dua sampai tiga proton digunakan untuk memberikan ATP (Zaborsky
et al. 1998).
Produksi biohidrogen oleh R. marinum
melibatkan enzim nitrogenase. Reaksi yang terjadi pada enzim nitrogenase adalah sebagai berikut:
2H+ + 2 Fdred + 4 ATP H2 + 2 Fdoks +
4ADP + 4 Pi.
dalam kondisi nitrogen terbatas. R. marinum
memperoleh elektron dari senyawa organik untuk mereduksi proton menjadi molekul hidrogen. Jika molekul nitrogen tidak ada, enzim nitrogenase akan mereduksi proton menjadi gas hidrogen yang dibantu dengan energi dalam bentuk ATP dan elektron yang diperoleh dari feredoksin. Dalam proses fotosistem bakteri ini, tidak terbentuk oksigen sehingga tidak menghambat kerja enzim nitrogenase mengingat enzim nitrogenase sensitif terhadap oksigen (Akkerman 2002).
Enzim Penghasil Hidrogen
Proses produksi hidrogen secara biologi bergantung pada keberadaan enzim penghasil hidrogen. Bakteri fotosintetik ungu nonsulfur, memiliki enzim yang dapat memproduksi hidrogen yaitu nitrogenase dan hidrogenase. Enzim hidrogenase memiliki kemampuan memproduksi sekaligus dapat mengkonsumsi hidrogen yang telah dihasilkan. Secara umum sifat hidrogenase dapat dikatakan sebagai metabolik antagonis dari nitrogenase (Tamagnini et al. 2002).
Nitrogenase merupakan kompleks enzimatik yang dapat memfiksasi nitrogen di udara. Kompleks nitrogenase berada bebas di dalam organisme yang memfiksasi nitrogen dan juga berada di dalam bakteri yang memfiksasi nitrogen. Berikut persamaan reaksi pembentukan amonia dari fiksasi nitrogen :
N2 + 8H+ + 8e- + 16 ATP 2NH3 + H2 +
16 ADP + 16 Pi.
Reduksi nitrogen menjadi amonia merupakan reaksi endergonik yang memerlukan energi metabolisme tinggi dalam bentuk ATP. Amonia dibentuk pada proses ini ditambatkan ke dalam asam amino glutamat dan glutamin serta asam nukleat (Tamagnini et al. 2002).
Kompleks nitrogenase mengandung 2 tipe protein, yaitu dinitrogenase (protein MoFe atau protein 1 atau protein pertama), dan dinitrogenase reduktase (protein Fe atau protein kedua). Protein MoFe memiliki berat molekul (BM) 220-240 kDa. Protein ini merupakan heterotetramer α2β2 yang
mengandung 28 ion Molibdenum sebagai kofaktor, (Tamagnini et al. 2002). Protein MoFe mengandung dua set kelompok logam unik : kelas P ([8Fe-7S]) yang menjembatani antara masing-masing pasangan subunit αβ, dan kofaktor FeMo (FeMoco) yang berlokasi
di dalam subunit α (Hu et al. 2006).
Protein Fe memiliki BM 60-70 kDa, dibentuk dari 2 subunit yang mengandung 8 atom Fe sebagai kofaktor, dan berperan
spesifik dalam mediasi transfer elektron dari donor elektron luar (feredoksin atau flavodoksin) ke dinitrogenase (Tamagnini et al. 2002). Homodimer protein Fe yang dienkodekan oleh nifH mengandung dua situs penempelan nukleotida (satu per subunit) dan satu kelas [4Fe-4S] pada antarmuka dimer.
Bersamaan dengan hidrolisis ATP oleh protein Fe, elektron ditransfer berturut-turut dari kelas [4Fe-4S] di dalam protein Fe melalui kelas P di dalam protein MoFe ke FeMoco, yang mana terjadi reduksi substrat. Protein Fe juga penting untuk perakitan dari komplek kelas di dalam protein MoFe. Delesi gen nifH yang mengenkodekan protein Fe menghasilkan pembentukan protein MoFe dengan kelas P terganggu atau prekursor fragmen yang terdiri atas [4Fe-4S] seperti kelas P akan terganggu, mengindikasikan bahwa protein Fe mungkin memfasilitasi penggabungan fragmen-fragmen ini menjadi bentuk rakitan penuh [8Fe-7S] kelas P (Hu et al. 2006). Kofaktor logam baik Fe maupun Mo meletakkan nitrogen di dalam posisi yang mudah untuk dikonversi menjadi amonia. Kedua protein tersebut bersama-sama memfiksasi nitrogen di udara. Nitrogenase sangat sensitif terhadap oksigen. Oksigen dapat menginaktivasi aktivitas nitrogenase (Tamagnini et al. 2002).
Hidrogenase merupakan enzim yang mengkatalisis oksidasi reversibel dari H2
menjadi proton. Beberapa mikroorganisme menggunakan enzim ini dengan tujuan yang berbeda-beda. Banyak bakteri dan arkaea dapat menggunakan hidrogen sebagai sumber elektronnya dengan bantuan hidrogenase. Beberapa bakteri fermentatif dan alga hijau menggunakan hidrogenase untuk melepas kelebihan power reduksi dengan mereduksi proton menjadi hidrogen, dan bakteri pemfiksasi nitrogen menggunakan hidrogenase untuk menangkap kembali hidrogen yang telah diproduksi oleh nitrogenase (Lindberg 2003).
Hidrogenase dibagi menjadi tiga kelas berdasarkan filogenetik, yaitu [Fe]-hidrogenase, [NiFe]-[Fe]-hidrogenase, dan logam bebas-hidrogenase (Linberg 2003). Berdasarkan komponen logam dari sisi aktif yang menempel atau membebaskan H2,
hidrogenase terbagi atas 3 kelas yaitu [NiFe]-, [FeFe]-, dan [Fe] hidrogenase (Stripp et al.
2009).
fotogenerasi H2 secara enzimatik. Reaksi
terjadi pada sisi aktif bimetalik yang terdiri atas atom Fe ([FeFe]-hidrogenase) atau Ni dan Fe ([NiFe]-hidrogenase), dikoordinasikan oleh ligan CO dan CN- (Stripp et al. 2009). [NiFe]-hidrogenase merupakan heterodimer dengan sisi aktif mengandung 2 subunit besar dan sistem penyaluran elektron kelas [FeS] yang melalui subunit kecil. Ukuran subunit besar dan kecil cenderung konsisten, masing-masing 60 kDa dan 30 kDa. Kelas [FeS] menyediakan sistem penyaluran transfer elektron yang mengizinkan loncatan elektron melewati matriks protein. Saluran uap menyediakan jalur untuk H2 dalam melintasi
antara sisi aktif dan bagian eksterior protein, dan sejumlah residu yang mudah dideprotonasi pada jalur transfer proton (Linberg 2003).
Pengaruh Cahaya pada Produksi Hidrogen
Cahaya merupakan salah satu parameter penting yang dibutuhkan dalam produksi hidrogen oleh bakteri fotosintetik.
Penggunaan cahaya secara optimal oleh bakteri sangat penting dalam menghasilkan hidrogen yang maksimal. Berbagai jenis cahaya memiliki intensitas dan panjang gelombang yang berbeda-beda. Efektivitas spektrum warna yang berbeda-beda dari cahaya tampak akan menaikkan hasil fotosintesis. Bila spektrum sesuai dengan pigmen fotosintesis maka serapan terhadap cahaya akan meningkatkan hasil fotosintesis (Nelson & Coxx 2004). Pada kondisi anaerobik di bawah pencahayaan, aparatus fotosintetik bakteri akan mengkonversi energi cahaya menjadi ATP. Jumlah cahaya yang diterima oleh pigmen antena bakteri akan menentukan tahap eksitasi dan transfer elektron pada proses fotofermentasi (Akkerman 2002).
Produksi hidrogen yang dikatalisis oleh nitrogenase juga bergantung pada proporsi intensitas cahaya (Koku et al. 2002). Berdasarkan hasil penelitian Roh et al.
(2004), pada Rhodobacter sphaeroides
intensitas cahaya menentukan level dan jumlah seluler Intacytoplsmic Membrane
(ICM). Sistem ICM ini merupakan sistem yang mendirikan aparatus fotosintetik dan memiliki komponen penting, seperti: penangkap energi cahaya, transfer elektron, serta transduksi energi.
Menurut Koku et al. (2002), pengaruh cahaya pada bakteri fotosintetik akan mengendalikan sintesis aparatus fotosintetik. Dalam keadaan anaerobik, sejumlah vesikel
membran fotosintetik dihasilkan bervariasi berlawanan dengan intensitas cahaya. Konversi energi cahaya juga berhubungan dengan kesesuaian pigmen yang ada. Bila cahaya tertentu diserap oleh pigmen yang sesuai mungkin akan meningkatkan efisiensi penggunaan cahaya oleh bakteri. Perbedaan intensitas cahaya dan pergantian periode terang dan gelap akan mempengaruhi aktivitas nitrogenase dalam memproduksi hidrogen.
Intensitas cahaya juga berperan penting dalam pertumbuhan bakteri fotosintetik. Pada
R. sphaeroides, intensitas cahaya yang tinggi akan meningkatkan pertumbuhan dan sebaliknya intensitas cahaya menurun, maka pertumbuhan menurun. Pertumbuhan tertinggi tidak selalu terdapat pada pemberian intensitas cahaya yang tertinggi (Akose 2008).
Pertumbuhan Mikrob
Pertumbuhan adalah penambahan mikrob secara teratur semua komponen sel suatu jasad. Pertumbuhan dapat diamati dari meningkatnya jumlah sel atau massa sel (berat kering sel). Pada umumnya bakteri dapat memperbanyak diri dengan pembelahan binner, yaitu satu sel membelah menjadi 2 sel baru. Waktu yang diperlukan untuk membelah diri dari satu sel menjadi dua sel sempurna disebut waktu generasi. Kecepatan pertumbuhan merupakan perubahan jumlah atau massa sel per unit waktu. Pertumbuhan dapat diukur dari perubahan jumlah sel atau berat kering massa sel. Jumlah total sel mikrob dapat ditetapkan langsung dengan pengamatan mikroskopis dan diamati dengan menggunakan metode ruang hitung (counting chamber). Jumlah sel hidup dapat ditetapkan dengan metode plate count.
Pertumbuhan sel dapat diukur dari massa sel dan secara tidak langsung dengan mengukur turbiditas cairan medium tumbuh. Turbiditas dapat diukur menggunakan alat fotometer, semakin pekat atau semakin banyak populasi mikrob maka cahaya yang diteruskan semakin sedikit. Turbiditas juga dapat diukur menggunakan spektrofotometer dengan nilai yang diketahui berupa Optical Density (OD). Unit fotometer atau optical density proporsional dengan massa sel dan juga jumlah sel.
suatu grafik atau kurva pertumbuhan. Pertumbuhan populasi mikrob dibedakan menjadi dua, yaitu biakan sistem tertutup (batch culture) dan biakan sistem terbuka (continous culture).
Biakan sistem tertutup memerlukan pengamatan jumlah sel dalam waktu yang cukup lama untuk memberikan gambaran berdasarkan kurva pertumbuhan bahwa terdapat fase-fase pertumbuhan. Fase pertumbuhan dimulai pada fase permulaan, fase pertumbuhan yang dipercepat, fase pertumbuhan logaritma (eksponensial), fase pertumbuhan yang mulai dihambat, fase stasioner maksimum, fase kematian yang dipercepat, dan fase kematian logaritma.
Fase permulaan ditandai dengan bakteri baru menyesuaikan diri dengan lingkungan yang baru, sehingga sel belum membelah diri. Sel mikrob mulai membelah diri pada fase pertumbuhan yang dipercepat, tetapi waktu generasinya masih panjang. Fase permulaan sampai fase pertumbuhan dipercepat disebut
lag phase. Sel membelah diri paling cepat terdapat pada fase pertumbuhan logaritma atau pertumbuhan eksponensial, dengan waktu generasi yang pendek dan konstan. Selama fase logaritma, metabolisme sel paling aktif, sintesis bahan sel sangat cepat dengan jumlah konstan sampai nutrien habis atau terjadinya penimbunan hasil metabolisme yang menyebabkan terhambatnya pertumbuhan.
Fase pertumbuhan yang mulai terhambat ditandai dengan berkurangnya kecepatan pembelahan sel dan jumlah sel yang mati mulai bertambah. Pada fase stasioner, maksimum jumlah sel yang mati semakin meningkat sampai terjadi jumlah sel hidup hasil pembelahan sama dengan jumlah sel yang mati, sehingga jumlah sel hidup konstan, seolah-olah tidak terjadi pertumbuhan. Pada fase kematian yang dipercepat, kecepatan kematian sel terus meningkat, sedangkan kecepatan pembelahan sel nol, sampai pada fase kematian logaritma maka kecepatan kematian sel mencapai maksimal, sehingga jumlah sel hidup menurun dengan cepat seperti deret ukur. Namun, penurunan jumlah sel hidup tidak mencapai nol, dalam jumlah minimum tertentu sel mikrob akan tetap bertahan sangat lama dalam medium (Sumarsih 2007).
Kromatografi Gas
Kromatografi gas merupakan metode separasi sampel yang dapat memisahkan komponen-komponen sampel di antara dua
fase, yaitu fase diam dengan luas area yang besar, dan fase gerak berupa gas yang mengalir melewati fase diam. Pada proses elusi, sampel diuapkan dan dibawa oleh gas pembawa (fase gerak gas) melewati kolom. Sampel dibagi ke dalam fase diam cair berdasarkan kelarutannya pada temperatur yang diberikan. Komponen-komponen sampel memisah dari yang lain berdasarkan tekanan uap relatif dan afinitas terhadap fase diam (Mcnair & Miller 1998).
Berdasarkan fase diam yang digunakan, kromatografi gas dibagi menjadi 2 jenis, yaitu kromatografi padat dan kromatografi gas-cair. Metode separasi dengan kromatografi gas memiliki beberapa keuntungan, di antaranya adalah 1) Analisis cepat, dalam beberapa menit. 2) Efisen karena menghasilkan resolusi yang tinggi, 3) Sensitif karena deteksi dalam ppm atau sering juga ppb, 4) Tidak dekstruktif, sehingga bisa digabung dengan spektroskopi massa (GCMS), 5) Keakuratan tinggi dalam analisis kuantitatif, 6) Sampel yang digunakan sangat sedikit (dalam mikro), 7) Dan murah. Namun, kromatografi gas ini juga memiliki keterbatasan, yaitu terbatas untuk sampel volatil, tidak cocok untuk sampel yang tidak tahan panas, sulit bagi sampel preparatif atau sampel yang banyak, dan memerlukan spektroskopi untuk mengidentifikasi puncak hasil kromatografi gas. (Mcnair & Miller 1998)
Bagian-bagian dasar gas kromatografi secara sederhana di antaranya adalah gas pembawa, kontrol laju alir, injektor, kolom, detektor, dan sistem data. Bagian utama dari kromatografi adalah kolom. Kolom merupakan tabung yang berisi sokongan inert untuk fase diam cair yang dilapiskan. Kolom yang sering digunakan saat ini adalah yang dibuat dari leburan silika dan tabung terbuka dengan dimensi kapiler. Gas pembawa berfungsi untuk membawa sampel melewati kolom. Gas pembawa merupakan fase gerak yang inert dan terdiri dari berbagai jenis yang memiliki kecocokan berbeda-beda untuk berbagai detektor. Kolom kromatografi dipaket secata kuat dengan fase diam pada pendukung padat inert (Mcnair & Miller 1998).
lebih tinggi dari titik leleh sampel. Temperatur untuk detektor diatur berdasarkan detektor yang dipakai (Mcnair & Miller 1998).
Detektor sangat sensitif terhadap keluaran dari kolom dan mencatat keluaran dalam bentuk kromatogram. Sinyal detektor sesuai terhadap jumlah analit sehingga data dapat digunakan untuk analisis kuantitatif. Detektor yang paling umum adalah flame ionization detector (FID). FID merupakan detektor yang memiliki sensitivitas tinggi, linearitas, dan murah. Beberapa detektor lain adalah thermal conductivity detector (TCD), electron capture detector (ECD) (Mcnair & Miller 1998).
Sistem data umumnya terdiri atas 2 jenis, yaitu integrator dan komputer. Pada integrator berbasis mikroprosesor, mikroprosesor didedikasikan dengan konventer analog ke digital untuk menghasilkan kromatrogram dan data analisis kuantitatif. Algoritma dipakai untuk mendukung fungsi tersebut. Komputer memiliki fleksibilitas paling besar dalam mendapatkan data, mengontrol alat, mereduksi data, menampilkan dan mentransfer ke alat lain. Komputer lebih sering digunakan karena memorinya besar, pemrosesan cepat, dan fleksibel untuk antarmuka pengguna (Mcnair & Miller 1998). Cara kerja kromatografi secara keseluruhan dan sederhana yaitu, gas pembawa yang inert mengalir secara kontinyu dari tabung silinder gas masuk ke lubang injeksi, kemudian ke kolom, dan detektor. Laju alir gas pembawa ini dikontrol untuk menghasilkan waktu retensi yang tepat dan meminimalkan gangguan. Selanjutnya, sampel diinjeksi ke dalam lubang injeksi yang panas, diuapkan dan dibawa ke dalam kolom. Sampel terpartisi antara fase diam dan fase gerak, kemudian pemisahan komponen masing-masing berdasarkan kelarutan relatif dalam fase diam cair dan tekanan uap relatif. Setelah melewati kolom, gas pembawa dan sampel melalui detektor sehingga dihasilkan sinyal-sinyal listrik yang kemudian dikirimkan ke sistem data atau sistem pencatat dan terakhir dihasilkan kromatogram. Sistem pencatatan data secara otomatis melaporkan luas puncak, kalkulasi bentuk, data kuantitatif, dan waktu retensi (Mcnair & Miller 1998).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah tabung ulir, botol Schott 1000 ml, botol serum 100 ml, gelas kimia, pipet mikro,
pipet pasteur, syringe (5 ml dan 50 ml), rak tabung, selang, shaker, inkubator bergoyang, neraca analitik, neraca timbang, vortex, mikrosentrifus dan sentrifus RC26 rotor GSA. Alat yang digunakan untuk pencahayaan, yaitu lampu berwarna merah, kuning, biru, dan lampu ultraviolet (UV). Selain itu, alat analisis yang digunakan adalah alat pengukur panjang gelombang lampu USB2000 Vis-NIR Spectrophotometer, pH indikator universal, spektrofotometer UV-VIS pharmaspec 1700, sensor hidrogen H2 scan
model 2240 dan kromatografi gas (GC) HP 5890.
Bahan mikrob yang digunakan adalah biakan bakteri fotosintetik Rhodobium
marinum NBRC No. 100434. Bahan yang
digunakan dalam pembuatan media bakteri adalah akuades, dinatrium suksinat, D-glukosa (Merck), ekstrak khamir, K2HPO4,
KH2PO4, EDTA.2Na, H3BO3, Na2MoO4.
2H2O, ZnSO4.7H2O, MnCl2, Cu(Mo3)2. 3H2O,
FeSO4. 7H2O, CaCl2. 2H2O, Mg SO4. 7 H2O ,
larutan NaOH 1 N, larutan HCl 2 N, gas N2,
natrium hidrogen karbonat, dan vitamin B12.
Bahan kimia yang digunakan untuk analisis kadar glukosa adalah glukosa kit merk WAKO. Bahan yang digunakan untuk analisis H2 dengan GC , yaitu gas N2.
Metode
Pembuatan Media Pembibitan R. marinum (Media Modifikasi Fotosintetik)
Media R. marinum dibuat dengan komposisi sebagai berikut : 10 gram dinatrium suksinat, 0.3 gram ekstrak khamir ditimbang menggunakan neraca analitik kemudian dimasukkan ke dalam botol Schott, 10 ml Bassal medium 100x (K2HPO4 = 750
mg, KH2PO4 = 850 mg, EDTA.2Na = 2 mg,
H3BO3 = 2,8 mg, Na2MoO4. 2H2O = 0,75 mg,
ZnSO4. 7 H2O = 0,24 mg, MnCl2 = 2,1 mg,
Cu(Mo3)2. 3H2O = 0,04 mg, FeSO4. 7H2O =
10 mg, CaCl2. 2H2O = 0,75 mg, Mg SO4. 7
H2O = 200 mg, dan 1 L akuades) dimasukkan
ke dalam botol Schott lalu ditambahkan akuades 1000 ml sambil diaduk. Pengkondisian pH menjadi 6.8 dengan menambahkan beberapa tetes NaOH 2 N atau HCl 2 N. Untuk menghilangkan oksigen dalam media, dilakukan penambahan gas nitrogen selama 1 jam. Setelah itu, ditambahkan 1.5 g NaHCO3. Media
disterilisasi di dalam autoklaf dengan suhu
121˚C selama 15 menit. Media didinginkan
kemudian ditambahkan 5 ml vitamin B12 0.01
Pembibitan Rhodobium marinum
Dua buah botol serum 100 ml disiapkan untuk masing-masing 2 ulangan bakteri. Media pembibitan yang telah dibuat dimasukkan sebanyak 72 ml ke masing-masing botol serum. Pembibitan bakteri ke dalam media dengan konsentrasi 10 %, yaitu dengan menambahkan bakteri dari stok ke dalam masing-masing botol sebanyak 8 ml. Selanjutnya, media yang telah ditanam bakteri diletakkan di inkubator bergoyang yang disinari cahaya lampu (UV atau warna).
Penggunaan Sumber Pencahayaan
Sumber cahaya untuk perlakuan pencahayaan didapatkan dari berbagai lampu yang mewakili beberapa panjang gelombang. Beberapa lampu yang digunakan adalah lampu merah, kuning, biru, dan ultraviolet. Panjang gelombang dari masing-masing lampu diperoleh dengan cara mengukur serapannya menggunakan alat USB2000 Vis-NIR Spectrophotometer yang telah dihubungkan dengan software Spectra Suite pada komputer. Puncak yang dihasilkan dari serapan masing-masing lampu merupakan panjang gelombang lampu tersebut.
Kurva Pertumbuhan R. marinum pada Pencahayaan Berbeda
R. marinum yang ditumbuhkan ke dalam media pembibitan diamati pertumbuhannya dengan mengukur OD setiap 24 jam menggunakan spektrofotometer UV-VIS (Pharmaspec 1700) pada panjang gelombang 660 nm. Kenaikan OD sebanding dengan kenaikan absorban. OD yang didapat dibuat plot dengan waktu menghasilkan kurva pertumbuhan bakteri. Kurva pertumbuhan untuk setiap perlakuan cahaya UV dan warna didapatkan dengan mengamati pertumbuhan bakteri yang disinari cahaya UV dan warna.
Sentrifugasi dilakukan ketika OD mencapai ±1. Sentrifugasi menggunakan sentrifus RC26 rotor GSA dengan kecepatan
6000 rpm pada suhu 7 ˚C selama 15 menit. Sentrifugasi bertujuan memanen bakteri untuk digunakan pada produksi hidrogen.
Pembuatan Media Produksi Hidrogen
D-glukosa sebanyak 10 gram dan 3 gram ekstrak khamir ditimbang menggunakan neraca analitik kemudian dimasukkan ke dalam botol Schott. Ke dalam botol Schott 1000 ml dimasukkan 10 ml Bassal medium lalu ditambahkan akuades 1000 ml kemudian diaduk. Pengkondisian pH menjadi 6.8 dengan menambahkan beberapa tetes NaOH
2N dan HCl 2N. Untuk menghilangkan oksigen dalam media, dilakukan penambahan gas N2 selama 1 jam. Setelah itu,
ditambahkan 1.5 g NaHCO3. Media
disterilisasi di dalam autoklaf pada suhu
121˚C selama 15 menit. Media didinginkan
kemudian ditambahkan 5 ml vitamin B12 0.01
%. Penambahan vitamin ke dalam media dilakukan di dalam laminar.
Fotofermentasi pada Pencahayaan Berbeda
Dua buah botol serum skala 100 ml disiapkan masing-masing untuk 2 ulangan R. marinum. Pelet R. marinum yang diperoleh dari hasil pemanenan sel dengan sentrifugasi, kemudian dilarutkan ke dalam media produksi. R. marinum dimasukkan ke media produksi dengan konsentrasi 10 %, yaitu dengan menambahkan ke dalam masing-masing botol sebanyak 8 ml ke media produksi yang berisi 72 ml. Selanjutnya, kultur diletakkan di inkubator bergoyang yang diberi perlakuan cahaya untuk proses fermentasi. Fotofermentasi untuk setiap perlakuan cahaya (merah, kuning, biru, dan UV) masing-masing menggunakan 2 ulangan. Sistem fermentasi yang digunakan pada penelitian ini adalah fotofermentasi diskontinyu.
Pengambilan Sampel
Pengambilan sampel baik medium maupun gas dilakukan setiap 24 jam. Sebanyak 1 ml medium diambil dari masing-masing botol serum menggunakan syringe
untuk diukur OD, pH, dan kadar glukosa. Setiap 24 jam juga dilakukan pengukuran pertambahan volum gas yang dihasilkan, yaitu dengan cara melihat langsung perubahan volume air tabung di dalam penampung gas akibat tekanan dari gas yang dihasilkan. Setelah jumlah gas dicatat, kemudian gas diambil menggunakan syringe khusus, lalu dimasukkan ke dalam botol serum yang telah divakumkan. Satu ml gas tersebut diambil menggunakan syringe khusus untuk diukur gas hidrogennya dengan alat kromatografi gas.
Pengukuran Kandungan Glukosa
UV-VIS (Pharmaspec 1700) pada panjang gelombang 505 nm. Sebelumnya dibuat standar glukosa dengan konsentrasi 1000, 2000, 3000, 4000, 5000, dan 6000 ppm. Kadar glukosa sampel dihitung dengan memasukkan data serapan ke persamaan kurva standar glukosa.
Analisis Gas Hidrogen dengan Kromatografi Gas (Modifikasi Kawaguchi et al. 2002)
Pengukuran gas hidrogen selain menggunakan sensor hidrogen H2 scan model
2240 juga diukur menggunakan alat kromatografi gas. Detektor yang digunakan adalah TCD (Thermal Conductivity Detector
atau detektor konduktivitas termal). Adapun kolom yang digunakan adalah kolom poropak, dengan temperatur injektor, detektor, dan kolom masing-masing adalah 150, 250, dan 80˚ C. Gas pembawa yang dipakai adalah gas nitrogen (N2). Sampel diinjeksikan sebanyak
1 ml ke dalam kolom kemudian hasil analisis berupa kromatogram yang menampilkan puncak analit dan luas area dilihat pada layar monitor (Kawaguchi et al. 2002). Sebelumnya telah ditentukan luas area puncak untuk gas hidrogen dengan konsentrasi 100 %. Konsentrasi hidrogen sampel ditentukan dengan membandingkan luas area puncak sampel terhadap luas area gas hidrogen konsentrasi 100 %.
HASIL DAN PEMBAHASAN
Sumber Pencahayaan
Cahaya memiliki sifat sebagai gelombang dan partikel. Cahaya juga memancarkan radiasi elektromagnetik yang dikenal dengan spektrum elektromagnetik dan sebagai gelombang elektromagnetik. Gelombang elektromagnetik dapat terbentuk secara ilmiah dari pancaran atom, molekul, atau inti atom dari materi (Jones 2010).
Cahaya merupakan salah satu faktor penting bagi pertumbuhan organisme fotosintetik. Organisme fotosinteik menggunakan energi cahaya untuk proses biosintesis (Kim & Gadd 2008). Bakteri fotosintetik menggunakan cahaya salah satunya untuk sintesis hidrogen. Penggunaan lampu sebagai sumber pencahayaan pada penelitian ini meliputi lampu merah, kuning, biru, dan UV. Lampu-lampu tersebut mewakili beberapa panjang gelombang. Hasil pengukuran panjang gelombang maksimum dari lampu merah, kuning, biru, UV masing-masing adalah 613, 544, 440, dan 360 nm.
Sinar UV memiliki panjang gelombang lebih pendek bila dibandingkan dengan sinar tampak. Radiasi UV didefinisikan sebagai bagian dari spektrum elektromagnetik di antara sinar x dan cahaya tampak (40-400 nm). Spektrum UV dibagi menjadi UV vakum (40-190 nm), UV jauh (190-220), UVC (220-290 nm), UVB (290-320 nm), dan UVA (320-400 nm). Lampu UV yang digunakan pada penelitian ini memiliki panjang gelombang maksimum 360 nm. Dengan mengetahui nilai panjang gelombang maksimum, maka lampu UV tersebut digolongkan jenis UVA. UVA merupakan jenis yang biasa ditemui dari sinar UV. Sinar UVA sering disebut cahaya hitam dan memiliki frekuensi paling tinggi di antara jenis UV lainnya (Zeman 2009). Radiasi UVA dapat menyebabkan kerusakan sel. Pada sel manusia, radiasi UVA memberikan pengaruh terhadap pigmentasi, penuaan dini, dan kanker kulit (Alatas 2004).
Cahaya tampak merupakan bagian radiasi spektrum elektromagnetik yang dapat terlihat oleh mata manusia. Daerah spektrum cahaya tampak yaitu dari 400 nm sampai 700 nm. Daerah tersebut dikenal sebagai spektrum cahaya optik. Spektrum cahaya tampak terdiri atas cahaya: merah, jingga, kuning, hijau, biru dan ungu. Dari berbagai spektrum cahaya tersebut, jenis spektrum cahaya yang digunakan pada penelitian ini adalah merah, kuning, dan biru.
Spektrum cahaya merah merupakan spektrum yang memiliki panjang gelombang tertinggi di antara spektrum cahaya tampak lainnya, merupakan cahaya monokromatik, daerah panjang gelombangnya berkisar antara 624-740 nm, memiliki kemampuan dalam menstimulasi proliferasi sel keratinosit dan fibroblast bersama induksi faktor pertumbuhan, dan juga dapat menstimulasi pertumbuhan kembali sel saraf (Lembeck 2010). Spektrum cahaya kuning memiliki panjang gelombang lebih pendek dibandingkan cahaya merah, merupakan cahaya monokromatik, dan daerah panjang gelombangnya antara 565-590 nm. Spektrum cahaya biru memiliki panjang gelombang paling pendek di antara cahaya merah dan kuning, merupakan cahaya monokromatik, daerah panjang gelombangnya antara 435-500 nm (Jones 2010), dan dapat membunuh beberapa bakteri penyebab infeksi seperti
Staphylococcus aureus resisten meticilin (Liebert 2009).
dan kuning memiliki panjang gelombang maksimum yang berada di luar daerah spektrum cahaya masing-masing. Sedangkan lampu biru dan UV memiliki panjang gelombang maksimum di daerah spektrum masing-masing.
Kurva Pertumbuhan R. marinum pada Pencahayaan Berbeda
Pertumbuhan sel mikrob dapat diukur dari pertambahan sel baik secara langsung maupun tidak langsung. Pertumbuhan R. marinum
diamati secara tidak langsung dengan mengukur kerapatan optik (OD) pada panjang gelombang 660 nm menggunakan alat spektrofotometer. Pengamatan OD terhadap waktu akan menghasilkan kurva pertumbuhan.
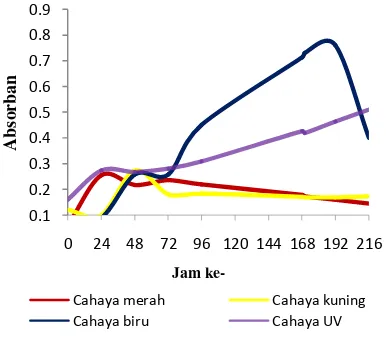
Pertumbuhan R. marinum terhadap berbagai macam pencahayaan (merah, kuning, biru, dan UV) menghasilkan kurva pertumbuhan yang berbeda-beda (Gambar 1). Fase pertumbuhan logaritma (fase log) bakteri pada perlakuan cahaya merah dan UV terjadi pada awal ditumbuhkan sampai jam ke-24, sedangkan pada perlakuan cahaya kuning dan biru, fase log terjadi setelah jam ke-24 sampai jam ke-48. Pola berbeda ditunjukkan bakteri ketika mendapat perlakuan cahaya kuning dan biru. Ketika ditumbuhkan sampai jam ke-24, bakteri tidak mencapai fase log, tetapi pertumbuhan bakteri menurun, kemudian terjadi peningkatan pertumbuhan setelah jam ke-24.
Fase stasioner bakteri pada perlakuan cahaya merah dan UV terjadi pada jam ke-24 sampai jam ke-72. Pada perlakuan cahaya biru, fase stationer terjadi dari jam ke-48 sampai jam ke-72, sedangkan pada perlakuan cahaya kuning fase stasioner baru terjadi pada jam ke-72 sampai jam ke-96.
Fase kematian tidak terlihat pada perlakuan UV, setelah terjadi fase stationer, pertumbuhan bakteri meningkat. Pada perlakuan cahaya biru, pertumbuhan bakteri juga meningkat setelah fase stasioner, namun saat jam ke-216 bakteri terjadi fase kematian. Fase kematian untuk perlakuan cahaya merah terjadi setelah jam ke-72, sedangkan untuk perlakuan cahaya kuning fase kematian terjadi setelah jam ke-96.
Hasil penelitian Habibi (2009) pada R.
marinum yang diberi cahaya putih,
menunjukkan bahwa fase log bakteri terjadi pada jam ke-2 sampai jam ke-18 dan fase stasioner terjadi pada jam ke-30. Hasil penelitian menunjukkan bahwa berbagai pencahayaan menghasilkan kurva
pertumbuhan berbeda-beda. Berdasarkan hasil keempat pencahayaan, didapatkan pola pertumbuhan yang hampir sama untuk perlakuan cahaya merah dan UV, yaitu mulai awal bakteri ditumbuhkan sampai melewati fase stasioner, tetapi pada perlakuan cahaya UV bakteri tidak mencapai fase kematian.
Bakteri pada umumnya memperbanyak diri dengan pembelahan biner, sehingga pembelahan sel tersebut menghasilkan pertambahan jumlah sel. Kurva pertumbuhan
R. marinum didapatkan dengan menentukan OD berdasarkan prinsip turbiditas terhadap cairan medium bakteri yang diukur dengan alat spektrofotometer. Semakin banyak populasi atau jumlah bakteri meningkat, maka cahaya yang diteruskan semakin sedikit. Secara tidak langsung pengukuran OD dapat menentukan jumlah sel (Sumarsih 2007). Jumlah bakteri yang dihitung diplotkan dengan waktu sehingga memberikan gambaran kurva pertumbuhan yang terdapat fase-fase pertumbuhan. Fase pertumbuhan bakteri terdiri atas: fase lag, fase log, fase stasioner, dan fase kematian (Sumarsih 2007). Fase lag ditandai dengan perubahan ukuran sel, sel membelah diri dengan lambat karena sel baru beradaptasi dengan lingkungannya. Sel mikrob mulai membelah diri dengan laju yang cepat pada fase log. Pembelahan sel dengan laju cepat akan mengakibatkan nutrien habis terpakai untuk sintesis bahan sel sehingga terjadi penimbunan hasil metabolime yang dapat menghambat pertumbuhan sel atau menyebabkan kematian sel. Pada fase stasioner, jumlah sel yang mati sama dengan jumlah sel hidup hasil pembelahan. Fase kematian ditandai dengan kematian sel yang terus meningkat. (Sumarsih 2007).
Gambar 1 Pertumbuhan R.marinum pada pencahayaan berbeda. 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
0 24 48 72 96 120 144 168 192 216
A b so r b an Jam
ke-Cahaya merah Cahaya kuning
[image:16.595.326.519.554.727.2]Cahaya menjadi salah satu faktor pertumbuhan bagi organisme fototropik selain temperatur, pH, tekanan osmotik, oksigen atau CO2. Selain itu, bakteri
fotosintetik memerlukan cahaya untuk melakukan fotosintesis dan bukan sebagai sumber penghasil panas (Hogg 2005). Spektrum cahaya yang sesuai bagi pigmen fotosintesis yang dimiliki bakteri akan meningkatkan hasil fotosintesis (Nelson & Cox 2004). Hal tersebut tentu berpengaruh dalam meningkatkan pertumbuhan bakteri.
Kandungan Glukosa
Pemakaian glukosa sebagai susbstrat pada fotofermentasi produksi hidrogen dapat ditunjukkan dari hasil penentuan kadar glukosa selama fermentasi. Pengukuran kadar glukosa pada penelitian ini menggunakan metode spektrofotometri dengan reagen glukosa kit. Prinsip kerja reagen tersebut adalah glukosa pada sampel akan bereaksi dengan enzim glukosa oksidase yang terdapat pada reagen sehingga merubah warna reagen dari tidak berwarna menjadi merah muda. Intensitas warna yang dihasilkan menunjukkan kadar glukosa sampel.
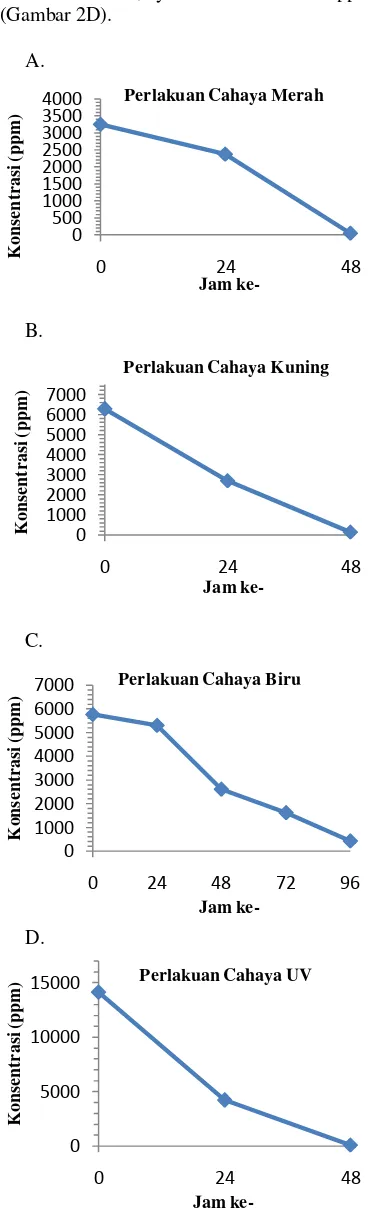
Hasil penentuan kadar glukosa selama fermentasi menunjukkan bahwa kadar glukosa pada perlakuan cahaya merah mengalami penurunan dari 3262 ppm pada jam ke-0 menjadi 2378 ppm pada jam ke-24, kemudian pada jam ke-24 sampai jam ke-48 kadar glukosa mengalami penurunan drastis sebesar 2326 ppm (Gambar 2A).
Kadar glukosa media fermentasi pada perlakuan cahaya kuning mengalami penurunan drastis dari 6278 ppm pada jam ke-0 menjadi 2696 ppm pada jam ke-24. Selanjutnya, terjadi penurunan kadar glukosa sebesar 2552 ppm dari jam ke-24 sampai jam ke-48 (Gambar 2B).
Kadar glukosa untuk perlakuan cahaya biru pada jam ke-0 sampai jam ke-24 mengalami penurunan tidak terlalu drastis seperti pada perlakuan cahaya merah dan kuning. Kadar glukosa menurun dari 5772 ppm pada jam ke-0 sampai 5305 ppm pada jam ke-24. Pada jam ke-24 sampai jam ke-48, penurunan kadar glukosa drastis mencapai 2696 ppm. Setelah jam ke-48, kadar glukosa menurun sebesar 995 ppm sampai pada jam 72. Penurunan kadar glukosa dari jam ke-72 sampai jam ke-96 sebesar 1185 ppm (Gambar 2C).
Kadar glukosa pada perlakuan cahaya UV juga menurun drastis pada jam ke-0 sampai jam ke-24, terjadi penurunan glukosa dari
14130 ppm menjadi 4196 ppm. Kadar glukosa dari jam ke-24 sampai jam ke-48 juga menurun drastis, yaitu sebesar 4127 ppm (Gambar 2D).
A.
B.
C.
[image:17.595.324.508.118.729.2]D.
Gambar 2 Kadar glukosa media produksi pada pencahayaan berbeda. 0 500 1000 1500 2000 2500 3000 3500 4000
0 24 48
K o n se n tr as i (p p m ) Jam ke-Perlakuan Cahaya Merah
0 1000 2000 3000 4000 5000 6000 7000
0 24 48
K o ns e nt r as i (ppm ) Jam ke-Perlakuan Cahaya Kuning
0 1000 2000 3000 4000 5000 6000 7000
0 24 48 72 96
K o n se n tr as i (p p m ) Jam ke-Perlakuan Cahaya Biru
0 5000 10000 15000
0 24 48
Berdasarkan hasil penentuan kadar glukosa dari keempat pencahayaan, terjadinya penurunan kandungan glukosa mengindikasikan adanya pemakaian glukosa oleh bakteri. Bakteri fotosintetik nonsulfur seperti: R. sphaeroides, R. rubrum, R. marinum, dan lain-lain dapat menggunakan secara luas sumber karbon dan sumber nitrogen. Penggunaan jalur metabolisme karbon secara luas dan kemungkinan berbeda-beda di antara strain yang berberbeda-beda dalam spesies yang sama pada bakteri fotosintetik nonsulfur (Koku et al. 2002).
Glukosa merupakan susbstrat yang baik dalam produksi hidrogen oleh R. marinum. Glukosa potensial dalam menghasilkan H2
paling banyak dengan menggunakan R. marinum (Habibi 2009). Secara stoikiometri, 1 mol glukosa menghasilkan 12 mol H2,
berikut reaksinya:
C6H12O6 + 6 H2O 12 H2 + 6 CO2.
R. marinum menggunakan glukosa sebagai
substrat fermentasi untuk memproduksi gas hidrogen pada penelitian ini. Glukosa yang terdapat pada media fermentasi kadarnya 1 %. Kadar glukosa tersebut lebih tinggi dibandingkan sumber nitrogennya yang berasal dari ekstrak khamir, yaitu 0.3 %.
Fotoorganotropik seperti bakteri fotosintetik nonsulfurmenggunakan senyawa organik sebagai sumber karbonnya dan menghasilkan hidrogen dalam kondisi fotoheterotopik (terdapat cahaya, anaerob, dan rasio C/N tinggi). Metabolisme glukosa akan masuk ke jalur EMP (Embden Meyerhoff Parnas) atau ED (Entner Doudoroff). Selanjutnya, piruvat mengalami fermentasi menjadi asam organik (asetat, butirat, dan laktat) (Kim & Gadd 2008).
Keadaan gelap dan anaerob, metabolisme glukosa akan menghasilkan asam organik, yaitu asetat atau aseton dan menghasilkan 4 mol hidrogen. Bila terdapat cahaya, asam organik tersebut menjadi substrat untuk menghasilkan hidrogen kembali. Asetat akan menghasilkan 8 mol hidrogen (Basak & Das 2007).
Bakteri fotosintetik ungu nonsulfur memiliki satu fotosistem (tipe pheophytin-quinon) pada sistem fotosintesisnya. Bakteri ini tidak memecah air untuk menghasilkan elektron dan oksigen pada proses fotosintesis. Hal ini dikarenakan bakteri tersebut anaerob fakultatif, sehingga beberapa bakteri fotosintetik menggunakan senyawa anorganik (H2S) atau asam organik seperti laktat, butirat,
dan asetat sebagai donor elektron dan hidrogen untuk fotosintesis. Reaksi
penggunaan salah satu senyawa organik sebagai donor elektron dan hidrogen adalah sebagai berikut:
2 laktat + CO2cahaya (CH2O) + H2O +
2 piruvat (Lehninger 2004).
Total Gas dan Analisis Gas Hasil Fermentasi
Hasil fotofermentasi oleh R. marinum
dengan substrat glukosa 1 % adalah gas H2
dan CO2 (Redwood & Macaskie 2006). Total
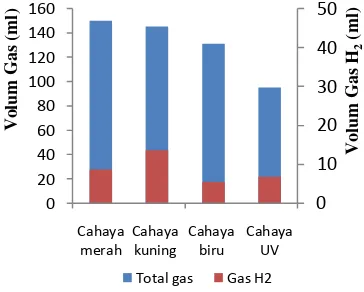
gas tertinggi pada hasil fermentasi terjadi pada perlakuan cahaya merah, yaitu sebanyak 150 ml, sedangkan total gas terendah didapatkan pada perlakuan cahaya UV (95 ml). Pada perlakuan cahaya kuning dan biru, total gas yang diproduksi masing-masing adalah 145 ml dan 131 ml (Gambar 3).
Penentuan gas H2 dari total gas yang
dihasilkan menggunakan alat kromatografi gas. Kadar gas H2 pada kromatografi gas ini
dideteksi oleh detektor konduktivitas termal atau Thermal Conductivity Detector (TCD). Hasil analisis kromatografi gas didapatkan gas H2 tertinggi pada perlakuan cahaya
kuning (13.565 ml) dari total gas 145 ml (9.36 % dari total gas yang dihasilkan), sedangkan gas H2 terendah didapatkan dari perlakuan
cahaya biru, yaitu sebesar 5.495 ml (4.20 % dari total gas yang dihasilkan). Gas H2 yang
dihasilkan pada perlakuan cahaya UV dan merah masing-masing adalah 6.905 ml (7.27 %) dan 8.725 ml (5.82 %).
[image:18.595.326.508.587.733.2]Berdasarkan hasil tersebut, dapat diterangkan bahwa spektrum cahaya yang berbeda-beda dari cahaya merah, kuning, biru, dan UV memberikan hasil gas hidrogen yang berbeda-beda pula. Cahaya kuning yang memberikan hasil tertinggi di antara keempat perlakuan pencahayaan, menjadi cahaya efektif dalam produksi hidrogen.
Gambar 3 Jumlah gas hasil fermentasi.
0 10 20 30 40 50 0 20 40 60 80 100 120 140 160 Cahaya merah Cahaya kuning Cahaya biru Cahaya UV V o lu m G as H 2 (m l) V o lu m G as ( m l)
Hasil penelitian Habibi (2009) melaporkan bahwa total gas yang dihasilkan pada fotofermentasi diskontinyu oleh R. marinum
dengan menggunakan cahaya putih adalah 205.25 ml. Kadar gas H2 dari total gas
tersebut sebesar 62 % (127.311 ml). Jumlah tersebut lebih besar dibandingkan dengan total gas yang dihasilkan pada perlakuan cahaya merah, dan juga lebih tinggi dari gas H2 yang paling banyak dihasilkan pada
pencahayaan kuning.
Menurut Happ et al. (2005), cahaya merupakan sinyal kritis dari lingkungan yang mempengaruhi regulasi pembentukan aparatus fotosintetik. Aparatus fotosintetik berperan dalam mengkonversi cahaya menjadi ATP dan pembawa energi tereduksi (Fdred).
ATP dan Fdred merupakan senyawa penting
bagi nitrogenase dalam menghasilkan hidrogen (Tamagnini et al. 2002).
Masing-masing organisme fotosintetik memiliki pigmen fotosintetik spesifik dalam rasio yang berbeda-beda dan menyerap cahaya pada panjang gelombang spesifik sesuai pigmen yang dimiliki. R. marinum
merupakan bakteri fotosintetik yang memiliki pigmen bakterioklorofil dan karotenoid. Bakteri fotosintetik menyerap panjang gelombang lebih pendek dari 600 nm dengan menggunakan pigmen karotenoid dan bakterioklorofilnya dapat menyerap panjang gelombang di atas 700 nm (Kim & Gadd 2008).
Cahaya UV memiliki energi lebih tinggi dibandingkan dengan cahaya merah, kuning, dan biru, namun tidak memberikan hasil gas hidrogen paling banyak. Sedangkan cahaya tampak berwarna kuning memberikan hasil gas hidrogen tertinggi. Hal tersebut mungkin dikarenakan kemampuan pigmen bakteri dalam menyerap cahaya dan mengkonversinya menjadi energi kimia.
Panjang gelombang maksimum dari beberapa lampu yang digunakan yang kurang dari 600 nm adalah lampu kuning, biru, dan UV. Namun, pada penelitian ini tidak digunakan lampu dengan panjang gelombang di atas 700 nm. Dari hasil penelitian, gas hidrogen tertinggi didapatkan dari perlakuan cahaya kuning yang memiliki panjang gelombang maksimum kurang dari 600 nm (544 nm). Panjang gelombang tersebut menghasilkan serapan maksimum bagi bakteri dalam memproduksi hidrogen. Kemungkinan pada panjang gelombang tersebut, merupakan daerah serapan maksimum bagi pigmen karotenoid bakteri. Oleh karena itu, dapat dikatakan bahwa cahaya kuning menjadi
panjang gelombang maksimum bagi bakteri dalam memproduksi hidrogen.
Penggunaan cahaya kuning dalam fermentasi untuk menghasilkan hidrogen oleh
R. marinum bertujuan meningkatkan efisiensi produksi hidrogen, karena cahaya kuning yang merupakan cahaya monokromatik memberikan hasil produksi paling banyak di antara cahaya monokromatik merah dan biru. Spektrum cahaya kuning mendukung keberadaan pigmen yang terkandung dalam bakteri. Energi radiasi cahaya kuning juga tidak lebih tinggi dari energi UV, sehingga memungkinan tidak terjadi mutasi.
pH awal media sebelum fermentasi yaitu sekitar pH 8-7. Selama fermentasi berlangsung, pH media menjadi pH 5 untuk setiap pencahayaan. Hal ini sesuai dengan penelitian Habibi (2009), pH media selama fermentasi oleh R. marinum dengan penyinaran cahaya putih berada pada pH 5. Proses fermentasi membuat pH media menurun dari pH 8 atau 7 menjadi pH 5. Hal ini dikarenakan metabolisme bakteri selama fermentasi Perlakuan cahaya tidak membuat perbedaan terhadap pH masing-masing media fermentasi.
Pertumbuhan R. marinum dan Produksi Gas H2 pada Pencahayaan Berbeda
Pertumbuhan R. marinum saat fermentasi dengan perlakuan cahaya merah mengalami fase log sampai jam ke-48, tetapi produksi gas H2 terbanyak terjadi sampai jam ke-24, yaitu
mencapai 7.958 ml, kemudian produksi H2
menurun setelah jam ke-24 sampai jam ke-48, yaitu sebanyak 0.767 ml (Gambar 4A). Pertumbuhan R. marinum pada media fermentasi yang diberi perlakuan cahaya kuning menghasilkan fase log dari jam ke-0 sampai jam ke-48. Sedangkan produksi gas H2
terbanyak pada perlakuan ini terjadi hingga jam ke-24 (12.985 ml) kemudian setelah jam ke-24 hingga jam ke-48, produksi gas H2
menurun (0.580 ml) (Gambar 4B).
Pola pertumbuhan R. marinum pada perlakuan cahaya biru menghasilkan fase pertumbuhan sedikit unik. Terdapat 2 fase log selama fermentasi, fase log pertama terjadi sampai jam ke-24, dan fase log kedua terjadi dari jam ke-72 hingga jam ke-96. Gas H2
Fase log bakteri saat fermentasi cahaya UV terjadi ketika awal ditumbuhkan sampai jam ke-48. Produksi gas H2 terbanyak pada
perlakuan cahaya ini saat pertumbuhan bakteri mengalami fase log, yaitu terjadi sampai jam ke-24, yaitu 3.995 ml, kemudian setelah jam ke-24 sampai jam ke-48 produksi gas H2 menurun menjadi 2.910 ml (Gambar
4D). Pola produksi gas pada perlakuan ini sama seperti yang ditunjukkan oleh fermentasi pada perlakuan cahaya merah dan kuning .
A.
B.
C.
D.
Gambar 4 Pertumbuhan R. marinum dan produksi H2 pada pencahayaan
berbeda.
Hasil penelitian Habibi (2009) menunjukkan bahwa R. marinum
memproduksi gas H2 terbanyak saat
pertumbuhan bakteri berada di fase log. Semua perlakuan pencahayan, dapat dijelaskan bahwa produksi hidrogen terbanyak terjadi ketika pertumbuhan bakteri mencapai fase log. Hal tersebut mungkin dikarenakan pertumbuhan bakteri yang sedang meningkat pesat memicu pembentukan hidrogen dari pemecahan senyawa organik dan juga dari hasil fotosintesis.
Pembentukan gas H2 pada bakteri ini lebih
diutamakan oleh kerja enzim nitrogenase. Substrat (sumber karbon) yang terdapat pada media fermentasi sebagai donor elektron untuk menghasilkan hidrogen dan elektron. Secara paralel, aparatus membran fotosintetik menyerap cahaya dan mengkonversi cahaya tersebut menjadi ATP. Transfer elektron dari hasil fermentasi ke nitrogenase dilakukan oleh pembawa elektron. ATP menjadi substrat bagi nitrogenase untuk mereduksi proton yang dihasilkan dari fermentasi sehingga menghasilkan hidrogen (Koku et al. 2002).
SIMPULAN DAN SARAN
Simpulan
Bakteri R. marinum memiliki pola pertumbuhan yang hampir sama ketika mendapat perlakuan cahaya merah dan UV. Selama fermentasi berlangsung, terjadi penurunan kadar glukosa media yang mengindikasikan pemakaian gukosa oleh bakteri. Hasil fermentasi menunjukkan bahwa total gas tertinggi terjadi pada perlakuan cahaya merah (150 ml) dan terendah terjadi pada perlakuan cahaya UV (95 ml). Gas H2
tertinggi terjadi pada perlakuan cahaya kuning (13.565 ml) dari total gas 145 ml (9.36 % dari total gas yang dihasilkan) dan gas H2 terendah
didapatkan dari perlakuan cahaya biru (4.2 % dari total gas yang dihasilkan). Cahaya UV yang memiliki energi lebih tinggi dibandingkan cahaya tampak tidak menghasilkan hidrogen terbanyak. Cahaya kuning menjadi panjang gelombang maksimum bagi R. marinum dalam menghasilkan hidrogen terbanyak.
Saran
Optimasi cahaya untuk produksi biohidrogen menggunakan R. marinum masih perlu dilakukan. Penggunaan sumber cahaya buatan seperti lampu fluoresens, lampu halogen, serat optik, dioda pengemisi cahaya, 0 2 4 6 8 10 0 0.3 0.6 0.9 1.2 1.5 1.8 2.1
0 24 48 72 96 120 144 168 192 216
G a s H2 (m l) A b so r b a n Jam
ke-Perlakuan Cahaya Merah
Pertumbuhan bakteri Gas H2 (ml)
0 3 6 9 12 15 18 0 0.3 0.6 0.9 1.2 1.5 1.8 2.1 2.4
0 24 48 72 96 120 144 168 192 216
G as H 2 (m l) A b so rba n Jam
ke-Perlakuan Cahaya Kuning
Pertumbuhan bakteri Gas H2 (ml)
0 1 2 3 4 5 6 0 0.3 0.6 0.9 1.2 1.5 1.8 2.1
0 24 48 72 96 120 144 168 192 216
G as H 2 (m l) A b so rba n Jam ke-Perlakuan Cahaya Biru
Pertumbuhan bakteri Gas H2 (ml)
0 1 2 3 4 5 6 7 8 0 0.3 0.6 0.9 1.2 1.5 1.8 2.1
0 24 48 72 96 120 144 168 192 216
G as H 2 (m l) A b so rba n Jam ke-Perlakuan Cahaya UV
[image:20.595.80.298.201.759.2]sinar radiasi aktif, atau sinar matahari perlu diteliti untuk memaksimalkan produksi hidrogen.
DAFTAR PUSTAKA
Akkerman et al.. 2002. Photobiological hidrogen production photochemical efficiency and bioreactor design. Int. J. Hydrogen Energy 27:1195-1208.
Alatas Z. 2004. Efek radiasi pengion dan nonpengion pada manusia. Buletin ALARA
5:99-112.
Boyles D. 1984. Bioenergy Technology
Thermodinamics and Cost. New York:
Willey.
Habibi MS. 2009. Fermentasi bakteri fotosintetik Rhodobium marinum dan isolat Sanur (koleksi BTCC) dengan substrat glukosa 1 % dalam menghasilkan biohidrogen [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Happ HN, Braatsch S, Broschek V, Osterloh L, Klug G. 2005. Light dependent regulation of photosynthesis genes in
Rhodobacter sphaeroides 2.4.1 is
coordinately controlled by photosynthetic electron transport via the the PrrBA two component system and the photoreceptor AppA. Molecular Biology 58: 903-914. Hiraishi AK, Urata, Satoh T. 1995. A new
genus of marine budding phototropic bacteria, Rhodobium gen Nov, which includes Rhodobium orientis sp. Nov, and
Rhodobium marinum cob. Nov. Int. J. Systematic Bacteriology 45:226-234. Hogg S. 2005. Essential Microbiology.
London: John Wiley & Sons Ltd.
Hu et al.. 2006. Nitrogenase Fe protein : a molibdate or homocitrate insertase. PNAS USA 103:17125-17130.
Jones AZ. 2010. The visible light spectrum [terhubung berkala]. http://www.voila. web.idhobifotografiwarna-dalam fotografi. aspx.htm. [18 Oktober 2010].
Kawaguchi et al.. 2002. Effect of algal extract on H2 Production by a photosynthetic
bacterium Rhodobium marinum A-501 : analysis of stymulating effect using a kinetic model. Bioscience & Bioengineering 94:62-69.
Kim BH & Gadd GM. 2008. Bacterial Physiology and Metabolisme. New York: Cambridge University Pr.
Koku H, Inci E, Ufuk G, Meral Y, Lemi T. 2002. Aspect of the metabolism of hydrogen production by Rhodobacter sphaeroides. Int. J. Hydrogen Energy
27:1315-1329.
Kotay SM, Das D. 2008. Biohydrogen as a renewable energy resource – prospect and potentials. Int. J. Hydrogen Energy
33:258-263.
Lembeck J. 2010. Light is medicine [terhubung berkala]. http://ezinearticles. com.html [29 November 2010].
Liebert MA. 2009. Blue light destroy antibiotic-resistant sthap infection [terhubung berkala]. http://esciencenews. com.html [29 November 2010].
Lindberg P. 2003. Cyanobacterial hydrogen metabolisme – uptake hydrogenase and hydrogenase production by nitrogenase in filamentous cyanobacteria [Tesis]. Uppsala: Faculty of Science and Technology, Acta Universitatis Upsaliensis.
Mahyudin AR, Koesnandar. 2006. Biohydrogen production: prospects and limitations to practical application. Akta Kimindo 1:73-77.
Mcnair HM, Miller JM. 1998. Basic Gas Chromatography. New York: John Wiley & Sons Inc.
Meyer J, Kelley BC, Vignais PM. 1978. Effect of light on nitrogenase function and synthesis in Rhodopseudomonas capsulata. J Bacteriol 136:201-208. Mohsin Y. 2004. Hidrogen. [terhubung
berkala]. http:// Chem-Is-Try.Org.html [2 September 2009].
Nelson DL, Cox MM. 2004. Lehninger Principles of Biochemistry fourth edition. New York: WH Freeman.
Redwood MD, Macaskie LE. 2006. A two-stage, two organism process for biohydrogen from glukose. Int. J. Hydrogen Energy 31: 1514-1521.
Ren YL, Xin HX, Chong Z, Zhong XG. 2005. A simplified method for assay of hydrogenase activities of H2 evolution and
uptake in Enterobacter aerogenes.
Sirait LR. 2007. Produksi gas hidrogen dari limbah cair tahu dengan bakteri fotosintetik Rhodobium marinum [tesis]. Depok: Sekolah Pascasarjana, Universitas Indonesia.
Stripp et al. 2009. How oxygen attacks [FeFe] hydrogenases from photosynthetic organisms [terhubung berkala]. http:// www.pnas.org/cgi/doi/10.1073/pnas.html [4 Januari 2010].
Sumarsih. 2007. Pertumbuhan mikrob. [terhubung berkala]. http://www. wordpress.com.html [2 September 2009]. Suwandi U. 2009. Fermentasi antibiotik.
[terhubung berkala]. http://www.kalbe. co.id.html [2 September 2009].
Tamagnini et al.. 2002. Hydrogenases and hydrogen metabolism of cyanobacteria.
Microbiology and Molecular Biology Reviews 66:1-20.
Winarno FG, Fardiaz S. 1980. Pengantar Teknologi Pangan. Jakarta: Gramedia. Zaborsky et al.. 1998. The Science of
Biohydrogen. New York: Plenum Pr.
Lampiran 1 Tahapan penelitian produksi gas hidrogen oleh bakteri fotosintetik R.
marinum pada pencahayaan berbeda
Media Kultur R.
marinum
Kultivasi R. marinum &
pengukuran OD
Pemanenan R. marinum
Fotofermentasi
Glukosa 1 %
Media Fermentasi
Produksi Hidrogen
Pengambilan contoh (sampel medium
dan gas)
Pengukuran OD, pH medium, dan
kadar glukosa medium
Pengukuran gas hidrogen dengan
H
2scan dan kromatografi gas
H
2Lampiran 2 Pertumbuhan R. marinum pada pencahayaan berbeda
Jenis cahaya/
jam ke-
Cahaya merah Cahaya kuning Cahaya biru
Cahaya UV
Lampiran 3 Kadar glukosa media pada pencahayaan berbeda
A.
Kadar glukosa media pada perlakuan cahaya merah
Jam ke-
Kadar glukosa (ppm)
ulangan 1
ulangan 2