PENGELOLAAN PENYAKIT AKAR GADA
(Plasmodiophora
brassicae
Wor.)
PADA TANAMAN KUBIS DENGAN TANAMAN
PERANGKAP DAN PERLAKUAN TANAH PEMBIBITAN
OLEH:
C I C U
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
SURAT PERNYATAAN
Dengan ini menyatakan bahwa tesis yang berjudul :
PENGELOLAAN PENYAKIT AKAR GADA (Plasmodiophora brassicae WOR.) PADA TANAMAN KUBS DENGAN TANAMAN PERANGKAP DAN PERLAKUAN TANAH PEMBIBITAN
Adalah benar merupakan hasil karya saya sendiri belum pernah dipublikasikan. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Nopember 2002
PENGELOLAAN PENYAKIT AKAR GADA
(Plasmodiophora
brassicae
Wor.) PADA TANAMAN KUBIS DENGAN TANAMAN
PERANGKAP DAN PERLAKUAN TANAH PEMBIBITAN
C I C U
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Entomologi dan Fitopatologi
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Pengelolaan Penyakit Akar Gada (Plasmodiophora brassicae Wor.) pada Tanaman Kubis dengan Tanaman Perangkap dan Perlakuan Tanah Pembibitan
Nama mahasiswa : Cicu Nomor pokok : 99524
Program studi : Entomologi dan Fitopatologi
Menyetujui: 1. Komisi pembimbing,
Prof.Dr.Ir. ~ i e n t i e S. Mandang Ketua
ki
Dr. Ir. Widodo Anggota
Mengetahui,
2. Ketua Program Studi
Dr. Ir. Meitv S. ~ i i a g a , MSc. Manuwoto,MSc
RIWAYAT HIDUP
Penulis dilahirkan di Kampiri (Sulawesi Selatan) pada tanggal 18 Desember 1962 sebagai anak pertama dari dua bersaudara dari ibu Pancai dan ayah Andi Badaruddin.
Penulis menyelesaikan pendidikan SD tahun 1974 di SD Negeri Kampiri, SMP Negeri Kampiri tahun 1977 dan SMA Negeri 226 Siengkang tahun 198 1.
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan hidayahNya penulis dapat menyelesaikan tesis ini dan sekaligus menyelesaikan Studi S2 di Program Pascasa rjana IPB.
Pada kesempatan ini penulis menyampaikan penghargaan dan terima kasih kepada Ibu Prof. Dr. Ir. Sientje S. Mandang, selaku ketua komisi pembimbing dan Bapak Dr. Ir. Widodo, selaku anggota komisi pembimbing, yang telah banyak memberikan bimbingan, saran dan arahan kepada penulis.
Ucapan terima kasih juga penulis sampaikan kepada:
1. Kepala Badan Penelitian dan Pengembangan Pertanian, Kepala Pusat Penelitian Sosial Ekonomi Pertanian, Kepala Balai Pengkajian Teknologi Pertanian Kendari serta Pemimpin Proyek Pembinaan Kelembagaan Penelitian dan Pengembangan Pertanian (ARMP 11) Departemen Pertanian, atas izin, kesempatan dan dukungan dana yang diberikan kepada penulis untuk mengikuti pendidikan program pascasa rjana (S2) di IPB, sehingga proses penyelesaian s tudi penulis be rjalan dengan lancar.
2. Direktur Program Pascasarjana IPB yang telah mengizinkan penulis untuk mengikuti pendidikan pada Program Pascasarjana IPB.
3. Ketua Program Studi Entomologi dan Fitopatologi dan seluruh staf pengajar yang telah meniberikan ilmunya kepada penulis selama mengikuti program S2 di IPB.
4. Kepala Kebun Instalasi Penelitian Tanaman Hias Cipanas dan stafnya yang telah membantu penulis selama penelitian berlangsung.
Akhimya terima kasih yang tulus penulis ucapkan kepada AyahlBunda tercinta atas segala doa dan restunya serta seluruh keluarga yang mendukung studi penulis di S2 IPB. Semoga Allah SWT selalu melimpahkan rahmatNya kepada kita semua
. .
.. . .
..Amin.Bogor, 2002
DAFTAR IS1
Halaman DAFTAR TABEL
...
vi DAFTAR GAMBAR...
vii...
DAFTAR LAMPIRAN...
vlll PENDAHULUAN...
Latar Belakang
...
...
Tuj uan
...
Hipotesis
TINJAUAN PUSTAKA
...
Penyakit Akar Gada
...
...Gejala
Patogen
...
Penyebaran Penyakit dan Virulensi Patogen
...
Pengaruh Faktor Lingkungan...
...
Pengendalian
Peranan Tanaman Perangkap
...
...Peranan Bahan Organik
...
Peranan Solarisasi
BAHAN DAN METODE
...
17 Tempat dan Waktu ... 17...
Metode 17
DAFTAR TABEL
Halaman 1. Pengaruh frekuensi tanam tanaman perangkap terhadap kejadian
penyakit, indeks penyakit akar gada (P. brassicae) dan produksi
kubis
...
25 2. Pengaruh perlakuan tanah pembibitan terhadap kejadian penyakit,indeks penyakit (P. brassicae) dan produksi kubis
...
25 3. Pengaruh perlakuan tanah pembibitan terhadap total populasimikrob rizosfer bibit kubis
...
26 4. Total populasi cendawan rizosfer bibit kubis pada berbagaiDAFTAR GAMBAR
Halaman
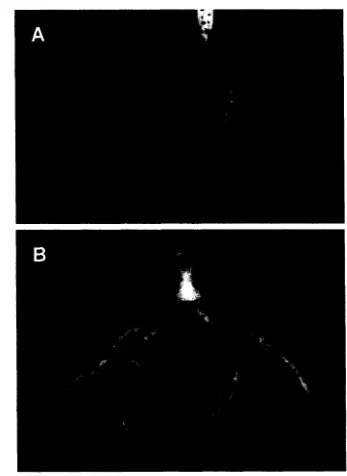
1. Akar tanaman caisin yang sehat atau tanpa gejala penyakit akar gada
P. brassicae (A) dan yang sakit karena infeksi P. brassicae (B),
umur 53 hari setelah semai
...
6 2. Rata-rata temperatur tanah pada kedalaman 15 cm selama solarisasiberlangsung (23 Oktober- 3 Desember 2001) pada berbagai
perlakuan tanah pembibitan
...
23 3. Populasi bakteri total (A), bakteri tahan panas (B), aktinokisetes (C),dan cendawan (D) rizosfer bibit kubis pada berbagai perlakuan
tanah pembibitan ... 27 4a. Keadaan tanaman kubis dilapangan pada kontrol (tanpa tanaman
perangkap) dengan kombinasi berbagai perlakuan tanah pembibitan,
pada umur 7 dan 10 minggu setelah tanam
...
3 3 4b. Keadaan tanaman kubis di lapangan pada perlakuan satu kalitanam tanaman perangkap dengan kombinasi berbagai perlakuan
tanah pernbibitan, pada umur 7 dan 10 minggu setelah tanam
...
34 4c. Keadaan tanaman kubis di lapangan pada perlakuan dua kalitanam tanaman perangkap dengan kombinasi berbagai perlakuan
tanah pembibitan, pada umur 7 dan 10 minggu setelah tanam
...
3 5 4d. Keadaan tanaman kubis di lapangan pada perlakuan tiga kalitanam tanaman perangkap dengan kobinasi berbagai perlakuan
DAFTAR
LAMPIRAN
Halaman 1. Daftar komposisi media yang digunakan untuk isolasi mikrob
rizosfer bibit kubis ... 53 2. Rata-rata temperatur tanah pada kedalaman 15 cm pada berbagai
perlakuan tanah pembibitan
...
54 3. Analisis sidik ragam pengaruh tanaman perangkap dan perlakuanPENDAHULUAN
Latar Belakang
Akar gada (akar bengkak) yang disebabkan oleh Plasrnodiophora brassicae Wor. merupakan salah satu penyakit tular tanah yang penting pada tanaman kubis-kubisan (Brassica spp.) di seluruh dunia (Colhoun 1958; Karling 1968; Ayers 1972; Yoshikawa dan Buczacki 1978; Rowe 1980). Di Australia, P. brassicae dapat menyebabkan kehilangan hasil tidak kurang dari 10 % setiap tahun pada tanaman kubis-kubisan yang mengakibatkan kehilangan pendapatan sebesar A$ 13 juta (Faggian et al. 1999). Di Indonesia, penyakit ini dapat menyebabkan kehilangan hasil 35 - 100 % (Suryaningsih 1981) dan menurut Subijanto (1988) kerugian akibat penyakit tersebut diperkirakan senilai Rp 2,8 milyar setiap musim tanam.
2
Berbagai upaya pengendalian penyakit akar gada telah dilakukan baik di luar maupun di dalam negeri, tetapi belum menunjukkan hasil yang memuaskan secara teknis maupun ekonomis. Pengapuran tanah dengan dosis 20 t/ha (CaO) belum mampu menekan serangan P. brassicae dan perendaman tanah selama 45, 75, dan 90 hari sebelum tanam dapat meningkatkan bobot daun kubis, tetapi pada kondisi lapang tidak dapat mengendalikan serangan P. brassicae (Djatnika 1989). Penggunaan mulsa jagung tidak memberikan pengaruh yang nyata terhadap intensitas penyakit dan berat brankas tanaman (Herdian 2000). Penggunaan mikrob antagonis (Pseudornonas spp.) dapat menekan serangan P. brassicae tetapi tidak menunjukkan pengaruh yang nyata terhadap bobot basah tanaman (Widodo et al. 1993). Penggunaan varietas resisten kemungkinan tidak akan berguna dalam jangka waktu yang lama karena perkembangan virulensi ras patogen (Ayers 1972; Buczacki et al. 1975). Rotasi dengan tanaman selain famili Brassicaceae membutuhkan waktu yang lama karena spora rehat patogen dapat bertahan di dalam tanah dalam jangka waktu yang lama (Channon dan Maude 197 1). Walaupun beberapa fungisida tersedia untuk pengendalian penyakit akar
gada, tetapi tidak efektif bila kepadatan spora rehat dan virulensi P. brassicae
tinggi (Akanuma et al. 1983; Tanaka et al. 1997).
3
aktinomisetes yang diduga secara langsung dapat menekan P. brassicae. Namun
demikian pengendalian dengan cara ini masih perlu dikaji untuk penerapan di lapangan karena memerlukan biaya yang cukup tinggi sehingga kemungkinan penggunaannya tidak efisien. Berkaitan dengan ha1 tersebut dan mengingat bibit tanaman Brassica sp. sangat rentan terhadap serangan P. brassicae, perlakuan solarisasi perlu pula dikaji pada lahan pembibitan. Di samping itu perlu diupayakan pendekatan lain yang dapat dipadukan dengan cara yang sudah digunakan dalam pengelolaan penyakit tanaman.
Tanaman perangkap merupakan salah satu komponen dari pengelolaan penyakit tanaman yang diharapkan dapat mengurangi populasi awal P. brassicae di dalam tanah sebelum tanaman utama ditanam. Penggunaan tanaman perangkap dalam pengelolaan penyakit tanaman masih sangat sedikit, khususnya dalam pengelolaan penyakit akar gada di Indonesia belum pernah dilaporkan.
Perlakuan tanah pembibitan dengan pemberian pupuk kandang ditujukan untuk meningkatkan aktivitas mikrob tanah yang dapat mengkolonisasi akar dan bersifat antagonis terhadap patogen. Penggunaan pupuk kandang yang ditujukan untuk memperbaiki sifat fisik tanah sudah lama diterapkan oleh petani. Namun demikian untuk tujuan pengelolaan penyakit akar gada belum pernah dilakukan.
Tujuan Penelitian
4
Hipotesis
1. Frekuensi tanam tanaman perangkap dengan tiga kali tanam akan memberikan pengaruh yang lebih baik dalam menekan P. brassicae dibanding dengan dua kali tanam atau satu kali tanam.
2. Perlakuan tanah pembibitan dengan solarisasi dan pupuk kandang akan memberikan pengaruh yang lebih baik dalam menekan P. brassicae di pembibitan dan di lapangan dari pada perlakuan tanah pembibitan hanya dengan solarisasi atau pupuk kandang saja.
TINJAUAN PUSTAKA
Penyakit Akar Gada Gejala
Gejala yang nampak di atas perrnukaan tanah adalah daun-daun tanaman yang terinfeksi P. brassicae layu pada hari panas dan kering
,
pulih kembali selama malam hari, dan kelihatan normal dan segar pada pagi hari. Selanjutnya jika penyakit berkembang terus, daun-daun menjadi kuning, tanaman kerdil dan mungkin mati atau hidup dalam keadaan merana selama musim tanam (Karling 1968). Menurut Agrios (1997) bibit cruciferae yang terinfeksi ketika masih muda dapat mati dalam beberapa minggu, bahkan mungkin mati segera setelah infeksi patogen ini. Infeksi pada tanaman yang lebih tua kemungkinan masih aktif tetapi tanaman menjadi kerdil dan gaga1 membentuk krop sehingga produksi menurun atau tidak berproduksi sama sekali.7 (Graveland et al. 1992). Apabila infeksi terjadi pada akhir musim tanam, ukuran gada biasanya kecil dan tanaman dapat bertahan hidup (Karling 1968).
Patogen
Penyakit akar gada disebabkan oleh Plasmodiophora brassicae Woronin. Alexopoulos et al. (1996) menggolongkan patogen ini ke dalam:
Kingdom : Protista
Phylum : Plasmodiophoromycota Kelas : Plasmodiophoromycetes Ordo : Plasmodiophorales Famili : Plasmodiophoraceae. Genus : Plasmodiophora
Spesies : Plasmodiophora brassicae Wor.
Menurut Agrios (1997), P. brassicae dianggap sebagai "Pseudofungi"
atau organisme yang menyerupai fungi dan diklasifikasikan sebagai berikut: Kingdom : Protozoa
Phylum : P1asmodiophoromycota Kelas : Plasmodiophoromycetes Ordo : Plasmodiophorales Famili : Plasmodiophoraceae Genus : Plasmodiophora
Spesies : Plasmodiophora brassicae Wor.
8 Siklus penyakit dimulai dengan perkecambahan satu zoospora primer dari satu spora rehat haploid di dalam tanah. Zoospora primer ini mempenetrasi rambut akar dan menginjeksi isi sel masuk ke dalam sel inang (Aist dan Williams 1971 dalam Voorrips 1995). Setelah penetrasi rambut akar atau sel epidermis inang oleh zoospora primer, protoplas yang berinti satu terbawa masuk ke dalam sel inang. Pembelahan mitotik terjadi dan protoplas membentuk plasmodium primer. Setelah plasmodium primer mencapai ukusan tertentu, tergantung pada ukuran sel epidermis inang, membelah menjadi beberapa bagian yang berkembang menjadi zoosporangia (Alexopoulos et al. 1996). Setiap zoosporangium mengandung 4 atau 8 zoospora sekunder yang dapat terlepas melalui lubang atau pori-pori pada dinding sel inang (Agrios 1997), apakah langsung masuk ke dalam sel inang yang lain atau keluar akar (Alexopoulos et al.
9 karena distimulasi dengan pembelahan sel inang yang diduga distimulir oleh konsentrasi sitokinin dan auksin yang tinggi. Perkembangan selanjutnya, inti yang haploid dalam plasmodia yang berinti banyak bergabung berpasangan (Tommerup dan Ingram 197 1 dalam Voorrips 1995). Setelah miosis terbentuk inti diploid yang baru yang kemudian berkembang menjadi spora rehat haploid yang terlepas masuk ke dalam tanah ketika akar yang sakit rusak (Voorrips 1995).
Penyebaran Penyakit dan Virulensi Patogen
Penyakit akar gada (clubroot) yang disebabkan oleh P. brassicae
menyebar hampir di seluruh pertanaman cruciferae yang ada di dunia (Karling 1968). Di Indonesia penyakit ini telah tersebar di Sumatera Utara, Jawa Tengah, dan terutama di Jawa Barat (Djatnika 1984).
Akar-akar yang busuk dari tanaman sakit sebelumnya mengandung sejumlah besar spora rehat P. brassicae yang merupakan sumber inokulum satu- satunya untuk penyakit akar gada (Orihara dan Yamamoto 1998). Apabila akar- akar yang sakit hancur di lahan
,
maka spora-spora terlepas masuk ke dalam tanah dan bertahan hidup dalam waktu yang lama (Karling 1968; Voorrips 1995). Kemampuan bergerak bentuk amuba dan zoospora patogen merupakan faktor penting dalam penyebaran penyakit, walaupun jarang berpindah lebih dari 5 inci secara horizontal selama satu musim (Chupp dalam Karling 1968). Spora- spora yang berkecambah dan menginfeksi akar-akar muda dari cruciferae kemudian tersebar melalui akar-akar yang sakit pada saat pemindahan tanaman tersebut ke lapangan (Walker 1975).10 melalui perlengkapan usahatani, sepatu pekerja, kuda dan kaki-kaki ternak merupakan penyebaran penyakit yang efektif (Karling 1968); melalui butiran tanah yang terbawa hasil panen (Walker 1975); melalui air permukaan (Stakman dan Harrar 1957); penyebaran penyakit melalui angin juga efektif walaupun tidak universal (Chupp dalam Karling 1968); melalui pupuk kotoran hewan (Karling 1968; Suryaningsih 198 1). Patogen juga dapat ditularkan oleh biji melalui kontaminasi permukaan dengan tanah yang terinfeksi. Selain itu sejumlah tanaman cruciferae liar dan beberapa tanaman inang lain yang rentan terhadap penyakit akar gada dapat menjadi tempat bertahan hidup patogen pada saat tanaman budidaya tidak ada (Karling 1968).
Menurut Karling (1968) dari 61 genera cruciferae, lebih dari 300 spesies dan varietas rentan terhadap P. brassicae dan 9 spesies dari genera bukan cruciferae ditemukan mengandung zoosporangia P. brassicae pada rambut- rambut akarnya. Reyes et al. (1974) melaporkan 9 jenis gulma dari cruciferae rentan terhadap P. brassicae ras 6. Di beberapa lahan pertanaman kubis-kubisan di Jawa Barat ditemukan 4 ras P. brassicae (Djatnika 1989).
Pengaruh Faktor Lingkungan
11 Kisaran temperatur optimum bagi perkembangan P. brassicae adalah 17,8
- 25 OC dengan temperatur minimum dan maksimum 12,2 OC dan 27,2 OC (Agrios 1997; Walker 1957; Channan dan Maude 1971). Menurut Chupp dalam Stakman dan Harrar (1 957), spora-spora P. brassicae berkecambah pada temperatur kamar dalam media agar yang mengandung bibit kubis yang muda, tetapi spora-spora tersebut tidak berkecambah atau berkecambah sangat buruk pada kondisi yang sama tanpa bibit kubis.
Kelembaban optimum selama 18 - 24 jam memungkinkan perkecambahan dan penetrasi patogen ke dalam jaringan inang (Wellman dalam Stakman dan Harrar 1957), kemudian infeksi hanya terjadi jika kelembaban tanah di atas 45 % (Monteith dalam Stakman dan Harrar 1957) dan kelembaban tanah 50 % atau lebih menyebabkan perkembangan penyakit bertambah cepat, sedangkan kelembaban tanah 45 % dapat menghambat infeksi (Mattusch 1977).
Tanaman inang yang berada pada lingkungan yang intensitas cahayanya rendah lebih tahan terhadap serangan P. brassicae dibanding dengan tanaman inang yang berada pada lingkungan yang intensitas cbhayanya tinggi (Garret 1970 dalaln Djatnika 1989).
dan nematoda. Mikrob tersebut dapat bersifat antagonistik, sinergistik atau tidak mempengaruhi aktivitas patogen.
Pengendalian
Beberapa upaya pengendalian yang telah dilakukan, baik di Indonesia maupun di luar negeri, antara lain pengapuran tanah (Karling 1968; Dobson et al.
1983; Djatnika 1989; Herdian 2000); rotasi tanaman (Karling 1968); perendaman lahan (Djatnika 1989); penggunaan fungisida (Lambe dan McCart 1975; Rowe dan Farley 1979; Djatnika 1989); penggunaan mulsa jagung (Djatnika 1989; Herdian 2000); penggunaan ekstrak bawang putih (Djatnika 1989); pemanfaatan mikrob antagonis (Murtafingah 1987; Djatnika 1989; Djatnika 1990; Widodo et al. 1993); varietas resisten (Rowe 1980; Yamagishi 1987); dan solarisasi tanah (Horiuchi et al. 1982; Widodo dan Suheri 1995).
Pengaturan kemasaman tanah dengan kapur hingga mencapai pH di atas netral (pH 7,2) pada beberapa kasus memberikan pengendalian yang baik tetapi pada kasus yang lain tidak efektif (Karling 1968). Menurut Colhoun (1953) tingkat inokulum P. brassicae yang sangat tinggi mendukung te rjadinya infeksi di dalam tanah dengan pH 8. Myers et al. (1981) dan Horiuchi dan Hori (1980) melaporkan bahwa pengapuran pada tipe tanah yang berbeda memberikan tingkat pengendalian penyakit yang berbeda. Pengapuran tanah dipengaruhi oleh distribusi atau redistribusi kapur di dalam tanah (Dobson et al. 1983), juga ada kemungkinan ras-ras P. brassicae yang berbeda bereaksi secara berbeda terhadap pH tanah (Stakman dan Harrar 1957).
13 kehilangan sifat resistensinya atau varietas tersebut dipatahkan resistensinya oleh perkembangan ras-ras fisiologi patogen (Reyes et al. 1974; Seaman et al. 1963; Yoshikawa dan Buczacki 1978). Rotasi tanaman dengan tanaman selain famili Brassicaceae memerlukan waktu yang lama karena spora rehat patogen dapat bertahan di dalam tanah lebih dari 7 tahun (Karling 1968; Channon dan Maude
1971).
Perbaikan drainase tanah dapat mengurangi kehilangan hasil tetapi tidak memberikan pengendalian yang dapat diandalkan, khususnya selama periode curah hujan yang berlebihan (Colhoun 1958; Rowe dan Farley 1979). Pengendalian dengan cara perendaman lahan hanya dapat dilakukan pada lahan sawah (Djatnika 1989).
Penggunaan pestisida seperti Benlate tidak memberikan pengendalian yang cukup memuaskan apabila diaplikasikan hanya satu kali dan Vorlex tidak praktis digunakan untuk pengendalian di lapangan (Reyes et al. 1974). Menurut Horiuchi et al. (1982) penggunaan pestisida sulit diterapkan pada lahan yang ditanami dengan famili Brassicaceae stcara terus-menerus. Walaupun Flusulfamida dapat menghambat perkecambahan spora rehat P. brassicae, tetapi tidak efektif mengendalikan P. brassicae yang sudah ada dalam sel korteks (Tanaka et al. 1999).
Penggunaan mikrob antagonis dapat menekan serangan P. brassibcae
14 penerapan di lapangan biayanya cukup mahal sehingga kemungkinan penggunaannya tidak efisien (Widodo dan Suheri 1995).
Peran Tanaman Perangkap
Tanaman perangkap telah banyak digunakan dalam pengelolaan serangga hama tanaman. Tanaman perangkap juga digunakan dalam pengelolaan penyakit tanaman walaupun masih sangat sedikit dan dalam cara yang berbeda (Agrios
1997).
Tanaman perangkap yang bukan inang sesungguhnya ditanam dengan tujuan membuat patogen-patogen tular tanah menjadi lemah potensi infeksinya (Palti 198 1). Ciri khas dari tanaman perangkap adalah mampu menstimulir perkecambahan biji tanaman parasit, dapat menyebabkan perkecambahan propagul cendawan yang dorman, atau dapat menstimulir penetasan telur-telur nematoda dalam bentuk kiste (Parbery dan Morgan 1980). Pengendalian nematoda puru akar pada perkebunan nenas berhasil dilakukan dengan menanam tanaman tomat sebagai tanaman perangkap dan kemudian tanaman tersebut dimusnahkan sebelum nematoda ini dapat memproduksi telur (Stevens 1960
dalarn Palti 1981).
15 Peran Bahan Organik
Bahan organik tanah dapat mempengaruhi sifat-sifat tanah seperti laju infiltrasi, kepadatan, stabilitas agregat, kapasitas tukar kation dan aktivitas biologi, dimana sifat-sifat ini berhubungan dengan fungsi-fungsi tanah yang penting (Sikora dan Stott 1996 dalam Gaskell et al. 2000). Bahan organik menstimulir pertumbuhan akar tanaman, meningkatkan ketersediaan hara, mengurangi evaporasi tanah, meningkatkan kapasitas menahan air, mengurangi aliran permukaan, memperbaiki drainase, mengatur temperatur tanah, dan menyediakan substrat yang berlimpah bagi mikrob tanah (Chen et al. 1987; Chen et al. 1988).
Penambahan berbagai jenis bahan organik (pupuk hijau, pupuk kandang, sisa-sisa tanaman atau sampah organik) yang dapat menyebabkan perubahan keseimbangan mikroflora tanah telah diakui sebagai suatu pendekatan biologi yang memberikan harapan dalam perbaikan pengelolaan penyakit tular tanah (William 1970). Hal yang sama dikemukakan oleh Gaskell et al. (2000) bahwa meningkatnya bahan organik di dalam tanah dapat menyebabkan populasi organisme tanah menjadi lebih banyak dan lebih beragam dan selanjutnya diduga dapat meningkatkan pengendalian hama dan penyakit secara biologi. Jenis substrat yang spesifik yang terdapat di dalam tanah secara nyata mempengaruhi jenis dan jumlah organisme yang akan menetap dan berkembang di dalam tanah
tersebut (William 1970).
Peran Solarisasi
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan dari bulan September 2001 hingga bulan Maret 2002 di Kebun Instalasi Penelitian Tanaman Hias Cipanas (ketinggian 1100 m dpl) dan di Laboratorium Mikologi, Jurusan Hama dan Penyakit Tumbuhan Fakultas Pertanian Institut Pertanian Bogor. Lahan yang digunakan sebagai lahan percobaan telah diketahui terinfestasi P. brassicae.
Metode Pelaksanaan
Penyiapan Bibit Tanaman Perangkap (Caisin)
18
Penyiapan Lahan dan Penanaman Tanaman Perangkap
Sambil menunggu bibit siap tanam, lahan dicangkul dengan kedalaman 20
- 30 cm kemudian digemburkan dan diratakan. Petak percobaan (berukuran 3,6 x
2,5 m) dipersiapkan sesuai dengan perlakuan yang akan diuji.
Bibit caisin ditanam pada petak percobaan dengan jarak tanam 20 x 20 cm. Tanaman tersebut dipelihara berdasarkan kebiasaan petani setempat. Panen dilakukan pada umur 28 hari setelah tanam dengan cara membongkar tanaman bersama akarnya. Setiap selesai panen petak percobaan digemburkan dan langsung ditanami kembali. Petak percobaan yang belum ditanami tanaman perangkap dan petak kontrol (tanpa tanaman perangkap) dibiarkan kosong tanpa tanaman atau gulma.
Perlakuan Pembibitan Tanaman Utama (Kubis)
19 bedeng dan dibasahi. Pengamatan temperatur tanah pada kedalaman 15 cm dilakukan setiap hari (selama perlakuan solarisasi berlangsung)
Setelah enam minggu, tanah pada setiap bedengan dari masing-masing perlakuan diayak dengan ayakan keranjang plastik dan dilanjutkan dengan pengisian bak pesemaian dan kantung-kantung plastik berukuran tinggi 12 cm dan diameter 8 cm.
Benih kubis varietas Grand 11 disemai pada bak pesemaian. Bibit kubis umur 7 hari setelah semai dipindahkan pada kantung-kantung plastik yang telah diisi dengan media hasil perlakuan tanah pembibitan dan selanjutnya dipelihara hingga berumur 30 hari setelah semai.
Penanaman Tanaman Utama (Kubis)
Setelah perlakuan tanaman perangkap selesai, tanah pada setiap petak percobaan digemburkan dan diratakan. Selanjutnya dibuat lubang tanam dengan jarak 60 x 50 cm (30 lubang tanam per petak). Pupuk kandang ayam sebanyak 0,5
melengkung keluar dan benvarna agak ungu. Pengamatan kejadian penyakit (KP),
indeks penyakit (IP), dan produksi kubis dilakukan pada saat panen. Kejadian penyakit dihitung dengan rumus:
n = jumlah tanaman yang menunjukkan pembengkakan N = jumlah tanaman yang diamati
Indeks penyakit dihitung dengan rumus:
ni = jumlah tanaman dengan skala serangan tertentu vi = skala serangan
N
= jumlah tanaman yang diamatiSkala serangan dihitung berdasarkan skala 0 -3, dimana 0 = tidak ada gejala pembengkakan; 1 = pembengkakan tejadi pada akar utama; 2 = pembengkakan te rjadi pada akar sekunder; dan 3 = pembengkakan terjadi pada akar utama maupun akar sekunder (Datnoff et al. 1987).
Produksi diukur berdasarkan bobot basah tanaman tanpa akar dengan menimbang seluruh tanaman dalam plot.
Isolasi Mikrob dari Rizosfer
2 1 tersebut disuspensikan ke dalam 45 ml air steril (pengenceran 10 -')lalu dikocok selama 30 menit dengan menggunakan shaker. Selanjutnya dengan menggunakan pipet volumetrik, sebanyak 1 ml suspensi dicampur dengan 9 ml air steril dalam tabung reaksi (10 -2). Hal yang sama dilakukan untuk pengenceran berikutnya. Pengenceran ini dilakukan sesuai dengan keperluan. Pengengenceran terakhir: untuk cendawan, untuk aktinomisetes, dan low8 untuk bakteri. Dari setiap pengenceran terakhir diambil 0,l ml untuk disebarkan secara merata pada cawan petri yang berisi 10 ml masing-masing media tumbuh. Untuk isolasi bakteri tahan panas, pengenceran terakhir dipanaskan pada suhu 80°C selama 30 menit sebelum disebarkan. Media tumbuh untuk cendawan digunakan Martin Agar (MA), untuk bakteri total dan bakteri tahan panas digunakan Tryptic Soy Agar (TSA), dan untuk aktinomisetes digunakan Starch Casein Agar (SCA). Komposisi media tersebut terlampir (Lampiran 1). Biakan diinkubasikan pada suhu kamar, kemudian diamati koloni yang terbentuk. Koloni bakteri, aktinomisetes dan cendawan masing-masing dihitung setelah 48, 72, dan 96 jam inkubasi.
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah rancangan faktorial dalam acak kelompok dengan dua faktor. Faktor Pertama adalah frekuensi penanaman tanaman perangkap (F) terdiri atas empat taraf, yaitu: FO = kontrol (tanpa tanaman perangkap); F1 = satu kali tanam tanaman perangkap; F2 = dua kali tanam tanaman perangkap; dan F3 = tiga kali tanam tanaman perangkap. Faktor Kedua adalah perlakuan tanah pembibitan (N) terdiri atas empat taraf, yaitu: NO = tanpa
22 N2 = perlakuan hanya dengan pupuk kandang ; dan N3 = perlakuan solarisasi dan pupuk kandang. Dengan demikian terdapat enam belas kombinasi perlakuan.
Tiap perlakuan diulang tiga kali.
Data dianalisis dengan menggunakan program Statistical Analysis System
(SAS) dan dilanjutkan dengan uji DMRT pada a = 0,05 (Steel & Torrie
HASIL DAN PEMBAHASAN
Hasil
Temperatur tanah
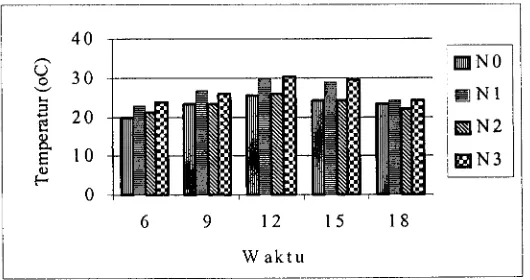
Temperatur tanah harian pada kedalaman 15 cm selama solarisasi berlangsung, yaitu dari 23 Oktober hingga 3 Desember 2001 tertera pada Gambar 2. Temperatur tanah pada perlakuan solarisasi tanah pembibitan baik dengan pupuk kandang ayam (N3) atau solarisasi tanah pembibitan tanpa pupuk kandang (N 1) lebih tinggi dibanding dengan perlakuan tanah pembibitan hanya dengan pupuk kandang (N2) atau kontrol (tanpa pupuk kandang dan tanpa solarisasi tanah pembibitan /NO). Temperatur tertinggi 30,32"C terjadi pada pukul 12 siang dicapai dengan perlakuan tanah pembibitan yang diberi pupuk kandang ayam dan diberi solarisasi yaitu rata-rata 4,82"C lebih tinggi dibanding dengan kontrol dan temperatur terendah pada perlakuan tersebut yaitu 23,69"C pada pukul6 pagi atau rata-rata 3,8OC lebih tinggi dibanding dengan kontrol (Tabel Lampiran 2).
[image:112.604.169.434.460.600.2]24
Kejadian penyakit, indeks penyakit akar gada dan produksi kubis
Berdasarkan hasil analisis sidik ragam diketahui bahwa tidak terjadi pengaruh interaksi antara kedua faktor yaitu frekuensi tanam tanaman perangkap dan perlakuan tanah pembibitan terhadap kejadian penyakit, indeks penyakit dan produksi kubis, tetapi masing-masing faktor menunjukkan pengaruh yang nyata (Tabel Lampiran 3).
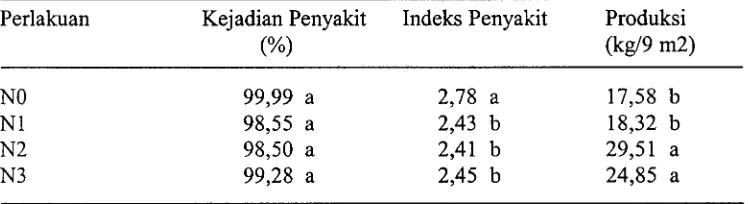
Kejadian penyakit akar gada terendah ditemui pada perlakuan satu kali tanam tanaman perangkap (Fl) berbeda nyata dengan perlakuan tiga kali tanam tanaman perangkap (F3) dan cenderung lebih baik dari pada perlakuan dua kali tanam tanaman perangkap (F2) atau tanpa tanaman perangkap (FO) (Tabel 1). Perlakuan satu kali tanam tanaman perangkap juga menunjukkan pengaruh yang nyata terhadap indeks penyakit akar gada yaitu lebih rendah dibanding dengan perlakuan lainnya. Walaupun antara perlakuan tanpa tanaman perangkap, satu kali tanam tanaman perangkap dan dua kali tanam tanaman perangkap tidak menunjukkan pengaruh yang nyata terhadap produksi kubis, tetapi perlakuan satu kali tanam tanaman perangkap cenderung lebih baik dan produksi kubis nyata lebih tinggi dibanding dengan perlakuan tiga kali tanam tanaman perangkap.
Tabel 1. Pengaruh frekuensi tanam tanaman perangkap terhadap kejadian penyakit, indeks penyakit akar gada (P. brassicae) dan produksi kubis Perlakuan Kejadian Penyakit Indeks Penyakit Produksi
(%) (kg19 m2)
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan DMRT pada a = 0,05.
[image:114.604.114.490.96.198.2]FO = tanpa tanaman perangkap, F1 = satu kali tanam tanaman perangkap, F2 = dua kali tanam tanaman perangkap, dan F3 = tiga kali tanam tanaman perangkap.
Tabel 2. Pengaruh perlakuan tanah pembibitan terhadap kejadian penyakit, indeks penyakit akar gada (P. brassicae) dan produksi kubis
Perlakuan Kejadian Penyakit Indeks Penyakit Produksi
(%) (kg19 m2)
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan DMRT pada a = 0,05.
NO = tanah pembibitan tanpa perlakuan solarisasi dan pupuk kandang, N1 = perlakuan tanah pembibitan hanya dengan solarisasi, N2 = perlakuan tanah pembibitan hanya dengan pupuk kandang, dan N3 = perlakuan tanah pembibitan dengan solarisasi dan pupuk kandang.
[image:114.604.117.491.318.420.2]26
Populasi mikrob rizosfer bibit kubis
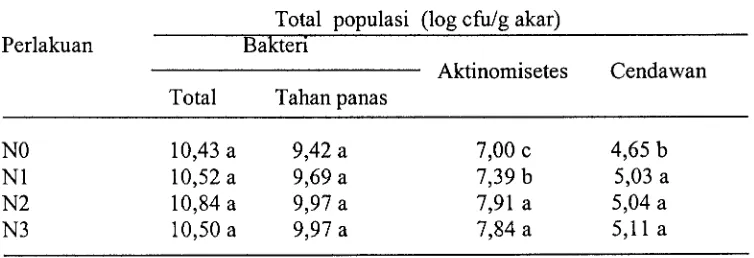
Populasi mikrob rizosfer bibit kubis meningkat pada tanah pembibitan yang diberi perlakuan (Tabel 3). Perlakuan tanah pembibitan (Nl, N2 dan N3) dengan nyata meningkatkan populasi cendawan dibanding dengan kontrol dan populasi aktinomisetes nyata lebih tinggi diperoleh dari perlakuan tanah pembibitan hanya dengan pupuk kandang ayam (N2) dan perlakuan tanah pembibitan dengan solarisasi dan pupuk kandang ayam (N3) dibanding dengan perlakuan tanah pembibitan hanya dengan solarisasi (Nl). Populasi mikrob rizosfer (bkteri total, bakteri tahan panas, aktinomisetes, dan cendawan) bibit kubis pada berbagai perlakuan tanah pembibitan ditunjukkan pada Gambar 3 dan total populasi cendawan rizosfer bibit kubis pada berbagai perlakuan tanah pembibitan pada Tabel 4.
Tabel 3. Pengaruh perlakuan tanah pembibitan terhadap total populasi mikrob rizosfer bibit kubis
Total populasi (log cfulg akar)
Perlakuan Bakteri
Aktinomisetes Cendawan Total Tahan panas
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan DMRT pada a = 0,05.
[image:115.604.118.495.437.566.2]Populasi bakteri total (A), bakteri tahan panas
(B),
aktinomisetes (C) dan cendawan(D)
rizosfer bibit kubis pada berbagai perlakuan tanah pembibitan: NO = tanpa perlakuan solarisasi dan pupuk kandang, N1 = perlakuan hanyaTabel 4. Total populasi cendawan rizosfer bibit kubis pada berbagai perlakuan tanah pembibitan
Perlakuan Cendawan
NO N1 N2 N3
Gliomastix
. .
..
.. . . .
..
. populasi (log cfulg akar) . . ..
.. . . . ..
0,000 3,456 4,109 4,109
Aspergillus dan
Cladosporium 0,000 3,757 0,000 3,63 1
Chalaropsis 3,933 4,058 4,301 4,234
* = tidak teridentifikasi
[image:117.604.109.485.95.314.2]29
Pembahasan
Sistem pertanian intensif dengan penanaman tanaman yang sama secara berulang-ulang dapat menyebabkan peningkatan jumlah inokulum patogen tular tanah yang tinggi, yang dapat mengancam produktivitas tanaman. Salah satu faktor yang sangat penting dalam pengelolaan penyakit yang disebabkan oleh patogen-patogen tular tanah adalah mengurangi tingkat inokulum patogen tersebut hingga tingkat di bawah ambang kritis sebelum suatu tanaman yang peka ditanam. Dalam ha1 ini, sterilisasi tanah dengan bahan kimia umumnya sering digunakan, bagaimanapun cara ini tidak mendukung pertanian berkelanjutan karena berbahaya terhadap lingkungan.
Solarisasi tanah adalah suatu disinfestasi tanah alternatif, merupakan proses pemanasan tanah di bawah mulsa plastik transparan dengan temperatur yang merugikan patogen-patogen tular tanah, telah berhasil mengendalikan berbagai penyakit tanaman ( Stapleton dan DeVay 1 986), tennasuk penyakit akar gada (clubroot) pada tanaman cruciferae (Horiuchi 1984; Horiuchi et al. 1982; Widodo dan Suheri 1995). Solarisasi tanah baik secara tunggal atau kombinasi dengan penambahan bahan organik adalah efektif mengendalikan patogen- patogen tular tanah (Gamliel dan Stapleton 1993; Katan 198 1).
30
Penggunaan tanaman perangkap caisin dengan perlakuan satu kali tanam (Fl) secara nyata dapat menurunkan indeks penyakit akar gada dibandingkan dengan kontrol (Tabel 1). Hal ini berarti tanaman caisin dapat digunakan untuk memerangkap P. brassicae di dalam tanah sebelum tanaman kubis ditanam. Inokulum P. brassicae di dalam tanah diduga sudah berkurang karena sebagian telah menginfeksi tanaman caisin atau sudah terperangkap sehingga inokulum yang dapat menginfeksi tanaman kubis juga menurun dan dengan demikian keparahan penyakit akar gada pada tanaman kubis menurun. Inokulum yang tidak terperangkap diduga tidak terjangkau dengan akar tanaman perangkap yang ditanam dengan jarak tanam 20 x 20 cm. Chupp dalam Karling (1968) melaporkan bahwa pada percobaan rumah kaca, zoospora dan amuba jarang berpindah lebih dari 5 inc secara horisontal selama satu musim dengan adanya inang yang peka.
3 1
Brassica oleracea, Brassica campestris dan Brassica napus. Selain itu penanaman tanaman perangkap lebih dari satu kali diduga meningkatkan populasi inokulum P. brassicae di dalam tanah. Spora rehat patogen yang kemungkinan terlepas dari akar tanaman perangkap pada saat panen menambah populasi lahan sebelum tanaman utama ditanam sehingga menyebabkan keparahan penyakit meningkat pada perlakuan tanaman perangkap lebih dari satu kali tanam. Naumov (1 928) dalanz Karling (1968) menunjukkan bahwa keberhasilan infeksi P. brassicae tergantung pada jumlah spora di dalam tanah dan infeksi tidak akan terjadi kecuali jika terdapat spora yang relatif tinggi dan jumlah spora yang lebih tinggi menyebabkan infeksi yang lebih parah. Persentase tanaman yang terserang meningkat dengan cepat dengan meningkatnya konsentrasi spora, dan menyebabkan proporsi tanaman yang terinfeksi juga meningkat (MacFarlane dalam Karling 1968). Colhoun (1957) melaporkan bahwa spora rehat P. brassicae (kurang dari 10 spora per gram tanah) menghasilkan "clubroot" yang maksimum apabila kondisi tanah mendukung, tetapi apabila kondisi tanah tidak mendukung, 10 - 10
'
sporalg tanah kadang-kadang tidak cukup clntuk menghasilkan clubroot. Pada penelitian ini, populasi spora rehat P. brassicae di dalam tanah tidak dapat dideteksi dengan menggunakan metode Takahashi dan Yamaguchi (1987). Pada pengamatan di bawah mikroskop flooresens, spora tidak dapat dihitung karena garis skala haemositometer tidak kelihatan. Hal ini mungkin karena kesalahan teknik.32
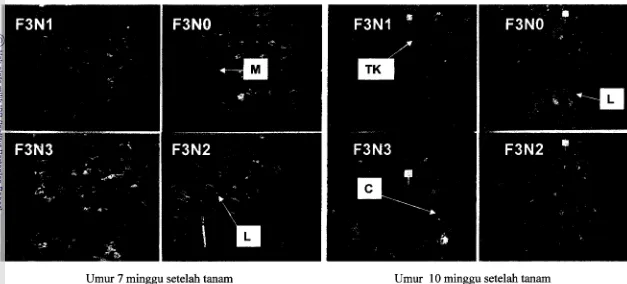
serangan ulat Crocidolomia binotalis Zeller yang cukup tinggi menjelang panen. Keadaan pertanaman kubis di lapang pada awal pembentukan krop yaitu umur 7 minggu setelah tanam belum menunjukkan adanya serangan ulat C. binotalis, tetapi setelah crop tanaman kubis terbentuk hingga tanaman dipanen terserang dengan ulat tersebut. C. binotalis tidak dapat diatasi dengan penyemprotan insektisida 2 kali seminggu karena dalam periode waktu tersebut curah hujan cukup tinggi sehingga insektisida yang diaplikasikan kemungkinan tercuci. Selain itu pengendalian mekanik yang dilakukan sekali seminggu dengan cara mengambil ulat dari crop tanaman juga belum mampu mengatasi serangan karena ulat yang berada di dalam crop sulit diambil. Keadaan pertanaman dari berbagai perlakuan masing-masing ditunjukkan pada Gambar 4a, 4b, 4c, dan 4d.
Umw 7 minggu setelah tanam Umw 10 minggu setelah tanam
Umur
7
minggu setelah tanam Umur 10 minggu setelah tanam [image:123.791.52.691.107.391.2]Umur 7 minggu setelah tanam Umur 10 minggu setelah tanam
Umur 7 minggu setelah tanam Umur 10 minggu setelah tanam
Gambar 4d. Keadan tanaman kubis di lapangan pada perlakuan tiga kali tanam tanaman perangkap dengan kombinasi berbagai perlakuan tanah pembibitan. Pada umur 7 minggu setelah tanam, sebagian besar tanaman memperlihatkan gejala layu (L) clan beberapa tanaman mati (M). Pada umur 10 minggu setelah tanam atau menjelang panen, sebagian tanaman tidak dapat membentuk krop (TK) dan sebagian besar tanaman terserang berat
3 7
beberapa cendawan mesofilik adalah 37OC selama 2-4 jam secara terus menerus (DeVay dan Katan 199 1). Takahashi dan Yamaguchi (1 989) melaporkan bahwa penyakit akar gada (clubroot) menurun apabila tanah terinfestasi diberi panas minimal 40°C selama 10 hari dan penurunan penyakit lebih besar dan lebih cepat pada temperatur yang lebih tinggi.
Penurunan indeks penyakit akar gada pada penelitian ini diduga karena efek kumulatif dari temperatur tanah harian yang dihasilkan oleh solarisasi yang secara tidak langsung mematikan patogen, tetapi hanya dapat melemahkannya. Disamping itu efek tersebut juga dapat meningkatkan populasi mikroorganisme tanah dan aktivitasnya yang diduga secara langsung dapat mempengaruhi P.
brassicae di dalam tanah. Pemanasan tanah karena solarisasi secara langsung dapat mempengaruhi propagul-propagul patogen dan juga dapat menyebabkan peningkatan aktivitas mikrob antagonis di dalam tanah (Greenberger et al. 1987; Katan et al. 1976; Stapleton dan DeVay 1984; Tjamos dan Paplomatas 1988). Bahkan Stapleton dan DeVay (1984) telah mengamati adanya peningkatan pertumbuhan tanaman dan penurunan keparahan penyakit pada plot yang diberi solarisasi tanpa peningkatan temperatur.
Walaupun produksi yang diperoleh pada perlakuan tanah pembibitan dengan solarisasi tidak berbeda nyata dengan kontrol (karena adanya serangan
38
39
40
J
penyangga tanah secara biologi, dapat menurunkan jumlah patogen selama dekomposisi, mempengaruhi nitrifikasi dan bentuk nitrogen, dan melindungi inang dari serangan patogen. Pengendalian biologi yang efektif apabila suatu pertahanan melawan patogen melalui lapisan organisme rizosfer yang ada sebelumnya untuk mencegah penetrasi (Baker dan Cook 1974). Menurut Beaumont dan Staniland (1933) dan Whitehead (1946) dalam Karling (1968) bahwa infeksi P. brassicae kurang berarti dan keparahan penyakit rendah pada tanaman yang dipupuk atau pada tanah yang diberi bahan organik. Peningkatan akar yang bengkak paling tinggi apabila nitrogen atau sulfur defisien, dan peningkatan akar yang bengkak relatif kecil apabila nitrogen atau kalium berlebih (Pryor 1940 dalam Karling 1968). Indeks penyakit akar gada pada tanaman yang disuplai dengan nitrogen lebih rendah dari pada tanaman yang tidak mendapat nitrogen yang cukup (Karling 1968). Pupuk kandang ayam adalah kotoran hewan yang mengandung nitrogen, fosfor, dan kalium yang cukup tinggi yang dapat larut dalam air (Casale et al. 1995), yang terdiri atas 2-3 % nitrogen, 1,5 % fosfor, dan 1,5 % kalium per berat kering (Gaskell et al. 2000). Tingkat amonia yang tinggi dari pupuk kandang ayam secara langsung bersifat toksik terhadap Phytopthora
cinnamomi (Aryantha et al. 2000). Menurut Fellows dan Ficke (1934) dalam
41
Perlakuan tanah pembibitan hanya dengan pupuk kandang ayam atau perlakuan tanah pembibitan dengan solarisasi dan pupuk kandang ayam tidak memberikan pengaruh yang berbeda nyata dalam menurunkan indeks penyakit akar gada atau dalam meningkatkan produksi kubis (Tabel 2). Hal ini berbeda dari beberapa laporan terdahulu yang menyatakan bahwa adanya peningkatan efek dari aplikasi ganda, seperti yang dilaporkan oleh Horiuchi (1991) bahwa penambahan bahan organik meningkatkan efek solarisasi walaupun bahan organik tersebut pada awalnya digunakan untuk memperbaiki kesuburan tanah dan keadaan fisik tanah. Ramirez dan Munnecke (1988) melaporkan bahwa solarisasi meningkatkan efek negatif gas fungitoksik dari residu tanaman cruciferae yang mengalami dekomposisi yang tertahan di bawah mulsa plastik terhadap Fusarium oxysporum f. sp. conglutinans sebagai penyebab penyakit layu pada kubis. Hasil penelitian ini menujukkan bahwa tidak selalu aplikasi ganda dapat meningkatkan efek pengendalian patogen, kemungkinan tergantung pada organisme yang dikendalikan atau bahan organik yang digunakan. Penurunan populasi bakteri total dan aktinomisetes pada perlakuan tanah pembibitan dengan solarisasi dan pupuk kandang dibanding dengan perlakuan tanah pembibitan hanya dengan pupuk kandang ayam (Tabel 3) diduga karena pertukaran gas seperti O2 lebih rendah pada tanah solarisasi menyebabkan populasi bakteri dan
aktinomisetes sedikit menurun. Blok et al. (2000) menunjukkan bahwa kondisi anaerob meningkat dengan cepat pada plot yang ditutup dengan plastik.
42
VanGundy (1968) bahwa efek negatif dari aerasi yang buruk terhadap
pertumbuhan dan sporulasi cendawan sering karena C 0 2 yang berlebihan
dibanding bila kekurangan oksigen.
43
tidak steril (Narisawa et al. 1998). H. chaetospira dapat menurunkan kejadian penyakit akar gada hingga 97 % dan layu Verticillium 67 % pada tanaman sawi putih dan kemungkinan berpotensi untuk mengendalikan penyakit-penyakit tular tanah yang penting lainnya seperti yang disebabkan oleh Fusarium dan
KESIMPULAN DAN SARAN
Kesimpulan
1. Tanaman perangkap caisin (satu kali tanam) dapat menurunkan indeks penyakit
akar gada (P. brassicae) pada tanaman kubis.
2. Perlakuan tanah pemibibitan dengan solarisasi, dengan pupuk kandang ayam atau
dengan solarisasi dan pupuk kandang ayarn dapat menurunkan indeks penyakit
akar gada dan meningkatkan produksi kubis. Perlakuan yang paling baik adalah
perlakuan tanah pembibitan dengan pupuk kandang ayarn.
3. Tidak ada pengaruh interaksi antara tanaman perangkap dan perlakuan tanah
pembibitan dalam menekan
P.
brassicae.Saran
Perlu penelitian lanjutan mengenai:
1. Waktu panen tanaman perangkap yang tepat agar
P.
brassicae yang terperangkaptidak terlepas kembali ke dalam tanah.
2. Waktu solarisasi sebaiknya pada puncak musim kemarau.
3. Waktu aplikasi pupuk kandang sebelum tanam untuk menstimulir mikroflora
tanah di lapangan.
4. Metode alternatif yang dapat digunakan untuk memprediksi tingkat infestasi P.
DAFTAR PUSTAKA
Agrios GN. 1997. Plant Pathology. 4 th ed. San Diego, California, London: Academic Press. 635 p.
Alexopoulos CJ, Mims CW, Blackwell M. 1996. Introductory Mycology. 4 th ed. New York-Chichester-Brisbane-Toronto Singapore: John Wiley and Sons, Inc. 869 p.
Akanuma R, Shimizu S, Sekiguchi A. 1983. Practical studies on the integrated control for clubroot disease of chinese cabbage in high altitude cool region. V. Chemical control of chinese cabbage clubroot disease caused by Plasmodiophora brassicae Woronin. Bull. Nagano Veg. & Ornam. Crops Exp. Sta. Japan 3: 1 15-122
Aryantha IP, Cross R, Guest DI. 2000. Suppression of Phytophthora cinnamomi
in potting mixes amended with uncomposted and composted animal manures. Phytopathology 90:775-782.
Ayers GW. 1972. Races of Plasmodiophora brassicae infecting crucifer crops in Canada. Plant Dis. Surv. 52:77-81
Baker KF, Cook RJ. 1974. Biological Control of Plant Pathogens. WH Freeman and Company San Francisco. 433 p.
Besri M. 1991. Solarization of soil and agricultural materials in Morocco for control of Verticillium wilt and Didymelle stem canker in Tomato. Pages 237-243. In J Katan and JE DeVay (eds.) Soil Solarization.. Boca Raton,
FL: CRC Press.
Blok WJ, Lamers JG, Temorshuizen AJ, Bollen GJ. 2000. Control of soilborne plant pathogens by incorporating fresh organic amendments followed by tarping. Phytopathology 90:253-259.
Buczacki ST, Toxopeus H, Mattusch P, Johnston TD, Dixon GR, Hobolth LA. 1975. Study of physiologic specialization in Plasmodiophora brassicae:
Proposals for attempted rationalization through an international approach. Trans. Br. Mycol. Soc. 65: 295-303.
Casale WL, Minassian V, Menge JA, Lovatt CJ, Pond E, Johnson E, Guillernet F. 1995. Urban and agricultural wastes for use as mulches on avocado and citrus and for delivery of microbial biocontrol agens. J. Hort. Sci. 70:3 15- 332.
Chen W, Hoitink HAJ, Schmitthenner AF. 1 987. Factors affecting suppression of Pythium damping-off in container media amended with composts. Phytopathology 77: 755-760.
Chen W, Hoitink HAJ, Madden LV. 1988. Microbial activity and biomass in Container media for predicting suppressivenes to damping-off caused by Pythium ultimatum. Phytopathology 78: 1447-1 550.
Chen Y, Katan J. 1980. Effect of solar heating of soils by transparent polyethylene mulching on their chemical properties. Soil Sci. 130: 271-277.
Chen Y, Gamliel A, Stapleton JJ, Aviad T. 1991. Chemical, physical, and microbial changes related to plant growth in disinfested soils. Pages 103- 129. In J Katan and JE DeVay (eds.) Soil Solarization. Boca Raton, FL: CRC Press.
Colhoun J. 1953. A study of the epidemiology of clubroot disease of brassicae. Ann. Appl. Biol. 40:262-283.
Colhoun J. 1958. Clubroot disease of crucifers caused by Plasmodiophora brassicae Wor. Phytopath. Pap. No. 3. Commonw. Mycol. Inst. Kew, Surrey, England. 108 pp.
Datnoff LE, Kroll TK, Lacy GH. 1984. Efficacy of chlorine for decontamining water infested with resting spore of Plasnzodioplzora brassicae. Plant Dis. 71: 734-736.
DeVay JE, Katan J. 1991 Mechanisms of pathogen control in solarized soils. Pages 87-101. In J Katan and JE DeVay (eds.) Soil Solarization. Boca Raton, FL: CRC Press.
Djatnika I. 1984. Upaya penanggulangan P. brassicae Wor. pada tanaman kubis-kubisan. Halaman 30-32. Di dalam Anonymous (ed.) Seminar Hama dan Penyakit Sayuran. Badan Penelitian dan Pengembangan Pertanian. Cipanas, Mei 1984. 82 hal.
Djatnika I. 1989. Upaya pengendalian Plasmodiophpra brassicae Wor. Penyebab penyakit akar bengkak pada Brassica spp. Disertasi. Fakultas Pascasarjana, Institut Pertanian Bogor.
Djatnika I. 1990. Pemanfaatan mikroba tanah untuk pengendalian
Plasmodiophora brassicae Wor, pada kubis (Brassica oleracea Linn). 3ul. Penel. Hort. 19(1):32-35.
Faggian R, Bulman SR, Lawrie AC, Porter IJ. 1999. Specific polymerase chain reaction primers for the detection of Plasmodiophora brassicae in soil and water. Phytopathology 89: 392-397.
Freeman S, Katan J. 1988. Weakening effect on propagules of Fusarium by sublethal heating. Phytopathology 78: 1656-1 66 1.
Gamliel A, Katan J. 1991. Involvement of flourescent pseudomonas and other microorganisms in increased growth response of plants in solarized soil. Phytopathology 8 1 : 494-502.
Gamliel A, Stapleton JJ. 1993. Characterization of antifungal volatile compounds evolved from solarized soil amended with cabbage residues. Phytopathology 83:899-905.
Gaskell M, Fouche B, Koike S, Lanini T, Mitchell J, Smith R. 2000. Organic vegetable production in California-science and practice. Hort. Technol. lO(4): 699-7 13.
Graveland R, Dale P, Mithen R. 1992. Gall development in hairy root cultures infested with Plasmodiophora brassicae. Mycol. Res. 96(3): 225- 228.
Greenberger A, Yogev A, Katan J. 1987. Induced suppressivenes in solarized soil. Phytopathology 77: 1663- 1667.
Herdian A. 2000. Pengaruh mulsa, sistem tanam tumpang sari dan pengaturan pH tanah terhadap penyakit akar gada (Plasmodiophora brassicae Wor.). Skripsi. Fakultas Pertanian IPB, Bogor.
Hoitink HAJ, Madden LV, Boehm MJ. 1996. Relationships among organic ~ a t t e r decomposition level, microbial species diversity, and soilborne disease severity. Pages 237-249. In R Hall (ed.) Principles and Practice of Managing Soilborne Plant Pathogens. St. Paul, MN: The American Phytopathological Society Press.
Horiuchi S. 1984. Soil solarization for suppressing soilborne diseases in Japan. Pages 11-23. In Soilborne Crop Diseases in Asia. FFTC Book Series No. 26. Food and Fertilizer Technology Center, Taiwan.
Horiuchi S. 199 1. Soil solarization in Japan. Pages 2 15-225. In J Katan and JE DeVay (eds.) Soil Solarization. Boca Raton, FL: CRC Press.
Horiuchi S, Hori M, Takahashi S, Shimizu K. 1982. Factors responsible for development of clubroot suppressing effect in soil solarization. Bull. Chugoku Natl.Agnic. 20: 25-48.
Kanazawa S, Filip Z. 1986. Distribution of microorganisms, total biomass, and enzyme activities in different particles of brown soil. Microb.Eco1. 12:205- 215.
Karling JS. 1968. The Plasmodiophorales. 2 nd ed. New York and London: Hafner Publishing Co. 256 p.
Katan J. 198 1. Solar heating (solarization) of soil for control of soilborne pests. Annu. Rev. Phytopathol. 19:211-236.
Katan J, DeVay JE. 199 1. Soil solarization. Historical perspective, principle and uses. Pages 23-27. 61 J Katan and JE DeVay (eds.) Soil Solarization. Boca Raton, FL: CRC Press.
Katan J, Fishler G, Grinstein A. 1983. Short and long-term effects of soil solarization and crop sequence on Fusarium wilt and yield of cotton in Israel. Phytopathology 73: 121 5-1219.
Katan J, Greenberger A, Alon H, Grastein A. 1976. Solar heating by polyethylene mulching for the control of diseases caused by soil-borne pathogens. Phytopathology 66:683-688.
Lambe RC, McCart GD. 1975. Control of cabbage clubroot. Fungicide and Nematicide Test Results of 1974, 30: 63.
Mattusch P. 1977. Epidemiology of clubroot of crucifers caused by P. brassicae Wor. Pages 24-28. 111 Proceeding of Woronin
+
100 Conference. Wisconsin, Madison, USA.Murtafingah C. 1987. Pengaruh pemberian cendawan Haplosporangium sp. terhadap keganasan Plasmodiophora brassicae Wor. pada tanaman petsai (Brassica campetris ssp. pekinensis (Lour) Olsson). Skripsi. Fakultas Biologi, Universitas Jendral Soedirman, Punvokerto.
Myers DF, Campbell RN, Greathead AS. 1981. Clubroot of crucifers in California: Soil respond differently to lime for clubroot control. (Abstr) Phytopathology 7 1 : 1005- 1006.
Narisawa K, Ohki KT, Hashiba T. 2000. Suppression of clubroot and Verticillium yellows in Chinese cabbage in the field by the root endophytic fungus, Heteroconium chaetospira. Plant Pathol. 49: 141 -146.
Orihara S, Yamamato T. 1998. Detection of resting spores of Plasmodiophora brassicae from soil and plant tissues by enzyme immunoassay. Ann. Phytopathol. Soc.Jpn. 64:569-573.
Palti J. 1981. Cultural practices and infectious crop diseases. Berlin Heidelberg New York: Springer-Verlag. 237 p.
Palti J, Katan J. 1997. Effect of cultivation practices and cropping syatems on soilborne diseases. Pages 377-396.
IIZ
RJ Hillocks and JM Waller (eds.) Soilborne Diseases of Tropical Crops. Cambridge: University Press. Parbery IH, Morgan FD. 1980. Control of plant parasites by cultural practices.Pages 360-369. In JF Brown (ed.) A Course Manual in Plant Protection. A.A.U.C.S.
Ramirez-Villapudua RJ, Munnecke DE. 1988. Effect of solar heating and soil amendments of cruciferous residues on Fusarium oxysporum f. sp. conglutinans and other organisms. Phytopathology 78:289-295.
Reyes AA, Devidson TR, Marks CF. 1974. Races, pathogenicity and chemical control of Plasmodiophora brassicae in Ontario. Phytopathology 64:173-177.
Rowe RC, Farley JD. 1979. Evaluation of soil applied fungicides to control clubroot of radish on "muck" soil. Fungic, Nematic Tests. Ann. Phytopathol. Soc. 34: 16 1
Rowe RL. 1980. Evaluation of radish cultivars for resistance to clubroot (Plasmodiophora brassicae) race 6 for Midwestern United States. Plant Dis. 70: 462-464.
Seaman WL, Walker JC, Larsan RH. 1963. A new races of P. brassicae affecting Badger Shipper Cabbage. Phytopathology 53: 1426-1429. Stakman EC, Harrar JG. 1957. Principles of plant pathology. New York:
The Ronald Press Company. 58 1 p.
Stapleton JJ, DeVay JE. 1984. Thermal components of soil solarization as related to changes in soil and root microflora and increased growth response. Phytopathology 74: 255-259.
Stapleton JJ, DeVay JE. 1986. Soil solarization: A non-chemical approach for management of plant pathogens and pests. Crop Prot. 5: 190-198. Steel RG, Torrie JH. 1980. Prinsipdan prosedur statistika: Suatu
pendekatan biometrik (Terjemahan). Ed ke-2. Jakarta: Gramedia Pustaka Utama.
Stolzy LH, VanGundy SD. 1968. The soil as an environment for microflora and microfauna. Phytopathology 583889-899.
Subijanto. 1988. Strategi penelitian hortikultura mendukung pertanian tangguh. Pros. Sem. Hort., Perhimpunan Hortikultura Indonesia Komisariat Bogor. Cipanas: 1-2
Suryaningsih E. 198 1. Penyakit akar pekuk (Plasmodiophora brassicae
Wor.), penyebaran dan cara pemberantasannya. Kongres Nasional PFI ke VI Padang.
Takahashi K, Yamaguchi T. 1987. An improved method for estimating the number of resting spores of Plasnzodiophora brassicae in soil. Ann. Phytopathol. Soc. Jpn. 53:507-5 15.
Takahashi K, Yamaguchi T. 1989. Assessment of pathogenecity of resting spore of P. brassicae in soil by fluorescence microscopy. Ann. Phytopathol.Soc.Jpn. 55:621-628.
Tanaka S, Yoshihara S, Ito S, Kameya-Iwaki M. 1997. The influence of virulence of Plasmodiophora brassicae population on epidemiology of chinese cabbage clubroot and efficacy of fungicides. Ann. Phytopathol. Soc. Jpn. 63: 183-187.
Tanaka S, Kochi S, Kunita H, Ito S, Kameya-Iwaki M. 1999. Biological mode of action of the fungicide, flusulfamide, against Plasmodiophora brassicae (clubroot). European J. Plant Pathol. 105: 577-584.
Tjamos EC, Paplomatas EJ. 1988. Long-term effect of soil solarization in controlling Verticillium wilt of globe artichokes in Greece. Plant Pathol. 37:505-5 15.
Voorrips RE. 1995. Plasmodiophora brassicae: Aspects of pathogenesis and resistance in Brassica oleracea. Euphytica 83: 139-146.
Widodo, Sinaga MS, Anas I, Mahmud M. 1993. Penggunaan Pseudomonas spp. Kelompok fluoresen untuk pengendalian penyakit akar gada (Plasnzodiophora brassicae Wor.) pada caisin (Brassica campestris L.var. chinensis (Rupr.) Olson). Bul. HPT 6(2): 94-105.
Widodo, Suheri. 1995. Suppression of clubroot disease of cabbage by soil solarization. Bul. HPT 8(2): 49-55
William AK. 1970. The reinfestation of treated soil. Pages 495-508. In KF Baker and WC Snyder (eds.) Ecology of Soil-borne Plant Pathogens. Berkeley: Univ. California Press.
Yamagishi H. 1987. Cultivation of clubroot-resistant strains to suppress population density of resting spore of Plasr~zodiophora brassicae in the soil. JARQ 2 1 :36-4 1.
Tabel Lampiran 1. Daftar komposisi media yang digunakan untuk isolasi mikrob rizosfer bibit kubis
Media Komposisi
Martin Agar (MA) Agar-agar
KH2po4 MgS04.7H20 Peptone Dextrose
Rose bengal (1%) Air suling
Streptomycin Starch-Casein Agar (SCA) Agar-agar
Starch Casein KN03 NaCl K2HP04 MgS04.7H20 CaC03 FeS04.7H20 Air suling
Nystatin & actidione Tryptic Soy Agar (TSA) Tryptic soy broth (0,1 %)
Tabel Lampiran 2. Rata-rata temperatur tanah pada kedalaman 15 cm selama solarisasi berlangsung (23 Oktober - 3 Desember 2001) pada berbagai perlakuan tanah pembibitan
Temperatur (O C) pada pukul
Perlakuan
NO = tanah pembibitan tanpa perlakuan solarisasi dan pupuk kandang, N 1 = perlakuan tanah pembibitan hanya dengan solarisasi, N2 = perlakuan tanah pembibitan
Tabel Lampiran 3. Analisis sidik ragam dari pengaruh tanaman perangkap dan perlakuan tanah pembibitan terhadap kejadian penyakit, indeks penyakit akar gada dan produksi kubis
Kejadian Penyakit Akar Gada
ULG 2 7.62360764 3.81 180382 0.72 0.4948
F 3 30.19675064 10.06558355 1.90 tn 0.1506
N 3 17.79619562 5.93206521 1.12 tn 0.3562
F*N 9 92.63815308 10.29312812 1.95 tn 0.0832
Acak 3 0 158.75544658 5.29184822
Total 47 307.01015355
R-Square KK Root MSE Rata-rata
0.482898 2.321 823 2.30040175 99.07738194
Indeks Penyakit Akar Gada
ULG 2 0.01761863 0.0088093 1 0.8757
F 3 2.79181306 0.93060435 0.0001
N 3 1.08629 123 0.36209708 0.0040
F*N 9 0.78428035 0.08714226 0.2686
Acak 3 0 1.98192404 0.06606413
Total 47 6.66 19273 1
R-Square KK Root MSE Rat-rata
0.702500 10.20439 0.25702944 2.51881250
Produksi Tanaman Kubis
ULG 2 277.40806667 138.70403333 0.0410
F 3 1005.65757292 335.21919097 0.0003
N 3 1 156.02002292 385.34000764 0.0001
F*N 9 694.88 120208 77.20902245 0.0776
Acak 30 1168.77733333 38.95924444
Total 47 4302.74419792
R-Square KK Root MSE Rata-rata
0.728365 27.66139 6.241 73409 22.56479167
tn = tidak nyata,
**
= berbeda sangat nyata U, [image:144.795.76.736.147.477.2]