ABSTRAK
ANALISIS BAKTERI Escherichia coli PADA AIR SUMUR BOR DI SEKITAR LABORATORIUM BIOMASSA UNIVERSITAS LAMPUNG
MENGGUNAKAN COLONY COUNTER
Oleh
RETNO NUR RAMADHANI
Penelitian ini dilakukan untuk mengetahui tingkat Escherichia coli pada sampel air dari tiga titik di lokasi sekitar Laboratorium Biomassa. Sampel diambil dari Laboratorium Biomassa (sampel A), Gedung MIPA Terpadu (sampel B), dan Laboratorium Biokimia (sampel C). Sampel dianalisis untuk diidentifikasi dan dihitung jumlah Escherichia coli yang terkandung di dalam sampel. Identifikasi bakteri dilakukan dengan cara pewarnaan gram untuk menentukan bakteri gram positif atau gram negatif, dan analisis kuantitatif dilakukan dengan metode colony counter. Hasil penelitian menunjukkan bahwa ketiga sampel mengandung bakteri
Escherichia coli dengan jumlah koloni yang berbeda. Sampel A mengandung 33,6 koloni, sampel B mengandung 54,8 koloni, dan sampel C mengandung 52,6 koloni. Menurut standar, sampel A tergolong berkualitas baik sedangkan sampel B dan C tergolong berkualitas kurang baik.
ABSTRACT
ANALYSIS OF Escherichia coli BACTERIA IN WATER WELLS DRILLED AROUND BIOMASS LABORATORY LAMPUNG
UNIVERSITY USING COLONY COUNTER
By
RETNO NUR RAMADHANI
This study was carried out to determine the level of Escherichia coli in water samples from three spots in the Biomass Laboratory location. The samples were taken from the Biomass Laboratory (sample A), MIPA Terpadu Building (sample B) and the Biochemistry Laboratory (sample C). The samples were analyzed to identify and quantify the Escherichia coli contained in the samples. Identification of the bacteria was conducted using gram staining to determine whether the bacteria belongs to gram negative or gram positive, and quantitative analysis was conducted using colony counter method. The results obtained indicate that the three samples contain Escherichia coli with different numbers of colony. Sample A was found to contain 33.6 colonies, sample B contains 54.8 colonies, and sample C contains 52.6 colonies. According to the standard, sample A is considered save to be used, while sample B and C are categorized as less save.
ANALISIS BAKTERI Escherichia coli PADA AIR SUMUR BOR DI SEKITAR LABORATORIUM BIOMASSA UNIVERSITAS
LAMPUNG MENGGUNAKAN COLONY COUNTER
Oleh
Retno Nur Ramadhani
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 22 Maret 1991, sebagai anak
ketiga dari Bapak Atmadi dan Ibu Supriyati.
Penulis menyelesaikan pendidikan Sekolah Dasar di SD Negeri 2 Harapan Jaya
Bandar Lampung pada tahun 2003, Sekolah Menengah Pertama di SMP Negeri 4
Bandar Lampung pada tahun 2006, dan Sekolah Menengah Atas di SMA Negeri 2
Bandar Lampung pada tahun 2009. Penulis diterima di Universitas Lampung,
Fakultas Matematika dan Ilmu Pengetahuan Alam Jurusan Kimia pada tahun 2009
melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
Selama menjadi mahasiswa, penulis pernah menjadi asisten praktikum Kimia
Dasar untuk Jurusan Agroteknologi FP Unila pada tahun 2012, asisten praktikum
Kimia Dalam Kehidupan untuk Jurusan Kimia FMIPA Unila pada tahun 2013,
asisten praktikum Kimia Dasar untuk Jurusan Agribisnis FP Unila pada tahun
2013. Penulis pernah memperoleh Beasiswa Bantuan Mahasiswa (BBM) pada
tahun 2010 dan 2013. Penulis juga aktif di Lembaga Kemahasiswaan Himpunan
Mahasiswa Kimia (HIMAKI) periode 2010/2011 dan 2011/2012. Pada tahun
2012 penulis melakukan Praktek Kerja Lapangan di Laboratorium Biomassa
MOTO
Orang yang luar biasa tidak pernah
memperhatikan hasil, tetapi mereka hanya
memikirkan dan mengerjakan prosesnya
(Asep Hilman)
“
Orang bijak bisa lebih banyak belajar dari orang bodoh, tetapi orang
bodoh menolak belajar dari orang bijak.
(Mario Teguh)
Keberuntungan adalah sesuatu yang terjadi ketika
kesempatan bertemu dengan kesiapan.
Dengan segala kerendahan hati
Karya kecil ini kupersembanhkan sebagai tanda
bhakti dan sayangku yang tiada tara kepada:
Bapak dan Mama
yang tak pernah putus mencurahkan cinta,
kasih sayang, motivasi, dan doa.
Kakak-kakakku
Yang selalu sabar membimbingku
Orang-orang yang telah menyangi dan
memberikan warna dalam hidupku sehingga
mampu membuat hari-hari ku menjadi lebih
indah
Teman-Teman Seperjuangan Kimia
SANWACANA
Assalamualaikum Wr. Wb
Puji dan syukur penulis panjatkan kehadirat Allah SWT, karena berkat rahmat,
ridho, dan karunia-Nya penulis dapat menyelesaikan skripsi ini. Shalawat dan
salam tidak lupa penulis haturkan kepada Nabi Muhammad SAW sebagai suri
tauladan.
Skripsi dengan judul “Analisis Bakteri Escherichia coli Pada Air Sumur Bor di Sekitar Laboratorium Biomassa Universitas Lampung Menggunakan Colony Counter” merupakan syarat untuk mencapai gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas
Lampung.
Pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan yang
tulus kepada :
1. Ibu Dra. Fifi Martasih, M.S. (alm) dan Ibu Dra. Aspita Laila, M.S. selaku
Pembimbing Utama yang telah membimbing penulis dengan sabar,
memberikan banyak ilmu pengetahuan, saran, arahan, dan motivasi
2. Bapak Dr. Eng. Surpto Dwi Yuwono, M.T. selaku pembimbing Kedua
yang telah membimbing,memberikan petunjuk, saran, serta nasehat dalam
menyelesaikan skripsi ini.
3. Bapak Dr. Hardoko Insan Qudus, M.S. selaku Pembahas yang telah
banyak memberikan banyak arahan, kritik dan saran demi terselesaikannya
skripsi ini.
4. Bapak Prof. Dr. John Hendri, M.S. selaku Pembimbing Akademik yang
telah memberi motivasi dan dukungannya.
5. Bapak Dr. Eng. Surpto Dwi Yuwono, M.T. selaku Ketua Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Bapak Prof. Dr. Suharso, Ph.D selaku Dekan Fakultas Matematika dan
Ilmu Pengetahuan Alam Universitas Lampung.
7. Mba Nora, Pak Gani, Mas Nomo, Paman, serta seluruh staf pengajar dan
karyawan Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan
Alam Universitas Lampung.
8. Bapakku Atmadi dan mamaku Supriyati atas limpahan kasih sayang yang
tak pernah habis untukku, keikhlasan merawat dan menjagaku, doa tulus
yang tiada henti, dan perhatian yang takkan pernah habis demi
keberhasilan penulis.
9. Kedua kakakku tersayang Octania Nurnela dan Gansyar Santoso atas do’a
dan dukungannya selama ini, sepupuku tersayang, Anggi dan Riri atas
motivasi, keceriaan, dan canda tawa yang tercipta selama ini, seluruh
keluarga besarku yang selalu memberikan motivasi, dukungan dan doa
10.Patner Penelitianku, mba Candra (08), mba Novi (08), dan kak Idrus (08)
atas kerja sama yang sangat baik serta bantuan, dukungan, dan
motivasinya selama penelitian.
11. Sahabat-sahabat terbaikku, Rizki Yuliandari, S.Si, Sherly Nurimani S.Si; Luh Gede Rai Putri, S.Si., Stephanie Oktiana, R. Meta Megawati, S.Si,
Nurjannah S.Si, Dani Agus Setiawan, Yahya Ariyanta, Novi Kurniawati,
S.P, atas segala bantuan dan motivasinya.
12.Teman-teman se-angkatan 2009, Juwita Ratna Sari, S.Si., M. Padli,
Mersiana, S.Si., Rizki Yuliandari,S.Si., Sherly Nurimani, S.Si., Suparno,
Ari Bowo, Dani Agus, Luh Gede, S.Si., Delphiana, Delfiana Sidabalok,
Dwiyanto,S.Si., Fitriyanti, S.Si., Ignatius S. Ellen, Khoirul Umam, S.Si.,
Neneng Suryani, S.Si., Nurjannah, S.Si., Purna Pirdaus, Resca Ridhatama,
S.Si., R. Meta Megawati, S.Si., Rhamadya Teta, Rinawati, S.Si, Siska Dwi
Aryani, S.Si., Tiurma N, Yahya Ariyanta, Mardiyah, Stephanie Oktiana,
dan Lia Andriani, atas kebersamaannya selama ini.
13.Rendi Robiyan, S.P. yang senantiasa memberikan dukungan dan motivasi.
14.Semua pihak yang tidak dapat penulis sebutkan satu persatu yang secara
tulus memberikan bantuan moril dan materil kepada penulis.
Bandar Lampung, Juni 2014
Penulis
DAFTAR ISI
D. Metode Perhitungan Jumlah Bakteri... 14
ii
4. Identifikasi Bakteri Escherichia coli ... 24
4.1 Uji Makroskopik ... 24
4.2 Uji Mikroskopik ... 25
5. Analisis Perhitungan Jumlah Bakteri Secara Colony counter ... 26
IV. HASIL DAN PEMBAHASAN A. Pengantar ... 27
B. Persiapan Sampel ... 27
C. Isolasi Bakteri Escherichia coli ... 28
D. Identifikasi Bakteri Escherichia coli ... 33
E. Analisis Perhitungan Jumlah Bakteri Secara Colony counter ... 35
V. SIMPULAN DAN SARAN A. Simpulan ... 38
B. Saran ... 39
DAFTAR PUSTAKA... 40
DAFTAR TABEL
Tabel Halaman
1. Hasil analisis kualitatif bakteri Escherichia coli pada sampel A, B, dan C dengan tiga kali pengulangan koloni bakteri
Escherichia coli. ...45
2. Hasil analisis kuantitatif bakteri Escherichia coli menggunakan
iii
DAFTAR GAMBAR
Gambar Halaman
1. Koloni bakteri Escherichia coli. ...11
2. Pewarnaan gram negatif...13
3. Dinding sel bakteri gram negatif ...14
4. Alat colony counter ...15
5. Skema pengambilan sampel...21
6. Hasil uji pendugaan Coliform pada (a) kontrol negatif, (b) sampel A, (c) sampel B, (d) sampel C, dan (e) kontrol positif. ...29
7. Hasil uji penegasan Coliform pada (a) kontrol negatif, (b) sampel A, (c) sampel B, (d) sampel C, dan (e) kontrol positif . ...30
8. Reaksi biokimia pembentukan gas CO2 dalam tabung durham ...31
9. Hasil uji pendugaan Escherichia coli pada (a) kontrol negatif, (b) sampel A, (c) sampel B, (d) sampel C, dan (e) kontrol positif ...32
10.Hasil uji positif penegasan Escherichia coli (a) sampel A, (b) sampel B, (c) sampel C, (d) kontrol negatif, (e) kontrol positif. ...33
11.Hasil uji morfologi dengan pewarnaan gram bakteri Escherichia coli pada (a) sampel A, (b) sampel B, (c) sampel C, (d) kontrol negatif dan (e) kontrol positif .. ...34
I. PENDAHULUAN
A.Latar Belakang
Air merupakan bahan yang penting bagi kehidupan, baik manusia, hewan, dan
tumbuhan (Suryani, 2004). Meningkatnya kebutuhan air disebabkan oleh jumlah
penduduk dunia yang semakin bertambah, dan peningkatan kebutuhan air untuk
keperluan rumah tangga, industri, rekreasi dan pertanian (Achmad, 2004).
Menurut WHO dan APHA, kualitas air secara umum ditentukan berdasarkan
karakteristik fisik, kimia, dan mikrobiologis air (Widiyanti, 2004). Secara
mikrobiologis, kualitas air ditentukan oleh adanya Escherichia coli.
Escherichiacoli merupakan contoh mikroba patogen, berupa bakteri yang banyak
ditemukan pada air tanah, seperti air sumur dan air sumur bor. Apabila bakteri
tersebut ditemukan dalam jumlah besar dalam air yang terkontaminasi oleh
kotoran manusia atau hewan, maka air akan menjadi tercemar serta
mengakibatkan menurunnya kualitas air.
Air sumur bor yang digunakan di Laboratorium Biomassa diduga memiliki
kandungan bakteri Escherichiacoli karena jarak air sumur bor tersebut yang
berdekatan dengan tempat pembuangan feses, limbah rumah tangga, dan limbah
2
Biomassa juga banyak menggunakan mikroorganisme, khususnya bakteri
Escherichia coli. Bakteri Escherichia coli dapat digunakan sebagai salah satu
indikator kualitas air, dengan semakin sedikit kandungan Escherichia coli, maka
kualitas air semakin baik. Oleh karena itu, perlu dilakukan penelitian untuk
menghitung jumlah bakteri Escherichia coli yang terdapat pada air di sekitar
Laboratorium Biomassa.Data informasi awal ini dapat digunakan sebagai
pembanding atau monitoring untuk tahun-tahun berikutnya.
Pada penelitian ini dilakukan analisis secara kualitatif dan kuantitatif. Untuk
analisis kualitatif dilakukan dengan cara isolasi dan identifikasi bakteri,
sedangkan untuk analisis kuantitatif dilakukan menggunakan colony counter.
Colony counter ini adalah alat untuk menghitung jumlah koloni bakteri atau
mikroorganisme. Pada alat colony counter, penghitungan jumlah koloni bakteri
dipermudah dengan adanya counter electronic. Dengan adanya counter tersebut
peneliti tinggal menandai koloni bakteri yang dihitung dengan menggunakan pen
yang terhubung dengan counter. Setiap koloni yang ditandai maka counter akan
menghitung secara otomatis.
B.Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah:
1. Menganalisis keberadaan bakteri Escherichia coli pada air sumur bor di sekitar
Laboratorium Biomassa.
2. Mengetahui kualitas air sumur bor yang digunakan di sekitar Laboratorium
3. Mengetahui jumlah bakteri Escherichia coli pada air sumur bor di sekitar
Laboratorium Biomassamenggunakan colony counter.
C.Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah untuk memberikan informasi data awal
mengenai keberadaan bakteri Escherichia coli pada air di sekitar Laboratorium
4
II. TINJAUAN PUSTAKA
A.Air
Air merupakan bahan esensial bagi kehidupan organisme. Oleh karena itu, air
selalu penuh dengan benda-benda hidup. Manfaat air di dalam tubuh manusia
antara lain untuk melarutkan berbagai jenis zat yang diperlukan tubuh,
mempertahankan suhu tubuh dengan cara penguapan keringat, untuk transportasi
zat-zat makanan dalam tubuh semuanya dalam bentuk larutan dengan pelarut air.
Sumber air bersih untuk kebutuhan hidup sehari-hari secara umum harus
memenuhi standar kuantitas dan kualitas.
a. Ditinjau dari segi kuantitas air
Ditinjau dari segi kuantitasnya, kebutuhan air rumah tangga menurut Karsidi
(2000) adalah:
1. Kebutuhan air untuk minum dan mengolah makanan 5 liter/ orang per hari.
2. Kebutuhan air untuk mandi dan membersihkan dirinya 25-30 liter/ orang per
hari.
3. Kebutuhan air untuk mencuci pakaian dan peralatan 25-30 liter/ orang per hari.
Kebutuhan air untuk menunjang pengoperasian dan pemeliharaan fasilitas
sanitasi atau pembuangan kotoran 4-6 liter/ orang per hari, sehingga total
b. Ditinjau dari segi kualitas air
Menurut peraturan Menteri Kesehatan Republik Indonesia Nomor 416/
Menkes/Per/IX/1990, air bersih adalah air yang digunakan untuk keperluan
sehari-hari yang kualitasnya memenuhi syarat kesehatan dan dapat diminum
setelah dimasak (Pitojo dan Purwantoyo, 2003). Air bersih diperoleh dari sumber
mata air yaitu air tanah, sumur, air tanah dangkal, sumur artetis atau air tanah
dalam.
Kualitas air bersih apabila ditinjau berdasarkan kandungan bakterinya menurut
SK. Dirjen PPM dan PLP No. 1/PO.03.04.PA.91 dan SK JUKLAK PKA Tahun
2000/2001, dapat dibedakan ke dalam lima kategori sebagai berikut:
1. Air bersih kelas A ketegori baik mengandung total Coliform kurang dari 50
bakteri.
2. Air bersih kelas B kategori kurang baik mengandung Coliform 51-100 bakteri.
3. Air bersih kelas C kategori jelek mengandung Coliform 101-1000 bakteri.
4. Air bersih kelas D kategori amat jelek mengandung Coliform 1001-2400
bakteri.
5. Air bersih kelas E kategori sangat amat jelek mengandung Coliform lebih 2400
bakteri (Effendi, 2003).
Air yang berkualitas baik harus memenuhi persyaratan fisik seperti berikut
(Slamet, 2002).
1.Jernih atau tidak keruh (kekeruhan)
Air yang keruh disebabkan oleh adanya butiran-butiran koloid dari bahan tanah
6
2.Tidak berwarna (warna)
Air untuk keperluan rumah tangga harus jernih. Air yang berwarna berarti
mengandung bahan-bahan lain yang berbahaya bagi kesehatan.
3.Rasa
Secara fisika, air bisa dirasakan oleh lidah. Air yang terasa asam, manis, pahit,
atau asin menunjukkan bahwa kualitas air tersebut tidak baik. Rasa asin
disebabkan adanya garam-garam tertentu yang larut dalam air, sedangkan rasa
asam diakibatkan adanya asam organik maupun asam anorganik.
4.Tidak berbau
Air yang baik memiliki ciri-ciri tidak berbau bila dicium dari jauh maupun dari
dekat. Air yang berbau busuk mengandung bahan-bahan organik yang sedang
mengalami dekomposisi (penguraian) oleh mikroorganisme air.
5.Temperatur normal (suhu)
Air yang baik harus memiliki temperatur sama dengan tempertur udara (20 ºC
sampai dengan 60 ºC). Air yang secara mencolok mempunyai temperatur di
atas atau di bawah temperatur udara berarti mengandung zat-zat tertentu
(misalnya fenol yang terlarut di dalam air cukup banyak) atau terjadi proses
tertentu (proses dekomposisi bahan organik oleh mikroorganisme yang
menghasilkan energi) yang mengeluarkan atau menyerap energi dalam air.
Kualitas air juga tergolong baik bila memenuhi persyaratan kimia berikut ini
(Kusnaedi, 2004):
1. pH netral
Derajat keasaman air harus netral, tidak boleh bersifat asam maupun basa. Air
bersifat basa. Air yang murni mempunyai pH = 7, pH di bawah 7 akan bersifat
asam sedangkan pH di atas 7 akan bersifat basa.
2. Tidak mengandung bahan kimia beracun
Air yang berkualitas baik tidak mengandung bahan kimia beracun seperti
sianida, sulfida, fenolik.
3. Tidak mengandung ion-ion logam
Air yang berkualitas baik tidak mengandung garam atau ion logam seperti Fe,
Mg, Ca, K, Hg, Zn, Mn, Cl, Cr, dan lain-lain.
4. Kesadahan rendah
Tingginya kesadahan berhubungan dengan garam-garam yang terlarut di dalam
air terutama garam Ca dan Mg.
5. Tidak mengandung bahan organik
Kandungan bahan organik dalam air yang melebihi ambang batas dapat terurai
menjadi zat-zat yang berbahaya bagi kesehatan. Bahan-bahan organik itu
seperti NH4+, H2S, SO42- dan NO₃-.
Selain persyaratan fisik dan kimia, kualitas air bersih juga harus memiliki
persyaratan mikrobiologis. Pada umumnya uji mikrobiologis yang harus dipenuhi
oleh air adalah sebagai berikut (Notoadmojo, 2003):
1. Tidak mengandung bakteri patogen, misalnya bakteri golongan coli, Shigella
dysenteriae, Salmonella typhi, Salmonella parathypi, Vibrio colerae.
Bakteri-bakteri ini mudah tersebar melalui air (transmitted by water).
2. Tidak mengandung bakteri non-patogen, seperti Actinomycetes, Ciadocera,
8
Salah satu sumber air yang sering dimanfaatkan oleh manusia adalah air sumur
atau air sumur bor. Biasanya air sumur atau air sumur bor yang digunakan
memiliki lokasi yang berdekatan dengan sumber pencemaran seperti tempat
pembuangan feses dan tempat pembuangan sampah sehingga ada kemungkinan
air sumur atau air sumur bor tercemar oleh bakteri. Laboratorium Biomassa
Universitas Lampung merupakan salah satu laboratorium yang sering digunakan
baik mahasiswa maupun dosen dalam penelitian. Penggunaan zat -zat kimia
dalam penelitian juga akan mempengaruhi lingkungan sekitar laboratorium.
Selain menggunakan zat-zat kimia, penelitian di Laboratorium Biomassa juga
banyak menggunakan mikroorganisme, khususnya bakteri golongan Escherichia
coli. Sumber air yang terdapat di Laboratorium Biomassa berasal dari air sumur
bor. Dengan adanya aktivitas makhluk hidup di dalam Laboratorium Biomassa,
dapat diperkirakan sumber air di laboratorium juga tercemar oleh bakteri. Jenis
bakteri yang biasanya terdapat di air sumur atau air sumur bor adalah bakteri
Escherichia coli.
B. Bakteri Coliform dan Escherichia coli
Bakteri adalah kelompok organisme yang tidak memiliki membran inti sel.
Organisme ini termasuk ke dalam domain prokariot dan berukuran sangat kecil
(mikroskopik), serta memiliki peran besar dalam kehidupan di bumi. Beberapa
kelompok bakteri dikenal sebagai agen penyebab infeksi dan penyakit, sedangkan
kelompok lainnya dapat memberikan manfaat di bidang pangan, pengobatan, dan
Hal inilah yang menjadi dasar perbedaan antara sel prokariot dengan sel eukariot
yang lebih kompleks.
1. Bakteri Coliform
Coliform merupakan suatu kelompok bakteri yang digunakan sebagai indikator
adanya polusi kotoran dan kondisi yang tidak baik terhadap air, makanan, dan
produk-produk susu. Kelompok bakteri Coliform dicirikan sebagai bakteri
berbentuk batang, gram negatif, tidak membentuk spora, aerobik dan anaerobik
fakultatif yang dapat memfermentasi laktosa menghasilkan asam dan gas dalam
waktu 48 jam pada suhu 35 ⁰C.
Bakteri Coliform dapat dibedakan menjadi 2 kelompok, yaitu:
1. Coliform fekal adalah bakteri indikator adanya pencemaran bakteri patogen.
Penentuan Coliform fekal menjadi indikator pencemaran dikarenakan jumlah
koloninya pasti berkorelasi positif dengan keberadaan bakteri patogen. Contoh
bakteri Coliform fekal adalahEscherichia coli yang berasal dari kotoran hewan
atau manusia (Dwee, 2010).
2. Coliform non-fekal misalnya Enterobacter aerogenes yang bukan berasal dari
kotoran manusia tetapi mungkin berasal dari hewan atau tanam-tanaman yang
telah mati.
Semakin tinggi tingkat kontaminasi bakteri Coliform, semakin tinggi pula risiko
kehadiran bakteri-bakteri patogen lain yang biasa hidup dalam kotoran manusia
dan hewan. Salah satu contoh bakteri patogen yang kemungkinan terdapat dalam
10
yaitu mikroba penyebab gejala diare, demam, kram perut, dan muntah-muntah
(Zuhri, 2009).
Bakteri Coliform biasanya digunakan sebagai organisme indikator. Kriteria
paling penting dari organisme indikator adalah mikroba tersebut selalu ada dalam
feses manusia sehingga jika terdeteksi dalam air mengindikasikan kontaminasi
feses manusia. Organisme indikator juga harus dapat bertahan hidup dalam jangka
waktu yang sama dengan patogen (Maulana, 2010).
2. Bakteri Escherichia coli
Escherichia coli adalah kuman oportunis yang banyak ditemukan di dalam usus
besar manusia sebagai flora normal. Bakteri ini bersifat unik karena dapat
menyebabkan infeksi primer pada usus, misalnya diare pada anak, seperti juga
kemampuannya menimbulkan infeksi pada jaringan tubuh lain di luar usus.
Escherichia coli terdiri dari dua spesies yaitu: Escherichiacoli dan Escherichia
hermanis (Irianto, 2007). Banyak strain Escherichia coli yang diantaranya tidak
berbahaya, terdapat pada saluran gastrointensinal pada manusia atau hewan
berdarah panas. Tetapi ada beberapa kategori Escherichia coli yang bersifat
beracun, dan dapat menyebabkan diare.
Bakteri Escherichia coli dalam keadaan normal menghuni saluran pencernaan
manusia dan hewan berdarah panas, tidak membentuk spora, aerob dan anaerob
fakultatif yang memfermentasi laktosa dan mampu menghasilkan asam dan gas
dalam waktu 48 jam pada suhu 35 ⁰C (Pelczar dan Chan, 2006). Escherichia coli
juga mempunyai sifat motil tak berspora coccobacili pendek, berbentuk
berpasangan dan rantai, bentuk koloni putih kelabu gelap rata dengan sisi tepi
yang teratur, dalam kaldu turbiditasnya sama dan memproduksi sedimen tebal,
pada media biasa diameternya beberapa millimeter. Bakteri ini tergolong bakteri
aerob dan anaerob pada suhu 40 ⁰C, pada suhu 60 ⁰C hanya dapat bertahan selama
30 menit, pada umumnya tidak resisten terhadap desinfektan dan pada keadaan
yang kering, ada dalam intestinal dan feses manusia sehat dan vertebrata tinggi
dan jumlahnya di colon, tumbuh menempel pada media sintetik yang berisi NaCl
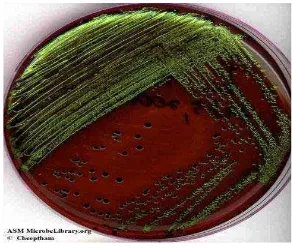
dan glukosa ditambah vitamin (Ruth, 2009). Adapun gambar koloni Escherichia
coli dapat disajikan pada Gambar 1.
Gambar 1. Koloni bakteri Escherichia coli (Pelczar dan Chan, 2006).
Bakteri Escherichia coli terdiri atas lima strain yang sifatnya patogen pada
manusia dan dapat menyebabkan diare adalah sebagai berikut :
1. Escherichia colienteropathogenic yang menyebabkan diare pada bayi dan
anak di negara berkembang dan mekanisme penyakitnya belum jelas.
2. Escherichia colienterotoxigenic yang menyebabkan diare seperti kolera,
dengan mekanisme perlekatan kuman pada sel mukosa usus (epitel usus) serta
12
3. Escherichia colienteroinvasive yang menyebabkan diare seperti disentri oleh
Shigella (tinja mengandung darah, mukus), dengan mekanisme kuman dapat
menginvasi sel mukosa usus yang mengakibatkan kerusakan sel mukosa dan
lapisan mukosa terlepas.
4. Escherichia colienterohemoragik dengan mekanisme kolitis hemoragik,
toksinnya bersifat sitotoksik terhadap sel vero dan hela, diare terjadi karena
toksin merusak sel endotel pembuluh darah, dan terjadi pendarahan kemudian
darah masuk ke usus.
5. Escherichia colienteroagregative yang menyebabkan diare akut dan kronik
dalam waktu lebih dari 14 hari terutama di negara sedang berkembang, dengan
mekanisme melekatnya kuman pada mukosa intestinal menghasilkan
enterotoksin dan sitotoksin sehingga mukosa rusak, mukus keluar, dan terjadi
diare.
C. Bakteri Gram Negatif
Coliform dan Escherichia coli merupakan bakteri gram negatif. Bakteri gram
negatif adalah bakteri yang tidak mempertahankan zat warna kristal violet
sewaktu proses pewarnaan gram sehingga akan berwarna merah bila diamati
dengan mikroskop. Disisi lain, bakteri gram positif akan berwarna ungu
(Madigan et al., 2006). Perbedaan keduanya didasarkan pada perbedaan struktur
dinding sel yang berbeda dan dapat dinyatakan oleh prosedur pewarnaan gram
Adapun gambar pewarnaan gram negatif dapat disajikan pada Gambar 2.
Gambar 2. Pewarnaan gram negatif (Cooper and Hausman, 2007).
Prosedur ini ditemukan pada tahun 1884 oleh ilmuwan Denmark bernama
Christian Gram dan merupakan prosedur penting dalam klasifikasi bakteri
(Singleton and Sainsbury, 2006). Bakteri gram positif seperti Staphylococcus
aureus (bakteri patogen yang umum pada manusia) hanya mempunyai membran
plasma tunggal yang dikelilingi dinding sel tebal berupa peptidoglikan. Sekitar
90% dari dinding sel tersebut tersusun atas peptidoglikan sedangkan sisanya
berupa molekul lain bernama asam teikhoat. Di sisi lain, bakteri gram negatif
(seperti Escherichia coli) memiliki sistem membran ganda di mana membran
plasmanya diselimuti oleh membran luar permeabel. Bakteri ini mempunyai
dinding sel tebal berupa peptidoglikan, yang terletak di antara membran dalam
dan membran luarnya.
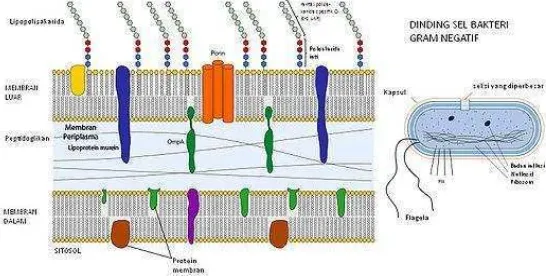
Banyak spesies bakteri gram negatif yang bersifat patogen, yang berarti mereka
berbahaya bagi organisme inang. Sifat patogen ini umumnya berkaitan dengan
komponen tertentu pada dinding sel gram negatif, terutama lipopolisakarida
14
Adapun gambar dinding sel bakteri gram negatif dapat disajikan pada Gambar 3.
Gambar 3. Dinding sel bakteri gram negatif (Prescott, 2002).
C.Metode Perhitungan Jumlah Bakteri
Ada beberapa macam cara untuk menghitung jumlah sel bakteri, antara lain
dengan lempeng total cawan (plate count), hitungan mikroskopik langsung (direct
microscopic count) atau MPN (Most Probable Number) (Fardiaz, 2000).
Penetapan jumlah bakteri dapat dilakukan dengan menghitung jumlah sel bakteri
yang mampu membentuk koloni di dalam media biakan atau membentuk suspensi
dalam larutan biak (Schlegel dan Schmidt, 2000).
Metode lempeng total cawan (plate count) adalah metode yang paling umum
digunakan untuk menentukan jumlah mikroba yang masih hidup berdasarkan
jumlah koloni yang tumbuh. Teknik ini di awali dengan pengenceran sampel
dengan kelipatan 1: 10. Masing-masing suspensi pengenceran ditanam dengan
metode cawan tuang (pour plate) atau cawan sebar (spread plate). Bakteri akan
18-24 jam. Metode ini dibantu dengan menggunakan alat, yaitu colony counter
(Berazandeh, 2008).
Colony counter adalah alat untuk menghitung jumlah koloni bakteri atau
mikroorganisme dalam cawan petri yang biasanya dilengkapi dengan pencatat
elektronik. Bakteri yang akan dihitung adalah bakteri yang masih hidup, dengan
melakukan pengeceran dari medium bakteri misalnya sampai 3 kali dalam tabung
reaksi. Kemudian bakteri ditanam dan diinkubasi, setelah itu dihitung koloni
yang tumbuh (Marasahi, 2011). Adapun gambar alat colony counter dapat
disajikan pada Gambar 4.
Gambar 4. Alat colony counter.
Perhitungan jumlah koloni bakteri dipermudah dengan adanya counter electronic.
Dengan adanya counter tersebut peneliti tinggal menandai koloni bakteri yang
dihitung dengan menggunakan pen yang terhubung dengan counter. Setiap koloni
yang ditandai maka counter akan menghitung (Asriyah, 2010).
Metode plate count ini terbagi menjadi dua yaitu, metode cawan tuang (pour
16
1. Metode pour plate
Metode pour plate (cawan tuang) adalah suatu teknik untuk menumbuhkan
mikroorganisme di dalam media agar dengan cara mencampurkan media agar
yang masih cair dengan stok kultur bakteri (agar) sehingga sel-sel tersebut
tersebar merata dan diam baik di permukaan agar atau di dalam agar (Harley and
Presscot, 2002).
Dalam metode ini diperlukan pengenceran sebelum ditumbuhkan pada medium
agar di dalam cawan petri. Setelah diinkubasi akan terbentuk koloni pada cawan
tersebut dalam jumlah yang dapat dihitung. Metode pour plate sangat mudah
dilakukan karena tidak membutuhkan keterampilan khusus dengan hasil biakan
yang cukup baik. Metode ini dilakukan dengan mengencerkan sumber isolat yang
telah diketahui beratnya ke dalam 9 mL garam fisiologis (NaCl 0,85%) atau
larutan buffer fosfat. Larutan ini berperan sebagi penyangga pH agar sel bakteri
tidak rusak akibat menurunnya pH lingkungan. Pengenceran dapat dilakukan
beberapa kali agar biakan yang didapatkan tidak terlalu padat atau memenuhi
cawan (biakan terlalu padat akan mengganggu pengamatan). Sekitar 1 ml
suspensi dituang ke dalam cawan petri steril, dilanjutkan dengan menuangkan
media penyubur (nutrien agar) steril hangat (40-50 ⁰C) kemudian ditutup rapat
dan diinkubasi selama 1-2 hari pada suhu 37 ⁰C. Penuangan dilakukan secara
aseptik atau dalam kondisi steril agar tidak terjadi kontaminasi atau tumbuh atau
masuknya organisme yang tidak diinginkan (di laboratorium, kontaminasi
Media yang dituang hendaknya tidak terlalu panas, karena selain mengganggu
proses penuangan (media panas sebabkan tangan jadi panas juga), media panas
masih mengeluarkan uap yang akan menempel pada cawan penutup, sehingga
mengganggu proses pengamatan. Pada metode ini, koloni akan tumbuh di dalam
media agar. Kultur diletakkan terbalik, dimasukkan di dalam plastik dengan
diikat kuat kemudian diletakkan dalam incubator.
Pada metode pour plate volume kultur sebanyak 0,1-1,0 mL diambil dan
dimasukkan ke dalam cawan petri steril. Kemudian ditambahkan media agar cair
dan dilakukan pencampuran antara kultur dan media dengan memutar cawan petri
secara pelan pada permukaan yang rata. Karena sampel dicampur dengan media
agar cair, maka volume kultur yang digunakan dapat lebih tinggi dibanding
dengan metode spread plate. Pada pengujian dengan metode pour plate,
kultur/sampel mikroba yang digunakan harus dapat bertahan hidup pada saat
media agar dengan suhu sekitar 45 ºC ditambahkan.
Keuntungan metode pour plate adalah sebagai berikut:
1. Hanya sel yang masih hidup yang dihitung
2. Beberapa jenis mikroba dapat dihitung sekaligus
3. Dapat digunakan untuk isolasi dan identifikasi mikroba karena koloni yang
terbentuk
4. Mungkin berasal dari satu sel mikroba dengan penambahan spesifik.
Kelemahan metode pour plate adalah sebagai berikut:
1. Hasil perhitungan tidak menunjukkan jumlah sel mikroba yang sebenarnya,
18
2. Medium dan kondisi yang berbeda mungkin menghasilkan nilai yang berbeda.
3. Mikroba yang ditumbuhkan harus dapat tumbuh pada medium padat dan
membentuk koloni yang kompak dan jelas, tidak menyebar.
4. Memerlukan persiapan dan waktu inkubasi beberapa hari sehingga
pertumbuhan koloni dapat dihitung (Asriyah, 2010).
2. Metode spread plate
Metode spread plate (cawan sebar) adalah suatu teknik di dalam menumbuhkan
mikroorganisme di dalam media agar dengan cara menuangkan stok kultur bakteri
di atas media agar yang telah memadat. Kelebihan teknik ini adalah
mikroorganisme yang tumbuh dapat tersebar merata pada bagian permukaan
media agar.
Pada metode cawan sebar sebanyak 0,1 mL suspensi bakteri yang telah
diencerkan (disebar pada media penyubur steril yang telah disiapkan.
Selanjutnya, suspensi dalam cawan diratakan dengan batang drugal agar koloni
tumbuh merata pada media dalam cawan tersebut, kemudian diletakkan dalam
inkubator (37 oC) selama 1-3 hari (Pradika, 2008).
Metode ini cukup sulit terutama saat meratakan suspensi dengan batang drugal,
untuk menumbuhkan koloni secara merata, biakan justru terkontaminasi. Oleh
karena itu, batang drugal harus benar-benar steril, yaitu dengan
mensemprotkannya terlebih oleh alkohol kemudian dipanaskan dengan api
bunsen. Perlu diingat, batang drugal, yang masih panas akibat pemanasan dengan
api bunsen, dapat merusak media agar, sehingga harus didinginkan terlebih dahulu
Di dalam penggunaan metode spread plate dan pour plate sangat penting jika
jumlah koloni yang tumbuh pada media agar tidak terlalu banyak. Hal ini
dikarenakan apabila pada cawan petri ditumbuhi koloni yang banyak, beberapa sel
tidak dalam bentuk koloni yang tunggal, sehingga dapat menyebabkan
perhitungan yang salah. Jumlah koloni yang sangat sedikit juga tidak diharapkan
karena secara statistik keakuratan hasil perhitungan jumlah koloni ini sangat
rendah. Dalam penerapannya, secara statistik yang paling baik adalah
menghitung jumlah koloni hanya jika pada media agar terdapat koloni antara
20
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Juni sampai Desember 2013 dengan tahapan
kegiatan, yaitu pengambilan sampel, isolasi dan identifikasi bakteri Escherichia
coli, serta analisis perhitungan jumlah bakteri menggunakan colony counter
dilakukan di Laboratorium Biomassa, Universitas Lampung.
B. Alat dan Bahan
Alat yang digunakan dalam penelitian ini, yaitu gelas kimia, gelas ukur, gelas
erlenmeyer, pipet tetes, spatula, tabung reaksi, tabung durham, jarum ose, cawan
petri, bunsen, mikroskop cahaya Carl Zeiss Axio imager A1, autoclave Hirayama
HV-25L, Laminar air flow Esco,incubator Memmer-Germany/INCO2, magnetic
stirer, neraca digital Wiggen Houser, mikropipet, dan colony counter Schuett
Biotec-De Count.
Adapun bahan-bahan yang digunakan adalah air di sekitar Laboratorium
Biomassa, bakteri Escherichia coli murni lisensi ATCC (American Type Culture
Lactosa Bile (BGLB), Eosin Methylen Blue (EMB), Lauryl Tryptose Broth (LTB),
Escherichia coli (Ec) Broth, Plate CountAgar (PCA), air salin, alkohol 70%,
spritus, larutan kristal violet, larutan iodin, etanol 95%, larutan safranin, akuades,
akuabidest, plastik wrab, alumunium foil, kertas label, kapas, dan tissue.
C. Prosedur Penelitian
1. Persiapan awal
Persiapan awal dilakukan dengan pengambilan sampel di tiga sumber air di sekitar
Laboratorium Biomassa Universitas Lampung. Selanjutnya dilakukan persiapan
alat dan bahan untuk pembuatan medium, lalu alat dan bahan (medium) tersebut
disterilisasi.
2. Teknik pengambilan sampel dan penanganan sampel
Adapun teknik pengambilan sampel (sampling) sebagai berikut:
Sampel diambil dari tiga sumber berbeda pada hari yang sama menggunakan botol
gelap steril, untuk lebih jelasnya dapat dilihat melalui skema pengambilan sampel
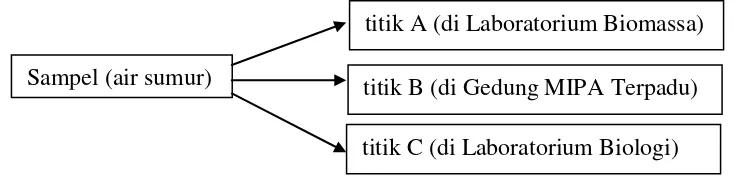
yang disajikan pada Gambar 5.
Gambar 5. Skema pengambilan sampel. Sampel (air sumur)
titik A (di Laboratorium Biomassa)
titik B (di Gedung MIPA Terpadu)
22
Sampel diambil melalui kran yang terhubung secara langsung dengan sumber air,
dengan memilih kran yang sering digunakan. Kemudian ujung kran dan bagian
dalamnya dibakar dengan nyala api bunsen selama sekitar 5 menit. Lalu air
dibiarkan keluar dari kran dengan debit tinggi selama satu menit. Kemudian botol
gelap yang pertama diisi dengan sampel air kran sebanyak 100 mL, dan dilakukan
cara yang sama sampai kelima botol terisi semua. Teknik sampling pada kedua
sumber air lainnya dilakukan dengan cara yang sama. Kemudian kelima sampel
tersebut dicampurkan ke dalam media spesifik untuk diisolasi dan diidentifikasi
bakteri Escherichia coli, serta dianalisis menggunakan colony counter untuk
mengetahui jumlah bakteri. Sampling diulangi sebanyak dua kali dengan cara
yang sama dan setiap pengulangan dilakukan 1 bulan setelah pengambilan sampel
sebelumnya.
3. Isolasi bakteri Escherichia coli 3.1 Uji pendugaan Coliform
Sebanyak 7 gLTB dilarutkan dalam 200 mL akuades dan dihomogenkan
menggunakan magnetic stirer, kemudian disterilisasi dengan autoclave selama 15
menit pada suhu 121 C. Setelah tahap pembuatan media LTB dilakukan,
selanjutnya disiapkan pengenceran 10-1 dengan cara menambahkan 1 mL sampel
ke dalam 9 mL air salin dan diencerkan sampai 10-3. Kemudian sebanyak 1 mL
sampel dari setiap pengenceran dimasukkan ke dalam tabung reaksi yang berisi 9
mL LTB dan tabung durham yang letaknya terbalik. Lalu tabung-tabung tersebut
diinkubasi selama 48 jam pada suhu 35 oC. Uji positif ditandai dengan kekeruhan
Tabung durham ini merupakan tabung yang bentuknya mirip seperti tabung reaksi
namun ukuran dan diameternya lebih kecil dan berfungsi untuk menampung atau
menjebak gas yang terbentuk akibat metabolisme oleh bakteri yang diujikan.
3.2 Uji penegasan Coliform
Sebanyak 13,2 gBGLBdilarutkan dalam 330 mL akuades dengan bantuan
magnetic stirer, lalu disterilisasi dengan autoclave. Kemudian diambil 1 ose dari
tabung-tabung LTB yang positif lalu diinokulasi ke dalam tabung-tabung reaksi
yang berisi media BGLB dan tabung durham yang diletakkan terbalik. Setelah itu
tabung-tabung reaksi tersebut diinkubasi selama 48 jam pada suhu 35 oC. Uji
positif ditandai dengan terjadinya kekeruhan pada media dan terbentuk gas di
dalam tabung durham.
3.3 Uji Pendugaan Escherichia coli
Sebanyak 12,6 g media Ec dilarutkan dalam 340 mL akuades dengan bantuan
magnetic stirer, lalu disterilisasi dengan autoclave. Kemudian diambil 1 ose dari
tabung-tabung berisi media BGLB yang positif, lalu diinokulasikan ke dalam
tabung-tabung reaksi berisi media Ec yang dilengkapi dengan tabung durham
dalam posisi terbalik. Tabung-tabung tersebut diinkubasi selama 48 jam pada
suhu 45 oC. Uji positif ditandai dengan terjadinya kekeruhan pada media dan
terbentuk gas di dalam tabung durham.
3.4 Uji Penegasan Escherichia coli
Media EMB ditimbang sebanyak 3,75 g, lalu dilarutkan dalam akuades sebanyak
100 mL dengan bantuan magnetic stirrer dan disterilisasi dengan autoclave. Dari
24
untuk selanjutnya dilakukan pengenceran kembali sampai faktor pengenceran
10-4. Kemudian pada dua pengenceran terakhir, diambil sebanyak 100 µL, lalu
ditanamkan ke media EMB secara pour plate (cawan tuang), dan diinkubasi
selama 48 jam pada suhu 35 ºC. Hasil uji positif untuk Escherichia coli ditandai
dengan terbentuknya koloni hitam atau hijau metalik pada bagian tengah media.
Setiap uji pada isolasi bakteri Escherichia coli menggunakan kontrol negatif dan
kontrol positif. Kontrol negatif yang digunakan yaitu akuabides steril, sedangkan
kontrol positif yang digunakan yaitu bakteri Escherichia coli murni lisensi ATCC
(American Type Culture Collection) Remel Culti-Loop di bawah naungan Remel
Inc USA. Masing-masing kontrol tersebut diberi perlakuan yang sama seperti
pada sampel.
4. Identifikasi Bakteri Escherichia coli
Identifikasi dilakukan berdasarkan hasil pengujian dari uji morfologi secara
makroskopis dan mikroskopis. Adapun tahap-tahap dan prosedur kerja dari uji
morfologi adalah sebagai berikut
4.1 UjiMarkroskopis
Uji morfologi secara makroskopis, dilakukan dengan mengamati koloni yang
tumbuh pada media EMB secara langsung tanpa bantuan mikroskop. Pengamatan
yang dilakukan adalah melihat ciri–ciri yang spesifik dari bakteri Escherichia coli,
4.2 Uji Mikroskopis
Sebanyak 2,35 g Nutrien Agar (NA)dilarutkan dalam 100 mL akuades dengan
bantuan magnetic stirrer dan disterilisasi dengan autoclave. Kemudian diambil 1
ose dari media EMB dan digoreskan ke media NA miring. Setelah itu media NA
diinkubasi selama 24 jam pada suhu 37 oC. Selanjutnya dilakukan uji morfologi
secara mikroskopik dengan melakukan pewarnaan gram dari setiap koloni
Escherichia coli yangterduga.
Prosedur Pewarnaan Gram
Kultur bakteri dari media NA yang telah diinkubasi selama 24 jam selanjutnya
dioleskan setipis mungkin pada object glass dan diberi setetes air steril untuk
membantu menyebarkan bakteri secara merata pada object glass. Setelah itu
olesan bakteri dibiarkan mengering dan difiksasi di atas api bunsen, lalu ditutup
dengan cover glass. Kemudian ditambahkan kristal violet, dibiarkan selama 1
menit, dan dicuci dengan air mengalir. Lalu ditambahkan dengan larutan iodin
dan dibiarkan terendam selama 1 menit. Selanjutnya dilakukan dekolorisasi
(penghilangan warna) dengan menggunakan alkohol 95 % hingga seluruh warna
biru menghilang (kira-kira 30 detik). Setelah itu ditambahkan larutan safranin
selama 1 menit, lalu dicuci kembali dengan air mengalir dan dikeringkan.
Kemudian diamati di bawah mikroskop cahaya. Jika penampakan sel berwarna
ungu, maka bakteri bersifat gram positif, tetapi jika berwarna merah bersifat gram
26
5. Analisis perhitungan jumlah bakteri dengan colony counter
Perhitungan jumlah bakteri dengan colony counter dilakukan menggunakan
metode Plate Count. Sampel yang digunakan adalah sampel yang telah diuji
penegasan Escherichia coli. Setelah itu koloni bakteri ditandai menggunakan pen
yang terhubung pada alat colony counter. Jumlah koloni dalam sampel dapat
dihitung sel relatifnya (CFU/mL) dengan rumus berikut:
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil penelitian yang telah dilakukan, dapat ditarik simpulan sebagai
berikut.
1. Hasil uji air sumur bor di sekitar Laboratorium Biomassa Universitas
Lampung pada sampel A, B, dan C menunjukan bahwa positif
mengandung bakteri Escherichia coli, dengan jumlah bakteri paling
banyak terdapat pada sampel B dengan jumlah rata-rata sebanyak 54,8
koloni, sedangkan jumlah rata-rata pada sampel A sebanyak 33,6 koloni
dan pada sampel C sebanyak 52,6 koloni.
2. Kualitas air sumur bor yang berasal dari sumber air di Titik A
(Laboratorium Biomassa) tergolong baik, sedangkan sumber air di titik B
(Gedung MIPA Terpadu) dan Titik C (Laboratorium Biokimia) tergolong
kurang baik. Meskipun demikian, sampel B dan C masih layak digunakan
karena jumlah koloni bakteri Escherichia coli yang terdapat di dalam
sampel kurang dari 60 koloni, dimana jumlah ini hanya sedikit melebihi
39
B. Saran
Dari hasil penelitian yang diperoleh, maka untuk penelitian selanjutnya
disarankan untuk dilakukan analisis dengan pengulangan lebih banyak pada uji
bakteri Escherichia coli menggunakan colony counter agar data yang diperoleh
DAFTAR PUSTAKA
Achmad, R. 2004. Kimia LingkunganEdisi 1. Yogyakarta. Andi Offset, pp 15-16
Asriyah. 2010. Hitung Jumlah Bakteri Metode Pour Plate.
http://nanaasriyah.blogspot.com/hitung-jumlah-bakteri-metode-pour-plate/, diakses pada tanggal 7 Maret 2013.
Berazandeh, N. 2008. MicrobiologiTitles. Jerman. Springer. Verlag Berlin Heidelberg Media. pp 9-11.
Cooper, G.M. and R. E. Hausman. 2007. An overview of cells and cell research.
In The cell: A molecular Approach (4th Edition). Washington D.C. ASM Press, pp 3-42.
Dwee, P. 2010. Bakteri Coliform Fekal.
http://www.bangkoyoy.com/2010/10/bakteri-coliform-fekal-coliform/, diakses pada tanggal 7 Maret 2013.
Effendi, H. 2003. Peranan Air Bagi Kehidupan. Jakarta. Gramedia.
Fardiez, S. 2000. Mikrobiologi Pangan I. Jakarta. Gramedia.
Harley and Presscot. 2002. Laboratory Exercise in Microbiology. USA. McGraw-Hill Publisher, pp 116.
Irianto, K. 2007. Mikrobiologi Menguak Dunia Organisme Jilid 1. Bandung. CV Yrama Widya
Karsidi. 2000. Hubungan antara Tingkat Pendidikan dan Pendapatan dengan Penggunaan Air Sungai oleh Penduduk di Sekitar Sungai Kali Jajar Demak. Skripsi. Universitas Diponogoro. Semarang.
Kusnaedi. 2004. Mengolah Air Gambut dan Air Kotor Untuk Air Minum. Jakarta. Swadaya.
41
Marasahi. 2011. Pengenalan Alat Mikrobiologi Dasar.
http://Sarifmahasari.wordpress.com/ pengenalan-alat-mikrobiologi-dasar/, diakses pada tanggal 7 Maret 2013.
Maulana, M. 2010. Makalah Mikrobiologi Coliform dan Pengaruhnya. Sekolah Tinggi Ilmu Kesehatan Surya Global. Yogyakarta.
Notoadmojo. 2003. Metode Penelitian Kesehatan. Jakarta. Rhineka Cipta.
Pelczar, M.J. dan E.C.S. Chan. 2006. Dasar-Dasar Mikrobiologi Jilid 2. Jakarta. UI Press.
Pitojo, S. dan E. Purwantoyo. 2003. Deteksi Pencemar Air Minum. Ungaran. Aneka Ilmu.
Pradika, E.I. 2008. Isolasi Mikroorganisme.
http://ekmon-saurus.blogspot.com/ 2008/ II/ bab-4-isolasi-mikroorganisme/, diakses pada tanggal 7 maret 2013.
Prescott, L.M. 2002. Prescott-Harley-Klein: Microbiology 5th Edition. USA: The McGrawth-Hill Companies.
Risky, B T., B. Polii, S. Sinolungan. 2013. Analisis Kualitatif Kandungan
Escherichia coli dan Coliform pada 3 Depot Air Minum Isi Ulang di Kota Manado. Skripsi. Fakultas Kesehatan Masyarakat Universitas Sam
Ratulangi. Sulawesi Utara.
Ruth, M. 2009. Escherichia coli Dalam Kehidupan Manusia. Journal BioTrends
Vol 4(1), pp 12.
Schlegel, H.G. dan K. Schmidt. 2000. Mikrobiologi Umum. Yogyakarta. Gajah Mada University Press.
Singleton, P. and D. Sainsbury. 2006. Dictionary of Microbiology and Molecular Biology3rd Edition. England: John Wiley and Sons. Ltd.
Slamet, J. S. 2002. Kesehatan Lingkungan. Yogyakarta. Gajah Mada University Press, pp 85-112.
Suryani. 2004. Lingkungan, Sumberdaya Alam dan Lingkungan. BPFE. Yogyakarta.
Suparmin. 2000. Studi Air Tanah Bebas Untuk Air Minum Penduduk di Kelurahan Plarangan Kecamatan Karanganyar Kabupaten Kebumen.
Widiyanti, N.L.P.M. dan N.P. Ristanti. 2004. Analisis Kualitatif Bakteri
Coliform pada Depo Air Minum isi ulang di kota Singaraja Bali. Jurnal Ekologi Kesehatan. Vol 3(1), pp 64-73.
Wirahadikusumah, M. 1985.Biokimia Metabolisme Energi, Karbohidrat, Dan Lipid. ITB. Bandung, pp 45.
Yulianti, O. N. 2009. Kajian Aktivitas Dan Antimikroba Ekstrak Biji, Kulit Buah, Batang, Dan Daun Tanaman Jarak Pagar. Skripsi. Fakultas Teknologi Pertanian IPB. Bogor.