glabra
) SEBAGAI POTENSI ANTIKANKER
WAHYU HENDANA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Toksisitas Akut Ekstrak Daun Sirsak Ratu (Annona muricata) dan Sirsak Hutan (Annona glabra) sebagai Potensi Antikanker adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2012
Wahyu Hendana
ABSTRAK
WAHYU HENDANA. Toksisitas Akut Ekstrak Daun Sirsak Ratu (Annona muricata) dan Sirsak Hutan (A. glabra) sebagai Antikanker Potensial. Dibimbing oleh GUSTINI SYAHBIRIN.
Tanaman sirsak diketahui memiliki aktivitas farmakologi seperti antikanker. Spesies sirsak yang cukup banyak terdapat di Indonesia adalah sirsak ratu (Annona muricata) dan sirsak hutan (A. glabra). Penelitian ini berhasil menentukan sifat toksisitas ekstrak daun kedua spesies ini terhadap larva udang dan embrio ikan zebra. Ekstrak sirsak hutan secara keseluruhan menghasilkan toksisitas paling tinggi. Nilai LC50 terbaik diberikan oleh ekstrak heksana daun
sirsak hutan, yaitu 197 µg/mL terhadap larva udang dan 326 µg/mL terhadap embrio ikan zebra. Nilai ini sudah menunjukkan korelasi yang signifikan sebagai senyawa antikanker. Ekstrak ini menghasilkan 8 noda pada pemisahan dengan kromatografi lapis tipis. Pengukuran 1H-NMR terhadap 2 noda yang terpisah dengan baik belum menunjukkan kandungan asetogenin yang telah dilaporkan sebagai komponen antikanker pada tanaman sirsak. Diperlukan fraksionasi lebih lanjut pada ekstrak untuk menentukan struktur senyawa aktif antikanker di dalamnya.
Kata kunci: Annona glabra, Annona muricata, daun sirsak, uji ikan zebra, uji letalitas larva udang
ABSTRACT
WAHYU HENDANA. Acute Toxicity of Leaf Extracts from Soursop (Annona muricata) and Pond Apple (A. glabra) as Potential Anticancer. Supervised by GUSTINI SYAHBIRIN.
Soursop plants has been known to have pharmacological activities such as anticancer. Soursop species that are widely found in Indonesia are soursop (Annona muricata) and pond apple (A. glabra). This study has determined the
toxicity properties of leaf extracts of these species to brine shrimps larvae and zebra fish embryos. Overall, the pond apple extract showed higher toxicity then the soursop. The best LC50 values were obtained from hexane extract of pond apple
leaves, namely 197 µg/mL to brine shrimps larvae and 326 µg/mL to zebra fish embryo. These values indicate a significant correlation as anticancer compounds. This extract of pond apple resulted 8 spots in separation by using thin layer chromatography. 1H-NMR measurement towards these 2 well-separated spot did not show acetogenin component, as previously reported as the anticancer components in soursop plants. Further fractionation of the extract is needed to ensure the structure of the anticancer active component it contained.
TOKSISITAS AKUT EKSTRAK DAUN SIRSAK RATU
(
Annona muricata
) DAN SIRSAK HUTAN (
Annona
glabra
) SEBAGAI POTENSI ANTIKANKER
WAHYU HENDANA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Toksisitas Akut Ekstrak Daun Sirsak Ratu (Annona muricata) dan Sirsak Hutan (Annona glabra) sebagai Potensi Antikanker
Nama : Wahyu Hendana NIM : G44060953
Disetujui oleh
Dr Gustini Syahbirin, MS Pembimbing
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas berkat limpahan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Toksisitas Akut Ekstrak Daun Sirsak Ratu (Annona muricata) dan Sirsak Hutan (Annona glabra) sebagai Potensi Antikanker. Shalawat serta salam semoga selalu tercurahkan kepada junjungan Nabi Muhammad SAW yang telah membimbing umatnya hingga akhir zaman. Penelitian ini bertujuan menganalisis potensi ekstrak kasar daun sirsak sebagai potensi antikanker. Penelitian dilaksanakan sejak Maret 2011 sampai Mei 2012 di Laboratorium Kimia Organik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Embriologi, Departemen Anatomi, Fisiologi, dan Farmakologi, Fakultas Kedokteran Hewan.
Penghargaan luar biasa penulis berikan kepada kedua orang tua dan keluarga penulis yang selalu memberi motivasi dan kasih sayang kepada penulis. Ucapan terima kasih penulis sampaikan kepada Ibu Dr Gustini Syahbirin, MS selaku pembimbing dan Bapak Novriyandi Hanif, DSc yang senantiasa memberikan arahan, dorongan semangat, dan doa kepada penulis selama melaksanakan penelitian. Penulis juga mengucapkan terima kasih kepada seluruh staf Laboratorium Kimia Organik, Bapak Budi Arifin MSi, Bapak drh. Kusdiantoro Muhamad, MSi, Kak Steven Gunawan dan Astari Wendarningtyas atas bantuan serta masukan selama penelitian berlangsung. Apresiasi penulis berikan kepada Mas Ryan dan Shiddiq (STK 43) atas bantuannya dalam pengolahan data penulis. Salam hangat penulis ucapkan kepada teman seperjuangan, Ridho Putrotomo, Indra Sugiarto, dan Lia Anggraini. Salam semangat untuk Livia, Fijar, Dwi Utami, Dwi Artha, Laras, Rina, Indra, Lita, dan keluarga besar Kimia atas doa, kasih sayang, motivasi, serta segala dukungan yang telah kalian berikan.
Atas segala khilaf dan kekurangan, semoga dapat dibukakan pintu maaf yang sebesar-besarnya. Penulis berharap karya ilmiah ini dapat bermanfaat bagi semua pihak juga perkembangan ilmu pengetahuan.
November 2012
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
BAHAN DAN METODE 3
Alat dan Bahan 3
Lingkup Kerja 3
Penentuan Kadar Air 3
Ekstraksi Daun Sirsak 3
Partisi Ekstrak Etanol Daun Sirsak 4
Uji Toksisitas In Vitro Ekstrak Terhadap A. salina 4 Uji Toksisitas In Vivo Ekstrak terhadap Embrio Ikan Zebra 5
Fraksionasi Ekstrak Teraktif 5
Pemisahan dan Pengukuran NMR Ekstrak Teraktif 5
HASIL DAN PEMBAHASAN 6
Kadar Air 6
Rendemen Ekstrak 6
Toksisitas In Vitro Terhadap Larva Udang 7 Toksisitas In Vitro Terhadap Embrio Ikan Zebra 8 Hasil Pengamatan Embrio Ikan Zebra secara In Vivo 8 Hasil Fraksionasi dan Pengukuran NMR Ekstrak Teraktif 12
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR GAMBAR
1 Salah satu struktur asetogenin 1
2 Sirsak ratu (A. muricata) 1
3 Sirsak hutan (A. glabra) 2
4 Embrio ikan zebra (D. rerio) 2
5 Nilai LC50 uji toksisitas terhadap A. salina 7
6 Nilai LC50 uji toksisitas terhadap ikan zebra 8
7 Foto embrio ikan zebra 9
8 Profil kromatogram ekstrak heksana sirsak hutan 13
9 Spektrum 1H-NMR noda e 14
10 Spektrum 1H-NMR noda h 14
DAFTAR LAMPIRAN
1 Diagram alir penelitian 18
2 Kadar air dan rendemen daun sirsak 19
3 Hasil uji toksisitas BSLT ekstrak heksana sirsak ratu dan hutan 20 4 Hasil uji toksisitas BSLT ekstrak etanol sirsak ratu dan hutan 21 5 Hasil uji toksisitas BSLT ekstrak etil asetat sirsak ratu dan hutan 22 6 Hasil uji toksisitas BSLT ekstrak air sirsak ratu dan hutan 23 7 Hasil uji toksisitas ikan zebra ekstrak heksana sirsak ratu dan hutan 24 8 Hasil uji toksisitas ikan zebra ekstrak etanol sirsak ratu dan hutan 25 9 Hasil uji toksisitas ikan zebra ekstrak etil asetat sirsak ratu dan hutan 26 10 Hasil pengamatan embrio ikan zebra ekstrak heksana daun sirsak ratu 27 11 Hasil pengamatan embrio ikan zebra ekstrak heksana daun sirsak hutan 28 12 Nilai Fhitung pengamatan embrio ikan zebra 29
PENDAHULUAN
Tanaman sirsak termasuk famili Annonaceae dan memiliki aktivitas farmakologi seperti antikanker. Secara umum tanaman famili Annonaceae dapat dibedakan dari bentuk buahnya. McLaughlin (2008) melaporkan bahwa tanaman famili Annonaceae mengandung banyak senyawa asetogenin, di antaranya ditunjukkan pada Gambar 1. Asetogenin merupakan senyawa metabolit sekunder yang secara alami terbentuk dalam tumbuhan, yang secara spesifik menyerang sel kanker tanpa memengaruhi sel normal pada makhluk hidup.
Gambar 1 Salah satu struktur asetogenin
Sirsak ratu (Annona muricata) (Gambar 2) merupakan jenis tanaman sirsak yang lebih dulu diteliti. Wu et al. (1995a dan 1995b), Zeng et al. (1996), dan Kim
et al. (1998) meneliti bagian daun, sementara Rieser et al. (1996), Li et al. (2000), Chang dan Wu (2001) meneliti bagian biji. Gleye et al. (1998 dan 2000) meneliti bagian akar. Akan tetapi, jenis tanaman sirsak ini sulit diperoleh dalam jumlah yang banyak di Indonesia.
Gambar 2 Sirsak ratu (A. muricata)
Gambar 3 Sirsak hutan (A. glabra)
Metode uji letalitas larva udang (BSLT) telah banyak digunakan sebagai metode pendahuluan untuk mengetahui toksisitas suatu bahan. Hasil uji toksisitas dengan metode ini telah terbukti memiliki korelasi dengan daya sitotoksik senyawa antikanker. Selain itu, metode ini juga mudah dikerjakan, murah, cepat, dan cukup akurat (Colegate dan Molyneux 2008).
Embrio ikan zebra (Danio rerio) (Gambar 4) secara in vivo juga dapat digunakan dalam pengujian awal terhadap aktivitas antikanker pada suatu bahan. Hasil uji toksisitas pada embrio ikan zebra telah terbukti memiliki korelasi positif dengan hasil uji toksisitas pada mamalia (Ma et al. 2007). Pengujian senyawa antikanker secara in vivo pada embrio ikan zebra juga telah dilakukan oleh Berghmans et al. (2005), Moore et al. (2006), Hsu et al. (2007), dan Nicoli dan Presta (2007). Menurut Berghmans et al. (2005), ikan zebra telah dikembangkan sebagai hewan uji dalam penelitian terhadap penyakit manusia, untuk memperoleh obat-obatan baru dari senyawa bahan alam.
Gambar 4 Embrio ikan zebra (D. rerio)
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan selama penelitian ini adalah alat kaca yang umum digunakan di laboratorium, mikropipet, neraca analitik, oven, penguap putar, pengering beku, multiwell, stereomikroskop yang dilengkapi dengan kamera digital di Laboratorium Embriologi Fakultas Kedokteran Hewan, IPB dan spektrometer VNMRS frekuensi 500 MHz (1H) untuk mengukur resonans magnet inti (NMR) di Laboratorium NMR, Gedung Basic Science A, ITB Bandung.
Bahan-bahan yang digunakan selama penelitian ini adalah daun sirsak hutan yang berasal dari Laboratorium Agronomi IPB Leuwikopo, daun sirsak ratu yang berasal dari daerah Sukabumi, etanol 80%, etil asetat, aseton, n-heksana, dimetil sulfoksida (DMSO), CDCl3, silika gel 60 F254 untuk kromatografi lapis tipis
(KLT), larva A. salina Leach, dan embrio ikan zebra yang didapat dari peternak ikan di daerah Cikaret.
Lingkup Kerja
Metode penelitian dilakukan mengikuti diagram alir pada Lampiran 1. Tahapannya meliputi penyiapan sampel daun sirsak, penentuan kadar air, ekstraksi daun sirsak, partisi ekstrak etanol daun sirsak, pengujian toksisitas, dan pencirian senyawa bioaktif.
Penentuan Kadar Air
Cawan porselen dikeringkan di dalam oven bersuhu 105 °C selama 60 menit. Selanjutnya cawan didinginkan dalam eksikator selama 30 menit dan ditimbang bobot kosongnya. Sebanyak 3 g sampel dimasukkan ke dalam cawan dan dikeringkan di dalam oven selama 24 jam pada suhu 105 °C. Setelah itu, cawan didinginkan dalam eksikator sekitar 30 menit dan ditimbang kembali. Pemanasan dilakukan sampai diperoleh bobot konstan. Penentuan kadar air dilakukan sebanyak 3 kali ulangan (triplo) (AOAC 1984).
Kadar air (%) = − ×100%
A B A
Keterangan:
A = bobot bahan sebelum dikeringkan (g)
B = bobot bahan setelah dikeringkan (g)
Ekstraksi Daun Sirsak
diperoleh ditimbang dan dihitung rendemennya dengan persamaan sebagai berikut:
Rendemen ekstrak = a
(1 − kadar air)b×100%
Keterangan:
a = bobot ekstrak (g)
b = bobot contoh awal (g)
Partisi Ekstrak Etanol Daun Sirsak
Partisi dengan heksana 1:1 berdasarkan volume terhadap ekstrak etanol dilakukan untuk mengambil fraksi nonpolar sehingga didapat fraksi polar dan nonpolar (ekstrak heksana). Penambahan heksana dilakukan beberapa kali hingga fraksi nonpolar tidak berwarna. Kedua fraksi dipekatkan dengan penguap putar. Fraksi polar pekat kemudian dilarutkan dengan 200 mL air dan dimasukkan ke dalam corong pisah. Setelah itu, diekstraksi menggunakan etil asetat dengan nisbah air-etil asetat 1:3 dan didapat fraksi polar (ekstrak air) dan semipolar (ekstrak etil asetat). Penambahan etil asetat dilakukan beberapa kali sampai fraksi semipolar tidak berwarna. Kedua fraksi dipisahkan, masing-masing dipekatkan dengan penguap putar dan dikeringbekukan.
Uji Toksisitas In Vitro Ekstrak Terhadap A. salina
Penetasan Telur A. salina
Telur A. salina yang sudah siap ditetaskan ditimbang sebanyak 0.5 g kemudian dimasukkan ke dalam wadah yang berisi air laut yang sudah disaring dan diaerasi. Telur dibiarkan selama 48 jam di bawah pencahayaan lampu agar menetas sempurna. Telur yang telah menetas menjadi larva digunakan untuk uji toksisitas.
Uji Toksisitas terhadap A. salina
Larutan standar ekstrak etanol, ekstrak heksana, ekstrak etil asetat, dan ekstrak air dibuat dalam konsentrasi 5000 µg/mL kemudian diencerkan dengan air laut hingga diperoleh konsentrasi 100, 500, 1000, 1500, dan 2000 µg/mL. Apabila ekstrak tidak larut ditambahkan DMSO. Ke dalam multiwell dimasukkan 400 μL air laut, 10 ekor larva udang dalam 600 μL air laut, dan 1 mL ekstrak. Ulangan dilakukan sebanyak 4 kali. Multiwell ditutup dengan aluminium foil dan diinkubasi selama 24 jam. Nilai konsentrasi letal 50% (LC50) ditentukan dengan
Uji Toksisitas In Vivo Ekstrak terhadap Embrio Ikan Zebra (Heiden et al. 2007, Wei et al. 2010, dan Coelho et al. 2011)
Uji Toksisitas
Larutan standar ekstrak etanol, ekstrak heksana, ekstrak etil asetat, dan ekstrak air dibuat dalam konsentrasi 5000 µg/mL kemudian diencerkan hingga diperoleh konsentrasi 100, 500, 1000, 1500, dan 2000 µg/mL. DMSO ditambahkan apabila ekstrak tidak larut. Sebanyak 10 telur ikan zebra dalam 1 mL air tawar dan 1 mL ekstrak dimasukkan ke dalam multiwell. Ulangan dilakukan sebanyak 4 kali. Multiwell ditutup dengan aluminium foil dan diinkubasi selama 24 jam. Nilai LC50 ditentukan dengan menggunakan kurva hubungan logaritma
konsentrasi ekstrak (sumbu x) dengan rerata persen kematian larva udang (sumbu
y).
Pengamatan Embrio Ikan Zebra
Embrio ikan zebra yang telah terpapar oleh ekstrak aktif selama 24 jam diamati morfologinya yaitu pigmentasi, panjang tubuh, diameter embrio (jika embrio tidak menetas), kepala, mata, jantung, kantung kuning telur, dan ekor dengan menggunakan stereomikroskop.
Fraksionasi Ekstrak Teraktif
Ekstrak teraktif daun sirsak ditotolkan pada pelat KLT. Setelah kering, langsung dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Elusi tahap pertama dilakukan dengan eluen tunggal etil asetat, kloroform, dan n-heksana. Noda yang dihasilkan dari proses elusi masing-masing eluen diamati di bawah lampu ultraviolet (UV) pada panjang gelombang 254 nm. Eluen terbaik ialah yang menghasilkan noda terbanyak dan terpisah dengan baik. Jika lebih dari 1 eluen menghasilkan noda terbanyak dan terpisah baik, maka eluen-eluen tersebut dicampurkan dengan nisbah tertentu hingga diperoleh campuran eluen terbaik (Houghton dan Raman 1998).
Pemisahan dan Pengukuran NMR Ekstrak Teraktif
HASIL DAN PEMBAHASAN
Kadar Air
Penyimpanan contoh dalam jangka waktu lama menjadi masalah tersendiri jika sifat contoh tersebut tidak diketahui. Menurut Winarno (1995), contoh dapat disimpan dalam jangka waktu lama apabila kadar airnya kurang dari 10%. Selain itu, kadar air juga digunakan sebagai faktor koreksi dalam perhitungan rendemen ekstrak (Harborne 1987). Pemanasan pada suhu 105 ⁰C dapat menghilangkan air yang terikat secara fisik pada daun sirsak (Harjadi 1986). Kadar air daun sirsak ratu diperoleh sebesar 8.61% dan daun sirsak hutan 7.10% (Lampiran 2). Kadar air keduanya kurang dari 10% sehingga dapat disimpan dalam jangka panjang.
Rendemen Ekstrak
Daun sirsak ratu dan sirsak hutan diekstraksi dengan 4 pelarut berbeda kepolaran, mulai dari yang paling polar ialah air, etanol, etil asetat, dan heksana. Daun sirsak terlebih dahulu diekstraksi dengan pelarut etanol karena pelarut tersebut dapat mengekstraksi senyawa polar dan nonpolar dengan baik (Harbone 1987). Wu et al. (1995), Zeng et al. (1996), dan Kim et al. (1998) juga menggunakan pelarut etanol untuk ekstraksi sampel sirsak ratu. Rendemen ekstrak etanol yang didapat sebesar 5.91% untuk sirsak ratu dan 3.98% untuk sirsak hutan (Tabel).
Tabel Rendemen ekstrak daun sirsak
Bahan
Partisi dengan pelarut heksana ke dalam ekstrak etanol bertujuan memisahkan komponen nonpolar dalam etanol ke dalam heksana. Rendemen yang didapat sebesar 1.94 dan 1.93% untuk sirsak ratu dan hutan (Tabel). Tahap selanjutnya, ekstrak polar (etanol) dilarutkan dengan air dan diekstraksi dengan etil asetat untuk memisahkan komponen semipolar yang terdapat dalam ekstrak polar. Colegate dan Molyneux (2008) menyatakan bahwa ekstrak metanol atau etanol dari contoh segar dapat dipartisi kembali dengan etil asetat untuk memisahkan komponen semipolar dari fraksi air. Rendemen ekstrak etil asetat sirsak ratu dan hutan sebesar 0.49 dan 1.85%, sedangkan untuk ekstrak air berturut-turut 3.47 dan 0.19%.
Toksisitas In Vitro Terhadap Larva Udang
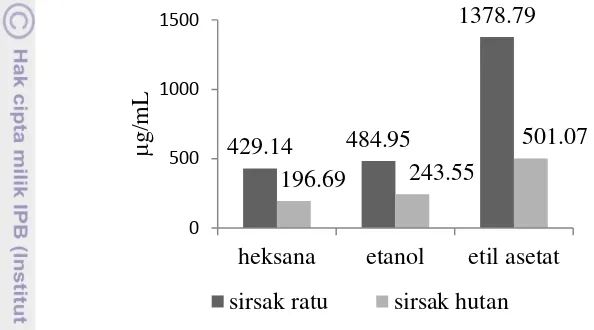
Data nilai LC50 dengan metode BSLT (Gambar 5) menunjukkan bahwa
daun sirsak hutan lebih toksik daripada daun sirsak ratu. Ketiga ekstrak dari daun sirsak hutan memiliki nilai LC50 yang lebih rendah daripada sirsak ratu, yang
mengindikasikan bahwa ekstrak tersebut lebih toksik. Urutan tingkat toksisitas daun sirsak hutan ialah ekstrak heksana > etanol > etil asetat. Hal yang sama juga dijumpai pada daun sirsak ratu.
Gambar 5 Nilai LC50 uji toksisitas terhadap A. salina
Ekstrak heksana untuk kedua jenis sirsak mempunyai nilai LC50 lebih
rendah dibandingkan dengan ekstrak etanol dan etil asetat. Ekstrak heksana sirsak ratu memiliki nilai LC50 429.14 µg/mL (r2 = 0.9225) dan ekstrak heksana sirsak
hutan memiliki nilai LC50 196.69 µg/mL (r2 = 0.9548) (Lampiran 3). Nilai ini
cukup sebanding dengan hasil penelitian Rieser et al. (1996) dan Zeng et al.
(1996) yang mendapatkan nilai LC50 untuk ekstrak kasar teraktif daun sirsak ratu
berada di bawah 250 mg/L.
Ekstrak heksana selain mengandung lemak juga mengandung sebagian besar komponen organik nonpolar. Senyawa asetogenin dalam daun juga dapat terekstraksi ke dalam fase heksana. Sifat toksik senyawa metabolit sekunder ini diduga menyebabkan ekstrak heksana mempunyai nilai LC50 lebih rendah.
Ekstrak etanol sirsak ratu dan sirsak hutan memiliki nilai LC50
masing-masing 484.95 µg/mL (r2 = 0.9996) dan 243.55 µg/mL (r2 = 0.94374) (Lampiran 4). Dalam penelitian sebelumnya, Zeng et al. (1996) mendapatkan nilai LC50
ekstrak etanol daun sirsak ratu sebesar 30.5 µg/mL, lebih kecil dibandingkan dengan hasil penelitian ini.
Ekstrak etil asetat sirsak ratu dan sirsak hutan memiliki toksisitas paling rendah dibandingkan dengan kedua ekstrak lainnya. Nilai LC50 berturut-turut
sebesar 1378.79 µg/mL (r2 = 0.8099) dan 501.07 µg/mL (r2 = 0.9999) (Lampiran 5). Ekstrak air sirsak ratu dan sirsak hutan tidak dapat ditentukan nilai LC50-nya
karena ekstrak ini tidak mampu mematikan larva udang yang diujikan (Lampiran 6).
Berdasarkan AOAC (2002), nilai koefisien korelasi (r2) yang baik adalah lebih besar atau sama dengan 0.9900. Meskipun uji toksisitas BSLT tidak spesifik
untuk antikanker, hasil uji senyawa antikanker telah dilaporkan menunjukkan korelasi yang signifikan dengan kematian larva udang (Mukhtar et al. 2007).
Toksisitas In Vitro Terhadap Embrio Ikan Zebra
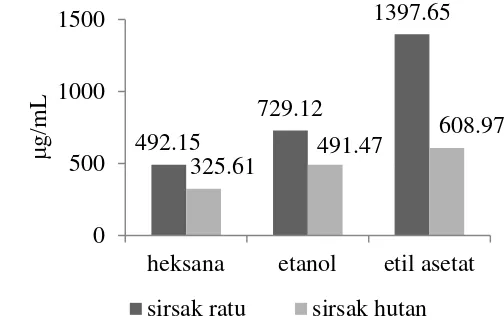
Uji in vitro toksisitas daun sirsak ratu dan sirsak hutan juga dilakukan terhadap embrio ikan zebra. Tingkat kematian embrio serta penghambatan dalam pertumbuhannya diamati setelah pemberian ekstrak. Hasil yang diperoleh sebanding dengan hasil uji BSLT, tetapi dengan nilai LC50 hasil pengujian ikan
zebra secara keseluruhan lebih besar.
Ekstrak heksana sirsak ratu dan sirsak hutan memiliki nilai LC50 492.15
µg/mL (r2 = 0.9815) dan 325.61 µg/mL (r2 = 0.9902) (Lampiran 7), ekstrak etanol berturut-turut 729.12 µg/mL (r2 = 0.9283) dan 491.47 µg/mL (r2 = 0.9721) (Lampiran 8), sedangkan ekstrak etil asetat berturut-turut 1397.65 µg/mL (r2 = 0.9357) dan 608.97 µg/mL (r2 = 0.9259) (Lampiran 9). Hasil ini diringkaskan pada Gambar 6.
Gambar 6 Nilai LC50 uji toksisitas terhadap ikan zebra
Nilai LC50 yang relatif lebih besar pada pengujian ikan zebra disebabkan
kekuatan hidup hewan uji tersebut lebih besar dibandingkan dengan larva udang. Selain itu, tingkat kematian ikan zebra lebih mudah diamati dibandingkan dengan pengamatan larva udang karena ukurannya yang lebih besar. Meskipun demikian, dalam uji dengan embrio ikan zebra, ekstrak heksana tetap memiliki nilai LC50
paling rendah. Oleh karena itu, pengamatan morfologi secara mikroskopik (uji in vivo) dilakukan terhadap embrio ikan zebra yang telah terpapar ekstrak heksana dalam penentuan nilai LC50 (uji in vitro).
Hasil Pengamatan Embrio Ikan Zebra secara In Vivo
Embrio ikan zebra secara in vivo dapat mewakili kompleksitas fisiologis dan morfologis pada organisme dewasa. Oleh karena itu, embrio tersebut dapat menggambarkan informasi organisme yang lengkap dalam uji toksisitas (Ma et al.
penambahan ekstrak tersebut pada embrio ikan zebra berpengaruh signifikan terhadap pertumbuhan morfologi embrio (Coelho et al. 2011).
Pengamatan embrio dilakukan dengan stereomikroskop. Foto objek dapat digunakan untuk mengukur organ-organ embrio dengan menggunakan skala preparat, setelah semua embrio dari masing-masing konsentrasi uji diamati. Pengamatan meliputi pigmentasi, panjang tubuh, diameter embrio (jika embrio tidak menetas), kepala, mata, jantung, kantung kuning telur, dan ekor.
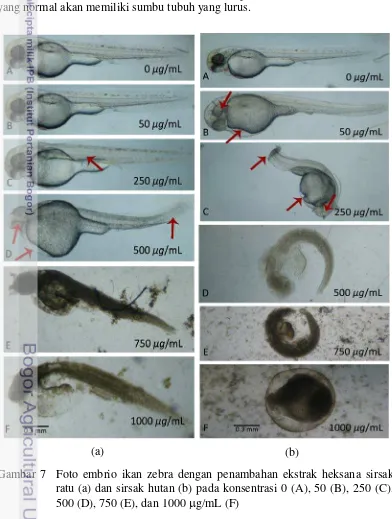
Perlakuan dengan ekstrak heksana sirsak ratu tidak berpengaruh signifikan pada morfologi embrio (Gambar 7a). Perlakuan pada kontrol (0 µg/mL), konsentrasi 50 dan 250 µg/mL menghasilkan perkembangan embrio yang serupa. Heiden et al. (2007) dan Wei et al. (2010) melaporkan bahwa larva ikan zebra yang normal akan memiliki sumbu tubuh yang lurus.
Gambar 7 Foto embrio ikan zebra dengan penambahan ekstrak heksana sirsak ratu (a) dan sirsak hutan (b) pada konsentrasi 0 (A), 50 (B), 250 (C), 500 (D), 750 (E), dan 1000 µg/mL (F)
Larva pada kontrol (0 µg/mL) memiliki sumbu tubuh yang lurus sehingga dapat dikatakan tumbuh normal (A). Perkembangan sempurna larva kontrol juga dapat ditunjukkan dengan pigmentasi yang terjadi. Coelho et al. (2011) menyatakan, jika larva ikan zebra memiliki kelainan, maka intensitas pigmennya akan berkurang. Intensitas pigmen pada larva kontrol sudah cukup terbentuk dan organ lain seperti jantung, kantung kuning telur, ekor, dan kepala juga telah berkembang dengan baik.
Perlakuan dengan konsentrasi 50 (B) dan 250 µg/mL (C) menghasilkan embrio yang menetas menjadi larva dan berkembang hampir sempurna. Sumbu tubuh keduanya lurus, namun intensitas pigmen berkurang. Pada larva C terbentuk mata yang kurang sempurna dan kantung telur agak membesar. Kantung kuning telur merupakan membran yang berfungsi menyediakan nutrisi bagi embrio. Pembesaran kantung kuning telur merupakan salah satu indikasi nutrisi tidak terdistribusi sempurna pada embrio. Hal tersebut akan menyebabkan kekurangan nutrisi pada embrio yang lambat laun akan menyebabkan kematian (Bie 2001). Namun, perkembangan kedua larva ini tergolong normal dibandingkan dengan larva pada konsentrasi lebih tinggi. Organ jantung keduanya dapat teramati dengan baik. Berdasarkan hasil ini, dapat dikatakan konsentrasi 50 dan 250 µg/mL ekstrak heksana sirsak ratu kurang toksik.
Perlakuan selanjutnya (D) merupakan pemaparan ekstrak dengan konsentrasi 500 µg/mL. Embrio menetas menjadi larva, namun terjadi keabnormalan pada perkembangannya. Sumbu tubuh melengkung ke atas dan ukurannya lebih kecil dibandingkan dengan kontrol. Kantung kuning telur sangat besar sehingga organ jantung tidak terlihat. Hal ini menyebabkan asupan makanan tidak merata sehingga sumbu tubuh terlihat lebih kecil. Selain itu, terjadi kebutaan pada organ mata dan ukurannya pun lebih kecil daripada kontrol. Semua keabnormalan tersebut menunjukkan bahwa ekstrak pada konsentrasi 500 µg/mL toksik. Konsentrasi 750 (E) dan 1000 (F) µg/mL menunjukkan kemiripan perkembangan larva. Larva menetas, namun pertumbuhan organ mata, jantung, kantung kuning telur, dan ekor tidak terlihat. Hal ini menunjukkan bahwa kedua konsentrasi ekstrak tersebut sangat toksik (Lampiran 10).
Berbeda dengan sirsak ratu, ekstrak heksana sirsak hutan (Gambar 7b) telah menampakkan keabnormalan sejak konsentrasi 50 µg/mL (B). Embrio kontrol (0 µg/mL) menetas dan berkembang dengan sempurna (A). Pigmentasi dan perkembangan organ-organ juga terjadi dengan baik.
Embrio dengan perlakuan konsentrasi 50 µg/mL (B) menetas menjadi larva. Namun, terdapat beberapa abnormalitas. Sumbu tubuh agak melengkung ke atas, intensitas pigmen tidak sebaik kontrol, kepala membesar, terjadi kelainan pada mata, dan ukuran kantung kuning telur lebih besar dibandingkan dengan kontrol (Lampiran 11). Ini merupakan indikasi bahwa pada konsentrasi 50 µg/mL, daya sitotoksik ekstrak sirsak hutan telah memengaruhi perkembangan embrio dan lebih kuat daripada ekstrak sirsak ratu. Hasil ini berkorelasi dengan nilai LC50
yang dihasilkan; nilai LC50 ekstrak heksana sirsak hutan lebih kecil dibandingkan
dengan ekstrak sirsak ratu.
terbentuk dengan sempurna, bahkan untuk mata dan jantung tidak terlihat. Selain itu, kantung kuning telur membesar dan sedikit hancur pada bagian bawahnya. Pada konsentrasi 500 µg/mL (D) embrio mulai tumbuh dan cangkang telur sudah terlepas. Namun, embrio tidak berkembang lagi dan mati.
Pengamatan embrio E (750 µg/mL) dan F (1000 µg/mL) menunjukkan daya sitotoksik tertinggi pada ekstrak heksana sirsak hutan. Embrio E tidak menetas, namun cangkang telur telah rusak dan terlihat embrio mulai berkembang di dalam telur. Embrio F tidak berkembang dalam telur dan juga tidak menetas. Embrio diperkirakan sudah mati sebelum 24 jam. Hal ini sesuai dengan meningkatnya sitotoksisitas pada konsentrasi ekstrak yang semakin tinggi.
Hasil pengamatan di atas menunjukkan bahwa ekstrak heksana sirsak ratu dan hutan sama-sama toksik terhadap ikan zebra. Organ tubuh ikan zebra seperti mata, jantung, dan kantung kuning telur dihambat pertumbuhannya. Peredaran darah dan pertumbuhan panjang tubuh mengalami keabnormalan yang beragam pada konsentrasi 50 sampai 500 µg/mL. Hal ini menunjukkan bahwa konsentrasi tersebut dapat menghambat pertumbuhan organ tubuh tanpa membunuh langsung hewan uji. Pengaruh inilah yang diharapkan terjadi pada sel kanker yang menyerang manusia. Sel kanker dihambat pertumbuhannya tanpa efek samping yang serius pada penderita kanker.
Analisis statistik yang digunakan untuk menguji data pengamatan embrio ikan zebra adalah uji Anova 2-arah dan uji lanjutan Dunnet post hoc dengan menggunakan perangkat lunak SPSS 17. Uji Anova 2-arah digunakan untuk membandingkan rata-rata lebih dari 2 kelompok dan untuk menganalisis apakah konsentrasi ekstrak yang diberikan memengaruhi morfologi embrio secara signifikan. Hipotesis yang digunakan adalah H0: konsentrasi tidak berpengaruh
terhadap morfologi embrio, dan H1: konsentrasi berpengaruh terhadap morfologi
embrio. Pengambilan putusan didasarkan perbandingan nilai Fhitung dengan Ftabel.
Jika Fhitung > Ftabel, maka H0 ditolak (Walpole 1993). Nilai Ftabel yang digunakan
pada taraf nyata 0.05 adalah 3.106.
Uji Dunnet digunakan untuk membandingkan perlakuan dengan kontrol. Taraf signifikansi yang digunakan 0.05. Hal ini berarti jika nilai signifikansi dari pengukuran embrio (p) < 0.05, maka perlakuan konsentrasi berbeda signifikan dengan kontrol (Mattjik dan Sumertajaya 2006).
Data pengamatan embrio sirsak ratu menghasilkan nilai Fhitung > Ftabel
kecuali pada pengamatan organ mata (Lampiran 12), maka konsentrasi yang diberikan berpengaruh terhadap morfologi embrio, kecuali perkembangan mata. Pengamatan embrio sirsak hutan menunjukkan Fhitung < Ftabel pada organ jantung,
kantung kuning telur, dan mata. Namun, hal tersebut bukan karena ekstrak tidak berpengaruh, melainkan karena mulai konsentrasi 50 dan 250 µg/mL, organ jantung dan mata sudah tidak terbentuk.
Hasil uji Dunnet untuk panjang tubuh embrio (Lampiran 13) memberikan nilai p < 0.05 pada konsentrasi ekstrak sirsak ratu 250 sampai 1000 µg/mL.
Konsentrasi 50 µg/mL menghasilkan nilai p > 0.05. Jadi, pada konsentrasi 50 µg/mL, panjang tubuh embrio tidak berbeda signifikan dengan kontrol, sedangkan pada konsentrasi 250–1000 µg/mL panjang tubuh embrio berbeda secara signifikan. Ekstrak sirsak hutan memberikan hasil yang sama untuk konsentrasi 50 µg/mL, namun mulai konsentrasi 250–1000 µg/mL tidak terdapat nilai p
Data pigmentasi untuk ekstrak sirsak ratu menghasilkan nilai signifikansi kurang dari 0.05 pada konsentrasi 50 dan 250 µg/mL. Konsentrasi 500–1000 µg/mL tidak menghasilkan nilai signifikansi karena pigmentasi tidak terbentuk. Hal ini juga terjadi pada ekstrak sirsak hutan, bahkan larva tidak menunjukkan pigmentasi sejak konsentrasi 250 µg/mL sehingga uji Dunnet tidak menghasilkan signifikansi sama sekali. Uji Dunnet akan menghasilkan nilai signifikansi jika sedikitnya ada 3 data.
Pada data jantung embrio, perlakuan ekstrak sirsak ratu memberikan nilai p
< 0.05 untuk konsentrasi 50 dan 250 µg/mL (Lampiran 13) dan tidak ada pertumbuhan jantung pada konsentrasi 500–1000 µg/mL (Lampiran 10). Pada perlakuan ekstrak sirsak hutan kembali tidak diperoleh signifikansi karena mulai konsentrasi 250 µg/mL jantung tidak terbentuk.
Data kantung kuning telur (Lampiran 13) untuk perlakuan ekstrak sirsak ratu dan sirsak hutan menghasilkan nilai p > 0.05 pada konsentrasi 50 dan 250 µg/mL,
artinya pada konsentrasi tersebut ekstrak tidak memengaruhi kantung kuning telur ikan zebra. Selanjutnya untuk sirsak ratu, pada konsentrasi 500 dan 750 µg/mL nilai p < 0.05, sedangkan pada 1000 µg/mL nilai p tidak terdeteksi. Untuk sirsak hutan, mulai konsentrasi 500 µg/mL kantung kuning telur sudah tidak terbentuk.
Pengukuran kepala embrio (Lampiran 13) dengan perlakuan ekstrak sirsak ratu menghasilkan nilai p < 0.05 untuk konsentrasi 500 dan 750 µg/mL.
Konsentrasi 50 dan 250 µg/mL tidak berbeda nyata dengan kontrol. Embrio ikan pada konsentrasi 1000 µg/mL menetas menjadi larva, namun ukuran kepala tidak dapat ditentukan. Untuk sirsak hutan mulai konsentrasi 250 µg/mL ukuran kepala tidak dapat ditentukan sehingga uji Dunnet tak dapat dilakukan.
Ukuran mata embrio (Lampiran 13) tidak berbeda nyata pada perlakuan ekstrak sirsak ratu dengan konsentrasi 50–500 µg/mL. Pada konsentrasi 750 dan 1000 µg/mL, mata sudah rusak dan tidak dapat diukur. Pada perlakuan ekstrak sirsak hutan kerusakan mata terjadi mulai konsentrasi 250 µg/mL, maka tidak dapat diuji Dunnet.
Pengukuran ekor embrio (Lampiran 13) pada perlakuan ekstrak sirsak ratu memberikan nilai p < 0.05 pada konsentrasi 250 dan 500 µg/mL dan tidak memberikan nilai p pada konsentrasi 750 dan 1000 µg/mL. Konsentrasi 50 µg/mL
memberikan nilai p > 0.05. Hasil pengukuran ekor pada ekstrak sirsak hutan tidak ada mulai konsentrasi 250 µg/mL karena tubuh ikan sudah terpengaruh oleh ekstrak. Akibatnya, tidak dapat dilakukan uji Dunnet.
Berdasarkan hasil pengamatan embrio dan analisis statistika di atas, kedua ekstrak daun memberikan daya sitotoksik, tetapi ekstrak sirsak hutan lebih tinggi sitotoksisitasnya. Hal itu ditunjukkan dengan pengaruh signifikan pada konsentrasi yang lebih rendah terhadap panjang tubuh, pigmentasi, jantung, kantung kuning telur, kepala, mata, dan ekor.
Hasil Fraksionasi dan Pengukuran NMR Ekstrak Teraktif
-heksana. Pelarut yang dijadikan sebagai penyusun fase gerak adalah yang menghasilkan jumlah noda terbanyak dan memiliki keterpisahan yang baik. Eluen tunggal n-heksana dan kloroform memberikan keterpisahan yang terbaik. Kedua pelarut tersebut digabungkan dengan nisbah tertentu untuk mendapatkan eluen campuran yang dapat memisahkan ekstrak dengan baik. Campuran eluen yang diujikan pada ekstrak heksana sirsak hutan sebagai ekstrak teraktif adalah kloroform:n-heksana (1:9 hingga 9:1) (Houghton dan Raman 1998).
Pola keterpisahan terbaik didapatkan dengan eluen kloroform:n-heksana (7:3). Ekstrak heksana sirsak hutan memisah menjadi 8 noda dengan nilai Rf seperti yang ditunjukkan pada Gambar 8. Hasil KLT ini menunjukkan bahwa diduga terdapat 8 komponen atau senyawa pada ekstrak aktif sirsak hutan yang memiliki kemungkinan sebagai antikanker.
Gambar 8 Profil kromatogram ekstrak heksana sirsak hutan dengan eluen kloroform:n-heksana (7:3)
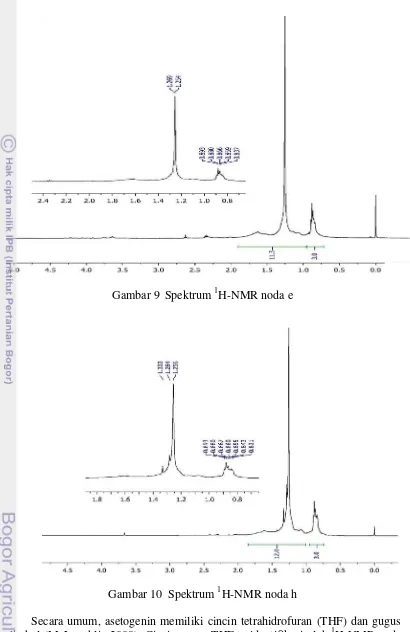
Kedelapan komponen tersebut selanjutnya dipisahkan dengan menggunakan KLTP dengan eluen kloroform:n-heksana (7:3). Empat noda tepisah dengan baik, yaitu e, f, g, dan h. Noda yang berhasil dimurnikan dan dilanjutkan untuk pengukuran NMR ialah noda e dan h.
Gambar 9 Spektrum 1H-NMR noda e
Gambar 10 Spektrum 1H-NMR noda h
baik noda e maupun h bukan senyawa asetogenin atau turunannya sehingga tidak dilakukan analisis 13C-NMR.
SIMPULAN DAN SARAN
Simpulan
Ekstrak daun sirsak (sirsak ratu dan sirsak hutan) berpotensi sebagai antikanker. Ekstrak sirsak hutan lebih sitotoksik daripada sirsak ratu. Ekstrak heksana paling aktif, dengan nilai LC50 ekstrak heksana sirsak hutan pada larva
udang 197 µg/mL dan pada embrio ikan zebra 326 µg/mL. Fraksionasi ekstrak ini diduga menghasilkan 8 senyawa, namun belum diperoleh senyawa target, yaitu asetogenin.
Saran
Ekstrak aktif daun sirsak perlu difraksionasi lebih lanjut. Pengukuran spektroskopi yang lebih lengkap juga dibutuhkan untuk menentukan jenis senyawa yang berperan sebagai antikanker.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 1984. Official Methods of Analysis. Ed ke-14. Arlington: AOAC.
[AOAC] Association of Official Analytical Chemists. 2002. AOAC International Methods Committee Guidelines for Validation of Qualitative and Quantitative Food Microbiological Official Methods of Analysis. J AOAC Int. 85:1-5.
Berghmans S, Jette C, Langenau D, Hsu K, Stewart R, Look T, Kanki JP. 2005. Making waves in cancer research: new models in the Zebrafish.
BioTechniques. 39:227-237.
Bie GVD. 2001. Embryology: Early Development from a Phenomenological Point of View. Driebergen: Louis Bolk Institute.
Chang FR, Wu YC. 2001. Novel cytotoxic Annonaceous acetogenins from
Annona muricata. J Nat Prod. 64:925-931.
Cochrane CB, Nair PKR, Melnick SJ, Resek AP, Ramachandran C. 2008. Anticancer effects of Annona glabra plant extracts in human leukemia cell lines. Anticancer Res. 28:965-972.
Coelho S, Oliveira R, Pereira S, Musso C, Domingues I, Bhujel RC, Soares AMVM, Nogueira AJA. 2011. Assessing lethal and sub-lethal effects of trichlorfon on different trophic levels. Aqua Toxicol. 103:191-198.
Gleye C, Duret P, Laurens A, Hocquemiller R, Cave A. 1998. cis -Monotetrahydrofuran acetogenins from the roots of Annona muricata. J Nat Prod. 61:576-579.
Gleye C, Raynaud S, Fourneau C, Laurens A, Laprevote O, Serani L, Fournet A, Hacquemiller R. 2000. Cohibin C and D, two important metabolites in the biogenesis of acetogenins from Annona muricata and Annona nutans. J Nat Prod. 63:1192-1196.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, penerjemah. Bandung: ITB. Terjemahan dari:
Phytochemical Methods.
Harjadi W. 1986. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Heiden TCK, Dengler E, Kao WJ, Heideman W, Peterson RE. 2007. Developmental toxicity of low generation PAMAM dendrimers in zebrafish. Toxicol Appl Pharmacol. 225:70-79.
Houghton PJ, Raman A. 1998. Laboratory Handbook for the Fractionation of Natural Extract. London: Chapman & Hall.
Hsu CH, Wen ZH, Lin CS, Chakraborty C. 2007. The zebrafish model: Use in studying cellular mechanism for a spectrum of clinical disease entities.
Curr Neurovascular Res. 4:111-120.
Kim G, Zeng L, Alali F, Rogers LL, Wu FE, McLaughlin JL, Sastrodihardjo S. 1998. Two new mono-tetrahydrofuran ring acetogenins, annomuricin E and muricapentocin, from the leaves of Annona muricata. J Nat Prod.
61:432-436.
Krishnaraju AV, Rao TVN, Sundararaju D, Vanisree M, Tsay HS, Subbaraju GV. 2005. Assessment of bioactivity of Indian medicinal plants using Brine Shrimp (A. salina) lethality assay. Int J Appl Sci Eng. 3:125-134.
Li DY, Yu JG, Luo XZ, Sun L, Yang SL. 2000. Muricatenol, a linear acetogenin from Annona muricata (Annonaceae). Chinese Chem Lett. 11:239-242. Ma C, Parng C, Seng WL, Zhang C, Willet C, Mc Grath P. 2007. Zebrafish, an in
vivo model for drug screening. Drug Discovery. 6:38-45.
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan MINITAB. Bogor (ID): IPB Pr.
McLaughlin JL. 2008. Paw paw and cancer: Annonaceous acetogenins from discovery to commercial products. J Nat Prod. 71:1311-1321.
Moore JL, Rush LM, Breneman C, Mohideen MAPK, Cheng KCl. 2006. Zebrafish genomic instability mutants and cancer susceptibility. Genetics.
10:1-33.
Mukhtar MH, Adnan AZ, Pitra MW. 2007. Uji sitotoksisitas minyak atsiri daun Kamanggi (Ocimum basilicum L) dengan metode Brine Shrimp Lethality Test Bioassay. J Sains Tek Far. 12:1-4.
Nicoli S, Presta M. 2007. The Zebrafish/tumor xenograft angiogenesis assay.
Nature Protocols. 2:2918-2923.
Rieser MJ, Gu ZM, Fang XP, Zeng L, Wood KV, McLaughlin JL. 1996. Five novel mono-tetrahydrofuran ring acetogenins from the seeds of Annona muricata. J Nat Prod. 59:100-108.
Wei X, Bugni TS, Harper MK, Sandoval IT, Manos EJ, Swift J, Wagoner RMV, Jones DA, Ireland CM. 2010. Evaluation of pyridoacridine alkaloids in a zebrafish phenotypic assay. Mar Drugs. 8: 1769-1778.
Winarno FG. 1995. Kimia Pangan dan Gizi. Jakarta: Gramedia.
Wu FE, Gu ZM, Zeng L, Zhao GX, Zhang Y, McLaughlin JL, Sastrodihardjo S. 1995a. Two new cytotoxic monotetrahydrofuran Annonaceous acetogenins, annomuricins A and B, from the leaves of Annona muricata.
J Nat Prod. 58:830-836.
Wu FE, Zeng L, Gu ZM, Zhao GX, Zhang Y, Schwedler JT, McLaughlin JL, Sastrodihardjo S. 1995b. Muricatocins A and B, two new bioactive monotetrahydrofuran annonaceous acetogenins from the leaves of Annona muricata. J Nat Prod. 58: 902-908.
Lampiran 1 Diagram alir penelitian
Ekstrak aktif
Uji toksisitas (BSLT) Partisi dengan etil asetat-air
Daun sirsak Penentuan kadar air Maserasi dengan etanol
Ekstrak etanol
Ekstrak etil asetat Ekstrak air
Pengamatan embrio ikan zebra
Partisi dengan heksana
Ekstrak heksana
1
Lampiran 2 Kadar air dan rendemen daun sirsak a) Kadar air daun sirsak
Ulangan
Sirsak ratu Sirsak hutan
A (g) B (g) Kadar air
b) Rendemen daun sirsak
Sampel Ekstrak b (gram) a (gram) Rendemen (% b/b)
Contoh perhitungan rendemen ekstrak etanol sirsak ratu:
Rendemen ekstrak= a
(1− kadar air)b×100% =
2.7025 g
(1 − 0.0861)50.0200 g ×100%
y = 107.6120x− 233.3039
ekstrak heksana sirsak ratu
y = 58.4318x− 84.0280
ekstrak heksana sirsak hutan
Lampiran 3 Hasil uji toksisitas BSLT ekstrak heksana sirsak ratu dan hutanKonsentrasi (µg/mL)
Jumlah larva awal
Sirsak ratu Sirsak hutan
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
0 10 0 0 0 0 0 0
Contoh perhitungan LC50: y=107.6120x − 233.3039 50=107.6120x − 233.3039
x=2.6326 LC50 =102.6326
y = 120.1799x− 272.7777
ekstrak etanol sirsak ratu
y = 20.0642x + 2.1151
ekstrak etanol sirsak hutan
Lampiran 4 Hasil uji toksisitas BSLT ekstrak etanol sirsak ratu dan hutan Konsentrasi
(µg/mL)
Jumlah larva awal
Sirsak ratu Sirsak hutan
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
0 10 0 0 0 0 0 0
Contoh perhitungan LC50: y=120.1799x − 272.7777 50=120.1799x − 272.7777
x=2.6857 LC50 = 102.6857
y = 64.6286x− 152.9008
ekstrak etil asetat sirsak ratu
y = 57.9808x− 106.5409
ekstrak etil asetat sirsak hutan
Lampiran 5 Hasil uji toksisitas BSLT ekstrak etil asetat sirsak ratu dan hutanKonsentrasi (µg/mL)
Jumlah larva awal
Sirsak ratu Sirsak hutan
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
0 10 0 0 0 0 0 0
Contoh perhitungan LC50: y=64.6286x − 152.9008 50=64.6286x − 152.9008
x=3.1395 LC50 = 103.1395
y = 0.0000
ekstrak air sirsak ratu
y = 0.0000
ekstrak air sirsak hutan
Lampiran 6 Hasil uji toksisitas BSLT ekstrak air sirsak ratu dan hutanKonsentrasi (µg/mL)
Jumlah larva awal
Sirsak ratu Sirsak hutan
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
y = 90.3101x− 193.1275
ekstrak heksana sirsak ratu
y = 61.9244x− 105.5961
ekstrak heksana sirsak hutan
Lampiran 7 Hasil uji toksisitas ikan zebra ekstrak heksana sirsak ratu dan hutanKonsentrasi (µg/mL)
Jumlah larva awal
Sirsak ratu Sirsak hutan
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
0 10 0 0 0 0 0 0
Contoh perhitungan LC50: y=90.3101x − 193.1275 50=90.3101x − 193.1275
x=2.6921 LC50 = 102.6921
y = 31.4497x− 40.0354
ekstrak etanol sirsak ratu
y = 88.9289x− 189.3488
ekstrak etanol sirsak hutan
Lampiran 8 Hasil uji toksisitas ikan zebra ekstrak etanol sirsak ratu dan hutanKonsentrasi (µg/mL)
Jumlah larva awal
Sirsak ratu Sirsak hutan
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
0 10 0 0 0 0 0 0
Contoh perhitungan LC50: y=31.4497x − 40.0354 50=31.4497x − 40.0354
x=2.8628 LC50 = 102.8628
y = 28.1167x− 38.4371
ekstrak etil asetat sirsak ratu
y = 35.1488x− 47.8737
ekstrak etil asetat sirsak hutan
Lampiran 9 Hasil uji toksisitas ikan zebra ekstrak etil asetat sirsak ratu dan hutanKonsentrasi (µg/mL)
Jumlah larva awal
Sirsak ratu Sirsak hutan
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
0 10 0 0 0 0 0 0
Contoh perhitungan LC50: y=28.1167x − 38.4371 50=28.1167x − 38.4371
x=3.1454 LC50 = 103.1454
Lampiran 10 Hasil pengamatan embrio ikan zebra dengan perlakuan ekstrak heksana daun sirsak ratu Konsentrasi
(µg/mL) Ulangan
Bentuk
Pigmentasi Ukuran (mm)
Embrio Larva Diameter Panjang tubuh Jantung Kantung kuning telur Kepala Ekor Mata
0 1 - 4 - 2.78 0.13 0.59 0.38 0.15 0.23
2 - 5 - 2.85 0.15 0.68 0.45 0.17 0.24
3 - 5 - 2.88 0.16 0.67 0.41 0.18 0.23
50 1 - 2 - 2.74 0.11 0.68 0.37 0.11 0.23
2 - 2 - 2.85 0.09 0.67 0.41 0.15 0.24
3 - 3 - 2.81 0.08 0.66 0.34 0.14 0.22
250 1 - 2 - 2.55 0.08 0.67 0.34 0.04 0.23
2 - 2 - 2.58 0.08 0.67 0.37 0.08 0.23
3 - 3 - 2.64 0.09 0.69 0.38 0.14 0.24
500 1 - 0 - 2.51 - 0.83 0.26 0.04 0.11
2 - 0 - 2.62 - 1.07 0.32 0.04 0.21
3 - 0 - 2.54 - 0.78 0.33 0.05 0.21
750 1 - 0 - 2.21 - 0.32 0.27 - -
2 - 0 - 2.13 - 0.31 0.28 - -
3 - 0 - 1.95 - 0.29 0.24 - -
1000 1 - 0 - 1.86 - - - - -
2 - 0 - 1.76 - - - - -
Lampiran 11 Hasil pengamatan embrio ikan zebra dengan perlakuan ekstrak heksana daun sirsak hutan Konsentrasi
(µg/mL) Ulangan
Bentuk
Pigmentasi
Ukuran (mm)
Embrio Larva Diameter Panjang
tubuh Jantung
Kantung kuning
telur Kepala Ekor Mata
0 1 - 3 - 2.87 0.10 0.45 0.44 0.14 0.25
2 - 4 - 2.97 0.08 0.49 0.41 0.15 0.23
3 - 3 - 2.81 0.08 0.52 0.39 0.14 0.22
50 1 - 2 - 2.66 0.09 0.49 0.37 0.12 0.24
2 - 1 - 2.62 - 0.60 0.33 0.09 0.14
3 - 0 - 2.35 - 0.46 0.22 - -
250 1 - 0 - 2.32 - 0.49 - - -
2 - 0 - 2.46 - 0.46 - - -
3 - 0 - 1.60 - 0.67 - - -
500 1 - 0 1.18 - - - -
2 - 0 1.24 - - - -
3 - 0 1.25 - - - -
750 1 - 0 1.13 - - - -
2 - 0 1.20 - - - -
3 - 0 1.06 - - - -
1000 1 - 0 1.02 - - - -
2 - 0 1.30 - - - -
3 - 0 1.32 - - - -
Lampiran 12 Nilai Fhitung pengamatan embrio ikan zebra
Objek pengamatan
Fhitung
Sirsak ratu Sirsak hutan Panjang tubuh 93.957 5.214
Pigmentasi 16.333 12.250
Jantung 20.867 0.063
Kuning telur 24.723 0.329
Kepala 11.171 5.120
Mata 2.654 1.237
Ekor 10.787 10.239
Lampiran 13 Hasil uji Dunnet pengamatan embrio ikan zebra
Konsentrasi (µg/mL)
p
Sirsak ratu Sirsak hutan
Panjang
tubuh Pigmentasi Jantung
Kuning
telur Kepala Mata Ekor
Panjang
tubuh Pigmentasi Jantung
Kuning
telur Kepala Mata Ekor
50 0.954 0.005 0.004 0.984 0.370 0.998 0.394 0.318 - - 0.864 - - -
250 0.005 0.005 0.002 0.961 0.211 1.000 0.022 0.032 - - 0.653 - - -
500 0.002 - - 0.007 0.005 0.110 0.002 - - - -
750 0.000 - - 0.001 0.000 - - - -
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 22 November 1988 dari pasangan Subiyatno dan Heni Setiawati. Penulis merupakan anak pertama dari dua bersaudara. Pada tahun 2006, penulis berhasil menyelesaikan studi di SMA Negeri 46 Jakarta dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Penelusuran Minat dan Kemampuan (PMDK) dan diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam pada tahun kedua.