UJI TOKSISITAS AKUT EKSTRAK AKTIF BUAH SIRSAK
RATU (
Annona muricata
) DAN SIRSAK HUTAN (
Annona
glabra
) SEBAGAI POTENSI ANTIKANKER
ASTARI WENDARNINGTYAS
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ASTARI WENDARNINGTYAS. Uji Toksisitas Akut Ekstrak Aktif Buah Sirsak
Ratu (
Annona muricata
) dan Sirsak Hutan (
Annona glabra
) sebagai Potensi
Antikanker. Dibimbing oleh GUSTINI SYAHBIRIN dan NOVRIYANDI
HANIF.
Penelitian khasiat antikanker dari berbagai bagian tumbuhan sirsak telah
marak dilakukan, namun penelitian khasiat antikanker dari bagian buah masih
jarang dilakukan. Buah sirsak yang cukup banyak terdapat di Indonesia adalah
buah sirsak ratu (
Annona. muricata
) dan buah sirsak hutan (
A. glabra
). Penelitian
toksisitas dari buah sirsak ratu dan buah sirsak hutan dilakukan dengan dua
metode, yaitu metode uji letalitas larva udang (BSLT) dan metode lebih terkini
dengan menggunakan embrio ikan zebra (
Danio rerio
). Nilai LC
50terbaik dari
ekstrak buah sirsak ratu dan sirsak hutan diberikan oleh ekstrak etil asetat baik
dengan menggunakan metode BSLT maupun dengan embrio ikan zebra. Hasil
pengamatan embrio ikan zebra melaporkan bahwa ekstrak etil asetat sirsak ratu
merupakan ekstrak dengan daya sitotoksik tertinggi. Uji fitokimia dari ekstrak etil
asetat masing-masing buah menghasilkan uji positif pada golongan senyawa
alkaloid, tanin, dan flavonoid. Ekstrak etil asetat sirsak ratu
menghasilkan 6 noda
dari hasil pemisahan dengan kromatografi lapis tipis dan ekstrak etil asetat sirsak
hutan
menghasilkan 8 noda dengan cara yang sama.
ABSTRACT
ASTARI WENDARNINGTYAS
.Acute Toxicity Test of Active Fruit Extract
from Soursop (
Annona muricata
) and Pond Apple (
Annona glabra
) as an
Anticancer Potential.
Supervised by GUSTINI SYAHBIRIN and NOVRIYANDI
HANIF
.The anticancer potential studies of soursop plants have been studied well,
but the anticancer potential of soursoup fruits is still rarely studied. Soursop fruits
are common in Indonesia and widely distribute as soursop (
Annona muricata)
and
pond apple (
A. glabra
). Investigation toxicity of these fruits is carried out in two
methods, brine shrimp lethality test (BSLT) and more advanced zebra fish (
Danio
rerio
) test. The best LC
50from soursop and pond apple extract were given by the
Disetujui
Pembimbing I
Dr Gustini Syahbirin, MS
NIP 19600819 198903 2 001
Pembimbing II
Novriyandi Hanif, DSc
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
Tanggal Lulus :
Judul :
Uji Toksisitas Akut Ekstrak Aktif Buah Sirsak Ratu (
Annona
muricata
) dan Sirsak Hutan (
Annona glabra
) sebagai Potensi
Antikanker
UJI TOKSISITAS AKUT EKSTRAK AKTIF BUAH SIRSAK
RATU (
Annona muricata
) DAN SIRSAK HUTAN (
Annona
glabra
) SEBAGAI POTENSI ANTIKANKER
ASTARI WENDARNINGTYAS
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas berkat limpahan
rahmat dan hidayah-Nya penulis dapat menyelesaikan karya ilmiah yang berjudul
Uji Toksisitas Akut Ekstrak Aktif Buah Sirsak Ratu (
Annona muricata
) dan
Sirsak Hutan (
Annona glabra
) sebagai Potensi Antikanker. Shalawat serta salam
semoga selalu tercurahkan kepada junjungan Nabi Muhammad SAW yang telah
membimbing umatnya hingga akhir zaman. Penelitian ini bertujuan menganalisis
potensi ekstrak kasar buah sirsak sebagai potensi antikanker. Penelitian
dilaksanakan sejak Maret sampai September 2011 di Laboratorium Kimia
Organik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam
dan Laboratorium Embriologi, Departemen Anatomi, Fisiologi, dan Farmakologi,
Fakultas Kedokteran Hewan.
Ucapan terima kasih penulis sampaikan kepada Ibu Dr. Gustini Syahbirin,
MS dan Bapak Novriyandi Hanif, DSc selaku pembimbing yang senantiasa
memberikan arahan, dorongan semangat, dan doa kepada penulis selama
melaksanakan penelitian. Penulis juga mengucapkan terima kasih kepada
seluruh
staf Laboratorium Kimia Organik, Bapak Budi Arifin, Kak Luthfan Irfana, Bapak
drh. Kusdiantoro Muhamad, MSi, dan Kak Steven Gunawan atas bantuan serta
masukan selama penelitian berlangsung. Terima kasih tak terhingga penulis
ucapkan kepada seluruh keluarga, Zulmy, Indah, Lilik, Ratna, Randi, Ria, dan
keluarga besar Kimia 44 atas doa, kasih sayang, motivasi, serta segala dukungan
yang telah kalian berikan.
Atas segala khilaf dan kekurangan, semoga dapat dibukakan pintu maaf
yang sebesar-besarnya. Penulis berharap karya ilmiah ini dapat bermanfaat bagi
semua pihak juga perkembangan ilmu pengetahuan.
September 2011
RIWAYAT HIDUP
Penulis dilahirkan di Tangerang pada tanggal 10 Maret 1989 dari pasangan
Alm. M. Daryono dan Alm. Naniek Anjarweniati. Penulis merupakan anak
keempat dari empat bersaudara. Pada tahun 2007 penulis berhasil menyelesaikan
studi di SMA Negeri 10 Tangerang dan pada tahun yang sama penulis lulus
seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi Penerimaan
Mahasiswa Baru (SPMB) dan diterima di Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
BAHAN DAN METODE
Alat dan Bahan ... 2
Lingkup Kerja ... 2
HASIL DAN PEMBAHASAN
Kadar Air dan Abu ... 4
Ekstraksi ... 4
Uji Toksisitas Terhadap Larva Udang ... 5
Uji Toksisitas Terhadap Embrio Ikan Zebra ... 6
Pengamatan Embrio Ikan Zebra ... 6
Uji Fitokimia ... 10
Penentuan Fraksi Ekstrak Teraktif ... 10
SIMPULAN DAN SARAN
Simpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 11
LAMPIRAN ... 14
DAFTAR TABEL
1 Kadar air dan abu buah sirsak ... 4
2 Rendemen buah sirsak... 5
3 Uji fitokimia ekstrak etil asetat buah sirsak ... 10
4 Nilai
R
fekstrak etil asetat buah sirsak ... 11
DAFTAR GAMBAR
1 Sirsak ratu (
A. muricata
). ... 1
2
Sirsak hutan (
A. glabra
). ... 1
3 Ikan zebra (
Danio rerio
). ... 2
4 Nilai LC
50uji toksisitas terhadap
A. salina.
... 5
5 Nilai LC
50uji toksisitas terhadap embrio ikan zebra. ... 6
6 Embrio ikan zebra dengan penambahan ekstrak etil asetat sirsak ratu
.
... 7
7 Embrio ikan zebra dengan penambahan ekstrak etil asetat sirsak hutan
.
... 7
8 Profil kromatogram ekstrak etil asetat sirsak ratu dan sirsak hutan dengan
eluen metanol:etil asetat (3:7). ... 11
DAFTAR LAMPIRAN
1 Diagram alir penelitian ... 15
2 Kadar air, kadar abu, dan rendemen buah sirsak ... 16
3 Hasil uji toksisitas BSLT ekstrak etanol ... 17
4 Hasil uji toksisitas BSLT ekstrak etil asetat ... 18
5 Hasil uji toksisitas BSLT ekstrak air ... 19
6 Hasil uji toksisitas embrio ikan zebra ekstrak etanol ... 20
7 Hasil uji toksisitas embrio ikan zebra ekstrak etil asetat... 21
8 Hasil uji toksisitas embrio ikan zebra ekstrak air... 22
9 Hasil pengamatan embrio ikan zebra dengan perlakuan ekstrak sirsak ratu ... 23
10 Hasil pengamatan embrio ikan zebra dengan perlakuan ekstrak sirsak hutan 24
11 Nilai F
hitungpengamatan embrio ikan zebra ... 25
12 Hasil uji Dunnet pengamatan embrio ikan zebra ... 25
PENDAHULUAN
Manfaat dan khasiat tanaman sirsak sebagai antikanker yang sangat efektif telah banyak diteliti. McLaughlin (2008) melaporkan bahwa tanaman famili Annonaceae dapat berfungsi sebagai antikanker, terutama karena kandungan asetogenin. Kelebihan senyawa asetogenin jika dibandingkan dengan obat kanker yang telah beredar adalah senyawa asetogenin secara spesifik menyerang sel kanker dan tidak menyerang sel normal pada tubuh. Golongan senyawa lain yang juga memiliki potensi antikanker adalah flavonoid (Mustariani 2011).
Jenis tanaman famili Annonaceae yang mengandung asetogenin antara lain Asimina triloba (paw paw), Goniothaelamuzs giganteus, Annona squamosa Linn (serikaya),
A. muricata Linn (sirsak), A. bullata Rich.,
Asimina pariflora (Michx.) Dunal, A. longifolia Kral., A. reticulata Linn, A. glabra
Linn, A. jahnii Saff., A. cherimolia Mill. (cherimolia), Xylopia aromatica (Mart.) Lam.,
Rollinia mucosa (Jacq.) Baill. (biriba), dan R. emarginata Schlecht. Jenis tanaman Annonaceae tersebut memiliki beberapa khasiat bagi para penderita tumor dan kanker, yaitu menurunkan kadar darah dari antigen tumor, memperkecil ukuran tumor, menghambat pembelahan sel kanker, menambah bobot badan, meningkatkan pergerakan tubuh, menambah energi, dan meningkatkan lama waktu hidup (McLaughlin 2008).
Jenis sirsak yang banyak dikonsumsi oleh masyarakat pada umumnya adalah A. muricata atau yang biasa disebut dengan sirsak ratu atau sirsak manis (Gambar 1). Pada umumnya bagian tanaman yang telah diteliti adalah daun, biji, dan akar. Wu et al. (1995a dan 1995b), Zeng et al. (1996), dan Kim et al.
(1998) meneliti bagian daun, sementara Rieser
et al. (1996), Li et al. (2000), dan Chang & Wu (2001) meneliti bagian biji. Gleye et al.
(1998 dan 2000) meneliti bagian akar. Bagian buah belum diteliti lebih lanjut, sehingga perlu dilakukan penelitian untuk menguji potensi buah sirsak ratu sebagai antikanker.
Gambar 1 Sirsak ratu (A. muricata).
Sirsak ratu merupakan tanaman pekarangan yang produksi buahnya hanya 400 batang per desa (Trubus 2011), sehingga sulit didapatkan dalam jumlah banyak. Salah satu solusinya adalah dengan mendapatkan jenis sirsak lainnya yang juga berkhasiat antikanker. Cochrane et al. (2008) telah menguji khasiat antikanker bagian-bagian tanaman A. glabra pada sel leukemia. Biji, daun, dan buah dilaporkan memiliki efek antikanker, dan bagian biji paling tinggi khasiatnya. A. glabra biasa dikenal dengan nama sirsak gundul atau sirsak hutan (Gambar 2), dan banyak terdapat di daerah pulau Jawa (Trubus 2011). Menurut masyarakat setempat, sirsak hutan memiliki rasa yang masam dan sering menyebabkan pusing ketika dikonsumsi.
Gambar 2 Sirsak hutan (A. glabra).
Daya sitotoksik dari buah sirsak sirsak ratu dan sirsak hutan sebagai potensi antikanker belum pernah dibandingkan sebelumnya. Oleh karena itu, penelitian ini bertujuan menganalisis dan membandingkan potensi ekstrak kedua buah sirsak tersebut sebagai antikanker. Uji potensi antikanker dilakukan dengan menguji toksisitas buah tersebut.
sitotoksik senyawa antikanker. Selain itu, metode ini juga mudah dikerjakan, murah, cepat, dan cukup akurat (Colegate & Molyneux 2008).
Ikan zebra (Gambar 3) merupakan hewan uji yang mutagennya telah banyak digunakan untuk mengidentifikasi perkembangan gen vertebrata (Jagadeeswaran & Sheehan 1999). Keuntungan penggunaan ikan zebra sebagai hewan uji antara lain tingkat kesamaan yang tinggi dengan mamalia dalam hal pengembangan mekanisme fisiologi molekular dan selular, pembuahan terjadi di luar sehingga memungkinkan pengamatan langsung dan manipulasi embrio, siklus perkembangan cukup cepat, memiliki korelasi sistem organ yang baik dengan vertebrata lain, dan biaya pemeliharaan yang murah. Selain itu, embrio ikan dan larva transparan sehingga dapat dilakukan pengamatan organ dalam secara langsung (tanpa operasi) dengan menggunakan mikroskop cahaya, dan embrio ikan bersifat permeabel terhadap molekul-molekul kecil dan obat-obatan sehingga memungkinkan pengamatan distribusi obat (Kari et al. 2007).
Gambar 3 Ikan zebra (Danio rerio).
Menurut Berghmans et al. (2005), ikan zebra telah dikembangkan sebagai hewan uji dalam penelitian terhadap penyakit manusia. Akhir-akhir ini telah dikembangkan pengujian toksisitas pada embrio ikan zebra terhadap penemuan obat-obatan terbaru dari suatu senyawa bahan alam, termasuk toksisitas akut (LC50). Hasil uji toksisitas pada embrio ikan zebra telah terbukti memiliki korelasi positif dengan hasil uji toksisitas pada mamalia (Ma
et al. 2007). Pengujian senyawa antikanker secara in vivo pada embrio dan ikan zebra juga telah dilakukan oleh Berghmans et al.
(2005), Moore et al. (2006), Hsu et al. (2007), dan Nicoli & Presta (2007).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan selama penelitian ini adalah alat kaca, corong pisah, pipet mikro, bejana kromatografi, neraca
analitik, oven, penguap putar, pengering beku, multiwell, shaker, dan mikroskop stereo.
Bahan-bahan yang digunakan selama penelitian ini adalah buah sirsak hutan yang berasal dari Laboratorium Agronomi IPB Leuwikopo, buah sirsak ratu yang berasal dari daerah Sukabumi, etanol 80%, etil asetat, metanol, kloroform, diklorometana, aseton, kloroform, n-heksana, dimetil sulfoksida (DMSO), dietil eter, FeCl3 1%, NH4OH, H2SO4, HCl pekat, amil alkohol, reagen Wagner, Mayer, Dragendorf, Liebermann-Buchard, serbuk Mg, natrium sulfat anhidrat, pelat aluminium jenis silika gel G60F254 dari Merck, larva A. salina Leach, dan embrio ikan zebra.
Lingkup Kerja
Metode penelitian dilakukan mengikuti diagram alir pada Lampiran 1. Tahapannya meliputi penyiapan sampel buah sirsak, penentuan kadar air dan abu, ekstraksi buah sirsak, partisi ekstrak etanol buah sirsak, pengujian toksisitas, dan pencirian senyawa bioaktif.
Ekstraksi Buah Sirsak (Harborne 1987) Buah sirsak dicuci kemudian dihilangkan kulit dan bijinya. Sebanyak ±100 g sampel buah dimaserasi dengan etanol 80% dengan nisbah 1:3 selama 24 jam. Penggantian pelarut dilakukan sampai hasil ekstraksi tidak berwarna lagi. Ekstrak lalu dipekatkan dengan penguap putar dan pengering beku. Ekstrak pekat yang diperoleh ditimbang dan dihitung rendemennya dengan persamaan sebagai berikut:
Keterangan:
a = bobot ekstrak (g)
b = bobot contoh awal (g)
3
Kadar air (%) =
100
%
A
B
A
Keterangan:
A = bobot bahan sebelum dikeringkan (g)
B = bobot bahan setelah dikeringkan (g)
Penentuan Kadar Abu (AOAC 1984) Cawan porselen dikeringkan di dalam oven bersuhu 105 °C selama 60 menit. Selanjutnya cawan didinginkan dalam eksikator selama 30 menit dan ditimbang bobot kosongnya. Sebanyak 3 g sampel dimasukkan ke dalam cawan dan dipijarkan hingga sampel kering. Sampel lalu diabukan di dalam tanur selama 60 menit pada suhu 700 °C. Setelah itu, cawan didinginkan dalam eksikator sekitar 30 menit dan ditimbang kembali. Penentuan kadar abu dilakukan sebanyak 3 kali ulangan (triplo).
Keterangan:
A = bobot bahan sebelum diabukan (g)
B = bobot bahan setelah diabukan (g)
Partisi Ekstrak Etanol Buah Sirsak
Ekstrak etanol buah sirsak dilarutkan dengan air sebanyak 200 mL dan dimasukkan ke dalam corong pisah. Kemudian diekstraksi menggunakan etil asetat dengan nisbah 1:2. Penambahan etil asetat dilakukan secara bertahap sampai fase organik tidak berwarna. Fase organik dipisahkan dari fase air, lalu dipekatkan dengan penguap putar dan dikeringbekukan.
Uji Toksisitas Ekstrak Terhadap A. Salina (Krishnaraju et al. 2005)
Penetasan Telur A. salina. Telur A. salina yang sudah siap ditetaskan ditimbang sebanyak 0.5 g kemudian dimasukkan ke dalam wadah yang berisi air laut yang sudah disaring dan diaerasi. Telur dibiarkan selama 48 jam di bawah pencahayaan lampu agar menetas sempurna. Telur yang telah menetas menjadi larva digunakan untuk uji toksisitas.
Uji Toksisitas terhadap A. salina. Larutan stok ekstrak etanol, ekstrak etil asetat, dan ekstrak air dibuat dalam konsentrasi 5000 ppm kemudian diencerkan hingga diperoleh konsentrasi 100, 500, 1000, 1500, dan 2000 ppm. Apabila ekstrak tidak larut ditambahkan DMSO. Ke dalam multiwell dimasukkan 400 μL air laut, 10 ekor larva udang dalam 600 μL air laut, dan 1 mL ekstrak. Ulangan dilakukan
sebanyak 4 kali. Multiwell ditutup dengan aluminium foil dan diinkubasi selama 24 jam. Nilai konsentrasi letal 50% (LC50) ditentukan dengan menggunakan kurva hubungan antara konsentrasi ekstrak (sumbu x) dengan rerata persen kematian larva udang (sumbu y).
Uji Toksisitas Ekstrak terhadap Embrio Ikan Zebra (Heiden et al. 2007, Wei et al. 2010, dan Coelho et al. 2011)
Uji Toksisitas. Larutan stok ekstrak etanol, ekstrak etil asetat, dan ekstrak air dibuat dalam konsentrasi 5000 ppm kemudian diencerkan hingga diperoleh konsentrasi 100, 500, 1000, 1500, dan 2000 ppm. DMSO ditambahkan apabila ekstrak tidak larut. Sebanyak 10 telur ikan zebra dalam 1 mL air tawar dan 1 mL ekstrak dimasukkan ke dalam
multiwell. Ulangan dilakukan sebanyak 4 kali.
Multiwell ditutup dengan aluminium foil dan diinkubasi selama 24 jam. LC50 ditentukan dengan menggunakan kurva hubungan antara konsentrasi ekstrak (sumbu x) dengan rerata persen kematian embrio ikan zebra (sumbu y).
Pengamatan Embrio Ikan Zebra.
Embrio ikan zebra yang telah terpapar oleh ekstrak aktif selama 24 jam diamati morfologinya dengan menggunakan mikroskop stereo.
Uji Fitokimia (Harborne 1987)
Alkaloid. Sebanyak 0.1 g ekstrak aktif buah sirsak dilarutkan dalam 10 mL kloroform lalu ditambahkan 4 tetes NH4OH dan disaring. Filtrat yang diperoleh ditambahkan 10 tetes H2SO4 2 M, kemudian dikocok hingga terbentuk 2 lapisan. Lapisan asam diteteskan pada lempeng tetes dan ditambahkan pereaksi Dragendorf, Mayer, dan Wagner. Uji positif jika berturut-turut didapatkan endapan berwarna jingga, putih, dan cokelat.
Saponin. Sebanyak 0.1 g ekstrak aktif buah sirsak dilarutkan dalam 10 mL akuades panas dan dididihkan selama 5 menit. Campuran disaring dan dikocok kuat selama 10 menit hingga timbul busa. Apabila busa stabil selama 10 menit, maka filtrat positif mengandung saponin.
ditambahkan 3 tetes pereaksi Lieberman-Burchard. Uji positif triterpenoid ditandai dengan terbentuknya warna merah atau ungu, sedangkan uji positif steroid ditandai dengan terbantuknya warna hijau atau biru.
Tanin. Sebanyak 0.1 g ekstrak aktif buah sirsak dilarutkan dalam 10 mL akuades panas, kemudian disaring. Filtrat ditambahkan FeCl3 1%. Warna hijau, biru, atau hitam menunjukkan filtrat positif mengandung tanin.
Flavonoid. Sebanyak 0.1 g ekstrak aktif buah sirsak dilarutkan dalam 10 mL akuades panas, kemudian disaring. Sebanyak 5 mL filtrat ditambahkan 0.05 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol, kemudian dikocok kuat. Adanya flavonoid ditunjukkan dengan terbentuknya warna merah, jingga, atau kuning pada lapisan amil alkohol.
Penentuan Fraksi Ekstrak Teraktif (Hounghton dan Raman 1998)
Digunakan pelat kromatografi lapis tipis (KLT) aluminium jenis gel silika G60F254 dari Merck. Ekstrak teraktif buah sirsak ditotolkan pada pelat KLT. Setelah kering, langsung dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Elusi tahap pertama dilakukan dengan menggunakan eluen tunggal metanol, etanol, etil asetat, aseton, diklorometana, kloroform, dan n-heksana. Noda yang dihasilkan dari proses elusi masing-masing eluen diamati di bawah lampu UV pada panjang gelombang 254 nm. Eluen terbaik ialah yang menghasilkan noda terbanyak dan terpisah dengan baik. Jika lebih dari 1 eluen menghasilkan noda terbanyak dan terpisah baik, maka eluen-eluen tersebut dicampurkan dengan nisbah tertentu hingga diperoleh campuran eluen terbaik dengan pemisahan noda yang terbaik.
HASIL DAN PEMBAHASAN
Kadar Air dan Kadar Abu
Penentuan kadar air dapat berguna untuk mengetahui cara penyimpanan contoh agar terhindar dari pengaruh aktivitas mikrob. Menurut Winarno (1995), contoh dapat disimpan dalam jangka waktu lama apabila kadar airnya kurang dari 10%. Selain itu, penentuan kadar air juga digunakan sebagai faktor koreksi dalam perhitungan rendemen ekstrak yang dihasilkan (Harborne 1987). Air yang terkandung dalam buah sirsak
dihilangkan dengan pemanasan pada suhu 105
⁰C. Air yang terikat secara fisik dapat dihilangkan dengan pemanasan pada suhu 100–105 ⁰C (Harjadi 1986). Kadar air yang diperoleh dari buah sirsak ratusebesar 80.49% dan sirsak hutan 89.28% (Tabel 1). Kadar air buah sirsak lebih dari 10% (Lampiran 2) dan cukup tinggi sehingga waktu simpan sampel cukup singkat dan harus dengan penanganan tertentu, seperti suhu penyimpanan rendah dan tempat penyimpanan yang tidak terkontaminasi oleh mikrob.
Tabel 1 Kadar air dan abu buah sirsak
Bahan Kadar air (%)
Kadar abu (%)
Sirsak ratu 80.49 0.67
Sirsak hutan 89.28 0.94
Abu merupakan zat anorganik sisa pembakaran suatu bahan organik, kadarnya bergantung pada bahan yang diabukan dan cara pengabuannya (Sudarmadji et al. 1996). Penentuan kadar abu dapat dilakukan dengan metode gravimetri. Prinsip metode ini adalah pemijaran sampel pada suhu 600 ⁰C selama ± 60 menit dalam tanur (Harjadi 1986). Hasil pemijaran adalah bobot mineral yang terkandung dalam suatu bahan. Dalimartha (2005) melaporkan batas maksimum kadar abu tanaman herbal yang dapat dipakai sebagai obat adalah 5%. Kadar abu buah sirsak ratu sebesar 0.67% dan buah sirsak hutan 0.94% (Tabel 1). Kadar abu kedua buah sirsak tersebut berada di bawah nilai 5%, sehingga aman untuk digunakan sebagai obat (Lampiran 2).
Ekstraksi
Metode maserasi digunakan untuk mengekstraksi sampel buah sirsak, karena kandungan senyawa yang terdapat pada sampel belum diketahui daya tahannya terhadap panas. Pelarut yang digunakan adalah etanol 80%. Harborne (1987) menyatakan bahwa alkohol merupakan pelarut serba guna yang sangat baik untuk ekstraksi pendahuluan, karena dapat mengekstraksi senyawa polar dan nonpolar dengan baik. Etanol juga tidak memiliki sifat toksik, sehingga aman untuk mengekstraksi bahan alam yang akan digunakan sebagai obat. Wu
5
yang terdapat dalam sampel telah terekstraksi dengan sempurna.
Hasil maserasi menghasilkan rendemen berdasarkan bobot basah sebesar 7.60% untuk ekstrak sirsak ratu dan 5.06% untuk ekstrak sirsak hutan (Tabel 2). Didapatkan padatan berwarna cokelat tua. Rendemen ekstrak sirsak ratu lebih besar dibandingkan dengan ekstrak sirsak hutan(Lampiran 2). Karena itu, kandungan senyawa fitokimia pada ekstrak sirsak ratu diperkirakan lebih besar jika dibandingkan dengan ekstrak sirsak hutan.
Tabel 2 Rendemen buah sirsak
Bahan
Rendemen (% (b/b)) Ekstrak etanol Ekstrak etil asetat Ekstrak air
Sirsak ratu 7.60 0.09 1.45 Sirsak hutan 5.06 0.19 0.38
Ekstrak etanol kemudian dipartisi cair-cair dengan pelarut air-etil asetat. Partisi ini bertujuan memisahkan komponen-komponen semipolar dan nonpolar dengan komponen polar. Colegate dan Molyneux (2008) menyatakan ekstrak metanol atau etanol dari sampel segar dapat dipartisi kembali dengan etil asetat untuk memisahkan komponen nonpolar dari fraksi air. Diharapkan komponen aktif ekstrak buah sirsak terdapat pada fase organik (etil asetat). Rendemen fraksi etil asetat berdasarkan bobot basah didapatkan sebesar 0.09% untuk ekstrak sirsak ratu dan 0.19% untuk ekstrak sirsak hutan (Tabel 2). Rendemen fraksi air berdasarkan bobot basah didapatkan sebesar 1.45% untuk ekstrak sirsak ratu dan 0.38% untuk ekstrak sirsak hutan (Tabel 2). Fraksi etil asetat berbentuk pasta berwarna cokelat tua dan fraksi air berbentuk padatan berwarna cokelat tua. Rendemen etil asetat ekstrak sirsak ratu lebih kecil (Lampiran 2), maka kandungan senyawa semipolar dan nonpolarnya diperkirakan lebih sedikit daripada ekstrak sirsak hutan.
Uji Toksisitas Terhadap Larva Udang Uji toksisitas dengan metode BSLT digunakan untuk memantau senyawa bioaktif yang baru dari bahan alam (Mukhtar et al.
2007). Hewan uji yang digunakan adalah A. salina L. Metode ini merupakan uji pendahuluan suatu komponen aktif dari tanaman yang kemudian dapat didukung oleh uji lanjutan terhadap senyawa aktif yang telah diisolasi. BSLT dapat meramalkan sitotoksisitas dan aktivitas pestisida. Hasil uji BSLT mempunyai korelasi yang positif dengan toksisitas dan sitotoksisitas pada sel
leukemia dan sel tumor (Colegate dan Molyneux 2008). Hasil uji yang didapatkan adalah nilai LC50 yang apabila nilainya berada di bawah 1000 ppm, maka ekstrak yang diujikan memiliki sifat sitotoksik dan potensi sebagai antikanker.
Gambar 4 menyajikan data nilai LC50 dengan metode BSLT. Hasil pengujian untuk ekstrak etanol sirsak ratu memiliki nilai R2
sebesar 0.9931 dan LC50 sebesar 274.0497 ppm. Ekstrak etanol sirsak hutan memiliki nilai R2 sebesar 0.9933 dan LC50 sebesar 309.2616 ppm (Lampiran 3). Ekstrak etil asetat sirsak ratu memiliki nilai R2 sebesar 0.9921 dan LC50 sebesar 30.4470 ppm. Ekstrak etil asetat sirsak hutan memiliki nilai
R2 sebesar 0.9931 dan LC50 sebesar 42.3488 ppm (Lampiran 4). Ekstrak air sirsak ratu memiliki nilai R2 sebesar 0.9966 dan LC50 sebesar 143.0910 ppm. sedangkan ekstrak air sirsak hutan memiliki nilai R2 sebesar 0.9983 dan LC50 sebesar 167.0250 ppm (Lampiran 5).
Gambar 4 Nilai LC50 uji toksisitas terhadap
A. salina.
Berdasarkan AOAC (2002), nilai koefisien korelasi (R2) yang baik adalah lebih besar atau sama dengan 0.9900. Semua nilai LC50 ekstrak buah sirsak memiliki nilai R2 di atas 0.9900, yang menunjukkan hubungan linear antara persen kematian dan konsentrasi sampel. Meskipun uji toksisitas ini tidak spesifik untuk antikanker, hasil uji senyawa antikanker menunjukkan korelasi yang signifikan terhadap kematian larva udang (Mukhtar et al. 2007). Ekstrak buah sirsak ratu dan sirsak hutan memiliki potensi aktivitas yang tinggi (kurang dari 1000 ppm) untuk diteliti dan dikembangkan dengan menggunakan metode yang lebih spesifik terhadap efek antikanker.
Dalam penelitian sebelumnya, Zeng et al. (1996) melakukan uji toksisitas terhadap ekstrak etanol daun sirsak ratu. Nilai LC50 yang didapatkan sebesar 30.5 ppm, lebih kecil dibandingkan dengan nilai LC50 ekstrak etanol
0 50 100 150 200 250 300 350 ekstrak etanol ekstrak etil asetat ekstrak air (p p m )
6
buah (274.0497 ppm). Karena itu, ekstrak etanol daun sirsak memiliki daya sitotoksik yang diprediksi lebih tinggi daripada ekstrak etanol buah sirsak. Rieser et al. (1996) dan Zeng et al. (1996) mendapatkan nilai LC50 untuk ekstrak kasar teraktif daun sirsak ratu berada di bawah nilai 250 ppm. Jika dibandingkan dengan nilai LC50 tersebut, maka ekstrak etil asetat merupakan ekstrak teraktif dengan nilai LC50 terendah.
Uji Toksisitas Terhadap Embrio Ikan Zebra
Pengembangan embrio dan ikan zebra sebagai hewan uji dalam pengujian penyakit dan obat manusia dilatarbelakangi oleh terbatasnya mamalia yang dapat digunakan sebagai hewan uji. Embrio ikan zebra telah berhasil dikembangkan sebagai model untuk pengujian toksisitas akut suatu obat (Kari et al. 2007). Pengujian toksisitas akut terhadap embrio ikan zebra telah dilakukan oleh Wei et al. (2010), dan Coelho et al. (2011). Heiden et al. (2007) melakukan uji toksisitas pada senyawa yang digunakan untuk medium obat dalam tubuh manusia. Uji toksisitas tersebut menghasilkan nilai LC50 yang dapat mengindikasikan efek dari obat yang diujikan terhadap mamalia (Kari et al. 2007).
Uji toksisitas dengan menggunakan embrio ikan zebra merupakan uji lanjutan terhadap ekstrak buah sirsak untuk melihat potensinya sebagai antikanker. Embrio diberikan perlakuan dengan penambahan ekstrak pada rentang konsentrasi tertentu. Setelah 24 jam, embrio ikan zebra akan menetas dan berkembang menjadi larva (Ma
et al. 2007). Jika ekstrak yang diberikan terhadap embrio bersifat toksik, maka perkembangan embrio tersebut akan terhambat dan dapat menyebabkan kematian.
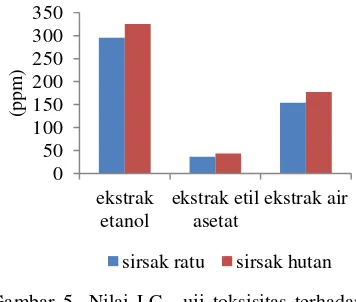
Gambar 5 menyajikan data nilai LC50 dengan menggunakan metode uji embrio ikan zebra. Ekstrak etanol sirsak ratu menghasilkan nilai R2 sebesar 0.9971 dan LC50 sebesar 295.1257 ppm. Ekstrak etanol sirsak hutan menghasilkan nilai R2 sebesar 0.9932 dan LC50 sebesar 325.1409 ppm (Lampiran 6). Ekstrak etil asetat sirsak ratu memiliki nilai R2
sebesar 0.9959 dan LC50 sebesar 36.2806 ppm. Ekstrak etil asetat sirsak hutan memiliki nilai R2 sebesar 0.9978 dan LC50 sebesar 43.8747 ppm (Lampiran 7). Ekstrak air sirsak ratu memiliki nilai R2 sebesar 0.9981 dan LC50 sebesar 153.8617 ppm, sedangkan ekstrak air sirsak hutan memiliki nilai R2 sebesar 0.9936 dan LC50 sebesar 177.3610 ppm (Lampiran 8). Nilai koefisien korelasi yang dihasilkan dari
setiap ekstrak buah sirsak berada di atas nilai 0.9900, sehingga dapat dikatakan terdapat hubungan yang linear antara persen kematian dan konsentrasi sampel pada uji toksisitas dengan embrio ikan zebra ini (AOAC 2002).
Gambar 5 Nilai LC50 uji toksisitas terhadap embrio ikan zebra.
Ekstrak etil asetat dari kedua sampel buah sirsak menghasilkan nilai LC50 yang paling rendah. Hasil ini serupa dengan pengujian menggunakan metode BSLT. Oleh karena itu, dapat dikatakan bahwa ekstrak etil asetat dari buah sirsak ratu dan sirsak hutan paling aktif dan memiliki daya sitotoksik paling tinggi.
Bila dibandingkan dengan nilai LC50 dari metode BSLT, nilai LC50 hasil uji toksisitas terhadap embrio ikan zebra lebih besar. Hal ini dikarenakan ikan zebra merupakan organisme yang lebih kompleks dibandingkan dengan A. salina, sehingga memiliki ketahanan tubuh yang lebih baik terhadap senyawa toksik yang diujikan.
Pengamatan Embrio Ikan Zebra Embrio ikan zebra yang telah diamati untuk penentuan nilai LC50 kemudian diamati secara mikroskopik untuk mengetahui pengaruh ekstrak aktif terhadap morfologi embrio. Embrio ikan zebra secara in vivo
dapat mewakili kompleksitas fisiologis dan morfologis yang terdapat pada organisme dewasa. Oleh karena itu, embrio tersebut memiliki potensi untuk menggambarkan informasi organisme yang lengkap dalam suatu uji toksisitas (Ma et al. 2007). Suatu ekstrak dapat dikatakan memiliki potensi antikanker apabila penambahan ekstrak tersebut pada embrio ikan zebra memberikan pengaruh yang signifikan terhadap pertumbuhan morfologi embrio (Coelho et al
2011).
Pengamatan embrio dilakukan dengan mikroskop stereo. Foto objek dapat digunakan untuk mengukur organ-organ embrio dengan
0 50 100 150 200 250 300 350 ekstrak etanol ekstrak etil asetat ekstrak air (p p m )
7
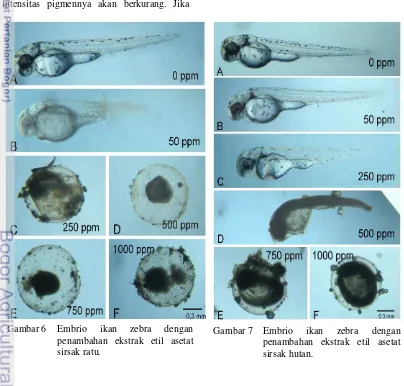
Gambar 6 Embrio ikan zebra dengan penambahan ekstrak etil asetat sirsak ratu.
Gambar 7 Embrio ikan zebra dengan penambahan ekstrak etil asetat sirsak hutan.
menggunakan skala preparat, setelah semua embrio dari masing-masing konsentrasi uji diamati. Organ-organ yang diamati antara lain pigmentasi, panjang tubuh, diameter embrio (jika embrio tidak menetas), kepala, mata, jantung, kantung kuning telur, dan ekor.
Perlakuan dengan ekstrak etil asetat sirsak ratu menghasilkan perbedaan morfologi embrio yang cukup signifikan (Gambar 6). Kontrol (0 ppm) menghasilkan perkembangan embrio yang telah sempurna menjadi larva (A). Organ-organ embrio tersebut telah berkembang dengan sempurna dan terlihat dengan jelas. Heiden et al. (2007) dan Wei et al. (2010) melaporkan bahwa larva ikan zebra yang normal akan memiliki sumbu tubuh yang lurus. Larva kontrol memiliki sumbu tubuh yang lurus, sehingga dapat dikatakan larva kontrol berkembang dengan normal. Perkembangan sempurna larva kontrol juga dapat ditunjukkan dengan pigmentasi yang terjadi. Coelho et al. (2011) menyatakan jika larva ikan zebra memiliki kelainan, maka intensitas pigmennya akan berkurang. Jika
dibandingkan dengan pigmentasi normal larva ikan zebra pada penelitian tersebut, intensitas pigmen pada kontrol memiliki kemiripan. Organ jantung, kantung kuning telur, ekor, dan kepala pada kontrol juga telah berkembang dengan baik.
8
Organ jantung dan mata tidak dapat teramati dengan jelas. Keabnormalan yang terjadi pada larva B merupakan indikasi bahwa ekstrak etil asetat sirsak ratu sudah bersifat toksik pada konsentrasi 50 ppm.
Perlakuan selanjutnya (C) merupakan pemaparan ekstrak dengan konsentrasi 250 ppm. Embrio tidak menetas menjadi larva, namun telah terjadi perkembangan embrio di dalam telur. Perlakuan konsentrasi 500 ppm (D), 750 ppm (E), dan 1000 ppm (F) membuat embrio tidak menetas dan bahkan tidak terjadi perkembangan di dalam telur. Embrio yang berwarna gelap menunjukkan bahwa embrio telah lama mati sebelum waktu pengamatan (sebelum 24 jam). Hasill pengamatan ini menunjukkan bahwa daya sitotoksik ekstrak semakin meningkat dengan semakin meningkatnya konsentrasi.
Hasil pengamatan pada perlakuan ekstrak sirsak hutan (Gambar 7) tidak menampakkan perbedaan yang signifikan jika dibandingkan dengan ekstrak sirsak ratu. Embrio kontrol (0 ppm) telah menetas dan berkembang dengan sempurna (A). Pigmentasi dan perkembangan organ-organ juga telah terjadi dengan baik.
Embrio dengan perlakuan konsentrasi 50 ppm (B) telah menetas menjadi larva. Namun, terdapat beberapa abnormalitas pada larva B. Intensitas pigmentasi tidak sebaik kontrol, posisi kepala menekuk ke dalam, dan ukuran kantung kuning telur lebih besar dibandingkan dengan kontrol (Lampiran 10). Ini merupakan indikasi bahwa pada konsentrasi 50 ppm, daya sitotoksik ekstrak sirsak hutan telah memengaruhi perkembangan embrio, tetapi tidak sekuat ekstrak sirsak ratu. Hasil ini berkorelasi dengan nilai LC50 yang dihasilkan, nilai LC50 ekstrak etil asetat sirsak ratu (36.2806 ppm) lebih kecil dibandingkan dengan ekstrak sirsak hutan (43.8747 ppm).
Konsentrasi 250 ppm (C), memberikan pengaruh yang lebih signifikan pada larva. Larva C lebih pendek daripada kontrol (Lampiran 10). Bentuk kepala juga lebih merunduk dan intensitas pigmentasi lebih sedikit dibandingkan dengan kontrol. Kantung kuning telur mengalami kerusakan sehingga dapat memengaruhi asupan nutrisi yang dibutuhkan oleh larva. Larva D dengan konsentrasi ekstrak 500 ppm mengalami abnormalitas yang lebih buruk. Embrio D telah menetas, namun tidak berkembang dengan baik menjadi larva. Diperkirakan setelah menetas, larva D langsung mengalami kematian. Hal ini ditunjukkan dengan organ tubuh yang belum berkembang dengan sempurna dan warna larva yang gelap.
Pengamatan embrio E (750 ppm) dan F (1000 ppm) menunjukkan daya sitotoksik tertinggi pada ekstrak etil asetat sirsak hutan. Embrio tidak menetas, namun mengalami perkembangan di dalam telurnya. Pada embrio E, perkembangannya lebih baik, ditandai dengan morfologi embrio yang sudah menyerupai larva. Hal ini sesuai dengan konsentrasi ekstrak yang semakin meningkat, maka daya sitotoksiknya pun akan semakin meningkat.
Gambar 6 dan 7 cukup jelas menunjukkan bahwa ekstrak etil asetat kedua buah sirsak dapat menghambat pertumbuhan embrio ikan zebra, maka diharapkan dapat memberikan efek yang serupa terhadap pertumbuhan sel kanker. Ekstrak etil asetat dapat menghambat pertumbuhan morfologi embrio, merusak organ mata, kantung kuning telur, dan jantung, serta menghambat laju peredaran darah embrio. Laju aliran darah pada embrio mengalami perlambatan dengan semakin besarnya konsentrasi ekstrak yang diberikan. Hal tersebut menggambarkan bahwa ekstrak etil asetat dapat menghambat laju aliran darah pada sel kanker. Jika laju aliran darah dapat dihambat, maka asupan nutrisi untuk sel akan berkurang. Hal ini jika berlangsung lama dapat mengakibatkan kematian pada sel. Efek tersebut diharapkan dapat membunuh sel kanker di dalam tubuh manusia. Namun, perlu dilakukan penelitian lebih lanjut untuk mengetahui kinerja spesifik antikanker dari ekstrak etil asetat buah sirsak.
Analisis statistik yang digunakan untuk menguji data pengamatan embrio ikan zebra adalah uji Anova 1 arah dan uji lanjutan Dunnet post hoc. Uji Anova 1 arah digunakan untuk membandingkan rata-rata lebih dari 2 kelompok dan untuk menganalisis apakah konsentrasi ekstrak yang diberikan memengaruhi morfologi embrio secara signifikan. Hipotesis yang digunakan adalah H0: konsentrasi tidak berpengaruh terhadap morfologi embrio, dan H1: konsentrasi berpengaruh terhadap morfologi embrio. Pengambilan putusan didasarkan perbandingan nilai Fhitung dengan Ftabel. Jika Fhitung > Ftabel, maka H0 ditolak (Walpole 1993). Nilai Ftabel yang digunakan pada taraf nyata 0.05 adalah 3.106.
9
perlakuan konsentrasi berbeda signifikan dengan kontrol (Mattjik & Jaya 2006).
Semua data pengamatan embrio menghasilkan nilai Fhitung > Ftabel (Lampiran 11) sehingga H0 ditolak dan H1 diterima: konsentrasi yang diberikan berpengaruh terhadap morfologi embrio. Pigmentasi pada ekstrak sirsak ratu tidak menghasilkan nilai Fhitung, hal ini dikarenakan data pigmentasi sudah berbeda nyata pada konsentrasi 50 ppm. Hasil uji Dunnet untuk panjang tubuh embrio (Lampiran 12) dengan ekstrak sirsak ratu memberikan nilai p < 0.05 pada konsentrasi 250 sampai 1000 ppm. Konsentrasi 50 ppm menghasilkan nilai p > 0.05. Jadi, pada konsentrasi 50 ppm, panjang tubuh embrio tidak berbeda signifikan dengan kontrol, sedangkan pada konsentrasi 250– 1000 ppm panjang tubuh embrio berbeda secara signifikan. Hasil uji Dunnet untuk panjang tubuh embrio dengan ekstrak sirsak hutan memberikan nilai p < 0.05 pada konsentrasi 500–1000 ppm. Konsentrasi 50 dan 250 ppm menghasilkan nilai p di atas 0.05. Panjang tubuh embrio pada kedua perlakuan tersebut tidak berbeda secara signifikan dengan kontrol, sedangkan pada konsentrasi 500 hingga 1000 ppm, panjang tubuh embrio berbeda secara signifikan. Perbandingan kedua hasil uji Dunnet tersebut menggambarkan bahwa ekstrak sirsak ratu memberikan pengaruh sitotoksik yang lebih besar dibandingkan dengan ekstrak sirsak hutan. Hal ini dapat dilihat dari perbedaan panjang tubuh embrio yang signifikan dimulai pada konsentrasi 250 ppm.
Data pigmentasi (Lampiran 9) untuk ekstrak sirsak ratu tidak menghasilkan nilai signifikansi. Hal ini dikarenakan pada konsentrasi 50 ppm, skor pigmentasi embrio adalah 0. Sama halnya untuk konsentrasi 250–1000 ppm, skor pigmentasi adalah 0, karena pada konsentrasi tersebut embrio tidak menetas menjadi larva sehingga tidak dapat diamati skor pigmentasinya. Ekstrak sirsak hutan menghasilkan nilai signifikansi pada konsentrasi 50 dan 250 ppm (Lampiran 12). Nilai p < 0.05, sehingga dapat dikatakan pigmentasi embrio pada kedua konsentrasi tersebut berbeda signifikan dengan kontrol. Pada konsentrasi 500–1000 ppm, tidak terdapat nilai signifikansi. Hal ini dikarenakan embrio tidak menetas menjadi larva. Data pigmentasi ini juga menyimpulkan bahwa ekstrak sirsak ratu memberikan efek sitotoksik yang lebih tinggi dibandingkan dengan ekstrak sirsak hutan, karena telah
menghambat perkembangan pigmen embrio dari konsentrasi 50 ppm.
Uji Dunnet pada data jantung embrio menunjukkan bahwa perlakuan ekstrak sirsak ratu memberikan nilai p < 0.05 untuk setiap konsentrasi (Lampiran 12). Nilai yang sama juga diperoleh untuk konsentrasi ekstrak sirsak hutan. Hal ini berarti setiap konsentrasi memberikan efek sitotoksik yang memengaruhi perkembangan jantung embrio. Berdasarkan data tersebut, dapat dikatakan kedua ekstrak buah sirsak memberikan daya sitotoksik yang cukup besar terhadap embrio ikan zebra.
Data kantung kuning telur (Lampiran 12) untuk perlakuan ekstrak sirsak ratu menghasilkan nilai p < 0.05 pada konsentrasi 250 hingga 1000 ppm. Konsentrasi 50 ppm menghasilkan nilai p > 0.05. Sementara data kantung kuning telur untuk perlakuan ekstrak sirsak hutan menghasilkan nilai p > 0.05 pada konsentrasi 50–500 ppm. Konsentrasi 750 dan 1000 ppm baru menghasilkan nilai p < 0.05. Jika dibandingkan dengan ekstrak sirsak hutan, ekstrak sirsak ratu juga memberikan daya sitotoksik yang lebih tinggi terhadap perkembangan kuning telur.
Pengukuran kepala embrio (Lampiran 12) dengan perlakuan ekstrak sirsak ratu menghasilkan nilai p < 0.05 untuk setiap konsentrasi. Embrio ikan pada konsentrasi 250–1000 ppm tidak menetas menjadi larva sehingga ukuran kepala tidak dapat dihitung. Namun, pada konsentrasi 50 ppm embrio telah menetas dan ukuran kepala berbeda signifikan jika dibandingkan dengan kontrol. Hal ini sekali lagi menggambarkan bahwa ekstrak sirsak ratu telah memberikan efek sitotoksik yang cukup besar dimulai dari konsentrasi terendah. Pengukuran kepala embrio pada perlakuan ekstrak sirsak hutan memberikan nilai p < 0.05 hanya pada konsentrasi 250– 1000 ppm.
10
perkembangan mata embrio mulai konsentrasi 500 ppm.
Pengukuran ekor embrio (Lampiran 12) pada perlakuan ekstrak sirsak ratu maupun sirsak hutan memberikan nilai p < 0.05 pada konsentrasi 250–1000 ppm. Konsentrasi 50 ppm memberikan nilai p > 0.05. Hal ini dikarenakan pada konsentrasi 250–1000 ppm, embrio tidak menetas menjadi larva. Hasil pengukuran mata embrio menunjukkan bahwa daya sitotoksik sirsak ratu lebih tinggi daripada sirsak hutan, tetapi hasil pengamatan ekor embrio memperlihatkan daya sitotoksik yang sama untuk kedua ekstrak.
Perbandingan hasil pengamatan embrio dari kedua ekstrak etil asetat buah sirsak secara umum menunjukkan bahwa ekstrak etil asetat sirsak ratu memberikan efek sitotoksik yang lebih besar pada embrio dibandingkan dengan ekstrak etil asetat sirsak hutan. Dapat dikatakan bahwa daya sitotoksik yang terbesar terdapat pada ekstrak etil asetat sirsak ratu. Hasil pengamatan embrio ini juga menunjukkan bahwa uji toksisitas menggunakan embrio ikan zebra lebih sensitif jika dibandingkan dengan menggunakan metode BSLT. Hal ini dikarenakan data toksisitas pada metode embrio ikan zebra dapat ditunjang dengan pengamatan mikroskopik bagian-bagian organ yang terkena dampak sitotoksik. Selain itu, ikan zebra memiliki organ-organ yang lebih kompleks sehingga memiliki korelasi yang lebih baik dengan organ hewan vertebrata lainnya.
Uji Fitokimia
Pengujian fitokimia bertujuan mengetahui kandungan metabolit sekunder yang terdapat pada suatu tanaman. Uji fitokimia dilakukan terhadap ekstrak teraktif, yaitu ekstrak etil asetat. Uji yang dilakukan meliputi uji alkaloid, saponin, triterpenoid, steroid, tanin, dan flavonoid.
Hasil uji fitokimia terhadap ekstrak etil asetat buah sirsak (Tabel 3) menunjukkan bahwa ekstrak etil asetat kedua buah sirsak mengandung golongan senyawa alkaloid, tanin, dan flavonoid. Hasil uji negatif ditunjukkan pada uji saponin, triterpenoid, dan steroid. Hasil uji negatif mengindikasikan bahwa ekstrak etil asetat buah sirsak tidak mengandung golongan senyawa tersebut atau kandungan fitokimia yang terdapat dalam contoh sangat kecil.
Tabel 3 Uji fitokimia ekstrak etil asetat buah sirsak
Uji fitokimia Bahan Keterangan Sirsak ratu Sirsak hutan
Alkaloid +++ +++ terdapat
endapan
Saponin - - tidak berbusa
Triterpenoid - -
tidak berwarna merah/ungu
Steroid - -
tidak berwarna hijau/biru
Tanin + ++ hijau
Flavonoid + ++ kuning
Keterangan: (-): tidak terdeteksi; (+): terdeteksi. Banyaknya (+) menunjukkan intensitas warna atau endapan yang terbentuk.
Alkaloid merupakan golongan senyawa yang banyak terkandung pada ekstrak etil asetat buah sirsak. Baik pada ekstrak sirsak ratu maupun sirsak hutan, hasil uji fitokimia untuk golongan senyawa alkaloid menghasilkan intensitas endapan yang cukup banyak. Uji fitokimia golongan senyawa tanin dan flavonoid pada sirsak hutanmenghasilkan intensitas warna yang lebih pekat jika dibandingkan dengan sirsak ratu. Hal tersebut mengindikasikan pada sirsak hutan mengandung lebih banyak golongan senyawa tanin dan flavonoid dibandingkan dengan sirsak ratu.
Hasil positif uji fitokimia menunjukkan bahwa kemungkinan golongan senyawa yang aktif sebagai antikanker pada buah sirsak adalah alkaloid, tanin, dan flavonoid. Mustariani (2011) melaporkan bahwa senyawa golongan flavonoid yang berperan sebagai antikanker dari daun sirsak adalah kaempferol. Hasil uji fitokimia ini juga sesuai dengan uji fitokimia yang dilakukan McLaughlin (2008) terhadap Asimina triloba
(paw paw). Pada penelitian tersebut ditemukan golongan senyawa tanin, flavonoid, dan alkaloid pada ekstrak A. triloba.
Penentuan Fraksi Ekstrak Teraktif Penentuan fraksi ekstrak teraktif dilakukan dengan menggunakan metode KLT. Langkah awal adalah penentuan pelarut terbaik. Pelarut yang digunakan memiliki tingkat kepolaran yang berbeda, antara lain metanol, etanol, etil asetat, aseton, diklorometana, kloroform, dan
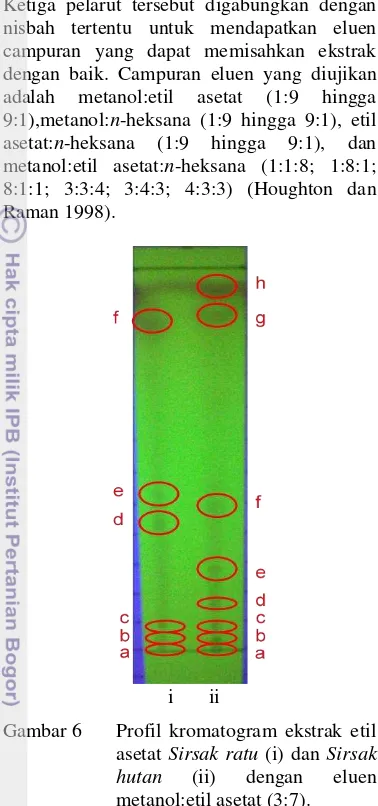
memberikan keterpisahan yang terbaik. Ketiga pelarut tersebut digabungkan dengan nisbah tertentu untuk mendapatkan eluen campuran yang dapat memisahkan ekstrak dengan baik. Campuran eluen yang diujikan adalah metanol:etil asetat (1:9 hingga 9:1),metanol:n-heksana (1:9 hingga 9:1), etil asetat:n-heksana (1:9 hingga 9:1), dan metanol:etil asetat:n-heksana (1:1:8; 1:8:1; 8:1:1; 3:3:4; 3:4:3; 4:3:3) (Houghton dan Raman 1998).
i ii
Gambar 6 Profil kromatogram ekstrak etil asetat Sirsak ratu (i) dan Sirsak hutan (ii) dengan eluen metanol:etil asetat (3:7).
Pola keterpisahan terbaik didapatkan dengan eluen metanol:etil asetat (3:7), baik untuk sirsak ratu dan sirsak hutan. Komponen ekstrak etil asetat sirsak ratu memisah menjadi 6 noda dan ekstrak etil asetat sirsak hutan menjadi 8 noda (Gambar 6). Tabel 4 memberikan informasi nilai Rf yang didapatkan dari kedua ekstrak etil asetat buah sirsak tersebut.
Tabel 4 Nilai Rf ekstrak etil asetat buah sirsak Noda Nilai Rf
Sirsak ratu Sirsak hutan
a 0.01 0.01
b 0.03 0.03
c 0.07 0.06
d 0.33 0.12
e 0.41 0.22
f 0.85 0.39
g - 0.87
h - 0.95
Berdasarkan nilai Rf tersebut, terdapat 2 noda yang memiliki nilai sama, yaitu noda a dan b. Nilai Rf yang sama mengindikasikan senyawa tersebut merupakan komponen atau senyawa yang sama. Hasil KLT ini menunjukkan bahwa terdapat 8 komponen atau senyawa pada ekstrak aktif sirsak hutan dan 6 komponen atau senyawa pada ekstrak aktif sirsak ratu yang memiliki kemungkinan sebagai antikanker.
SIMPULAN DAN SARAN
Simpulan
Ekstrak kasar buah sirsak (sirsak ratu dan sirsak hutan) berpotensi sebagai antikanker. Ekstrak etil asetat paling aktif, dengan daya sitotoksik terbaik dimiliki oleh ekstrak etil asetat sirsak ratu, berdasarkan uji dengan metode BSLT dan pengamatan embrio ikan zebra. Ekstrak etil asetat sirsak ratu memiliki 6 noda dan ekstrak etil asetat sirsak hutan memiliki 8 noda. Golongan senyawa yang terkandung antara lain alkaloid, flavonoid, dan tanin.
Saran
Perlu dilakukan penelitian lebih lanjut untuk memfraksionasi ekstrak aktif buah sirsak, menentukan jenis senyawa yang berperan sebagai antikanker, dan menganalisis kinerja spesifik antikanker dari ekstrak aktif buah sirsak.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 1984. Official Methods of Analysis. Ed ke-14. Arlington: AOAC.
[AOAC] Association of Official Analytical Chemists. 2002. AOAC International methods committee guidelines for validation of qualitative and quantitative food microbiological official methods of analysis. J AOAC Int 85:1-5.
Berghmans S et al. 2005. Making waves in cancer research: New models in the Zebrafish. BioTechniques 39:227-237.
12
Point of View. Driebergen: Louis Bolk Institut.
Chang FR, Wu YC. 2001. Novel cytotoxic Annonaceous acetogenins from Annona muricata. J Nat Prod 64:925-931.
Cochrane CB, Nair PKR, Melnick SJ, Resek AP, Ramachandran C. 2008. Anticancer effects of Annona glabra plant extracts in human leukimia cell lines. Anticancer Res
28:965-972.
Coelho et al. 2011. Assessing lethal and sub-lethal effects of trichlorfon on different trophic levels. Aqua Toxicol 103:191-198.
Colegate SM, Molyneux RJ. 2008. Bioactive Natural Products: Detection, Isolation, and Structural Determination. California: CRC Pr.
Dalimartha S. 2005. Temu Lawak dalam Atlas Tumbuhan Obat Indonesia. [terhubung berkala]. http://pusdiknakes.or.id/persi-new/news/content/temulawak_herbal.pdf [31 Des 2010].
Gleye C, Duret P, Laurens A, Hocquemiller R, Cave A. 1998. cis-Monotetrahydrofuran acetogenins from the roots of Annona muricata. J Nat Prod 61:576-579.
Gleye C et al. 2000. Cohibin C and D, two important metabolites in the biogenesis of acetogenins from Annona muricata and
Annona nutans. J Nat Prod 63:1192-1196.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, penerjemah. Bandung: ITB. Terjemahan dari:
Phytochemical Methods.
Harjadi W. 1986. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Heiden TCK, Dengler E, Kao WJ, Heideman W, Peterson RE. 2007. Developmental toxicity of low generation PAMAM dendrimers in zebrafish. Toxicology Appl Pharmacol 225:70-79.
Houghton PJ, Raman A. 1998. Laboratory Handbook for the Fractionation of Natural Extract. London: Chapman & Hall.
Hsu CH, Wen ZH, Lin CS, Chakraborty C. 2007. The zebrafish model: Use in studying cellular mechanism for a spectrum of clinical disease entities. Curr Neurovascular Res 4:111-120.
Jagadeeswaran P, Sheehan JP. 1999. Analysis of blood coagulation in the Zebrafish.
Blood Cells, Molecules, and Diseases
15:239-249.
Kari G, Rodeck U, Dicker AP. 2007. Zebrafish: An emerging model system for human disease and drug discovery. Clin Pharmacol Therapeutics 82:70-80.
Kim G et al. 1998. Two new mono-tetrahydrofuran ring acetogenins, annomuricin E and muricapentocin, from the leaves of Annona muricata. J Nat Prod
61:432-436.
Krishnaraju AV et al. 2005. Assessment of bioactivity of Indian medicinal plants using Brine Shrimp (A. salina) lethality assay. Int J Appl Sci Eng 3:125-134.
Li DY, Yu JG, Luo XZ, Sun L, Yang SL. 2000. Muricatenol, a linear acetogenin from Annona muricata (Annonaceae).
Chinese Chem Lett 11:239-242.
Ma C et al. 2007. Zebrafish, an in vivo model for drug screening. Drug Discovery 6:38-45.
Mattjik AA, Jaya IS. 2006. Perancangan Percobaan dengan Aplikasi SAS dan MINITAB. Bogor: IPB Pr.
McLaughlin JL. 2008. Paw paw and cancer: Annonaceous acetogenins from discovery to commercial products. J Nat Prod
71:1311-1321.
Moore JL, Rush LM, Breneman C, Mohideen MAPK, Cheng KCl. 2006. Zebrafish genomic instability mutants and cancer susceptibility. Genetics 10:1-33.
Mukhtar MH, Adnan AZ, Pitra MW. 2007. Uji sitotoksisitas minyak atsiri daun Kamanggi (Ocimum basilicum L) dengan metode Brine Shrimp Lethality Test Bioassay. J Sains Tek Far 12:1-4.
13
sel kanker ranji [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Nicoli S, Presta M. 2007. The Zebrafish/tumor xenograft angiogenesys assay. Nature Protocols 2:2918-2923.
Rieser MJ et al. 1996. Five novel mono-tetrahydrofuran ring acetogenins from the seeds of Annona muricata. J Nat Prod
59:100-108.
Sudarmadji S, Haryono B, Suhardi. 1996.
Analisa Bahan Makanan dan Pertanian. Yogyakarta: Liberty.
Trubus. 2011. My Healthy Life: Daun Sirsak vs Kanker. Depok: Trubus.
Walpole RE. 1993. Pengantar Statistika Edisi ke-3. Sumantri B, penerjemah. Jakarta: Gramedia. Terjemahan dari: Introduction to Statistics 3rd Edition.
Wei X et al. 2010. Evaluation of pyridoacridine alkaloids in a zebrafish phenotypic assay. Mar Drugs 8: 1769-1778.
Winarno FG. 1995. Kimia Pangan dan Gizi. Jakarta: Gramedia.
Wu FE et al. 1995a. Two new cytotoxic monotetrahydrofuran Annonaceous acetogenins, annomuricins A and B, from the leaves of Annona muricata. J Nat Prod
58:830-836.
Wu FE et al. 1995b. Muricatocins A and B, two new bioactive monotetrahydrofuran annonaceous acetogenins from the leaves of Annona muricata. J Nat Prod 58: 902-908.
15
Lampiran 1 Diagram alir penelitian
Ekstrak aktif
Uji toksisitas (BSLT dan uji ikan zebra)
Partisi dengan etil asetat-air
Buah sirsak
Penentuan kadar air dan abu
Maserasi dengan etanol
Ekstrak etanol
Ekstrak etil asetat
Ekstrak air
Pengamatan embrio ikan zebra
Uji fitokimia
Penentuan fraksi (KLT)
Perbandingan daya sitotoksik ekstrak buah
sirsak ratu dan sirsak hutan
16
Lampiran 2 Kadar air, kadar abu, dan rendemen buah sirsak
a)
Kadar air buah sirsak
Ulangan
Sirsak ratu
Sirsak hutan
A
(g)
B
(g)
Kadar air
(%)
A
(g)
B
(g)
Kadar air
(%)
1
3.0796
0.6012
80.48
3.0581
0.3191
89.57
2
3.0883
0.6021
80.50
3.0661
0.3289
89.27
3
3.0939
0.6035
80.49
3.0768
0.3383
89.00
Rerata
80.49
Rerata
89.28
Contoh perhitungan:
Kadar air (%)
=
100
%
A
B
A
b)
Kadar abu buah sirsak
Ulangan
Sirsak ratu
Sirsak hutan
A
(g)
B
(g)
Kadar abu
(%)
A
(g)
B
(g)
Kadar abu
(%)
1
3.0244
0.0211
0.70
3.0189
0.0297
0.98
2
3.0232
0.0199
0.66
3.0122
0.0285
0.95
3
3.0111
0.0194
0.64
3.0107
0.0271
0.90
Rerata
0.67
Rerata
0.94
Contoh perhitungan :
Kadar abu (%)
=
100
%
A
B
c)
Rendemen buah sirsak
Sampel
Ekstrak
b
(gram)
a
(gram)
Rendemen (% b/b)
Sirsak ratu
Etanol
221.5900
11.2124
5.06
Etil asetat
221.5900
0.4106
0.19
Air
221.5900
0.8450
0.38
Sirsak hutan
Etanol
493.3800
37.4768
7.60
Etil asetat
493.3800
0.4440
0.09
Air
493.3800
7.1504
1.45
Contoh perhitungan rendemen ekstrak etanol
Sirsak ratu
:
17
y = 46.694x - 63.832
R2= 0.9931
0 20 40 60 80 100
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak etanol sirsak ratu
y = 45.586x - 63.524
R2= 0.9933
0 20 40 60 80 100
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak etanol sirsak hutan
Lampiran 3 Hasil uji toksisitas BSLT ekstrak etanol
Konsentrasi Jumlah larva
awal
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
0 10 0 0 0 0 0 0
10 0 0
10 0 0
10 0 0
50 10 2 1.75 17.5 2 1.5 15
10 2 2
10 2 1
10 1 1
250 10 4 4.5 45 5 4.5 45
10 5 5
10 4 4
10 5 4
500 10 5 6 60 5 5.75 57.5
10 6 5
10 6 6
10 7 7
750 10 6 7 70 6 6.5 65
10 7 7
10 7 7
10 8 6
1000 10 8 8 80 8 7.75 77.5
10 7 7
10 9 8
10 8 8
Contoh perhitungan LC
50:
18
y = 34.741x - 1.5398
R2 = 0.9921
0 20 40 60 80 100 120
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak etil asetat sirsak ratu
y = 37.472x - 10.961
R2 = 0.9931
0 20 40 60 80 100 120
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak etil asetat sirsak hutan
Lampiran 4 Hasil uji toksisitas BSLT ekstrak etil asetat
Konsentrasi Jumlah larva
awal
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
0 10 0 0 0 0 0 0
10 0 0
10 0 0
10 0 0
50 10 5 5.75 57.5 5 5.25 52.5
10 5 6
10 7 5
10 6 5
250 10 7 8 80 8 8 80
10 8 7
10 9 9
10 8 8
500 10 9 9.5 95 9 8.75 87.5
10 9 9
10 10 8
10 10 9
750 10 10 10 100 10 10 100
10 10 10
10 10 10
10 10 10
1000 10 10 10 100 10 10 100
10 10 10
10 10 10
10 10 10
Contoh perhitungan LC
50:
19
y = 52.83x - 63.881
R2= 0.9966
0 20 40 60 80 100 120
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak air sirsak ratu
y = 52.989x - 67.783
R2 = 0.9983
0 20 40 60 80 100
0 1 2 3 4
%
k
em
a
ta
in
log konsentrasi
ekstrak air sirsak hutan
Lampiran 5 Hasil uji toksisitas BSLT ekstrak air
Konsentrasi Jumlah larva
awal
Jumlah larva
mati Rerata %kematian
Jumlah larva
mati Rerata %kematian
0 10 0 0 0 0 0 0
10 0 0
10 0 0
10 0 0
50 10 2 2.75 27.5 2 2.25 22.5
10 3 2
10 3 4
10 3 1
250 10 5 6 60 5 6 60
10 7 6
10 6 6
10 6 7
500 10 7 7.75 77.5 6 7.25 72.5
10 8 8
10 8 7
10 8 8
750 10 9 8.75 87.5 8 8.5 85
10 8 8
10 9 9
10 9 9
1000 10 9 9.75 97.5 9 9.25 92.5
10 10 8
10 10 10
10 10 10
Contoh perhitungan LC
50:
20
y = 46.761x - 65.5 R2 = 0.9971
0 20 40 60 80 100
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak etanol sirsak ratu
y = 45.23x - 63.621
R2 = 0.9932
0 20 40 60 80
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak etanol sirsak hutan
Lampiran 6 Hasil uji toksisitas embrio ikan zebra ekstrak etanol
Konsentrasi Jumlah embrio
awal
Jumlah embrio
mati Rerata %kematian
Jumlah embrio
mati Rerata %kematian
0 10 0 0 0 0 0 0
10 0 0
10 0 0
10 0 0
50 10 2 1.5 15 2 1.5 15
10 2 2
10 1 1
10 1 1
250 10 4 4.5 45 4 4.25 42.5
10 5 5
10 5 4
10 4 4
500 10 5 6 60 5 5.5 55
10 6 4
10 6 6
10 7 7
750 10 5 6.75 67.5 5 6.75 67.5
10 7 7
10 7 7
10 8 8
1000 10 8 7.75 77.5 8 7.5 75
10 7 7
10 9 9
10 7 6
Contoh perhitungan LC
50:
21
y = 35.915x - 6.0157
R2 = 0.9959
0 20 40 60 80 100 120
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak etil asetat sirsak ratu
y = 36.997x - 10.757
R2 = 0.9978
0 20 40 60 80 100 120
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak etil asetat sirsak hutan
Lampiran 7 Hasil uji toksisitas embrio ikan zebra ekstrak etil asetat
Konsentrasi Jumlah embrio
awal
Jumlah embrio
mati Rerata %kematian
Jumlah embrio
mati Rerata %kematian
0 10 0 0 0 0 0 0
10 0 0
10 0 0
10 0 0
50 10 5 5.75 57.5 5 5.25 52.5
10 5 6
10 7 4
10 6 6
250 10 7 8 80 8 7.75 77.5
10 8 7
10 9 8
10 8 8
500 10 9 9.5 95 9 8.75 87.5
10 9 9
10 10 8
10 10 9
750 10 10 10 100 9 9.75 97.5
10 10 10
10 10 10
10 10 10
1000 10 10 10 100 10 10 100
10 10 10
10 10 10
10 10 10
Contoh perhitungan LC
50:
22
y = 53.305x - 66.585
R2 = 0.9981
0 20 40 60 80 100
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak air sirsak ratu
y = 54.32x - 72.158
R2 = 0.9936
0 20 40 60 80 100
0 1 2 3 4
%
k
em
a
tia
n
log konsentrasi
ekstrak air sirsak hutan
Lampiran 8 Hasil uji toksisitas embrio ikan zebra ekstrak air
Konsentrasi Jumlah embrio
awal
Jumlah embrio
mati Rerata %kematian
Jumlah embrio
mati Rerata
%kematia n
0 10 0 0 0 0 0 0
10 0 0
10 0 0
10 0 0
50 10 2 2.5 25 2 2.25 22.5
10 3 2
10 3 4
10 2 1
250 10 5 6 60 5 5.25 52.5
10 6 6
10 6 6
10 7 4
500 10 7 7.5 75 7 7.5 75
10 8 8
10 7 7
10 8 8
750 10 9 8.75 87.5 7 8.5 85
10 8 8
10 9 9
10 9 10
1000 10 9 9.5 95 9 9.25 92.5
10 9 8
10 10 10
10 10 10
Contoh perhitungan LC
50:
Lampiran 9
Hasil pengamatan embrio ikan zebra dengan perlakuan ekstrak sirsak ratu
Konsentrasi
(ppm)
Ulangan
Bentuk
Pigmentasi
Ukuran (mm)
Embrio
Larva
Diameter
Panjang tubuh
Jantung
Kantung kuning telur
Kepala Ekor Mata
0
1
-
3
-
2.75
0.07
0.51
0.46
0.14
0.27
2
-
3
-
2.42
0.11
0.58
0.37
0.15
0.16
3
-
3
-
2.74
0.06
0.53
0.44
0.15
0.22
50
1
-
0
-
2.26
-
0.54
0.30
-
-
2
-
0
-
2.43
-
0.50
0.34
-
-
3
-
0
-
2.16
-
0.66
0.38
0.20
-
250
1
-
0
0.95
-
-
-
-
-
-
2
-
0
0.94
-
-
-
-
-
-
3
-
0
1.50
-
-
-
-
-
-
500
1
-
0
0.94
-
-
-
-
-
-
2
-
0
0.94
-
-
-
-
-
-
3
-
0
0.84
-
-
-
-
-
-
750
1
-
0
1.00
-
-
-
-
-
-
2
-
0
1.00
-
-
-
-
-
-
3
-
0
0.95
-
-
-
-
-
-
1000
1
-
0
1.00
-
-
-
-
-
-
2
-
0
0.88
-
-
-
-
-
-
3
-
0
0.78
-
-
-
-
-
-
Lampiran 10 Hasil pengamatan embrio ikan zebra dengan perlakuan ekstrak sirsak hutan
Konsentrasi
(ppm)
Ulangan
Bentuk
Pigmentasi
Ukuran (mm)
Embrio Larva
Diameter
Panjang
tubuh
Jantung
Kantung kuning
telur
Kepala Ekor Mata
0
1
-
5
-
2.72
0.09
0.48
0.39
0.16 0.22
2
-
4
-
2.89
0.08
0.49
0.40
0.12 0.25