SINTESIS FLAVONOL MELALUI 2
’
-HIDROKSIKALKON
LIVIA ELSA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis Flavonol melalui 2’-Hidroksikalkon adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2013
Livia Elsa
ABSTRAK
LIVIA ELSA. Sintesis Flavonol melalui 2’-Hidroksikalkon. Dibimbing oleh BUDI ARIFIN dan SUMINAR S ACHMADI.
Flavonol merupakan golongan flavonoid yang banyak ditemukan dalam buah-buahan dan sayuran. Flavonol memiliki banyak kegunaan terutama dalam bidang pangan dan kesehatan. Dalam penelitian ini, flavonol taktersubstitusi berhasil disintesis melalui zat antara 2’-hidroksikalkon. Senyawa 2’ -hidroksikalkon disintesis dengan metode kondensasi Claisen-Schmidt antara o -hidroksiasetofenon dan benzaldehida menggunakan 4 katalis yang berbeda, yaitu KOH 60%, KOH pelet, BF3-Et2O, dan NaH dalam DMF. KOH 60% merupakan
katalis terbaik dengan rendemen tertinggi (57%). Selanjutnya flavonol disintesis dengan 1 tahap siklisasi oksidatif dari 2’-hidroksikalkon menggunakan reaksi Algar-Flynn-Oyamada menghasilkan rendemen 76%. Rendemen flavonol total yang diperoleh dari o-hidroksiasetofenon adalah 43%. Semua produk sintesis dalam penelitian ini telah dicirikan titik leleh dan spektrumnya. Keberhasilan sintesis flavonol ini membuka jalan untuk sintesis turunan flavonol yang bermanfaat seperti kuersetin dan kaempferol.
Kata kunci: flavonoid, flavonol, 2’-hidroksikalkon, kondensasi Claisen-Schmidt, reaksi Algar-Flynn-Oyamada
ABSTRACT
LIVIA ELSA. Synthesis of Flavonol from 2’-Hydroxychalcone. Supervised by BUDI ARIFIN and SUMINAR S ACHMADI.
Flavonol is a class of flavonoids commonly found in fruits and vegetables. Flavonol is very useful, especially in food sector and health. In this study, flavonol unsubstituted was successfully synthesized from an intermediate material 2’-hydroxychalcone. The 2’-hydroxychalcone was synthesized by Claisen-Schmidt condensation method between o-hydroxyacetophenone and benzaldehyde using 4 different catalysts, namely KOH 60%, solid pellet of KOH-grinding technique, BF3-Et2O, and NaH in DMF. The KOH 60% was the best
catalyst, giving the highest yield (57%). Afterward, the flavonol was synthesized in 1-stage oxidation cyclization of o-hydroxyacetophenone using Algar-Flynn-Oyamada (AFO) reaction, giving 76%. The flavonol total yield from 2’ -hydroxychalcone was 43%. All synthesized products were characterized by their melting points and their spectra. The success of the synthesis flavonol opens the way to synthesis of useful flavonol derivatives such as quercetin and kaempferol.
SINTESIS FLAVONOL MELALUI 2
’
-HIDROKSIKALKON
LIVIA ELSA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Program Studi Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis Flavonol melalui 2’-Hidroksikalkon Nama : Livia Elsa
NIM : G44080062
Disetujui oleh
Budi Arifin, SSi, MSi Pembimbing I
Prof Dr Ir Suminar S Achmadi Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
PRAKATA
Assalamualaikum Wr. Wb.
Segala puji beserta syukur ke hadirat Allah SWT penulis ucapkan atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Sintesis Flavonol melalui 2’-Hidroksikalkon. Shalawat serta salam semoga selalu tercurahkan kepada Nabi Muhammad SAW, keluarganya, dan semoga kita semua menjadi pengikutnya hingga akhir zaman.
Terima kasih penulis ucapkan kepada yang terhormat Budi Arifin, SSi, MSi dan Prof Ir Suminar S Achmadi, PhD selaku pembimbing yang selalu memberikan bimbingan, dorongan semangat, dan doa. Karya tulis ini merupakan wujud penghargaan untuk Ayahanda dan Ibunda tercinta, H Iwan dan Hj Ida selaku orang tua wali penyusun, Arif Sumarlin, Dhealia Athifah, Tira Nisa, Fahmi, dan Rafli selaku kakak dan adik penyusun, serta yang tersayang Ridho Putrotomo yang telah ikut serta memperlancar pembuatan karya ilmiah ini, dan juga untuk seluruh keluarga yang senantiasa memberikan doanya.
Penulis berterima kasih pula kepada teman-teman dan para staf di Laboratorium Penelitian Kimia Organik (Kak Luthfan, Bapak M Farid, Bapak Novriandi, Dwi Utami, Lia Anggraeni, Indra Sugiarto, Dwi Artha, Dyah Anna, Dumas, Rina, Indra Bayu, Kartika, Fadli, Toriq, Rifai, Ami, Ani, Ade Irma, Erik, Christine, Wahyu Hendana, Fijar, Fanindra, Bapak Sabur, Mba Nia, dan Ibu Yenni) atas kerja sama, kebersamaan, masukan, dan semangatnya. Semoga karya tulis ini dapat bermanfaat bagi ilmu pengetahuan.
Wassalamualaikum Wr. Wb.
Bogor, Januari 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
BAHAN DAN METODE 2
Bahan dan Alat 2
Langkah Kerja 2
Sintesis 2’-Hidroksikalkon 3
Sintesis Flavonol 3
HASIL 4
2’-Hidroksikalkon 4
Flavonol 5
PEMBAHASAN 6
2’-Hidroksikalkon 6
Flavonol 12
SIMPULAN DAN SARAN 14
DAFTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR TABEL
1 Rendemen sintesis 2’-hidroksikalkon dan flavanon dengan 4 jenis katalis 5 2 Rendemen sintesis flavonol dari 2’-hidroksikalkon katalis 5 3 Posisi sinyal-sinyal NMR 2’-hidroksikalkon (pelarut CDCl3) 8
4 Analisis sinyal 1H-NMR flavanon (pelarut CDCl3) 9
5 Perbandingan 4 metode sintesis 2’-hidroksikalkon 11 6 Analisis sinyal 1H dan 13C-NMR flavonol (pelarut CDCl3) 13
DAFTAR GAMBAR
1 Analisis retrosintesis flavonol 2
2 Kromatogram lapis tipis 2'-hidroksikalkon kasar menggunakan katalis: KOH 60% (a), KOH pelet (b), BF3-Et2O (c), dan NaH-DMF (d) 4
3 Padatan dan kromatogram lapis tipis 2'-hidroksikalkon [eluen: n-heksana- EtOAc (9:1)] yang dihasilkan dengan katalis KOH 60% (a), KOH pelet
(b), dan NaH-DMF (c) 4
4 Padatan flavonol (a) dan kromatogram lapis tipis flavonol (eluen: n
-heksana-EtOAc 8:2) (b) 5
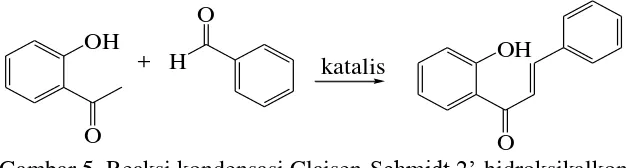
5 Reaksi kondensasi Claisen-Schmidt 2'-hidroksikalkon 6 6 Spektrum UV-Vis 2'-hidroksikalkon dan flavanon (Cirilli et al. 2008) 7
7 Flavanon dalam koformasi kursi 9
7 Reaksi AFO pembentukan flavonol dari 2'-hidroksikalkon 12
DAFTAR LAMPIRAN
1 Bagan alir penelitian 17
PENDAHULUAN
Flavonoid adalah kelompok metabolit sekunder yang penting dalam dunia tumbuhan. Flavonoid telah diidentifikasi sebagai senyawa antioksidan, antitumor, dan pengikat radikal bebas. Pada tumbuhan, flavonoid berfungsi sebagai pelindung dari sinar ultraviolet (UV) dan sebagai sinyal antara akar dan bakteri pengikat nitrogen dalam tanah. Salah satu kelas flavonoid yang memiliki peran penting dalam reproduksi tanaman adalah flavonol. Serbuk sari jagung tidak mampu berkecambah apabila kekurangan flavonol (Tanaka et al. 2000).
Flavonol memiliki fungsi yang sangat luas, antara lain sebagai antioksidan, antimikrob, dan fotoreseptor (Pietta 2000). Hubungan antara flavonol yang masuk ke dalam tubuh dan penurunan risiko penyakit jantung koroner juga telah dilaporkan Crozier et al. (2000). Aneka substituen, terutama hidroksil dan metoksil, dapat terikat pada cincin benzena dan heterosiklik flavonol dan membentuk keragaman jenis flavonol. Berdasarkan pangkalan data USDA (2011), jenis flavonol utama dalam makanan manusia adalah kuersetin [2-(3’,4’ -dihidroksifenil)-3,5,7-trihidroksikromen-4-on], kaempferol [2-(4’ -hidroksifenil)-3,5,7-trihidroksikromen-4-on], mirisetin [2-(3’,4’,5’ -trihidroksifenil)-3,5,7-trihidroksikromen-4-on], dan isoramnetin [2-(4’-hidroksi-3’-metoksifenil)- 3,5,7-trihidroksikromen-4-on]. Makanan yang mengandung flavonol dalam jumlah cukup banyak adalah apel, teh, kacang-kacangan, paprika, bawang, brokoli, dan bluberi, yaitu sekitar 100–300 mg/100 g.
Ketersediaan flavonol di alam relatif terbatas. Upaya isolasi dan pemurnian flavonol guna memenuhi kebutuhan konsumsi maupun studi lanjut memerlukan proses yang cukup panjang dan rumit dengan biaya dan waktu yang tidak sedikit. Umumnya rendemen yang diperoleh juga relatif rendah. Hasil penelitian Sultana dan Anwar (2008) pada berbagai macam sampel tanaman obat, buah, dan sayur menunjukkan kandungan flavonol tertinggi terdapat pada tanaman obat moringa, buah stroberi, dan sayur bayam dengan rendemen berturut-turut 0.61, 0.36, dan 0.17%. Oleh karena itu, upaya menyintesis flavonol terus dilakukan untuk memenuhi kebutuhan konsumsi maupun pengembangan ilmu pengetahuan di bidang pangan dan kesehatan.
Pendekatan yang lazim digunakan dalam sintesis flavonol secara kimia melibatkan senyawa antara 2’-hidroksikalkon. Senyawa ini dapat dibuat melalui reaksi kondensasi Claisen-Schmidt o-hidroksiasetofenon (o-HAP) dengan benzaldehida. Beberapa metode telah dilaporkan di antaranya dengan katalis basa dalam pelarut etanol (Kamble et al. 2011), katalis basa tanpa pelarut (Zangade et al. 2011, Jayapal dan Sreedhar 2010), katalis asam (Narender dan Reddy 2007), dan dengan teknik sonikasi (Calvino et al. 2006).
Flavonol dapat disintesis dari 2’-hidroksikalkon dengan menggunakan metode Algar-Flynn-Oyamada (AFO) 1-tahap (Dahln et al. 2006), AFO 3-tahap (Pandurangan et al. 2011), dan modifikasi metode Baker-Venkataraman yang lazim digunakan dalam sintesis flavon (Fougerousse et al. 2000). Setiap metode memiliki kelebihan dan kekurangan masing-masing, ditinjau dari efisiensi waktu, harga, kerumitan, rendemen, dan sebagainya.
memberikan rendemen paling tinggi, kemurnian paling baik, dan paling efisien dari segi waktu. Senyawa 2’-hidroksikalkon hasil sintesis dengan katalis terbaik selanjutnya disiklisasi menjadi flavonol dengan metode AFO. Skema retrosintesis flavonol yang dilakukan ditunjukkan pada Gambar 1.
Gambar 1 Analisis retrosintesis flavonol
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan p.a. yang digunakan untuk sintesis ialah dietil eter, benzaldehida, KOH, metanol, N,N-dimetilformamida (DMF), H2O2 30%, NaOH
(Merck®), BF3-Et2O, NaH 60% terdispersi dalam minyak mineral, dan
tetrahidrofuran (THF) (Sigma Aldrich®). Digunakan pula aseton dan metilena klorida (MTC) teknis yang didistilasi 2 kali. Semua bahan p.a. digunakan langsung tanpa praperlakuan.
Alat-alat analitis yang digunakan ialah pelat kromatografi lapis tipis (KLT) GF254 dan radas penentuan titik leleh Mel-Temp Model 1202D Barnstead® (tanpa
koreksi). Spektrum ultraviolet-tampak (UV-Vis) direkam dengan spektrometer Shimadzu UV-1601 di Laboratorium Bersama, Departemen Kimia IPB. Spektrum resonans magnet inti (NMR) diperoleh dengan spektrometer JEOL ECA 500 yang bekerja pada frekuensi 500 MHz (1H) dan 125 MHz (13C) di Pusat Penelitian Kimia LIPI, Puspiptek Serpong.
Langkah Kerja
3
Sintesis 2’-Hidroksikalkon
2’-Hidroksikalkon disintesis menggunakan metode kondensasi Claisen-Schmidt dengan 4 katalis berbeda. Metode pertama mengadaptasi prosedur Kamble et al. (2011) dengan menggunakan katalis KOH 60%. Sebanyak 2 mmol
o-HAP dan 2 mmol benzaldehida ditambahkan 6 mL etanol di dalam gelas piala. Setelah itu, ditambahkan tetes demi tetes KOH 60% sebanyak 2 mL pada suhu 0
o
C. Campuran kemudian diaduk selama 7 jam pada suhu kamar. Selanjutnya ke dalam campuran dituang 10 mL air es, dan dinetralkan dengan penambahan tetes demi tetes HCl 1 N dingin sekitar 10 mL pada suhu 0 oC. Padatan dengan warna kuning terang yang terbentuk disaring dan dikeringudarakan selama 1 hari, lalu dipantau nodanya dengan menggunakan KLT dengan eluen n-heksana-EtOAc 9:1.
Metode kedua mengadaptasi prosedur Zangade et al. (2011) dengan menggunakan katalis KOH pelet-teknik grindstone. Sebanyak 2 mmol o-HAP dan 2 mmol benzaldehida dimasukkan ke dalam lumpang beserta KOH pelet sebanyak 4 mmol. Semua bahan digerus selama 4–8 menit, kemudian ditambahkan 5 mL air dingin dan dinetralkan dengan tetes demi tetes HCl 1 N dingin sekitar 15 mL. Padatan dengan warna kuning terang yang terbentuk disaring dan dikeringudarakan selama 1 hari, lalu dipantau nodanya dengan menggunakan KLT dengan eluen n-heksana-EtOAc 9:1.
Metode ketiga mengadaptasi prosedur Narender dan Reddy (2007) dengan menggunakan katalis BF3-Et2O. Sebanyak 2 mmol o-HAP direaksikan dengan 2
mmol benzaldehida dalam labu leher-2 di bawah aliran gas N2, kemudian
ditambahkan tetes demi tetes BF3-Et2O sebanyak 0.12 mL pada suhu kamar
dengan tetap dialiri gas N2. Campuran diaduk selama 15 menit pada suhu kamar,
lalu ditambahkan 20 mL dietil eter dan dicuci dengan air (3×50 mL). Ekstrak eter dikeringkan dengan Na2SO4 anhidrat, lalu dipekatkan. Produk kemudian dipantau
noda KLT-nya dengan eluen n-heksana-EtOAc 9:1.
Metode keempat mengadaptasi prosedur Nay et al. (2001) dengan
pencampuran. Reaksi dihentikan dengan penambahan air kemudian diekstraksi dengan MTC. Ekstrak MTC dikeringkan dengan Na2SO4 anhidrat, lalu
dipekatkan. Pelarut DMF dipisahkan melalui proses KLT preparatif dengan eluen
n-heksana-EtOAc 9:1.
Sintesis Flavonol
Flavonol disintesis dengan menggunakan reaksi Algar-Flynn-Oyamada (AFO) mengadaptasi metode Dahln et al. (2006). Sebanyak 2.5 mmol 2’ -hidroksikalkon ditambahkan 2.5 mL H2O2 30% dan 3.8 mL NaOH 4 M di dalam
kuning pucat disaring dan dikeringkan dalam oven pada suhu sekitar 50 oC, lalu dipantau nodanya dengan menggunakan KLT dengan eluen n-heksana-EtOAc 8:2.
HASIL
2’-Hidroksikalkon
Produk sintesis 2’-hidroksikalkon dengan 4 katalis dipantau dengan menggunakan KLT dengan eluen n-heksana-EtOAc (9:1) (Gambar 2). Dihasilkan 2 noda utama untuk setiap katalis yang digunakan, kecuali BF3-Et2O yang tidak
menghasilkan noda-noda yang terpisah baik (Gambar 2c).
Gambar 2 Kromatogram lapis tipis 2’-hidroksikalkon kasar menggunakan katalis KOH 60% (a), KOH pelet (b), BF3-Et2O (c), dan NaH-DMF (d)
2’-Hidroksikalkon yang dihasilkan dengan katalis KOH 60%, KOH pelet, maupun NaH dalam DMF berupa endapan kuning (Gambar 3) dengan Rf ~ 0.80
pada eluen n-heksana-EtOAc (9:1). Titik leleh produk dengan katalis KOH 60% adalah 80–84 ºC, KOH pelet 78–81 ºC, dan NaH-DMF 80–83 ºC.
Gambar 3 Padatan dan kromatogram lapis tipis 2’-hidroksikalkon [eluen: n -heksana-EtOAc (9:1)] yang dihasilkan dengan katalis KOH 60% (a), KOH pelet (b), dan NaH-DMF (c)
Selain 2’-hidroksikalkon, juga dihasilkan flavanon sebagai produk samping dengan Rf ~ 0.74 pada eluen n-heksana-EtOAc (9:1). Flavanon yang terbentuk
dengan katalis KOH 60% berupa padatan putih dengan titik leleh 73–76 oC. Rendemen 2’-hidroksikalkon dan flavanon yang diperoleh ditunjukkan pada Tabel 1. Data selengkapnya ditunjukkan di Lampiran 2.
(a) (b) (c)
5
Tabel 1 Rendemen sintesis 2’-hidroksikalkon dan flavanon dengan 4 jenis katalis
Katalis 2’-Hidroksikalkon
Spektrum UV-Vis 2’-hidroksikalkon dari produk reaksi berkataliskan KOH 60%, KOH pelet, dan NaH-DMF (Lampiran 3a) memunculkan puncak serapan berturut-turut di 316.8, 315.5, dan 315.0 nm. Spektrum 1H-NMR dari produk berkataliskan KOH 60% (Lampiran 3b) menunjukkan 1 sinyal singlet di 12.82 ppm, 2 sinyal doblet di 7.67 dan 7.93 ppm, dan 6 sinyal aromatik di 6.94, 7.04, 7.44, 7.50, 7.67, dan 7.93 ppm. Spektrum 13C-NMR (Lampiran 3c) menunjukkan 4 sinyal C-kuaterner di 193.93, 163.79, 134.78, dan 120.19 ppm. Terdapat 2 sinyal karbon dengan intensitas 2 kali lebih tinggi di 129.24 dan 128.86 ppm, dan 7 sinyal lainnya merupakan sinyal karbon-sp2 dari cincin benzena. Spektrum 1 H-NMR dari produk reaksi berkataliskan KOH pelet memberikan sinyal-sinyal yang sama, namun muncul pengotor di daerah alifatik (Lampiran 3d).
Spektrum UV-Vis flavanon (Lampiran 4a) memunculkan masing-masing 3 puncak serapan dengan puncak serapan maksimum berturut-turut di 220.0, 216.6, dan 218.0 nm untuk katalis KOH 60%, KOH pelet, dan NaH-DMF. Spektrum 1 H-NMR flavanon yang dihasilkan dengan katalis KOH 60% (Lampiran 4b) menunjukkan 3 sinyal proton di daerah alifatik (2.91, 3,10, dan 5.51 ppm) serta 9 sinyal proton aromatik di daerah 7.05–7.94 ppm.
Flavonol
Flavonol berwujud padatan kuning pucat dengan nilai Rf ~ 0.44 pada eluen n-heksana-EtOAc 8:2 (Gambar 4). Senyawa flavonol diperoleh sebanyak 76% dari 2’-hidroksikalkon produk reaksi berkatalis KOH 60% (Tabel 2) sebagai produk tunggal dengan titik leleh 169–172 °C.
Gambar 4 Padatan flavonol (a) dan kromatogram lapis tipis flavonol (eluen: n -heksana-EtOAc 8:2) (b)
Tabel 2 Rendemen sintesis flavonol dari 2’-hidroksikalkon
Spektrum UV-Vis flavonol memiliki 2 puncak serapan di panjang gelombang 240.5 dan 346 nm (Lampiran 5a). Spektrum 1H NMR (Lampiran 5b) memperlihatkan 6 sinyal proton aromatik di 7.41, 7.47, 7.53, 7.58, 7.70, dan 8.25 ppm. Tidak terdapat sinyal proton enolik khas di sekitar 9 ppm dan muncul 1 sinyal pengotor di 7.14 ppm. Spektrum 13C NMR (Lampiran 5c) menunjukkan sinyal karbon keton di 173.67 ppm, sinyal C-β pada sistem keton takjenuh-,β di 145.13 ppm, sinyal C-hidroksil di 138.65 ppm, serta 3 sinyal C-kuaterner lainnya. Selain itu, terdapat 7 sinyal karbon-sp2 dari cincin benzena.
PEMBAHASAN
2’-Hidroksikalkon
Senyawa 2’-hidroksikalkon berhasil disintesis dengan mereaksikan o-HAP dengan benzaldehida. Fenil asetat yang digunakan sebagai bahan baku o-HAP diperoleh dari esterifikasi fenol dengan anhidrida asetat (modifikasi Septiani 2011) dengan rendemen 94.0%. Hasil ini hampir sama dengan yang dilaporkan Septiani (2011), yaitu 74.4–95.2%. Senyawa o-HAP disintesis melalui penataan-ulang Fries fenil asetat dengan katalis AlCl3 pada suhu 120 oC (Anggraeni 2012)
dan dihasilkan rendemen 38.1%. Hasil ini juga hampir sama dengan yang dilaporkan Anggraeni (2012), yaitu 40.9%.
2’-Hidroksikalkon disintesis menggunakan metode kondensasi Claisen-Schmidt (Gambar 5) dengan bantuan katalis. Katalis yang digunakan adalah KOH 60% (Kamble et al. 2011), KOH pelet-teknik grindstone (Zangade et al. 2011), asam Lewis BF3-Et2O (Narender dan Reddy 2007), dan NaH dalam DMF (Nay et al. 2001). Asam Lewis menghasilkan campuran produk yang tidak terpisahkan secara baik dengan KLT, maka tidak dimurnikan lebih lanjut.
OH
O
+ H O
OH
O katalis
Gambar 5 Reaksi kondensasi Claisen-Schmidt 2’-hidroksikalkon
Katalis basa telah lama digunakan dalam metode kondensasi Claisen-Schmidt. Elektron bebas pada basa mendeprotonasi hidrogen-α dari o-HAP membentuk karbanion yang akan mengadisi atom C-karbonil benzaldehida. Pada akhir reaksi dilepaskan molekul air dan terbentuk 2’-hidroksikalkon sebagai produk kondensasi. Katalis asam juga mulai digunakan oleh beberapa peneliti untuk melangsungkan senyawa ini, salah satunya ialah asam Lewis BF3-Et2O
7
atom C-karbonil sehingga mudah diadisi oleh tautomer enol. Reaksi juga diakhiri dengan lepasnya molekul air membentuk 2’hidroksikalkon. Mekanisme reaksi keduanya ditunjukkan pada Lampiran 6. Metode terbaik dipilih berdasarkan rendemen 2’-hidroksikalkon tertinggi, efisiensi waktu kerja, dan kemurnian senyawa. memiliki pola yang sama dengan 2’-hidroksikalkon, sementara pola spektrum UV-Vis fraksi F2 (Lampiran 4a) sama dengan flavanon, ketika dibandingkan dengan spektrum UV-Vis standar yang dilaporkan oleh Cirilli et al. (2008) (Gambar 6). Dugaan ini dipertegas dengan kesesuaian nilai titik leleh. Fraksi F1 yang diperoleh dengan katalis KOH 60% memiliki titik leleh 80–84 ºC, mendekati nilai yang dilaporkan Barros et al. (2004), yaitu 81–83 ºC. Titik leleh fraksi F2 (73–76) ºC juga mendekati titik leleh flavanon yang dilaporkan Kamboj et al. (2011), yaitu 77–78 ºC.
Gambar 6 Spektrum UV-Vis 2’-hidroksikalkon dan flavanon (Cirilli et al. 2008)
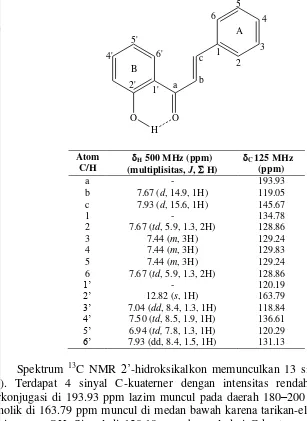
Produk F1 dan F2 dicirikan dengan menggunakan NMR untuk memastikan bahwa senyawa yang terbentuk benar-benar 2’-hidroksikalkon (F1) dan flavanon (F2). Sinyal-sinyal 1H-NMR dan 13C-NMR untuk F1 terangkum dalam Tabel 3. Spektrum 1H-NMR menunjukkan 12 sinyal (Lampiran 3b). Sinyal proton dari karbon-sp2 vinilik, yaitu 7.67 dan 7.93 ppm (Cb, Cc) memiliki tetapan kopling 11–
18 Hz yang menunjukkan geometri alkena trans (Pavia et al. 2009). Selain itu, terdapat 6 sinyal proton aromatik. Proton aromatik pada cincin A 2’ -hidroksikalkon menghasilkan 2 sinyal di 7.67 dan 7.44 ppm. Dua proton di posisi
orto merasakan perambatan tarikan-elektron dari sistem keton takjenuh-,β sehingga sinyalnya lebih ke medan bawah (7.67 ppm). Sementara sinyal dengan integrasi 3.01 di 7.44 ppm merupakan tumpang-tindih sinyal yang berasal dari 3 proton di posisi meta dan para. Proton aromatik pada cincin B 2’-hidroksikalkon menghasilkan 4 sinyal di 7.93, 7.50, 7.04, dan 6.94 ppm. Dua sinyal di medan bawah berasal dari atom hidrogen yang orto(7.93 ppm, C6’) dan para (7.50 ppm, C4’) terhadap substituen karbonil yang merupakan penarik-elektron. Dua sinyal di medan atas berasal dari atom hidrogen orto(7.04 ppm, C3’) dan para (6.94 ppm, C5’) terhadap gugus hidroksil fenolik yang bersifat penyumbang-elektron. Sinyal
di 12.82 ppm (C2’) menunjukkan keberadaan gugus hidroksil fenolik tersebut yang berikatan hidrogen intramolekul dengan gugus O-asil. Geseran jauh ke medan bawah dari proton hidroksil ini disebabkan sifatnya sangat tidak terperisai karena adanya ikatan hidrogen intramolekul.
Tabel 3 Posisi sinyal-sinyal NMR 2’- hidroksikalkon (pelarut CDCl3)
O
Spektrum 13C NMR 2’-hidroksikalkon memunculkan 13 sinyal (Lampiran 3c). Terdapat 4 sinyal C-kuaterner dengan intensitas rendah. Sinyal keton terkonjugasi di 193.93 ppm lazim muncul pada daerah 180–200 ppm. Sinyal C-fenolik di 163.79 ppm muncul di medan bawah karena tarikan-elektron langsung dari gugus -OH. Sinyal di 120.19 ppm berasal dari C-kuaterner yang mengikat substituen karbonil penarik-elektron, tetapi berposisi orto terhadap substituen hidroksil fenolik. Sinyal di 134.78 ppm berasal dari C-kuaterner cincin benzena monosubstitusi.
9
C-metina di cincin B. Dua atom karbon yang orto dan para terhadap substituen karbonil menghasilkan sinyal lebih ke medan atas di 131.13 dan 136.61 ppm. Dua atom lainnya yang orto dan para terhadap substituen hidroksil fenolik menghasilkan sinyal lebih ke medan bawah di 118.84 dan 120.29 ppm. Analisis spektrum NMR ini telah sesuai dengan yang dilaporkan oleh Appu (2010) dan membuktikan fraksi F1 sebagai 2’-hidroksikalkon dengan geometri molekul trans
(E-2’-hidroksikalkon).
Spektrum 1H-NMR dari F2 menunjukkan 12 sinyal proton (Lampiran 4b) yang terangkum dalam Tabel 4. Terdapat 3 sinyal proton karbon-sp3, yaitu di 3.08 dan 2.92 ppm (H3a, H3b) dan di 5.51 ppm (H2). Dua atom H geminal pada gugus metilena C3 menghasilkan sinyal yang berbeda karena sifatnya yang diastereotopik. Struktur kimia yang relatif kaku membuat keduanya merasakan lingkungan kimia yang berbeda. Korelasi geminal antara H3a dan H3b ditunjukkan oleh nilai tetapan kopling yang sama, yaitu 16.8–16.9 Hz (nilai khas
Jgem adalah 12–18 Hz). Proton H3a diidentifikasi berada di posisi aksial karena
memiliki nilai tetapan kopling 13.7 Hz dengan H2 yang juga berposisi aksial (nilai khas Jaa ialah 10–14 Hz). Sementara proton H3b diidentifikasi di posisi
ekuatorial dengan tetapan kopling 3.2 Hz dengan H2 (nilai khas Jae ialah 2–6 Hz).
Nilai khas tetapan kopling yang dirujuk berasal dari Pavia et al. (2009). Gambar 7 menggambarkan posisi proton alifatik flavanon dalam konformasi kursi.
Tabel 4 Analisis sinyal 1H-NMR flavanon (pelarut CDCl3)
O
Proton aromatik pada cincin A memberikan 3 sinyal di 7.94, 7.40, dan 7.07 ppm. Dua sinyal di medan bawah berasal dari atom hidrogen yang orto (7.94 ppm, H5) dan para (7.40 ppm, H7) terhadap substituen karbonil, sedangkan sinyal dengan integrasi 1.92 yang berada di medan atas merupakan tumpang tindih sinyal yang berasal dari atom hidrogen orto dan para terhadap atom oksigen eter (7.05–7.08 ppm, H6 dan H8). Sementara 5 proton pada cincin B memberikan sinyal multiplet di 7.43–7.53 ppm yang merupakan tumpang-tindih sinyal proton
orto, meta maupun para. Analisis spektrum NMR telah membuktikan fraksi F2 sebagai flavanon.
Tabel 1 menunjukkan bahwa metode Kamble et al. (2011) dengan katalis KOH 60% menghasilkan rendemen 2’-hidroksikalkon paling tinggi dengan kisaran 41.7–56.9%. Rendemen tersebut dihasilkan dengan bahan awal masing-masing 10 mmol o-HAP dan benzaldehida. Rendemen lebih rendah diperoleh saat sintesis dilakukan dengan masing-masing 2 mmol reaktan, yaitu sekitar 37%. Rendemen yang lebih tinggi dengan pereaksi yang lebih banyak terjadi karena saat digunakan pereaksi dalam jumlah sedikit, kehilangan sedikit saja produk pada tahap pemurnian dapat berpengaruh signifikan pada penurunan rendemen.
Pada setiap metode yang dirujuk, 2’-hidroksikalkon kasar direkristalisasi untuk menghilangkan pengotor. Pelarut rekristalisasi yang terbaik ialah metanol. Akan tetapi, pada penelitian ini, produk setelah direkristalisasi dengan metanol memberikan noda yang sama dengan sebelum rekristalisasi, maka proses pemurnian dilakukan dengan KLT preparatif dengan eluen n-heksana-EtOAc 9:1.
Metode dengan katalis KOH 60% kurang efisien dari segi waktu, yaitu 6 jam. Selain itu, masih dibutuhkan pelarut etanol dalam reaksinya. Metode dengan katalis KOH pelet dilakukan tanpa pelarut. Metode ini juga jauh lebih cepat, hanya memerlukan sekitar 10 menit. Namun, rendemen 2’-hidroksikalkon yang didapat hanya 28%. Selain itu, spektrum 1H-NMR F1 untuk metode ini (Lampiran 3d) memiliki puncak pengotor yang lebih banyak di daerah alifatik. Ini berarti kemurnian produk tidak sebaik ketika digunakan KOH 60%. Waktu sintesis yang lebih lama untuk katalis KOH 60% dibandingkan dengan KOH pelet terjadi karena konsentrasi KOH yang lebih tinggi pada KOH pelet mampu mendeprotonasi Hα lebih cepat dan 2’-hidroksikalkon pun lebih cepat terbentuk. Berdasarkan hasil ini, meningkatkan konsentrasi KOH dalam etanol diduga dapat memperpendek waktu reaksi.
Metode ketiga menggunakan katalis BF3-Et2O yang merupakan asam Lewis
cukup keras. Diharapkan dengan sifat keasaman tersebut, 2’-hidroksikalkon dapat terbentuk dengan cepat tanpa menimbulkan produk samping seperti yang mungkin terbentuk dengan asam kuat Brӧnsted-Lowry, misalnya HCl. Akan tetapi, produk sintesis dengan katalis BF3-Et2O dalam penelitian ini didapati sukar
dimurnikan. Selain itu, penanganan reaksi lebih sulit seperti penggunaan BF3
-Et2O yang tidak boleh kontak dengan udara karena dapat menghilangkan
keasamannya. Narender dan Reddy (2007) telah menyintesis beberapa jenis kalkon dengan rendemen >75% dari turunan benzaldehida dengan asetofenon, tetapi tidak melaporkan sintesis 2’-hidroksikalkon. Hasil tersebut tidak terulangi dalam penelitian ini. Penelitian dengan menggunakan katalis BF3-Et2O juga
pernah dilakukan oleh Appu (2010) untuk sintesis 2’,4-dihidroksikalkon
11
Penggunaan basa NaH dalam DMF yang merujuk metode Nay et al. (2001) diperkirakan mampu menghasilkan 2’-hidroksikalkon dengan rendemen yang lebih baik karena sifat kebasaan NaH lebih kuat dibandingkan dengan KOH dan NaOH. Nilai pKa H-= 37, jauh lebih besar daripada pKa OH-=16 (Jung 2001). Selain itu, Arnaudinaud et al. (2001) juga telah melaporkan penggunaan basa ini untuk menyintesis turunan 2’-hidroksikalkon dengan rendemen yang tinggi, yaitu 89%. Namun, dalam penelitian ini rendemen yang didapat penelitian ini hanya sekitar 25%, jauh lebih rendah dibandingkan dengan penggunaan katalis KOH 60%. Sintesis dengan metode ini juga terkendala oleh sulitnya menghilangkan pelarut DMF karena titik didihnya yang tinggi, yaitu 153 oC. Penghilangan pelarut DMF dengan KLT preparatif cukup memboroskan pelarut dan waktu. Rekapitulasi sintesis 2’-hidroksikalkon dalam Tabel 5 memperlihatkan katalis KOH 60% sebagai metode terbaik dari yang diujikan.
Tabel 5 Perbandingan 4 metode sintesis 2’-hidroksikalkon
Katalis Kemudahan
sintesis Rendemen (%) Waktu Kemurnian KOH 60% Mudah 47–57 6 jam Baik dibandingkan dengan hidrogen-α, sehingga bersaing untuk bereaksi dengan pasangan elektron bebas dari basa. Basa diharapkan mendeprotonasi hidrogen-α, namun, sebagian akan cenderung menyerang hidrogen fenolik sehingga berpotensi menurunkan rendemen. Beberapa peneliti menggunakan gugus pelindung pada -OH agar tidak terjadi reaksi yang tidak diharapkan. Beberapa gugus pelindung lazim digunakan untuk melindungi -OH sebagai turunan eternya, antara lain metoksimetil (MOM), seperti yang dilaporkan oleh Pandurangan et al. (2011). Kelebihan gugus pelindung eter adalah praktis lembam dengan basa dan mudah dilepaskan kembali dengan penambahan asam. Oleh karena itu, gugus pelindung ini sangat cocok untuk digunakan dalam sintesis 2’-hidroksikalkon dengan katalis basa. Meskipun dalam penelitian ini tidak digunakan gugus pelindung, 2’-hidroksikalkon masih terbentuk cukup banyak karena hidrogen fenolik terstabilkan oleh ikatan hidrogen intramolekul dengan O-asil sehingga reaktivitasnya menurun. Penambahan KOH 60% tetes demi tetes pada suhu rendah (0 oC) juga dimaksudkan untuk mengurangi reaksi samping yang tidak diharapkan.
dan Seoane (2005) melaporkan bahwa menyintesis flavanon dari o-HAP dengan benzaldehida tidak menghasilkan flavanon seutuhnya dan masih adanya 2’ -hidroksikalkon yang terbentuk. Beberapa faktor seperti suhu dan lama pemanasan menjadi salah satu yang memengaruhi rendemen flavanon yang dihasilkan. Metode Kamble et al. (2011) yang merupakan metode terbaik untuk menyintesis 2’-hidroksikalkon digunakan dalam tahap penelitian selanjutnya untuk menghasilkan flavonol.
Flavonol
Senyawa flavonol dihasilkan melalui reaksi siklisasi oksidatif senyawa 2’ -hidroksikalkon menurut reaksi AFO dengan menggunakan modifikasi metode Dahln et al. (2006) (Gambar 8). H2O2 30% mengoksidasi OH- dari NaOH
membentuk –OOH yang akan melangsungkan adisi-1,4 pada ikatan rangkap-α,β dari 2’-hidroksikalkon membentuk kalkon epoksida yang selanjutnya tertata-ulang menjadi flavonol (Lampiran 7).
OH
Gambar 8 Reaksi AFO pembentukan flavonol dari 2’-hidroksikalkon
Reaksi selama 12 jam dan 7 jam diujikan dalam penelitian ini dan menghasilkan rendemen flavonol yang sama, yaitu 76%. Hasil ini hampir 2 kali lipat dibandingkan dengan hasil yang dilaporkan oleh Dahln et al. (2006), yaitu 41%. Produk yang dihasilkan memberikan noda tunggal pada pelat KLT dengan berbagai macam eluen. Eluen yang diujikan ialah MTC (Rf ~ 0.80), aseton (Rf ~
0.95), metanol (Rf ~ 0.90), EtOAc (Rf ~ 0.99), dan n-heksana-EtOAc (8:2) (Rf ~
0.44). Hal ini menunjukkan bahwa senyawa yang terbentuk murni. Titik leleh flavonol yang diperoleh sebesar 169–172 oC, mendekati nilai yang dilaporkan oleh Dick dan Ernsting (1987), yaitu 171.5 °C. Selain itu, bukti-bukti spektroskopi sebagaimana akan dijelaskan di bawah ini telah memastikan produk yang diperoleh sebagai flavonol.
Spektrum UV-Vis menunjukkan 2 puncak serapan khas pada panjang gelombang sekitar 240.5 dan 347 nm (Lampiran 5a). Pola spektrum UV-Vis yang dihasilkan mirip dengan literatur NIST (2007), yaitu 2 puncak pada panjang gelombang 241 dan 348 nm. Hasil ini memperkuat bahwa flavonol telah terbentuk.
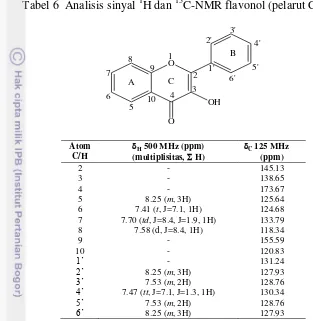
Analisis spektrum 1H dan 13C NMR flavonol dirangkum dalam Tabel 6. Spektrum 1H NMR flavonol (Lampiran 5b) menunjukkan 6 sinyal aromatik di 7.41, 7.47, 7.56, 7.53, 7.58, dan 8.25 ppm, tetapi tidak muncul sinyal proton khas hidroksil enolik di sekitar 9 ppm. Proton hidroksil ini bersifat asam sehingga sinyal seharusnya ada pada daerah medan magnet rendah. Dalam pelarut CDCl3
13
metanol-d4 atau mampu berikatan hidrogen dengan -OH seperti aseton-d6.
Kebanyakan literatur yang dilaporkan, analisis NMR flavonol menggunakan pelarut DMSO-d6 (Moon et al. 2005). Meskipun demikian, analisis spektrum 13C
NMR dibawah ini menunjukkan keberadaan gugus 3-OH tersebut. karbon-sp2 cincin benzena. Korelasi antara sinyal-sinyal proton dan karbon perlu dianalisis untuk memastikan identitas sinyal yang dihasilkan. Moon et al. (2005) telah melakukan pengujian NMR 2-dimensi spektroskopi korelasi (COSY) dan
heteronuclear multiple bond coherence (HMBC) terhadap sinyal-sinyal 1H dan
13
C NMR senyawa flavonol dan hasilnya dimanfaatkan untuk elusidasi struktur flavonol dalam penelitian ini.
Sinyal karbon kuaterner keton terkonjugasi muncul di 173.67 ppm. Sinyal di daerah 155.59 ppm berasal dari C-kuaterner yang mengikat substituen eter. Tarikan-elektron kuat oleh atom oksigen dan dari gugus karbonil orto
C-kuaterner cincin benzena monosubtitusi, sedangkan sinyal di 120.83 ppm berasal dari C-kuaterner yang mengikat substituen karbonil.
Sinyal di 128.76 dan 127.93 ppm memiliki intensitas 2 kali lebih tinggi, menunjukkan bahwa masing-masing berasal dari 2 C-metina yang ekuivalen pada cincin B.Sinyal di 130.34 ppm berasal dari karbon para pada cincin B tersebut.
Atom-atom karbon-sp2 cincin A flavonol ditunjukkan oleh 4 sinyal lainnya. Dua sinyal di medan atas berasal dari atom karbon yang orto (118.34 ppm) dan para
(124.68 ppm) terhadap substituen oksigen eter pendorong-elektron. Dua sinyal di medan bawah berasal dari atom karbon yang orto (125.64 ppm) dan para (133.79 ppm) terhadap substituen karbonil penarik-elektron. Berdasarkan analisis ini, spektrum NMR telah membuktikan terbentuknya flavonol.
SIMPULAN DAN SARAN
Senyawa flavonol telah berhasil disintesis menggunakan reaksi AFO melalui siklisasi oksidatif 2’-hidroksikalkon dengan rendemen 76%. Dibandingkan dengan katalis KOH pelet, BF3-Et2O, dan NaH-DMF, metode
sintesis 2’-hidroksikalkon terbaik adalah menggunakan katalis KOH 60% yang menghasilkan rendemen terbesar 57%. Rendemen total flavonol terbesar yang dihasilkan adalah 43%.
Perlu dilakukan sintesis 2’-hidroksikalkon dengan menggunakan gugus pelindung untuk meningkatkan rendemen serta variasi waktu reaksi dan variasi konsentrasi KOH untuk optimalisasi metode berkataliskan KOH 60%. Selain itu, perlu dicari eluen terbaik untuk pemisahan 2’-hidroksikalkon dari produk dengan katalis BF3-Et2O, dan dicari waktu sintesis yang paling efektif dalam menyintesis
flavonol.
DAFTAR PUSTAKA
Anggraeni L. 2012. Sintesis flavon dari fenol dan benzoil klorida [skripsi]. (ID): Institut Pertanian Bogor.
Appu V. 2010. Synthesis of chalcones and derivatives [tesis]. Malaysia. (MY): Universiti Teknologi Malaysia.
Arnaudinaud V, Nay B, Nuhrich A, Deffieux G, Merillon J, Monti J, Vercauteren J. 2001. Total synthesis of isotopi cally labelled flavonoids. Part 3: 13 C-labelled (-)-procyanidin B3 from 1-[13C] acetic acid. Tetrahedron Lett. 42(2001):1279-1281.
Barros AIRNA, Silva AMS, Alkorta I, Elguero J. 2004. Synthesis experimental and theoretical NMR study of 2’-hydroxychalcones bearing a nitro substituent on their bring. Tetrahedron. 60(31):6513-6521.
15
Cirilli R, Ferretti R, Santis ED, Gallinella B, Zanitti L, Torre FL. 2008. High-performance liquid chromatography separation of enantiomers of flavanone and 2’-hydroxychalcone under reverred-phase conditions. J Chromatogr A. 1190(2008):95-101.
Crozier A, Burns J, Aziz AA, Stewart AJ, Rabiasz HS, Jenkins GI, Edwards CA, Lean ME. 2000. Antioxidant flavonols from fruits, vegetables and beverages: measurements and bioavailability. J Braz Chem Soc. 32(2):1-11.
Dahln K, Walln EAA, Grtli M, Luthman K. 2006. Synthesis of 2,3,6,8-tetrasubstituted chromone scaffolds. J Org Chem. 71(18):6863-6871.
Dick B, Ernsting NP. 1987. Excited-state intramolecular proton transfer in 3-hydroxyflavone isolated in solid argon: fluorescence and fluorescence-excitation spectra and tautomer fluorescence rise time. J Phys Chem. 91(16):4264-4266.
Drexler MT, Amiridis MD. 2003. The effect of solvents on the heterogenous synthesis of flavanone over MgO. J Catal. 214(2003):136-145.
Fougerousse A, Gonzales EM, Brouillard R. 2000. A convenient method for synthesizing 2-aryl-3-hydroxy-4-oxo-4H-1-benzopyrans or flavonols. J Org Chem. 65(2000):583-586.
Jayapal MR, Sreedhar NY. 2010. Anhydrous K2CO3 as catalyst for synthesis of
chalcones under microwave irradiation. JPSR. 2(10):644-647.
Jung ME. 2001. Chemistry 130A. Spring. [terhubung berkala]. http://charette.corg.umontreal.ca/CHM3320/pKa_Jung.pdf [30 Mar 2013]. Kamble VM, Hatnapure GD, Keche AP, Birajdar S, Patil SG, Rodge AH, Turkar
SS, Gour K, Tale RH. 2011. Synthesis and biological evaluation of a novel series of methoxylated chalcones as antioxidant and anti-microbial agents. J Chem Pharm. 3(6):639-648.
Kamboj RC, Sharma G, Kumar D, Arora R, Sharma C, Aneja KR. 2011. An environmentally sound approach for the synthesis of some flavanones and their antimicrobial activity. Chemtech. 3(2):901-910.
Moon BH, Lee Y, Ahn J, Lim Y. 2005. Complete assignments of the 1H and 13C NMR data of flavonol derivatives. Magn Reson Chem. 2005(43):858-860. Mundy BP, Ellerd MG, Favaloro FG. 2005. Name Reactions and Reagents in
Organic Synthesis. Ed ke-2. New Jersey: Wiley and Sons.
Narender T, Reddy KP. 2007. A simple and highly efficient method for the synthesis of chalcones by using boron trifluoride-etherate. Tetrahedron Lett. 48(2007):3177-3180.
Nay B, Arnaudinaud V, Vercauteren J. 2001. Gram-scale production and applications of optically pure 13C-labelled (+)-catechin and (-)-epicatechin.
Eur J Org Chem. (2001):2379-2384.
[NIST] National Institute of Standards and Technology. 2007. Spectrum UV-Vis for Flavonol. Gaithersburg(US):NIST.
Pandurangan N, Bose C, Banerji A. 2011. Synthesis and antioxygenic activities of seabuckthorn flavone-3-ols and analogs. Bioorg Med Chem Lett. 21(2011):5328-5330.
Pavia DL, Lampman GM, Kriz GS, Vyvyan JR. 2009. Introduction to Spectroscopy. Ed ke-4. Washington: Cengage learning.
Sagrera GJ, Seoane GA. 2005. Microwave accelerated solvent-free synthesis of flavanones. J Braz Chem Soc. 16(4):851-856.
Septiani D. 2011. Sintesis 1-(2-hidroksifenil)-3-fenilpropana-1,3-dion dari o -hidroksiasetofenon dan benzoil klorida [skripsi]. (ID): Institut Pertanian Bogor.
Sultana B, Anwar F. 2008. Flavonols (kaempferol, quercetin, myricetin) contents of selected fruits, vegetables and medicinal plants. Food Chem. 108(2008):879-884.
Tanaka H, Stohlmeyer MMA, Wandless TJ, Taylor LP. 2000. Synthesis of flavonol derivatives as probes of biological processes. Tetrahedron Lett.
41(2000):9735-9739.
[USDA] United States, Department of Agriculture. Database for the Flavonoid Content of Selected Foods. 2011 Beltsville: USDA. hlm 1-150.
17
Lampiran 1 Bagan alir penelitian
OH O OH 4. BF3-Et2O(Narender & Reddy 2007)
Metode Dahln et al. (2006)
Lampiran 2 Rendemen 2’-hidroksikalkon dan flavanon
Keterangan : *tidak ditentukan
Lampiran 3 Elusidasi struktur produk sintesis 2’-hidroksikalkon
KOH 60% KOH pelet
NaH-DMF
(a) Spektrum UV-Vis senyawa 2’-hidroksikalkon
Panjang gelombang (nm) Panjang gelombang (nm)
A b s o r b a n s
A b s o r b a n s
A b s o r b a n s
19
(b) Spektrum 1H-NMR 2’-hidroksikalkon katalis KOH 60% (500 MHz, CDCl3)
K e l i m p a h a n
O
(c) Spektrum 13C-NMR 2’-hidroksikalkon katalis KOH 60% (125 MHz, CDCl3)
(d) Spektrum 1H-NMR 2’-hidroksikalkon katalis KOH pelet (500 MHz, CDCl3)
21
Lampiran 4 Elusidasi struktur produk sintesis Flavanon
KOH 60% KOH pelet
NaH-DMF
(a) Spektrum UV-Vis senyawa flavanon
Panjang gelombang (nm) Panjang gelombang (nm)
Panjang gelombang (nm) A
b s o r b a n s
A b s o r b a n s
A b s o r b a n s
327.0
326.5
325.0 250.5
250.0
(b) Spektrum 1H-NMR flavanon (500 MHz, CDCl3)
K e l i m p a h a n
23
Lampiran 5 Elusidasi struktur produk sintesis flavonol
i ii
(a) Spektrum UV-Vis senyawa flavonol literatur (NIST 2007) (i), hasil sintesis (ii)
(b) Spektrum 1H-NMR (500 MHz, CDCl3)
Panjang gelombang (nm) Panjang gelombang (nm)
A b s o r b a n s
A b s o r b a n s
K e l i m p a h a n
(c) Spektrum 13C-NMR (125 MHz, CDCl3)
K e l i m p a h a n
25
Lampiran 7 Mekanisme reaksi AFO pembentukan flavonol (Mundy et al. 2005)
OH
O O
O
-O
O
-O
O
O
OH
O
O
-O
-O
OH O
H2O2 + -OH -OOH + H2O
-OH -OOH
O OH
H
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 11 Februari 1991, merupakan anak pertama dari tiga bersaudara dari pasangan Asam Syaukani dan Elis Marlina. Penulis menyelesaikan pendidikan di SMAN 1 Ciparay pada tahun 2008. Pada bulan Juli 2008, penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).