GANJAR MAULANA NUGRAHA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
ABSTRACT
GANJAR MAULANA NUGRAHA. Differentiation of White Blood Cells in Pregnant Superovulated Ewes Administered Temulawak Extract Plus. Supervised
by ANDRIYANTO and WASMEN MANALU.
ABSTRAK
GANJAR MAULANA NUGRAHA. Diferensiasi Sel Darah Putih Domba Bunting Hasil Superovulasi dan Dicekok Ekstrak Temulawak Plus. Dibimbing oleh ANDRIYANTO dan WASMEN MANALU.
Superovulasi merupakan suatu teknologi yang dapat digunakan untuk meningkatkan produktivitas domba. Penelitian dilakukan untuk melihat efek superovulasi dan pemberian ekstrak temulawak plus pada diferensiasi sel darah putih domba bunting. Enam belas ekor domba betina yang telah dewasa kelamin dengan bobot badan antara 20-25 kg digunakan dengan rancangan acak lengkap dan pola faktorial 2×2 dengan 4 ulangan. Faktor pertama ialah superovulasi dan faktor kedua ialah pemberian ekstrak temulawak plus. Sinkronisasi estrus dilakukan dengan penyuntikan PGF2α 5-15 mg/ekor. Superovulasi diinduksi dengan menyuntikkan PMSG and hCG 75-125 IU/ekor secara intramuskuler. Domba-domba penelitian yang menunjukkan gejala estrus kemudian dikawinkan secara alami. Ekstrak temulawak plus diberikan pada bulan kedua kebuntingan secara per oral dengan dosis 1 mg/kg bobot badan. Parameter yang diamati dalam penelitian ini ialah jumlah netrofil, basofil, eosinofil, limfosit, dan monosit. Sampel darah diambil setiap bulan kebuntingan hingga induk domba melahirkan. Hasil penelitian menunjukkan bahwa soperovulasi menaikkan jumlah netrofil pada bulan pertama hingga keempat kebuntingan. Superovulasi dan pemberian ekstrak temulawak plus menurunkan jumlah eosinofil pada bulan ketiga kebuntingan dan juga menurunkan limfosit pada bulan keempat kebuntingan. Dari penelitian ini dapat disimpulkan bahwa domba yang disuperovulasi dan diberi ekstrak temulawak plus memiliki tingkat cekaman yang lebih tinggi selama kebuntingan.
DIFERENSIASI SEL DARAH PUTIH DOMBA BUNTING
HASIL SUPEROVULASI DAN DICEKOK EKSTRAK
TEMULAWAK PLUS
GANJAR MAULANA NUGRAHA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul : Diferensiasi Sel Darah Putih Domba Bunting Hasil Superovulasi dan Dicekok Ekstrak Temulawak Plus adalah benar-benar hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya-karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan tercantum dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Oktober 2011
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Judul skripsi : Diferensiasi Sel Darah Putih Domba Bunting Hasil Superovulasi dan Dicekok Ekstrak Temulawak Plus Nama : Ganjar Maulana Nugraha
NRP : B04070102
Disetujui
Diketahui Wakil Dekan FKH-IPB
Dr. Nastiti Kusumorini 19621205 198703 2 001
Tanggal lulus:
Pembimbing 1
drh. Andriyanto, MSi. 19820104 200604 1 006
Pembimbing 2
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT karena atas rahmat dan karunia-Nya penulis dapat menyelesaikan penulisan skripsi dengan judul Diferensiasi Sel Darah Putih Domba Bunting Hasil Superovulasi dan Dicekok Ekstrak Temulawak Plus. Skripsi ini ditulis sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Shalawat dan salam semoga selalu tercurah kepada Rasulullah Muhammad SAW, kepada keluarganya, para sahabatnya, dan pada kita selaku umatnya.
Penulis mengucapkan terima kasih kepada drh. Andriyanto, M.Si dan Prof.
Dr. Ir. Wasmen Manalu selaku pembimbing skripsi yang telah memberikan bimbingan dan arahan dari mulai dilaksanakannya penelitian hingga skripsi ini selesai ditulis. Tidak lupa penulis juga menucapkan terima kasih kepada Pakde Sri, Pakde Tri, Pak Dikdik, dan Pak RK serta warga sekitar kandang tempat penelitian berlangsung.
Selanjutnya, penulis mengucapkan terima kasih kepada rekan-rekan sepenelitian (Dardjat dan Ridi) yang telah bekerja keras untuk melakukan penelitian bersama. Diucapkan juga terima kasih kepada teman-teman Angkatan 44 “Gianuzzi” serta anak-anak Pondok Handajani (Rizki, Pepi, Dian, Yoda, Angga, Mas Wisnu, Pak Sem, dan Pak Orim) yang senantiasa memberikan dorongan dan motivasi kepada penulis. Teristimewa penulis ucapkan terima kasih kepada kedua orang tua yang telah berjuang dan berdoa untuk kesuksesan penulis. Adik satu-satunya, Fitri dan sanak saudara yang telah memberikan dukungan dan doanya. Tidak lupa juga kepada Dr. drh. Heru Setijanto, PAVet. (K), selaku dosen pembimbing akademik dan pengganti orang tua di Bogor.
Penulis memohon maaf jika terdapat kekurangan pada penulisan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi penulis sendiri dan memberikan informasi bagi yang membutuhkan.
Bogor, Oktober 2011
RIWAYAT HIDUP
Penulis dilahirkan di Garut pada tanggal 29 Oktober 1989. Penulis merupakan anak pertama dari dua bersaudara pasangan Bapak Yayan Supian dan Ibu Siti Jenab.
Penulis masuk sekolah dasar di SDN Lebakhuni pada tahun 1995, saat kelas 2, penulis pindah sekolah mengikuti orang tua ke SDN Sukamerang 1 dan pindah lagi ke SDN Galihpakuwon 1 pada kenaikan ke kelas 5. Setelah lulus SD, pada tahun 2001, penulis melanjutkan ke SMPN 1 Limbangan dan lulus pada tahun 2004. Pada tahun yang sama penulis melanjutkan pendidikan ke SMAN 1 Limbangan (sekarang SMAN 13 Garut) dan lulus pada tahun 2007.
DAFTAR ISI
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan Penelitian ... 3
1.3. Manfaat Penelitian ... 3
II. TINJAUAN PUSTAKA ... 4
2.1. Superovulasi ... 4
2.2. Temulawak (Curcuma xanthorrhiza Roxb. ) ... 5
2.3. Leukosit (Sel Darah Putih) ... 6
2.3.1. Netrofil ... 7
2.3.2. Eosinofil ... 8
2.3.3. Basofil ... 8
2.3.4. Limfosit ... 9
2.3.5. Monosit ... 10
III. METODE ... 12
3.1. Waktu dan Tempat ... 12
3.2. Alat dan Bahan ... 12
3.3. Tahap Persiapan ... 12
3.3.1. Hewan Percobaan ... 12
3.3.2. Aklimatisasi Domba ... 12
3.3.3. Kandang, Pakan, dan Minum ... 13
3.4. Tahap Pelaksanaan ... 13
3.4.1. Rancangan Percobaan ... 13
3.4.2. Superovulasi ... 13
3.4.3. Pencekokan Ekstrak Temulawak Plus ... 14
3.4.4. Pengambilan dan Analisis Sampel ... 14
3.5. Parameter yang Diamati ... 15
IV. HASIL DAN PEMBAHASAN ... 16
4.1. Netrofil ... 16
4.2. Basofil ... 17
4.3. Eosinofil ... 19
4.4. Limfosit ... 22
4.5. Monosit ... 24
4.6. Rasio Netrofil/Limfosit (N/L) ... 25
V. PENUTUP ... 28
5.1. Kesimpulan ... 28
5.2. Saran ... 28
VI. DAFTAR PUSTAKA ... 29
DAFTAR TABEL
Tabel 1. Jumlah sel darah putih sampel domba sebelum disuperovulasi untuk netrofil, basofil, eosinofil, limfosit, dan monosit
(×50/mm3)………..………… 16
Tabel 2. Rataan jumlah netrofil lima bulan kebuntingan pada kelompok domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (×50/mm3)………. 17 Tabel 3. Rataan jumlah basofil lima bulan kebuntingan pada kelompok
domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (×50/mm3)…..………... 19 Tabel 4. Rataan jumlah eosinofil lima bulan kebuntingan pada kelompok
domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (×50/mm3)………. 21 Tabel 5. Rataan jumlah limfosit lima bulan kebuntingan pada kelompok
domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (×50/mm3).……… 23
Tabel 6. Rataan jumlah monosit lima bulan kebuntingan pada kelompok domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (×50/mm3)….……….... 24 Tabel 7. Nilai rasio N/L pada lima bulan kebuntingan pada kelompok
DAFTAR GAMBAR
Gambar 1. Netrofil Segmen (Theml 2004)……….…... 7
Gambar 2. Netrofil Band (Kern 2002)………...………... 7
Gambar 3. Eosinofil (Kern 2002)……….………...…….. 8
Gambar 4. Basofil (Kern 2002)…...………...………... 9
Gambar 5. Limfosit (Theml 2004)………....……… 10
Gambar 6. Monosit (Kern 2002)………..………. 10
Gambar 7. Rataan jumlah netrofil pada 5 bulan kebuntingan dan domba tidak bunting, dengan kontrol (♦), pemberian ekstrak temulawak (▲), superovulasi (■),superovulasi + ekstrak temulawak (×), dan tidak bunting (●)……….. 18
Gambar 8. Rataan jumlah eosinofil pada 5 bulan kebuntingan dan domba tidak bunting, dengan kontrol (♦), pemberian ekstrak temulawak (▲), superovulasi (■),superovulasi + ekstrak temulawak (×), dan tidak bunting (●)……….. 21
DAFTAR LAMPIRAN
Lampiran 1. Hasil analisis General Linear Model bulan ke-1………..… 33
Lampiran 2. Hasil analisis General Linear Model bulan ke-2……….. 35
Lampiran 3. Hasil analisis General Linear Model bulan ke-3……….. 37
Lampiran 4. Hasil analisis General Linear Model bulan ke-4……….. 39
Sekarang ini, konsumsi protein hewani masyarakat Indonesia masih sangat rendah. Tidak hanya di kawasan Asia, di regional Asia Tenggara saja Indonesia masih berada dalam urutan bawah dalam hal konsumsi protein hewani. Konsumsi daging Indonesia hanya 4,51 kg/kapita/tahun (Matanews 2009). Jumlah ini masih jauh lebih kecil dibanding negara tetangga seperti Malaysia yang mencapai46,87 kg/kapita/tahun, Thailand sebanyak 18 kg/kapita/tahun, dan Filippina 13 kg/kapita/tahun (Matanews 2009). Bahkan, konsumsi protein hewani dari daging masyarakat Indonesia pada tahun 2009 adalah 2,22 g/kapita/hari (Badan Pusat Statistik 2011).
Protein hewani merupakan salah satu bagian penyusun dari setiap sel, jaringan, dan organ tubuh manusia. Protein hewani memiliki kandungan asam amino esensial yang lengkap dibanding protein nabati (CDC 2011). Asam amino esensial tidak diproduksi tubuh, melainkan diperoleh dari makanan. Asam amino sebagai pembentuk protein berperan dalam pertumbuhan dan pemeliharaan sel tubuh, termasuk sel-sel otak. Dengan demikian, secara tidak langsung pemenuhan protein hewani yang mencukupi akan turut mendukung peningkatan kualitas sumber daya manusia.
Salah satu sumber protein hewani yang potensial dikembangkan ialah domba. Kandungan protein hewani yang tinggi terdapat pada dagingnya. Daging domba memiliki banyak keunggulan dari segi nutrisi dan vitamin. Daging domba memiliki kandungan omega 3 dan vitamin B12. Selain itu, ternak domba memiliki kelebihan lain, yaitu mudah berkembang biak, dapat beranak 3 kali dalam 2 tahun, dan waktu reproduksinya yang pendek. Kelebihan lainnya ialah kandungan karkas domba yang dapat mencapai 40-50% dari total bobot tubuh.
Di Indonesia, kebutuhan daging domba masih sangat tinggi. Namun, penyediaan daging tersebut tidak mencukupi jumlahnya. Kebutuhan daging domba Indonesia sejumlah651.717 ton pada tahun 2009 sedangkan produksinya baru mencapai 54.175 ton (Direktorat Jenderal Peternakan dan Kesehatan Hewan
domba pada tahun 2009 adalah120.025 ekor (Direktorat Jenderal Peternakan dan Kesehatan Hewan 2011b). Mengingat kondisi yang telah dipaparkan tersebut, perlu segera dicari alternatif solusi teknologi yang dapat meningkatkan produktivitas domba.
Salah satu teknologi yang dapat dikembangkan untuk meningkatkan produktivitas domba adalah superovulasi. Dengan superovulasi, domba akan memiliki jumlah anak yang lebih banyak dari normal dan memiliki bobot lahir yang lebih baik (Andriyanto dan Manalu 2010). Akan tetapi, jumlah anak yang lebih banyak ini diduga akan menyebabkan cekaman tersendiri pada domba hasil disuperovulasi (Andriyanto dan Manalu 2011). Akibatnya, anak domba yang dihasilkan oleh induk dengan litter size lebih dari tiga menjadi lebih kecil ukurannya dengan tingkat kematian pascakelahiran yang lebih tinggi. Hal ini harus ditanggulangi terutama pada domba dengan litter size lebih dari tiga agar teknologi superovulasi dapat dioptimalkan.
Temulawak secara turun temurun telah menjadi tanaman obat yang banyak digunakan masyarakat Indonesia. Temulawak berkhasiat meningkatkan nafsu makan dan memperlancar produksi cairan empedu yang pada akhirnya meningkatkan aktivitas pencernaan ransum (Arifin dan Kardiyono 1985). Manfaat lain temulawak, terutama diperoleh dari kurkuminoid, mampu menghambat
pertumbuhan bakteri (Wiryawan et al. 2005). Pemberian temulawak pada domba diharapkan akan meningkatkan kondisi pertahanan tubuh dan mencegah infeksi bakteri yang masuk pada domba yang disuperovulasi. Selain itu, diharapkan juga dapat mengurangi cekaman pada induk dengan litter size lebih dari tiga. Dengan demikian, domba hasil superovulasi, terutama yang memiliki litter size lebih dari tiga akan mengalami peningkatan kualitas bakalan yang dihasilkan.
1.2. Tujuan Penelitian
Tujuan penelitian ini ialah untuk mengetahui pengaruh superovulasi serta pemberian ekstrak temulawak pada diferensiasi sel darah putih domba. Selain itu, penelitian ini digunakan untuk mendapatkan formulasi yang efektif antara superovulasi dan pemberian ekstrak temulawak untuk menghasilkan gambaran sel
darah putih yang optimal pada domba. Penelitian ini juga bertujuan untuk mendapatkan data dasar diferensial sel darah putih pada domba hasil superovulasi dan diberi ekstrak temulawak.
1.3. Manfaat Penelitian
Penelitian ini bermanfaat untuk mengoptimalkan teknologi reproduksi, yaitu superovulasi pada domba, dikombinasikan dengan pemberian ekstrak temulawak plus. Teknologi ini dapat digunakan dalam upaya peningkatan populasi dan
II.
TINJAUAN PUSTAKA
2.1. Superovulasi
Superovulasi merupakan teknologi reproduksi yang memungkinkan terjadinya ovulasi yang lebih banyak dari normal dalam sekali siklus estrus. Superovulasi dapat dilakukan dengan pemberian hormon gonadotropin eksogen menjelang ovulasi. Sediaan gonadotropin eksogen yang dapat digunakan untuk menginduksi superovulasi di antaranya human chorionic gonadotrophin (hCG) dan pregnant mare serum gonadotrophin (PMSG). Sediaan hCG diperoleh dari urin wanita yang sedang hamil dan mempunyai kerja utamanya seperti LH dan sedikit efek FSH. Sementara itu, PMSG diperoleh dari serum kuda yang bunting dan mempunyai kerja utamanya seperti FSH dan sedikit efek LH (Noakes et al. 2001). Hormon FSH berperan dalam pertumbuhan dan perkembangan folikel dan LH berperan dalam proses ovulasi.
Superovulasi sebelum perkawinan dilaporkan dapat menghasilkan anak yang lebih banyak dari normal dalam sekali kelahiran (Andriyanto dan Manalu 2010). Banyaknya folikel yang terbentuk membuat teknologi superovulasi dapat meningkatkan jumlah korpus luteum yang dihasilkan (Adriani et al. 2007). Superovulasi sebelum perkawinan juga dapat meningkatkan produksi susu
kambing selama 5 bulan laktasi (Adriani et al. 2004) baik pada induk kambing beranak tunggal maupun pada induk kambing beranak kembar (Adriani et al. 2007). Pada babi, perlakuan superovulasi induk sebelum perkawinan dapat memperbaiki konsentrasi hormon metabolisme yang digambarkan melalui peningkatan sekresi endogen T3 dan T4 dan metabolit penting, yaitu trigliserida, protein, dan glukosa darah (Mege et al. 2011)
sehingga mampu meningkatkan pertumbuhan fetus (prepartum) dan pertumbuhan postpartum (Adriani et al. 2004) terutama pada litter size kurang dari tiga.
2.2. Temulawak (Curcuma xanthorrhiza Roxb.)
Temulawak (Curcuma xanthorhiza Roxb.) merupakan tanaman obat asli Indonesia, disebut juga Curcuma javanica (Rahardjo 2010). Temulawak telah dimanfaatkan industri obat sebagai jamu, herbal terstandar, dan obat fitofarmaka, di Indonesia maupun di mancanegara (Rahardjo 2010). Temulawak juga dapat berfungsi sebagai hepatoprotektor (Anonimous 2010) dan dapat meningkatkan bobot badan dan bobot karkas ayam broiler (Adriani et al. 2009).
Klasifikasi temulawak ialah divisi Spermatophyta, subdivisi Angiospermae, kelas Monocotyledonae, ordo Zingiberales, famili Zingiberaceae, genus Curcuma, dan spesies Curcuma xanthorrhiza roxb (Purseglove et al. 1981). Secara alami, temulawak tumbuh dengan baik di lahan-lahan yang teduh dan terlindung dari teriknya sinar matahari. Rumpun tanaman ini tumbuh subur di bawah naungan pohon bambu atau jati. Namun, temulawak juga dapat dengan mudah ditemukan di tempat yang terik, seperti tanah tegalan. Secara umum, tanaman ini memiliki daya adaptasi yang tinggi terhadap berbagai cuaca di daerah beriklim tropis. Suhu
udara yang baik untuk budi daya tanaman ini antara 19-30oC. Tanaman ini memerlukan curah hujan tahunan antara 1.000-4.000 mm/tahun.
merupakan enzim pengkatalis reaksi penguraian asparagin menjadi asam L-aspartat dan amonia (Haninda 2007).
Kurkumin adalah zat yang melindungi eritrosit dan hemoglobin dari oksidasi oleh senyawa nitrit. Kurkumin dapat meningkatkan hepatoglobin dan sintesis protein haemopeksin dalam hati. Kolagoga adalah zat yang dapat meningkatkan fungsi empedu dan menurunkan lemak tubuh, sehingga kita mendapatkan daging rendah lemak dan daging dengan komposisi protein yang tinggi.
Minyak volatil atau disebut juga minyak atsiri, dibentuk pada retikulum endoplasma dalam sel-sel tumbuhan, dan dapat diperoleh dengan cara penyulingan. Minyak volatil tidak berpengaruh pada populasi mikroorganisme, tetapi berpengaruh positif pada enzim pencernaan. Sekarang, minyak atsiri semakin populer di bidang pertanian dan sektor peternakan karena minyak ini digunakan sebagai promotor pencernaan dan metabolisme, dan tidak menimbulkan resistensi pada hewan (Adriani et al. 2009).
Ekstrak temulawak plus merupakan sediaan ekstrak temulawak yang ditambahkan vitamin. Vitamin-vitamin yang ditambahkan ialah vitamin A, B1, B2, B6, B12, B5, dan vitamin D. Vitamin A berperan dalam memelihara kesehatan gigi, tulang, jaringan lunak, membran mukosa, dan kulit. Vitamin B1
membantu sel-sel tubuh mengubah karbohidrat menjadi energi. Vitamin B6 dan B12 membantu pembentukan sel darah merah dan pemeliharaan fungsi otak. Vitamin D membantu tubuh dalam mengabsorbsi kalsium (Evert 2011).
2.3. Leukosit (Sel Darah Putih)
2.3.1.Netrofil
Netrofil berkembang dalam sum-sum tulang kemudian dikeluarkan dalam sirkulasi. Sel-sel netrofil merupakan 60-70% dari leukosit yang beredar dalam darah. Terdapat dua jenis netrofil, yaitu netrofil segmen dan netrofil band (Kern 2002). Netrofil segmen atau yang telah dewasa mempunyai diameter antara 10-12 µm (Nabity dan Ramaiah 2010). Netrofil muda disebut juga band cell memiliki nukleus yang menggulung atau seperti batang tanpa segmentasi (Swenson 1984). Granul pada netrofil terdiri atas dua macam, yaitu granul azurofilik yang mengandung enzym lisozom dan peroksidase dan granul spesifik yang lebih kecil mengandung fosfatase alkali dan zat-zat bakterisidal (protein kationik) yang dinamakan fagositin (Zukesti 2003).
Gambar 1 Netrofil Segmen (Theml 2004).
Netrofil merupakan garis depan pertahanan seluler terhadap invasi mikroorganisme, trauma jaringan, atau gejala peradangan lain (Nabity dan Ramaiah 2010). Adanya asam amino D oksidase dalam granula azurofilik penting dalam pencernaan dinding sel bakteri yang mengandung asam amino D (Zukesti 2003).
2.3.2.Eosinofil
Eosinofil berasal dari sel-sel induk (stem cell) yang sama dengan netrofil dengan titik awal morfologi eosinofil dapat didefinisikan di sumsum tulang, yaitu pada tahap promielosit (Theml 2004). Eosinofil memiliki nukleus bergelambir dua, dikelilingi butir-butir asidofil yang cukup besar berukuran antara 0,5-1,0 μm. Diameter eosinofil berkisar antara 10-15 μm dan jangka waktu hidup dalam sirkulasi darah selama 3-5 hari (Dellmann dan Brown 1989). Jumlah eosinofil hanya 1-4% leukosit darah (Zukesti 2003).
Gambar 3 Eosinofil (Kern 2002).
Eosinofil mempunyai pergerakan amuboid dan mampu melakukan fagositosis, tetapi lebih lambat dan lebih selektif dibanding netrofil. Eosinofil berfungsi untuk melawan infeksi parasit dan fagositosis kompleks antigen-antibodi (Kern 2002). Peningkatan eosinofil di atas 400/μl harus dilihat sebagai indikasi parasitosis, alergi, dan kondisi lainnya (Theml 2004). Eosinofil mengandung profibrinolisin, diduga berperan mempertahankan darah dari pembekuan, khususnya bila keadaan cairnya diubah oleh proses-proses patologi (Zukesti 2003).
2.3.3.Basofil
segera pada reaksi hipersensitivitas dan berkaitan dengan imunoglobulin E (Kern 2002).
Gambar 4 Basofil(Kern 2002).
Basofil merupakan leukosit granulosit dengan jumlah yang paling sedikit pada mamalia domestik, yaitu sekitar 5% dari total leukosit dalam kondisi sehat. Dalam pembuluh darah perifer, basofil bersirkulasi secara singkat ( sekitar 6 jam)
tetapi dapat hidup sampai 2 minggu dalam jaringan. Basofil masuk ke jaringan saat terjadi respons imun atau peradangan (Pohlman 2010). Untuk itu, basofil
bermigrasi dari aliran darah ke dalam jaringan pada respons terhadap agen kemotaktik.
2.3.4.Limfosit
T menyediakan pertahanan lokal untuk melawan antigen, yaitu benda asing organik dan anorganik pada hipersensitivitas tipe lambat. Limfosit T dibagi menjadi sel helper dan sel supresor.
Gambar 5 Limfosit (Theml 2004).
2.3.5.Monosit
Monosit merupakan sel leukosit yang besar dengan jumlah antara 3-8% dari jumlah leukosit normal (Zukesti 2003; Kern 2004), diameternya antara 9-10 µm tapi pada sediaan darah kering diameter mencapai 20 µm atau lebih (Zukesti 2003). Inti sel monosit biasanya eksentris dengan adanya lekukan yang dalam berbentuk tapal kuda, berbentuk kacang, atau tidak beraturan. Kromatin inti kurang padat dan susunannya lebih fibriler. Keadaan ini merupakan sifat tetap monosit. Monosit diproduksi di sumsum tulang dan berkembang dari tahap awal dari seri granulositik (Theml 2004). Monosit ditemukan dalam darah, 8-14 jam kemudian monosit masuk ke jaringan dan menjadi makrofag (Kern 2002).
Gambar 6 Monosit (Kern 2002).
III.
METODE
3.1. Waktu dan Tempat
Penelitian dilakukan selama 8 bulan yang dimulai pada bulan Mei sampai dengan Desember 2010. Penelitian dilaksanakan di peternakan domba Mitra Maju yang beralamat di Jalan Manunggal No. 1, Tegal Waru, Ciampea, Bogor. Analisis sampel darah dilakukan di Laboratorium Fisiologi, Departemen Anatomi, Fisiologi, dan Farmakologi, Fakultas Kedokteran Hewan IPB.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini ialah kandang percobaan, spuid, tabung reaksi, timbangan digital, gelas objek, kamar hitung Neubauer, dan mikroskop cahaya. Sementara itu, bahan-bahan yang digunakan ialah domba, albendazole, vitamin B kompleks, Prostaglandin (PGF2α), Pregnant Mare Serum Gonadotrophin (PMSG), ekstrak temulawak plus (terdiri atas ekstrak Curcuma xanthorrhiza dan multivitamin), Etilen Diamin Tetraasetat (EDTA), giemsa, metil alkohol, larutan turk, dan antibiotik.
3.3. Tahap Persiapan 3.3.1. Hewan Percobaan
Hewan yang digunakan dalam penelitian ini sebanyak 16 ekor domba betina yang telah dewasa kelamin dengan kisaran bobot badan antara 20-25 kg. Domba-domba penelitian tersebut merupakan Domba-domba lokal yang berasal dari daerah Priangan Timur.
3.3.2. Aklimatisasi Domba
Sementara itu, vitamin B kompleks diberikan untuk meningkatkan daya tahan tubuh dan mengoptimalkan kondisi tubuh domba.
3.3.3.Kandang, Pakan, dan Minum
Kandang yang digunakan dalam penelitian ini adalah kandang kelompok
tipe panggung dengan ketinggian 50 cm dari permukaan tanah. Hal ini dimaksudkan untuk meminimalisir paparan gas amoniak yang berasal dari feses. Sementara itu, pakan diberikan 3 kali sehari pada pagi, siang, dan sore. Pakan yang diberikan ialah rumput dan umbi singkong. Rumput diberikan pada pagi dan sore hari. Selanjutnya, umbi singkong diberikan pada siang hari. Air minum tersedia secara ad libitum.
3.4. Tahap Pelaksanaan 3.4.1. Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini ialah Rancangan Acak Lengkap (RAL) dengan pola faktorial 2×2 dan 4 ulangan. Faktor pertama ialah superovulasi sebelum perkawinan yang terdiri atas dua level, yaitu domba yang diinjeksi PMSG dan hCGdengan dosis 0 IU/ekor dan domba yang diinjeksi PMSG dan hCGdengan dosis 75-125 IU/ekor. Sementara itu, faktor kedua ialah
dosis ekstrak temulawak plus yang terdiri atas dua level, yaitu domba yang diberi ekstrak temulawak plus 0 mg/kg bobot badan dan domba yang diberi ekstrak temulawak plus 1 mg/kg bobot badan.
3.4.2. Superovulasi
Tahap superovulasi diawali dengan pemeriksaan ultrasonography (USG) untuk memastikan tidak ada domba yang sedang bunting sebelum diberi PGF2α. Hal ini mengingat pemberian PGF2α pada domba yang sedang bunting akan
hCG secara intramuskuler dengan dosis 75-125 IU/ekor untuk menginduksi superovulasi.
Pada 24-36 jam setelah pemberian PMSG dan hCG, domba menunjukkan gejala estrus yang ditandai dengan memerahnya vulva, membengkaknya vulva, dan meningkatnya jumlah lendir pada vulva. Deteksi estrus juga dilakukan dengan mendekatkan domba jantan pada domba betina. Jika domba betina estrus, domba jantan memperlihatkan keinginan untuk mengawini domba betina tersebut. Kemudian, domba betina yang estrus dikawinkan secara alami dengan pejantan yang telah diseleksi. Pada hari ke-30 setelah dikawinkan, domba penelitian di-USG untuk mendeteksi kebuntingan dan menghitung jumlah fetus.
3.4.3. Pencekokan Ekstrak Temulawak Plus
Pencekokan ekstrak temulawak plus dilakukan per oral dengan dosis 1 mg/kg bobot badan. Pencekokan dilakukan setiap minggu yang dimulai pada bulan ke-2 selama periode kebuntingan.
3.4.4. Pengambilan dan Analisis Sampel
Sampel darah diambil sebelum perlakuan dan pada periode kebuntingan (bulan ke-1, ke-2, ke-3, ke-4, dan ke-5). Sampel darah diambil dari vena jugularis dan ditampung pada tabung reaksi yang telah diberi antikoagulan (EDTA). Penghitungan jumlah sel darah putih dilakukan dengan metode hemositometer menggunakan pengencer turk. Sampel darah diambil sampai batas angka 1 pada pipet leukosit kemudian diencerkan dengan pengencer turk hingga batas angka 11. Kedua ujung pipet ditutup dengan ibu jari dan telunjuk. Campuran pada pipet dihomogenkan dengan membolak-balikkan pipet membentuk angka delapan. Campuran diteteskan pada kamar hitung Neubauer dan ditutup cover glass. Jumlah sel darah putih dihitung pada empat bujur sangkar di sudut kamar hitung di bawah mikroskop cahaya dengan pembesaran objektif 40 kali.
gelas objek pertama. Gelas objek kedua didorong sehingga darah menyebar sepanjang gelas objek pertama. Sediaan ulas darah dikeringkan dan difiksasi dengan metil alkohol selama lima menit. Sediaan yang telah difiksasi diwarnai dengan pewarna Giemsa selama 30 menit. Setelah selesai, sediaan dicuci dengan air mengalir dan dikeringkan di udara. Diferensiasi sel darah putih diamati di bawah mikroskop cahaya dengan pembesaran objektif 100 kali.
3.5. Parameter yang Diamati
Parameter yang diamati dalam penelitian ini ialah jumlah dan diferensial sel darah putih. Diferensial sel darah putih terdiri atas agranulosit yang terdiri atas limfosit dan monosit serta granulosit yang terdiri atas netrofil, eosinofil, dan basofil. Kemudian, dihitung nilai rasio N/L atau netrofil/limfosit dari jumlah yang diperoleh.
3.6. Analisis Data
IV.
HASIL DAN PEMBAHASAN
Sebelum dilakukan superovulasi, domba diukur diferensial sel darah putihnya. Pengukuran dilakukan secara acak pada lima ekor domba yang akan digunakan. Pengukuran dilakukan untuk mengetahui diferensiasi sel darah putih pada domba yang tidak bunting. Dari pengukuran diferensiasi sel darah putih tersebut, didapat nilai rasio N/L (netrofil/limfosit) pada domba tidak bunting sebesar 0,93±0,18. Selanjutnya, gambaran sel darah putih disajikan pada Tabel 1.
Tabel 1. Jumlah sel darah putih sampel domba sebelum disuperovulasi untuk netrofil, basofil, eosinofil, limfosit, dan monosit (×50/mm3)
No Sel Darah Putih Jumlah (n=5)
1 Netrofil 37,40±3,36
2 Basofil 0,00±0,00
3 Eosinofil 1,20±1,64
4 Limfosit 40,80±5,63
5 Monosit 3,80±1,64
4.1. Netrofil
Domba yang disuperovulasi saja (SO) dan domba yang disuperovulasi dan diberi ekstrak temulawak plus (SO+TM) memiliki jumlah rata-rata netrofil yang lebih tinggi setiap bulannya dibandingkan dengan domba nonsuperovulasi yang diberi ekstrak temulawak plus (TM) maupun kontrol (KO). Jumlah netrofil pada kedua kelompok tersebut mengalami kenaikan hingga bulan ke-3 dengan jumlah masing-masing (51,25±6,29)×50/mm3 dan (53,75±2,50)×50/mm3. Jumlah tersebut kemudian menurun pada bulan ke-4 dan ke-5 hingga mencapai (48,25±2,50)×50/mm3 dan (50,00±5,77)×50/mm3. Domba yang diberi ekstrak temulawak plus saja mempunyai jumlah netrofil yang meningkat setiap bulannya dari (32,25±6,08)×50/mm3 pada awal kebuntingan hingga (46,25±2,50)×50/mm3 pada akhir kebuntingan. Sementara itu, domba kontrol (yang tidak disuperovulasi dan tidak diberi ekstrak temulawak plus) mengalami fluktuasi netrofil setiap bulannya dengan jumlah yang lebih kecil dari kelompok SO maupun TM
[image:30.595.97.514.74.822.2]tersebut pada saat dilakukan pemeriksaan (Maheshwari et al. 2001). Jumlah netrofil pada domba yang bunting lebih tinggi dibanding domba yang tidak bunting seiring meningkatnya usia kebuntingan. Domba yang tidak bunting memiliki jumlah netrofil sebanyak (37,40±3,36)×50/mm3. Al-Saad et al.(2010) mendapatkan jumlah netrofil yang lebih besar pada domba yang tidak bunting, yaitu sebanyak (69,95±8,70)×50/mm3 pada penelitian yang dilakukannya. Selanjutnya jumlah rataan netrofil disajikan pada Tabel 2.
Tabel 2. Rataan jumlah netrofil lima bulan kebuntingan pada kelompok domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (× 50/mm3)
Bulan
ke-
KO TM
SO TM SO*TM KO (n=4) SO (n=4) KO (n=4) SO (n=4)
1 35,50 ± 1,29 40,75 ±2,22 32,25 ± 6,08 40,00 ± 7,07 * - -
2 41,25 ± 0,50 47,50 ± 6,45 39,25 ± 2,22 50,00 ± 8,16 * - -
3 37,50 ± 9,57 51,25 ± 6,29 42,50 ± 5,00 53,75 ± 2,50 * - -
4 40,00 ± 7,07 50,00 ± 4,08 46,25 ± 6,29 50,00 ± 4,08 * - -
5 43,75 ± 4,79 48,25 ± 2,50 46,25 ± 2,50 50,00 ± 5,77 - - -
Ket: KO = Kontrol; SO = Superovulasi; TM = Ekstrak temulawak plus; * = berpengaruh signifikan (P<0,05)
Superovulasi berpengaruh menaikkan jumlah netrofil pada bulan ke-1 sampai dengan bulan ke-4 kebuntingan dibandingkan kontrol. Jumlah netrofil
terjadi cekaman akut atau infeksi (Kern 2002). Fungsi utama netrofil ialah fagositosis terutama untuk infeksi bakteri (Kern 2002).
Gambar 7 Rataan jumlah netrofil pada 5 bulan kebuntingan dan domba tidak bunting, dengan kontrol (♦), pemberian ekstrak temulawak (▲), superovulasi (■),superovulasi + ekstrak temulawak (×), dan tidak bunting (●).
Domba yang tidak disuperovulasi, yaitu kelompok KO dan TM memiliki jumlah netrofil tertinggi pada akhir kebuntingan. Jumlah ini sejalan dengan penelitian Maheswari et al.(2001) yang memiliki jumlah netrofil tertinggi pada akhir kebuntingan. Menjelang kelahiran, induk domba mengalami cekaman yang tinggi akibat dari sekresi kortisol yang dihasilkan oleh fetus yang mengalami cekaman. Kortisol yang tinggi dapat menginduksi tingginya jumlah netrofil yang dikeluarkan dari sumsum tulang ke aliran darah dan menurunnya diapedesis ke jaringan.
Domba yang hanya diberikan ekstrak temulawak plus pada awal kebuntingan mempunyai jumlah netrofil yang kecil, akan tetapi terus meningkat hingga bulan ke-5 kebuntingan. Pemberian ekstrak temulawak plus tidak berpengaruh signifikan dalam menaikkan jumlah netrofil dan tidak ada interaksi dengan superovulasi. Pemberian ekstrak temulawak plus juga tidak mengurangi cekaman metabolisme yang diduga sebagai akibat dari litter size yang besar pada domba yang disuperovulasi.
0 10 20 30 40 50 60
1 2 3 4 5
Ju
m
lah
n
etr
o
fil
(
×
50)
4.2. Basofil
Jumlah rata-rata basofil pada tiap bulan hampir tidak ditemukan pada setiap kelompok perlakuan. Basofil hanya ditemukan sebanyak (0,25±0,50)×50/mm3 pada kelompok superovulasi (SO) pada kebuntingan bulan ke-1 dan ke-2 dan kelompok domba yang diberi ekstrak temulawak plus (TM) pada bulan ke-1
kebuntingan saja. Pada domba yang tidak bunting juga tidak ditemukan basofil. Hasil ini sejalan dengan hasil penelitian Maheshwari et al. (2001) dengan kambing sebagai hewan cobanya, yang hanya menemukan basofil pada awal kebuntingan. Basofil yang ditemukan sebanyak (1,00±0,00)×50/mm3, baik pada domba yang bunting tunggal maupun kembar. Secara umum, selama periode kebuntingan, superovulasi dan pemberian ekstrak temulawak plus tidak mempengaruhi jumlah basofil. Basofil secara normal berjumlah kurang dari 1% dari jumlah sel darah putih (Kern 2002) atau kurang dari 10 sel dari 1000 sel darah putih.
Basofil bersama dengan sel mast dan eosinofil telah lama dianggap sebagai efektor penting dalam gangguan alergi (Costa et al. 1997). Tidak ditemukannya basofil dalam jumlah yang signifikan menandakan domba-domba penelitian tidak mengalami alergi maupun infeksi. Basofil yang ditemukan pada sebagian domba di bulan pertama kebuntingan diduga karena adanya proses adaptasi domba penelitian terhadap lingkungan yang baru. Selanjutnya, jumlah rataan basofil disajikan pada Tabel 3.
Tabel 3. Rataan jumlah basofil lima bulan kebuntingan pada kelompok domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (× 50/mm3)
Bulan ke-
KO TM
SO TM SO*TM KO (n=4) SO (n=4) KO (n=4) SO (n=4)
1 0,00 ± 0,00 0,25 ± 0,50 0,25 ± 0,50 0,00 ± 0,00 - - -
2 0,00 ± 0,00 0,25 ± 0,50 0,00 ± 0,00 0,00 ± 0,00 - - -
3 0,00 ± 0,00 0,00 ± 0,00 0,00 ± 0,00 0,00 ± 0,00 - - -
4 0,00 ± 0,00 0,00 ± 0,00 0,00 ± 0,00 0,00 ± 0,00 - - -
5 0,00 ± 0,00 0,00 ± 0,00 0,00 ± 0,00 0,00 ± 0,00 - - -
Ket: KO = Kontrol; SO = Superovulasi; TM = Ekstrak temulawak plus; * = berpengaruh signifikan (P<0,05)
[image:33.595.81.510.31.832.2]mencegah koagulasi. Basofilia pada mamalia domestik biasanya dikaitkan dengan gangguan hipersensitif berperantara IgE dan biasanya disertai dengan eosinofilia (Pohlman 2010). Potensi fagositik basofil rendah, salah satu fungsi protektifnya melibatkan pertahanan melawan cacing. Hal ini disebabkan pengaruh stimulasi sel T untuk memproduksi limfosit T helper tipe 2 (Th2). Saat tidak ada basofil, Th2 sitokin yang diproduksi oleh sel T sangat sedikit atau bahkan tidak ada (Pohlman 2010).
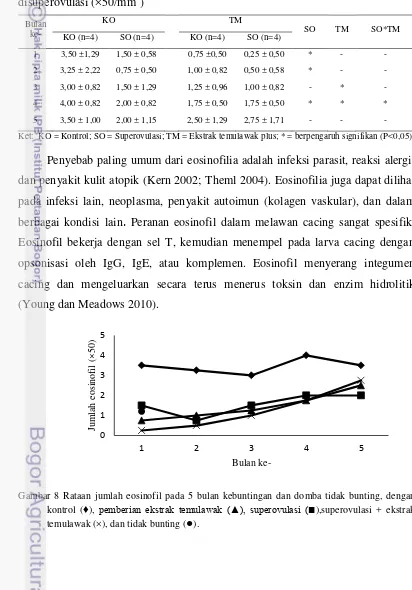
4.3. Eosinofil
Jumlah rata-rata eosinofil lebih tinggi pada domba kontrol (KO), yang tidak disuperovulasi dan tidak diberi ekstrak temulawak plus. Jumlahnya sebanyak (3,50±1,29)×50/mm3 pada bulan pertama kebuntingan dan mencapai puncaknya pada kebuntingan bulan ke-4 sebanyak (4,00±0,82)×50/mm3. Domba yang disuperovulasi saja (SO) memiliki jumlah eosinofil yang lebih kecil dari kontrol (KO). Jumlah terkecil pada bulan ke-2 kebuntingan sebanyak (0,75±0,50)×50/mm3 dan tertinggi pada bulan ke-3 dan ke-4 kebuntingan dengan masing-masing berjumlah (2,00±0,82) dan (2,00±1,15) dikali 50/mm3. Pemberian ekstrak temulawak plus menurunkan eosinofil pada bulan ke-3 dan ke-4. Jumlahnya terus meningkat dari awal hingga akhir kebuntingan. Pada bulan ke-4 terjadi interaksi antara superovulasi dan pemberian ekstrak temulawak plus dalam menurunkan jumlah eosinofil. Interaksi tersebut menandakan adanya senyawa dalam ekstrak temulawak plus yang dapat menurunkan eosinofil baik secara langsung maupun tidak langsung. Domba yang tidak bunting memiliki jumlah eosinofil yang lebih rendah dari domba kontrol, yaitu sebesar (1,20±1,64)×50/mm3.
Domba yang disuperovulasi dan yang diberi ekstrak temulawak plus (SO+TM) mempunyai jumlah eosinofil yang relatif rendah dibandingkan dengan
atsiri yang terkandung dalam temulawak mempunyai aktivitas antihelmentik terhadap cacing askaris baik pada tahap perkembangan telur menjadi telur berembrio, perkembangan telur berembrio menjadi larva, dan melumpuhkan cacing dewasa (Sukandar et al. 1997). Selanjutnya, jumlah rataan eosinofil disajikan pada Tabel 4.
Tabel 4. Rataan jumlah eosinofil lima bulan kebuntingan pada kelompok domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (×50/mm3)
Bulan ke-
KO TM
SO TM SO*TM KO (n=4) SO (n=4) KO (n=4) SO (n=4)
1 3,50 ±1,29 1,50 ± 0,58 0,75 ±0,50 0,25 ± 0,50 * - -
2 3,25 ± 2,22 0,75 ± 0,50 1,00 ± 0,82 0,50 ± 0,58 * - -
3 3,00 ± 0,82 1,50 ± 1,29 1,25 ± 0,96 1,00 ± 0,82 - * -
4 4,00 ± 0,82 2,00 ± 0,82 1,75 ± 0,50 1,75 ± 0,50 * * *
5 3,50 ± 1,00 2,00 ± 1,15 2,50 ± 1,29 2,75 ± 1,71 - - -
Ket: KO = Kontrol; SO = Superovulasi; TM = Ekstrak temulawak plus; * = berpengaruh signifikan (P<0,05)
Penyebab paling umum dari eosinofilia adalah infeksi parasit, reaksi alergi, dan penyakit kulit atopik (Kern 2002; Theml 2004). Eosinofilia juga dapat dilihat pada infeksi lain, neoplasma, penyakit autoimun (kolagen vaskular), dan dalam berbagai kondisi lain. Peranan eosinofil dalam melawan cacing sangat spesifik.
Eosinofil bekerja dengan sel T, kemudian menempel pada larva cacing dengan opsonisasi oleh IgG, IgE, atau komplemen. Eosinofil menyerang integumen cacing dan mengeluarkan secara terus menerus toksin dan enzim hidrolitik (Young dan Meadows 2010).
Gambar 8 Rataan jumlah eosinofil pada 5 bulan kebuntingan dan domba tidak bunting, dengan kontrol (♦), pemberian ekstrak temulawak (▲), superovulasi (■),superovulasi + ekstrak temulawak (×), dan tidak bunting (●).
0 1 2 3 4 5
1 2 3 4 5
[image:35.595.95.507.227.817.2]Jumlah eosinofil cenderung lebih besar pada akhir kebuntingan dibandingkan dengan awal dan pertengahan kebuntingan pada kelompok domba perlakuan, yaitu superovulasi dan pemberian ekstrak temulawak plus. Sementara itu, kelompok domba kontrol mempunyai jumlah eosinofil yang tinggi pada pertengahan kebuntingan dibanding awal dan akhir kebuntingan (Gambar 8). Hal ini sejalan dengan hasil penelitian Ullrey et al. (1965) yang menunjukkan tingginya jumlah eosinofil pada pertengahan kebuntingan. Pada ruminansia, jumlah eosinofil meningkat karena adanya infeksi parasit dan dapat menurun jika terjadi cekaman atau pemberian kortikosteroid (Tornquist dan Rigas 2010).
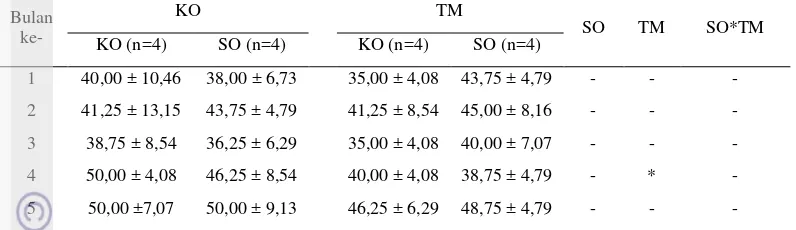
4.4. Limfosit
Kadar limfosit dalam darah relatif lebih tinggi pada akhir kebuntingan (bulan ke-5) dengan jumlah yang hampir sama untuk setiap perlakuan. Tidak ada interaksi superovulasi dan pemberian ekstrak temulawak plus pada jumlah limfosit. Pemberian ekstrak temulawak plus menurunkan limfosit pada bulan ke-4 kebuntingan saja. Pada bulan ini, jumlah limfosit lebih rendah pada domba yang diberikan ekstrak temulawak plus, baik yang di superovulasi (SO+TM) maupun tidak (TM), dibandingkan dengan yang tidak diberi ekstrak temulawak plus (KO dan SO). Perlakuan superovulasi tidak mempengaruhi jumlah limfosit. Jumlah limfosit tidak berbeda nyata dari setiap perlakuan dengan jumlah terendah (35,00±4,08)×50/mm3 dan tertinggi (50,00±9,13)×50/mm3. Sementara itu, domba yang tidak bunting memiliki jumlah limfosit sebanyak (40,80±5,63)×50/mm3. Jumlah limfosit domba tidak bunting lebih tinggi dari hasil penelitian Javed et al. (2010) yang mendapatkan limfosit dengan jumlah (35,18±0,43)×50/mm3.
Limfosit dapat menjadi parameter adanya cekaman. Dalam kondisi cekaman, kadar limfosit dalam darah akan menurun (Zahorec 2001; Tornquist dan Rigas 2010). Jumlah limfosit yang tinggi mengindikasikan terjadinya
Tabel 5. Rataan jumlah limfosit lima bulan kebuntingan pada kelompok domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (×50/mm3)
Bulan ke-
KO TM
SO TM SO*TM KO (n=4) SO (n=4) KO (n=4) SO (n=4)
1 40,00 ± 10,46 38,00 ± 6,73 35,00 ± 4,08 43,75 ± 4,79 - - -
2 41,25 ± 13,15 43,75 ± 4,79 41,25 ± 8,54 45,00 ± 8,16 - - -
3 38,75 ± 8,54 36,25 ± 6,29 35,00 ± 4,08 40,00 ± 7,07 - - -
4 50,00 ± 4,08 46,25 ± 8,54 40,00 ± 4,08 38,75 ± 4,79 - * -
5 50,00 ±7,07 50,00 ± 9,13 46,25 ± 6,29 48,75 ± 4,79 - - -
Ket: KO = Kontrol; SO = Superovulasi; TM = Ekstrak temulawak plus; * = berpengaruh signifikan (P<0,05)
Jumlah limfosit lebih tinggi pada akhir kebuntingan untuk setiap kelompok domba (Tabel 5). Hal ini berlawanan dengan hasil yang diperoleh Maheshwari et al. (2001) yang menunjukkan rendahnya jumlah limfosit pada akhir kebuntingan. Pada akhir kebuntingan, terutama menjelang kelahiran tingkat cekaman cukup tinggi. Hal ini diakibatkan sekresi kortisol dari korteks adrenal fetus yang mengalami cekaman. Tingginya kortikosteroid dan kortisol saat terjadi cekaman mengakibatkan jumlah limfosit menurun (Tornquist dan Rigas 2010). Sementara itu, limfositosis pada ruminansia dapat terjadi pada infeksi virus yang kronis, trypanosomiasis kronis, dan peradangan kronis yang lain yang menyebabkan pelepasan epinefrin (Tornquist dan Rigas 2010).
Pemberian ekstrak temulawak plus berpengaruh menurunkan jumlah limfosit pada bulan ke-4 kebuntingan (Tabel 5). Dalam ekstrak temulawak plus terdapat beberapa zat yang terkandung, di antaranya kurkumin, minyak atsiri, serta vitamin. Minyak atsiri dapat berkhasiat sebagai antimikroba, sehingga jumlah limfosit tidak mengalami peningkatan yang signifikan karena domba penelitian tidak mengalami peradangan. Vitamin yang terkandung di dalamnya juga berkhasiat dalam meningkatkan sistem imun (Fatmah 2006). Vitamin A
[image:37.595.115.513.133.248.2]4.5. Monosit
Jumlah rata-rata monosit pada tiap perlakuan tidak berbeda. Jumlah monosit berada pada kisaran 3,50 ± 1,29sampai 6,75 ± 1,50 × 50/mm3 dengan pola yang meningkat pada akhir masa kebuntingan. Jumlah monosit berfluktuasi pada pertengahan kebuntingan. Pada domba kontrol (KO), jumlah monosit cenderung menurun pada akhir kebuntingan dibandingkan bulan pertama kebuntingan. Semua perlakuan pada domba, baik superovulasi maupun pemberian ekstrak temulawak plus, tidak berpengaruh secara signifikan dalam menaikkan maupun menurunkan jumlah monosit (Tabel 6). Sementara itu, rataan jumlah monosit pada domba yang tidak bunting ialah 3,80±1,64 × 50/mm3. Secara umum domba yang bunting memiliki jumlah monosit yang lebih banyak dari domba yang tidak bunting. Selanjutnya jumlah rataan limfosit disajikan pada Tabel 6.
Tabel 6. Rataan jumlah monosit lima bulan kebuntingan pada kelompok domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi (×50/mm3)
Bulan ke-
KO TM
SO TM SO*TM KO (n=4) SO (n=4) KO (n=4) SO (n=4)
1 5,75 ± 0,96 3,50 ± 1,29 4,25 ± 3,30 3,75 ± 2,22 - - -
2 4,50 ± 1,29 4,50 ± 2,38 5,00 ± 1,41 3,25 ± 1,50 - - -
3 6,00 ± 2,16 5,00 ± 2,16 5,50 ± 1,29 4,50 ± 1,29 - - -
4 5,75 ± 2,63 5,00 ± 2,94 5,25 ± 2,06 4,00 ± 2,31 - - -
5 5,50 ± 0,58 6,00 ± 2,16 6,75 ± 1,50 5,25 ± 2,75 - - -
Ket: KO = Kontrol; SO = Superovulasi; TM = Ekstrak temulawak plus; * = berpengaruh signifikan (P<0,05)
Monosit biasanya hadir dalam akhir peradangan akut dan kronis, khususnya pada kasus Endocarditis lenta, listeriosis, brucellosis, tuberculosis (Theml 2004).
makrofag memiliki peranan penting dalam pertahanan melawan beberapa organisme termasuk Mycobacterium, Leishmania, Rhodococcus, Toxoplasma, Listeria, Brucella, Salmonella, Yersinia, Shegellia, Rickettsia, Legionella, dan Theileria.
4.6. Rasio Netrofil/Limfosit (N/L)
Rasio N/L atau netrofil/limfosit dapat menggambarkan tingkat cekaman. Nilai N/L dapat merefleksikan kenaikan kadar kortisol plasma yang merupakan salah satu hormon stres (Widowski et al. 1989). Domba yang tidak bunting, memiliki nilai rataan N/L sebesar 0,93±0,18. Sementara itu, domba yang disuperovulasi, baik yang dicekok ekstrak temulawak plus (SO+TM) maupun yang tidak (SO), memiliki nilai rataan N/L lebih besar dibanding kontrol (KO). Rataan nilai N/L pada kelompok kontrol ialah 0,91±0,08 dan pada domba yang dicekok ekstrak temulawak saja sebesar 1,05±0,13. Sementara itu, domba yang disuperovulasi saja memiliki nilai N/L sebesar 1,13±0,16 dan domba yang disuperovulasi dengan dicekok ekstrak temulawak plus sebesar 1,14±0,18. Terjadi fluktuasi nilai N/L pada kontrol (Gambar 9). Selanjutnya nilai rasio N/L disajikan pada Tabel 7.
Tabel 7. Nilai rasio N/L pada lima bulan kebuntingan pada kelompok domba kontrol dan yang diberi ekstrak temulawak plus baik yang tidak maupun yang disuperovulasi
Bulan ke-
KO TM
SO TM SO*TM KO (n=4) SO (n=4) KO (n=4) SO (n=4)
1 0,89±0,23 1,07±0,25 0,92±0,16 0,91±0,25 - - -
2 1,00±0,44 1,09±0,06 0,95±0,26 1,11±0,31 - - -
3 0,97±0,34 1,41±0,38 1,21±0,19 1,34±0,20 - - -
4 0,80±0,16 1,08±0,31 1,16±0,12 1,29±0,23 - * -
5 0,88±0,09 0,98±0,22 1,00±0,14 1,03±0,21 - - - Ket: KO = Kontrol; SO = Superovulasi; TM = Ekstrak temulawak plus; *=berpengaruh signifikan
Domba yang disuperovulasi saja, diberi ekstrak temulawak plus saja, dan kombinasi keduanya menunjukkan kenaikan nilai N/L pada setiap bulannya dan mencapai puncak pada bulan ke-3 dengan rasio N/L masing-masing ialah 1,41±0,38; 1,21±0,19; dan 1,34±0,30. Setelah itu, jumlahnya menurun hingga akhir kebuntingan. Secara umum, domba yang bunting memiliki nilai rasio N/L
di awal dan akhir masa kebuntingan (Gambar 9). Domba dewasa memiliki rasio sekitar N/L 1,00 sedangkan domba yang baru lahir nilainya lebih besar dari 1,00 (Tornquist dan Rigas 2010).
Tingginya rasio N/L pada domba yang disuperovulasi semakin menguatkan dugaan bahwa superovulasi memberikan cekaman tersendiri terhadap domba yang bunting. Hal ini dikarenakan superovulasi sebelum perkawinan dapat meningkatkan jumlah korpus luteum, sehingga terjadi peningkatan konsentrasi estradiol dan progesteron (Adriani et al. 2007). Tingginya estradiol menyebabkan meningkatnya kadar corticotrophin releashing hormone (Roy et al. 1999) sehingga kadar kortisol juga tinggi. Keadaan ini menggambarkan terjadinya cekaman. Domba superovulasi yang diberi ekstrak temulawak plus (SO+TM) mempunyai rataan litter size 2,50±0,58 dan yang tidak diberi ekstrak temulawak plus (SO) sebesar 2,25±0,50. Nilai tersebut 2 kali lipat dari litter size domba yang tidak disuperovulasi, baik yang diberi ekstrak temulawak plus (TM) maupun yang tidak (KO) , dengan rataan litter size 1,25±0,50. Litter size yang lebih tinggi pada domba superovulasi memberikan beban metabolisme yang lebih tinggi pula. Keadaan ini diduga memberikan cekaman yang lebih tinggi terhadap domba superovulasi (Andriyanto dan Manalu 2011).
Gambar 9 Nilai rasio N/L pada 5 bulan kebuntingan dan pada domba tidak bunting, dengan kontrol (♦), pemberian ekstrak temulawak (▲), superovulasi (■), superovulasi + ekstrak temulawak (×), dan tidak bunting (●).
0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60
1 2 3 4 5
R
asio
N/L
V.
PENUTUP
5.1. Kesimpulan
Superovulasi dapat menyebabkan cekaman pada domba yang bunting. Hal ini terlihat dari meningkatnya jumlah netrofil dan rasio N/L yang merupakan indikator tingginya cekaman. Sementara itu, pemberian ekstrak temulawak plus tidak berpengaruh pada cekaman pada periode kebuntingan. Formulasi yang tepat untuk meningkatkan produktivitas domba ialah superovulasi tanpa pemberian ekstrak temulawak plus. Data dasar diferensiasi sel darah putih domba bunting yang disuperovulasi dan diberi ekstrak temulawak plus didapatkan dalam penelitian ini.
5.2. Saran
VI.
DAFTAR PUSTAKA
Adriani L, Sujana E, Mushawwir A, Maradona A. 2009. The effect of ration with antibiotics (Virginamycin) and temulawak (Curcuma xanthorriza roxb.) to broiler performances. Proceeding of The 1st International Seminar on Animal Industry. Faculty of Animal Science, Bogor Agricultural University, Bogor. Hlm 103-105
Adriani, Sutama I K, Sudono A, Sutardi T, Manalu W. 2004. Pengaruh superovulasi sebelum perkawinan dan suplementasi seng terhadap produksi susu kambing peranakan etawah. Anim Prod 6(2): 86-94
Adriani, Sudono A, Sutardi T, Manalu W , Sutama I K. 2007. Pertumbuhan prenatal dalam kandungan kambing melalui superovulasi. HAYATI J Biosci 14(2):44-48
Andriyanto, Manalu W. 2010. Prospek penerapan teknologi perbaikan sekresi endogen hormon kebuntingn pada domba skala peternakan rakyat. Prosiding Seminar Nasional Peranan Teknologi Reproduksi Hewan dalam Rangka Swasembada Pangan Nasional. Bagian Reproduksi dan Kebidanan, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor, Bogor. Hlm. 125-127
Andriyanto, Manalu W. 2011.Potency of ethanol extract Curcuma xanthriza as a natural growth promotor in pregnant ewes with suprovulation. Globalization of Jamu Brand Indonesia. The 2nd Internationl Symposium on Temulawak. The 40th Meeting of National Working Group on Indonesian Medical Plant. IICC, Bogor. Hlm. 134-136
Anonimous. 2010. Lembaran Informasi: Temu Lawak. Jakarta: Yayasan Spiritia.
Arifin Z, Kardiyono. 1985. Temulawak dalam pengobatan tradisional. Dalam: Prosiding Simposium Nasional Temulawak. Bandung: Lembaga penelitian Universitas Padjajaran. Hlm. 210-219
Badan Pusat Statistik [BPS]. 2011. Populasi ternak 2000-2008. http://www.bps.go.id/tab_sub/view.php?tabel=1&daftar=1&id_subyek=24& notab=12. [14 Mei 2011].
Candra A A. 2008. Efektivitas Pemberian Infus dan Bubuk Temulawak (Curcuma xanthorrhiza roxb.) terhadap Penampilan dan Kajian Ekonomi Ayam Pedaging yang Diinfeksi Eimeria maxima [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Centers for Disease Control and Prevention [CDC]. 2011. Protein. http://www.cdc.gov/nutrition/ everyone/basics/protein.html [14 September 2011].
Day MJ. 2010. Immune - mediated anemias in the dog. Di dalam: Weiss DJ, Wardrop K. J, editor. Schalm’s Veterinary Hematology Sixth Edition. Iowa: Blackwell Publishing Ltd. Hlm. 216-225
Dellmann HD, Brown EM. 1989. Buku Teks Histologi Veteriner, Edisi ke-3. Jan Tambayong, penerjemah; Jakarta: EGC. Terjemahan dari: Textbook of Veterinary Histology 3rd ed.
Direktorat Jenderal Peternakan dan Kesehatan Hewan [DITJENNAK]. 2011a. Produksi daging nasional per provinsi – domba. http://www.ditjennak.go.id/ basisdataproses.asp?thn1=2008&thn2=2008&jd=Domba&button=Submit&r ep=5&ket=Produksi+Daging+Nasional+Per+Provinsi+. [10 Juli 2011]
Direktorat Jenderal Peternakan dan Kesehatan Hewan [DITJENNAK]. 2011b. Pemasukan Domba Tahun 2005-2009 (Per Propinsi). http://www.ditjennak.go.id/bank/Tabel_3_17.pdf. [10 Juli 2011]
Evert A. 2011. Vitamins. http://www.nlm.nih.gov/medlineplus/ency/ article/ 002399.htm [20 september 2011]
Fatmah. 2006. Respons imunitas yang rendah pada tubuh manusia usia lanjut. Makara Kesehatan 10(1): 47-53
Haninda DA. 2007. Isolasi dan karakterisasi enzim l-asparaginase dari rimpang temulawak (Curcuma xanthorrhiza roxb.) dalam sediaan utuh dan serbuk [Abstrak]. Di dalam: Seminar Tugas Akhir S1 Jurusan Kimia FMIPA UNDIP; Semarang, 12 Feb 2010. Semarang: Jurusan Kimia, FMIPA UNDIP.
Isroli, Sudarmoyo B, Widyastuti E, Yudiarti T, Sartono TA, Pratikno H. 2002. Pengaruh cekaman panas terhadap gambaran hematologi domba lokal. Laporan Penelitian. Semarang: Laboratorium Fisiologi dan Biokimia, Fakultas Peternakan, Universitas Diponegoro.
Jain NC. 1993. Essentials of Veterinary Hematology. Pennsylvania: Lea and Febiger.
Javed MT, Ahmad L, Irfan M, Ali I, Khan et al. 2010.Haematological and serum protein values in tuberculin reactor and non-reactor water buffaloes, cattle, sheep and goats. Pak Vet J 30(2): 100-104
Kern MD W. 2002. PDQ Hematology. USA: Pmph USA.
Kristiana H. 2008. Gambaran Darah Mencit (Mus musculus albinus) yang Diberi Salep ekstrak Etanol dan Fraksi Hexan Rimpang Kunyit (Curcuma longa linn.) Pada Proses Persembuhan Luka. (Skripsi). Fakultas Kedokteran Hewan, Institut Pertanian Bogor
Mashita AR. 2008. Efek antimikroba ekstrak rimpang temulawak (Curcuma xanthorrhiza) terhadap pertumbuhan Staphylococcus aureus [tesis]. Malang: Departemen Pendidikan Kesehatan, Fakultas Kedokteran, Universitas Muhammadiyah Malang.
Matanews. 2009. Konsumsi protein hewani Indonesia terendah di Asean. http://matanews.com/2009/12/17/konsumsi-protein-hewani-indonesia
terendah-di-asean/. [14 Mei 2011].
Mc Donald L.E. 1980. Veterinary Endocrinology and Reproduction, 3rd ed. Philadelphia: Lea and Febriger.
Mege RA, Manalu W, Kusumorini N, Nasution SH. 2011. Konsentrasi hormon tiroid dan metabolit darah induk babi disuperovulasi sebelum perkawinan. Anim Prod 11(2) 88-95
Nabity MB, Ramaiah SK. 2010. Neutrophil structure and biochemistry. Di dalam: Weiss DJ, Wardrop K. J, editor. Schalm’s Veterinary Hematology Sixth Edition. Iowa: Blackwell Publishing Ltd. Hlm. 263-267
Noakes DE, Parkinson TJ, England GCW, editor. 2001. Arthur’s Veterinary Reproduction and Obstericks 8th ed. Philadelphia: W.B Saunders
Nugroho B, Malau DP, Rokhmanto F, Laili N. 2008. Pengaruh suhu ekstraksi terhadap kandungan kurkuminoid dan air serbuk temulawak (Curcuma xanthorrhiza). LIPI: Diklat Metode Penelitian dan Pengolahan Data.
Pohlman LM. 2010. Basophils, mast cells, and their disorders. Di dalam: Weiss DJ, Wardrop K. J, editor. Schalm’s Veterinary Hematology Sixth Edition. Iowa: Blackwell Publishing Ltd. Hlm. 290-297
Purseglove JW, Brown EG, dan Green CL. 1981. Spices. London: Longmans.
Rahardjo M. 2010. Penerapan SOP budi daya untuk mendukung temulawak sebagai bahan baku obat potensial. Prospektif 9(2): 78-93
Roy BN, Reid RL, Van Vugt DA. 1999. The effects of estrogen and progesterone on corticotropin-releasing hormone and arginine vasopressin messenger ribonucleic acid levels in the paraventricular nucleus and supraoptic nucleus of the rhesus monkey.Endoc Soc 140 (5): 2191-2198
Al-Saad KM, Al-Hadi HI, Abdul Majeed MO. 2010. Clinical, hematological, biochemical, and pathological studies on zinc deficiency (hyperzincemia) in sheep. Vet Res. 3(2): 14-20
Sukandar EY, Suganda AG, Ranti AS, Kristiana DW. 1997. Efek anthelmentika Zingiber zerumbet, Zingiber cassumunar, dan Curcuma xanthorrhiza terhadap cacing Ascaris suum. Majalah Farmasi Indonesia 8(1): 12-23
Sutama IK. 1990. Production and reproductive performance of javanese fat tail sheep. Production Aspects of Javanese Fat Tail Sheep in Indonesia.
Proceeding of the Workshop at the Indonesian Small Ruminant Network;
Surabaya, 10-11 Aug 1990. Surabaya: Indonesian Small Ruminant Network. Hlm: 69-78
Swenson MJ. 1984. Dukes Physiology of Domestic Animals 10th ed. Ithaca and London: Cornell University Press.
Theml H, Diem H, Haferlach T. 2004. Color atlas of hematology, PracticalMicroscopic and Clinical Diagnosis. Stuttgart: Thieme.
Tornquist SJ, Rigas J. 2010. Interpretation of ruminant leukocyte responses. Di dalam: Weiss DJ, Wardrop K.J, editor. Schalm’s Veterinary Hematology Sixth Edition. Iowa: Blackwell Publishing Ltd. Hlm. 307-313
Ullrey DE, Miller ER, Long CH, Vincent BH. 1965. Sheep hematology from birth to maturity II. Leukocyte concentration and differential distribution. J Anim Sci 24: 141-144.
Weiss DJ, Souza CD. 2010. Monocytes and macrophages and their disorders. Di dalam: Weiss Douglas J, Wardrop K. J, editor. Schalm’s Veterinary Hematology Sixth Edition. Iowa: Blackwell Publishing Ltd. Hlm. 298-306 Widowski TM, Curtis SE, Graves CN.1989. The neutrophil:lymphocyte ratio in
pig fed cortisol. Can J Anim Sci 69(2): 501-504
Williams HE, Provine HT. 1966. Effects of estradiol on glycogen synthetase in
the rat uterus. Endocrinology. 78(4): 786-790. http://endo. endojournals.org/content/78/4/786.short
Wiryawan KG, Suharti S, Bintang M. 2005. Kajian antibakteri temulawak, jahe dan bawang putih terhadap Salmonella typhimuriam serta pengaruh bawang putih terhadap performans dan respons imun ayam pedaging. Med. Pet. 28 (2): 52-62
Young KM, Meadows RL. 2010. Eosinophils and their disorders. Di dalam: Weiss Douglas J, Wardrop K.J, editor. Schalm’s Veterinary Hematology Sixth Edition. Iowa: Blackwell Publishing Ltd. Hlm. 281-289
Zahorec R. 2001. Ratio of neutrophil to lymphocyte counts-rapid and simple parameter of systemic inflammation and stress in critically ill. Bratisl Lek Listy 102 (1): 5–14
VII.
LAMPIRAN
Lampiran 1 Hasil analisis General Linear Model bulan ke-1
Between-Subjects Factors
N
Faktor1 0 8
1 8
Faktor2 2 8
3 8
Tests of Between-Subjects Effects
Source
Dependent Variable
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model Netrofil 191.250a 3 63.750 2.727 .091
Basofil .250b 3 .083 .667 .588
Eosinofil 24.500c 3 8.167 13.067 .000 Limfosit 161.687d 3 53.896 1.110 .383
Monosit 12.188e 3 4.062 .882 .478
NperL .093f 3 .031 .613 .620
Intercept Netrofil 22052.250 1 22052.250 943.412 .000
Basofil .250 1 .250 2.000 .183
Eosinofil 36.000 1 36.000 57.600 .000 Limfosit 24570.562 1 24570.562 505.958 .000
Monosit 297.562 1 297.562 64.629 .000
NperL 15.152 1 15.152 299.376 .000
Faktor1 Netrofil 169.000 1 169.000 7.230 .020
Basofil .000 1 .000 .000 1.000
Eosinofil 6.250 1 6.250 10.000 .008
Limfosit 45.562 1 45.562 .938 .352
Monosit 7.562 1 7.562 1.643 .224
NperL .033 1 .033 .658 .433
Faktor2 Netrofil 16.000 1 16.000 .684 .424
Basofil .000 1 .000 .000 1.000
Eosinofil 16.000 1 16.000 25.600 .000
Limfosit .562 1 .562 .012 .916
Monosit 1.562 1 1.562 .339 .571
NperL .033 1 .033 .658 .433
Basofil .250 1 .250 2.000 .183
Eosinofil 2.250 1 2.250 3.600 .082
Limfosit 115.562 1 115.562 2.380 .149
Monosit 3.062 1 3.062 .665 .431
NperL .026 1 .026 .522 .484
Error Netrofil 280.500 12 23.375
Basofil 1.500 12 .125
Eosinofil 7.500 12 .625
Limfosit 582.750 12 48.562
Monosit 55.250 12 4.604
NperL .607 12 .051
Total Netrofil 22524.000 16
Basofil 2.000 16
Eosinofil 68.000 16 Limfosit 25315.000 16
Monosit 365.000 16
NperL 15.852 16
Corrected Total Netrofil 471.750 15
Basofil 1.750 15
Eosinofil 32.000 15 Limfosit 744.437 15
Monosit 67.438 15
NperL .700 15
Grand Mean
Dependent
Variable Mean Std. Error
95% Confidence Interval
Lower Bound Upper Bound
Netrofil 37.125 1.209 34.491 39.759
Basofil .125 .088 -.068 .318
Eosinofil 1.500 .198 1.069 1.931 Limfosit 39.188 1.742 35.392 42.983
Monosit 4.312 .536 3.144 5.481
NperL .973 .056 .851 1.096
Lampiran 2 Hasil analisis General Linear Model bulan ke-2
Between-Subjects Factors
N
Faktor1 0 8
1 8
Faktor2 2 8
3 8
Tests of Between-Subjects Effects
Source
Dependent Variable
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model netrofil 309.500a 3 103.167 2.217 .139
basofil .187b 3 .062 1.000 .426
eosinofil 19.250c 3 6.417 4.162 .031
limfosit 42.188d 3 14.062 .168 .916
monosit 6.688e 3 2.229 .770 .533
NperL .052f 3 .017 .194 .899
Intercept netrofil 31684.000 1 31684.000 680.766 .000
basofil .062 1 .062 1.000 .337
eosinofil 30.250 1 30.250 19.622 .001 limfosit 29326.562 1 29326.562 349.733 .000
monosit 297.562 1 297.562 102.755 .000
NperL 18.598 1 18.598 206.875 .000
Faktor1 netrofil 289.000 1 289.000 6.209 .028
basofil .062 1 .062 1.000 .337
eosinofil 9.000 1 9.000 5.838 .033
limfosit 39.062 1 39.062 .466 .508
monosit 3.062 1 3.062 1.058 .324
NperL .025 1 .025 .276 .609
Faktor2 netrofil .250 1 .250 .005 .943
basofil .062 1 .062 1.000 .337
eosinofil 6.250 1 6.250 4.054 .067
limfosit 1.562 1 1.562 .019 .894
monosit .562 1 .562 .194 .667
NperL .001 1 .001 .012 .915
Faktor1 * Faktor2 netrofil 20.250 1 20.250 .435 .522
basofil .062 1 .062 1.000 .337
eosinofil 4.000 1 4.000 2.595 .133
monosit 3.062 1 3.062 1.058 .324
NperL .026 1 .026 .294 .598
Error netrofil 558.500 12 46.542
basofil .750 12 .062
eosinofil 18.500 12 1.542
limfosit 1006.250 12 83.854
monosit 34.750 12 2.896
NperL 1.079 12 .090
Total netrofil 32552.000 16
basofil 1.000 16
eosinofil 68.000 16
limfosit 30375.000 16 monosit 339.000 16
NperL 19.729 16
Corrected Total netrofil 868.000 15
basofil .937 15
eosinofil 37.750 15 limfosit 1048.438 15
monosit 41.438 15
NperL 1.131 15
Grand Mean
Dependent
Variable Mean Std. Error
95% Confidence Interval
Lower Bound Upper Bound
netrofil 44.500 1.706 40.784 48.216
basofil .062 .062 -.074 .199
eosinofil 1.375 .310 .699 2.051
limfosit 42.812 2.289 37.825 47.800
monosit 4.312 .425 3.386 5.239
NperL 1.078 .075 .915 1.241
Lampiran 3 Hasilanalisis General Linear Model bulan ke-3
Between-Subjects Factors
N
Faktor1 0 8
1 8
Faktor2 2 8
3 8
Tests of Between-Subjects Effects
Source
Dependent Variable
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model netrofil 687.500a 3 229.167 5.641 .012
basofil .000b 3 .000 . .
eosinofil 9.687c 3 3.229 3.298 .058
limfosit 62.500d 3 20.833 .465 .712
monosit 5.000e 3 1.667 .526 .673
NperL .464f 3 .155 1.826 .196
Intercept netrofil 34225.000 1 34225.000 842.462 .000
basofil .000 1 .000 . .
eosinofil 45.562 1 45.562 46.532 .000 limfosit 22500.000 1 22500.000 502.326 .000 monosit 441.000 1 441.000 139.263 .000
NperL 25.604 1 25.604 302.390 .000
Faktor1 netrofil 625.000 1 625.000 15.385 .002
basofil .000 1 .000 . .
eosinofil 3.062 1 3.062 3.128 .102
limfosit 6.250 1 6.250 .140 .715
monosit 4.000 1 4.000 1.263 .283
NperL .354 1 .354 4.181 .063
Faktor2 netrofil 56.250 1 56.250 1.385 .262
basofil .000 1 .000 . .
eosinofil 5.062 1 5.062 5.170 .042
limfosit .000 1 .000 .000 1.000
monosit 1.000 1 1.000 .316 .584
NperL .017 1 .017 .200 .663
Faktor1 * Faktor2 netrofil 6.250 1 6.250 .154 .702
basofil .000 1 .000 . .
eosinofil 1.562 1 1.562 1.596 .230
limfosit 56.250 1 56.250 1.256 .284
monosit .000 1 .000 .000 1.000
Error netrofil 487.500 12 40.625
basofil .000 12 .000
eosinofil 11.750 12 .979
limfosit 537.500 12 44.792
monosit 38.000 12 3.167
NperL 1.016 12 .085
Total netrofil 35400.000 16
basofil .000 16
eosinofil 67.000 16 limfosit 23100.000 16 monosit 484.000 16
NperL 27.084 16
Corrected Total netrofil 1175.000 15
basofil .000 15
eosinofil 21.437 15 limfosit 600.000 15
monosit 43.000 15
NperL 1.480 15
Grand Mean
Dependent
Variable Mean Std. Error
95% Confidence Interval
Lower Bound Upper Bound
netrofil 46.250 1.593 42.778 49.722
basofil .000 .000 .000 .000
eosinofil 1.688 .247 1.149 2.226 limfosit 37.500 1.673 33.854 41.146
monosit 5.250 .445 4.281 6.219
NperL 1.265 .073 1.107 1.423
Lampiran 4 Hasil analisis General Linear Model bulan ke-4
Between-Subjects Factors
N
Faktor1 0 8
1 8
Faktor2 2 8
3 8
Tests of Between-Subjects Effects
Source
Dependent Variable
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model netrofil 267.187a 3 89.062 2.898 .079
basofil .000b 3 .000 . .
eosinofil 14.250c 3 4.750 10.364 .001 limfosit 337.500d 3 112.500 3.484 .050
monosit 6.500e 3 2.167 .344 .794
NperL .541f 3 .180 3.751 .041
Intercept netrofil 34689.062 1 34689.062 1.129E3 .000
basofil .000 1 .000 . .
eosinofil 90.250 1 90.250 196.909 .000 limfosit 30625.000 1 30625.000 948.387 .000 monosit 400.000 1 400.000 63.576 .000
NperL 19.338 1 19.338 402.334 .000
Faktor1 netrofil 189.062 1 189.062 6.153 .029
basofil .000 1 .000 . .
eosinofil 4.000 1 4.000 8.727 .012
limfosit 25.000 1 25.000 .774 .396
monosit 4.000 1 4.000 .636 .441
NperL .219 1 .219 4.547 .054
Faktor2 netrofil 39.062 1 39.062 1.271 .282
basofil .000 1 .000 . .
eosinofil 6.250 1 6.250 13.636 .003
limfosit 306.250 1 306.250 9.484 .010
monosit 2.250 1 2.250 .358 .561
NperL .294 1 .294 6.123 .029
Faktor1 * Faktor2