STUDI INDUKSI DAN PENDEWASAAN EMBRIO
SOMATIK JARAK PAGAR (
Jatropha curcas
L.)
DENGAN BERBAGAI JENIS EKSPLAN DAN ZAT
PENGATUR TUMBUH
ERWIN AL HAFIIZH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul “Studi Induksi dan Pendewasaan Embrio Somatik Jarak Pagar (Jatropha Curcas L.) dengan Berbagai Jenis Eksplan dan Zat Pengatur Tumbuh” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun ke perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini
. Bogor, Agustus 2012
ABSTRACT
ERWIN AL HAFIIZH. Study on induction and maturation of somatic embryos
of Jatropha Curcas L. initiated from different types of explants and plant growth regulators. Supervised by DARDA EFENDI and TRI MUJI ERMAYANTI.
Jatropha curcas L. is a potential plant for biodiesel. This plant produces seeds containing oil from 33 to 60%. However, up to now, there are lack of high-quality of clones and limited research in the plant breeding. Therefore, an alternative method is needed including the application of biotechnology. Propagation of plants through somatic embryogenesis is not only helps to obtain a large number of plants throughout the year, but also it can be used as a good tool for genetic improvement of crops through genetic engineering. This study was aimed to induce somatic embryogenesis using different type of explants and several concentrations of plant growth regulators, as well as to study the development of the somatic embryos. Hypocotil and leaf used as explants were obtained from 1week-old seedling germinated on MS medium. Young embryos and embryo axis from immature and mature fruits were also used as explants for the induction of somatic embryos. After surface sterilization, explants were cultured on solid MS medium containing 3% of sucrose, 0; 0.5; 1; 1.5; 2; 2.5; 3; 4 or 5 mgL-1 of Picloram or 0; 0.5; 1; 1.5; 2 or 2.5 mg L-1 of 2,4-D. Cultures were incubated in the dark, at a temperature of 26±2°C, for 8 weeks. The results showed that embryo axis explants from mature fruit produced somatic embryos in globular, heart, torpedo and cotyledonary stages 6 weeks after culture (WAC) in the medium containing 2.5 mg/l of Picloram, whereas in medium containing 3, 4, or and 5 mg/l of Picloram, the somatic embryos were found after more than 7 WAC. Somatic embryos formed either directly or indirectly. Proliferation and maturation can be performed in solid or liquid MS medium without growth regulators and in liquid MS with the addition of 2.5 mg L-1 of Picloram with 3% of sucrose and B5 vitamin.
RINGKASAN
ERWIN AL HAFIIZH. Studi Induksi dan Pendewasaan Embrio Somatik Jarak
Pagar (Jatropha curcas L.) dengan Berbagai Jenis Eksplan dan Zat Pengatur Tumbuh. Dibimbing oleh DARDA EFENDI dan TRI MUJI ERMAYANTI.
Jatropha curcas L. merupakan salah satu tanaman non pangan yang memiliki potensi untuk dikembangkan sebagai biodisel. Tanaman ini dapat menghasilkan biji dengan kandungan minyak mencapai 33-60%. Kendala yang dihadapi adalah kurangnya klon-klon bermutu tinggi dan pemuliaan tanaman yang belum maksimal, sehingga mempengaruhi produktivitas. Oleh karena itu diperlukan metode alternatif dengan penerapan bioteknologi untuk peningkatan produksi. Propagasi tanaman melalui embriogenesis somatik tidak hanya membantu untuk mendapatkan jumlah tanaman besar sepanjang tahun, tetapi juga dapat digunakan sebagai metode yang baik untuk perbaikan genetik tanaman melalui rekayasa genetika. Pada penelitian ini dilakukan dua kegiatan yaitu (1) induksi embrio somatik dari berbagai jenis eksplan J. curcas komposit IP3-P dan genotipe Dompu dan (2) proliferasi dan pendewasaan kalus embriogenik. Penelitian dilakukan pada bulan November 2010 – Januari 2012 di Laboratorium Kultur Jaringan, Institut Pertanian Bogor dan Pusat Penelitian Bioteknologi-LIPI. Penelitian ini bertujuan untuk mendapatkan informasi yang tepat mengenai jenis eksplan dan konsentrasi zat pengatur tumbuh auksin yaitu Picloram dan 2.4-D dalam media induksi yang didukung dengan kajian mengenai struktur dan perkembangan embrio somatik secara morfologi dan anatomi.
Induksi embrio somatik dapat diinisiasi dari berbagai jenis eksplan J. curcas komposit IP-3P dan aksesi Dompu. Eksplan hipokotil dan daun ditanam dari kecambah berumur 1 minggu setelah tanam pada media MS, sedangkan eksplan kotiledon, embrio muda, aksis embrio muda dan aksis embrio tua, serta aksis embrio buah masak langsung ditanam setelah disterilisasi pada media MS padat yang ditambahkan zat pengatur tumbuh picloram 0; 0.5; 1.0; 1.5; 2.0; 2.5; 3.0; 4.0 dan 5.0 mg/L dan 2.4-D 0; 0.5; 1.0; 1.5; 2.0 dan 2.5 mg/L, dengan sukrosa 30% dan vitamin Gamborg B5. Kultur diinkubasi di tempat gelap, pada suhu
26±2°C, selama 8 minggu.
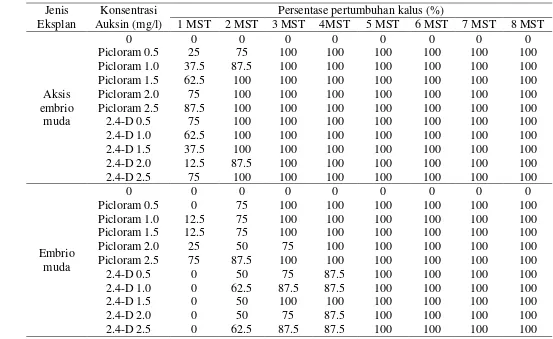
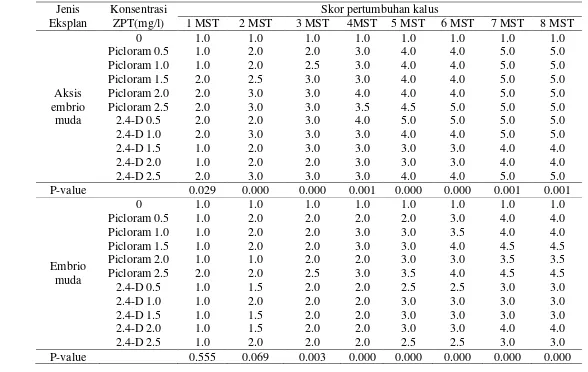
Eksplan dari J. curcas komposit IP3-P (hipokotil, daun, kotiledon dan aksis embrio tua) dan eksplan dari J. curcas aksesi Dompu (embrio muda dan aksis embrio muda) yang diinduksi pada media MS yang mengandung picloram atau 2.4-D tidak dapat membentuk kalus embriogenik maupun embrio somatik. Kalus yang terbentuk merupakan kalus meremah dan kompak. Pertumbuhan kalus tertinggi ditunjukkan pada eksplan hipokotil yang dapat mencapai skor 5 pada media yang mengandung picloram 1.0 dan 2.0 mgL-1, 7 minggu setelah tanam (MST), sedangkan pertumbuhan kalus terendah ditunjukkan pada eksplan embrio muda pada media yang mengandung 2.4-D 1 mg/L-1 dengan skor 3.0.
globular dan torpedo menjadi kotiledon terbentuk pada 8 MST. Pada media yang mengandung 0.5; 1.0; 1.5; 2.0 mg/L-1 picloram dan 0.5; 1.0; 1.5; 2.0; 2.5 mg/L-1 2.4-D tidak membentuk kalus embriogenik dan embrio somatik.
Pada penelitian yang menggunakan eksplan aksis embrio buah masak dengan konsentrasi picloram yang ditingkatkan menghasilkan kalus embriogenik dan embrio somatik di media yang mengandung 2.5 mg/L-1 picloram pada 6 MST, sedangkan pada media dengan 3.0; 4.0; dan 5.0 mg/ L-1. Picloram embrio somatik terbentuk 7 MST. Embrio somatik terbentuk secara langsung pada media dengan 3.0; 5.0 mg/L-1 picloram dan tidak langsung pada media 2.5; 4.0; dan 5.0 mg/ L-1 picloram.
Kalus embriogenik dan embrio somatik pada media MS padat dan cair tanpa zat pengatur tumbuh, serta media MS cair dengan penambahan 2.5 mg/L-1 picloram mengalami proliferasi dan pendewasaan dengan peningkatan jumlah embrio somatik dan perkembangan embrio somatik dari fase globular ke fase jantung, torpedo dan kotiledon. Pada media cair embrio somatik sampai membentuk tahap kotiledon, sedangkan pada media padat sampai berkecambah.
© Hak Cipta Milik IPB, tahun 2012 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
STUDI INDUKSI DAN PENDEWASAAN EMBRIO
SOMATIK JARAK PAGAR (
Jatropha curcas
L.)
DENGAN BERBAGAI JENIS EKSPLAN DAN ZAT
PENGATUR TUMBUH
ERWIN AL HAFIIZH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Mayor Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Studi Induksi dan Pendewasaan Embrio Somatik Jarak Pagar (Jatropha curcas L.) dengan Berbagai Jenis Eksplan dan Zat Pengatur Tumbuh
Nama : Erwin Al Hafiizh
NIM : A253090121
Disetujui,
Komisi Pembimbing
Dr. Ir. Darda Efendi, M.Si
Ketua Anggota
Dr. Tri Muji Ermayanti
Mengetahui,
Ketua Mayor Dekan Sekolah Pascasarjana Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Trikoesoemaningtyas, MSc. Dr. Ir. Dahrul Syah, MSc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Alloh SWT atas segala
rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan tesis ini yang
merupakan syarat untuk mendapat gelar Magister di Institut Pertanian Bogor
(IPB), dengan judul “Studi Induksi dan Pendewasaan Embrio Somatik Jarak Pagar
(Jatropha curcas L.) dengan Berbagai Jenis Eksplan dan Zat Pengatur Tumbuh”.
Dengan terselesaikannya penulisan tesis ini, saya ucapkan terima kasih yang
sebesar-besarnya kepada :
1. Dr. Ir. Darda Efendi, MSi dan Dr. Tri Muji Ermayanti selaku komisi
pembimbing atas bimbingan dan arahannya selama perencanaan, pelaksanaan,
dan penulisan tesis ini.
2. Dr. Ir. Trikoesoemaningtyas, MSc selaku Ketua Mayor Pemuliaan dan
Bioteknologi Tanaman dan seluruh dosen dan karyawan atas bimbingan dan
bantuannya yang tidak ternilai kepada penulis.
3. Dr. Dewi Sukma selaku penguji luar komisi yang telah memberikan masukan
dalam perbaikan tesis ini.
4. Dr. Dini Dinarty selaku kepala Laboratorium Kultur Jaringan 3, Institut
Pertanian Bogor dan seluruh karyawan atas bantuan dan kerjasamanya dalam
penelitian.
5. Bapak dan Ibu tercinta atas doa dan restunya yang senantiasa menyertai
penulis agar selalu diberikan kemudahan dan kebaikan.
6. Istri dan anak tercinta atas doa dan motivasi selama saya menempuh
pendidikan.
7. Teman-teman S2 PBT angkatan 2009 (Nur arifin, Deni Dwiguna, Asep
Rodiansah, Yogo Nugroho, Purbo Kurniawan, Consti, Jose Maria, Juwartina
Ida Royani, Rahmah, Karlina Sahruddin, Ernila, Vina Novita, Fitri dan
Winda) atas kebersamaan dan kekompakan selama ini.
8. Keluarga besar Puslit Bioteknologi-LIPI: Dr. Ir. Witjaksono M.Sc selaku
kepala Puslit Bioteknologi-LIPI Cibinong, Dr.
Kepala Bidang Biologi Sel dan Jaringan beserta staf dan rekan-rekan di
Dyah Retno Wulandari, MSi, Andri Fadilah Martin, MSi, Betalini MSi,
Rudiyanto, SP, Evan Maulana, A.Md, Lutvinda Ismanjani)
9. Teman-teman seperjuangan dan semua pihak atas bantuan dan motivasinya
selama pelaksanakan penelitian dan penyusunan tulisan.
Penulis menyadari bahwa tulisan ini masih jauh dari sempurna, namun
penulis berharap tulisan ini bermanfaat bagi dunia ilmu pengetahuan.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 19 Oktober 1975 sebagai anak
kedua dari pasangan Hasan Bisri dan Alm. Djuhariah. Pendidikan Sekolah Dasar
ditempuh di SDN 03 Jakarta Timur tahun 1988, SMPN 222 Jakarta Timur tahun
1991 dan SMAN 67 Jakarta Timur tahun 1994. Pada tahun 1999 penulis
menyelesaikan pendidikannya di Fakultas Teknologi Pertanian, Institut Teknologi
Indonesia, Jurusan Teknologi Industri Pertanian, Program Studi Bioteknologi.
Semenjak tahun 2007 diterima bekerja di Pusat Penelitian Bioteknologi - LIPI
Cibinong hingga sekarang. Tahun akademik 2009/2010 penulis tercatat sebagai
mahasiswa pada Sekolah Pasca Sarjana, Institut Pertanian Bogor, Program Studi
i
Halaman
DAFTAR TABEL ………. v
DAFTAR GAMBAR ……… vii
DAFTAR LAMPIRAN ……… ix
PENDAHULUAN ……… 1
A.Latar Belakang ………... 1
B.Tujuan Penelitian ……….. 4
C.Hipotesis ……… 4
D.Manfaat Penelitian ……… 5
E. Ruang Lingkup Penelitian ………. 5
TINJAUAN PUSTAKA ……….. 9
A.Tanaman Jarak Pagar (Jatropha curcas L.) ……….. 9
B. Kultur Jaringan ……….. 12
C.Zat Pengatur Tumbuh ……… 14
D.Embriogenesis Somatik ………. 16
BAHAN DAN METODE ………. 21
A.Tempat dan Waktu ……….………… 21
B. Bahan dan Alat ………. 21
C.Metode Percobaan ………. 21
1. Induksi Embrio Somatik ………. 21
a). Induksi embrio somatik dari berbagai eksplan J. curcas komposit IP-3P ……… 21
Sterilisasi dan inisiasi kecambah ………. 21
ii
Sterilisasi ……….. 23
Induksi embrio somatik ………... 23
c). Induksi embrio somatik dari aksis embrio buah masak J. curcas aksesi Dompu dengan picloram dan 2.4-D ………. 25
d). Induksi embrio somatik dari aksis embrio buah masak J. curcas aksesi Dompu dengan picloram ……….…….. 26
2. Proliferasi dan Pendewasaan Kalus Embriogenik .………... 28
a). Proliferasi dan pendewasaan kalus embriogenik pada media padat ………. 28
b). Proliferasi dan pendewasaan kalus embriogenik pada media cair ……… 28
D.Analisis Statistik ………... 28
HASIL DAN PEMBAHASAN ……… 31
1. Induksi Embrio Somatik ………. 31
a). Induksi embrio somatik dari berbagai eksplan J. curcas komposit IP-3P ……… 31
b). Induksi embrio somatik dari aksis embrio muda dan embrio muda J. curcas aksesi Dompu ……….. 37
c). Induksi embrio somatik dari aksis embrio buah masak hijau J. curcas aksesi Dompu dengan picloram dan 2.4-D …….…. 43
d). Induksi embrio somatik dari aksis embrio buah masak hijau J. curcas aksesi Dompu dengan picloram ………... 47
2. Proliferasi dan Pendewasaan Kalus Embriogenik ……… 52
a). Proliferasi dan pendewasaan kalus embriogenik pada media padat ………. 52
b). Proliferasi dan pendewasaan kalus embriogenik pada media cair………... 55
iii
Simpulan ……… 69
Saran ……….. 69
DAFTAR PUSTAKA ……….. 71
v
Halaman
1. Penelitian J. curcas dengan teknik kultur jaringan dengan berbagai metode regenerasi dan jenis eksplan ………..…….
14
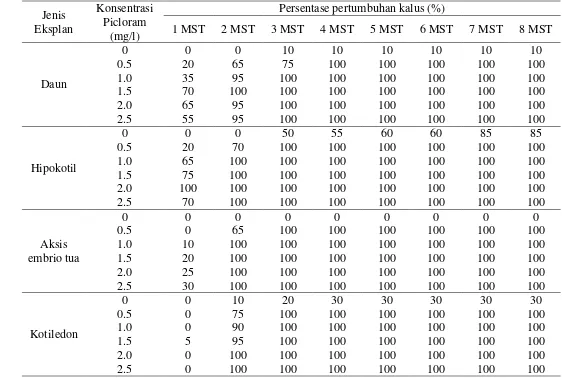
2. Pengaruh picloram terhadap persentase pertumbuhan kalus dari berbagai eksplan J. curcas komposit IP3-P …………...………
32
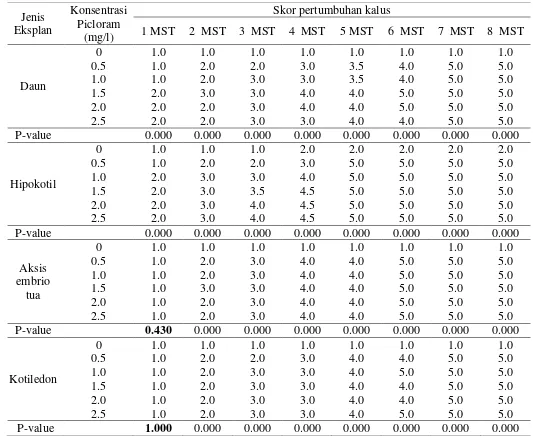
3. Pengaruh picloram terhadap skor pertumbuhan kalus dari berbagai eksplan J. curcas komposit IP3-P .………..
34
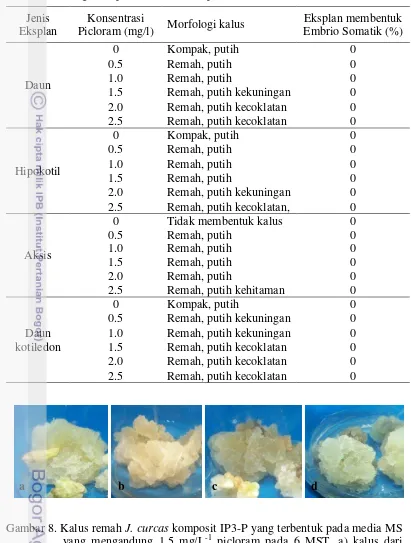
4. Pengaruh picloram terhadap morfologi kalus yang terbentuk dari berbagai eksplan J. curcas komposit IP3-P………
36
5. Pengaruh auksin terhadap presentase pertumbuhan kalus dari eksplan aksis muda dan embrio muda J. curcas aksesi Dompu …...…
39
6. Pengaruh auksin terhadap skor pertumbuhan kalus dari eksplan aksis muda dan embrio muda J. curcas aksesi Dompu ………
41
7. Pengaruh picloram terhadap morfologi kalus yang terbentuk dari eksplan aksis embrio muda dan embrio muda J. curcas aksesi Dompu ………
42
8. Pengaruh ZPT terhadap persentase pertumbuhan kalus dari eksplan aksis buah masak hijau J. curcas aksesi Dompu ………
43
9. Pengaruh ZPT terhadap skor pertumbuhan kalus dari eksplan aksis buah masak hijau J. curcas aksesi Dompu ………. 44
10. Pengaruh ZPT terhadap morfologi kalus dan jumlah embrio somatik yang terbentuk dari eksplan aksis embrio buah masak hijau J. curcas
aksesi Dompu ……….. 45
11. Pengaruh picloram terhadap skor pertumbuhan kalus, persentase eksplan membentuk embrio somatik dan waktu pembentukan embrio
somatik pada 8 MST ………... 50
12. Pengaruh picloram terhadap tipe embriogenesis dan tahap embrio somatik yang terbentuk dari eksplan aksis buah masak hijau J. curcas
aksesi Dompu pada 8 MTS ………. 51
13. Pengaruh media MS tanpa zat pengatur tumbuh terhadap pembentukan embrio somatik pada 2 minggu setelah subkultur ………...
vii
Halaman
1. Diagram alir kegiatan penelitian ………... 7
2. Keragaan tanaman dan buah jarak pagar (Jatropha curcas L.) komposit
IP3-P .……….. 9
3. Eksplan J.curcas komposit IP3-P a) eksplan daun, b) eksplan hipokotil, c) eksplan aksis embrio dan d) eksplan kotiledon ………
22
4. Eksplan a) aksis embrio muda dan b) embrio muda ………
23
5. Skor perkembangan kalus dari eksplan daun……….. 24
6. Sumber eksplan a) buah jarak masak hijau dan b) aksis buah masak
hijau (tanda panah) ……….………. 25
7. Pertumbuhanan kalus dari eksplan daun J. curcas komposit IP3-P …. 35
8 Kalus remah J. curcas komposit IP3-P yang terbentuk pada media MS yang mengandung 1.5 mgL-1 picloram pada 6 MST. ….……… 36 9. Embrio somatik J. curcas aksesi Dompu yang terbentuk pada 8 MST
dari eksplan aksis embrio buah masak ……….…… 46
10. Pembentukan embrio somatik J. curcas aksesi Dompu secara langsung dan tidak langsung ………..……….
48
11. Tahapan perkembangan embrio somatik J. curcas aksesi Dompu … 54
12. Proliferasi dan pendewasaan embrio somatik J. curcas aksesi Dompu
pada media cair 4 MST…..………... 56
13. Embrio somatik J. curcas aksesi Dompu pada berbagai tahap pertumbuhan yang berbeda pada media MS cair + 2.5 mgL-1 picloram . 57 14. Irisan membujur dari berbagai fase perkembagan embrio somatik yang
berasal dari eksplan aksis embrio buah masak aksesi Dompu pada media pendewasaan MS tanpa zat pengatur tumbuh ………….…….. 58
15. Skema diagram alir sistem embriogenesis J. curcas yang dihasilkan
ix
Halaman
1. Komposisi Media Murashige and Skoog dan Media Gamborg ……….. 77
PENDAHULUAN
A. Latar Belakang
Kebutuhan energi dunia saat ini sebagian besar dipenuhi dari bahan bakar
fosil yang tidak terbarukan yaitu minyak bumi dan batubara. Kebutuhan energi ini
akan terus meningkat hingga tahun-tahun mendatang seiring dengan peningkatan
populasi penduduk dan pertumbuhan ekonomi dunia. Menurut laporan
International Atomic Energy Agency (IAEA), bahwa pada tahun 2025 kebutuhan
energi akan meningkat hingga 50% dari total kebutuhan energi pada tahun 2007.
Kebutuhan tersebut diperkirakan akan terus meningkat, sedangkan cadangan
energi ini semakin menipis, sehingga habisnya energi tinggal menunggu waktu
(Lemhanas 2007).
Untuk mengurangi ketergantungan terhadap bahan bakar minyak,
pemerintah berperan aktif menanggulangi masalah tersebut. Kebijakan pemerintah
dalam pengembangan biofuel dengan membentuk tim nasional pengembangan
bahan bakar nabati (BBN) sebagai upaya untuk mendukung pengembangan bahan
bakar nabati dengan menerbitkan blue print dan road map untuk mewujudkan
pengembangan BBN tersebut. Selain itu, pemerintah telah menerbitkan Peraturan
Presiden Republik Indonesia nomor 5 tahun 2006 tentang kebijakan energi
nasional untuk mengembangkan sumber energi alternatif sebagai pengganti bahan
bakar minyak. Kebijakan tersebut menekankan pada sumber daya yang dapat
diperbarui sebagai alternatif pengganti bahan bakar minyak. Ditambah dengan
penerbitan Instruksi Presiden No 1 tahun 2006 tertanggal 25 Januari 2006 tentang
penyediaan dan pemanfaatan bahan bakar nabati (biofuels), sebagai energi
alternatif. Sumber energi alternatif itu diantaranya jarak pagar dan kelapa sawit
untuk biodisel, serta sagu, sorgum, jagung, ubi kayu dan ubi jalar untuk bioetanol.
Jarak pagar (Jatropha curcas L.), merupakan tanaman asli daerah tropis
Amerika yang termasuk ke dalam famili Euphorbiaceae (Heller 1996). Di
Indonesia jarak pagar dapat ditemukan di hampir seluruh wilayah. Tanaman ini
dilaporkan dapat menghasilkan biji dengan kandungan minyak berkualitas tinggi
yang dapat dimanfaatkan sebagai biodisel (Heller 1996). Biodisel Jatropha
meningkatkan kualitas pembakaran, bersih, ramah lingkungan dan biaya produksi
yang rendah.
Meskipun pengembangan tanaman jarak pagar hingga saat ini kurang
maksimal sebagai sumber energi alternatif, tidak berarti upaya untuk
mengeksplorasi, mempelajari dan mengembangkan tanaman ini tidak perlu
dilakukan. Mengingat manfaatnya yang cukup besar, maka berbagai kegiatan
penelitian telah dilakukan. Hal yang menjadi perhatian saat ini adalah potensi
produksi tanaman. Untuk dapat dikembangkan dan memberikan nilai ekonomi
tinggi, diperlukan jarak pagar yang memiliki potensi produksi tinggi.
Sejumlah upaya pemuliaan tanaman jarak pagar telah mulai dilakukan
sejak tahun 2006 melalui penelitian ex vitro maupun in vitro, baik oleh instansi
pemerintah maupun swasta. Permasalahan penanaman J. curcas di Indonesia
adalah kurangnya klon-klon yang bermutu tinggi. Adanya variasi yang sangat
besar pada benih, menyebabkan kapasitas dan konsentrasi minyak berbeda.
Ketidakseragaman matangnya buah menambah biaya produksi dan tidak tahannya
terhadap penyakit serta serangga hama yang dapat mempengaruhi produktivitas.
Permasalahan lainnya adalah viabilitas benih rendah, perkecambahan rendah,
perakaran yang sedikit dan stek vegetatif yang lambat (Heller 1996 dan Openshaw
2000). Tanaman yang diperbanyak dengan stek mempunyai umur lebih pendek,
kurang toleran terhadap kekeringan dan kurang resisten terhadap penyakit (Heller
1996).
Mengingat manfaatnya yang besar, sejumlah bahan tanaman berkualitas
diperlukan untuk penggunaannya di masa depan. Dengan demikian, peningkatan
produksi melalui penerapan bioteknologi tanaman dapat dirasakan.
Mikropropagasi J. curcas telah banyak diteliti dengan menggunakan berbagai
jaringan yang berbeda dari tanaman yang tumbuh di lapang, tetapi pada semua
kasus, jumlah pertumbuhannya rendah sehingga aplikasinya kurang, maka
diperlukan teknologi baru dalam teknik kultur jaringan yang berguna untuk
mendapatkan bibit yang lebih banyak dan seragam, yaitu digunakan regenerasi
tanaman melalui embriogenesis somatik (Jha et al. 2007).
Propagasi tanaman melalui embriogenesis somatik tidak hanya membantu
digunakan sebagai strategi yang baik untuk perbaikan genetik tanaman melalui
rekayasa genetika, penyimpanan jangka pendek maupun jangka panjang
(Bhansali, 1990). Beberapa penelitian tanaman J. curcas dengan metode
embriogenesis (Sardana et al. 2000; Jha et al. 2007; Kalimuthu et al. 2007) telah
dilakukan dengan menggunakan eksplan daun dan berbagai zat pengatur tumbuh,
namun kemampuan membentuk sel embriogenik dan planlet masih rendah.
Keberhasilan embriogenesis melalui kultur in vitro dipengaruhi beberapa
faktor diantaranya: genotipe eksplan, jenis eksplan yang digunakan, kondisi
fisiologis tanaman donor (Jimenes & Viktor 2001), jenis dan kondisi fisik
medium, lingkungan dan zat pengatur tumbuh (Zhang et al. 2000). Untuk induksi
kalus embriogenik, kultur umumnya ditumbuhkan pada media yang mengandung
auksin yang mempunyai aktivitas kuat atau dengan konsentrasi tinggi.
Zat pengatur tumbuh merupakan salah satu faktor yang menentukan
keberhasilan embriogenesis somatik, diantaranya auksin dan sitokinin (Chen &
Chang 2001). Berbagai hasil penelitian menunjukkan bahwa 2.4-D merupakan
auksin yang efektif untuk induksi kalus embriogenik (Bhojwani & Razdan, 1996)
dan picloram dapat digunakan untuk induksi embriogenesis Pisum sativum L dan
Soybean dari embrio dan tunas apikal (Kysely et al. 1987; Kysely dan Jacobsen,
1990). Oleh karena itu zat pengatur tumbuh auksin (2.4-D dan picloram) dan
sitokinin (kinetin) diperkirakan dapat juga dipergunakan untuk embriogenesis
jarak pagar dari berbagai jaringan tertentu.
Penggunaan eksplan yang bersifat merismatik umumnya memberikan
keberhasilan yang lebih tinggi dalam pembentukan embrio somatik. Eksplan yang
digunakan dapat berupa daun, hipokotil, kotiledon, embrio zigotik muda, aksis
embrio muda dan dewasa. Keberhasilan induksi embrio somatik dari berbagai
jenis eksplan telah dilaporkan pada banyak spesies tanaman, seperti jarak pagar
dengan menggunakan eksplan daun (Jha et al. 2007), aksis embrio dan kotiledon
(Nindita 2010), kentang dengan eksplan daun (Oggema et al. 2007), kacang tanah
dengan eksplan aksis embrio dan daun (Pacheco et al. 2007), sorgum dengan
eksplan embrio zigotik muda (Grootboom et al. 2008), jeruk dengan eksplan
daun, batang, kotiledon, dan embrio zigotik dewasa (Kiong et al. 2008), kopi
Embrigenesis somatik merupakan pilihan perbanyakan vegetatif secara in
vitro. Selama ini penelitian embriogenesis J. curcas sudah dilakukan dengan
berbagai macam metode regenerasi, tetapi keberhasilannya relatif rendah dan
masih mengalami kesulitan dalam meregenerasikan menjadi planlet. Nidita
(2010) melaporkan bahwa keberhasilan embriogenesis somatik J. curcas
komposit IP3-P dari eksplan aksis embrio dan kotiledon pada media MS yang
mengandung 1 mgL-1 picloram masih relatif rendah dan mengalami kesulitan dalam proliferasi dan pendewasaannya menjadi planlet. Keberhasilan
embriogenesis somatik ditentukan oleh pemilihan jaringan yang tepat sebagai
sumber eksplan, selain juga ditentukan oleh beberapa faktor, diantaranya genotipe
dan jenis eksplan, serta komposisi zat pengatur tumbuh dalam media. Oleh sebab
itu, perlu dilakukan penelitian tentang metode regenerasi embriogenesis somatik
yang tepat, efisien dan praktis, seperti penggunaan berbagai genotipe dan jenis
eksplan J. curcas, dan zat pengatur tumbuh.
B. Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan sebagai berikut:
1. Mempelajari pengaruh taraf konsentrasi zat pengatur tumbuh picloram dan
2,4-D pada media MS dengan jenis eksplan hipokotil, daun, kotiledon, aksis
embrio tua, embrio muda, aksis embrio muda, dan aksis embrio buah masak
terhadap pembentukan kalus embriogenik dan embrio somatik secara in vitro.
2. Mempelajari pengaruh media MS padat dan cair dengan penambahan zat
pengatur tumbuh picloram terhadap proliferasi dan pendewasaan embrio
somatik.
C. Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Pembentukan kalus embriogenik dan embrio somatik J. curcas dapat diinduksi
dengan zat pengatur tumbuh picloram dan 2.4-D pada konsentrasi tertentu
2. Pembentukan kalus embriogenik dan embrio somatik dapat diinduksi dari
jaringan hipokotil, daun, kotiledon, aksis embrio masak, embrio muda, aksis
embrio muda dan aksis embrio buah masak hijau J. curcas.
3. Pendewasaan dan perkecambahan embrio somatik dapat diinduksi dengan
media MS padat dan cair dengan zat pengatur tumbuh picloram pada
konsentrasi tertentu.
D. Manfaat Penelitian
Manfaat dari penelitian ini adalah:
1. Diperoleh informasi jenis eksplan yang terbaik dalam induksi embrio
somatik J. curcas komposit IP3-P dan aksesi Dompu.
2. Diperoleh informasi konsentrasi zat pengatur tumbuh yang terbaik dalam
induksi embrio somatik J. curcas komposit IP3-P dan aksesi Dompu.
3. Diperoleh informasi media terbaik dalam induksi embrio somatik J. curcas
komposit IP3-P dan aksesi Dompu.
E. Ruang Lingkup Penelitian
Pada penelitian ini dilakukan 2 kelompok percobaan, dengan total 6 percobaan
yaitu:
1. Induksi embrio somatik
a). Induksi embrio somatik dilakukan dari J. curcas komposit IP3-P pada
media MS dengan penambahan picloram (0; 0.5; 1.0; 1.5; 2.0 dan 2.5
mgL-1. Eksplan yang digunakan adalah hipokotil dan daun yang berasal dari kecambah berumur 1 minggu setelah tanam pada media MS; eksplan
kotiledon dan aksis embrio tua.
b). Induksi embrio somatik dari eksplan embrio muda dengan ukuran 0.7-1.0
cm dan aksis embrio muda J. curcas aksesi Dompu, dengan penambahan
picloram (0; 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL-1) dan 2,4-D (0; 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL-1).
c). Induksi embrio somatik dari eksplan aksis embrio buah masak hijau J.
curcas aksesi Dompu, dengan penambahan picloram (0; 0.5; 1.0; 1.5; 2.0
d). Induksi embrio somatik dari eksplan aksis embrio buah masak hijau J.
curcas aksesi Dompu. Percobaan ini dirancang untuk optimasi konsentrasi
auksin berdasarkan hasil Percobaan 1c.
2. Proliferasi dan pendewasaan kalus embriogenik. Kalus embriogenik dan
embrio somatik disubkultur ke media MS padat dengan 2.5 mgL-1 picloram, kemudian pada 2 MST disubkultur ke media MS cair dengan penambahan 0
atau 2.5 mgL-1 picloram.
Gambar 1. Diagram alir kegiatan penelitian Planlet
A. J. curcas komposit IP3-P
- Eksplan : Daun, hipokotil, kotiledon dan aksis embrio tua. - ZPT: picloram 0; 0.5; 1.0; 1,5; 2.0 & 2.5 mgL-1.
Embrio Somatik
II. Proliferasi dan Pendewasaan Embrio Somatik
- Eksplan: embrio somatik
- ZPT: picloram 0 dan 2.5 mgL-1
Tanaman J. curcas
I. Induksi embrio somatik
C. J. curcas aksesi Dompu
- Eksplan : Aksis embrio buah masak hijau
- ZPT: picloram ; 2.4-D @ 0; 0.5; 1.0; 1.5; 2.0 & 2.5 mgL-1)
D. J. curcas aksesi Dompu
- Eksplan : Aksis embrio buah masak hijau - ZPT: picloram 2.5; 3.0, 4.0 & 5.0 mgL-1
B. J. curcas aksesi Dompu
- Eksplan : Embrio muda dan aksis embrio muda.
- ZPT: picloram ; 2.4-D @ 0; 0.5; 1.0; 1.5; 2.0 & 2.5 mgL-1
MS padat
ZPT: picloram 0 dan 2.5 mgL-1
MS cair
TINJAUAN PUSTAKA
A. Tanaman Jarak Pagar (Jatropha curcas L.)
Jarak pagar (Jatropha curcas L.), merupakan tumbuhan perdu dan banyak
tumbuh di daerah tropis serta banyak ditanam sebagai tanaman pagar pekarangan.
Tanaman ini sudah tidak asing lagi bagi masyarakat Indonesia, karena
penyebarannya yang luas. Hal ini terbukti dari aneka ragam nama daerahnya.
Menurut Kusuma (2009), tanaman jarak pagar memiliki beberapa nama daerah
antara lain jarak budeg, jarak gundul, arak cina (Jawa); baklawah, nawaih (NAD);
dulang (Batak); jarak kosta (Sunda); jarak kare (Timor); peleng kaliki (Bugis);
kalekhe paghar (Madura); jarak pager (Bali); lulu mau, paku kase, jarak pageh
(Nusa Tenggara); dan jarak kosta, jarak wolanda, bindalo, bintalo, tondo utomene
(Sulawesi). Keragaan salah satu komposit jarak pagar yang tumbuh di Indonesia
IP3-P tertera pada Gambar 2.
Jarak pagar termasuk famili Euphorbiaceae, satu famili dengan karet dan
ubi kayu. Klasifikasi tanaman jarak pagar adalah sebagai berikut (Hambali et al.
2006).
Jarak pagar tumbuh di dataran rendah sampai ketinggian sekitar 500 mdpl.
Curah hujan yang sesuai untuk tanaman jarak pagar adalah 625 mm/tahun, namun
tanaman ini dapat tumbuh pada daerah dengan curah hujan antara 300-2.380
mm/tahun. Kisaran suhu yang sesuai untuk tanaman jarak adalah 20-26°C. Pada
daerah dengan suhu terlalu tinggi (di atas 35°C) atau terlalu rendah (di bawah
15°C) pertumbuhannya terhambat, kadar minyak dalam biji berkurang dan
berubah komposisinya (Hambali et al. 2006).
Tanaman jarak pagar termasuk perdu dengan tinggi 1-7 m, bercabang
tidak teratur. Batangnya berkayu, silindris dan bila terluka mengeluarkan getah.
Daunnya biasanya berlekuk 3-5, terkadang ada yang sampai 7. Lekukan dangkal
atau agak dalam. Panjang helaiannya 10-19 cm, urat daun menjari, warna helaian
daun hijau muda sampai hijau masak polos. Kedudukan daun berselang-seling,
sekilas seperti berhadapan melingkari batang (spiral). Bunganya muncul di bagian
ujung batang, pada ketiak daun. Panjang tangkai bunga 3-12 cm. Bunga jantan
dan betina terpisah, terdapat di ujung-ujung tangkai bunga. Bunga betina sedikit
lebih besar dibandingkan dengan jantan. Bunganya berwarna kuning kehijauan
(Prana 2006).
Tumbuhan ini dikenal tahan kekeringan karena mempunyai sistem
perakaran yang kuat serta dapat hidup pada berbagai jenis dan tekstur tanah. Oleh
sebab itu, tanaman ini sangat cocok ditanam di lahan kering dan berfungsi sebagai
tanaman penahan erosi. Di kepulauan Comoro, Papua New Guinea dan Uganda
sedangkan di Kuba digunakan sebagai tanaman pelindung untuk tanaman kopi
(Khatri dan Gandhi 2011). Saat ini tanaman jarak banyak dikembangkan di
lahan-lahan kritis dan tidur yang belum dimanfaatkan. Hal lain yang membuat tanaman
ini berpotensi untuk dikembangkan karena sebagai penghasil minyak nabati yang
bukan merupakan bahan baku untuk kebutuhan pangan, sehingga tidak terjadi
persaingan kebutuhan bahan baku pangan dengan bahan baku energi (Hambali et
al. 2006). Tanaman ini juga dapat dimanfaatkan sebagai minyak pelumas, bahan
baku pembuatan sabun, bahan baku dalam industri insektisida, fungisida dan
molluskasida, untuk obat anti tumor, dan untuk ekorestorasi di semua jenis tanah
marginal (Heller 1996; Prabakaran dan Sujatha, 1999; Lin et al. 2003).
Saat ini biji jarak mendapat perhatian sebagai sumber bahan bakar hayati
untuk mesin diesel karena kandungan minyaknya. Biji jarak pagar mengandung
20-40% minyak nabati, namun bagian biji (tanpa cangkang) dapat mengandung
45-60% minyak kasar (Heller 1996). Komposisi asam lemak dari 11 kultivar jarak
pagar, menunjukkan bahwa asam lemak yang dominan adalah asam oleat, asam
linoleat, asam stearat, dan asam palmitat (Heller 1996). Komposisi asam oleat dan
asam linoleat bervariasi, sementara dua asam lemak lainnya, merupakan asam
lemak jenuh relatif tetap.
Berbagai teknologi telah dihasilkan oleh para peneliti di Indonesia, mulai
dari pengumpulan aksesi plasma nutfah (telah terkumpul 591 aksesi), pelepasan
komposit (IP1-P, IP1-M, IP2-P, IP2-M, IP2-A, IP3-P, IP3-M dan IP3-A),
budidaya tanaman (teknologi pembibitan, pemupukan pengendalian hama,
penyakit dan gulma, pasca panen dan pengembangan alat pengolah biji jarak
(Syakir 2010).
Aksesi dan komposit J. curcas yang berpotensi dikembangkan di
Indonesia adalah aksesi Dompu dan komposit IP3-P. Aksesi Dompu merupakan
salah satu aksesi yang toleran kekeringan dan memiliki kandungan minyak yang
cukup tinggi yaitu 30-37% dengan bobot biji 2.0-2.23 gr, sedangkan komposit
IP3-P merupakan hasil seleksi rekuren dari populasi IP2-P dan IP2-A yang
memiliki potensi produksi 2.3-2.6 ton/ha/tahun untuk tahun pertama dan dapat
mencapai 8-9 ton/ha pada tahan ke empat. Hasil ini jauh melampaui potensi
Kandungan minyak dari produksi IP3-P adalah sebesar 36% dan tanaman ini
sudah mulai berproduksi 14 minggu setelah pemindahan ke lapangan (Hasnam
2007).
B. Kultur Jaringan
Kultur jaringan adalah suatu metode perbanyakan vegetatif tanaman yang
dilakukan dengan cara mengisolasi bagian tanaman seperti protoplas, sel,
sekelompok sel, jaringan atau organ, kemudian menumbuhkannya dalam kondisi
aseptik, sehingga bagian tanaman tersebut dapat memperbanyak diri dan
beregenerasi menjadi tanaman yang lengkap (Gunawan 1992). Cara ini sering
disebut in vitro, karena bagian tanaman tersebut ditumbuhkan dalam tabung
inkubasi atau cawan petri dari kaca atau material tembus pandang lainnya di
dalam laboratorium pada kondisi aseptik dan disebut juga perbanyakan mikro
sebab tanaman yang dihasilkan berupa tanaman kecil (Kyte & Kleyn 1990).
Prinsip yang mendasari teknik kultur jaringan disebut dengan “totipotensi sel” yaitu bahwa setiap sel mempunyai kemampuan tumbuh dan berkembang membentuk jaringan, organ dan akhirnya menjadi individu baru yang lengkap
apabila ditumbuhkan dalam media dan lingkungan yang sesuai. Hal ini
menunjukkan bahwa dalam masing-masing sel tumbuhan mengandung informasi
genetik atau sarana fisiologis tertentu sehingga dapat membentuk tanaman
lengkap bila ditempatkan dalam lingkungan yang sesuai (Doyle & Griffiths
1999). Walaupun secara teoritis seluruh sel bersifat totipotensi, yang
mengekspresikan keberhasilan terbaik adalah sel yang meristematik.
Dalam perbanyakan tanaman melalui kultur jaringan dapat ditempuh
melalui dua jalur, yaitu organogenesis dan embriogenesis somatik. Organogenesis
adalah suatu proses membentuk dan menumbuhkan tunas dari jaringan
meristematik (Gunawan 1992; Pardal 2002). Menurut Watimena (2006),
regenerasi eksplan menjadi organ dan plantlet dapat diperoleh melalui jalur
organogenesis langsung dan organogenesis tidak langsung. Organogenesis
langsung terjadi tanpa melalui pembentukan kalus, sedangkan organogenesis tidak
langsung diawali dengan pembentukan kalus, lalu muncul organ pada kalus.
tetapi berkembang dari sel somatik (Williams & Maheswara 1986). Jalur
embriogenesis somatik lebih mendapat perhatian karena bibit dapat berasal dari
satu sel somatik sehingga bibit yang dihasilkan lebih banyak dibandingkan
melalui jalur organogenesis. Di samping itu, sifat perakarannya sama dengan bibit
asal biji.
Metode kultur jaringan dikembangkan untuk membantu memperbanyak
tanaman, khususnya untuk tanaman yang sulit dikembangbiakkan secara
generatif. Bibit yang dihasilkan dari kultur jaringan mempunyai beberapa
keunggulan, antara lain: mempunyai sifat yang identik dengan induknya, dapat
diperbanyak dalam jumlah yang besar sehingga tidak terlalu membutuhkan
tempat luas, mampu menghasilkan bibit dengan jumlah besar dalam waktu
singkat, bebas dari patogen dan mutu bibit lebih terjamin, kecepatan tumbuh bibit
lebih cepat dibandingkan dengan perbanyakan konvensional. Adapun tahapan
yang dilakukan dalam perbanyakan tanaman melalui metode kultur jaringan
adalah pembuatan media, pemilihan atau isolasi bahan tanam (eksplan), sterilisasi
eksplan, inokulasi eksplan, aklimatisasi (George & Sherrington 1994; Pierik
1997). Melalui metode ini dapat dibuktikan bahwa bagian tanaman yang diisolasi
dan dipelihara secara aseptik dalam media buatan yang cocok mampu membelah
dan berdiferensiasi sehingga membentuk individu baru yang lengkap seperti
tanaman asalnya, baik melalui tahap multiplikasi, organogenesis ataupun
emriogenesis (Pierik 1997).
Keberhasilan metode kultur jaringan dipengaruhi oleh beberapa faktor
diantaranya: pemilihan eksplan sebagai bahan dasar untuk pembentukan kalus,
tunas dan akar, penggunaan media yang cocok sebagai sumber nutrisi, dan kondisi
lingkungan tempat kultur di inkubasi. Meskipun pada perinsipnya semua jenis sel
dapat ditumbuhkan, sebaiknya dipilih bagian tanaman yang masih muda dan
mudah tumbuh yaitu bagian meristematik, misalnya: daun muda, ujung akar,
ujung batang, keping biji dan sebagainya. Jaringan meristem terdiri dari sel-sel
yang selalu membelah, dindingnya tipis, belum mempunyai penebalan dari zat
pektin, plasmanya penuh dan vakuolanya kecil-kecil, sehingga jaringan ini selalu
Pada saat ini, teknologi kultur jaringan tanaman telah dimanfaatkan untuk
penyediaan bibit tanaman penghasil biodisel, antara lain jarak pagar, kelapa sawit
dan Brassica napus (Zou et al. 1995). Teknik regenerasi in vitro jarak pagar
digunakan dengan memanfaatkan fleksibilitas kemampuan sel/totipotensi dan
tergantung dari kemampuan dasar sel alami maupun yang diperoleh melalui
proses induksi. Sistem perbanyakan tanaman tersebut dapat dikelompokkan
menjadi regenerasi langsung dan tidak langsung. Penelitian kultur jaringan jarak
pagar telah banyak dilakukan dengan menggunakan berbagai metode regenerasi
dan jenis eksplan (Mukherjee et al. 2011) (Tabel 1).
Tabel 1. Penelitian J. curcas dengan teknik kultur jaringan dengan berbagai metode regenerasi dan jenis eksplan.
No. Jenis eksplan Metode regenerasi Pustaka
1. Buku Perbanyakan tunas Kalimuthu et al. (2007) 2. Daun Regenerasi embrio somatik Sardana et al. (2000) 3. Daun Embriogenesis somatik Jha et al. (2007)
4. Daun Tunas advebtif Deore dan Johnson
(2008)
5. Daun dan
hipokotil Kalus dan kultur suspensi
Soomro dan Memon. (2007)
6. Embrio muda Organogenesis tidak langsung Varshney dan Johnson (2010)
8. Kotiledon Induksi embrio somatik Kalimuthu et al. (2007) 9. Mata tunas Organogenesis langsung Datta et al. (2007)
Perbanyakan tunas adventif Sujatha et al. (2005)
12. Pucuk tunas Organogenesis dan perakaran
tunas Rajore dan Batra (2005)
13. Tunas aksilar Perbanyakan tunas Thepsamran et al. (2007)
14. Tunas apikal Induksi tunas melalui
pembentukan kalus Purkayastha et al. (2010)
C. Zat Pengatur Tumbuh
Perkembangan dan pertumbuhan tanaman dalam teknik kultur jaringan
zat pengatur tumbuh yang ditambahkan ke dalam media kultur. Menurut Pierik
(1997), senyawa-senyawa lain yang memiliki karakteristik sama dengan hormon,
tetapi diproduksi secara eksogen dikenal sebagai zat pengatur tumbuh, sedangkan
menurut Hendaryono dan Wijayani (1994), zat pengatur tumbuh adalah senyawa
organik bukan hara, yang dalam jumlah sedikit dapat mendukung, menghambat
dan dapat mengubah proses fisiologi tumbuhan.
Zat pengatur tumbuh tanaman berperan penting dalam mengontrol proses
biologi dalam jaringan tanaman dan dapat menimbulkan tanggapan secara
biokimia, fisiologis, dan morfologis (Gaba, 2005). Aktivitas zat pengatur tumbuh
di dalam pertumbuhan tanaman tergantung dari jenis, struktur kimia, konsentrasi,
genotipe tanaman serta fase fisiologi tanaman (Satyavathi et al. 2004).
Zat pengatur tumbuh ini dapat dibagi menjadi beberapa golongan yaitu
auksin, sitokinin, giberelin dan inhibitor. Zat pengatur tumbuh yang tergolong
auksin adalah Indol Asam Asetat (IAA), Indol Asam Butirat (IBA), Naftalen
Asam Asetat (NAA) dan 2.4-Diklorofenoksiasetat (2.4-D). Zat pengatur tumbuh
yang termasuk golongan sitokinin adalah Kinetin, Zeatin dan Bensil Aminopurin
(BAP), sedangkan golongan giberelin adalah GA1, GA2, GA3, GA4, dan
golongan inhibitor adalah fenolik dan asam absisik.
Zat pengatur tumbuh golongan auksin menurut Pierik (1997), umumnya
berperan merangsang pemanjangan sel, terutama di daerah meristem, pembelahan
sel dan pembentukan akar adventif. Auksin berpengaruh pula untuk menghambat
pembentukan tunas adventif dan tunas aksilar, namun kehadirannya dibutuhkan
dalam meningkatkan embriogenesis somatik pada kultur suspensi sel.
Konsentrasi auksin yang rendah meningkatkan pembentukan akar adventif,
sedangkan konsentrasi auksin yang tinggi merangsang pembentukan kalus,
mencegah morfogenesis, mempercepat dan memperbanyak jumlah embrio
somatik yang terbentuk.
Peran auksin pada embriogenesis somatik antara lain untuk inisiasi
embriogenesis somatik, induksi kalus embriogenik, proliferasi kalus embriogenik
dan induksi embrio somatik (Utami et al. 2007). Dari berbagai hasil penelitian
embriogenik. Di samping auksin, sering pula diberikan sitokinin seperti benzil
adenin (BA) atau kinetin secara bersamaan (Bhojwani dan Razdan 1996).
Golongan auksin merupakan zat pengatur tumbuh yang sering digunakan
dalam embriogenesis somatik. Raemakers et al. (1995) melaporkan keberhasilan
embriogenesis somatik dari 65 spesies tanaman dikotil, pada media tanpa zat
pengatur tumbuh mencapai 17 spesies, pada media yang mengandung auksin
mencapai 29 spesies dan 25 spesies pada media yang mengandung sitokinin.
Diantara zat pengatur tumbuh auksin yang digunakan adalah 2.4-D (49%), NAA
(27%), IAA (6%), picloram (5%) dan Dicamba (5%), sedangkan sitokinin yang
digunakan adalah BAP (57%), kinetin (37%), zeatin (3%) dan thidiazuron (3%)
(Raemaker et al. 1995).
Selain golongan auksin, zat pengatur tumbuh yang sering digunakan
adalah golongan sitokinin. Sitokinin berperan dalam meningkatkan pembelahan
sel serta mengatur pertumbuhan dan perkembangan tanaman. Di dalam kultur
jaringan, sitokinin berperan dalam proliferasi dan morfogenesis pucuk. Golongan
sitokinin yang sering dipergunakan dalam kultur jaringan adalah BAP
(6-Benzylaminopurine). Menurut George dan Sherrington (1984), BAP merupakan
salah satu sitokinin sintetik yang aktif dan daya merangsangnya lebih lama karena
tidak mudah dirombak oleh enzim dalam tanaman. Menurut Noggle dan Fritz
(1983), BAP memiliki struktur yang mirip dengan kinetin dan juga aktif dalam
pertumbuhan dan proliferasi kalus, sehingga BAP merupakan sitokinin yang
paling aktif.
D. Embriogenesis Somatik
Embrio tumbuhan terbentuk melalui proses embriogenesis, baik sebagai
kelanjutan dari proses pembuahan (embrio zigotik) maupun melalui proses
induksi dari sel-sel somatik (embrio somatik). Pada saat perkembangan embrio,
setidaknya ada beberapa tahap yang dapat diamati secara visual, yaitu fase
globular, triangular, jantung, dan torpedo. Tahap perkembangan selanjutnya
setelah terbentuk kotiledon adalah tahap maturasi dan germinasi (George et al.
Embriogenesis somatik berlangsung melalui tahap yang serupa dengan
embriogenesis zigotik, dan dapat diperoleh secara langsung dari eksplan jaringan,
atau secara tidak langsung melalui kultur sel somatik atau kultur kalus. Embrio
somatik adalah struktur yang harus melalui tahap diferensiasi, sehingga proses
diferensiasi dan metabolisme yang menyertainya dapat ditingkatkan.
Mikropropagasi dalam kultur jaringan dapat dilakukan melalui jalur
organogenesis dan embriogenesis somatik. Pada organogenesis, proses
pembentukan pucuk dan atau akar adventif berkembang dari dalam massa kalus
yang berlangsung setelah periode pertumbuhan kalus (Hartman et al. 1990),
sedangkan embriogenesis somatik merupakan suatu proses dimana sel somatik
(baik haploid maupun diploid) berkembang membentuk tumbuhan baru melalui
tahap perkembangan embrio yang spesifik tanpa melalui fusi gamet (Williams &
Maheswara 1986), sedangkan menurut Zulkarnain (2009), embriogenesis somatik
adalah proses perkembangan embrio lengkap dari sel-sel vegetatif atau sel-sel
somatik yang diperoleh dari berbagai sumber eksplan yang inisiasi dan
diferensiasinya tidak melibatkan proses seksual.
Embrio somatik dapat dicirikan dari strukturnya yang bipolar, yaitu
mempunyai calon meristem akar dan meristem tunas. Mikropropagasi melalui
embriogenesis somatik banyak mendapat perhatian karena jumlah propagula yang
dihasilkan tidak terbatas dan dapat diperoleh dalam waktu lebih singkat.
Regenerasi tumbuhan melalui embriogenesis somatik lebih menguntungkan dari
organogenesis, karena tumbuhan yang diregenerasikan dari embrio somatik dapat
berkembang dari sel tunggal, sehingga mengurangi variasi somaklonal (Endress
1997). Embrio somatik memiliki kemampuan pertumbuhan dan perkembangan
seperti embrio zigotik, sehingga sangat efisien untuk digunakan dalam studi
perkembangan, manipulasi genetik dan benih sintetis (Kumari et al. 2000). Selain
itu, embrio somatik juga diketahui mengakumulasi produk penyimpanan, seperti
protein dan lipid yang dapat digunakan dalam pengembangan produksi metabolit
tanaman secara in vitro (Preil dan Beck 1991).
Di samping keuntungan, terdapat beberapa kendala dalam penerapan
embriogenesis, yaitu peluang terjadi mutasi lebih tinggi, metode lebih sulit, ada
serta memerlukan penanganan yang lebih intensif karena kultur lebih rapuh.
Namun demikian, variasi yang dihasilkan sering dianggap menguntungkan karena
dapat digunakan sebagai sumber keragaman genetik (gene pool) (Purnamaningsih,
2002).
Embrio somatik biasanya dapat diinisiasi dari jaringan juvenil atau
jaringan meristematik. Eksplan yang digunakan dapat berupa daun muda, embrio
muda, ujung tunas, kotiledon, dan hipokotil. Tetapi respon eksplan sangat
tergantung dari genotip tanaman. Jadi untuk spesies tanaman yang berbeda, hanya
jaringan tertentu yang dapat digunakan untuk inisiasi embrio somatik (Gray,
2005).
Induksi embriogenesis somatik dapat terjadi secara langsung maupun tidak
langsung. Embrio somatik dapat langsung terbentuk dari eksplan daun, batang,
protoplas maupun dari mikrospora. Pada tahap ini, sel-sel pada eksplan tersebut
telah mengalami determinasi untuk membentuk embrio dan hanya memerlukan
kondisi yang sesuai untuk ekspresinya. Embriogenesis langsung secara in vitro
umumnya terjadi pada sel-sel eksplan yang masih muda (jaringan meristematik),
sedangkan embriogenesis tak langsung terjadi pada sel-sel yang telah mengalami
diferensiasi, pembelahan sel, dan transformasi menjadi sel embriogenik. Sel-sel
embriogenik yang akan menjadi embrio adalah sel-sel yang berukuran kecil,
dengan isi sitoplasma yang penuh atau tanpa vakuola. Pada pembentukan embrio
somatik secara tidak langsung, pembentukan embrio terjadi melalui fase kalus
terlebih dahulu atau melalui kultur suspensi. Proses embriogenesis somatik secara
tidak langsung memerlukan media yang lebih kompleks, antara lain diperlukan
penambahan zat pengatur tumbuh untuk menginduksi dediferensiasi dan reinisiasi
pembelahan sel dari sel-sel yang telah terdiferensiasi sebelum sel-sel dapat
mengekspresikan kompetensi embriogeniknya (Jimenez 2001).
Tahapan dalam proses embriogenesis somatik adalah induksi kalus
embriogenik, pendewasaan, perkecambahan, dan hardening (tahap aklimatisasi)
(Purnamaningsih 2002). Pada tahap induksi kalus embriogenik, kultur umumnya
ditumbuhkan pada media yang mengandung auksin yang mempunyai daya
aktivitas kuat atau dengan konsentrasi tinggi dibandingkan keperluan auksin pada
menunjukkan bahwa 2.4-D merupakan auksin yang efektif untuk induksi kalus
embriogenik. Zat pengatur tumbuh tersebut merupakan auksin sintetis yang cukup
kuat dan tahan terhadap degradasi karena reaksi enzimatik dan fotooksidasi. Di
samping auksin, sering pula diberikan sitokinin seperti benzil adedin (BA) atau
kinetin secara bersamaan (Bhojwani dan Razdan, 1989). Auksin yang tinggi
diperlukan untuk tahap awal induksi kalus embriogenik, sedangkan untuk tahap
proliferasi dibutuhkan auksin yang rendah atau tanpa auksin.
Tahap pendewasaan adalah tahap perkembangan dari struktur globular
membentuk kotiledon dan primordia akar. Beberapa hasil penelitian menunjukkan
bahwa tahap pendewasaan adalah tahap yang paling sulit. Pada tahap ini sering
digunakan media tanpa auksin (Pierik 1987), media dengan konsentrasi auksin
rendah (Purnamaningsih 2002), media dengan konsentrasi auksin dan sitokinin
yang sangat rendah dapat menginduksi pembentukan embrio bipolar yang
selanjutnya berkembang membentuk planlet (Ammirato 1984).
Tahap perkecambahan adalah fase di mana embrio somatik membentuk
tunas dan akar. Pada media perkecambahan, konsentrasi zat pengatur tumbuh
sitokinin yang digunakan sangat rendah atau tanpa zat pengatur tumbuh. Menurut
Mariska et al. (2001),pada tahap perkecambahan sering ditambahkan GA3.
Tahap hardening, yaitu tahap aklimatisasi bibit embrio somatik dari
kondisi in vitro ke lingkungan baru di rumah kaca. Aklimatisasi dilakukan setelah
embrio berkecambah dan diperoleh plantlet yang siap untuk dipindahkan ke
lapangan. Aklimatisasi plantlet hasil dilakukan dengan menurunkan kelembaban
dan peningkatan intensitas cahaya.
Menurut Namasivayam (2007) pembentukan embrio somatik dapat
dipengaruhi oleh genotipe, jaringan dan tahap perkembangan eksplan, dan kondisi
kultur seperti keseimbangan zat pengatur tumbuh endogen dan eksogen, kondisi
osmotik dan perubahan pH. Penggunaan eksplan yang bersifat merismatik
umumnya memberikan keberhasilan pembentukan embrio somatik yang lebih
tinggi. Eksplan yang digunakan dapat berupa aksis embrio zigotik muda dan
dewasa, kotiledon, mata tunas, epikotil maupun hipokotil. Sumber nitrogen dan
gula yang terdapat dalam komposisi media berperan penting dalam induksi dan
morfogenesis secara in vitro yang berfungsi untuk inisiasi dan perkembangan
embrio, sedangkan gula berfungsi sebagai sumber karbon dan mempertahankan
osmotik media. Menurut Chen dan Chang (2001) zat pengatur tumbuh yang
paling umum digunakan untuk menginduksi embriogenesis somatik adalah auksin
BAHAN DAN METODE
A. Tempat dan Waktu
Penelitian dilakukan di Laboratorium Kultur Jaringan, Institut Pertanian
Bogor dan Pusat Penelitian Bioteknologi-LIPI. Penelitian ini berlangsung dari
bulan November 2010 sampai Januari 2012.
B. Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah benih Jatropha
curcas L. komposit IP3-P Pakuwon, Sukabumi dan aksesi Dompu dari SBRC
IPB, Kebun Jarak pagar PT Indocement Tunggal Prakarsa Tbk, Cibinong. Eksplan
yang digunakan adalah hipokotil, daun, kotiledon, embrio muda, aksis embrio
muda, aksis embrio tua dan aksis embrio dari buah masak. Media kultur adalah
MS (Murashige dan Skoog) (Lampiran 1) dan zat pengatur tumbuh 2,4-D dan
Picloram. Alat yang digunakan adalah peralatan kultur dan sterilisasi.
C. Metode Percobaan
Pada penelitian ini dilakukan 6 percobaan yang dibagi dalam 2 kelompok
percobaan utama yaitu: 1. Induksi embrio somatik (4 percobaan) dan 2. Proliferasi
dan pendewasaan embrio somatik (2 percobaan).
1 . Induksi Embrio Somatik
a). Induksi embrio somatik dari berbagai jenis eksplan J. curcas komposit IP3-P
Sterilisasi dan inisiasi kecambah
Tahapan ini bertujuan untuk menyediakan sumber eksplan in vitro dalam
induksi kalus embriogenik. Proses sterilisasi meliputi: biji yang telah dikupas
direndam dengan mankozeb 2.4% selama 30 menit, kemudian dibilas dengan
air mengalir. Sterilisasi selanjutnya dilakukan di Laminar Air flow Cabinet
dengan merendam biji yang sudah dikupas dalam alkohol 70% selama 1 menit
sambil dikocok. Alkohol dibuang, lalu biji direndam dalam Na-hipoklorit 25%
direndam kembali dalam larutan Na-hipoklorit 20% selama 30 menit,
kemudian dibilas dengan air steril sebanyak 3 kali. Setelah proses sterilisasi
dilakukan, biji diletakkan di cawan petri steril, kemudian dipotong menjadi dua
bagian. Bagian yang tidak terdapat embrio dibuang, sedangkan bagian yang
terdapat embrio ditanam pada media Murashige dan Skoog (MS) tanpa zat
pengatur tumbuh (ZPT), dan dibiarkan tumbuh selama satu minggu tanpa
subkultur.
Induksi kalus embriogenik
Eksplan hipokotil dan daun diambil dari kecambah berumur 1 minggu
setelah tanam pada media MS, sedangkan aksis embrio tua dan kotiledon
berasal dari biji yang telah dikupas dan disteril. Hipokotil dan daun
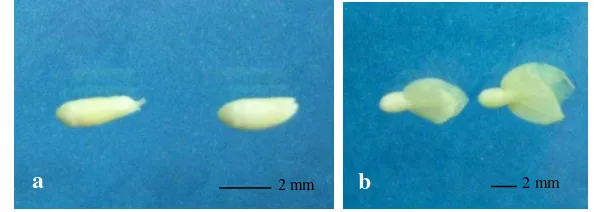
dipotong-potong dengan ukuran 0.5 cm, aksis embrio tua (± 0.3 cm) dan kotiledon (± 0.5
cm) (Gambar 3), kemudian ditanam pada media MS padat dengan sukrosa 3%
yang ditambahkan zat pengatur tumbuh picloram 0.0; 0.5; 1.0; 1.5; 2.0 dan 2.5
mgL-1 dan 2.4 D 0; 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL-1. Kultur diinkubasi di tempat gelap, pada suhu 26±2°C, selama 8 minggu.
Gambar 3. Eksplan J. curcas komposit IP3-P a) eksplan daun, b) eksplan hipokotil, c) eksplan aksis embrio dan d) eksplan kotiledon
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap
(RAL) dengan dua faktor. Faktor pertama adalah konsentrasi zat pengatur
b a
tumbuh dengan 6 taraf yaitu: 0.0; 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL-1 Picloram, sedangkan faktor kedua adalah jenis eksplan dengan 4 taraf yaitu: daun,
hipokotil, aksis tua dan kotiledon. Setiap perlakuan diulang 10 kali, tiap botol
berisi 2 eksplan sehingga totalnya yaitu 240 satuan percobaan.
b). Induksi embrio somatik dari aksis embrio muda dan embrio muda J.
curcas aksesi Dompu
Sterilisasi
Pada sterilisasi aksis embrio muda dan embrio muda (Gambar 4), buah
berukuran 27-30 mm direndam dalam larutan Na-hipoklorit 25% selama 30
menit, kemudian larutan Na-hipoklorit dibuang dan buah dipotong kemudian
embrio muda dipisahkan dari endosperm. Setelah terpisah embrio muda
berukuran 11.5-15.0 mm dipindahkan ke media perlakuan.
Gambar 4. Eksplan a) aksis embrio muda dan b) embrio muda.
Induksi kalus embriogenik
Eksplan aksis embrio buah muda dan embrio muda ditanam pada media
perlakuan setelah biji disterilisasi yaitu pada media MS padat dengan sukrosa
3% yang ditambahkan zat pengatur tumbuh picloram 0.0; 0.5; 1.0; 1,5; 2.0 dan
2.5 mgL-1 dan 2.4 D 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL-1. Kultur diinkubasi ditempat gelap, pada suhu 26±2°C, selama 8 minggu.
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap
(RAL) dengan dua faktor. Faktor pertama adalah konsentrasi zat pengatur
tumbuh dengan 11 taraf yaitu: 0.0; 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL-1 picloram dan 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL-1 2.4-D, sedangkan faktor kedua adalah jenis eksplan dengan 2 taraf yaitu: aksis embrio muda dan embrio muda. Setiap
2 mm 2 mm
perlakuan diulang 8 kali, tiap botol berisi 2 eksplan, sehingga totalnya yaitu
176 satuan percobaan.
Pengamatan percobaan 1a dan 1b dilakukan untuk mengetahui
pertumbuhan dan perkembangan kalus yang terbentuk mulai dari 1-8 minggu.
Pengamatan meliputi :
1. Jumlah eksplan membentuk kalus
Pengamatan dilakukan setiap minggu sampai 8 minggu setelah tanam
(MST).
Persentase eksplan membentuk kalus =
Σ eksplan berkalus X 100% Σ eksplan yang digunakan
2. Pertumbuhan kalus
Pengamatan dilakukan setiap minggu sampai 8 minggu setelah tanam
(MST). Pengamatan dilakukan dengan sistem skoring (Gambar 5).
Skoring pertumbuhan kalus:
Skor 1: eksplan tidak membentuk kalus
Skor 2 : 1-25% kalus menutupi eksplan
Skor 3 : 26-50% kalus menutupi eksplan
Skor 4 : 51-75% kalus menutupi eksplan
Skro 5 : 76-100% kalus menutupi eksplan
Gambar 5. Skor perkembangan kalus dari eksplan daun a) skor 1, b) skor 2, c) skor 3, d) skor 4, dan e) skor 5.
a b
3. Morfologi kalus (struktur dan warna).
Pengamatan dilakukan setiap minggu sampai 8 MST. Pengamatan dilakukan
dengan cara melihat struktur dan warna kalus.
4. Jumlah eksplan membentuk embrio somatik
Persentase eksplan membentuk embrio somatik =
Σ eksplan membentuk embrio somatik X 100% Σ eksplan yang berkalus
c). Induksi embrio somatik dari aksis embrio buah masak J. curcas aksesi Dompu dengan picloram dan 2.4-D
Eksplan aksis embrio buah masak ditanam pada media perlakuan setelah
biji disterilisasi (Gambar 6), pada media MS padat dengan sukrosa 3% yang
ditambahkan zat pengatur tumbuh picloram 0.0; 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL
-1
dan 2.4 D 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL-1. Kultur diinkubasi di tempat gelap, pada suhu 26±2°C, selama 8 minggu.
Gambar 6. Sumber eksplan a) buah jarak masak hijau dan b) aksis embrio buah masak hijau (tanda panah).
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap
(RAL) dengan 1 faktor yaitu konsentrasi zat pengatur tumbuh dengan 11 taraf
yaitu: 0.0; 0.5; 1; 1.5; 2.0 dan 2.5 mgL-1 Picloram dan 0.5; 1.0; 1.5; 2.0 dan 2.5 mgL-1 2.4-D. Setiap perlakuan diulang 10 kali, tiap botol berisi 2 eksplan, sehingga totalnya yaitu 110 satuan percobaan.
Pengamatan dilakukan untuk melihat pertumbuhan dan perkembangan
kalus yang terbentuk 1-8 minggu.
Pengamatan meliputi :
1. Jumlah eksplan membentuk kalus
Pengamatan dilakukan setiap minggu sampai 8 MST.
Persentase eksplan membentuk kalus =
Σ eksplan berkalus X 100% Σ eksplan yang digunakan
2. Pertumbuhan kalus
Pengamatan dilakukan setiap minggu sampai 8 MST. Pengamatan dilakukan
dengan sistem skoring.
Skoring pertumbuhan kalus:
Skor 1: eksplan tidak membentuk kalus
Skor 2 : 1-25% kalus menutupi eksplan
Skor 3 : 26-50% kalus menutupi eksplan
Skor 4 : 51-75% kalus menutupi eksplan
Skor 5 : 76-100% kalus menutupi eksplan
3. Morfologi kalus (struktur dan warna)
Pengamatan dilakukan setiap minggu sampai 8 MST. Pengamatan dilakukan
dengan cara melihat struktur dan warna kalus.
4. Jumlah eksplan membentuk embrio somatik
Persentase eksplan membentuk embrio somatik =
Σ eksplan membentuk embrio somatik X 100% Σ eksplan yang berkalus
5. Histodiferensiasi (irisan tentang tahap-tahap perkembangan embrio somatik)
d). Induksi embrio somatik dari aksis embrio buah masak J. curcas aksesi
Dompu dengan picloram
Eksplan aksis embrio buah masak ditanam pada media perlakuan
setelah biji disterilisasi, pada media MS padat dengan sukrosa 3% yang
ditambahkan zat pengatur tumbuh picloram 2.5; 3.0; 4.0 dan 2.5 mgL-1. Kultur diinkubasi di tempat gelap, pada suhu 26±2°C, selama 8 minggu.
Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) 1
faktor yaitu konsentrasi picloram, dengan 4 taraf yaitu: 2.5; 3.0; 4.0 dan 2.5
mgL-1. Setiap perlakuan diulang 3 kali, tiap Petri dish berisi 6 eksplan, sehingga totalnya 12 satuan percobaan.
Pengamatan dilakukan untuk melihat pertumbuhan dan perkembangan kalus
Pengamatan meliputi :
1.Persentase eksplan membentuk kalus
Pengamatan dilakukan setiap minggu sampai 8 MST.
Persentase eksplan membentuk kalus =
Σ eksplan berkalus X 100% Σ eksplan yang digunakan
2. Pertumbuhan kalus
Pengamatan dilakukan setiap minggu sampai 8 MST. Pengamatan dilakukan
dengan sistem skoring.
Skoring perkembangan kalus:
Skor 1: eksplan tidak membentuk kalus
Skor 2 : 1-25% kalus menutupi eksplan
Skor 3 : 26-50% kalus menutupi eksplan
Skor 4 : 51-75% kalus menutupi eksplan
Skro 5 : 76-100% kalus menutupi eksplan
3. Morfologi kalus (struktur dan warna)
Pengamatan dilakukan setiap minggu sampai 8 MST. Pengamatan dilakukan
dengan cara melihat struktur dan warna kalus.
4. Jumlah eksplan membentuk embrio somatik
Persentase eksplan membentuk embrio somatik =
Σ eksplan membentuk embrio somatik X 100% Σ eksplan yang berkalus
5. Histodiferensiasi (irisan tentang tahap-tahap perkembangan embrio somatik
dari globular, hati, torpedo dan kotiledon)
Pengamatan secara mikroskopik dengan membuat irisan contoh
menurut metode parafin (Sass, 1951) (Lampiran 2), hanya dilakukan untuk
embrio somatik yang terbentuk yaitu dengan irisan membujur. Pembuatan
preparat melalui beberapa tahapan, yaitu fiksasi, dehidrasi, infiltrasi
pemblokan, embedding, pengirisan dan staining (pewarnaan). Pewarna yang
2. Proliferasi dan Pendewasaan Kalus Embriogenik
a). Proliferasi dan pendewasaan kalus embriogenik pada media padat
Kalus embriogenik dan embrio somatik yang terbentuk pada media
Picloram atau 2.4-D disubkultur ke media MS padat tanpa zat pengatur
tumbuh dengan penambahan 3% sukrosa, vitamin Gamborg B5 dan
phytagel 2 g/L-1.
b). Proliferasi dan pendewasaan kalus embriogenik pada media cair
Kalus embriogenik dan embrio somatik yang terbentuk pada media
dengan penambahan picloram atau 2.4-D disubkultur ke media MS padat
tanpa zat pengatur tumbuh dengan penambahan 3% sukrosa, vitamin
Gamborg B5 selama 2 minggu, kemudian disubkultur ke media cair tanpa
atau dengan penambahan 2.5 mgL-1 picloram. Pengamatan meliputi :
1.Jumlah kalus embriogenik
2.Jumlah embrio somatik yang terbentuk
3.Jumlah embrio somatik yang bertunas
4.Deskripsi histodiferensiasi
D. Analisis Statistik
Percobaan 1a dan 1b menggunakan percobaan acak lengkap dengan dua
faktor, sedangkan percobaan 1c dan 1d menggunakan percobaan acak lengkap
dengan satu faktor. Data dianalisis dengan menggunakan Analysis of Variance
(ANOVA) untuk mengetahui pengaruh antar perlakuan. Perlakuan yang
berpengaruh nyata kemudian diuji lanjut dengan menggunakan Duncan’s multiple
range test (DMRT) dengan tingat kepercayaan 5%. Data skoring diuji
menggunakan uji peringkat Kruskal Wallis (Walpole 1995).
Model statistik percobaan acak lengkap dengan dua faktor (percobaan 1a
dan 1b) menurut Mattjik dan Sumertajaya (2006), yaitu:
Yijk= μ + αi+ βj+ (αβ)ij+ εijk
Dimana,
Yijk = Nilai pengamatan pada faktor pertama taraf ke-1 faktor kedua taraf ke-j
dan ulangan ke-k μ = Rataan umum
αi = Pengaruh utama Faktor pertama
βj = Pengaruh utama Faktor kedua
(αβ)ij = Pengaruh interaksi faktor pertama ke-i dan faktor kedua ke-j
εijk = Pengaruh galat untuk pengamatan taraf ke (i,j,k)
Model statistik percobaan acak lengkap dengan satu faktor (percobaan 1c
dan 1d) menurut Mattjik dan Sumertajaya (2006), yaitu:
Yij= μ + τi + εij
Dimana,
i = 1,2…,r dan j=1,2…,r
Yijk = Nilai pengamatan pada faktor pertama taraf ke-1 dan ulangan ke-j
μ = Rataan umum
τi = Pengaruh perlakuan ke-i