UJI COBA PENGGUNAAN PELET YANG MENGANDUNG
IMUNOGLOBULIN-Y (IG-Y) ANTI KOI HERPESVIRUS
SEBAGAI PENCEGAH PENYAKIT PADA IKAN MAS
(Cyprinus carpio carpio)
REZHA HUTAMA SANTOSO
SKRIPSI
DEPARTEMEN ILMU PENYAKIT HEWAN DAN
KESEHATAN MASYARAKAT VETERINER
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
i
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Saya dengan ini menyatakan bahwa skripsi berjudul Uji Coba Penggunaan Pelet Yang Mengandung Imunoglobulin-Y (Ig-Y) Anti Koi Herpesvirus Sebagai Pencegah Penyakit Pada Ikan Mas (Cyprinus Carpio Carpio) adalah karya saya dibawah bimbingan pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Maret 2011
ii ABSTRAK
REZHA HUTAMA SANTOSO. Uji Coba Penggunaan Pelet Yang Mengandung Imunoglobulin-Y (Ig-Y) Anti Koi Herpesvirus Sebagai Pencegah Penyakit Pada Ikan Mas (Cyprinus carpio carpio). Dibimbing oleh FACHRIYAN HASMI PASARIBU.
Penelitian ini bertujuan untuk mengetahui dosis efektif pada pencegahan penyakit Koi Herpesvirus (KHV) dengan pemberian imunisasi pasif terhadap ikan Mas dan menekan kerugian petani ikan Mas. Penelitian ini menggunakan 100 ekor ikan Mas dengan ukuran 50 gr/ekor yang dibagi menjadi kelompok kontrol negatif, perlakuan dosis rendah (5% (w/w) Ig-Y), dan perlakuan dosis tinggi (20% (w/w) Ig-Y). Perlakuan pemberian pelet dilakukan selama 14 hari dan 28 hari. Data perlakuan diambil setelah dilakukan pengujian serum, uji tantang, dan Polymerase Chain Reaction, kemudian dianalisis secara deskriptif. Ikan yang diberi perlakuan dosis rendah 5% (w/w) selama 14 hari sudah menunjukkan adanya reaksi positif uji serum. Pada uji tantang KHV terhadap ikan perlakuan dosis rendah 5% (w/w) menunjukkan tingkat ketahanan hidup yang baik. Pada uji PCR dari insang ikan Mas yang sakit menunjukkan hasil negatif. Imunisasi pasif Ig-Y anti KHV pada ikan perlakuan dengan cara pemberian pelet mampu menekan infeksi penyakit KHV. Dosis efektif Ig-Y yang dapat mencegah terjadinya infeksi dan kematian akibat KHV yaitu pada pelet berimunoglobulin-Y dengan dosis rendah 5% (w/w) selama 14 hari.
iii ABSTRACT
REZHA HUTAMA SANTOSO. Trial Application of Pellet Containing
Immunoglobulin-Y (Ig-Y) anti Koi Herpesvirus as the Prevention in Common Carp (Cyprinus carpio carpio). Dibimbing oleh FACHRIYAN HASMI PASARIBU.
The objective of this research was to observe effective dose in conducting common carp passive immunization and to reduce disadvantage of carp breeders. This research uses 100 common carps which weight is 50 grams each, and treatment groups based on negative control, low dose 5% (w/w) Ig-Y, and high dose 20% (w/w) Ig-Y. The treatmen of the Ig-Y was applied on its pellet and was given within 14 days and 28 days. The treatment data was taken after the serum test, challenge test, Polymerase Chain Reaction, and then analyzed descriptively. The serum test indicated that cross reaction was shown in low dose 5% (w/w) Ig-Y treated at 14 days. Challenge test on 5% (w/w) treatment shows good survival
rates. PCR test shows a negative results in sick carp gills sample. Passive
immunization of Ig-Y anti KHV in fish pellet able to reduce KHV infection and mortality which effective dose is 5% (w/w) for 14 days.
iv
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
UJI COBA PENGGUNAAN PELET YANG MENGANDUNG
IMUNOGLOBULIN-Y (IG-Y) ANTI KOI HERPESVIRUS
SEBAGAI PENCEGAH PENYAKIT PADA IKAN MAS
(Cyprinus carpio carpio)
Oleh:
REZHA HUTAMA SANTOSO B04060891
Skripsi
Sebagai bagian persyaratan untuk memperoleh gelar Sarjana Kedokteran Hewan
Pada
Fakultas Kedokteran Hewan, Institut Pertanian Bogor
DEPARTEMEN ILMU PENYAKIT HEWAN DAN
KESEHATAN MASYARAKAT VETERINER
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
v
HALAMAN PENGESAHAN
Judul Tugas Akhir : Uji Coba Penggunaan Pelet Yang Mengandung
Imunoglobulin-Y (Ig-Y) Anti Koi Herpesvirus Sebagai Pencegah Penyakit Pada Ikan Mas (Cyprinus carpio carpio).
Bentuk Tugas Akhir : Penelitian
Nama Mahasiswa : Rezha Hutama Santoso
NIM : B04060891
Disetujui :
Pembimbing I
Prof. Dr. drh. Fachriyan H. Pasaribu NIP: 19510313 197902 1 002
Diketahui :
Wakil Dekan Fakultas Kedokteran Hewan
Dr. Nastiti Kusumorini NIP: 19621205 198703 2 001
vi PRAKATA
Alhamdulillahirobbil’alamiin. Puji syukur kehadirat Allah SWT atas
rahmat, ridho dan hidayahNya sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan di Fakultas Kedokteran Hewan IPB. Sholawat dan salam selalu tercurahkan kepada junjungan Nabi besar kita, Nabi Muhammad SAW.
Seiring dengan selesainya penulisan skripsi ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Orangtua tercinta Harjono Budhi Santoso, M.Sc dan Sri Lastitik Widowatik, SH yang selalu melantunkan doa, memberikan semangat, kasih dan sayangnya kepada penulis, adikku tersayang Galuh Fitriarestu Santoso dan Ilham Permana Santoso, serta kepada bude dan pakde yang selalu memberikan nasehat dan saran yang membangun mental penulis. 2. Prof. Dr. drh. Fachriyan Hasmi Pasaribu sebagai dosen pembimbing atas
didikan, bimbingan, arahan, waktu, dan kesabaran yang telah diberikan kepada penulis.
3. drh. Dewi Murni A. sebagai mediator penelitian yang telah memberikan arahan dan masukkannya.
4. drh. Tutik Wresdianti, MS, PhD. sebagai pembimbing akademik yang selalu memberikan motivasi, semangat, dan nasehatnya selama penulis kuliah.
5. Staf dan Pegawai Laboratorium Budidaya Perikanan FPIK IPB. Staf dan
Pegawai Lab Bakteriologi Bagian Mikrobiologi Kesehatan , UPT Medik
Dept. IPHK (P. Agus S, M’ Shelin, M’ Lia, M’ Adhe, P. Said, Mas Ivan).
6. Saudara dan Saudariku Eronu Gea, Harlendo Swedianto, Mawas Iswayudi, Satyo Agususilo, Yandhi Prahardian, dan Vully Oktarina, yang telah banyak membantu dalam penelitian penulis.
vii Wahyudi, Msi), dan pondok Cinta (Ani Mukhtihapsari, Astriani, Catur Fajrin, Eka Martriana, Gusti Ningrum, dan Vully Oktarina).
8. Keluarga Himpro HKSA 2008/2009 dan 2009/2010 (pimpinan-pimpinan,
Divisi Satwa akuatik, Divisi kuda, Divisi Infokus, Divisi Hewan Kecil, serta perangkat kerja Himpunan Profesi Hewan Kesayangan dan Satwa Akuatik).
9. Kakak-kakakku (B’39, B’40, B’41, B’42), kawan-kawan seperjuangan
Aesculapius (B’43), dan adik-adikku (B’44, B’45).
10.Perkumpulan petualang sejati dan luar biasa “ASSHOLIGAN” yang telah bersama-sama menjalankan pendidikan di Institut Pertanian Bogor, staf guild DoT.A Aglonema, staf guild WOW Aglonema.
Bogor, Maret 2011
viii RIWAYAT HIDUP
Penulis dilahirkan di Sragen, Jawa Tengah
pada tanggal 23 Juli 1988. Penulis adalah putra pertama dari tiga bersaudara, dari pasangan Harjono Budhi Santoso, M.Sc dan Sri Lastitik Widowatik, SH.
Penulis menempuh pendidikan Taman
Kanak-Kanak di TK Puspa Bangsa (1993-1994), Sekolah dasar di SDN Jatiwarna I (1994-2000), kemudian penulis melanjutkan studi di SLTPN 259 TMII (2000-2003), lalu penulis melanjutkan studi di SMUN 9 Halim Perdana Kusuma, Jakarta Timur (2003-2006). Penulis diterima di Institut Pertanian Bogor melalui jalur SPMB (2006), dan diterima di Fakultas Kedokteran Hewan (2007).
Selama mengikuti perkuliahan, penulis aktif dalam beberapa organisasi intra dan ektra kampus antara lain: Staf pelaksanan Pengmas BEM FKH IPB periode 2007-2008, Staf pelaksana Divisi Satwa akuatik Himpunan Profesi Hewan Kesayangan dan Satwa Akuatik periode 2007-2008, Koordinator Divisi Peran dan Teatrikal LS Steril periode 2007-2008, Divisi Musik Steril periode 2008-2009, Ketua Himpunan Profesi Hewan Kesayangan dan Satwa Akuatik
ix
Taksonomi, Morfologi, dan Siklus Hidup Ikan Mas……... 5
Virus Herpes……….. 8
Morfologi dan Klasifikasi Virus Herpes………. 8
Replikasi Virus Herpes……….. 10
Koi Herpesvirus (KHV)………. 11
Infeksi Penyakit KHV……….... 13
Gejala Klinis………... 13
Diagnosa………. 14
Faktor Muncul Penyakit………... 14
Imunoglobulin-Y (Yolk Immunoglobulin)………... 15
BAHAN DAN METODE………. 17
Tempat dan Waktu Penelitian……….. 17
Alat dan Bahan Penelitian………... 17
Metode Penelitian………. 17
Laboratorium……….. 17
Analisis Data……….... 19
x
SIMPULAN DAN SARAN……….. 31
Simpulan……….. 31
Saran……….... 31
DAFTAR PUSTAKA……….... 32
xi DAFTAR TABEL
Halaman
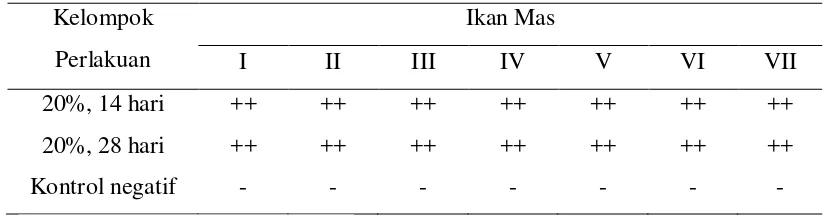
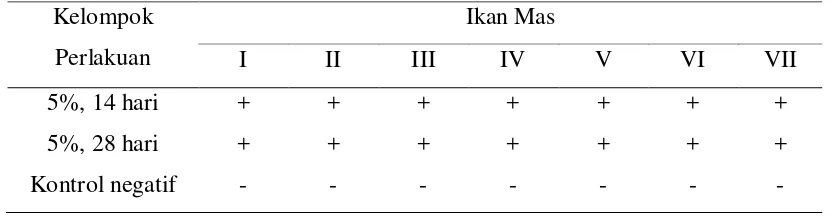
1. Hasil uji serum (rapid test) pada kelompok ikan yang diberikan pelet berimunoglobulin-Y anti KHV selama 14 hari dan 28 hari
perlakuan………... 21
2. Hasil uji serum (rapid test) pada kelompok ikan yang diberikan pelet berimunoglobulin-Y anti KHV selama 14 hari dan 28 hari
perlakuan……….. 23
3. Hasil Uji tantang pada kelompok ikan Mas yang diberikan pelet
berimunoglobulin-Y anti KHV dengan level Ig-Y 5% selama
14 dan 28 hari………. 23
4. Hasil Uji tantang pada kelompok ikan Mas yang diberikan pelet
berimunoglobulin-Y anti KHV dengan level Ig-Y 20%
xii DAFTAR GAMBAR
Halaman
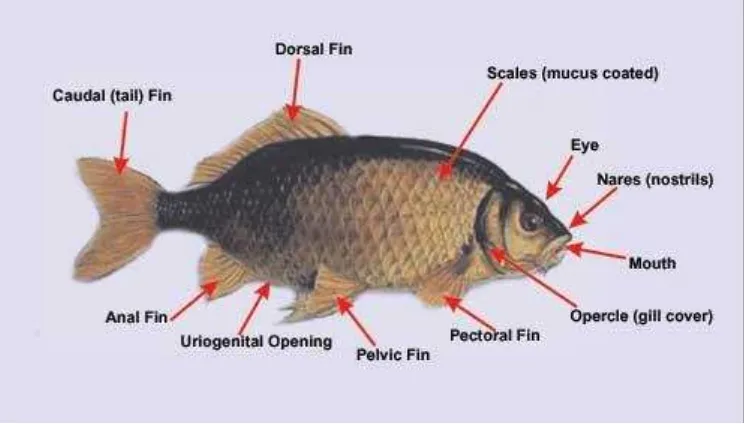
1. Gambar Ikan Mas (Cyprinus carpio carpio)………... 5
2. Gambar Morfologi Ikan Mas (Cyprinus carpio carpio)…………... 6
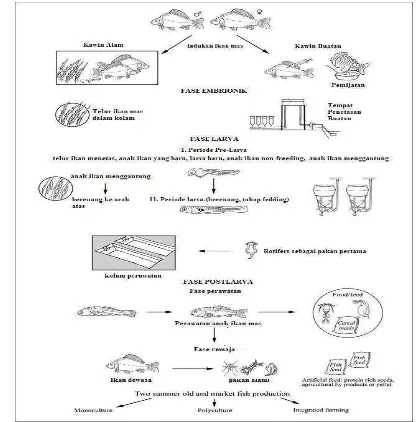
3. Gamabar Siklus Hidup Ikan Mas (Cyprinus carpio carpio)………... 8
4. Gambar Morfologi Virus herpes………... 9
5. Gambar Virus Koi Herpesvirus……….... 11
6. Peta Penyebaran KHV di Indonesia (Koi herpesvirus)………. 11
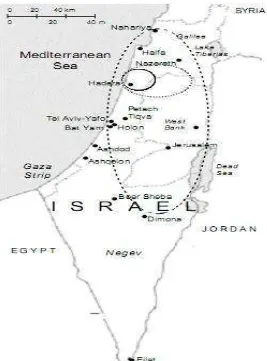
7. Peta Penyebaran kasus Pertama KHV di Israel……….... 12
8. Gambar Hasil Uji Serum Darah Ikan Mas Perlakuan 5% (w/w)……… 20
9. Gambar Hasil Uji Serum Darah Ikan Mas Kontrol Negatif………... 20
10.Gambar Hasil Uji Serum Darah Ikan Mas Perlakuan 20% (w/w)………... 22
11.Gambar Lesio pada Ikan kontrol Negatif setelah dilakukan Uji Tantang………... 25
xiii DAFTAR LAMPIRAN
Halaman
1. Foto kedatagan ikan Mas bebas Penyakit KHV di laboratorium….. 36
2. Foto aklimatisasi ikan Mas dalam akuarium………. 36
3. Foto pensortiran ikan Mas berukuran 50gram/ekor………. 37
4. Foto penyuntikkan KHV ke dalam tubuh ikan Mas……….. 37
1 PENDAHULUAN
Latar Belakang
Budidaya ikan Mas (Cyprinus carpio carpio) atau ikan Koi (Cyprinus
carpio koi) pada saat ini berkembang sangat pesat, karena ikan Mas merupelet
ikan konsumsi yang cukup diminati masyarakat Indonesia dan ikan Koi merupelet ikan yang banyak diminati para pencinta ikan hias. Ikan Mas merupelet komoditas terbesar budidaya ikan air tawar dengan rata-rata produksi 72.000 ton per tahun. Produksi terbesar dihasilkan daerah Jawa Barat.
Pada beberapa tahun belakangan, budidaya ikan Mas ataupun ikan Koi mengalami permasalahan berupa wabah penyakit KHV yang disebabkan oleh virus Koi herpesvirus. Dimana wabah penyakit KHV ini sudah menyebar keberbagai wilayah Indonesia, dari pulau Jawa sampai pulau Sumatera sejak tahun 2002. Penyakit tersebut pertama kali menyerang ikan Koi di Blitar (Jawa Timur) dan kemudian menyerang ikan Mas di jawa Barat. Setelah itu, penyakit KHV tersebut meluas sampai ke Sumatera mulai dari Lubuklinggau (Sumsel), Danau Maninjau (Sumbar), dan Danau Toba (Sumut). Produksi ikan Mas menurun sejak
terjadinya kematian masal pada ikan Mas karena wabah penyakit KHV pada bulan Maret 2002 (DKP, 2004).
Kerugian yang ditimbulkan oleh penyakit KHV ini sangat besar dan meresahkan pembudidaya ikan Mas. Secara kumulatif, kerugian akibat penyakit ini mencapai angka 150 Miliyar rupiah (DKP, 2004).
2 Gejala klinis umum pada ikan sakit, paling sering teramati luka pada
insang, sisik, ginjal, limfa, jantung dan sistem gastrointestinal. Secara visual pada bagian eksternal tubuh, dapat teramati adanya warna sisik yang gelap dan nekrosis insang yang akut dan hemoragik pada dasar sirip punggung, sisip dada, dan sirip anus, sedangkan secara histologi dapat teramati adanya perubahan pada insang berupa kehilangan lamella (Anonim, 2007). Ikan yang terserang penyakit KHV akan menunjukkan gejala nafsu makan menurun, kondisi melemah, gerakan melamban, sering di permukaan air untuk mendapatkan oksigen, insang memucat, memar atau melepuh pada permukaan tubuh, dan sirip geripis. Gejala klinis ini sesuai dengan yang diungkapkan (Mudjiutami et al. 2007a), karena sulit bernapas maka mulut ikan sering terlihat di permukaan air untuk mendapatkan oksigen. Selain itu ikan lebih suka berenang ke arah sumber air. Penyakit KHV menyerang sel-sel epitel dari ikan, terutama pada insang dan kulit. Insang akan mengalami kerusakan, yaitu diawali dengan memucatnya warna insang dan selanjutnya terjadi kerusakan pada lembar insang, jika serangan bertambah parah, insang akan mengalami perdarahan. Ciri lainnya terjadi infeksi sekunder dapat berupa memar atau melepuh ataupun borok pada permukaan kulit dan tubuh akan
memproduksi lendir berlebihan disertai rontoknya sisik. Jika kondisi semakin akut terjadi pendarahan di bagian perut dan pangkal sirip. Jika penyakit KHV ini telah menyerang organ dalam seperti hati dan limpa maka akan mengalami perubahan warna atau nekrosis, dan ginjal akan membengkak (Mudjiutami et al. 2007b). Gejala diatas muncul karena sifat dari virus Koi herpesvirus yang tinggal di dalam
inti sel dan biasanya menimbulkan bercak merah serta kerusakan insang. Selain itu karena penyakit KHV bersifat immunosupresif atau membuat pertahanan tubuh menurun, maka infeksi sekunder berupa luka atau bercak putih dipermukaan tubuh dapat disebabkan oleh infeksi bakteri seperti Aeromonas hydrophila ataupun Flexibacter columnaris.
3 Keputusan Menteri Kelautan dan Perikanan no. 28 tahun 2003 yang melarang
pengiriman ikan Mas dan Koi keluar pulau jawa, serta penghentian impor ikan Mas dan Koi dari luar, dan juga Keputusan Menteri Kelautan dan Perikanan no. 40 tahun 2003 yang menyatakan bahwa pulau Jawa dan Bali merupelet daerah terjangkit dan semua aktifitas pengiriman ikan Mas dan ikan Koi hanya diperbolehkan bila berasal dari negara bebas penyakit KHV dan dilengkapi dengan sertifikat status kesehatan ikan (Rukyani dan Sunarto, 2003 dalam Mulyana 2006).
Pendeteksian penyakit KHV dapat dilakukan dengan berbagai macam cara. Menurut DKP (2004), deteksi penyakit KHV dapat dilakukan dengan melihat gejala klinis dan uji laboratoris. Dimulai dari isolasi virus, dilanjutkan dengan identifikasi histopatologis, mikroskop elektron, dan PCR. Namun metode yang umum dilakukan dibeberapa laboratorium adalah Polymerase Chain Reaction (PCR). Teknik lain yang digunakan adalah uji tantang, uji ini dilakukan dengan mencampurkan ikan terinfeksi dengan ikan sehat dalam kurun waktu tertentu. Teknik rapid test atau uji serum dilakukan untuk menguji langsung antibodi terhadap virus Koi herpesvirus.
Kemajuan teknologi dalam dunia kedokteran hewan memberikan konstribusi pada cara pengobatan yang dilakukan. Pengobatan penyakit yang disebabkan oleh virus dapat dilakukan dengan cara pemberian imunisasi aktif maupun pasif. Imunisasi pasif dapat dilakukan dengan cara pemanfaatan immunoglobulin-Y (Ig-Y) spesifik asal kuning telur ayam untuk penanggulangan
penyakit pada ikan (pelet) yang mengandung immunoglobulin spesifik. Imunoglobulin-Y (Ig-Y) adalah antibodi yang dihasilkan oleh unggas yang diproduksi dari serum dan telur yang memiliki fungsi biologis yang sama dengan immunoglobulin-G (Warr et al. 1995 dalam Ramlah 2008).
Tujuan
4 Manfaat
5 TINJAUAN PUSTAKA
Biologi Ikan Mas
Taksonomi, Morfologi, dan Siklus Hidup Ikan Mas
Ikan Mas memiliki nama latin Cyprinus carpio carpio dan terdaftar dengan nomor 163345 dalam ITIS (integrated Taxonomic Information System). Secara umum ikan Mas dikenal sebagai common carp (English). Ikan Mas juga memiliki nama FAO carpe (French), dan carpe común (Spanish) (Anonim, 2009). Berdasarkan taksonomi, ikan Mas diklasifikasikan sebagai berikut (Saanin, 1984). Kingdom : Animalia (Animal, animals, animaux)
Phylum : Chordata (chordates, cordado, cordés)
Subphylum : Vertebrata (vertebrado, vertebrates, vertebras)
Superclass : Osteichthyes (bony fishes, peixe ósseo, poissons osseux)
Class : Actinopterygii (poisson épineux, poissons à nageoires rayonnées)
Subclass : Neopterygii (neopterygians) Infraclass : Teleostei
Superorder : Ostariophysi
Order : Cypriniformes (cyprins, meuniers, minnows, suckers) Superfamily : Cyprinoidea
Family : Cyprinidae (carpas, carpas y carpitas, carpes, carpes et ménés) Genus : Cyprinus Linnaeus, (common carps)
Species : Cyprinus carpio Linnaeus, (carpa común, carpe, common carp) Subspecies : Cyprinus carpio carpio (Linnaeus, 1758; Saanin, 1984)
6 Secara garis besar tubuh ikan Mas terbagi tiga bagian, yaitu kepala, badan,
dan ekor. Mulut, sepasang mata, hidung, dan tutup insang terletak di kepala. Seluruh bagian tubuh ikan Mas ditutupi dengan sisik yang besar, dan berjenis ctenoid. Pada bagian itu terlihat ada garis linea lateralis, memanjang mulai dari belakang tutup insang sampai pangkal ekor.
Mulut kecil, membelah bagian depan kepala. Sepasang mata bisa dibilang cukup besar terletak di bagian tengah kepala di kiri dan kanan. Sepasang lubang hidung terletak di bagian kepala. Sepasang tutup insang terletak di bagian belakang kepala. Selain itu, pada bagian bawah kepala memiliki dua pasang sungut yang pendek.
Ikan Mas memiliki lima buah sirip, yaitu sirip punggung, sirip dada, sirip perut, sirip dubur, dan sirip ekor. Sirip punggung panjang terletak di bagian punggung. Sirip dada sepasang terletak di belakang tutup insang, dengan satu jari-jari keras, dan yang lainnya berjari-jari-jari-jari lemah. Sirip perut hanya satu terletak pada perut. Sirip dubur hanya terletak di belakang dubur. Sirip ekor juga hanya satu, terletak di belakang, dengan bentuk cagak.
Gambar 2. Morfologi ikan Mas (Cyprinus carpio carpio)(Anonim, 2009)
7 akhirnya bergerigi. Garis rusuknya (linea lateralis atau gurat sisi) tergolong
lengkap, berada di pertengahan tubuh dengan bentuk melintang dari tutup insang sampai ke ujung belakang pangkal ekor (Hardjamulia 1978).
Ikan Mas mudah untuk dibedakan antara jantan dan betina, terlihat apabila sifat kelamin sekunder sudah terlihat jelas dapat diamati dari kelamin luarnya. Ikan Mas jantan, lubang gentalnya terletak dibelakang genital palpila dan tidak menonjol letaknya. Ujung papilla memiliki lubang untuk pengeluara urine dan sperma. Sedangkan ikan Mas betina memiliki lubang genital di depan genital papilla yang terlihat menonjol. Lubang pengeluaran urine dan telur terletak di ujuang papilla. Tubuh ikan Mas betina lebih gemuk dibandingkan dengan ikan Mas jantan pada umur yang sama (Hardjamulia 1978).
Ikan Mas merupelet kelompok hewan ovivar, ikan betina dan ikan jantan tidak memiliki alat kelamin luar. Ikan Mas betina tidak mengeluarkan telur yang bercangkang, namun mengeluarkan ovum yang tidak akan berkembang lebih lanjut apabila tidak dibuahi oleh sperma. Ovum tersebut dikeluarkan dari ovarium melalui oviduk dan dikeluarkan melalui kloaka. Saat akan bertelur, ikan betina mencari tempat yang rimbun oleh tumbuhan air atau diantara bebatuan di dalam
air.
Bersamaan dengan itu, ikan Mas jantan juga mengeluarkan sperma dari testis yang disalurkan melalui saluran urogenital (saluran kemih sekaligus saluran sperma) dan keluar melalui kloaka, sehingga terjadi fertilisasi di dalam air (fertilisasi eksternal). Peristiwa ini terus berlangsung sampai ratusan ovum yang
dibuahi melekat pada tumbuhan air atau pada celah-celah batu.
8 Gambar 3. Siklus hidup ikan Mas (Cyprinus carpio carpio) (Anonim, 2009)
Virus Herpes
Morfologi dan Klasifikasi Virus Herpes
Virus herpes banyak terdapat didalam lingkungan, tipe virus ini mampu
menyerang manusia dan hewan. lebih dari 100 spesies virus herpes saat ini, delapan diantaranya menyerang manusia dan bersifat zoonosis. Virus herpes termasuk dalam tipe virus yang memiliki ukuran besar dibandingkan dengan ukuran virus yang lainnya. Secara morfologi, anggota virus herpes memilki
struktur yang serupa satu dengan yang lainnya.
9 lapisan tegument, dan selubung. Kapsid terdiri atas protein-protein yang tersusun
dalam simetri ikosahedral. Tegumen yang terdapat diantara kapsid dan selubung merupelet massa fibous dengan ketebalan yang bervariasi dan seringkali asimetri. Selubung, jika dilihat dibawah mikroskop elektron tampak seperti susunan tiga lapis. Sebagian selubung berasal dari membran sel yang diinfeksinya, karena dalam selubung terkandung unsur lipid, virus herpes menjadi sensitif terhadap pengaruh detergen dan pelarut lipid lainnya (Daili et al. 2002).
Amplop virus bersifat sedikit pleomorphic (mampu berubah bentuk), berbentuk bola dan memilki diameter 120-200 nm. Pada permukaan amplop yang dapat diproyeksikan dengan banyaknnya duri (spike) yang menyebar merata di seluruh permukaan virus herpes. Nukleokapsid virus herpes dikelilingi oleh kulit yang terdiri dari bahan globular yang sering asimetris. Virus herpes memiliki total panjang genom 120000-220000 nt. Guanine + cytosine ratio 35-75 % (Fenner et al. 1993).
Gambar 4. Morfologi Virus herpes (Anonim, 2010)
10 Replikasi Virus Herpes
Virus herpes bereplikasi dalam metabolisme sel inang dengan menggunakan asam nukleat. Virus yang menempel pada induk semang akan masuk dalam metabolisme induk semang dan keluar dari sel induk semang dengan merusak membran plasma (Sugiri, 1992 dalam Mulyana 2006).
Virus masuk kedalam sel dengan cara fusi glikoprotein selubung virus dengan reseptornya yang terdapat di membran plasma. reseptor dari
cytomegalovirus dapat berupa heparin sulfate, amino peptidase dan glikoprotein
membran plasma lain. Selanjutnya, nukleo kapsid pindah dari sitoplasma ke inti sel. Setelah kapsid rusak, genom virus kemudian dilepaskan didalam inti sel. Genom DNA yang tadinya linear segera berubah menjadi sirkuler. Sebagian gen langsung ditranskripsikan dan produk RNA-nya dipindahkan ke sitoplasma untuk bersama ribosom sel ditranslasikan membentuk klompok protein alfa. Klompok protein ini kemudian pindah ke inti sel untuk memfasilitasi transkripsi gen penyandi protein beta, terjadi transkripsi dan translasi lategenes menjadi protein gamma. Jumlah jenis protein yang disandi lebih dari 50, banyak diantara protein alfa dan beta merupelet enzim dari protein lain yang akan berikatan dengan DNA genom virus (Daili et al. 2002).
Transkripsi DNA virus terjadi sepanjang siklus replikasi didalam sel dengan bantuan enzim RNA polymerase sel dan protein virus lain. Transkripsi dalam bentuk DNA virus selanjutnya dirakit menjadi virion pada membran inti sel. Pelepasan virion dari sitoplasma keluar inti sel terjadi melalui struktur tubuler
atau melalui proses eksositosis vakuola yang berisi virion (Sugiri, 1992 dalam Mulyana 2006).
11 membran sel dan mempunyai sistim metabolisme lengkap dan mandiri yang
mencakup mitokondria dan ribosom (Fenner et al. 1993).
Koi Herpesvirus (KHV)
Koi herpesvirus (KHV) merupelet salah satu penyakit infeksius yang
menyerang spesies Cyprinus carpio Linnaeus yaitu ikan Mas yang disebabkan oleh virus DNA. Penyakit ini pertama kali dilaporkan tahun 1998 dan telah dikonfirmasi terjadi di negara Israel tahun 1999 (Gambar 7). Sejak itu kejadian kasus dilaporkan berlanjut ke Amerika Serikat, Eropa, dan Asia. Kerugian ekonomi yang dialami akibat kematian ikan yang disebabkan oleh penyakit ini di Israel mencapai 4 juta dollar Amerika (OATA, 2001). Gambar 5. Virus Koi Herpesvirus (OATA, 2001)
12 Gambar 7. Peta Penyebaran kasus pertama KHV di Israel (Perelberg et al. 2003).
13 Tulungagung, Blitar, Malang, Kediri, dan Surabaya), Jawa Tengah (Semarang dan
Brebes), Jawa Barat (Subang, Bogor, Bandung, Purwakarta, Cianjur, dan Bekasi), Banten, dan Sumatra (Lampung, Bengkulu, dan Sumatra Selatan).
Virus Koi herpesvirus menyerang golongan ikan Mas (Cyprinus carpio carpioI) dan ikan Koi (Cyprinus carpio koi) dengan tingkat kematian 80%-95%. Penyebaran penyakit ini adalah melalui kontak langsung antar ikan dan ikan yang terjangkit, kontaminasi air, transportasi, dan penanganan seperti pergantian lingkungan dan fluktuasi temperature. Secara morfologi KHV termasuk dalam golongan Herpesvirus yaitu virus yang memiliki bentuk heksagonal dengan diameter 110 nm. Koi herpesvirus pada umunya dapat hidup dan memperbanyak diri pada temperatur antara 18-30oC.
Infeksi Penyakit KHV
Penyakit KHV yang menyerang golongan ikan mas, memiliki tingkat mematikan yang tinggi. Virus ini bersifat laten dan aktif pada kondisi tertentu seperti stess dari transportasi, penanganan serta pergantian lingkungan, dan fluktuasi temperatur (Sunarto et al. 2005 dalam Mulyana 2006). Studi komparatif
menunjukkan bahwa KHV dari Indonesia mempunyai persamaan 99,65% sekuen DNA dengan KHV dari Amerika Serikat (Sunarto et al. 2005 dalam Mulyana 2006).
Koi herpesvirus pada umumnya dapat hidup dan berkembangbiak pada suhu antara 18o-30oC (devanport, 2001). Gilad et al. (2003) mengatakan
pertumbuhan optimal Koi herpesvirus pada sel kultur antara 15o-25oC. Kematian yang tinggi pada ikan terjadi pada temperatur 18o-28oC, namun kematian dan replikasi Koi herpesvirus berkurang pada temperatur rendah.
Gejala Klinis
14 tingkah laku antara lain berenang dipermukaan air, berkumpul dekat aerasi,
gerakan yang kurang terkontrol, dan terlihat tersengal-sengal pada permukaan air. secara histopatologi ditemukan nekrosa pada insang, sisik, sirip, ekor, ginjal, limpa, dan hati. Pada insang terjadi hyperplasia dan hipertropi sel epitel (Mudjiutami et al. 2007a).
Diagnosa
Diagnosa penyakit KHV sampai saat ini umum dilakukan di laboratorium dan balai karantina adalah dengan cara menggunakan teknik Polymerase Chain Reaction (PCR). PCR adalah reaksi berantai suatu primer dari urutan (sequence) DNA dengan bantuan enzim polymerase sehingga terjadi amplifikasi DNA target secra invitro. Prinsip kerja PCR adalah memperbanyak DNA suatu patogen sampai jumlah yang dapat dilihat dengan mata telanjang. Menurut Sunarto et al. (2003) dalam Mulyana (2006) teknik PCR ditemukan pertama kali oleh Dr. Kary tahun 1993.
Diagnosa KHV dapat dilakukan dengan cara isolasi virus pada kultur jaringan. Sel yang digunakan adalah sel fibroblast dari KT (Koi Tail). Supernatan
homogenat dari bagian ikan yang dianggap sakit di inokulasikan dalam KT, kemudian di inkubasi selama 1 jam pada suhu 250C agar KHV menempel pada permukaan KT. Setelah diinokulasikan, virus dapat terdeteksi dengan terlihatnya efek sitopatik yang cepat dalam kultur sel.
Faktor Munculnya Penyakit
15 Virus merupelet parasit obligat yang secara keseluruhan kebutuhan
hidupnya bergantung pada sel inang yang diinfeksi. Energi yang diperoleh virus digunakan untuk reproduksi, sintesa protein, lemak, dan karbohidrat. Umumnya sebagian besar serangan virus patogen berhubungan dengan stress karena kepadatan yang tinggi, penanganan atau kondisi budidaya yang kurang optimum, pencemaran air oleh bahan-bahan kimia, infeksi atau dampak dari ablasi mata air (Sinderman, 1990 dalam depita 2004).
Imunoglobulin-Y (Yolk Imunoglobulin)
Imunogloblin (Ig) merupelet salah satu bagian penyusun dari antibodi yang berperan sebagai substansi pertama untuk diidentifikasi molekul dalam serum yang mampu menetralkan sejumlah mikroorganisme penyebab infeksi. Imunoglobulin dihasilkan oleh sel plasma yang merupelet fase terminal dalam diferensiasi sel B. Imunoglobulin di dalam tubuh terdapat 2 bentuk yang berbeda, yaitu sebagai reseptor permukaan untuk antigen dan sebagai antibodi yang disekresikan kedalam cairan ekstraseluler. Antibodi yang disekresikan dapat berfungsi sebagai adaptor untuk meningkatkan antigen pada struktur binding-sitenya yang spesifik (Wibawan et al. 2003).
Imunoglobulin dibentuk oleh 4 rantai polipeptida dasar yang terdiri dari 2 rantai berat (heavy chain) dan 2 rantai ringan (light chain) yang identik. Setiap rantai ringan terikat pada rantai berat melalui ikatan disulfida (S-S), demikian pula rantai berat satu dengan yang lain dihubungkan dengan ikatan S-S
(Wibawan et al. 2003).
Hingga saat ini dalam tubuh mamalia dikenal 5 kelas immunoglobulin utama, yaitu Ig-G, Ig-M, Ig-A, Ig-D, dan Ig-E. Setiap kelas memiliki rantai berat yang spesifik. Ig-G memiliki rantai gama (γ) sedangkan pada Ig-M adalah mu (µ), pada Imunoglobulin-A rantai beratnya adalah alfa (α), pada Imunoglobulin-D
16 Imunoglobulin-Y memiliki fungsi biologis yang sama dengan
immunoglobulin-G pada mamalia. Imunoglobulin-Y yang terdapat didalam telur merupelet maternal antibodi pada kuning telur ayam akibat adanya transport antibodi dari serum induk ayam pada anaknya. Transport antibodi terjadi dalam dua tahap, yaitu pada tahap pertama Ig-Y ditransportasikan dari serum ke kuning telur sebagaimana transfer plasenta mamalia, kemudian tahap kedua adalah
transfer Ig-Y dari kantung kuning telur ke telur yang berembrio (Gassman et al. 1990).
17 BAHAN DAN METODE
Tempat dan Waktu penelitian
Penelitian ini dilakukan di Laboratorium Kesehatan Satwa Akuatik dan Unit Pelayanan Mikrobiologi Terpadu Bagian Mikrobiologi Medik Departemen
Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan–Institut Pertanian Bogor. Penelitian ini dilakukan selama 8 bulan, mulai bulan November 2009 sampai Juni 2010.
Alat Penelitian
Alat yang dipergunakan dalam penelitian adalah akuarium, aerator, kapas filter, jaring pemisah (sekat), selang aerator, termometer, kawat jaring (penutup akuarium), penggiling pelet, Oven, mikroskop, gelas objek, dan Ice container.
Bahan Penelitian
Bahan yang dipergunakan adalah ikan Mas (Cyprinus carpio carpio) sebanyak 100 ekor dengan ukuran 50 gr/ekor, alat-alat gelas, kuning telur (Ig-Y), pelet ikan komersial, finntip > 200µ l, finntip < 200µ l, eppendorf tube, disposible needle, tuberculin (1,0 ml, 10 ml), virus reference, PCR reagens, blod agar base, nutrient agar, acrylamide, bisacrylamide, kertas HVS A4 80 gram, spidol, marker permanen, tinta printer color, tinta printer black, tinta printer laser hp 6p.
Metode
Di Laboratorium
a. Produksi pellet plus Ig-Y anti KHV: Pembuatan pellet dilakukan dengan memakai pellet pelet komersial yang dihancurkan terlebih dahulu. Kemudian Ig-Y dari kuning telur atau kuning telur yang sudah diketahui titer Ig-Y nya, dicampur secara merata pada pelet tersebut. Lalu dilakukan pembuatan pellet kembali dengan menggunakan mesin giling daging.
18 dosis rendah 5% (w/w) dan dosis tinggi 20% (w/w). Setiap hari, seekor ikan
mendapat pellet plus Ig-Y sesuai dengan bobot badan.
c. Uji coba bebas KHV pada ikan Mas: Ikan yang berasal dari daerah bebas KHV diuji terlebih dahulu apakah masih mengandung virus KHV atau tidak dengan PCR.
d. Uji Serum: Ikan yang telah diberikan pelet perlakuan dosis rendah, dosis tinggi, dan ikan kontrol negatif dilakukan pengambilan serum darah. Serum darah masing-masing kelompok direaksikan langsung dengan KHV.
e. Uji Tantang: Ikan perlakuan dosis rendah, dosis tinggi, dan kontrol negatif di suntikkan secara intramuscular (i.m.) sediaan KHV sebanyak 0,1 ml (>106 virus partikel) (OIE, 2009).
f. Uji PCR: sampel organ dari ikan yang mencirikan lesion terserang KHV di isolasi dan di lakukan uji PCR.
19 HASIL DAN PEMBAHASAN
Pengujian Uji Serum (Rapid Test) Pada Ikan Mas Yang Diberikan Pelet
Berimunoglobulin-Y Anti KHV Dengan Dosis rendah Ig-Y 5% (w/w)
Ikan Mas yang diberikan pelet berimunoglobulin-Y anti KHV selama 14 hari dan 28 hari, dengan dosis rendah Ig-Y 5% (w/w) di uji serum (rapid test) menunjukkan hasil positif. Interaksi yang terjadi pada uji serum antara serum ikan Mas perlakuan dengan sediaan virus Koi herpesvirus terjadi penggumpalan berupa bituran pasir. (Gambar 8). Pada uji serum ikan kontrol negatif tidak terbentuk gumpalan pasir. (Gambar 9).
Gambar 8. Hasil uji serum ikan perlakuan dosis rendah 5% (w/w) dengan virus Koi herpesvirus; [ ] = terjadi reaksi silang berupa akumulasi presipitasi.
20 Pada kelompok ikan dengan perlakuan dosis rendah 5% (w/w) selama 14
hari, tujuh ikan Mas yang telah diberikan perlakuan dilakukan pengambilan darah intravena melalui pembuluh darah di ekor. Serum yang diperoleh langsung dilakukan pengujian dengan KHV dan menunjukkan hasil positif. Untuk kelompok ikan dengan perlakuan dosis rendah 5% (w/w) selama 28 hari
menunjukkan hasil yang sama dengan kelompok pertama.
Pada kelompok kontrol negatif yang tidak diberikan perlakuan seperti ikan yang diberikan pelet berimunoglobulin-Y anti KHV menunjukkan hasil negatif terhadap uji serum (rapid test). Tidak terbentukknya gumpalan pasir halus pada mengindikasikan tidak ada reaksi silang antara serum ikan kontrol negatif dengan KHV.
Tabel 1. Hasil uji serum (rapid test) pada kelompok ikan yang diberikan pelet berimunoglobulin-Y anti KHV selama 14 hari dan 28 hari perlakuan.
Kelompok
Keterangan : -)Negatif: Tidak terbentuk pasir halus
+)Positif Sedang: Terjadi penggumpalan/pasir halus ++)Positif Kuat
Pengujian Uji Serum (Rapid Test) Pada Ikan Mas Yang Diberikan Pelet
Berimunoglobulin-Y Anti KHV Dengan Dosis tinggi Ig-Y 20% (w/w)
21 Gambar 10. Hasil uji serum ikan perlakuan dosis tinggi 20% (w/w) dengan virus Koi herpesvirus; [ ] = terjadi reaksi silang dengan terbentuknya akumulasi presipitasi.
Pada kelompok ikan dengan perlakuan dosis tinggi 20% (w/w) selama 14 hari, tujuh ikan Mas yang telah diberikan perlakuan dilakukan pengambilan darah intravena melalui pembuluh darah di ekor. Serum yang diperoleh langsung dilakukan pengujian dengan KHV dan menunjukkan hasil positif. Untuk kelompok ikan dengan perlakuan dosis tinggi 20% (w/w) selama 28 hari menunjukkan hasil yang sama dengan kelompok pertama.
22 Tabel 2. Hasil uji serum (rapid test) pada kelompok ikan yang diberikan pelet
berimunoglobulin-Y anti KHV selama 14 hari dan 28 hari perlakuan. Kelompok
Keterangan -)Negatif: Tidak terbentuk pasir halus
+)Positif Sedang: Terjadi penggumpalan/pasir halus ++)Positif Kuat
Uji Tantang Pada Ikan Mas Yang Diberikan Pelet Berimunoglobulin-Y Anti
KHV Dengan Dosis rendah Ig-Y 5% (w/w)Dengan Rentang Suhu Ligkungan
28-32oC
Ikan mas yang diberikan perlakuan pelet berupa pelet yang berimunoglobulin-Y anti KHV dengan dosis rendah Ig-Y 5% (w/w) 14 dan 28 hari di uji tantang. Hasil dari uji tantang menunjukkan bahwa kelompok ikan mas yang diberi perlakuan berupa pelet berimunoglobulin-Y anti KHV tidak menunjukkan gejala terinfeksi. Hal ini dapat dilihat dari tingkat keberhasilan hidup ikan mas perlakuan setelah dilakukan uji tantang. Pada ikan kontrol negatif yang di uji tantang mengalami kematian serempak, dengan menunjukkan gejala klinis terserang KHV.
Keterangan - : tidak terjadi kematian x : tidak ada yang hidup
23 dan kedua tidak terlihat timbulnya gejala klinis ataupun kematian. Pada
pengamatan mulai hari ke-1 sampai dengan ke-7, kelompok ikan mas perlakuan yang berjumlah tujuh ekor masih tetap hidup. Pada kelompok ikan kontrol negatif, setelah dilakukan uji tantang mulai timbul gejala klinis pada hari ketiga. Ikan kontrol negatif terjadi penurunan aktifitas dan lebih sering dipermukaan air atau didekat airator untuk bernapas. Pada hari kelima ikan kontrol negatif mengalami kematian secara serempak dan menujukkan lesion akibat infeksi KHV. (Gambar 11).
Uji Tantang Pada Ikan Mas Yang Diberikan Pelet Berimunoglobulin-Y Anti
KHV Dengan Dosis tinggi Ig-Y 20% (w/w)Dengan Rentang Suhu Ligkungan
28-32oC
Ikan mas yang diberikan perlakuan pelet berupa pelet yang berimunoglobulin-Y anti KHV dengan dosis Ig-Y 20% (w/w) 14 dan 28 hari di uji tantang. Hasil dari uji tantang menunjukkan bahwa kelompok ikan mas yang diberi perlakuan berupa pelet berimunoglobulin-Y anti KHV tidak menunjukkan gejala terinfeksi. Hal ini dapat dilihat dari tingkat keberhasilan hidup ikan mas
perlakuan setelah dilakukan uji tantang. Sedangkan pada ikan kontrol negatif yang dilakukan uji tantang mengalami kematian serempak, dengan menunjukkan gejala klinis terserang KHV.
Keterangan - : tidak terjadi kematian x : tidak ada yang hidup
24 pengamatan mulai hari ke-1 sampai dengan ke-7, kelompok ikan mas perlakuan
yang berjumlah tujuh ekor masih tetap hidup. Pada kelompok ikan kontrol negatif setelah dilakukan uji tantang mulai timbul gejala klinis pada hari ketiga. Ikan kontrol negatif terjadi penurunan aktifitas dan lebih sering dipermukaan air atau didekat airator untuk bernapas. Pada hari kelima ikan kontrol negatif mengalami kematian secara serempak dan menujukkan lesion akibat infeksi virus KHV. (Gambar 11).
Gambar 11. Kerusakan jaringan pada ikan kontrol negatif yang terinfeksi KHV. A: Pemucatan insang dan terjadi nekrosis.
B: Peradangan pada pectoral vin. C: Peradangan pada pelvic vin.
Uji PCR (Polymerase Chain Reaction) Pada Insang Ikan
Pada uji laboratoris dengan teknik PCR menunjukkan hasil yang negatif.
25 Gambar 12. Pencitraan PCR (Poly Chain Reaction) pada sampel insang ikan yang terinfeksi KHV tidak terbentuk pita putih seperti pada sampel kontrol positif.
Pembahasan
Pengujian serum (rapid test) pada kelompok ikan percobaan pertama, dimana ikan mendapatkan perlakuan pelet berimunoglobulin-Y anti KHV dengan
26 penggumpalan halus seperti pasir berwarna putih (Wibawan et al. 2003). OIE (2009) menyebutkan bahwa, pada level rendah antibodi KHV dalam serum ikan sudah cukup untuk terjadinya reaksi silang dengan antigen. Antibodi yang
terkadung di dalam serum kelompok ikan perlakuan berinteraksi secara langsung dengan antigen KHV. Sifat antibodi yang memiliki kemampuan spesifik untuk mengikat determinan site antigen atau yang disebut determinan antigenik menyebabkan terjadinya ikatan, kumpulan ikatan antara antibodi dan antigen
menyebabkan timbulnya gumpalan pasir halus pada dasar object glass. Antigen sendiri merupelet zat kimia atau zat asing yang masuk kedalam tubuh dan memungkingkan untuk merangsang terbentuknya antibodi. Antigen memiliki struktur tiga dimensi dengan dua atau lebih determinan site. Sedangkan determinan site sendiri merupelet bagian dari antigen yang dapat melekat pada bagian sisi pengikat pada antibodi. Antigen akan menimbulkan kerusakan atau efek jika antigen dapat larut dalam tubuh. Oleh karena itu, kerja antibodi untuk dapat menetralisir antigen adalah dengan membuat antigen tersebut menjadi tidak larut dalam tubuh. Fungsi antibodi dalam menetralisir antigen adalah sebagai presipitan yang mengendapkan antigen, sebagai aglutinin yang menggumpalkan antigen, sebagai inhibin yang menghambat perlekatan antigen dan sebagai opsonin yang melapisi antigen sehingga menjadi lebih mudah untuk difagositosis oleh sel-sel fagosit (Wibawan et al. 2003).
Pada pengujian serum (rapid test), dua kelompok ikan perlakuan dengan dosis tinggi Ig-Y 20% (w/w) dalam pelet menunjukkan hasil positif kuat. Hasil dari pengamatan uji serum ini memperlihatkan terbentuknya butiran pasir halus
27 Imunoglobulin-Y adalah suatu protein, sehingga dalam saluran pencernaan Ig-Y berpotensi mengalami denaturasi oleh suhu, pH dan enzim protease (Rawendra, 2005). Akita et al. dalam Rawendra (2005) menyebutkan bahwa Ig-Y
yang telah terdenaturasi akan menghasilkan fragmen-fragmen yang Masih memiliki kemampuan mengikat antigen dan mampu melakukan aktivitas netralisasi antigen. Fragmen-fragmen yang memiliki kemampuan untuk
melakukan aktivitas netralisasi antigen adalah fragmen Fab’ dan Fab’2. Oleh sebab itu pada serum ikan yang mendapatkan perlakuan pelet berimunoglobulin-Y anti KHV membuktikan adanya antibodi terhadap antigen KHV.
Dosis efektif Ig-Y yang dapat membentuk antibodi KHV yaitu pada dosis rendah 5% (w/w) immunoglobulin-Y anti KHV. Alasan dari pernyataan tersebut adalah karena pada uji serum (rapid test) sudah terbentuknya gumpalan seperti pasir halus pada dasar object glass, dimana endapan tersebut hasil interaksi antara antibodi dengan antigen KHV.
Percobaan kedua yaitu uji tantang terhadap kelompok ikan Mas pertama, dimana ikan Mas mendapatkan perlakuan pelet berimunoglobulin-Y anti KHV dengan dosis rendah Ig-Y 5% (w/w) selama 14 dan 28 hari menunjukkan tingkat ketahanan hidup yang baik. Setiap ikan Mas perlakuan disuntikkan dengan antigen KHV secara intramuskular (i.m.) sebanyak 0,1 ml (>106 virus partikel) (OIE, 2009). Aklimatisasi dilakukan selama masa inkubasi ikan Mas yang diberi perlakuan. Pada kelompok ikan Mas kedua yang mendapatkan pelet berimunoglobulin-Y anti KHV dengan dosis tinggi 20% (w/w) juga menunjukkan tingkat ketahanan hidup yang baik. Seluruh ikan perlakuan yang diuji tantang
mampu bertahan hidup selama masa inkubasi, yaitu tujuh hari.
28 karenakan terlalu tebalnya ekstrasi dari sampel insang. Ekstraksi sampel insang yang tidak sesuai akan menyebabkan kegagalan disetiap tahapan PCR. Tahap peleburan pada PCR menyebabkan terputusnya ikatan hidrogen DNA dan DNA
menjadi berkas tunggal, pada tahap ini apabila DNA target tidak ada akan menyebabkan tahap PCR yang berikutnya menjadi gagal. Tidak terdapatnya DNA target akan mempengaruhi tahap elongasi dan pada pencitraan PCR tidak terbentuk pita putih.
Way et al. (2004) mengatakan bahwa pada dasarnya dalam uji PCR,
jaringan segar dari ikan yang hampir mati dan menunjukkan gejala klinis terserang KHV sangat membantu dalam penyelidikan. Namun, isolasi virus dari jaringan yang beku kurang dapat diandalkan, ketika menggunakan ikan yang hampir mati atau baru mati suatu saat terjadi kegagalan dalam isolasi virus (Hedrick et al. 2000).
Kemampuan hidup ikan perlakuan terhadap antigen KHV yang disuntikkan kedalam tubuh (i.m.) tidak terlepas dari antibodi yang sudah terbentuk didalam tubuh ikan. Sugiri (1992) dalam Mulyana (2006) menyebutkan bahwa virus herpes bereplikasi dalam metabolisme sel inang dengan menggunakan asam nukleat. Virus yang menempel pada induk semang akan masuk dalam metabolisme induk semang dan keluar dari sel induk semang dengan merusak
membran plasma. Daili et al. (2002) menyebutkan virus masuk ke dalam sel dengan cara fusi glikoprotein selubung virus dengan reseptornya yang terdapat di membran plasma. Hal ini tidak terjadi pada ikan perlakuan karena di dalam serum darah ikan Mas mengandung antibodi KHV, antibodi yang beredar dalam darah
secara spontan berinteraksi dengan antigen KHV. Antibodi mengikat antigen dan mencegah terjadinya penetrasi virus ke dalam plasma sel tubuh ikan.
29 titik kerusakan pada sisik dan timbul kemerahan pada pangkal-pangkal sirip. Gejala klinis terserang KHV ini sesuai dengan pernyataan Mudjiutami et al. (2007b). Hari kelima pengamatan, ikan kontrol mengalami kematian serempak
dengan penampelet pada daerah insang yang memutih dan timbulnya kerusakan (necrosis).
Hasil dari pengamatan memperlihatkan bahwa dosis efektif dalam pemberian immunoglobulin-Y anti KHV adalah dosis rendah 5% (w/w). Alasan
30 KESIMPULAN DAN SARAN
Kesimpulan
Hasil penelitian menunjukkan bahwa imunisasi pasif Ig-Y anti KHV dengan cara pemberian pelet mampu menekan infeksi penyakit KHV. Dengan meningkatnya kekebalan ikan Mas terhadap KHV, maka dapat menekan angka
kematian ikan Mas dan kerugian bagi petani ikan. Dosis efektif Ig-Y yang dapat mencegah terjadinya infeksi akibat virus Koi herpesvirus yaitu pada pelet berimunoglobulin-Y dengan dosis rendah 5% (w/w) selama 14 dan 28 hari.
Saran
31 DAFTAR PUSTAKA
Amri K, Khairuman. 2008. Ciri Morfologi Ikan Mas. Jurnal Agro Media
Pustaka.
Anonim. 2007. Koi Herves Virus (KHV): Penyebab Kematian Massal pada Ikan Mas dan Koi. [terhubung berkala]. http://indoorcommunity
.wordpress.com /2007/ 07/24/
Koi-herves-virus-khv-penyebab-kematian-massal-pada-ikan-mas-dan-Koi/. [7 January 2010].
Anonim. 2009. Taksonomi ikan mas. [terhubung berkala].
http://id.wikipedia.org/wiki/Ikan mas. [29 Juni 2010].
Anonim. 2010. Aquatic Animal Diseases Significant to Asia–Pacific: Diseases of
finfish: Viral diseases—Koi herpesvirus disease. [terhubung berkala].
http://library.enaca.org/Health/FieldGuide/html/fv050ikh.htm. [31 Agustus 2010].
Daili SF dan Makes WI 2002. Infeksi Virus Herpes. Kelompok Studi Virus Herpes. Jakarta: Fakultas Kedokteran, Universitas Indonesia.
[DKP] Departemen Kelautan dan Perikanan. 2004. Petunjuk pengendalian
penyakit insang membusuk. [terhubung berkala]. http://www
dkp.go.idcontent. php?c=1631. [23 Januari 2010].
Depita F. 2004. Peran Artemia sp dalam Penularan White Spot Syndrome Virus (WSSV) pada udang windu (Penaeus monodon Fabr.) dengan berbagai perlakuan [Skripsi]. Program Studi Teknologi dan Manajemen Akuakultur. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu
Kelautan. Institut Pertanian Bogor. Bogor.
Davenport K. 2001. Koi Herpesvirus (KHV). United Kingdom: Ornamental Aquatic Trade Assiciation.
32 Gilad O, Yun SMA, Adkison KW, Willits NH, Bercovier H, Hedrick RP. 2003.
Molecular comparison of isolates of an emerging fish pathogen, Koi herpesvirus, and the effect of water temperature on mortality of
experimentally infected Koi. J. Gen Virol, 2661-2667;
DOI 10.1099/vir.0.19323-0.
Hardjamulia A. 1978. Budidaya perikanan, budidaya ikan mas, ikan nila, ikan jambal, ikan mola, dan ikan jambal. Bogor: SPP-SUPM.
Hedrick RP
,
Gilad O, Yun S, Spangenberg JV, Marty GD, Nordhausen RW,Kebus MJ, Bercovier H, and Eldar A. 2000. A herpesvirus associated with Mass mortality of juvenile and adult Koi, a strain of common carp. Journal of Aquatic Animal Health, 12:44-57.
Mudjiutami E, Ciptoroso, Zainun Z, Sumarjo, Rahmat. 2007a. Pemanfaatan Immunostimulan Untuk Pengendalian Penyakit Pada Ikan Mas. Jurnal Budidaya Air Tawar Vol. 4, 1:1-9.
Mudjiutami E, Ciptoroso, Zainun Z. 2007b. Uji Toleransi Berbagai Strain Ikan Mas Terhadap KHV. Jurnal Budidaya Air Tawar Vol. 4, 2:37-41.
Mulyana A. 2006. Titer Dosis Infektif Koi Herpesvirus (KHV) Dengan Menggunakan Kultur Sel KT-2 (Koi Tail no. 2). [Skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Mustopa AZ. 2008. Telur Anti Diare. http:/forismafkunair. wordpress.com / 2008/07/01/potensi-immunoglobulin-y-igy-sebagai-terapi-imunitas-pasif [28 Oktober 2010].
OATA. 2001. Koi Herpesvirus (KHV). [terhubung berkala]. http:
www.ornamentalfish.org. [13 Juli 2010].
[OIE] World Organisation For Animal Health. 2009. Koi Herpesvirus Disease. Manual of Diagnostic Test for Aquatic Animals. 2:241-246.
Pasaribu FH, Rawendra R. Wibawan IWT, Poerwanto SB. 2005. Penggunaan Telur Ayam yang mengandung Imunoglobulin-Y anti Enteropatogenik Escherichia coli K.1.1. Untuk mencegah Diare. Laporan Penelitian Hibah Bersaing Perguruan Tinggi XII. LPPM-IPB.
33
Cyprinus Carpio In Israel. The Israeli Journal of Aquaculture – Bamidgeh
55(1), 5-12.
Ramlah. 2008. Purifikasi dan Karakteristik immunoglobulin Y (IgY) Spesifik
KHV dari Serum Ayam Single Comb Brown Leghorn [Skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Rawendra R. 2005. Imunoglobulin Y (Ig-Y) Fraksi Larut Air (WSF) Kuning Telur Kering Beku Anti Enteropathogenic Escherisia coli (EPEC)
[Disertasi]. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor. Saanin H. 1984. Taksonomi dan kuntji Identifikasi Ikan. Binatjipta. Bogor.
Sunarto A. 2003. Teknik Diagnosa Cepat Penyakit Ikan Karantina Dengan Metoda PCR. Pusat Karantina Ikan. Departemen Kelautan dan Perikanan. Way K, LeDeuff RM, Stone DM, Denham KL, St-Hilaire S. 2004. Koi
Herpesvirus: Diagnostic and Research at CEFAS Weymouth Laboratory 2000-2003. International Koi Herpesvirus Workshop. London.
Wibawan IWT, Retno DS, Chandramaya SD dan Tiok BT. 2003. Diktat Imunologi. Laboratorium Imunologi Departemen Kitwan. Fakultas Kedokteran Hewan. Institut Pertanian Bogor. Bogor.
34
LAMPIRAN
35 Lampiran 1. Kedatangan ikan Mas bebas Penyakit KHV di laboratorium
36 Lampiran 3. Pensortiran ikan Mas berukuran 50gram/ekor
1 PENDAHULUAN
Latar Belakang
Budidaya ikan Mas (Cyprinus carpio carpio) atau ikan Koi (Cyprinus
carpio koi) pada saat ini berkembang sangat pesat, karena ikan Mas merupelet
ikan konsumsi yang cukup diminati masyarakat Indonesia dan ikan Koi merupelet ikan yang banyak diminati para pencinta ikan hias. Ikan Mas merupelet komoditas terbesar budidaya ikan air tawar dengan rata-rata produksi 72.000 ton per tahun. Produksi terbesar dihasilkan daerah Jawa Barat.
Pada beberapa tahun belakangan, budidaya ikan Mas ataupun ikan Koi mengalami permasalahan berupa wabah penyakit KHV yang disebabkan oleh virus Koi herpesvirus. Dimana wabah penyakit KHV ini sudah menyebar keberbagai wilayah Indonesia, dari pulau Jawa sampai pulau Sumatera sejak tahun 2002. Penyakit tersebut pertama kali menyerang ikan Koi di Blitar (Jawa Timur) dan kemudian menyerang ikan Mas di jawa Barat. Setelah itu, penyakit KHV tersebut meluas sampai ke Sumatera mulai dari Lubuklinggau (Sumsel), Danau Maninjau (Sumbar), dan Danau Toba (Sumut). Produksi ikan Mas menurun sejak
terjadinya kematian masal pada ikan Mas karena wabah penyakit KHV pada bulan Maret 2002 (DKP, 2004).
Kerugian yang ditimbulkan oleh penyakit KHV ini sangat besar dan meresahkan pembudidaya ikan Mas. Secara kumulatif, kerugian akibat penyakit ini mencapai angka 150 Miliyar rupiah (DKP, 2004).
2 Gejala klinis umum pada ikan sakit, paling sering teramati luka pada
insang, sisik, ginjal, limfa, jantung dan sistem gastrointestinal. Secara visual pada bagian eksternal tubuh, dapat teramati adanya warna sisik yang gelap dan nekrosis insang yang akut dan hemoragik pada dasar sirip punggung, sisip dada, dan sirip anus, sedangkan secara histologi dapat teramati adanya perubahan pada insang berupa kehilangan lamella (Anonim, 2007). Ikan yang terserang penyakit KHV akan menunjukkan gejala nafsu makan menurun, kondisi melemah, gerakan melamban, sering di permukaan air untuk mendapatkan oksigen, insang memucat, memar atau melepuh pada permukaan tubuh, dan sirip geripis. Gejala klinis ini sesuai dengan yang diungkapkan (Mudjiutami et al. 2007a), karena sulit bernapas maka mulut ikan sering terlihat di permukaan air untuk mendapatkan oksigen. Selain itu ikan lebih suka berenang ke arah sumber air. Penyakit KHV menyerang sel-sel epitel dari ikan, terutama pada insang dan kulit. Insang akan mengalami kerusakan, yaitu diawali dengan memucatnya warna insang dan selanjutnya terjadi kerusakan pada lembar insang, jika serangan bertambah parah, insang akan mengalami perdarahan. Ciri lainnya terjadi infeksi sekunder dapat berupa memar atau melepuh ataupun borok pada permukaan kulit dan tubuh akan
memproduksi lendir berlebihan disertai rontoknya sisik. Jika kondisi semakin akut terjadi pendarahan di bagian perut dan pangkal sirip. Jika penyakit KHV ini telah menyerang organ dalam seperti hati dan limpa maka akan mengalami perubahan warna atau nekrosis, dan ginjal akan membengkak (Mudjiutami et al. 2007b). Gejala diatas muncul karena sifat dari virus Koi herpesvirus yang tinggal di dalam
inti sel dan biasanya menimbulkan bercak merah serta kerusakan insang. Selain itu karena penyakit KHV bersifat immunosupresif atau membuat pertahanan tubuh menurun, maka infeksi sekunder berupa luka atau bercak putih dipermukaan tubuh dapat disebabkan oleh infeksi bakteri seperti Aeromonas hydrophila ataupun Flexibacter columnaris.
3 Keputusan Menteri Kelautan dan Perikanan no. 28 tahun 2003 yang melarang
pengiriman ikan Mas dan Koi keluar pulau jawa, serta penghentian impor ikan Mas dan Koi dari luar, dan juga Keputusan Menteri Kelautan dan Perikanan no. 40 tahun 2003 yang menyatakan bahwa pulau Jawa dan Bali merupelet daerah terjangkit dan semua aktifitas pengiriman ikan Mas dan ikan Koi hanya diperbolehkan bila berasal dari negara bebas penyakit KHV dan dilengkapi dengan sertifikat status kesehatan ikan (Rukyani dan Sunarto, 2003 dalam Mulyana 2006).
Pendeteksian penyakit KHV dapat dilakukan dengan berbagai macam cara. Menurut DKP (2004), deteksi penyakit KHV dapat dilakukan dengan melihat gejala klinis dan uji laboratoris. Dimulai dari isolasi virus, dilanjutkan dengan identifikasi histopatologis, mikroskop elektron, dan PCR. Namun metode yang umum dilakukan dibeberapa laboratorium adalah Polymerase Chain Reaction (PCR). Teknik lain yang digunakan adalah uji tantang, uji ini dilakukan dengan mencampurkan ikan terinfeksi dengan ikan sehat dalam kurun waktu tertentu. Teknik rapid test atau uji serum dilakukan untuk menguji langsung antibodi terhadap virus Koi herpesvirus.
Kemajuan teknologi dalam dunia kedokteran hewan memberikan konstribusi pada cara pengobatan yang dilakukan. Pengobatan penyakit yang disebabkan oleh virus dapat dilakukan dengan cara pemberian imunisasi aktif maupun pasif. Imunisasi pasif dapat dilakukan dengan cara pemanfaatan immunoglobulin-Y (Ig-Y) spesifik asal kuning telur ayam untuk penanggulangan
penyakit pada ikan (pelet) yang mengandung immunoglobulin spesifik. Imunoglobulin-Y (Ig-Y) adalah antibodi yang dihasilkan oleh unggas yang diproduksi dari serum dan telur yang memiliki fungsi biologis yang sama dengan immunoglobulin-G (Warr et al. 1995 dalam Ramlah 2008).
Tujuan
4 Manfaat
5 TINJAUAN PUSTAKA
Biologi Ikan Mas
Taksonomi, Morfologi, dan Siklus Hidup Ikan Mas
Ikan Mas memiliki nama latin Cyprinus carpio carpio dan terdaftar dengan nomor 163345 dalam ITIS (integrated Taxonomic Information System). Secara umum ikan Mas dikenal sebagai common carp (English). Ikan Mas juga memiliki nama FAO carpe (French), dan carpe común (Spanish) (Anonim, 2009). Berdasarkan taksonomi, ikan Mas diklasifikasikan sebagai berikut (Saanin, 1984). Kingdom : Animalia (Animal, animals, animaux)
Phylum : Chordata (chordates, cordado, cordés)
Subphylum : Vertebrata (vertebrado, vertebrates, vertebras)
Superclass : Osteichthyes (bony fishes, peixe ósseo, poissons osseux)
Class : Actinopterygii (poisson épineux, poissons à nageoires rayonnées)
Subclass : Neopterygii (neopterygians) Infraclass : Teleostei
Superorder : Ostariophysi
Order : Cypriniformes (cyprins, meuniers, minnows, suckers) Superfamily : Cyprinoidea
Family : Cyprinidae (carpas, carpas y carpitas, carpes, carpes et ménés) Genus : Cyprinus Linnaeus, (common carps)
Species : Cyprinus carpio Linnaeus, (carpa común, carpe, common carp) Subspecies : Cyprinus carpio carpio (Linnaeus, 1758; Saanin, 1984)
6 Secara garis besar tubuh ikan Mas terbagi tiga bagian, yaitu kepala, badan,
dan ekor. Mulut, sepasang mata, hidung, dan tutup insang terletak di kepala. Seluruh bagian tubuh ikan Mas ditutupi dengan sisik yang besar, dan berjenis ctenoid. Pada bagian itu terlihat ada garis linea lateralis, memanjang mulai dari belakang tutup insang sampai pangkal ekor.
Mulut kecil, membelah bagian depan kepala. Sepasang mata bisa dibilang cukup besar terletak di bagian tengah kepala di kiri dan kanan. Sepasang lubang hidung terletak di bagian kepala. Sepasang tutup insang terletak di bagian belakang kepala. Selain itu, pada bagian bawah kepala memiliki dua pasang sungut yang pendek.
Ikan Mas memiliki lima buah sirip, yaitu sirip punggung, sirip dada, sirip perut, sirip dubur, dan sirip ekor. Sirip punggung panjang terletak di bagian punggung. Sirip dada sepasang terletak di belakang tutup insang, dengan satu jari-jari keras, dan yang lainnya berjari-jari-jari-jari lemah. Sirip perut hanya satu terletak pada perut. Sirip dubur hanya terletak di belakang dubur. Sirip ekor juga hanya satu, terletak di belakang, dengan bentuk cagak.
Gambar 2. Morfologi ikan Mas (Cyprinus carpio carpio)(Anonim, 2009)
7 akhirnya bergerigi. Garis rusuknya (linea lateralis atau gurat sisi) tergolong
lengkap, berada di pertengahan tubuh dengan bentuk melintang dari tutup insang sampai ke ujung belakang pangkal ekor (Hardjamulia 1978).
Ikan Mas mudah untuk dibedakan antara jantan dan betina, terlihat apabila sifat kelamin sekunder sudah terlihat jelas dapat diamati dari kelamin luarnya. Ikan Mas jantan, lubang gentalnya terletak dibelakang genital palpila dan tidak menonjol letaknya. Ujung papilla memiliki lubang untuk pengeluara urine dan sperma. Sedangkan ikan Mas betina memiliki lubang genital di depan genital papilla yang terlihat menonjol. Lubang pengeluaran urine dan telur terletak di ujuang papilla. Tubuh ikan Mas betina lebih gemuk dibandingkan dengan ikan Mas jantan pada umur yang sama (Hardjamulia 1978).
Ikan Mas merupelet kelompok hewan ovivar, ikan betina dan ikan jantan tidak memiliki alat kelamin luar. Ikan Mas betina tidak mengeluarkan telur yang bercangkang, namun mengeluarkan ovum yang tidak akan berkembang lebih lanjut apabila tidak dibuahi oleh sperma. Ovum tersebut dikeluarkan dari ovarium melalui oviduk dan dikeluarkan melalui kloaka. Saat akan bertelur, ikan betina mencari tempat yang rimbun oleh tumbuhan air atau diantara bebatuan di dalam
air.
Bersamaan dengan itu, ikan Mas jantan juga mengeluarkan sperma dari testis yang disalurkan melalui saluran urogenital (saluran kemih sekaligus saluran sperma) dan keluar melalui kloaka, sehingga terjadi fertilisasi di dalam air (fertilisasi eksternal). Peristiwa ini terus berlangsung sampai ratusan ovum yang
dibuahi melekat pada tumbuhan air atau pada celah-celah batu.
8 Gambar 3. Siklus hidup ikan Mas (Cyprinus carpio carpio) (Anonim, 2009)
Virus Herpes
Morfologi dan Klasifikasi Virus Herpes
Virus herpes banyak terdapat didalam lingkungan, tipe virus ini mampu
menyerang manusia dan hewan. lebih dari 100 spesies virus herpes saat ini, delapan diantaranya menyerang manusia dan bersifat zoonosis. Virus herpes termasuk dalam tipe virus yang memiliki ukuran besar dibandingkan dengan ukuran virus yang lainnya. Secara morfologi, anggota virus herpes memilki
struktur yang serupa satu dengan yang lainnya.
9 lapisan tegument, dan selubung. Kapsid terdiri atas protein-protein yang tersusun
dalam simetri ikosahedral. Tegumen yang terdapat diantara kapsid dan selubung merupelet massa fibous dengan ketebalan yang bervariasi dan seringkali asimetri. Selubung, jika dilihat dibawah mikroskop elektron tampak seperti susunan tiga lapis. Sebagian selubung berasal dari membran sel yang diinfeksinya, karena dalam selubung terkandung unsur lipid, virus herpes menjadi sensitif terhadap pengaruh detergen dan pelarut lipid lainnya (Daili et al. 2002).
Amplop virus bersifat sedikit pleomorphic (mampu berubah bentuk), berbentuk bola dan memilki diameter 120-200 nm. Pada permukaan amplop yang dapat diproyeksikan dengan banyaknnya duri (spike) yang menyebar merata di seluruh permukaan virus herpes. Nukleokapsid virus herpes dikelilingi oleh kulit yang terdiri dari bahan globular yang sering asimetris. Virus herpes memiliki total panjang genom 120000-220000 nt. Guanine + cytosine ratio 35-75 % (Fenner et al. 1993).
Gambar 4. Morfologi Virus herpes (Anonim, 2010)
10 Replikasi Virus Herpes
Virus herpes bereplikasi dalam metabolisme sel inang dengan menggunakan asam nukleat. Virus yang menempel pada induk semang akan masuk dalam metabolisme induk semang dan keluar dari sel induk semang dengan merusak membran plasma (Sugiri, 1992 dalam Mulyana 2006).
Virus masuk kedalam sel dengan cara fusi glikoprotein selubung virus dengan reseptornya yang terdapat di membran plasma. reseptor dari
cytomegalovirus dapat berupa heparin sulfate, amino peptidase dan glikoprotein
membran plasma lain. Selanjutnya, nukleo kapsid pindah dari sitoplasma ke inti sel. Setelah kapsid rusak, genom virus kemudian dilepaskan didalam inti sel. Genom DNA yang tadinya linear segera berubah menjadi sirkuler. Sebagian gen langsung ditranskripsikan dan produk RNA-nya dipindahkan ke sitoplasma untuk bersama ribosom sel ditranslasikan membentuk klompok protein alfa. Klompok protein ini kemudian pindah ke inti sel untuk memfasilitasi transkripsi gen penyandi protein beta, terjadi transkripsi dan translasi lategenes menjadi protein gamma. Jumlah jenis protein yang disandi lebih dari 50, banyak diantara protein alfa dan beta merupelet enzim dari protein lain yang akan berikatan dengan DNA genom virus (Daili et al. 2002).
Transkripsi DNA virus terjadi sepanjang siklus replikasi didalam sel dengan bantuan enzim RNA polymerase sel dan protein virus lain. Transkripsi dalam bentuk DNA virus selanjutnya dirakit menjadi virion pada membran inti sel. Pelepasan virion dari sitoplasma keluar inti sel terjadi melalui struktur tubuler
atau melalui proses eksositosis vakuola yang berisi virion (Sugiri, 1992 dalam Mulyana 2006).
11 membran sel dan mempunyai sistim metabolisme lengkap dan mandiri yang
mencakup mitokondria dan ribosom (Fenner et al. 1993).
Koi Herpesvirus (KHV)
Koi herpesvirus (KHV) merupelet salah satu penyakit infeksius yang
menyerang spesies Cyprinus carpio Linnaeus yaitu ikan Mas yang disebabkan oleh virus DNA. Penyakit ini pertama kali dilaporkan tahun 1998 dan telah dikonfirmasi terjadi di negara Israel tahun 1999 (Gambar 7). Sejak itu kejadian kasus dilaporkan berlanjut ke Amerika Serikat, Eropa, dan Asia. Kerugian ekonomi yang dialami akibat kematian ikan yang disebabkan oleh penyakit ini di Israel mencapai 4 juta dollar Amerika (OATA, 2001). Gambar 5. Virus Koi Herpesvirus (OATA, 2001)
12 Gambar 7. Peta Penyebaran kasus pertama KHV di Israel (Perelberg et al. 2003).
13 Tulungagung, Blitar, Malang, Kediri, dan Surabaya), Jawa Tengah (Semarang dan
Brebes), Jawa Barat (Subang, Bogor, Bandung, Purwakarta, Cianjur, dan Bekasi), Banten, dan Sumatra (Lampung, Bengkulu, dan Sumatra Selatan).
Virus Koi herpesvirus menyerang golongan ikan Mas (Cyprinus carpio carpioI) dan ikan Koi (Cyprinus carpio koi) dengan tingkat kematian 80%-95%. Penyebaran penyakit ini adalah melalui kontak langsung antar ikan dan ikan yang terjangkit, kontaminasi air, transportasi, dan penanganan seperti pergantian lingkungan dan fluktuasi temperature. Secara morfologi KHV termasuk dalam golongan Herpesvirus yaitu virus yang memiliki bentuk heksagonal dengan diameter 110 nm. Koi herpesvirus pada umunya dapat hidup dan memperbanyak diri pada temperatur antara 18-30oC.
Infeksi Penyakit KHV
Penyakit KHV yang menyerang golongan ikan mas, memiliki tingkat mematikan yang tinggi. Virus ini bersifat laten dan aktif pada kondisi tertentu seperti stess dari transportasi, penanganan serta pergantian lingkungan, dan fluktuasi temperatur (Sunarto et al. 2005 dalam Mulyana 2006). Studi komparatif
menunjukkan bahwa KHV dari Indonesia mempunyai persamaan 99,65% sekuen DNA dengan KHV dari Amerika Serikat (Sunarto et al. 2005 dalam Mulyana 2006).
Koi herpesvirus pada umumnya dapat hidup dan berkembangbiak pada suhu antara 18o-30oC (devanport, 2001). Gilad et al. (2003) mengatakan
pertumbuhan optimal Koi herpesvirus pada sel kultur antara 15o-25oC. Kematian yang tinggi pada ikan terjadi pada temperatur 18o-28oC, namun kematian dan replikasi Koi herpesvirus berkurang pada temperatur rendah.
Gejala Klinis



![Gambar 10. Hasil uji serum ikan perlakuan dosis tinggi 20% (w/w) dengan virus Koi herpesvirus; [ ] = terjadi reaksi silang dengan terbentuknya akumulasi presipitasi](https://thumb-ap.123doks.com/thumbv2/123dok/780638.372177/36.595.167.458.101.282/gambar-perlakuan-tinggi-herpesvirus-terjadi-terbentuknya-akumulasi-presipitasi.webp)