ISOLASI DAN IDENTIFIKASI BAKTERI KITINOLITIK
SEBAGAI AGENS BIOKONTROL CENDAWAN PATOGEN
PADA KOKON
Cricula trifenestrata
(Lepidoptera: Saturniidae)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Isolasi dan Identifikasi
Bakteri Kitinolitik sebagai Agens Biokontrol Cendawan Patogen pada Kokon Cricula trifenestrata (Lepidoptera: Saturnidae)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
RINGKASAN
MELDA YUNITA. Isolasi dan Identifikasi Bakteri Kitinolitik sebagai Agens Biokontrol Cendawan Patogen pada Kokon Cricula trifenestrata (Lepidoptera: Saturnidae). Dibimbing oleh NISA RACHMANIA MUBARIK dan DEDY DURYADI SOLIHIN.
Cricula trifenestrata merupakan salah satu serangga penghasil sutra alam yang belum didomestikasi, sehingga dikenal sebagai ulat sutra liar. C. trifenestrata mengeluarkan air liur yang mengandung protein dan menjadi bahan pembentukan kokon. Kokon ini dikumpulkan untuk diolah menjadi benang sutra. Sutra hasil olahan kokon C. trifenestrata memiliki nilai ekonomi yang tinggi di pasaran karena memiliki serat berwarna kuning emas yang merupakan warna khas kokonnya. Hal inilah yang menjadi pembeda antara C. trifenestrata dengan ulat sutra lainnya.
Salah satu patogen yang dikenal menyerang kokon ulat sutra ialah cendawan. Serangan cendawan dapat mengakibatkan kualitas dan kuantitas benang sutra yang dihasilkan mengalami penurunan. Di India, kegagalan panen kokon akibat serangan cendawan mencapai 30-40%. Cendawan memiliki dinding sel yang tersusun atas kompleks kitin dan merupakan target utama bagi agens anti cendawan, misalnya fungisida kimiawi. Namun, adanya dampak negatif yang ditimbulkan dari penggunaan fungisida kimiawi menyebabkan perlu dicari fungisida biologi seperti memanfaatkan bakteri kitinolitik potensial yang mampu menghambat bahkan membunuh cendawan patogen karena menghasilkan enzim kitinase. Bakteri kitinolitik memiliki potensi tinggi sebagai agens pengendali biologi terhadap cendawan patogen pada C. trifenestrata sehingga penurunan kualitas dan kuantitas sutra emas dapat dihindari. Tujuan penelitian ini ialah untuk mengisolasi bakteri kitinolitik dan cendawan patogen asal kokon C. trifenestrata serta identifikasi dan potensinya sebagai biokontrol.
Hasil isolasi dari kokon C. trifenestrata di Desa Babakan Lebak, Dramaga, Bogor didapatkan 10 isolat cendawan dan 36 isolat bakteri kitinolitik dengan Indeks Kitinolitik (IK) bervariasi. Isolat bakteri kitinolitik BSEP.3 diketahui mampu menghambat isolat cendawan CSAJ.2 yang diduga sebagai cendawan patogen dengan persentase penghambatan sebesar 50%. Kitinase yang dihasilkannya sebesar 5.11 U/mL pada jam ke-15 waktu inkubasi. Ekstrak kasar kitinasenya memiliki persentase penghambatan sebesar 47.5%. Sekuen hasil amplifikasi gen penyandi 16S rRNA dan konstruksi pohon filogenetik menunjukkan bahwa bakteri BSEP.3 memiliki kemiripan 98% dengan Bacillus amyloliquefaciens galur B5. Sekuen hasil amplifikasi daerah ITS rDNA dan konstruksi pohon filogenetik menunjukkan bahwa isolat cendawan CSAJ.2 memiliki kemiripan 100% dengan Trichoderma virens galur TV242. Aplikasi kitinase ekstrak kasar isolat bakteri kitinolitik BSEP.3 menunjukkan kemampuannya dalam menghambat pertumbuhan cendawan patogen pada kokon ulat sutra emas C. trifenestrata baik secera preventif maupun kuratif.
SUMMARY
MELDA YUNITA. Isolation and Identification of Chitinolytic Bacteria as Biological Control Agent of Pathogenic Fungi on Cocoon Cricula trifenestrata (Lepidoptera: Saturnidae). Supervised by NISA RACHMANIA MUBARIK and DEDY DURYADI SOLIHIN.
Cricula trifenestrata is one of the silk producer insect that have not been domesticated and known as the wild silkworm. C. trifenestrata salivate contains proteins as cocoon former. This cocoon could be processed into silk yarn. Processed silk from C. trifenestrata cocoon has high economic and market value because of its typically golden yellow color. This is the difference between C. trifenestrata with other silkworm.
One of the known pathogen of cocoon silkworm is the fungi. The fungus attacks decreased quality and quantity of silk yarn. In India, cocoon crop failure reached 30-40% influenced due to attack of the pathogenic fungi. Fungus cell wall composed of chitin complex becoming major target for anti-fungal agents, such as chemical fungicides. However, the presence of the negative impacts of chemical fungicide usages can be an important reason to find a biological fungicide such as the potential chitinolytic bacteria which is able to inhibit or even kill pathogenic fungi because they could producing chitinase. Chitinolytic bacteria has a high potential to be used as biological control against pathogenic fungi on C. trifenestrata, thus reduction of quality and quantity of gold silkworm can be avoided.
A total of 10 pathogenic fungal isolates and 36 isolates of chitinolytic bacteria were obtained from cocoon C. trifenestrata in Babakan Lebak Village, Dramaga, Bogor with a various Chitinolytic Index (CI). BSEP.3 chitinolytic bacterial isolate could inhibit isolate CSAJ.2 which was suspected as a pathogenic fungi with a percentage of inhibition 50%. The BSEP.3 chitinase productivity was obtained 5.11 U/mL at 15th hours of incubation time. The crude extract of chitinase had a percentage of inhibition 47.5%. Sequence amplification of gene 16S rRNA and contruction of phylogenetic tree showed that isolate BSEP.3 had 98% similarities with Bacillus amyloliquefaciens strain B5. Sequence amplification of the ITS region of rDNA and contruction of phylogenetic tree showed that isolate CSAJ.2 had 100% similarities with Trichoderma virens strain TV242. Application of chitinase crude extract showed its ability in inhibiting the growth of pathogenic fungi on gold silkworm cocoon C. trifenestrata preventively and curratively.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
ISOLASI DAN IDENTIFIKASI BAKTERI KITINOLITIK
SEBAGAI AGENS BIOKONTROL CENDAWAN PATOGEN
PADA KOKON
Cricula trifenestrata
(Lepidoptera: Saturnidae)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
4
4
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2014 sampai Mei 2015 ini ialah Isolasi dan Identifikasi Bakteri Kitinolitik sebagai Agens Biokontrol Cendawan Patogen pada Kokon Cricula trifenestrata (Lepidoptera: Saturnidae).
Terima kasih penulis ucapkan kepada Dr Nisa Rachmania Mubarik, MSi sebagai ketua komisi pembimbing dan Dr Dedy Duryadi Solihin, DEA sebagai anggota komisi pembimbing, yang telah banyak memberikan nasehat, saran, motivasi, waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr Ir Teguh Santoso, DEA dan kepada Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi dan masukan pada saat ujian sidang tesis. Terima kasih atas beasiswa pendidikan dan penelitian BPPDN DIKTI 2013 sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Penulis juga mengucapkan terima kasih kepada Ibu Heni dan Bapak Jaka selaku teknisi Laboratorium Mikrobiologi IPB, Mikrotropisian 2013 serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga juga penulis ucapkan kepada ayah Uluan Nainggolan, ibu Siti Rona Harahap, dan adik-adikku tercinta Dewi Suryani, SPd, Siti Nurkholiza Putri, SH, Rahmad Heriansyah dan Aulia Ramadhani tersayang, atas doa, dukungan, kasih sayang, dan semangat yang diberikan. Terima kasih untuk teman-teman seperjuangan di Program studi Mikrobiologi IPB angkatan 2013 serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
Identifikasi Bakteri Kitinolitik Menggunakan Gen 16S rRNA 6 Identifikasi Cendawan Patogen Menggunakan Gen ITS rDNA 7
BAHAN DAN METODE 8 Penapisan Bakteri Kitinolitik melalui Uji Daya Hambat terhadap
Cendawan Patogen 9
Penentuan Kurva Tumbuh dan Produksi Kitinase Ekstrak Kasar
Isolat Terpilih serta Uji Daya Hambatnya 10
Identifikasi Bakteri Kitinolitik secara Morfologi, Biokimia, dan
Molekuler 10
Identifikasi Cendawan Patogen secara Morfologi dan Molekuler 11 Aplikasi Kitinase Ekstrak Kasar pada Pupa Sehat secara In vivo 11
HASIL DAN PEMBAHASAN 12
Isolasi dan Seleksi Bakteri Kitinolitik 12
Isolasi Cendawan dan Uji Patogenisitas 13
Penapisan Bakteri Kitinolitik melalui Uji daya Hambat terhadap
Cendawan Patogen 13
Penentuan Kurva Tumbuh dan Produksi Kitinase Ekstrak Kasar
Isolat Terpilih serta Uji Daya Hambatnya 14
Identifikasi Bakteri Kitinolitik secara Morfologi, Biokimia, dan
Molekuler 15
Identifikasi Cendawan Patogen secara Morfologi dan Molekuler 17 Aplikasi Kitinase Ekstrak Kasar pada Pupa Sehat secara In vivo 19
4
1 Hasil isolasi bakteri kitinolitik berdasarkan Indeks Kitinolitik (IK) 12 2 Analisis homologi sekuen gen 16S rRNA isolat bakteri kitinolitik
BSEP.3 menggunakan program BLAST-N 16
3 Analisis homologi sekuen gen ITS rDNA isolat cendawan patogen
CSAJ.2 menggunakan program BLAST-N 18
setelah 2 hari inkubasi 12
5 Pertumbuhan hifa cendawan CSAJ.2 pada kokon C. trifenestrata
(tanda panah) 13
6 Uji daya hambat isolat bakteri kitinolitik melawan cendawan
patogen pada media PDA dan media PDA+Pepton 1% 14 7 Kurva Pertumbuhan dan produksi kitinase oleh isolat bakteri
kitinolitik BSEP.3 14
8 Hasil uji daya hambat bakteri kitinolitik BSEP.3 terhadap cendawan patogen CSAJ.2 pada media PDA dan pengamatan
mikroskopik hifa cendawan 15
9 Hasil pewarnaan Gram dan endospora isolat bakteri kitinolitik
BSEP.3 15
10 Hasil visualisasi gen 16S rRNA isolat bakteri kitinolitik BSEP.3
pada gel agarosa 1% 16
11 Konstruksi pohon filogenetik isolat bakteri kitinolitik BSEP.3 menggunakan metode Neighbour Joining dengan nilai ulangan
bootsrap 1000x 17
12 Morfologi dan anatomi isolat cendawan patogen CSAJ.2 17 13 Hasil visualisasi gen ITS rDNA isolat cendawan patogen CSAJ.2
14 Konstruksi pohon filogenetik isolat bakteri kitinolitik CSAJ.2 menggunakan metode Neighbour Joining dengan nilai ulangan
bootsrap 1000x 18
15 Persentase hasil aplikasi spora cendawan T. virens CSAJ.2 pada
pupa sehat setelah 6 minggu inkubasi 19
16 Urutan aplikasi kitinase ekstrak kasar B. amyloliquefaciens
BSEP.3 20
DAFTAR LAMPIRAN
1 Prosedur isolasi DNA genom menggunakan PrestoTM Mini gDNA
Kit (Geneaid) 28
2 Karakteristik morfologi bakteri kitinolitik diisolasi dari kokon ulat
sutra emas Cricula trifenestrata 30
3 Hasil isolasi cendawan patogen pada kokon ulat sutera emas
Cricula trifenestrata 31
4
PENDAHULUAN
Latar Belakang
Ulat sutera emas (Cricula trifenestrata Helf.) merupakan salah satu serangga penghasil sutra alam yang belum didomestikasi, sehingga dikenal sebagai ulat sutra liar. Cricula trifenestrata mengeluarkan air liur yang mengandung protein dan menjadi bahan pembentukan kokon. Kokon ini dikumpulkan untuk diolah menjadi benang sutra. Sutra hasil olahan kokon C. trifenestrata memiliki nilai ekonomi yang tinggi di pasaran karena memiliki serat berwarna kuning emas yang merupakan warna khas dari kokonnya. Hal inilah yang menjadi pembeda antara C. trifenestrata dengan ulat sutra lainnya (Mondal et al. 2007).
Salah satu patogen yang dikenal menyerang kokon ulat sutra ialah cendawan. Serangan cendawan dapat mengakibatkan kualitas dan kuantitas benang sutra yang dihasilkan mengalami penurunan. Di India, kegagalan panen kokon akibat Aspergillus sp. mencapai 30-40% (Hee 1998). Fungisida kimiawi umumnya digunakan untuk membasmi serangan cendawan patogen. Namun, adanya dampak negatif yang ditimbulkan dari penggunaan fungisida kimiawi menyebabkan perlu dicari fungisida biologi, seperti bakteri kitinolitik potensial yang mampu menghambat bahkan membunuh cendawan patogen karena menghasilkan enzim kitinase yang mampu menguraikan kitin pada dinding sel cendawan pathogen (Kim et al. 2008).
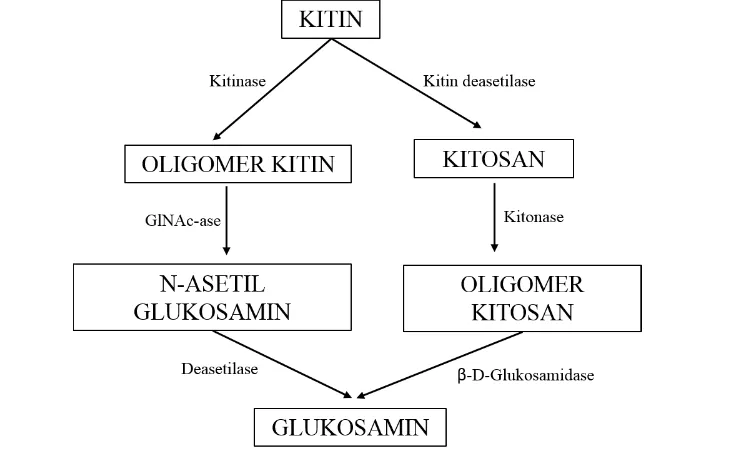
Kitinase merupakan enzim yang mengkatalisis reaksi pemecahan kitin dengan memotong ikatan glikosidik sehingga menjadi monomer N-asetilglukosamin. Bakteri kitinolitik memiliki potensi tinggi sebagai agens pengendali biologi terhadap cendawan patogen pada C. trifenestrata sehingga penurunan kualitas dan kuantitas sutra emas dapat dihindari. Bakteri yang dilaporkan memiliki aktivitas kitinolitik tersebar pada kelompok bakteri Gram negatif dan Gram positif, antara lain Pseudomonas aeruginosa, Serratia marcescens, Vibrio furnissi, Bacillus circulans, Bacillus careus, dan Streptomyces griseus (Anitha dan Rabeeth 2010).
Novitasari (2013) memperoleh 17 isolat bakteri kitinolitik dari kokon C. trifenestrata yang dapat menghambat pertumbuhan Scopulariopsis sp. Namun, pada penelitian sebelumnya belum dilakukan identifikasi bakteri kitinolitik penghasil kitinase yang dapat menghambat pertumbuhan cendawan patogen. Oleh karena itu, perlu dilakukan penelitian kembali guna memperoleh bakteri kitinolitik yang potensial dalam menghambat cendawan patogen serta identifikasinya secara molekuler.
Perumusan Masalah
4
lingkungan, seperti residu yang tidak mudah didegradasi. Bakteri kitinolitik memiliki potensi sebagai agens fungisida hayati sehingga diharapkan mampu menghambat pertumbuhan cendawan patogen pada kokon ulat sutra emas C. trifenstrata dan lebih ramah lingkungan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi, menyeleksi, mengkarakterisasi, dan mengidentifikasi bakteri kitinolitik dan cendawan patogen pada kokon ulat sutra emas C. trifenestrata.
Manfaat Penelitian
Identifikasi serta uji daya hambat pada penelitian ini, diharapkan dapat memberikan informasi mengenai jenis bakteri kitinolitik yang dapat dijadikan sebagai agens pengendali hayati cendawan patogen pada kokon ulat sutra emas C. trifenestrata. Hasil penelitian ini juga diharapkan dapat memberikan informasi mengenai kemampuan yang dimiliki isolat bakteri kitinolitik khususnya potensinya sebagai agen pengendali hayati.
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini meliputi isolasi bakteri kitinolitik dan cendawan patogen, uji patogenisitas cendawan, uji daya hambat, pengukuran aktivitas kitinase, serta identifikasi bakteri kitinolitik menggunakan gen 16S rRNA dan identifikasi cendawan patogen menggunakan gen Internal Transcribed Sequence (ITS) rDNA. Tahap identifikasi bakteri kitinolitik meliputi pengamatan morfologi, pewarnaan Gram dan amplifikasi gen 16S rRNA. Tahap identifikasi cendawan patogen meliputi pengamatan morfologi dan amplifikasi daerah ITS. Uji patogenisitas dilakukan untuk mengetahui gejala patogenisitas yang ditimbulkan cendawan patogen pada kokon ulat sutra emas C. trifenestrata. Uji daya hambat dilakukan untuk mengetahui aktivitas daya hambat bakteri kitinolitik terhadap cendawan patogen. Pengukuran aktivitas kitinase dilakukan mengkonfirmasi senyawa antifungi yang dihasilkan oleh bakteri kitinolitik.
TINJAUAN PUSTAKA
Ulat Sutra Emas Cricula trifenestrata
Cricula trifenestrata merupakan serangga penghasil sutra yang termasuk anggota famili Saturniidae dan tersebar di Asia, terutama Asia Tenggara. Berbeda dengan ulat sutra putih (Bombyx mori), sutra yang dihasilkan oleh C. trifenestrata lebih lembut warna alaminya lebih nyata, tidak berbau dan tidak mudah luntur (Wibowo et al. 2004). Di Indonesia, C. trifenestrata belum didomestikasi sehingga dikenal dengan nama ulat sutra liar, atau juga dikenal dengan nama ulat sutra emas karena warna emas pada kokonnya. Kokon C. trifenestrata banyak digunakan dalam produksi benang sutera, tas tangan wanita, asesoris, dompet, sampul buku, serta hiasan dinding. Selain itu, di beberapa daerah seperti Yogyakarta dan Bali, pupa C. trifenestrata juga banyak dikonsumsi sebagai makanan tambahan yang mengandung protein tinggi. Oleh karena itu, produk olahan sutra dari C. trifenestrata ini memiliki nilai jual yang lebih tinggi dibandingkan sutra alam lainnya (Wikardi dan Djuwarso 2000).
Ketersediaan bahan baku di alam menjadi kendala utama untuk pemenuhan kebutuhan untuk kokon ulat sutra emas C. trifenestrata yang bersifat polifagus. Umumnya tanaman inang yang disukai oleh C. trifenestrata ialah jambu mete, alpukat, kayu manis, kenari dan kedondong (Tazima 1978). Yoseph (2009) melaporkan bahwa kandungan fitokimia daun jambu mete seperti tanin dan flavonoid berkorelasi positif terhadap kualitas kokon C. trifenestrata. Selain itu, tingginya kualitas kokon C. trifenestrata dipengaruhi oleh kandungan protein yang terdapat pada kokon tersebut.
Kitin
Kitin merupakan biopolimer (2-asetamido-2-deoksi-β-(1→4) -D-glukopiranosa) dengan rumus molekul (C8H13NO5)n yang tersusun atas 47% C, 6% H, 7% N, dan 40% O. Struktur kitin menyerupai struktur selulosa, hanya saja berbeda pada gugus yang terikat di posisi atom C-2. Gugus pada C-2 selulosa adalah gugus hidroksil, sedangkan pada C-2 kitin adalah gugus N-asetil (-NHOCH3, asetamida) (Dutta et al. 2004).
Gambar 1 Struktur kimia kitin (Aranaz et al. 2009)
4
bagian konstituen organik yang sangat penting pada kerangka hewan golongan Artropoda, Annelida, Molusca, Coelentrata, Nematoda, beberapa kelas serangga dan cendawan. Pada Cendawan, kitin merupakan komponen struktural utama pada dinding sel. Proporsi kitin pada khamir dan cendawan berfilamen cukup jauh berbeda. Kitin pada khamir Saccharomyces cerevisiae mencapai 1-2% dari bobot kering dinding sel, sedangkan proporsi pada cendawan berfilamen bervariasi antara 10-30% dari bobot kering dinding sel (Aranaz et al. 2009).
Kitin termasuk polisakarida yang sangat sukar dilarutkan pada pH netral seperti air sehingga pelarutan dilakukan dalam suasana asam atau basa. Hal ini dikarenakan secara alaminya, kitin berbentuk kristal yang mengandung polimer yang terikat satu sama lain dengan ikatan hidrogen yang sangat kuat. Namun, Kitin dapat didegradasi secara biologi oleh mikroorganisme yang memiliki aktivitas kitinase. Kitin dapat larut dalam heksafluoro isopropanol, heksafluoro aseton, dan kloro alkohol serta dimetilasetamida (DMAc) yang mengandung 5% litium klorida (LiCl) (Dutta et al. 2004).
Kitinase
Kitinase (EC 3.2.1.14) merupakan enzim yang mampu menghidrolisa polimer kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin secara sinergis dan berurutan. Enzim ini dihasilkan oleh bakteri, cendawan, tanaman, dan hewan. Atas dasar cara kerjanya dalam mendegradasi substrat, kitinase dibedakan ke dalam 2 kelompok utama: endokitinase dan eksokitinase. Endokitinase memotong polimer kitin secara acak menghasilkan dimer, trimer, tetramer atau oligomer gula. Eksokitinase memotong kitin hanya dari ujung non reduksi (Toharisman et al. 2005).
Kitinase banyak dimanfaatkan sebagai agens pengendali hayati terutama bagi target yang terserang cendawan patogen. Hal ini dikarenakan kitin merupakan komponen utama dinding sel cendawan yang dapat didegradasi oleh kitinase. Pemanfaatan kitinase dari mikroorganisme secara langsung ke tanah dilaporkan bisa mengurangi serangan patogen (Herdyastuti et al. 2009).
Aplikasi kitinase dalam pengendalian patogen bisa dilakukan secara langsung pada target atau dengan cara introduksi gen penyandi kitinase pada tanaman. Cara yang lebih sederhana telah dilakukan oleh Metcalfe et al. (2002) dengan metode tidak langsung memakai kitin. Kitin ditaburkan ke tanah sekitar tanaman, kemudian akan menginduksi kitinase dari mikrob tanah. Enzim ini selanjutnya dilepaskan ke lingkungan dan mampu menghambat pertumbuhan cendawan di sekitarnya.
Berbagai organisme menghasilkan aneka jenis kitinase terkait dengan fungsi biologinya, dengan spesifitas terhadap substrat yang bervariasi, dan juga karakteristik yang berlainan. Bakteri mengeluarkan kitinase sebagai sarana memperoleh nutrisi dan agen parasitisme, sementara cendawan, protozoa dan invertebrata mengeluarkan enzim tersebut untuk proses morfogenesis. Tanaman mengeluarkan kitinase untuk mempertahankan diri dari serangan patogen. Baculovirus, yang biasa dimanfaatkan untuk kontrol hama serangga, juga menghasilkan kitinase untuk proses patogenesitas (Toharisman 2007).
Dengan adanya kitinase penguraian kitin berlangsung secara kontinyu sehingga tidak terjadi akumulasi kitin dari sisa cangkang udang, cendawan, kepiting, cumi, dan organisme laut lainnya. Secara alami, kitinase dihasilkan serangga untuk proses morfogenesis. Dalam perkembangan pertumbuhan serangga, kitin pada kutikel tua didegradasi kitinase, kemudian diganti kitin baru hasil enzim kitin sintase. Proses ini terus berlangsung selama siklus pertumbuhan serangga. Tanaman tidak memiliki mekanisme sistem kekebalan terhadap serangan hama dan penyakit. Sebagai gantinya, tanaman melakukan proteksi terhadap organ vegetatif dan reproduktifnya melalui berbagai mekanisme dimana salah satunya melibatkan kitinase. Pada saat diserang patogen, kitinase terinduksi sehingga kemudian dikeluarkan oleh tanaman. Enzim ini selanjutnya akan mendegradasi dinding sel cendawan atau serangga penyerang. Banyak laporan menunjukkan bahwa tanaman transgenik yang disisipi gen kitinase mampu menghasilkan kitinase dalam jumlah cukup memiliki resistensi yang tinggi terhadap serangan cendawan (Toharisman 2007).
Gambar 2 Tahapan degradasi kitin secara enzimatik (Gooday 1994)
Bakteri Kitinolitik
Bakteri kitinolitik merupakan salah satu dari kelompok mikroorganisme yang memiliki aktivitas kitinolitik dalam mendegradasi kitin di alam. Kitin merupakan senyawa yang sukar larut, serta memiliki ukuran dan susunan molekul yang kompleks. Kitin tidak dapat didegradasi di dalam sel, akan tetapi dapat didegradasi secara ekstraseluler oleh oleh bakteri yang menghasilkan kitinase. Bakteri kitinolitik memproduksi kitinase dalam jumlah yang lebih banyak daripada hewan dan tumbuhan (Matsumoto 2006). Bakteri kitinolitik ini dapat diisolasi dan dideteksi melalui zona bening yang terbentuk pada medium selektif agar (Purwani et al. 2002).
4
Beberapa bakteri kitinolitik yang telah dilaporkan mampu mengendalikan cendawan patogen, antara lain Serratia marcescens untuk mengendalikan penyakit Sclerotium rolfsii (Fravel et al. 2004), Pseudomonas chlororaphis PA23 yang dikombinasikan dengan Bacillus subtilis BSCBE4 untuk mengendalikan penyakit rebah kecambah pada cabai (Nakkeeran et al. 2006), dan Pseudomonas flourescens yang dikombinasikan dengan Bacillus licheniformis dan Chryseobacterium balustinum untuk penyakit yang sama (Domenech et al. 2006).
Uji Daya Hambat (Uji Antagonis)
Penggunaan bakteri antagonis merupakan salah satu cara pengendalian hayati yang mulai banyak mendapat perhatian karena memiliki beberapa keuntungan, antara lain tidak mengandung bahan beracun yang dapat menimbulkan residu pada lingkungan, tidak mengganggu ekosistem dan rantai makanan, tidak memerlukan aplikasi berulang karena bakteri dapat memperbanyak diri secara alami selama lingkungan mendukung perkembangannya, tidak menimbulkan efek samping terhadap organisme lain dan dapat meningkatkan pertahanan target terhadap serangan patogen (Wei et al. 1990).
Beberapa penelitian tentang pengendalian hayati cendawan patogen menggunakan bakteri kitinolitik telah banyak dilakukan, diantaranya kemampuan bakteri kitinolitik dalam menghambat pertumbuhan Fusarium semitectum pada cabai dan Ganoderma spp. pada kelapa sawit (Suryanto 2011). Pengendalian hayati cendawan dengan menggunakan bakteri kitinolitik didasarkan pada kemampuan bakteri tersebut dalam menghasilkan kitinase yang mampu melisiskan dinding sel cendawan (El-Katatny et al. 2000).
Identifikasi Bakteri Kitinolitik Menggunakan Gen 16S rRNA
Salah satu metode yang dapat digunakan untuk identifikasi bakteri ialah secara molekular dengan menggunakan teknik PCR. Teknik ini digunakan untuk menelaah profil DNA gen 16S rRNA. Penggunaan 16S rRNA telah digunakan sebagai parameter sistematik molekuler universal, representatif, dan praktis untuk mengkonstruksi kekerabatan filogenetik pada tingkat spesies. Analisis PCR dengan primer spesifik merupakan langkah terbaik untuk kepentingan identifikasi bakteri karena dapat menentukan secara cepat keberadaan gen target, cukup sensitif dan mudah digunakan dalam kegiatan rutin (Rychlic 1995).
daerah variabel dan konservatif, dimana primer universal untuk amplifikasi gen 16S rRNA secara lengkap biasanya dipilih dari daerah konservatif tersebut, sementara daerah variabel lebih banyak digunakan untuk taksonomi perbandingan (Prakash et al. 2007).
Identifikasi Cendawan Patogen Menggunakan Gen ITS rDNA
Daerah ITS (Internal Transcribed Spacer) rDNA merupakan sekuen DNA terbanyak yang disekuensing pada cendawan. Daerah ini sangat penting dalam studi sistematika molekular pada tingkat spesies, bahkan analisa filogenetik pertama dari seluruh genus Trichoderma adalah dengan menggunakan daerah ITS rDNA. Daerah ITS DNA berulang dari ujung 3’ gen 28S dan ujung 5’ pada gen 28S yang diamplifikasi dengan 2 primer, yaitu ITS5 dan ITS4 yang disintesis berdasarkan daerah konservatif gen rRNA eukariotik (Hillis et al. 1991).
Pada eukariot, gen pengkode rRNA ribosom diatur dalam suatu susunan yang mengandung unit tranksripsi berulang yang melibatkan gen 16-18S, 5.8S dan 23-28S rRNA, dua intergenic spacer ITS1 dan ITS2 dan dua sekuen external spacer (5’ dan 3’ ETS). Unit-unit ini ditranskripsi oleh RNA polimerase I dan dipisahkan oleh IGS (intergenic spacers) yang tidak ditranskripsi. Produk RNA polimerase I diproses di nukleolus, dimana ITS1 dan ITS2 dipotong dan tiga tipe rRNA dihasilkan. Pada genom eukariot, daerah ITS sangat bervariasi baik dalam ukuran maupun urutan sekuen. Pada S. cerevisiae, ITS1 berukuran 361 pb dan ITS2 berukuran 232 pb. Daerah ITS memiliki arti yang penting dalam menghasilkan rRNA. Struktur ITS1 dan ITS2 mengandung tiga sampai empat lengan heliks. Perubahan ukuran dan sekuen pada daerah ini secara biologi diperbolehkan selama tidak mengganggu pembentukan struktur sekunder yang memfasilitasi proses pembentukan rRNA. Oleh karena itu, ITS dapat dijadikan metode sederhana untuk menentukan variabilitas antar inter atau intraspesies cendawan (Hillis et al. 1991).
Identifikasi cendawan secara akurat dan definitif sangat penting untuk diagnosa suatu penyakit yang benar yang disebabkan oleh serangan cendawan. Karakterisasi spesies cendawan menggunakan metode klasik tidak terlalu spesifik seperti yang dilakukan dengan metode-metode genotipe. Teknik genotipe melibatkan amplifikasi target secara filogenetik, seperti sub unit kecil ribosom 28S gen rRNA (Woese and Fox 1997). rRNA penting untuk pertanahan sel, dan gen-gen pengkode rRNA sangat stabil pada cendawan dan kingdom lainnya. Sekuen rRNA dan protein yang terdiri dari ribosom sangat stabil terhadap evolusi, karena gen-gen tersebut membutuhkan interaksi inter dan intramolekuler yang kompleks untuk menjaga mesin sintesis protein (Sacchi et al. 2002).
4
BAHAN DAN METODE
Bahan
Bahan yang digunakan pada penelitian ini adalah kokon ulat sutra emas C. trifenestrata berasal dari pohon alpukat dan jambu yang tumbuh di Desa Babakan Lebak, Dramaga, Bogor (6.55733o LS dan 106.73799o BT).
Kerangka Penelitian
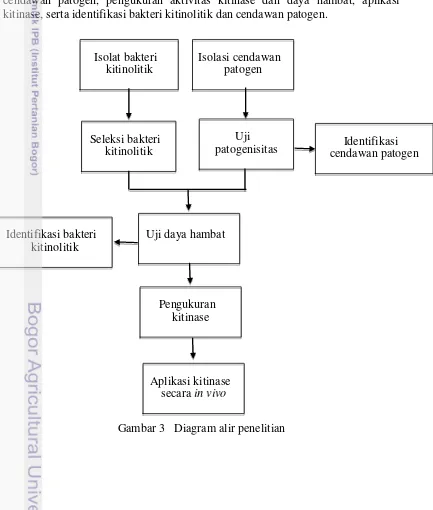
Kerangka penelitian (Gambar 3) meliputi isolasi bakteri kitinolitik dan cendawan patogen, pengukuran aktivitas kitinase dan daya hambat, aplikasi kitinase, serta identifikasi bakteri kitinolitik dan cendawan patogen.
Gambar 3 Diagram alir penelitian Seleksi bakteri
kitinolitik Isolat bakteri
kitinolitik
Isolasi cendawan patogen
Identifikasi cendawan patogen
Uji daya hambat Identifikasi bakteri
kitinolitik
Pengukuran kitinase
Aplikasi kitinase secara in vivo
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Juni 2014 sampai Mei 2015. Penelitian dilaksanakan di Laboratorium Mikrobiologi, Departeman Biologi, FMIPA dan Laboratorium Biologi Molekuler, PPSHB, IPB Bogor.
Isolasi dan Seleksi Bakteri Kitinolitik
Sampel yang digunakan dalam isolasi dan seleksi bakteri kitinolitik ialah kokon C. trifenestrata asal pupa yang terserang cendawan dan kokon asal pupa sehat sebagai kontrol. Sebanyak 3 g dari masing-masing kokon dimasukkan ke dalam 100 ml kaldu nutrien (NB) yang mengandung 0,5% koloidal kitin dalam erlenmeyer 500 ml, kemudian diinkubasi pada shaker incubator suhu ruang selama 24 jam. Isolasi bakteri kitinolitik diawali dengan melakukan pengenceran berseri dari 10-1 sampai 10-8 dalam larutan garam fisiologis NaCl 0,85%. Suspensi dituang pada media agar-agar kitin dan diinkubasi selama 24 jam pada suhu 37 oC (Suryanto et al. 2011).
Isolasi Cendawan Patogen dan Uji Patogenisitas
Isolasi patogen dilakukan dengan menggunakan metode Lim (Lim et al. 2002) dengan beberapa modifikasi. Isolasi cendawan patogen diawali dengan memotong kokon asal pupa yang terserang cendawan menjadi empat bagian. Potongan kokon direndam di dalam campuran 2 ml kloroxilenol 0,8% dengan tujuan surface sterilization dan 100 ml akuades steril. Potongan kokon diletakkan di atas media Potato Dextrose Agar (PDA) yang telah ditambahkan dengan kloramfenikol 500 mg/L kemudian diinkubasi selama lima hari pada suhu 25 oC. Koloni cendawan yang tumbuh dipindahkan pada media PDA yang baru sehingga didapatkan kultur cendawan murni. Uji patogenisitas cendawan dilakukan dengan membuat suspensi spora dari cendawan kemudian diteteskan pada kokon sehat di dalam petri steril, kemudian diinkubasi selama lima hari pada suhu 25 oC. Koloni cendawan yang tumbuh pada kokon dan menyebabkan gejala patogenisitas diisolasi kembali pada media PDA yang baru.
Penapisan Bakteri Kitinolitik melalui Uji Daya Hambat terhadap Cendawan Patogen
Aktivitas daya hambat diuji menggunakan dua metode, yaitu dengan cara: menggoreskan 36 isolat bakteri kitinolitik hasil isolasi sepanjang 4 cm pada tepi media PDA bersamaan dengan meletakkan potongan biakan murni cendawan
patogen (Φ 0,5 cm) di tengah media PDA. Akuades steril digunakan sebagai kontrol. Persentase penghambatan cendawan patogen dapat diukur dengan menggunakan rumus [100% x (r1-r2)/r1], dengan nilai r1 ialah panjang pertumbuhan miselium ke arah pinggir petri (3 cm) dan r2 ialah panjang miselium ke arah bakteri (Fokkema 1973).
4
Penentuan Kurva Tumbuh dan Produksi Kitinase Ekstrak Kasar Isolat Terpilih serta Uji Daya Hambatnya
Isolat bakteri kitinolitik hasil penapisan diukur kurva pertumbuhannya dengan cara: sebanyak 2 lup isolat bakteri ditumbuhkan di media kaldu nutrien (NB) dan ditambahkan 0,3% koloidal kitin kemudian diinkubasi selama 32 jam dengan kecepatan 120 rpm pada suhu 37 oC. Selanjutnya 1% (108 sel/ml) inokulum diinokulasi ke media NB 100 ml ditambah 0,3% koloidal kitin dalam erlenmeyer 250 ml sebagai media produksi dan diinkubasi pada suhu 37 oC dengan kecepatan 120 rpm. Setiap 3 jam dilakukan pengambilan kultur sel untuk diukur densitas selnya pada panjang gelombang 600 nm yang berlangsung 24 jam. Kultur sel yang sama kemudian disentrifugasi selama 10 menit dengan kecepatan 10.000 rpm pada suhu 4 oC. Supernatan yang diperoleh merupakan kitinase ekstrak kasar yang selanjutnya diukur aktivitasnya menggunakan metode Spindler (1997), yaitu dengan cara mencampurkan 225 L ekstrak kasar kitinase dengan
450 L 0,3% koloidal kitin dan 225 L bufer fosfat 0,1 M pada suhu 37 oC, pH 7.0, 120 rpm. Aktivitas enzim ditentukan dengan mengukur absorbansi pada panjang gelombang 420 nm. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang menghasilkan 1 mol N-asetil glukosamin per menit. Konsentrasi N-asetilglukosamin dihitung berdasarkan kurva standar N-asetil glukosamin. Kadar protein diukur dengan metode Bradford (1976), yaitu dengan cara mencampurkan 100 L kitinase ekstrak kasar dengan 5 mL pereaksi Bradford. Absorbansi sampel dibaca pada 5λ5 nm Kadar protein dihitung berdasarkan kurva standar Bovin Serum Albumin (BSA). Kadar protein yang diperoleh digunakan untuk menentukan aktivitas spesifik kitinase.
Kultur cair dan Kitinase ekstrak kasar diuji kembali aktivitas daya hambatnya dengan metode Paper disk. Paper diskdirendam dalam 100 L kultur sel dan kitinase ekstrak kasar kemudian diletakkan dengan posisi 4 cm pada tepi media PDA bersamaan dengan meletakkan potongan biakan murni cendawan
patogen (Φ 0,5 cm) di tengah media PDA (Fokkema 1λ73).
Identifikasi Bakteri Kitinolitik secara Morfologi, Biokimia, dan Molekuler
selama 1.5 menit), dan extension (72 oC selama 5 menit). Produk hasil PCR divisualisasi dengan menggunakan UV transiluminator Gel Doc (Labquip) pada 1% (w/v) gel agarosa selama 45 menit. Sekuensing dilakukan menggunakan jasa 1st BASE Malaysia. Sekuen yang diperoleh disejajarkan pada Gene Bank menggunakan program BLASTN dan konstruksi filogenetiknya dengan menggunakan program MEGA 5.05.
Identifikasi Cendawan Patogen secara Morfologi dan Molekuler
Cendawan terpilih hasil uji patogenisitas selanjutnya diidentifikasi secara morfologi dengan metode Riddell (Riddell 1950). Sepotong agar-agar (1 cm x 0,5 cm) diletakkan di tengah kaca objek steril dan pada keempat sisinya diinokulasi cendawan dengan jarum inokulasi. Kaca penutup steril diletakkan pada bagian atas potongan agar-agar yang telah diinokulasikan cendawan dan diinkubasi selama 3 hari. Cendawan yang telah tumbuh pada kaca penutup dan kaca objek dipindahkan untuk dibuat preparat semi permanen menggunakan laktofenol kemudian diamati menggunakan mikroskop. Identifikasi menggunakan buku identifikasi Barnett (Barnett dan Hunter 1987).
Ekstraksi DNA dilakukan dengan mengikuti prosedur Kit Qiagen. Hasil ekstraksi DNA diukur kosentrasi dan kemurniannya dengan menggunakan Nano Drop 2000 spektrofotometer (Thermo Scientific, Wilmington, DE, USA). DNA hasil ekstraksi diamplifikasi menggunakan mesin Polymerase Chain Reaction (PCR) dengan primer ITS 5F 5’-GGA AGT AAA AGT CGT AAC AAG G-3’
dan ITS 4R 5’-TCC TCC GCT TAT TGA TAT GC-3’ (White et al. 1990). Kondisi mesin PCR yang digunakan ialah pre-denaturation (95 oC selama 1 menit), annealing (55 oC selama 1 menit), elongation (72 oC selama 1.5 menit), dan extension (72 oC selama 5 menit). Produk hasil PCR divisualisasi dengan menggunakan UV transiluminator Gel Doc (Labquip) pada 1% (w/v) gel agarosa selama 45 menit. Sekuensing dilakukan menggunakan jasa 1st BASE Malaysia. Sekuen yang diperoleh disejajarkan pada Gene Bank menggunakan program BLASTN dan konstruksi filogenetiknya dengan menggunakan program MEGA 5.05.
Aplikasi Kitinase Ekstrak Kasar pada Pupa Sehat secara In vivo
Aplikasi dilakukan dengan cara meneteskan spora cendawan dengan kerapatan 103 spora/mL pada pupa sehat, kemudian diinkubasi hingga pupa terserang cendawan. Kemudian sebanyak 1000 µL kitinase ekstrak kasar diteteskan pada pupa tersebut kemudian diinkubasi selama lima hari. Hal ini bertujuan untuk melihat kemampuan kitinase ekstrak kasar dalam menghambat pertumbuhan cendawan patogen secara in vivo.
4
HASIL DAN PEMBAHASAN
Isolasi dan Seleksi Bakteri Kitinolitik
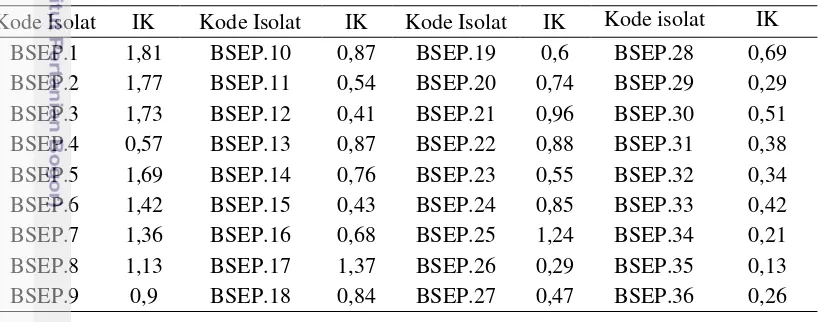
Isolasi bakteri kitinolitik menggunakan sampel kokon asal pupa sehat dan kokon asal pupa terserang cendawan. Sampel kokon C. trifenestrata asal pupa sehat memiliki bentuk seperti jaring, serat tidak rusak, memiliki pori yang besar, berwarna kuning keemasan, dan tidak berbau (Kalshoven 1981). Sampel kokon asal pupa terserang cendawan memiliki ciri berbeda, yaitu tampak berwarna cokelat kehitaman dan terkadang terlihat adanya hifa yang menjalar di permukaan kokon. Isolasi bakteri kitinolitik dari sampel kokon sehat dan sakit di sekitar Desa Babakan Lebak, Dramaga, Bogor menghasilkan 36 isolat (Tabel 1) dengan karakter morfologi yang bervariasi (Lampiran 2). Indeks Kitinolitik terbesar dihasilkan isolat BSEP.1, yaitu 1.81 sedangkan Indeks Kitinolitik terkecil dihasilkan isolat BSEP.35, yaitu 0.13.
Tabel 1 Hasil isolasi bakteri kitinolitik berdasarkan Indeks Kitinolitik (IK)
Kode Isolat IK Kode Isolat IK Kode Isolat IK Kode isolat IK
BSEP.1 1,81 BSEP.10 0,87 BSEP.19 0,6 BSEP.28 0,69
BSEP.2 1,77 BSEP.11 0,54 BSEP.20 0,74 BSEP.29 0,29
BSEP.3 1,73 BSEP.12 0,41 BSEP.21 0,96 BSEP.30 0,51
BSEP.4 0,57 BSEP.13 0,87 BSEP.22 0,88 BSEP.31 0,38
BSEP.5 1,69 BSEP.14 0,76 BSEP.23 0,55 BSEP.32 0,34
BSEP.6 1,42 BSEP.15 0,43 BSEP.24 0,85 BSEP.33 0,42
BSEP.7 1,36 BSEP.16 0,68 BSEP.25 1,24 BSEP.34 0,21
BSEP.8 1,13 BSEP.17 1,37 BSEP.26 0,29 BSEP.35 0,13
BSEP.9 0,9 BSEP.18 0,84 BSEP.27 0,47 BSEP.36 0,26
Keseluruhan isolat bakteri kitinolitik mampu tumbuh dan membentuk zona bening pada media agar-agar kitin. Zona bening merepresentasikan kemampuan bakteri kitinolitik dalam mendegradasi koloidal kitin yang ada di dalam media sebagai nutrisi bagi pertumbuhannya (Gambar 4).
Isolasi Cendawan dan Uji Patogenisitas
Isolasi cendawan patogen dari sampel kokon rusak menghasilkan 10 isolat yang diberi kode CSAJ.1-CSAJ.10 (Lampiran 3). Uji patogenisitas cendawan dilakukan untuk melihat tingkat patogenisitas cendawan terhadap kokon sehat. Hasil uji patogenisitas menunjukkan bahwa dari 10 cendawan yang berhasil diisolasi hanya cendawan dengan kode CSAJ.2 yang berhasil tumbuh pada kokon dan menyebabkan warna kokon menjadi lebih gelap (Gambar 5). Hal ini mengindikasikan bahwa CSAJ.2 mampu menjadi parasit pada kokon tersebut. Sesuai dengan tahapan Postulat Koch, isolat cendawan CSAJ.2 selanjutnya diisolasi dan dimurnikan kembali pada media PDA. Isolat CSAJ.2 inilah yang dijadikan sebagai cendawan patogen dalam uji selanjutnya.
Gambar 5 Pertumbuhan hifa cendawan CSAJ.2 pada kokon ulat sutra emas C. trifenestrata (tanda panah)
Penapisan Bakteri Kitinolitik melalui Uji Daya Hambat terhadap Cendawan Patogen
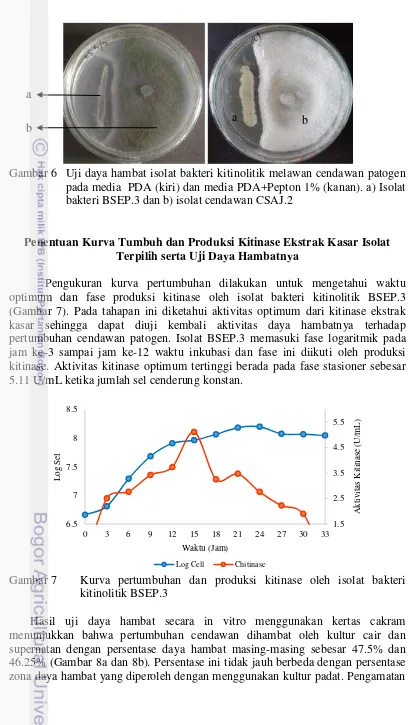
Uji daya hambat diawali dengan menumbuhkan cendawan dan bakteri secara bersamaan pada media PDA dan PDA+pepton 1% dan diinkubasi selama 5 hari. Inkubasi pada media yang berbeda bertujuan untuk melihat perbedaan antara pertumbuhan bakteri dan cendawan serta aktivitas daya hambat. Pada media PDA, pertumbuhan bakteri cenderung lebih tipis sedangkan cendawan tetap tumbuh dengan baik. Pada media PDA+Pepton 1% terlihat bahwa baik bakteri maupun cendawan tumbuh dengan baik karena media PDA+pepton merupakan media yang diperkaya dengan pepton yang merupakan sumber N bagi bakteri dan cendawan sehingga akan lebih mudah untuk melihat aktivitas daya hambat yang terjadi. Hasil uji antagonis menunjukkan bahwa dari 36 isolat bakteri kitinolitik hanya 1 isolat dengan kode BSEP.3 yang berhasil menghambat pertumbuhan cendawan patogen yang ditandai dengan terbentuknya zona hambat di sekitar cendawan (Gambar 6). Persentase penghambatan yang diperoleh oleh isolat bakteri kitinolitik BSEP.3 ialah sebesar 50%.
4
Gambar 6 Uji daya hambat isolat bakteri kitinolitik melawan cendawan patogen pada media PDA (kiri) dan media PDA+Pepton 1% (kanan). a) Isolat bakteri BSEP.3 dan b) isolat cendawan CSAJ.2
Penentuan Kurva Tumbuh dan Produksi Kitinase Ekstrak Kasar Isolat Terpilih serta Uji Daya Hambatnya
Pengukuran kurva pertumbuhan dilakukan untuk mengetahui waktu optimum dan fase produksi kitinase oleh isolat bakteri kitinolitik BSEP.3 (Gambar 7). Pada tahapan ini diketahui aktivitas optimum dari kitinase ekstrak kasar sehingga dapat diuji kembali aktivitas daya hambatnya terhadap pertumbuhan cendawan patogen. Isolat BSEP.3 memasuki fase logaritmik pada jam ke-3 sampai jam ke-12 waktu inkubasi dan fase ini diikuti oleh produksi kitinase. Aktivitas kitinase optimum tertinggi berada pada fase stasioner sebesar 5.11 U/mL ketika jumlah sel cenderung konstan.
Gambar 7 Kurva pertumbuhan dan produksi kitinase oleh isolat bakteri kitinolitik BSEP.3
Hasil uji daya hambat secara in vitro menggunakan kertas cakram menunjukkan bahwa pertumbuhan cendawan dihambat oleh kultur cair dan supernatan dengan persentase daya hambat masing-masing sebesar 47.5% dan 46.25% (Gambar 8a dan 8b). Persentase ini tidak jauh berbeda dengan persentase zona daya hambat yang diperoleh dengan menggunakan kultur padat. Pengamatan
mikroskopik dilakukan untuk melihat efek yang ditimbulkan kitinase terhadap sel cendawan patogen (Gambar 8c dan 8d).
Gambar 8 Hasil uji daya hambat bakteri kitinolitik BSEP.3 terhadap cendawan patogen CSAJ.2 pada media PDA dan pengamatan mikroskopik hifa cendawan. a) Uji daya hambat menggunakan kultur cair b) uji daya hambat menggunakan kitinase ekstrak kasar, c) hifa membengkok, dan d) hifa menggulung
Pengamatan mikroskopik menunjukkan bahwa pengaruh utama dari kitinase dapat mendegradasi dinding sel. Hifa yang terhambat pertumbuhannya menjadi tidak normal seperti hifa membengkok dan menggulung karena adanya kitinase ekstrak kasar yang dihasilkan oleh isolat bakteri kitinolitik BSEP.3 (Gambar 8c dan 8d).
Identifikasi Bakteri Kitinolitik secara Morfologi, Biokimia, dan Molekuler
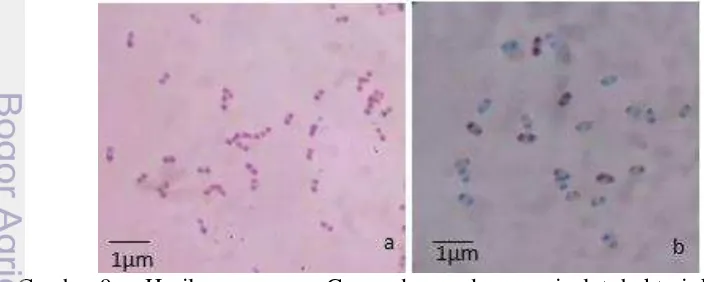
Karakterisasi Isolat BSEP.3 secara morfologi menghasilkan warna koloni putih susu, bentuk koloni keriput, tepian koloni berombak, dan elevasi berbukit-bukit. Hasil pewarnaan Gram menunjukkan bahwa isolat BSEP.3 yang diperoleh termasuk ke dalam Gram positif dengan bentuk sel batang pendek (Gambar 9 a). Isolat bakteri kemudian dilanjutkan dengan pewarnaan endospora (Gambar 9 b).
Gambar 9 Hasil pewarnaan Gram dan endospora isolat bakteri kitinolitik BSEP.3. a) Gram positif dan b) endospora
4
uji positif terhadap gliserol, salisin, selobiosa, maltosa, laktosa, D-melibiosa, D-sukrosa, D-trehalosa, L-arabinosa, D-ribosa, D-xilosa, D-raffinosa, metil-αD-glukopiranosida, amidon (Starch), glikogen, glukosa, fruktosa, D-manosa, Inositol, D-manitol, D-sorbitol, amigdalin, arbutin, dan eskulin ferik sitrat (Lampiran 4).
Isolat BSEP.3 selanjutnya diidentifikasi secara molekuler berdasarkan 16S rRNA. Hasil pengukuran kosentrasi dan kemurnian DNA genom menunjukkan bahwa kosentrasi DNA genom bakteri yang diperoleh sebesar 56.5 ng/µ L. DNA genom tersebut dijadikan cetakan (template) pada proses PCR gen pengkode 16S rRNA. Hasil visualisasi amplifikasi gen penyandi 16S rRNA pada gel agarosa 1% menghasilkan produk pita DNA berukuran ± 1300 pb (Gambar 10).
Gambar 10 Hasil visualisasi gen 16S rRNA isolat bakteri kitinolitik BSEP.3 pada gel agarosa 1%
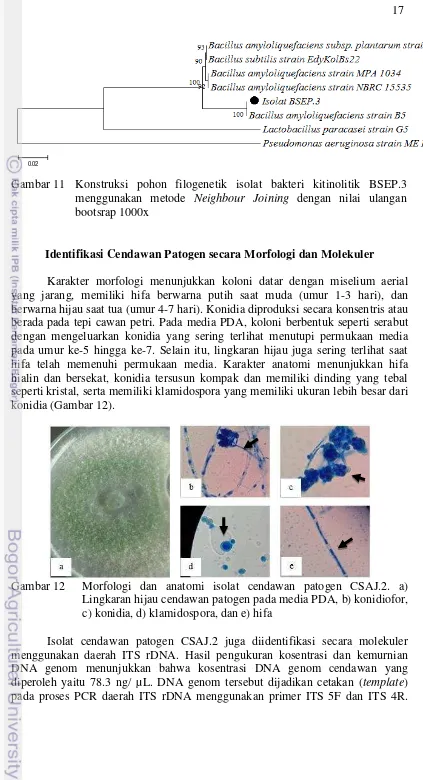
Analisis sekuen gen penyandi 16S rRNA (Lampiran 5) dengan data di Gene Bank pada program BLAST-N juga menunjukkan bahwa isolat BSEP.3 memiliki kemiripan dengan Bacillus amyloliquefaciens galur B5 sebesar 98% (Tabel 2). Hasil ini menunjukkan kemiripan dengan hasil uji biokimia. Konstruksi pohon filogenetik dilakukan untuk mengetahui kelompok dan hubungan kekerabatan isolat (Gambar 11).
Bacillus amyloliquefaciens galur B5 98 0.0 KM263703.1
Bacillus subtilis galur EdyKolBs22 98 0.0 JX625998.1
Bacillus amyloliquefaciens galur MPA 98 0.0 NR117946.1
Bacillus amyloliquefaciens galur NBRC 98 0.0 NR112685.1
M BSEP. 3
1300 bp
Gambar 11 Konstruksi pohon filogenetik isolat bakteri kitinolitik BSEP.3 menggunakan metode Neighbour Joining dengan nilai ulangan bootsrap 1000x
Identifikasi Cendawan Patogen secara Morfologi dan Molekuler
Karakter morfologi menunjukkan koloni datar dengan miselium aerial yang jarang, memiliki hifa berwarna putih saat muda (umur 1-3 hari), dan berwarna hijau saat tua (umur 4-7 hari). Konidia diproduksi secara konsentris atau berada pada tepi cawan petri. Pada media PDA, koloni berbentuk seperti serabut dengan mengeluarkan konidia yang sering terlihat menutupi permukaan media pada umur ke-5 hingga ke-7. Selain itu, lingkaran hijau juga sering terlihat saat hifa telah memenuhi permukaan media. Karakter anatomi menunjukkan hifa hialin dan bersekat, konidia tersusun kompak dan memiliki dinding yang tebal seperti kristal, serta memiliki klamidospora yang memiliki ukuran lebih besar dari konidia (Gambar 12).
Gambar 12 Morfologi dan anatomi isolat cendawan patogen CSAJ.2. a) Lingkaran hijau cendawan patogen pada media PDA, b) konidiofor, c) konidia, d) klamidospora, dan e) hifa
Isolat cendawan patogen CSAJ.2 juga diidentifikasi secara molekuler menggunakan daerah ITS rDNA. Hasil pengukuran kosentrasi dan kemurnian DNA genom menunjukkan bahwa kosentrasi DNA genom cendawan yang diperoleh yaitu 78.3 ng/ µL. DNA genom tersebut dijadikan cetakan (template) pada proses PCR daerah ITS rDNA menggunakan primer ITS 5F dan ITS 4R.
0.02
4
Hasil visualisasi pada gel agarosa 1% menghasilkan produk pita DNA berukuran ± 700 pb (Gambar 13).
Gambar 13 Hasil visualisasi gen ITS rDNA isolat cendawan patogen CSAJ.2 pada gel agarosa 1%
Analisis sekuen gen penyandi daerah ITS rDNA (Lampiran 6) dengan data di Gene Bank pada program BLAST-N menunjukkan bahwa isolat cendawan CSAJ.2 diduga memiliki kemiripan dengan Trichoderma virens galur TV242 sebesar 100%.
Tabel 3 Analisis homologi sekuen gen ITS rDNA isolat cendawan CSAJ.2 menggunakan program BLAST-N
Kode
Isolat Homologi
% Identitas
E- Value
No Akses
CSAJ.2
Trichoderma virens galur TV242 100 0.0 KP263703.1
Trichoderma koningiopsis galur QSQ4004 100 0.0 JQ040366.1
Trichoderma virens galur TR039 100 0.0 HQ608079.1
Hypocrea virens galur 35CP 100 0.0 GU066623.1
Ukuran nukleotida yang digunakan untuk konstruksi pohon filogenetik ialah sepanjang 55p pb. Konstruksi pohon filogenetik dilakukan untuk mengetahui kelompok dan hubungan kekerabatan isolat. Isolat cendawan CSAJ.2 berkerabat dekat dengan dengan Trichoderma virens yang merupakan cendawan anamorf dari Hypocrea virens (Gambar 14).
Gambar 14 Konstruksi pohon filogenetik isolat cendawan patogen CSAJ.2 menggunakan metode Neighbour Joining dengan nilai ulangan bootsrap 1000x
Aplikasi Kitinase Ekstrak Kasar pada Pupa Sehat secara In vivo
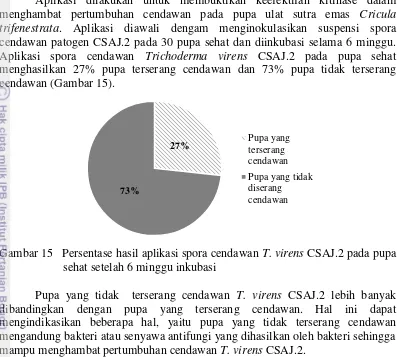
Aplikasi dilakukan untuk membuktikan keefektifan kitinase dalam menghambat pertumbuhan cendawan pada pupa ulat sutra emas Cricula trifenestrata. Aplikasi diawali dengam menginokulasikan suspensi spora cendawan patogen CSAJ.2 pada 30 pupa sehat dan diinkubasi selama 6 minggu. Aplikasi spora cendawan Trichoderma virens CSAJ.2 pada pupa sehat menghasilkan 27% pupa terserang cendawan dan 73% pupa tidak terserang cendawan (Gambar 15).
Gambar 15 Persentase hasil aplikasi spora cendawan T. virens CSAJ.2 pada pupa sehat setelah 6 minggu inkubasi
Pupa yang tidak terserang cendawan T. virens CSAJ.2 lebih banyak dibandingkan dengan pupa yang terserang cendawan. Hal ini dapat mengindikasikan beberapa hal, yaitu pupa yang tidak terserang cendawan mengandung bakteri atau senyawa antifungi yang dihasilkan oleh bakteri sehingga mampu menghambat pertumbuhan cendawan T. virens CSAJ.2.
Pembuktian mengenai argumen ini dilakukan dengan cara mengisolasi kembali bakteri yang ada pada pupa yang tidak terserang cendawan sama sekali dan menguji daya hambatnya terhadap T. virens CSAJ.2. Hasil menunjukkan terdapat 1 jenis bakteri yang memiliki karakter morfologi dan pewarnaan Gram yang sama dengan isolat B. amyloliquefaciens BSEP.3 yang mampu menghambat pertumbuhan cendawan T. virens CSAJ.2 Sebaliknya, pupa yang terserang cendawan terlihat ditumbuhi oleh hifa cendawan yang berwarna putih sehingga membuat kokon terlihat berwarna lebih kusam dari sebelum diinokulasi spora cendawan. Pupa tersebut kemudian diaplikasikan dengan kitinase ekstrak kasar dengan konsentrasi 5.11 U/mL dan diinkubasi selama 8 hari. Hasil inkubasi menunjukkan adanya pengurangan hifa (Gambar 16).
27%
73%
Pupa yang terserang cendawan Pupa yang tidak diserang cendawan
4
Gambar 16 Urutan aplikasi kitinase ekstrak kasar B. amyloliquefaciens BSEP.3. a) Pupa sehat (kontrol) b) pupa yang telah terserang T. virens CSAJ.2 c) pupa yang telah diaplikasikan kitinase ekstrak kasar B. amyloliquefaciens BSEP.3 setelah 8 hari inkubasi
Pembahasan
Sebanyak 36 bakteri kitinolitik telah berhasil diisolasi pada media agar-agar kitin dan keseluruhan isolat juga mampu membentuk zona bening. Adanya zona bening di sekitar koloni menunjukkan kemampuan bakteri tersebut dalam mendekomposisi substrat berupa koloidal kitin yang terdapat dalam media sebagai sumber karbon untuk pertumbuhannya (Liu et al. 2011). Semakin tinggi tingkat dekomposisi substratnya maka semakin besar zona bening yang terbentuk. Zona bening di sekitar koloni juga dapat merepresentasikan adanya suatu senyawa yang dikeluarkan oleh isolat bakteri kitinolitik (Yu et al. 2008). Isolat bakteri kitinolitik BSEP.3 adalah satu-satunya isolat yang mampu menghambat pertumbuhan cendawan patogen bila dibandingkan dengan isolat-isolat lainnya pada penelitian ini.
Isolat bakteri kitinolitik BSEP.3 diduga mengeluarkan suatu senyawa antifungi yang dapat menghambat pertumbuhan cendawan dengan persentase zona daya hambat yang diperoleh ialah sebesar 50%. Hal ini menunjukkan bahwa isolat BSEP.3 memiliki kemampuan untuk dijadikan sebagai pengendali biologi. Pengendalian biologi terhadap cendawan patogen dengan menggunakan bakteri merupakan cara yang efektif. Bakteri memiliki kemampuan untuk menghambat cendawan patogen dengan berbagai cara, antara lain dengan menghasilkan berbagai senyawa yang dapat menghambat pertumbuhan cendawan, seperti antibiotik, enzim litik dan induksi ketahanan tanaman dengan aktivitasi gen
seperti kitinase, β-1.3 glukanase, peroksidase, dan phenilalanine ammonia liase (Chang et al. 2007). Kitinase diutamakan dalam pengendalian biologi terhadap cendawan patogen saat ini karena kemampuannya dalam mendegradasi kitin pada dinding sel cendawan (Yu et al. 2008).
Kitinase belum dihasilkan pada awal fase pertumbuhan. Hal ini terjadi karena isolat BSEP.3 masih berada pada fase adaptasi terhadap nutrisi yang ada dalam media. Pengukuran kitinase menunjukkan bahwa isolat BSEP.3 masih berada pada fase lag pada 3 jam pertama waktu inkubasi. Hal ini terjadi karena isolat BSEP.3 masih beradaptasi terhadap media baru untuk memanfaatkan nutrisi yang ada bagi pertumbuhannya. Isolat BSEP.3 memasuki fase logaritmik pada
c
jam ke-3 sampai jam ke-12 dan pada fase ini mulai diikuti oleh produksi kitinase. Aktivitas kitinase optimum tertinggi berada pada fase stasioner sebesar 5.11 U/mL ketika jumlah sel cenderung konstan. Hasil yang sama juga dilaporkan oleh Han et al. (2014) pada Serratia sp. dan Bacillus sp. Penelitian lain oleh Natsir et al. (2010) juga menyatakan bahwa kitinase secara optimal dihasilkan pada fase stasioner. Hal ini terjadi karena pada fase stasioner terjadi penurunan jumlah nutrisi pada media sehingga kitinase ekstraseluler disekresikan dalam jumlah yang tinggi untuk mendegradasi koloidal kitin dalam media menjadi monomer N-asetilglukosamin yang dapat digunakan sebagai sumber karbon dan nitrogen bagi pertumbuhannya (Thompson et al. 2001).
Kitinase pada penelitian ini dihasilkan lebih cepat dan lebih tinggi bila dibandingkan dengan kitinase yang dihasilkan oleh Bacillus cereus yang diisolasi dari rizosfer cabai sebesar 0.75 U/mL (Mubarik et al. 2010). Penelitian lain menunjukkan bakteri kitinolitik membentuk aktivitas antifungi pada jam ke-10 saat fase logaritmik. Perbedaan waktu dalam pembentukan aktivitas antifungi dapat disebabkan oleh asal isolasi dan komposisi medium yang berbeda sehingga bakteri kitinolitik juga memiliki cara yang berbeda dalam merespon dan menggunakan nutrisi dalam media (Wang et al. 2012).
Hasil uji daya hambat secara in vitro menunjukkan bahwa pertumbuhan cendawan dihambat oleh kultur cair dan supernatan dengan nilai persentase penghambatan yang tidak jauh berbeda dengan menggunakan kultur padat. Hal ini membuktikan bahwa memang ada senyawa yang dikeluarkan oleh bakteri sehingga mempu menghambat pertumbuhan cendawan patogen. Fenomena ini dibuktikan dengan hasil pengamatan mikroskopik pada bagian hifa yang terhambat pertumbuhannya. Pengamatan mikroskopik menunjukkan bahwa pengaruh utama dari kitinase ialah untuk mendegradasi dinding sel. Hal Ini juga merupakan fungsi utama dari kitinase, yang merupakan salah satu protein antifungi paling penting yang dihasilkan oleh Bacillus sp. yang dapat mendegradasi kitin pada dinding sel sehingga dinding sel pada hifa lisis dan protoplasma menjadi bocor (Liu et al. 2011). Pengamatan mikroskopik hifa memperlihatkan bahwa hifa yang terhambat pertumbuhannya menjadi tidak normal seperti hifa membengkok dan menggulung karena adanya kitinase ekstrak kasar yang dihasilkan oleh isolat bakteri kitinolitik BSEP.3.
Berdasarkan gen 16S rRNA, isolat bakteri kitinolitik BSEP.3 teridentifikasi sebagai Bacillus amyloliquefaciens galur B5 dengan ukuran pita DNA 1300 pb. Gen 16S rRNA merupakan marka molekuler yang bersifat ubikuitus sehingga dapat digunakan untuk identifikasi bakteri. Bacillus amyloliquefaciens telah dikenal sebagai bakteri penghasil kitinase yang umum digunakan untuk degradasi kitin yang merupakan polisakarida terbanyak setelah selulosa (Hutsebaut et al. 2006). Bakteri ini sangat berkerabat dekat dengan kelompok B. subtilis karena sebelumnya dianggap sebagai galur B. subtilis dan hanya dibedakan berdasarkan analisis urutan 16S rDNA (Chun dan Bae 2000). Hutsebaut et al. (2006) melaporkan bahwa urutan gen 16S rRNA pada B. subtilis dan B. amyloliquefaciens menunjukkan kemiripan lebih dari 99%.
4
B. amyloliquefaciens. Laporan penelitian oleh Kucuk dan Kivanc (2004)
menyatakan bahwa aktivitas kitinase dan β-1,3 glukanase yang dihasilkan oleh Bacillus sp. dapat mendegradasi dinding sel cendawan Trichoderma sp.
Karakterisasi morfologi cendawan patogen CSAJ.2 yang diperoleh merupakan karakter yang sesuai dengan morfologi dan anatomi yang dimiliki oleh Trichoderma virens. Suhu optimum untuk pertumbuhan T. virens ialah 30 oC pada media PDA. Hal ini sejalan dengan hasil penelitian Stewart et al. (2001) yang juga menyatakan bahwa suhu optimum untuk pertumbuhan T. virens berkisar antara 25-30 oC. Karakter morfologi menunjukkan koloni datar dengan miselium aerial yang jarang, memiliki hifa berwarna putih saat muda (umur 1-3 hari) dan berwarna hijau saat tua (umur 4 sampai 7 hari). Warna hijau yang terbentuk pada hifa karena T. virens telah menghasilkan konidia. Konidia diproduksi secara konsentris atau berada pada tepi cawan petri. Pada media PDA, koloni berbentuk seperti serabut dengan mengeluarkan konidia yang sering terlihat menutupi permukaan media. Selain itu, lingkaran hijau juga sering terlihat saat hifa telah memenuhi permukaan media.
Gen ITS rDNA memiliki arti yang penting dalam menghasilkan rRNA sehingga dapat dijadikan sebagai metode sederhana untuk menentukan variabilitas antar inter atau intraspesies cendawan. Identifikasi isolat cendawan patogen secara molekuler menggunakan daerah ITS rDNA juga menunjukkan kesamaan dengan hasil uji biokimia yaitu Trichoderma virens galur TV242 dengan ukuran pita DNA 700 pb. Hasil ini sesuai dengan berbagai laporan penelitian yang menyebutkan bahwa untuk cendawan Trichoderma pada berbagai spesies berkisar antara 600-700 pb (Chakraborty et al. 2010). Trichoderma virens dikenal sebagai cendawan tanah yang yang memiliki kemampuan hidup dan daya bersaing yang tinggi sebagai hiperparasit yang merupakan parasit pada cendawan parasit lainnya sehingga umum dijadikan sebagai pengendali biologi terhadap cendawan patogen lainnya (Pozo et al. 2004). Namun, pada penelitian ini T. virens CSAJ.2 berperan sebagai cendawan perusak bagi kokon ulat sutra emas yang dapat menurunkan kualitas dan kuantitas ulat sutra emas C. trifenstrata. Pada penelitian lain, Trichoderma sp. juga diduga dapat membuka jalan bagi bakteri untuk meningkatkan penyakit pada tanaman tomat (Lange dan Smart 2005).
proliferasi spora. Beberapa senyawa yang dikerluarkan oleh T. virens, yaitu lipase, amilase, protease, pospatase, dan esterase.
Dari hasil penelitian ini, cendawan T. virens CSAJ.2 diduga menyerang kokon pada fase larva, karena pada fase ini keadaan larva masih rentan terhadap serangan patogen (Genthner et al. 1997). Larva yang terserang berkembang menjadi tidak normal sehingga tidak mampu membentuk kokon. Kemungkinan lain jika mampu membentuk kokon, kokon juga ikut terserang cendawan sehingga tidak dapat diolah menjadi produk seperti kain sutera, kap lampu, dan berbagai asesoris lainnya. Cendawan juga dapat menyerang kokon untuk memanfaatkan nutrisi yang ada pada kokon.
Aplikasi kitinase ekstrak kasar secara in vivo pada penelitian ini membuktikan bahwa kitinase ekstrak kasar memang efektif dalam mengendalikan pertumbuhan cendawan patogen CSAJ.2 pada kokon ulat sutra emas C. trifenestrata. Kitinase dapat mengendalikan pertumbuhan cendawan patogen baik secara preventif maupun kuratif. Kitin pada dinding sel cendawan akan menginduksi kitinase sehingga diharapkan kokon ulat sutera emas C. trifenestrata terangsang untuk memiliki respon ketahanan terhadap serangan cendawan.
SIMPULAN DAN SARAN
Simpulan
Sebanyak 36 isolat bakteri kitinolitik dan 10 isolat cendawan patogen berhasil diperoleh dari kokon ulat sutra emas Cricula trifenestrata. Isolat CSAJ.2 diduga sebagai cendawan patogen dan isolat BSEP.3 merupakan satu-satunya isolat yang memiliki aktivitas kitinase dan daya hambat terhadap cendawan patogen. Isolat BSEP.3 diidentifikasi sebagai Bacillus amyloliquefaciens berdasarkan karakter biokimia dan gen 16S rRNA, sedangkan isolat CSAJ.2 diidentifikasi sebagai Trichoderma virens berdasarkan karakter morfologi dan molekuler menggunakan daerah ITS rDNA.
Saran
Perlu dilakukan kajian mengenai Trichoderma virens sebagai cendawan patogen, yang sebelumnya pada penelitian lain dikenal sebagai pengendali biologi terhadap cendawan patogen. Selain itu, juga perlu dilakukan pemurnian kitinase dan uji antagonis lebih lanjut terhadap kokon ulat sutera emas Cricula trifenestrata yang terserang cendawan patogen di alam.
4
DAFTAR PUSTAKA
Anitha A, Rabeeth M. 2010. Degradation of fungal cell walls of phytopathogenic fungi by lytic enzyme of Streptomyces griseus. Afr J Plant Sci. 4(3):61-66.
Aranaz I, Mengíbar M, Panos RH, Miralles B, Acosta N, Galed G, Heras A. 2009. Functional characterization of chitin and chitosan. J Chem Biol. 3(3):203-230.
Dutta PK, Dutta J, Tripathi VS. 2004. Chitin and chitosan: chemistry, properties and application. J Sci Indust Res. 63(1): 20-31.
Barnett HL, Hunter BB. 1987. Illustratred Genera of Imperfecti Fungi. Ed ke-4. New York (US): Macmilan Publ Company.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72(1):248-254.
Chakraborty BN, Chakraborty U, Saha A, Dey PL, Sunar K. 2010. Molecular characterization of Trichoderma viride and Trichoderma harzianum isolated from soils of North Bengal based on rDNA markers and analysis of their PCR-RAPD profiles. Global J Biotechnol Biochem. 5(1): 55-61. Chang WT, Chen YC, Jao CL. 2007. Antifungal activity and enhancement of
plant growth by Bacillus cereus grown on shellfish chitin wastes. Biores Technol. 98(6):1224-1230.
Chun J, Bae KS. 2000. Phylogenetic analysis of Bacillus subtilis and related taxa based on partial gyrA gene sequences. Anton Leeuw Int JG. 78(1):123-127.
Domenech J, Reddy MS, Kloepper JW, Ramos B, Manero FJG. 2006. Combined application of the biological product LS213 with Bacillus, Pseudomonas or Chryseobacterium for growth promotion and biological control of soilborne diseases in pepper and tomato. Bio Control. 51(2):245-258. Dutta PK, Dutta J, Tripathi VS. 2004. Chitin and chitosan: chemistry, properties,
and application. J Sci Indust Res. 63(1):20-31.
El-Katatny MH, Somitsch W, Robra KH, El-Katatny MS, Gilbitz GM. 2000.
Production of chitinase and β 1,3-glucanase by Trichoderma harzianum for control of the phytopathogenic fungus Sclerotium rolfsii. Food Technol Biotechnol. 38:173-180.
Ferron. 1985. Fungal Control. Di dalam: Kerkut IGA, Gilbert LI, executive editors. Comprehensive Insect Physiology, Biochemistry and Pharmacology. Oxford (GB): Pergamon Pr. p:313-346.
Fokkema NJ. 1973. The role of saprophytic fungi in antagonism against Drechslera sorokiniana (Helminthosporium sativum) on agar plates and on rye leaves with pollen. Phys Plant Pathol. 3:195-205.
Fravel LJ, Wanten P, Blok W. 2004. Biological soil disinfestation: a safe and effective approach for controlling soilborne pests and diseases. Agroindustria. 3(3):289-291.
Gooday GW. 1994. Physiology of Microbial Degradation of Chitin and Chitosan. Di dalam: Ratledge C, editor. Biochemistry of Microbial Degradation. Amsterdam (NL): Kluwer Academic Publ. p:279-312.
Han K, Patnaik BB, Cho AR, Lim JK, Lee JM, Jang YG, Jeong YS, Yoo TK, Lee GS, Han MD. 2014. Characterization of chitinase-producing Serratia and Bacillus strains isolated from insects. Entomol Res. 44:109-120.
Hee RC. 1998. Panduan Teknis Persutraan Alam Indonesia. Surabaya (ID): PT Indojado Sutra Pratama, Silk Industri.
Herdyastuti N, Raharjo JT, Mudasir, Matsjeh S. 2009. Kitinase dan mikroorganisme kitinolitik: isolasi, karakterisasi dan manfaatnya. Indones J Chem. 9(1):31-38.
Hillis DM, Moritz C, Porter CA, Baker RJ. 1991. Evidence for biased gene conversion in concerted evolution of ribosomal DNA. Science. 251:308-310.
Hutsebaut D, Vandroemme J, Heyrman J, Dawyndt P, Vandenabeele P, Moens L, de Vos P. 2006. Raman microspectroscopy as an identification tool within the phylogenetically homogeneous Bacillus subtilis-group. Syst Appl Microbiol. 29(1):650-660.
Kalshoven LGE. 1981. Pest of Crop in Indonesia. Penerjemah: Laan PA van der. Jakarta (ID): Ichtiar baru/Van Hoeve.
Kim YC, Jung H, Kim KY, Park SK. 2008. An effective biocontrol bioformulation against Phytophthora blight of pepper using growth mixtures of combined chitinolytic bacteria under different field conditions. Eur J Plant Pathol. 120(4):373-382.
Kucuk C, Kivanc M. 2004. In vitro antifungal activity of strain of Trichoderma harzianum. J Biol. 25(1):111-115.
Lange HW, Smart CD. 2005. Comparing efficacy of foliar and soil treatments for bacterial speck of tomato. Fungic Nematic Tests. 60(82):712-716.
Lim J, Helim TH, Cha B. 2002. Isolation and identification of Colletotrichum musae from imported bananas. Plant Pathol J. 18:161-164.
Liu Y, Tao J, Yan Y, Li B, Li H, Li C. 2011. Biocontrol Efficiency of Bacillus silkworm, Bombyx mori Linn. A review. Caspian J Environ Sci. 5(2):63-67.
Matsumoto KS. 2006. Fungal chitinases. J Agric Food Biotechnol. 28(2):93-94. Metcalfe AC, Krsek M, Gooday GW, Prosser J, Wellington EMH. 2002.
Molecular analysis of a bacterial chitinolytic community in an upland pasture. Appl Environ Microbiol. 68:5042-5050.
Mubarik NR, Mahagiani I, Anindyaputri A, Santoso S, Rusmana I. 2010. Chitinolytic bacteria isolated from chili rhizosphere: chitinase characterization and its application as biocontrol for whitefly (Bemisia tabaci Genn). Am J Agric Biol Sci. 5(4):430-435.