PRODUKSI NANOEMULSI EKSTRAK DAUN GEDI
(
Abelmoschus manihot
L. Medik) DAN UJI POTENSINYA
SEBAGAI HEPATOPROTEKTOR
DODYK PRANOWO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Produksi Nanoemulsi Ekstrak Daun Gedi (Abelmoschus manihot L. Medik) dan Uji Potensinya Sebagai Hepatoprotektor adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
DODYK PRANOWO. Produksi Nanoemulsi Ekstrak Daun Gedi (Abelmoschus manihot L. Medik) dan Uji Potensinya Sebagai Hepatoprotektor. Dibimbing oleh ERLIZA NOOR, LIESBETINI HARDITJAROKO dan AKHIRUDDIN MADDU.
Tanaman Gedi (Abelmoschus manihot L. Medik) merupakan tanaman yang termasuk dalam famili tanaman berbunga (malvacea) dan memiliki genus abelmoschus, habitat alami tanaman gedi adalah daerah tropis hingga sub-tropis. Hasil karakterisasi ekstrak etanol daun tanaman gedi menunjukkan bahwa daun tanaman gedi memiliki senyawa flavonoid glikosida yang berpotensi sebagai sumber antioksidan. Pada umumnya senyawa flavonoid yang dihasilkan dari ekstrak tanaman memiliki ukuran partikel yang sangat besar, hal ini berdampak pada rendahnya tingkat kelarutan dan bioaviabilitas dari senyawa tersebut. Untuk mengatasi permasalahan tersebut perlu dilakukan modifikasi terhadap penanganan flavonoid glikosida yang terdapat dalam daun gedi sehingga ketika ditransformasi ke dalam tubuh masih memiliki kemampuan sebagai sumber antioksidan dengan bioaviabilitas yang tinggi, dan mampu berperan sebagai hepatoprotektor.
Tujuan dari penelitian ini adalah untuk mendapatkan teknologi produksi nanoemulsi ekstrak etanol daun gedi yang terbaik sebagai hepatoprotektor yang dilakukan dengan mendapatkan parameter-parameter standarisasi daun gedi diantaranya adalah kadar senyawa yang larut dalam air, kadar senyawa yang larut dalam etanol, kadar flavonoid total, kadar abu, kadar air, total bakteri dan total kapang serta kadar logam timbal, kemudian mendapatkan kondisi proses ekstraksi daun geni yang optimum terhadap rendemen ekstrak etanol dan aktivitas antioksidan yang dihasilkan, hasil dari ekstraksi kemudian dilakukan pembuatan nanoemulsi ekstrak etanol daun gedi dan selanjutnya di uji sebagai hepatoprotector secara in vivo.
Berdasarkan pada hasil penelitian menunjukkan simplisia daun gedi telah memenuhi standar MMI dengan kadar air 7,45 ± 0,28 %bk, kadar abu total 10,46 ± 0,33% bk, kadar abu tidak larut asam 0,96 ± 0,03 %bk, kadar sari larut air 12,80 ± 0,20 %bk, kadar sari larut etanol 17,44 ± 0,16 %bk. Ekstrak etanol daun gedi juga telah memenuhi standar Perka BPOM No 12. Tahun 2014 tentang persyaratan mutu sediaan obat, dimana ekstrak etanol yang dihasilkan memiliki kadar air 5,60 ± 0,37 %b/b, kadar abu total 12, 82 ± 0,44 % b/b, kadar abu tidak larut asam 0,24 ± 0,05 %b/b, bobot jenis ekstrak pada pengenceran 5% 0, 83 ± 0,01, bobot jenis ekstrak pada pengenceran 10% 0,85 ± 0,02, total cemaran bakteri 2,1 x 103 koloni g-1, total cemaran kapang 3,6 x 103 koloni g-1, dan kadar timbal sebesar 4,67 ± 0,03 %.Konsentrasi pelarut yang paling baik untuk mengekstrak flavonoid dari daun gedi adalah pelarut etanol dengan konsentrasi sebesar 96% dengan flavonoid total yang didapat sebesar 37,29 ± 0,40 mg g-1 dengan aktivitas antioksidan IC50 512,41 ± 3,44 µg ml-1.
Persamaan regresi berganda ekstraksi daun gedi yang dihasilkan adalah Total Flavonoid = 55.138 -0.229X1+ 0.430X2 + 1.273X3 - 1.553X12 - 1.465X22 -
0.829X32. Berdasarkan persamaan tersebut kondisi proses yang optimal didapat
Faktor yang paling berpengaruh pada proses ekstraksi ini adalah waktu ekstraksi > kecepatan pengadukan > suhu ekstraksi. Aktivitas antioksidan ekstrak daun gedi dinyatakan dalam IC50 sebesar 383,49 µg ml-1.
Dengan teknik homogenisasi dan evaporasi, nanoemulsi ekstrak daun gedi terbaik diperoleh pada kecepatan homogenisasi sebesar 20.000 rpm (G-force 2.912 × g) selama 10 menit dengan ukuran partikel yang dihasilkan adalah 100 ± 4 nm, sedangkan nilai konduktivitas dan pH sebesar 259,55 ± 0,59 µS cm-1 dan 6,73 ± 0,00. Kadar total flavonoid pada kondisi proses terbaik lebih rendah dibandingkan dengan ekstrak etanol daun gedi, namun memiliki aktivitas antioksidan lebih tinggi (IC50 = 467,55 ± 0,36 µg ml-1). Stabilitas ukuran partikel nanoemulsi ekstrak daun gedi selama 14 hari tidak berbeda nyata, namun untuk parameter konduktivitas, pH, kadar flavonoid total dan aktivitas antioksidan cenderung tidak stabil
Berdasarkan pada hasil evaluasi biokimia dan hispatologi, dosis yang paling baik sebagai hepatoprotektor adalah larutan nanoemulsi ekstrak etanol daun gedi sebesar 2 ml kg-1 berat badan memberikan nilai SGPT, SGOT, total bilirubin dan total albumin masing-masing sebesar 60,87 ± 8,65 U ml-1, 76,16 ± 1,94 U ml-1, 67,3 ± 7,9 µg ml-1, 15,9 ± 1,0 mg ml-1
Secara keseluruhan, tanaman gedi memiliki potensi untuk dikembangkan sebagai salah satu sumber antioksidan baru yang memiliki peluang sebagai hepatoprotektor. Oleh karena itu, kedepan perlu dikembangkan lebih lanjut aplikasi sediaan nanoemulsi sebagai bahan obat.
SUMMARY
DODYK PRANOWO. Production of Nanoemulsion of Extract Abelmoschus manihot L. Medik Leaves and Its Potential For A Hepatoprotector. Supervised by ERLIZA NOOR, LIESBETINI HARDITJAROKO and AKHIRUDDIN MADDU.
Abelmoschus manihot L. Medik, a plant belong to the family and genus of malvacea and abelmoschus respectively and has the natural habitat in the area of tropics to sub-tropics, is locally known as Gedi. Characterization on the ethanolic extract of the Gedi leaves indicated that the leaves contain flavonoid glycosides, a compound that have the potential as a source for antioxidants. However, flavonoid products produced from plant extracts generally have a large particle size which adversely affects its solubility and bioavailability. Therefore, modifications on the particle size of the flavonoid glycosides which particularly found in the Gedi leaves is required to maintain its antioxidant activity, bioavailability and capability to acts as a hepatoprotector.
The aim of the present study was to obtain the optimum production process of nanoemulsion of ethanolic extract of Gedi leaves as a hepatoprotector. The methods included were as follows. First, characterization on the Gedi leaves which measured the water-soluble compounds, ethanol-soluble compounds, total flavonoid content, ash content, water content, total bacteria and fungi, and the total heavy metal content. Next, optimization of the extraction processes was investigated based on the yield of the ethanol extracts and the antioxidant activites. Then, production of a nanoemulsion from the ethanol extract of the leaves was conducted, followed by in-vivo tests to explore its capability as a hepatoprotector.
Characterization on simplicia the Gedi leaves showed that it consist of 7.45 ± 0.28 wt% water, 10.46 ± 0.33 wt% total ash, 0.96 ± 0.03 wt% acid insoluble ash, 12.80 ± 0.20 wt% water soluble extract and 17.44 ± 0.16% ethanol soluble extract, all of which met the standard of Materia Medika Indonesia (MMI). Characterization on the ethanol extract of Gedi leaves also met the Indonesia regulation cited from BPOM No. 12 2014 about drug preparations quality requirements, containing 5.60 ± 0.37 wt% water , 12.82 ± 0.44 wt% total ash, 0.24 ± 0.05 wt% acid insoluble ash , 5% 0, 83 ± 0.01 specific gravity of the dilution, 0.85 ± 0.02 specific gravity at 10% dilution, of 2.1 x 103 colonies g-1 total bacterial contamination, 3.6 x 103 colonies g-1 total contamination of mold, and 4.67 ± 0,03% soluble lead. The better condition for the flavonoids extraction was using 96% of ethanol, resulting in total of 37.29 ± 0.40 mg g-1 flavonoid with antioxidant activity IC50 of 3.44 ± 512.41 µg ml-1 .
Using a maceration method, the optimum extraction time of the Geni leaves was obtained at 4.83 hours and the temperature at 34.33 oC and stirring speed by 322 rpm , resulting a total flavonoid of 55.41 mg g-1. The significant factors of the extraction process from the most important order were: extraction time> stirring speed > extraction temperature, resulting in a maximum antioxidant activity IC50 of 383.49 µg ml-1 .
size, The conductivity and pH values were 259.55 ± 0.59 µS cm-1 and 6.73 respectively. The total of flavonoids in the optimum condition was found smaller than that of in the ethanol extract, but it had a higher antioxidant activity (IC50 = 467.55 ± 0.36 µ g ml-1). The particle sizes of the nanoemulsion was stable for 14 days. However, the other parameters, such as conductivity, pH, total flavonoid content and antioxidant activity tends to be unstable.
The biochemistry and histopathology evaluation showed that of the nanoemulsion was recommended , as hepatoprotector at 2 ml kg-1 body weight, providing the value of SGPT, SGOT, total bilirubin and total albumin at60.87 ± 8.65 U ml-1, 76.16 ± 1.94 U ml-1, 67.3 ± 7.9 µg ml-1, 15.9 ± 1.0 mg ml-1 respectively.
Overall, the Gedi leaves has the potential to be developed as a source of new antioxidant for hepatoprotective agent. Therefore, development in applications of Gedi leaves nanoemulsion as a medicinal ingredient was recommended.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Teknologi Industri Pertanian
PRODUKSI NANOEMULSI EKSTRAK DAUN GEDI
(
Abelmoschus manihot
L. Medik) DAN UJI POTENSINYA
SEBAGAI HEPATOPROTEKTOR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Penguji pada Ujian Tertutup:
Dr. Indah Yuliasih, S.TP, M.Si Dr. Sri Yuliani
Penguji pada Ujian Terbuka:
Dr. Sri Yuliani
Judul Tesis : Produksi Nanoemulsi Ekstrak Daun Gedi (Abelmoschus manihot L. Medik) dan Uji Potensinya Sebagai
Hepatoprotektor Nama : Dodyk Pranowo
NIM : F-361107221
Disetujui oleh Komisi Pembimbing
Prof. Dr. Ir. Erliza Noor Ketua
Dr. Ir. Liesbetini Harditjaroko, MS Anggota
Dr Akhiruddin Maddu,S.Si. MSi Anggota
Diketahui oleh
Ketua Program Studi
Teknologi Industri Pertanian
Prof. Dr. Ir. Machfud, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahuwataala atas segala karunia-Nya sehingga karya ilmiah ini bisa diselesaikan. Tema yang dipilih dalam penelitian ini adalah pengembangan proses, dengan judul “Produksi Nanoemulsi Ekstrak Daun Gedi (Abelmoschus manihot L. Medik) dan Uji Potensinya Sebagai Hepatoprotektor”
Penulis mengucapkan terimakasih kepada Prof. Dr. Erliza Noor sebagai ketua komisi pembimbing; Dr. Ir. Liesbetini Haditjaroko, MS dan Dr. Akhiruddin Maddu S.Si, M.Si, sebagai anggota komisi pembimbing, Serta Dr. Indah Yuliasih, S.TP, M.Si, Dr. Sri Yuliani, Dr. Akhmad Endang Zainal Hasan sebagai Penguji luar dalam sidang tertutup dan sidang promosi atas arahan, saran dan masukan terhadap penelitian ini. Penulis juga mengucapkan terimakasih kepada Direktorat Jenderal Perguruan Tinggi Depdiknas RI, atas bantuan berupa beasiswa pendidikan BPDN.
Tidak lupa ungkapan terimakasih juga disampaikan kepada istri tercinta Ruri Siti Resmisari, S.Hut. M.Si, ananda Akhilla Meisya, ayah (almarhum) dan ibu, kedua mertua dan seluruh keluarga, atas segala doa dan kasih sayangnya. Untuk bantuan yang diberikan kepada penulis dari banyak pihak dan perorangan yang tidak bisa disebutkan satu persatu, terutama kepada rekan-rekan angkatan 2010 diucapkan terimakasih. Semoga karya ilmiah ini bermanfaat bagi pengembangan biofarmaka di Indonesia.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 4
Ruang Lingkup Penelitian 4
Manfaat Penelitian 5
Kebaruan 5
2 METODE 6
Bahan 6
Alat 6
Tahapan Penelitian 6
3 KARAKTERISASI SIMPLISIA DAN EKSTRAK DAUN GEDI
(Abelmoschus manihot L.Medik) SEBAGAI BAHAN SEDIAAN OBAT 8
Pendahuluan 8
Metode 9
Hasil dan Pembahasan 11
Simpulan dan Saran 17
4 OPTIMASI PROSES EKSTRAKSI FLAVONOID DAUN GEDI
(Abelmoschus manihot L. Medik) MENGGUNAKAN METODE CENTRAL COMPOSITE DESIGN (CCD) DAN UJI AKTIVITAS
ANTIOKSIDANNYA 18
Pendahuluan 18
Metode Penelitian 19
Hasil Dan Pembahasan 21
Analisis Respon Permukaaan 24
Optimasi dan Verifikasi 25
Aktivitas Antioksidan Daun Gedi 26
Simpulan 26
Saran 26
5 PRODUKSI NANOEMULSI EKSTRAK DAUN GEDI (Abelmoschus manihot L. Medik) DENGAN TEKNIK KOMBINASI HOMOGENISASI
DAN EVAPORASI 27
Pendahuluan 27
Alat dan Bahan 28
Simpulan dan Saran 43 6 KAJIAN POTENSI NANOEMULSI EKSTRAK DAUN GEDI
(Abelmoschus manihot L. Medik) SEBAGAI HEPATOPROTEKTOR 44
Pendahuluan 44
Alat dan Bahan 44
Metode 45
Hasil dan Pembahasan 46
Simpulan dan Saran 51
7 PEMBAHASAN UMUM 52
8 SIMPULAN DAN SARAN 57
Simpulan 57
Saran 57
DAFTAR PUSTAKA 58
DAFTAR TABEL
1. Parameter uji standarisasi simplisia daun gedi 12
2. Parameter spesifik ekstrak daun gedi 13
3. Parameter standarisasi non spesifik ekstrak etanol daun gedi pada
konsentrasi etanol 70% dan 96%. 14
4. Hasil uji fitokimia ekstrak etanol daun gedi pada konsentrasi pelarut
etanol 70% dan 96% 15
5. Hasil analisis uji flavonoid total dan aktivitas antioksidan ekstrak etanol daun gedi pada konsentrasi pelarut 70% dan 96%. 16 6. Matrik faktor dan taraf dalam rancangan central composite design
ekstrak daun gedi 20
7. Hasil karakterisasi serbuk daun gedi 21
8. Matrik faktor dan taraf dalam optimasi dengan central composite
design dan hasil flavonoid total 23
9. Hasil analisis ANOVA ekstraksi flavonoid daun gedi 24 10.Hasil Uji lanjut Tukey ukuran partikel nanoemulsi ekstrak daun gedi
pada berbagai perlakuan 34
11.Hasil Uji lanjut Tukey konduktivitas nanoemulsi ekstrak daun gedi
pada berbagai perlakuan 35
12.Hasil Uji lanjut Tukey pH nanoemulsi ekstrak daun gedi pada
berbagai perlakuan 36
13.Perbandingan kadar flavonoid selama proses penyimpanan 42 14.Perbandingan aktivitas antioksidan selama proses penyimpanan 43 15.Pengaruh pemberian nanoemulsi ekstrak daun gedi dan parasetamol
pada parameter biokimia darah tikus 48
DAFTAR GAMBAR
1. Kerangka penelitian nanoemulsi ekstrak daun gedi 7 2. Tanaman gedi (Abelmoschus manihot L. Medik) (a) dan daun
tanaman gedi (b) 11
3. Hasil uji penapisan terhadap ekstrak etanol 96% daun Gedi (a) flavonoid, (b) alkaloid, (c)tanin, (d) saponin 15 4. Respon permukaan tiga dimensi dan dua dimensi yang menunjukkan
perbedaan pengaruh pada beberapa variabel bebas 25 5. Diagram alir proses pembentukan nanoemulsi senyawa flavonoid
glikosida dari daun gedi (Silva et al. 2011) yang dimodifikasi 29 6. Rata-rata ukuran partikel nanoemulsi ekstrak etanol daun gedi pada
kombinasi kecepatan homogenisasi (a) dan lama waktu
homogenisasi (b) 33
7. Hubungan antara ukuran partikel dengan konduktivitas nanoemulsi
ekstrak daun gedi 36
9. Rata-rata Aktivitas antioksidan IC50 nanoemulsi ekstrak daun gedi
pada berbagai kandungan flavonoid total. 38
10.Rata-rata ukuran partikel nanoemulsi ekstrak daun gedi pada
berbagai kondisi perlakuan selama 14 hari 39
11.Rata-rata konduktivitas nanoemulsi ekstrak etanol daun gedi pada
berbagai kondisi perlakuan selama 14 hari 40
12.Rata-rata pH nanoemulsi ekstrak daun gedi pada berbagai kondisi
perlakuan selama 14 hari 41
13.Hasil spektrum ionisasi LC MS/MS nanoemulsi ekstrak daun gedi 47 14.Hispatologi hati tikus dari berbagai perlakuan, (I) kontrol positif
yang hanya diberikan asupan rangsum, (II) kontrol negatif, diberikan parasetamol 500 mg kg-1 bb, (III) larutan ekstrak daun gedi 2 ml kg-1 bb, (IV) nanoemulsi ekstrak daun gedi 2 ml kg-1 bb, (V) nanoemulsi
ekstrak daun gedi 1 ml kg-1 bb 50
15.Ekstrak etanol simplisia daun gedi 53
16.Perbandingan penampakan ektrak etanol pada pengenceran 1:100 (a) dengan produk nanoemulsi ekstrak etanol (b) 55
DAFTAR LAMPIRAN
1. Prosedur karakterisasi simplisia daun gedi 69
2. Prosedur analisis parameter spesifik dan non spesifik daun gedi 70
3. Persamaan kurva standar quercetin 73
4. Grafik persen inhibisi untuk menentukan IC50 quercetin 74
5. Hasil uji t parameter cemaran bakteri 75
6. Hasil uji t parameter cemaran kapang/jamur 76
7. Hasil uji t parameter cemaran logam 77
8. Hasil uji t parameter flavonoid total 78
9. Hasil uji t parameter aktivitas antioksidan 79 10.Prinsip kerja Particle Size Distribution CILAS 1090 80 11.Data ukuran partikel pada berbagai pelakuan 81 12.ANOVA ukuran partikel nanoemulsi ekstrak daun gedi 82 13.Uji lanjut Tukey ukuran partikel nanoemulsi ekstrak etanol 83 14.ANOVA konduktivitas nanoemulsi ekstrak daun gedi 84 15.Uji lanjut Tukey konduktivitas nanoemulsi ekstrak daun gedi 85
16.ANOVA pH nanoemulsi ekstrak daun gedi 86
17.Uji lanjut Tukey pH nanoemulsi ekstrak daun gedi 87 18.ANOVA flavonoid total nanoemulsi ekstrak daun gedi 88 19.Uji lanjut Tukey flavonoid total nanoemulsi ekstrak daun gedi 89 20.Analisis ANOVA ukuran partikel nanoemulsi ekstrak daun gedi
selama proses penyimpanan 90
21.ANOVA konduktivitas nanoemulsi ekstrak daun gedi selama proses
penyimpanan 93
22.UJi lanjut Tukey konduktivitas nanoemulsi ekstrak daun gedi selama
proses penyimpanan 97
23.ANOVA pH nanoemulsi ekstrak daun gedi selama proses
24.ANOVA Flavonoid nanoemulsi ekstrak daun gedi selama proses
penyimpanan 101
25.ANOVA aktivitas antioksidan nanoemulsi ekstrak daun gedi selama
proses penyimpanan 104
1
PENDAHULUAN
Latar Belakang
Tanaman gedi (Abelmoschus manihot L. Medik) merupakan tanaman yang termasuk dalam famili tanaman berbunga (malvacea) dan termasuk genus abelmoschus, habitat alami tanaman gedi adalah daerah tropis hingga sub-tropis (Charrier 1984). Menurut Hamon dan Sloten (1995) tanaman gedi terkadang tidak menghasilkan bunga, sehingga penanamannya dioptimalkan pada pemanfaatan daun, beberapa yang telah memanfaatkan daun tanaman gedi diantaranya adalah Papua Nugini, pulau Solomon dan Pulau Pasifik Utara (Keatinge 2009). Di Tiongkok bunga tanaman ini telah banyak dikembangkan sebagai produk herbal (Ai et al. 2013), diantaranya adalah untuk mempermudah proses kelahiran, mengontrol fertilitas, menstimulasi penyusuan, dan merangsang aborsi (Bourdy dan Walter 1992).
Tanaman gedi di Indonesia dikenal sebagai tanaman sayuran, menurut Assagaf et al. (2013) tanaman gedi yang digunakan sebagai sayuran adalah tanaman gedi berdaun hijau (Abelmoschus esculenta L. Medik), sedangkan tanaman gedi yang berdaun merah (Abelmoschus manihot L.) secara tradisional telah digunakan sebagai obat tradisional (Mamahit dan Soekamto 2010). Bahkan di Papua daun tanaman gedi telah digunakan sebagai obat tradisional untuk memperlancar air susu ibu (ASI) bagi ibu yang sedang menyusui (Plantamor 2006). Hal ini menunjukkan bahwa daun tanaman gedi memiliki senyawa metabolit sekunder yang bermanfaat bagi tubuh manusia.
Karakterisasi ekstrak etanol daun tanaman gedi yang dilakukan oleh Pine et al. (2011) menunjukkan bahwa daun tanaman gedi memiliki senyawa flavonoid glikosida yang berpotensi sebagai sumber antioksidan. Ekstrak etanol daun gedi yang berasal dari Palu memiliki aktivitas antioksidan tertinggi dengan nilai IC50 sebesar 575 µg ml-1. Menurut Lako et al (2007) daun gedi yang diekstrak dengan cara dikukus memiliki kandungan total antioksidan sebesar 1 mg g-1 bahan, quercetin sebesar 80 µg g-1 bahan dan -karotin sebesar 280 µg g-1 bahan. Hal ini menunjukkan bahwa tanaman ini memiliki potensi untuk dikembangkan sebagai salah satu tanaman penghasil antioksidan yang tinggi. Namun dalam dosis yang terlalu tinggi, ekstrak etanol daun gedi memiliki sifat toksik walaupun toksisitasnya tergolong dalam toksisitas rendah (Assagaf et al. 2013).
Flavonoid merupakan kelompok senyawa fenol terbesar pada tanaman dan memiliki aktivitas antioksidan yang signifikan (Heim et al. 2002). Menurut Harbone dan Williams (2000) bagian tanaman yang banyak mengandung flavonoid adalah daun, biji, kulit tanaman dan bunga. Boumendjel et al. (2002) menyatakan bahwa lebih dari 6.500 jenis flavonoid yang terdapat pada tanaman telah diidentifikasi. Beberapa senyawa flavonoid yang berhasil diidentifikasi dari tanaman gedi adalah hiperin, isoquersetin, mirisetin, hibifolin, quersetin 3-O-robinobiosida, stigmasterol, -sitosterol dan adenosine (Wang et al. 2004; Lai et al. 2007; Xian et al. 2009; Jain dan Bari 2009; Lai et al. 2009).
2
senyawa flavonoid glikosida yang berasal dari daun (Vongsak et al. 2013; Chen et al. 2012; Mamahit dan Soekamto 2010; Pine et al. 2011). Disamping itu, metode ini merupakan metode yang paling sederhana dan tidak membutuhkan suhu ekstraksi yang tinggi, sehingga senyawa flavonoid glikosida yang terdapat dalam bahan tidak banyak mengalami kerusakan (Gupta et al. 2013). Kelemahan proses metode maserasi adalah waktu proses yang sangat lama dan kebutuhan pelarut yang tinggi, hal ini menyebabkan biaya proses menjadi mahal. Beberapa metode perbaikan proses ekstraksi yang selama ini banyak diteliti adalah dengan menggunakan gelombang ultrasonik, gelombang mikro dan teknik superkritis, keuntungan dari penggunakan metode tersebut adalah waktu proses yang lebih cepat (Gupta et al. 2013). Namun, hingga saat ini metode ektraksi tersebut masih belum dapat digunakan dalam skala komersial karena penerapan dalam skala industri yang masih mengalami kesulitan.
Flavonoid adalah kelompok terbesar dari fenolik dengan kapasitas antioksidan yang kuat (Aberoumand dan Deokule 2008). Flavonoid termasuk kelompok benzo- -piron dengan struktur umum difenilpropan (C6-C3-C6) terdiri dari 2 (dua) cincin aromatis yang dihubungkan oleh 3 (tiga) atom karbon membentuk heterosiklik teroksigenasi, ditandai dengan A, B, C (Filipiak 2001). Efektivitas flavonoid sebagai penangkap radikal dan pengkelat ion logam ditentukan oleh adanya struktur (katekol) ortho dihidroksi pada cincin B, ikatan rangkap pada C2-3 yang terkonjugasi dengan gugus fungsi C4 okso, gugus OH pada C3 di cincin C, dan gugus OH pada C5 di cincin A (Tapas et al. 2008). Kombinasi gugus C3-OH dan C5-OH dengan C4-karbonil dan ikatan rangkap C2-3 dapat meningkatkan aktivitas penangkap radikal bebas (Amic et al. 2003). Selain itu kemampuan senyawa flavonoid sebagai antioksidan juga ditentukan oleh potensial reduksinya. Senyawa flavonoid yang mempunyai aktivitas antioksidan semakin tinggi ditandai dengan potensial reduksinya makin rendah (Rice-Evans et al. 1997).
3 mencerminkan stabilitas emulsi selama penyimpanan (Ananingsih et al, 2013;. Heertje, 2013). Stabilitas emulsi diukur dengan pengamatan struktur mikro, indeks kekentalan, ukuran partikel, analisis zeta potensial, nilai peroksida dan penentuan fase pemisahan (Lante dan Friso, 2013; Zarena et al, 2012).
Gangguan fungsi hati merupakan ancaman kesehatan yang serius di Indonesia. Penderita hepatitis B dan C diperkirakan sebanyak 25 juta orang di Indonesia, sebanyak 50% di antaranya berkembang menjadi kronis dan 10% lainnya berkembang menjadi kanker hati. Angka prevalensi tersebut akan terus meningkat karena hepatitis dapat juga disebabkan oleh konsumsi alkohol yang berlebihan, dan racun. Faktor lain yang mendukung pertambahan prevalensi hepatitis adalah gejala hepatitis tidak spesifik, sehingga sulit terdeteksi sejak dini. Sekitar 10 – 20 % prevalensi hepatitis dapat berkembang menjadi sirosis hati (PPHI 2013).
Berdasarkan pada kondisi tersebut, maka asupan hepatoprotektor (komponen yang dapat memproteksi hati) sangat diperlukan. Senyawa-senyawa antioksidan dalam bahan pangan dapat difungsikan sebagai hepatoprotektor. Beberapa penelitian yang menyatakan bahwa senyawa kimia dalam bahan pangan dapat difungsikan sebagai hepatoprotektor adalah ekstrak bawang putih (Hidayati et al. 2003), ekstrak rimpang bangle (Arafah et al. 2004), silymarin (Tedesco 2004), Sacogolotis gabonensis (Maduka 2005), dan ekstrak buah merah (Nugraha et al. 2008). Beberapa jenis obat juga dapat bertindak sebagai hepatoprotektor, di antaranya adalah kaptopril dan losarbn. Kemampuan tanaman dan obat-obatan tersebut sebagai hepatoprotektor disebabkan oleh kemampuannya sebagai antioksidan.
Tanaman gedi (Abelmoschus manihot L. Medik) merupakan salah satu tanaman yang memiliki kandungan senyawa kimia yang berupa quercetin-3-o-robinobiosid, hyperin, isoquercetin, gossipetin-8-o-glukuronid, dan myricetin yang berfungsi sebagai antioksidan alami (Liu et al. 2006). Menurut Wu et al. (2007) senyawa aktif yang paling dominan di bunga tanaman gedi adalah golongan flavonoid glikosida, dimana hasil penelitian menunjukkan bahwa senyawa bioaktif hyperin dapat berfungsi sebagai hepatoprotektor
Perumusan Masalah
Sifat dari senyawa flavonoid yang terkandung dalam ekstrak daun gedi adalah mudah rusak terhadap pengaruh kondisi lingkungan, hal ini akan menyebabkan rendahnya aktivitas antioksidan dari senyawa tersebut. Di samping itu, senyawa flavonoid merupakan senyawa yang memiliki tingkat kelarutan rendah pada air, sehingga senyawa ini akan sulit larut dalam tubuh jika dibuat dalam bentuk padat seperti tablet dan kapsul yang berdampak pada rendahnya bioavailabilitas dari senyawa aktifnya.
4
gedi yang mampu memiliki masa aktif dan bioavailabilitas yang tinggi untuk hepatoprotektor.
Untuk mendapatkan produk nanoemulsi ekstrak daun gedi, diperlukan beberapa metode penanganan, sehingga produk tersebut memiliki aktivitas antioksidan tinggi, beberapa metode tersebut diantaranya adalah metode ekstraksi yang efektif dan teknik nanoenkapsulasi dalam bentuk nanoemulsi yang tepat untuk senyawa flavonoid. Metode ekstraksi yang selama ini dilakukan untuk menghasilkan senyawa flavonoid glikosida adalah dengan teknik maserasi menggunakan etanol 96% dengan suhu kamar dan selama 3 × 24 jam (Pine et al. 2011) atau menggunakan etanol 80% (Wu et al. 2007). Kelemahan dari metode tersebut adalah waktu proses yang lama, oleh karena itu dalam penelitian ini akan dilakukan optimasi proses ekstraksi, sehingga efisiensi dan efektifitas proses ektraksi menjadi lebih baik.
Berdasarkan pada uraian diatas maka beberapa permasalahan yang akan diselesaikan dalam penelitian ini adalah sebagai berikut :
a. Bagaimana teknologi proses ekstraksi yang optimal untuk mendapatkan rendemen ekstrak etanol dan aktivitas antioksidan yang tinggi?
b. Bagaimana teknologi nanoemulsi dengan metode kombinasi solvent displacement dan homogenisasi untuk mendapatkan nanoemulsi ekstrak etanol daun gedi yang memiliki aktivitas antioksidan yang tinggi?
c. Bagaimana potensi nanoemulsi ekstrak etanol daun gedi dalam bentuk emulsi sebagai hepatoprotektor secara in vivo?
Tujuan Penelitian
Tujuan utama dari penelitian ini adalah untuk merancang teknologi produksi nanoemulsi ekstrak daun gedi yang terbaik sebagai hepatoprotektor, adapun secara khusus tujuan penelitian ini adalah :
a. Mengeksplorasi karakteristik parameter-parameter standarisasi simplisa dan ekstrak daun gedi sebagai bahan baku sediaan obat
b. Mengoptimasi proses ekstraksi flavonoid daun gedi yang memiliki rendemen dan aktivitas antioksidan terbaik
c. Merancang teknologi produksi nanoemulsi ekstrak daun gedi yang memiliki aktivitas antioksidan yang tinggi
d. Mengkaji potensi produk nanoemulsi ekstrak etanol daun gedi sebagai hepatoprotektor secara in vivo
Ruang Lingkup Penelitian
a. Bagian tanaman gedi yang dipakai dalam penelitian ini adalah daun gedi. b. Proses optimasi ekstraksi daun gedi dilakukan dengan tiga faktor yaitu faktor
suhu ekstraksi, kecepatan pengadukan dan lama waktu ekstraksi. Hasil proses optimasi ektraksi yang dianalisis adalah rendemen esktraksi etanol dan aktivitas antioksidannya
5 adalah distribusi ukuran nanoemulsi selama masa penyimpanan dan aktivitas antioksidannya selama masa penyimpanan
d. Mengkaji potensi nanoemulsi ekstrak daun gedi sebagai hepatoprotektor secara in vivo.
Manfaat Penelitian
a. Memperkaya potensi bahan baku sebagai alternatif sediaan suplemen yang berfungsi sebagai hepatoprotektor
b. Memberikan sumbangan ilmu pengetahuan dan teknologi untuk memproduksi nanoemulsi yang bersumber dari tanaman gedi
c. Sebagai alternatif diversifikasi pengolahan daun gedi menjadi produk yang memiliki nilai tambah.
Kebaruan
a. Produk nanoemulsi ekstrak daun gedi yang diproduksi dengan menggunakan metode kombinasi antara homogenisasi dan evaporasi
6
2
METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah daun tanaman gedi (Abelmoschus manihot L. Medik) yang telah berumur ± 3 bulan yang ditanam di daerah Malang (07º 59’ LS 11βº γ6’ BT), daun gedi, etanol 70% dan 96% sebagai pelarut, standar quersetin,aquades, aseton, etil asetat, etanol p.a , Asam asetat glasial, medium PDA, NaOH, Al2C3, larutan 1,1-diphenyl-2-picryl-hydrate (DPPH) 0,4 mM, lempeng KLT, NaNO2, AlCl2, Tween 80, , reagen kit SGPT, SGOT, Total bilirubin, total albumin, Blood Analyser, paracetamol 500 mg, etanol 96%, parafin, pewarna hematoksilin-Eosin (HE).
Alat
Peralatan yang digunakan diantaranya adalah Homogenizer IKA Ultra-Turax Model T25 Digital Homogenizer, Particle Size Distribution CILAS 1090 Liquid, Rotary Evaporator IKA RV 10 Digital, Accela LC system (Thermo) LC MS/MS (Thermo Fisher Scientific, Bremen, Germany), labu ukur, gelas piala, thermometer, kondensor, magnetic stirrer, timbangan analitik GR 200 (AND), vacuum evaporator tipe RV 10D (IKA), Hotplate/stirrer HP220, pompa vacuum jenis CVC 3000 Vacuubrand, spektrofotometer UV/Vis Plus (Bio Rad), C861 multi-parameter analyser Consort United Kingdom
Tahapan Penelitian
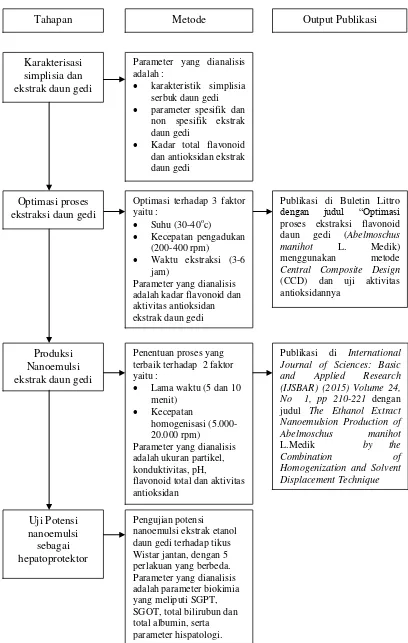
Secara keseluruhan penelitian ini dilakukan dalam 4 tahap (Gambar 1) meliputi : 1) Karakterisasi parameter standarisasi simplisia dan ekstrak daun gedi (Abelmoschus manihot L. Medik) merupakan tahap awal penelitian dalam mendeteksi senyawa aktif yang terdapat dalam daun gedi, 2) Optimasi proses ekstraksi daun gedi (Abelmoschus manihot L.Medik) yang menghasilkan proses ekstraksi yang optimal terhadap kandungan flavonoid total yang terdapat dalam daun gedi, 3) Perancangan proses produksi nanoemulsi esktrak daun gedi, yang tahap ini mendapatkan kondisi proses yang mampu menghasilkan nanoemulsi ekstrak daun gedi sesuai dengan parameter yang telah ditentukan sebagai standar produk nanoemulsi, 4) Kajian potensi nanoemulsi esktrak daun gedi (Abelmoschus manihot L. Medik) sebagai hepatoprotektor.
7
Tahapan Metode Output Publikasi
Karakterisasi simplisia dan ekstrak daun gedi
Parameter yang dianalisis adalah :
karakteristik simplisia serbuk daun gedi
parameter spesifik dan non spesifik ekstrak daun gedi
Kadar total flavonoid dan antioksidan ekstrak daun gedi
Optimasi proses ekstraksi daun gedi
Optimasi terhadap 3 faktor yaitu :
Suhu (30-40oc)
Kecepatan pengadukan
(200-400 rpm)
Waktu ekstraksi (3-6
jam)
Parameter yang dianalisis adalah kadar flavonoid dan aktivitas antioksidan ekstrak daun gedi
Publikasi di Buletin Littro
dengan judul “Optimasi
proses ekstraksi flavonoid
daun gedi (Abelmoschus
manihot L. Medik)
menggunakan metode
Central Composite Design
(CCD) dan uji aktivitas antioksidannya
Produksi Nanoemulsi ekstrak daun gedi
Penentuan proses yang terbaik terhadap 2 faktor yaitu :
Lama waktu (5 dan 10
menit)
Kecepatan
homogenisasi (5.000-20.000 rpm)
Parameter yang dianalisis adalah ukuran partikel, konduktivitas, pH,
flavonoid total dan aktivitas antioksidan
Publikasi di International Journal of Sciences: Basic and Applied Research (IJSBAR) (2015) Volume 24, No 1, pp 210-221 dengan judul The Ethanol Extract Nanoemulsion Production of Abelmoschus manihot
L.Medik by the
Combination of
8
3
KARAKTERISASI SIMPLISIA DAN EKSTRAK DAUN
GEDI
(Abelmoschus manihot
L.Medik
)
SEBAGAI BAHAN
SEDIAAN OBAT
Pendahuluan
Kebutuhan obat di Indonesia diperkirakan akan berkembang pesat, berdasarkan pada hasil analisis Departemen Kesehatan pertumbuhan industri farmasi berkembang antara 10-14% per tahunnya (Permenkes Nomor 87 Tahun 2013). Hal ini akan mendorong diperlukannya sumber-sumber bahan sediaan obat baik kimiawi maupun alami. Produk obat herbal berdasarkan pada data Badan POM Republik Indonesia, jumlah obat herbal yang terdaftar hingga tahun 2015 adalah 8.921 produk (BPOM 2015). Hal ini menunjukkan bahwa produk obat herbal sangat berpotensi untuk terus dikembangkan. Salah satu penyebab meningkatnya penggunaan obat herbal adalah rendahnya potensi resiko yang ditimbulkan (Patra et al. 2010), bahkan WHO telah merekomendasikan penggunaan ekstrak tanaman obat sebagai obat herbal karena mudah didapatkan dan harganya murah (Chaudhury dan Rafei 2002; Raina 2003).
Penggunaan tanaman obat sebagai obat herbal diperlukan standarisasi produk, hal ini dilakukan untuk menjamin obat herbal tersebut layak untuk dikonsumsi. Standardisasi ekstrak tumbuhan obat di Indonesia merupakan salah satu tahapan penting dalam pengembangan obat herbal. Menurut Kepmenkes No.261/MENKES/SK/IV/2009, ekstrak tumbuhan obat adalah sedian berupa bahan kering, kental maupun cairan yang didapatkan dari simplisia. Ekstrak tumbuhan obat ini dapat berupa bahan awal, bahan antara, atau bahan produk jadi. Menurut Ekka et al. (2008) kandungan fitokimia yang terdapat didalam tanaman obat adalah berbeda-beda, tergantung pada kondisi lingkungan dan varietas, oleh karena itu standarisasi ekstrak tanaman obat menjadi penting untuk dilakukan.
9 Metode
Bahan dan Alat
Bahan simplisia yang digunakan adalah daun tanaman gedi (Abelmoschus manihot L. Medik) yang berasal dari Malang (07º 59’ LS 11βº γ6’ BT). Sedangkan bahan untuk karakterisasi adalah etanol 70%, aquades, aseton, etil asetat, etanol 96%, etanol ≥ 99,8%, Asam asetat glasial, medium PDA, NaOH, Al2C3, larutan 1,1-diphenyl-2-picril hydrazil (DPPH) 0,4 mM, lempeng KLT, NaNO2, AlCl2, standar quercetin.
Peralatan yang digunakan adalah labu Erlenmeyer, gelas piala, gelas ukur, kondensor, magnetic stirrer, timbangan analitik GR 200 (AND), vacuum evaporator tipe RV 10D (IKA), pompa vacuum jenis CVC 3000 Vacuubrand, spektrofotometer UV/Vis Plus (Bio Rad).
Pembuatan Simplisia Daun Gedi
Daun gedi dipetik secara langsung dengan tangan. Daun yang telah dikumpulkan disortasi basah atau dicuci dengan air mengalir, kemudian dikeringkan. Pengeringan dilakukan dengan menggunakan sinar matahari, hingga daun gedi menunjukkan kering fisiologis, yaitu jika dipegang dapat dipatahkan dengan tangan. Daun yang telah kering disortasi dan diserbukkan. Untuk penyeragaman ukuran, dilakukan pengayakan hingga lolos 40 mesh. Setelah itu dilakukan penyimpanan bahan simplisia serbuk daun gedi pada suhu 10oC.
Pembuatan Ekstrak
Serbuk daun gedi diekstraksi dengan menggunakan metode maserasi. Sebanyak 800 g serbuk daun gedi dimaserasi dengan pelarut etanol 70% dan 96% selama 3x24 jam pada wadah kaca yang berbeda dengan perbandingan bahan dan pelarut adalah 1:5 b/v. Filtrat kemudian di evaporasi untuk mendapatkan ekstrak kental etanol 70% dan 96%. Ekstrak daun gedi kemudian di simpan didalam lemari pendingin pada suhu 10oC. Semua perlakuan dilakukan sebanyak 3 kali Penentuan Parameter Standarisasi Simplisia
Standarisasi simplisia meliputi: kadar air, kadar abu, kadar abu larut air, kadar abu tidak larut asam, kadar sari larut air, kadar sari larut etanol. metode penetapan tersebut dilakukan sesuai prosedur yang telah ditetapkan dalam Materia Medika Indonesia (MMI) (Depkes 2000) (Lampiran 1).
Penentuan Parameter Standarisasi Ekstrak Daun Gedi
10
Penentuan Flavonoid Total Ekstrak Daun Gedi
Penentuan kadar flavonoid total menggunakan metode yang dikembangkan oleh Wan et al. (2014) dengan sedikit modifikasi. 0,5 mL larutan ekstrak daun gedi yang mengandung flavonoid, dicampur dengan 0,5 mL NaNO2 5% (b/b) dan dibiarkan selama 6 menit. Larutan kemudian ditambahkan 0,5 mL AlCl3 10% (b/b), setelah 6 menit hasil dari larutan yang telah dicampur tersebut ditambahkan 5 mL NaOH 1 mol l-1. Setelah 15 menit larutan di ukur absorbansinya dengan menggunakan Spektrofotometer UV/Vis dengan panjang gelombang 510 nm. Kisaran kurva kalibrasi dengan menggunakan standar quercetin adalah sebesar 5 - 50 mg dengan fungsi y= 0,0125x -0,01613 (R=0,9993) (Lampiran 3) dimana y adalah nilai dari absorbansi dan x adalah nilai quercetin (mg ml-1). Penentuan nilai flavonoid akhir dilakukan berdasarkan formula yang dikembangkan oleh Pan et al. (2012) yaitu :
( )
Y merupakan konsentrasi Flavonoid contoh yang dihitung dengan menggunakan persamaan kurva standard (mg ml-1), N adalah nilai pengenceran, V merupakan volume hasil ekstraksi (ml) dan w adalah bobot simplisia daun gedi (g)
Uji Aktivitas Antioksidan Ekstrak Daun Gedi
Aktivitas antioksidan ekstrak daun gedi ditentukan dengan menggunakan metode yang dikembangkan oleh Locatelli et al. (2004) dengan sedikit modifikasi. Ekstrak daun gedi dibuat larutan dengan konsentrasi yang berbeda-beda berkisar antara 200-800 µg ml-1 dengan pelarut metanol. Quercetin digunakan sebagai pembanding dengan konsentrasi 2-8 µg ml-1 . Larutan DPPH yang akan digunakan, dibuat dengan melarutkan DPPH dalam pelarut methanol dengan konsentrasi 1 mM. sebanyak 4,5 ml larutan uji atau pembanding direaksikan dengan 500 µl larutan DPPH 1 mM dalam tabung reaksi. Campuran larutan di aduk dan diinkubasi pada suhu 37oC dalam kondisi gelas selama 30 menit. Serapan kemudian diukur pada spektrofotometer dengan panjang gelombang 517 nm. Aktivitas antioksidan dari setiap sampel dan quercetin dinyatakan dalam persen inhibisi, dan dihitung dengan rumus :
11 Hasil dan Pembahasan
Parameter Standarisasi Simplisia
Tanaman gedi yang digunakan dalam penelitian ini adalah tanaman gedi yang berasal dari Malang Jawa Timur (7°54'-8°03'LS 112°34'-112°41'BT). Daun tanaman gedi yang diambil merupakan daun yang telah berwarna hijau tua (Gambar 1), hal ini dilakukan untuk meminimalisir terjadinya variasi sumber bahan baku. Daun gedi yang telah dipetik kemudian dilakukan pengeringan dengan menggunakan sinar matahari. Untuk menjaga kandungan flavonoid yang terdapat didalam daun gedi, pengeringan dengan sinar matahari dilakukan mulai pukul 8.00 hingga 10.00 WIB kemudian diangin-anginkan. Menurut Sutjipto et al. (2009) metode pengeringan yang paling baik untuk menjaga kandungan flavonoid dalam simplisia adalah dengan diangin-anginkan dan tidak terlalu lama kontak dengan sinar matahari, hal ini dibuktikan dengan tingginya kandungan flavonoid (0,88%) simplisia daun kumis kucing (Orthopison stamineus Benth) yang diangin-anginkan dibandingkan dengan sinar matahari penuh (0,55%).
Gambar 2 Tanaman gedi (Abelmoschus manihot L. Medik) (a) dan daun tanaman gedi (b)
Hasil analisis parameter standariasi simplisia daun gedi dapat dilihat pada Tabel 1. Berdasarkan data terlihat bahwa kadar air simplisia daun gedi yang dihasilkan adalah sebesar 7,45 ± 0,28 % bk, hal ini menunjukkan bahwa kadar air simplisia serbuk daun gedi telah memenuhi standar MMI. Menurut Amponsah et al. (2014) kadar air dalam simplisia merupakan senyawa yang bertanggungjawab terhadap terjadinya dekomposisi komponen utama, baik yang disebabkan oleh mikroba maupun perubahan struktur kimia. Kadar air yang tinggi pada simplisia akan menyebabkan aktivasi enzim tertentu dan menyebabkan tumbuhnya mikroba dalam simplisia tersebut (Arora et al. 2013).
12
Tabel 1 Parameter uji standarisasi simplisia daun gedi
Parameter Uji Nilai Standar MMI1)
Kadar air (% bk) 7,45 ± 0,28 ≤ 10,00
Kadar abu total (% bk) 10,46 ± 0,33 ≤ 10,00 Kadar abu tidak larut asam (% bk) 0,96 ± 0,03 ≤ β,60 Kadar sari larut air (% bk) 12,80 ± 0,20 ≥ 18,00 Kadar sari larut etanol (% bk) 17,44 ± 0,16 ≥ 6,γ0
Keterangan : 1) Berdasarkan Kemenkes RI No 661/Menkes/SK/VII/2006 2) bk = bobot kering
Kadar abu total dan kadar abu total larut asam merupakan senyawa anorganik yang tidak diinginkan dalam proses pengobatan (Gupta dan Rao 2012). Standar yang ditetapkan dalam MMI adalah ≤ 10% untuk kadar abu total dan ≤ 2,60 % untuk kadar abu tidak larut asam. Dalam penelitian ini simplisia daun gedi memiliki nilai kadar abu total sebesar 10,46 ± 0,33 % bk, sedangkan kadar abu tidak larut asam sebesar 0,96 ± 0,03 % bk. Hal ini menunjukkan bahwa kadar abu simplisia daun gedi belum memenuhi standar yang ditetapkan oleh MMI, namun kadar abu tidak larut asam telah sesuai dengan standar MMI. Kadar abu yang tinggi menunjukkan bahwa simplisia tersebut mengandung senyawa anorganik yang tinggi, Mandey et al. (2014) menyatakan bahwa senyawa anorganik yang terdapat dalam daun gedi di Sulawesi rata-rata sebesar 11-14%.
Kadar sari larut air dan kadar sari larut etanol merupakan indikator yang menunjukkan senyawa penting yang larut dalam pelarut polar maupun semi polar (Thomas et al. 2008, Kumar et al. 2011). Simplisia daun gedi memiliki kadar sari larut air sebesar 12,80 ± 0,20 % bk dan kadar sari larut etanol sebesar 17,44 ± 0,16 % bk. Hal ini menunjukkan bahwa simplisia serbuk daun gedi sebagai tidak dapat digunakan bahan baku untuk sediaan jamu, yang disajikan dalam bentuk infusia, karena kadar sari larut air ≤ 18% bk, namun simplisia daun gedi telah memenuhi standar sebagai bahan sediaan ekstrak etanol karena memiliki kadar sari larut etanol > 6,3 % bk. Berdasarkan pada data tersebut, produk esktrak etanol daun gedi merupakan produk yang lebih sesuai untuk digunakan sebagai bahan sediaan obat dan bentuk ekstrak etanol.
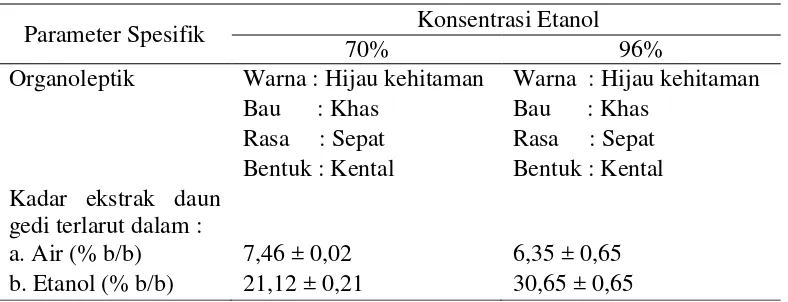
Parameter Standarisasi Spesifik Ekstrak Etanol Daun Gedi
13 Tabel 2 Parameter spesifik ekstrak daun gedi
Parameter Spesifik Konsentrasi Etanol
70% 96%
Organoleptik Warna : Hijau kehitaman Warna : Hijau kehitaman Bau : Khas Bau : Khas
Rasa : Sepat Rasa : Sepat Bentuk : Kental Bentuk : Kental Kadar ekstrak daun
gedi terlarut dalam :
a. Air (% b/b) 7,46 ± 0,02 6,35 ± 0,65 b. Etanol (% b/b) 21,12 ± 0,21 30,65 ± 0,65
Analisis kadar senyawa terlarut dalam air dan etanol dilakukan untuk mengetahui polaritas dari ekstrak etanol daun gedi. Berdasarkan pada hasil penelitian menunjukkan bahwa ekstrak etanol 70% dan 96% memiliki kecenderungan bersifat semi polar. Hal ini ditunjukkan dengan kelarutan dalam air relatif kecil yaitu sebesar 7,46 ± 0,02 % b/b untuk pelarut etanol 70% dan 6,35 ± 0,65 % b/b untuk pelarut etanol 96%. Tingkat kepolaran hasil ekstraksi dapat digunakan untuk mengestimasi senyawa spesifik yang terdapat didalam bahan seperti golongan flavonoid, alkaloid dan tannin (Gupta dan Rao 2012; Thomas et al. 2008; Kumar et al. 2011).
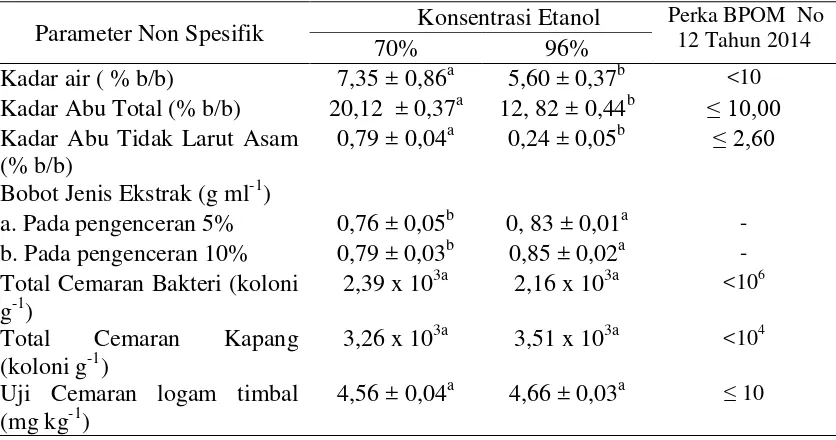
Parameter Standarisasi Non Spesifik Ekstrak Etanol Daun Gedi
Parameter standarisasi non spesifik yang diuji dalam penelitian ini meliputi kadar air, kadar abu total, kadar abu tidak larut asam, bobot jenis ekstrak, total cemaran bakteri, total cemaran kapang dan uji cemaran logam timbal (Depkes RI 2009). Berdasarkan pada hasil penelitian (Tabel 3), kadar air ekstrak etanol 96% memiliki kadar air yang lebih rendah (5,60 ± 0,37 % b/b) jika dibandingkan dengan kadar air ekstrak etanol 70% (7,35 ± 0,86 % b/b), Hal ini terjadi karena pelarut etanol 96% memiliki konsentrasi air yang lebih kecil (4% air) jika dibandingkan dengan pelarut etanol 70% (30% air), sehingga ekstrak yang dihasilkan memiliki kadar air yang berbeda. Meskipun demikian kedua ekstrak tersebut telah standar yang diperbolehkan dalam bahan ekstrak yaitu sebesar 10% (PerKa BPOM No. 12 Tahun 2014). Berdasarkan pada kadar air tersebut, ekstrak daun gedi telah memenuhi standar BPOM sebagai sediaan obat dalam bentuk ekstrak.
14
Tabel 3 Parameter standarisasi non spesifik ekstrak etanol daun gedi pada konsentrasi etanol 70% dan 96%.
Parameter Non Spesifik Konsentrasi Etanol Perka BPOM No 12 Tahun 2014
70% 96%
Kadar air ( % b/b) 7,35 ± 0,86a 5,60 ± 0,37b <10 Kadar Abu Total (% b/b) 20,12 ± 0,37a 12, 82 ± 0,44b ≤ 10,00 Kadar Abu Tidak Larut Asam
(% b/b)
0,79 ± 0,04a 0,24 ± 0,05b ≤ β,60 Bobot Jenis Ekstrak (g ml-1)
a. Pada pengenceran 5% 0,76 ± 0,05b 0, 83 ± 0,01a - b. Pada pengenceran 10% 0,79 ± 0,03b 0,85 ± 0,02a - Total Cemaran Bakteri (koloni
g-1)
2,39 x 103a 2,16 x 103a <106 Total Cemaran Kapang
(koloni g-1)
3,26 x 103a 3,51 x 103a <104 Uji Cemaran logam timbal
(mg kg-1)
4,56 ± 0,04a 4,66 ± 0,03a ≤ 10
Keterangan : huruf yang berbeda pada baris yang sama menunjukkan bahwa nilai tersebut berbeda nyata pada uji t dengan P-value < 0,5
Bobot jenis ekstrak etanol 70% memiliki nilai yang lebih rendah jika dibandingkan dengan bobot jenis ekstrak etanol 96%. Hal ini disebabkan karena senyawa organik yang terekstrak lebih banyak pada pelarut etanol 96% jika dibandingkan dengan pelarut 70%. Bobot jenis merupakan bobot ekstrak per satuan volume, sehingga dengan volume yang sama akan menghasilkan bobot jenis yang berbeda ketika kandungan dalam ekstrak tersebut berbeda.
Total cemaran bakteri pada kedua jenis pelarut telah memenuhi standar yang ditetapkan untuk ekstrak sediaan obat, dimana dari total cemaran bakteri adalah sebesar 2,36 x 103 koloni g-1 untuk pelarut etanol 70% dan 2,16 x 103 koloni/g untuk pelarut etanol 96%, sementara standar yang ditetapkan oleh BPOM melalui Perka BPOM No 12. Tahun 2014 sebesar < 104 koloni g-1. Sedangkan untuk total cemaran kapang, masih belum memenuhi persyaratan yang ditetapkan oleh BPOM, hal ini disebabkan karena kedua ekstrak etanol tersebut berada lebih besar dari 103 koloni g-1.
Cemaran logam berat yang diuji dalam penelitian ini adalah cemaran logam timbal (Pb), batas maksimum logam Pb yang diijinkan untuk produk sediaan obat tradisional adalah sebesar ≤ 10 mg kg-1, sedangkan hal penelitian menunjukkan bahwa cemaran logam Pb adalah 4,56 ± 0,04 mg kg-1untuk ekstrak etanol 70% dan 4,66 ± 0,03 mg kg-1 untuk ekstrak etanol 96%.
15 Golongan Senyawa Kimia Ekstrak Etanol Daun Gedi
[image:33.595.107.461.252.341.2]Uji fitokimia yang terdapat didalam ekstrak etanol daun gedi, digunakan untuk mendeteksi awal, senyawa fitokimia yang terkandung dalam daun gedi, uji ini merupakan uji kualitatif yang ditujukan untuk menunjukkan keberadaan senyawa tertentu ketika direaksikan dengan senyawa lain. Uji fitokimia yang dilakukan meliputi uji flavonoid, uji alkaloid, uji tannin dan uji saponin. Berdasarkan pada hasil penelitian, konsentrasi etanol tidak mempengaruhi perbedaan senyawa fitokimia yang terdapat didalam ekstrak etanol daun gedi. Tabel 4 Hasil uji fitokimia ekstrak etanol daun gedi pada konsentrasi pelarut
etanol 70% dan 96%
Golongan Senyawa Kimia Konsentrasi Etanol
70% 96%
Flavonoid + +
Alkaloid + +
Tannin + +
Saponin - -
Berdasarkan pada Tabel 4 terlihat bahwa golongan senyawa kimia yang menunjukkan positif terdapat didalam daun gedi adalah senyawa flavonoid, alkaloid dan tannin, sementara senyawa saponin memberikan respon yang negatif. Respon senyawa flavonoid ini ditunjukkan dengan berubahnya larutan menjadi berwarna agak kekuningan (Gambar 3a), sedangkan untuk uji senyawa alkaloid (Gambar 3b) larutan membentuk endapan putih dan endapan coklat kekuningan terbentuk ketika larutan diuji terhadap kandungan tanin (Gambar 3c). Pengujian terhadap saponin negatif karena tidak terbuntuk busa yang stabil (Gambar 3d).
(a) (b) (c) (d)
[image:33.595.198.459.479.694.2]16
Flavonoid Total dan Aktivitas Antioksidan Ekstrak Etanol Daun Gedi
Keberadaan senyawa flovonoid yang terdapat didalam daun gedi selanjutnya dianalisis secara kuantitatif dengan menentukan kadar flavonoid totalnya dan aktivitas antioksidan dari flavonoid tersebut. Hasil analisis Uji t menunjukkan bahwa terdapat perbedaan nyata antara hasil ekstrak dengan menggunakan etanol 96% dengan etanol 70% (Tabel 5). Kondisi ini menunjukkan bahwa pelarut etanol 96% memiliki polaritas yang lebih rendah, jika dibandingkan dengan etanol 70%. Peningkatan konsentrasi etanol akan menurunkan polaritas pelarut, sehingga mendekati polaritas senyawa flavonoid yang bersifat semi polar (Vongsak et al. 2013). Jika dibandingkan dengan hasil penelitian yang dilakukan oleh Pine et.al. (2011) ekstrak daun gedi hasil penelitian memiliki nilai flavonoid total yang lebih rendah dengan tanaman gedi asal Palu (41,56 ± 0,120 mg g-1), namun dengan tanaman gedi asal Gorontalo (23,63±0,06 mg g-1) masih lebih tinggi.
Flavonoid merupakan salah satu antioksidan alami yang mampu memberikan efek biologis terhadap beberapa penyakit seperti anti bakteri, anti imflamasi, anti virus dan anti alergi (Cook dan Samman 1996; Velioglu et al. 1998). Flavonoid yang terdapat didalam daun gedi juga memiliki aktivitas sebagai antioksidan (Xue et al. 2011). Penghambatan radikal bebas dengan metoda DPPH merupakan salah satu metode untuk menentukkan aktivitas antioksidan. Parameter yang digunakan dalam uji DPPH adalah IC50, yaitu konsentrasi yang diperlukan untuk menghambat 50% dari radikal bebas DPPH. Nilai IC50 diperoleh dari persamaan hubungan antara konsentrasi ekstrak dengan persen inhibisi (penghambatan). Nilai IC50 yang kecil berarti kemampuan dalam menghambat radikal bebas dari DPPH sangat besar. Hal ini menunjukkan kuatnya suatu bahan sebagai antioksidan. Hasil penelitian menunjukkan bahwa ekstrak daun gedi menggunakan pelarut etanol 96% memiliki aktivitas antioksidan yang lebih tinggi dengan nilai IC50 sebesar 512,41 ± 3,44 µg ml-1 dibandingkan dengan pelarut etanol 70% (IC50 = 625,14 ± 2,65 µg ml-1). Hasil uji t menunjukkan bahwa keduanya berbeda nyata (Lampiran 8 dan 9), sehingga dapat disimpulkan bahwa faktor konsentrasi mempengaruhi nilai kadar flavonoid total dan aktivitas antioksidan. Hal ini sesuai dengan yang diungkapkan oleh Qian et al. (2004) bahwa peningkatan konsentrasi etanol akan meningkatkan kadar flavonoid dan aktivitas antioksidannya.
Tabel 5 Hasil analisis uji flavonoid total dan aktivitas antioksidan ekstrak etanol daun gedi pada konsentrasi pelarut 70% dan 96%.
No Golongan Senyawa Kimia Konsentrasi Etanol
70% 96%
1 Flavonoid Total (mg g-1) 27,19 ± 0,78a 37,29 ± 0,40b 2 Aktivitas antioksidan (IC50) 625,14 ± 2,65a 512,41 ± 3,44b
17 Simpulan dan Saran
Simpulan
Simplisia daun gedi tidak memenuhi standar MMI jika digunakan sebagai sediaan obat untuk infusia, namun sebagai sediaan obat untuk produk esktrak telah memenuhi, karena memiliki kadar sari larut etanol diatas 6,3% bk.
Ekstrak etanol daun gedi telah memenuhi standar Perka BPOM No 12. Tahun 2014 tentang persyaratan mutu sediaan obat, dimana ekstrak etanol yang dihasilkan memiliki kadar air 5,60 ± 0,37 % b/b, kadar abu total 12, 82 ± 0,44 % b/b, kadar abu tidak larut asam 0,24 ± 0,05 %b/b, bobot jenis ekstrak pada pengenceran 5% 0, 83 ± 0,01 g ml-1 , bobot jenis ekstrak pada pengenceran 10% 0,85 ± 0,02 g ml-1, total cemaran bakteri 2,1 x 103 koloni g-1, total cemaran kapang 3,6 x 103 koloni g-1, dan kadar timbal sebesar 4,67 ± 0,03 mg kg-1.
Konsentrasi pelarut yang paling baik untuk mengekstrak flavonoid dari daun gedi adalah pelarut etanol konsentrasi 96% dan menghasilkan flavonoid total sebesar 37,29 ± 0,40 mg g-1 dengan aktivitas antioksidan pada nilai IC50 sebesar 512,41 ± 3,44 µg ml-1
Saran
Untuk diaplikasikan sebagai bahan sediaan obat, perlu dilakukan analisis lanjutan terhadap parameter ekstrak daun gedi yang lainnya, yaitu kadar sisa pelarut dan viskositas dari ekstrak.
18
4
OPTIMASI PROSES EKSTRAKSI FLAVONOID DAUN
GEDI
(Abelmoschus manihot
L. Medik
)
MENGGUNAKAN
METODE
CENTRAL COMPOSITE DESIGN (CCD)
DAN
UJI AKTIVITAS ANTIOKSIDANNYA
Pendahuluan
Meningkatnya penyakit degeneratif seperti kanker, penurunan sistem imun, disfungsi hati, disfungsi otak dan katarak disebabkan karena kekurangan antioksidan, hal ini menyebabkan terjadinya kondisi stress oksidatif, yaitu suatu kondisi dimana antioksidan yang ada di dalam tubuh tidak mampu menetralisir peningkatan konsentrasi radikal bebas, sehingga berdampak pada kerusakan komponen sel seperti DNA, lipid, dan protein (Ames et al. 1993; Chen et al. 1996; Valko et al. 2004). Oleh karena itu, tubuh membutuhkan asupan antioksidan yang berasal dari luar, menurut Peter et al. (2007) asupan harian antioksidan yang dibutuhkan oleh tubuh berkisar antara 20 – 1000 mg hari-1. Umumnya pemenuhan kebutuhan antioksidan tubuh menggunakan buah, sayuran dan minuman dengan jumlah vitamin C, E, dan -karotin yang bervariasi (Mullie et al. 2007), ditambah dengan beberapa antioksidan sintetik. Beberapa peneliti mengungkapkan bahwa penggunaan antioksidan sintetik akan memberikan efek buruk bagi kesehatan dan bersifat toksik (Chen et al. 1992; Kahl dan Kappus 1993). Oleh karena itu, antioksidan alami menjadi salah satu alternatif yang sangat dibutuhkan.
Flavonoid merupakan salah satu antioksidan alami yang dibutuhkan oleh tubuh, menurut Heim et al. (2002) kebutuhan flavonoid tubuh setiap harinya mencapai 23 mg hari-1. Kemampuan flavonoid sebagai antioksidan telah banyak diteliti (Rice-Evan et al. 1996; Pourmorad et al. 2006 Procházková et al. 2011). Flavonoid memiliki kemampuan mengubah atau mereduksi radikal bebas dan juga sebagai anti radikal bebas (Zuhra 2008). Hasil penelitian yang dilakukan oleh Pine et al. (2011) menunjukkan bahwa daun gedi (Abelmoschus manihot L. Medik) memiliki kandungan flavonoid yang cukup tinggi yaitu berkisar antara 23-41%, hal ini menunjukkan bahwa daun gedi memiliki potensi sebagai sumber antioksidan. Potensi daun gedi sebagai sumber antioksidan telah diketahui dalam penelitian Pine et al. (2011) dimana aktivitas antioksidan ekstrak etanol daun gedi meningkat sejalan dengan meningkatnya konsentrasi total flavonoid, aktivitas antioksidan tertinggi dihasilkan dari daerah palu dengan nilai IC50 sebesar 575 µg ml-1
19 ekstraksi baru dengan maseri dinamis yang bertujuan untuk meningkatkan proses ekstraksi lebih efektif dan efisien, serta mampu mengurangi degradasi bahan aktif selama proses ekstraksi. Efektivitas ekstraksi sangat dipengaruhi oleh beberapa hal diantaranya adalah waktu ekstraksi, suhu ekstraksi, jenis pelarut dan kecepatan pengadukan. Berdasarkan pada beberapa faktor tersebut, dalam penelitian ini dilakukan optimasi proses ekstraksi daun gedi untuk mendapatkan total flavonoid yang paling optimal sehingga dapat dikembangkan dalam skala komersial.
Metode Penelitian
Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Teknologi Agro Kimia Jurusan Teknologi Industri Pertanian Universitas Brawijaya, mulai bulan Januari 2014 sampai dengan bulan Desember 2014.
Bahan dan Alat
Bahan-bahan yang digunakan antara lain daun tanaman gedi yang telah berumur lebih dari 3 bulan, aquades, etanol 96%, NaOH, DPPH (1,1-Diphenyl-2-picryl hydrazyl) , NaNO2, AlCl2 (Merck), standar quercetin (Sigma Aldrich).
Alat yang digunakan adalah labu Erlenmeyer, beaker glass, gelas ukur, kondensor, magnetic stirrer, timbangan analitik GR 200 (AND), vacuum evaporator tipe RV 10D (IKA), Hotplate/stirrer HP220, pompa vacuum jenis CVC 3000 Vacuubrand, spektrofotometer UV/Vis Plus (Bio Rad). Software Design Expert Ver. 9 versi trial.
Persiapan contoh
Daun yang digunakan dalam penelitian ini adalah daun tanaman gedi yang berumur 3 bulan, dan bagian yang diambil adalah daun yang berwarna hijau tua. Daun yang akan diekstrak dikeringkan hingga mendapatkan kadar air yang relatif rendah (< 10%), kemudian daun gedi kering digiling hingga berukuran 40 mesh. Karakterisasi Serbuk Daun Gedi
Karakterisasi serbuk daun gedi dilakukan untuk memastikan bahwa komponen yang terdapat dalam daun gedi, tidak mengalami perubahan yang signifikan. Parameter yang dikarakterisasi diantaranya adalah kadar air, kadar sari larut air dan kadar sari larut etanol serta total flavonoid. Prosedur analisis kadar air, kadar sari larut air dan kadar sari larut etanol dilakukan sesuai dengan prosedur analisis simplisia pada Lampiran 1.
Ekstraksi Flavonoid Daun Gedi
20
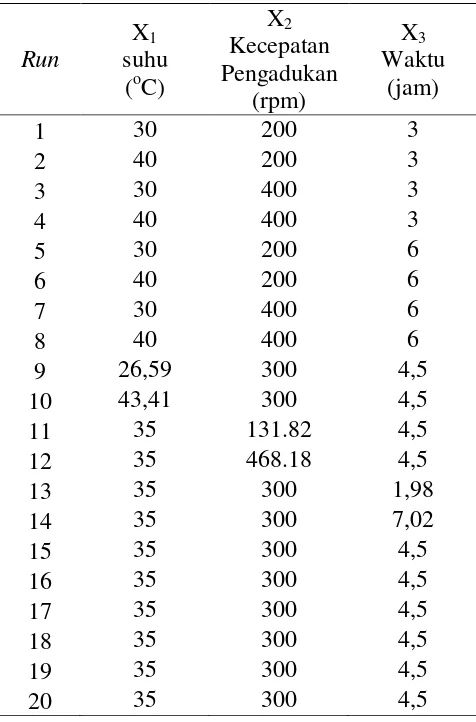
Rancangan Percobaan Dengan Central Composite Design (CCD)
[image:38.595.164.402.262.623.2]Rancangan percobaan dalam penelitian ini menggunakan Central Composite Design (CCD), dimana metode ini akan membantu dalam menyelidiki pengaruh linear, kuadrat dan interaksi antar faktor dari proses ekstraksi daun gedi (Chow dan Liu 1995). CCD terdiri dari 20 run percobaan dengan 6 ulangan pada titik pusat (centre point). Adapun matrik faktor dan taraf dalam rancangan central composite design disusun seperti pada Tabel 6.
Tabel 6 Matrik faktor dan taraf dalam rancangan central composite design ekstrak daun gedi
Run
X1 suhu
(oC)
X2 Kecepatan Pengadukan
(rpm)
X3 Waktu
(jam)
1 30 200 3
2 40 200 3
3 30 400 3
4 40 400 3
5 30 200 6
6 40 200 6
7 30 400 6
8 40 400 6
9 26,59 300 4,5
10 43,41 300 4,5
11 35 131.82 4,5
12 35 468.18 4,5
13 35 300 1,98
14 35 300 7,02
15 35 300 4,5
16 35 300 4,5
17 35 300 4,5
18 35 300 4,5
19 35 300 4,5
20 35 300 4,5
Analisis regresi dan keragaman dilakukan dengan menggunakan software Design Expert Ver. 9.0. Trial. Setiap respon dari proses ekstraksi digunakan untuk mengembangkan sebuah model matematis yang berkorelasi dengan flavonoid total menurut persamaan polinomial berikut (Montgomery et al. 2012) :
∑
∑
21 y adalah hasil perkiraan respon yang diinginkan (flavonoid total ), xi, xj mewakili peubah-peubah yang meliputi suhu ekstraksi, lama waktu ekstraksi dan kecepatan pengadukan, O merupakan koefisien model, i adalah pengaruh linier peubah
terhadap respon, ij pengaruh interaksi antar peubah terhadap respon, ii adalah pengaruh kuadratik peubah terhadap respon dan adalah derajat error
Penentuan Flavonoid Total Ekstrak Daun Gedi
Penentuan kadar flavonoid total dengan menggunakan metode yang digunakan oleh Wan et al. (2014) dan telah dijelaskan dalam Bab 2 .
Uji Aktivitas Antioksidan Ekstrak Daun Gedi
Aktivitas antioksidan ekstrak daun gedi ditentukan dengan menggunakan metode yang dikembangkan oleh Locatelli et al. (2004) dan telah dijelaskan dalam Bab 2
Hasil Dan Pembahasan
Karakteristik Serbuk Daun Gedi
Simplisia daun gedi dikarakterisasi terhadap kadar air, kadar sari larut air, kadar sari larut etanol dan kandungan flavonoid total sebelum dilakukan proses ekstraksi. Kadar air merupakan parameter fisikokimia yang berhubungan langsung dengan stabilitas senyawa aktif bahan herbal selama proses penyimpanan. Kadar air yang berlebihan akan memudahkan pertumbuhan mikroba yang akan menghidrolisis senyawa aktif (Czech et al. 2001; List dan Smith 1984) sehingga bahan tersebut cepat mengalami kerusakan. Disisi lain, bahan herbal yang terlalu kering ( kadar air < 5%) akan menyebabkan struktur sel menjadi lebih sulit untuk diekstraksi (Souza et al. 2007).
[image:39.595.177.449.575.649.2]Sebelum dilakukan proses ekstraksi daun gedi, serbuk daun gedi dikarakteriasi ulang untuk memastikan kualitas daun gedi. Hasil karakterisasi menunjukkan bahwa kadar air serbuk daun gedi adalah 8,1 ± 0,5 % bk. Hal ini menunjukkan bahwa serbuk daun gedi masih berada dalam batas yang ditetapkan yaitu sebesar 6-14 % bk untuk bahan herbal yang disimpan dalam kondisi tidak kedap udara (List dan Smith 1984; Souza et al. 2007).
Tabel 7. Hasil karakterisasi serbuk daun gedi
Parameter Nilai
Kadar Air (% bk) 8,1 ± 0,50
Kadar sari larut air (% bk) 9,1 ± 0,08 Kadar sari larut etanol (% bk) 17,87 ± 0,60 Total flavonoid (mg/g) 56,2 ± 0,09
22
ekstrak daun gedi dengan pelarut air lebih tinggi (9,50 ± 0,3 % bk), jika dibandingkan dengan pelarut etanol 70 % (8,31 ± 0,3% bk). Konsentrasi etanol memberikan pengaruh yang signifikan terhadap rendemen ekstrak, hasil penelitian Mandey et al. (2014) menunjukkan bahwa pada ekstraksi daun gedi dengan pelarut etanol 96% mendapatkan rendemen ekstrak sebesar 15%.
Kadar flavonoid total serbuk daun gedi sebelum dilakukan ekstraksi adalah 56,2 ± 0,09 mg g-1 bahan setara quercetin. Jika dibandingkan dengan kadar flavonoid total sebelumnya (37,29 ± 04 mg g-1), maka kadar flavonoid total ektsrak daun gedi telah mengalami degradasi, diduga disebabkan karena proses ekstraksi. Menurut Biesaga (2011) salah satu faktor yang mempengaruhi degradasi flavonoid adalah lama waktu ekstraksi dan struktur kimia dalam sistem, metode maserasi yang dilakukan lebih dari 24 jam berpotensi untuk mendegradasi kandungan flavonoid dalam bahan.
Pembentukan Model Persamaan Ekstraksi Daun Gedi
Ekstrasi flavonoid dapat dilakukan dengan berbagai macam metode, mulai dari metode konvensional hingga metode baru diantaranya adalah ekstraksi CO2 superkritis (Wang et al. 2008), gelombang mikro (Routray dan Orsat 2012) dan ekstraksi fluida superkritis (Bimakr et al. 2011). Sampai saat ini, metode yang digunakan untuk melakukan ekstraksi senyawa aktif didominasi oleh metode konvensional, karena metode ini dianggap merupakan metode yang sederhana dan aplikatif (Grigonis et al. 2005). Gupta et al. (2013) menyatakan bahwa metode maserasi merupakan metode yang paling sederhana dan tidak membutuhkan suhu ekstraksi yang tinggi sehingga senyawa flavonoid glikosida yang terdapat dalam bahan tidak banyak mengalami kerusakan. Namun kelemahan dari metode ini adalah membutuhkan pelarut yang relatif banyak (Bimakr et al. 2011). Untuk mengoptimalkan proses ekstraksi daun gedi, metode yang digunakan adalah metode maserasi dinamis. Faktor yang berpengaruh pada proses ekstraksi dengan maserasi dinamis menurut Xu et al. (2013) adalah waktu ekstraksi, suhu ekstraksi, komposisi pelarut dan rasio padatan terlarut. Oleh karena itu, dalam penelitian ini faktor yang dioptimalkan adalah waktu ekstraksi, kecepatan pengadukan dan lama waktu ekstraksi.
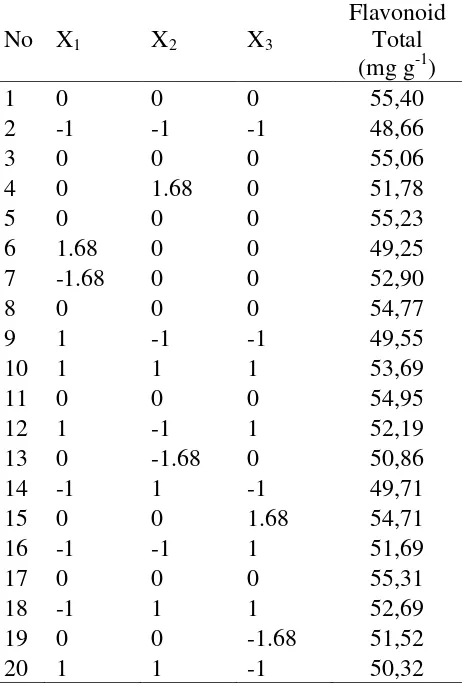
Berdasarkan pada hasil penelitian (Tabel 8), flavonoid total yang didapatkan berkisar antara 48,66 – 55,40 mg g-1. Analisis dengan menggunakan regresi berganda menghasilkan persamaan orde dua sebagai berikut :
Total Flavonoid = 55.138 -0.229X1+ 0.430X2 + 1.273X3 - 1.553X12 - 1.465X22 -
0.829X32
23 Tabel 8 Matrik faktor dan taraf dalam optimasi dengan central composite design
dan hasil flavonoid total
No X1 X2 X3
Flavonoid Total (mg g-1)
1 0 0 0 55,40
2 -1 -1 -1 48,66
3 0 0 0 55,06
4 0 1.68 0 51,78
5 0 0 0 55,23
6 1.68 0 0 49,25
7 -1.68 0 0 52,90
8 0 0 0 54,77
9 1 -1 -1 49,55
10 1 1 1 53,69
11 0 0 0 54,95
12 1 -1 1 52,19
13 0 -1.68 0 50,86
14 -1 1 -1 49,71
15 0 0 1.68 54,71
16 -1 -1 1 51,69
17 0 0 0 55,31
18 -1 1 1 52,69
19 0 0 -1.68 51,52
20 1 1 -1 50,32
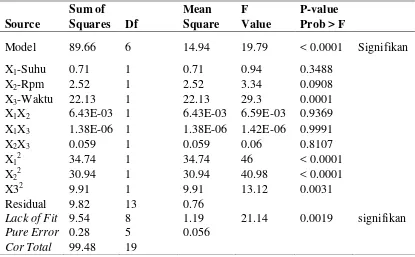
Variabel yang sangat signifikan terhadap hasil flavonoid total adalah variable linear X3(waktu) dan variable kuadratik X12, X22 karena memiliki P-value < 0,0001.Variabel yang memiliki pengaruh signifikan adalah variable kuadratik X32 dan variabel yang tidak berpengaruh terhadap hasil ekstraksi flavonoid total adalah variabel linear X1(Suhu), X2(kecepatan pengadukan) dan variabel interaksi antara X1X2, X1X3, X2X3. Berdasarkan pada hasil analisis tersebut maka dapat disimpulkan bahwa faktor yang mempengaruhi respons flavonoid total pada proses ekstraksi daun gedi adalah sebagai berikut : waktu ekstraksi > kecepatan pengadukan > suhu ekstraksi.
24
Tabel 9 Hasil analisis ANOVA ekstraksi flavonoid daun gedi
Sum of Mean F P-value
Source Squares Df Square Value Prob > F
Model 89.66 6 14.94 19.79 < 0.0001 Signifikan
X1-Suhu 0.71 1 0.71 0.94 0.3488
X2-Rpm 2.52 1 2.52 3.34 0.0908
X3-Waktu 22.13 1 22.13 29.3 0.0001
X1X2 6.43E-03 1 6.43E-03 6.59E-03 0.9369 X1X3 1.38E-06 1 1.38E-06 1.42E-06 0.9991
X2X3 0.059 1 0.059 0.06 0.8107
X12 34.74 1 34.74 46 < 0.0001
X22 30.94 1 30.94 40.98 < 0.0001
X32 9.91 1 9.91 13.12 0.0031
Residual 9.82 13 0.76
Lack of Fit 9.54 8 1.19 21.14 0.0019 signifikan
Pure Error 0.28 5 0.056
Cor Total 99.48 19
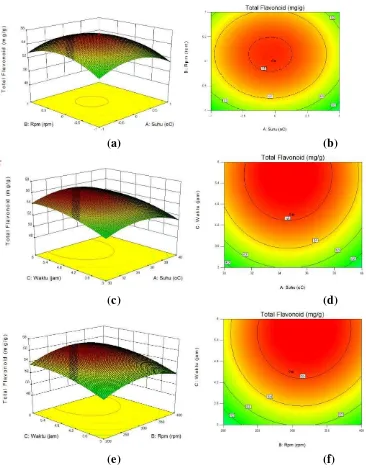
Analisis Respon Permukaaan
Respon permukaan tiga dimensi dan dua dimensi dari fungsi regresi ditampilkan seperti pada Gambar 4. Berdasarkan pada Gambar 4a dan 4b, terlihat bahwa variabel bebas (kecepatan pengadukan dan suhu ekstraksi) pada level rendah dan tinggi akan menghasilkan total flavonoid yang rendah, kondisi tersebut menunjukkan bahwa interaksi antara kecepatan pengadukan dan suhu ekstraksi berpengaruh terhadap total flavonoid yang dihasilkan. Kecepatan pengadukan merupakan salah satu faktor yang berpengaruh terhadap proses ekstraksi, hal ini berkaitan dengan perpindahan massa konvektif dari bahan yang diekstrak kepada pelarut (List dan Schmidt 1989). Pada maserasi statis perpindahan massa dari bahan ke pelarut hanya ditentukan oleh kecepatan difusi dan koefisien osmosis antara lapisan tipis daun gedi dengan pelarut (List dan Schmidt 1989). Sedangkan pada maserasi dinamis, kecepatan pengadukan menyebabkan terjadinya peningkatan pengaruh konvektif sehingga menurunkan tegangan permukaan bahan untuk menuju keseimbangan dengan pelarut etanol (Jacques et al. 2007).