PENAPISAN FITOKIMIA DAN KAJIAN IN VITRO EKSTRAK
DAUN KEMUNING (
Murraya paniculata
L. Jack) TERHADAP
TRICHOSTRONGYLIDAE
GRESY EVA TRESIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul berjudul Penapisan Fitokimia dan Kajian in vitro Ekstrak Daun Kemuning (Murraya paniculata L. Jack) terhadap Trichostrongylidae adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
Gresy Eva Tresia
RINGKASAN
GRESY EVA TRESIA. Penapisan Fitokimia dan Kajian in vitro Ekstrak Daun Kemuning (Murraya paniculata L. Jack) terhadap Trichostrongylidae. Dibimbing oleh DWIERRA EVVYERNIE dan RISA TIURIA.
Nematoda saluran pencernaan terus menghambat produksi ternak ruminansia kecil karena resistensi obat cacing dan kurangnya produk yang efektif untuk pengendalian nematoda saluran pencernaan dalam tingkat produksi organik. Penelitian sebelumnya menunjukkan bahwa herbal daun kemuning (Murraya paniculata L. Jack) memiliki kemampuan sebagai kandidat obat cacing pada ternak kambing PE laktasi dalam mengurangi telur tiap gram tinja (TTGT) dari
Strongylida sebesar 43.67% dibandingkan dengan pemberian Oxfendazole 0.0005% secara oral sebagai kontrol. Untuk mengkonfirmasi hal tersebut, penelitian ini bertujuan menentukan dosis efektif dari daun kemuning dengan dua metode ekstraksi (infusa dan maserasi) dalam mereduksi Trichostrongylidae dan mengidentifikasi senyawa bioaktif yang terkandung dalam daun kemuning secara
in vitro.
Penelitian ini menggunakan rancangan acak lengkap (RAL) dengan 11 perlakuan dan 5 ulangan. Perlakuan tersebut terdiri dari kontrol, Oxfendazole (0.0005% dan 0.005%), ekstrak infusa daun kemuning dan ekstrak maserasi dengan level 1%, 3%, 5% dan 7% (b/v). Materi uji in vitro meliputi telur cacing dalam feses kambing PE laktasi, larva infektif dan cacing dewasa
Trichostrongylidae. Tipe larva yang diamati adalah Trichostrongylus sp.,
Haemonchus sp., dan Cooperia sp. yang merupakan bagian famili
Trichostrongylidae. Peubah yang diamati pada ekstrak adalah rendemen dan fitokimia secara kualitatif dan kuantitatif (flavonoid quarcetin, saponin, dan tanin). Peubah yang diamati pada uji in vitro adalah rataan jumlah kematian, persentase mortalitas, lethal time (LT50), dan lethal concentration terhadap perkembangan larva, larva infektif dan cacing dewasa Trichostrongylidae.
Hasil penelitian menunjukkan bahwa perlakuan sangat nyata (P<0.01) meningkatkan mortalitas dan mempercepat waktu kematian (lethal time)
Trichostrongylidae. Semakin tinggi konsentrasi perlakuan maka efektifitasnya semakin tinggi. Ekstrak infusa memiliki rendemen 6.48% yang mengandung flavonoid quarcetin, saponin, tanin secara berturut-turut 0.53%, 2.38%, dan 1.35%. Ekstrak maserasi memiliki rendemen 2.87% yang mengandung flavonoid quarcetin, saponin, tanin secara berturut-turut secara berturut-turut 3.39%, 2.46%, dan 0.65%. Ekstrak infusa 7% memiliki rendemen dan kandungan tannin yang lebih tinggi dan lebih efektif dibanding ekstrak maserasi 7% dan Oxfendazole 0.005% terhadap perkembangan larva, larva infektif dan cacing dewasa
ekstrak infusa daun kemuning dapat dikembangkan sebagai kandidat terbaik herbal obat cacing dalam mengendalikan infeksi Trichostrongylidae.
SUMMARY
GRESY EVA TRESIA. Phytochemical Screening and in vitro Analysis Extract Kemuning Leaves (Murraya paniculata L. Jack) of Trichostrongylidae. Supervised by DWIERRA EVVYERNIE and RISA TIURIA.
Gastrointestinal nematodes (GIN) continue to hinder small ruminant production because of anthelmintic resistance and lack of effective products for GIN control in organic production. In previous research, a herbs kemuning leaves (Murraya paniculata L. Jack) has capability as an anthelmintic candidate for PE dairy goats lactation by reducing 43.67% of the egg per gram (EPG) of Strongylida compared to 0.0005% oxfendazole orally as control. To confirm it, the aim of this in vitro research was to determine the effective dosage of the kemuning leaves from two extraction methods (infuse and maceration) to reduce the Trichostrongylidae and to evaluate the bioactive compounds of the leaves.
This study used randomized complete design (RCD) with 11 treatments and 5 replicates. The treatment consisted of the control control, Oxfendazole (0.0005% and 0.005%), kemuning leaves infuse extract and maceration extract with level of each 1%, 3%, 5% and 7% (w/v). Materials for analysis in vitro were egg strongylid in feces etawah crossbreed goat, larva infective, and worm adult of
Trichostrongylidae. The parameters of extract were measured yield extracts and screening phytochemicals as qualitative and quantitative (flavonoids quarcetin, saponins, tannins). The parameters in vitro were the average number of mortality, the percentage of mortality, lethal time, and lethal concentration of the larva development, the larva infective, and the adult worms Trichostrongylidae.
Type of larvae were observed Trichostrongylus sp., Haemonchus sp., and
Cooperia sp. which was part Trichostrongylidae’s family. The results showed that the treatments were significantly (P <0.01) increased mortality and accelerate lethal time. The higher the concentration extract kemuning have higher effectiveness. Infuse extract has yield 6.48% contain flavonoids quarcetin, saponins tannins 0.53%, 2.38%, and 1.35%, respectively.. Maceration extract had yield 4.04% contain flavonoids quarcetin, saponins tannins 3.39%, 2.46%, and 0.65%. The 7% kemuning leaves infuse extract, which had high yield and tannin was more effective than kemuning leaves maceration extract at 7% and Oxfendazole at 0.005% against larval development, the infective larvae and adult worms Trichostrongylidae (93.14%, 94.39% and 90%, respectively). Maceration extract concentration of 7% has effective against larval development, the infective larvae and adult worms Trichostrongyloidae 72%, 84.34% and 86.64%, respectively. Concentration of extract infuse caused 50% mortality in the larval development, the infective larvae and adult worms were 1.78%, 3.10%, and 4.12%, respectively while the maceration extract was 6.77%, 3.77%, and 5.65%. 4.12%, respectively and at concentration at 7% can be predicted to decrease 100% epg for 6-7 days in vivo. As conclusion from this in vitro research, the 7% kemuning leaves infuse extract was able promoted as the best candidate of herbs anthelmintic in controlling infections of Trichostrongylidae.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Nutrisi dan Pakan
PENAPISAN FITOKIMIA DAN KAJIAN IN VITRO EKSTRAK
DAUN KEMUNING (
Murraya paniculata
L. Jack) TERHADAP
TRICHOSTRONGYLIDAE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Penapisan Fitokimia dan Kajian in vitro Ekstrak Daun Kemuning (Murraya paniculata L. Jack) terhadap Trichostrongylidae
Nama : Gresy Eva Tresia NIM : D251150326
Disetujui oleh Komisi Pembimbing
Dr Ir Dwierra Evvyernie, MS MSc Ketua
Drh Risa Tiuria, MS PhD Anggota
Diketahui oleh
Ketua Program Studi Ilmu Nutrisi dan Pakan
Prof Dr Ir Yuli Retnani MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2015 ini ialah antelmintika herbal, dengan judul Penapisan fitokimia dan kajian in vitro ekstrak daun kemuning (Murraya paniculata L. Jack) terhadap Trichostrongylidae. Bagian dari tesis ini sedang dalam proses penerbitan pada di Media Peternakan sebagai publikasi yang berjudul “Phytochemical Screening and in vitro Ovicidal, Larvacidal, Nematicidal Murraya paniculata [L.] Jack Extract on Gastrointestinal Parasites on Goat”.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Dwierra Evvyernie MS MSc dan Ibu drh Risa Tiuria MS PhD selaku pembimbing yang telah banyak memberi saran, motivasi dan dukungan dana penelitian mandiri. Terimakasih juga penulis sampaikan kepada Dr Indah Wijayanti STP MSi dan Dr Ir Lilis Khotijah MSi selaku penguji yang telah banyak memberi saran untuk penyempurnaan karya ilmiah ini. Penulis juga mengucapkan terimakasih kepada Dr drh Eva Herlina MSi yang berperan penting dalam penentuan topik penelitian dan Ketua program studi INP Prof Dr Ir Yuli Retnani MSc atas saran selama proses pendidikan. Di samping itu, penghargaan penulis sampaikan kepada Bapak Eman staf dari Laboratorium Helmintologi, staf pascasarjana, teman-teman Sinergi INP angkatan ke-3 (Fast Track) dan kelas INP 2014 atas motivasi dan bantuannya. Ungkapan terima kasih terdalam juga disampaikan kepada ayahanda Paimin Sitorus, ibunda Senti Situmorang atas segala doa, limpahan kasih sayang, bimbingan moral dan materi yang tiada henti kepada penulis. Terimakasih juga kepada Bang Henry, Bang Gerry, Andreas, Rika dan Juan serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
2 METODE 2
Lokasi dan Waktu 2
Materi 3
Prosedur Penelitian 3
Rancangan Percobaan dan Analisis Data 9
3 HASIL DAN PEMBAHASAN 10
Pengaruh Ekstraksi terhadap Kandungan Bioaktif dan Rendemen
Ekstrak Daun Kemuning 10
Pengaruh Ekstrak Daun Kemuning terhadap Pekembangan Larva
Trichostrongylidaein vitro 12 Pengaruh Ekstrak Daun Kemuning terhadap Larva Infektif
Trichostrongylidaein vitro 14 Pengaruh Ekstrak Daun Kemuning terhadap Cacing Dewasa
Trichostrongylidaein vitro 15
Lethal Concentration Ekstrak Daun Kemuning terhadap
Trichostrongylidae 18
Prediksi Kebutuhan Tepung Daun Kemuning secara in vivo 19
4 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 20
LAMPIRAN 25
DAFTAR TABEL
1. Komponen bioaktif dan rendemen tepung dan ekstrak daun
kemuning 11
2. Rataan jumlah larva hidup dan persentase mortalitas perkembangan
larva Trichostrongylidae 13
3. Rataan waktu, jumlah kematian dan persentase mortalitas larva
Trichostrongylidae 15
4. Rataan waktu, jumlah kematian dan persentase mortalitas cacing
Trichostrongylidae (Haemochus contortus) 16 5. Lethal concentration ekstrak daun kemuning (%) terhadap
4. Mekanisme Saponin, Flavonoid dan Tanin sebagai Antelmintika 17
DAFTAR LAMPIRAN
1. Identifikasi larva infektif 25
2. Hasil sidik ragam mortalitas perkembangan larva infektif 25 3. Hasil sidik ragam kumulatif perkembangan larva infektif 25 4. Hasil sidik ragam persentase mortalitas larva infektif 25 5. Hasil sidik ragam jumlah kematian larva infektif 25 6. Hasil sidik ragan Lethal Time (LT50) larva infektif 26 7. Hasil sidik ragam persentase mortalitas cacing dewasa H.contortus 26 8. Hasil sidik ragam jumlah kematian cacing dewasa H.contortus 26 9. Hasil sidik ragam Lethal Time (LT50) cacing dewasa H.contortus 26 10. Hasil uji lanjut Duncan mortalitas perkembangan larva infektif 26 11. Hasil uji lanjut Duncan kumulatif perkembangan larva infektif 27 12. Hasil uji lanjut Duncan persentase mortalitas larva infektif 27 13. Hasil uji lanjut Duncan jumlah kematian larva infektif 28 14. Hasil uji lanjut Duncan Lethal Time (LT50) larva infektif 28 15. Hasil uji lanjut Duncan persentase mortalitas cacing dewasa
H.contortus 29
16. Hasil uji lanjut Duncan jumlah kematian cacing dewasa
H.contortus 29
17. Hasil uji lanjut Duncan Lethal Time (LT50) cacing dewasa
H.contortus 29
18. Hasil uji goodness of fit perkembangan larva 30
19. Hasil uji goodness of fit larva infektif 30
21. Hasil uji regresi perkembangan larva 30
22. Hasil uji regresi larva infektif 30
23. Hasil uji regresi cacing dewasa H.contortus 31
24. Spray dryer, daun kemuning, serbuk ekstrak infusa daun kemuning 31 25. Rotary evaporator, ekstrak maserasi daun kemuning 31 26. Pupukan Feses untuk uji larva infective Assay, vermiculite,
pemanenan larva 32
1
PENDAHULUAN
Latar Belakang
Pemeliharaan kambing merupakan salah satu upaya alternatif diversifikasi ternak penghasil susu atau daging disamping ternak sapi dalam pemenuhan kebutuhan susu dan daging di Indonesia. Usaha untuk meningkatkan produktivitas ternak seringnya dibatasi oleh dua hal yakni nutrisi dan kesehatan, sehingga untuk mengoptimalkan produktivitas kambing perlu diiringi dengan perbaikan kualitas dan kuantitas pakan serta manajemen kesehatan terpadu. Permasalahan yang sering dihadapi dalam pengembangan ternak kambing salah satunya penyakit kecacingan. Prevalensi penyakit kecacingan pada ternak kambing dan domba di Jawa Barat dilaporkan sekitar 80%, dengan derajat infeksi yang cukup tinggi terutama pada musim hujan (Beriajaya dan Stevenson 1986). Penyakit kecacingan (nematodiasis) menyebabkan tingginya kompetisi dalam nutrien dan kerusakan jaringan yang berasosiasi dengan menurunnya performa ternak, yaitu dapat menurunkan bobot badan dan menurunkan produktivitas susu ternak kambing sebesar 6.25%–21.5%, sehingga mengakibatkan kerugian ekonomi bagi peternak (Alberti et al. 2012).
Infestasi cacing pada saluran pencernaan kambing biasanya merupakan kelas Nematoda, Ordo Strongylida dengan Family Trichostrongylidae (Zanzani et al. 2014; Beriajaya dan Copeman 1997). Salah satu spesies dari
Trichostrongylidae adalah Haemonchus contortus. Haemonchus contortus dapat menyebabkan gejala kronis dan morbiditas yang tinggi pada semua ruminansia, sehingga terdapat kebutuhan yang mendesak harus hadir dalam manajemen pemeliharaan untuk mengendalikan infeksi (Miller dan Horohov 2006).
Pencegahan terhadap penyakit kecacingan yaitu dengan perbaikan tata laksana pemeliharaan, pemeriksaan feses secara berkala, pemberian obat cacing sesuai dengan dosis dan periode yang direkomendasikan, rotasi atau penggantian jenis obat cacing yang digunakan. Penanggulangan infeksi cacing dapat ditekan dengan melakukan tindakan pemberian obat cacing (antelmintika). Jenis antelmintika yang biasa digunakan berasal dari obat sintetis dapat menimbulkan beberapa efek samping yang merugikan seperti timbulnya galur cacing yang resisten terhadap obat cacing dan residu pada produk asal ternak (Kinsella et al.
2009). Kasus resistensi cacing yang pernah dilaporkan terjadi antara lain
Oesophagostonum spp. yang menginfeksi babi, resisten terhadap Pyrantel dan Levamisol atau kasus Cyathostomes pada kuda resisten terhadap Benzimidazol (Dargatz et al. 2000), dan kasus Haemonchus contortus pada domba resisten terhadap Benzimidazol di daerah Kendal (Jawa Tengah), Ciomas (Jawa Barat) dan Dramaga (Jawa Barat) dengan resistensi tersebut berkisar antara 8-17% (Beriajaya 2002). Kasus resistensi tersebut kemungkinan besar karena penggunaan obat cacing yang terlalu sering dalam satu tahun (5-12 kali) (Dargatz et al. 2000). Oleh karena itu resiko dari obat sintetis ini telah mendorong pencarian bahan aktif baru yang tidak toksik dan lebih efisien. Salah satu alternatif tersebut mungkin dengan penggunaan tanaman obat.
2
yang potensial sebagai antelmintika adalah tanaman kemuning. Keampuhan herbal dapat diketahui dari hilangnya gejala klinis dan performa yang lebih baik. Hilangnya gejala klinis biasanya diketahui dari pengalaman yang diturunkan secara turun temurun, tetapi hal ini belum banyak dibuktikan secara ilmiah.
Kemuning termasuk Kelas Magnoliopsida, Ordo Geraniales, Famili
Rutaceae, Genus Murraya, Spesies Murraya paniculata. Senyawa aktif yang terkandung dalam daun kemuning berbeda di setiap pelarut/penyari dan media tanamnya (Gautam et al. 2012; Vaghasiya et al. 2012; Syahadat dan Aziz 2012). Senyawa aktif yang umumnya terdapat di dalam daun kemuning adalah flavonoid, saponin, dan tanin, sehingga daun ini dapat dijadikan antikanker, antimikroba, antoioksidan, antidiabetes (Ng et al. 2012) Pada penelitian sebelumnya, penggunaan tepung daun kemuning (Murraya paniculata L. Jack) sebesar 0.7% di dalam ransum kambing PE laktasi dengan rataan produksi susu 940 ml-1ekor-1hari -1
yang terinfeksi parasit cacing alami ordo Strongylida, mampu mereduksi telur tiap gram tinja (TTGT) sebesar 21.28% pada minggu keempat (Winarni et al.
2014). Peningkatan reduksi TTGT selama 5 minggu menjadi 43.6% ketika konsentrasi tepung daun kemuning ditingkatkan menjadi 1% dengan kontrol yang digunakan berupa Oxfendazole pada kambing PE laktasi dengan rataan produksi susu 861 ml-1ekor-1hari-1yang terinfeksi parasit cacing alami ordo Strongylida (Tresia et al. 2015). Efek positif pada ternak dari kedua penelitian tersebut adalah terdeteksinya perbaikan profil darah mendekati normal dan berkurangnya sel-sel somatic dalam air susu ternak, sehingga meskipun belum dapat meningkatkan produksi susu, perbaikan kesehatan ternak telah terpacu dengan pemberian tepung daun kemuning di dalam ransum kambing PE laktasi. Berdasarkan penelitian-penelitian tersebut tampak bahwa pemberian daun kemuning belum memiliki dosis yang mampu mengurangi efek kecacingan secara signifikan, oleh karena itu dalam penelitian ini dilakukan pengujian dosis efektif secara in vitro tentang penggunaan daun kemuning dalam bentuk ekstrak yang tepat agar dapat mengoptimalkan kandungan senyawa bioaktif yang berperan sebagai antelmintika, sehingga dapat menghambat berkembangnya larva sampai reduksi cacing dewasa.
Tujuan Penelitian
Penelitian ini bertujuan mengkaji pengaruh metode ekstraksi yang berbeda (maserasi dan infusa) terhadap kandungan senyawa fitokimia dan aktivitas antelmintika terhadap Trichostrongylidae secara in vitro. Selain itu, menentukan konsentrasi yang paling efektif terhadap Trichostrongylidae.
2
METODE
Lokasi dan Waktu
3 Tanaman Obat dan Aromatik (Balittro); dan Laboratorium Balai Penelitian Ternak (Balitnak). Penelitian dilaksanakan selama 5 bulan yakni pada bulan Desember 2015 sampai dengan April 2016.
Materi
Alat-alat yang digunakan adalah TLC Scanner, Spektrofotometer, shaker, timbangan, evaporator, jarum ose, mikroskop, spot plate, cawan petri, pengaduk, saringan, stopwatch, gunting, dan plastik. Bahan-bahan yang digunakan dalam penelitian ini adalah tepung daun kemuning, akuades, etanol 96%, folin denis,
Na2CO3 anhidrat denis, asam tanat,aluminium sheet silika gel 60 GF 254, CHCl3, alumunium foil, kloroform, H2SO4, reagen Dragendorf, Mayer, Wagner, metanol NaOH 10%, FeCl3 1%, NaCl fisiologis 0.9%, feses kambing PE, cacing
Haemonchus contortus dan larva Trichostrongylidae.
Prosedur Penelitian
1. Persiapan Ekstrak dan Penapisan Fitokimia
Pembuatan Ekstrak Daun Kemuning
Ekstraksi dilakukan untuk mendapatkan komponen bioaktif yang terkandung dalam daun kemuning. Daun kemuning yang digunakan merupakan daun kemuning yang diperoleh dari perkebunan di Kabupaten Bantul, Yogyakarta, Jawa Tengah dan dikirim dalam bentuk tepung. Tepung daun kemuning diekstraksi dengan 2 metode yakni infusa dan maserasi serta dengan 2 penyari yaitu akuades dan etanol.
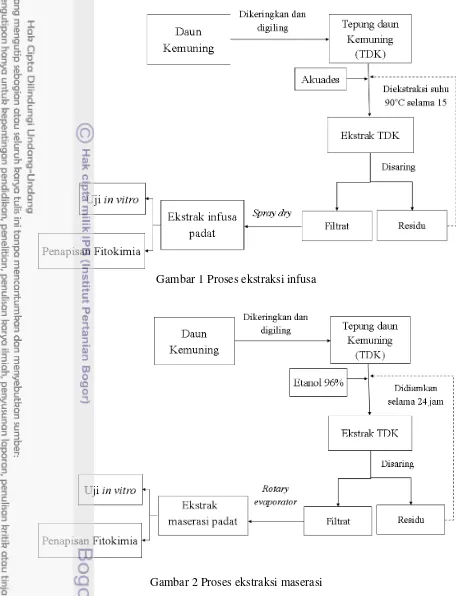
a. Metode Infusa (Depkes 2000). Pembuatan sediaan infus daun kemuning dilakukan dengan cara menimbang tepung daun kemuning dan ditambahkan pelarut akuades dengan perbandingan daun kemuning dan aquades adalah 1:10 (b/v) di dalam panci infus, diaduk dan dipanaskan di atas penangas air selama 15 menit sejak suhu mencapai 90oC. Panci infus diangkat dan didinginkan, kemudian disaring dengan kain flanel, proses infusa dilakukan pengulangan pada tepung daun kemuning yang sama. Filtrat dipisahkan menggunakan penyaring kemudian dipekatkan dengan proses spray drying (mini spray dry Buchi 190). Ekstrak tersebut digunakan untuk pengujian in vitro. Proses pembutan ekstrak infusa yang dilakukan dengan alur seperti pada Gambar 1.
4
Gambar 1 Proses ekstraksi infusa
Gambar 2 Proses ekstraksi maserasi
Pengujian Fitokimia (Harbone 1987)
5 secara kualitatif. Hasil analisa dengan senyawa aktif terbanyak akan diuji secara kuantitatif.
a. Uji alkaloid. Sampel ekstrak/tepung daun kemuning dilarutkan dengan 10 mL kloroform-amoniak setelah itu disaring. Filtrat yang diperoleh ditetesi H2SO4 2N, kemudian dikocok sehingga terbentuk dua lapisan. Lapisan asam (tak berwarna) dipipet ke dalam tabung reaksi lain, kemudian larutan dibagi 3. Masing-masing larutan ditambahkan beberapa tetes reagen Dragendrorf, Mayer dan Wagner. Uji akan positif alkaloid apabila menghasilkan endapan yang berwarna orange setelah ditambah reagen Dragendrorf, endapan putih kekuningan setelah ditambah reagen Mayer dan endapan coklat setelah ditambah reagen Wagner.
b. Uji flavonoid. Sampel ekstrak/tepung daun kemuning ditambahkan beberapa mL (terendam) etanol atau akuades kemudian dipanaskan sampai mendidih lalu disaring. Kemudian ditambahkan NaOH 10% dan akan muncul warna kuning. Setelah itu, akan warna akan memudar jika ditambahkan H2SO4 pekat yang menandakan positif adanya flavonoid.
c. Uji Saponin dan Tanin. Sampel ekstrak/ tepung daun kemuning dilarutkan dengan akuades panas kemudian dipanaskan sampai mendidih. Kemudian disaring dan filtrat dibagi 2 ke dalam tabung reaksi. Bagian pertama untuk uji saponin larutan dibiarkan dulu agak dingin kemudian dikocok secara vertikal, apabila timbulnya busa yang stabil setinggi lebih kurang 1 cm selama 10 menit menandakan positif adanya saponin. Pada tabung reaksi kedua filtrat ditambahkan FeCl3 1% bila menghasilkan warna hijau, biru, hitam menandakan positif adanya tanin.
d. Uji Triterpenoid dan Steroid. Sampel ekstrak/tepung daun kemuning dilarutkan dengan 25 ml etanol panas (50 ᵒC) kemudian hasilnya disaring ke dalam pinggan porselin dan diuapkan sampai kering. Residu ditambahkan eter dan ekstrak eter di pindahkan ke dalam lempeng tetes kemudian ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat (Uji Lieberman-Burchard). Warna merah ungu menunjukkan adanya triterpenoid, sedangkan warna hijau positif mengandung steroid.
Pengujian Fitokimia Kuantitatif (Flavonoid Quarcetin, Tanin, Saponin)
Tingkat intensitas warna pada pengujian kualitatif yang positif kemudian diuji secara kuantitatif meliputi pengujian flavonoid quarcetin, saponin dan tanin dengan metode sebagai berikut :
6
ppm, 5 ppm dari standar induk asam tanat 100 ppm. Sampel dan standar diukur menggunakan spektrofotometer Hitachi U-2000 250 V dengan panjang gelombang 725 nm. volume labu, kemudian dikocok dengan menggunakan shaker selama 2 jam. Setelah 2 jam, volume ditepatkan sampai tanda tera (25 mL) dan disimpan selama 24 jam. Filtrat disaring dan ditotolkan pada lempeng aluminium sheet silika gel 60 GF 254 sebanyak µL dengan menggunakan bahan pembanding saponin yang dilarutkan dalam air dengan konsentrasi 190 ppm sebanyak 5 µL. Elusi dengan menggunakan eluen perbandingan CHCl3 : etanol adalah 49 : 1 yang ditambahkan beberapa tetes etil asetat sampat batas eluen ±15 cm. Setelah selesai dielusi, lempeng KLT dibiarkan kering dan diukur dengan menggunakan alat Thin Layer Chromatography (TLC) scanner Camag 3 pada panjang gelombang 292 menggunakan spektrofotometer pada panjang gelombang 725 nm. Larutan contoh diencerkan sebanyak 6 kali lalu diambil sebanyak 0.05 mL dijadikan 0.5 mL dengan penambahan akuades. Setelah itu, larutan contoh diperlakukan sama dengan larutan standar. Setelah itu dilakukan perhitungan konsentrasi tanin sampel dengan prosedur perhitungan sebagai berikut :
[ s s s
s s s x konsentrasi tanin standar (g x 10 -2
g) x faktor pengenceran]
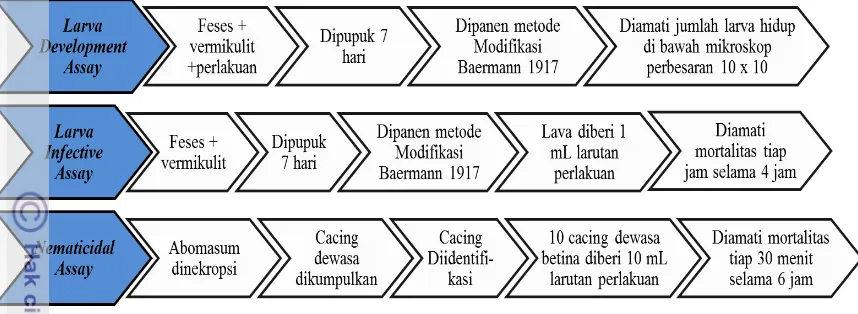
2. Pengujian in vitro Ekstrak Daun Kemuning terhadap Perkembangan Larva, Larva Infektif dan Cacing Dewasa Trichostrogylidae
Pengambilan Sampel Feses
Sampel feses diambil sebanyak 3 kali. Sampel diambil langsung dari anus 12 ekor kambing sebanyak 4 gram tiap ekor untuk analisa telur tiap gram tinja (TTGT). Pengambilan feses kedua diambil sebanyak 300 gram dari 4 ekor kambing dengan derajat TTGT paling tinggi (nilai TTGT lebih dari 2000 strongylid) diantara 12 ekor untuk pengujian larva infektif. Pengambilan feses ketiga sebanyak 140 gram dari satu ekor kambing untuk pengujian larva development assay (LDA).
Analisis Telur Tiap Gram Tinja (TTGT) (Permin dan Hansen 1998)
7 mikroskop dengan perbesaran 10 x 10. Rumus perhitungan telur cacing tiap gram tinja (TTGT) sebagai berikut :
Vtotal : volume larutan pengapung dan feses (mL) Vhitung : volume McMaster
In vitro Perkembangan Larva / Larval Development Assay (Molan et al. 2003)
Larva infektif diperoleh dari pembiakan telur cacing dari feses ternak kambing yang terinfeksi alami. Sampel tinja sebanyak 4 gram tinja dilumatkan dengan sendok, lalu dicampur dengan medium vermiculite sebagai penahan kelembapan dengan rasio volumenya 1:3. Setelah itu, campuran tersebut ditambahakan ditambahkan perlakuan (ekstrak daun kemuning atau oxfendazole), kemudian dimasukkan ke dalam cawan petri diameter 7 cm yang dialasi kertas Whatman. Permukaannya diratakan, ditutup dan dibiarkan selama satu minggu. Bila tinja terlalu kering sebaiknya dibasahi dengan akuades, karena bila terlalu kering larva akan cepat mati sedangkan bila terlalu basah telur hanya sedikit yang menetas. Pupukan dieramkan pada suhu 25 ᵒC – 29 ᵒC atau suhu kamar. Setelah 7 hari larva dipanen dengan metode modifikasi Baerman (1917) selama 12 jam. Sebanyak 20 mL larutan yang mengandung larva tersebut diambil. Kemudian sebanyak 0.1 mL larutan tersebut diaambil dan dipindahkan ke 10 kaca objek dengan volume 0.01 mL tiap kaca objek dan diamati di bawah mikroskop (Nikon YS 100) dengan perbesaran 10 x 10. Proses pengujian ekstrak terhadap perkembangan larva secara in vitro dilakukan dengan alur seperti pada Gambar 3. Rumus untuk menghitung jumlah larva infektif dalam 20 mL larutan sebagai berikut ini.
N1 =
Keterangan :
N1 = Jumlah larva infektif 20 mL N2 = Jumlah larva infektif 10 mL V1 = Volume larutan 20 mL V2 = Volume larutan 0.1 mL
Pemupukan Larva Infektif (Molan et al. 2003)
Sampel tinja sebanyak 300 gram dicampur medium vermiculite dengan rasio volumenya 1:3 dan dimasukan ke dalam cawan petri diameter 25 cm. Permukaannya diratakan, ditutup dan dibiarkan selama satu minggu, bila tinja terlalu kering dibasahi dengan akuades dan dieramkan selama 7 hari.
Pemanenan Larva Infektif ( Modifikasi Metode Baermann 1917)
8
Baermann yang telah diisi akuades sebelumnya ±280 mL. Selanjutnya ditunggu 12 jam, maka larva akan terendap dalam gelas Baermann dan bisa ditampung dengan membuka jepitannya. Cairan hasil penyaringan kurang lebih 20 mL dipindahkan dalam botol.
Pengujian Larva Infektif / Larval Infective Assay (Dey et al. 2015)
Sebanyak 0.01 mL cairan mengandung larva infektif diambil dan dimasukkan counting plate diameter 2 cm dan ditambahkan perlakuan. Jumlah larva diamati dibawah mikroskop perbesaran 4 x 10 dengan jumlahnya sebanyak 60-130 ekor larva infektif. Setiap jam selama 4 jam jumlah larva diamati. Proses pengujian ekstrak terhadap larva infektif secara in vitro dilakukan dengan alur seperti pada Gambar 3.
Identifikasi Larva Infektif Trichostrongylidae (van Wyk dan Mayhew 2013)
Sebanyak 0.01 mL cairan mengandung larva infektif diambil dengan mikropipet dipindahkan ke kaca objek dan ditambahkan lugol dan diamati di bawah mikroskop (Nikon Eclipse E600) perbesaran 10 x 10 dengan jumlah larva yang diamati 100 ekor dan sebanyak 3 ekor tiap jenis larva diukur panjang dan diamaternya dengan menggunakan mikroskop yang terhubung visual scaler (SVS 3000) dan monitor. Larva dibedakan berdasarkan ada tidaknya selubung, bentuk kepala, ada tidaknya refraktil, dan ukuran selubung ekor.
Pengambilan Cacing Dewasa Trichostrongylidae (Beriajaya et al. 1998)
Cacing dewasa dikoleksi dari abomasum dan usus halus kambing yang berasal dari Rumah Potong Hewan (RPH) Empang, Bogor. Abomasum kambing dibuka menggunakan gunting, kemudian isinya ditampung kedalam wadah berisi NaCl fisiologis isotonis 0.9 % (b/v). Selanjutnya wadah dibawa ke laboratorium Helmintologi untuk dilakukan pemisahan cacing dari isi abomasum,kemudian dengan pinset halus dimasukkan ke dalam cawan petri yang telah diisi 10 mL NaCl isotonis.
Identifikasi Cacing Dewasa Haemonchus contortus
Identifikasi cacing dewasa Trichostrongylidae berdasarkan Manual of Veterinary Parasitological Laboratory Techniques (1971). Cacing
Trichostrongylidae yang ditemukan pada sampel isi abomasum kambing dapat dibedakan dari ukuran, dan jenis kelamin cacing. Cacing dewasa yang digunakan adalah cacing betina dengan perbedaan jantan dan betina dilihat dari ukuran, warna dan alat kelamin yang diamati di bawah mikroskop perbesaran 4 x 10.
Pengujian Ekstrak terhadap Cacing Dewasa Tipe Trichostrongylidae / Nematicidal Assay) (Beriajaya et al. 1998)
9 disentuh. Proses pengujian ekstrak secara in vitro dilakukan dengan alur seperti pada Gambar 3.
Gambar 3 Pengujian in vitro Ekstrak Daun Kemuning terhadap
Trichostrongylidae
Rancangan Percobaan dan Analisis Data
Perlakuan
Penelitian ini terdiri dari 11 perlakuan dengan 5 ulangan. Perlakuan yang digunakan masing-masing terdiri dari :
P0 = Kontrol (tanpa ekstrak daun kemuning atau oxfendazole) P1 = Ekstrak infusa daun kemuning konsentrasi 1%
P2 = Ekstrak infusa daun kemuning konsentrasi 3% P3 = Ekstrak infusa daun kemuning konsentrasi 5% P4 = Ekstrak infusa daun kemuning konsentrasi 7% P5 = Ekstrak maserasi daun kemuning konsentrasi 1% P6 = Ekstrak maserasi daun kemuning konsentrasi 3% P7 = Ekstrak maserasi daun kemuning konsentrasi 5% P8 = Ekstrak maserasi daun kemuning konsentrasi 7% P9 = Oxfendazole konsentrasi 0.0005%
P10 = Oxfendazole konsentrasi 0.005%
Analisis data
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan 11 perlakuan dan 5 ulangan. Analisis data menggunakan sidik ragam (ANOVA) dan jika perlakuan berpengaruh nyata maka dilakukan uji lanjut Duncan menggunakan SPSS 16.0, sedangkan untuk
lethal concentration menggunakan analisa probit Minitab 14.0. Model matematika RAL sebagai berikut:
Yij= μ + τi + εij
Keterangan :
Yij = Respon pengamatan pada perlakuan ke-i dan ulangan ke-j
10
τi = Pengaruh perlakuan ke-i
ε j = Pengaruh galat perlakuan ke-i dan ulangan ke-j
Peubah
Peubah yang diamati dalam penelitian ini adalah 1. Rendemen
Rendemen ekstrak = s
x 100%
2. Kandungan kualitatif dan kuantitatif senyawa fitokimia tepung daun kemuning dan ekstrak daun kemuning
3. Rataan jumlah kematian cacing dewasa, larva infektif dan perkembangan larva Trichostrongylidae (ekor).
LT50 adalah waktu yang dibutuhkan untuk menimbulkan kematian pada 50% jumlah cacing pada konsentrasi tertentu dengan menggunakan persamaan regresi linear.
7. Lethal Concentration
Dosis ekstrak daun kemuning yang efektif ditentukan dengan penghitungan lethal concentration 50% (LC50), 60% (LC60), 70% (LC70), 80% (LC80), dan 90% (LC90) yaitu konsentrasi yang diperlukan untuk dapat membunuh persentase mortalitas tersebut pada waktu tertentu dengan menggunakan analisa probit.
3
HASIL DAN PEMBAHASAN
Pengaruh Ekstraksi terhadap Kandungan Bioaktif dan Rendemen Ekstrak Daun Kemuning
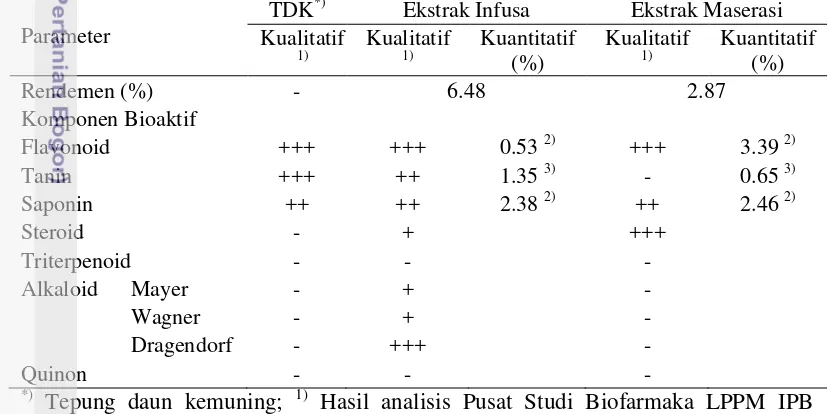
11 maserasi lebih baik dalam menyari flavonoid jenis quarcetin dan saponin namun tidak pada kandungan tanin dibanding metode infusa. Hal ini juga menunjukkan bahwa banyaknya kandungan flavonoid jenis lain selain quarcetin yang terkandung dalam ekstrak infusa.
Banyaknya senyawa bioaktif dan tingginya rendemen pada ekstrak infus kemungkinan disebabkan oleh lebih mudahnya senyawa bioaktif (tanin, flavonoid dan alkaloid) yang tersaring di dalam ekstrak penyari pada infusa dibandingkan dengan penyari pada maserasi atau dengan kata lain lebih banyak zat yang tersaring. Banyaknya zat yang terlarut dipengaruhi oleh perbedaan daya larut dalam proses ekstraksi. Faktor perbedaan daya larut ini disebabkan oleh kepolaran pelarut dan zat terlarut serta pemanasan. Pelarut yang baik adalah pelarut yang memiliki daya melarutkan yang tinggi terhadap zat terlarut dengan dapat melarutkan zat tertentu sesuai dengan kepolaran, pelarut akuades merupakan pelarut polar sedangkan etanol merupakan pelarut semipolar. Dengan demikian, ekstrak daun kemuning (EDK) ini tergolong ekstrak yang bersifat polar karena lebih banyak tersari dalam pelarut polar (akuades). Selain perbedaan kepolaran pelarut, adanya pengaruh proses pemanasan pada sedian infus dapat meningkatkan daya larut sehingga menghasilkan rendemen yang lebih tinggi dibanding sediaan maserasi. Namun dampak pemanasan juga dapat menurunkan kandungan tanin. Rehman dan Shah (2005) juga melaporkan bahwa konsentrasi tanin akan menurun 0.20-1.40% akibat pemanasan (suhu 121 ᵒC) selama 10 menit. Tabel 1 Komponen bioaktif dan rendemen tepung dan ekstrak daun kemuning
Parameter
TDK*) Ekstrak Infusa Ekstrak Maserasi
Kualitatif (2016); 2) Flavonoid quarcetin, Hasil analisis Balittro (2016); 3) Hasil analisis Balitnak (2016). (-) Tidak ada, (+) Positif lemah, (++) Positif, (+++) Positif kuat, (++++) Positif sangat kuat.
12
polar dan akuades senyawa polar, dan begitu pula terjadi pada senyawa alkaloid yang merupakan senyawa polar meskipun dengan konsentrasi yang cenderung sedikit. Jenis alkaloid yang terdapat pada daun kemuning adalah yuehchuken (Ng
et al. 2012).
Kemampuan ekstrak daun kemuning sebagai antelmintika berkaitan dengan keberadaan saponin dan tanin yang diketahui sebagai antinutrisi. Adanya senyawa anti nutrisi dalam bahan pakan dapat menjadi pembatas penggunaannya dalam ransum, karena senyawa antinutrisi ini akan menimbulkan pengaruh negatif terhadap pertumbuhan dan produksi ternak tergantung pada dosis yang masuk ke dalam tubuh. Batas toleransi saponin di ruminansia adalah sebesar 0.002%-0.87% bahan kering (Onwuka 1992) dan batas toleransi terhadap tanin <6% dimana level 7% sudah dapat mengganggu performa ternak seperti menurunkan konsumsi, pertumbuhan dan mengganggu aktivitas mikroba rumen (Molan et al. 2003). Melalui perhitungan level penggunaan ekstrak terhadap kandungan total didapatkan bahwa pada level 7% ekstrak daun kemuning infusa memiliki kandungan tanin dan saponin berturut-turut 0.09 % dan 0.17%, sedangkan pada metode maserasi 0.04% dan 0.17%. Hal ini menunjukkan bahwa pemakaian saponin dan tanin yang terkandung dari kedua ekstrak ini pada level tertinggi yakni 7% dapat ditolerir oleh ruminansia dan diharapkan potensial sebagai antelmintika yang tidak menimbukan pengaruh negatif pada ternak.
Pengaruh Ekstrak Daun Kemuning terhadap Pekembangan Larva Trichostrongylidaein vitro
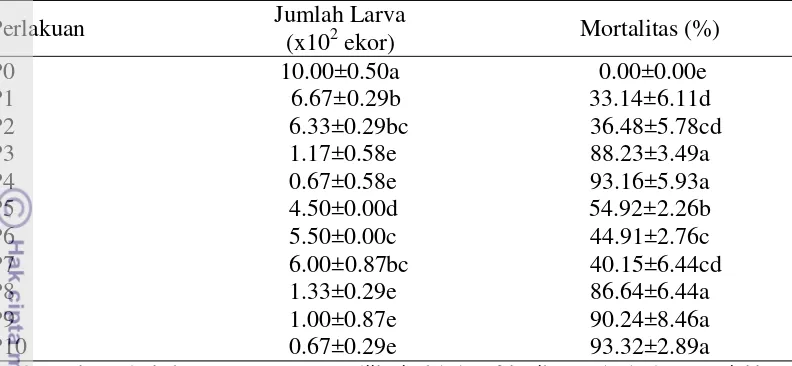
Rataan kumulatif mortalitas dan persentase mortalitas perkembangan larva
13
Hal ini berbeda dengan Nery et al. (2010) yang membuktikan bahwa efikasi ekstrak penyari air (infusa) dari daun Anacardium humile lebih efektif dibandingkan ekstrak maserasi dengan efikasi ekstrak penyari air 15% terhadap LDA sebesar 97.3% dan ekstrak penyari etanol (maserasi) 8% sebesar 99.6%. Meskipun demikian, kedua ekstrak daun kemuning memiliki efikasi yang sebanding dengan penelitian tersebut (Nery et al. 2010) namun tidak sebaik ekstrak penyari akuades Genipa americana yang mampu menghambat 99.6% dan 100% LDA pada level 50 mg mL-1 (5%) dan 100 mg mL-1 (10%) dengan kandungan senyawa hidrolisis tanin dan flavonoid (Noguera et al. 2014). Perbedaan efikasi ini setiap tanaman herbal ini disebabkan oleh kandungan senyawa bioaktif tanaman dan tersari dalam ekstraksi tersebut, senyawa aktif yang beragam dengan konsentrasi yang tinggi belum tentu memiliki efikasi yang lebih baik karena kemungkinan adanya reaksi sinergis dan antagonis antara senyawa aktif. Diduga saponin, tanin dan flavonoid memiliki aktivitas sinergis sebagai agen penghambat perkembangan larva (ovisidal).
Botura et al. (2013) melaporkan bahwa fraksi flavonoid memiliki kemampuan ovisidal lebih besar dibanding larvasidal dan nematosidal, sedangkan senyawa saponin sebaliknya. Meskipun demikian, ekstraksi dengan infusa daun kemuning lebih efektif dibanding maserasi yang memiliki flavonoid quarcetin yang lebih tinggi sehingga kandungan quarcetin belum menjadi tolak ukur aktivitas antelmintika terhadap perkembangan larva karena secara kualitatif flavonoid dalam infusa positif lebih kuat dibanding maserasi. Oleh karena itu, adanya kemungkinan jenis flavonoid lain yang terkandung dalam daun kemuning selain quarcetin memilki kemampuan antelmintika. Selain itu, efikasi terhadap perkembangan larva pada infusa yang lebih tinggi ini juga dipengaruhi oleh adanya konsentrasi tanin yang lebih tinggi dalam ekstrak infusa dibanding maserasi memiliki pengaruh menghambat perkembangan larva dan dibuktikan oleh Molan et al. (2002) bahwa ekstrak condessed tannin hijauan (400 µg CT mL -1
) mampu menghambat penetasan telur dan perkembangan larva infektif nematoda Tabel 2 Rataan jumlah larva hidup dan persentase mortalitas perkembangan larva
14
sebesar 87% dan 100%. Penetasan telur nematoda dimulai oleh ransangan lingkungan dan dihasilkan pelepasan enzim seperti protease, lipase, dan kitinase oleh larva muda yang berfungsi mendegradasi membran sel telur (Mansfield et al.
1992). Saponin, tanin dan flavonoid yang hadir dalam fraksi maserasi dan infusa daun kemuning dapat bertindak menghambat aktivitas enzim ini, dengan tindakan flavonoid dikaitkan dengan perubahan aktivitas enzim dan proses metabolisme parasit seperti meningkatkan produksi nitrit oxide (NO) (Kerboeuf et al. 2008; Brunet et al. 2007). Terganggunya sekresi enzim akan menghambat proses degradasi dan tidak terbentuk larva baru.
Pengaruh Ekstrak Daun Kemuning terhadap Larva Infektif Trichostrongylidaein vitro
Rataan kumulatif mortalitas, waktu kematian 50% dan persentase mortalitas Trichostrongylidae pada pengamatan selama 3 jam tersaji pada Tabel 3. Hasil uji sidik ragam menunjukkan perlakuan sangat nyata (P<0.01) mempengaruhi jumlah kematian larva, waktu kematian larva (LT50) dan persentase mortalitas larva. Semakin tinggi konsentrasi larutan yang dipakai untuk perendaman larva, maka makin cepat larutan tersebut mempunyai efikasi untuk membunuh larva, dengan efikasi paling tinggi pada konsentrasi 7%. Pada Tabel 4 terlihat bahwa efikasi tertinggi terdapat pada ekstrak infusa konsentrasi 7% (P4) dengan persentase mortalitas yang tinggi sekitar 94% dan waktu kematian tersingkat 1 jam. Berdasarkan klasifikasi dengan indeks efikasi diusulkan oleh Asosiasi Dunia untuk Kemajuan Hewan, ekstrak infusa konsentrasi 7% (P4) dianggap efektif dalam terhadap larva infektif Trichostrongylidae (Wood et al.
1995). Adapun tipe larva yang diamati adalah Trichostrongylus sp, Haemonchus sp, dan Cooperia sp. yang merupakan bagian Family Trichostrongylidae Ordo
Strongylida kelas Nematoda.
15
Saponin dan tanin diduga memiliki efektifitas yang lebih baik dibanding dengan flavonoid sebagai larvasidal. Barau et al. (2005) melaporkan flavonoid (flavonol glikosida dari Onobrychis viviifola) memiliki khasiat yang rendah terhadap kematian larva infektif Haemonchus contortus dan juga dilaporkan tidak mempengaruhi kematian larva Haemonchus contortus (Botura et al. 2013). Saponin dari Calendula officinalis dan Beta vulgaris terbukti mengurangi kelangsungan hidup larva infektif (L3) in vitro (75%) dari Heligmosomoides sp, nematoda tikus (Doligalska et al. 2011). Meskipun demikian, efektivitas dari saponin dan tanin semakin meningkat dengan adanya flavonoid. Hal ini didukung oleh Ademola et al. (2009) yang melaporkan bahwa metabolit sekunder dari
Khaya senegalensi memiliki aktivitas terhadap larva infektif H.contortus, dan metabolit ini termasuk saponin (A), saponin dan alkaloid (B), saponin, terpenoid, flavonoid, tannin (C), dan saponin dan tanin (D) dengan LC50 secara berurutan adalah 80.81, 63.73, 44.03, dan 63.90 mg mL-1dengan nilai LC50 yang semakin kecil menunjukkan semakin besar fungsi antelmintiknya. Tanin kondensasi mampu menghambat proses pelepasan kutikula larva cacing nematoda, melalui penghambatan enzim yang berperan dalam proses pelepasan kutila larva infektif (Brunet et al. 2007). Dengan demikian, pada tahap parasitik dalam tubuh ternak, mekanisme penghambatan dalam proses pelepasan kutila larva infektif akan menyebabkan penurunan jumlah larva yang mampu berkembang menjadi cacing dewasa.
Pengaruh Ekstrak Daun Kemuning terhadap Cacing Dewasa Trichostrongylidaein vitro
Rataan kumulatif mortalitas cacing dewasa, waktu kematian 50% dan persentase mortalitas Haemonchus contortus pada pengamatan selama 6 jam tersaji pada Tabel 4. Hasil uji sidik ragam menunjukkan perlakuan sangat nyata (P<0.01) mempengaruhi jumah kematian cacing, waktu kematian cacing (LT50) dan persentase mortalitas cacing. Semakin tinggi konsentrasi larutan yang dipakai Tabel 3 Rataan waktu, jumlah kematian dan persentase mortalitas larva
P7 66.25±24.72bcd 1.83±0.36de 75.58±15.56c
P8 118.75±10.8a 1.72±0.22e 84.34±7.53b
P9 77.00±7.48bc 2.24±0.05bc 63.07±2.11d
P10 82.20±15.79b 2.04±0.23cd 73.49±2.55c
16
untuk perendaman cacing, maka makin cepat larutan tersebut mempunyai efikasi untuk membunuh cacing, dengan efikasi paling tinggi pada konsentrasi 7% (P4). Berdasarkan klasifikasi dengan indeks efikasi diusulkan oleh Asosiasi Dunia untuk Kemajuan Hewan, ekstrak infusa konsentrasi 7% (P4) dianggap efektif dalam terhadap cacing dewasa Trichostrongylidae (Wood et al. 1995).
Bila dibandingkan antara sediaan infusa dan sediaan maserasi maka tampak sediaan infusa lebih efektif daripada sediaan maserasi karena sediaan infusa membutuhkan konsentrasi yang lebih rendah, sedangkan bila dibandingkan sediaan infusa dengan oxfendazole sebagai kontrol positif tampak bahwa sediaan infusa lebih efektif pada konsentrasi 5% (P3) dan 7% (P4)dan waktu perendaman yang lebih singkat pada level 7% untuk menimbulkan efikasi yang sama. Akan tetapi, waktu yang dibutuhkan untuk membunuh sebagian dari 10 cacing dewasa
Haemonchus contortus pada level yang sama 7% sediaan infusa konsentrasi sama dengan sediaan maserasi. Hal ini tidak sama dengan Dey et al. (2015) yang melaporkan bahwa efikasi 5% ekstrak metanol dan akuades dari tanaman lazabati, sharna lata, halud adalah sama berturut-turut 40%, 60%, dan 40%, sedangkan pada tanaman neem, tamak, buah korolla, daun korolla, dan chatim efikasi 5% ekstrak metanol lebih tinggi dibanding ekstrak akuades berturut-turut 100%, 100%, 80%, 60%, dan 80%. Perbedaan efikasi ini setiap tanaman herbal ini disebabkan oleh kandungan senyawa bioaktif tanaman dan tersari dalam ekstraksi tersebut. Meskipun demikian, efikasi dari kedua ekstrak ini sebanding dengan beberapa tanaman yang diteliti oleh Dey et al. (2015). Diduga saponin, tanin dan flavonoid memiliki aktivitas sinergis sebagai agen penyebab kematian cacing
Haemonchus contortus (nematisidal).
Respon pada TDK 1% lebih tinggi (Tresia et al. 2015) dibanding dengan mortalitas cacing dewasa secara in vitro dalam penelitian ini. Hal ini memungkinkan bahwa mekanisme dari herbal daun kemuning lebih efektif dalam membatasi reproduksi cacing strongylida dibanding menimbulkan mortalitas pada cacing. Hal ini didukung oleh pernyataan Martínez-Ortíz-de-Montellano et al.
Tabel 4 Rataan waktu, jumlah kematian dan persentase mortalitas cacing
Trichostrongylidae (Haemochus contortus)
P10 5.40±0.55c 5.12±0.50a 54.0±5.48c
17 (2010) bahwa terjadinya penurunan pada ttgt, fekunditi betina (kerusakan vulva) dan panjang cacing akibat pemberian tanin dari tzalam 1200 µg mL-1.
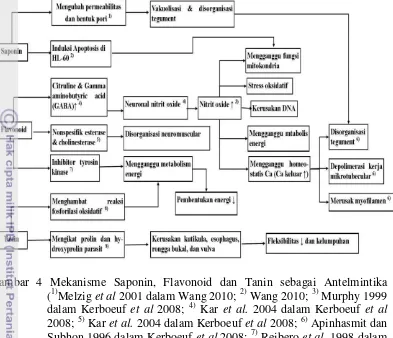
Gambar 4 Mekanisme Saponin, Flavonoid dan Tanin sebagai Antelmintika (1)Melzig et al 2001 dalam Wang 2010; 2) Wang 2010; 3) Murphy 1999 dalam Kerboeuf et al 2008; 4) Kar et al. 2004 dalam Kerboeuf et al
2008; 5) Kar et al. 2004 dalam Kerboeuf et al 2008; 6) Apinhasmit dan Subhon 1996 dalam Kerboeuf et al 2008; 7) Reibero et al. 1998 dalam Kerboeuf et al 2008; 8) Hoste et al. 2006), ↑ ; ↓ . Saponin, tanin dan flavonoid yang terkandung dalam ekstrak daun kemuning diduga bekerja sinergis sebagai antelmintika. Mekanisme dari flavonoid, saponin dan tanin dikaji dalam Gambar 7. Saponin dan tanin mampu merusak kutikula parasit, saponin dapat mengubah bentuk pori dan permeabilitas kutikula parasit dan tanin mampu mengikat protein kutikula parasit (Kerboeuf et al. 2008; Wang et al. 2010). Diduga melalui mekanisme tersebut akan memudahkan flavonoid difusi (terjadi peningkatan pemaparan flavonoid). Tanin dan flavonoid dapat menghambat sekresi enzim (tyrosin kinase, nonspesifik of colinesterase and esterase), sehingga terjadi ketidakstabilan intraseluler parasit yang fatal seperti disorganisasi neuromuscular (sel saraf dan otot) dan metabolisme energi. Hal ini akan menyebabkan hilangnya fleksibilitas, kelumpuhan, dan kekurangan energi pada Trichostrongylidae dan akan berujung kematian (Hoste et al. 2006; Kerboeuf
et al. 2008). Ketiga senyawa aktif ini potensial sebagai antelmintika terhadap
18
Oxfendazole, waktu kematian dan persentase mortalitas Trichostrongylidae
dipengaruhi juga oleh kondisi in vitro yang tidak sama 100% dengan kondisi lingkungan sebenarnya (in vivo). Cacing dengan habitatnya berada dalam abomasum kambing yang secara fisiologis terdapat cairan abomasum berisi makanan dan enzim yang dapat mendukung kelangsungan hidup cacing, sedangkan NaCl hanya mampu menjaga keseimbangan cairan dan ion
Trichostrongylidae.
Penelitian sebelumnya penggunaan daun kemuning masih rendah (Tresia
et al. 2015) sehingga reduksi belum mencapai 50% meskipun pemberian sudah selama 5 minggu jika dibandingkan dengan pemberian Oxfendazole. Ketika dibandingkan dengan Oxfendazole 0.0005% (hanya sekali tanpa pengulangan) pada kambing PE laktasi dapat mereduksi ttgt 100%. Hal ini karena senyawa aktif yang terserap masih jauh dibawa efektifitasnya dalam mereduksi TTGT. Oleh karena itu, untuk benar membuktikan bahwa herbal kemuning dapat digunakan sebagai alternatif Oxfendazole, maka konsentrasi 7% harus lolos dari organ rumen, yang berarti 90% dapat bertindak membunuh cacing. Pada penelitian selanjutnya, diharapkan secara in vivo diterapkan modifikasi atau rekayasa herbal daun kemuning sehingga yang terkandung dalam daun kemuning bisa masuk organ pasca rumen akan tetapi tanpa menyebabkan efek negatif pada mikroorganisme rumen, mengingat mikrooganisme mudah mati akibat antinutrisi, dan didapatkan respon yang sama dengan kajian in vitro.
Lethal Concentration Ekstrak Daun Kemuning terhadap Trichostrongylidae
Lethal concentration (LC) merupakan konsentrasi yang diperlukan untuk dapat membunuh persentase mortalitas tertentu pada waktu tertentu. Tingkat toksisitas atau daya antelmintika dari ekstrak tanaman dapat dinyatakan dengan melihat hasil dari LC-nya, yaitu semakin kecil LC yang dihasilkan maka semakin toksik dan semakin besar fungsi antelmintikanya. Dosis letal ekstrak infusa dan maserasi daun kemuning pada cacing dewasa, larva infektif dan perkembangan larva tersaji pada Tabel 5. Konsentrasi sediaan infusa untuk membuat mortalitas pada tiap fase tersebut lebih rendah dibanding maserasi. Hal ini membuktikan bahwa ekstrak infusa memiliki fungsi antelmintika yang lebih baik dibanding ekstrak maserasi. Konsentrasi yang dibutuhkan untuk membuat mortalitas cacing 50%-80% lebih tinggi diikuti dengan LD dan larva infektif untuk sediaan infusa maupun sediaan maserasi. Secara umum juga cacing dewasa memiliki waktu kematian yang lebih lambat dibandingkan dengan larva infektif. Hal ini dapat disebabkan karena adanya perbedaan perkembangan dari morfologi seperti perbedaan dalam struktur antara kutikula larva maupun cacing nematoda (Mansfield et al. 1992), sistem metabolisme, sistem pertahanan tubuh dari tiap fase cacing Trichostrongylidae.
19 mempertahankan diri dengan menggunakan nutrisi siap pakan dari hasil makan pada tahap L1 dan L2.
Kebutuhan dosis ekstrak untuk membuat mortalitas berdasarkan kerja dari kandungan senyawa bioaktifnya yang diduga dari kandungan flavonoid bukan hanya quarcetin, saponin, dan tanin yang memiliki peran besar sebagai antelmintika dalam ekstrak daun kemuning. Beberapa senyawa flavonoid yang telah diteliti memiliki aktivitas antelmintika, seperti flavon (2-phenyl cromone) terhadap nematoda (Lee et al. 2008), apigenin terhadap larva nematoda (L2) (Yoon et al. 2006), chalcone (trans-1,3-diphenylpropenone), flavone glycosides linaroside, lantanoside, ratenone terhadap nematoda (Ohri dan Panuu 2010). Tandon et al. (2003) melaporkan bahwa genistein memiliki aktivitas metacestodasidal yang mempengaruhi metabolisme glikogen dan karbohidrat cestoda Raillietina echinobothrida (Tandon dan Das 2007). Senyawa flavonoid lainnya adalah artemisinin yang aktif terhadap protoskolek dan metacestoda
Echinococcus (Spicher et al. 2008). Mekanisme sinergisitas antara quarcetin dan tanin belum banyak diketahui, namun Klongsiriwit et al. (2015) melaporkan bahwa quarcetin (30 dan 60 µM) dan tanin kondensasi (150 dan 300 µg) memiliki sinergi setelah 40-60 menit.
Prediksi Kebutuhan Tepung Daun Kemuning secara in vivo
Pada penelitian sebelumnya oleh Tresia et al. (2015) bahwa dengan analisis regresi pemberian tepung daun kemuning (TDK) sebagai additive sebesar 1% setara ekstrak dengan pemadatan freeze dry (atau sebesar 0.003% ekstrak infusa dalam penelitian ini) dapat mereduksi ttgt hingga 100% selama 38 hari. Uhlinger
et al.(1992) melaporkan bahwa jumlah cacing Haemonchus contortus di Amerika Serikat merupakan 75%-100% dari jumlah telur tiap gram tinja (ttgt). Melalui pendekatan inilah dapat diperhitung secara sederhana kebutuhan tepung daun kemuning. Pada taraf 1% ekstrak infusa dapat menimbulkan mortalitas
H.contortus sebesar 16%, sehingga pada taraf 7 % selama 6-7 hari dapat mereduksi ttgt sebesar 100%.
Tepung daun kemuning memiliki kandungan BK 70.16%, TDN 58.16%, PK 14.28%, LK 4.54%, dan SK 21.22%. Aplikasi in vivo 7% ekstrak infusa, sebagai
feed additive pada ransum kambing laktasi awal dengan kebutuhan berat kering 3.92% (NRC 2007) dalam ransum berbasis konsentrat 35%, dibutuhkan tepung daun kemuning sebesar 0.59 Kg ekor-1 hari-1 dan selama 6-7 hari sebesar
3.55-Tabel 5 Lethal concentration ekstrak daun kemuning (%) terhadap
Trichostrongylidae
Paramater Ekstraksi Lethal Concentration (%)
50 60 70 80 90
Cacing dewasa Infusa 4.12±0.07 4.72±0.08 5.36±0.09 6.11±0.10 7.15±0.13
Maserasi 5.05±0.12 6.04±0.15 7.10±0.18 8.34±0.23 10.06±0.31 Larva Infektif Infusa 1.78±0.10 2.64±0.09 3.56±0.10 4.64±0.12 6.12±0.17
Maserasi 3.67±0.09 4.55±0.11 5.51±0.13 6.62±0.16 8.17±0.22 Perkembangan
Larva
20
4.14 Kg ekor-1, sedangkan kebutuhan daun kemuning segar 0.84 Kg ekor-1 hari-1 dan selama 6-7 hari membutuhkan 5.05-5.89 Kg ekor-1.
Siklus hidup cacing Haemonchus contortus terdiri dari fase preparasitik, parasitik dan prepaten (Soulsby 1965 dalam Casey 2014). Fase preparasitik adalah tahap dari telur dalam tinja menjadi larva infektif (L3) selama 5-7 hari. Pada tahap ini ternak yang mengkonsumsi tepung daun kemuning akan mengeluarkan senyawa yang bersifat polar cenderung tidak dapat dicerna dan kemungkinan dapat tercampur dengan telur strongylid dalam tinja. Apabila pada manajemen peternakan memakai feses sebagai salah satu unsur hara hijauan dapat diminalkan terjadinya tahap parasitik dalam tubuh ternak karena ekstrak infusa sudah menghambat ±70% perkembangan larva. Sedangkan fase parasitik adalah dari tahap tertelannya larva infektif menjadi cacing dewasa. Pada pemberian EDK dalam periode 6-7 hari kemungkinan dapat menghambat fase parasitik, namun ada kekhawatiran diperlukannya ekstrak infusa setelah perlakuan selesai yakni 18-21 hari berikutnya akan terdapat cacing dewasa pada saluran pencernaan dan setelah 17-21 hari terdapat telur strongylid dalam feses yang disebut sebagai fase prepaten.
4
SIMPULAN DAN SARAN
Simpulan
Ekstraksi daun kemuning dengan 2 metode yang berbeda yaitu maserasi dan infusa diperoleh rendemen tepung daun kemuning tertinggi sebesar 6.48% dari metode ekstraksi infusa yang mengandung 0.53% flavonoid quarcetin, 2.38 % saponin, dan 1.35% tanin. Konsentrasi 7% ekstrak infusa merupakan konsentrasi paling efektif dalam menurunkan atau mematikan 93.16% perkembangan larva, 94.39% larva infektif, dan 90% cacing dewasa.
Saran
Perlu dilakukan penelitian lebih lanjut untuk pengujian senyawa metabolit sekunder lain seperti flavonoid total, steroid, dan alkaloid pada ekstrak daun kemuning secara kuantitatif. Selain itu, perlu dilakukan isolasi senyawa aktif serta pengujian ekstrak daun kemuning secara in vitro pada jenis cacing berbeda dan kajian in vivo level 7 % selama 6-7 hari sebagai feed additive pada ransum kambing perah atau ternak lain.
DAFTAR PUSTAKA
21 Alberti EJ, Zanzani SA, Ferrari N, Bruni G, Manfredi MT. 2012. Effects of gastrointestinal nematodes on milk productivity in three dairy goat breeds.
Small Rumin. Res. 106 : 12–17.
Barrau E, Fabre N, Fouraste I, Hoste H. 2005. Effect of bioactive compounds from Sainfoin (Onobrychis viciifolia Scop.) on the in vitro larval migration of Haemonchus contortus: role of tannins and flavonol glicosides.
Parasitology 131: 531–538.
Beriajaya, Haryuningtyas D, Gray GD. 2002. Kejadian resistensi terhadap antelmintik pada domba dan kambing di Jawa barat, Jawa tengah, dan Yogyakarta. Di dalam : Haryanto B, editor. Inovasi teknologi peternakan dan veteriner dalam menunjang keterpaduan usaha peternakan yang berdaya saing, editor. Bogor 30 September-1 Oktober 2002, Bogor, Indonesia. Bogor (ID) : Deptan. Hal 403-407.
Beriajaya, Murdiati TB, Herawaty M. 1998. Anthelmintic effect of Zingiber purpureum infuse and extract on adult worms of Haemonchus contortus in vitro. JITV 3(4): 277-282.
Beriajaya, Murdiati TB, Herawaty M. 1998. Anthelmintic effect of Zingiber purpureum infuse and extract on adult worms of Haemonchus contortus in Indonesia as a result of gastrointestinal nematode infections. Livestock Production and Diseases in the Tropics. Proceeding 5th Conference Institute Tropical Veterinary Medicine.
Botura MB, dos Santos CDG, da Silvi GD, de limar HG, Olivera JVA, de Almeida MAO, Batatinha MJM, Branco A.2013. In vitro ovicidal and larvicidal activity of Agave sisalana Perr. (sisal) on gastrointestinal nematodes of goats. Vet. Parasitol. 192 (1-3): 211– 217. Abstract
Brunet S, Fourquaux I, Hoste H. 2011. Ultrastructural changes in the third-stage, infective larvae of ruminant nematodes treated with sainfoin (Onobrychis viciifolia) extract. Parasitol. Int. 60 (4): 419-424.
Brunet S, Aufrere J, El Babili F, Fouraste I, Hoste H. 2007. The kinetics of exsheathment of infective nematode larvae is disturbed in the presence of a tannin-rich plant extract (sainfoin) both in vitro and in vivo. Parasitology 134 (9):1253–1262.
Casey SJ. 2014. Haemonchus contortus Infections in Alpacas and Sheep.[Tesis]. Blacksburg (US) : Virginia Polytechnic Institute.
Dargatz DA, Dargatz JLT, Sangster NC. 2000. Antimicrobic and anthelmintic resistance. Veterinary Clinic of North America 16 (3) : 515-536.
Departemen Kesehatan RI. 2000. Acuan Sediaan Herbal. Jakarta (ID) : Direktorat Jendral POM –Depkes RI.
Departemen Kesehatan RI. 2009. Farmakope Herbal Indonesia. Jakarta (ID) : Direktorat Jendral POM –Depkes RI.
22
Doligalska M, Józwicka K, Kiersnowska M, Mroczek A, Paczkowski C, Janiszowska W. 2011. Triterpenoid saponins affect the functionof P-glycoprotein and reduce the survival of the free living stages of Heligmosomoides bakeri. Vet. Parasitol. 179 (1-3) : 144–151.
Gautam MK, Gangwar M, Nath G, Rao CV, Goel RK. 2012. In–vitro antibacterial activity on human pathogens and total phenolic, flavonoid contents of Murraya paniculata Linn. Leaves. APJTB 2(3):S1660-S1663.
Gulnaz AR, Savitha G. 2013. Evaluation of anthelmintik activity different leaf and stem extract of Sida cordata burm. Int J. Curr. Microbiol. App. Sci 2(11): 247-255.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisa Tumbuhan. Edisi II. Terjemahan Kosasih Padma Winata dan Iwang Soedirjo. Bandung (ID): Institut Teknologi Bandung.
Hoste H, Jackson F, Athanasiadou S, Thamsborg SM, Hoskin SO. 2006. The effects of tannin-rich plants on parasitic nematodes in ruminants. Trends Parasitol. 22 (6): 253-261.
Johstone C. 2000. The Trichostrongyloidea. [diakses pada 29 Maret 2016]. Tersedia pada: http/ca;.ubc.upenn.edu/merial/Trichos/trich_2.htm
Kerboeuf D, Riou M, Guegnard F. 2008. Flavonoid and related compounds in parasitic disease control. Min.Rev. Med. Chem. 8 (2): 116-128.
Kinsella B, Lehotay SJ, Mastovska K, Lightfield AR, Furey A, Danaher M. 2009. New method for the analysis of flukicide and other anthelmintic residues in bovine milk and liver using liquid chromatography–tandem mass spectrometry. Anal. Chim. Acta. 637 (1-2) : 196–207.
Klongsiriwet C, Quijada J, Williams AR, Mueller-Harvey I, Williamson L, Hoste H. 2015. Synergistic inhibition of Haemonchus contortus exsheathment by flavonoid monomers and condensed tannins. Int. J.Parasitol. Drugs Drug Resist 5 (3):127-134.
Lee YU, Kawasaki I, Lim Y, Oh WS, Pail YK,Shim YH. 2008. Inhibition of developmental processes by flavone in Caenorhabditis elegans and its application to the pinewood nematode, Bursaphelenchus xylophilus. Mol. Cells 26(2): 171-174.
Mansfield, LS, Gamble HR, Fetterer RH. 1992. Characterization of the eggshell of Haemonchus contortus–I, structural components. Comp. Biochem. Physiol.
103(3) : 681–686.
Manual of Veterinary Parasitological Laboratory Techniques. 1971. [Internet]. [diunduh 2015 November 10] Tersedia dalam http://www.kashvet.org/pdf/ lab_manual_parasite.pdf
Miller JE, Horohov DW. 2006. Immunological aspects of nematode parasite control in sheep. J. Anim. Sci 84 :124-132.
Min BRD, Hart SP. 2003. Tannin for suppresion of internal parasites. J. Anim. Sci.
81(2):102-109.
Molan AL, Meagher LP, Spencer PA, Sivakumaran S. 2003. Effect of flavan-3-ols on in vitro egg hatching, larval development and viability of infective larvae of Trichostrongylus colubriformis. Int. J. Parasitol. 33(14): 1691–1698. Molan Al, Waghorn GC,McNabb WC. 2002. The impact of condensed tannin on
23 Martínez-Ortíz-de-Montellano C, Arroyo-López C, Fourquaux I , Torres-Acosta JFJ, Sandoval-Castro C, Hoste H. 2013. Scanning electron microscopy of Haemonchus contortus exposed to tannin-rich plants under in vivo and in vitro conditions. Exp. Parasitol. 133(3):281-286.
Naguleswaran A, Spicher M, Vonlaufen N, Ortegamora LM, Torgerson P, Gottstein B, Hemphill A. 2006. In vitro metacestodicidal activities of genistein and other isofl avones against Echinococcus multilocularis and
Echinococcus granulosus. Antimicrob. Agents Cemother. 50 (11):3770-3778. Nery PS, Nogueira FA, Martins ER, Duarte ER. 2010. Effect of Anacardium
humile on the larval development of gastrointestinal nematodes of sheep. Vet Parasitol. 171 (3-4):361–364.
Ng MK, Abdulhadi NY, Cheah YK, Yeap Sk, Alitheen NB. 2012. Bioactive studies and chemical constituents of Murraya paniculata (Linn) Jack. IFRJ
19(4):1307-1312.
Nogueira FA, Nery PS, Morais-costa F, Oliveira NJ, Martins ER, Duarte ER. 2014. Efficacy of aqueous extracts of Genipa americana L. (Rubiaceae) in inhibiting larval development and eclosion of gastrointestinal nematodes of sheep. JAAR 42(3):356-360.
Onwuka CFI. 1992. Tannin and Saponin Contents of some tropical browse species fed to goats. Trop. Agric 69: 176 – 180.
Permin A, Nansen P, Bisgard M, Fradsen, Pearman M. 1998. Studies on Ascarida galli in chickenss kept at different stocking rates. J.Avi.Pathol. 27(4) : 382-389.
Rehman Z, Shah WH. 2005. Thermal heat processing effects on antinutrients, protein and starch digestibility of food legumes. Food Chemistry 91(2): 327– 331
Sharker MS, Israt JS , Hasanuzzaman M.2009. Antinociceptive and bioactivity of leaves of Murraya paniculata (L.) Jack, Rutaceae. Braz. J. Pharmacog.
19(3): 746-748
Spicher M, Roethlisberger C, Lany C, Stadelmann B, Keiser J, Ortegamora LM, Gottstein B, Hemphil A. 2008. In vitro and in vivo treatments of Echinococcis protoscoleces and metacestodes with artemisinin and artemisinin derivates.
Antimicrob. Agents Cemother. 52 (9):3447-3450.
Syahadat RM, Aziz SA. 2012. Pengaruh komposisi media dan fertigasi pupuk organik terhadap kandungan bioaktif daun tanaman kemuning (Murraya paniculata (L.) Jack) di pembibitan. Bul. Littro 23(2): 142-147.
Tandon V, Das B, Saha N. 2003. Anthelmintic effi cacy of Flemingia vestita
(Fabaceae): effect of genisten on glycogen metabolism in the cestode,
Raillietina echinobothrida. Parasitol. Int. 52 (2):179-183.
Tandon V, Das B. 2007. In vitro testing of anthelmintic efficacy of Flemingia vestita (Fabaceae) on carbohydrate metabolism in Raillietina echinobothrida.
Methods 42 (4):330-338.
24
Vagashiya Y, Dave R, Chandra S. 2011. Phytochemical analysis of some medical plants from western region of India. Res. J. Med. Plant 5(5): 567-576.
Van Wyk JA, Mayhew E. 2013. Morphological identification of parasitic nematode infective larvae of small ruminants and cattle: A practical lab guide.
Onderstepoort Journal of Veterinary Research 80(1):1-14.
Wang Y, Zhang Y, Zhu Z, Zhu S, Li Y, Li M, Yu B. 2007. Exploration of the correlation between the structure, hemolytic activity, and cytotoxicity of steroid saponins. Bioorg. Med. Chem. 15 (7): 2528–2532.
Whitlock HV. 1948. Some modification of the Mc Master helminth egg-counting technique and apparatus. J. Counc. Sci. Ind. Res. 21: 117 - 118.
Winarni A, Harlina E, Evvyernie D. 2014. Effect of Saga and Kemuning Leaves Meal on Parasites Infection of Etawah Crossbred Goat. Indonesia Traditional Medicine for Human Welfare. 4-6 June 2014; Tawangmangu, Indonesia. Tawangmangu (ID) : Prosiding International Symposium on Medicinal Plant and Traditional Medicine.
Wood IB, Amaral NK, Bairden K, Duncan JL, Kassai T, Malone Jr JB, Pankavich JA, Reinecke RK, Slocombe O, Taylor SM, Vercruysse J. 1995. World Association for the Advancement of Veterinary Parasitology (WAAVP) second edition of guidelines for evaluating the efficacy of anthelmintics in ruminants (bovine, ovine, caprine). Vet. Parasitol. 58 (3): 181–213.
Yoon YA, Kim H, Lim Y, Shim YH. 2006. Relationships between the larval growth inhibition of Caenorhabditis elegans by apigenin derivatives and their structures. Arch. Pharm. Res. 29 (7): 582-586.
25 Lampiran 1 Identifikasi larva infektif
Parameter Tipe larva infektif
Trichostrongylus sp. Haemonchus sp. Cooperia sp.
Total (%) 83.1 8.92 7.98
Faktor klasifikasi
Selubung Ada Ada Ada
Bentuk Kepala Kotak Bulat Kotak
Refraktil Tidak ada Tidak ada Ada
Diameter (µm) 18.87±0.21 22.49±1.36 33.84±3.55
Panjang (µm) 653.40±39.74 803.30±30.63 919.07±5.37
Literatur* (µm) 730±50 882.13±102.63 1005±123
*Panjang larva infektif oleh van Wyk dan Mayhew (2013)
Lampiran 2 Hasil sidik ragam mortalitas perkembangan larva infektif
SK db JK KT F hitung F0.01 P
Perlakuan 10 33 010.91 3 301.09 45.96 2.75 0.00
Galat 22 3 160.00 71.82
Total 32 36 170.91
SK = sumber keragaman, db = derajat bebas, JK = jumlah kuadrat, KT = kuadrat tengah.
Lampiran 3 Hasil sidik ragam kumulatif perkembangan larva infektif
SK db JK KT F hitung F0.01 P
Perlakuan 10 330.11 33.01 45.97 2.75 0.00
Galat 44 31.60 0.72 0.00
Total 54 361.71
Lampiran 4 Hasil sidik ragam persentase mortalitas larva infektif
SK db JK KT F hitung F0.01 P
Perlakuan 10 31 543.76 3 154.38 73.78 2.75 0.00
Galat 44 1 881.23 42.76
Total 54 33 424.99
Lampiran 5 Hasil sidik ragam jumlah kematian larva infektif
SK db JK KT F hitung F0.01 P
Perlakuan 10 32 105.87 3 210.59 17.21 2.75 0.00
Galat 44 7 647.05 186.51 0.00
Total 54 39 753 92