AKTIVITAS ANTIOKSIDAN DAN EFEK ANTIDIABETES
PROBIOTIK Lactobacillus plantarum SK(5) ASAL BEKASAM
NUR SYAFIQOH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertas berjudul Aktivitas Antioksidan dan Efek Antidiabetes Probiotik Lactobacillus plantarum SK(5) Asal Bekasam adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2016
Nur Syafiqoh
RINGKASAN
NUR SYAFIQOH. Aktivitas Antioksidan dan Efek Antidiabetes Probiotik
Lactobacillus plantarum SK(5) Asal Bekasam. Dibimbing oleh SRI BUDIARTI dan DESNIAR
Lactobacillus plantarum SK(5) adalah bakteri asam laktat (BAL) yang diisolasi dari produk fermentasi ikan Indonesia (bekasam). L. plantarum SK(5) telah dievaluasi memiliki potensi sebagai probiotik, yaitu toleran terhadap asam dan garam empedu, serta memiliki senyawa antimikrob. Berdasarkan aktivitas antimikrob, kemampuan menurunkan kadar glukosa darah, dan kemampuan antioksidan, probiotik diharapkan membuktikan tujuannya untuk membantu pengendalian diabetes mellitus tipe 2 pada manusia di masa depan. Ada banyak studi tentang BAL sebagai pengobatan untuk diabetes dan bukti-bukti menunjukkan bahwa BAL memiliki potensi mengurangi insiden diabetes. Tujuan dari penelitian ini adalah mendapatkan informasi adanya aktivitas antioksidan dan efek antidiabetes dari L. plantarum SK(5) asal bekasam.
Ekstrak kasar supernatan pada penelitian ini diperoleh dari hasil ekstraksi menggunakan etil asetat. Pengujian aktivitas antioksidan menggunakan metode
1,1-diphenyl-2-picrylhydrazyl (DPPH) menunjukkan bahwa ekstrak kasar
L. plantarum SK(5) memiliki aktivitas antioksidan sebesar 34,1% (cukup baik) pada konsentrasi 350 ppm dan memiliki potensi dalam menghambat enzim alfa-gukosidase. Pengujian efek antidiabetes dari liofilisasi sel L. plantarum SK(5) dilakukan menggunakan hewan uji. Hewan uji dibagi menjadi dua grup utama, yaitu yang diinduksi dengan streptozotocin (STZ) (tikus diabetes) dan kelompok tikus normal tanpa induksi STZ. Kelompok tikus diabetes (4 kelompok)
masing-masing diberikan intervensi acarbose, phosphate buffer saline (PBS),
L. plantarum (SK5) (30 mg/Kg bb), dan L. plantarum (SK5) (15 mg/Kg bb) secara oral setiap hari selama 14 hari. Berat badan pada semua tikus diabetes mengalami penurunan. Kadar glukosa darah diperoleh lebih rendah pada semua kelompok tikus diabetes dan tidak berbeda nyata pada semua kelompok perlakuan maupun dengan tikus normal. Penurunan paling tinggi setelah 14 hari perlakuan diperoleh pada kelompok tikus diabetes dengan pemberian L. plantarum SK(5) (30 mg/Kg bb) (86,22%). L. plantarum SK(5) ditemukan aman selama pemberian 14 hari dengan dosis yang sama berdasarkan analisis profil biokimia darah menggunakan protokol kit Analytical Medical System-Spanyol. Profil imunohistokimia pankreas menggunakan protokol kit Biocare Medical-USA
menunjukkan bahwa terjadi regenerasi sel beta pankreas pada pemberian
L. plantarum SK(5) berdasarkan jumlah sel beta pankreas menggunakan software imageJ.
L. plantarum SK(5) memiliki aktivitas antioksidan dan berhubungan dengan efek antidiabetes pada penurunan kadar glukosa darah dan perbaikan efek atidiabetes pada tikus. Aktivitas antioksidan dan penurunan kadar glukosa darah berbasis bakteri asam laktat diharapkan dapat bermanfaat sebagai terapi untuk membantu pengendalian diabetes tipe 2 pada manusia sebagai pangan fungsional. Kata kunci: Aktivitas antioksidan, antidiabetes, inhibitor alfa-glukosidase,
SUMMARY
NUR SYAFIQOH. Antioxidant Activity and Antidiabetic Effect of Probiotic
Lactobacillus plantarum SK(5) of Bekasam. Supervised by SRI BUDIARTI and DESNIAR.
Lactobacillus plantarum SK(5) is lactic acid bacteria (LAB) that isolated from traditional Indonesian fermented fish product (bekasam). L. plantarum
SK(5) was previously isolated from bekasam and evaluated for its probiotic properties, including acid and bile tolerance, and production of antimicrobial compounds. Based on their antimicrobial activity, blood-glucose-lowering, and antioxidative capabilities, probiotics are expected to prove its purpose to treat the type 2 diabetes mellitus on human in the future. There have been many studies on LAB as a treatment for diabetes and the evidences showed that they have potentially been able to reduce the incidence of diabetes. The aim of this study was to get informations about antioxidant activity and antidiabetic effect of L. plantarum SK(5) of bekasam.
Cell free-supernatant of L. plantarum (SK5)was extracted with ethyl acetate as solvent. Determination of antioxidant activity was conducted by using
1,1-diphenyl-2-picrylhydrazyl (DPPH) method showed that the crude extract of
L. plantarum SK(5) had antioxidant activity with percentage of inhibition of 34,1% (moderately good) at 350 ppm concentration and had potential of alpha-glucosidase inhibitory activity. Investigation of antidiabetic effect of lyophilization of L. plantarum SK(5) cells was conducted by using rats. Rats were divided into 2 main groups that STZ-induced diabetes (treated group) and one group as normal rats without STZ-induced diabetes. Treated group (4 groups) received acarbose, PBS, L. plantarum (SK5) (30 mg/Kg b.wt), and L. plantarum
(SK5) (15 mg/Kg b.wt) orally once a day for 14 days, respectively. Body weight loss showed in all treated groups. Blood glucose level were lower in all groups and not significant neither with all treated group nor with normal group after 14 days treatments. The highest lowering blood glucose level was L. plantarum
SK(5) (30 mg/Kg b.wt) treatment (86,22%). L. plantarum SK(5) was found safe in 14 day repeated dose toxicity studies based on blood chemistry analysis were conducted by using kit protocol of Analytical Medical System-Spain. Immunohistochemistry showed that regenerative changes of pancreatic islet cells at L. plantarum SK(5) treatment based on number of beta cells were conducted by using kit protocol of Biocare Medical-USA and the number of pancreatic beta cells is calculated from a brown color formed on the islets of Langerhans using ImageJ software.
L. plantarum SK(5) has an antioxidant activity and has a relating to effect on blood glucose levels and improved diabetic effect in rats. Antioxidant activity and blood glucose-lowering lactic acid bacteria are expected to be useful as a therapeutic for treating type 2 diabetes in human as a functional food.
Keywords: Antidiabetic, antioxidant activity, inhibitor alpha-glocosidase,
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
AKTIVITAS ANTIOKSIDAN DAN EFEK ANTIDIABETES
PROBIOTIK Lactobacillus plantarum SK(5) ASAL BEKASAM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga penulis dapat menyelesaikan tesis dengan judul Aktivitas Antioksidan dan Efek Antidiabetes Probiotik Lactobacillus plantarum
SK(5) Asal Bekasam. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Mikrobiologi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini, dengan segala kerendahan hati penulis ingin mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dan dorongan hingga penulis dapat menyelesaikan tesis ini, yaitu Dr dr Sri Budiarti dan Dr Desniar, SPi, MSi selaku dosen pembimbing yang telah memberikan pengarahan dalam penyusunan tesis ini; Prof Dr Lilis Nuraida, MSc selaku dosen penguji luar komisi yang telah memberikan saran dan kritik untuk perbaikan tesis ini; Prof Dr Anja Meryandini, MS selaku ketua program studi yang telah memberikan saran perbaikan pada penyusunan tesis; Dr Rika Indri Astuti, MSi selaku penjamin mutu yang telah memberikan saran perbaikan pada saat ujian; Kemenristek Dikti atas dana yang diberikan untuk berlangsungnya proyek Penelitian Institusi tahun 2015 dengan judul Pengembangan Produk Biomedis Antidiabetes sesuai kontrak nomor 083/SP2H/PL/Dit. Litbabmas/II/2015 melalui Dr Desniar, SPi, MSi; Ema Masruroh, SSi, Dini Indriani, Amd, Saeful Bahri, Amd, drh Ines Maulidiyah, drh Okta Wismandanu, Mepid, Mulyadi, Himawan Prasetiyo, MSi, dan drh Vivi Arin yang telah membantu penulis selama penelitian di Laboratorium; Ayah, Ibu, dan Adik, serta seluruh keluarga yang telah memberikan motivasi kepada penulis; Teman seperjuangan Mikrobiologi 2014 (khususnya yang sering direpotkan: Ukhin, Siska, Lia, Nisa, Dini, Dika, Mbak Adit, Mila, Risa, dan Wiwid) atas kebersamaan dan suka duka selama penelitian serta penyusunan tesis ini; Risky Hadiwibowo, MSi dan Marisky Nur Adnin, SPi yang telah membantu dalam penyusunan jurnal; serta teman-teman Mikrobiologi 2013, THP 46, dan GGC atas segala doa dan kerja samanya.
Penulis menyadari bahwa penulisan tesis ini masih jauh dari sempurna. Oleh karena itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan. Semoga tesis ini dapat memberikan manfaat bagi semua pihak yang memerlukannya.
Bogor, September 2016
DAFTAR ISI
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
1 PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
2 TINJAUAN PUSTAKA... 3
Probiotik ... 3
Bakteri Asam Laktat ... 3
Aktivitas Antioksidan ... 4
Mekanisme Probiotik sebagai Antidiabetes ... 6
3 METODE ... 9
Waktu dan Tempat Penelitian ... 9
Bahan dan Alat ... 9
Prosedur ... 9
Analisis data ... 14
4 HASIL DAN PEMBAHASAN ... 15
Hasil ... 15
Aktivitas Antioksidan ... 15
Penghambatan Enzim Alfa-glukosidase ... 16
Berat Badan Hewan Uji ... 16
Kadar Glukosa Darah ... 17
Profil Biokimia Darah... 19
Profil Imunohistokimia Pankreas ... 20
Pembahasan ... 21
5 SIMPULAN DAN SARAN ... 28
Simpulan ... 28
Saran ... 28
DAFTAR PUSTAKA ... 28
LAMPIRAN ... 33
DAFTAR TABEL
1 Reaksi inhibisi enzim α-glukosidase ... 11
2 Profil biokimia darah ... 19
DAFTAR GAMBAR
1 Multifaktor penyebab diabetes tipe 2 (Panwar et al. 2013)... 52 Analogi keadaan normal dan diabetes di dalam sel (IDF 2013) ... 6
3 Peran mikrobiota usus dalam pengembangan dan pengendalian diabetes (Panwar et al. 2013) ... 7
4 Perkiraan mekanisme aksi probiotik dalam manajemen diabetes tipe 2 (Panwar et al. 2013) ... 7
5 Jalur metabolik yang dipengaruhi oleh mikrobiota usus (Tilg dan Moschen 2014) ... 8
6 Aktivitas antioksidan L. plantarum SK(5) dengan metode DPPH ... 15
7 Penghambatan alfa-glukosidase L. plantarum SK(5) ... 16
8 Hasil pengukuran berat badan hewan uji selama 14 hari perlakuan ... 17
9 Persentase perubahan berat badan selama perlakuan 14 hari ... 17
10 Hasil pengukuran kadar glukosa darah hewan uji selama 14 hari perlakuan ... 18
11 Hasil pengukuran kadar glukosa darah hewan uji selama 14 hari perlakuan ... 18
12 Persentase perubahan kadar glukosa darah hewan uji setalah 14 hari perlakuan ... 19
13 Pulau Langerhans dan sel beta pankreas ... 20
14 Rata-rata jumlah sel beta pankreas hewan uji ... 21
DAFTAR LAMPIRAN
1 Hasil ekstrak supernatan L. plantarum SK(5) ... 342 Perhitungan TPC L. plantarum SK(5) yang digunakan ... 34
3 Kultur kering L. plantarum SK(5) ... 35
4 STZ ... 35
5 Pakan BRAVO-512 ... 35
6 Pengukuran kadar glukosa darah dari ujung ekor tikus ... 36
7 Hasil gula darah hiperglikemik ... 36
8 Tikus umur 8 minggu ... 36
9 Kandungan nutrisi BRAVO-512 ... 36
10 Air minum ad libitum ... 37
11 Pemberian intervensi perlakuan peroral ... 37
12 Eutanasi dengan exanguination ... 37
14 Serum darah berwarna bening... 38
15 Pengambilan sampel jaringan pankreas ... 38
16 Pemfiksasian dalam paraformaldehid 4% ... 38
17 Perhitungan aktivitas antioksidan ... 38
1 PENDAHULUAN
Latar Belakang
Lactobacillus plantarum merupakan bakteri asam laktat (BAL) heterofermentatif fakultatif, Gram positif, tidak berspora, katalase negatif, anaerob fakultatif, tidak motil, dan toleran terhadap asam. Bakteri ini memiliki aplikasi yang luas, misalnya sebagai kultur starter dalam fermentasi sayuran dan daging, sebagai probiotik untuk manusia dan hewan, dan dewasa ini digunakan sebagai agen terapeutik (Plumed-Ferrer 2007). L. plantarum SK(5) ditemukan berkontribusi pada fermentasi bekasam. Bekasam adalah produk fermentasi ikan Indonesia yang memiliki rasa asam dan banyak dikenal di daerah Jawa Tengah, Sumatera Selatan, dan Kalimantan Selatan. Produk ini dibuat dengan fermentasi menggunakan bahan baku ikan air tawar, garam, dan sumber karbohidrat seperti nasi atau tape dengan lama fermentasi sekitar 4-10 hari (Desniar 2012).
Isolat L. plantarum SK(5) menunjukkan ketahanan yang baik terhadap asam dan garam empedu (Syafiqoh 2014). Ketahanan terhadap asam dan garam empedu merupakan prasyarat suatu mikroorganisme dapat digunakan sebagai probiotik. Hal ini mengindikasikan kemampuannya bertahan hidup dalam saluran pencernaan. Probiotik didefinisikan sebagai mikroorganisme hidup yang apabila dikonsumsi oleh manusia atau hewan dalam jumlah cukup, mampu memberikan manfaat kesehatan bagi inangnya (FAO dan WHO 2006).
Fungsi probiotik dari bakteri asam laktat dewasa ini telah menerima banyak perhatian dunia (Honda et al. 2012). Beberapa spesies BAL diaplikasikan sebagai suplemen mikroba hidup, yang secara positif mempengaruhi kesehatan, terutama dengan meningkatkan komposisi mikrobiota usus (Grajek et al. 2005). Berbagai penelitian telah menunjukkan bahwa probiotik dapat mengurangi intoleransi laktosa, meningkatkan kesehatan usus, memperkuat sistem kekebalan tubuh (Galdeano et al. 2007), memiliki efek antihipertensi (Zhang dan Zhang 2013), memiliki efek antioksidan (Yadav et al. 2007), memiliki efek penurun kolesterol (Bosch et al. 2014), dan memiliki efek antidiabetes (Gomes et al. 2014).
Diabetes mellitus (DM) merupakan penyakit kronis yang ditandai dengan hiperglikemia yang disebabkan oleh resistensi insulin dan atau penurunan sekresi insulin akibat adanya kegagalan sel beta pankreas (Damasceno et al. 2014). Insulin bertindak sebagai kunci yang memungkinkan sel-sel tubuh untuk menggunakan glukosa sebagai energi. Jumlah penderita diabetes di dunia pada tahun 2013 mencapai 382 juta jiwa dan diprediksi akan meningkat 55% menjadi 592 juta jiwa pada tahun 2035. Sebanyak 5,1 juta jiwa kematian akibat diabetes terjadi pada tahun 2013 atau terjadi satu kematian setiap enam detik. Indonesia merupakan negara dengan penderita diabetes peringkat tujuh di dunia dengan penderita sebanyak 8,5 juta jiwa pada tahun 2013 (IDF 2013).
2
yang diinduksi pakan tinggi fruktosa dan diberi perlakuan L. acidophilus dan
L. casei pada dahi (Yadav et al. 2007). Penelitian lainnya melaporkan bahwa beberapa bakteri asam laktat memiliki aktivitas antioksidan dan kemampuan antidiabetes secara in vitro (Chen et al. 2014).
Mekanisme lainnya dari probiotik sebagai antidiabetes adalah kemampuan penghambatan terhadap enzim alfa-glukosidase (Ramchandran dan Shah 2008).
L. casei 2W dan L. rhamnosus Z7 memiliki aktivitas penghambatan alfa-glukosidase secara in vitro (Chen et al. 2014). Beberapa ekstrak Lactobacillus
yang diisolasi dari feses bayi secara efektif menghambat aktivitas alfa-glukosidase (Panwar et al. 2014).
Berdasarkan beberapa penelitian mengenai sifat fungsional yang dimiliki strain probiotik dari bakteri asam laktat, maka isolat L. plantarum SK(5) juga diduga memiliki beberapa sifat fungsional tersebut. Untuk mengetahui sifat fungsional dari probiotik isolat L. plantarum SK(5) asal bekasam, maka pada penelitian ini dilakukan analisis aktivitas antioksidan dan efek antidiabetes. Hasil penelitian ini diharapkan dapat memberikan kontribusi informasi mengenai potensi pangan fungsional berbasis pangan lokal sehingga dapat meningkatkan kedaulatan pangan Indonesia.
Perumusan Masalah
Penggunaan obat antidiabetes masih memiliki efek samping. Banyak upaya telah difokuskan pada pengembangan produk alami sebagai pengobatan diabetes. Probiotik telah banyak diteliti memiliki beberapa manfaat bagi kesehatan inangnya, tetapi potensi kemampuan antioksidan dan efek antidiabetes pada probiotik L. plantarum SK(5) asal bekasam belum diteliti sehingga diharapkan dapat dihasilkan probiotik dari produk perikanan Indonesia yang memiliki efek antidiabetes dan dapat dikembangkan sebagai pangan fungsional.
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan informasi adanya aktivitas antioksidan dan efek antidiabetes dari L. plantarum SK(5) asal bekasam.
Manfaat Penelitian
Manfaat dari penelitian ini yaitu diperolehnya informasi mengenai kemampuan antioksidan dan efek antidiabetes dari Lactobacillus plantarum SK(5) asal bekasam secara in vitro, serta pengaruh pemberian probiotik tersebut secara
3
2 TINJAUAN PUSTAKA
Probiotik
Probiotik didefinisikan sebagai mikroorganisme yang dalam jumlah cukup dapat memberikan efek kesehatan bagi inang (Servin dan Coccoiner 2003). Persyaratan BAL dapat digunakan sebagai probiotik adalah sebagai berikut: 1) tahan terhadap asam, terutama asam lambung yang memiliki pH antar 1,5-2,0 sewaktu tidak makan dan pH 4,0-5,0 sehabis makan, sehingga mampu bertahan dan hidup lama ketika melalui lambung dan usus; 2) stabil terhadap garam empedu dan mampu bertahan hidup selama berada pada bagian usus kecil. Empedu disekresikan ke dalam usus untuk membantu absorbsi lemak dan asam empedu yang terkonjugasi dan diserap dari usus kecil; 3) memproduksi senyawa antimikrob seperti asam laktat, hidrogen peroksida dan bakteriosin; 4) mampu menempel pada sel usus manusia. Faktor penempelan oleh probiotik merupakan syarat untuk pengkolonisasian, aktivitas antagonis terhadap patogen, pengaturan sistem daya tahan tubuh dan mempercepat penyembuhan infeksi; 5) tumbuh baik dan berkembang dalam saluran pencernaan; 6) koagregasi membentuk lingkungan mikroflora normal dan seimbang. Koagregasi juga mencerminkan kemampuan interaksi antar kultur untuk saling menempel; dan 7) aman digunakan oleh manusia (FAO dan WHO 2006).
Mikroba-mikroba yang umum digunakan dalam pembuatan minuman dan makanan probiotik utamanya berasal dari kelompok bakteri asam laktat (BAL). Bakteri ini sering digunakan sebagai probiotik karena kebanyakan strainnya tidak patogen, bahkan beberapa strain telah mendapatkan status generally recognized as safe (GRAS) dari food & drugs administration (FDA). Selain itu, kemampuannya untuk hidup di dalam saluran pencernaan dapat menekan pertumbuhan bakteri patogen sehingga dapat dimanfaatkan untuk menjaga kesehatan tubuh dan potensi ini yang menyebabkan BAL digunakan sebagai probiotik (Grajek et al. 2005). Beberapa strain BAL yang berpotensi sebagai probiotik antara lain Lactobacillus
dan Bifidobacterium (Shen et al. 2012).
Bakteri Asam Laktat
Bakteri asam laktat (BAL) dianggap sebagai kelompok utama dari bakteri probiotik. Bakteri ini umumnya merupakan kelompok mikroorganisme Gram-positif, tidak memiliki sitokrom, hidup dalam kondisi anaerob, tetapi sebagian
aerotolerant, toleran kondisi asam, dan umumnya melakukan fermentasi dengan asam laktat sebagai produk utamanya. Genus yang utama adalah: Lactobacillus,
Lactococcus, Enterocococcus, Streptococcus, Pediococcus, Leuconostoc, dan
Bifidobacterium. Anggota BAL dibedakan menjadi dua kelompok berdasarkan metabolisme karbohidratnya, yaitu homofermentatif yang terdiri dari Lactococcus,
Pediococcus, Enterococcus, Streptococcus, dan beberapa Lactobacillus yang memanfaatkan jalur Embden-Meyerhof (glikolitik). Jalur ini mengubah sumber karbon menjadi asam laktat. Kelompok yang kedua adalah heterofermentatif. Kelompok ini adalah kelompok bakteri yang menghasilkan sejumlah laktat, CO2,
4
kelompok ini termasuk Leuconostoc, Weissellia, dan beberapa Lactobacillus
(Vasiljevic dan Shah 2008).
Lactobacillus spp. merupakan genus terbesar dari kelompok BAL. Genus
Lactobacillus bersifat Gram positif dan tidak membentuk spora, serta bersifat anaerob fakultatif. Lactobacillus spp. banyak terdapat pada produk makanan fermentasi seperti produk-produk susu fermentasi (yoghurt, keju, kefir) produk fermentasi daging seperti sosis fermentasi, serta produk fermentasi sayuran seperti pikel, kimchi, dan sauerkraut. Lactobacillus spp. berkontribusi untuk pengawetan, ketersediaan nutrisi, dan flavour pada produk fermentasi tersebut (Salminen dan Wright 2004).
Beberapa strain Lactobacillus dan Bifidobacterium telah terbukti memperbaiki obesitas, peradangan, dan komplikasi metabolik yang berhubungan dengan beberapa mekanisme, termasuk penghambatan adesi patogen pada mukosa usus, stabilisasi struktur komunitas mikroba, dan melalui peningkatan integritas mukosa serta fungsi penghalang terhadap penyakit, cedera, atau stres (Shen et al.
2012). Mayoritas bakteri dari strain Lactobacillus dan Bifidobacterium diakui aman. BAL jarang patogen untuk manusia dan hewan, kecuali Streptococcus dan
Enteroccci. Namun, daftar strain probiotik masih sedikit. Strain dari jenis
Lactobacillus dan Bifidobacterium termasuk strain yang ditawarkan oleh industri susu dan beberapa kelompok ilmiah (Grajek et al. 2005).
Aktivitas Antioksidan
Stres oksidatif merupakan penyebab dari berbagai macam penyakit kronis pada manusia. Stres oksidatif disebabkan oleh aktivitas dari reactive oxidative species (ROS) melalui proses oksidasi. Oksidasi adalah reaksi kimia yang mentransfer elektron dari substansi ke agen pengoksidasi. Reaksi oksidasi dapat memproduksi radikal bebas yang memiliki elektron tidak berpasangan (Mishra et al. 2015).
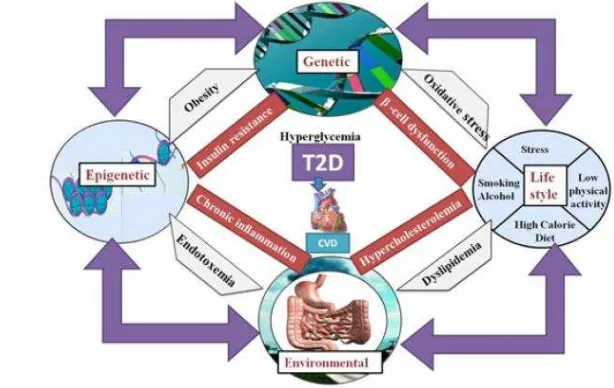
Stres oksidatif didefinisikan sebagai ketidakseimbangan antara pro-oksidan dan sistem pertahanan antioksidan tubuh sebagai hasil dari ROS yang steady state. Stres oksidatif baru-baru ini ditemukan bertanggung jawab pada kerusakan sel beta pankreas pada hiperglikemia (Gambar 1). Beberapa mekanisme reaksi yang dianggap terlibat dalam genesis dari stres oksidatif pada pasien diabetes dan hewan diabetes diantaranya adalah autooksidasi glukosa, glikasi protein, pembentukan turunan produk glikasi, dan jalur poliol. Selama proses-proses tersebut, ROS diproduksi dan menyebabkan kerusakan jaringan. Pemberian STZ menyebabkan peningkatan malonaldehida (MDA) secara signifikan dan menurunkan antioksidan enzim, seperti katalase, glutathione peroxidase, dan superoksida dismutase dibandingkan dengan kontrol hewan dalam percobaan. Penurunan aktivitas antioksidan dan peningkatan aktivitas MDA secara simultan menunjukkan kerentanan pankreas terhadap induksi STZ yang menyebabkan stres oksidatif (Eleazu et al. 2013).
5
menghasilkan radikal baru berupa senyawa yang bersifat toksik terhadap sel. Radikal baru akan berikatan dengan molekul lain dan membentuk kembali molekul radikal, sehingga terbentuk rantai reaksi radikal dan menginduksi stres oksidatif. Aktivitas ini mengakibatkan kerusakan sel, jaringan maupun fungsi genetik yang bermuara pada oksidasi protein, lemak, dan asam nukleat. Aktivitas radikal bebas akan memicu timbulnya berbagai penyakit degeneratif, seperti jantung koroner, hepatitis, alzheimer, proses penuaan, diabetes, kanker, dan katarak (Mishra et al. 2005).
Gambar 1 Multifaktor penyebab diabetes tipe 2 (Panwar et al. 2013)
Antioksidan merupakan suatu inhibitor bagi radikal bebas. Radikal bebas adalah spesies yang tidak stabil karena memiliki elektron yang tidak berpasangan dan mencari pasangan elektron dalam makromolekul biologi. Protein, lipida, dan DNA dari sel manusia yang sehat merupakan sumber pasangan elektron yang baik. Sumber radikal bebas diantaranya hasil metabolisme, neutrofil, radiasi uv, polusi air dan udara, lemak makanan, bahan kimia berbahaya, dan asap rokok. Antioksidan yang terdapat dalam tubuh dapat berupa enzim seperti fosfolipase, protease, serta enzim yang dapat memperbaiki susunan DNA (Ozyurt et al. 2006). Antioksidan yang tersedia dalam tubuh tidak sebanding dengan banyaknya radikal bebas yang mungkin masuk ke dalam tubuh. Oleh karena itu, untuk menangkap dan mencegah radikal bebas tersebut merusak sel-sel tubuh, diperlukan tambahan antioksidan dari luar tubuh (Mishra et al. 2015).
Bakteri asam laktat memiliki kemampuan antioksidan. Berdasarkan pengujian menggunakan strain L. plantarum diperoleh bahwa bakteri tersebut dapat menghambat radikal bebas DPPH. Identifikasi lebih lanjut menggunakan
high-performance liquid chromatographic (HPLC) terhadap hasil ektrak etil asetat dari kultur media L. plantarum (supernatan) tersebut dalam media MRSB (pH 4,0) diperoleh bahwa senyawa metabolit yang berperan terhadap penghambatan DPPH adalah L-3-(4-hydroxyphenyl) lactic acid (HPLA) dan L-indole-3-lactic acid (ILA). Identifikasi dengan HPLC juga dilakukan pada larutan media MRSB yang tidak ditumbuhi bakteri dan ditambahkan 1% asam laktat agar pH menjadi 4,0 sebagai pembanding. Hasil tersebut menunjukkan bahwa tidak ditemukan adanya puncak yang sama dengan ektrak etil asetat supernatan
6
Mekanisme antioksidan dari probiotik dapat terjadi melalui pengikatan ROS, pengkelatan ion logam, penghambatan enzim, dan mengurangi serta menghambat aktivitas autooksidasi askorbat. Mekanisme lain juga bisa menjadi dasar efek antioksidan dari pemberian probiotik, yaitu tikus stres yang diberikan suplemen probiotik memiliki kadar GSH yang stabil (Amaretti et al. 2013).
Terdapat berbagai metode pengukuran aktivitas antioksidan, salah satunya ialah dengan menggunakan radikal DPPH (1,1-diphenyl-2-picrylhydrazyl). Radikal DPPH merupakan suatu senyawa organik berupa serbuk berwarna ungu tua yang mengandung nitrogen yang tidak stabil. DPPH akan bereaksi dengan komponen senyawa aktif tertentu pada ekstrak uji yang memiliki kemampuan untuk mendonorkan atom hidrogen. Semakin banyak gugus hidroksil dari suatu senyawa maka aktivitasnya dalam menghambat radikal DPPH semakin tinggi (Zhang et al. 2011).
Pengujian dilakukan dengan penambahan etanol. DPPH merupakan radikal bebas yang stabil dalam etanol. Penambahan larutan etanol dalam uji berperan dalam mempertahankan kestabilan DPPH. Aktivitas antioksidan DPPH dapat diukur dengan menghitung besarnya persentase inhibisi, yaitu besarnya aktivitas senyawa antioksidan yang dapat meredam radikal bebas DPPH (Salazar-Aranda et al. 2011).
Mekanisme Probiotik sebagai Antidiabetes
Diabetes terjadi ketika tubuh tidak dapat memproduksi cukup hormon insulin atau tidak dapat menggunakan insulin secara efektif. Insulin bertindak sebagai kunci yang memungkinkan sel-sel tubuh menggunakan glukosa dan menggunakannya sebagai energi (Gambar 2). Diabetes dapat menyebabkan komplikasi kesehatan serius termasuk penyakit jantung, kebutaan, gagal ginjal, dan lain-lain. Ada dua jenis utama diabetes mellitus. Tipe 1 atau insulin dependent diabetes mellitus (IDDM) melibatkan autoimun. Tipe 2 atau non-insulin dependent diabetes mellitus (NIDDM) disebabkan karena berkurangnya sekresi insulin atau terjadinya resistensi insulin (Hwang dan Yun 2010).
Gambar 2 Analogi keadaan normal dan diabetes di dalam sel (IDF 2013)
7
luas bahwa etiologi resistensi insulin adalah kompleks dan melibatkan berbagai jalur. Jalur inflamasi secara kritis terlibat dalam evolusi resistensi insulin (Tilg dan Moschen 2014). Peradangan diamati pada penderita diabetes tipe 2 dan tikus diabetes serta manusia yang mengalami kenaikan level plasma lipopolisakarida (LPS), sebuah komponen membran dari bakteri Gram negatif yang telah terbukti merusak metabolisme glukosa pada tikus (Karlsson et al. 2013) (Gambar 3).
Gambar 3 Peran mikrobiota usus dalam pengembangan dan pengendalian diabetes (Panwar et al. 2013)
Metabolit bakteri yang paling banyak dipelajari dan berhubungan dengan metabolisme host adalah short chain fatty acid (SCFA) (Gambar 4). Short chain fatty acid merupakan produk dari hasil fermentasi polisakarida oleh mikroba di
colon. Produk tersebut memodulasi kadar beberapa hormon usus yang terlibat dalam homeostasis glukosa dan energi, termasuk glucagon-like peptide (GLP)-1 (Cani et al. 2014). Glucagon-like peptide (GLP-1) menurunkan kadar glukosa darah selama hiperglikemia dengan merangsang sekresi insulin dan mengurangi ketergantungan glukosa. Hormon ini merangsang rasa kenyang dan menunda pengosongan lambung melalui mekanisme pusat, sehingga mengurangi kadar glukosa postprandial (Wang et al. 2015).
8
Short chain fatty acid beredar dalam darah dan dengan demikian dapat bertindak pada target perifer untuk memodulasi sensitivitas insulin dan seluruh metabolisme energi dari host (Cani et al. 2014). Modulasi mikrobiota usus dengan probiotik dapat memfasilitasi pengelolaan sejumlah kondisi klinis. Probiotik dapat terlibat dalam pemeliharaan dari mikrobiota usus yang lebih sehat, dan juga telah diidentifikasi sebagai adjuvant efektif dalam terapi resistensi insulin (Gomes et al.
2014).
Aktivasi SCFA-mediated dari G-protein coupled receptor (Gpr43) mengakibatkan supresi sinyal insulin dalam jaringan adiposa kemudian mencegah akumulasi lemak. Diet tinggi lemak menginduksi resistensi insulin, sebagaimana dibuktikan pada pengujian toleransi insulin dan toleransi glukosa, diperoleh bahwa resistensi insulin dan kadar glukosa darah meningkat pada tikus yang kekurangan Gpr43 dibandingkan dengan tikus galur liar dan yang mendapat perlakuan antibiotik. Aktivasi Gpr43 juga meningkatkan sensitivitas insulin dengan meningkatkan sekresi GLP-1 di usus. G-protein coupled receptor (Gpr43) tidak diekspresikan di hati maupun diotot dan oleh karena itu adipose tissue-derived Gpr43 mampu memodulasi semua efek metabolik setelah adanya keterlibatan dengan produk yang dihasilkan mikroba seperti SCFA. Short chain fatty acid (butirat, propionat, dan asetat) dengan demikian merupakan sumber energi penting untuk host dan bertindak sebagai molekul sinyal, terutama di jaringan adiposa sehingga menjaga keseimbangan energi (Gambar 5) (Tilg dan Moschen 2014).
9
3 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Agustus 2015 hingga Maret 2016. Pembuatan kultur kering dan ekstraksi BAL dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor; Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor; Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor; dan Laboratorium Mikrobiologi, Lembaga Ilmu Pengetahuan Indonesia, Cibinong. Pengujian antioksidan dan inhibisi alfa-glukosidase dilakukan di Laboratorium Pusat Studi Biofarmaka, Institut Pertanian Bogor. Pengujian aktivitas antihiperglikemik kultur kering L. plantarum SK(5) secara in vivo dilakukan di kandang percobaan Pusat Studi Biofarmaka, Institut Pertanian Bogor. Analisis biokimia darah dilakukan di laboratorium klinik Mandapa, Bogor. Analisis imunohistokimia pankreas dilakukan di Laboratorium Patologi, Pusat Studi Satwa Primata, Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah isolat
L. plantarum SK(5) asal bekasam Palembang hasil isolasi Desniar (2012). Alat – alat yang digunakan antara lain adalah spektrofotometer, glucometer (GlucoDr), dan peralatan laboratorium lainnya.
Prosedur
Penelitian ini dilakukan melalui beberapa tahapan, yaitu tahapan pertama adalah uji efek antidiabet BAL secara in vitro, meliputi ekstraksi, uji antioksidan,
dan penentuan aktivitas daya hambat BAL terhadap enzim α-glukosidase; lalu tahapan kedua adalah uji efek antidiabet BAL secara in vivo meliputi pembuatan kultur kering BAL dan pengujian pada hewan uji tikus putih jantan galur Sprague Dawley (SD).
Uji In Vitro Efek Antidiabetes L. plantarum SK(5)
Ekstraksi Media Kultur L. plantarum SK(5) dalam MRSB (modifkasi Rapsang et al. 2011)
Produksi senyawa aktif dari supernatan BAL (media kultur) diperoleh dengan proses ekstraksi. Produksi dilakukan dengan memperbanyak biomasa
basah bakteri asam laktat terlebih dahulu. Pertama dilakukan penyegaran
10
dalam kondisi anaerob (fase awal stasioner berdasarkan Desniar (2012)). Setelah itu dilakukan pemisahan antara biomassa basah dan supernatan dari kultur menggunakan sentrifuge suhu 4°C dengan kecepatan 6000 rpm selama 30 menit. Supernatan bebas sel selanjutnya diekstraksi meggunakan pelarut etil asetat. Ekstraksi dilakukan dengan mencampur supernatan bebas sel dan pelarut etil asetat dengan perbandingan 1:1 kemudian dilakukan pengocokkan atau pengadukan selama 3x24 jam tanpa proses pemanasan dengan shaker. Pemisahan media kultur dan hasil ekstrak etil asetat dilakukan dengan corong pisah dan didiamkan beberapa saat sampai fase antara media kultur dan ekstrak etil asetat memisah dengan jelas. Ekstrak yang diperoleh selanjutnya dipekatkan menggunakan rotary evaporator pada suhu 40oC. Ekstrak media kultur yang
diperoleh (Lampiran 1) merupakan sampel yang akan digunakan pada uji
antioksidan dan uji inhibisi enzim α-glukosidase.
Uji Aktivitas Antioksidan (Salazar-Aranda et al. 2011)
Analisis aktivitas antioksidan dilakukan menggunakan 1,1-diphenyl-2-picrylhydrazyl (DPPH) dengan melihat kemampuan sampel yang digunakan dalam mereduksi radikal bebas (DPPH). Sebanyak 10 mg ekstrak kasar ditimbang, kemudian ditambahkan 1 mL dimetil sufoksida (DMSO) untuk pembuatan stok larutan 10000 ppm, dan diencerkan dengan etanol dalam beberapa konsentrasi (25, 50, 100, 200, dan 350 ppm). Sebanyak 2,5 mg DPPH diencerkan dalam 50 mL etanol. Lalu sebanyak 100 µL etanol dimasukkan ke dalam
microwell plate yang telah disiapkan. Pengisian ekstrak sebanyak 100 µL dilakukan dengan beberapa konsentrasi dan penambahan 100 µL larutan DPPH. Campuran dihomogenkan dan diinkubasi pada 37°C selama 30 menit dalam ruang gelap. Serapan yang dihasilkan diukur dengan spektrofotometer UV-visible pada panjang gelombang 517 nm. Kontrol positif yang digunakan adalah vitamin C. Persentase penghambatan aktivitas radikal bebas dihitung menggunakan rumus sebagai berikut:
Aktivitas antioksidan (%) = [(A – B)/A] x 100% Keterangan:
A = Absorbansi blanko terkoreksi B = Absorbansi sampel terkoreksi
Uji Daya Hambat Aktivitas Enzim Alfa-glukosidase (Sancheti et al. 2009)
Campuran reaksi dalam uji ini meliputi larutan kontrol blanko (B0), larutan
blanko (B1), larutan kontrol sampel (S0) dan larutan sampel (S1). Persiapan larutan
kontrol blanko (B0) dan blanko (B1) dilakukan dengan pembuatan substrat dengan
cara melarutkan p-nitrofenil α-D-glukopiranosida dalam bufer fosfat 0,1 M pH 7,0
dan pembuatan larutan enzim α-glukosidase dengan cara melarutkan 1 mg α -glukosidase dalam 100 mL bufer fosfat (pH 7,0) yang mengandung 200 mg BSA. Enzim diencerkan 25 kali dengan bufer fosfat sebelum digunakan. Campuran
reaksi blanko terdiri dari 10 μL larutan dimetil sulfoksida (DMSO), 50 μL bufer
fosfat 0,1 M (pH 7,0), 25 μL p-nitrofenil α-D-glukopiranosida sebagai substrat,
dan 25 μL larutan enzim α-glukosidase. Perbedaan antara blanko dan kontrol
11
oleh penambahan 100 μL larutan natrium karbonat 0,2 M, kemudian diukur pada panjang gelombang 410 nm dengan Microplate reader.
Persiapan larutan kontrol sampel (S0) dan sampel (S1) dilakukan dengan
melarutkan ekstrak supernatan BAL dalam DMSO. Sebanyak 10 mg ekstrak kasar ditimbang, kemudian ditambahkan 1 mL dimetil sufoksida (DMSO) untuk pembuatan stok larutan 10000 ppm dan diencerkan dengan DMSO dalam beberapa konsentrasi (5000, 20000, dan 60000 ppm). Campuran reaksi sampel
terdiri dari 10 μL ekstrak supernatan BAL, 50 μL bufer fosfat 0,1 M (pH 7,0), 25
μL p-nitrofenil α-D-glukopiranosida 10 mM sebagai substrat, dan 25 μL larutan
enzim α-glukosidase. Perbedaan antara sampel dan kontrol sampel, pada kontrol sampel tidak menggunakan enzim α-glukosidase. Campuran reaksi kemudian diinkubasi pada suhu 37°C selama 30 menit. Reaksi dihentikan oleh penambahan
100 μL larutan natrium karbonat 0,2 M. Absorban dari p-nitrofenol diukur pada panjang gelombang 410 nm dengan Microplate reader. Sampel dilakukan dalam tiga ulangan.
Kontrol positif yang digunakan pada pengujian ini adalah acarbose. Konsentrasi larutan acarbose 1% sebagai pembanding yang digunakan dibuat dari tablet Glucobay yang dilarutkan dalam akuades dan HCl 2N (1:1) dengan konsentrasi 1% (b/v) digunakan sebagai standar, kemudian disentrifugasi dan
supernatan diambil sebanyak 10 μL dan dimasukkan ke dalam campuran reaksi seperti dalam sampel dan absorban dari p-nitrofenol diukur pada panjang gelombang 410 nm dengan Microplate reader. Reaksi enzim selengkapnya untuk satu sampel dapat dilihat pada Tabel 1.
Tabel 1 Reaksi inhibisi enzim α-glukosidase
B0(μL) B1(μL) S0(μL) S1(μL)
Pengujian daya hambat ekstrak terhadap aktivitas α -glukosidase dihitung dalam % inhibisi dengan rumus :
Inhibisi (%) = [(K – (S1-S0)/K] x 100 %
Keterangan :
K = Absorbansi blanko (B1) dikurangi kontrol blanko (B0) S0 = Absorbansi kontrol sampel
S1 = Absorbansi sampel
Uji In Vivo Efek Antidiabetes L. plantarum SK(5)
Pembuatan Kultur Kering dengan Metode Pengeringan Beku (modifikasi Yun et al. 2009)
12
(SK5) pada MRSA miring. Setelah itu, satu ose bakteri dari MRSA diinokulasikan pada MRSB dengan volume kerja 10 mL dan diinkubasi pada wadah tertutup (anaerob). Kultur diinokulasi sebanyak 10% (b/v) ke dalam MRSB steril dengan volume kerja 150 mL, kemudian diinkubasi 20 jam pada suhu 37°C dalam kondisi anaerob. Sel BAL kemudian dihitung dengan menggunakan metode
total plate count (TPC) sebelum dilakukan pemanenan (Lampiran 2) dan diperoleh jumlah sel sebanyak 2,50 x 109 CFU/mL. Pemanenan biomasa basah dilakukan menggunakan sentrifuse pada kecepatan 6000 rpm selama 30 menit dalam kondisi suhu 4°C. Setelah itu biomasa basah dikeringbekukan. Sebelum dilakukan proses pengeringan beku, dilakukan penambahan bahan pelindung (kariogenik) yaitu susu skim dengan konsentrasi larutan 10% (b/v).
Perbandingan antara biomasa basah dengan bahan pelindung adalah 1:10. Biomasa basah (3 gram) yang telah ditambahkan bahan pelindung (30 mL susu skim) disimpan pada suhu dingin selama 1 jam untuk memungkinkan difusi bahan pelindung. Kultur selanjutnya dilakukan pengeringan beku pada suhu -49°C, 0,01 Mpa selama 18 jam dengan menggunakan freeze dryer eyela. Kultur kering BAL (Lampiran 3) selanjutnya digunakaan dalam pengujian efek antidiabetes secara in vivo. Setelah pengeringbekuan diperoleh biomasa kering BAL sebanyak 2,7 g dan diperkirakan memiliki jumlah sel sebanyak 3,36 x 1011 CFU dalam 2,7 g kultur kering tersebut (Lampiran 2) sesuai hasil penelitian Saskia (2014).
Penginduksian Diabetes (modifikasi Duan et al. 2015)
Pendinduksian diabetes pada penelitian ini dilakukan menggunakan
streptozotocin (STZ) (Santa Cruz, California) (Lampiran 4) dengan dosis 40 mg/Kg bb yang dilarutkan dalam 50 mM bufer sodium sitrat pH 4,5. STZ diinduksikan secara intraperitonial menggunakan syringe 27-G. Penginduksian hanya dilakukan sekali, setelah itu tikus diberikan larutan sukrosa 5% (b/v) selama tiga hari sebagai air minum dan pakan standard (BRAVO-512) (Lampiran 5) dengan nutrisi yang ditampilkan pada Lampiran 9. Selanjutnya kadar glukosa tikus diamati setelah tiga hari pasca penginduksian STZ dan pembelian larutan gula dengan menggunakan glucometer (GlucoDr) (dalam satuan mg/dL) dengan menggunakan darah dari ujung ekor tikus (Lampiran 6). Tikus ditetapkan pada kondisi hiperglikemik jika kadar glukosa darah lebih dari 200 mg/dL berdasarkan Damasceno et al. (2014) (Lampiran 7). Ketika kadar glukosa tikus mengalami diabetes atau >200 mg/dL setelah penginduksian STZ dan pemberial larutan sukrosa, maka waktu tersebut ditetapkan sebagai hari ke-0 perlakuan. Tikus dipuasakan selama 6 jam terlebih dahulu sebelum dilakukan pengukuran kadar glukosa darah. Sel β pankreas akan rusak oleh STZ sehingga fungsi pankreas menjadi abnormal dan pankreas tidak mampu untuk menghasilkan insulin, sehingga timbul gangguan metabolik berupa diabetes mellitus.
Analisis Hewan Uji dan Desain Eksperimen
13
dalam kandang plastik dan dipelihara di kandang hewan Pusat Studi Biofarmaka, IPB dengan diberikan ransum berupa pakan standar 15 g/hari (BRAVO-512) dengan kandungan nutrisi dapat dilihat pada Lampiran 9 dan air minum ad libitum
(Lampiran 10).
Selama adaptasi dan perlakuan, tikus diberikan ransum berpa pakan standard BRAVO-512. Tikus (n = 3 ekor/kelompok) dibagi kedalam 5 kelompok dan mendapatkan perlakuan selama 14 hari, yaitu 4 kelompok yang diinduksi intervensi dilarutkan dalam 1 mL PBS dan diberikan secara oral setiap hari sekali selama 14 hari perlakuan (Lampiran 11). Pembagian kelompok hewan uji pada penelitian ini adalah sebagai berikut:
A : Tikus diabetes (diinduksi STZ) dan diberikan intervensi acarbose 1 mg/Kg bb (kontrol positif);
B : Tikus diabetes (diinduksi STZ) dan diberikan intervensi PBS 1 mL (kontrol negatif);
C : Tikus diabetes (diinduksi STZ) dan diberikan intervensi L. plantarum SK(5) (30 mg/Kg bb);
D : Tikus diabetes (diinduksi STZ) dan diberikan intervensi L. plantarum SK(5) (15 mg/Kg bb);
E : Tikus normal tanpa induksi STZ.
Berat badan ditimbang dengan timbangan digital dan kadar glukosa darah diukur setiap dua hari sekali selama 14 hari. Tikus dipuasakan selama 6 jam terlebih dahulu sebelum dilakukan pengukuran. Semua tikus dilakukan eutanasi pada akhir masa percobaan. Eutanasi dilakukan dengan cara exsanguination
(Lampiran 12) yang sebelumnya dianestesi menggunakan ketamine 80 mg/Kg bb dan xylazine 10 mg/Kg bb setelah 14 hari perlakuan (Lampiran 13), untuk mendapatkan organ pankreas, serta dilakukan pengambilan sampel darah dari jantung untuk mendapatkan serum darah. Serum darah digunakan untuk mengukur serum glutamat oksaloasetat transaminase (SGOT), serum glutamat piruvat transaminase (SGPT), blood urea nitrogen (BUN), dan kreatinin. Pengukuran kadar SGOT, SGPT, BUN, dan kreatinin dilakukan menggunakan protokol kit dari Analytical Medical System, Spanyol.
Analisis profil biokimia darah
14
dan 1 mL. Serum darah dan reagen diukur dalam spektrofotometri pada suhu 25ºC, dengan panjang gelombang 340 nm untuk uji SGOT dan SGPT, 510 nm pada uji kreatinin, dan 570 nm pada uji BUN.
Analisis profil imunohistokimia pankreas (modifikasi Abunasef et al. 2014)
Prinsip imuohistokimia adalah ikatan antara antigen dan antibodi yang ditandai dengan reaksi pewarnaan antara substrat dan enzim. Proses pewarnaan imunohistokimia diawali dengan proses pembuatan preparat histopat meliputi dilakukannya pengambilan sampel jaringan (sampling) (Lampiran 15) dan pemasukan ke dalam larutan fiksatif paraformaldehid 4% (Lampiran 16), pemfiksasian dengan alkohol 70%, pendehidrasian dengan alkohol bertingkat (80%, 90%, dan 95%) dilanjutkan dengan alkohol absolut (100%), penjernihan (clearing) dengan xylol, penginfiltrasian dalam parafin cair, proses embedding
dalam cetakan parafin, pemotongan (sectioning) blok parafin yang berisi jaringan
pankreas menggunakan mikrotom dengan ketebalan kurang lebih 3 μm dan
diletakkan pada gelas objek yang telah dilapisi perekat neophren in toluene 0,2%,
dan selanjutnya pewarnaan (staining) imunohistokimia.
Proses analisis histokimia menggunakan protokol kit Biocare Medical-USA dilakukan dengan cara dilakukannya deparafinisasi dengan xylol, kemudian rehidrasi dengan akuades, dilanjutkan dengan perendaman preparat dengan H2O2
dalam metanol (blocking endogenous peroxidase) selama 15 menit, pencucian dengan PBS tiga kali masing-masing selama 5 menit, penetesan Biocare’s
Background Sniper dan diinkubasi pada suhu 37°C selama 15 menit, penetesan serum normal dan diinkubasi pada suhu 37°C selama 60 menit, pencucian dengan PBS sebanyak tiga kali masing-masing selama 5 menit, penetesan anti insulin (Monoclonal Anti-Insulin, Sigma Aldrich, No. Catalog I 2018) dan diinkubasi pada suhu 40°C over night, pencucian dengan PBS sebanyak tiga kali masing-masing selama 5 menit, penetesan antibodi sekunder yang terkonjugasi dengan biotin (Trekkie Universal Link) dan inkubasi pada suhu 37°C selama 20 menit, pencucian dengan PBS tiga kali masing-masing selama 5 menit, penetesan streptavidin-HRP kompleks (TrekAvidin-HRP label) dan inkubasi pada suhu 37°C selama 10 menit, pencucian dengan PBS tiga kali masing-masing selama 5 menit, penetesan Betazoid diamino benzidine (DAB) chromogen solution, pencucian dengan akuades dan pengecekan dengan mikroskop, dilanjutkan dengan counterstain menggunakan hematoksilin, lalu pencucian dengan air kran mengalir, pencucian dengan akuades sambil dilakukan pengecekan dengan mikroskop, terakhir dilakukan dehidrasi, penjernihan, dan mounting dengan menggunakan Entelan®. Pengamatan dilakukan dengan menggunakan mikroskop cahaya perbesaran 400x dan dilakukan pengambilan gambar pulau Langerhans dari 10 lapang pandang menggunakan kamera Nikon Eclipse 80i DS Fi1, Jepang. Jumlah sel beta pankreas dihitung dari warna coklat yang terbentuk pada pulau Langerhans menggunakan bantuan software imageJ.
Analisis data
15
darah, profil biokimia darah, dan jumlah sel beta pankreas dianalisis menggunakan uji sidik ragam (ANOVA) menggunakan prosedur One Way-ANOVA pada program SPSS 15. Tingkat perbedaan nilai tengah antar perlakuan diuji menggunakan uji selang berganda Duncan dengan P < 0.05.
4 HASIL DAN PEMBAHASAN
Hasil Aktivitas Antioksidan
Pengujian aktivitas antioksidan dilakukan dengan metode DPPH. Metode penangkapan radikal DPPH telah digunakan sebagai alat penting untuk mengevaluasi aktivitas antioksidan BAL (Chen et al. 2014). Metode ini secara luas digunakan untuk mengevaluasi aktivitas antioksidan karena kesederhanaan dan sensitivitasnya lebih baik dibandingkan dengan metode lain. Prinsipnya adalah interaksi antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen dari DPPH akan menetralkan karakter radikal bebas dari DPPH. Jika semua elektron pada DPPH menjadi berpasangan maka warna larutan berubah dari ungu tua menjadi kuning terang (Zhang et al. 2011). Hasil pengujian aktivitas antioksidan dapat dilihat pada Gambar 6.
Gambar 6 Aktivitas antioksidan L. plantarum SK(5) dengan metode DPPH Hasil analisis antioksidan menggunakan DPPH menunjukkan bahwa ekstrak media kultur L. plantarum SK(5) memiliki aktivitas antioksidan yang meningkat
seiring dengan peningkatan konsentrasi (Gambar 6). Ekstrak media kultur
16
Penghambatan Enzim Alfa-glukosidase
Aktivitas daya hambat terhadap enzim alfa-glukosidase dipelajari dengan mengetahui kemampuan sampel untuk menghambat reaksi hidrolisis glukosa pada substrat p-nitrofenil-α-D-glukopiranosida (p-NPG). Setelah mengalami hidrolisis
substrat akan terhidrolisis menjadi α-D-glukosa dan p-nitrofenol yang berwarna kuning. Warna kuning yang dihasilkan oleh p-nitrofenol menjadi indikator kemampuan inhibitor untuk menghambat reaksi yang terjadi. Semakin besar kemampuan inhibitor untuk menghambat maka produk yang dihasilkan semakin sedikit atau warna larutan setelah inkubasi lebih cerah dibandingkan dengan larutan tanpa inhibitor (Sugiwati 2005). Hasil pengujian inhibisi alfa-glukosidase dapat dilihat pada Gambar 7.
Gambar 7 Penghambatan alfa-glukosidase L. plantarum SK(5)
Hasil analisis penghambatan enzim alfa-glukosidase menunjukkan bahwa ekstrak media kultur L. plantarum SK(5) memiliki aktivitas inhibisi alfa-glukosidase yang meningkat seiring dengan peningkatan konsentrasi. Ekstrak kasar dengan konsetrasi 60000 ppm menunjukkan penghambatan tertinggi sebesar -17,28% (Lampiran 18). Hasil ini sangat jauh lebih rendah dibandingkan kontrol positif glucobay yang meiliki penghambatan sebesar 98,28% pada konsentrasi 10 ppm.
Berat Badan Hewan Uji
Berat badan tikus uji diamati setiap kali dilakukan pegujian kadar gula darah. Penimbangan dilakukan tiap 2 hari sekali selama 14 hari perlakuan. Hasil pengukuran berat badan hewan uji dapat dilihat pada Gambar 8. Tubuh tikus kontrol normal meningkat selama periode percobaan, namun kelompok diabetes menunjukkan penurunan berat badan pada hari terakhir dari percobaan. Persentase perubahan berat badan selama 14 hari percobaan dapat dilihat pada Gambar 9. Berat badan tikus normal (E) meningkat sebanyak 5,32%, sedangkan berat badan kelompok tikus diabetes menurun sebanyak 5,46% (acarbose) (A), 1,56% (PBS) (B), 9,08% (L. plantarum SK(5) 30 mg/Kg bb) (C), dan 17,8% (L. plantarum
17
Gambar 8 Hasil pengukuran berat badan hewan uji selama 14 hari perlakuan. (A): acarbose (kontrol positif), (B): PBS (kontrol negatif), (C): L. plantarum
SK(5) 30 mg/Kg bb, (D): L. plantarum SK(5) 15 mg/Kg bb, (E): tikus normal tanpa induksi diabetes
Gambar 9 Persentase perubahan berat badan selama perlakuan 14 hari. (A):
acarbose (kontrol positif), (B): PBS (kontrol negatif), (C):
L. plantarum SK(5) 30 mg/Kg bb, (D): L. plantarum SK(5) 15 mg/Kg bb, (E): tikus normal tanpa induksi diabetes
Kadar Glukosa Darah
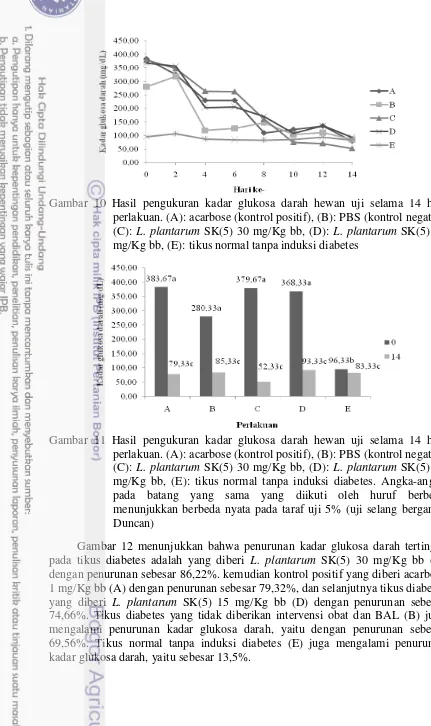
Diabetes mellitus ditandai dengan tingkat abnormal glukosa darah (hiperglikemia) (Alsayadi et al. 2014). Kadar glukosa darah pada penelitian ini dilakukan tiap 2 hari selama 14 hari perlakuan. Hasil pengukuran kadar glukosa darah dapat dilihat pada Gambar 10, adanya penurunan selama intervensi obat dan BAL dapat dilihat pada Gambar 11, dan persentase penurunan dapat dilihat pada Gambar 12. Gambar 10 menunjukkan bahwa semua tikus yang diinduksi STZ mengalami hiperglikemia yang ditandai dengan kadar glukosa darah >200 mg/dL berdasarkan Damsceno et al. (2014). Kadar glukosa darah berfluktuasi, namun semua perlakuan mengalami penurunan hingga hari ke-14 perlakuan (Gambar 10). Tikus yang diinduksi STZ mengalami diabetes dengan ditunjukkan oleh kadar glukosa darah yang berbeda nyata dengan tikus normal (Gambar 11). Selama 14 hari perlakuan, diperoleh adanya penurunan kadar glukosa darah dibandingkan dengan awal perlakuan. Gambar 11 menunjukkan bahwa dengan adanya perlakuan yang diberikan menghasilkan kadar glukosa darah yang tidak berbeda nyata dengan tikus normal pada hari ke-14 perlakuan.
18
Gambar 10 Hasil pengukuran kadar glukosa darah hewan uji selama 14 hari perlakuan. (A): acarbose (kontrol positif), (B): PBS (kontrol negatif), (C): L. plantarum SK(5) 30 mg/Kg bb, (D): L. plantarum SK(5) 15 mg/Kg bb, (E): tikus normal tanpa induksi diabetes
Gambar 11 Hasil pengukuran kadar glukosa darah hewan uji selama 14 hari perlakuan. (A): acarbose (kontrol positif), (B): PBS (kontrol negatif), (C): L. plantarum SK(5) 30 mg/Kg bb, (D): L. plantarum SK(5) 15 mg/Kg bb, (E): tikus normal tanpa induksi diabetes. Angka-angka pada batang yang sama yang diikuti oleh huruf berbeda menunjukkan berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
19
Gambar 12 Persentase perubahan kadar glukosa darah hewan uji setalah 14 hari perlakuan. (A): acarbose (kontrol positif), (B): PBS (kontrol negatif), (C): L. plantarum SK(5) 30 mg/Kg bb, (D): L. plantarum SK(5) 15 mg/Kg bb, E: tikus normal tanpa induksi diabetes
Profil Biokimia Darah
Analisis biokimia dilakukan untuk mengidentifikasi gangguan pada profil biokimiawi serum darah yang dapat dikorelasikan dengan profil histopatologi hati dan ginjal. Gangguan fungsi hati dapat diindikasikan dari glutamat oksaloasetat transaminase (SGOT) dan glutamat piruvat transaminase (SGPT). Gangguan fungsi ginjal dapat diindikasi dari kandungan blood urea nitrogen (BUN) dan kreatinin (Panjaitan et al. 2007). Hasil pengujian biokimia darah tikus dapat dilihat pada Tabel 2. Kadar SGOT, SGPT, BUN, dan kreatinin meningkat pada kelompok tikus diabetes dibandingkan dengan kelompok tikus normal.
Tabel 2 Profil biokimia darah
Perlakuan SGOT (U/L) SGPT (U/L) BUN (mg/dL) Kreatinin (mg/dL)
A 242,50±20,51a 155,50±30,41a 42,50±0,71a 0,32±0,01ab
B 115,00±4,24b 51,00±2,83b 44,00±11,31a 0,37±0,01c
C 145,50±47,38b 44,50±0,71b 43,50±10,61a 0,32±0,00b
D 124,50±13,44b 59,50±10,61b 49,00±21,21a 0,40±0,02d
E 88,00±8,49b 37,50±2,12b 34,00±9,90a 0,29±0,00a
Keterangan: (A): acarbose (kontrol positif), (B): PBS (kontrol negatif), (C): L. plantarum SK(5) 30 mg/Kg bb, (D): L. plantarum SK(5) 15 mg/Kg bb, (E): tikus normal tanpa induksi diabetes. Angka-angka pada kolom yang sama yang diikuti oleh huruf berbeda menunjukkan berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
20
dalam kategori normal sesuai dengan batas menurut Derelanko (2008), yaitu 0,3-0,8 mg/dl (Derelanko 2008).
Profil Imunohistokimia Pankreas
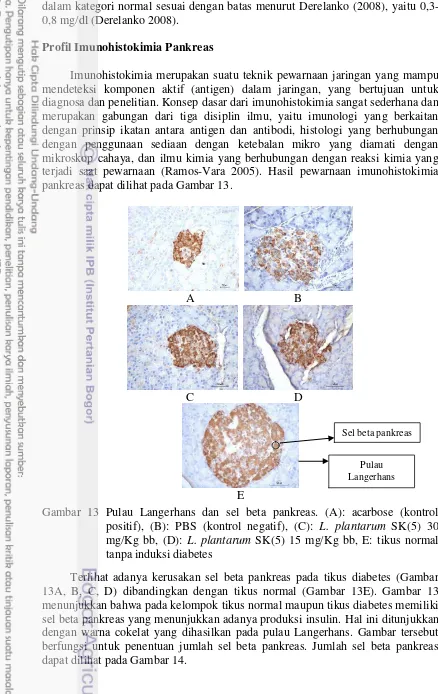
Imunohistokimia merupakan suatu teknik pewarnaan jaringan yang mampu mendeteksi komponen aktif (antigen) dalam jaringan, yang bertujuan untuk diagnosa dan penelitian. Konsep dasar dari imunohistokimia sangat sederhana dan merupakan gabungan dari tiga disiplin ilmu, yaitu imunologi yang berkaitan dengan prinsip ikatan antara antigen dan antibodi, histologi yang berhubungan dengan penggunaan sediaan dengan ketebalan mikro yang diamati dengan mikroskop cahaya, dan ilmu kimia yang berhubungan dengan reaksi kimia yang terjadi saat pewarnaan (Ramos-Vara 2005). Hasil pewarnaan imunohistokimia pankreas dapat dilihat pada Gambar 13.
A B
C D
E
Gambar 13 Pulau Langerhans dan sel beta pankreas. (A): acarbose (kontrol positif), (B): PBS (kontrol negatif), (C): L. plantarum SK(5) 30 mg/Kg bb, (D): L. plantarum SK(5) 15 mg/Kg bb, E: tikus normal tanpa induksi diabetes
Terlihat adanya kerusakan sel beta pankreas pada tikus diabetes (Gambar 13A, B, C, D) dibandingkan dengan tikus normal (Gambar 13E). Gambar 13 menunjukkan bahwa pada kelompok tikus normal maupun tikus diabetes memiliki sel beta pankreas yang menunjukkan adanya produksi insulin. Hal ini ditunjukkan dengan warna cokelat yang dihasilkan pada pulau Langerhans. Gambar tersebut berfungsi untuk penentuan jumlah sel beta pankreas. Jumlah sel beta pankreas dapat dilihat pada Gambar 14.
Sel beta pankreas
21
Rata-rata jumlah sel beta pada tikus normal adalah 202,25±22,06, sedangkan jumlah rerata sel pada tikus diabetes lebih rendah dari jumlah sel tikus normal (Gambar 14). Hasil tersebut menunjukkan bahwa jumlah sel tiku normal berbeda nyata dengan jumlah rerata sel tikus diabetes, kecuali pada pemberian
L. plantarum SK(5) 30 mg/Kg bb. Rerata jumlah sel tikus diabetes tertinggi adalah pada perlakuan pemberian L. plantarum SK(5) 30 mg/Kg bb dengan rerata jumlah sel sebanyak 152,25±36,65 (tidak berbeda nyata dengan jumlah sel pada perlakuan tikus diabetes lainnya), kemudian kelompok kontrol negatif (B) dengan rerata jumlah sel sebanyak 132,75±17,06 (berbeda nyata dengan tikus normal), lalu pemberian L. plantarum SK(5) 15 mg/Kg bb dengan rerata jumlah sel sebanyak 102,58±15,09 (berbeda nyata dengan tikus normal), dan terakhir kelompok kontrol positif (A) dengan rerata jumlah sel sebanyak 95,83±19,78 (berbeda nyata dengan tikus normal).
Gambar 14 Rata-rata jumlah sel beta pankreas hewan uji. (A): acarbose (kontrol positif), (B): PBS (kontrol negatif), (C): L. plantarum SK(5) 30 mg/Kg bb, (D): L. plantarum SK(5) 15 mg/Kg bb, (E): tikus normal tanpa induksi diabetes. Angka-angka pada batang yang sama yang diikuti oleh huruf berbeda menunjukkan berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Pembahasan
Peningkatan pemahaman tentang hubungan mikrobiota usus terkait dengan diabetes tipe 2 dan obesitas dalam beberapa tahun terakhir telah memberikan target potensial baru untuk mengurangi risiko diabetes tipe 2 (Zhang dan Zhang 2013). Beberapa peneliti dalam beberapa tahun terakhir telah melaporkan bahwa probiotik (BAL) memiliki potensi yang berkaitan dengan penurunan efek diabetes (Yadav et al. 2007; Stancu et al. 2008; Yun et al. 2009; Honda et al. 2012; Panwar et al. 2014). Zhang dan Zhang (2013) melaporkan bahwa terdapat beberapa mekanisme efek antidiabetes dari probiotik, diantaranya adalah beberapa strain probiotik memiliki efek antioksidan yang mengurangi peradangan kronis.
22
menunjukkan bahwa kemampuan probiotik L. plantarum SK(5) dalam menangkap radikal bebas (DPPH) (Gambar 6) mengindikasikan adanya efek antioksidan (34,1% pada konsentrasi 350 ppm).
Aktivitas antioksidan yang dihasilkan L. plantarum SK(5) jauh lebih rendah dibandingkan dengan vitamin C yang memiliki aktivitas antioksidan sebesar 96,72% pada konsentrasi 20 ppm. Nilai 34,1% penangkapan radikal bebas DPPH menunjukkan adanya efek antioksidan yang cukup baik. Subhashini et al. (2013) melaporkan bahwa penangkapan radikal bebas DPPH oleh Bifidobacterium spp. yang diisolasi dari produk susu sebesar 33,07% termasuk dalam kategori efek antioksidan yang cukup baik (moderately good).Metabolit yang diduga berperan dalam aktivitas antioksidan yang dihasilkan oleh L. plantarum SK(5) adalah L-3-(4-hydroxyphenyl) lactic acid (HPLA) dan L-indole-3-lactic acid (ILA). Hasil identifikasi Suzuki et al. (2013) mengenai metabolit dari ekstrak supernatan bebas sel L. plantarum yang memiliki aktivitas antioksidan terhadap DPPH dengan menggunakan HPLC menunjukkan bahwa terdapat L-3-(4-hydroxyphenyl) lactic acid (HPLA) dan L-indole-3-lactic acid (ILA).
Hasil ekstrak supernatan L. plantarum SK(5) pada penelitian ini memiliki aktivitas antioksidan yang lebih tinggi jika dibandingkan dengan pengujian aktivitas antioksidan yang dilakukan Chen et al. (2014) pada cell freeextract dari
L. rhamnosus GG yang diperoleh dari koleksi Valio Ltd., Finlandia (16.44%);
L. rhamnosus Z7 (17.99%) dan B. bifidum F-35 (3,62%) yang diisolasi dari
human faeces, L. casei BDII yang diperoleh dari koleksi Technology Center of Bright Dairy and Food Co., Ltd., Shanghai, China (17,70%), L. bulgaricus L24 yang diisolasi dari yoghurt (7.20%), dan yang dilakukan oleh Zhang et al. (2011) pada Lactobacillus casei subsp. casei dan Lactobacillus delbrueckii subsp.
bulgaricus yang diisolasi dari yoghurt tradisional cina (masing-masing <23.99%). Hasil pada penelitian Chen et al. (2014) dan Zhang et al. (2011) menunjukkan bahwa ekstrak intact cell memilki hasil aktivitas antioksidan yang lebih tinggi dibandingkan dengan ekstrak cell free sehingga untuk selanjutnya dapat dilakukan pengujian aktivitas ekstrak L. plantarum SK(5) dengan persentase penangkapan radikal DPPH yang lebih tinggi dengan menggunakan intact cell.
Beberapa studi telah menunjukkan bahwa asosiasi penanda stres oksidatif diabetes dan reactive oxygen species (ROS) memainkan peran penting dalam regulasi resistensi insulin (Furukawa et al. 2004; Houstis et al. 2006; Urakawa et al. 2003). Diet tinggi lemak meningkatkan oksidasi asam lemak dalam jaringan hati dan adiposa (Gomes et al. 2014). Hal tersebut juga menginduksi terjadinya resistensi insulin dan menyebabkan hiperglikemia (Panwar et al. 2013). Banyak penelitian telah menunjukkan bahwa Lactobacilli memiliki kemampuan antioksidan (Yadav et al. 2007, Zhang et al. 2011, Shori 2013, Chen et al. 2014) sehingga antioksidan dapat memainkan peran penting dalam kemampuan antidiabetes dari BAL.
23
Hasil negatif (-) pada ekstrak BAL belum tentu menunjukkan tidak adanya aktivitas inhibisi alfa-glukosidase. Hal ini dapat dilihat dari semakin tinggi konsentrasi, maka semakin besar % inhibisi. Penggunaan konsentrasi uji diduga masih kurang untuk melihat aktivitas inhibisi alfa-glukosidase dari L. plantarum
SK(5). Hasil pengujian Panwar et al. (2014) pada beberapa ekstrak sel
Lactobacillus yang diisolasi dari infant faeces dapat menghambat enzim alfa-glukosidase dengan persentase inhibisi antara 20%-70% pada konsentrasi 250 mg/mL hingga 500 mg/mL, namun pada konsentrasi yang lebih rendah, yaitu 200 mg/mL, diperoleh persentase inhibisi dengan nilai negatif. Hasil yang sama juga diperoleh dari pengujian Bajpai et al. (2016) pada ekstrak kultur L. sakei 1I1 yang diisolasi dari ikan air tawar Zacco koreanus. Ekstrak kultur diperoleh dengan ekstraksi menggunakan pelarut etanol. Ekstrak etanol dari L. sakei 1I1 pada konsentrasi 1, 5, 25, 50 dan 100 mg/ml menunjukkan adanya penghambatan alfa-glukosidase masing-masing sebesar 9,34%, 12,53%, 21,54%, 36,32% dan 60,69%. Hal ini menunjukkan bahwa konsentrasi yang digunakan mempengaruhi inhibisi yang dihasilkan.
Hasil Chen et al. (2014) pada beberapa BAL berbeda menghasilkan persentase inhibisi alfa-glukosidase yang berbeda. Ekstrak cell free L. rhamnosus GG yang diperoleh dari koleksi Valio Ltd., Finlandia (11.40%); L. rhamnosus Z7 (14.17%) dan B. bifidum F-35 (21.82%) yang diisolasi dari human faeces, L. casei
BDII yang diperoleh dari koleksi Technology Center of Bright Dairy and Food Co., Ltd., Shanghai, China (1.08%), L. bulgaricus L24 yang diisolasi dari yoghurt (9.94%). Hal ini menunjukkan bahwa strain berbeda memiliki kemampuan inhibisi alfa-glukosidase yang berbeda.
Pemberian BAL adalah sebuah potensi baru dan intervensi gaya hidup untuk mengendalikan hiperglikemia di masa depan sebagai tambahan untuk pengendalian diabetes. Penelitian Panwar et al. (2014) menyajikan bukti definitif bahwa strain tertentu dari Lactobacillus menghasilkan potensi penghambatan yang signifikan terhadap berbagai alfa-glukosidase. Peran fisiologis Lactobacilli
dalam memodulasi enzim alfa-glukosidase masih belum jelas. Pemurnian lebih lanjut dan identifikasi bioaktif diperlukan untuk mengungkapkan potensi BAL yang sebenarnya. Aktivitas penghambatan bergantung pada konsentrasi ekstrak dan juga adanya sel dari BAL (Panwar et al. 2014). Panwar et al. (2014) dan Bajpai et al. (2016) melaporkan bahwa isi sitoplasma atau produk metabolisme bakteri mungkin bertanggung jawab untuk aktivitas ini.
Enzim alfa-glukosidase atau dengan nama lain alfa-D-glukosida glukohidrolase merupakan enzim yang berperan dalam sel usus halus mamalia. Enzim tersebut merupakan enzim kunci pada proses akhir pemecahan karbohidrat. Enzim alfa-glukosidase mengkatalisis hidrolisis terminal residu glukosa non pereduksi yang berikatan alfa-1,4 pada berbagai substrat dan dihasilkan alfa-D-glukosa. Alfa-glukosidase menghidrolisis ikatan alfa-glikosidik pada oligosakarida dan alfa-D-glikosida (Gao et al. 2007).