PENINGKATAN KETENGGANGAN TERHADAP ALUMINIUM
DAN pH RENDAH PADA TANAMAN PAD1 MELALUI
KERAGAMAN SOMAKLONAL DAN
IRADIASI SINAR GAMMA
OLEH
SYAHMI ED1
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SYAHMI EDI. Peningkatan Ketenggangan terhadap Aluminium dan pH Rendah pada Tanaman Padi Melalui Keragaman Somaklonal dan Iradiasi Sinar Gamma. Di bawah bimbingan ED1 GUHARDJA sebagai ketua, SAID HARRAN dan IKA MARISKA sebagai anggota.
Masalah utarna yang dihadapi untuk pengembangan tanaman padi di tanah masam adalah keracunan A1 dan pH rendah. Salah satu pendekatan yang efisien dan ramah lingkungan untuk menanggulangi masalah tersebut adalah memperbaiki kultivar-kultivar tanaman terhadap cekaman lingkungan, akan tetapi varietas yang tenggang saat ini jumlahnya masih terbatas. Salah satu metode yang dapat digunakan untuk memperoleh genotipa-genotipa baru yang dapat ditanam di tanah masam adalah melalui keragaman somaklonal dan iradiasi sinar gamma. Percobaan ini bertujuan untuk mendapatkan beberapa genotipa tanaman padi yang tenggang terhadap A1 dan pH rendah melalui keragaman somaklonal dan iradiasi sinar gamma. Ada tiga tahap percobaan yang dilakukan : 1) percobaan kultur in vitro
meliputi induksi kalus, iradiasi sinar gamma, seleksi in vitro dan regenerasi, 2) seleksi tanaman di kultur hara, dan 3) seleksi tanaman pada tanah masam di rumah kaca.
Dari percobaan pertama yang telah dilakukan didapatkan h a i l sebagai berikut : 1) Media MS
+
2.4-D2+
CH3 merupakan media terbaik untuk induksi kalus pada varietas Jatiluhur dan Gajah mungkur, sedangkan media terbaik untuk varietas Cirata dan T 309 masing-masing adalah LS+
2.4-D2+
Kin 1 clan MS+
2,4-D0.5 mgll+
NAAl mgA+
BA1.5 mgA, 2) LD 50 dari varietas Jatiluhur dan Gajah mungkur adalah 1.5 krad, sedangkan untuk varietas Cirata dan T309 masing- masing adalah 1 dan 2 krad, dan 3) keragaman tertinggi pada varietas Jatiluhur adalah 838.68 (LD 47.92), Gajah mungkur 874.98 (LD 50), Cirata 713.42 (LD 52.08) dan T309 1062.76 (LD 50).Pada percobaan kedua didapatkan hasil sebagai berikut : 1) tanaman somaklonal hasil induksi kalus, iradiasi sinar gamma dan seleksi in vitro
mempunyai ketenggangan yang relatif baik jika dibandingkan dengan tanaman asalnya, 2) pengujian tanaman dikultur hara (A1 45 ppm) berdasarkan pertambahan panjang akar dan perubahan pH didapatkan 28 genotipa tanaman tenggang.
ABSTRACT
SYAHMI EDI. Increase of Aluminium Tolerant and Low pH in Rice through Somaclonal Variation and Gamma Ray Irradiation. Supervised by ED1 GUHARDJA, SAID HARRAN and IKA MARISKA.
The main problem faces the expansion of rice plants in acid soils are A1 toxicity and low pH. The best approach to solve it is to produce tolerance varieties through genetic improvement. It is stable and enviroment friendly. One of the method
was
conducted through somaclonal variation and gamma ray irradiation. The aims of the recearch is to get rice plant genotypes which is tolerant to Al and low pH through somaclonal variation and gamma ray irradiation. Three stages of experiments were conducted : 1) in vitro culture experiment consists of callus induction, gamma ray irradiation, in vitro selection and regeneration, 2) plant selection grown on nutrient culture, and 3) plant selection in acid soils in green house.The first experiment proved that : 1) the best media composition for embryogenic callus induction is : MS
+
2.4-D2+
CH3 for Jatiluhur dan Gajah mungkur genotype, LS+
2.4-D2+
Kin 1 for Cirata and MS+
2,4-D0.5 mg/l+
NAAl mg/l+
BA1.5 mg/l for T309, 2) the LD 50 from Jatiluhur dan Gajah mungkur genotype 1.5 krad, for as Cirata and T309 respectively 1 and 2 krad, and 3) the highest variation are from Jatiluhur genotype 838.68 (LD 47.92), Gajah mungkur 874.98 (LD SO), Cirata 713.42 (LD 52.08) and T309 1062.76 (LD 50).The second experiment proved that : 1) somaclonal plantlet from callus induction, treated with gamma ray irradiation and followed with in vitro selection are more tolerant then their parents, 2) test in nutient solution (Al 45 ppm) produced 28 tolerant genotype.
The third experiment proved that test of plantlet in acid soil in green house with saturation of Al 74.98 %, pH 4.28 and Aldd 11.56 me1100 g soils resulted : 1) plants tolerant to Al and low pH grown in acid soil are also tolerant (78.57) if grown in nutient solution, 2) planlets from in vitro culture are more varied then their parents (controls), 3) the result are 18 genotypes tolerant and 4 rather tolerant
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala penyataan dalam disertasi saya yang berjudul :
Peningkatan
Ketenggangan
terhadap Aluminium dan pH
Rendah pada Tanaman Padi Melalui Keragaman Somaklonal dan
Iradiasi Sinar Gamma
Adalah gagasan atau h a i l penelitian disertasi saya sendiri dengan bimbingan Komisi Pembimbing, kecuali yang dengan jelas ditunjukkan nljukannya. Disertasi ini belum pemah diajukan untuk memperoleh gelar pada program sejenis di Perguruan Tinggi lain.
Semua data clan informasi yang digunakan telah dinyatakan dengan jelas dan dapat diperiksa kebenaramya.
SYAHMI ED1
PENINGKATAN KETENGGANGAN TERHADAP ALUMINIUM
DAN pH RENDAH PADA TANAMAN PAD1 MELALUI
KERAGAMAN SOMAKLONAL DAN
IRADIASI SINAR GAMMA
OLEH
:SYAHMI ED1
995124lBIO
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Peningkatan Ketenggangan terhadap Aluminium dan pH Rendah pada Tanaman Padi Melalui Keragaman Somaklonal dan Iradiasi Sinar Gamma
Nama Mahasiswa : Syahmi Edi
Nomor Pokok : 995124
Program Studi : Biologi
Menyetujui :
1. Komisi Pembimbing
Prof. Dr. Ir. Edi Guhardja, MSc. Ketua
/i
Dr. I.
Said Harran, MSc. Anggota2. Ketua Program Studi Biologi
Dr. Ir. Ika Mariska, APU Anggota
RIWAYAT HIDUP
Penulis dilahirkan di Sawah Tangah, Batusangkar, Sumatera Barat, tanggal 10 Juli 1964, merupakan anak ke tiga dari enam bersaudara dari ayah Sanusi dan ibu
Rosna. Penulis menikah dengan Susana Armita, SH pada tahun 1993 dan telah dikaruniai 4 orang anak : Aufrah Fadhillah (Alm), Muthia Paramita, Andhio
Saputra dan Tasya Ramadhani.
Penulis menyelesaikan pendidikan Sekolah Dasar Negeri I Sawah Tangah tahun 1976, Sekolah Menengah Pertama Negeri Simabur tahun 1980 dan Sekolah Menengah Atas Negeri Batusangkar tahun 1983. Tahun 1987 menyelesaikan pendidikan Sa jana pada Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Andalas Padang. Tahun 1991 mengikuti program Magister Sains pada Program Studi Biologi, Program Pascasarjana IPB, lulus tahun 1994. Sejak Agustus 1999 mengikuti program Doktor pada Program Studi Biologi, Sekolah Pascasarjana IPB.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT karena atas limpahan
rahmatNya, penulis dapat menyelesaikan disertasi ini. Disertasi ini bertujuan untuk mencari metode yang tepat supaya mendapatkan genotipa tanarnan padi yang tenggang terhadap A1 dan pH rendah melalui keragaman somaklonal dan iradiasi sinar gamma pada kultur in vitro.
Selesainya disertasi ini tidak terlepas dari bantuan dan arahan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis menyampaikan rasa terima kasih yang tulus kepada Bapak Prof. Dr. Ir. Edi Guhardja, MSc. sebagai ketua komisi pembimbing yang selalu dengan rarnah menerima penulis, memberikan bimbingan dan pengarahan sehingga memperluas wawasan penulis dalam memahami hasil penelitian.
Ucapan terima kasih dan hormat yang sangat dalam kepada Bapak Dr. Ir. Said Harran, MSc. selaku anggota komisi pembimbing yang telah banyak memberikan tambahan ilmu mulai dari bangku perkuliahan sarnpai kepada penyusunan disertasi, sehingga dengan bekal ilmu tersebut penulis lebih mudah menyusun disertasi ini.
Terima kasih yang tidak terhingga penulis sarnpaikan kepada Ibu Dr. Ir. Ika Mariska, APU selaku anggota komisi pembimbing yang memberikan sarana dan prasarana sehingga penelitian ini dapat berjalan sesuai dengan waktu yang telah ditentukan. Selain memberikan saran dan arahan selama penelitian, juga memberikan solusi terbaik dalam mengatasi berbagai masalah selama penelitian. Semoga jerih payah beliau-beliau menjadi amal baik dan mendapat imbalan dari Allah SWT.
Ucapan terirna kasih dan penghargaan yang tulus penulis sampaikan kepada :
1. Rektor Universitas Negeri Medan, Rektor Institut Pertanian Bogor, Dekan Sekolah Pascasarjana IPB yang telah memberikan kesempatan kepada penulis untuk mengikuti pendidikan Sekolah Pascasarjana di Institut Pertanian Bogor.
2. Pimpinan Proyek PGSM dan Stag Pemerintah Provinsi Sumatera Utara, Direktur
BPPS, Direktur Pertamina (Exon Mobil), Direktur Supersemar atas beasiswa dan dana bantuan penelitian yang telah diberikan.
3. Ketua kelompok peneliti, staf dan teknisi laboratorium Reproduksi dan Pertumbuhan Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian yang telah memberikan fasilitas tempat penelitian.
4. Rekan-rekan sesama mahasiswa, khususnya program Studi Biologi dan Agronomi IPB, atas dorongan moril dan bantuan yang telah diberikan selama penelitian.
Ucapan terima kasih yang sangat dalam penulis tujukan buat isteri tercinta Susana Armita, SH yang dengan sangat sabar dan tidak henti-hentinya memotivasi serta memberikan dorongan untuk menyelesaikan studi. Ucapan yang sama ditujukan buat anak-anak kami A u h h Fadhillah (Alm), Muthia Pararnita, Andhio Saputra dan Tasya Ramadhani yang sangat mengerti dengan kondisi orang tua yang "berstatus mahasiswa" sibuk dengan kegiatan perkuliahan dan penelitian. Ucapan terima kasih yang tidak terhingga buat Ibunda tercinta Rosna dan Ayahnda Sanusi yang selalu mendoakan agar anaknya cepat selesai dari bangku perkuliahan serta semua keluarga
Akhirnya, kepada semua pihak yang turut membantu dalam penelitian hingga penulisan disertasi ini, penulis sampaikan terima kasih, semoga disertasi ini bermanfaat bagi pengembangan ilmu Biologi khususnya bidang kultur jaringan tanaman.
Bogor, April 2004
DAFTAR IS1
Halaman
...
DAFTAR TABEL x
DAFTARGAMBAR
...
xii...
DAFTAR LAMPIRAN xiv PENDAHULUAN...
1...
Latar Belakang 1 TujuanPenelitian...
5Hipotesis
...
6TINJAUAN PUSTAKA
...
7Pertumbuhan dalam Kultur Jaringan
...
7...
Pengaruh Keracunan Al 8...
Mekanisme Ketenggangan A1 10...
Studi Pewarisan Sifat Ketenggangan Al 11 Penelitian Kultur dan Seleksi In vitro...
12Keragaman Somaklonal
...
14...
Mutagen 16 BAHAN DAN METODE...
18Tempat dan Waktu Penelitian
...
18Bahan dan Alat
...
18Metode Penelitian
...
19Prosedur Penelitian
...
24Komposisi Media Kultur dan Larutan
...
29...
HASIL DAN PEMBAHASAN
...
.
1 Percobaan di Laboratorium
...
1.1. Uji viabilitas benih (eksplan)1.2. Uji kepekaan benih (eksplan) terhadap A1 dan pH rendah
...
...
1.3. Sterilisasi eksplan...
1.4. Induksi kalus...
1.5. Iradiasi sinar gamma
1.6. Seleksi kalus pada media yang mengandung A1 dan pH 4
...
...
1.7. Regenerasi kalus menjadi planlet
...
1.7.1. Regenerasi kalus menjadi tunas
...
1.7.2. Induksi akar...
.
2 Percobaan di Rumah Kaca
...
2.1. Aklimatisasi planlet...
2.2. Pengujian tanarnan pada larutan hara seleksi
...
592.2.1. Penentuan peubah
...
602.2.2. Pertambahan panjang akar
...
612.2.3. Perubahan pH
...
692.3. Penguj ian tanaman pada tanah masam
...
772.3.1. Komponen vegetatif
...
772.3.2. Komponen hasil
...
83KESIMPULAN DAN SARAN
...
98Kesimpulan
...
98Saran
...
99DAFTAR PUSTAKA
...
100Halaman
1. Uji viabilitas benih padi varietas Jatiluhur, Gajah mungkur, Cirata dan T309 3 1 2. Jumlah benih yang mati setelah perlakuan AlC13 dan pH 4 pada varietas
padi Jatiluhur, Gajah mungkur, Cirata dan T309
...
32 3. Pengaruh beberapa formulasi sterilan terhadap jumlah eksplan yang tumbuhdan steril pada beberapa varietas padi
...
334. Rata-rata bobot kalus varietas padi Jatiluhur, Gajah mungkur, Cirata dan
T309 pada berbagai formulasi media umur 6 minggu
...
355. Rata-rata diameter kalus padi varietas padi Jatiluhur, Gajah mungkur, Cirata
clan T309 pada berbagai formulasi media umur 6 minggu
...
40 6. Persentase kalus yang hidup dan sirnpangan baku setelah iradiasi sinargamma pada beberapa varietas padi
...
427. Persentase dan jumlah yang hidup setelah seleksi in vitro pada beberapa varietas padi
...
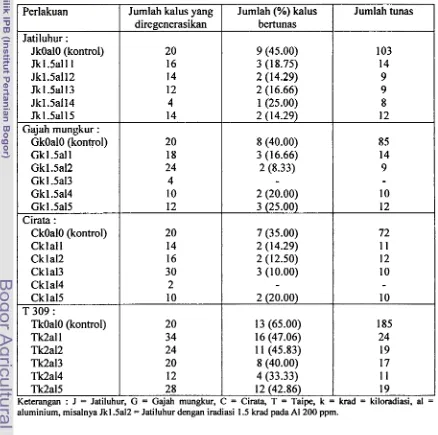
468. Jumlah dan persentase kalus yang dapat bertunas dan jumlahtunas hasil iradiasi dan seleksi in vitro untuk setiap perlakuan
...
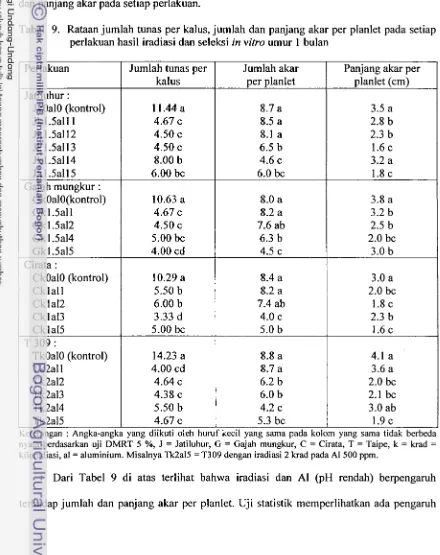
529. Rataan jumlah tunas per kalus, panjang dan jumlah akar planlet pada setiap perlakuan h a i l iradiasi dan seleksi in vitro umur 1 bulan
...
5510. Jumlah planlet hasil seleksi invitro dan planlet yang hidup setelah diaklimatisasi untuk keempat varietas yang digunakan
...
58 11. Pengaruh A1 dan pH rendah pada beberapa varietas tanaman padi terha-dap panjang akar dan tinggi tanaman umur 2 minggu
...
6012. Jumlah nomor setiap varietas dan jumlah nomor berdasarkan pertambahan panjang akar, perubahan pH, pertarnbahan panjang akar
+
perubahan pH melebihi kontrol tenggang (Dupa) yang telah diseleksi dengan A1 dan pH rendah...
7613. Komponen vegetatif varietas Jatiluhur di tanah masam dengan kejenuhan
14. Komponen vegetatif varietas Gajah Mungkur di tanah masam dengan kejenuh A1 74.98 %, pH 4.28 dan Aldd 11.56 me1100 g tanah
...
15. Komponen vegetatif varietas Cirata di tanah masam dengan kejenuhanA1 74.98 %, pH 4.28 dan Aldd 11.56 me1100 g tanah
...
16. Komponen hasil varietas Jatiluhur di tanah masam dengan kejenuhan A1 74.98 %, pH 4.28 dan Aldd 11.56 me1100 g tanah
...
17. Komponen hasil varietas Gajah Mungkur di tanah masam dengankejenuhan A1 74.98 %, pH 4.28 dan Aldd 11.56 me1100 g tanah
...
18. Komponen hasil varietas Cirata di tanah masam dengan kejenuhan A174.98 %, pH 4.28 dan Aldd 1 1.56 me11 00 g tanah
...
19. Pengurutan genotipa turunan varietas Jatiluhur berdasarkan bobot danrasio bobot gabah per rumpun serta reaksinya pada tanah masarn dengan kejenuhan A1 74.98 %, pH 4.28 dan Aldd 1 1.56 me11 00 g tanah
...
20. Pengurutan genotipa turunan Gajah mungkur berdasarkan bobot dan rasio bobot gabah per rumpun serta reaksinya pada tanah masam dengan...
kejenuhan A1 74.98 %, pH 4.28 dan Aldd 11.56 me1100 g tanah
21. Pengurutan genotipa turunan Cirata berdasarkan bobot dan rasio bobot gabah per rumpun serta reaksinya pada tanah masam dengan kejenuhan
...
A1 74.98 %, pH 4.28 dan Aldd 1 1.56 me1100 g tanah
DAFTAR GAMBAR
Halaman
...
1. Diagram prosedur penelitian2. Penampakan kalus dari beberapa media : A). MS+2,4DOS+NAA l+BA 1
B). MS+2,4DO.S+NAAl+BA1.5 C). LS+2,4D2+Kin 0.5 D). LS+2,4D2+ Kin 1 E). MS+2,4D2+CH2 F). MS+2,4D2+CH3
...
3. Penampakan kalus dari 4 varietas : A). Varietas Jatiluhur, B). Varietas Gajah Mungkur, C) Varietas Cirata dan D). Varietas T 309
...
4. Persentase kalus hidup dan simpangan baku setelah iradiasi sinar gamma pada varietas Jatiluhur, Gajah mungkur, Cirata d m T 309
...
5. Seleksi kalus pada media yang mengandung A1 d m pH 4 : A). A1 0 (kontrol), B). A1 100, C). A1 200, D). A1 300, E). A1 400, E). A1 500 ppm
6. Seleksi kalus dari beberapa varietas yang diuji : A). Varietas T 309, B). Gajah mungkur, C). Jatiluhur dan D). Cirata
...
7. Regenerasi kalus : A). Kalus ernriogenik, B. Kalus mulai membentuk tunas (umur 2 minggu), C). Tunas umur 3 minggu, D). Tunas umur 4 minggu, E). Tunas pada media pengakaran dan F). Planlet siap untuk diaklimatisasi
...
8. Penampilan beberapa planlet hasil seleksi in vifro : A). Daun halus dankriting, B). Daun roset dan kriting, C). Albino, D). Normal, E). Daun kriting dan F). Normal tanpa seleksi
...
9. Penampilan akar planlet Gajah mungkur : A. Planlet tenggang akar panjang dan kasar, B. Planlet agak tenggang akar pendek d m kasar dan C. Planlet peka akarnya mati (hitam)
...
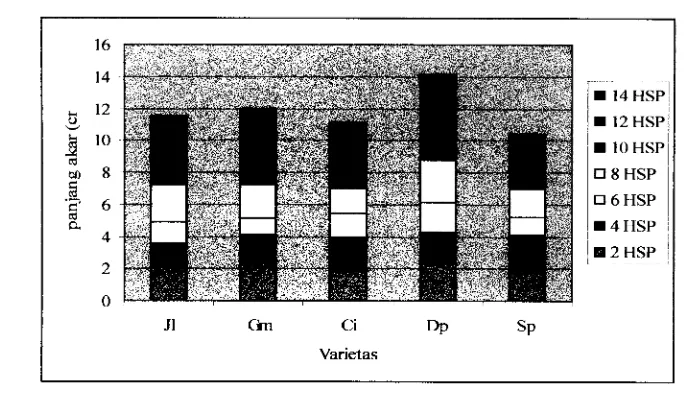
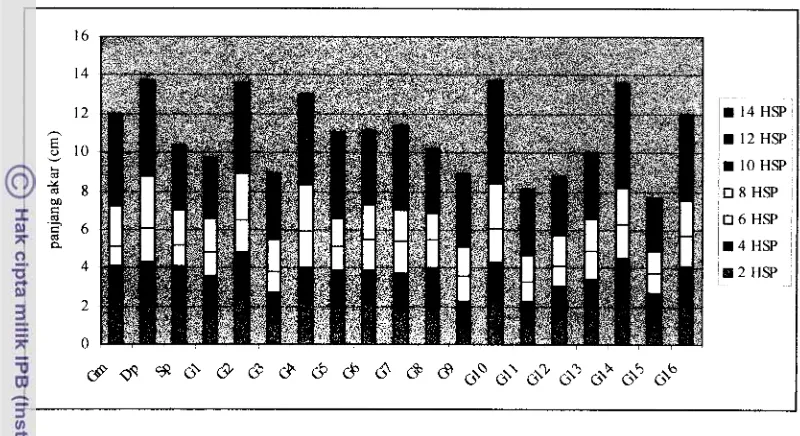
10. Grafik pertambahan panjang akar Jatiluhur (Jl), Gajah mungkur (Gm), Cirata (Ci), Dupa (Dp), dan Salum pikit (Sp)
...
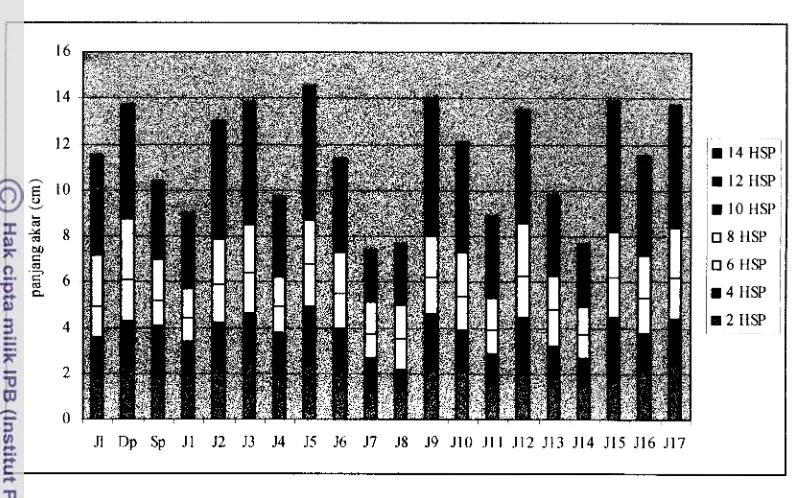
11. Grafik pertambahan panjang akar Jatiluhur (Jl) dan nomor-nomor baru yang dihasilkan (J1 - 517) dibandingkan Dp p u p a ) dan Sp (Salum pikit)..
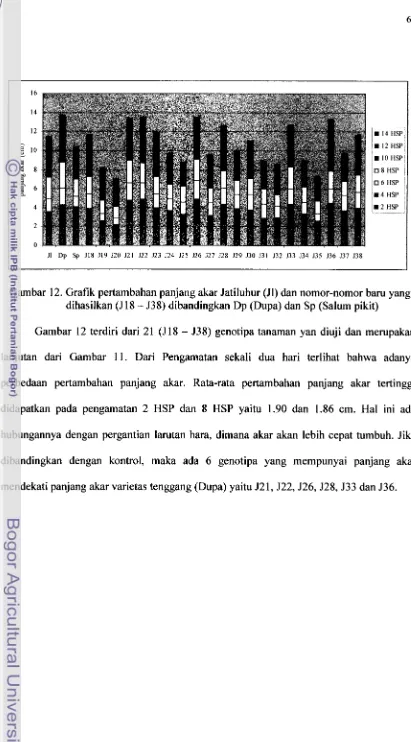
12. Grafik pertambahan panjang akar Jatiluhur (Jl) dan nomor-nomor baru yang dihasilkan (518 - 538) dibandingkan Dp p u p a ) dan Sp (Salum pikit)
14. Grafik pertambahan panjang akar Gajah mungkur dan nomor-nomor baru yang dihasilkan (G17
-
G33) dibandingkan Dp p u p a ) dan Sp (Salum pikit) 15. Grafik pertambahan panjang akar Cirata dan nomor-nomor baru yangdihasilkan (C 1 - C17) dibandingkan Dp (Dupa) dan Sp (Salum pikit)
...
16. Grafik pertambahan panjang akar Cirata dan nomor-nomor baru yang dihasilkan (C 18 - C32) dibandingkan Dp (Dupa) dan Sp (Salum pikit)...
17. A. Pengujian tanaman pada larutan hara dan B. Penampilan akar dari yangtenggang ke peka (kiri ke kanan)
...
18. Grafik perubahan pH Jatiluhur (Jl), Gajah mungkur (Gm), Cirata (Ci),Dupa (Dp) dan Salum pikit (Sp)
...
19. Grafik perubahan pH Jatiluhur (Jl) dan nomor-nomor baru yang dihasilkan(Jl
-
J17) dibandingkan Dp (Dupa) dan Sp (Salum pikit)...
20. Grafik perubahan pH Jatiluhur (Jl) dan nomor-nomor baru yang dihasilkan...
(J 18-
538) dibandingkan Dp p u p a ) dan Sp (Salum pikit)2 1. Grafik perubahan pH Gajah mungkur (Gm) dan nomor-nomor baru yang
...
dihasilkan (GI-
G16) dibandingkan p u p a ) dan Sp (Salurn pikit)22. Grafik perubahan pH Gajah mungkur (Gm) dan nomor-nomor baru yang dihasilkan (G 17 - G33) dibandingkan (Dupa) dan Sp (Salum pikit)
...
23. Grafik perubahan pH Cirata (Ci) dan nomor-nomor baru yang dihasilkan (C 1-
C 17) dibandingkan (Dupa) dan Sp (Salim pikit)...
24. Grafik perubahan pH Cirata (Ci) dan nomor-nomor baru yang dihasilkan(C18 - C32) dibandingkan (Dupa) clan Sp (Salim pikit)
...
25. Penampilan tanaman hasil seleksi in vifro dan larutan hara di tanah masarndengan kejenuhan A1 74.98 %, pH 4.28 dan Aldd 1 1.56 me1100 g tanah :
A) dan B) Tanaman secara keseluruhan, C). Tanaman peka, D). Tanaman moderat, E) Tanaman tenggang dan F). Keragaman tanaman dari paling
...
DAFTAR LAMPIRAN
Halaman
1
.
Pertambahan Panjang Akar Varietas Kontrol...
1072
.
Perubahan pH Varietas Kontrol...
1073
.
Pertambahan Panjang Akar Varietas Jatiluhur dan Keturunannya...
1074
.
Perubahan pH Varietas Jatiluhur dan Keturunannya...
1085
.
Pertambahan Panjang Akar Varietas Gajah Mungkur dan Keturunannya...
1096
.
Perubahan pH Varietas Gajah Mungkur dan Keturunannya...
1 10 7.
Pertambahan Panjang Akar Varietas Cirata dan Keturunannya...
1 1 1 8.
Perubahan pH Varietas Cirata dan Keturunannya...
1129
.
Deskripsi Padi Varietas Jatiluhur...
113.
10 Deskripsi Padi Varietas Gajah Mungkur...
1141 1
.
Deskripsi Padi Varietas Cirata...
11512
.
Forrnulasi Sterilan pada Padi Varietas Jatiluhur. Gajah mungkur. Cirata dan T309...
11613
.
Konsentrasi gelrite yang dibutuhkan pada media seleksi yang mengandung AldanpH4...
11614
.
Komposisi Media MS. LS. Media Seleksi dan Larutan Hara Seleksi...
11715
.
Hasil analisis tanah yang digunakan sebagai media tanam pada percobaan pot (Laboratorium Pascapanen. Balai Penelitian Pascapanen Pertanian) 1 18 16.
Jumlah dan persentase kalus yang hidup setelah iradiasi sinar gamma pada beberapa varietas padi...
119PENDAHULUAN
Latar Belakang
Padi merupakan komoditas paling strategis dan dibutuhkan secara esensial dalam kehidupan masyarakat Indonesia. Produksi padi tahun 2002 mencapai 5 1.379 juta ton, mengalami peningkatan sekitar 2.27 % dibandingkan dengan produksi tahun 2001 (Deptan, 2002). Jumlah penduduk yang cukup besar dengan pertumbuhan sekitar 1.49 % per tahun dan pola konsumsi pangan yang masih sangat tergantung pada beras akan membawa konsekuensi pada permintaan pangan dalam jumlah yang besar (Krisnamurthi, 2003).
Meskipun pernah mencapai swasembada beras pada tahun 1984 pemerintah
masih mengimpor beras untuk memenuhi kebutuhan dalam negeri. Impor beras setiap tahun bervariasi, pada tahun 2002 mencapai 2 juta ton (Deptan, 2002). Oleh karena itu usaha peningkatan produksi padi melalui intensifikasi dan perluasan tanam perlu dilakukan.
Salah satu usaha yang dapat dilakukan untuk meningkatkan produksi padi
adalah dengan memanfaatkan lahan yang tersedia cukup luas di luar pulau Jawa. Dari luas total daratan Indonesia, sekitar 47.6 juta hektar (32.4 %) merupakan lahan kering yang umumnya didominasi oleh tanah masam podsolik merah kuning (Karama dan Abdurachman, 1993).
konsentrasi A1 yang mencapai tingkat toksisitas. Kendala lain yang mungkin adalah kurangnya varietas (genotipa) adaptif pada lahan masam khususnya pada program ekstensifikasi. Harjadi dan Yahya (1988) mengemukakan bahwa ketenggangan
terhadap lingkungan tumbuh yang marginal merupakan daerah kiprah baru bagi perkembangan pertanian untuk memenuhi bahan pangan dan sandang.
Salah satu cara untuk mengatasi keracunan A1 pada lahan masam adalah meniadakan pengaruh negatif tanah masam itu sendiri melalui manipulasi sifat fisika- kimia tanah yang mengurangi kelarutan A1 dengan cara pengapuran. Pendekatan ini telah ditempuh oleh pemerintah Indonesia, misalnya pada pengembangan program transmigrasi pada satu dekade terakhir ini. Namun demikian hasil yang diperoleh nampaknya belum sesuai yang diharapkan. Pendekatan yang lebih efektif secara
agronomis dan efisien secara ekonomis adalah penggunaan varietas yang tenggang terhadap kemasaman tanah.
Peluang untuk mendapatkan genotipa yang mampu beradaptasi dengan kondisi stres lingkungan dari populasi tanaman budidaya cukup besar. Menurut Foy
(1 976) varietas dan spesies tanaman juga memiliki perbedaan ketenggangan terhadap
kelebihan atau kekurangan unsur ham tertentu. Perbedaan tersebut mencerminkan keragaman genetik karena adanya perbedaan kontrol genetik (Polle dan Calvin, 1990). Keberhasilan usaha tersebut sangat ditentukan oleh kemampuan pemulia dalam mengidentifikasi genotipa unggul melalui tahap seleksi.
membutuhkan tempat seleksi yang luas, tekanan seleksi yang diberikan seragam sehingga tidak ada penyimpangan (escape) dan tidak dipengaruhi musim.
Matsumoto (1991) mengemukakan bahwa informasi karakter fisiologi dan biokimia tanaman yang tenggang terhadap A1 sangat diperlukan sebagai bahan bagi pemulia tanaman untuk merakit varietas yang tenggang terhadap Al.
Marschner (1995) mengungkapkan bahwa toksisitas A1 terhadap akar dipengaruhi oleh sejumlah faktor (misalnya : konsentrasi Al, Ca, Mg dan pH larutan), sehingga masalah yang paling besar adalah mengembangkan teknik seleksi cepat (utamanya sistem kultur air) untuk menemukan suatu kecocokan dari kombinasi faktor-faktor tersebut. Kultur jaringan yang dimunculkan dengan konsentrasi A1 tinggi serta regenerasi tanaman dari kalus terseleksi (pada penelitian ini lewat variasi somaklonal) akan menawarkan pendekatan alternatif "teknik seleks?' untuk tanaman tenggang A1 tinggi.
Beberapa faktor yang mempengaruhi terjadinya variasi somaklonal secara in vitro antara lain : (a) metode propagasi vegetatif, makin banyak struktur organ
antara lain : (1) tipe kultur yang digunakan (kultur kalus, kultur suspensi dan kultur protoplasma, (2) zat pengatur tumbuh yang dipakai, (3) lamanya fase pertumbuhan kalus, (4) komposisi bahan kimia yang digunakan dalam media, (5) genotipe induk yang dipakai (homozigot atau heterozigot), dan (6) jenis eksplan (daun, batang, akar, umbi dan biji).
Keragaman somaklonal adalah keragaman genetik yang terjadi selama proses kultur dan merupakan manifestasi mutasi yang dapat diturunkan pada progeni tanaman hasil regenerasi (Larkin dan Scowcroft, 1981). Keragaman somaklonal dapat ditingkatkan dengan iradiasi sinar gamma dengan munculnya berbagai mutan. Manurut Watson (1977) mutasi adalah suatu proses dirnana suatu gen mengalami perubahan struktur, gen yang berubah karena mutasi disebut mutan (perubahan bahan keturunan yang mengakibatkan perubahan fenotipe yang diturunkan).
Iradiasi sinar gamma pada kultur jaringan diberikan pada tingkat kalus karena
: ( I ) sel-sel meristematik lebih radiosensitif dari pada sel-sel dewasa, (2) struktur yang sederhana dalam kultur in vitro dan (3) kecilnya ketergantungan sel dalam kultur dibandingkan meristem pucuk yang secara keseluruhan tergantung pada tanaman untuk menjalankan fungsinya (Tal, 1983).
kadang-kadang sulit diperoleh akibat terbatasnya kemampuan eksplan untuk beregenerasi (Srinives, Kareeros dan Kaveeta, 1994).
Berdasarkan keterangan di atas, perlu dilakukan suatu penelitian mengenai peningkatan ketenggangan terhadap aluminium dan pH rendah pada tanaman padi melalui keragaman somaklonal dan iradiasi sinar gamma.
Tujuan penelitian
Tujuan umum dari penelitian ini adalah mendapatkan beberapa genotipa tanaman padi yang tenggang terhadap A1 dan pH rendah melalui keragaman somaklonal dan iradiasi sinar gamma, dengan tujuan khusus :
1. Mencari media dasar dan zat pengatur tumbuh untuk dapat menginduksi kalus
embriogenik yang dapat beregenerasi menjadi tanaman.
2. Mencari laju dosis sinar gamma yang tepat untuk meningkatkan keragaman somaklonal pada tingkat kalus.
3. Mendapatkan keragaman somaklonal tanaman padi yang tenggang terhadap keracunan A1 dan pH rendah melalui penerapan tekanan seleksi pada tingkat in
vitro.
4. Mendapatkan genotipa-genotipa tanaman padi yang tenggang terhadap A1 dan pH rendah pada larutan hara seleksi.
Hipotesis
Adapun hipotesis umurn yang diajukan adalah : Melalui keragaman somaklonal dan iradiasi sinar gamma dapat dihasilkan beberapa genotipa tanaman ; padi yang lebih tenggang terhadap A1 dan pH rendah, dengan hipotesis khusus :
1. Media dasar dan zat pengatur tumbuh tertentu dapat menginduksi kalus embriogenik yang dapat beregenerasi menjadi tanaman.
2. Iradiasi sinar gamma pada kalus embriogenik dapat meningkatkan keragaman somaklonal.
3. Keragaman somaklonal tanaman padi yang tenggang terhadap keracunan A1 dan pH rendah dapat ditingkatkan melalui penerapan tekanan seleksi pada tingkat in
vitro.
4. Pengujian tanaman pada larutan hara seleksi akan menghasilkan beberapa genotipa tanaman padi yang tenggang terhadap A1 dan pH rendah.
5. Ada kesesuaian antara genotipa-genotipa tanaman padi yang tenggang terhadap
TINJAUAN PUSTAKA
Pertumbuhan dalam Kultur Jaringan
Kultur jaringan adalah suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, sekelompok sel, jaringan dan organ, serta menumbuhkannya dalam kondisi aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali (Bhojwani dan Razdan, 1983). Pertumbuhan dan perkembangan suatu tanaman secara in vitro ditentukan oleh beberapa faktor komplek di antaranya : (1) susunan genetik dari spesies tanaman, (2) nutrisi, (3) faktor-faktor pertumbuhan fisik, (4) beberapa senyawa organik seperti zat pengatur tumbuh, vitamin dan sebagainya.
Gunawan (1992) menyatakan bahwa keberhasilan dalam penggunaan metode kultur jaringan sangat bergantung pada media yang digunakan. Media kultur jaringan tersusun dari : hara makro dan mikro, vitamin, gula, asam amino dan N organik, persenyawaan komplek alamiah (air kelapa, juice tomat), buffer organik, arang aktif, zat pengatur pertumbuhan dan bahan pemadat media.
morfogenesis in vitro diatur oleh interaksi dan keseimbangan antara suplai zat pengatur tumbuh dalam media dan yang diproduksi secara endogen oleh sel-sel yang dikultur.
Pertumbuhan dimanifestasikan sebagai peningkatan permanen dalam ha1 ukuran, atau berat. Ukuran tidak hanya kriteria yang digunakan untuk mengukur pertumbuhan, misalnya pertumbuhan sel dalam kultur suspensi dapat dinilai dengan mengukur bobot segar jaringan yang hidup. Pertumbuhan dari zigot akan menyebabkan te jadinya pertambahan volume, bobot, jumlah sel, jumlah protoplasma dan juga kompleksitas. Pengukuran perturnbuhan dapat dilakukan terhadap faktor- faktor tersebut walaupun yang banyak digunakan adalah pengukuran pertambahan bobot kering (Salisbury dan Ross, 1995; Taiz dan Zeiger, 1991).
Pengaruh Keracunan A1
Kendala utama dalam peningkatan produksi pangan pada lahan kering atau lahan marginal adalah rendahnya ketersediaan hara N, P, K, Ca, Mg dan Mo (Raper dan Kramer, 1987; Marschner, 1995). Pada lahan dengan tingkat kamasaman tinggi, pertumbuhan tanaman dihambat oleh ion-ion logam seperti Al, Fe dan Mn. Namun di antara ion-ion tersebut Al mempakan unsur penting karena m e ~ p a k a n faktor utama dalam penghambatan pertumbuhan dan bersifat racun bagi tanaman. Menumt Marschner (1995) lebih dari 70 % tanah masam tropis mengalami defisiensi Ca dan Mg sehingga memiliki kapasitas fiksasi P yang amat tinggi.
menyebabkan kerusakan pada membran dan kebocoran K+ dari sel akar (Matsumoto, Yamamoto dan Kasai, 1992).
Efek kerusakan oleh A1 pada tanaman diawali dengan gangguan terhadap tudung akar yang mempunyai sinyal dan merupakan detektor gaya gravitasi serta halangan mekanis sehingga pada gilirannya akan mengurangi sekresi musilage sel tudung akar dimana sel tersebut merupakan sumber pengatur endogen pertumbuhan. Pada tingkat molekuler, A1 berhubungan dengan DNA sehingga interaksi A1 dengan DNA akan mempengaruhi sifat-sifat fisikokimia dan fbngsi biologis seperti menghentikan pembelahan sel pada meristem akar, perpanjangan sel, sintesis DNA dan RNA. Hal ini didukung oleh hasil penelitian Matsumoto (1991) yang menyatakan bahwa A1 menghambat pembelahan sel dengan mengganggu penggandaan DNA.
Mekanisme Ketenggangan A1
Studi Pewarisan Sifat Ketenggangan A1
Studi pewarisan sifat ketenggangan A1 telah banyak dilakukan terutama pada mutan-mutan tanaman tembakau (Nicotiana plurnbaginifolia), analisis genetik menunjukkan bahwa tanaman h a i l seleksi in vitro yang tenggang terhadap Al dikendalikan oleh gen tunggal dominan (Conner dan Meredith, 1985ab).
Penelitian Fageria et al. (1990) pada tanaman sorghum yang ditanam pada media tanah masam di mmah kaca dan larutan hara menunjukkan bahwa sifat ketenggangan terhadap Al diwariskan sebagai sifat dominan.
Rhue et al. (1978) melaporkan bahwa sifat tenggang A1 pada hibrid F1 dari 9 galur inbred jagung bersifat dominan. Sedangkan studi yang dilakukan Garcia dan da Silva (1979) pada populasi
F1,
F2 dan silangbalik tanaman jagung dari tiga galur tenggang dan dua galur peka pada kultur ham dengan 75 ppm A1 menunjukkan bahwa sifat tenggang A1 dikendalikan oleh gen tunggal dominan.Anjos et al. (1981) melaporkan ketenggangan padi gogo terhadap A1 dikendalikan lebih dari satu pasang gen yang terlihat dari pewarisan secara kuantitatif dan bersifat aditif. Sedangkan Martinez-Racinez (1977) melaporkan bahwa sifat tenggang A1 pada tanaman padi bersifat resesif dan dikendalikan oleh dua gen major yang diidentifikasi sebagai alul dan alu2.
Selanjutnya dari studi pada tingkat molekuler yang dilakukan oleh Richards et al. (1998) pada bibit Arabidopsis thaliana terbukti bahwa ada empat gen yang terekspresi yang sifatnya transien menginduksi peroksidase, glutathione-s-transferase,
protein yang mengikat tembaga biru, protein homolog pada retikulum dan enzim oksidoreduktase. Hasil ekspresi gen tersebut menyimpulkan bahwa perlakuan A1 pada Arabidopsis menginduksi stres oksidatif. Dalam ha1 ini stres oksidatif mempakan reaksi tanaman terhadap level toksik Al.
Penelitian Kultur dan Seleksi In vitro
penelitian didapatkan konsentrasi IAA 0,l mg/l dan BAP 0,7 mg/l memberikan persentase kalus bertunas yang tertinggi yaitu 16,67 % (Maftuchah, Slamet-Loedin dan Aswidinnor, 2000), (b) variasi somaklonal padi Indika dan Javanika, dari hasil penelitian didapatkan varietas Kapuas dapat menghasilkan planlet walaupun dengan persentase yang rendah yaitu pada media BAP 1 mg/l
+
NAA 0,5 mgA (Masyhudidan Ambarwati, 1993), (c) peranan fisiologis poliamin dalam regenerasi tanaman pada kultur antera padi ( O r p a sativa L.), dari hasil penelitian didapatkan penambahan putresin 10" M (poliamin terbaik) pada media N6
+
NAA 2 mgA+
Kinetin 0.5 mg/l+
60 gA sukrosa dan media MS+
NAA 0.5+
Kinetin 2 mgll+
40 gAsukrosa pada kultur anther F1 padi silangan T 309 dengan Asemandi dapat meningkatkan induksi kalus dan regenerasi tanaman hijau (Dewi, 2003), (d) induksi kalus biji dan regenerasi tanaman padi in vitro, dari hasil penelitian didapatkan persentase regenerasi tanaman dari kalus yaitu varietas Aselapan 17 %, Hawara batu 9,7 %, Pandan wangi 10,7 %, Jalawara 1 1,7 %, Rojolele 1 1,3 % dan T309 14,3 %
pada media MS (Masyhudi dan Sustipriyatno, 1994), dan (e) kultur embrio muda tanaman padi Cisadane pada beberapa media dasar MS, LS, N6 dan KNOP, dari hasil penelitian didapatkan regenerasi terbaik diperoleh dari media MS dengan penambahan NAA 2 mgA dan BAP 4 mgA (Ambarwati dan Hanarida, 1991).
tanah masam dan A1 pada tanaman kedelai, dari hasil penelitian didapatkan varietas Kelinci yang tahan terhadap tanah masam (Hutabarat dan Ratma, 1996), (b) pengaruh sinar gamma terhadap toleransi A1 pada padi varietas Sentani melalui teknik kultur jaringan dengan mengiradiasi embrio zigotik biji didapatkan mutan padi yang tenggang A1 pada perlakuan 10 Gy
+
8 ppm A1 dan 20 Gy+
14 ppm A1 (Hutabarat, 199 l), (c) induksi keragaman somaklon ke arah ketenggangan terhadap keracunan A1 pada tanaman jagung, dari hasil penelitian didapatkan terjadinya peningkatan dayaketenggangan tanarnan jagung somaklon terhadap keracunan A1 sampai taraf 800 ph4
AlC13 (Sutjahjo, 1994), dan (d) seleksi varietas padi peka menjadi tahan A1 menggunakan keragaman somaklonal, dari hasil penelitian didapatkan tanaman padi
genotipe Aiwu yang tahan terhadap A1 pada konsentrasi 250 dan 1000 pmoVl dengan
pH 3,85 (Van Sint Jan et al., 1997).
Keragaman Somaklonal
Metode kultur jaringan selain menghasilkan propagula yang bermutu, juga dapat menghasilkan keragaman somaklonal yang dapat dipergunakan dalam pemuliaan tanaman secara in vitro. Keragaman somaklonal tanaman didefinisikan sebagai karagaman genetik dari tanaman yang dihasilkan melalui kultur jaringan (Larkin dan Scowcroft, 1981).
somaklonal yaitu : (1) keragaman yang diperoleh kemungkinan tidak akan diperoleh pada genepool yang ada, (2) perubahan beberapa sifat yang akan memperbaiki penampilan. Melalui teknik kultur jaringan terdapat dua ha1 yang berbeda kepentingannya bagi pemuliaan tanaman yaitu mempertahankan kestabilan genotipe dan merangsang karagaman genetik. Kestabilan genotipe dapat dicapai dengan mendorong sesingkat mungkin fase pertumbuhan tak berdiferensiasi (fase kalus, sel bebas), sedangkan keragaman genetik dapat dicapai pada fase tak berdiferensiasi yang relatif panjang. Sejumlah mutan diduga dapat terbentuk pada fase kalus dan sel bebas, dari sini dapat diseleksi turunan yang sangat berguna bagi pemuliaan tanaman. Oleh karena itu dari hasil kultur jaringan dapat diseleksi genotipa yang berguna bagi pemuliaan tanaman seperti sifat-sifat tahan penyakit, toleransi terhadap salinitas dan ion-ion yang meracuni tanaman (seperti Al, Mn, Pb, Fe), kekeringan serta herbisida (Gunawan, 1992).
Pada kultur jaringan keadaan eksplan dan keseimbangan zat pengatur tumbuh
dalam media dapat mempengaruhi kestabilan genetik materi kultur (Ancora dan Sonuino, 1987). Menurut D'Amato (1 978) dan Bayliss (1 980) kultur jaringan merupakan sumber potensial untuk mendapatkan keragaman, yaitu dengan cara
mengatur komposisi media, keseimbangan zat pengatur tumbuh, dan lama mengkulturkan. Terdapat tiga cara memperoleh keragaman somaklonal dari eksplan yang telah berhasil dikerjakan yaitu : (1) eksplan yang beregenerasi langsung membentuk tunas dan akar, (2) menginduksi kalus terlebih dahulu kemudian
Reisch (1983) mengungkapkan bahwa kultur kalus dapat menghasilkan keragarnan somaklonal. Keragaman ini dapat ditingkatkan dengan menggunakan mutagen. Mutagen yang digunakan dapat berupa mutagen fisik seperti sinar-x dan sinar gamma, maupun mutagen kimia dapat berupa bahan kimia antara lain etil metan sulfonat (EMS), dietil sulfat (DES) dan nitroso metil urea (NMU) (Ancora dan Sonuino, 1987).
Mutagen
Keragaman somaklonal yang terjadi tidak hanya mengandalkan pada cara spontan, tetapi dapat ditingkatkan dengan cara induksi dari luar dengan menggunakan mutagen fisik maupun kimia, dan mutasi yang diperoleh merupakan mutasi buatan (induced mutation) (Ismachin, 1988). Penggunaan mutagen dalarn pemuliaan tanaman dimulai tahun 1940an. Di antara peneliti yang telah melakukannya adalah Freisleben dan In Halle dari Jerman. Mereka berhasil mendapatkan mutan barley yang tenggang mildew. Pada saat yang sama Tolenaar berhasil mendapatkan mutan dari tanaman tembakau yang diradiasi sinar-x di Deli Medan (Ismachin, 1988).
Sinar-x dan sinar gamma (mutagen fisik) adalah gelombang elektro magnetik, dimana protonnya akan meresap kedalam materi dengan suatu proses dimana
sebagian atau seluruh energi proton ditransfer ke energi kinetik suatu elektron. Elektron ini kemudian kehilangan energinya karena berinteraksi dengan atom
elektron tersebut akan terjebak dalam sistem polar, sehingga cukup waktu bagi ion radikal yang lebih dan aktif itu untuk bereaksi dengan molekul lain atau masuk ke dalam susunan jaringan (Ismachin, 1988).
Materi biologi selalu mengandung air yang cukup banyak. Dengan demikian penyerapan sinar pengion dalam materi biologi akan melibatkan proses fisika dan
kimia sebagai sumber kerusakan gen (Ismachin, 1988). Bagi para pemulia tanaman perlu diketahui tinggi rendahnya kecepatan dosis atau laju dosis iradiasi. Dosis terserap untuk setiap sinar pengion adalah jumlah energi yang diserap per berat benda yang disinari. Satuan sinar radiasi adalah Gray (Gy) atau rad.
1 rad = I00 erg per gr = 10 joule per kg 1 Gy = 100 rad = 0,l krad
Kecepatan dosis adalah jumlah dosis terserap persatuan waktu (rad per detik atau Gy per detik). Dosimeter adalah alat pengukur besarnya dosis radiasi. Dosimeter standar yang umum digunakan adalah dosimeter Fricke, tetapi dosimeter ini hanya untuk pengukuran dosis sinar gamma antara 40-400 Gy. Diluar dosis itu dosimeter sudah tidak tepat lagi. Pengukuran dosis diluar selang tersebut dilakukan kalibrasi dengan perhitungan atas laju dosis dan waktu penyinaran (Ismachin, 1988).
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kultur Jaringan dan Rumah Kaca Balai Penelitian Bioteknologi dan Sumber Daya Genetik Pertanian Cimanggu Bogor. Perlakuan sinar gamma dilaksanakan di Puslitbang Teknoiogi Isotop dan Radiasi (P3TIR), Badan Tenaga Atom Nasional (BATAN) Pasar Jumat Jakarta. Penelitian
dilakukan mulai bulan Maret 200 1 sampai bulan Agustus 2003.
Bahan dan Alat
Bahan yang akan digunakan berupa 3 macam varietas padi gogo unggul yaitu
: Jatiluhur, Gajah mungkur, Cirata dan T 309 (kontrol in vitro). Sebagai pembanding dilapangan digunakan varietas Dupa (tahan Al dan pH rendah) dan varietas Salum pikit (peka Al dan pH rendah). Bahan kimia yang diperlukan sesuai dengan formula media Murashige & Skoog (1962) dan Linsmaier & Skoog (1965), media seleksi dan larutan seleksi. Zat pengatur tumbuh yang digunakan meliputi : Auksin (IAA, NAA, 2,4-D), sitokinin (BAP, kinetin dan zeatin). Asam amino campuran yaitu casein hydrolisate (CH). Bahan sterilisasi meliputi : deterjen, benlate, alkohol, sunklin dan akuades steril. Bahan untuk tutup botol kultur antara lain aluminium foil, plastik wrap dan karet gelang.
Alat yang akan digunakan sebagian besar berupa alat gelas standar seperti :
botol kultur, erlemeyer, petridis, pipet isap, labu ukur, corong, saringan, timbangan analitik, autoklaf, pH meter, kompor listrik, oven, alat diseksi (pisau, pinset dan
Bahan dan alat yang digunakan di rumah kaca adalah : a) untuk aklimatisasi :
tanah kebun dan pupuk kompos, polibag kecil ukuran 12 x 12 cm, gelas akua untuk tutup planlet, b) untuk pengujian planlet pada larutan ham seleksi : botol kultur ukuran 500 ml, gabus dan busa tutup botol, aerator, slang kecil dan c) untuk
pengujian tanaman pada tanah masam menggunakan tanah podsolik merah kuning
(PMK) Gajrug (Jasinga), kapur pertanian (kaptan), pupuk buatan (urea, SP 36, KCI), pot plastik besar, ayakan dan bahan pengendalian hama dan penyakit (Azodrin I ccll dan Dithane M-45 1 gll).
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) faktorial untuk menganalisis perbedaan ragam yang te rjadi, dengan model :
Yijk = pengamatan pada perlakuan a ke-i,
P
ke-j dan ulangan ke-kF.1 = rata-rata umum ai = perlakuan a ke-i (3j = perlakuan
P
ke-j(aP)ij = interaksi antara a dan P, pada a ke-i, f3 ke-j E ijk = error pada a ke-i,
P
ke-j, dan ulangan ke-kUntuk menguji perbedaan setiap perlakuan digunakan uji Duncan Multiple Range Test (DMRT) dan uji Beda Nyata Terkecil (BNT) 5 %. Ragam diuji menggunakan uji
2
untuk melihat kehomogenan ragam. Rataan komponen vegetatifdan hasil akan dibandingkan dengan menggunakan sebaran t-student.
Penelitian terdiri dari 3 tahap : (1). Percobaan di laboratorium (in vitro)
media yang mengandung Al dan pH rendah (pH 4.0), regenerasi kalus menjadi planlet (media tunas dan akar), (2). Percobaan di rumah kaca mencakup : aklimatisasi planlet, pengujian tanaman pada larutan hara seleksi, dan pengujian tanaman pada tanah masam.
1. Percobaan di Laboratorium (In vitro) I. 1. Uji viabilitas benih (eksplan)
Sebelum benih padi digunakan sebagai sumber eksplan, terlebih dahulu diuji viabilitas (daya tumbuh) benih dengan jalan mengecambahkannya di atas petridis dengan beberapa kali ulangan untuk keempat varietas padi yang digunakan.
1.2. Uji kepekaan benih (eksplan)
Benih padi yang akan digunakan sebagai sumber eksplan perlu diuji kepekaannya terhadap Al C13.6H20 pada pH 4.0. Perlakuannya : lima varietas padi (Jatiluhur, Gajah mungkur, Cirata, T309 dan Salum pikit (kontrol) pada konsentrasi Al C13.6H20 1 mM. Terdapat 5 perlakuan dan 5 ulangan.
1.3. sterilisasi ekspIan
Bahan sterilisasi yang digunakan meliputi : deterjen (rinso), benlate, alkohol 70 %, Hg Cl 0.2 %, sunklin (10, 20, 30 %) dan akuades steril. Semua bahan ini dikombinasikan untuk mendapatkan formulasi sterilan terbaik sehingga kontaminasi eksplan dapat diminimalkan.
1.4. Indubi kalus pada media dasar dengan konsentrasi zat pengatur tumbuh Perlakuannya : Media dasar MS (Murashige dan Skoog) + 2,4-D
+
NAA+
BAMedia Dasar LS (Linsmaier dan Skoog) + 2,4-D
+
Kinetin1.4.1. Perlakuan Media Dasar MS
+
2,4-D+
NAA+
BAFaktor pertama konsentrasi 2,4-D : 0.5, 1 .O, 2.0 mg/l Faktor kedua konsentrasi NAA : 0.5, 1.0 mg/l Faktor ketiga konsentrasi BA : 1.0, 1.5 mg/l
Terdapat 12 (3
x
2x
2) kombinasi perlakuan, dengan ulangan 12 kali (botol kultur) untuk setiap kombinasi perlakuan. Setiap botol kultur berisi 8 buah eksplan (embrio). Menggunakan RAL faktorial. Peubah yang diamati : bobot kalus.1.4.2. Perlakuan media dasar LS
+
2,4-D+
KinetinFaktor pertama konsentrasi 2,4-D : 0.5, 1 .O, 1.5, 2.0 mg/l Faktor kedua konsentrasi kinetin : 0.5, 1 .O, 1.5 mg/l
Terdapat 12 (4
x
3) kombinasi perlakuan, dengan ulangan 12 kali (botol kultur) untuk setiap kombinasi perlakuan. Setiap botol kultur berisi 8 buah eksplan (embrio). Menggunakan RAL faktorial. Peubah yang diamati : bobot kalus.1.4.3. Perlakuan media dasar MS
+
2,4-D+
CHFaktor pertama konsentrasi 2,4-D : 0.5, 1 .O, 2.0 mg/l Faktor kedua konsentrasi CH : 0.5, 1.0, 2.0, 3.0 g/l
Terdapat 12 (3 x 4) kombinasi perlakuan, dengan ulangan 12 kali (botol kultur) untuk setiap kombinasi perlakuan. Setiap botol kultur berisi 8 buah eksplan (embrio). Menggunakan RAL faktorial. Peubah yang diamati : bobot kalus.
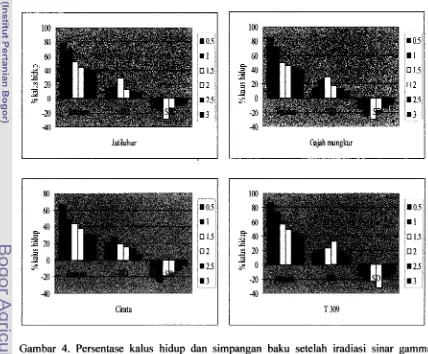
1.5. Iradimi sinar gamma
keragaman somaklonal sehingga diharapkan terjadi mutasi. Dosis sinar gamma : 0.5,
1 .O, 1.5, 2.0, 2.5, 3.0 krad untuk keempat varietas yang digunakan.
Terdapat 24 (6 x 4) kombinasi perlakuan, dengan ulangan 6 kali (botol kultur) untuk setiap kombinasi perlakuan. Setiap botol kultur berisi 8 buah eksplan (embrio). Menggunakan RAL faktorial. Peubah yang diamati : persentase (jurnlah) kalus yang hidup. Kemudian dihitung standar deviasi untuk mendapatkan karagaman tertinggi. 1.6. Seleksi kalus pada media yang mengandung Aluminium (Al)dan pH 4
Konsentrasi A1 yang digunakan : 0, 100, 200, 300, 400 dan 500 ppm untuk keempat varietas yang digunakan. Terdapat 24 (6 x 4) kombinasi perlakuan dengan ulangan 6 kali (botol kultur) untuk setiap kombinasi perlakuan. Setiap botol kultur berisi 7 buah eksplan (embrio). Menggunakan RAL faktorial. Peubah yang diamati :
persentase (jumlah) kalus yang hidup. Kemudian dihitung standar deviasi. Untuk melihat perbedaan rataan diuji dengan BNT 5 %.
1.7. Regenerasi kalus menjadi planlet
1.7.1. Regenerasi kalus menjadi tunas
Regenerasi kalus menjadi planlet menggunakan media MS dengan menggunakan konsentmi sitokinin (BAP, Thidiazuron, dan Zeatin) lebih tinggi dari pada auksin (IAA) yaitu : BA 3 mg/l + IAA 0.1 mg/l
+
Zeatin 0.2 mg/l. Peubah yang diamati : jumlah (%) kalus bertunas dan jumlah tunas per kalus.1.7. 2. Induksi akar
Induksi akar menggunakan media %MS
+
IAA 1 mg/l. Peubah yang diamati :2. Percobaan di Rumah Kaca
2.1. Aklimatisasi planlet
Aklimatisasi dilakukan untuk mendapatkan tanaman yang tahan terhadap kondisi luar (alami) yang sangat berbeda dengan kondisi sebelumnya yaitu kondisi in vitro (kondisi laboratorium) yang steril. Perlakuannya adalah media tanam menggunakan campuran tanah kebun dan kompos (2 : 1). Peubah yang diamati adalah : jumlah (%)
tanaman tenggang (hidup) setelah proses akhir aklimatisasi. Hasil aklimatisasi akan digunakan untuk pengujian pada larutan hara seleksi.
2.2. Pengujian tanaman pada larutan hara seleksi
Tanaman hasil aklimatisasi diuji menggunakan larutan hara seleksi (Tabel Lampiran 14) dengan konsentrasi A1 45 ppm dan pH 4 selama 2 minggu. Larutan ham seleksi diperbarui setiap minggu dan optimasi pH 4 (pH awal) dilakukan dengan penambahan 0.1 N NaOH atau 0.1 N HCl. Untuk menghindari terjadinya pengendapan pada larutan hara digunakan aerator. Peubah yang diamati adalah pertambahan panjang akar dan perubahan pH larutan.
Pengamatan pertambahan panjang akar dan perubahan pH dilakukan sekali dua hari. Data pertambahan panjang akar dan perubahan pH ditampilkan dalam bentuk grafik.
2.3. Pengujian tanaman pada tanah masam
sampai menghasilkan biji R1. Peubah yang diamati : komponen vegetatif (tinggi tanaman, jumlah anakan produktif dan umur berbunga) dan komponan hasil (panjang malai, jumlah gabah per malai, jumlah gabah isi per malai, persentase gabah hampa, bobot 100 gabah dan bobot gabah per rumpun). Selanjutnya rasio bobot gabah per rumpun (RBGR) dihitung dengan persamaan :
Bobot gabah per rumpun pada keadaan tercekarn Al
RBGR = x 100 %
Bobot gabah per rumpun pada keadaan tanpa A1
Berdasarkan nilai skoring RBGR, tanaman dikelompokkan berdasarkan sifat ketenggangannya terhadap Al mengikuti metode Sarkarung (1986) yang telah
dimodifikasi, yaitu skor 0 > 90% (sangat tenggang), 1 = 81 - 90 % (tenggang), 2 = 71
- 80% (agak tenggang), 3 = 61 - 70% (agak peka), 4 = 5 1 - 60 (peka) dan 5 =
c
50%(sangat peka).
Prosedur Penelitian
1. Sterilismi alat, botol dan ehplan
Semua alat yang akan dugunakan terlebih dahulu disterilkan supaya tercapai kondisi yang aseptik (bebas hama). Alat-alat yang digunakan untuk penanaman terdiri atas pisau, pinset, gunting, petridis disterilkan dengan oven sampai mencapai suhu 150 O C. Botol kultur disterilkan dengan autoklaf selama 1 jam pada tekanan 20 psi. Akuades disterilkan dengan autoklaf selama 15 menit.
Sterilisasi eksplan dilakukan sebagai berikut : biji-biji padi yang terpilih dikuliti (dibuang sekamnya), kemudian dicuci dengan air rinso (dete den) selama 2
dilakukan dalam kotak pindah suci hama (laminar air flow cabinet), dimana semua alat dan bahan yang akan dimasukkan ke dalam laminar disemprot dahulu dengan alkohol 70 %. Sterilisasi dilanjutkan dengan perendaman biji padi ke dalam alkohol 70 % selama 5 atau 10 menit, Hg C1 0.2 % selama 1 atau 2 menit, kemudian dalam sunklin 30 %, 20 % dan 10 % masing-masing selama 10, 15 dan 30 menit. Setelah itu dibilas dengan akuades steril sebanyak 3 kali masing-masing 5 menit.
Biji-biji yang sudah steril dipindahkan ke dalam botol kultur yang sudah berisi media MSo (kontrol) untuk mengalami proses pembengkakan embriozigotik (2
-
3 hari) dalam ruangan gelap sehingga lebih mudah diisolasi.2. Pembuatan Media KuItur
Dalam penelitian ini digunakan media padat dari Murashige & Skoog (1962), Linsmaeir & Skoog (1965) untuk induksi kalus (Tabel Lampiran 14) dengan penambahan zat pengatur tumbuh sesuai perlakuan. Kemasaman media (pH) diatur sebesar 5.8 sebelum diautokaf dengan menambahkan beberapa tetes 0.1 N NaOH atau 0.1 N HCl ke dalam media.
Untuk membuat menjadi padat dengan menambahkan gelrite konsentrasi 0.25
% (2.5 gll). Media dipanaskan di atas tungku listrik untuk melarutkan agar dan sukrosa. Setelah media mendidih yang berupa larutan jernih, selanjutnya dimasukkan ke dalam botol kultur' yang sudah disterilkan sebelumnya sebanyak 25 ml setiap botol. Setelah itu botol kultur ditutup dengan aluminium foil dan disterilkan dalam autoklaf selama 15 menit dengan suhu 121 O C pada tekanan 20 psi.
(Tabel Lampiran 13). Penambahan gelrite disesuaikan dengan konsentrasi A1 yang ditambahkan (makin tinggi konsentrasi Al, gelrite yang ditambahkan semakin banyak). Kemasaman media (pH) diatur sebesar 4.0 sebelum diautoklaf.
Pembuatan larutan ham seleksi digunakan untuk seleksi planlet, komposisi unsur makro sesuai dengan yang dikemukakan Van Sint Jan et al. (1997) dan unsur mikro yang dikemukakan Yoshida et al. (1976) (Tabel Lampiran 14). Konsentrasi 45 ppm, kemasaman larutan ham seleksi (pH) diatur 4.0 dengan penambahan 0.1 N NaOH atau 0.1 N HCl. Larutan ham seleksi diperbarui setiap minggu.
3. Prosedur percobaan
Induksi kalus, biji-biji yang sudah mengalami pembengkakan segera diisolasi (dibuang endosperm), kemudian embrionya diinokulasi pada media induksi kalus (sesuai perlakuan) masing-masing 8 eksplan per botol kultur. Selanjutnya semua botol kultur ditutup dengan aluminium foil dan diinkubasi dalam mang pertumbuhan.
Suhu ruang pertumbuhan sudah diatur sekitar (28
*
2) OC dan diberikan cahaya lampuTL 40 watt selama 16 jam per hari. Setelah satu minggu semua kalus yang terbentuk diperiksa dan skutelum yang tumbuh diujung kalus dipotong dan dibuang. Selanjutnya kalus dikulturkan kembali di dalam media yang sama selama 6 minggu (2 kali sub kultur).
Radiasi gamma, sebelum kalus diradiasi, terlebih dahulu alat Irradiator Gammacell 220 dengan sumber cahaya berasal dari Co60 dikalibrasi untuk
dipindahkan ke media kultur yang sama selama dua minggu guna untuk melihat
keadaan kalus seperti jumlah (%) kalus yang hidup (tenggang), warna kalus atau bagaimana keragamannya.
Seleksi kalus pada media yang mengandung A1 dan pH rendah, kalus yang keadaannya bagus (kalus mengkilap, warna putih kekuningan, kompak artinya tidak hancur bila diraba dengan pinset) akan dipindahkan ke dalam media seleksi. Kalus dibiarkan tumbuh dan berkembang selama dua bulan (dua kali subkultur). Pada media seleksi ini sebagian besar kalus akan mati yang ditandai dengan warna kalus yang menghitam, hanya kalus-kalus yang tenggang akan dapat berkembang secara terus- menerus.
Regenerasi kalus akan dilakukan setelah melewati seleksi. Kalus yang masih tumbuh dengan baik (kalus tenggang) ditandai dengan warna kalus kekuning- kuningan. Pertama-tama kalus diinduksi untuk menghasilkan tunas yang ditandai dengan berobahnya warna kalus dari kuning menjadi putih kekuning-kuningan, tahap selanjutnya akan muncul spot-spot hijau yang nantinya akan muncul tunas. Aluminium akan menghambat pertumbuhan akar, oleh karena itu tunas yang sudah tumbuh dengan baik akan dipindahkan ke media pengakaran guna menginduksi pertumbuhan akar. Planlet yang sudah mempunyai akar banyak dan kuat akan segera diaklimatisasi.
Aklimatisasi dilakukan untuk penyesuaian dengan lingkungan luar yang tidak steril. Sebelum planlet dipindahkan kelingkungan luar, terlebih dahulu disiapkan
media tanam yang terdiri dari campuran tanah kebun dengan kompos (2 : I),
kecil(l2 x 12 cm). Setelah itu permukaan tanah disiram dengan benlate 1 gll. Planlet yang ada dalam botol kultur dikeluarkan, media kultur yang masih ada pada akar planlet secara berlahan-lahan dicuci pada air mengalir. Selanjutnya planlet ditanam pada pot-pot yang telah disiapkan. Untuk menjaga penguapan yang terlalu besar, planlet ditutupi dengan gelas akua dan paranet yang berwarna hitam selama 10 hari. Setelah 10 hari secara berangsur-angsur tutup gelas dan paranet dibuka sedikit demi sedikit sampai akhirnya tanpa penutup sama sekali. Tanaman yang sudah dapat bertahan diruangan terbuka akan dipindahkan kelarutan hara seleksi (seleksi planlet).
Pengujian planlet pada kurtur larutan hara, pembuatan larutan hara seleksi dilakukan dengan cara menimbang dan mencampur bahan kimia makro dan mikro serta melarutkannya dalam akuades. Selanjutnya larutan hara seleksi dimasukkan ke dalam botol kultur besar sebanyak 400 ml. Gabus dan busa digunakan sebagai penyangga tanaman di atas permukaan botol, setiap botol satu tanaman. Suplai oksigen dilakukan dengan menggunakan aerator yang dihubungkan oleh slang kecil ke tiap-tiap botol kultur. Larutan diperbarui setiap minggu, selama dua minggu.
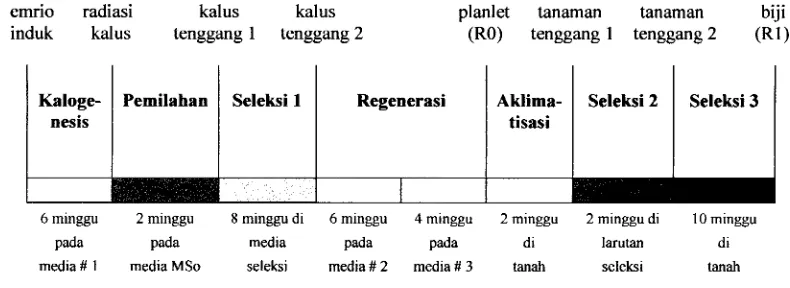
4 g KC1 per pot. Penyiraman dilakukan dua hari sekali, sedangkan pengendalian hama dan penyakit dilakukan secara kontinyu setiap dua minggu atau apabila tanaman menunjukkan gejala serangan. Garnbar 1 menyajikan diagram prosedur penelitian.
emrio radiasi kalus kalus planlet tanaman tanaman biji induk kalus tenggang 1 tenggang 2 (RO) tenggang 1 tenggang 2 ( R I )
6 minggu 2 minggu 8 minggu di 6 minggu 4 minggu 2 minggu 2 minggu di 10 minggu
pada pada media pads pada di larutan di
[image:46.568.115.510.199.343.2]media # 1 media MSo seleksi media # 2 media # 3 tanah seleksi tanah
Gambar 1. Diagram prosedur penelitian
Komposisi Media Kultur dan Larutan
Media # 1 terdiri dari media MS (Murashige & Skoog, 1962) dan media LS (Linsmaeir & Skoog, 1965) ditambah dengan 100 mg L-I myoinositol, 0.5 mg L-'
asam nikotinat, 0.5 mg L-' pyridoxin HCI, 0.1 mg L-I tiamin HCI, 3 % sukrosa dan
0.25 % gelrite, auksin dan sitokinin (sesuai perlakuan). Media # 2 dan media # 3 merupakan media regenerasi yang terdiri dari media MS ditambah auksin dan sitokinin (sesuai perlakuan).
Komposisi media seleksi adalah sebagai berikut : 2.4 g L" NH4N03, 1.9 g L-I
pertumbuhan seperti pada medium # 1. Perbedaan konsentrasi AlCl3. 6H2O (0 - 500 ppm), pH 4.0, gelrite 2.5 - 17 g L-' yang ditambahkan sebelum diautoklaf.
Larutan hara seleksi digunakan untuk seleksi tanaman berisi : 240.7 mg L"
MgS04. 7H20, 228.6 mg L-' N&N03, 41.02 mg L-' Ca(N03)2. 4 3 2 0 , 27.8 mg L"
HASIL DAN PEMBAHASAN
1. Percobaan di Laboratorium
1.1. Uji viabilitas benih (eksplan)
Sebelum benih digunakan sebagai sumber eksplan, maka terlebih dahulu diuji viabilitas (daya tumbuh) benih dengan cam mengecambahkan di atas petri yang dilapisi kertas saring dibasahi dengan akuades pada temperatur 26 O C selama enam hari. Hasilnya dapat dilihat pada Tabel 1.
Tabel 1. Uji viabilitas benih padi varietas Jatiluhur, Gajah mungkur, cirata dan T309
Dari Tabel 1 di atas terlihat bahwa viabilitas benih tertinggi didapatkan pada varietas Cirata yaitu 96.80 % dan terendah pada varietas T309 yaitu 94.00 %. Setelah diuji secara statistik keempat varietas ini tidak memperlihatkan perbedaan yang nyata. Artinya viabilitas biji adalah tinggi yaitu lebih dari 90 %, sehingga dapat digunakan sebagai sumber eksplan.
1.2.
Uji
kepekaan benih (eksplan) terhadap A1 dan pH rendahUji ini dilakukan untuk memastikan apakah varietas yang digunakan sebagai sumber eksplan betul-betul peka terhadap Al. Caranya dengan mengecambahkan benih dalam petridis yang telah dilapisi kertas saring, setelah akarnya mencapai 1 cm kecambah dipindahkan ke atas kertas saring pada temperatur 26 O C selama 3 hari. Kertas saring
selalu dibasahi dengan akuades yang telah ditambah dengan A1C13 sebanyak 1 mM dengan pH 4. Kecambah yang Al-sensitif akan mati, sedangkan kontrol (tanpa perlakuan Al) akan tumbuh normal. Hasil disajikan pada Tabel 2.
Tabel 2. Jumlah benih yang mati setelah perlakuan AlC13 dan pH 4 pada varietas padi Jatiluhur, Gajah mungkur, Cirata dan T309
Dari Tabel 2 di atas terlihat bahwa benih yang dipakai sebagai sumber eksplan cukup peka terhadap perlakuan AICl3. Hal ini terbukti dengan banyak benih yang mati setelah perlakuan A1 dan pH rendah. Persentase benih tertinggi yang mati terdapat pada varietas Cirata yaitu 98.8 % dan terendah pada varietas Jatiluhur yaitu 96.0 %. Sebagai
1.3. Sterilkasi Eksplan
Kendala utama yang dihadapi pada kultur jaringan (in vitro) adalah kontaminasi yang berasal dari eksplan maupun media. Kontaminasi dari eksplan dapat dihindari dengan jalan membuat formulasi sterilan yang tepat. Artinya setelah dikulturkan eksplan yang digunakan tetap tumbuh dan steril. Pengaruh beberapa formulasi sterilan terhadap beberapa varietas padi disajikan pada Tabel 3.
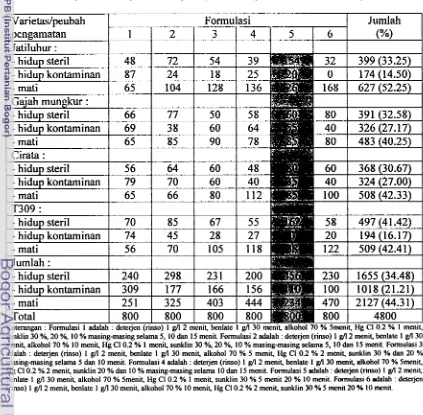
Tabel 3. Pengaruh beberapa formulasi sterilan terhadap jumlah eksplan yang tumbuh dan steril pada beberapa varietas padi (200 benih per varietas untuk setiap formulasi)
Jatiluhur :
I
-
h i d u ~ steril1
481
721
541
39 Varietaslpeubahoenrramatan
I
-
h i d u ~ steril1
661
771
501
58I
Cirata :I
I
I
I
Formulasi
1 1 2 1 3 1 4 1 5 1 6
1
-
hiduo steril1
701
851
671
55Jumlah
(%)
I
I
Jumlah :I
I
I
I
[image:50.568.82.505.292.707.2]Dari Tabel 3 di atas terlihat bahwa formulasi terbaik untuk sterilisasi eksplan
adalah pada formulasi 5 yang terdiri dari deterjen (rinso) 1 g/l 2 menit, benlate 1 g/l 30 menit, alkohol 70 % Smenit, Hg Cl 0.2 % 1 menit, sunklin 30 % 5 menit 20 % 10 menit. Hal ini mengacu pada jumlah eksplan yang hidup steril setelah 3 hari ditumbuhkan pada media kontrol (MSo) yaitu 456 benih. Banyak eksplan yang hidup steril sangat tergantung pada konsentrasi dan lamanya waktu sterilisasi. Dipihak lain juga ditentukan oleh ketenggangan eksplan terhadap bahan-bahan sterilisasi yang digunakan. Ketenggangan eksplan sangat ditentukan oleh varietas yang dipakai sebagai sumber eksplan. Dari Tabel 3 di atas juga terlihat bahwa eksplan hidup steril tertinggi didapatkan pada varietas T309 yaitu 497 benih (41.42 %), diikuti oleh varietas Jatiluhur sebanyak 399 benih (33.25 %),
varietas Gajah mungkur sebanyak 391 benih (32.58 %) dan varietas Cirata sebanyak 368 benih (30.67 %).
Rendahnya eksplan yang hidup steril pada perlakuan formulasi 3, 4, dan 6 berhubungan dengan pemberian sterilan HgCl 0.2 % yang terlalu lama (2 menit), sehingga jumlah eksplan yang mati lebih banyak. Waktu terbaik untuk pemberian sterilan Hg C1 0.2
% adalah 1 menit dengan menggabungkannya dengan sterilan sunklin 30 % dan 20 %
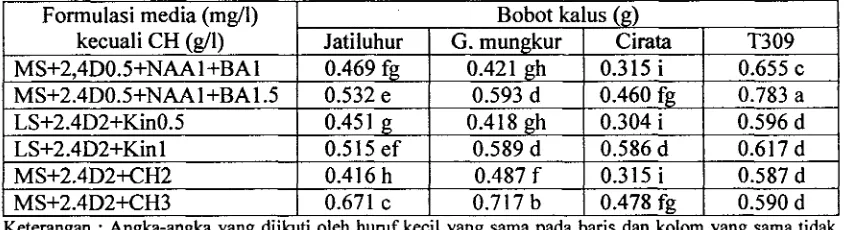
Benih yang telah steril dan embrionya mengalami pembengkakan (2 - 3 hari dalam ruang gelap pada media MSo) diisolasi dari endospermnya untuk ditumbuhkan pada beberapa formulasi media dan konsentrasi zat pengatur tumbuh yang berbeda. Tujuan untuk mendapatkan kalus yang baik dengan harapan kalus tersebut dapat diregenerasikan menjadi planlet. Peubah bobot kalus pada beberapa varietas padi disajikan pada Tabel 4. Tabel 4. Rata-rata bobot kalus varietas padi Jatiluhur, Gajah mungkur, Cirata dan T309
pada beberapa formulasi media umur 6 minggu
Dari Tabel 4 di atas terlihat adanya pengaruh interaksi antara varietas dengan media
~- -
~ormulasi media (mg/l) kecuali CH (dl) MS+2,4DOS+NAAI +BA 1 MS+2.4D0.5+NAAl+BA1.5 LS+2.4D2+Kin0.5
LS+2.4D2+Kin 1 MS+2,4D2+CH2 MS+2.4D2+CH3
yang digunakan. Bobot kalus rata-rat. tertinggi untuk varietas Jatiluhur, Gajah mungkur, Cirata dan T309 masing-masing adalah 0.671, 0.717, 0.586 dan 0.783 g. Uji statistik
Keterangan : Angka-angka yang diikuti oleh huruf kecil yang sama pada baris dan kolom yang sama tidak berbeda nyata menurut uji DMRT taraf 5 %.
Bobot kalus (g)
memperlihat perbedaan yang nyata antara bobot tertinggi dengan perlakuan media lainnya. Artinya media terbaik terdapat pada bobot kalus tertinggi tersebut. Media terbaik untuk
Jatiluhur 0.469 fg 0.532 e 0.451 g 0.515 ef 0.416 h 0.671 c
varietas Jatiluhur dan Gajah mungkur adalah MS
+ 2.4 D 2
+ CH 3, sedangkan untuk
Cirata 0.315 i 0.460 fg 0.304 i 0.586 d 0.315 i 0.478 fg G. mungkur 0.421 gh 0.593 d 0.418 gh 0.589 d 0.487 f 0.717 bvarietas Cirata dan T 309 adalah media LS + 2.4 D 2
+
Kin 1 dan MS + 2.4 D 0.5+
NAA 1 T309 0.655 c 0.783 a0.596 d 0.617 d 0.587 d 0.590 d
+
BA 1.5. Secara keseluruhan dapat dikatakan 2.4 D pada dua konsentrasi (0.5 dan 2 mg/l) [image:52.574.99.521.308.423.2]meningkatkan pertumbuhan dan diferensiasi sel-sel kalus. Jika dibandingkan formulasi media MS
+
2.4 D 0.5 + NAA 1 + BAI dan MS+
2.4 D 0.5+
NAAl
+
BA 1.5 pada varietas T 309, maka terjadi kenaikan bobot kalus dari 0.655 g menjadi 0.783 g. Kemudian jika dibandingkan formulasi LS+
2.4 D 2+
Kin 0.5 dan LS+ 2.4
D 2+
Kin 1 pada varietas Cirata juga terjadi kenaikan bobot kalus dari 0.304 g menjadi 0.586 g. Dodds dan Roberts (1982) menyatakan bahwa penambahan 2.4 D (0.2 - 2.0 mgll) sudah mampu memacu induksi kalus, akan tetapi pertumbuhannya akan lebih baik bila ditambahkan sitokinin (0.5 - 2.0 mgll) ke dalam media. Selanjutnya Abidin (1985), menyatakan penggunaan beberapa macam zat pengatur tumbuh dalam suatu media dapat menimbulkan terjadinya interaksi. Rangsangan kinetin terhadap pertumbuhan berhubungan dengan struktur kimianya dan terutama berpengaruh pada pembelahan sel, sedangkan auksin lebih berperan dalam pembesaran sel. Diperoleh indikasi bahwa auksin dapat meningkatkan sintesis protein, meningkatkan permeabilitas sel terhadap air, melunakkan dinding sel yang diikuti dengan menurunnya tekanan dinding sel sehingga air dapat masuk ke dalam sel yang disertai dengan kenaikan volume sel.Penambahan kasein hidrolisat pada media yang sudah mengandung auksin 2.4 D dapat meningkatkan pertumbuhan kalus embriogenik. Jika dibandingkan formulasi media MS
+
2.4 D 2+
CH 2 dan MS + 2.4 D 2+
CH 3 terdapat kenaikan bobot kalus dari 0.416 g menjadi 0.671 g untuk varietas Jatiluhur dan 0.487 g menjadi 0.717 g untuk varietas Gajah mungkur. Gunawan (1988) menyatakan bahwa asam amino merupakan sumber N organik akan lebih cepat diambil oleh tanaman dari pada N anorganik. Selanjutnya Georgepembentukan kalus embriogenik, karena di dalam kloroplas asam amino dapat berperan sebagai prekusor untuk pembentukan asam nukleat dan proses seluler lainnya.
Varietas mempunyai respon yang berbeda terhadap bobot kalus yang terbentuk. Bobot kalus tertinggi pada masing-masing varietas berbeda nyata setelah diuji secara statistik. Bobot kalus tertinggi didapatkan pada varietas T309 yaitu 0.783 g, sedangkan bobot kalus terendah didapatkan pada varietas Cirata yaitu 0.586 g. Artinya keempat varietas mempunyai respon yang berbeda terhadap peningkatan bobot kalus. Dengan demikian verietas (genotipa) tanaman berpengaruh terhadap pembentukan kalus yang berkaitan dengan faktor genetik. Menurut Raina (1989) terdapat perbedaan efisiensi induksi kalus dan regenerasi pada tanaman padi Japonika (T309) dan Indika (Jatiluhur, Gajah mungkur dan Cirata). Tanaman padi varietas T309 terkenal akan kemarnpuamya dalam pembentukan kalus dan regenerasi dengan efisiensi yang tinggi, sehingga sering digunakan sebagai kontrol dalam kultur in vitro.
Pengamatan kalus secara visual menunjukkan bahwa formulasi media mempengaruhi penampakan kalus. Kriteria kalus yang baik adalah : 1) berwarna putih kekuningan, 2) berbentuk globular dengan nodul-nodul yang mengkilap dan 3) remah (friabel), sehingga kalus yang diperoleh dapat diregenerasikan menjadi planlet. Dari enam
akar dipengaruhi oleh nisbah auksin dan sitokinin. Bila nis