ISOLASI DAN DETERMINASI PATOTIPE MOLEKULER
VIRUS Newcastle disease : KAJIAN LAPANG DI WILAYAH
JAWA TIMUR
ERIN KURNIANINGTYAS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Determinasi Patotipe Molekuler Virus Newcastle Disease : Kajian Lapang di Wilayah Jawa Timur adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2016
Erin Kurnianingtyas
RINGKASAN
ERIN KURNIANINGTYAS. Isolasi dan Determinasi Patotipe Molekuler Virus
Newcastle Disease : Kajian Lapang di Wilayah Jawa Timur. Dibimbing oleh SURACHMI SETIYANINGSIH dan AGUSTIN INDRAWATI.
Newcastle disease adalah penyakit yang disebabkan oleh virus dan dapat menyebabkan infeksi sistemik hingga kematian pada unggas. Isolasi virus berhasil diperoleh di berbagai wilayah di Indonesia dan menjadi endemik di berbagai negara berkembang. Virus ini dilaporkan menyebabkan 14 000 kasus unggas terinfeksi di Jawa Timur pada tahun 2011. Tujuan penelitian ini adalah mengkaji keberadaan dan determinasi patotipe secara molekuler virus Newcastle disease di wilayah Jawa Timur. Sampel usapan kloaka sebanyak 289 diambil dari unggas (ayam dan bebek) pekarangan, peternakan, pengepul, dan pasar unggas di Probolinggo, Situbondo, dan Bondowoso. Sampel dipool dengan setiap pool
terdiri dari 5-7 individu berdasarkan jenis unggas dan lokasi pengambilan sampel sehingga didapatkan total pool sebanyak 56 pool. Sampel pool diinokulasi pada telur ayam berembrio SPF dan dilanjutkan dengan Real Time Reverse Transcription Polymerase Chain Reaction (rRT-PCR) matrix (M). Sampel positif, kemudian diuji kembali secara individu dengan diinokulasi kembali pada telur ayam berembrio SPF. Karakterisasi patotipe isolat dilakukan dengan rRT-PCR
Fusion (F), uji hemagglutination inhibition (HI), uji waktu elusi, dan sekuensing gen F untuk melihat motif cleavage site.
Hasil menunjukkan 6 dari 56 pool terdeteksi positif VND. Enam pool positif terdiri dari 5 pool dari ayam kampung dan 1 pool dari bebek. Isolasi VND dari individu sampel asal pool positif diperoleh 8 isolat. Semua isolat berasal dari pasar unggas di Probolinggo dan Bondowoso. Delapan isolat individu yang terdeteksi positif VND dengan primer matrix (M). Hasil titer HI dengan menggunakan Komarov berkisar antara 3 – 4 log2, berbeda dengan antiserum B1
menunjukkan variasi lebih rendah yaitu berkisar antara 2 – 4 Log2, sehingga
semua isolat memiliki afinitas lebih tinggi terhadap Komarov dan bereaksi positif pada uji rRT-PCR F. Uji waktu elusi menunjukkan bahwa 7 isolat termasuk ke dalam velogenik dan 1 isolat termasuk mesogenik. Sebagai peneguhan dari ketiga uji diatas, analisis sekuen nukleotida menunjukkan motif asam amino multibasic pada cleavage site protein F; tujuh isolat memiliki motif 112RRQKRF117 dan satu isolat 112RRRKRF117.
Kedelapan isolat memiliki kesamaan secara karakteristik, akan tetapi isolat IDNSMP-4A memiliki keragaman karakteristik berbeda dilihat dari motif
cleavage site pada protein F. Semua isolat diperoleh dari pasar unggas dan tidak menunjukkan gejala secara klinis, sehingga dapat diindikasikan bahwa virus mampu menyebar dengan cepat di area pasar. Hasil penelitian bisa sebagai informasi akurat menjelaskan bahwa perlu ada pengawasan lalu lintas sebagai pencegahan dan pengendalian penyebaran penyakit infeksi VND di pasar unggas. Kata kunci: Newcastle disease, patotipe molekuler, motif cleavage site, pasar
SUMMARY
ERIN KURNIANINGTYAS. Isolation and Molecular Pathotyping Determination of Newcastle disease Virus : Field studies in area of East Java. Supervised by SURACHMI SETIYANINGSIH and AGUSTIN INDRAWATI.
Newcastle disease is viral disease of birds which cause systemic infection and death. Virus isolation have been reported in some areas of Indonesia and endemic in some of developing countries. It have been reported 14 000 cases of infected chickens in East Java, 2011. The purposes of this study were to assess the presence and determine the molecular pathotype of Newcastle disease virus (NDV) in some areas of East Java. Two hundred eighty nine of cloacal swab samples were taken from birds (chickens and ducks) from backyards, farms, collecting facilities, and live bird markets in the districts of Probolinggo, Situbondo, and Bondowoso. Samples were pooled with each pool consisting of 5-7 individuals based on the type of bird and sampling locations to obtain a total pool of 56 pools. Samples pool inoculated in SPF embryonated chicken eggs followed by Real Time Reverse Transcription Polymerase Chain Reaction (rRT-PCR) matrix (M). Positive samples of pools were tested again individually with inoculated in SPF embryonated chicken eggs. Pathogenicity was determined by rRT-PCR fusion (F), HI test, elution time, and F gene sequencing.
The results showed 6 of 56 pools were detected positive NDV. Six positive pool consisting of 5 pools of chicken and 1 pool of duck. Isolation NDV had obtained 8 isolates positive individually from pools. All isolates were taken from poultry markets in Probolinggo and Bondowoso. Eight isolates were detected positive individuals VND with matrix (M). The HI titer using Komarov ranging motif, and only one isolate has 112RRRKRF117 motif.
Eight isolates had same characteristics, however isolates IDNSMP-4A had different characteristics based on the F protein cleavage site motif. All isolates obtained from live bird markets and showed no clinical symptoms, so it can be indicated that the virus is able to spread rapidly in the area market. The results of the research can be as reference data that there needs to be monitoring the traffic as the prevention and control of the spread NDV in the poultry market
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
ISOLASI DAN DETERMINASI PATOTIPE MOLEKULER
VIRUS Newcastle disease : KAJIAN LAPANG DI WILAYAH
JAWA TIMUR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Isolasi dan Determinasi Patotipe Molekuler Virus Newcastle Disease : Kajian Lapang di Wilayah Jawa Timur
Nama : Erin Kurnianingtyas NIM : B253140011
Disetujui oleh Komisi Pembimbing
Drh Surachmi Setiyaningsih, Ph.D Ketua
Dr Drh Agustin Indrawati, MBiomed Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi Medik
Prof. Dr.Drh. Fachriyan H Pasaribu
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2015 – Maret 2016 ini ialah Newcastle disease dengan judul Isolasi dan Determinasi Patotipe Molekuler Virus Newcastle disease: Kajian Lapang di Wilayah Jawa Timur.
Terima kasih penulis ucapkan kepada Ibu Drh. Surachmi Setiyaningsih Ph.D dan Ibu Dr. Drh. Agustin Indrawati M.Biomed selaku pembimbing yang telah banyak memberi saran dan masukan. Di samping itu, penghargaan penulis sampaikan kepada Bapak Prof. Dr. Drh. Fachriyan H Pasaribu selaku ketua program studi Mikrobiologi Medik. Terimakasih saya sampaikan kepada ayahanda Drs. Supena M.Pd dan ibunda Tusiyani S.Pd yang telah memberikan
do’a dan dukungannya. Terima kasih juga untuk adikku Farhan Lisyahril F yang
telah memberikan semangat yang sangat besar. Terima kasih kepada Drh. Maya Shofa dan Agustin Eka Pujiono S.Si atas bantuan dan dukungannya. Terimakasih kepada rekan-rekan MKM 2014 atas semangat dan kerjasamanya semoga silaturahmi kita tetap terjalin. Ungkapan terima kasih juga saya sampaikan kepada para staff Lab. Terpadu Mikrobiologi Medik FKH IPB.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 TINJAUAN PUSTAKA 3
Newcastle disease (ND) 3
Etiologi 3
Gejala Klinis 8
Diagnosa Laboratorium 10
Pengendalian Penyakit 10
3 METODE 11
Waktu dan Tempat Penelitian 11
Bahan dan Alat 11
Metode Penelitian 12
Analisis Data 14
4 HASIL DAN PEMBAHASAN 14
Isolasi virus pada telur ayam berembrio 14
Patotipe secara molekuler 15
Karakter antigenisistas VND dengan uji Hemaglutination Inhibition (HI) 16
Karakter Virus dengan uji Elusi 17
Karakter virus berdasarkan motif cleavage site gen F 18
Deteksi VND di Wilayah Jawa Timur 21
5 SIMPULAN DAN SARAN 22
Simpulan 22
Saran 22
DAFTAR PUSTAKA 23
DAFTAR TABEL
1 Jenis motif cleavage site pada VND 6
2 Primer dan probe untuk mendeteksi VND dengan rRT-PCR 13
3 Hasil deteksi VND dengan rRT-PCR 16
4 Hasil isolasi dan identifikasi VND di wilayah Jawa Timur 19
DAFTAR GAMBAR
1 Struktur virus dilihat dari mikroskop elektron 4
2 Struktur virus ND 4
3 Struktur genom Newcastle disease 5
4 Diagram skematis glycoprotein F 5
5 Model perubahan bentuk HN dan memicu protein F 7
6 Siklus hidup VND 8
7 Gejala klinis dari penyakit ND pada unggas 9
8 Lokasi pengambilan sampel 11
9 Penampakan embrio secara makroskopis 15
1
PENDAHULUAN
Latar Belakang
Sektor peternakan unggas merupakan bidang yang banyak diminati di Indonesia, terutama di pulau Jawa. Nilai ekonomis dan teknik dalam beternak unggas yang relatif mudah, merupakan alasan masyarakat Indonesia secara umum memilih untuk beternak unggas. Usaha peternakan ayam komersial saat ini telah mencapai kemajuan yang signifikan, namun terdapat beberapa kendala yang mengancam produktivitas, diantaranya yang paling fatal adalah serangan wabah penyakit menular (Tarmudji 2005). Satu diantara penyakit yang paling umum menyerang unggas adalah virus Newcastle disease.
Wabah Newcastle disease (ND) pertama kali terjadi di Jawa, Indonesia dan Newcastle Upon Tyne, Inggris yang dilaporkan sekitar pertengahan tahun 1920 (Dortmans et al. 2011). Menurut The Center for Food Security and Public Health
(CFSPH) (2008) hanya dalam beberapa tahun kemudian virus ND ini mulai menyebar hampir ke seluruh dunia dan menjadi endemik di beberapa negara. Data yang dilaporkan office International Des Epizooties Zoonisatory Code (OIE) (2015) dalam kejadian ND di Bali, Indonesia pada tahun 2007, sekitar 1500 hingga 8000 ekor ayam terinfeksi setiap bulannya, sedangkan kasus di Jawa Timur dilaporkan sekitar 100 sampai 1500 ekor unggas terinfeksi tiap bulan dan melonjak menjadi 14000 kasus pada Februari 2011. Kasus di Indonesia setiap tahun selalu muncul namun tidak sebanding dengan laporan tentang isolat asal Indonesia itu sendiri secara rinci dan akurat. Beberapa laporan mengenai isolat yang berhasil dikoleksi di Indonesia yaitu, tahun 2009 isolat tersebut bernama NDV/Bali-1/07 yang merupakan isolat strain velogeni dengan indeks patogenisitas mean death time (MDT) 54 jam (Adi et al. 2011), tahun 2013 telah ditemukan virus ND di daerah Tangerang (Emilia et al. 2015) dan Jakarta (genotipe XIII) (Forrester et al. 2013), tahun 2014 di Aceh (Darniati 2014) dan tahun 2015 ditemukan di beberapa kecamatan di Kabupaten Subang (Panus et al.
2015).
Virus ND tergolong dalam Avian paramyxovirus serotipe 1 (APMV-1), dan terbagi menjadi kelas I dan kelas II. Kedua kelas tersebut memiliki jumlah genotipe yang berbeda yaitu untuk kelas I hanya mempunyai 1 genotipe dan kelas II dibagi menjadi 18 genotipe (genotipe I-XVIII) (Snoeck et al. 2013). Kelas I hanya terdiri dari strain virus ND avirulen yang banyak ditemukan pada unggas air. Sedangkan kelas II terdari dari strain virus ND yang avirulen dan virulen (Cattoli et al. 2010). Kelompok kelas II banyak ditemukan pada ayam, burung peliharaan, dan unggas air (Dortmans et al. 2011). RNA genom virus ini
mengandung enam gen utama yang mengkode protein struktural 3ʹ -NP-P-M-F-HN-L-5ʹ dan dua protein non struktural W dan V (Gambar 3) (Chambers et al.
1986). Strain virus yang bersifat avirulen dan virulen dapat dibedakan dari sekuen motif cleavage site pada protein F. Strain virus yang avirulen (lentogenik) memiliki asam amino monobasic pada protein F yaitu 112 G-R/K-Q-G-R↓L117 dan strain virus virulen (mesogenik dan velogenik) memiliki asam amino multibasic
2
Jawa timur merupakan wilayah kedua setelah Jawa Barat yang memiliki populasi ternak unggas terbanyak, dengan total populasi 265 juta ekor (BPS (2015). Probolinggo, Situbondo, dan Bondowoso, kabupaten di Jawa Timur, secara umum memiliki sistem pemeliharaan unggas secara backyard atau dikenal sebagai peternakan sektor 4 dengan penanganan biosecurity yang sangat lemah. Ketiga kabupaten ini juga didominasi dengan pasar unggas hidup yang dinilai kurang higienis. Kondisi pasar unggas hidup juga diperhitungkan kontribusinya dalam penyebaran penyakit, karena hampir semua pasar unggas hidup di Indonesia tidak memiliki sanitasi yang maksimal sehingga kemungkinan adanya kontaminan cukup tinggi. Unggas yang diperdagangkan pada pasar unggas hidup juga tidak didukung dengan informasi yang jelas tentang asal kedatangannya maupun ada tidaknya infeksi penyakit pada unggas tersebut. Oleh karena itu, unggas yang terinfeksi dalam pasar unggas maupun dari luar pasar mampu mentransmisikan penyakit dengan mudah. Penelitian sebelumnya oleh Susta et al.
(2010)ditemukan beberapa isolat positif yang didapatkan dari pasar unggas hidup dan peternakan dengan tidak menunjukkan gejala secara klinis.
Perumusan Masalah
Data OIE (2015) menyatakan bahwa Indonesia masih belum terbebas dari serangan VND. Beberapa daerah di Indonesia khususnya Jawa Timur minim informasi rinci dan akurat mengenai identitas dan karakter virus ND ini. Deteksi dan isolasi virus perlu dilakukan untuk mengetahui virus yang bersirkulasi di lapangan menggunakan teknologi yang sensitif dan spesifik, selain itu diperlukan karakterisasi virus untuk mengetahui keragaman dan sifat patogenisitasnya.
Tujuan Penelitian
Penelitian ini secara umum bertujuan untuk mengkaji karakter VND yang bersirkulasi di beberapa wilayah kabupaten Probolinggo, Situbondo, Bondowoso. Secara khusus penelitian ini bertujuan untuk mendeteksi, mengisolasi serta mengidentifikasi patotipe VNDsecara molekuler di tiga kabupaten tersebut.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan data referensi tentang karakter VND yang bersirkulasi di beberapa wilayah kabupaten Probolinggo, Situbondo, dan Bondowoso sebagai masukan bagi pemerintah setempat dalam mengatur sistem pemeliharaan dan sistem pemasaran sebagai pengendalian penyebaran penyakit yang efektif.
Ruang Lingkup Penelitian
Penelitian ini dilakukan serangkaian kegiatan yaitu koleksi sampel swab kloaka dari beberapa jenis unggas (ayam kampung, ayam bangkok, bebek, entok, ayam broiler, dan ayam arab) yang diambil dari beberapa lokasi di kabupaten Probolinggo, Situbondo, dan Bondowoso, pooling sampel usapan, isolasi VND pada telur berembrio (TAB) spesific pathogen free (SPF), Uji haemaglutination
3
matrix, dan karakterisasi VND dengan uji haemaglutination inhibition (HI), rRT-PCR fusion, serta uji elusi.
2
TINJAUAN PUSTAKA
Newcastle disease (ND)
Newcastle disease (ND) merupakan penyakit infeksius yang banyak ditemukan di wilayah peternakan. Penyakit ini menyebar sangat luas hampir diseluruh dunia dan berdampak pada sektor ekonomi dan berakibat terjadi penurunan dalam industri peternakan dalam hal ini usaha unggas (Dortmans 2011). Virus Newcastle disease, sebagai agen penyebab, mampu menginfeksi lebih dari 240 spesies unggas yang penyebarannya dengan berinteraksi langsung antar unggas yang terinfeksi dengan unggas yang sehat (CFSPH 2008).
Wabah pertama yang disebabkan oleh virus ND terjadi di Jawa, Indonesia dan Newcastle Upon Tyne, Inggris yang dilaporkan sekitar pertengahan tahun 1920 (Dortmans et al. 2011). Beberapa tahun kemudian virus ND ini mulai termasuk dalam subfamili Paramyxovirinae, famili Paramyxoviridae.
Paramyxovirus diisolasi dari spesies unggas yang telah diklasifikasikan dengan uji serologis dan memiliki sembilan serotipe diantaranya APMV-1 hingga APMV-9. Selain itu, terdapat isolat yang telah diduga dikelompokkan menjadi golongan APMV-10 hingga APMV-13 (Terregino et al. 2013; Yamamoto et al.
2015; Goraichuk et al. 2016) dan untuk virus ND merupakan golongan APMV-1 (Alexander 2000). Strain virus ND memiliki perbedaan gejala klinis yang dihasilkan pada ayam yang terinfeksi.
Patotipe VND terbagi berdasarkan gejala klinis pada unggas yaitu velogenik, mesogenik, lentogenik, dan asymptomatic enteric. Velogenik menyebabkan kematian cukup tinggi pada unggas. Patotipe velogenik dibagi menjadi dua yaitu viscerotropic velogenic Newcastle disease (vvND) yang mengakibatkan lesi hemoragi pada saluran pencernaan serta neurotropic velogenic
Newcastle disease (nvND) yang mengakibatkan gangguan saraf (Miller dan Koch 2013).
Sruktur dan genom virus
4
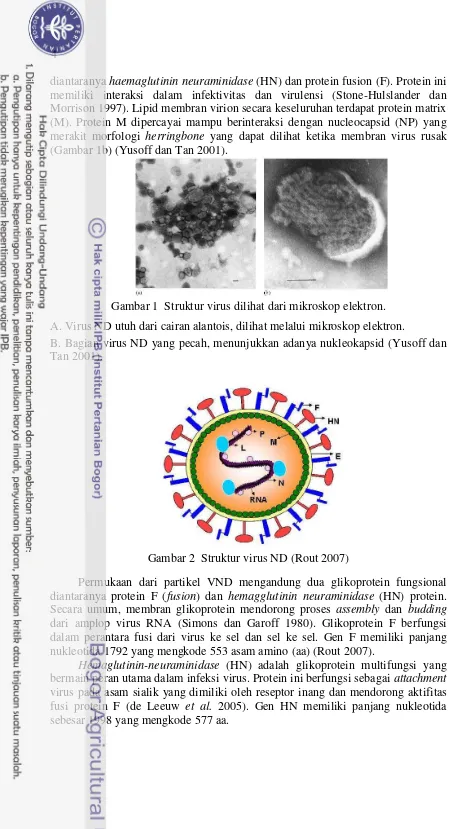
diantaranya haemaglutinin neuraminidase (HN) dan protein fusion (F). Protein ini memiliki interaksi dalam infektivitas dan virulensi (Stone-Hulslander dan Morrison 1997). Lipid membran virion secara keseluruhan terdapat protein matrix (M). Protein M dipercayai mampu berinteraksi dengan nucleocapsid (NP) yang merakit morfologi herringbone yang dapat dilihat ketika membran virus rusak (Gambar 1b) (Yusoff dan Tan 2001).
Gambar 1 Struktur virus dilihat dari mikroskop elektron. A. Virus ND utuh dari cairan alantois, dilihat melalui mikroskop elektron.
B. Bagian virus ND yang pecah, menunjukkan adanya nukleokapsid (Yusoff dan Tan 2001).
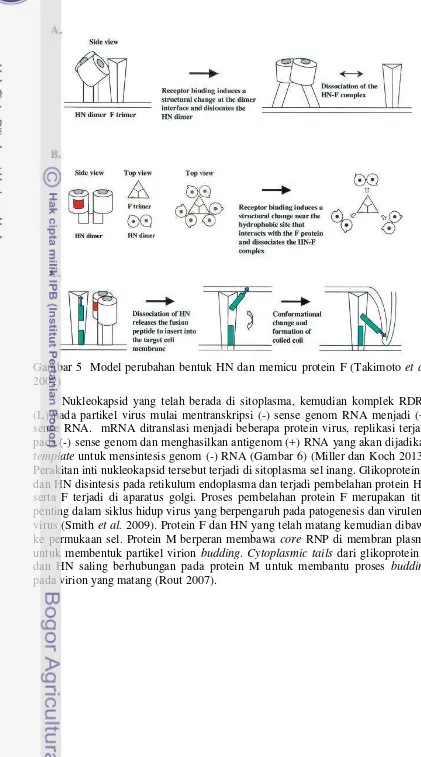
Gambar 2 Struktur virus ND (Rout 2007)
Permukaan dari partikel VND mengandung dua glikoprotein fungsional diantaranya protein F (fusion) dan hemagglutinin neuraminidase (HN) protein. Secara umum, membran glikoprotein mendorong proses assembly dan budding
dari amplop virus RNA (Simons dan Garoff 1980). Glikoprotein F berfungsi dalam perantara fusi dari virus ke sel dan sel ke sel. Gen F memiliki panjang nukleotida 1792 yang mengkode 553 asam amino (aa) (Rout 2007).
Hemaglutinin-neuraminidase (HN) adalah glikoprotein multifungsi yang bermain peran utama dalam infeksi virus. Protein ini berfungsi sebagai attachment
5 Gen Nucleocapsid (NP) dari VND memiliki panjang nukleotida 1747 (Rout 2007) yang mengkode 489 aa dengan berat molekul 54 kDa. Protein NP saling berhubungan dengan protein P dan L selama proses transkripsi dan replikasi. Protein NP juga berinteraksi dengan protein M pada saat proses perakitan virus. Protein L adalah protein struktural terbesar yang mengkode 2204 aa dengan berat molekul sekitar 249 kDa. Selain itu terdapat protein V dan W yang merupakan protein nonstruktural. Protein L dalam hal ini memiliki komponen utama dari
RNA-dependent RNApolymerase (RDRP). (Yusoff dan Tan 2001).
Virus ND dikelompokkan menjadi 2 kelas berdasarkan kandungan nukleotida genomnya yaitu : kelas I terdiri dari 15198 nukleotida dan kelas II terdiri dari 15186 atau 15192 nukleotida. Kelompok kelas II yang banyak ditemukan pada ayam, burung peliharaan, dan unggas air (Dortmans et al. 2011). genom VND mengandung enam gen utama yang mengkode protein struktural 3ʹ -NP-P-M-F-HN-L-5ʹ dan dua protein non struktural W dan V (Chambers et al.
1986).
Gambar 3 Struktur genom Newcastle disease (Huang et al. 2003)
Virulensi dan Patogenisitas
Urutan aa pada tempat pembelahan protein F telah terbukti sebagai unsur utama virulensi dari NDV tersebut (Ogasawara et al. 1992). Pembelahan pada prekursor protein F0 menjadi F1 dan F2 oleh protease sel inang sangat penting bagi virus progeny untuk menjadi infektif (Garten et al. 1980). Virus lentogenik memiliki aa monobasic pada C-terminus dari protein F2 dan leusin di N-terminus protein F1, dan pembelahannya secara ekstraseluler oleh trypsin-like protease
yang ditemukan pada saluran pernafasan dan usus. Strain mesogenik dan velogenik memiliki motif asam amino multi-basic di C-terminus protein F2 dan fenilalanin pada N-terminus dari protein F1, dapat membelah secara intraseluler oleh ubiquitous furin-like protease (Gambar 4) (Ogasawara et al. 1992).
Gambar 4 Diagram skematis glycoprotein F (Yusoff dan Tan 2001) Penentu virulensi dari VND bisa dilihat dari aa pada motif cleavage site
pada protein F. Strain virus yang avirulen (lentogenik) memiliki asam amino
monobasic pada protein F yaitu 112 G-R/K-Q-G-R↓L117 dan strain virus virulen (mesogenik dan velogenik) memiliki asam amino multibasic pada protein F yaitu
112
6
Tabel 1 Jenis motif cleavage site pada VND
Tipe Patogenisitas Motif cleavage site Referensi
Avirulen sebagai mediasi terjadinya fusi (Takimoto et al. 2002). Perubahan aa protein HN atau konstruksi rekombinan HN, beberapa penelitian menunjukkan adanya efek dari fungsi HN pada patogenisitasnya (de Leeuw et al. 2005). Mutasi dari protein ini menurut (McGinnes dan Morrison 1994) berefek pada aktifitas penempelan dan aktifitas pada saat proses fusi. Sebaliknya, terdapat penelitian dengan menggunakan metode penelitian yang sama tetapi menggunakan strain NDV yang berbeda, menunjukkan bahwa protein HN tidak memiliki efek pada virulensi (Aldous et al. 2004).
Replikasi VND
Tahap awal infeksi VND melalui proses protein attachment dalam hal ini protein HN dengan reseptor permukaan sel yaitu asam sialik. Ikatan reseptor mempengaruhi perubahan bentuk HN dan F menjadi komplek HN-F. Perubahan konformasi protein HN kemudian memberikan sinyal pada protein F untuk memulai proses fusi. Peptida fusi masuk ke dalam membran sel inang (target) kemudian membentuk triple-helix coiled-coil dengan menggabungkan dua membran (Gambar 5) (Takimoto et al. 2002). Amplop virus akan melebur (fusi) dengan membran plasma inang yang diperantarai oleh protein F (Dimitrov 2004). Protein HN juga memiliki aktivitas enzim neuraminidase. Fungsi neuraminidase dalam replikasi virus belum diketahui secara pasti, akan tetapi memiliki fungsi melepaskan reseptor virus dari sel inang untuk mencegah terjadinya reattachment
dan aggregation (Alexander 2016). Matrix-nucleocapsid akan mengalami
7
Gambar 5 Model perubahan bentuk HN dan memicu protein F (Takimoto et al.
2002)
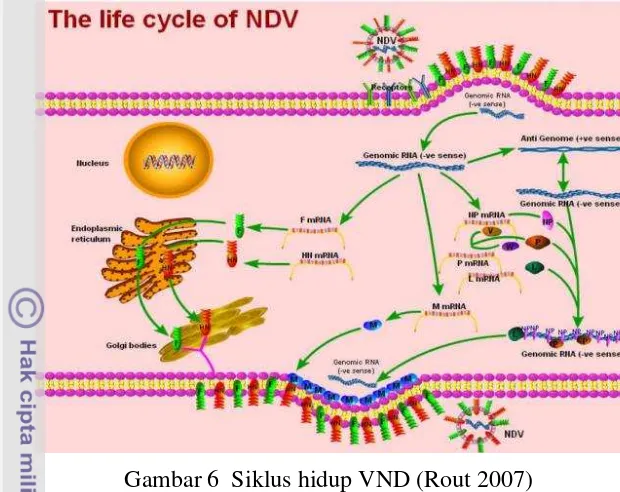
Nukleokapsid yang telah berada di sitoplasma, kemudian komplek RDRP (L) pada partikel virus mulai mentranskripsi (-) sense genom RNA menjadi (+) sense RNA. mRNA ditranslasi menjadi beberapa protein virus, replikasi terjadi pada (-) sense genom dan menghasilkan antigenom (+) RNA yang akan dijadikan
template untuk mensintesis genom (-) RNA (Gambar 6) (Miller dan Koch 2013). Perakitan inti nukleokapsid tersebut terjadi di sitoplasma sel inang. Glikoprotein F dan HN disintesis pada retikulum endoplasma dan terjadi pembelahan protein HN serta F terjadi di aparatus golgi. Proses pembelahan protein F merupakan titik penting dalam siklus hidup virus yang berpengaruh pada patogenesis dan virulensi virus (Smith et al. 2009). Protein F dan HN yang telah matang kemudian dibawa ke permukaan sel. Protein M berperan membawa core RNP di membran plasma untuk membentuk partikel virion budding. Cytoplasmic tails dari glikoprotein F dan HN saling berhubungan pada protein M untuk membantu proses budding
8
Gambar 6 Siklus hidup VND (Rout 2007)
Transmisi
Transmisi virus terjadi melalui kontak langsung antara unggas sehat dan unggas yang terinfeksi maupun pada benda-benda yang terkontaminasi. Rute transmisi bisa melalui feses yang terdapat agen infeksi atau inhalasi droplet yang mengandung virus. Replikasi virus yang terjadi di saluran pernafasan pada unggas yang terinfeksi diikuti dengan adanya virus selama nasal discharge. Replikasi yang terjadi pada saluran pernafasan unggas yang baru terinfeksi memiliki potensial menyebarkan virus dengan mudah dalam satu kandang (Hines dan Miller 2012).
Pasar unggas hidup tradisional dapat berkontribusi sebagai sumber dan penyebaran virus. Unggas hidup yang dijual di pasar memiliki resiko menularkan atau tertular, dilihat dari kondisi pasar tradisional yang cenderung tidak memiliki sanitasi yang maksimal. Selain itu unggas liar juga mampu mentransmisikan NDV melalui kontak langsung, dan makanan atau minuman yang terkontaminasi (Hines dan Miller 2012).
Masa Inkubasi
Masa inkubasi VND pada unggas sangat bervariasi tergantung pada beberapa faktor. VND memiliki kisaran masa inkubasi sekitar tiga hingga enam hari berdasarkan imunitas inang, jumlah, dan jenis patotipe virus yang menyerang (Kapczynski et al. 2013). Kondisi lingkungan, stres pada unggas, dan rute transmisi virus juga diperhitungkan sebagai penentu panjangnya masa inkubasi (Hines dan Miller 2012).
Gejala Klinis
9 dalam jumlah yang sedikit di daerah saluran pencernaan maka infeksi virus ini disebut Asymptomatic enteric yang tidak menunjukkan gejala klinis (Hines dan Miller 2012). LoVND disebut juga lentogenik VND dengan tidak menunjukkan gejala klinis pada unggas dewasa, akan tetapi mengakibatkan penyakit pernafasan
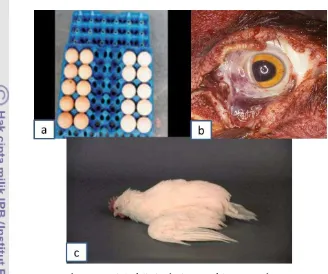
Gambar 7 Gejala klinis dari penyakit ND pada unggas
a. warna telur memudar b. Hemoragi pada area mata c. Otot sayap dan leher mulai kaku dan tremor pada sayap (Capua dan Terregino 2011; Anonim 2012; [CFSPH] 2016).
yang cukup serius pada unggas muda. Virus lentogenik yang diinfeksikan pada
day old chicks (DOC) umur satu hingga tujuh hari akan menunjukkan penurunan nafsu makan serta gangguan pernafasan (Capua dan Terregino 2011).
Virus mesogenik dapat menyebabkan infeksi secara sistemik dan gangguan sistem pernafasan. Penurunan produksi telur dan perubahan pigmen telur (Gambar 7) bisa disebabkan oleh virus mesogenik. Gangguan pada sistem saraf sangat jarang terjadi, akan tetapi virus ini mampu mengakibatkan kematian (Hines dan Miller 2012).
Velogenik VND dapat menyebabkan infeksi sistemik dan morbiditas hingga mortalitas dalam jumlah besar. Velogenik VND terbagi menjadi dua yaitu
velogenic viscerotropic ND (vvND) dan velogenic neurotropic (vnND). vvND dapat menyebabkan infeksi akut pada mukosa gastrointestinal sehingga menghasilkan lesi hemoragik dan kematian. Gejala klinis yang ditimbulkan adalah lesu, meningkatnya laju pernafasan, diare dengan feses berwarna hijau, kejang otot, kelumpuhan dan mortalitas dapat terjadi hingga mencapai 100 % (Hines dan Miller 2012).
10
100 % dan mortilitas dapat mencapai 50 %, akan tetapi pada unggas muda mampu mencapai 90 % (Capua dan Terregino 2011; Hines dan Miller 2012).
Diagnosa Laboratorium
Diagnosa laboratorium dibutuhkan untuk mengetahui konfirmasi dan patotipe dari VND tersebut. Beberapa teknik yang banyak digunakan adalah isolasi virus, HI, Elisa, PCR, sekuensing, dan nilai indeks patogenisitas. Isolasi virus biasanya berasal dari usapan kloaka, trakea, dan feses pada unggas yang masih hidup atau organ dari unggas yang telah mati (OIE 2012).
Teknik serologi yang paling umum digunakan adalah uji HI dan Enzyme-linked immunosorbent assay (ELISA) untuk menentukan titer antibodi yang berasal dari respon imunitas tubuh setelah infeksi maupun vaksinasi. ELISA memiliki beberapa metode dalam mendeteksi antibodi VND yaitu indirect,
sandwich, dan competitive ELISA menggunakan Mouse monoclonal antibodies
(MAbs) (OIE 2012). Penelitian yang dilakukan oleh Phan et al. (2013) menggunakan uji HI dan C-ELISA dengan menunjukkan bahwa C-ELISA memiliki tingkat kesensitifan lebih tinggi daripada uji HI.
Patogenisitas virus dapat dilihat melalui beberapa metode yang dilakukan yaitu mean death time (MDT), intravenous pathogenicity index (IVPI), dan
intracerebral pathogenicity index (ICPI) (Hines dan Miller 2012). Sekuensing dapat digunakan yang kemudian untuk menulusuri asam amino dari protein F dan HN sebagai penentu virulensi dari VND tersebut (Hu et al. 2010; Dortmans 2011).
Teknik real-time reverse transcriptase PCR (rRT-PCR) sudah banyak digunakan untuk mendeteksi NDV. Pengujiannya berdasarkan flouresen yang merupakan perangkat rRT-PCR untuk mendeteksi ribonuclease acid (RNA),
deoxyribunucleic acid (DNA), complementary DNA (cDNA). rRT-PCR lebih menguntungkan karena mengurangi resiko kontaminasi silang, lebih cepat, dan ramah lingkungan (Hoffmann et al. 2009). Teknik ini menggunakan probe
spesifik yang berguna dalam peningkatan sensitifitas dibandingkan dengan konvensional PCR.
Pengendalian Penyakit
VND merupakan penyakit infeksius pada unggas yang berpotensi menurunkan nilai secara ekonomi pada industri peternakan unggas. Wabah VND mampu menyebar dengan cepat dan mengakibatkan mortalitas hingga mencapai 50 – 100 % (Dortmans 2011). Pengendalian VND dilakukan dengan pemberian vaksin pada unggas dan kontrol biosekuriti.
Terdapat tiga tipe vaksin untuk VND yaitu live lentogenic, live mesogenic, dan vaksin inaktif. Virus live lentogenic yang banyak digunakan yaitu Hitchner-B1, LaSota, V4, NDW, I2, sedangkan virus live mesogenic yaitu Roakin,
Mukteswar, dan Komarov. Vaksin rekombinan juga banyak dikembangkan dengan mengandalkan dua protein yang paling berpengaruh dalam sifat patogenesis yaitu protein F dan protein HN (Alexander et al. 2004; OIE 2012).
11 peternakan unggas, pemisahan unggas yang berbeda spesies, meminimalisasi pergerakan keluar masuk peternakan, dan semua alat yang akan digunakan harus dilakukan penyemprotan disinfektan sebelum digunakan.
Menurut FAO (2015) pengelolaan pasar unggas hidup juga perlu diterapkan untuk meminimalisir penyebaran penyakit. Pengelolaan pasar unggas diantaranya memisahkan lokasi pasar dengan area publik, memisahkan dengan unggas liar, tidak mencampur semua spesies yang berbeda dalam satu kandang, pembersihan dan desinfektan pada truk, kandang, dan alat-alat yang digunakan sebelum keluar maupun masuk pasar, program kontrol untuk serangga dan rodensia, serta semua pasar unggas harus mendapatkan pelaksanaan standar biosekuriti dari dokter hewan dan kesehatan masyarakat.
3
METODE
Waktu dan Tempat Penelitian
Pengambilan sampel penelitian dilakukan di pekarangan, pengepul, peternak, dan pasar unggas di wilayah Kabupaten Probolinggo, Situbondo, dan Bondowoso di Provinsi Jawa Timur (Gambar 8). Penelitian ini dilaksanakan di bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesmavet Fakultas Kedokteran Hewan IPB.
Gambar 8 Lokasi pengambilan sampel Kabupaten Probolinggo : 1. Semampir
2. Gending
Kabupaten Situbondo : 1. Bungatan (Paling Barat) 2. Asembagus (Paling timur) Kabupaten Bondowoso : 1. Prajekan
12
Alat dan Bahan
Alat dan bahan yang digunakan adalah TAB specific pathogen free (SPF) berumur sembilan hari, penisilin, streptomisin, dan alkohol. Red blood cell (RBC) ayam, phosphat buffer saline (PBS), cotton swab dan media transport brain heart infusion broth (BHIB). Peralatan yang digunakan yaitu mikropipet, mikrotip, spuit 1 cc, spuit 5 cc, plat mikrotitrasi, freezer, refrigerator, sentrifus, vortex, inkubator, dan biosafety cabinet (BSC).
Metode Penelitian
Pengambilan sampel usap kloaka
Sampel diambil dari 289 ekor unggas yang tidak menunjukkan gejala klinis yang berasal dari pekarangan, pedagang di pasar unggas hidup, peternakan komersial, dan pengepul. Sampel usapan kloaka diambil dari 129 ayam kampung, 77 ayam pedaging, 40 ayam bangkok, 10 ayam arab, empat ekor ayam petelur, dua ekor ayam ketawa, 20 itik, dan tujuh ekor entok yang berasal dari pekarangan, peternakan, pengepul, dan pasar unggas.
Sampel ditransportasikan dalam BHIB dengan menjaga rantai dingin (antara 4–8 °C) dan dibawa ke laboratorium kemudian disimpan di frezeer (-20 °C) sampai saat akan dilakukan pengujian. Beberapa sampel (5–7 individu) di-pool
berdasarkan tempat pengambilan dan jenis unggas, masing- masing 100 µl tiap individu.
Isolasi virus pada telur ayam berembrio
Isolasi virus dilakukan dengan menginokulasikan sampel pool yang telah ditambahkan 10 000 IU/ml penisilin dan 10 mg/ml streptomisin pada TAB SPF berumur 9 hari melalui ruang alantois. Inkubasi TAB dilakukan selama 4 hingga 7 hari pada suhu 37 °C (OIE 2012). Pengamatan dilakukan setiap 8 jam dan TAB yang mati disimpan di dalam refrigerator. Cairan alantois dipanen dan diuji ada tidaknya aktivitas virus dengan uji HA dan rRT-PCR sebagai peneguhan bahwa virus yang terisolasi adalah VND. Sampel pool yang terdeteksi positif dengan PCR selanjutnya diinokulasi kembali secara individu.
Uji Haemagglutination (HA) (OIE 2012)
Larutan PBS sebanyak 25 µl dimasukkan ke dalam setiap sumuran. Sumuran pertama diisi 25 µl sampel cairan alantois yang telah dipanen. Kemudian dilakukan pengenceran hingga sumuran ke-11 dan ditambahkan kembali PBS 25 µl pada setiap sumuran. Sel darah merah (SDM) 1 % sebanyak 25 µl ditambahkan pada setiap sumuran. Selanjutnya dihomogenkan secara perlahan yang kemudian diinkubasi selama 40 menit pada suhu ruang. Hasil positif ditunjukkan dengan adanya aglutinasi dari sel darah merah pada dasar sumuran plat yang terlihat seperti pasir.
Uji Haemagglutination Inhibition (HI) (OIE 2012)
13 menit. Suspensi sel darah merah 1 % sebanyak 25 µl ditambahkan ke dalam semua sumuran dan digoyang secara perlahan yang selanjutnya ditempatkan pada suhu ruang. Reaksi dibaca setelah 30 sampai 60 menit, hasil positif ditunjukkan dengan terbentuknya tear drop pada saat plat dimiringkan.
Isolasi RNA
Isolasi RNA virus dari sampel usap kloaka menggunakan High Pure Viral Nucleic Acid Kit (Roche®). Sampel usap kloaka sebanyak 200 µl terlebih dahulu dipersiapkan pada mikrotube 2 ml yang kemudian ditambahkan working solution
200 µl dan 50 µl Proteinase K. Sampel diinkubasi pada 72 °C selama 10 menit dan dilanjutkan dengan penambahan 100 µl binding buffer, kemudian dihomogenkan. Suspensi dipindahkan pada High pure filter tube kemudian disentrifugasi selama 1 menit 8000 g. Supernatan dibuang, kemudian ditambahkan 500 µl inhibitor removal buffer, dan disentrifugasi selama 1 menit 8000 g. Supernatan dibuang, kemudian ditambahkan 450 µl wash buffer dan disentrifugasi selama 1 menit 8000 g (supernatan dibuang dan ulangi tahap berikut). Supernatan dibuang kemudian disentrifugasi selama 10 detik 13000 g.
Filter tube dipindahkan ke mikrotube baru dan ditambahkan 50 µl elution buffer
selanjutnya di inkubasi selama 10 menit. Tahap terakhir dilakukan sentrifugasi 8000 g selama 1 menit. RNA yang berhasil diisolasi kemudian disimpan dalam
freezer -80 °C sampai saat akan dilakukan pengujian.
Uji Real-Time Reverse-Transcriptation Polymerase Chain Reaction (rRT-PCR)
Amplifikasi rRT-PCR menggunakan Ag-Path ID TM One-Step RT-PCR kit
dari Ambion®. Primer dan probe yang digunakan ditunjukkan pada Tabel 2. Proses amplifikasi dibaca menggunakan perangkat Applied Biosystems 7500 Real-Time PCR System.
Tabel 2 Primer dan probe untuk mendeteksi VND dengan rRT-PCR
Gen Target Primer/probe
14
waktu elusi dilakukan pada sumuran terakhir dengan aglutinasi sempurna, sampai virus mulai melepaskan eritrosit ditunjukkan dengan munculnya tears drop.
Sekuensing
Isolat positif berdasarkan rRT-PCR diamplifikasi menggunakan primer
forward 4100 ʹ5-AGTGATGTGCTCGGACCTTC-3ʹ (Wise et al. 2004) dan
reverse 5090 ʹ5-TCATTAACAAAYTGCTGCATCTTCCCWAC-3ʹ (Kim et al.
2007). Produk PCR dielektroforesis pada gel agarosa 1 % pada tegangan 120 V selama 35 menit. Pita amplikon berada pada 990 base pair (bp) dan dipurifikasi dengan QIAquick gel extraction kit (Qiagen). Sekuensing dilakukan menggunakan BigDye® Terminator v3.1 cycle sequencing kit (ThermoFisher Scientific). Analisis sekuen dilakukan dengan program Bioedit 7.2.5.
Analisis Data
Seluruh data yang diperoleh dari penelitian ini dianalisa secara deskriptif berdasarkan uji HI, hasil rRT-PCR dan motif cleavage site.
4
HASIL DAN PEMBAHASAN
Isolasi virus pada telur ayam berembrio
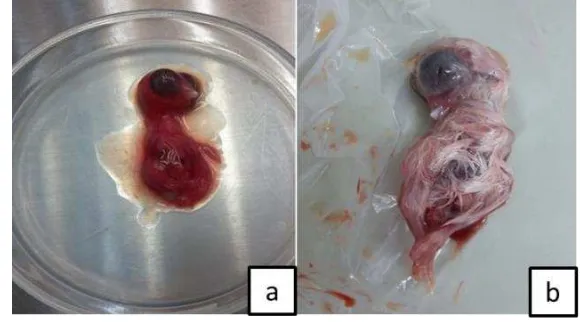
Sampel usap kloaka sebanyak 289 dijadikan satu pool sesuai dengan tempat pengambilan dan jenis unggas yang dalam satu pool terdiri dari 5–7 sampel individu. Terdapat 56 sampel pool yang diinokulasikan ke dalam TAB SPF, kemudian didapatkan enam sampel pool yang mengakibatkan kematian pada TAB. Embrio yang mengalami kematian memiliki warna kemerahan diseluruh tubuhnya, berbeda pada embrio yang normal tanpa adanya infeksi. Menurut Khorajiya et al. (2015) embrio yang diinfeksikan dengan isolat virus ND, akan menimbulkan gross lesi dan hemoragi hampir diseluruh permukaan tubuh, terutama pada bagian kepala. Pertumbuhan VND virulen akan merusak sel – sel epitel, makrofag, endotel, dan akan menyebar ke seluruh bagian tubuh embrio sehingga mengakibatkan hemoragi pada tubuh embrio tersebut dan menyebabkan kematian embrio (Wibowo et al. 2012).
15
Gambar 9 Penampakan embrio secara makroskopis Embrio yang mengalami kematian (a) Embrio normal (b)
Rentang waktu kematian embrio pada penelitian ini berkisar antara 40 hingga 94 jam yang mengindikasikan bahwa virus tergolong ke dalam virus galur ganas (mesogenik atau velogenik). Secara makroskopis, hampir semua embrio yang mati memiliki kondisi munculnya kemerahan atau hemoragi di seluruh tubuhnya (Gambar 9), hal ini sesuai dengan penelitian Darniati (2014) bahwa kisaran waktu kematian antara 45 hingga 70 jam memperlihatkan perubahan embrio yang lebih parah daripada pada embrio yang mati pada waktu 125 jam.
Etriwati (2015) menemukan bahwa infeksi VND isolat lapang mampu menyebar secara sistemik pada organ interna ayam. Gejala klinis yang muncul berupa depresi, diare hijau-keputihan, penurunan nafsu makan, dan kematian. Hemoragi dan edema ditemukan pada usus dan organ lainnya. Penyebaran VND yang sangat tinggi pada organ interna ditemukan pada saluran pernafasan, pencernaan, organ syaraf hingga otak.
Cairan alantois dari keenam sampel pool dikoleksi dan dideteksi menggunakan metode rRT-PCR gen M dengan hasil enam sampel pool tersebut positif amplifikasi. Sampel pool yang terdeteksi positif dengan PCR selanjutnya diinokulasi kembali secara individu dan didapatkan hasil tujuh sampel individu positif mengakibatkan kematian pada TAB. Akan tetapi pada hasil uji HA, isolat 3A menunjukkan negatif HA dengan kematian embrio dan IDNSMP-4A positif HA namun embrio tidak mati, sehingga dilakukan inokulasi kembali pada TAB. Total akhir isolat yang didapatkan berdasarkan positif HA dan kematian embrio adalah delapan isolat.
Patotipe secara molekuler
16
Tabel 3 Hasil deteksi VND dengan rRT-PCR
Kota/Kab Kec Nama isolat Lokasi Unggas
Prajekan IDNPRJ-2A Pasar Ayam kampung 26.79 33.75
Wonosari IDNWON-4A Pasar Ayam kampung 19.33 29.61
IDNWON-5A Pasar Ayam kampung 26.02 36.39
Grujugan IDNDDP-1A Pasar Ayam kampung 27.92 33.15
IDNDDP-2B Pasar Ayam kampung 19.93 33.99
positif dan Nilai 0 dianggap negatif (Farkas et al. 2009).
Metode diagnostik yang banyak digunakan dan berkembang cepat yaitu metode rRT-PCR. rRT-PCR merupakan metode cepat yang memberikan hasil dengan sensitifitas tinggi (Wise et al. 2004). Secara umum penentuan patotipe secara molekuler pada VND dilakukan pada gen F, karena pada gen ini terdapat prekursor cleavage yang berperan pada sifat patogenisitas dari VND tersebut. Akan tetapi kegagalan deteksi juga bisa terjadi karena tidak adanya kecocokan antara primer atau probe dengan template cDNA sampel (Cattoli et al. 2011). Selain itu, keragaman genetik dan perubahan asam amino (subtitusi atau mutasi) dapat menyebabkan kegagalan deteksi yang disebabkan oleh primer dan probe yang telah di desain tidak terdapat kecocokan dengan template sampel.
Hasil positif delapan isolat tersebut selanjutnya dilakukan pengujian HI dan sekuensing untuk mengetahui konfirmasi secara pasti bahwa virus tersebut bersifat galur ganas sesuai dengan hasil positif rRT-PCR menggunakan gen F.
Karakter antigenisistas VND dengan uji Hemaglutination Inhibition (HI)
17
Gambar 10 Titer HI menggunakan antiserum standar Komarov dan B1
Uji HI dengan menggunakan antiserum B1 menunjukkan reaksi yang lebih beragam daripada antiserum Komarov, akan tetapi afinitas semua isolat bereaksi lebih tinggi pada antiserum Komarov. Afinitas lebih tinggi pada antiserum Komarov sesuai dengan hasil positif pada perlakuan rRT-PCR dengan menggunakan primer Fusion yang mengindikasikan semua isolat termasuk dalam galur ganas. Isolat dinyatakan jika titer HI menunjukkan 4 log 2 pada 4 HAU atau 3 log 2 pada 8 HAU. Uji HI digunakan untuk mendeteksi ada tidaknya virus ND dengan menggunakan serum spesifik berdasarkan (OIE 2012).
Menurut Miller et al. (2013)penggunaan vaksin yang homolog tidak hanya meningkatkan titer antibodi unggas akan tetapi juga akan menurunkan replikasi dari virus tersebut. Titer antibodi akan terbentuk tinggi ketika virus dan serum yang terbentuk bersifat homolog. Akan tetapi antibodi tidak akan memiliki afinitas yang sempurna apabila virus yang menginfeksi memiliki keragaman epitop pada protein eksternalnya berbeda dengan galur virus yang menggertak antibodi unggas. Menurut Cornax et al. (2012) vaksin LaSota heterolog tidak efektif dalam mencegah replikasi virus pada dosis protektif (103 hingga 105).
Variasi genetik epitop protein HN dari VND dapat diketahui dengan uji HI, seperti halnya yang telah dilakukan oleh Hu et al. (2010) dengan menggunakan antibodi monoklonal. Ibu et al. (2008) memberikan hasil bahwa 13 isolat yang digunakan memiliki nilai R-value berdasarkan perlakuan HI lebih tinggi pada virus heterolog daripada virus homolog. Variabilitas dari antigenik virus bisa terjadi akibat adanya mutasi pada protein eksternal. Penelitian sebelumnya oleh Hu et al. (2010) bahwa adanya mutasi pada asam amino 347 protein HN menghasilkan tingkat kereaktifan yang berbeda terhadap MAbs. Protein HN merupakan bagian penting dari VND yang merupakan protein permukaan virus tersebut, sehingga patogenisitas VND tidak hanya dilihat dari protein F.
Karakter Virus dengan uji Elusi
Hasil pengamatan waktu elusi pada sampel positif VND, menunjukkan hasil yang tidak terlalu bervariasi (Tabel 4). Rata-rata waktu elusi yang telah dilakukan
18
menunjukkan bahwa 1 isolat (IDNPRJ-2A) termasuk galur mesogenik, dan 7 isolat termasuk galur velogenik. Penentuan isolat termasuk mesogenik maupun velogenik berdasarkan pada penelitian Ezeibe dan Ndip (2005), dengan rentang waktu untuk patotipe velogenik antara 84 hingga 189 menit, patotipe mesogenik antara 43 hingga 78 menit, sedangkan lentogenik antara 20 hingga 45 menit.
Uji elusi digunakan untuk melihat waktu elusi yang berhubungan dengan aktivitas dari enzim neuraminidase, dan juga berhubungan langsung dengan aktivitas dari hemagglutinin sebagai faktor virulensi virus. Patogenisitas dari
Paramyxovirus tergantung pada protein hemagglutinin neuraminidase yang terletak pada amplop virus. Aktivitas neuraminidase yang lemah akan meningkatkan aktivitas hemaglutinin sehingga dibutuhkan waktu elusi yang lebih lama (Ezeibe dan Ndip 2005). NA memiliki aktivitas mengikat molekul – molekul kecil, sedangkan pada HA berfungsi mengikat sel darah merah (Crennell et al.
2000).
Suhu ruangan berpengaruh pada lamanya waktu elusi yang terjadi, pada penelitian Ezeibe dan Ndip (2005) uji elusi dilakukan pada suhu ruang, yang dianggap suhu tersebut merupakan suhu paling stabil pada proses elusi. Berdasarkan penelitian Hussain et al. (2008) proses elusi suatu virus akan membutuhkan waktu yang cukup lama apabila dilakukan pada suhu 4 °C, sebaliknya akan membutuhkan waktu lebih singkat jika temperatur ruangan yang digunakan lebih dari 35 °C. Proses elusi yang terjadi pada virus influensa pada
turkey dengan suhu 4 °C menunjukkan inaktivasi dari NA sehingga tidak ada satupun virus yang berhasil melakukan proses elusi meskipun telah diamati selama semalaman (Giannecchini et al. 2006).
Molekul dimeric HN terbentuk dari dua kristal molekul yaitu kristal hexagonal dengan pH 6.5 yang akan terbentuk akibat interaksi dengan 2-deoxy-2,3-dehydro-Nacetyl-neuraminic acid (Neu5Ac2en) dan kristal orthorhombic dengan pH 4.6. Aktivitas NA tergantung pada triarginyl cluster (R174, R416, R498) yang diketahui mudah sekali mengalami mutasi. Perubahan pada posisi 174 menjadi glutamat, aspartat, atau glutamin menunjukkan bahwa ekspresi protein melemah dan aktivitas NA menurun. Mutasi pada R416 mengakibatkan kehilangan fungsi aktifitas dari NA dan Had, sama halnya dengan mutasi pada R498 (Connaris et al. 2002).
Karakter virus berdasarkan motif cleavage site gen F
19 b.
Gambar 11 Sekuen asam amino dan nukleotida pada cleavage site protein F a). Motif asam amino 112RRQKRF117 ditemukan pada 7 isolat b). Motif asam amino 112RRRKRF117 pada 1 isolat IDNSMP-4A
Hasil translasi sekuen nukleotida yang diperoleh memperlihatkan adanya motif asam amino multibasic pada cleavage site protein F dari delapan isolat (Gambar 11). Menurut Farkas et al. (2009), VND virulen memiliki setidaknya tiga asam amino lisin (K) dan arginin (R) antara posisi 113 dan 116 pada terminus C (motif cleavage site112R/K-R-Q-R/K-F117) dan fenilalanin (F) pada terminus N.
Sekuen asam amino pada cleavage site protein F diketahui sebagai penentu utama virulensi dari VND tersebut. Pembelahan pada daerah F0 glikoprotein menjadi F1 dan F2 oleh protease sel inang yang dibutuhkan virus untuk bereplikasi. Virus lentogenik memiliki motif asam amino monobasic yang membelah secara ekstraseluler oleh trypsin-like protease pada saluran pernafasan dan pencernaan inang. Virus mesogenik dan velogenik mempunyai motif asam amino multibasic yang membelah secara intraseluler oleh ubiquitous furin-like protease sehingga menyebabkan infeksi sistemik (Dortmans 2011).
Tabel 4 Hasil isolasi dan identifikasi VND di wilayah Jawa Timur
Nama Isolat TABª
CT : Nilai Cycle Threshold yang muncul secara otomatis pada mesin rRT-PCR.
ªWaktu kematian embrio pasca inokulasi
Perbandingan tipe patogenisitas berdasarkan rRT-PCR gen F, uji HI, dan motif cleavage site menunjukkan hasil yang seragam (Tabel 4). Berdasarkan motif
20
Perubahan satu basa nukleotida yang disebabkan mutasi mampu mengubah motif asam amino yang dihasilkan terlihat pada Gambar 11, sehingga kejadian ini biasanya dikaitkan dengan banyaknya keragaman genotipe pada virus tersebut. Snoeck et al. (2013) menunjukkan keragaman genetik dari virus ND yang bersirkulasi di daerah Afrika Tengah dan Barat dengan ditemukannya strain baru dari virus ND tersebut dan diklasifikasikan menjadi tiga genotipe yaitu XIV, XVII, dan XVIII. Jumlah asam amino yang lebih banyak pada protein F dan HN juga dapat mempengaruhi struktur dari kedua protein tersebut.
Perubahan asam amino pada motif cleavage site protein F mampu mengubah patogenisitas dari virus tersebut. Menurut Shengqing et al. (2002) isolat asal unggas air liar yang memiliki patogenisitas sangat rendah akan berubah menjadi galur ganas dengan dilakukan pasase pada TAB dan organ otak pada motif RRQKRF dengan mengubahnya menjadi GRQGRL, dan didapatkan bahwa isolat yang sama dan termasuk galur ganas akan berubah menjadi avirulen ketika terjadi perubahan pada susunan basa nukleotidanya, selain itu isolat tersebut memiliki titer HI lebih tinggi daripada vaksin komersial dan memiliki daya proteksi pada unggas yang telah diinfeksi oleh virus VND galur ganas Ban/010 (genotipe VII) dan GB Texas (genotipe II).
Analisis filogenetik menggunakan gen F dapat digunakan untuk menentukan dan mengklasifikasikan virus kedalam sub-genotipe hingga genotipe yang berbeda. Miller et al. (2015) menemukan sub-genotipe VIIi pada beberapa isolat Indonesia yang memiliki kemiripan dengan isolat yang berasal dari Israel dan Pakistan berdasarkan gen F, yang sebelumnya telah muncul sub-genotipe VIIh dan XIIIb yang menjadi panzootic di berbagai negara.
Karakter patogenisitas dari VND ini juga bisa dilihat dari protein HN. Variasi antigenik yang biasa terjadi pada VND dengan strain yang sama diakibatkan karena mutasi dari protein eksternal, salah satunya yaitu protein HN (Ibu et al. 2008). Penelitian Hu et al. (2010)menunjukkan bahwa terdapat variasi antigenik VND meskipun menggunakan empat jenis antibodi monoklonal, hal ini dikarenakan terjadi mutasi pada residu K (lisin) pada posisi 347 protein HN. Selain itu, cysteine pada asam amino HN posisi 123 berpengaruh pada aktivitas penempelan dan meningkatkan indeks patogenisitas virus tersebut (Romer-Oberdorfer et al. 2006).
21
Deteksi VND di Wilayah Jawa Timur
Virus ND ditemukan pada dua Kabupaten yaitu Probolinggo dan Bondowoso yang berasal dari ayam kampung. Menurut DISNAK (2015) kabupaten Probolinggo memiliki jumlah ayam kampung sebanyak 570 ribu ekor sedangkan jumlah ayam broiler sekitar dua juta ekor. Kabupaten Bondowoso memiliki jumlah ayam kampung sebanyak 552 ribu ekor sedangkan jumlah ayam broiler satu juta ekor. Virus ditemukan pada sampel yang diambil dari pasar unggas hidup dan tidak menunjukkan gejala klinis. Transmisi virus akan mudah menyebar dengan cepat pada unggas lain, dari mulai kontak langsung dengan unggas yang terinfeksi, maupun melalui kandang, air, pakan, dan alat-alat kandang yang terkontaminasi (Miller et al. 2013). Pasar tradisional merupakan tempat menjual unggas hidup yang didatangkan dari berbagai daerah dan tidak diketahui kondisi kesehatannya, hal ini sesuai dengan pernyataan Hines dan Miller (2012) bahwa pasar unggas hidup tradisional dapat berkontribusi sebagai sumber dan penyebaran virus. Kedelapan isolat positif diambil dari pasar unggas hidup dengan tidak menunjukkan gejala klinis, sesuai dengan Susta et al. (2010) bahwa isolat positif diambil dari pasar unggas hidup dan peternakan unggas dengan beberapa kasus tanpa gejala klinis. Gejala klinis yang ditunjukkan pada unggas tergantung pada patotipe virus, sistem imunitas inang, jumlah virus yang bereplikasi, dan beberapa faktor lainnya (Wibowo et al. 2012).
22
5
SIMPULAN DAN SARAN
Simpulan
Virus ND berhasil dideteksi dan diisolasi dari enam ekor ayam kampung dan dua ekor bebek tanpa gejala klinis yang dijual dipasar unggas hidup tradisional. Lima dari delapan isolat yang dinyatakan positif virus ND, didapatkan dari Kabupaten Bondowoso, sedangkan ketiga sampel lainnya berasal dari Kabupaten Probolinggo. Kedelapan isolat menunjukkan bahwa secara umum mereka termasuk jenis virus galur ganas dengan tujuh isolat memiliki motif
cleavage site 112RRQKRF117 dan satu isolat memiliki motif yang berbeda yaitu
112
RRRKRF117.
Saran
23
DAFTAR PUSTAKA
[CFSPH] The Center for Food Security and Public Health. 2008. Newcastle disease. Avian Paramyxovirus-1 Infection, Goose Paramyxovirus Infection. Iowa (USA): The Center for Food Security and Public Health. [BPS] Badan Pusat Statistik. 2015. Data Sensus Peternakan [Internet]. Badan
Pusat Statistik; [diunduh 25 Juli 2016]. Tersedia pada: https://www.bps.go.id/Subjek/view/id/24#subjekViewTab3|accordion-daftar-subjek3
[CFSPH] The Center for Food of Public Health. 2016. Disease images: Newcastle disease [Internet]. Iowa State University; [diunduh 18 September 2016]. Tersedia pada: http://www.cfsph.iastate.edu/DiseaseInfo/clinical-signs-photos.php?name=newcastle-disease
[DISNAK] Dinas Peternakan. 2015. Data Statistik Populasi Ternak Kab/Kota di Jawa Timur [Internet]. Dinas Peternakan Provinsi Jawa Timur; [diunduh
09 November 2016]. Tersedia pada:
http://disnak.jatimprov.go.id/web/layananpublik/datastatistik
[FAO] Food and Agricultural Organization of United Nations. FAO. 2015. Biosecurity guide for live poultry markets. Rome: Food and Agricultural Organization of United Nations.
[OIE] Office International des Epizooties. OIE. 2012. Newcastle disease. Office International des Epizooties.
[OIE] Office International des Epizooties. 2015. Disease distribution maps : Newcastle disease [Internet]. World Organisation for Animal Health (OIE); [diunduh 18 November 2015]. Tersedia pada: http://www.oie.int/wahis_2/public/wahid.php/countrymapinteractive [NVSL] National Veterinary Services Laboratories. Pedersen JC. 2005.
Real-Time RT-PCR for Detection of Virulent Newcastle Disease Virus in Clinical Samples. USDA: National Veterinary Services Laboratories. Adi AA, Kardena I, Astawa N, Putra K, Hayashi Y, Matsumoto Y. 2011. Kloning,
sikuensing dan analisis filogenetik gen nukleokapsid protein virus tetelo isolat Bali-1/07. J Vet. 12(3):173-179.
Afdora PT. 2015. Kajian kontaminasi virus Newcastle disease (VND) dari beberapa pasar tradisional di wilayah Jawa Barat dan Banten [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Aldous EW, Fuller CM, Mynn JK, Alexander DJ. 2004. A molecular epidemiological investigation of isolates of the variant avian paramyxovirus type 1 virus (PPMV-1) responsible for the 1978 to present panzootic in pigeons. Avian Pathol. 33(2):258-69. doi:10.1080/0307945042000195768
Alexander D, Bell J, Alders R. 2004. A technology review: Newcastle disease. Rome: FAO Animal Production and Health.
Alexander DJ. 2000. Newcastle disease and other avian paramyxoviruses. Rev sci tech Off int Epiz. 19(2):443-462.
24
Anonim 2012. Clonic Spasm [Internet]. Ithaca, New York: Cornell University College of Veterinary Medicine; [diunduh 18 September 2016]. Tersedia pada: http://partnersah.vet.cornell.edu/content/clonic-spasms
Capua I, Terregino C. 2011. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Ceva. OIE/FAO Referense Laboratory for Avian Influenza and Newcastle disease
Cattoli G, Fusaro A, Monne I, Molia S, Le Menach A, Maregeya B, Nchare A, Bangana I, Maina AG, Koffi JN, et al. . 2010. Emergence of a new genetic lineage of Newcastle disease virus in West and Central Africa--implications for diagnosis and control. Vet Microbiol 142(3-4):168-76. doi:10.1016/j.vetmic.2009.09.063
Cattoli G, Susta L, Terregino C, Brown C. 2011. Newcastle disease: a review of field recognition and current methods of laboratory detection. J Vet Diagn Invest. 23(4):637-56. doi:10.1177/1040638711407887
Chambers P, Millar N, Bingham R, Emmerson P. 1986. Molecular cloning of complementary DNA to Newcastle disease virus, and nucleotide sequence analysis of the junction between the genes encoding the haemagglutinin-neuraminidase and the large protein. J gen Vir. 67:475-486.
Connaris H, Takimoto T, Russell R, Crennell S, Moustafa I, Portner A, Taylor G. 2002. Probing the sialic acid binding site of the hemagglutinin-neuraminidase of Newcastle disease virus: identification of key amino acids involved in cell binding, catalysis, and fusion. J of Vir 76(4):1816-1824. doi:10.1128/jvi.76.4.1816-76(4):1816-1824.2002
Cornax I, Miller PJ, Afonso CL. 2012. Characterization of live LaSota vaccine strain-induced protection in chickens upon early challenge with a virulent Newcastle disease virus of heterologous genotype. Avian Dis. 56(3):464-70. doi:10.1637/10043-122011-Reg.1
Creelan JL, Graham DA, McCullough SJ. 2002. Detection and differentiation of pathogenicity of avian paramyxovirus serotype 1 from field cases using one-step reverse transcriptase-polymerase chain reaction. Avian Pathol.
31(5):493-9. doi:10.1080/0307945021000005860
Crennell S, Takimoto T, Portner A, Taylor G. 2000. Crystal structure of the multifunctional paramyxovirus hemagglutinin-neuraminidase. Nature Struc Bio. 7(11):1067-1074.
Darniati. 2014. Deteksi molekuler dan keragaman virus Newcastle disease pada ayam kampung di wilayah aceh [tesis]. Bogor (ID): Institut Pertanian Bogor.
de Leeuw OS, Koch G, Hartog L, Ravenshorst N, Peeters BP. 2005. Virulence of Newcastle disease virus is determined by the cleavage site of the fusion protein and by both the stem region and globular head of the haemagglutinin-neuraminidase protein. J Gen Virol 86(Pt 6):1759-69. doi:10.1099/vir.0.80822-0
Dimitrov DS. 2004. Virus entry: molecular mechanisms and biomedical applications. Nat Rev Microbiol 2(2):109-22. doi:10.1038/nrmicro817 Dortmans JC. 2011. Virulence determinants of Newcastle disease virus [disertasi].
25 Dortmans JC, Koch G, Rottier PJ, Peeters BP. 2011. Virulence of Newcastle disease virus: what is known so far? Vet Res. 42:122. doi:10.1186/1297-9716-42-122
Emilia, Setiyaningsih S, Soejoedono R. 2015. Isolasi dan karakterisasi biologik virus Newcastle disease. Kedokteran Hewan. 9(1):47-51.
Etriwati. 2015. Kajian patologi dan imunohistokimia kasus lapang newcastle disease pada ayam [tesis]. Bogor (ID): Institut Pertanian Bogor.
Ezeibe MCO, Ndip ET. 2005. Red blood cell elution time of strains of Newcastle disease virus. J of Vet Sci. 6(4):287-288.
Farkas T, Szekely E, Belak S, Kiss I. 2009. Real-time PCR-based pathotyping of Newcastle disease virus by use of TaqMan minor groove binder probes. J Clin Microbiol 47(7):2114-23. doi:10.1128/JCM.01652-08
Forrester NL, Widen SG, Wood TG, Travassos da Rosa AP, Ksiazek TG, Vasilakis N, Tesh RB. 2013. Identification of a new Newcastle disease virus isolate from Indonesia represents an ancestral lineage of class II genotype XIII. Virus Genes. 47(1):168-72. doi:10.1007/s11262-013-0900-8
Garten W, Berk W, Nagai Y, Rott R, Klenk H. 1980. Mutational changes of the protease susceptibility of glycoprotein F of Newcastle disease virus: Effects on pathogenicity. J gen Vir. 50:135-147.
Giannecchini S, Campitelli L, Calzoletti L, De Marco MA, Azzi A, Donatelli I. 2006. Comparison of in vitro replication features of H7N3 influenza viruses from wild ducks and turkeys: potential implications for interspecies transmission. J Gen Virol. 87(Pt 1):171-5. doi:10.1099/vir.0.81187-0
Gohm DS, Thur B, Hofmann MA. 2000. Detection of Newcastle disease virus in organs and faeces of experimentally infected chickens using RT-PCR.
Avian Pathol 29(2):143-52. doi:10.1080/03079450094171
Goraichuk I, Sharma P, Stegniy B, Muzyka D, Pantin-Jackwood MJ, Gerilovych A, Solodiankin O, Bolotin V, Miller PJ, Dimitrov KM, et al. . 2016. Complete genome sequence of an Avian Paramyxovirus representative of putative new serotype 13. Genome Announc 4(4). doi:10.1128/genomeA.00729-16
Heiden S GC, Roder A, Granzow H, Kuhnel D, Mettenleiter TC, Oberdorfer AR. . 2014. Different regions of the Newcastle disease virus fusion protein
modulate pathogenicity. Plos One. 9(12).
doi:10.1371/journal.pone.0113344
Hines NL, Miller CL. 2012. Avian paramyxovirus serotype-1: a review of disease distribution, clinical symptoms, and laboratory diagnostics. Vet Med Int.
2012:708216. doi:10.1155/2012/708216
Hoffmann B, Beer M, Reid SM, Mertens P, Oura CA, van Rijn PA, Slomka MJ, Banks J, Brown IH, Alexander DJ, et al. . 2009. A review of RT-PCR technologies used in veterinary virology and disease control: sensitive and specific diagnosis of five livestock diseases notifiable to the World Organisation for Animal Health. Vet Microbiol. 139(1-2):1-23. doi:10.1016/j.vetmic.2009.04.034
hemagglutinin-26
neuraminidase protein. Vet Microbiol. 140(1-2):92-7. doi:10.1016/j.vetmic.2009.07.029
Huang Z, Krishnamurthy S, Panda A, Samal SK. 2003. Newcastle disease virus V protein is associated with viral pathogenesis and functions as an alpha interferon antagonist. J of Vir. 77(16):8676-8685. doi:10.1128/jvi.77.16.8676-8685.2003
Hussain M, Mehmood M, Ahmad A, Shabbir M, Yaqub T. 2008. Factors affecting hemagglutination activity of Avian influenza virus Subtype H5N1. J Vet Anim Sci. 1:31-36.
Ibu J, Okoye J, Eze D, Fasina F, Adulugba A, EP, Abechi A, Woma Y. 2008. Antigenic relatedness among Newcastle disease virus isolates from nigerian feral birds and the la sota strain. Vet Sci. 13(2):79-84.
Kapczynski DR, Afonso CL, Miller PJ. 2013. Immune responses of poultry to Newcastle disease virus. Dev Comp Immunol. 41(3):447-53. doi:10.1016/j.dci.2013.04.012
Khorajiya JH, Pandey S, Ghodasara PD, Joshi BP, Prajapati KS, Ghodasara DJ, Mathakiya RA. 2015. Patho-epidemiological study on Genotype-XIII Newcastle disease virus infection in commercial vaccinated layer farms.
Vet World 8(3):372-81. doi:10.14202/vetworld.2015.372-381
Kim LM, King DJ, Suarez DL, Wong CW, Afonso CL. 2007. Characterization of class I Newcastle disease virus isolates from Hong Kong live bird markets and detection using real-time reverse transcription-PCR. J Clin Microbiol
45(4):1310-4. doi:10.1128/JCM.02594-06
McGinnes L, Morrison TG. 1994. Modulation of the activities of HN protein of Newcastle disease virus by nonconserved cysteine residues. Virus Res.
34:305-316.
Miller PJ, Afonso CL, El Attrache J, Dorsey KM, Courtney SC, Guo Z, Kapczynski DR. 2013. Effects of Newcastle disease virus vaccine antibodies on the shedding and transmission of challenge viruses. Dev Comp Immunol. 41(4):505-13. doi:10.1016/j.dci.2013.06.007
Miller PJ, Haddas R, Simanov L, Lublin A, Rehmani SF, Wajid A, Bibi T, Khan TA, Yaqub T, Setiyaningsih S, et al. . 2015. Identification of new sub-genotypes of virulent Newcastle disease virus with potential panzootic features. Infect Genet Evol. 29:216-29. doi:10.1016/j.meegid.2014.10.032 Miller PJ, Koch G. 2013. Newcastle disease, other Avian Paramyxoviruses, and
Avian Metapneumovirus infections. Disease of poultry. John Wiley & Sons, Inc. hlm 89-107.
Ogasawara T, Gotoh B, Suzuki H, Asaka J, Shimokata K, Rott R, Nagai Y. 1992. Expression of factor X and its significance for the determination of paramyxovirus tropism in the chick embryo. The Embo J. 11(2):467-472. Panus A, Setiyaningsih S, Mayasari NLPI. 2015. Newcastle Disease Virus
infection study on duck and chicken in Subang district. JITV. 20(2). doi:10.14334/jitv.v20i2.1168
Phan LV, Park MJ, Kye SJ, Kim JY, Lee HS, Choi KS. 2013. Development and field application of a competitive enzyme-linked immunosorbent assay for detection of Newcastle disease virus antibodies in chickens and ducks.
27 Romer-Oberdorfer A, Veits J, Werner O, Mettenleiter TC. 2006. Enhancement of pathogenicity of Newcastle disease virus by alteration of specific amino acid residues in the surface glycoproteins F and HN. Avian Dis. 50(2):259-63. doi:10.1637/7471-111505R.1
Rout SN. 2007. The role of Newcastle disease virus internal protein in pathogenesis [disertasi]. Maryland: University of Maryland.
Shengqing Y, Kishida N, Ito H, Kida H, Otsuki K, Kawaoka Y, Ito T. 2002. Generation of velogenic Newcastle disease viruses from a nonpathogenic waterfowl isolate by passaging in chickens. Virology. 301(2):206-211. doi:10.1006/viro.2002.1539
Simons K, Garoff H. 1980. The budding mechanisms of enveloped animal viruses. J gen Vir. 50:1-21.
Smith EC, Popa A, Chang A, Masante C, Dutch RE. 2009. Viral entry mechanisms: the increasing diversity of paramyxovirus entry. FEBS J
276(24):7217-27. doi:10.1111/j.1742-4658.2009.07401.x
Snoeck CJ, Owoade AA, Couacy-Hymann E, Alkali BR, Okwen MP, Adeyanju AT, Komoyo GF, Nakouné E, Le Faou A, Muller CP. 2013. High genetic diversity of Newcastle disease virus in poultry in west and central africa: cocirculation of genotype xiv and newly defined genotypes XVII and XVIII. J of Clin Micro. 51(7):2250-2260.
Solomon P, Abolnik C, Joannis TM, Bisschop S. 2012. Virulent Newcastle disease virus in Nigeria: identification of a new clade of sub-lineage 5f from livebird markets. Virus Genes. 44(1):98-103. doi:10.1007/s11262-011-0678-5
Stone-Hulslander J, Morrison TG. 1997. Detection of an interaction between the HN and F proteins in Newcastle disease virus-infected cells. J of Vir.
71(9):6287-6295.
Susta L, Miller PJ, Afonso CL, Estevez C, Yu Q, Zhang J, Brown CC. 2010. Pathogenicity evaluation of different Newcastle disease virus chimeras in 4-week-old chickens. Trop Anim Health Prod. 42(8):1785-95. doi:10.1007/s11250-010-9638-7
Takimoto T, Taylor GL, Connaris HC, Crennell SJ, Portner A. 2002. Role of the Hemagglutinin-Neuraminidase Protein in the Mechanism of Paramyxovirus-Cell Membrane Fusion. Journal of Virology 76(24):13028-13033. doi:10.1128/jvi.76.24.13028-76(24):13028-13033.2002
Tarmudji. 2005. Penyakit pernafasan pada ayam, ditinjau dari aspek klinik dan patologik serta kejadiannya di Indonesia. Wartozoa. 15(2):72-83.