PENGUJIAN VIRUS
NEWCASTLE DISEASE
GEN VII ISOLAT
LAPANG SEBAGAI VIRUS STANDAR PADA UJI TANTANG
VAKSIN
DK FARAH ANA BINTI ZAIDUN
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengujian Virus
Newcastle Disease Gen VII Isolat Lapang Sebagai Virus Standar Pada Uji
Tantang Vaksin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
DK Farah Ana Binti Zaidun
ABSTRAK
DK FARAH ANA BINTI ZAIDUN. Pengujian Virus Newcastle Disease Gen VII Isolat Lapang Sebagai Virus Standar Pada Uji Tantang Vaksin. Dibimbing oleh SRI MURTINI dan RETNO D. SOEJOEDONO.
Penelitian ini dilakukan untuk mengetahui standar virus Newcastle Disease
Gen VII isolat lapang sebagai virus tantang pada pengujian vaksin. Suspensi virus yang telah diuji HA sebelumnya dititrasi dengan uji Embryo Infectious Dose50
(EID50) menggunakan telur embrio tertunas (TET) SPF umur 10 hari sebanyak 30
butir. Uji Chicken Lethal Dose50(CLD50) dilakukan untuk mengetahui titer virus
yang mampu menyebabkan kematian sebesar 50% populasi ayam. Uji CLD50
menggunakan 25 ekor day-old-chicken (DOC) yang dibagi menjadi 5 kelompok. Virus di encerkan dari 10-1 sampai 10-8. Pada pengenceran 10-4 sampai 10-8, virus ND diinfeksikan kepada setiap kelompok ayam melalui tetes mata dan intranasal sebanyak 0.1 ml/ekor. Uji hemaglutinasi menunjukkan bahwa cairan alantois yang dipanen memiliki titer virus yang tinggi yaitu 512 HAU. Virus infektif ND yang dititrasi dengan uji EID50 menunjukkan titer virus sebesar 109 EID50/0.1 ml atau
1010 EID50/ml dan titer virus pada uji CLD50 menunjukkan titer virus sebesar106.48
CLD50/0.1 ml atau 107.48 CLD50/ml. Hasil ini dapat disimpulkan bahwa isolat ND
Gen VII sangat sesuai digunakan sebagai virus standar pada uji tantang vaksin. Kata kunci: uji CLD50, uji EID50, uji HA, virus Newcastle Disease Gen VII
ABSTRACT
DK FARAH ANA BINTI ZAIDUN. A Test On Newcastle Disease Virus Field
Isolate Gene VII AS A Standard Virus To Vaccine Test. Supervised by SRI
MURTINI dan RETNO D. SOEJOEDONO.
This study was conducted to determine the standard of Newcastle disease virus Gene VII field isolate as a virus challenge to vaccine test. A virus suspension that has previously been tested by HA test then titrated with EID50
using 30 Specific Pathogen Free (SPF) of 10 day old chicken embryonated eggs. In addition, chicken lethal dose50 (CLD50) test were used to determine the virus
titer that could cause 50% death of the chicken population. The CLD50 testwas
used 25 day-old-chickens (DOC) divided into 5 groups. The virus was diluted from 10-1 to 10-8. The 104 to 10-8 dilution of NDV was infected to every group of chicken via eyedrop and intranasal with 0.1 ml/chicken dosage. Haemagglutination test showed that the allantoic fluid were contain high titers of NDV is 512 HAU. The infective NDV that had been titrated by EID50 test showed
the virus titers is 109 EID50/0.1 ml or 1010 EID50/ml and the virus titers of CLD50
test e.i 106.48 CLD50/0.1 ml or 107.48 CLD50/ml. These results can be concluded that
the NDV Gene VII field isolates were most appropriate to be used as a standard virus to vaccine test.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
PENGUJIAN VIRUS
NEWCASTLE DISEASE
GEN VII ISOLAT
LAPANG SEBAGAI VIRUS STANDAR PADA UJI TANTANG
VAKSIN
DK FARAH ANA BINTI ZAIDUN
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengujian Virus Newcastle Disease Gen VII Isolat Lapang Sebagai Virus Standar Pada Uji Tantang Vaksin
Nama : DK Farah Ana Binti Zaidun
NIM : B04088003
Disetujui oleh
Dr drh Sri Murtini, MSi Pembimbing I
Prof Dr drh Retno D Soejoedono, MS Pembimbing II
Diketahui oleh
drh Agus Setiyono, MS, Ph.D, APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Pengujian Virus Newcastle Disease Gen VII Isolat Lapang Sebagai Virus Standar Pada Uji Tantang Vaksin. Skripsi ini disusun sebagai salah satu syarat memperoleh gelar Sarjana Kedokteran Hewan Institut Pertanian Bogor.
Rasa terima kasih penulis berikan kepada Dr drh Sri Murtini, MSi selaku dosen pembimbing skripsi pertama dan pembimbing akademik atas segala bimbingan, nasihat, ilmu, waktu dan kesabaran yang diberikan selama penelitian dan penyusunan skripsi serta selama proses akademik berlangsung. Disamping itu, penulis juga berterima kasih kepada Prof Dr drh Retno Soejoedono, MS sebagai dosen pembimbing skripsi kedua atas segala bimbingan, ilmu, waktu, dan kesabaran yang diberikan selama penelitian dan penyusunan skripsi ini.
Ucapan terima kasih yang tidak terhingga penulis sampaikan kepada keluarga tercinta (Ummie, Abah, Vivi, Dhilah, Adzlin dan Izhan) atas segala dukungan, kasih sayang, doa dan semangat yang diberikan setiap saat. Terima kasih juga penulis sampaikan kepada sahabat Pondok Artis tersayang, ahli PKPMI Bogor, teman-teman Avenzoar 45 dan Geochelone 46 atas segala kebersamaan.
Skripsi ini tidak luput dari kekurangan dan kesalahan. Oleh karena itu, penulis terbuka menerima kritik dan saran yang membangun guna penulisan selanjutnya.
Semoga skripsi ini bermanfaat untuk kita semua.
Bogor, Oktober 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Tujuan Penelitian 4
Manfaat Penelitian 4
METODE 4
Waktu dan Tempat 4
Prosedur Penelitian 4
Uji HA Mikrotitrasi 4
Uji Embryo Infectious Dose50 (EID50) 5
Uji Chicken Lethal Dose50 (CLD50) 6
HASIL DAN PEMBAHASAN 7
SIMPULAN 11
DAFTAR PUSTAKA 11
DAFTAR TABEL
1 Contoh tabel hasil evaluasi pada uji EID50 6
2 Contoh tabel hasil evaluasi pada uji CLD50 7
3 Hasil evaluasi uji HA 8
4 Hasil evaluasi pada uji EID50 8
5 Hasil evaluasi pada uji CLD50 10
DAFTAR GAMBAR
1 Skematis virus Newcastle Disease (ND) 1
PENDAHULUAN
Penyakit Newcastle Disease (ND) merupakan penyakit unggas yang penyebarannya meliputi seluruh wilayah di dunia terutama di Asia Tenggara.
Newcastle Disease pertama kali ditemukan oleh Doyle di daerah Newcastle
Inggris pada tahun 1926. Di Indonesia, penyakit ini merupakan penyakit infeksius penting dalam industri perunggasan karena dapat menimbulkan kerugian berupa kematian ayam, penurunan produksi telur pada ayam petelur, gangguan pertumbuhan, dan penurunan berat badan pada ayam pedaging (DEPTAN 2006).
Newcastle Disease dikenal dengan berbagai nama di antaranya pseudo-fowl pest, avian pest, avian distemper, Tetelo disease, pseudovogel-pest, pseudo-poultry plaque, Korean fowl plaque, Ranikhet disease, Atypische Geflugelpest,
dan avian pneumoencephalitis (Alexander 2003). Penyakit ini menyerang semua jenis unggas, baik yang liar ataupun yang telah dibudidayakan (Fadillah dan Polana 2004). Newcastle disease merupakan suatu penyakit pernafasan yang bersifat sistemik, akut, dan epidemik disebabkan oleh virus golongan
paramyxovirus. Famili ini tergolong ke dalam virus RNA yang memiliki selubung luar (envelope) dan sel target berupa sel epitel mukosa saluran pernafasan dan pencernaan (Dortmans et al. 2011).
Gambar 1 Skematis virus Newcastle Disease (ND) (sumber : FAO 2004)
Virus Newcastle Disease atau Avian paramyxovirus-1 (Gambar 1) diklasifikasikan dalam golongan Avulavirus dan famili Paramyxoviridae (Lamb
et al. 2005). Virus ini berbentuk pleomorfik, beramplop, dan mempunyai ukuran yang besar dengan diameter 100-500 nm tetapi ditemukan juga dalam bentuk filamen dengan diameter 100 nm. Menurut Yusoff dan Tan (2001) panjang virus
2
atas lipid bilayer, lapisan protein, dan glikoprotein yang berbentuk paku menonjol pada permukaan partikel (Fenner et al. 1995, Alexander 2003). Virus ini memiliki aktivitas neuraminidase dan hemaglutinasi yang dapat mengabsorbsi sel darah merah unggas dan menyebabkan agregasi.
Perkembangan teknologi terkini memunculkan klasifikasi virus secara genotipe. Identifikasinya dengan melihat asam inti virus. Klasifikasi virus ND secara genotipe berawal dari analisis secara filogenetik (kekerabatan) yaitu virus ND dikelompokkan menjadi 2 divisi yaitu kelas I yang menyerang unggas air dan kelas II yang menyerang unggas darat. Divisi virus ND kelas I memiliki 9 genotipe dan terdiri dari golongan virus bervirulensi rendah sedangkan virus ND kelas II memiliki 10 genotipe dan terdiri dari virus bervirulensi ganas (Dormans et al. 2011).
Virus ND kelas II selanjutkan dikategorikan ke dalam 10 genotipe (I X). Virus ND kelas II genotipe 2 yang digunakan sebagai galur vaksin, yaitu virus La Sota, B1, dan VG/GA. Vaksin yang banyak beredar di Indonesia umumnya dibuat dengan isolat virus La Sota dan Hitchner B1 asal Amerika yang tergolong ke dalam genotipe 2. Kasus ND yang dominan terjadi di Indonesia sepanjang 2009 2011 saat ini disebabkan oleh virus ND genotipe VII. Hal ini berdasarkan pada hasil isolasi virus dari kejadian ND terkini di lapangan sehingga virus ND genotipe VII menjadi perhatian utama masyarakat peternakan di Indonesia.
Newcastle Disease dapat dibagi atas 5 fenotipe berdasarkan gejala klinik yang timbul, yakni viscerotropic velogenic newcastle disease (VVND), velogenic newcastle disease (NVND), mesogenic, lentogenic respiratory, dan asymptomatic enteric (Herendra dan Franco 1996). Bentuk Doyle ditandai oleh adanya infeksi yang bersifat akut dan fatal pada semua umur ayam. Bentuk ini dicirikan dengan adanya gangguan pencernaan akibat perdarahan dan nekrosis pada saluran pencernaan sehingga dikenal dengan nama viscerotropic velogenic newcastle disease (VVND). Bentuk Beach ditandai oleh adanya infeksi yang bersifat akut dan kerap kali dapat menimbulkan kematian sampai 50% pada unggas dewasa dan sebesar 90% pada unggas muda. Bentuk ini dicirikan oleh adanya gejala klinis pada saluran pernafasan dan saraf sehingga disebut neurotropic velogenic newcastle disease (NVND).
Bentuk Beaudette merupakan suatu bentuk virus ND galur mesogenic yang kurang patogen dan hanya dapat menyebabkan kematian pada unggas muda. Bentuk dari virus ini dapat digunakan sebagai vaksin aktif untuk vaksinasi ulang terhadap ND. Virus ND galur lentogenik ditandai oleh adanya infeksi pernapasan ringan dan tidak menimbulkan kematian pada unggas dewasa yang juga dikenal dengan bentuk Hitchner. Bentuk asymptomatic enteric tidak menimbulkan gejala suatu penyakit tertentu namun dapat ditandai dengan infeksi pada usus yang ditimbulkan oleh virus ND tipe lentogenik (Alexander 2003).
3 Vaksin terbagi menjadi vaksin lived dan vaksin killed (Tizzard 1988). Vaksin aktif (lived) merupakan vaksin yang mengandung organisme yang masih hidup namun telah dilemahkan (attenuated) sehingga tidak menimbulkan penyakit. Vaksin aktif (lived) umumnya lebih baik daripada vaksin inaktif (killed) karena dapat memberikan respon kekebalan yang cepat dan merangsang produksi interferon (Tizard 1988). Vaksin inaktif (killed) adalah vaksin yang mengandung agen penyakit yang telah dimatikan dan biasanya ditambah adjuvan (Akoso 1998). Adjuvan merupakan zat umum yang dicampurkan bersama vaksin untuk meningkatkan respon kekebalan baik humoral maupun seluler.
Vaksin ND dapat berasal dari tipe lentogenik, mesogenik maupun velogenik. Menurut Fadillah dan Polana (2004) biasanya vaksin ND dibuat dari virus ringan (lentogenik) dan sedang (mesogenik). Virus lentogenik merupakan strain virus ND yang mempunyai tingkat virulensi dan mortalitas yang rendah yaitu strain B1 (Hitchner), strain La Sota dan strain F (FAO 2004). Strain F mempunyai tingkat virulensi yang paling rendah dibandingkan strain lentogenik lainnya. Vaksin strain F paling efektif digunakan secara individu namun memiliki tingkat virulensi yang lebih rendah di bandingkan strain B1.
Tipe mesogenik memberikan kekebalan lebih lama dibandingkan kekebalan yang dihasilkan oleh tipe lentogenik, namun pemberian vaksin tipe mesogenik pada ayam yang belum mempunyai kekebalan dasar dapat menimbulkan reaksi post-vaksinasi dan penurunan produksi telur (Nugroho 1981). Tipe mesogenik yang digunakan sebagai vaksin antaranya strain Rokain, strain Mukteswar, strain Hartfordshire, dan strain Komarov (Allan et al. 1987, Fadillah dan Polana 2005). Tipe velogenik jarang digunakan sebagai bahan vaksin namun dapat dibuat dalam bentuk vaksin inaktif dan memiliki tingkat virulensi yang paling tinggi (FAO 2004).
Vaksinasi terhadap Newcastle Disease (ND) dapat diberikan melalui berbagai cara, yaitu melalui air minum, tetes mata, spray, injeksi intramuskular, dan subkutan. Vaksin yang baik harus harus memberikan proteksi lebih daripada 95% terhadap hewan coba atau tidak lebih dari 5% terhadap hewan yang terinfeksi atau sakit. Keberhasilan vaksinasi sangat dipengaruhi oleh status kesehatan unggas, nutrisi, sanitasi lingkungan dan sistem perkandangan, serta program vaksinasi yang baik (Akoso 1998). Vaksinasi dapat mengalami kegagalan karena berbagai sebab salah satunya unggas yang mengalami imunosupresi akibat terinfeksi penyakit Gumboro, Marek, atau pakan yang mengandung mikotoksin (Gillingham 2006).
4
Tujuan Penelitian
Penelitian ini bertujuan menentukan standar virus Newcastle Disease Gen VII isolat lapang sebagai virus tantang pengujian vaksin.
Manfaat Penelitian
Manfaat yang didapatkan dari penelitian ini adalah memberikan informasi mengenai standar titer virus ND Gen VII isolat lapang sehingga dapat digunakan sebagai virus standar pada uji tantang vaksin.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Agustus 2012 di Laboratorium Terpadu, Bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, dan Kandang Unit Pengelola Hewan Laboratorium (UPHL) Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Prosedur Penelitian
Uji Hemaglutinasi Mikrotitrasi (OIE 2012)
Larutan Phosphat Buffer Saline (PBS) sebanyak 25µl dimasukkan ke dalam 12 sumur mikroplate berbentuk V (V bottom microplate) dari baris A sampai F, kolom dua sampai 12. Antigen ND sebanyak 50µl dimasukkan dari sumur A1 sampai E1. Kemudian sebanyak 25µl dipindahkan dari sumur A1 sampai E1 ke dalam sumur A2 sampai E2 menggunakan pipet multichannel lalu dihomogenkan lima kali dengan cara memipet naik dan turun. Setiap memasukkan antigen dilakukan penggantian tips.
Larutan PBS 25µl dimasukkan ke dalam sumur B2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Selanjutnya dari sumur B2 dikeluarkan sebanyak 25µl campuran tersebut sehingga pengencerannya menjadi 1/3. Setelah itu, sebanyak 75µl larutan PBS dimasukkan ke dalam sumur C2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun, dan dari sumur C2 diambil 75µl campuran pada sumur tersebut sehingga pengencerannya menjadi 1/5. Kemudian sebanyak 125µl larutan PBS dipipet ke dalam sumur D2 dan dihomogenkan 10 kali dengan cara memipet naik dan turun. Dari sumur D2 diambil 125µl suspensi sehingga pengenceran pada sumur tersebut menjadi 1/7. Larutan PBS sebanyak 175µl dipipet ke dalam sumur E2 dan dihomogenkan sebanyak 10 kali dengan cara memipet naik dan turun. Dari sumur E2 diambil 175µl suspensi sehingga pengenceran pada sumur tersebut menjadi 1/9.
5 dihomogenkan lima kali dengan cara memipet naik dan turun. Sebanyak 25µl suspensi dipipet dengan tips dari kolom A3 sampai E3 ke dalam kolom A4 sampai E4 dan dihomogenkan lima kali dengan cara memipet naik dan turun. Langkah ini diulangi hingga kolom A12 sampai E12. Setelah dihomogenkan lima kali dari A12 sampai E12, sebanyak 25µl suspensi dari kolom terakhir dibuang. Selanjutnya sebanyak 25µl PBS dimasukkan ke dalam setiap sumur dan ditambahkan 25µl RBC (1% v/v) ke dalam setiap sumur. Kemudian microplate
dikocok selama 10 detik dan diinkubasi selama 60 menit pada suhu 4 ˚C. Hasil diamati setelah sumur kontrol positif menunjukkan adanya reaksi penghambatan aglutinasi dengan memiringkan microplate.
Uji Embryo Infectious Dose50 (EID50)
Peneropongan (candling) dilakukan pada telur embrio tertunas (TET) untuk melihat kondisi embrionya dan menentukan batas kantong udara terlebih dahulu. Telur diberi dua tanda menggunakan pensil yaitu satu bagian pada atas kepala embrio dan satu bagian lagi diatas kantung udara. Daerah yang ditandai dihapus hamakan dengan mengoleskan alkohol 70%. Lubang dibuat pada bagian kerabang telur yang sudah ditandai menggunakan bor telur tetapi tidak sampai merusak “shell membrane”.
Uji Embryo Infectious Dose50 (EID50) dilakukan dengan menggunakan 30
butir telur embrio tertunas (TET) umur 10 hari. Pengenceran virus dilakukan secara bertingkat dimulai dari pengenceran 10-1 sampai 10-10 dengan teknik yang steril. Suspensi virus dengan pengenceran 10-5 sampai 10-9 diinokulasi sebanyak 0.1 ml ke dalam ruang alantois dan tiap pengenceran diinokulasi ke lima butir telur dan lima butir sisanya sebagai kontrol.
Lubang tempat penyuntikan ditutup kembali menggunakan kolodion. Telur diinkubasi di dalam inkubator dengan suhu 37-38 ˚C dengan posisi kantong udara berada diatas. Telur diamati dengan di candling setiap dua kali sehari selama 4 hari. Telur yang mati setelah inokulasi disimpan dalam refrigerator. Telur tertunas yang telah diinokulasi virus Newcastle Disease dipanen dari cairan alantoisnya dan disentrifus untuk memisahkan debris dari cairan yang dipanen dan dihitung titernya.
6
Tabel 1 Contoh tabel hasil evaluasi pada uji EID50
Pengenceran virus
Jumlah telur
Respon embrio Jumlah akumulasi Persentasi
infektif
Dari tabel diatas dapat diperkirakan pengenceran virus menyebabkan kematian 50% populasi dengan rumus :
Proportionate Distance (PD) = % infeksi > 50% - (50%)
% infeksi > 50% - (% infeksi < 50%)
Sehingga 50% endpoint dapat dihitung dengan rumus :
Uji Chicken Lethal Dose50 (CLD50)
Uji Chicken Lethal Dose50 (CLD50) dilakukan dengan menggunakan 25
ekor day-old-chicken (DOC). Pengenceran virus dilakukan terlebih dahulu sebelum diinfeksikan secara buatan pada ayam dengan melakukan pengenceran virus secara desimal mulai dari pengenceran 10-4 sampai 10-8 dengan teknik yang steril. Uji CLD50 dilakukan dengan cara ayam diinfeksi virus ND Gen VII isolat
lapang melalui tetes mata dan intranasal sebanyak 0.1 ml/ekor dan tiap pengenceran diinfeksikan ke 5 ekor ayam. Semua ayam yang diuji CLD50
dicampur dalam satu kandang isolator sehingga terjadi penularan virus ND yang ganas. Selama uji dijalankan, pakan, dan air diberikan secara ad libitum.
Pengamatan dilakukan dua kali yaitu pada pagi dan sore hari dan semua ayam mati dan sakit dicatat dan dihitung titer virusnya. Penghitungan titer virus CLD50 dilakukan hampir sama seperti penghitungan titer virus EID50 yaitu dengan
menghitung endpoint dari pengenceran virus yang menyebabkan kematian 50% populasi (jumlah ayam/n) menggunakan metode Reed and Muench dengan tabel dan rumus berikut :
7 Tabel 2 Contoh tabel hasil evaluasi pada uji CLD50
Pengenceran virus
Jumlah ayam
Respon ayam Jumlah akumulasi Persentasi
kematian
Dari tabel diatas dapat diperkirakan pengenceran virus menyebabkan kematian 50% populasi dengan rumus :
Proportionate Distance (PD) = % infeksi > 50% - (50%)
% infeksi > 50% - (% infeksi < 50%)
Sehingga 50% endpoint dapat dihitung dengan rumus :
HASIL DAN PEMBAHASAN
.Uji HA Mikrotitrasi
Uji Hemaglutinasi merupakan dasar dalam menentukan titer virus ND (Darminto 1996). Hasil penelitian pada uji HA dengan metode OIE dari seluruh cairan alantois yang dipanen dan diinokulasi virus ND Gen VII pada delapan butir SPF menunjukkan bahwa titer virus tertinggi adalah sebesar 29 atau 512 HAU (Tabel 3). Uji HA didasarkan pada prinsip kemampuan hemaglutinasi dari virus ND terhadap sel darah merah unggas (Grimes 2002). Titer HA adalah pengenceran tertinggi yang masih dapat mengaglutinasi sel darah merah unggas. Hemaglutinasi (HA) sempurna ditandai dengan adanya aglutinasi sel darah merah secara merata pada dasar sumur microplate dan penjernihan dari cairan di bagian atas tanpa terjadinya pengendapan (Ernawati et al. 1996).
8
Tabel 3 Hasil evaluasi uji HA
Baris Titer Virus
1 2 3 4 5 6 7 8 9
Reaksi aglutinasi pada uji HA dapat dihambat dengan antibodi spesifik terhadap antigen sehingga reaksi ini digunakan sebagai dasar pada identifikasi virus serta diferensiasi pada strain varian yang sering muncul. Virus dapat mengaglutinasi eritrosit karena virus memiliki protein hemaglutinin pada permukaan virusnya. Hemaglutinin secara spontan akan melekat pada permukaan sel darah merah unggas yang merupakan reseptor dari membran eritrosit unggas sehingga membentuk sebuah jembatan antara dua sel darah merah. Aglutinasi sempurna pada pengenceran tertinggi dinyatakan sebagai endpoint dan memiliki titer 1 HAU (Haemaglutinasi Unit), 1 HAU setara dengan 107 partikel virus.
Uji Embryo Infectious Dose50 (EID50)
Titrasi virus dengan uji HA dapat menghitung jumlah virus yang telah mati (tidak infektif) maupun masih hidup (infektif) sedangkan titrasi virus yang infektif dapat diukur menggunakan uji Embryo Infectious Dose50 (EID50) yang artinya
dosis yang digunakan mampu menginfeksi 50% populasi embrio.
Pada uji EID50, telur embrio tertunas (TET) paling sering digunakan sebagai
media isolasi dan propagasi atau pembiakan virus. Telur berembrio atau sering disebut telur embrio tertunas (TET) merupakan tempat pembenihan virus yang ideal karena TET merupakan sumber sel hidup yang relatif murah dan mudah untuk isolasi virus. Keunggulan yang dimiliki TET adalah kondisinya yang steril dan tidak mudah terkontaminasi, ukurannya yang kecil dan mudah ditangani.
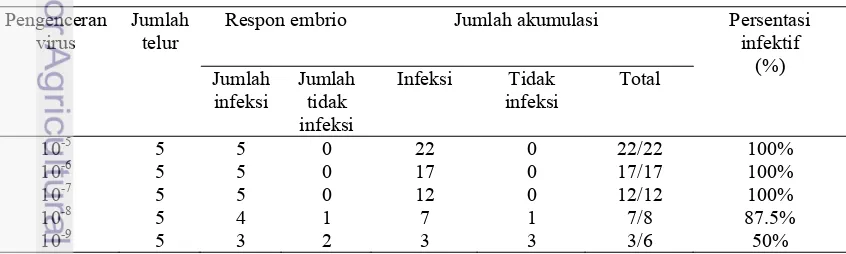
Berdasarkan penelitan yang dilakukan, uji EID50 evaluasi titer virus ND dari
isolat lapang dengan uji EID50 disajikan pada Tabel 4.
Tabel 4 Hasil evaluasi pada uji EID50
Pengenceran virus
Jumlah telur
Respon embrio Jumlah akumulasi Persentasi
9 Berdasarkan data diatas bila dihitung dengan metode Reed and Muench
diperoleh :
Proportionate Distance (PD) = . . = 1.00
Sehingga 50% endpoint dapat dihitung dengan rumus :
Log dari 50% endpoint = log pengenceran diatas 50%-(PD x log faktor pengenceran)
= (-8) – (1.00 x 1.0) = 109 EID50/0.1 ml
= 1010 EID50/ml
Hasil penelitian pada pengujian titrasi virus dengan uji EID50 menunjukkan
bahwa titer virus pada uji ini sebesar 109 EID50/0.1 ml atau 1010 EID50/ml
sehingga suspensi virus ini menunjukkan titer virus infektif yang tinggi. Titer virus yang tinggi sangat diperlukan pada uji tantang karena pada suatu uji tantang diperlukan jumlah tertentu yang mampu menginfeksi inang (ayam).
Virus yang dipanen dari cairan alantois memiliki kemampuan hidup yang tinggi. Hal ini terkait erat dengan penggunaan media isolasi yang digunakan selama pembiakan virus. Pembiakan virus menggunakan telur sebaikkan digunakan telur yang berasal dari breeding flock yang bebas patogen tertentu (Specific Pathogen Free) karena telur SPF tidak memiliki antibodi spesifik pada kuning telur sehingga aman untuk digunakan.
Pembiakan virus Newcastle Disease (ND) dilakukan pada ruang alantois karena sel target virus ND terletak pada epitel mukosa saluran pernafasan dan pencernaan serta terdapat banyak epitel khorion sehingga ruang alantois dapat menjadi sel targetnya. Cairan alantois berada di dalam kantong alantois yang letaknya dibawah kerabang kapur berpori berperan utama dalam penyerapan kalsium, pernapasan, dan tempat penyimpanan sisa-sisa metabolisme embrio (Syahrurrachman 1994).
Uji Chicken Lethal Dose50 (CLD50)
Pada uji Chicken Lethal Dose50 (CLD50) dilakukan pengenceran virus mulai
dari pengenceran 10-4, 10-5, 10-6, 10-7 sampai 10-8. Berdasarkan Tabel 5, pengenceran virus yang dapat menyebabkan kematian 50% populasi adalah antara 10-6 (71%) dan 10-7 (28%). Berdasarkan pengujian Chicken Lethal Dose50 (CLD50)
diketahui bahwa 50% endpoint adalah pada pengenceran 106.48 sehingga titer virusnya adalah 106.48 CLD50/0.1 ml atau 107.48 CLD50/ml. Data ini menunjukkan
10
Tabel 5 Hasil evaluasi pada uji CLD50
Pengenceran virus
Jumlah ayam
Respon Ayam Jumlah akumulasi Persentasi
kematian
Berdasarkan data diatas bila dihitung dengan metode Reed and Muench
diperoleh :
Proportionate Distance (PD) = =
= 0.48
Sehingga 50% endpoint dapat dihitung dengan rumus :
Log dari 50% endpoint = log pengenceran diatas 50% - (PD x log faktor pengenceran)
=(-6) – (0.48 x 1.0) = 106.48 CLD50/0.1 ml
= 107.48 CLD50/ml
Gambar 2 Ayam yang diinfeksi dengan virus ND Gen VII melalui intranasal
Hasil pengamatan yang dilakukan terhadap day-old-chicken (DOC) pada uji CLD50 menunjukkan bahwa ayam yang sebelumnya diinfeksi dengan virus ND
11 diantaranya penurunan nafsu makan, bulu kusam, bersin, batuk, ngorok, diare, terdapat eksudat dan lemah serta berakhir dengan kematian. Masa inkubasi penyakit ini beragam antara 2-15 hari, tergantung dari jenis virus yang menginfeksi, umur dan status kekebalan unggas, infeksi dengan organisme lain, kondisi lingkungan dan jalur penularan (Alexander 2003).
SIMPULAN
Titrasi virus Newcastle Disease (ND) Gen VII isolat lapang yang telah diuji dengan uji HA memiliki titer virus tertinggi sebesar 512 HAU (29) dengan titer virus infektif sebesar 1010 EID50/ml dan 107.48 CLD50/ml menunjukkan bahwa
isolat lapang ND Gen VII memiliki titer virus yang cukup tinggi dan dapat digunakan sebagai virus standar pada uji tantang vaksin.
DAFTAR PUSTAKA
Agung MA, Mantik MA, Santhia AP, Matsumoto Y. 2008. Deteksi virus penyakit tetelo isolat lapangan dengan metode nested reserve transcriptase-polymerase chain reaction. J.Vet. Bali. 2(1): 74-76
Akoso BT. 1998. Kesehatan Unggas Panduan bagi Petugas Teknis, Penyuluh dan Peternak. Yogyakarta (ID): Kanisius.
Alexander DJ. 2003. Newcastle Disease, Other Avian Paramyxoviruses, and Pneumovirus Infections. Di dalam : Frank Jordan et al, editor. Disease of Poultry. Edisi ke-11. Blackwell Publishing. Hlm 63-81.
Allan WH, Lancaster JE, Thoth B. 1978. Newcastle Disease Vaccines : Their Production and Use. Rome (IT): FAO Animal Product and Health Series No.10.
Cahyono MI. 2010. Pengaruh Waktu dan Suhu Penyimpanan Terhadap Daya Tahan Antigen Virus Newcastle Disease. Bogor (ID): Balai Besar Penelitian Veteriner.
Darminto. 1996. Vaksinasi secara lateral pada ayam pedaging: pengaruh rasio dan densitas. Bogor (ID): Jurnal Ilmu Ternak dan Veteriner. 1(3): 178-184. Darminto dan P. Ronohardjo. 1996. Vaksin Newcastle Disease Inaktif Berasal
dari Virus Isolat Lokal Galur Velogenik. Bogor (ID): Balai Penelitian Veteriner.
[DEPTAN] Departemen Pertanian RI. 2006. Restrukturisasi Sistem Perunggasan di Indonesia [internet]. [diunduh pada 2013 Juni 20]. Tersedia pada: http://www.ditjennak.go.id.
Dortmans JC, Koch G, Rottier PJ, Peeters BP. 2011. Virulence of Newcastle Disease Virus : What is Known So Far?. Netherlands (NL): Veterinary Research. 42:122.
12
Titer Antibodi pada Ayam serta Pertumbuhan dan Perubahan
Histopatologis pada Telur Ayam Bertunas. Surabaya (ID): Lembaga
Penilitian Universitas Airlangga.
Fadillah R dan Polana A. 2004. Aneka Penyakit pada Ayam dan Cara Mengatasinya. Jakarta (ID): PT.Agromedia Pustaka.
[FAO]. 2004. Newcastle Disease Vaccines: an Overview [internet]. [diunduh 2013 Juni 20]. Tersedia pada: http://www.fao.org/DOCREP005/ AC802E/ac802e04.htm.
Fenner J dan Fransk. 1995. Virologi Veteriner Edisi kedua. Harya P, Penerjemah. Semarang. IKIP Semarang Press. Terjemahan dari: Veterinary Virology. Gillingham S. 2006. General principles of vaccination [internet]. [diunduh 2013
Juni 20]. Tersedia pada: http://www.canadianpoultry.ca/ principles_of_vaccination.htm.
Grimes SE. 2002. A basic laboratory manual for the small scale production and testing of 1 – 2 Newcastle Disease Vaccine. FAO Regional Office for Asia and the Pacific.Bangkok (TH): RAP Publication.
Herenda DC, Franco DA. 1996. Poultry Disease and Meat Hygiene: a Color Atlas. Iowa (US): Iowa State State University Pr.
Kayne SB dan Jepson MH. 2004. Veterinary Pharmacy. London (UK): Pharmaceutical Pr.
Lamb RA, Collins PL, Kolakofsky D, Melero JA, Nagai Y, et al. (2005) Family paramyxoviridae. In: Fauquet CM, Mayo J, Maniloff J, Desselberger U, Ball LA, editors. Virus taxonomy: 8th report of the International Committee on Taxonomy of Viruses. San Diego (US): Elsevier. pp. 655–668.
Nahamya FH, Mukiibi-Muka G, Nasinyama GW, Kabasa JD. 2006. Assessment of the cost efectiveness of vaccinating pee range poultry against Newcastle disease in Busedde sub-county, Jiitja district, Uganda In Livestock Research for Rural Development 18 (11) 2006. [internet]. [diunduh 2013 Juli 30]. Tersedia pada: http://www.ci~av.org.collrrd/lrrdlS/l lIcontlSl 1 .htm.
Nugroho. 1981. Penyakit Ayam di Indonesia. Semarang (ID): Eka Offset.
[OIE]. Office International des Epizootics World Organization. 2012. OIE Terestrial Manual Paris (FR): 1-19
Syahrurrachman. 1994. Mikrobiologi Kedokteran. Jakarta (ID): Bina Rupa Aksara Tizzard IR. 1988. Pengantar Imunologi Veteriner Edisi II. Partodiredjo M,
Penerjemah. Surabaya (ID): Airlangga University Press. Terjemahan dari :
Introduction to Veterinary Immunology.
Yusoff K dan Tan WS. 2001. Newcastle disease virus: macromolecules and opportunities. Selangor (MY): University Putra Malaysia. Terjemahan dari:
13
RIWAYAT HIDUP
DK Farah Ana Binti Zaidun dilahirkan di Sabah, Malaysia pada tanggal 17 Juli 1990 dari pasangan Zaidun Bin Pg. Hj. Mohd Noor dan Norah Binti Abu Bakar. Penulis merupakan anak pertama dari lima bersaudara.
Penulis menyelesaikan pendidikan awal di Tabika (Taman Bimbingan Kanak-Kanak) Khoi Ming, Kota Marudu dan melanjutkan pendidikan dasar di Sekolah Rendah Jenis Cina (SRJK) Khoi Ming, Kota Marudu. Kemudian pada tahun 1998, penulis berpindah ke Sekolah Kebangsaan (SK) Tanjung Aru, Kota Kinabalu. Pada tahun 1999-2001, penulis melanjutkan pendidikan dasar di SD Babakan I, Malabar, Bogor dan pada tahun 2002 penulis menyelesaikan pendidikan dasar di SK Kolombong, Kota Kinabalu. Pada tahun 2003 Penulis melanjutkan pendidikan menengah di Sekolah Menengah Kebangsaan (SMK) Arshad, Kota Belud. Kemudian penulis berpindah dan melanjutkan pendidikan menengah selama empat tahun sehingga selesai di Sekolah Menengah Kebangsaan (SMK) Kota Marudu, Sabah pada tahun 2007. Tahun 2008 penulis diterima sebagai mahasiswa Fakultas Kedokteran Hewan, Institut Pertanian Bogor melalui jalur mahasiswa asing.