KAJIAN KONTAMINASI VIRUS NEWCASTLE DISEASE
(VND) DARI BEBERAPA PASAR TRADISIONAL
DI WILAYAH JAWA BARAT DAN BANTEN
PUPIMADITA TIZAR AFDORA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kajian Kontaminasi Virus Newcastle Disease (VND) dari Beberapa Pasar Tradisional di Wilayah Jawa Barat dan Banten adalah benar karya saya denganarahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Pupimadita Tizar Afdora
RINGKASAN
PUPIMADITA TIZAR AFDORA. Kajian Kontaminasi Virus Newcastle Disease (VND) dari Beberapa Pasar Tradisional di Wilayah Jawa Barat Dan Banten. Dibimbing oleh RETNO DAMAJANTI SOEJOEDONO dan SURACHMI SETIYANINGSIH.
Penyakit tetelo atau Newcastle disease (ND) merupakan penyakit menular
penting pada unggas yang disebabkan oleh virus Newcastle disease (VND) strain
virulen dari avian paramyxovirus tipe 1 (APMV-1). Penyakit endemik ini telah
menyebabkan kerugian yang cukup besar terhadap industri peternakan di Indonesia. Penelitian ini bertujuan mengkaji keberadaan VND di lingkungan pasar tradisional, khususnya melalui isolasi, identifikasi dan penentuan patotipevirus baik secara molekuler maupun biologis.
Pasar kajian meliputi 30 pasar tradisional di wilayah Propinsi Jawa Barat dan Banten; 20 pasar diantaranya mendapatkan program intervensi peningkatan higienitas pedagang dalam proses berdagang daging ayam (karkas) ataupun ayam hidup. Tiap pasar diambil sampel 2 kali, yaitu tiga dan enam bulan setelah intervensi. Sebanyak 60 pool sampel lingkungan dipasase ke telur ayam berembrio (TAB) sebanyak 2 kali. Pertumbuhan virus di cairan alantois dideteksi dengan uji hemaglutinasi (HA). Semua sampel positif HA diuji lebih lanjut menggunakan uji molekuler, serologis, elusi dan biologis.
Hasil menunjukkan 13 dari 60 panenan cairan alantois positif uji HA. Pengujian menggunakan teknik real-time reverse-transcriptation polymerase chain reaction (rRT-PCR) dengan target gen matrix mengidentifikasi 12 isolat
sebagai VND, yang mana 10 diantaranya merupakan VND ganas karena positif dengan rRT-PCR fusion. Karakterisasi antigenik dengan uji Hemaggutination Inhibition (HI), menunjukkan ke-12 sampel positif VND memiliki variasi
antigenisitas dari 3Log2 sampai 6Log2 dengan antisera Hitchner B1 dan dari 4,5Log2 sampai 6,5Log2 dengan antisera Komarov, akan tetapi 10 sampel positif F memiliki afinitas lebih tinggi dengan antisera Komarov.
Uji elusi menunjukkan 1 lentogenik, 5 mesogenik dan 7 velogenik berdasarkan lama waktu elusi sampel. Akan tetapi hasil ini memperlihatkan variasi tipe yang berbeda dengan hasil rRT-PCR fusion. Hasil yang berbeda pada
uji elusi dan rRT-PCR digunakan sebagai dasar pemilihan 2 sampel yang dilanjutkan ke pengujian ke ayam umur 7 hari. Kedua isolat positif fusion teridentifikasi merupakan tipe lentogenik dan mesogenik melalui uji elusi, ternyata mematikan unruk semua ayam. Semua ayam yang diinfeksi memperlihatkan gejala klinis khas VND. Hasil positif VND juga ditemukan di otak dan proventrikulus dengan rRT-PCR. Hal ini menunjukkan bahwa uji elusi saja masih belum dapat dijadikan acuan untuk menentukan virulensi virus.
implementasi kebersihan dapat menurunkan penyebaran meskipun tidak cukup untuk menghilangkan VND dari lingkungan pasar. Penelitian ini membuktikan bahwa pasar memiliki potensi menjadi satu tempat penyebaran VND.
SUMMARY
PUPIMADITA TIZAR AFDORA. Study of Newcastle Disease Virus (NDV) Contamination from in West Java and Banten Provincies. Under direction RETNO DAMAJANTI SOEJOEDONO and SURACHMI SETIYANINGSIH.
Newcastle disease (ND) is an important infectious disease in poultry caused by virulent Newcastle disease virus (NDV) strains of avian paramyxovirus type 1 (APMV-1). The disease is endemic in Indonesia and causes a great economic losses to the national poultry industry. The aims of this study was to examine the presence of NDV in the traditional market environment via virus isolation, identification and pathotyping using serological, molecular and biological.
The study includes 30 traditional markets in West Java and Banten areas; 20 of them received intervention program to improve the hygienic practises among merchants in selling chicken meat (carcass) or live chicken. Each market sampled twice at three and six monts after the intervention program. A total of 60 pool environment samples were passaged twice in embryonated chicken eggs (ECE). The virus growth in the allantoic fluid (AF) was detected using Hemagglutination (HA). All haemagglutinating samples were further tested by molecular, serological, elution and bioassay methods.
The HI test showed 13 out of 60 harvested AF have hemagglutinating activity. Further testing using real-time reverse-transcriptation polymerase chain reaction (rRT-PCR) technique targeted the matrix gene identified 12 isolatesas NDV, and 10 of them were recognized as virulent strains by rRT-PCR fusion. Antigenicexaminationof all isolates using hemaggutination inhibition (HI) test suggested antigenic variation among isolates with HI titers ranging from 3Log2 to 6Log2 and from 4,5Log2 to 6,5Log2 using lentogenic Hitchner B1 and mesogenic Komarov antisera, respectively. The 10 virulent strains identified by rRT-PCR fusion have a higher affinity to Komarov antisera.
The elution test identified 1 lentogenic, 5 mesogenic and 7 velogenic strains based on their haemagglutination-elution profile, which shows a few disagreements with rRT-PCR fusion. This finding was used as the basis for selecting two isolates for bioassay using 7-day old chickens. Both fusion positive isolates, identified as lentogenic and pathogenic by elution test were deadly for the chickens, which showed clinical and pathological symptoms typical of ND. The presence of the virus was confirmed in the brain and proventriculus of all infected chickens.This shows that the elution test alone cannot be used to determine the virulence of the virus.
intervention. Significant reduction in the number of contaminated market was shown after 6 moths of intervention, in which NDV was detected only in 1 market recieving intervention. This study proves that traditional market has the potential to spread NDV to the environment, and that consistent implementation of hygienic practices can reduce NDV contamination. Other biosecurity measures need to be implemented to enable elimination of NDV from market environment. Keywords: Environment, live bird market, Newcastle disease, pathotyping,
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medis
KAJIAN KONTAMINASI NEWCASTLE DISEASE (VND)
DARI BEBERAPA PASAR TRADISIONAL DI WILAYAH
JAWA BARAT DAN BANTEN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Kajian kontaminasi virus newcastle disease (VND) dari beberapa
pasar tradisional di wilayah Jawa Barat dan Banten Nama : Pupimadita Tizar Afdora
NIM : B253110011
Disetujui oleh Komisi Pembimbing
Prof. Dr. Drh. Retno Damayanti Soejoedono, MS
Ketua
Drh. Surachmi Setyaningsih, Ph.D. Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi Medis
Prof . Dr. Drh. Fachriyan Hasmi Pasaribu
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 24 Juni 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2013 sampai Desember 2014ini ialah Virus Newcastle Disease, dengan judul Kajian
kontaminasi Virus Newcastle Disease (VND) dari beberapa pasar tradisional di
wilayah jawa barat dan banten.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. Drh. Retno Damayanti Soejoedono, MS dan Ibu Drh. Surachmi Setiyaningsih, Ph.D yang telah banyak memberi saran dan masukan. Di samping itu, penghargaan penulis sampaikan kepada Bapak Prof. Dr. Drh. Fachriyan Hasmi Pasaribu selaku ketua program studi Mikrobiologi Medik. Terima kasih untuk Para Staff Laboratorium Terpadu Mikrobiologi FKH IPB. Terima kasih untuk Drh. Uni Purwaningsih, M.Si, Drh. Darniati, M.Si, Drh. Aprizal Panus, M.Si, Drh.M. Daud AK dan Drh. Maya Shofa atas bantuan dan dorongan semangat selama ini. Terima kasih kepada rekan-rekan MKM semoga silaturrahmi kita tetap terjalin.Ungkapan terima kasih juga saya sampaikan kepada Ayahanda Drs. Zainuri, SH, M.Pd dan ibunda Dra. Harti Kartini, M.Pd, yang telah memberikan do’a dan dukungannya. Terima kasih untuk kakakku Rerenstradika Tizar Terryana, SP. M.Si, dan adikku Damangrea Tizar Balamrayoga, ST yang memberikan motivasi dan kekuatan yang sangat besar, juga keluarga besar yang telah mendukung selama penulis menyelesaikan pendidikan di Mayor Mikrobiologi Medis, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
Sejarah Penyebaran Penyakit Newcastle Disease (ND) 4
Newcastle Disease Virus (VND) 5
Struktur dan karakteristik virus 6
Replikasi Virus 7
Epidemiologi dan Transmisi VirusNewcastle Disease 8
Inang (Host) 8
Penyebaran dan Penularan 9
Gejala Klinis 9
Perubahan Patologis Infeksi virus Newcastle Disease 10
Teknik Diagnosa 10
Kondisi Umum Pasar Tradisional di Indonesia 11
3 METODE 12
Uji Hemaglutination (HA) dengan metode mikrotitrasi 14
Uji Hemaglutination Inhibition (HI) dengan metode mikrotitrasi 14
Uji waktu elusi dengan metode mikrotitrasi 14
Ekstraksi RNA 15
Uji Realtime Reverse Transcriptation Polychain Reaction (RRT-PCR) 15
Keragaman antigenisitas VND dengan uji Hemaglutination Inhibition (HI)
18
Karakterisasi VND dengan metode elusi 19
Infeksi pada ayam SPF 22
Perbandingan karakter VND dari berbagai metode pengujian 26 Hubungan kebersihan pasar dengan penyebaran VND 26
5. Kesimpulan 29
Kesimpulan 29
Saran 30
DAFTAR TABEL
1. Daftar pasar asal sampel koleksi 13
2. Pasangan primer dan probe serta kondisi rRT-PCR untuk mendeteksi
VND 16
3. Karakteristik 13 isolat asal lingkungan pasar 21 4. Perbedaan gross lesion pada berbagai macam organ yang telah diinfeksi
dengan NDV/Env/Ciamis/Indonesia/2013/02/TM1 dan NDV/Env/Ciamis/Indonesia/2012/11/TM3 bila dibandingkan dengan
kontrol. 24
5. Perbandingan tipe patogenisitas VND berdasarkan tiga jenis pengujian 26
DAFTAR GAMBAR
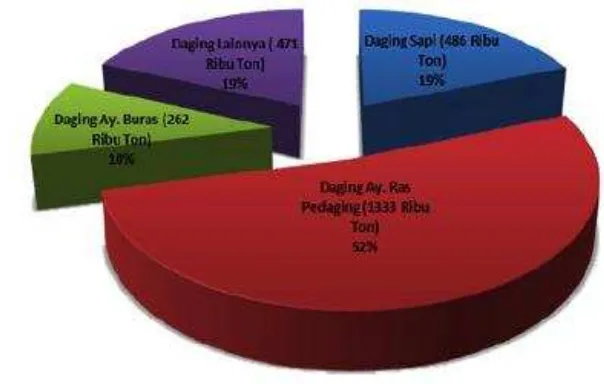
1. Produksi daging konsumsi tahun 2012 3
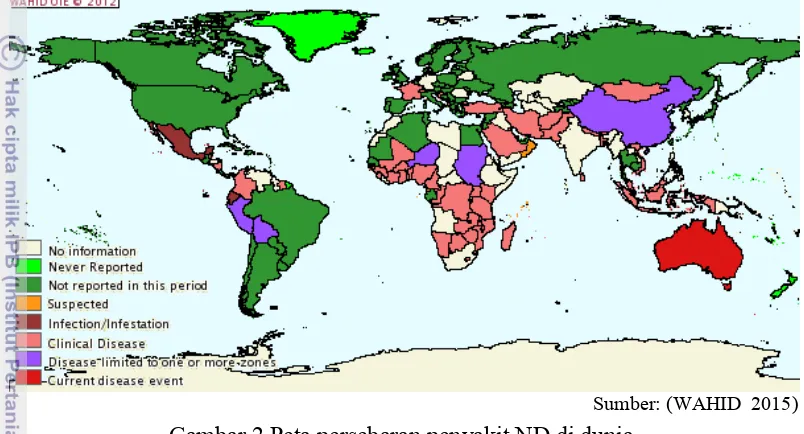
2. Peta persebaran penyakit ND di dunia 5
3. Taksonomi family Paramyxoviridae 6
4. Skema Struktur VND 6
5. Susunan Genom VND 7
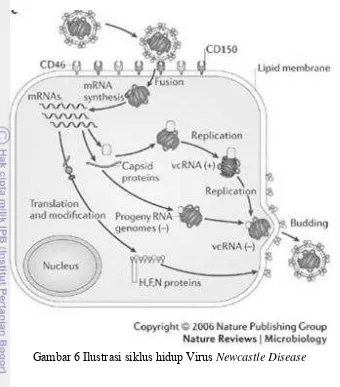
6. Ilustrasi siklus hidup Virus Newcastle Disease 8
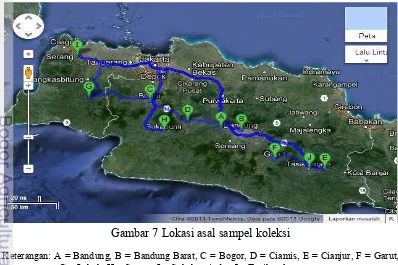
7. Lokasi asal sampel koleksi 13
8. Hasil deteksi sampel menggunakan rRT-PCR 18
9. Perbandingan titer HI isolat VND 19
1
PENDAHULUAN
Latar Belakang
Penyakit tetelo atau Newcastle disease (ND) merupakan salah satu penyakit
menular pada unggas. Penyakit yang memiliki karakteristik mudah menular,
mudah menyebar dan dapat menyerang unggas semua umur ini disebabkan oleh virus Newcastle Disease (VND) atau strain virulen dari avian paramyxovirus tipe
1 (APMV-1). Virus ini termasuk dalam genus Avulavirus anggota dari subfamili Paramyxovirinae dan famili Paramyxoviridae. Paramyxoviridae merupakan jenis virus dengan genom untai tunggal RNA negatif sense, panjang genomnya 15-16 kb dan mempunyai amplop dengan dua lapis lemak (bilayer lipid membrane) dan
kapsid simetris heliks, tidak bersegmen, berdiameter 13-18 nm (Fenner et al.
1995, Miller et al. 2010). Virus ini menginfeksi lebih dari 250 spesies dari 27
golongan unggas. Spesies yang biasa terinfeksi antara lain ayam, kalkun, merpati dan bebek (Alexander dan Senne 2008). Lima manifestasi klinis ND menurut Beard dan Hanson (1984), antara lain Viscerotropic Velogenic ND
(VVND),Neurotropik Velogenic ND (NVND), Mesogenic ND, Lentogenic ND,
dan Asymthomatic.
Gejala klinis digunakan sebagai diagnosa awal sedangkandiagnosa lanjutan dilakukan di laboratorium (identifikasi agen penyakit dan uji serologi). Identifikasi agen penyakit dapat dimulai dari pengambilan sampel untuk isolasi virus, uji keberadaan virus dengan isolasi dengan metode pasase ke telur ayam berembrio (TAB) atau kultur jaringan, identifikasi dengan menggunakan uji HA dan HI, uji patogenisitas dengan metodeMean Death Time (MDT), Intravenous Pathogenicity Test (IVPT) dan Intracerebral Pathogenicity Index (ICPI) dan
dengan menggunakan pendekatan molekuler (OIE 2013). Metode pendekatan molekuler menggunakan realtime Reverse Transcriptase Polymerase Chain Reaction (rRT-PCR) bagian yang dideteksi adalah asam amino tambahan pada
bagian fusion VND karena asam amino fusion diketahui sebagai penyebab
virulensi dan sering digunakan sebagai karakter patogenisitas VND (Aldous dan Alexander 2001).
Penyebaran ND secara umum bisa terjadi melalui kontak langsung dengan sekresi maupun eksresi unggas yang terinfeksi.Virus dapat dikeluarkankan baik di feses maupun melalui sekresi respirasi. Olesiuk (1951), APMV-1 dapat bertahan pada lingkungan yang bervariasi dimungkinkan karena beberapa faktor, antara lain kelembaban, temperatur udara, dan paparan cahaya. Proses penularan VND umumnya melalui rute pencernaan (fecal/oral) dan pernafasan(Charles 2000).
Tingginya tingkat penularan dan kerugian ekonomi menyebabkan organisasi kesehatan hewan dunia (OIE) mengolongkan penyakit ini dalam kategori “notifiable diseases” (OIE 2013). Tingkat kejadian ND terdapat di seluruh dunia
2 maupun tidak langsung pada lingkungan dengan tingkat lalu lintas yang tinggi.Salah satu tempat dengan lalu lintas yang tinggi adalah pasar tradisional.
Pasar merupakan salah satu tempat karena di pasar pertukaran ekonomi, budaya dan pengetahuan karena di dalam pasar terjadi interaksi antara pedagang, pembeli, bahan yang diperjualbelikan yang salah satunya merupakan unggas baik dalam keadaan mati (karkas) maupun yang hidup. Daging unggas merupakan salah satu jenis protein hewani yang mudah didapat dan paling banyak dikonsumsi oleh masyarakat Indonesia (Gambar 1). Persentase lebih dari 60% pada gambar menunjukkan bahwa secara umum konsumsi daging ayam ras pedaging per kapita di Indonesia lebih tinggi dibandingkan konsumsi jenis-jenis daging lain (Ditjennak 2012). Sebagian besar masyarakat Indonesia menggunakan fasilitas pasar untuk membeli unggas hidup dan/atau daging unggas. Pasar tradisional di Indonesia merupakan bagian terbesar dari seluruh tempat belanja masyarakat Indonesia (Soeharno 2002). Provinsi Jawa Barat sendiri merupakan salah satu daerah penyangga produksi ternak ayam pedaging nasional. Sentra produksi ternak ayam pedaging di Provinsi Jawa Barat antara lain di Kabupaten Bogor dan Bandung disamping beberapa kabupaten yang lain seperti Tasikmalaya, Ciamis, Purwakarta serta Subang. Sebagai sentra produksi peternakan, maka provinsi Jawa Barat bertanggung jawab terhadap penyediaan hasil produksi yang sehat dan aman untuk dikonsumsi. Banyak kasus penyakit menular pada unggas yang studi kasusnya dilakukan di Jawa Barat. Upaya pemantauan penyakit, pencegahan serta penanganan dilakukan untuk tujuan yang lebih luas. Sebagai pendukung maka sistem produksi, sistem pemeliharaan serta sistem pemasarannya (Ditjennak 2012).
Kondisi pasar tradisional di Indonesia terutama di wilayah Jawa Barat tidak dapat dikatakan bagus. Hal ini dapat menjadi salah satu kondisi penyebaran dan penularan penyakit. Hal ini dibuktikan oleh penelitian Indriani et al. (2010),
terdeteksi keberadaan virus H5N1 (flu burung) pada 3 dari 82 sampel usap lingkungan. Sampel lingkungan yang diambil antara lain usap talenan, pisau, pegangan pisau, tempat pembuangan, lap yang digunakan untuk membersihkan permukaan meja dagangan, dan permukaan dari meja dagangan. Penyakit yang disebabkan oleh virus dapat dengan mudah menyebar. Penularan ND dapat terjadi secara langsung melalui droplet yang dihasilkan oleh unggas yang terinfeksi,
3
Sumber: (Ditjennak 2012)
Gambar 1 Produksi daging konsumsi tahun 2012
Salah satu program yang ditetapkan pemerintah untuk menanggulangi penyebaranVND adalah vaksinasi. Strain vaksin yang terdaftar di Indonesia antara lain La Sota, Clone 30, N63, Ulster 2C, F, B1 Hitchner, VH, ITA, Komarov,
Hertz, Kimber dan Mukteswar (Ditjennak 2012). Salah satu seed vaksin yang
sering digunakan adalah strain Lasota. Penelitian Ideris (1993), mengungkapkan bahwa terdapat perbedaan jarak genetik antara VND di Indonesia dengan strain virus Lasota kurang lebih 20%. Berdasarkan susunan asam amino, perbedaan susunan asam amino dengan Lasota sebanyak 13 gugus asam aminoNamun. Perbedaan asam amino ini dapat menjadikan penyebab adanya kegagalan program vaksinasi.Melihat tingginya angka kejadian dan kondisi pasar tradisional, maka tidak menutup kemungkinan bahwa penyakit ini dapat menyebar ke lingkungan.
Perumusan Masalah
Newcastle disease merupakan penyakit dengan tingkat kejadian cukup
4 Tujuan Penelitian
Secara umum penelitian ini bertujuan mengkaji keberadaan virus Newcastle Disease di beberapa lingkungan pasar tradisional. Secara khusus penelitian ini
dengan rRT-PCR, mengisolasi dan mengidentifikasi karakteristik virus Newcastle disease asal lingkungan dengan rRT-PCR dan patogenitasnya.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat dijadikan informasi mengenai keberadaan virus Newcastle disease pada lingkungan pasar tradisional sehingga
dapat dijadikan acuan untuk mengevaluasi program biosekuriti pada pasar tradisional.
Ruang Lingkup Penelitian
Dalam penelitian ini dilakukan serangkaian kegiatan yaitu koleksi sampel berupa usap lingkungan, kloaka dan trakhea dari ayam pedaging dan ayam kampung yang dijual di pasar tradisional; isolasi virus Newcastle disease;
identifikasi virus Newcastle disease dengan uji serologis; deteksi virus Newcastle disease dengan metode rRT-PCR; uji patogenitas isolat virus Newcastle disease.
Hipotesis
Virus Newcastle Disease yang berasal dari usap lingkungan pasar
tradisional yang telah terlebih dahulu ditumbuhkan pada telur ayam berembrio (TAB) dapat dideteksi dengan rRT-PCR. Karakterisasi isolat virus dapat dilakukan dengan uji serologis, rRT-PCR fusion, uji elusi dan uji patogenisitas serta karakter VND yang diperoleh beragam.
2
TINJAUAN PUSTAKA
Sejarah Penyebaran Penyakit Newcastle Disease (ND)
Newcastle disease (ND) merupakan salah satu penyakit unggas yang sangat
penting di industri peternakan. Distribusi ND sudah terjadi di seluruh dunia antara lain Asia, Afrika dan Amerika, hanya negara-negara Oceania relatif bebas dari penyakit ini, meskipun wabah yang serius pernah terjadi di Australia selama tahun 1998-2000 (Gambar 2) (Kirkland 2000). ND juga merupakan penyakit unggas yang sangat merugikan secara ekonomi karena infeksi yang diakibatkan dapat berupa tidak ada gejala apa-apa sampai dapat menyebabkan kematian mencapai 100% (Beard dan Hanson 1984, Cattoli et al. 2011).
Kasus outbreak Newcastle Disease pertama di Indonesia terjadi pada tahun
5 penyakit yang ganas. Kejadian wabah pertama kali dilaporkan di Jawa Barat, Indonesia dan diidentifikasi oleh Prof. Kranevelt di laboratorium yang sekarang dikenal sebagai Balai Penelitian Veteriner (Balitvet) Bogor dan terjadi pula pada tahun 1927 di daerah Newcastle, Inggris (Doyle 1927), penyebab penyakit ini diidentifikasi oleh Doyle. Nama Newcastle Disease sendiri baru digunakan oleh
Doyle setelah tahun 1935 (Samal 1997).
Sumber: (WAHID 2015)
Gambar 2 Peta persebaran penyakit ND di dunia
Brown et al. (1999), mengemukakan bahwa di Inggris, ND dapat
menyebabkan angka kematian unggas yang terkena lebih dari 90 %. Wabah ND di California, Nevada dan Texas, Amerika Serikat menyerang lebih dari 3,4 juta ekor unggas dan memerlukan biaya lebih dari US $ 5 Milyar untuk pengendalian penyakit. Kejadian lain di Australia, pada beberapa tahun terakhir ini juga membuat panik kalangan industri perunggasan, karena dampak secara ekonomi sangat tinggi. Kerugian berupa kematian, pengendalian penyakit serta penghentian import dari negara-negara yang terserang wabah ND. Karena kemampuan penyakit ini berbeda dari penyakit yang mematikan unggas lainnya. dalam kurun beberapa tahun ND telah menyebar ke seluruh dunia dan menjadi endemik di banyak negara. Hal ini diperlihatkan bahwa pada tahun 2010 terdapat wabah yang dilaporkan berada di Belgia, Belize, Perancis, Jerman, Honduras, Israel, Jepang, Mongolia, Peru dan Spanyol (WAHID 2015)
Newcastle Disease Virus (VND)Newcastle disease disebabkan oleh Virus
Newcastle Disease (VND) atau avian paramyxovirus tipe 1 (APMV-1). Virus ini termasuk dalam genus Avulavirus anggota dari subfamili Paramyxovirinae dan famili Paramyxoviridae. Sampai saai ini family Paramyxoviridae diklasifikasikan dalam 10 serotipe yaitu APMV-1 sampai dengan APMV-10 (Gambar 3) (OIE 2013). Serotipe VND dibagi menjadi 2 kelas (Czegledy et al. 2006). Kelas I
berasal dari unggas air dan burung pantai (Czegledy et al. 2006, Kim et al. 2007)
6
Sumber: (Najjar et al. 2014)
Gambar 3 Taksonomi family Paramyxoviridae
Struktur dan karakteristik virus
Paramyxoviridae merupakan jenis virus dengan genom untai tunggal RNA negatif sense, panjang genomnya 15-16 kb dan mempunyai amplop dengan dua lapis lemak (bilayer lipid membrane) dan kapsid simetris heliks, tidak bersegmen,
berdiameter 13-18 nm (Gambar 4) (Fenner et al. 1995, Miller et al. 2010). Di
sekeliling amplop terdapat dua jenis glikoprotein yaitu protein haemagglutinin-neuraminidase (HN) dan fusion (F). Dua jenis glikoprotein ini merupakan protein
kompleks yang bekerjasama dalam proses infeksi. Diantara membran lipid ini ada sebuah lapisan yang protein matriks (M) hydrophobic non-glycosylated, yang
tidak hanya dikaitkan dengan membran tetapi juga dengan segmen N-terminal dari protein HN yang berlokasi di permukaan dalamnya. Protein M diperkirakan berinteraksi dengan protein nukleokapsid (NP) yang merakit morfologi
herringbone klasik yang dapat dilihat jelas ketika membran virus rusak. Struktur
seperti herringbone terdiri dari beribu subunit NP yang terkait erat dengan beberapa copy dari phosphoprotein (P) dan large protein (L) (Yusoff dan Tan
2001).
Sumber: (Najjar et al. 2014)
7 Genom VND terdiri dari 15.186 , 15.192 atau 15198 nukleotida (nt). Genom ini mengandung enam open reading frame (ORF) yang menyandi nukleoprotein
(NP), phosphoprotein (P), matriks protein (M), protein fusi (F), hemaglutinin-neuraminidase (HN) dan RNA dependent RNA polymerase (L) serta protein non
struktural yaitu V dan W yang dihasilkan oleh RNA editing selama transkripsi gen P. Diantara gen terdapat nukleotida non-coding yang disebut dengan daerah
intergen. Panjang basa pada daerah ini bervariasi antara 1 sampai dengan 47 nukleotida (OIE 2013). Skema susunan genom VND diperlihatkan pada Gambar 5.
Gambar 5 Susunan Genom VND
Keterangan: NP=nukleoprotein, P=phosphoprotein, M=matriks protein, F=protein fusi,
HN=hemaglutinin-neuraminidase, L=RNA dependent RNA polymerase, V dan W
= protein non struktural
Replikasi Virus
Proses infeksi virus dimulai dengan penempelan membran sel virus dengan sel target. Ikatan glikoprotein HN dengan asam sialik pada permukan sel target. menggertak protein F untuk melakukan fusi sel. Setelah fusi terjadi, kompleks ribonukleoprotein (RNP kompleks) yang terdiri dari genom RNA yang terbungkus oleh Nukleoprotein bekerjasama dengan komplek polimerase membentuk protein L dan P. Nukleokapsid masuk ke sitoplasma sel. Virus ND mempunyai genom negatif-sense RNA, maka RNA dependent RNA polymerase (L)
diperlukan untuk masuk ke dalam sel dan genom RNA diperlukan untuk transkripsi terjadi. Positif-sense RNA intermediates terbentuk yang bertindak
sebagai mRNA. Virus menggunakan mekanisme sel inang untuk translasi protein.
Protein virus di transportasikan ke membran sel untuk pembentukan virion. Membran sel inang dimodifikasi dan membentuk amplop virus yang baru. Protein nukleokapsid akan tersusun dalam membran baru untuk membentuk RNP yang kompleks. Partikel-partikel virus baru yang dibebaskan dengan budding melalui
8
Gambar 6 Ilustrasi siklus hidup Virus Newcastle Disease
Epidemiologi dan Transmisi VirusNewcastle Disease Inang (Host)
Newcastle disease dapat menginfeksi lebih dari 250 spesies dari 27
golongan unggas. Sebagian jenis unggas ada yang terserang virus ini menujukkan gejala sementara ada beberapa jenis unggas yang lain tetap tidak menunjukkan gejala. Contoh jenis unggas yang peka terhadap penyakit ini antara lain ordo Psittaciformes, Struthioniformes, Columbiformes, Charadriiformes, Strigiformes, Pelecaniformes, dan Passeriformes. Sedangkan jenis unggas yang resisten ataupun tidak menunjukkan gejala klinis walaupun terinfeksi ND antara lain golongan Raptor dan ordo Anseriformes. Tingkat kejadian dan kematian terhadap infeksi ND bergantung pada jenis atau strain virus yang menyerang. Selain pada golongan Unggas, penyakit ini juga dapat menyerang manusia. Manifestasi yang terjadi adalah konjungtivitis, oedema pada kelopak mata, dan hemoragic pada bagian sub-conjuctival dilaporkan terjadi 24 jam setelah terinfeksi VND pada bagian mata (Swayne dan King 2003). Berdasarkan Goebel et al. (2007),
9
Penyebaran dan Penularan
Penyebaran ND secara umum bisa terjadi melalui kontak langsung dengan sekresi maupun eksresi unggas yang terinfeksi. Virus dapat disheddingkan baik di
feces maupun di sekresi respirasi. Kemampuan masing-masing unggas dalam shedding virus berbeda-beda. Contohnya pada ordo Gallinaceous dapat mengeksresikan virus dalam waktu 1-2 minggu sedangkan ordo Psittaciformes membutuhkan waktu lebih lama yaitu beberapa bulan. Kemampuan bertahan hidup dari virus ini sangat tinggi, salah satunya masih dapat bertahan hidup walaupun inangnya telah mati. Berdasarkan Olesiuk (1951), APMV-1 dapat bertahan pada lingkungan yang bervariasi dimungkinkan karena beberapa faktor, antara lain kelembaban, temperature udara, dan paparan cahaya. Sumber penularan virus dapat berasal dari eksresi/sekresi unggas yang terinfeksi, semua bagian dari karkas, sheeding virus, maupun bekas kandang yang pernah terinfeksi
dan lingkungan yang tidak bersih. Proses penularan ND umumnya melalui rute pencernaan (fecal/oral) dan inhalasi (Charles 2000, OIE 2012). Secara umum
penularan ND terjadi secara horizontal. Sedangkan anak ayam yang baru menetas juga dapat terinfeksi penyakit ini dari cangkang yang terkontaminasi (Fenner et al.
1995).
Gejala Klinis
Tanda-tanda klinis yang muncul secara umum meliputi gangguan pada sistem saraf, sistem pernafasan, sistem gastrointestinal dan juga sistem reproduksi. Morbiditas biasanya tinggi dan mortalitas bervariasi antara 0-100 %. Mortalitas yang lebih tinggi terlihat pada ayam yang tidak divaksinasi tetapi terkena infeksi tipe velogenik (Calnek et al. 1997). Lima manifestasi klinis ND menurut Beard
dan Hanson (1984), diidentifikasikan sebagai berikut : 1. Viscerotropik Velogenik ND (VVND)
Jenis ini merupakan jenis yang sangat virulen untuk ayam, tetapi kurang virulen pada kalkun. Gejala Klinis yang diperlihatkan adalah gangguan pernafasan parah, sering terlihat adanya lesi hemoragic pada usus dan menyebabkan kematian sampai 90 %.
2. Neurotropik Velogenik ND (NVND)
Bersifat akut dan fatal pada ayam semua usia, menyebabkan gangguan neurologis dan gangguan pernafasan.
3. Mesogenik ND
Tipe ini menyebabkan gangguan pernafasan, kadang kala menunjukkan gejala gangguan syaraf, dan mempengaruhi kualitas dan produksi telur serta mengakibatkan kematian sampai 10 %.
4. Lentogenik ND
Tipe ini bersifat ringan, kadang-kadang subklinis. Mempengaruhi hewan pada segala usia. Strain ini dapat dikembangkan sebagai vaksin, menghasilkan tanda-tanda ringan dengan tingkat mortalitas yang dapat diabaikan.
5. Asimtomatik
10 Gejala awal yang umum terjadi adalah gangguan pernapasan dan serak yang diikuti dengan kelumpuhan kaki, sayap dan tortikolis leher pada 1 atau 2 hari berikutnya (Kommers et al. 2002). Pada unggas dewasa, penurunan produksi
yang bersamaan dengan gangguan pernapasan serta kelumpuhan terjadi 4 sampai 6 hari pasca infeksi. Tanda-tanda lain mencakup gangguan pernapasan (terengah-engah, batuk), gangguan syaraf (depresi, tremor otot, sayap terkulai, torsi kepala dan leher, berputar-putar serta kelumpuhan), pembengkakan jaringan sekitar mata dan leher, diare berair kehijauan, kualitas telur yang kasar atau tipis dan berisi albumen encer serta produksi telur berkurang (Charlton 2006).
Perubahan Patologis Infeksi virus Newcastle Disease
Beberapa lesi post-mortem antara lain: airsacculitis, tracheitis, necrotik plaque di proventrikulus, ptechiae di proventrikulus dan submukosa gizzard,
nekrotik-hemoragi usus, enteritis parah di duodenum, sekum dan perdarahan di proventrikulus. Lesio pada usus terutama terjadi pada bentuk ND tipe
viscerotropic (Jordan 1990). Lesi mikroskopik utama ND adalah encephalomyelitis nonpurulent, vaskulitis, nekrosis limfoid (bursa, limpa, timus
dan jaringan limfoid mukosa usus), trakheitis, pneumonia, nekrosis hati, infiltrasi selular pankreas, dan konjungtivitis. Menurut Ernawati et al. (1991), dalam
percobaannya, semua ayam specific Pathogenic Free (SPF) dengan titer HI
rendah yang diinokulasi dengan virus ND mengalami kematian pada hari ke-3 pasca inokulasi. Gejala klinis terlihat jelas kecuali depresi. Perubahan makroskopik, ayam menunjukkan perdarahan di konjungtiva. Secara histologi, ayam mengalami nekrosis limpa, hepatosit, nekrosis limfositik serta deplesi dalam jaringan limfoid (bursa, timus, dan seka tonsil), serta perdarahan dan nekrosis pembuluh darah pada konjungtiva. Tidak ditemukan lesio pada sistem saraf pusat atau pankreas (Gohm et al. 2000). Bhaiyat et al. (1994), melaporkan lesi yang
paling sering diamati pada kasus ND adalah pada organ otak. Perubahan yang sering diamati adalah encephalomyelitis dengan degenerasi neuronal dan hipertrofi sel endotel otak. Lesi pada otak selalu diamati pada ayam yang terinfeksi dengan patotipe neurotropik velogenik walaupun kadang kala juga ditemukan pada tipe viscerotropik dan tipe mesogenik. Pada umumnya, lesi histologi dari sistem saraf pusat ditemukan pada medula, otak kecil, otak tengah, dan sumsum tulang belakang dan jarang ditemukan dalam otak besar.
Teknik Diagnosa
Diagnosa awal yang dilakukan adalah melihat gejala klinis, apabila terdapat kematian yang mendadak tanpa adanya gejala klinis yang khas, maka lesi post mortem dapat dijadikan sebagai salah satu petunjuk untuk diagnosa penyakit. Diganosa banding yang digunakan adalah penyakit fowl cholera, highly
pathogenic avian influenza (HPAI), laryngotracheitis, mycoplasmosis, infectious bronchitis, aspergilosis dan permasalahan manajemen seperti ventilasi yang kurang baik dan tingkat asupan makanan dari unggas tersebut (OIE 2013).
11 lebih lanjut dengan cara ditanam dalam Telur Embrio Tertunas Specific Pathogen Free (TET- SPF) umur 9-11 hari. Penanaman ini berfungsi untuk mengisolasi dan
menumbuhkan agen penyebab penyakit. Setelah pengamatan selama 4 hari, Chorio Alantois Membran dipanen dan diuji keberadaan virus dengan uji Hemaglutinasi (HA). Uji HA dapat memberikan hasil positif untuk 10 suptipe APMV maupun 16 subtipe hemaglutinin virus A Influenza ataupun cairan nonsteril yang terkontaminasi bakteri HA. Uji spesifik ND dapat diakukan dengan uji Hemaglutination Inhibition (HI) dengan antiserum standart ND.
Variasi virulensi dari VND dapat diketahui dengan melakukan berbagai uji patogenisitas. Uji yang digunakan antara lain uji Mean Death Time (MDT), Intravenous Pathogenicity Test (IVPT) dan uji Intracerebral Pathogenicity Index
(ICPI). Berdasarkan kesepakatan internasional, uji yang dapat digunakan sebagai uji virulensi adalah ICPI. Hal ini dimaksudkan untuk memperkecil kemungkinan terjadinya kesalahan produksi virus yang tidak berasal dari ayam. Sehingga memperkecil kemungkinan agen untuk menyebar ke lingkungan. Selain diuji secara in vivo, variasi virulensi juga dapat dilakukan dengan menggunakan basis molekuler dengan metode realtime Reverse Transcriptase Polymerase Chain Reaction (rRT-PCR). Bagian yang dapat dideteksi adalah bagian asam amino
tambahan pada bagian fusion VND. Apabila tidak terdapat asam amino tambahan pada bagian fusion, maka tingkat virulensi dapat dilihat dari hasil ICPI. Dari hasil rRT-PCR tersebut dapat dilanjutkan ke tahap sekuensing untuk mendapatkan analisis filogenetik dari agen tersebut (OIE 2013).
Uji laboratorium berikutnya adalah uji serologi. Uji serologi ini dapat berfungsi melihat keanekaragaman antigen permukaan VND. uji serologi juga dapat digunakan sebagai uji konfirmasi untuk serum netralisasi atau enzyme-linked immunoabsorbent assay (ELISA). Dan uji Hemaglutination Inhibition (HI)
memiliki fungsi untuk menguji titer antibody pada serum (OIE 2013)
Kondisi Umum Pasar Tradisional di Indonesia
Kondisi pasar tradisional di Indonesia pada umumnya memprihatinkan. Banyak pasar tradisional di Jabodetabek yang tidak terawat sehingga dengan berbagai kelebihan yang ditawarkan oleh pasar modern kini pasar tradisional terancam oleh keberadaan pasar modern. Masalah utama yang dihadapi sebagian besar pasar tradisional di kota-kota besar adalah kondisi pasar yang sempit, kotor, becek, pengap dan bau, serta akses jalan yang macet. Pasar-pasar tradisional rata-rata sudah beroperasi puluhan tahun dan telah direnovasi beberapa kali. Kondisi pasar tradisional yang kurang layak telah mendorong pemda memodernisasi dan merenovasi bangunan pasar dengan struktur bangunan bertingkat demi efisiensi lahan sehingga mampu menampung jumlah pedagang dan pembeli lebih banyak.
Faktor lain yang juga menjadi penyebab kurang berkembangnya pasar tradisional adalah minimnya daya dukung karakteristik pedagang tradisional, yakni strategi perencanaan yang kurang baik, terbatasnya akses permodalan yang disebabkan jaminan (collateral) yang tidak mencukupi, tidak adanya skala
ekonomi (economies of scale), tidak ada jalinan kerja sama dengan pemasok
12 Meskipun dengan kondisi yang tidak menguntungkan, tetap ditemukan adanya pasar tradisional yang mampu bertahan karena dikelola dengan baik dan memperhatikan seluruh aspek seperti kebersihan, kenyamanan, dan keamanan dalam berbelanja. Kelebihan pasar tradisional adalah kekhasannya yang tidak dimiliki oleh pasar modern, seperti jual-beli dengan tawar-menawar harga.
3
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesmavet Fakultas Kedokteran Hewan IPB dimulai dari bulan Juli 2013 sampai Desember 2014.
Alat dan Bahan
Media transport yang digunakan adalah brain heart infusion (BHI). Sampel
usap diambil menggunakan cotton swab steril. Untuk isolasi genom virus
digunakan QIAmp Viral RNA Mini Kit. Sedangkan rRT-PCR dilakukan menggunakan KitAg-Path ID™ One-Step RT-PCR dari Ambion® dengan plat
optik 96 sumuran pada mesin AppliedBiosystems 7500 Real Time PCR System.
Bahan dan peralatan yang digunakan untuk isolasi virus antara lain telur ayam bertunas (TAB) spesific pathogen free (SPF) berumur 9-11 hari, larutan phosphate buffered saline (PBS) pH 7.2, sel darah merah ayam, antibiotik : penicillin (100 IU/ml) , streptomycin (0,1 mg/ml), mikropipet, tips mikropipet, biosafety cabinet (BSC)(Esco), plat mikrotitrasi 96 sumuran berdasar V atau U,
kontrol antiserapositif VND (strain Lasota, Komarov), kontrol antiserapositifVAI, VND La sota 7 (BPMSOH), VND Sato (FKH), dan antigen VAI clade 2.1.3 (pusvetma).
Metode Penelitian Koleksi Sampel
13 Tabel 1 Daftar pasar asal sampel koleksi
Kabupaten Pasar 1 Pasar 2 Pasar 3
Bandung Soreang Sayati Ciwidey
Bandung Barat Lembang Batujajar Cililin
Bogor Jonggol Citayam Citeureup
Ciamis Manis Pananjung Banjarsari
Cianjur Cipanas Sukanegara Muka
Garut Malangbong Sukamukti Wanaraja
Lebak Rangkasbitung Maja Malimping
Serang Anyer Cikande Sirih
Sukabumi Sukaraja Parung Kuda Cibadak
Tasikmalaya Ciawi Rajapolah Manonjaya
Keterangan: pasar 1 dan 2 merupakan pasar yang diintervensi dengan implementasi program implementasi kebersihan, sedangkan pasar 3 merupakan pasar kontrol yang tidak diintervensi dengan program implementasi kebersihan.
Peremajaan virus
Peremajaan virus dilakukan menurut protokol yang ada di (OIE 2013).Sampel alantois sampel sebanyak 0.18 ml dicampur dengan 0.02 ml antibiotik penicillin-streptomycin10.000 IU. Sampel dihomogenasi dan diinkubasi pada suhu ruang
selama 30 menit dan diinokulasikan ke TAB Specific Pathogen Free (SPF) umur
9-11 hari pada bagian ruang alantois.Telur yang sudah diinokulasi sampel, diinkubasi pada suhu 37C dan diamati selama 4 hari untuk dilihat viabilitasnya. Cairan alantois TAB diambil dan diuji kembali keberadaan aktivitas HA dengan uji HA kemudian diteruskan ke proses isolasi RNA.
Gambar 7 Lokasi asal sampel koleksi
14
Uji Hemaglutination (HA) dengan metode mikrotitrasi
Phosphate Buffer Saline sebanyak 0.025 ml dimasukkan kedalam tiap
sumuran (1 s.d 12) plat mikrotiter (V-bottomed wells). Kemudian pada sumuran
pertama dimasukkan 0.025 ml suspensi virus. Cairan pada sumuran pertama dihomogenenasi dan diambil 0.025 ml untuk dipindahkan ke sumur 2. Lalu dari sumur 2 diambil dan dipindahkan ke sumur 3 dan dilakukan sampai dengan sumur ke-11 kemudian dari sumur ke-11 diambil 0,025 untuk dibuang. Sumur ke-12 digunakan sebagai kontrol negatif. Kemudian dilakukan penambahan PBS kembali sebanyak 0.025 ml ke dalam tiap sumuran dan SDM 1% sebanyak 0.025 ml dimasukkan ke tiap sumuran. Kemudian dihomogenasi dengan hati-hati dan plat ditempatkan pada suhu 4C atau temperatur ruang (20-24C). Hasil dapat dibaca setelah 30 menit (pada temperatur ruang) atau 40 menit pada suhu 4C ketika SDM kontrol sudah turun berbentuk titik di dasar plat. Hasil positif terlihat apabila terdapat aglutinasi yang berupa butiran seperti pasir pada dasar plat dan hasil negatif terlihat apabila terdapat aliran sel darah merah atau membentuk tear drop. Titer virus (HAU) merupakan pengenceran terakhir yang dapat
mengaglutinasi darah. Titer virus dapat dihitung lebih akurat apabila ditambahkan beberapa jenis rentang pengenceran (1/3, 1/5, 1/7, dam 1/9) (OIE 2013).
Uji Hemaglutination Inhibition (HI) dengan metode mikrotitrasi
Hal yang perlu diperhatikan sebelum melakukan uji HI adalah membuat stok virus dengan titer 4 HAU. Uji HI dimulai dengan dimasukkanya Phosphat Buffer Saline (PBS) sebanyak 0.025 ml ke dalam tiap sumuran (1 s.d 12) plat
mikrotiter (V-bottomed wells). Kemudian 0.025 ml serum standar dimasukkan
pada kolom sumuran pertama. Kemudian dilakukan pengenceran dua kali dengan cara cairan pada sumuran pertama dihomogenenasi dan diambil 0.025 ml untuk dipindahkan ke sumur 2. Lalu dari sumur 2 diambil dan dipindahkan ke sumur 3 dan dilakukan sampai dengan sumur ke-10 kemudian dari sumur ke-10 diambil 0.025 ml untuk dibuang. Lalu ditambahkan stok virus yang mengandung 4 HAU ke sumuran (1 s.d 11). Sumur ke-11 merupakan kontrol virus. Sedangkan pada sumur ke-12 ditambahkan PBS sebanyak 0.025 ml digunakan sebagai kontrol negatif. Secara pelan digoyang dan plat ditempatkan pada suhu 4oC selama 40 menit atau suhu ruang selama 30 menit. SDM 1 % ditambahkan 0.025 ml ke semua sumuran dan digoyang secara perlahan dan ditempatkan pada suhu 4C atau suhu ruang. Plat dibaca setelah 30-40 menit atau ketika kontrol sel darah merah sudah turun. Sumur 11 (kontrol virus) harus memberikan hasil aglutinasi sedangkan sumur 12 (kontrol SDM) harus memberikan hasil yang berbentuk tear drop. Hasil positif terlihat apabila terdapat terdapat aliran sel darah merah atau
membentuk tear drop dan hasil negatif terlihat apabila aglutinasi yang berupa
butiran seperti pasir pada plat. Titer HI merupakan pengenceran terakhir yang tidak dapat mengaglutinasi darah (OIE 2013).
Uji waktu elusi dengan metode mikrotitrasi
15 pelepasan aglutinasi virus dengan sel darah merah. Metode yang digunakan untuk elusi hampir sama seperti uji HA. Phosphate Buffer Saline sebanyak 0.05 ml
dimasukkan kedalam tiap sumuran (1 s.d 12) plat mikrotiter (V-bottomed wells).
Kemudian pada sumuran pertama dimasukkan 0.05 ml suspensi virus. Cairan pada sumurarn pertama dihomogenenasi dan diambil 0.025 ml untuk dipindahkan ke sumur 2. Lalu dari sumur 2 diambil dan dipindahkan ke sumur 3 dan dilakukan sampai dengan sumur ke-11 kemudian dari sumur ke-11 diambil 0,025 untuk dibuang. Sumur ke-12 digunakan sebagai kontrol negatif. Kemudian dilakukan penambahan SDM 0.6% sebanyak 0.05 ml dimasukkan ke tiap sumuran. Kemudian dihomogenasi dengan hati-hati dan plat ditempatkan pada suhu 4C atau temperatur ruang (20-24C). Hasil dapat dibaca setelah 30 menit (pada temperatur ruang) atau 40 menit pada suhu 4C ketika SDM kontrol sudah turun berbentuk titik di dasar plat. Perhitungan waktu elusi dilakukan pada sumuran terakhir yang masih menunjukkan hasil aglutinasi sempurna. Perhitungan waktu dihentikan ketika pengenceran HA terakhir yang teraglutinasi berubah menjadi aliran sel darah merah (tear drop).
Ekstraksi RNA
Sampel cairan allantois yang memiliki hasil HA positif dilanjutkan ke tahap ekstraksi RNA sesuai prosedur standar QIAmp Viral RNA Mini Kit. Langkah awal yang digunakan dalam ekstraksi RNA adalah mengambil 0.56 ml AVL dimasukkan ke dalam 1.5 ml microtube kemudian ditambahkan 0.14 ml sampel
(cairan allantois) dan dihomogenasi dengan vortex selama 15 detik. Campuran tersebut diinkubasi pada temperatur ruangan selama 10 menit. Langkah berikutnya microtube disentrifugasi singkat untuk menurunkan cairan yang
menempel pada dinding tabung. Kemudian dilakukan penambahkan 0.56 ml ethanol dan dihomogenasi dengan vortex selama 15 detik, kemudian
microtubedisentrifugasi singkat kembali. Campuran larutan dimasukkan ke dalam
QIAamp column dan disentrifugasi dengan kecepatan 8,000 rpm selama 1 menit.
Kolom dipindahkan ke dalam tabung koleksi yang baru (collection tube) dan
ditambahkan 0.5 ml buffer AW1 ke dalam kolom, disentrifugasi 8000 rpm selama 1 menit dan kolom diletakkan ke dalam tabung koleksi yang baru. Selanjutnyaditambahkan 0.5ml buffer AW2 ke dalam kolom serta disentrifugasi kembali dengan kecepatan 8 rpm selama 3 menit kemudian kolom diletakkan ke dalam 1.5 tabung microtube yang baru. Langkah akhir, ditambahkan 0.06 ml
buffer AVE ke dalam kolom dan inkubasi pada temperatur ruang selama 1 menit dan disentrifugasi kembali dengan kecepatan 8,000 rpm selama 1 menit.Hasil elusi RNA dalam microtubedisimpan untuk nantinya digunakan sebagai template
PCR dan/atau disimpan pada suhu -80°C hingga digunakan.
Uji Realtime Reverse Transcriptation Polychain Reaction (RRT-PCR)
Protokol yang digunakan untuk uji rRT-PCR sesuai dengan protokol NVSL (2005). Langkah awal adalah membuat master mix PCR matriks (1x reaksi) yang
secara berurutan terdiri dari 2x RT-PCR buffer, primer forward (20 pmol/l),
primer reverse (20 pmol/l), probe (6 pmol/l), 25x RT-PCR enzyme mix, dan enhancer dengan total master mix per reaksi 0,017 ml (Ambion). Master mix
16 sumuran plat optik 96 sumuran dimasukkan kemudian ditambahkan 8 µl RNA
template. Plat ditutup dengan seal optik kemudian di tempatkan pada mesin Applied Biosystems 7500 Real Time PCR System dengan kondisi siklus rRT-PCR.
Hasil PCR dianalisis menggunakan Applied Biosystems 7500 Real-Time PCR
System software.Hasil rRT-PCR primer matriks dengan nilai CT<38 dilanjutkan
dengan menggunakan primer fusion.
Tabel 2 Pasangan primer dan probe serta kondisi rRT-PCR untuk mendeteksi VND
Primer Sekuen Siklus rRT-PCR
M+4100 AGTGATGTGCTCGGACCTTC (1x) 45°C 10’, 95°C 10’, (40x) 94°C 10’’, 45°C 30’’, 72°C 10’’ M+4169 [FAM]TTCTCTAGCAGTGGGAC AGCCTGC[BHQ]
M-4220 CCTGAGGAGAGGCATTTGCTA
F+4829 GGTGAGTCTATCCGGARGATACAAG (1x) 45°C 10’, 95°C 10’, (40x) 94°C 10’’, 58°C 30’’, 72°C 10’’ F+4894 [FAM]AAGCGTTTCTGTCTCCTT CCTCCA[BHQ]
F-4939 AGCTGTTGCAACCCAAG Uji Patogenisitas
Uji patogenitas terhadap 2 isolat terpilih dilakukan menggunakan 20 ekor ayam SPF umur 7 hari, masing-masing 8 ekor untuk infeksi sampel dan 2 ekor sebagai kontrol. Infeksi dilakukan dengan meneteskan 0.05 ml/matadari larutan virus yang mengandung 104,0HAU/0.025 ml pada conjunctival sac. Grup kontrol diinokulasi dengan PBS dengan rute yang sama. Pengamatan dilakukan setiap 24 jam selama 8 hari. Nekropsi dilakukan segera setelah ditemukan kematian pada ayam. Organ yang diambil untuk diperiksa antara lain otak, trakhea, proventrikulus, paru-paru, limpa, usus dan seka tonsil. Setelah diambil, organ otak dan proventrikulus dilanjutkan ke tahap uji molekuler dengan rRT-PCR primer M untuk mendeteksi keberadaan VND dalam organ.
Analisis Data
Seluruh data yang didapatkan dari studi ini dianalisa secara deskriptif.
4. HASIL DAN PEMBAHASAN
Pengelompokan sampel Isolasi dan identifikasi VND
17 menyebabkan kematian embrio dapat digunakan untuk melihat virulensi virus. Embrio yang diinokulasi sampel memperlihatkan adanya kekerdilan, kemerahan atau hemoragi pada bagian kulit dan pertumbuhan bulu yang terhambat. Lesi embrio yang dihasilkan oleh VND mirip seperti lesi yang disebabkan oleh Avian Influenza (AI) seperti yang dijelaskan oleh Wibowo et al. (2012) bahwa lesi
embrio yang terinfeksi AI memperlihatkan adanya kekerdilan embrio, hemoragik pada bagian kulit dan gangguan pertumbuhan bulu. Kondisi yang berbeda terlihat pada TAB yang diinfeksi virus dengan galur lentogenik akan memperlihatkan kematian yang lambat karena titer virus yang rendah dalam darah sehingga tidak dapat melewati barrier hyperplastic inner lining dari kantong allantois. Menurut
(Gotoh et al. 1990) pertumbuhan paramyxovirus dalam cairan allantois
ditentukan oleh enzim Virus Activating Protease (VAP) sejenis Ca2+ dependent serin yang berperan dalam proses pembelahan atau reproduksi VND.
Pathotyping secara melokuler
Patotipe VND ditentukan dengan rRT-PCR gen F yang mengidentifikasi 10 dari 12 isolat sebagai isolat VND virulen (mesogenik atau velogenik). Primer
fusion digunakan karena protein fusion merupakan salah satu protein yang
berperan dalam masuknya virus ke dalam sel selain protein hemaglutinin-neuromidase (Ogasawara et al. 1992). Protein F pada patotipe velogenik dan
mesogenik dapat menginfeksi lebih banyak sel yang berbeda karena pada bagian sekuen asam aminonya merupakan substrat untuk protease dari furin (Gotoh et al.
1990).Sebaliknya, protein F pada patotipe lentogenik menghambat asam amino yang berbeda dan hanya dapat bekerja untuk pembelahan proteolitik dan hanya dapat dilakukan pada sel sel tertentu (Nagai et al. 1979).
Collins et al. (1994), melakukan studi untuk perbandingan prekursor sekuen
18
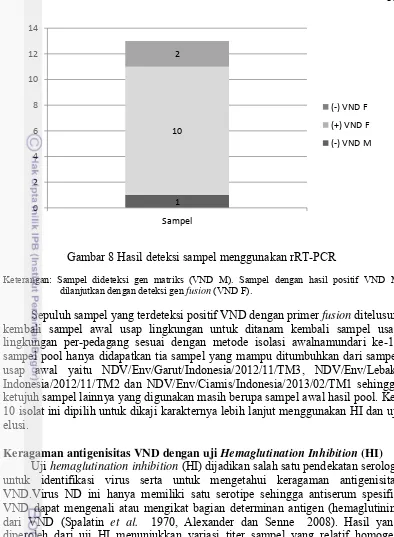
Gambar 8 Hasil deteksi sampel menggunakan rRT-PCR
Keterangan: Sampel dideteksi gen matriks (VND M). Sampel dengan hasil positif VND M dilanjutkan dengan deteksi gen fusion (VND F).
Sepuluh sampel yang terdeteksi positif VND dengan primer fusion ditelusuri
kembali sampel awal usap lingkungan untuk ditanam kembali sampel usap lingkungan per-pedagang sesuai dengan metode isolasi awalnamundari ke-10 sampel pool hanya didapatkan tia sampel yang mampu ditumbuhkan dari sampel usap awal yaitu NDV/Env/Garut/Indonesia/2012/11/TM3, NDV/Env/Lebak/ Indonesia/2012/11/TM2 dan NDV/Env/Ciamis/Indonesia/2013/02/TM1 sehingga ketujuh sampel lainnya yang digunakan masih berupa sampel awal hasil pool. Ke-10 isolat ini dipilih untuk dikaji karakternya lebih lanjut menggunakan HI dan uji elusi.
Keragaman antigenisitas VND dengan uji Hemaglutination Inhibition (HI) Uji hemaglutination inhibition (HI) dijadikan salah satu pendekatan serologi
untuk identifikasi virus serta untuk mengetahui keragaman antigenisitas VND.Virus ND ini hanya memiliki satu serotipe sehingga antiserum spesifik VND dapat mengenali atau mengikat bagian determinan antigen (hemaglutinin) dari VND (Spalatin et al. 1970, Alexander dan Senne 2008). Hasil yang
19 antiserum standar (La Sota, Komarov, G7, ITA dan H5).Hasil yang diperoleh menunjukkan semua sampel memperlihatkan reaksi silang kecuali dengan antiserum H5 dan titer paling tinggi ditunjukkan pada antiserum yang homolog dengan virusnya.
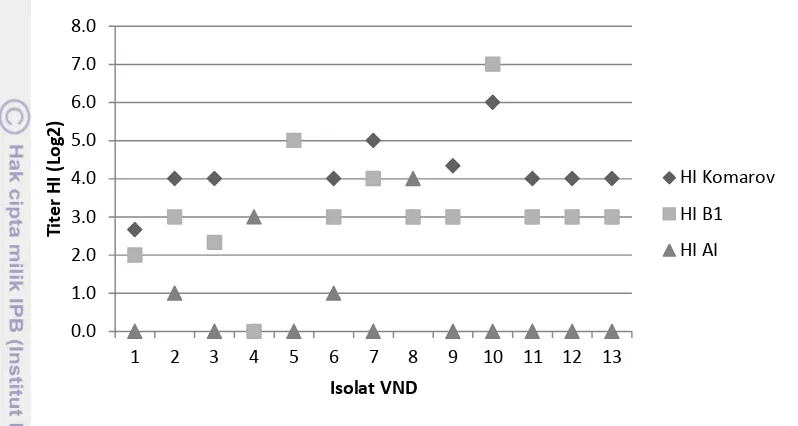
Gambar 9 Perbandingan titer HI isolat VND
Berdasarkan hasil yang diperoleh menunjukkan bahwa 9 isolat memiliki afinitas dengan lebih tinggi antiserum Komarov yang merupakan strain dengan patotipemesogenik, sedangkan 1 isolat menunjukkan afinitas yang lebih tinggi dengan antiserum B1, hal ini sesuai dengan hasil deteksi positif menggunakan rRT-PCR dengan primer Matriks dan Fusion.Menurut Miller et al. (2013) titer
antibodi yang tinggi dapat terjadi jika serum dengan virus bersifat homolog. Serum homolog memiliki afinitas yang lebih tinggi pada epitop permukaan virus sehingga lebih optimal dalam menghambat aglutinasi oleh hemaglutinin. Vaksinasi ayam dengan galur yang berbeda dengan virus yang beredar tidak akan melindungi ayam dari infeksi VND karena serum yang diproduksi tidak mampu menahan kecepatan replikasi dari virus, akibatnya ayam yang telah divaksin akan tetap menunjukkan gejala sakit (Sa'idu dan Abdu 2008).
Penelitian Choi et al (2009), juga melaporkan bahwa antiserum VND dari
ayam yang sudah divaksinasi masih dapat mengenali wabah VND jenis virulen dengan titer yang rendah bila dibandingkan dengan antiserum yang diambil dari unggas yang selamat dari wabah. Menurut Alexander dan Senne (2008), perbedaan antigenik VND yang dapat dikenali oleh antibodi spesifik ditentukan oleh protein HN. Selain itu menurut Adu (1985) dan Ibu et al. (2008) variasi
antigenik pada VND dari galur yang sama terjadi karena beragamnya fungsi dari protein eksternal akibat adanya mutasi.
Karakterisasi VND dengan metode elusi
Pengamatan waktu elusi pada sampel positif VND menunjukkan hasil yang bervariasi. Hasil uji elusi sampel menunjukkan variasi waktu elusi yaitu isolat 13termasuk lentogenik, 5 isolat (isolat 3, 4, 5, 9 dan 10)termasuk mesogenik dan 7
20 isolat (isolat 1, 2, 6, 7, 8, 11 dan 12)termasuk velogenik (Tabel 3). Isolat 13(Ndv/Env/Ciamis/Indonesia/2013/02/Tm1) dianggap sebagai isolat lentogenik karena berada dalam rentang lentogenik, tetapi standar deviasi yang tinggi memungkinkan isolat dimasukkan dalam rentang yang isolat mesogenik. Menurut Ezeibe dan Ndip (2005), waktu elusi virus dengan patotipe velogenik yaitu antara 84-189 menit, patotipe mesogenik antara 45-84 menit, sedangkan lentogenik memiliki waktu elusi antara 20-45 menit. Percobaan yang dilakukan oleh penelitian ini hanya menguji satu (1) isolat pada masing-masing patotipe tetapi perhitungan dilakukan sebanyak empat (4) kali. Hal yang mempengaruhi penempelan dan pelepasan virus dengan SDM adalah protein hemaglutinin-neuromidase. Hemaglutinin merupakan salah satu bagian protein protein berfungsi yang menangkap reseptor membran sel inang termasuk salah satunya sel darah merah. Sedangkan neuromidase (NA) merupakan enzim aktif yang berfungsi melepaskan virus dari membran sel inang. Aktivitas enzim ini mempengaruhi lama waktu yang dibutuhkan virus untuk melepaskan diri dari sel inang atau dalam hal ini SDM (Grims 2002).
Graves (1996) membuktikan peran NA dengan melakukan percobaan menguji penghambatan NA pada 575 of Newcastle disease virus (NDV) dengan penambahan antibodi elution-inhibition (EI). Penambahan antibodi EI tersebut menngakibatkankan pola aglutinasi SDM yang permanen. Hasil elusi terlihat berbeda pada kontrol VAI clade 2.1.3 yang menunjukkan waktu lebih dari 300 menit atau lebih lama dari semua sampel ND. Virus AI sendiri telah diketahui memiliki waktu elusi sampai lebih dari 8 jam (Hussain et al. 2008). Virus ND
pada kondisi ekstraseluler protein HN berfungsi sebagai pengkait yang memfasilitasi protein fusion untuk melakukan proses fusi melalui tempat perlekatannya namun tidak ditemukan interaksi ketika virus telah masuk ke sel (intraseluler). Mutasi pada protein HN dapat mengakibatkan virus kehilangan daya penempelan sehingga mengakibatkan kegagalan fusi virus (McGinnes et al.
Tabel 3 Karakteristik 13 isolat asal lingkungan pasar
Isolat Nama isolat (jam)Mati (Log2)HA rRT-PCR
M (CT)
HI Komarov
(Log2) (Log2)HI B1 (Log2)HI AI rRT-PCR F (CT) Waktu elusi (menit) 1 Ndv/Env/bandung/indonesia/2012/11/tm2 > 96 9.00.8 7.2 2.70.3 2.00.0 0.00.0 33.6 84.38.0 2 Ndv/Env/bandung/indonesia/2012/11/tm3 48 7.00.0 12.0 4.00.0 3.00.0 1.00.0 24.3 327.02.9 3 Ndv/Env/bogor/indonesia/2012/11/tm3 48 8.30.5 TD 4.00.0 2.30.4 0.00.0 23.3 45.04.0 4 Ndv/Env/ciamis/indonesia/2012/11/tm1 48 6.00.0 TD 0.00.0 0.00.0 3.00.0 Undet 62.32.0 5 Ndv/Env/ciamis/indonesia/2012/11/tm3 48 6.30.5 14.7 5.00.0 5.00.0 0.00.0 29.9 70.00.8 6 Ndv/Env/garut/indonesia/2012/11/tm2 96 7.30.5 TD 4.00.0 3.00.0 1.00.0 22.2 305.04.1 7 Ndv/Env/garut/indonesia/2012/11/tm3 48 7.30.5 12.2 5.00.0 4.00.0 0.00.0 20.1 150.311.5 8 Ndv/ Env/lebak/indonesia/2012/11/tm1 48 7.00.0 7.6 3.00.0 3.00.0 4.00.0 30.6 309.73.8 9 Ndv/Env/lebak/indonesia/2012/11/tm2 48 7.60.4 TD 4.30.4 3.00.0 0.00.0 31.2 73.317.0 10 Ndv/Env/sukabumi/indonesia/2012/11/tm1 48 6.30.5 TD 6.00.0 7.00.0 0.00.0 Undet 65.04.1 11 Ndv/ Env/serang/indonesia/2012/11/tm2 48 8.00.0 TD 4.00.0 3.00.0 0.00.0 38.9 225.712.3 12 Ndv/ Env/tasikmalaya/indonesia/2012/11/tm2 48 9.60.4 10.3 4.00.0 3.00.0 0.00.0 19.5 225.612.2 13 Ndv/Env/ciamis/indonesia/2013/02/tm1 48 9.30.9 20.2 4.00.0 3.00.0 0.00.0 30.9 34.38.9
14 Sato 48 8.00.0 TD 4.70.4 2.00.0 0.00.0 TD 59.32.7
15 Lasota >96 7.00.0 TD 4.00.0 2.00.0 0.00.0 TD 129.37.3
16 Antigen vai clade 2.1.3 TD 4.00.0 TD 0.00.0 0.00.0 4.00.0 TD >360 menit
22 Infeksi pada ayam SPF
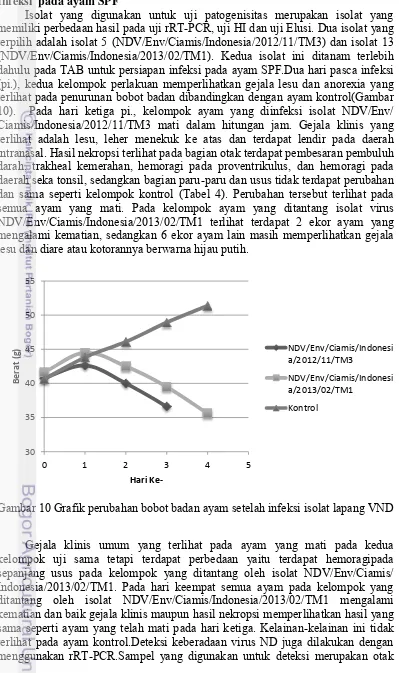
Isolat yang digunakan untuk uji patogenisitas merupakan isolat yang memiliki perbedaan hasil pada uji rRT-PCR, uji HI dan uji Elusi. Dua isolat yang terpilih adalah isolat 5 (NDV/Env/Ciamis/Indonesia/2012/11/TM3) dan isolat 13 (NDV/Env/Ciamis/Indonesia/2013/02/TM1). Kedua isolat ini ditanam terlebih dahulu pada TAB untuk persiapan infeksi pada ayam SPF.Dua hari pasca infeksi (pi.), kedua kelompok perlakuan memperlihatkan gejala lesu dan anorexia yang terlihat pada penurunan bobot badan dibandingkan dengan ayam kontrol(Gambar 10). Pada hari ketiga pi., kelompok ayam yang diinfeksi isolat NDV/Env/ Ciamis/Indonesia/2012/11/TM3 mati dalam hitungan jam. Gejala klinis yang terlihat adalah lesu, leher menekuk ke atas dan terdapat lendir pada daerah intranasal. Hasil nekropsi terlihat pada bagian otak terdapat pembesaran pembuluh darah, trakheal kemerahan, hemoragi pada proventrikulus, dan hemoragi pada daerah seka tonsil, sedangkan bagian paru-paru dan usus tidak terdapat perubahan dan sama seperti kelompok kontrol (Tabel 4). Perubahan tersebut terlihat pada semua ayam yang mati. Pada kelompok ayam yang ditantang isolat virus NDV/Env/Ciamis/Indonesia/2013/02/TM1 terlihat terdapat 2 ekor ayam yang mengalami kematian, sedangkan 6 ekor ayam lain masih memperlihatkan gejala lesu dan diare atau kotorannya berwarna hijau putih.
Gambar 10 Grafik perubahan bobot badan ayam setelah infeksi isolat lapang VND
Gejala klinis umum yang terlihat pada ayam yang mati pada kedua kelompok uji sama tetapi terdapat perbedaan yaitu terdapat hemoragipada sepanjang usus pada kelompok yang ditantang oleh isolat NDV/Env/Ciamis/ Indonesia/2013/02/TM1. Pada hari keempat semua ayam pada kelompok yang ditantang oleh isolat NDV/Env/Ciamis/Indonesia/2013/02/TM1 mengalami kematian dan baik gejala klinis maupun hasil nekropsi memperlihatkan hasil yang sama seperti ayam yang telah mati pada hari ketiga. Kelainan-kelainan ini tidak terlihat pada ayam kontrol.Deteksi keberadaan virus ND juga dilakukan dengan menggunakan rRT-PCR.Sampel yang digunakan untuk deteksi merupakan otak
23 dan proventrikulus dari masing-masing kelompok ayam.Hasil yang diperoleh adalah pada semua sampel terdeteksi keberadaan VND dengan menggunakan primer matriks dengan CT sebesar 23.2 pada kelompok NDV/Env/Ciamis/Indonesia/2012/11/TM3 dan sebesar 27.1 pada kelompok NDV/Env/Ciamis/Indonesia/2013/02/TM1. Hasil rRT-PCR ini membuktikan bahwa ayam uji coba telah terinfeksi oleh isolat VND.
Menurut Oladele et al. (2008), gejala klinis VND umumnya muncul
setelah 3-4 hari pi. antara lain demam, anorexia, anemia, diare, dehidrasi, paralisa alat gerak (kaki dan sayap), kejang-kejang dan berakhir kematian. Anemia terjadi akibat lisisnya sel darah merah (eritrosit) dan hemoragi pada dinding usus serta proventrikulus akibat replikasi VND dan kematian mulai terlihat 4 hari pi. Selain itu terdapat juga perubahan antara lain: hiperemi, oedema konjungtiva, depresi dan sianosis pada bagian pial (Gohm et al. 2000). Sedangkan penurunan bobot
badan sesuai dengan pendapatKuiken et al. (1999)yaitu anorexia disebabkan nafsu
makan menurun sehingga usus kosong tidak berisi makanan, akibatnya pertumbuhan bobot juga terganggu.Menurut Brown et al. (1999), lesi yang
spesifik pada 4 hari pasca infeksi adalah hemoragi nekrotik di seka tonsil dan usus halus. Pada usus halus lesi nekrotik hemoragi bersifat multifokal(Brown et al.
1999, Alexander 2000, Alexander 2001, Kommers et al. 2002, Kommers et al.
2003, Wakamatsu et al. 2006, Alexander dan Senne 2008, Susta et al.
2010).Seka tonsil terlihat menonjol dan terdapat agregat limfoid usus yang terletak di bagian proksimal seka tonsil tersebut, sering dianggap sebagai "gejala pasti" lesi untuk VVND, karena gejala ini merupakan gejala yang paling konsisten dengan tetap menampilkan adanya perdarahan dan nekrosis. Hal ini bisa terjadi akibat suhu tubuh yang sangat tinggi akibat viremia akan menyebabkan rusaknya struktur pembuluh darah sehingga sel darah akan keluar dari pembuluh darah. Anemia terjadi karena replikasi virus yang menyebabkan lisisnya eritrosit dan kejadian hemoragi pada dinding usus dan mukosa proventrikulus (Cheville et al.
1972).
Lesi usus umum lainnya adalah perdarahan multifokal dan ulserasi di persimpangan antara proventrikulus dan tembolok, yang merupakan situs pengembangan agregat limfoid. Limpa yang membesar dan berbintik-bintik (Brown et al. 1999, Alexander 2000, Alexander 2001, Kommers et al. 2002,
Kommers et al. 2003, Wakamatsu et al. 2006, Alexander dan Senne 2008, Susta et al. 2010). Perdarahan pada bagian trachea jarang dijelaskan, tetapi gejala
utama pada ayam yang terinfeksi dengan isolat CA02, sebagian besar terlihat pada bagian trakea dan merupakan konsekuensi dari nekrosis di tonsils (Wakamatsu et al. 2006). Pembengkakan pada kelopak mata adalah yang temuan konsisten pada
hewan diinokulasi melalui rute konjungtiva (Brown et al. 1999, Nakamura et al.
24
Tabel 4. Perbedaan gross lesion pada berbagai macam organ yang telah diinfeksi dengan NDV/Env/Ciamis/Indonesia/2013/02/TM1 dan NDV/Env/Ciamis/Indonesia/2012/11/TM3 bila dibandingkan dengan kontrol.
Organ NDV/Env/Ciamis/Indonesia/2013/02/TM1 NDV/Env/Ciamis/Indonesia/2012/11/TM3 Kontrol
Otak
Trakhea
Proventrik ulus
25
Organ NDV/Env/Ciamis/Indonesia/2013/02/TM1 NDV/Env/Ciamis/Indonesia/2012/11/TM3 Kontrol
Paru-paru
Seka tonsil
26
Perbandingan karakter VND dari berbagai metode pengujian
Hasil yang ditunjukkan pada uji elusi dan uji patogenitas berbeda dari pada uji elusi NDV/Env/Ciamis/Indonesia/2013/02/TM1 memiliki karakteristik VND lentogenik sedangkan NDV/Env/Ciamis/Indonesia/2012/11/TM3 memiliki karakteristik mesogenik (Tabel 5). Hal ini tidak terlihat jelas pada uji patogenitas karena kedua sampel tersebut justru menunjukkan karakter velogenik berdasarkan waktu kematian ayam, lesi organ, dan dapat ditemukannya material genetik VND dengan primer F pada bagian otak dan proventrikulus. Perbedaan ini dapat disebabkankan oleh perbedaan pengelompokan waktu elusiseperti disampaikan oleh Spalatin et al. (1970), yang mencoba melihat pola elusi pada tiga (3) patotipe
VND dengan menggunakan enam (6) jenis strain pada masing-masing patotipe, menyimpulkan bahwa ketiga patotipe terdapat pola waktu elusi yang masih belum bisa dikelompokkan terutama waktu elusi yang dekat dengan rentang batas masing-masing patotipe. Hal ini disebabkan karena pada masing-masing patotipe terdapat strain yang memiliki kedua jenis pola elusi yaitu elusi cepat dan elusi lambat.Selain pola elusi adanya mutasi ataupun subtitusi asam amino pada gen F maupun HN dapat mengubah virulensi VND. Hal ini juga dikemukakan oleh Bilal et al. (2014) yang meneliti patotipe VND yang beredar di sudan selama
tahun 2008-2013 menemukan 7 isolat (5 dari ayam dan 2 dari burung dara) yang berhasil diisolasi dari wabah di sudan. Berdasarkan ICPI, 4 isolat merupakan jenis velogenik dan 3 isolat merupakan jenis mesogenik. Sedangkan berdasarkan waktu elusi, semua isolat membutuhkan waktu lama untuk elusi dan memiliki preferensi jenis darah yang berbeda sehingga waktu elusi dianggap tidak berkorelasi dengan virulensi isolat. Hal ini senada dengan penelitian Tan et al. (2008) yang
menemukan tiga isolat bervirulensi tinggi berdasarkan uji patogenitas tetapi memiliki susunan asam amino lentogenik pada gen F.
Tabel 5 Perbandingan tipe patogenisitas VND berdasarkan tiga jenis pengujian
rRT-PCR
primer F Elusi Uji secara in vivo NDV/Env/Ciamis/Indonesia/2012/11/TM3 Mesogenik/Velogenik Mesogenik Velogenik
NDV/Env/Ciamis/Indonesia/2013/02/TM1 Mesogenik/Velogenik Lentogenik Velogenik
Hubungan kebersihan pasar dengan penyebaran VND
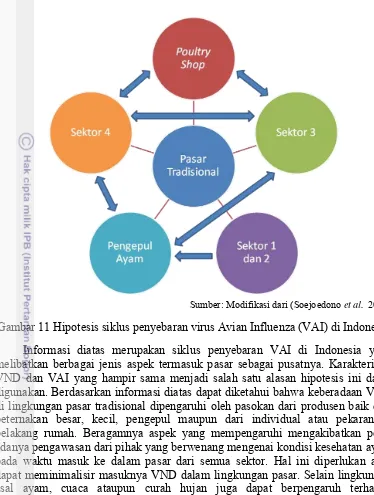
27 di lingkungan pasar meskipun tidak cukup untuk menghilangkan VND dari lingkungan pasar. Pasar tradisional sendiri merupakan pusat rantai produsen-konsumen yang menyatukan berbagai aspek antara lain pedagang kecil, produsen skala kecil, produsen skala besar, pengepul dan konsumen (Gambar 11).
Penelitian Emilia (2013), menemukan 20 isolat positif gen matriks dari 529 sampel usap kloaka ayam telah dikoleksi dari pasar-pasar tradisional dan peternakan rakyat di daerah Bogor dan Tangerang. Sebanyak 4 isolat dari 11 sampel berhasil diisolasi dan 2 isolat menunjukkan karakter mesogenik, 1 lentogenik dan 1 velogenik berdasarkan pengijuan secara serologis dan MDT. Penelitian dengan cara yang sama juga dilakukan Panus (2014) dan Darniati (2014). Total 18 isolat berhasil diisolasi dari sampel usapan kloaka dan usapan orofaring individu yang menunjukkan karakter antigenik yang homogen. Mayoritas isolat menunjukkan afinitas lebih tinggi terhadap antisera Komarov, sedangkan karakterisasi patogenisitas dengan uji elusi menunjukkan 3 isolat sesuai dengan karakter mesogenik dan 15 sesuai dengan karakter velogenik. Hasil yang sedikit berbeda ditunjukkan oleh Darniati (2014), yang menguji51 dari 69 isolat positif gen matriks menunjukkan positif pada F.Hasil penelitian menunjukkanND masih endemis di wilayah Aceh. Virus ND berhasil diisolasi dari seluruh wilayah yang dilakukan pengambilan sampeldan isolat yang diperoleh didominasi oleh galur virulen dengan antigenisitas yang beragam.
Wilayah yang dapat diisolasi VND dan ditemukan keragaman virus ND umumnya terjadi di area pasar dan wilayah yang berdekatan dengan pasar. Geografi di Aceh cukup beragam dan antar tempat pengambilan sampel dipisahkan oleh bukit sehingga variasi antigenisitas VND yang beragam sedangkan kondisi geografi wilayah subang (Panus 2014) relatif lebih homogen dan dibuktikan dengan variasi antigenisitas VND yang homogen pula. Hal ini meneguhkan dugaan jika kondisi geografi dan pasar unggas hidup memberi dampak yang besar terhadap penyebaran dan keragaman virus di lapang.