STUDI VIABILITAS BAKTERI ASAM LAKTAT
PADA FERMENTASI TAUCO
DALAM LARUTAN GARAM
TESIS
Oleh
YUSI INDRIANI
077030029/BIO
S
E K O L A H
P A
S C
A S A R JA
NA
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
2009
STUDI VIABILITAS BAKTERI ASAM LAKTAT
PADA FERMENTASI TAUCO
DALAM LARUTAN GARAM
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Magister Sains
dalam Program Studi Biologi
pada Sekolah Pascasarjana Universitas Sumatera Utara
Oleh
YUSI INDRIANI
077030029/BIO
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
2009
Judul Tesis : STUDI VIABILITAS BAKTERI ASAM LAKTAT PADA FERMENTASI TAUCO DALAM LARUTAN GARAM Nama Mahasiswa : Yusi Indriani
Nomor Pokok : 077030029 Program Studi : Biologi Konsentrasi : Mikrobiologi
Menyetujui
Komisi Pembimbing
(Dr. Ir. Herla Rusmarilin, MS) (Prof. Dr. Dwi Suryanto, M.Sc) Ketua Anggota
Ketua Program Studi Direktur
Tanggal lulus : 10 September 2009 Telah diuji pada
Tanggal 10 September 2009
PANITIA PENGUJI TESIS
Ketua : Dr. Ir. Herla Rusmarilin, MS
Anggota : 1. Prof. Dr. Dwi Suryanto, M.Sc
2. Prof. Dr. Erman Munir, M.Sc
ABSTRAK
Tujuan dari penelitian ini adalah untuk menganalisis pengaruh lama fermentasi tauco dalam larutan garam terhadap viabilitas bakteri asam laktat (BAL). Sampel tauco diambil sebanyak 1 gram setiap minggu dengan menganalisis jumlah total koloni BAL berdasarkan metode Standard Plate Count (SPC). Identifikasi jenis BAL dengan melakukan pengamatan karakteristik morfologi dan biokimia. Karakteristik biokimia dilakukan berdasarkan uji motilitas, katalase, sitrat, pertumbuhan pada 4%, 6.5% dan 18% NaCl, produksi gas CO2, fermentasi
karbohidrat serta pertumbuhan pada pH 7.5 dan 8.5. Uji terhadap kandungan kimia tauco dilakukan sebagai data pendukung.
Hasil penelitian menunjukkan bahwa terdapat 7 jenis BAL yang berhasil diisolasi dari tauco pada proses fermentasi dalam larutan garam. Jumlah total koloni BAL tertinggi ditemukan pada minggu ke tiga (19.7 x 106 CFU/g) dan terendah pada minggu ke delapan (0.5 x 106 CFU/g). Lama fermentasi berpengaruh terhadap kandungan gula reduksi, asam laktat, pH dan asam amino. Kandungan gula reduksi terendah dicapai pada minggu ke empat (0.022 mg/g) dan minggu ke tujuh merupakan minggu dengan kandungan gula reduksi tertinggi (4.624 mg/g). Kandungan asam laktat tertinggi (0.279%) dicapai pada minggu ke tiga sedang kandungan asam laktat terendah (0.048%) dicapai pada minggu ke tujuh. Derajat keasaman tertinggi (5.50) ditemukan pada minggu ke nol dan pH terendah (4.71) pada minggu ke delapan. Asam glutamat, asam aspartat, leusin, arginin, prolin dan lisin merupakan jenis asam amino yang memiliki kandungan yang tinggi dibanding dengan asam amino lainnya. Kandungan yang tinggi dari asam-asam amino ini berpengaruh terhadap rasa dan aroma tauco.
ABSTRACT
The objective of this research was to analyze the effect of the fermentation period of fermented tauco in salt solution on viability of lactic acid bacteria. The sample of fermented tauco was taken every week to analyze total colony of LAB based on Standard Plate Count method. Identification of isolated bacteria was conducted by morphology and biochemistry characteristic. Test of reduction sugar, lactic acid, pH and amino acid contents was conducted as supporting data.
The result indicated that totally 7 species of LAB which were succesed to be isolated from fermented tauco in salt solution. The highest total colony of LAB was found on the third week (19.7 x 106 CFU/g) and the lowest on the eighth week (0.5 x 106 CFU/g). Period of fermentation affected the content of reduction sugar, lactic acid, pH and amino acid. The highest reduction sugar content was reached on the seventh week (4.624 mg/g), the highest content of lactic acid was reached on the third week (0.022 mg/g) and the acidity level of fermentation was the highest before fermentation process in salt solution (5.50). The contents of amino acid such as glutamic acid, aspartic acid, leusine, argynine, proline and lysine were higher which may be important for the taste and flavor of tauco.
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah swt. atas limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penulisan tugas akhir dalam bentuk tesis ini. Tesis ini dimaksudkan untuk melengkapi sebagian persyaratan dalam mendapatkan gelar Magister Sains pada Sekolah Pascasarjana Universitas Sumatera Utara.
Penulisan tesis ini tidak akan selesai tanpa dukungan dari banyak pihak. Karena itu pada kesempatan ini penulis ingin mengucapkan terima kasih kepada yang terhormat:
1. Ibu Prof. Dr. Ir. T. Chairun Nisa B., M.Sc selaku Direktur Sekolah Pascasarjana Universitas Sumatera Utara
2. Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku Ketua Program Studi Biologi Sekolah Pascasarjana Universitas Sumatera Utara dan pembimbing yang telah memberikan bimbingan dan masukan dalam menyelesaikan tesis ini
3. Ibu Dr. Ir. Herla Rusmarilin, MS selaku dosen pembimbing yang telah memberikan bimbingan dalam menyelesaikan tesis
4. Teman-teman mikro’07 atas persahabatan dan persaudaraan yang sudah terjalin selama ini
Teristimewa ucapan terima kasih dan penghargaan yang setinggi-tingginya kepada ayahanda (alm. H. M. Yusuf) dan ibunda (Hj. Susilawati) terkasih atas segala yang telah diberikan, suami tercinta M. Syahrin Asman, SE atas pengertian, kepercayaan dan kesabaran yang telah diberikan, ananda terkasih M. Faiz Abrar atas pengertiannya, adinda tercinta, Rini dan Ari yang selalu direpotkan Faiz serta Ozan dan Syifa, terima kasih sudah sering menemani Faiz.
Akhirnya dengan menyadari bahwa masih banyak terdapat kekurangan pada tesis ini, penulis berharap semoga karya ini dapat bermanfaat sebagaimana mestinya.
Medan, September 2009
RIWAYAT HIDUP
DAFTAR ISI
Halaman
ABSTRAK ... i
ABSTRACT ... ii
KATA PENGANTAR ... iii
RIWAYAT HIDUP ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 3
1.3 Tujuan Penelitian ... 4
1.4 Hipotesis ... 4
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Tanaman Kedelai ... 6
2.2 Tauco dan Proses Pembuatan Tauco ... 8
2.3 Bakteri Asam Laktat ... 12
BAB III BAHAN DAN METODE ... 18
3.1 Waktu dan Tempat Penelitian ... 18
3.2 Pembuatan Tauco ... 18
3.3 Enumerasi dan Isolasi BAL ... 19
3.4 Identifikasi BAL ... 19
3.5 Analisis Gula Reduksi ... 21
3.7 Pengukuran pH ... 24
3.8 Kadar Asam Amino ... 24
3.9 Penentuan Warna Tauco ... 25
3.10 Nilai Organoleptik Aroma dan Rasa Tauco ... 26
3.11 Rancangan Penelitian dan Analisis Data ………. 26
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Viabilitas BAL ... 28
4.2 Identifikasi BAL ... 31
4.3 Analisis Kimiawi Tauco ... 35
4.4 Uji Organoleptik Tauco ... 42
BAB V KESIMPULAN DAN SARAN ... 46
5.1 Kesimpulan ... 46
5.2 Saran ... 47
DAFTAR TABEL
Nomor Judul Halaman
1. Kandungan kalori, protein, lemak dan karbohidrat (CHO)
dari setiap 100 gram bahan makanan ... 6
2. Kandungan asam amino esensial berbagai sumber protein ... 7
3. Penentuan glukosa, fruktosa dan gula invert dalam suatu bahan dengan metode Luff-Schoorl ... 23
4. Uji hedonik warna ... 25
5. Uji hedonik aroma dan rasa ... 26
6. Uji LSR pengaruh lama fermentasi terhadap viabilitas BAL ... 29
7. Karakteristik morfologi koloni BAL ... 32
8. Karakteristik morfologi sel dan uji biokimia 10 isolat BAL ... 33
DAFTAR GAMBAR
Nomor Judul Halaman
1. Diagram Alir Pembuatan Tauco ... 11
2. Identifikasi awal untuk menentukan genera BAL ... 14
3. Lintasan Homofermentasi ... 16
4. Lintasan Heterofermentasi ... 17
5. Jumlah total koloni BAL selama proses fermentasi tauco ... 28
6. Kadar gula reduksi selama proses fermentasi tauco ... 36
7. Kadar asam laktat selama proses fermentasi tauco ... 38
8. Nilai pH selama proses fermentasi tauco ... 39
9. Grafik asam amino pada fermentasi tauco minggu ke-0, 4, dan 8 ... 41
10. Organoleptik warna tauco ... 43
11. Organoleptik rasa tauco ... 44
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Alur Kerja Penelitian ... 54 2. Alur Kerja Identifikasi BAL ... 55 3. Jumlah total koloni BAL pada fermentasi tauco dalam larutan
garam ... 56 4. Analisis sidik ragam pengaruh lama fermentasi terhadap
viabilitas BAL ... 57 5. Jumlah total koloni BAL pada fermentasi tauco dalam larutan
garam ... 58 6. Grafik jumlah koloni khamir selama fermentasi tauco dalam
larutan garam ... 59 7. Data kadar gula reduksi tauco ... 60 8. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi
terhadap kadar gula reduksi tauco ... 61 9. Data kadar asam laktat tauco ... 62 10. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi
terhadap kadar asam laktat tauco ... 63 11. Data pH tauco ... 64 12. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi
terhadap pH tauco ... 65 13. Data uji organoleptik warna ... 66 14. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi
terhadap warna tauco ... 67 15. Data uji organoleptik rasa ... 68 16. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi
terhadap rasa tauco ... 69 17. Data uji organoleptik aroma ... 70 18. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi
19. Kandungan asam amino pada fermentasi tauco minggu ke-0,
ABSTRAK
Tujuan dari penelitian ini adalah untuk menganalisis pengaruh lama fermentasi tauco dalam larutan garam terhadap viabilitas bakteri asam laktat (BAL). Sampel tauco diambil sebanyak 1 gram setiap minggu dengan menganalisis jumlah total koloni BAL berdasarkan metode Standard Plate Count (SPC). Identifikasi jenis BAL dengan melakukan pengamatan karakteristik morfologi dan biokimia. Karakteristik biokimia dilakukan berdasarkan uji motilitas, katalase, sitrat, pertumbuhan pada 4%, 6.5% dan 18% NaCl, produksi gas CO2, fermentasi
karbohidrat serta pertumbuhan pada pH 7.5 dan 8.5. Uji terhadap kandungan kimia tauco dilakukan sebagai data pendukung.
Hasil penelitian menunjukkan bahwa terdapat 7 jenis BAL yang berhasil diisolasi dari tauco pada proses fermentasi dalam larutan garam. Jumlah total koloni BAL tertinggi ditemukan pada minggu ke tiga (19.7 x 106 CFU/g) dan terendah pada minggu ke delapan (0.5 x 106 CFU/g). Lama fermentasi berpengaruh terhadap kandungan gula reduksi, asam laktat, pH dan asam amino. Kandungan gula reduksi terendah dicapai pada minggu ke empat (0.022 mg/g) dan minggu ke tujuh merupakan minggu dengan kandungan gula reduksi tertinggi (4.624 mg/g). Kandungan asam laktat tertinggi (0.279%) dicapai pada minggu ke tiga sedang kandungan asam laktat terendah (0.048%) dicapai pada minggu ke tujuh. Derajat keasaman tertinggi (5.50) ditemukan pada minggu ke nol dan pH terendah (4.71) pada minggu ke delapan. Asam glutamat, asam aspartat, leusin, arginin, prolin dan lisin merupakan jenis asam amino yang memiliki kandungan yang tinggi dibanding dengan asam amino lainnya. Kandungan yang tinggi dari asam-asam amino ini berpengaruh terhadap rasa dan aroma tauco.
ABSTRACT
The objective of this research was to analyze the effect of the fermentation period of fermented tauco in salt solution on viability of lactic acid bacteria. The sample of fermented tauco was taken every week to analyze total colony of LAB based on Standard Plate Count method. Identification of isolated bacteria was conducted by morphology and biochemistry characteristic. Test of reduction sugar, lactic acid, pH and amino acid contents was conducted as supporting data.
The result indicated that totally 7 species of LAB which were succesed to be isolated from fermented tauco in salt solution. The highest total colony of LAB was found on the third week (19.7 x 106 CFU/g) and the lowest on the eighth week (0.5 x 106 CFU/g). Period of fermentation affected the content of reduction sugar, lactic acid, pH and amino acid. The highest reduction sugar content was reached on the seventh week (4.624 mg/g), the highest content of lactic acid was reached on the third week (0.022 mg/g) and the acidity level of fermentation was the highest before fermentation process in salt solution (5.50). The contents of amino acid such as glutamic acid, aspartic acid, leusine, argynine, proline and lysine were higher which may be important for the taste and flavor of tauco.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Pengolahan bahan pangan secara tradisional sudah dikenal lama. Salah satu cara pengolahan yang dilakukan adalah dengan fermentasi. Fermentasi telah lama digunakan dan merupakan salah satu cara pemrosesan dan bentuk pengawetan makanan tertua (Achi, 2005). Fermentasi merupakan cara untuk memproduksi berbagai produk yang menggunakan biakan mikroba melalui aktivitas metabolisme baik secara aerob maupun anaerob. Fermentasi dapat terjadi karena adanya aktivitas mikroba pada substrat organik yang sesuai. Terjadinya fermentasi dapat menyebabkan perubahan sifat bahan pangan akibat pemecahan kandungan bahan pangan tersebut (Marliyati, 1992) sehingga memungkinkan makanan lebih bergizi, lebih mudah dicerna, lebih aman, dapat memberikan rasa yang lebih baik (Rahayu dan Sudarmadji, 1989; Widowati dan Misgiyarta, 2003; Parveen dan Hafiz, 2003) dan memberikan tekstur tertentu pada produk pangan (Widowati dan Misgiyarta, 2003; Parveen dan Hafiz, 2003). Fermentasi juga merupakan suatu cara yang efektif dengan biaya rendah untuk mengawetkan, menjaga kualitas dan keamanan makanan (Parveen dan Hafiz, 2003).
mikroba. Kedelai merupakan salah satu bahan yang banyak digunakan dalam proses fermentasi. Makanan hasil fermentasi yang bahan baku utamanya kedelai cukup banyak di Indonesia dan salah satu pengolahan kedelai melalui proses fermentasi adalah produk yang dikenal sebagai tauco. Tauco bagi kalangan tertentu merupakan produk yang tidak dapat dipisahkan dari menu makanan sehari-hari.
Meskipun kandungan protein tauco cukup tinggi, tauco tidak dapat digunakan sebagai sumber protein dalam makanan karena biasanya hanya dimakan dalam jumlah kecil, yaitu sebagai bumbu dalam makanan ataupun sebagai saus (Suwaryono dan Ismeini, 1988). Tauco tidak digunakan secara langsung, tetapi sebagai bumbu (condiment) ataupun sebagai penyedap rasa (flavoring agent) (Indriani, 1990).
Umumnya tauco dibuat secara tradisional dalam skala industri rumah tangga atau industri kecil. Tauco dihasilkan melalui dua tahapan fermentasi. Tahap pertama adalah fermentasi kedelai oleh kapang dan tahap kedua fermentasi di dalam larutan garam yang dibantu oleh bakteri asam laktat (BAL) dan khamir. BAL merupakan mikroorganisme yang memegang peranan penting dalam banyak fermentasi makanan. Adanya pertumbuhan bakteri pada bahan pangan menyebabkan perubahan-perubahan, baik yang bersifat kimiawi maupun biokimiawi bahan, bahkan dapat terjadi perubahan fisik (Rahayu dan Sudarmadji, 1989).
lama perendaman, semakin baik aroma dan rasanya yang ditandai dengan perubahan warna tauco menjadi berwarna merah tua (Wolf dan Coman, 1971). Berdasarkan penelitian Limbong (1981) didapatkan bahwa penggunaan konsentrasi larutan garam 20% dengan waktu fermentasi 8 minggu memberikan hasil yang terbaik terhadap kadar protein tauco. Kandungan protein tauco merupakan penilaian pertama terhadap tauco untuk menentukan baik atau tidaknya mutu produk tauco.
BAL memiliki peranan penting hampir dalam semua proses fermentasi makanan dan minuman. Bakteri ini dalam industri makanan berperan utama dalam pengasaman bahan mentah dengan memproduksi sebagian besar asam laktat (bakteri homofermentasi) atau campuran asam laktat, asam asetat, etanol dan CO2 (bakteri
heterofermentasi) (Desmazeaud, 1996; Jenie, 1996). BAL juga digunakan dalam produksi susu seperti yogurt, susu asam, keju, mentega dan produksi asam-asaman serta asinan (Lindquist, 1998). Berbagai makanan fermentasi Indonesia yang biasanya digunakan sebagai saus, misalnya kecap, belacan dan tauco dalam proses pembuatannya juga dilakukan oleh BAL.
Dari uraian di atas perlu kiranya dilakukan penelitian mengenai viabilitas BAL dan identifikasi BAL yang berperan pada fermentasi tauco dalam larutan garam mengingat peran BAL yang sangat penting dalam fermentasi makanan.
Tauco merupakan produk fermentasi yang dibuat melalui dua tahapan fermentasi, yaitu fermentasi kedelai oleh kapang (fermentasi tahap pertama) dan fermentasi di dalam larutan garam (fermentasi tahap kedua) yang dibantu oleh BAL dan khamir. Larutan garam merupakan penyeleksi BAL yang dapat hidup dan membantu proses fermentasi tahap kedua dalam proses pembuatan tauco. Lama waktu fermentasi dalam larutan garam serta besarnya konsentrasi larutan garam yang digunakan mempengaruhi mutu tauco serta viabilitas BAL yang membantu proses fermentasi.
Berdasarkan penjelasan di atas maka dapat dibuat rumusan masalah sebagai berikut:
1. Bagaimana viabilitas BAL pada fermentasi tauco dalam larutan garam?
2. Apa jenis BAL yang terdapat pada proses fermentasi tauco dalam larutan garam? 3. Bagaimana kualitas tauco yang dihasilkan dari proses fermentasi tauco dalam
larutan garam?
1.3 Tujuan Penelitian
1. Untuk mengetahui viabilitas BAL pada fermentasi tauco dalam larutan garam 2. Untuk mengidentifikasi BAL yang terdapat pada proses fermentasi tauco dalam
larutan garam
1.4 Hipotesis
Lama fermentasi tauco dalam larutan garam mempengaruhi viabilitas dan keragaman BAL serta mempengaruhi kualitas tauco
1.5 Manfaat Penelitian
1. Memberikan gambaran mengenai viabilitas BAL pada fermentasi tauco dalam larutan garam
2. Mengetahui peranan BAL pada fermentasi tauco dalam larutan garam
BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Kedelai
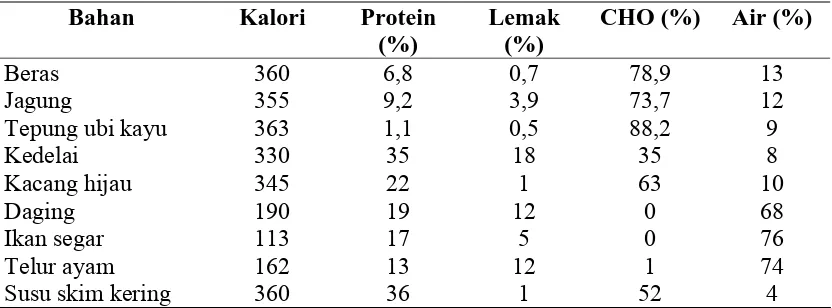
Kedelai (Glycine max) merupakan salah satu anggota tanaman kacang-kacangan yang telah banyak dimanfaatkan baik sebagai pangan maupun pakan (Kasmidjo, 1990). Dilihat dari segi pangan dan gizi, kedelai merupakan sumber protein yang paling murah di dunia, di samping menghasilkan minyak dengan mutu yang baik (Pakpahan, 1998). Kedelai merupakan sumber protein nabati yang efisien, dalam arti bahwa untuk memperoleh jumlah protein yang cukup diperlukan kedelai dalam jumlah kecil (Suprapto, 1995). Bila dibandingkan dengan bahan makanan yang lain, kandungan protein kedelai cukup tinggi. Perbandingan dari setiap 100 gram kedelai dengan bahan makanan lain dapat dilihat pada Tabel 1 berikut.
Tabel 1. Kandungan kalori, protein, lemak dan karbohidrat (CHO) dari setiap 100 gram bahan makanan
Bahan Kalori Protein
(%)
Lemak (%)
CHO (%) Air (%)
Beras 360 6,8 0,7 78,9 13
Jagung 355 9,2 3,9 73,7 12
Tepung ubi kayu 363 1,1 0,5 88,2 9
Kedelai 330 35 18 35 8
Kacang hijau 345 22 1 63 10
Daging 190 19 12 0 68
Ikan segar 113 17 5 0 76
Telur ayam 162 13 12 1 74
Sumber : Suprapto, 1992
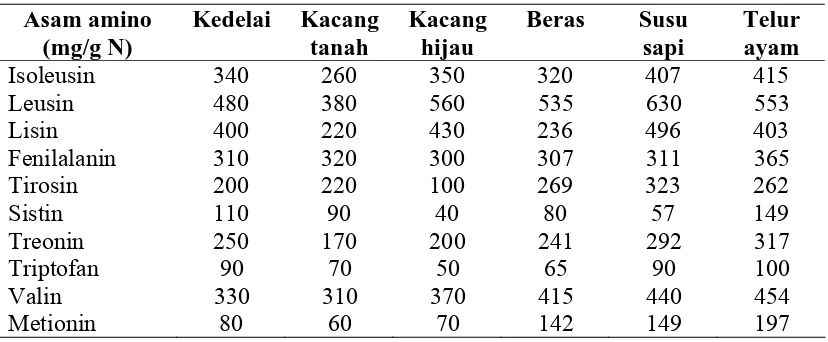
Protein kedelai sebagian besar (85-95%) terdiri dari globulin. Dibandingkan dengan kacang-kacangan yang lain, susunan asam amino pada kedelai lebih lengkap dan seimbang, seperti yang terlihat pada Tabel 2.
Tabel 2. Kandungan asam amino esensial berbagai sumber protein Asam amino
Isoleusin 340 260 350 320 407 415
Leusin 480 380 560 535 630 553
Sumber : Direktorat Gizi Depkes RI (1972 dalam Pakpahan, 1998)
gizi kedelai. Di Indonesia, kedelai banyak digunakan dalam bentuk makanan fermentasi. Kedelai dalam bentuk makanan hasil fermentasi seperti tauco mempunyai kandungan protein bahan lebih rendah namun lebih mudah dicerna (Suprapto, 1992).
2.2 Tauco dan Proses Pembuatan Tauco
Tauco adalah produk berbentuk pasta atau cair yang berwarna kekuning-kuningan, rasanya agak asin dan dibuat dengan cara fermentasi (Marliyati, 1992). Tauco mempunyai cita rasa yang khas dan sangat digemari oleh masyarakat Indonesia, khususnya masyarakat Jawa Barat (Rahman, 1992) dan digunakan dalam pembuatan sup dan masakan lainnya, misalnya bumbu untuk masakan daging, ikan dan sayuran (Kuswanto, 2004). Sebagai bahan makanan, tauco terutama berfungsi sebagai pengharum karena baunya yang khas. Tauco merupakan produk fermentasi kedelai yang dibantu oleh aktivitas berbagai mikroba, antara lain kapang, bakteri dan khamir, mirip dengan taosi di Filipina dan miso di Jepang. Pembuatan tauco melalui tahap-tahap perendaman kedelai, penghilangan kulit dan perebusan, penirisan, inokulasi dan inkubasi (fermentasi kapang) serta perendaman dalam larutan garam (fermentasi dalam larutan garam).
mempunyai enzim selulase sehingga tidak dapat tumbuh pada kulit. Perebusan kedelai selain untuk melunakkan biji juga berfungsi untuk membunuh bakteri-bakteri kontaminan yang tumbuh selama perendaman, menonaktifkan senyawa tripsin inhibitor dan membantu membebaskan senyawa-senyawa dalam biji yang diperlukan untuk pertumbuhan kapang (Hidayat et al., 2006). Setelah perebusan kedelai, dilakukan penirisan yang berfungsi untuk mengurangi kadar air bahan dan pendinginan yang bertujuan untuk mendapat kondisi yang sesuai bagi pertumbuhan kapang (Indriani, 1990).
Pada tahap fermentasi kapang, kapang yang berperan adalah R. oligosporus, R. oryzae atau A. oryzae atau juga campuran dari ketiganya. Waktu fermentasi 3-6
hari tergantung pada kecepatan pertumbuhan kapang. Makin lama fermentasi kapang, makin lunak bijinya. Setelah fermentasi berakhir, perlu dilakukan pengeringan. Biasanya dijemur di bawah sinar matahari dan setelah kering dilakukan pemisahan miselia jamur. Fermentasi kapang merupakan fermentasi aerob. Menurut Fardiaz (1992) fermentasi aerob terjadi karena oksidasi berlangsung tidak sempurna dan menghasilkan produk-produk akhir berupa senyawa organik.
selektif pada mikroba tertentu (Winarno dan Jenie, 1974). Frazier (1976) menyebutkan bahwa garam juga mampu menarik air, memiliki ion Cl- yang bersifat toksis bagi mikroba, mengurangi kelarutan oksigen dalam air, menurunkan ketahanan mikroba terhadap CO2 dan menghambat enzim proteolitik. Larutan garam yang
Kedelai Dibersihkan, dicuci
Direndam (12-24 jam, suhu kamar) Ditiriskan
Dikupas kulitnya Direbus 1-2 jam
Ditiriskan Didinginkan
Dicampur dengan tepung beras Inokulasi dengan inokulum tempe Fermentasi kapang (suhu kamar, 2 hari)
Dikeringkan dengan sinar matahari (sun drying)
Dihancurkan
Dimasukkan ke dalam larutan garam Inkubasi dalam wadah terbuka di bawah sinar matahari selama 8 minggu
Gambar 1. Diagram alir pembuatan tauco (Naruki dan Sarjono, 1984)
Karbohidrat dalam kedelai dipecah menjadi dekstrin, maltosa dan glukosa yang dapat dipergunakan sebagai media pertumbuhan khamir dan bakteri pada fermentasi dalam larutan garam. Selama proses ini, terjadi kenaikan jumlah asam-asam organik seperti asam-asam laktat, asetat, suksinat dan fosfat (Rahayu dan Sudarmadji, 1989). Tauco mempunyai rasa dan aroma yang ditimbulkan oleh senyawa glutamat. Asam laktat dan asam organik lain yang dihasilkan juga berperan dalam membentuk rasa dan aroma tauco (Naruki dan Sardjono, 1984).
2.3 Bakteri Asam Laktat
Bakteri asam laktat (BAL) merupakan kelompok bakteri berbentuk batang atau kokus yang mempunyai karakteristik umum gram positif, tidak membentuk spora, tidak motil, membentuk pigmen, katalase dan oksidase negatif, asam laktat merupakan senyawa utama hasil fermentasi karbohidrat (Wibowo, 1989; Adams dan Moss, 1995; Nair dan Surendran, 2005; Malaka dan Laga, 2005; Ibourahema et al., 2008), aerotoleran, toleran terhadap asam (König dan Fröhlich, 2009), kadang-kadang memproduksi asam volatil dan CO2 serta fermenter obligat (Fardiaz, 1992).
dihasilkan selama dehidrogenasi gula (Adams dan Moss, 1995). BAL juga mampu menghasilkan senyawa-senyawa tertentu selain asam laktat dan asam asetat yang dapat menghambat pertumbuhan bakteri lain. Senyawa-senyawa ini biasanya dihasilkan dalam jumlah yang lebih sedikit dibandingkan dengan produksi asam organik, di antaranya H2O2, diasetil, bakteriosin, produk reaksi sekunder seperti
hipotiosianat yang dihasilkan dari kegiatan laktoperoksidase terhadap H2O2 dan
tiosianat (Daeschel, 1989).
Secara morfologi, BAL terdiri dari dua famili, yaitu Lactobacillaceae yang berbentuk batang dan Streptococcaceae yang berbentuk bulat. Famili Lactobacillaceae terdiri dari genus Lactobacillus, sedangkan famili Streptococcaceae terdiri dari genus Streptococcus, Leuconostoc dan Pediococcus (Wibowo, 1989). Streptococcus, Pediococcus dan beberapa spesies Lactobacillus bersifat
homofermentasi, sedang Leuconostoc dan spesies Lactobacillus lainnya bersifat heterofermentasi (Fardiaz, 1992). Kadang-kadang dengan pengecualian, BAL bersifat anaerob aerotoleran, artinya bahwa BAL memiliki tipe metabolisme fermentasi yang berhubungan dengan kondisi anaerob dan juga tidak berbeda dengan keberadaan O2
(Cappuccino dan Sherman, 1996). Identifikasi awal untuk menentukan genera BAL dapat dilihat pada Gambar 2 berikut.
Isolat BAL
(gram positif, katalase negatif)
Batang Bulat
Tetrad, berpasangan rantaian
Pediococcus
Lactobacillus heterofermentatif
Lactobacillus homofermentatif
Streptococcus Lactococcus Leuconostoc
Gambar 2. Identifikasi awal untuk menentukan genera BAL (Rahayu dan Margino, 1997)
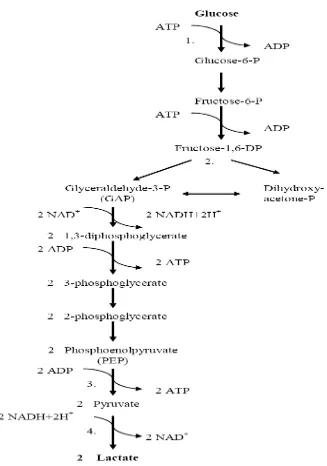
Sebagai fermenter obligat terhadap karbohidrat, BAL secara universal dapat memfermentasi glukosa. Energi seluler yang diperoleh dari fermentasi karbohidrat menghasilkan terutama asam laktat. Untuk menghasilkan asam laktat, BAL menggunakan salah satu dari dua lintasan yang berbeda dan ini merupakan salah satu cara klasifikasi BAL (Adams dan Moss, 1995). Lintasan homofermentasi disajikan pada Gambar 3.
Menurut Adam dan Moss (1995), homofermenter menghasilkan asam laktat sebagai produk tunggal dari fermentasi glukosa. BAL homofermentasi mengikuti lintasan glikolitik Embden-Meyerhof-Parnas (EMP). Molekul glukosa 6 karbon difosforilasi dan diisomerisasi sebelum dipecah oleh aldolase menjadi gliseraldehid-3-fosfat yang kemudian dikonversi menjadi piruvat dan menghasilkan 2 molekul ATP untuk setiap molekul glukosa yang difermentasi.
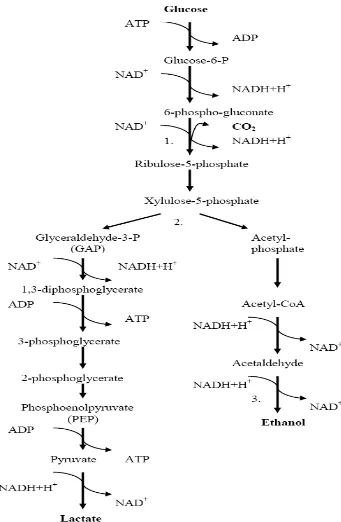
Heterofermenter menghasilkan sejumlah laktat, etanol/asetat dan CO2 dari
melalui oksidasi dan dekarboksilasi. Pentosa dipecah menjadi gliseraldehid fosfat dan asetil fosfat oleh fosfoketolase. Triosa fosfat dikonversi menjadi laktat melalui serangkaian reaksi yang sama pada glikolisis menghasilkan 2 molekul ATP. Asetil fosfat tergantung pada adanya akseptor elektron. Asetil fosfat direduksi menjadi etanol dengan menggantikan 2 molekul NAD+ dari NADH. Dengan adanya keberadaan O2, NAD+ dapat digantikan oleh NADH oksidase dan peroksidase, asetil
fosfat dikonversi menjadi asetat. Heterofermenter dan homofermenter dapat dibedakan dengan uji di laboratorium untuk melihat kemampuan heterofermenter menghasilkan CO2 dalam media yang berisi glukosa (Adams dan Moss, 1995). Untuk
BAB III
BAHAN DAN METODE
3.1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Maret sampai Juli 2009 di Laboratorium Mikrobiologi Departemen Biologi Fakultas MIPA USU, Laboratorium Teknologi Pangan Fakultas Pertanian USU, dan PT Saraswanti Indo Genetech, Bogor.
3.2 Pembuatan Tauco
Pembuatan tauco dilakukan secara tradisional berdasarkan Hasbullah (2001) dengan modifikasi. Kedelai dibersihkan kemudian dicuci lalu direndam dalam air bersih selama 12-24 jam. Setelah direndam, kedelai ditiriskan, dikupas kulitnya kemudian direbus selama 1-2 jam, ditiriskan dan dibiarkan hingga dingin. Setelah dingin, dicampur dengan tepung beras hingga rata. Untuk setiap 10 kg kedelai mentah kering ditambahkan dengan 2 kg tepung beras yang sebelumnya telah disangrai sampai berwarna coklat. Pengadukan dilakukan agar kedelai dan tepung beras tercampur merata.
terbentuk tempe. Tempe kemudian disuir-suir atau dilepaskan butiran-butirannya. Setelah itu butiran tempe dijemur sampai kering.
Butiran tempe kering kemudian direndam di dalam larutan garam. Untuk membuat 10 liter larutan garam 20% dilakukan dengan cara memasukkan garam sebanyak 2 kg ke dalam ember, kemudian ditambahkan air sedikit demi sedikit sambil diaduk sampai volume larutan menjadi 10 liter. Tiap kg kedelai membutuhkan larutan garam sebanyak 1 liter. Perendaman dilakukan selama 8 minggu.
3.3 Enumerasi dan Isolasi BAL
Lima gram tauco mentah dihaluskan dan dicampurkan dengan 45 ml akuades steril, kemudian dilakukan pengenceran berseri hingga pengenceran 10-4. Dari pengenceran 10-4 suspensi diambil 0,1 ml dan diinokulasikan menggunakan media de Man Rogosa dan sharpe Agar (MRS Agar) dalam petri dengan metode sebar (spread
plate). Inkubasi dilakukan pada suhu 30°C selama 48 jam. Kultur dimurnikan pada
media MRS agar dan diinkubasi pada suhu 30°C selama 48 jam (modifikasi dari Misgiyarta dan Widowati, 2003).
3.4 Identifikasi BAL
produksi gas CO2 dari glukosa (Kacem et al., 2005). Pengujian lebih lanjut dilakukan
berdasarkan Holt et al. (1994).
3.4.1 Pewarnaan Gram
Preparat ulas dibuat pada gelas benda, difiksasi di atas api bunsen. Preparat ditetesi dengan larutan kristal ungu, didiamkan selama 60 detik dan dicuci dengan air mengalir dan dikeringkan. Preparat ditetesi dengan larutan iodin dan didiamkan selama 2 menit, dicuci dengan air mengalir dan dikeringkan. Preparat ditetesi dengan aseton alkohol dan kemudian dengan cepat dicuci dengan air mengalir. Tahap akhir preparat ditetesi dengan safranin dan didiamkan selama 30 detik, dicuci dengan air mengalir dan dikeringkan. Preparat kemudian diamati dengan mikroskop. Uji gram positif jika sel berwarna ungu dan negatif jika sel berwarna merah (Hadioetomo, 1985).
3.4.2 Uji Katalase
Isolat dari agar miring diambil 1 ose, kemudian dioleskan pada gelas benda yang telah diberi alkohol. Gelas benda ditetesi dengan 2-3 tetes larutan H2O2 3% dan
3.4.3 Uji Motilitas
Isolat dari agar miring diambil 1 ose kemudian diinokulasikan pada media SIM semisolid dengan cara menusukkannya hingga setengah media pada tabung reaksi. Media SIM yang berisi isolat BAL kemudian diinkubasi selama 48 jam pada suhu 30°Cuntuk kemudian diamati jejak pergerakan bakteri. Uji motilitas positif jika pertumbuhan koloni menyebar luas pada agar (Cappuccino dan Sherman, 1996).
3.4.4 Uji Produksi Gas CO2
Jarum ose yang berisi inokulum kultur BAL murni diinokulasikan pada tabung reaksi yang berisi media glukosa broth dengan merah fenol (pada tabung reaksi diberi tabung durham). Media yang berisi kultur BAL kemudian diinkubasikan selama 48 jam dengan suhu 37°C dan diamati terjadinya perubahan warna serta ada tidaknya gelembung pada tabung durham. Merah fenol merupakan indikator pH. Pada pH netral (7.0) akan berwarna merah dan berubah menjadi kuning pada pH sedikit asam yang mengindikasikan bahwa asam menyebabkan terjadinya perubahan warna. Uji positif jika terjadi perubahan warna merah fenol menjadi kuning, kadang diikuti dengan pembentukan gas (Cappuccino dan Sherman, 1996).
3.5 Analisis Gula Reduksi
55
akuades. Bubur Al(OH) 3 ditambahkan ke dalam labu takar. Penambahan bahan
penjernih ini diberikan tetes demi tetes sampai penetesan dari reagensia tidak menimbulkan pengeruhan lagi, kemudian ditambahkan akuades sampai tanda tera dan disaring. Filtrat ditampung dalam labu takar 200 ml.
Untuk menghilangkan kelebihan Pb, ditambahkan Na2CO3 anhidrat
secukupnya kemudian ditambahkan akuades sampai tanda, digojog dan disaring. Filtrat bebas Pb bila ditambahkan Na2CO3 tetap jernih. Filtrat bebas Pb diambil 25
ml, dimasukkan dalam erlenmeyer dan ditambahkan 25 ml larutan Luff-Schoorl dan 25 ml akuades. Larutan Luff-Schoorl 25 ml dan 25 ml akuades juga dibuat sebagai perlakuan blanko. Erlenmeyer yang berisi filtrat bebas Pb ditambahkan beberapa butir batu didih, kemudian erlenmeyer dihubungkan dengan pendingin balik, lalu didihkan. Pendidihan larutan dipertahankan selama 10 menit. Selanjutnya cepat-cepat didinginkan dan ditambahkan 15 ml KI 20% dan dengan hati-hati ditambahkan 25 ml H2SO4 26,5%. Yodium yang dibebaskan dititrasi dengan larutan Na-thiosulfat 0,1 N
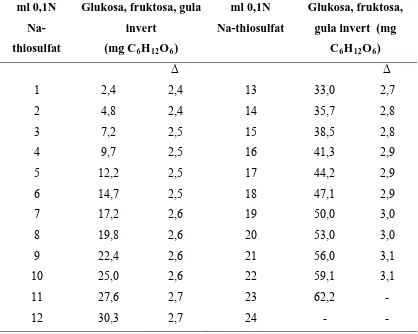
Tabel 3. Penentuan glukosa, fruktosa dan gula invert dalam suatu bahan dengan metode Luff-Schoorl
ml 0,1N
Na-thiosulfat
Glukosa, fruktosa, gula
3.6 Kadar Asam Laktat
Sampel sebanyak 10 gram dimasukkan ke dalam labu takar 100 ml dan diencerkan sampai tanda tera dengan air destilasi. Sampel yang sudah diencerkan sebanyak 5 ml dipindahkan ke dalam erlenmeyer dan ditambahkan 2 tetes fenoftalen 1%. Titrasi dilakukan dengan menggunakan larutan NaOH 0.1N sampai timbul warna merah muda. Total asam tertitrasi diasumsikan sebagai total asam laktat (Fardiaz, 1989).
total asam tertitrasi = ml 0.1N NaOH x 0.009 x 100 (% asam laktat) gram sampel
3.7 Pengukuran pH
Pengukuran pH dilakukan dengan menggunakan pH meter.
3.8 Kadar Asam Amino
Penentuan kadar asam amino tauco dilakukan dengan High Performance Liquid Chromatography (HPLC). Buffer sodium borat: 0,5M, pH 10,5; larutan
(5mM) masing-masing asam amino disiapkan dalam campuran metanol-air (8:2 v/v) dan disimpan pada suhu 4oC.
Standar untuk asam amino total (masing-masing 1 mM larutan glutamat dan glisin) disiapkan dengan cara mencampurkan masing-masing 1 ml 5 mM glutamat dan glisin dan dibuat menjadi 5 ml dengan campuran metanol-air (80:20 v/v); larutan asam amino standar (untuk profil HPLC): konsentrasi equimolar (0,1 mM dari masing-masing asam amino) campuran disiapkan sebelum digunakan dengan mencampurkan larutan stok masing-masing asam amino (Babu et al., 2002).
3.9 Penentuan Warna Tauco
Penentuan warna dilakukan secara visual pada penampakan tauco dengan menggunakan uji mutu hedonik. Penilaian dilakukan berdasarkan kriteria yang tertera pada tabel 4 berikut (Soekarto, 1990).
Tabel 4. Uji hedonik warna
Skala Hedonik Skala Numerik
Coklat kemerahan Coklat Kuning kecoklatan
Kuning
4 3 2 1
Penentuan aroma dan rasa ditentukan dengan uji organoleptik yaitu uji penentuan dengan cara uji kesukaan dengan panelis sebanyak 15 orang. Penilaian dilakukan berdasarkan kriteria seperti tertera pada Tabel 5 (Soekarto, 1990).
Tabel 5. Uji hedonik aroma dan rasa
Skala Hedonik Skala Numerik
Sangat suka Suka Agak suka Tidak suka
4 3 2 1
3.11 Rancangan Penelitian dan Analisis Data
Penelitian ini menggunakan rancangan acak lengkap (RAL) nonfaktorial dengan tiga ulangan. Hasil pengamatan dianalisis dengan menggunakan model (Hanafiah, 1991) :
Y = μ + τ + ε dimana :
Y : nilai pengamatan hasil percobaan μ : nilai rerata (mean) harapan
τ : pengaruh faktor perlakuan
ε : pengaruh galat
Perlakuan adalah :
To : waktu fermentasi pada minggu ke-0
T2 : waktu fermentasi pada minggu ke-2
T3: waktu fermentasi pada minggu ke-3
T4 : waktu fermentasi pada minggu ke-4
T5 : waktu fermentasi pada minggu ke-5
T6 : waktu fermentasi pada minggu ke-6
T7 : waktu fermentasi pada minggu ke-7
T8 : waktu fermentasi pada minggu ke-8
BAB IV
HASIL DAN PEMBAHASAN
4.1 Viabilitas BAL
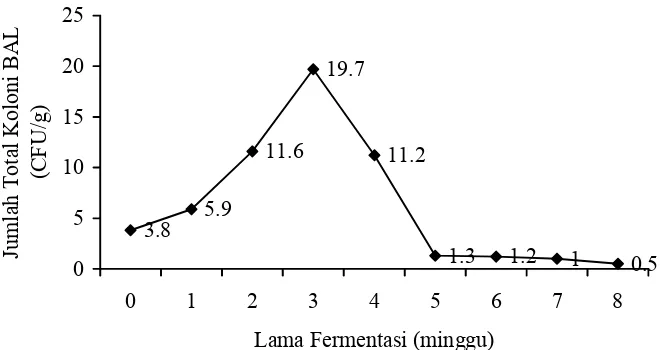
Viabilitas BAL selama delapan minggu fermentasi tauco dalam larutan garam menunjukkan terdapatnya variasi pertumbuhan. Pada saat awal fermentasi dalam larutan garam, diperoleh hasil 3.8 x 106 CFU/g kemudian viabilitas BAL meningkat pada minggu pertama (5.9 x 106 CFU/g). Minggu kedua naik sebesar 11.6 x 106 CFU/g dan mencapai nilai tertinggi pada minggu ketiga (19.7 x 106 CFU/g). Setelah minggu ketiga, viabilitas BAL mengalami penurunan, minggu kelima menunjukkan penurunan yang sangat tajam (Gambar 5). Perhitungan berdasarkan Standard Plate Count (SPC) disajikan pada Lampiran 3.
3.8
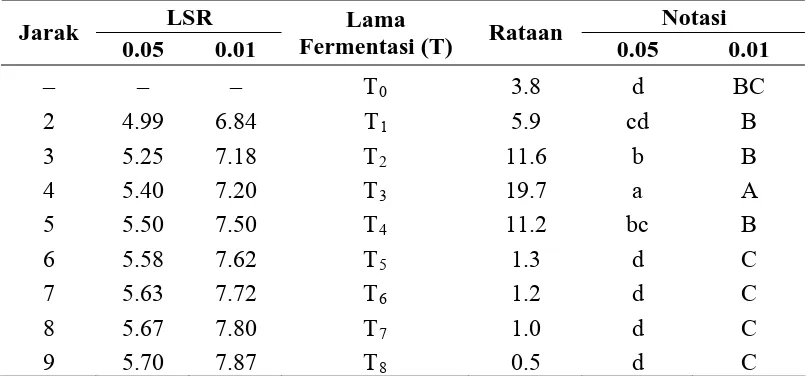
Berdasarkan hasil analisis statistik diketahui bahwa viabilitas BAL dipengaruhi oleh lamanya fermentasi dalam larutan garam (Lampiran 4). Hasil pengujian dengan Least Significant Ranges (LSR) menunjukkan perbedaan seperti pada Tabel 6 berikut.
Tabel 6. Uji LSR pengaruh lama fermentasi terhadap viabilitas BAL
LSR Notasi Jarak
0.05 0.01
Lama
Fermentasi (T) Rataan 0.05 0.01
– – – T0 3.8 d BC
2 4.99 6.84 T1 5.9 cd B
3 5.25 7.18 T2 11.6 b B
4 5.40 7.20 T3 19.7 a A
5 5.50 7.50 T4 11.2 bc B
6 5.58 7.62 T5 1.3 d C
7 5.63 7.72 T6 1.2 d C
8 5.67 7.80 T7 1.0 d C
9 5.70 7.87 T8 0.5 d C
Keterangan: notasi huruf yang berbeda menunjukkan beda nyata pada taraf 5% dan sangat nyata pada taraf 1%
garam. Hasil penelitian menunjukkan bahwa pada saat awal fermentasi dalam larutan garam ditemukan BAL menunjukkan bahwa BAL juga terdapat pada fermentasi oleh kapang.
BAL merupakan salah satu kelompok bakteri pembentuk asam yang penting dalam industri pangan (Fardiaz, 1992). BAL memainkan peranan dalam pembuatan produk susu fermentasi, pembuatan pikel sayuran, bir, daging dan saus. BAL juga secara luas digunakan sebagai kultur starter dan berperanan penting dalam pengawetan makanan, stabilitas mikrobiologi dan produksi senyawa aroma pada berbagai produk makanan (Salminen dan Wright, 1993; Daly dan Davis, 1998). BAL merupakan mikroorganisme yang pertama kali tumbuh dengan cepat dan mengkonsumsi gula yang dibebaskan dari degradasi pati selama fermentasi kapang (Hidayat et al., 2006). Ketersediaan nutrisi di dalam larutan garam disebabkan adanya tekanan osmosis dari larutan garam terhadap bahan, sehingga gula, vitamin dan mineral akan keluar dari bahan. Zat-zat nutrisi ini akan digunakan BAL untuk pertumbuhannya (Astuti, 2006).
ion-35
ion hidrogen dan mengganggu fungsi metabolik esensial seperti translokasi substrat dan fosforilasi oksidatif sehingga mereduksi pH intraseluler (Baird-Parker, 1980; Banwart, 1979).
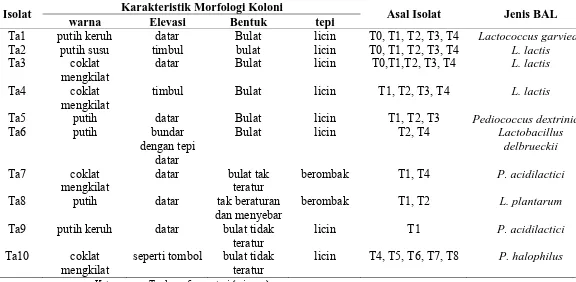
4.2 Identifikasi BAL
Selama proses fermentasi tauco dalam larutan garam ditemukan keragaman morfologi koloni BAL. Setelah dilakukan karakterisasi morfologi terhadap koloni BAL, diperoleh 10 isolat dengan karakteristik seperti yang ditampilkan pada Tabel 7 dan diduga merupakan genus Lactococcus, Pediococcus dan Lactobacillus didasarkan atas skema identifikasi awal genera BAL berdasarkan Rahayu dan Margino (1997). Satu isolat (Ta6) merupakan anggota genus Lactobacillus, 4 isolat (Ta5, Ta7, Ta9 dan Ta10) merupakan anggota genus Pediococcus, dan sisanya 5 isolat (Ta1, Ta2, Ta3, Ta4 dan Ta8) merupakan
anggota genus Lactococcus. Data yang diperoleh ditampilkan pada Tabel 8. Identifikasi lanjut setiap isolat dilakukan berdasarkan Holt et al. (1994).
Tabel 7. Karakteristik morfologi koloni BAL Karakteristik Morfologi Koloni
Isolat
warna Elevasi Bentuk tepi Asal Isolat Jenis BAL
Ta1 putih keruh datar Bulat licin T0, T1, T2, T3, T4 Lactococcus garviea
Ta5 putih datar Bulat licin T1, T2, T3 Pediococcus dextrinic
Ta6 putih bundar
dengan tepi datar
Bulat licin T2, T4 Lactobacillus
delbrueckii
Ta7 coklat mengkilat
datar bulat tak
teratur
berombak T1, T4 P. acidilactici
Ta8 putih datar tak beraturan
dan menyebar
berombak T1, T2 L. plantarum
Ta9 putih keruh datar bulat tidak teratur
licin T1 P. acidilactici
Ta10 coklat mengkilat
seperti tombol bulat tidak teratur
licin T4, T5, T6, T7, T8 P. halophilus Keterangan: T = lama fermentasi (minggu)
33
Tabel 8. Karakteristik morfologi sel dan uji biokimia 10 isolat BAL
Isolat Karakteristik
1 2 3 4 5 6 7 8
Bentuk sel bulat bulat bulat bulat bulat batang bulat bu
Menurut Hidayat et al. (2006), organisme yang ada dalam fermentasi garam sangat tergantung dari sumbernya. Pada proses alami jumlah BAL tidak diketahui dengan pasti dan umumnya jumlahnya sedikit. Pediococcus halophilus merupakan jenis BAL yang sering ditemukan dalam fermentasi kecap. Karena proses pembuatan kecap sama halnya seperti proses pembuatan tauco, bisa diduga bakteri ini juga ditemukan pada proses fermentasi tauco dalam larutan garam. Rahayu (1993) dalam penelitiannya juga menemukan bahwa bakteri yang terdapat pada fermentasi dalam larutan garam pada pembuatan kecap adalah dari genus Pediococcus. Menurut Naruki dan Sarjono (1984) serta Adam dan Moss (1995)
mikroorganisme yang mampu tumbuh pada tauco adalah bakteri halofilik antara lain: Pediococcus sp. dan Lactobacillus sp. Yokotsuka (1998) dan Banwart (1979) melaporkan bahwa spesies dari Pediococcus dan Lactobacillus merupakan BAL utama yang terdapat pada fermentasi dalam larutan garam pada proses pembuatan kecap. Penelitian dari Anonim (1990) terhadap saus yang dibuat secara tradisional secara fermentasi di Asia Tenggara menemukan bahwa pada tauco telah berhasil diisolasi dan diidentifikasi sebagai Lactobacillus coryniformis subsp. coryniformis dan Leuconostoc mesenteroides subsp. mesenteroides.
Seperti halnya mikroorganisme lain, bakteri halofil juga perlu menjaga keseimbangan osmotik di dalam dan di luar sel. Keseimbangan osmotik dapat dicapai melalui akumulasi garam dan/atau molekul organik. Pediococcus halophilus dapat mentoleransi kadar garam yang tinggi sehingga dapat melakukan
seperti trehalosa dan gliserol, asam amino seperti glutamat dan prolin, derivat asam amino seperti betain dan ektoin) tidak menghambat sebagian besar proses seluler. Pada kelompok BAL, identifikasi dan peran senyawa-senyawa ini telah diselidiki pada Lactobacillus casei subsp rhamnosus, Lactococcus lactis dan Lactobacillus plantarum. Glisin betain dilaporkan berperan sebagai
osmoprotektan utama yang efektif pada bakteri tersebut (Robert et al., 2000).
4.3 Analisis Kimiawi Tauco
3.86
Gambar 6. Kadar gula reduksi selama proses fermentasi tauco
BAL memanfaatkan gula glukosa hasil degradasi kapang pada fermentasi tahap pertama yang terdapat dalam larutan garam untuk pertumbuhannya. Hal ini dapat dibandingkan kadar gula reduksi yang terkandung dalam substrat fermentasi mengalami perubahan.
Pada tahap fermentasi oleh kapang, kapang yang berperan pada proses fermentasi seperti A. oryzae mensekresikan enzim proteolitik dan amilolitik. Kapang mati pada saat proses fermentasi dalam larutan garam, tetapi enzim yang dihasilkan tetap bisa bekerja. Naiknya kadar gula reduksi pada minggu kelima hingga minggu ketujuh dimungkinkan karena masih bekerjanya enzim amilolitik dari kapang yang mengubah gula kompleks menjadi gula sederhana (Huang dan Teng, 2004). Hal ini sejalan dengan Adam dan Moss (1995) yang menerangkan bahwa pada fermentasi dalam larutan garam kapang tidak dapat hidup lebih lama tetapi aktivitas enzim hidrolitik melanjutkan pemecahan protein dan polisakarida sehingga memperkaya substrat dengan nutrisi yang terlarut.
BAL dan khamir menggunakan gula sederhana hasil degradasi untuk menghasilkan asam laktat dan asam asetat. Selama proses fermentasi tauco dalam larutan garam, selain menghasilkan asam laktat dan asam asetat juga dihasilkan asam organik lainnya. Penurunan pH terjadi diduga karena akumulasi asam asetat yang dihasilkan oleh khamir serta asam organik lainnya.
Kadar asam laktat tertinggi dicapai pada minggu ketiga (0,279%), kemudian untuk minggu selanjutnya mengalami penurunan dan naik kembali pada minggu kedelapan (0,099%) (Gambar 8).
0.066 0.06 0.054
Gambar 7. Kadar asam laktat selama proses fermentasi tauco
tumbuh dalam tauco, maka makin banyak pula asam yang dihasilkan dari fermentasi. Menurunnya kadar asam laktat mulai minggu keempat hingga minggu ketujuh menurut Banwart (1979) dapat disebabkan oleh khamir yang juga dapat menggunakan asam laktat yang dihasilkan BAL. Fakta minggu ke delapan kadar asam laktat kembali naik diduga karena adanya aktivitas BAL yang ditemukan pada minggu kedelapan, yaitu P. halophilus yang mengubah glukosa menjadi asam laktat.
Pada Gambar 8 terlihat bahwa pH mengalami penurunan pada setiap minggu fermentasi. Kisaran pH berada antara 5.50 – 4.71. Asam laktat yang dihasilkan oleh BAL akan menurunkan keasaman substrat (Widowati dan Misgiyarta, 2003). Penurunan nilai pH tidak diikuti dengan peningkatan kadar asam laktat. Pada proses fermentasi tauco dalam larutan garam selain BAL, khamir juga menggunakan gula yang terdapat pada substrat dan akan diubah menjadi asam asetat dan sedikit alkohol. Asam asetat yang dihasilkan khamir ini juga memberikan kontribusi terhadap penurunan pH substrat.
5.5
4.96
4.85 4.78
4.77 4.78 4.76 4.75 4.71
4.2 4.4 4.6 4.8 5 5.2 5.4 5.6
0 1 2 3 4 5 6 7 8
Lama Fermentasi (minggu)
pH
40
Hasil analisis terhadap kandungan asam amino tauco diperoleh seperti yang tertera pada Gambar 9. Kandungan 17 asam amino mengalami fluktuasi. Beberapa jenis asam amino (serin, histidin dan arginin) kandungannya turun seiring dengan semakin lamanya waktu fermentasi. Asam aspartat, asam glutamat, glisin, alanin, tirosin, metionin, sistin, isoleusin dan leusin pada minggu keempat menurun, kemudian naik lagi pada minggu kedelapan. Asam amino valin dan lisin kadarnya naik selama minggu keempat dan kedelapan, sedangkan treonin, prolin dan fenilalanin kadarnya meningkat pada minggu keempat, tetapi pada minggu kedelapan menurun.
Tahap fermentasi dalam larutan garam ini berpengaruh terhadap hidrolisis protein. Kandungan asam amino terbesar adalah asam glutamat, diikuti dengan asam aspartat. Kedua jenis asam amino ini sangat berperan penting dalam memberikan flavor pada tauco. Tauco mempunyai rasa dan aroma yang ditimbulkan oleh senyawa glutamat. Asam laktat dan asam organik lain yang dihasilkan juga berperan dalam membentuk rasa dan aroma tauco (Naruki dan Sardjono, 1984).
0.000
Lisin merupakan asam amino dengan kandungan yang paling rendah jumlahnya di antara asam amino esensial lain yang terdapat dalam protein nabati (Martin dan Leonard, 1973). Melalui proses fermentasi, kandungan lisin meningkat. Ray (2001) melaporkan bahwa dari beberapa hasil penelitian pada tahun-tahun terakhir menunjukkan strain bakteri yang telah diisolasi kebanyakan dari BAL menghasilkan dan mengekskresikan lisin dalam jumlah besar ke dalam lingkungannya.
4.4 Uji Organoleptik Tauco
Penentuan terhadap warna tauco dilakukan secara visual dengan 15 panelis. Warna tauco yang baik seperti yang disyaratkan Wolf dan Coman (1971) adalah berwarna coklat kemerahan. Hasil uji penentuan warna tauco diketahui bahwa tauco dengan lama fermentasi 8 minggu memiliki warna coklat kemerahan. Hasil analisis sidik ragam menunjukkan bahwa lama fermentasi berpengaruh nyata terhadap warna tauco. Uji LSR pengaruh lama fermentasi terhadap warna tauco diberikan pada Lampiran 14.
1.15 1.33
Gambar 10. Organoleptik warna tauco
Uji organoleptik juga dilakukan terhadap rasa dan aroma tauco untuk menentukan kualitas tauco serta untuk melihat tingkat kesukaan yang diwakili oleh 15 orang panelis. Berdasarkan hasil analisis statistik diketahui bahwa tingkat kesukaan dipengaruhi oleh lama fermentasi. Data hasil uji organoleptik terhadap rasa dan aroma tauco diberikan pada Lampiran 15 dan 17.
kemungkinan juga memberikan kontribusi terhadap rasa dan aroma tauco. Kombinasi asam amino dengan rasanya yang unik memungkinkan timbulnya rasa atau fungsi yang baru (Anonim, 2003). Penelitian Je et al. (2004) menemukan bahwa kandungan taurin, asam glutamat, lisin, glisin dan alanin yang tinggi memberikan kontribusi terhadap rasa dan aroma saus tiram yang difermentasi. Kandungan glisin, alanin, prolin, asam aspartat dan asam glutamat yang lebih tinggi berperan sangat penting terhadap rasa saus ikan dan kerang (Pyo et al., 2005).
1.18 1.31
1.27 1.53
2.56 2.67 2.80
2.91 3.18
3.42 3.64
0 0.5 1 1.5 2 2.5 3 3.5 4
0 1 2 3 4 5 6 7 8 9
Lama Fermentasi (Minggu)
O
rga
no
le
pt
ik
A
rom
a
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat diambil kesimpulan : 1. Viabilitas BAL dipengaruhi oleh lamanya waktu fermentasi. Viabilitas BAL pada
minggu ketiga mencapai pertumbuhan tertinggi (19,7 x 106 CFU/g). Mulai minggu keempat menurun hingga minggu kedelapan. Perubahan kadar gula reduksi, asam laktat, pH dan kandungan asam amino tauco juga dipengaruhi oleh lama fermentasi.
2. Selama delapan minggu fermentasi dalam larutan garam, ditemukan 10 isolat bakteri yang diidentifikasi sebagai Lactococcus garvieae (isolat Ta1), L. lactis (isolat Ta2, Ta3 dan Ta4), L. plantarum (isolat Ta8), Lactobacillus delbruecky (isolat Ta6), Pediococcus dextrinicus (isolat Ta5), P. acidilactici (isolat Ta7 dan Ta9) serta P. halophilus (isolat Ta10)
5.2 Saran
DAFTAR PUSTAKA
Aarnikunnas, J. 2006. Metabolic Engineering of Lactic Acid Bacteria and Characterization of Novel Enzymes for the Production of Industrially Important Compounds. Tersedia pada http://ethesis.helsinki.fi/julkaisut/ ela/perus/vk/aarnikunnas/metaboli.pdf. [3 Januari 2009].
Abegaz, K. 2007. Isolation, characterization and identification of LAB involved in traditional fermentation of borde, an Ethiopian cereal beverage. African Journal of Biotechnology 6(12):1469-1478.
Achi, O.K. 2005. The potential for upgrading traditional fermented foods through biotechnology. African Journal of Biotechnology 4(5):375-380.
Adam, M.R. and M.O. Moss 1995. Food Microbiology. The Royal Society of Chemistry, Cambridge.
Anonim. 1990. Isolation and identification of lactic acid bacteria from traditional fermented sauce in Southest Asia. Japanese Journal of Dairy and Food Science 39(5): 1-5.
Anonim. 2003. Food and amino acids. Tersedia pada www.ajinomoto.com/amino/ eng/ food.htm.[5 Agustus 2009].
Astuti, S.M. 2006. Teknik pelaksanaan percobaan pengaruh konsentrasi garam dan
blanching terhadap mutu acar buncis. Buletin Teknik Pertanian 11(2): 59-63.
Babu, S.V.S., M.M. Shareef, A. Pavan Kumar Shetty and K. Taranath Shetty. 2002. HPLC method for amino acids profile in biological fluids and inborn metabolic disorders of aminoacidopathies. Indian Journal of Clinical Biochemistry 17(2):7-26.
Baird-Parker, A.C. 1980. Organic Acids. In: Microbial Ecology of Foods. pp. 126-135. Academic Press. New York.
Cappuccino, J.B. and N. Sherman. 1996. Microbiology a Laboratory Manual. The Benjamin Cummings, California.
Daeschel, A.M. 1989. Antimicrobial substances from acid lactic bacteria for use as food preservative. Food Technol 43: 91-94.
Daly, C. and R. Davis. 1998. The biotechnology of lactic acid bacteria with emphasis on applications in food safety and human health. Agri and Food Sci. 7(2):251-264.
Desmazeaud, M. 1996. Lactic acid bacteria in food: use and safety. Cahiers Agricultures 5 (5): 331-342.
Fardiaz, S. 1989. Mikrobiologi Pengolahan Pangan. PAU Pangan dan Gizi IPB, Bogor.
---. 1992. Mikrobiologi Pangan 1. Gramedia Pustaka Utama, Jakarta.
Frazier. 1976. Food Microbiology. Tata McGraw Hill Publishing Company, New Delhi.
Hadioetomo, R.S. 1985. Mikrobiologi Dasar dalam Praktek. Gramedia, Jakarta. Hanafiah, K.A. 1991. Rancangan Percobaan, Teori dan Aplikasi. PT Raja Grafindo
Persada, Jakarta.
Hasbullah. 2001. Tauco. Tersedia pada http://www.ristek.go.id. [20 Maret 2008]. Hidayat, N., M.C. Padaga dan S. Suhartini. 2006. Mikrobiologi Industri. Penerbit
Andi, Yogyakarta.
Holt, J.G., N.R. Krieg, P.H.A. Sneath, J.T. Stanley and S.T. Williams. 1994. Bergey’s Manual of Determinative Bacteriology. 9th Edition. Williams and Wilkins, Baltimore.
Holzapfel, W.H., R. Geinsen and U. Schillinger. 1995. Biological preservation of foods with reference to protective cultures, bacteriocins and food grade enzymes. Int. J. Food Microbiol. 24(3):343-362.
Ibourahema, C., R.D. Dauphin, D. Jacqueline and P. Thonart. 2008. Characterization of lactic acid bacteria isolated from poultry farms in Senegal. African Journal of Biotechnology 7(12):2006-2012.
Indriani, E.A. 1990. Pengaruh Substitusi NaCl dengan KCl terhadap Sifat Mikrobiologi, Kimiawi dan Sensoris Tauco. Skripsi. Jurusan PHP Fakultas Teknologi Pertanian UGM, Yogyakarta.
Je, J., P. Park, W., Jung, and S. Kim. 2005. Amino acid changes in fermented oyster (Crassostrea gigas) sauce with different fermentation periods. J. Food Chemistry 91(1) : 15-18.
Jenie, B.S.L. 1996. Peranan bakteri asam laktat sebagai pengawet hayati makanan (food biopreservative). J. Ilmu dan Tek. Pangan 7(2):46-51.
Kacem, M., H. Karam and N. Karam. 2005. Isolation of acid lactic bacteria from naturally fermented Algerian olives. J. King Saud Univ. 18(2):89-98.
Kasmidjo. 1990. Tempe Mikrobiologi dan Biokimia Pengolahan serta Pemanfaatannya. PAU Pangan dan Gizi UGM, Yogyakarta.
König, H. and J. Fröhlich. 2009. Biology of Microorganism on Grapes, in Must and in Wine. Springer-Verlag, Berlin.
Kulp, K. and J.G. Ponte. 2000. Handbook of Cereal Science and Technology. Marcel Dekker Inc, New York.
Kuswanto, K.R. 2004. The Industry of Fermented Food in Indonesia: Present Status and Development. Di dalam: Proceedings of the International Seminar on Developing Agricultural Technology for Value-added Food Production in Asia. Tersedia pada http//www.cryo.affrc.go.jp/kankobutu/fftc/Oral_ Presentations/ fftc_or_07/fftc_or_07.htm. [3 Maret 2008].
Lay, B.W. 1994. Analisis Mikrobia di Laboratorium. PT Raja Grafindo Persada, Jakarta.
Lindquist, J. 1998. General Overview of the Lactic Acid Bacteria. Tersedia pada http//www.splammo.net/bact102/102xlactics.html. [20 Juni 2008].
Malaka, R dan A. Laga. 2005. Isolasi dan identifikasi Lactobacillus bulgaricus strain ropy dari yogurt komersial. Sains dan Teknol. 5(1):50-58.
Marliyati, S.A. 1992. Pengolahan Pangan Tingkat Rumah Tangga. PAU Pangan dan Gizi IPB, Bogor.
Martin, J.H. and W.S. Leonard. 1973. Principles of Field Crop Production. Mc Millan Publishing, London.
Misgiyarta dan S. Widowati. 2003. Seleksi dan Karakterisasi Bakteri Asam Laktat (BAL) Indigenus. Di dalam : Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman. Tersedia pada biogen.litbang.deptan.go.id/terbitan/ prosiding/fulltext_pdf/prosiding2003_374-387_misgiyarta_seleksi.pdf. [2 Mei 2008].
Nair, P.S. and P.K. Surendran. 2005. Biochemical characterization of lactic acid bacteria isolated from fish and prawn. Journal of Culture Collections 4:48-52. Naruki, S. dan Sarjono. 1984. Pembuatan Tauco. Jurusan PHP Fakultas Teknologi
Pertanian UGM, Yogyakarta.
Öksüztepe, G., B. Patir, dan M. Çalicioğlu. 2005. Identification and distribution of LAB during the ripening of savak tulum cheese. Turk. J. Vet. Anim. Sci. 29:873-879.
Pakpahan, H.K.P. 1998. Pengaruh Jenis Laru terhadap Rendemen dan Mutu Tempe Kedelai (Glycine max L.). Skripsi. Jurusan THP Fakultas Pertanian Universitas HKBP Nommensen, Medan.
Parveen, S. and F. Hafiz. 2003. Fermented cereal from indigenous raw materials. Pakistan Journal of Nutrition 2(5):289-291.
Prachyakij, P., J. Schnürer, W. Charernjiratrakul and D. Kantachote. 2007. Selection and identification of lactic acid bacteria that inhibit yeast contaminants isolated from fermented plant beverages. Songklanakarin J. Sci. Technol. 29:211-218.
Rahayu, E.S. 1993. Bahan Pangan Hasil Fermentasi. PAU Pangan dan Gizi UGM, Yogyakarta.
Rahayu, E.S. dan Margino. 1997. Bakteri Asam Laktat Isolasi dan Identifikasi. PAU Pangan dan Gizi UGM, Yogyakarta.
Rahayu, K. dan S. Sudarmadji. 1989. Mikrobiologi Pangan. PAU Pangan dan Gizi UGM, Yogyakarta.
Rahman, A. 1992. Teknologi Fermentasi. Arcan, Jakarta.
Ray, B. 2001. Fundamental Food Microbiology. CRC Press, Washington.
Robert, H., C. Le Marrec, C. Blanco and M. Jebbar. 2000. Glycine betaine, carnitine and choline enhance salinity tolerance and prevent the accumulation of sodium to a level inhibiting growth of Tetragenococcus halophila. App Environ Microbiol 66(2):509-517.
Salminen, S. and A. Wright. 1993. Lactic Acid Bacteria. Marcel Dekker, New York. Soekarto, S.T. 1990. Penilaian Organoleptik untuk Industri Pangan dan Hasil Industri
Pertanian. Bharata, Jakarta.
Sudarmadji, S., B. Haryono dan Suhardi. 1984. Prosedur Analisis Bahan Makanan dan Pertanian. Penerbit Liberty, Yogyakarta.
Suprapto. 1992. Kedelai. Penebar Swadaya, Jakarta.
Suwaryono, O. dan Y. Ismeini. 1988. Fermentasi Bahan Makanan Tradisional. PAU Pangan dan Gizi UGM, Yogyakarta.
Tsuda, H., K. Hara and T. Miyamoto. 2007. High bile- and low pH-resistant bacteria isolated from traditional fermented dairy products in inner Mongolia, China. Milk Science 55(3):129-134.
Wibowo, D. 1989. Fisiologi Bakteri Asam Laktat. Hand Out Kursus Singkat Fisiologi Bakteri. PAU Bioteknologi UGM, Yogyakarta.
Tersedia pada biogen.litbang.deptan.go.id/terbitan/prosiding/fulltext_pdf/ prosiding2003_360-373_sriwidowati_seleksi.pdf. [24 Juni 2008].
Winarno, F.G. dan B.S.L. Jenie. 1974. Dasar Pengawetan Sanitasi dan Keracunan. Departemen teknologi hasil IPB, Bogor.
Wolf, W.J. and J.C. Coman. 1971. Soybean as Food Source. Butter Worths, London. Yokotsuka, T. 1998. Fermented Protein Foods in the Orient, with Emphasis on Shoyu
Lampiran 1. Alur kerja penelitian
TAUCO
Fermentasi II (dalam lar. Garam) Fermentasi I
(oleh kapang)
a asam
amino pH
Jumlah koloni BAL
(SPC)
Isolasi, identifikasi
BAL
Lampiran 2. Alur kerja identifikasi BAL
Fermentasi Tauco dalam Larutan Garam
Isolasi dan purifikasi BAL
Karakterisasi isolat BAL
Morfologi koloni dan pewarnaan gram Uji katalase
Uji motilitas
Uji penggunaan sitrat
Uji produksi gas dari glukosa Fermentasi karbohidrat
Lampiran 3. Jumlah total koloni BAL pada fermentasi tauco dalam larutan garam (x106 CFU/gr)
Ulangan Perlakuan
I II III Total Rataan
T0 4.6 3.7 3.0 11.3 3.8 ± 0.8
T1 3.3 8.6 5.8 17.7 5.9 ± 0.1
T2 14.7 8.0 12.0 34.7 11.6 ± 1.8
T3 16.3 14.7 28.2 59.2 19.7 ± 4.5
T4 10.2 12.4 11.0 33.6 11.2 ± 2.9
T5 2.0 0.7 1.2 3.9 1.3 ± 1.6
T6 1.7 0.7 1.1 3.5 1.2 ± 1.7
T7 2.1 0.7 0.2 3.0 1.0 ± 1.7
Lampiran 4. Analisis sidik ragam pengaruh lama fermentasi terhadap viabilitas BAL
Ftabel
SK DB JK KT Fhitung
0.05 0.01
Perlakuan 8 1054.33 131.79 15.53 ** 2.51 3.71
Linear 1 124.99 124.99 14.73 ** 4.41 8.28
Kuadratik 1 95.58 95.58 11.27 ** 4.41 8.28
Kubik 1 85.03 85.03 10.02 ** 4.41 8.28
Kuartik 1 13.79 13.79 1.62 tn 4.41 8.28
Kuintik 1 59.26 59.26 6.98 * 4.41 8.28
Galat/Error 18 152.72 8.48
Total 26 1207.05
Lampiran 5. Jumlah total koloni khamir pada fermentasi tauco dalam larutan garam (x107 CFU/gr)
Ulangan Perlakuan
I II III Total Rataan
T0 3.0 3.4 3.9 10.3 3.4 ± 0.8
T1 3.5 4.2 3.6 11.3 3.8 ± 0.7
T2 4.0 5.5 6.7 16.2 5.4 ± 0.1
T3 8.5 15.0 12.9 36.4 12.1 ± 2.1
T4 14.8 15.3 13.1 43.2 14.4 ± 2.9
T5 9.8 10.3 3.6 23.7 7.9 ± 0.7
T6 4.1 2.1 3.1 9.3 3.1 ± 0.9
T7 2.1 2.8 3.7 8.6 2.9 ± 1.0
Lampiran 7. Data kadar gula reduksi tauco
Ulangan Perlakuan
I II III Total Rataan
T0 3.850 3.868 3.861 11.579 3.860 ± 0.585
T1 3.052 3.311 3.045 9.408 3.136 ± 0.344
T2 1.988 2.003 1.988 5.979 1.993 ± 0.037
T3 2.248 2.500 2.271 7.019 2.340 ± 0.078
T4 0.021 0.033 0.013 0.067 0.022 ± 0.694
T5 0.025 0.021 0.244 0.290 0.097 ± 0.379
T6 1.490 1.992 1.984 5.466 1.822 ± 0.094
T7 3.857 4.713 5.303 13.873 4.624 ± 0.840
Lampiran 8. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi terhadap kadar gula reduksi tauco
Analisis sidik ragam pengaruh lama fermentasi terhadap kadar gula reduksi tauco
Ftabel
Keterangan : ** = berbeda sangat nyata
Uji LSR pengaruh lama fermentasi terhadap kadar gula reduksi tauco
LSR Notasi
Lampiran 9. Data kadar asam laktat tauco
Ulangan Perlakuan
I II III Total Rataan
T0 0.063 0.063 0.072 0.198 0.066 ± 0.008
T1 0.054 0.072 0.054 0.180 0.060 ± 0.010
T2 0.054 0.054 0.054 0.162 0.054 ± 0.012
T3 0.279 0.234 0.324 0.837 0.279 ± 0.063
T4 0.099 0.072 0.072 0.243 0.081 ± 0.003
T5 0.072 0.081 0.090 0.243 0.081 ± 0.003
T6 0.054 0.054 0.054 0.162 0.054 ± 0.012
T7 0.045 0.045 0.054 0.144 0.048 ± 0.014
Lampiran 10. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi terhadap kadar asam laktat tauco
Analisis sidik ragam pengaruh lama fermentasi terhadap kadar asam laktat tauco Ftabel
Keterangan : ** = berbeda sangat nyata
Uji LSR pengaruh lama fermentasi terhadap kadar asam laktat tauco
LSR Notasi
Lampiran 11. Data pH tauco
Ulangan Perlakuan
I II III Total Rataan
T0 5.56 5.46 5.49 16.51 5.50 ± 0.21
T1 4.94 4.95 4.98 14.87 4.96 ± 0.03
T2 4.88 4.85 4.83 14.56 4.85 ± 0.01
T3 4.77 4.79 4.77 14.33 4.78 ± 0.03
T4 4.76 4.78 4.76 14.30 4.77 ± 0.03
T5 4.78 4.78 4.77 14.33 4.78 ± 0.03
T6 4.77 4.86 4.64 14.27 4.76 ± 0.04
T7 4.67 4.79 4.78 14.24 4.75 ± 0.04
Lampiran 12. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi terhadap pH tauco
Analisis sidik ragam pengaruh lama fermentasi terhadap pH tauco
Fhitung Ftabel
Keterangan : ** = berbeda sangat nyata * = berbeda nyata tn = berbeda tidak nyata
Uji LSR pengaruh lama fermentasi terhadap pH tauco
Keterangan: notasi huruf yang berbeda menunjukkan beda nyata pada taraf 5% dan sangat nyata pada taraf 1%
Lampiran 13. Data uji organoleptik warna
Ulangan Perlakuan
I II III Total Rataan
T0 1.13 1.13 1.20 3.46 1.15 ± 0.30
T1 1.33 1.33 1.33 3.99 1.33 ± 0.24
T2 1.67 1.53 1.47 4.67 1.56 ± 0.17
T3 1.73 1.73 1.67 5.13 1.71 ± 0.12
T4 1.80 1.80 1.80 5.40 1.80 ± 0.09
T5 2.40 2.33 2.33 7.06 2.35 ± 0.10
T6 2.67 2.60 2.40 7.67 2.56 ± 0.17
T7 2.87 3.00 3.00 8.87 2.96 ± 0.30
Lampiran 14. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi terhadap warna tauco
Analisis sidik ragam pengaruh lama fermentasi terhadap warna tauco
Ftabel
SK DB JK KT Fhitung
0.05 0.01
Perlakuan 8 12.1128 1.5141 326.8134 ** 2.51 3.71
Linear 1 3.1008 3.1008 669.3026 ** 4.41 8.28
Keterangan : ** = berbeda sangat nyata * = berbeda nyata tn = berbeda tidak nyata
Uji LSR pengaruh lama fermentasi terhadap warna tauco
Keterangan : notasi huruf yang berbeda menunjukkan beda nyata pada taraf 5% dan sangat nyata pada taraf 1%
Lampiran 15. Data uji organoleptik rasa
Ulangan Perlakuan
I II III Total Rataan
T0 1.20 1.27 1.07 3.54 1.18 ± 0.25
T1 1.27 1.40 1.27 3.94 1.31 ± 0.20
T2 1.67 1.67 1.53 4.87 1.62 ± 0.10
T3 1.73 1.73 1.67 5.13 1.71 ± 0.07
T4 1.87 1.93 1.93 5.73 1.91 ± 0.003
T5 2.13 2.13 2.13 6.39 2.13 ± 0.07
T6 2.27 2.20 2.20 6.67 2.22 ± 0.10
T7 2.47 2.53 2.53 7.53 2.51 ± 0.20
Lampiran 16. Analisis sidik ragam dan uji LSR pengaruh lama fermentasi terhadap rasa tauco
Analisis sidik ragam pengaruh lama fermentasi terhadap rasa tauco
Fhitung Ftabel
SK DB JK KT
0.05 0.01
Perlakuan 8 6.3749 0.7969 248.0135 ** 2.51 3.71
Linear 1 1.5169 1.5169 472.1063 ** 4.41 8.28
Kuadratik 1 0.0003 0.0003 0.0850 tn 4.41 8.28
Kubik 1 0.0014 0.0014 0.4402 tn 4.41 8.28
Kuartik 1 0.0001 0.0001 0.0415 tn 4.41 8.28
Kuintik 1 0.0019 0.0019 0.5918 tn 4.41 8.28
Galat/Error 18 0.0578 0.0032
Total 26 6.4327
Keterangan : ** = berbeda sangat nyata tn = berbeda tidak nyata
Uji LSR pengaruh lama fermentasi terhadap rasa tauco
LSR Notasi Jarak
0.05 0.01
Lama
Fermentasi (T) Rataan 0.05 0.01
– – – T0 1.18 g F
2 0.10 0.13 T1 1.31 f F
3 0.10 0.14 T2 1.62 e E
4 0.11 0.14 T3 1.71 e E
5 0.11 0.15 T4 1.91 d D
6 0.11 0.15 T5 2.13 c C
7 0.11 0.15 T6 2.22 c C
8 0.11 0.15 T7 2.51 b B