ISOLASI DAN KARAKTERISASI BAKTERI ASAM LAKTAT
PENGHASIL BAKTERIOSIN DARI FERMENTASI SUSU
JAGUNG
LISMAYANA HANSUR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Karakterisasi Bakteri Asam Laktat Penghasil Bakteriosin dari Fermentasi Susu Jagung adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2013
Lismayana Hansur
RINGKASAN
LISMAYANA HANSUR Isolasi dan Karakterisasi Bakteri Asam Laktat Penghasil Bakteriosin dari Fermentasi Susu Jagung. Dibimbing oleh IMAN RUSMANA dan NISA RACHMANIA MUBARIK.
Susu jagung merupakan diversifikasi olahan jagung yang dijumpai pada masyarakat sebagai sumber nutrisi pilihan selain makanan pokok, namun karena masih diproduksi secara tradisional sehingga daya tahan produk masih rendah. Pemanfaatan pengawet kimia dapat digunakan untuk menjaga kontaminasi bakteri pembusuk tetapi pengawet tersebut sangat berbahaya bagi manusia. Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi isolat BAL penghasil antimikrob dari fermentasi jagung yang dapat memberi produk terbaik pada susu jagung fermentasi.
Isolasi bakteri asam laktat (BAL) dilakukan dari fermentasi jagung secara spontan dengan 3 perlakuan dan 2 ulangan. Perlakuan pertama yaitu tabung dibuka dan tidak dipanaskan (JMB), tabung ditutup dan tidak dipanaskan (JMT) serta tabung ditutup dan dipanaskan (JMA). Penapisan BAL penghasil aroma terbaik dilakukan menggunakan uji organoleptik. BAL yang terpilih adalah BAL yang secara karakteristik organoleptik yang unggul dan juga mampu mempertahankan aroma setelah penyimpanan 6 bulan pada suhu 40C. Penapisan antimikrob dilakukan dengan metode antagonisme langsung dengan stab
inokulasi menggunakan galur indikator yaitu Staphylococcus aureus dan
Escherichia coli. BAL hasil penapisan dari uji organoleptik dan penghasil senyawa antimikrob di amati fase pertumbuhannya. Bakteri yang menghasilkan zona bening selanjutnya diuji menggunakan metode difusi sumur agar. Keberterimaan konsumen terhadap inokulasi BAL diukur menggunakan nilai hedonik dan dianalisis berdasarkan Fredman tes. Bakteri terpilih selanjutnya di identifikasi berdasarkan 16S rRNA.
Isolat sebanyak 33 diperoleh dari perlakuan pertama, kedua, dan perlakuan ketiga menghasilkan 22, 7, 4 isolat secara berturut-turut. BAL yang terpilih
merupakan bakteri dengan zona bening terluas yaitu Lactobacillus JMB 9,
Lactobacillus JMB 13 dan Lactobacillus JMT 6. Lactobacillus JMB 4 dan
Lactobacillus JMB 6 sebagai kandidat BAL yang dapat memberikan aroma terbaik. Penapisan menggunakan metode antagonis langsung diperoleh 13 isolat yang menghasilkan daya hambat pada mikroba uji Sthapylococcus aureus dan
E.coli. Selanjutnya, 13 isolat tersebut diuji antagonis metode sumur agar pada perlakuan pH 4 dan pH 6 menggunakan mikroba uji Sthapylococcus aureus dan diperoleh isolat BAL JMB 6 yang diduga memiliki kemampuan penghasil bakteriosin. Pengujian bakteriosin selanjutnya dilakukan dengan menambahkan enzim protease pada supernatan isolat Lactobacillus JMB 6. Penambahan protease menyebabkan terhambatnya aktivitas bakteriosin. Sehingga substansi antimikrob yang dihasilkan oleh Lactobacillus JMB 6 diduga ialah bakteriosin. Aplikasi bakteriosin dan perlakuan inokulasi bakteri terpilih pada susu jagung menunjukkan bahwa semua perlakuan memiliki kemampuan mempertahankan aroma. Hasil identifikasi bakteri terpilih JMB 4 menunjukkan kesamaan 97% dengan Lactobacillusplantarum.
SUMMARY
LISMAYANA HANSUR. Isolation and Characterization Lactid Acid Bacteria Producing Bacteriocins from Corn Fermented Milk. Supervised by IMAN RUSMANA and NISA RACHMANIA MUBARIK.
Corn milk is one of diversification product in the society as a nutrition source selection than staple food. Corn milk is low durability due to contamination spoilage bacteria. The use of chemical preservatives can be used to keep the spoilage bacteria contamination but these preservatives are very harmfull to humans. The research study purpose is isolation and identification of lactid acid bacteria producing bacteriocin from fermented corn for biopreservatives on corn milk.
Isolation of lactid acid bacteria (LAB) from fermented corn was done spontaneously with 3 treatments and 2 replications. The first treatment of the tube was opened and not heated (JMB), the tube was closed and not heated (JMT) and the tube was closed and heated (JMA). Screening LAB performed was used the best flavour as a organoleptic test. The selected LAB as the best organoleptic characteristics, also able to maintain the flavor after 6 months of storage at 40C of temperature. The bacteria was found will be selected by direct antagonism method with stab inoculation againts indicator bacteria strain Staphylococcus aureus and
Escherichia coli. The bacteria that produced a clear zone was chosen to next selection by using well diffusion method. The LAB screening results of organoleptic tests and producing antimicrobial compounds then observed of growth phase. The 13 isolates were tested by using well diffusion methods which used S. aureus as microbial test in pH 4, pH 6 after that protease treatments.
Consumer acceptance of the BAL inoculation were measured and analyzed using hedonic value based Fredman test. The chosen bacteria was identification by 16S rRNA.
Total of 33 isolates were obtained. The first until third treatment obtained 22, 7, and 5 isolates respectively. The selected LAB is a bacteria by the widest clear zone is Lactobacillus JMB 9, Lactobacillus JMB 13 dan Lactobacillus JMT 6. Lactobacillus JMB 4 and Lactobacillus JMB 6 as BAL candidate who can give the best flavor. Direct antagonist screening method obtained 13 isolates that produce inhibitory effects on Sthapylococcus aureus and E.coli. Based on the screening results obtained Lactobacillus JMB 6 has the ability to produce inhibition in pH 6. The addition of protease make a disturb of bacteriocins activity. The antimicrobial substance produced by Lactobacillus JMB 6 can be concluded as a bacteriocins. The addition of bacteriocins treatment and inoculation of lactic acid bacteria showed preference value not significantly different scents. Bacteriocins added and bacterial selected inoculation on corn milk showed that all treatments have the ability to retain flavor. Identification bacterial based on 16 sRNA was showed 97% similarity LAB JMB 4 with
Lactobacillus plantarum.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
ISOLASI DAN KARAKTERISASI BAKTERI ASAM LAKTAT
PENGHASIL BAKTERIOSIN DARI FERMENTASI SUSU
JAGUNG
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul Tesis : Isolasi dan Karakterisasi Bakteri Asam Laktat Penghasil Bakteriosin dari Fermentasi Susu Jagung
Nama : Lismayana Hansur NIM : G351110021
Disetujui oleh Komisi Pembimbing
Dr Iman Rusmana, MS Ketua
Dr Nisa Rachmania Mubarik, MSi Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 21 November 2013
PRAKATA
Syukur alhamdulillah penulis panjatkan ke hadirat Allah SWT, karena dengan rahmat dan karunia-Nya sehingga penelitian yang dilanjutkan dengan penyusunan dan penulisan tesis dengan judul ” Isolasi dan Karakterisasi Bakteri Asam Laktat Penghasil Bakteriosin dari Fermentasi Susu Jagung” dapat terselesaikan. Tesis ini disusun dalam rangka penyelesaian studi Program Magister (S2) pada Program Studi Mikrobiologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (MIPA), Sekolah Pascasarjana Institut Pertanian Bogor. Penelitian ini merupakan sebuah upaya untuk mencari alternatif pemanfaatan hasil pertanian yang dapat dinikmati secara langsung serta mencari alternatif pengawet alami dari bakteri asam laktat.
Ucapan terima kasih dengan penuh hormat saya sampaikan kepada Bapak Dr. Ir. Iman Rusmana, MSi, Pembimbing Akademik dan ketua komisi pembimbing, juga sebagai Ketua Departemen Biologi, Fakultas MIPA IPB, yang selalu bersedia untuk berdiskusi, memberikan nasihat dan solusi pada setiap masalah yang dihadapi penulis, tidak hanya menjadi pembimbing tetapi juga menjadi pembimbing psikologi yang telah menjaga semangat penulis selama di IPB. Sebagai anggota komisi pembimbing, Ibu Dr Nisa Rachmaia Mubarik, MSi yang selain sebagai pembimbing juga menjadi seorang motivator selama penelitian dan penulisan tesis yang tidak pernah bosan menampung keluh kesah, mengarahkan walau sering terjadi kesalahan dan kecerobohan pribadi penulis, serta selalu memberikan semangat kepada penulis. Terima kasih saya haturkan kepada Bapak dan Ibu pembimbing yang telah menyediakan waktu, energi dan upaya serta telah mau memahami kekurangan penulis.
Kepada yang terhormat Ibu Dr Gayuh Rahayu, MSi dan Ibu Prof Dr Anja Meryandini, MSi sebagai Ketua Prodi Mikrobiologi yang senantiasa menyemangati penulis, terimakasih atas segala kesediaan waktu dan masukan yang telah diberikan. Selanjutnya kepada Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional, terimakasih atas beasiswa yang telah diberikan. Penulis juga ucapkan terimakasih kepada Rektor Institut Pertanian Bogor beserta seluruh civitas akademika atas kesempatan yang diberikan kepada penulis untuk mengikuti pendidikan S2 di IPB.
Ucapan terimakasih dengan tulus juga penulis sampaikan untuk seluruh civitas akademika Program Studi Mikrobiologi, Kepada Pak Edjen yang telah banyak membantu. Kepada keluarga kecil Mikrotropisian (WES, TH, IH, ES, KSN, AU, IPP, RWP, NN, ER, mba 3, FS ) serta rekan-rekan lain yang telah berpartisipasi dan mendukung penulis baik selama mengikuti studi maupun dalam penelitian, diucapkan terimakasih atas segala perhatian dan bantuan yang telah diberikan.
dalam lindungan-Nya. Akhir kata, semoga tesis yang disusun ini menjadi berguna bagi penulis, masyarakat dan bangsa. Penulis selalu menantikan saran dan kritik yang bertujuan untuk lebih memperbaiki tesis ini.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
1 PENDAHULUAN i
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 2
Bahan 2
Alat 2
Prosedur Kerja 2
Fermentasi spontan 3
Isolasi dan karakterisasi bakteri asam laktat 3 Penapisan Bakteri Asam Laktat Menggunakan Karakteristik Organoleptik
dan Kemampuan Mempertahankan Aroma 3
Penapisan Bakteri Asam Laktat Berdasarkan Kemampuan Menghasilkan
Antimikrob 4
Kurva Pertumbuhan BAL terpilih 5
Fermentasi Susu Jagung Menggunakan Isolat Terpilih dan Uji Organoleptik 5
Analisis Data 5
Identifikasi dan Filogenetik Bakteri Asam Laktat Berdasarkan 16S rRNA 6
3 HASIL 7
Isolasi dan Identifikasi Bakteri Asam Laktat dari Jagung Fermentasi 7 Penapisan Bakteri Asam Laktat Menggunakan Karakteristik
Organoleptik dan Kemampuan Mempertahankan Aroma 9 Penapisan Bakteri Asam Laktat Berdasarkan Kemampuan Menghasilkan
Antimikrob 11
Fase Turbidimetrik Bakteri Asam Laktat Terpilih 13 Uji Organoleptik Susu Fermentasi Jagung Menggunakan
Inokulum Bakteri Asam Laktat Terpilih 13 Karakterisasi Senyawa Antimikrob Lactobacillus JMB 6 14 Identifikasi dan Filogenetik Bakteri Asam Laktat Berdasarkan 16S rRNA 14
4 PEMBAHASAN 145
5 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 23
DAFTAR TABEL
1 Jumlah isolat bakteri dan khamir hasil isolasi dari susu jagung
fermentasi secara spontan 7
2 Karakteristik morfologi BAL hasil isolasi 8
3 Hasil mutu organoleptik susu fermentasi jagung berdasarkan
karakteristik warna, kekentalan dan aroma 10
4 Aktivitas antimikrob isolat pada S.aureus dan E.coli melalui uji
antagonisme 12
5 Indeks penghambatan supernatan kultur BAL terhadap bakteri
Staphylococcus aureus 13
6 Nilai rataan uji mutu penerimaan konsumen terhadap aroma susu jagung fermentasi setelah masa simpan 5-6 hari 15 7 Hasil BLAST-N gen sequen 16 S rRNA dari isolat JMB 4 18
DAFTAR GAMBAR
1 Rata-rata mutu organoleptik berdasarkan karakteristik aroma setelah
penyimpanan 6 bulan pada suhu 4oC. 10
2 Kurva turbiditas pertumbuhan BAL terpilih 13
3 Kurva pertumbuhan isolat JMB 6 15
4 Pengujian antimikrob supernatan pH 4 (A), PH 6 (B) penambahan
enzim protease (C) 16
5 Hasil amplifikasi gen 16s RNA isolat JMB 4 16
6 Pohon filogenetik isolat JMB 4 menggunakan piranti lunak MEGA 5.0 17
DAFTAR LAMPIRAN
1 Rata-rata mutu organoleptik berdasarkan karakteristik aroma setelah
penyimpanan 6 bulan pada suhu 4oC 22
2 Rata-rata mutu organoleptik hasil inokulasi BAL susu jagung fermentasi berdasarkan karakteristik organoleptik (warna, kekentalan
dan aroma) 23
3 Standar error (SE) rata-rata diameter zona hambat isolat 24
1
PENDAHULUAN
Latar Belakang
Keanekaragaman sumber daya alam hayati Indonesia berupa hasil pertanian dapat digunakan sebagai sumber pangan, salah satunya ialah jagung. Susu jagung merupakan salah satu diversifikasi produk olahan jagung yang dijumpai di masyarakat sebagai sumber nutrisi pilihan selain makanan pokok. Susu jagung masih diproduksi secara tradisional di Sulawesi Selatan sehingga daya tahan produk masih rendah yang berdampak pada rendahnya keberadaan produk tersebut di pasaran. Susu jagung memiliki nutrisi yang baik bagi tubuh, karena memiliki kandungan vitamin yang tinggi (Supavititpatana et al. 2008).
Susu jagung adalah produk olahan jagung yang juga dapat mengalami kerusakan yang diakibatkan kontaminasi mikroba perusak makanan. Kandungan nutrisi pada pangan menjadi tempat berkembang biak bagi mikroorganisme. Menurut Jos dan Veld (1996) pembusukan makanan dapat disebabkan oleh berbagai reaksi yang dipengaruhi faktor fisik, kimia, dan enzim yang dihasilkan mikroorganisme akibat kontaminasi selama proses produksi (manufacturing). Untuk mengatasi hal tersebut, maka diperlukan suatu bahan pengawet yang berfungsi untuk menghindari kerusakan akibat mikroorganisme sehingga tidak menimbulkan bahaya bagi kesehatan konsumen. Preservasi merupakan cara untuk mengawetkan produk pangan hewani maupun nabati sehingga terhindar dari pembusukan akibat cemaran oleh mikrob (Suardana et al. 2007).
Cara yang digunakan untuk menghindari kontaminasi yaitu penggunaan bahan kimia sebagai bahan pengawet. Pemanfaatan bahan kimia selain menyebabkan masalah kesehatan ketika dikonsumsi dalam jangka panjang juga dapat menyebabkan perubahan warna dan bau pada makanan. Bahan yang kini dikembangkan untuk preservasi yaitu bakteriosin. Bakteriosin digunakan karena merupakan bahan pengawet alami yang aman, berasal dari mikroorganisme yaitu bakteri asam laktat (BAL).
Bakteriosin merupakan zat antimikrob yang dihasilkan oleh BAL dan bekerja menghambat bakteri lain termasuk bakteri patogen (Razak et al. 2009). Bakteri asam laktat yaitu Lactobacillus sp. telah umum digunakan sebagai biopreservasi pada bahan pangan karena tidak adanya residu yang dapat menimbulkan efek negatif. Lactobacillus sp. merupakan salah satu bakteri pada bahan pangan dengan hampir 140 spesies yang sebagian besar digunakan pada industri makanan. Bakteri ini merupakan flora alami dari berbagai produk makanan seperti susu mentah, produk susu fermentasi, buah-buahan, sayuran, dan produk daging. Lactobacillus sp. juga berfungsi sebagai starter untuk sejumlah produk makanan fermentasi baik untuk meningkatkan kualitas ataupun untuk manfaat kesehatan (Singh et al. 2009).
Trias et al. (2008) telah berhasil mengisolasi BAL yang terdapat pada buah apel segar dan memiliki potensi daya hambat terhadap bakteri perusak bahan pangan. Kemampuan penghambatan tersebut disebabkan kemampuan BAL menghasilkan asam organik atau bakteriosin yang memiliki aktivitas antimikrob. Selain itu Sankar et al. (2012) berhasil mengkarakterisasi bakteriosin dari isolat
2
mikroorganisme patogen pada bahan pangan dan juga memiliki kemampuan probiotik untuk kesehatan konsumen.
Berdasarkan latar belakang tersebut, maka perlu dilakukan seleksi yaitu mencari beberapa isolat baru dengan aktivitas antimikrob yang lebih baik. Usaha ini diharapkan menjadi alternatif biopreservasi pada susu jagung yang memanfaatkan sumber isolat dari jagung. Penelitian ini bertujuan untuk mengidentifikasi isolat bakteri asam laktat penghasil bakteriosin dari fermentasi jagung sebagai biopreservasi pada susu jagung fermentasi.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi isolat BAL penghasil antimikrob dari fermentasi jagung yang dapat memberi produk terbaik pada susu jagung fermentasi.
Manfaat Penelitian
Isolat bakteri asam laktat penghasil antimikrob dari fermentasi jagung yang berhasil diisolasi dapat dimanfaatkan sebagai biopreservasi pada susu jagung fermentasi.
2
METODE
Bahan
Bahan yang akan digunakan ialah jagung Sweetcorn (Zea mays saccharata) E.coli dan S. aureus sebagai bakteri indikator antimikrob yang merupakan koleksi Laboratorium Mikrobiologi, FMIPA IPB.
Alat
Alat yang digunakan antara lain: blender, swab steril, cawan Petri, tabung reaksi dan penutup, rak tabung, pipet, gelas piala, bunsen, erlenmeyer, gelas ukur,
tube shaker, batang ose, pinset steril, timbangan, inkubator, sentrifuge, autoklaf,
spreader glass, stearer, pH meter, refrigerator, mikroskop, coloni counter, serta alat-alat pendukung lainnya.
Prosedur Kerja
3 supernatan bakteriosin, dibandingkan dengan organoleptik susu fermentasi jagung yang diinokulasi oleh isolat terbaik (5) isolasi DNA, amplifikasi DNA,
Blast-N dan pembuatan pohon filogenetik BAL. Fermentasi Spontan
Jagung sweetcorn dipipil dari tongkolnya dicuci dan dibersihkan dengan air mengalir. Biji jagung yang telah dibersihkan selanjutnya dimasukkan ke dalam tabung dan dihancurkan menggunakan batang pengaduk. Selanjutnya ditambahkan aquades steril dengan perbandingan 1:5. Setelah itu dilakukan fermentasi selama 24 jam. Proses isolasi BAL dilakukan dengan 3 perlakuan dan 2 ulangan. Perlakuan pertama yaitu tabung dibuka dan tidak dipanaskan (JMB), tabung ditutup dan tidak dipanaskan (JMT) serta tabung ditutup dan dipanaskan pada suhu 60oC selama 15 menit (JMA).
Isolasi dan Karakterisasi Bakteri Asam Laktat
Isolasi bakteri asam laktat (BAL) dilakukan dari fermentasi jagung secara spontan seperti yang dijelaskan sebelumnya. Sebanyak 100 gram sampel cairan fermentasi diambil, diencerkan dengan larutan NaCl fisiologis. Bakteri ditumbuhkan dalam media MRS (de Mann Rogosa Sharpe) agar, selanjutnya diinkubasi dengan suhu 37oC selama 2 hari. Koloni yang tumbuh diisolasi dan selanjutnya diseleksi. Koloni yang berbeda kemudian digores pada media untuk diuji pewarnaan Gram, endospora dan uji katalase. Lama inkubasi, morfologi bakteri dan koloni diamati. Karakterisasi isolat diidentifikasi taraf genus sesuai petunjuk Kandler dan Weiss (1995) dalam Bergey's Manual Systematic Bacteriology.
Penapisan Bakteri Asam Laktat Menggunakan Karakteristik Organoleptik dan Kemampuan Mempertahankan Aroma
Sampel penelitian adalah susu jagung, diperoleh dari proses ekstraksi biji jagung yang dipanaskan dengan suhu 600C selama 15 menit. Susu jagung kemudian di sterilisasi. Setelah susu jagung dingin, BAL hasil isolasi, diinokulasikan pada tabung-tabung yang berisi susu jagung steril. Susu jagung diinkubasi selama 48 jam dan diamati karakteristik organoleptik (warna, aroma, kekentalan) dan selanjutnya disimpan pada suhu 40C selama 6 bulan.
Pengujian organoleptik dilakukan di Laboratorium Mikrobiologi, panelis yang dipilih yaitu panelis semi terlatih (semi-trained panel) yaitu mahasiswa di Laboratorium Mikrobiologi. Uji organoleptik setelah fermentasi 48 jam menggunakan panelis perseorangan. Penilaian organoleptik dilakukan dengan menggunakan uji mutu hedonik. Data penilaian uji mutu hedonik dapat ditransformasi dalam skala numerik dan selanjutnya dirata-ratakan untuk interpretasinya.
4
terjemahan nilai mutu karakteristik warna hasil fermentasi jagung menggunakan isolat terpilih yaitu: sangat kuning (7), kuning (6), agak kuning (5), kuning memudar (4), kuning pucat (3), kuning agak keputih-putihan (2), bening (1) . Berdasarkan karakteristik kekentalan dengan skor 7-1 : amat sangat kental (7), sangat kental (6), kental (5), agak kental (4), agak tidak kental (3), tidak kental (2), encer (1). Berdasarkan karakteristik aroma : khas yoghurt (7), agak khas yoghurt (6), khas jagung (5), asam (4), agak asam (3), sangat asarn (2), alkohol (1).
Kemampuan BAL mempertahankan aroma selama penyimpanan yang berhubungan dengan perubahan yang dipengaruhi oleh BAL. Pengujian organoleptik setelah 6 bulan penyimpanan menggunakan panelis terbatas (3-5 orang) (Setyaningsih et al. 2010). Karakteristik organoleptik bakteri hasil isolasi dengan batasan: warna 1 hingga 7, besar skala uji untuk setiap sifat organoleptik pada perlakuan aplikasi BAL yaitu rentang 1 hingga 7. Terjemahan nilai mutu hedonik tersebut yaitu; 1 (sangat tidak suka), 2 (tidak suka), 3 (agak tidak suka), 4 (agak suka), 5 (suka), 6 (sangat suka) dan 7 (amat sangat suka).
Penilaian organoleptik menggunakan uji mutu organoleptik, untuk menentukan tingkat kesukaan panelis terhadap hasil fermentasi. BAL yang terpilih adalah BAL yang secara karakteristik organoleptik yang unggul dan juga mampu mempertahankan aroma setelah penyimpanan 6 bulan pada suhu 4oC.
Penapisan Bakteri Asam Laktat Berdasarkan Kemampuan Menghasilkan Antimikrob
Metode Antagonis Langsung
Metode yang digunakan ialah antagonisme langsung dengan stab inokulasi menggunakan galur indikator (Usmiati dan Marwati 2009). Galur indikator yang digunakan yaitu Staphylococcus aureus dan Escherichia coli. Uji ini dilakukan pada media semipadat dengan metode agar-agar tuang. Sebelum media dituang, bakteri indikator dicampurkan pada media semipadat kondisi suam kuku (40oC). Setelah dituang bakteri uji diambil dan ditimpakan pada permukaan media agar-agar yang telah mulai memadat. Setelah itu di atas koloni bakteri yang akan diuji disentuhkan jarum ose, selanjutnya diletakkan diatas permukaan galur indikator yang telah dituang bersama media sebelumnya dengan sedikit masuk ke dalam media. Biakan diinkubasikan pada suhu 37oC selama 24 jam. Adanya senyawa antimikrob yang dihasilkan oleh bakteri ditandai dengan zona terang di sekitar isolat. Isolat yang menghasilkan zona hambatan terluas (diukur dalam satuan mm) dipakai sebagai bakteri penghasil substansi antimikrob pada uji selanjutnya (Suardana et al. 2007).
Produksi Bakteriosin
5 merupakan protein yang memiliki aktivitas paling tinggi terhadap bakteri indikator. Selanjutnya, supernatan netral diuji aktivitasnya dengan metode sumur agar-agar.
Metode Difusi Sumur Agar-Agar
Inokulum bakteri indikator (bakteri uji) masing-masing dimasukkan ke dalam medium agar-agar lunak yaitu media natrium (NA) cair. Media sebanyak 240 ml yang mengandung agar-agar 1.2% dituang secara aseptis ke dalam cawan Petri dan dibiarkan membeku, kemudian dituang ke cawan Petri. Sumur-sumur dibuat untuk pengujian pada media yang memadat. Supernatan antimikrob dimasukkan ke dalam sumur sebanyak 40 μl, lalu diinkubasikan pada suhu kamar selama 24 jam. Zona hambatan yang terbentuk diukur.
Kurva Pertumbuhan BAL Terpilih
Sebanyak 0.1 ml dari kultur cair dan kultur agar-agar miring segar ditanam dalam MRS cair dan diinkubasi pada suhu ruang. Pertumbuhan bakteri diikuti setiap 3 jam dengan mengamati nilai kerapatan optik atau optical density (OD) dari starter pada media MRS dengan metode turbidimetrik dengan panjang gelombang 600 nm. Tahap ini bertujuan untuk mengetahui kurva pertumbuhan dan fase pertumbuhan bakteri terbaik hasil uji antagonis langsung. Kurva pertumbuhan bakteri dilakukan sampai mencapai fase kematian. Hal ini dimaksudkan untuk mengetahui fase-fase kehidupan bakteri yang berguna untuk menentukan waktu generasi bakteri, khususnya fase eksponensial yang erat hubungannya dengan sekresi substansi antimikrob.
Kultur bakteri diambil untuk mengetahui jumlah BAL pada kerapatan optik yang akan diukur. Kerapatan optik diukur selanjutnya diencerkan 1:1, 1:2, 1:4, 1:8, 1:16. Kultur cair di ambil sebanyak 1 ml dan diencerkan sampai pengenceran 10-8, selanjutnya disebar pada media MRS agar-agar. Bakteri hasil
plating digunakan sebagai dasar penentuan kurva standar.
Fermentasi Susu Jagung Menggunakan Isolat Terpilih dan Uji Organoleptik
Sampel penelitian adalah susu jagung, diperoleh dari proses ekstraksi biji jagung yang dipanaskan dengan suhu 600C selama 15 menit. Susu jagung kemudian di sterilisasi. Uji organoleptik dengan 2 perlakuan yaitu: penambahan supernatan (bakteriosin ekstrak kasar) bakteri dan susu jagung fermentasi yang diinokulasikan bakteri terpilih. Kedua perlakuan tersebut akan dibandingkan dengan susu jagung tanpa inokulan sebagai pembanding.
Pengujian organoleptik dilakukan di Laboratorium Mikrobiologi. Panelis yang dipilih yaitu panelis semi terlatih (semi-trained panel) yaitu mahasiswa di Laboratorium Mikrobiologi. Sebelum melakukan penilaian, panelis diberi penjelasan secukupnya mengenai uji organoleptik yang dilakukan. Panelis yang digunakan yaitu sebanyak 15 – 25 orang.
Penilaian organoleptik dilakukan dengan menggunakan uji mutu hedonik. Pada uji mutu hedonik data penilaian dapat ditransformasi dalam skala numerik dan selanjutnya dapat dianalisis statistik untuk interpretasinya (Setyaningsih et al.
6
yaitu rentang 1-7. Penilaian organoleptik ditujukan untuk menilai perubahan aroma selama penyimpanan yang berhubungan dengan sifat biopreservasi yang dipengaruhi oleh BAL.
Analisis Data
Untuk kualitas organoleptik, data yang diperoleh diuji dengan uji non-parametrik Friedman’s test (Setyaningsih et al. 2010) dan apabila berpengaruh nyata dilanjutkan dengan uji LSD untuk melihat perbedaan antar perlakuan.
Identifikasi dan Filogenetik Bakteri Asam Laktat Berdasarkan 16S rRNA
Isolasi DNA
Isolasi DNA bakteri dilakukan sesuai protokol stanadar Xprerp soil DNA Mini Kit (PhileKorea Technology). Kultur sel diambil menggunakan ose dan dimasukkan ke dalam tabung mikro steril, dan disentrifugasi pada kecepatan 10000 rpm selama 1 menit. Pelet sel isolat bakteri dicuci sebanyak tiga kali dengan cara 200 μL bufer Tris-EDTA (TE) dituang kedalam tabung mikro, disuspensi dan disentrifugasi dengan kecepatan 10000 rpm selama 5 menit. Sebanyak 250 µL XPSDE buffer 1, 20 µL proteinase-K (2mg/ml), dan 2 mg glass beads ditambahkan ke pelet sel, lalu diinkubasi pada suhu 70oC selama 10 menit. Sampel ditambahkan 100 µL XPSDE buffer 2 dan diinkubasi pada es selama 5 menit, setalah itu sampel disentrifugasi dengan kecepatan 10000 rpm. Supernatan selanjutnya dipindahkan pada ke tabung mikro baru dan ditambahkan 200 µL XPSDE buffer 3 selanjutnya di inkubasi pada suhu ruang selama 2 menit. Supernatan selanjutnya dipindahkan ke tabung mikro baru dan ditambahkan 250 µL XPSDE buffer 4 dan ethanol 100% kedalam supernatan. Setelah dihomogenkan, sampel dipindahkan ketabung mikro kolom dan di sentrifugasi, kemudian ditambahkan 750 µL buffer elusi di sentrifugasi lagi. Selanjutnya tabung mikro kolom dipindahkan ketabung mikro yang baru dan ditambahkan 50 µL buffer elusi dan disentrifugasi. DNA genom hasil isolasi selanjutnya dapat digunakan untuk amplifikasi gen 16S RNA. Hasil isolasi diperiksa dengan dimigrasi pada gel agarosa 1% dengan kondisi voltase 75V selama 30 menit. Amplifikasi Gen 16S rRNA dengan PCR
Komponen reaksi PCR pada proses amplifikasi gen 16S rDNA untuk 25 µL volume total terdiri atas 3 µL DNA bakteri, 0,1 µl ex taq DNA polimerase, primer forward 20F (5’-AGAGTTTGATCATGGCTCAG-3’), primer reverse 1541R (5’-GGTTACCTTGTTACGACTT-3’). masing-masing primer sebanyak 1,25 µL, 0,5 µL dNTP, bufer PCR sebanyak 5 µL, 0,5 µL MgCl2, dan 13,4 µL akuabides steril (ddH2O). Proses PCR terdiri atas pre-denaturasi pada suhu 95ºC selama 2 menit, kemudian denaturasi 95ºC selama 30 detik, annealing primer 55ºC selama 45 detik, extension primer 72ºC selama 1 menit, dan final extension
7 atas paparan sinar UV untuk memastikan fragmen DNA yang diamplifikasi pada ukuran pasang basa yang tepat (~1500 pb) (Sambrook et al. 1989).
Sekuensing Gen 16S rRNA, Analisis Bioinformatika dan Konstruksi Pohon Filogenetik
Total produk akhir hasil purifikasi PCR sebanyak 10 µL, dan selanjutnya disekuensing sesuai dengan protokol standar DNA sekuenser (ABI PRISM 3100) di Laboratorium 1st Base Singapura. Hasil sekuen nukleotida dibandingkan dengan GenBank database melalui NCBI Blast (http://www.ncbi.nlm.nih.gov.). Untuk analisis filogenetik atau kekerabatan antar isolat bakteri asam laktat berdasarkan neighbor-joining method, dan menggunakan program Bioedit versi 7.0.4.01 dan Clustal_X.
3
HASIL
Isolasi dan Karakterisasi Bakteri Asam Laktat dari Susu Jagung Fermentasi
Hasil isolasi dari fermentasi jagung diperoleh 33 isolat bakteri yang mampu tumbuh pada media agar-agar MRS. Perlakuan pertama diperoleh BAL sebanyak 22 isolat, JMT sebanyak 7 isolat dan JMA sebanyak 4 isolat (Tabel 1). Karakteristik Gram berdasarkan pengamatan mikroskopis diketahui terdapat khamir pada JMB sebanyak 7 isolat dan JMT sebanyak 4 isolat, pada perlakukan ketiga (JMA) tidak ditemukan isolat khamir. Terdapat bakteri Gram negatif pada JMB, JMT dan JMA masing-masing 3, 1 dan 1 isolat. Gram positif yang merupakan tujuan dari penelitian ini diperoleh pada JMB, JMT dan JMA masing-masing 12 , 2 dan 3 isolat (Tabel 1).
Tabel 1 Jumlah isolat bakteri dan khamir hasil isolasi dari susu jagung fermentasi secara spontan
No Perlakuan Isolasi
Jumlah bakteri Gram
Khamir Total Gram + Gram -
JMB 12 3 7 22
JMT 2 1 4 7
JMA 3 1 0 4
17 5 11 33
Keterangan: JMB; Tabung dibuka dan tidak dipanaskan JMT; Tabung ditutup dan tidak dipanaskan, JMA; Tabung ditutup dan dipanaskan
8
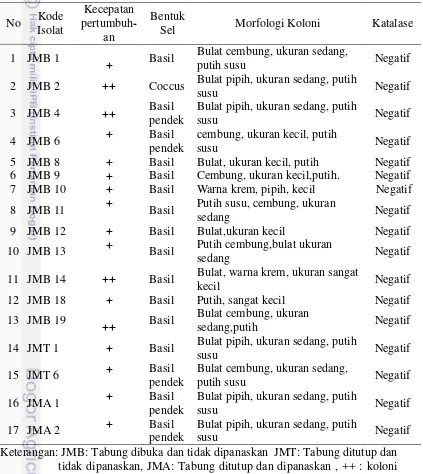
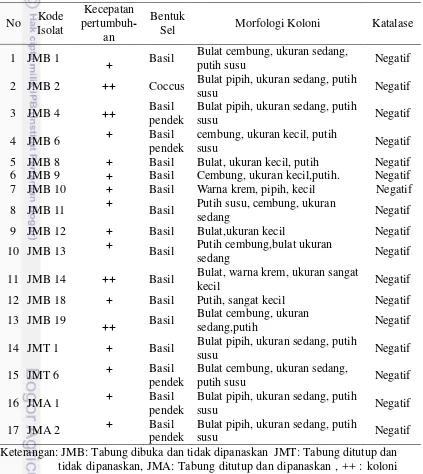
Terdapat 17 bakteri Gram positif merupakan BAL yang karakteristiknya diamati berdasarkan kecepatan pertumbuhan, bentuk sel, morfologi koloni, dan kemampuan menghasilkan enzim katalase (Tabel 2). Bakteri dapat tumbuh setelah masa inkubasi 24 jam dan 48 jam. Morfologi sel secara umum yaitu basil, kokus, dan batang pendek. Morfologi koloni secara umum yaitu bulat, cembung, warna putih susu. Perbedaan ukuran koloni berbeda signifikan ada yang koloninya besar, sedang dan sangat kecil. Sebanyak 17 bakteri bersifat katalase negatif.
Tabel 2 Karakteristik morfologi BAL hasil isolasi No Kode
Isolat
Kecepatan
pertumbuh-an
Bentuk
Sel Morfologi Koloni Katalase
1 JMB 1
+ Basil
Bulat cembung, ukuran sedang,
putih susu Negatif
2 JMB 2 ++ Coccus Bulat pipih, ukuran sedang, putih
susu Negatif
3 JMB 4 ++ Basil
pendek
Bulat pipih, ukuran sedang, putih
susu Negatif
4 JMB 6 + Basil
pendek
cembung, ukuran kecil, putih
susu Negatif
5 JMB 8 + Basil Bulat, ukuran kecil, putih Negatif 6 JMB 9 + Basil Cembung, ukuran kecil,putih. Negatif 7 JMB 10 + Basil Warna krem, pipih, kecil Negatif 8 JMB 11 + Basil Putih susu, cembung, ukuran
sedang Negatif
9 JMB 12 + Basil Bulat,ukuran kecil Negatif
10 JMB 13 + Basil Putih cembung,bulat ukuran
sedang Negatif
11 JMB 14 ++ Basil Bulat, warna krem, ukuran sangat
kecil Negatif
12 JMB 18 + Basil Putih, sangat kecil Negatif
13 JMB 19
++ Basil
Bulat cembung, ukuran
sedang,putih Negatif
14 JMT 1 + Basil Bulat pipih, ukuran sedang, putih
susu Negatif
15 JMT 6 + Basil
pendek
Bulat cembung, ukuran sedang,
putih susu Negatif
16 JMA 1 + Basil
pendek
Bulat pipih, ukuran sedang, putih
susu Negatif
17 JMA 2 + Basil
pendek
Bulat pipih, ukuran sedang, putih
susu Negatif
Keterangan: JMB: Tabung dibuka dan tidak dipanaskan JMT: Tabung ditutup dan tidak dipanaskan, JMA: Tabung ditutup dan dipanaskan , ++ : koloni tumbuh pada jam ke 24, + : Koloni tumbuh pada jam ke-48.
9 kategori Lactobacillus spp. Bakteri hasil isolasi yang merupakan Gram positif, bentuk selnya basil dan bersifat katalase negatif merupakan genus Streptococcus
spp. Hasil isolasi diperoleh 16 genus Lactobacillus spp. dan 1 genus
Streptococcus spp. pada Tabel diberi kode JMB 2.
Penapisan Bakteri Asam Laktat Menggunakan Karakteristik Organoleptik dan Kemampuan Mempertahankan Aroma
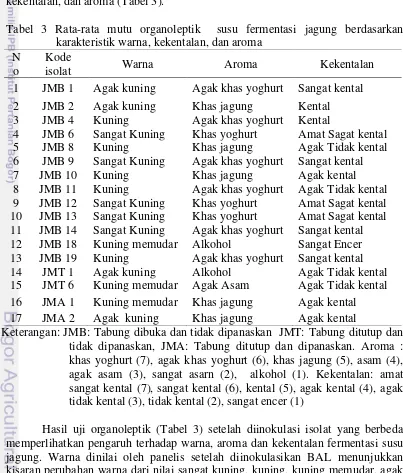
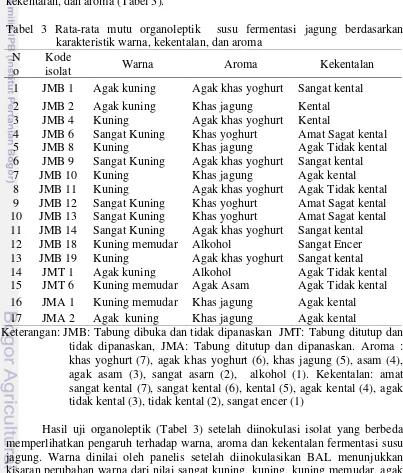
Kemampuan bakteri dalam mempengaruhi sifat organoleptik sangat penting dalam pengembangan suatu produk karena hal ini menentukan penerimaan konsumen terhadap susu jagung fermentasi. Penilaian konsumen terhadap kesukaan suatu produk ditentukan oleh warna, kekentalan, dan aroma. Uji organoleptik susu jagung fermentasi pada penelitian ini meliputi uji warna, kekentalan, dan aroma (Tabel 3).
Tabel 3 Rata-rata mutu organoleptik susu fermentasi jagung berdasarkan karakteristik warna, kekentalan, dan aroma
Keterangan: JMB: Tabung dibuka dan tidak dipanaskan JMT: Tabung ditutup dan tidak dipanaskan, JMA: Tabung ditutup dan dipanaskan. Aroma : khas yoghurt (7), agak khas yoghurt (6), khas jagung (5), asam (4), agak asam (3), sangat asarn (2), alkohol (1). Kekentalan: amat sangat kental (7), sangat kental (6), kental (5), agak kental (4), agak tidak kental (3), tidak kental (2), sangat encer (1)
Hasil uji organoleptik (Tabel 3) setelah diinokulasi isolat yang berbeda memperlihatkan pengaruh terhadap warna, aroma dan kekentalan fermentasi susu jagung. Warna dinilai oleh panelis setelah diinokulasikan BAL menunjukkan kisaran perubahan warna dari nilai sangat kuning, kuning, kuning memudar, agak
N o
Kode
isolat Warna Aroma Kekentalan
1 JMB 1 Agak kuning Agak khas yoghurt Sangat kental 2 JMB 2 Agak kuning Khas jagung Kental 3 JMB 4 Kuning Agak khas yoghurt Kental
4 JMB 6 Sangat Kuning Khas yoghurt Amat Sagat kental
5 JMB 8 Kuning Khas jagung Agak Tidak kental
6 JMB 9 Sangat Kuning Agak khas yoghurt Sangat kental
7 JMB 10 Kuning Khas jagung Agak kental
10
kuning masing-masing mempengaruhi 5 isolat, 5 isolat, 3 isolat, 4 isolat secara berurutan. Penilaian panelis terhadap aroma susu jagung menunjukkan khas yoghurt, agak khas yoghurt, khas jagung, agak asam dan aroma alkohol masing- masing mempengaruhi 3 isolat, 6 isolat, 5 isolat, 1 isolat, 2 isolat secara berurutan. Kekentalan: amat sangat kental, sangat kental, kental, agak kental, agak tidak kental, encer masing-masing dipengaruhi 3 isolat, 4 isolat, 2 isolat, 3 isolat, 4 isolat, 1 isolat secara berurutan.
Bakteri yang dapat memberi karakteristik yang baik dari segi warna, aroma dan kekentalan akan di seleksi berdasarkan rata-rata hasil organoleptik (Lampiran 2). Penilaian panelis berdasarkan rata-rata karakteristik organoleptik susu jagung fermentasi diperoleh 8 isolat bakteri rata–rata tertinggi yaitu
Lactobacillus JMB 1, Lactobacillus JMB 4, Lactobacillus JMB 6, Lactobacillus
JMB 9, Lactobacillus JMB 12, Lactobacillus JMB 13, Lactobacillus JMB 14,
Lactobacillus JMB 19 (Lampiran 2) yang selanjutnya akan diseleksi berdasarkan kemampuan mempertahankan aroma setelah penyimpanan.
Untuk mendapatkan bakteri yang dapat mempertahankan aroma sampai waktu yang cukup lama, maka selanjutnya dilakukan penapisan BAL yang dapat memberi aroma terbaik pada masa simpan 6 bulan (Gambar 1).
Gambar 1 Rata-rata mutu organoleptik berdasarkan karakteristik aroma setelah penyimpanan 6 bulan pada suhu 4oC. 1 (sangat tidak suka), 2 (tidak suka), 3 (agak tidak suka), 4 (agak suka), 5 (suka), 6 (sangat suka) dan 7 (amat sangat suka).
Berdasarkan penilaian panelis, susu jagung fermentasi pada taraf suka dengan nilai 5 diperoleh 2 isolat bakteri yang dapat mempertahankan aroma setelah penyimpanan 6 bulan pada suhu 40C yaitu Lactobacillus JMB 4,
11 Penapisan Bakteri Asam Laktat Berdasarkan Kemampuan Menghasilkan
Antimikrob
Metode Antagonis Langsung Menggunakan Bakteri Patogen S.aureus dan E.coli
Aktivitas penghambatan BAL menggunakan bakteri uji S.aureus dan
E.coli (Tabel 4). Berdasarkan hasil uji terdapat 13 isolat yang memiliki kemampuan aktivitas antimikrob terhadap S. aureus.
Tabel 4 Aktivitas antimikrob isolat pada S.aureus dan E.coli melalui uji antagonism
No Kode Isolat Aktivitas Antimikrob
S.aureus E.coli
1 Lactobacillus JMB 1 + - 2 Streptococcus JMB 2 ++ - 3 Lactobacillus JMB 4 - - 4 Lactobacillus JMB 6 ++ - 5 Lactobacillus JMB 8 + - 6 Lactobacillus JMB 9 +++ - 7 Lactobacillus JMB 10 + - 8 Lactobacillus JMB 11 ++ - 9 Lactobacillus JMB 12 - - 10 Lactobacillus JMB 13 +++ - 11 Lactobacillus JMB 14 +++ - 12 Lactobacillus JMB 18 + - 13 Lactobacillus JMB 19 ++ - 14 Lactobacillus JMT 1 + - 15 Lactobacillus JMT 6 +++ - 16 Lactobacillus JMA 1 - - 17 Lactobacillus JMA 2 - -
Keterangan : - = tidak memiliki daya hambat, + =0.5 mm-0.6mm, ++=0.7- 0.8mm, +++ = 0.9 - 1.0 mm.
Aktivitas antimikrob terbesar yaitu 0,9-1,0 mm dihasilkan oleh isolat
Lactobacillus JMB 9, Lactobacillus JMB 13, Lactobacillus JMB 14 dan
Lactobacillus JMT 6 secara berturut-turut. Aktivitas antimikrob pada kisaran 0.7-0.8 mm yaitu Lactobacillus JMB 2, Lactobacillus JMB 6, Lactobacillus JMB 11,
Lactobacillus JMB 16, Lactobacillus JMB 19. Bakteri menghambat pada
Sthapylococcus aureus tetapi tidak menghambat bakteri uji E. coli. Penapisan BAL Penghasil Bakteriosin Menggunakan Metode Sumur
12
Tabel 5 Indeks penghambatan (IP) supernatan kultur BAL umur 24 jam terhadap bakteri Staphylococcus aureus
No Kode isolat
Rata-rata index penghambatan (IP) supernatan
IP±SE
pH 4 pH 6
1 Lactobacillus JMB 1 1,55 ±1,5 - 2 Streptococcus JMB 2 1,25±1,5 - 3 Lactobacillus JMB 6 1,70±5 0,5±0,5 4 Lactobacillus JMB 9 2,70±0 - 5 Lactobacillus JMB 10 1,30±0,5 - 6 Lactobacillus JMB 11 1,05±9 - 7 Lactobacillus JMB 13 2,50±1 - 8 Lactobacillus JMB 14 1,40±0,5 - 10 Lactobacillus JMB 18 0,95±0,5 - 11 Lactobacillus JMB 19 1,10±0 - 12 Lactobacillus JMT1 - - 13 Lactobacillus JMT6 1,80±5 -
Keterangan: IP: index penghambatan, SE: standar error, (-): tidak memiliki daya hambat terhadap bakteri uji.
Pada pH 6 hanya diperoleh 1 isolat yang menghasilkan luas penghambatan 0.5 (Tabel 5). Berdasarkan hasil penapisan BAL tersebut diperoleh 1 bakteri yang diduga menghasilkan bakteriosin yaitu Lactobacillus JMB 6 .
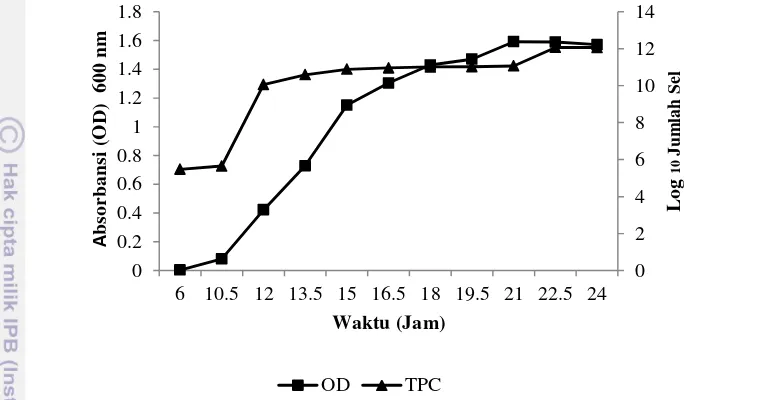
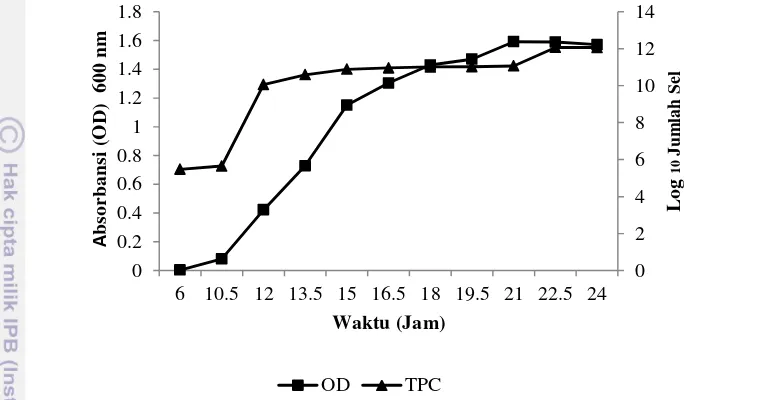
Fase Turbidimetrik Bakteri Asam Laktat
Kurva pertumbuhan ini dimaksudkan untuk mengetahui fase serta jumlah sel pada nilai OD tertentu. Hal ini dimaksudkan untuk mengetahui jumlah sel yang diinokulasikan pada saat pengujian. Fase eksponensial dimulai pada OD 0.8 dengan jumlah sel ± 1 x 1010 sel/ml pada masa inkubasi 12 jam. Hal ini akan menjadi pedoman dalam inokulasi dan produksi bakteriosin BAL pada pengujian selanjutnya.
Fase pertumbuhan dapat menjadi gambaran dalam sintesis senyawa yang dihasilkan misalnya bakteriosin yang merupakan substansi antibakteri yang disintesis langsung di ribosom selama pertumbuhan bakteri asam laktat (pada fase eksponensial), sehingga bakteriosin disebut sebagai metabolit primer. Sedangkan fase stasioner dihasilkan metabolit sekunder. Fase pertumbuhan bakteri asam laktat (BAL) terdiri atas fase lag, fase eksponensial, fase stasioner dan fase kematian.
13
bakteri karena jumlah sel yang tumbuh sama dengan jumlah sel yang mati, hal ini terjadi dari jam 12 sampai jam ke 21 (Gambar 2), pada fase ini senyawa metabolit sekunder di produksi, misalnya senyawa asam laktat yang merupakan hasil metabolit sekunder bakteri asam laktat.
Gambar 2 Kurva pertumbuhan isolat JMB 6
Fase terakhir adalah fase kematian, fase kematian pada pertumbuhan bakteri terjadi mulai jam ke-22 terjadi penurunan jumlah sel bakteri karena nutrisi dalam media mulai habis (Lampiran 5). Bakteri umumnya memproduksi metabolit sekunder yang disintesis selama fase stasioner pada masa pertumbuhan bakteri.
Uji Organoleptik Susu Fermentasi Jagung Menggunakan Inokulum Bakteri Asam Laktat (BAL) Terpilih
Berdasarkan penapisan antimikrob BAL yang terpilih merupakan bakteri dengan yang mampu menghasilkan zona bening pada pH 6. Kandidat BAL yaitu
Lactobacillus JMB 6. Bakteri terpilih diinokulasi pada susu jagung, susu jagung yang ditambahankan bakteriosin serta susu jagung tanpa perlakuan akan dibandingkan dalam kemampuan bakteri mempertahankan aroma.
Tabel 6 Nilai rataan uji mutu penerimaan konsumen terhadap aroma susu jagung fermentasi setelah masa simpan 5-6 hari
No Perlakuan Rata-rata mutu aroma
1 Kontrol (Tanpa bakteri) 2.35 a
2 Kontrol (Bakteriosin) 4.7 b
5 Lactobacillus JMB6 4.9b
Keterangan: a,b,): Nilai dengan huruf superskrip di belakang angka yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata (p<0.05). Kesukaan : 1 (Sangat Tidak Suka), 2 (Tidak Suka), 3 (Agak Tidak Suka), 4 (Agak Suka), 5 (Suka), 6 (Sangat Suka), 7 (Amat Sangat Suka) 0 2 4 6 8 10 12 14 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8
6 10.5 12 13.5 15 16.5 18 19.5 21 22.5 24
14
Tingkat kesukaan panelis terhadap aroma susu jagung fermentasi (menggunakan inokulum) tidak mengalami perbedaan antara pembanding yang diberikan bakteriosin, tetapi berbeda nyata dengan kontrol (tanpa inokulasi) (Tabel 6).
Karakterisasi Senyawa Antimikrob Lactobacillus JMB 6
Isolat Lactobacillus JMB 6 yang masih memiliki penghambatan pada pH 6 (Tabel 5) hal ini diduga berhubungan dengan kemampuan isolat tersebut menghasilkan bakteriosin.
Gambar 4 Pengujian antimikrob supernatan pH 4 (A), pH 6 (B) penambahan enzim protease (C)
Penapisan BAL dalam menghasilkan bakteriosin telah diuji dan diperoleh isolat Lactobacillus JMB 6 menghasilkan indikasi penghasil bakteriosin setelah penambahan protease pada supernatan.
Identifikasi dan Filogenetik Bakteri Asam Laktat Berdasarkan 16S rRNA
Hasil amplifikasi gen 16S RNA yang dielektroforesis pada gel agarosa 1% menunjukan amplikon berukuran sekitar 1500 pasang basa (Gambar 5).
Gambar 5 Hasil amplifikasi gen 16s RNA isolat JMB 6
pH 6 Protease
Supernatan
Zona hambat
B C
15 Berdasarkan hasil konstruksi menggunakan neighbor joining method
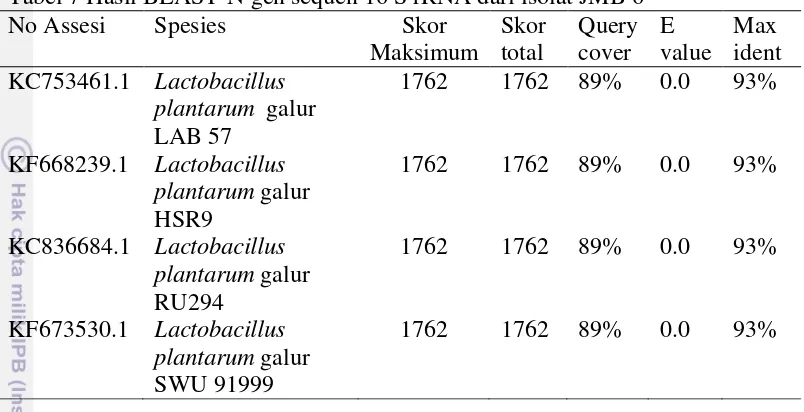
(bootstrap1000x) menunjukan hasil konstruksi pohon filogenetik sampel JMB 6. Tabel 7 Hasil BLAST-N gen sequen 16 S rRNA dari isolat JMB 6
No Assesi Spesies Skor
Maksimum Skor total
Query cover
E value
Max ident KC753461.1 Lactobacillus
plantarum galur LAB 57
1762 1762 89% 0.0 93%
KF668239.1 Lactobacillus plantarum galur HSR9
1762 1762 89% 0.0 93%
KC836684.1 Lactobacillus plantarum galur RU294
1762 1762 89% 0.0 93%
KF673530.1 Lactobacillus plantarum galur SWU 91999
1762 1762 89% 0.0 93%
Hasil BLAST-N sequen gen 16S rRNA menunjukan bahwa beberapa isolat yang memiliki kedekatan dengan nilai kemiripan sebesar 93% yaitu:
Lactobacillus plantarum galur LAB 57, Lactobacillus plantarum galur HSR9,
Lactobacillus plantarum galur RU294, Lactobacillus plantarum galur SWU 91999 (Tabel 7).
Gambar 6 Pohon filogenetik isolat JMB 6 menggunakan piranti lunak MEGA 5.0
Analisis sequencing 16S rRNA mengindikasikan bahwa galur JMB 6 termasuk dalam genus Lactobacillus seperti yang tampak pada gambar 6 dengan persen kesamaan sebesar 93%.
PEMBAHASAN
Penapisan BAL berdasarkan cirri-ciri morfologi dan biokimia diperoleh 17 isolat bakteri asam laktat (Table 2). Terdiri dari 16 genus Lactobacillus spp. dan 1 genus Streptococcus spp. Bakteri asam laktat merupakan Gram positif, katalase negative, dan bersifat fakultatif aerob, bentuk sel yaitu kokus dan batang yang merupakan karakteristik genus Lactobacillus (Sa´nchez et al. 2000). Morfologi koloni yaitu bulat, buram, memiliki warna putih susu dan ada yang warna krem (Ashe dan Paul 2010). Bakteri asam laktat bersifat katalase negatif, dapat tumbuh
Lactobacillus plantarum strain LAB57 Lactobacillus plantarum strain HS-R9 Lactobacillus plantarum strain RU29-4 Lactobacillus plantarum strain SWU91999 JMB 6
68
16
pada kondisi aerob dan anaerob walaupun secara umum lebih menyukai hidup pada kondisi anaerob, efek tekanan oksigen pada pertumbuhan bakteri asam laktat tidak mempengaruhi pertumbuhan bakteri pada media MRS agar-agar (Wen
et al. 2006).
Perbedaan sumber isolat akan mempengaruhi sumber keragaman genus BAL (Feutry et al. 2012). Hasil isolasi pada susu lebih beragam bila dibandingkan dengan hasil isolasi pada fermentasi jagung. Ashe dan Paul (2010) melaporkan bahwa pada limbah susu diperoleh distribusi isolat oleh genus Lactobacillus, Brevebacterium, Streptococcus, Leuconostoc dan Lactococcus. Hilmi dan Gokalp (2000) berhasil mengisolasi beberapa galur BAL pada sampel makanan fermentasi sucuk yaitu : Lactobacillus plantarum, L. curvatus, Pediococcus pentosaceus, L. pentosus, L. sake, L. delbrueckii, L. rhamnosus, Lactobacillus spp. P. pentosaceus , P. acidilactici, L. curvatus, L. plantarum dan Lactobacillus spp., BAL tersebut menghasilkan metabolit yang mirip dengan bakteriosin dan memiliki penghambatan pada beberapa bakteri patogen.
Penghambatan secara antagonis metode langsung memperlihatkan hasil yang beragam berdasarkan luas daya hambat. Hal ini juga sesuai dengan hasil penelitian Arokiyamary dan Sivakumar (2011) yang menguji supernatan bakteri asam laktat terhadap beberapa bakteri patogen, dari penelitian tersebut diketahui bahwa diameter tertinggi mencapai 15 mm penghambatan melawan
Staphylococcus aureus. Hasil penelitian Anas (2008) memperlihatkan hasil yang sama yaitu kemampuan penghambatan Lactobacillus sp memiliki daya hambat yang lebih luas terhadap Gram positif (Staphylococcus aureus) dibandingkan bakteri Gram negatif Bacillus sp. dan E. coli. Perbedaan komponen metabolit yang dihasilkan seperti asam laktat menyebabkan penurunan pH sehingga suasana menjadi asam yang dapat menghambat pertumbuhan bakteri patogen (Cizeikiene
et al. 2013).
Perbedaan daya hambat disebabkan oleh jenis BAL, dan kemampuan menghambat pada pH 6 berhubungan dengan kemampuan bakteriosin. Menurut Moll et al. (1999), mekanisme kerja bakteriosin dalam menghambat pertumbuhan bakteri uji diawali dengan penempelan molekul protein pada reseptor yang terdapat pada permukaan sel bakteri kemudian membentuk pori dan masuk melalui dinding sel dan menempel pada membran. Hal ini akan menyebabkan membran sitoplasma menjadi tidak stabil, akibatnya, viabilitas sel rendah dan menyebabkan keluarnya material yang terdapat dalam inti sel bakteri sehingga sel mati. Jack et al. (1995) selanjutnya menegaskan mekanisme pada bakteri Gram positif terjadi melalui mekanisme fungsi membran yang tidak stabil dan memiliki aktivitas antibakteri dengan spektrum yang relatif sempit. Pemanfaatan bakteriosin sejauh ini digunakan pada bahan pangan untuk meningkatkan daya tahan atau fungsi biopreservasi.
17 Produksi bakteriosin Pediocon PD-1 disintesis selama fase eksponensial dan dicapai produksi maksimum pada fase stasioner (Navaro et al. 2000). Ogunbanwo et al. (2003) menyatakan bahwa bakteriosin merupakan molekul protein sehingga molekulnya mudah terdegradasi dan aktifitasnya terhambat oleh enzim proteolitik dan kloroform, tetapi tidak dipengaruhi oleh enzim nonproteolitik, mitomycin C dan cahaya UV. Ahn dan Stiles (1990) melaporkan bahwa pada umumnya bakteriosin sensitif terhadap protease. perpanjangan waktu inkubasi setelah fase stationer menyebabkan aktivitas bakteriosin menurun karena terbebasnya protease dari sel pada saat sel memasuki fase kematian (Kusmiati dan Malik 2002). Selanjutnya, Gonzales et al. (1996) menegaskan bahwa karena substansi tersebut merupakan protein sehingga dapat terdegradasi pada pencernaan manusia dan hewan.
Bakteriosin telah diaplikasikan pada produk pangan tetapi ada faktor lain yang ikut berpengaruh karena fungsi preservasi secara efektif hanya pada saat kondisi optimum saja (Cleveland et al. 2001). Pada dasarnya terdapat pilihan dalam aplikasi bakteriosin pada pangan, pendekatan untuk biopreservasi pangan yaitu inokulasi pangan dengan BAL yang memproduksi bakteriosin, hal ini berhubungan dengan kemampuan BAL untuk tumbuh dan menghasilkan bakteriosin dalam produk dan pemurnian senyawa bakteriosin yang dimurnikan dari sel BAL (Schillinger et al. 1996).
Pada penelitian ini pemberian perlakuan dengan menggunakan bakteriosin ekstrak kasar tidak berbeda nyata dengan perlakuan inokulasi bakteri. Aplikasi pada susu jagung sebaiknya menggunakan isolat bakteri secara langsung. Berdasarkan laporan Saarela et al. (2000) syarat yang harus dimiliki BAL sebagai biopreservasi yaitu harus memiliki sifat yang baik sehingga dapat diproduksi dan dimasukkan ke dalam produk makanan tanpa kehilangan kelangsungan hidup dan fungsi, menciptakan rasa dan tekstur yang baik serta memperhatikan aspek fungsional yaitu viabilitas dan stabilitas genetik. Pithva et al. (2012) menegaskan bahwa syarat ideal preservasi pangan yang alami harus melalui beberapa kriteria yaitu toksisitas yang rendah, stabil selama proses dan penyimpanan pangan, efektivitas pada konsentrasi yang rendah, tidak digunakan di dunia medis dan tidak memiliki efek merusak makanan. Berdasarkan syarat tersebut proses aplikasi membutuhkan karakterisasi bakteriosin yang dihasilkan oleh BAL asal fermentasi jagung secara lebih lanjut.
18
Mikroorganisme pada makanan memiliki berbagai enzim yang dapat memecah komponen-komponen makanan menjadi bentuk yang sederhana yang dapat mengakibatkan perubahan sifat fisik makanan seperti warna, tekstur dan aroma (Fardiaz 1992). BAL selama fermentasi akan menghasilkan enzim yang akan memecah komponen-komponen makanan sehingga menyebabkan perubahan warna (Syah 2010). Telah dilaporkan bahwa BAL dapat memproduksi subtansi antimikrob, polimers gula, senyawa aromatik, vitamin dan enzim serta kemampuan probiotik (Ali 2010). BAL yang unggul yaitu yang dapat memberikan dan mempertahankan aroma setelah penyimpanan pada masa tertentu.
Berdasarkan identifikasi 16s RNA diketahui bahwa BAL JMB 6 memiliki kemiripan dengan Lactobacillus plantarum. Menurut Siezen and Vlieg (2011) L. plantarum memiliki genom yang cukup besar yang mengindikasikan kemampuannya beradaptasi dalam berbagai lingkungan serta kemampuannya yang dapat memfermentasi berbagai jenis karbohidrat, genom yang besar tersebut membuatnya mampu bertahan pada berbagai relung lingkungan yang beragam dan memiliki keragaman besar dalam sifat fenotip, kapasitas metabolisme dan aplikasi industri.
Lactobacillus plantarum adalah salah satu spesies terbesar dari genus
Lactobacillus jika dibandingkan dengan 90 spesies lainnya dari genus tersebut.
Lactobacillus plantarum adalah golongan bakteri asam laktat Gram positif yang umum digunakan pada proses fermentasi karena tidak patogen (Kandler and Weiss 1995). Lactobacillus plantarum ditemukan sebagian besar pada makanan fermentasi, juga ditemukan pada air liur dan saluran pencernaan. Pemanfaatan
Lactobacillus plantarum pada makanan menyebabkan bakteri tersebut sangat sesuai untuk dikembangkan sebagai probiotik (Maaike et al. 2006).
Lactobacillus plantarum terbagi dalam 3 grup yang berdasarkan fungsinya mampu melakukan fermentasi yaitu: (1) homofermentatif obligat yang dapat memfermentasi heksosa menjadi asam laktat tetapi tidak dapat memfermentasi glukonat atau pentosa (2) heterofermentatif fakultatif dapat memfermentasi heksosa menjadi asam laktat dan juga mampu memfermentasi pentosa dan glukonat (3) dan heterofermentatif obligate memfermentasi heksosa menjadi asam laktat, asam asetat, etanol dan karbon dioksida. L. plantarum adalah bakteri yang merupakan heterofermentatif fakultatif (Kandler and Weiss 1995). Selain itu L. plantarum memiliki manganese katalase yang berfungsi untuk melindungi sel bakteri terhadap toksisitas oksigen dengan mereduksi oksigen menjadi H2O2. H2O2 yang dihasilkan kemudian dapat dikonversi menjadi O2 dan air, hal ini berhubungan dengan kemampuan mempertahankan hidup pada kondisi terdapat oksigen dilingkungan, ketika oksigen tidak ada maka jalur metabolism yang digunakan yaitu fermentasi dan mengubah gula menjadi asam laktat atau alkohol ( heterofermentatif ) (Barynin et al. 2001).
L. plantarum memiliki toleransi yang tinggi pada pH rendah, berdasarkan beberapa kajian bahwa L. plantarum mendominasi dalam makanan fermentasi yang pH 4 atau yang lebih rendah, juga pada kondisi pH 1,5- 2 pada pencernaan manusia, hal ini menunjukkan resistensi yang tinggi terhadap kondisi asam (Haller et al. 2001). Hal tersebut merupakan karakteristik istimewa L. plantarum
19
4
SIMPULAN DAN SARAN
Simpulan
Sebanyak 17 bakteri asam laktat (BAL) berhasil diisolasi. Berdasarkan penapisan antimikrob 1 isolat penghasil bakteriosin yaitu Lactobacillus JMB 6. Berdasarkan hasil identifikasi, bakteri JMB 6 menunjukkan kesamaan 93% dengan Lactobacillusplantarum.
Saran
uji kemampuan pertumbuhan bakteri asam laktat pada media alami dan uji potensi probiotik isolate terpilih. Aplikasi dapat dilakukan dengan inokulasi BAL secara langsung.
DAFTAR PUSTAKA
Ahn C, Stiles ME. 1990. Plasmid- associated bacteriosin production by a strain of
Carnobacterium piscicola from meat. Appl Environ Microbiol. 56:2503-2510.
Ali AA. 2010. Beneficial role of lactic acid bacteria in food preservation and human health: a review. Research J Microbiol. 5: 1213-1221.
Anas M, Eddine HJ, Mebrouk K. 2008. Antimicrobial activity of Lactobacillus
species isolated from algerian raw goat’s milk against Staphylococcus aureus. World J Dairy Food Sci. 3: 39-49.
Arokiyamary A, Sivakumar PK. 2011. Antibacterial activity of bacterocin producing Lactobacillus sp isolated from traditional milk products. Curr Bot. 2:05-08.
Ashe B, Paul S. 2010. Isolation and characterization of lactic acid bacteria from dairy effluents. J Environ Res Develop. 4(4): 984-991.
Barynin VV, Whittaker MM, Antonyuk SV, Lamzin VS, Harrison PM, Artymiuk PJ, Whittaker JW. 2001. Crystal structure of manganese catalase from
Lactobacillus plantarum.Structure. 9:725– 738.doi:S0969-2126(01)00628-1.
Cizeikiene D, Juodeikiene G, Paskevicius A. 2013. Antimicrobial activity of lactic acid bacteria against pathogenic and spoilage microorganism isolated from food and their control in wheat bread. Food Control.31: 539–545.
Cleveland J, Montville TJ, Nes IF, Chikindas ML. 2001. Bacteriocins: safe, natural antimicrobials for food preservation. Int J Food Microbiol. 71: 1–20. Desniar, Rusmana I, Suwanto A, Mubarik NR. 2012. Senyawa antimikrob yang
20
Feutry F, Oneca M, Berthier F, Torre P. 2012. Biodiversity and growth dynamics of lactic acid bacteria in artisanal PDO ossau-iraty cheeses made from raw ewe’s milk with different starters. Food Microbiol. 29: 33-42
Gonzales BE, Glaasker E, Kunji ERS, Driessen AJM, Suarez JE, Onings WNK. 1996. Bactericidal mode of Action of plantaricin s. Appl Environ Microbiol.
62 : 2701-2709.
Haller D, Colbus H, Ganzle MG, Scherenbacher P, Bode C, Hammes WP. 2001. Metabolic and functional properties of lactic acid bacteria in the gastro-intestinal ecosystem: A comparative in vitro study between bacteria of intestinal and fermented food origin. Syst Appl Microbiol. 24: 218–226.
Hilmi ACE, Gokalp HSY. 2000. Production of bacteriocin-like metabolites by lactic acid cultures isolated from sucuk samples. Meat Sci. 55: 89-96. Jack RW, Tagg JR, Ray B. 1995. Bacteriocin of Gram positive bacteria. Microbiol.
59(2): 1416-1429.
Jos HJ, Veld H. 1996. Microbial and biochemichal spoilage of foods. Int J Food Microbiol. 33: I- 18.
Kusmiati, Malik A. 2002. Aktivitas bakteriosin dari bakteri Leuconostoc mesenteroides pbac1 pada berbagai media. Makara Kesehatan. 6(1): 1-10. Kandler O, Weiss N. 1995. Bergeys Manual : Systematic Bacteriology.
Baltimore[US]. The Williams and Wilkins Company.
Maaike CV, Vaughan EE, Kleerebezem M, de Vos WM. 2006. Lactobacillus plantarum—survival, functional and potential probiotic properties in the human intestinal tract. Int Dairy J. 16 : 1018–1028.
Moll GN, Konings, Driessen AJM. 1999. Bacteriosin: mechanism of membrane insertion and pore formation. Netherlan (NL): Klaver Academic Pr.
Navaro L, Zaraxaga M, Saenz J, Ruiz-Larrea F, Torres C. 2000. Bacteriocin production by lactic acid bacteria isolated from rioja red wines. J Appl Microbiol. 88: 44-51.
Ogunbanwo ST, Sanni A, Onilude AA. 2003. Characterization of bacteriocin produced by Lactobacillus plantarum F1 and Lactobacillus brevis OG1. Afr J Biotechnol. 2 (8): 219-227.
Pithva S, Ambalam P, Jayantilal M, Dave, Vyas BR. 2012. Potential of Probiotic Lactobacillus Strains as Food Additives, Food Additive. Yehia El-Samragy, Editor. Shanghai (CN): Intech pres.
Ray B, Field RA. 1992. Antibacterial effectiveness of a pediocin AcH based biopreservatif against spoilage and pathogenic bacteria from vacum packaged refrigerated meat. Proceedings: 38 th International Congress of meat Science and Technology: August 23-28, 1992, Clermont Ferrand, France 4: 31-734.
Razak AR, Patong AR, Harlim T, Djide MN, Haslia, Mahdalia. 2009. Produksi senyawa bakteriosin secara fermentasi menggunakan isolat BAL Enterococcus faecium DU55 dari dangke. Indones Chem Act. 2(2):1-9. Sa´nchez I, Palop L, Ballesteros C. 2000. Biochemical characterization of lactic
acid bacteria isolated from spontaneous fermentation of ‘Almagro’ eggplants. Int J Food Microbiol 59: 9–17.
21 Saarela M, Mogensen G, Fonden R, Matto J, Sandholm MT. (2000). Probiotic bacteria: safety, functional and technological properties. J Biotechnol. 84: 197-215
Sankar NR, Priyanka VD, Reddy VD, Rajanikanth,P, Kumar VD , Indira M. 2012. Purification and characterization of bacteriocin produced by Lactobacillus plantarum isolated from cow milk. Int J Microbiol Research. 3 (2): 133-137. doi: 10.5829/idosi.ijmr.2012.3.2.62182.
Schillinger U, Schillinger GR, Holzapfel WH. 1996. Potential of antagonistic microorganisms and bacteriocins for the biological preservation of foods.
Trends Food Scien Technol 7 (5) : 158-164.
Setyaningsih D, Apriyantono A, Sari MP. 2010. Analisis Sensori untuk Industri Pangan dan Agro. Bogor (ID): IPB Pr.
Signorini ML, Alquiciraep EP, Legarreta IG. 2006. Effect of lactic acid and lactic acid bacteria on growth of spoilage microorganisms invacuum-packaged beef. J Muscle Foods.17 : 277–290.
Siezen RJ, Vlieg JETH. 2011. Genomic diversity and versatility of Lactobacillus plantarum, a natural metabolic engineer. Microbial Cell Fact 10(1): 1-5. doi:10.1186/1475-2859-10-S1-S3.
Singh S, Goswami P, Singh R, Heller KJ. 2009. Application of molecular identification tools for Lactobacillus, with a focus on discrimination between closely related species: a review. Food Sci Technol. 42(2):448–457. Soomro AH, Masud T, Anwaar K. 2002. Role of lactic acid bacteria (LAB) in
food preservation and human health – a review. Pakist J Nutr. 1(2): 20-24. Suardana IW, Suarsana IN, Sujaya IN, Wiryawan K. 2007. Isolasi dan identifikasi
bakteri asam laktat dari cairan rumen sapi bali sebagai kandidat biopreservatif. J Veter. 8: 155 – 159.
Supavititpatana P, Wirjantoro TI, Apichartsrangkoon A, Raviyan P. 2008. Addition of gelatin enhanced gelation of corn–milk yogurt. Food Chem.
106(1): 211–216.
Syah SP. 2012. Potensi daya hambat bakteri asam laktat terhadap cendawan pada dangke selama penyimpanan [tesis]. Bogor (ID) :Institut Pertanian Bogor. Trias R, Baneras L, Badosa E, Montesinos E. 2008. Bioprotecting of golden
delicious apple and iceberg lettuce against foodborne bacterial phatogens by lactid acid bacteria. Int J Food microbial. 123(1-2): 50-60.
Usmiati S, Marwati T. 2007. Seleksi dan optimasi proses produksi bakteriosin dari
Lactobacillus sp. J Pascapanen. 4(1): 27-37
22
Lampiran 1 Rata-rata mutu organoleptik berdasarkan karakteristik aroma setelah penyimpanan 6 bulan pada suhu 4oC
No Kode isolat rata-rata
1 JMB 1 3.4
2 JMB2 3.8
3 JMB4 5.4
4 JMB6 5.8
5 JMB8 5
6 JMB10 3.8
7 JMB11 4.2
8 JMB12 4.8
9 JMB13 5
10 JMB18 3
11 JMB19 4
23 Lampiran 2 Rata-rata mutu organoleptik hasil inokulasi BAL susu jagung fermentasi berdasarkan karakteristik organoleptik (warna, kekentalan dan aroma)
No Kode isolat Warna kekentalan Aroma Rata-rata Skala organoleptik
1 JMB1 5 6 6 5.6
2 JMB2 5 5 3 4.3
3 JMB4 6 6 5 5.6
4 JMB6 7 7 7 7.0
5 JMB8 5 5 4 4.6
6 JMB9 7 6 6 6.3
7 JMB10 6 5 4 5.0
8 JMB11 6 6 3 5.0
9 JMB12 7 7 7 7.0
10 JMB13 7 7 7 7.0
11 JMB14 7 6 6 6.3
12 JMB18 4 1 1 2.0
13 JMB19 6 6 6 6.0
14 JMT1 5 1 3 3.0
15 JMT6 4 3 3 3.3
16 JMA1 4 5 4 4.3
17 JMA2 5 5 4 4.6
24
Lampiran 3 Rata-rata diameter zona hambat isolat No Kode isolat
Rata-rata Diameter Zona
Hambat(mm)
Standar
25
Lampiran 4 Jumlah Log BAL pada fase pertumbuhan
No Jumlah Sel Log 10 sel
1 300000 5.477121
2 450000 5.653213
3 11454550000 10.05898
4 39272730000 10.59409
5 77636360000 10.89007
6 91636360000 10.96207
7 1.03E+11 11.01284
8 1.06727E+11 11.02828
9 1.17818E+11 11.07121
10 1.17636E+12 12.07054
26
RIWAYAT HIDUP
Lismayana Hansur adalah anak ketiga dari empat bersaudara, pasangan Hansur Sutte dan Astika. Dilahirkan di Katonantana 27 Juli 1986. Jenjang pendidikan yang pernah dilaluinya: SDN Katonantana Kecamatan Malangke Kab Luwu Utara, Provinsi Sulawesi Selatan pada tahun 1992 dan selesai pada tahun 1999. Kemudian melanjutkan pendidikan pada Sekolah Lanjut di SLTP Negeri 1 Malangke Kabupaten Luwu pada tahun 1999 sampai tahun 2002, lanjut di sekolah SMU Neg 3 Palopo tahun 2002 sampai tahun 2005. Selanjutnya memilih Jurusan Biologi Universitas Negeri Makassar (UNM) pada tahun 2005 sampai tahun 2009. Prodi Mikrobiologi Departemen Biologi FMIPA IPB tahun 2011.
1
PENDAHULUAN
Latar Belakang
Keanekaragaman sumber daya alam hayati Indonesia berupa hasil pertanian dapat digunakan sebagai sumber pangan, salah satunya ialah jagung. Susu jagung merupakan salah satu diversifikasi produk olahan jagung yang dijumpai di masyarakat sebagai sumber nutrisi pilihan selain makanan pokok. Susu jagung masih diproduksi secara tradisional di Sulawesi Selatan sehingga daya tahan produk masih rendah yang berdampak pada rendahnya keberadaan produk tersebut di pasaran. Susu jagung memiliki nutrisi yang baik bagi tubuh, karena memiliki kandungan vitamin yang tinggi (Supavititpatana et al. 2008).
Susu jagung adalah produk olahan jagung yang juga dapat mengalami kerusakan yang diakibatkan kontaminasi mikroba perusak makanan. Kandungan nutrisi pada pangan menjadi tempat berkembang biak bagi mikroorganisme. Menurut Jos dan Veld (1996) pembusukan makanan dapat disebabkan oleh berbagai reaksi yang dipengaruhi faktor fisik, kimia, dan enzim yang dihasilkan mikroorganisme akibat kontaminasi selama proses produksi (manufacturing). Untuk mengatasi hal tersebut, maka diperlukan suatu bahan pengawet yang berfungsi untuk menghindari kerusakan akibat mikroorganisme sehingga tidak menimbulkan bahaya bagi kesehatan konsumen. Preservasi merupakan cara untuk mengawetkan produk pangan hewani maupun nabati sehingga terhindar dari pembusukan akibat cemaran oleh mikrob (Suardana et al. 2007).
Cara yang digunakan untuk menghindari kontaminasi yaitu penggunaan bahan kimia sebagai bahan pengawet. Pemanfaatan bahan kimia selain menyebabkan masalah kesehatan ketika dikonsumsi dalam jangka panjang juga dapat menyebabkan perubahan warna dan bau pada makanan. Bahan yang kini dikembangkan untuk preservasi yaitu bakteriosin. Bakteriosin digunakan karena merupakan bahan pengawet alami yang aman, berasal dari mikroorganisme yaitu bakteri asam laktat (BAL).
Bakteriosin merupakan zat antimikrob yang dihasilkan oleh BAL dan bekerja menghambat bakteri lain termasuk bakteri patogen (Razak et al. 2009). Bakteri asam laktat yaitu Lactobacillus sp. telah umum digunakan sebagai biopreservasi pada bahan pangan karena tidak adanya residu yang dapat menimbulkan efek negatif. Lactobacillus sp. merupakan salah satu bakteri pada bahan pangan dengan hampir 140 spesies yang sebagian besar digunakan pada industri makanan. Bakteri ini merupakan flora alami dari berbagai produk makanan seperti susu mentah, produk susu fermentasi, buah-buahan, sayuran, dan produk daging. Lactobacillus sp. juga berfungsi sebagai