ISOLASI DAN KARAKTERISASI ß-GALAKTOSIDASE
BAKTERI ASAM LAKTAT DARI MAKANAN HASIL
FERMENTASI
SITARESMI YUNINGTYAS
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
ABSTRAK
SITARESMI YUNINGTYAS.
Isolasi dan Karakterisasi ß-Galaktosidase Bakteri
Asam Laktat dari Makanan Hasil Fermentasi. Dibimbing oleh DJAROT
SASONGKO HAMI SENO dan TATIK KHUSNIATI.
ß-Galaktosidase (EC 3.2.1.23) berguna untuk menghidrolisis laktosa menjadi
glukosa dan galaktosa. Penelitian ini bertujuan mendapatkan beberapa isolat
bakteri asam laktat penghasil ß-galaktosidase dari makanan hasil fermentasi serta
mengetahui aktivitas dan karakterisasi enzimatik dari isolat terseleksi. Aktivitas
enzimatik ß-galaktosidase dari isolat terseleksi ini dibandingkan dengan bakteri
pembanding, Lactobacillus bulgaricus. Penelitian ini diawali dengan isolasi dan
seleksi bakteri asam laktat dari makanan hasil fermentasi. Aktivitas dan
karakterisasi
enzim
ditentukan
dengan
menggunakan
o-nitrofenil-ß-D-galaktopiranosida (oNPGal).
Isolasi bakteri asam laktat dari makanan hasil fermentasi mendapatkan 13
isolat yang menghasilkan ß-galaktosidase dengan aktivitas tertinggi pada isolat
AV-1. ß-Galaktosidase dari isolat AV-1 mempunyai kondisi optimum pada waktu
inkubasi 25 menit, suhu 43 °C, dan pH 6.5 dengan aktivitas sebesar 0.214 U/ml.
ß-Galaktosidase dari L. bulgaricus mempunyai kondisi optimum pada waktu
inkubasi 25 menit, suhu 43 °C, dan pH 6 dengan aktivitas sebesar 0.336 U/ml.
Aktivitas ß-galaktosidase isolat AV-1 dengan isolat L. bulgaricus secara analisis
statistik berbeda nyata (a = 0.05).
Parameter kinetik (v
maksdan K
M)
ß-galaktosidase isolat AV-1 sebesar 0.212 U/ml dan 0.326 mM sedangkan untuk
ABSTRACT
SITARESMI YUNINGTYAS. Isolation and Characterization of ß-Galactosidase
Lactic Acid Bacteria from Fermented Food. Under the direction of DJAROT
SASONGKO HAMI SENO and TATIK KHUSNIATI.
ß-Galactosidase (EC 3.2.1.23) hydrolized lactose into glucose and galactose.
The aim of this research is to find out lactic acid bacteria produced ß-galactosidase
from fermented food and determine its activity and characterization of
ß-galactosidase from selected isolate. The ß-galactosidase activity of selected
isolate was compared with Lactobacillus bulgaricus which was used as a
reference. The objective of this research was to isolation and selection lactic acid
bacteria from fermented food. Activity and characterization of ß-galactosidase
were determined using o-nitrophenyl-ß-galactopiranosida (oNPGal).
Isolation lactic acid bacteria from fermented food had 13 isolates, isolate
AV-1 has produced ß-galactosidase with the highest activity. The optimum
ß-galactosidase activity from isolate AV-1 was shown 0.214 U/ml at 25 minute
incubation, 43 °C and pH 6.5. The optimum ß-galactosidase activity from
L. bulgaricus was shown 0.336 U/ml at 25 minute incubation, 43 °C and pH 6.
ß-Galactosidase activity from isolate AV-1 was significantly different (a = 0.05) to
ß-galactosidase activity from L. bulgaricus. ß-Galactosidase of isolate AV-1 had
v
maks0.212 U/ml and K
M0.326 mM while that L. bulgaricus had v
maks0.333 U/ml
ISOLASI DAN KARAKTERISASI ß-GALAKTOSIDASE
BAKTERI ASAM LAKTAT DARI MAKANAN HASIL
FERMENTASI
SITARESMI YUNINGTYAS
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul Skripsi: Isolasi dan Karakterisasi ß-Galaktosidase Bakteri Asam Laktat dari
Makanan Hasil Fermentasi
Nama
: Sitaresmi Yuningtyas
NIM
: G44104012
Disetujui
Drs. Djarot Sasongko H.S, MS
Dr. Ir. Tatik Khusniati, M. App. Sc
Ketua
Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas rahmat, karunia,
dan ridho-Nya penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah
yang berjudul Isolasi dan Karakterisasi ß-Galaktosidase Bakteri Asam Laktat dari
Makanan Hasil Fermentasi. Karya ilmiah ini disusun berdasarkan hasil penelitian
di Laboratorium Biokimia Mikrob, Bidang Mikrobiologi, Pusat Penelitian
Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong dari bulan Maret
hingga Juli 2008.
Penelitian dan penyusunan karya ilmiah ini tidak terlepas dari bantuan
berbagai pihak. Oleh karena itu, penulis menyampaikan rasa terima kasih yang
sebesar-besarnya kepada Bapak Drs. Djarot Sasongko HS, MS. selaku
pembimbing dari Program Studi Biokimia dan Ibu Dr. Ir. Tatik Khusniati,
M.App.Sc selaku pembimbing dari institusi LIPI. Ucapan terimakasih juga
penulis sampaikan kepada staff Laboratorium Biokimia Mikrob, Mba Hamda, Teh
Neng, Suri, Nyunyui, Indah, Dewi, Ela, Intan, Aulin, Hanifah, Safety, Amie, Abi,
Sidiq dan rekan-rekan Biokimia 41 atas segala bantuannya.
Penulis juga mengucapkan rasa terima kasih yang tulus dan rasa hormat
setinggi-tingginya kepada Ayah, Mama, Yuthika, Ari, dan Nenek yang senantiasa
tulus memanjatkan doa dan memberikan segala perhatian serta semangat. Penulis
berharap semoga karya ilmiah ini bermanfaat bagi ilmu pengetahuan dan pihak
yang membutuhkan.
Bogor, September 2008
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 13 Juni 1987 dari ayah Suyono
dan ibu Lina Herlina. Penulis merupakan anak pertama dari tiga bersaudara.
Tahun 2004 penulis menyelesaikan sekolah menengah umum dari SMU
Negeri 4 Bogor. Pada tahun yang sama, penulis lulus seleksi masuk IPB melalui
jalur Undangan Seleksi Masuk IPB (USMI) dan terdaftar sebagai mahasiswa pada
Program Studi Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum
mata kuliah Biokimia Umum pada mahasiswa S1 Biologi tahun 2007-2008 dan
mahasiswa S1 Fakultas Kedokteran Hewan tahun 2007-2008. Penulis juga aktif
sebagai pengurus Community of Research and Education in Biochemistry
(CREBs) sebagai staf Bidang Biokimia Industri dan Mikrobiologi periode
2005-2006 serta Sekretaris II periode 2005-2006-2007. Penulis melakukan praktik lapangan
di Laboratorium Bioproses 3 Pusat Penelitian Bioteknologi, Lembaga Ilmu
Pengetahuan Indonesia (LIPI) Cibinong dari bulan Juli sampai Agustus 2007.
Judul praktik lapangan penulis adalah Aktivitas Antibakteri Curdlan dari
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN... 1
TINJAUAN PUSTAKA
ß-Galaktosidase... 2
Karakterisasi Enzim ... 2
Bakteri Asam Laktat ... 3
Lactobacillus bulgaricus... 4
Makanan Hasil Fermentasi ... 4
BAHAN DAN METODE
Bahan dan Alat... 5
Metode ... 5
HASIL DAN PEMBAHASAN
Isolasi dan Pemurnian Bakteri Asam Laktat dari Makanan
Hasil Fermentasi... 6
Seleksi Bakteri Asam Laktat Penghasil ß-Galaktosidase... 7
Produksi Enzim ß-Galaktosidase... 7
Penentuan Waktu Inkubasi Optimum... 8
Penentuan Suhu Optimum... 9
Penentuan pH Optimum ... 9
Aktivitas ß-Galaktosidase pada Kondisi Optimum ... 10
Parameter Kinetik (K
Mdan v
maks) ... 10
SIMPULAN DAN SARAN
Simpulan... 11
Saran ... 11
DAFTAR PUSTAKA... 11
DAFTAR GAMBAR
Halaman
1.
Reaksi hidrolisis laktosa oleh ß-galaktosidase ... 2
2.
Lactobacillus bulgaricus ... 4
3.
Morfologi koloni bakteri asam laktat dari makanan hasil fermentasi ... 7
4.
Hasil seleksi bakteri asam laktat penghasil ß-galaktosidase ... 7
5.
Kurva pertumbuhan AV-1 dan L. bulgaricus... 8
6.
Reaksi hidrolisis oNPGal oleh ß-galaktosidase... 8
7.
Penentuan waktu inkubasi optimum ß-galaktosidase isolat AV-1
dan L. bulgaricus ... 9
8.
Pengaruh suhu terhadap aktivitas enzim ß-galaktosidase isolat AV-1
dan L. bulgaricus ... 9
9.
Pengaruh pH terhadap aktivitas enzim ß-galaktosidase isolat AV-1
dan L. bulgaricus ... 10
10.
Aktivitas enzim ß-galaktosidase sebelum dan sesudah optimasi ... 10
11.
Kurva Michaelis Menten dari isolat AV-1 dan L. bulgaricus ... 10
12.
Kurva Lineweaver Burk isolat AV-1 dan L. bulgaricus ... 11
DAFTAR LAMPIRAN
Halaman
1.
Kegiatan penelitian... 15
2.
Bentuk morfologi isolat bakteri asam laktat dari makanan hasil fermentasi... 16
3.
Hasil seleksi bakteri asam laktat penghasil ß-galaktosidase
berdasarkan terbentuknya o-nitrofenol (oNP) ... 16
4.
Hasil penentuan kurva pertumbuhan isolat AV-1 ... 17
5.
Hasil penentuan kurva pertumbuhan dari L.bulgaricus ... 17
6.
Hasil penentuan absorbansi larutan standar o-nitrofenol (oNP)... 18
7.
Aktivitas ß-galaktosidase pada berbagai waktu inkubasi... 19
8.
Aktivitas ß-galaktosidase pada berbagai variasi suhu ... 20
9.
Aktivitas ß-galaktosidase pada berbagai variasi pH... 21
10.
Data penentuan kinetika enzim ... 22
11.
Analisis statistik aktivitas enzim ß-galaktosidase ... 23
1
PENDAHULUAN
Susu merupakan bahan pangan yang memiliki komponen spesifik seperti lemak susu, protein susu, karbohidrat susu (laktosa), vitamin, dan mineral. Laktosa adalah karbohidrat utama susu dengan proporsi 4.7% dari total susu (Chaplin 2004). Laktosa adalah disakarida yang terdiri dari galaktosa dan glukosa yang dihubungkan dengan ikatan ß-(1,4)-glikosidik (Fox & McSweeney 1981). Keberadaan laktosa dalam susu merupakan salah satu keunikan dari susu itu sendiri karena laktosa tidak terdapat di alam kecuali sebagai produk dari kelenjar susu. Laktosa merupakan zat makanan yang menyediakan energi bagi tubuh. Namun, laktosa ini harus dipecah menjadi glukosa dan galaktosa oleh enzim ß-galaktosidase agar dapat diserap oleh usus, masuk ke pembuluh darah, dan kemudian diedarkan ke seluruh tubuh untuk digunakan sebagai bahan bakar.
Laktosa intoleran adalah ketidakmampuan mencerna laktosa menjadi glukosa dan galaktosa karena enzim ß-galaktosidase yang rendah pada brush border pada usus halus (Marsh & Riley 1998). Jika seseorang tidak mempunyai cukup enzim ß-galaktosidase maka laktosa menjadi tidak tercerna dan tidak dapat diserap masuk ke dalam darah. Bahan-bahan ini akan menumpuk di dalam usus. Oleh bakteri usus, tumpukan gula susu ini akan diubah menjadi asam-asam organik dan gas karbon dioksida, gas metan, dan hidrogen. Deposit asam ini merangsang timbulnya gerakan usus. Hal ini menyebabkan diare dengan tinja berair, berbusa, dan berbau asam. Penderita laktosa intoleran di Amerika sekitar 95%, Eropa 50%, Asia 80%, dan Afrika 80% (Rusynyk & Still 2001).
Penyebab munculnya laktosa intoleran dapat disebabkan bawaan dari lahir, penyebab primer, dan penyebab sekunder. Penyebab primer dapat akibat dari penurunan aktivitas ß-galaktosidase seiring bertambahnya usia. Bagi sebagian besar populasi di dunia, aktivitas ß-galaktosidase meningkat selama periode gestasi lanjut (27-32 minggu), dan tetap tinggi sampai usia sekitar 5-7 tahun. Setelah usia ini, aktivitas tersebut turun sampai dewasa. Hal ini disebabkan setelah dewasa, susu tak lagi menjadi makanan utama lagi sehingga kebutuhan enzim pengurai susu pun menjadi
menurun. Penyebab sekunder dapat
diakibatkan rusaknya sel-sel permukaan usus halus yang jadi pabrik pembuat enzim ß-galaktosidase (Rusynyk & Still 2001). Kerusakan ini disebabkan infeksi dan
gangguan-gangguan yang merusak sel-sel usus. Dengan demikian perlu dilakukan upaya-upaya untuk menurunkan kadar laktosa susu dan meningkatkan kecernaan laktosa bagi penderita laktosa intoleran.
Susu dapat dimodifikasi bagi penderita laktosa intoleran dengan ultrafiltrasi, fermentasi (Fox & McSweeney 1981), dan hidrolisis (Winarno 1999). Proses ultrafiltrasi akan menghilangkan mineral dan vitamin sehingga proses ini akan mengurangi nutrisi (Fox & McSweeney 1981). Proses fermentasi akan mengubah susu menjadi produk-produk baru, misalnya susu asam dan yoghurt yang pada umumnya dapat menurunkan 25% kadar laktosa dan sisanya masih tersisa dalam produk susu tersebut (Winarno 1999). Hidrolisis laktosa dilakukan secara enzimatik menggunakan enzim ß-galaktosidase yang akan menghidrolisis laktosa menjadi glukosa dan galaktosa yang masih memiliki nilai energi tinggi namun aman bagi penderita laktosa intoleran. Dalam proses hidrolisis dengan menggunakan ß-galaktosidase, tidak semua laktosa dihidrolisis tetapi disisakan sebanyak 25% (Tossaveinen 2003). Selain itu, penderita laktosa intoleran dapat juga mengonsumsi suplemen ß-galaktosidase. Metode perlakuan dengan konsumsi suplemen ß-galaktosidase memang terbukti efektif mereduksi gejala yang berhubungan dengan malabsorbsi laktosa tetapi obat ini harganya mahal (Fox & McSweeney 1981).
Produksi hidrolisis laktosa dapat menggunakan bakteri asam laktat. Bakteri asam laktat mempunyai enzim-enzim ß-galaktosidase dan laktat dehidrogenase (LDH) yang menghasilkan asam laktat dari laktosa pada proses fermentasi (Surono 2004). Secara alami bakteri asam laktat ditemukan pada beberapa bahan makanan seperti daging, buah-buahan, sayur-sayuran, susu, dan makanan hasil fermentasi. Menurut Wierzbicki dan Kosikowski (1973), Lactobacillus bulgaricus dan Streptococcus thermophillus dapat menghidrolisis laktosa hingga 50-60%.
Penelitian ini bertujuan mendapatkan beberapa isolat bakteri asam laktat penghasil ß-galaktosidase dari makanan hasil fermentasi serta mengetahui aktivitas dan karakterisasi enzimatik (kondisi optimum dan parameter kinetik) dari beberapa isolat tersebut. Aktivitas enzimatik ß-galaktosidase isolat terseleksi ini dibandingkan dengan bakteri pembanding, yaitu Lactobacillus bulgaricus. Hipotesis penelitian ini adalah isolat bakteri asam laktat dari makanan hasil fermentasi menghasilkan ß-galaktosidase. Selain itu, terdapat perbedaan
2
aktivitas enzim ß-galaktosidase dari isolat-isolat tersebut dengan Lactobacillus bulgaricus. Hasil penelitian ini diharapkan
dapat memberikan informasi ilmiah mengenai berbagai isolat bakteri asam laktat dari makanan hasil fermentasi sebagai penghasil ß-galaktosidase. Enzim ß-galaktosidase ini dapat juga digunakan dalam pembuatan produk susu rendah laktosa untuk penderita laktosa intoleran.
TINJAUAN PUSTAKA
ß-Galaktosidase
ß-galaktosidase (EC 3.2.1.23) termasuk enzim hidrolase yang dapat menghidrolisis ikatan ß-D-galaktosida pada ujung nonreduksi residu ß-D-galaktosa. Nama sistematiknya adalah ß-D-galaktosida galaktohidrolase. Enzim ini mempunyai nama lain laktase. Enzim ini bersifat intraseluler pada bakteri dan yeast tetapi bersifat ekstraseluler pada fungi (IUBMB Enzyme Nomenclature 1980). Cara kerja enzim ini adalah menghidrolisa ikatan ß-(1,4)-glikosida pada laktosa. Penggunaan enzim ß-galaktosidase dalam proses hidrolisa ini mempunyai kekurangan dimana hidrolisa laktosa secara keseluruhan tidak mungkin terjadi karena enzim dihambat oleh terbentuknya galaktosa didalam reaksi hidrolisis (Boyer 2002).
Menurut Tryland dan Fiskdal (1997), ß-galaktosidase dapat dihasilkan oleh bakteri
Gram negatif (Enterobacteriaceae,
Vibrinoceae, Pseudomonadaceae, dan
Neisseriaceae), bakteri Gram positif (Lactobacteriaceae, Streptococcaceae), yeast , dan fungi. Enzim ß-galaktosidase yang dihasilkan oleh yeast (Kluyveromyces fragilis dan Kluyveromyces lactis) bersifat aktif pada pH tinggi sedangkan yang berasal dari fungi (Aspergillus oryzae dan Aspergillus niger) bersifat aktif pada pH rendah.
ß-galaktosidase terdapat pada usus halus manusia yang dapat menghidrolisis laktosa menjadi glukosa dan galaktosa serta mempunyai pH optimum 6 (Campbell et al. 2005). Jika laktosa tidak dapat dihidrolisis oleh ß-galaktosidase, laktosa yang mempunyai sifat osmotik yang tinggi ini dapat menarik air dan cairan tubuh ke dalam saluran pencernaan usus kecil. Masuknya cairan tubuh ke dalam usus kecil akan merangsang gerakan peristaltik dinding usus menjadi lebih cepat. Hal ini akan mendorong isi usus kecil berpindah secara cepat pula ke dalam usus besar. Di dalam usus
besar ini bakteri-bakteri akan
memfermentasikan laktosa menghasilkan berbagai asam organik dan gas. Akibatnya, akan timbul gejala sakit perut, mulas, kejang perut, pengeluaran gas, dan diare (Winarno 1999).
ß-galaktosidase dapat diaplikasikan untuk penderita laktosa intoleran dengan cara hidrolisis laktosa pada susu serta konsumsi suplemen ß-galaktosidase (Rusynyk & Still 2001). Produk suplemen ß-galaktosidase yang sudah beredar di pasaran adalah Lactaid, Lactase F “Amano”, Biolacta FN5, dan Lactoles L3 (Amano Enzyme 2007). Selain itu, enzim ini dapat digunakan pada produk susu, perlakuan untuk whey, degradasi laktosa, produksi dari galaktooligosakarida (GOS), dan industri es krim (Chaplin 2004).
Gambar 1 Reaksi hidrolisis laktosa oleh ß-galaktosidase (Chaplin 2004).
Karakterisasi Enzim
Aktivitas enzim terhadap substrat dipengaruhi oleh beberapa faktor yaitu, pH, suhu, konsentrasi substrat, aktivator (koenzim dan kofaktor), dan inhibitor (Winarno 1999). Setiap enzim mempunyai kondisi tertentu agar bekerja secara optimum.
pH
Efek pH pada enzim berkaitan dengan keadaan ionisasi dari sistem yang dikatalisis, termasuk substrat, dan enzim itu sendiri. Perubahan pH dapat mempengaruhi keadaan ionisasi dari asam-asam amino pada sisi aktif
enzim sehingga akan mempengaruhi
interaksinya dengan molekul substrat. Kadar pH yang terlalu tinggi atau terlalu rendah akan menyebabkan ketidakstabilan pada konformasi enzim sehingga menyebabkan struktur pada enzim rusak. Enzim mempunyai pH optimum yang khas yang akan menyebabkan aktivitas maksimal. Keadaan optimum ini dihubungkan dengan saat gugus pemberi proton atau penerima proton yang aktif pada sisi enzim berada pada kondisi ionisasi yang tepat. Keadaan optimum tidak harus sama dengan pH lingkungannya (Lehninger 1994). Enzim ß-galaktosidase yang berasal dari fungi mempunyai pH optimum sekitar 2.5-4.5 sedangkan yang berasal dari yeast berkisar 6.0-7.0 (Szczodark 2000). Enzim ß-galaktosidase dari bakteri mempunyai pH optimum 5.0-7.0 (Winarno 1999).
3
Suhu
Suhu mempunyai dua pengaruh yang saling bertentangan. Suhu dapat meningkatkan aktivitas enzim, tetapi dapat pula merusak struktur enzim. Suhu optimum merupakan batas keduanya (Dixon & Webb 1978). Peningkatan suhu sebelum tercapai suhu optimum akan meningkatkan kecepatan reaksi katalitik enzim karena energi kinetik molekul-molekul yang bereaksi, yaitu pada saat kompleks enzim-substrat melampaui energi aktivasi terlalu besar, sehingga memecah ikatan sekunder pada konformasi enzim dan sisi aktifnya. Hal ini mengakibatkan enzim terdenaturasi dan kehilangan sifat katalitiknya (Martin 1981). ß-galaktosidase yang dihasilkan oleh fungi mempunyai suhu optimum 55°C sedangkan yeast mempunyai suhu optimum 35°C (Crueger & Crueger 1982).
Konsentrasi Substrat
Kecepatan reaksi yang dikatalisis enzim sangat dipengaruhi oleh berbagai konsentrasi substrat terhadap kecepatan reaksi awal apabila konsentrasi enzim dijaga konstan. Konsentrasi substrat yang amat rendah menyebabkan kecepatan reaksi amat rendah tetapi kecepatan akan meningkat dengan meningkatnya konsentrasi substrat. Pada akhirnya, akan tercapai titik batas, dan setelah titik ini dilampaui, kecepatan reaksi hanya akan
meningkat sedemikian kecil dengan
bertambahnya konsentrasi substrat. Pada batas ini, enzim menjadi jenuh oleh substratnya dan tidak dapat berfungsi lebih cepat (Lehninger 1994).
Michaelis dan Menten mendefinisikan suatu tetapan yang dinyatakan sebagai tetapan Michaelis-Menten (KM) adalah konsentrasi
substrat tertentu pada saat enzim mencapai setengah kecepatan maksimumnya. Kecepatan maksimum (vmaks) adalah kecepatan yang
berangsur-angsur dicapai pada konsentrasi substrat tinggi. Persamaan Michaelis-Menten adalah pernyataan aljabar bagi bentuk hiperbolik kurva tersebut dengan parameter pentingnya adalah konsentrasi substrat ([S]), kecepatan awal (v0), vmaks, dan KM. Persamaan
ini menjadi dasar bagi semua penelitian kinetika enzim karena memungkinkan perhitungan kuantitatif sifat-sifat enzim dan analisis penghambatan enzim (Lehninger 1994). Persamaan Michaelis-Menten adalah sebagai berikut. [S] K [S] v v M maks 0
Persamaan Michaelis – Menten dapat ditransformasikan ke suatu persamaan lain
yang disebut persamaan Lineweaver-Burk. Persamaan ini akan menghasilkan nilai vmaks
dan KM yang lebih tepat karena pemetaan 1/v0
terhadap 1/[S] menghasilkan garis lurus. Garis ini akan memiliki sudut KM/vmaks, perpotongan
garis pada sumbu y sebesar 1/vmaks dan
perpotongan pada sumbu x sebesar -1/KM
(Lehninger 1994). Persamaan Lineweaver-Burk adalah sebagai berikut.
maks maks M 0 v 1 S 1 K 1
]
[
.
v
v
Aktivator dan Inhibitor
Beberapa enzim membutuhkan komponen tambahan bagi aktivitasnya. Bila komponen tambahan tersebut berupa senyawa anorganik disebut kofaktor, sedangkan jika senyawa organik disebut koenzim. Pada beberapa enzim, kofaktor dan koenzim terlibat langsung pada proses katalitik, tetapi ada juga yang berfungsi sebagai pembawa gugus fungsional tertentu. Hampir semua enzim dapat dihambat oleh senyawa kimia tertentu misalnya ion logam, senyawa pengkelat, senyawa organik, bahkan substrat enzim itu sendiri (Lehninger 1994). Ion K+ dan Mg2+ dibutuhkan agar aktivitas enzim ß-galaktosidase optimum (Adams et al. 1994 dalam Marshall dan Tamime 1997).
Bakteri Asam Laktat
Bakteri asam laktat adalah bakteri yang memproduksi asam laktat, termasuk golongan bakteri Gram positif, tidak membentuk spora, sel berbentuk batang atau bulat, baik tunggal, berpasangan atau berantai, kadang-kadang berbentuk tetrad. Bakteri asam laktat tidak motil atau sedikit motil, bersifat mikroaerofilik sampai anaerob, bersifat kemoorganotropik dan kompleks, serta bersifat mesofilik atau menyukai suhu 10-40 °C (Stamer 1980). Bakteri asam laktat merupakan sebutan umum untuk bakteri yang memfermentasi gula seperti laktosa atau glukosa untuk menghasilkan sejumlah besar asam laktat. Bakteri asam laktat mempunyai enzim-enzim ß-galaktosidase dan laktat dehidrogenase (Surono 2004). Laktosa akan masuk ke dalam sel bakteri asam laktat melalui permease, kemudian ß-galaktosidase akan memutus ikatan glikosida pada laktosa sehingga akan menghasilkan glukosa dan galaktosa (Marshall & Tamime 1997).
Bakteri asam laktat mempunyai 4 genus yaitu Lactobacillus, Streptococcus, Leuconostoc, dan Pediococcus. Secara fisiologis dan berdasarkan metabolismenya, bakteri asam laktat dikelompokkan menjadi
4
dua bagian, yaitu homofermentatif dan heterofermentatif (Surono 2004). Bakteri asam laktat homofermentatif melibatkan jalur Embden Meyerhof, yaitu glikolisis, menghasilkan asam laktat, 2 mol ATP dari 1 molekul glukosa atau heksosa dalam kondisi normal, tidak menghasilkan CO2 dan
menghasilkan biomassa sel dua kali lebih banyak daripada bakteri asam laktat heterofermentatif. Bakteri asam laktat heterofermentatif melalui jalur 6-fosfoglukonat atau fosfoketolase selain menghasilkan asam laktat juga menghasilkan etanol, CO2, asam
asetat, senyawa citarasa, dan manitol serta 1 mol ATP dari heksosa dan tidak mempunyai enzim aldolase (Jay 2000).
Lactobacillus bulgaricus
Bakteri ini memiliki klasifikasi sebagai berikut: kingdom: Prokariota; divisi: Bacteria; kelas: Bacilli; ordo: Lactobacillales; famili: Lactobacillaceae; dan genus: Lactobacillus (Buchanan & Gibbons 1975). L. bulgaricus merupakan bakteri berbentuk batang (Gambar 2), tidak berspora, Gram positif, non motil, dan membentuk koloni dengan diameter 1-3 µm. Suhu optimum pertumbuhan 40-43 °C, masih dapat tumbuh pada suhu 45 °C atau kadang-kadang pada suhu 50-52 °C dan tidak dapat tumbuh pada suhu 15 °C (Deibel & Seeley 1974).
Spesies L. bulgaricus bersifat anaerobik, yaitu lebih senang hidup tanpa atau dengan sedikit oksigen. Selain itu, bakteri ini termasuk bakteri asam laktat homofermentatif (Marshall & Tamime 1997). Enzim ß-galaktosidase dari bakteri ini memerlukan ion magnesium untuk aktivitasnya (Adams et al. dalam Marshall & Tamime 1997). Enzim ß-galaktosidase dari bakteri ini mempunyai pH optimum antara 5.2 sampai 6.8 (Cesca et al. 1984) dan suhu optimum sekitar 55-57 °C (Itoh et al. 1980).
Gambar 2 Lactobacillus bulgaricus (Buchanan & Gibbons 1975).
Makanan Hasil Fermentasi
Fermentasi merupakan proses berbantuan
mikroorganisme yang salah satunya
dimanfaatkan dalam pembuatan dan
peningkatan cita rasa makanan. Mikrob yang bersifat fermentatif dapat mengubah karbohidrat dan turunannya menjadi alkohol, asam, dan karbon dioksida. Fermentasi yang menghasilkan asam laktat dapat ditemui dalam sosis, sayur-sayuran, buah-buahan, dan susu. Fermentasi yang menghasilkan alkohol dalam roti, bir, dan wine. Fermentasi yang menghasilkan asam dan alkohol adalah kopi, coklat, kecap, tempe, dan vinegar (Fellows 1992).
Sayur dan buah yang mengalami proses fermentasi menghasilkan asam laktat adalah acar dan asinan. Asam laktat dapat berasal dari fermentasi cairan buah atau sayuran itu sendiri atau ditambahkan dalam bentuk cuka makan. Hampir semua jenis sayur dan buah dapat difermentasi secara alami oleh bakteri asam laktat karena sayur dan buah mengandung gula yang diperlukan untuk pertumbuhan bakteri tersebut (Apandi 1984). Proses fermentasi sayur dan buah dipengaruhi oleh berbagai faktor, seperti kondisi anaerobik, konsentrasi garam, suhu, dan adanya bakteri asam laktat (Buckle et al. 1985).
Susu fermentasi adalah produk olahan hasil fermentasi susu oleh mikroorganisme tertentu. Contoh susu fermentasi adalah yoghurt, kefir (Belitz & Grosch 1986), dan dadih. Sosis adalah campuran daging dan lemak dengan garam nitrat atau nitrit, gula, dan rempah-rempah yang diisikan pada casing dan melalui masa fermentasi kemudian mengalami masa proses pengeringan. Proses produksi sosis pada prinsipnya adalah penggilingan dan pencampuran, pengisian pada casing,
fermentasi, dan pemeraman (Fellows 1992).
Fermentasi asam laktat beserta
mikroorganisme yang digunakan dapat dilihat pada Tabel 1.
Tabel 1 Pangan yang dapat difermentasi dan menghasilkan asam laktat
Pangan Mikroorganisme
Daging Pediococcus cerevisiae Lactobacillus plantarum L. curvatus
Susu L. bulgaricus
Streptococcus thermophilus
Susu S. diacetylactis, S. cremoris S. lactis, Lactobacilli Sayur dan Buah L. mesenteroides L. brevis, L. plantarum Penicillium cerevisiae (Fellows 1992)
5
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan untuk isolasi bakteri asam laktat adalah makanan hasil fermentasi, media MRS (de Man Rogosa Sharpe) agar (1 g pepton, 0.8 g beef extract, 0.4 g yeast extract, 2 g laktosa, 0.1 ml Tween 80, 0.2 g Na2HPO4, 0.5 g CH3COONa.3H2O,
0.2 g triamonium sitrat, 0.02 g MgSO4.7H2O,
0.005 g MnSO4.4H2O, 2 g bakto agar dalam
100 ml akuades, pH 6.2), dan akuades steril. Bahan-bahan untuk seleksi bakteri asam laktat, produksi galaktosidase, karakterisasi ß-galaktosidase, dan uji aktivitas ß-galaktosidase adalah media MRS cair, Lactobacillus bulgaricus yang berasal dari koleksi biakan
bakteri Bidang Mikrobiologi LIPI Cibinong, nitrofenil-ß-D-galaktopiranosida (oNPGal), o-nitrofenol (oNP), buffer fosfat 0.1 M pH 7, buffer fosfat 0.01 M pH 7, buffer fosfat 0.1 M pH 4.5-8, dan Na2CO3 1 M.
Alat-alat yang digunakan untuk isolasi bakteri asam laktat adalah tabung reaksi steril, cawan petri, sudip, mortar, batang kaca penyebar, mikropipet, jarum ose, bunsen,
laminar air flow, inkubator Isuzu, dan autoklaf Hiclave. Alat-alat yang digunakan untuk
seleksi bakteri asam laktat, produksi ß-galaktosidase, karakterisasi ß-ß-galaktosidase, dan uji aktivitas ß-galaktosidase adalah
microtiter plate, mikropipet, tabung reaksi,
erlenmeyer, termometer, neraca analitik, vorteks, penangas air Memmert, penangas es,
stopwatch, kuvet, pH meter HM-25G TOADKK, spektrofotometer UV-Vis 1700
Shimadzu, inkubator Isuzu, botol sentrifus, High Speed Refrigerated Centrifuge 6500 KUBOTA, dan sonikator Eyela.
Metode
Penyiapan Media Tumbuh Bakteri Asam Laktat (Man et al. 1960)
Sebanyak 1 g pepton, 0.8 g beef extract, 0.4 g yeast extract, 2 g laktosa, 0.1 ml Tween 80, 0.2 g Na2HPO4, 0.5 g CH3COONa.3H2O, 0.2 g
triamonium sitrat, 0.02 g MgSO4.7H2O, dan
0.005 g MnSO4 dilarutkan ke dalam 100 ml
akuades dalam labu erlenmeyer, pHnya diatur hingga 6.2 dan ditambahkan 2 g bakto agar. Selanjutnya larutan dipanaskan hingga homogen, ditutup sumbat kapas, lalu disterilisasi menggunakan autoklaf pada suhu 121 °C selama 15 menit. Setelah itu larutan dituangkan ke cawan petri.
Isolasi dan Pemurnian Bakteri Asam Laktat dari Makanan Hasil Fermentasi (Misgiyarta & Widowati 2002)
Sampel makanan hasil fermentasi sebanyak 1 ml atau 1 gram ditambahkan ke dalam 9 ml akuades steril (merupakan pengenceran 10-1). Pengenceran dilakukan secara berseri hingga pengenceran 10-7. Masing-masing pengenceran diambil 100 µl dan disebar dengan menggunakan batang kaca penyebar pada media MRS agar yang telah padat pada cawan petri. Selanjutnya diinkubasi selama 48 jam, suhu 37 °C. Koloni-koloni yang terpisah dan berbeda bentuk dimurnikan dengan metode cawan gores dengan cara 1 ose koloni bakteri digoreskan pada media MRS agar, setelah itu diinkubasi selama 48 jam, suhu 37 °C. Koloni murni yang tumbuh diambil 1 ose kemudian digoreskan secara zig zag ke dalam media MRS agar miring kemudian diinkubasi selama 48 jam pada suhu 37 °C.
Seleksi Bakteri Asam Laktat Penghasil ß-Galatosidase (Lapage et al. modifikasi 1973)
Sebanyak 1000 µl oNPGal dan 1 ose isolat bakteri asam laktat dimasukkan ke dalam
microtiter plate. Suspensi isolat kemudian
diinkubasi selama 48 jam pada suhu 37 °C. Setelah inkubasi selesai, suspensi isolat ditambahkan 2500 µl Na2CO3 1 M lalu
dianalisis menggunakan spektrofotometer UV VIS pada panjang gelombang 420 nm.
Produksi ß-Galaktosidase (Huang et al. 1993)
Sebanyak 2% inokulum bakteri asam laktat dengan kerapatan optik 0.5 diinokulasikan ke dalam 900 ml media MRS yang telah steril, diinkubasi pada suhu 37 °C. Sel dipanen pada waktu fermentasi yang menunjukkan fase eksponensial. Setelah fermentasi selesai, cairan disentrifus dengan kecepatan 10000 g selama 15 menit pada suhu 4 °C. Peletnya dilakukan pencucian sebanyak dua kali dengan buffer fosfat 0.1 M pH 7. Sebanyak 1 gram pelet yang diperoleh dilarutkan dalam 5 ml buffer fosfat 0.1 M pH 7 kemudian dilakukan pemecahan sel dengan sonikator selama 5 menit pada suhu 4 °C. Selanjutnya suspensi sel disentrifus dengan kecepatan 10000 g selama 15 menit pada suhu 4 °C. Supernatan yang diperoleh merupakan cairan enzim ß-galaktosidase.
Uji Aktivitas ß-Galatosidase (Marteau et al. modifikasi 1990)
Uji aktivitas ß-galatosidase dilakukan dengan cara sebanyak 1000 µl buffer fosfat 0.1 M pH 7 dan 100 µl enzim dimasukkan ke
6
dalam tabung reaksi lalu diinkubasi pada suhu 37 °C selama 5 menit. Kemudian ditambahkan 200 µl o-nitrofenil-ß-D-galaktopiranosida (oNPGal) 4 mg/ml dan diinkubasi pada suhu 37 °C selama 15 menit. Pada menit ke-15 ditambahkan 1000 µl Na2CO3 1 M. Larutan
dianalisis menggunakan spektrofotometer UV VIS pada panjang gelombang 420 nm. Aktivitas enzim (U/ml) didefinisikan sebagai jumlah µmol o-nitrofenol (oNP) yang dibentuk per menit per mililiter enzim pada kondisi percobaan. Aktivitas (U/ml) =
t
V
NP mikromol o Keterangan:V = Volume enzim yang diuji (0.1 ml) t = Waktu inkubasi (menit)
Karakterisasi ß-Galaktosidase
Penentuan Waktu Inkubasi Optimum.
Optimasi waktu inkubasi dilakukan dengan uji aktivitas enzim ß-galaktosidase pada berbagai variasi waktu yaitu 0, 5, 10, 15, 20, 25, dan 30 menit. Aktivitas tertinggi berdasarkan uji aktivitas ß-galaktosidase (Marteu et al. modifikasi 1990) merupakan waktu inkubasi optimum enzim ß-galaktosidase.
Penentuan Suhu Optimum. Penentuan
suhu optimum dilakukan dengan uji aktivitas enzim pada berbagai variasi suhu, yaitu 34, 37, 40, 43, 46, dan 49 °C. Pengujian aktivitas dilakukan pada waktu inkubasi optimum. Aktivitas tertinggi berdasarkan uji aktivitas ß-galaktosidase (Marteu et al. modifikasi 1990) menunjukkan suhu optimum enzim ß-galaktosidase.
Penentuan pH Optimum. Optimasi pH
dilakukan dengan menggunakan buffer fosfat dan substrat yang diatur pada kisaran pH 4.5, 5.0, 5.5, 6.0, 6.5, 7.0, 7.5, dan 8.0. Pengujian aktivitas dilakukan pada suhu dan waktu inkubasi optimum. Aktivitas tertinggi berdasarkan uji aktivitas ß-galaktosidase (Marteu et al. modifikasi 1990) menunjukkan pH optimum enzim ß-galaktosidase.
Penentuan Aktivitas Optimum Enzim Galaktosidase. Penenentuan aktivitas
ß-galaktosidase dilakukan dengan metode Marteu et al. modifikasi (1990) dilakukan pada waktu inkubasi, suhu, dan pH optimum.
Penentuan Kinetika Enzim. Analisis KM
dan Vmaks melalui uji aktivitas ß-galaktosidase
(Marteu et al. modifikasi 1990) dilakukan pada waktu inkubasi, suhu, dan pH optimum dengan berbagai variasi konsentrasi ONPG yang diujikan adalah 0.1, 0.5, 1, 2, 4, 6, 8, 10, 15, dan 20 mg/ml.
Analisis Statistik
Analisis statistik yang digunakan adalah rancangan faktorial dalam Rancangan Acak Lengkap (RAL) satu faktor. Penelitian ini dilakukan dengan tiga kali ulangan. Model linier (Matjik & Sumertajaya 2000) yang digunakan adalah:
Yij = µ + ?i + eij
keterangan:
= Pengaruh rataan umum
?i = Pengaruh aktivitas ß-galaktosidase isolat ke-i
ij = Pengaruh galat aktivitas ß-galaktosidase ke-i dan ulangan ke-j, j = 1,2,3
i = 1 isolat terseleksi
i = 2 bakteri pembanding L. bulgaricus Data yang diperoleh dianalisis dengan
Analysis of Variance (ANOVA) pada tingkat
kepercayaan 95% dan taraf 0.05. Analisis data dilakukan dengan program SPSS 10.0.
HASIL DAN PEMBAHASAN
Isolasi dan Pemurnian Bakteri Asam Laktat dari Makanan Hasil Fermentasi
Isolat yang diperoleh diisolasi dari makanan hasil fermentasi meliputi susu fermentasi, keju, sayuran, dan buah-buahan yang difermentasi. Isolat bakteri dari suatu bahan yang mengandung campuran mikroba dapat dilakukan isolasi dengan beberapa metode. Menurut Lay (1994), secara umum terdapat tiga metode untuk mengisolasi mikroba menjadi biakan murni, yaitu teknik penggoresan agar, agar tuang, dan agar sebar. Penelitian ini menggunakan metode agar sebar untuk mengisolasi bakteri.
Tahap awal isolasi, sampel makanan hasil fermentasi diencerkan terlebih dahulu dengan akuades steril selanjutnya ditumbuhkan di dalam media MRS agar, yang merupakan media selektif untuk pertumbuhan bakteri asam laktat, dengan cara disebar. Pengenceran yang dilakukan berkisar dari 10-1 sampai 10-7. Penyebaran suspensi bakteri yang telah diencerkan pada permukaan media MRS agar dengan alat penyebar yang terbuat dari gelas. Menurut Lay (1994), keuntungan dari teknik ini adalah pertumbuhan koloni akan menyebar sehingga memudahkan dalam pengambilan koloni bakteri.
Hasil pengamatan menunjukkan bahwa semakin besar faktor pengencerannya, jumlah isolat bakteri yang memiliki koloni tunggal semakin banyak. Hal ini disebabkan isolat memiliki ruang gerak yang lebih luas pada pengencerannya yang lebih tinggi. Setelah dilakukan isolasi bakteri asam laktat
7
selanjutnya dilakukan pemurnian isolat dengan metode cawan gores. Bakteri yang telah murni ini selanjutnya diamati morfologinya berupa bentuk koloni, bentuk tepian koloni, bentuk elevasi koloni, dan warna koloni. Gambar 3 menunjukkan morfologi koloni bakteri asam laktat dari makanan hasil fermentasi. Berdasarkan hasil isolasi diperoleh 13 isolat bakteri asam laktat. Kode AY merupakan isolat dari susu fermentasi. Kode AC merupakan isolat dari keju. Kode AM merupakan isolat dari sosis. Kode AV merupakan isolat dari sayuran yang difermentasi. Kode AF merupakan isolat dari buah yang difermentasi.
Gambar 3 Morfologi koloni bakteri asam laktat dari makanan hasil fermentasi.
Seleksi Bakteri Asam Laktat Penghasil ß-Galaktosidase
Aktivitas ß-galaktosidase dapat diketahui dengan menggunakan substrat laktosa untuk menentukan jumlah glukosa dan galaktosa yang terbentuk. Penentuan aktivitas ß-galaktosidase sering dilakukan dengan mengukur jumlah glukosa dan galaktosa yang terbentuk . Disamping laktosa sebagai substrat dapat juga digunakan o-nitrofenil-ß-galaktopiranosida (oNPGal). Laju dari reaksi tersebut dapat diikuti dengan memperkirakan jumlah kromogen o-nitrofenol yang terbentuk (Winarno 1999).
Seleksi bakteri asam laktat penghasil ß-galaktosidase dilakukan dengan cara menginkubasi isolat-isolat tersebut dengan o-nitrofenil-ß-D-galaktopiranosida di dalam
microtiter plate selama 48 jam. Setelah itu
ditambahkan Na2CO3 1 M sebagai penghenti
reaksi. Jumlah o-nitrofenol (oNP) yang terbentuk dideteksi dengan spektrofotometer dengan ? = 420 nm.
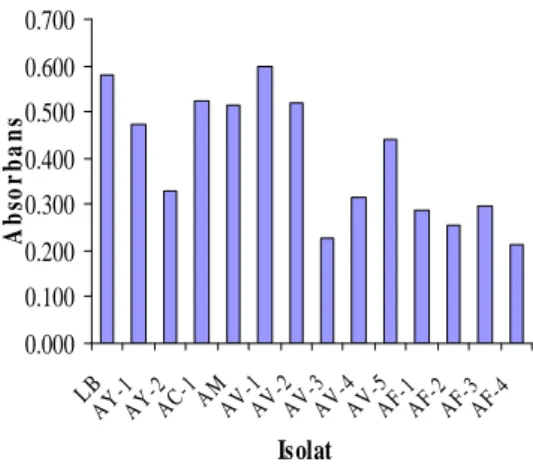
Gambar 4 menunjukkan absorbans dari seleksi 13 isolat bakteri asam laktat. Isolat yang mempunyai absorbans terbesar adalah isolat AV-1 sebesar 0.596. Absorbans isolat ini lebih besar daripada bakteri pembanding L.
bulgaricus sebesar 0.581. Isolat AV-1 dipilih
untuk pengujian aktivitas ß-galaktosidase karena berpotensi mempunyai aktivitas yang lebih tinggi dibandingkan bakteri pembanding
L. bulgaricus. 0.000 0.100 0.200 0.300 0.400 0.500 0.600 0.700 LB AY-1AY-2A C-1 AMAV-1AV-2AV-3AV-4AV-5AF-1AF-2AF-3AF-4 Isolat A b so r b a n s
Gambar 4 Hasil seleksi bakteri asam laktat penghasil ß-galaktosidase.
Produksi Enzim ß-Galaktosidase
Tahapan penelitian selanjutnya adalah produksi enzim dari isolat AV-1 dan L.
bulgaricus. Pada penelitian ini media yang
digunakan, yaitu media MRS dengan sumber karbon glukosa diganti dengan laktosa. Media ini merupakan media selektif untuk bakteri asam laktat. Laktosa sebagai sumber energi, karbon, dan induser enzim ß-galaktosidase (Kilara & Shahani 1975). Pepton dan beef
extract sebagai sumber karbon, nitrogen, dan
vitamin untuk pertumbuhan bakteri. Yeast
extract sebagai sumber vitamin dan asam
amino. Tween 80 sebagai surfaktan untuk membantu penyerapan nutrien oleh bakteri asam laktat. Magnesium sulfat dan mangan sulfat merupakan sumber kation yang digunakan untuk metabolisme (Man et al. 1960). Nutrisi-nutrisi tersebut dibutuhkan untuk pertumbuhan bakteri asam laktat. Pada saat produksi, bakteri berkembang biak dan menghasilkan enzim yang diinginkan.
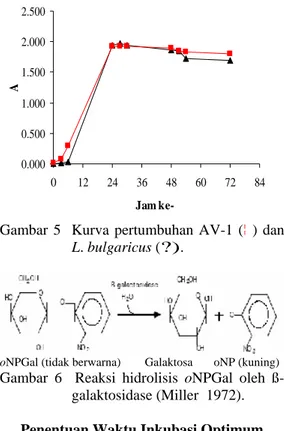
Pemanenan sel dilakukan pada saat fase eksponensial karena pembentukkan enzim terdapat pada fase tersebut. Oleh sebab itu, perlu dilakukan pengukuran pertumbuhan isolat-AV-1 dan L. bulgaricus selama 72 jam dengan menggunakan spektrofotometer pada panjang gelombang 600 nm. Gambar 5 menunjukkan fase eksponensial untuk isolat AV-1 setelah diinkubasi selama 3-27 jam sedangkan untuk L. bulgaricus berada pada 6-27 jam. Pada fase tersebut, sel membelah dengan laju konstan, masa menjadi dua kali lipat dengan laju yang sama, aktivitas
8
metabolik konstan, dan menghasilkan enzim untuk pertumbuhan (Pelczar & Chan 1986).
Pemanenan sel dilakukan dengan cara sentrifugasi dengan kecepatan 10000 g selama 15 menit pada suhu 4 °C, untuk mencegah kerusakan enzim. Dengan demikian, sel yang berbobot molekul lebih besar dari larutan media akan mengendap karena gaya gravitasi. Sel yang diperoleh kemudian dicuci dua kali dengan buffer fosfat 0.1 M pH 7 agar terbebas dari pengotor yang berasal dari media. Selanjutnya sel mengalami pemecahan sel dengan metode sonikasi. Metode ini bertujuan untuk memecah dinding sel dengan frekuensi gelombang suara yang besar. Sel dipecah di dalam buffer fosfat 0.1 M pH 7 pada suhu 4 °C agar enzim tidak rusak. Sel dipisahkan dari ekstrak enzim dengan sentrifugasi. Menurut Huang et al. (1993), enzim ß-galaktosidase pada bakteri asam laktat merupakan enzim intraseluler sehingga memerlukan pemecahan dinding sel.
Metode analisis aktivitas ß-galaktosidase pada penelitian ini menggunakan substrat o-nitrofenil-ß-galaktopiranosida (oNPGal). Dalam keadaan normal, oNPGal tidak
berwarna. Ketika ß-galaktosidase
menghidrolisis oNPGal maka akan
menghasilkan galaktosa dan o-nitrofenol (oNP). Reaksi ini dihentikan dengan penambahan Na2CO3 sehingga pH di dalam
larutan menjadi basa sekitar pH 10-11. Pada pH tersebut oNP akan berubah menjadi bentuk anionik yang berwarna kuning dan ß-galaktosidase menjadi inaktif (Gambar 6). Jumlah oNP sebanding dengan jumlah ß-galaktosidase yang bereaksi sehingga intensitas warna kuning yang dihasilkan dari
oNP dapat digunakan untuk menentukan
konsentrasi enzim. Jumlah oNP yang terbentuk dapat dideteksi dengan spektrofotometer pada ? = 420 nm (Miller 1972). Pengukuran aktivitas enzim dengan metode Marteau et al. modifikasi (1990) menunjukkan aktivitas enzim ß-galaktosidase untuk isolat AV-1 dan
L. bulgaricus masing-masing sebesar 0.095
U/ml dan 0.088 U/ml. Menurut Bury et al. (2001), L. bulgaricus 11842 mempunyai aktivitas ß-galaktosidase sebesar 1.08 U/ml. Aktivitas ß-galaktosidase dari L. bulgaricus hasil percobaan lebih kecil dibandingkan L.
bulgaricus 11842 karena enzim yang berasal
dari hasil percobaan belum mengalami purifikasi sehingga aktivitasnya rendah.
Berdasarkan hasil percobaan, diperoleh nilai aktivitas enzim rata-rata kecil. Hal ini disebabkan dalam ekstrak enzim kasar tersebut masih banyak terdapat enzim lain selain enzim
ß-galaktosidase. Selain itu, waktu dan kondisi yang diukur belum optimum untuk setiap isolat tersebut sehingga perlu dicari kondisi optimum untuk mengetahui aktivitas tertinggi dari mikroorganisme penghasilnya. Berdasarkan hasil yang diperoleh, isolat AV-1 mempunyai aktivitas ß-galaktosidase lebih tinggi dari L.
bulgaricus. 0.000 0.500 1.000 1.500 2.000 2.500 0 12 24 36 48 60 72 84 Jam ke-A
Gambar 5 Kurva pertumbuhan AV-1 (¦ ) dan
L. bulgaricus (?).
oNPGal (tidak berwarna) Galaktosa oNP (kuning) Gambar 6 Reaksi hidrolisis oNPGal oleh
ß-galaktosidase (Miller 1972).
Penentuan Waktu Inkubasi Optimum
Aktivitas enzim juga dipengaruhi oleh waktu inkubasi. Waktu inkubasi merupakan waktu yang diperlukan oleh enzim untuk berikatan dengan substrat. Menurut Winarno (1999), semakin lama reaksi antara enzim dengan substrat, jumlah produk yang dihasilkan semakin meningkat. Jumlah enzim bebas semakin lama semakin menurun hingga suatu batas dimana jumlah enzim konstan. Jumlah kompleks enzim-substrat pun meningkat seiring dengan lamanya waktu, namun berhenti hingga suatu batas dimana pembentukannya telah jenuh. Setelah jenuh, penambahan waktu tidak berpengaruh terhadap jumlah kompleks enzim-substrat yang terbentuk dan jumlah enzim bebas.
Penentuan waktu inkubasi dilakukan pada 0, 5, 10, 15, 20, 25, dan 30 menit. Gambar 7 menunjukkan pembentukkan oNP untuk isolat AV-1 dan L. bulgaricus meningkat hingga menit ke-25. Jumlah kompleks enzim-substrat meningkat seiring dengan lamanya waktu hingga tercapai titik optimum. Aktivitas enzim ß-galaktosidase untuk isolat AV-1 dan L.
9
bulgaricus mencapai optimum pada menit
ke-25 dengan pembentukkan oNP masing-masing sebesar 0.226 µmol dan 0.201 µmol. Setelah titik optimum, aktivitasnya menurun karena daya katalitiknya habis atau substrat sudah habis sehingga enzim mengalami kejenuhan.
0.000 0.050 0.100 0.150 0.200 0.250 0 5 10 15 20 25 30 35
Waktu Inkubasi (menit)
m ik r o m o l o N P
Gambar 7 Penentuan waktu inkubasi optimum ß-galaktosidase isolat AV-1 ( ) dan
L. bulgaricus (¦ ).
Penentuan Suhu Optimum
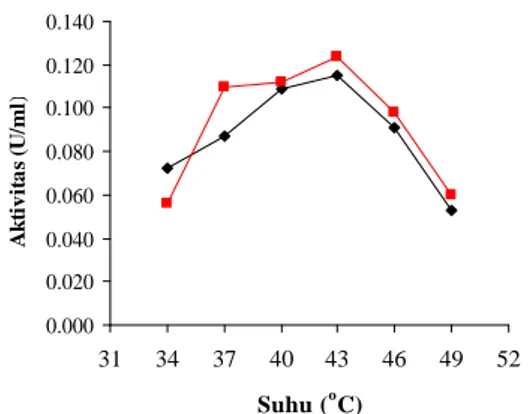
Suhu merupakan salah satu faktor yang mempengaruhi kinerja enzim. Penentuan suhu optimum dilakukan pada suhu 34, 37, 40, 43, 46, dan 49 °C. Gambar 8 menunjukkan aktivitas ß-galaktosidase pada isolat AV-1 dan isolat L. bulgaricus meningkat hingga suhu 43 °C. Sebelum suhu optimum, aktivitas enzim meningkat karena terjadi peningkatan energi kinetik yang mempercepat gerak vibrasi, translasi, serta rotasi enzim dan substrat sehingga memperbesar peluang keduanya untuk saling bertumbukan. Suhu optimum enzim ß-galaktosidase pada isolat AV-1 dicapai pada suhu 43 °C dengan nilai aktivitas 0.115 U/ml sedangkan suhu optimum enzim ß-galaktosidase dari L. bulgaricus dicapai pada 43 °C dengan aktivitas sebesar dan 0.124 U/ml. Pada suhu setelah suhu optimum, aktivitas enzim menurun karena enzim adalah molekul protein yang dapat terdenaturasi pada suhu tinggi. Peningkatan suhu hingga batas tertentu dapat menyebabkan semakin meningkatnya aktivitas katalitik enzim dan semakin bertambahnya kerusakan enzim (Palmer 1991).
Sebagai perbandingan, suhu optimum ß-galaktosidase dari bakteri asam laktat seperti
Lactobacillus murinus (Macias et al. 1983) dan Pediococcus (Bhowmik & Marth 1990) sekitar
45 °C. Bakteri L. bulgaricus (Itoh et al. 1980) dan Streptococcus thermophillus (Hemme et
al. 1993 dalam Huang et al. 1993) sekitar
55-57 °C. Suhu optimum ß-galaktosidase dari
Leuconostoc mesenteroides dari 43-58 °C
(Huang et al. 1993). 0.000 0.020 0.040 0.060 0.080 0.100 0.120 0.140 31 34 37 40 43 46 49 52 Suhu (oC) A k ti v it a s (U /m l)
Gambar 8 Pengaruh suhu terhadap aktivitas enzim ß-galaktosidase isolat AV-1 ( ) dan L. bulgaricus (¦ ).
Penentuan pH Optimum
Reaksi enzim dipengaruhi oleh pH. Peningkatan pH sebelum titik optimum menyebabkan terus meningkatnya aktivitas enzim, sampai seluruh enzim berikatan dengan substrat membentuk kompleks enzim-substrat. Kelebihan ion H+ dapat berikatan dengan sisi aktif enzim atau sisi lain enzim yang bermuatan positif, akibatnya akan terjadi tolakan muatan yang sama sehingga menagkibatkan struktur enzim terbuka.
Terbukanya struktur enzim dapat
mengakibatkan perubahan konformasi pada sisi aktif enzim. Bila sisi aktif enzim tidak sama dengan substrat, maka reaksi tidak akan terjadi. Adanya ion OH- dapat bereaksi dengan gugus karboksil pada sisi aktif, sehingga muatan enzim menjadi berubah dan berubah pula pH pada enzim. Hal ini menyebabkan tidak terjadinya ikatan antara substrat dan sisi aktif enzim, akibatnya terjadi penurunan aktivitas (Palmer 1991).
Gambar 9 memperlihatkan bahwa pada kondisi mendekati pH 6.5 (pH 4.5 sampai pH 6), aktivitas enzim ß-galaktosidase pada isolat AV-1 cenderung meningkat dan mencapai optimum pada pH 6.5 dengan nilai aktivitas masing-masing 0.128 U/ml. L. bulgaricus pada kondisi mendekati pH 6 aktivitas cenderung meningkat. Aktivitas optimum enzim ß-galaktosidase dicapai pada pH 6 dengan nilai aktivitas sebesar 0.130 U/ml. Pada kondisi pH tersebut sisi aktif enzim sudah seluruhnya berikatan dengan substrat membentuk kompleks enzim-substrat. Menurut Lehninger (1994), pada pH optimum, gugus penerima proton yang penting pada sisi aktif berada dalam tingkat ionisasi yang diinginkan. Peningkatan pH diatas batas optimum kerja enzim menyebabkan kerja enzim menurun, karena terjadi denaturasi enzim atau perubahan
10
struktur tiga dimensi molekul enzim. Aktivitas ß-galaktosidase pada isolat AV-1 terus menurun mulai pH 7 sedangkan penurunan aktivitas enzim ini dari L. bulgaricus mulai pH 6.5. Aktivitas enzim masih ditemukan hingga pH 8 walaupun kemampuan enzim untuk menghidrolisis substrat sudah mulai menurun.
Sebagai perbandingan, pH optimum aktivitas enzim ß-galaktosidase dari
Leuconostoc sekitar 7.2 (Huang et al. 1993), Lactobacillus sekitar 5.2 sampai 6.8 (Cesca et al. 1984), dan Pediococcus sekitar 6.5 (Bhowmik & Marth 1990).
0.000 0.020 0.040 0.060 0.080 0.100 0.120 0.140 4.5 5.0 5.5 6.0 6.5 7.0 7.5 8.0 pH A k ti v it a s (U /m l)
Gambar 9 Pengaruh pH terhadap aktivitas enzim ß-galaktosidase isolat AV-1 ( ) dan L. bulgaricus (¦ ).
Aktivitas ß-Galaktosidase pada Kondisi Optimum
Aktivitas ß-galaktosidase isolat AV-1 dan
L. bulgaricus dengan menggunakan metode
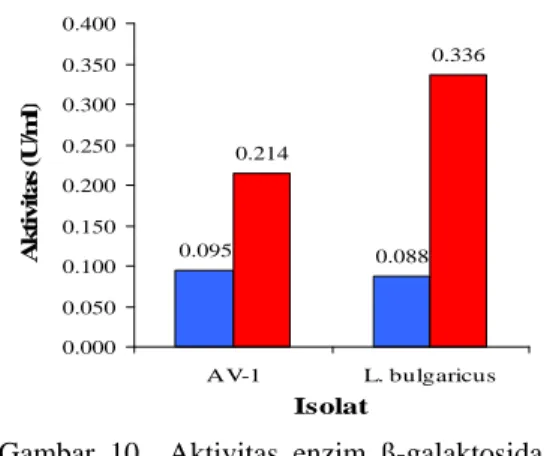
Marteau et al. modifikasi (1990) masing-masing sebesar 0.095 U/ml dan 0.088 U/ml. Setelah dilakukan penentuan kondisi optimum berupa waktu inkubasi, suhu, dan pH diperoleh aktivitas enzim ß-galaktosidase yang lebih tinggi (Gambar 10). Enzim ß-galaktosidase dari isolat AV-1 mempunyai kondisi optimum pada waktu inkubasi 25 menit, suhu 43 °C, dan pH 6.5 dengan aktivitas sebesar 0.214 U/ml. Enzim ß-galaktosidase dari isolat L. bulgaricus mempunyai kondisi optimum pada
waktu inkubasi 25 menit, suhu 43 °C, dan pH 6 dengan aktivitas sebesar 0.336 U/ml.
Berdasarkan pengujian statistik menunjukkan aktivitas ß-galaktosidase dari isolat AV-1 berbeda nyata (a = 0.05) dengan aktivitas ß-galaktosidase dari isolat L. bulgaricus dengan nilai berturut-turut 0.214
U/ml dan 0.336 U/ml. Aktivitas enzim ß-galaktosidase dari isolat AV-1 lebih rendah dibandingkan aktivitas enzim yang dihasilkan
L. bulgaricus. 0.095 0.088 0.214 0.336 0.000 0.050 0.100 0.150 0.200 0.250 0.300 0.350 0.400 AV-1 L. bulgaricus Isolat A k ti v it a s (U /m l)
Gambar 10 Aktivitas enzim ß-galaktosidase sebelum (¦ ) dan sesudah (¦ ) optimasi.
Parameter Kinetik (KM dan vmaks)
Gambar 11 menunjukkan kurva Michaelis Menten dari isolat AV-1 dan L. bulgaricus. Konsentrasi substrat yang amat rendah menyebabkan kecepatan reaksi amat rendah tetapi kecepatan akan meningkat dengan meningkatnya konsentrasi substrat. Pada akhirnya, akan tercapai titik batas, dan setelah titik ini dilampaui, kecepatan reaksi hanya akan meningkat sedemikian kecil dengan bertambahnya konsentrasi substrat. Pada batas ini, enzim menjadi jenuh oleh substratnya dan tidak dapat berfungsi lebih cepat.
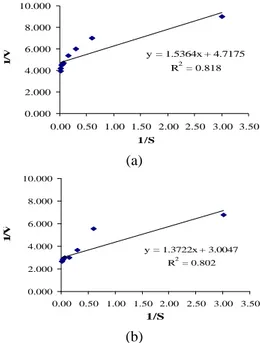
Penentuan nilai KM dan vmaks secara lebih
tepat dan mudah dilakukan pemetaan data dengan memanfaatkan transformasi aljabar persamaan Lineweaver Burk (Gambar 12). Persamaan Lineweaver Burk untuk isolat AV-1 adalah y = 1.5364x + 4.7175 dengan nilai r2 sebesar 0.8182 sehingga kecepatan maksimum aktivitas ß-galaktosidase sebesar 0.212 U/ml dan nilai KM sebesar 0.326 mM.
Pada isolat L. bulgaricus, peningkatan konsentrasi substrat juga meningkatkan kecepatan reaksi. Persamaan Lineweaver Burk untuk L. bulgaricus adalah y = 1.3722x + 3.0047 dengan nilai r2 sebesar 0.802 sehingga kecepatan maksimum aktivitas ß-galaktosidase
L. bulgaricus sebesar 0.333 U/ml dengan nilai
KM sebesar 0.457 mM. 0.000 0.050 0.100 0.150 0.200 0.250 0.300 0.350 0.400 0 10 20 30 40 50 60 70 [Substrat] (mM ) A k ti v it a s (U /m l)
Gambar 11 Kurva Michaelis Menten dari isolat AV-1 ( ) dan L. bulgaricus (¦ ).
11
Semakin rendah nilai KM maka semakin
kuat ikatan antara enzim dan substrat. Dengan mengetahui nilai KM dan vmaks maka kecepatan
reaksi suatu enzim pada setiap konsentrasi substrat dapat dihitung. Selain itu, dengan mengetahui nilai KM dapat mengetahui enzim
tersebut berikatan kuat dengan substrat atau ikatannya lemah, yang berarti dapat diketahui kesesuaian enzim dengan substrat yang diberikan (Winarno 1999). Berdasarkan nilai diatas, nilai KM enzim ß-galaktosidase dari
isolat AV-1 lebih kecil dibandingkan nilai KM
dari L. bulgaricus sehingga ß-galaktosidase dari isolat AV-1 lebih kuat mengikat substrat daripada enzim enzim ß-galaktosidase yang dihasilkan dari L. bulgaricus. Nilai KM yang
rendah ini, menyebabkan energi yang diperlukan untuk memulai terjadinya reaksi enzimatik lebih sedikit sehingga reaksi lebih mudah terjadi. y = 1.5364x + 4.7175 R2 = 0.818 0.000 2.000 4.000 6.000 8.000 10.000 0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 1/S 1 /V (a) y = 1.3722x + 3.0047 R2 = 0.802 0.000 2.000 4.000 6.000 8.000 10.000 0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 1/S 1 /V (b)
Gambar 12 Kurva Lineweaver Burk (a) isolat AV-1 (b) L. bulgaricus.
SIMPULAN DAN SARAN
Simpulan
Isolasi bakteri asam laktat dari makanan hasil fermentasi mendapatkan 13 isolat yang dapat menghasilkan ß-galaktosidase dengan aktivitas ß-galaktosidase tertinggi pada isolat AV-1. Enzim ß-galaktosidase dari isolat AV-1 mempunyai kondisi optimum pada waktu inkubasi 25 menit, suhu 43 °C, dan pH 6.5 dengan aktivitas sebesar 0.214 U/ml. Enzim ß-galaktosidase dari L. bulgaricus mempunyai kondisi optimum pada waktu inkubasi 25 menit, suhu 43 °C, dan pH 6 dengan aktivitas
sebesar 0.336 U/ml. Aktivitas ß-galaktosidase isolat AV-1 dengan isolat L. bulgaricus secara analisis statistik berbeda nyata (a = 0.05).
Parameter kinetik (vmaks dan KM) enzim
ß-galaktosidase isolat AV-1 sebesar 0.212 U/ml dan 0.326 mM sedangkan untuk bakteri
L. bulgaricus sebesar 0.333 U/ml dan 0.457
mM.
Saran
Perlu dilakukan purifikasi enzim tingkat lanjut sehingga nilai aktivitas yang dihasilkan tinggi. Karakterisasi enzim ß-galaktosidase yang telah dilakukan terhadap isolat AV-1 perlu didukung informasi lain dengan penentuan aktivator, inhibitor, pengaruh pelarut organik, dan bobot molekul. Selain itu, perlu dilakukan identifikasi jenis bakteri isolat AV-1.
DAFTAR PUSTAKA
Amano Enzyme. 2007. Lactase. [terhubung berkala]. http://www.amanoenzyme.co.jp /eng/enzyme/23.html. [6 Maret 2008]. Apandi. 1984. Teknologi Buah dan Sayuran.
Bandung: Alumni.
Belitz HD, Grosch W. 1986. Food Chemistry. Germany: Springer Verlag.
Bhowmik T, Marth EH. 1990. ß-Galactosidase of Pediococcus sp.: induction, purification, and partial characterization. J
Appl Environ Biotechnol 33:317-323.
Boyer R. 2002. Concepts in Biochemistry. United States: Brook Cole.
Buchanan RE, Gibbons. 1975. Bergey’s
Manual of Determinative Bacteriology.
Baltimore: Woverly.
Buckle KA, Edwards RA, Fleet GH, Wootton M. 1985. Ilmu Pangan. Purnomo H, Adiono, penerjemah. Jakarta : UI Pr. Terjemahan dari: Food Science.
Bury D, Geciova J, Jelen P. 2001. Effect of yeast extract supplementation on ß-galactosidase activity of Lactobacillus
delbrueckii subsp. bulgaricus 11842
grown in whey. Chech J Food Sci 19:166-170.
Campbell et al. 2005. The molecular basis of lactose intolerance. Science Progress 88:157-202.
Cesca et al. 1984. ß-D-Galactosidase of
12
Chaplin M. 2004. The use of lactases in dairy industry. [terhubung berkala]. http://www. lsbu.ac.uk/biology/enztech/lactase.html. [1 Maret 2008].
Crueger W, Crueger A. 1982. Biotechnology: a
Textbook of Industrial Microbiology.
Wiesbaden: Science Tech.
Dixon M, Webb EC. 1978. Enzymes. New Yok: Academica Pr.
Fellows P. 1992. Food Processing Technology
Principles and Practice. New York: Ellis
Horwood.
Fox PF, McSweeney PLH. 1981. Dairy
Chemistry and Biochemistry. London:
Blackie Academic and Professional. Huang DQ, Prevost H, Divies C. 1995.
Principal characteristics of ß-galactosidase from Leuconostoc spp. J Int Dairy 5:29-43.
IUBMB Enzyme Nomenclature. 1980. EC 3.2.1.23. [terhubung berkala]. http://www. chem.qmul.ac.uk/iubmb/enzyme/EC3/2/1/ 23.html. [6 Maret 2008].
Itoh T, Ohhashi M, Toba T, Adachi S. 1980. Purification and properties of ß-galactosidase from Lactobacillus bulgaricus. Milchwissenschaft
35:593-597.
Jay JM. 2000. Modern Food Microbiology. Maryland: Aspen.
Kilara A, Shahani KM. 1975. Lactase activity of cultured and acidified dairy products. J
Dairy Sci 59:2031-2035.
Lapage SP, Efstratiou A, Hill LR. 1973. The ortho-nitrophenol (oNP) test and acid from lactose in Gram-negative genera. J
Clin Path 26:821-825.
Lay BW. 1994. Analisis Mikroba di Laboratorium. Jakarta: Raja Grafindo
Persada.
Lehninger AL. 1994. Dasar-Dasar Biokimia. Thenawidjaja M, penerjemah. Jakarta : Erlangga. Terjemahan dari: Principles of
Biochemistry.
Macias N de et al. 1983. Isolation and purification of ß-galactosidase of L.
murinus CNRZ 313. Curr Microbiol
9:99-104.
Man JC de, Rogosa M, Sharpe ME. 1960. A medium for the cultivation of lactobacilli.
J Appl Bacteriol 23:130-135.
Marsh MN, Riley SA. 1998. Digestion and absorption of nutrients and vitamins.
Sleisenger and Fordtran’s Gastrointestinaland Liver Disease
26:1495-1496.
Marshall VME, Tamime AY. 1997.
Physiology and Biochemistry of Fermented Milks. New York: Chapman &
Hall.
Marteau et al. 1990. Effect of the microbial lactase (EC 3.2.1.23) activity in yoghurt on the intestinal absorption of lactose: an in vivo study in lactase-deficient humans.
Brit J Nutr 64:71-79.
Martin DW. 1981. Harper’s Review of
Biochemistry. California: Medical.
Miller J. 1972. Experiments in Molecular
Genetics. New York: Cold Spring Harbor
Laboratory.
Misgiyarta, Widowati S. 2002. Seleksi dan karakterisasi bakteri asam laktat indigenus. Di dalam: Bioteknologi. Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman;
Bogor, 20 Sep 2002. Bogor: Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian. hlm 374-381.
Palmer T. 1991. Understanding Enzymes. England: Ellis Horwood.
Pelczar MJ, Chan ECS. 1986. Dasar-Dasar
Mikrobiologi. Hadioetomo RS, Imas T,
Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements
of Microbiology.
Rusynyk AR, Still CD. 2001. Lactose intolerance. JAOA 101 :10-12
Stamer JR. 1980. Lactic Acid Bacteria. Wesport Connecticut: Avi.
Surono IS. 2004. Probiotik: Susu Fermentasi
dan Kesehatan. Jakarta: Tri Cipta Karya.
Szczodrak J. 2000. Hydrolysis of lactose in whey permeate by immobilized ß-galactosidase from Kluyveromyces fragilis. J Molecular Cat 10:631-637.
Tossaveinen O. 2003. Losing the lactose.
Dairy Industries International 68:23-26.
Tryland I, Fiskdal L. 1997. Enzyme characteristics of D-galactosidase and ß-D-glucuronidase-positive bacteria and their interference in rapid methods for detection of waterborne coliforms and
13
Escherichia coli. J Appl Environ Microbiol 64:1018-1023.
Wierzbicki LE, Kosikowski FV. 1973. Lactase potential of various microorganism grown in whey. J Dairy Sci 56:26-29.
Winarno FG. 1999. Enzim Pangan. Jakarta:
15
Lampiran 1 Kegiatan penelitian
Sumber isolat (makanan hasil fermentasi)
Isolasi dan pemurnian bakteri asam
laktat
Isolat-isolat bakteri asam laktat
Seleksi bakteri asam laktat penghasil
ß-galaktosidase
Isolat penghasil ß-galaktosidase
Produksi ß-galaktosidase dari isolat-isolat
Penentuan karakterisasi ß-galaktosidase (waktu inkubasi optimum, suhu optimum,
pH optimum, aktivitas optimum, K
M, dan V
maks)
16
Lampiran 2 Bentuk morfologi isolat bakteri asam laktat dari makanan hasil
fermentasi
Morfologi Koloni
Kode
Bentuk
Tepian
Elevasi
Warna
AY-1
bulat
licin
cembung
putih
AY-2
bulat
licin
datar
kuning
AC-1
bulat
licin
datar
putih
AM
bulat
licin
datar
putih
AV-1
bulat
licin
cembung
putih
AV-2
bulat
licin
datar
putih
AV-3
bulat
tak beraturan
datar
putih
AV-4
bulat
tak beraturan
cembung
putih
AV-5
bulat
berlekuk
cembung
putih
AF-1
bulat
licin
datar
putih
AF-2
bulat
licin
datar
kuning muda
AF-3
bulat
berlekuk
datar
putih
AF-4
bulat
licin
cembung
putih
Lampiran 3 Hasil seleksi bakteri asam laktat penghasil ß-galaktosidase
berdasarkan terbentuknya o-nitrofenol (oNP)
Absorbans
No.
Kode
ulangan
1
ulangan
2
ulangan
3
Absorbans
rerata1
LB
0.706
0.502
0.535
0.581
2
AY
10.347
0.489
0.578
0.471
3
AY
20.315
0.401
0.276
0.331
4
AC
10.638
0.382
0.549
0.523
5
AM
0.633
0.470
0.445
0.516
6
AV
10.703
0.413
0.673
0.596
7
AV
20.588
0.587
0.387
0.521
8
AV
30.228
0.209
0.247
0.228
9
AV
40.297
0.312
0.332
0.314
10
AV
50.421
0.359
0.536
0.439
11
AF
10.283
0.265
0.311
0.286
12
AF
20.275
0.240
0.246
0.254
13
AF
30.214
0.314
0.363
0.297
14
AF
40.218
0.213
0.212
0.214
‡Isolat bakteri asam laktat yang digunakan untuk analisis lebih lanjut adalah AV-1 karena absorbans yang dihasilkan paling tinggi. Bakteri pembanding yang digunakan adalah Lactobacillus