i
STUDI TOKSISITAS NIKEL [Ni] TERHADAP KONSUMSI
OKSIGEN, KONDISI HEMATOLOGI, HISTOPATOLOGI
DAN STRES SEKUNDER JUVENIL IKAN BANDENG
Chanos chanos
Forsskal
KADIR SABILU
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ii PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini, saya menyatakan bahwa Tesis Studi Toksisitas Nikel (Ni) terhadap Konsumsi Oksigen, Kondisi Hematologi, Histopatologi dan Stres Sekunder Juvenil Ikan Bandeng Chanos chanos [Forsskal] adalah karya saya sendiri dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2010
iii ABSTRACT
KADIR SABILU. Study On The Toxicity of Nickel to Oxygen Consumption, Haematological and Histopathological Condition and Secondary Stress of Juvenile Milkfish Chanos chanos [Forsskal] Juvenile. Under Direction of EDDY SUPRIYONO andSUKENDA.
A heavy metal, nickel has potential to cause toxic and affect blood cell, gill histopathological changes, and alter the cell chromosome. The aims of this experiment was to determine the potency of the nickel toxicity that expressed by median lethal concentration (LC50) and to analyze its sub-chronic level effect such as oxygen consumption, haematological condition, and blood glucose. This research was conducted in three steps : finding range test, acute test, and sub-chronic level test. Acute test was conducted in 5 concentration levels (0.00 ppm; 8.89 ppm; 15.81 ppm; 28.12 ppm and 50.01 ppm). Sub-chronic test was also conducted in 5 concentration levels (0.00 ppm; 0.12 ppm; 0.59 ppm; 1.19 ppm and 3.56 ppm) with 3 replications. Nickel concentration analysis was used Atomic Absorbption Spectroscopy (AAS). LC50 at exposure time 24, 48, 72, and 96 hours were 36.79 ppm, 23.54 ppm, 18.04 ppm, and 11.88 ppm, respectively. Oxygen consumption of milkfish juvenile at 3.56 ppm and 0.12 ppm of nickel concentration after 30 days of exposure time were 0.37±0.01 mgO2/grBW/hr and 0.73±0.10 mgO2/grBW/hr, respectively. These were lower than control (0.96±0.03 mgO2/grBW/hr). The longer exposure time the higher nickel concentration, it decrease oxygen consumption, haematocryte, haemoglobin and erythtrocyte. However, leukosit and blood glucose increase.
iv
RINGKASAN
KADIR SABILU. Studi Toksisitas Nikel (Ni) terhadap Konsumsi Oksigen, Kondisi Hematologi, Histopatologi dan Stres Sekunder Juvenil Ikan Bandeng Chanos chanos [Forsskal]. Dibimbing oleh EDDY SUPRIYONO dan SUKENDA.
Nikel merupakan salah satu jenis logam berat yang memiliki sifat toksik. Logam berat nikel dapat meracuni darah, menganggu sistem pernapasan, merusak jaringan, selaput lendir, dan mengubah sistem sel. Kegagalan produksi budidaya ikan pada perairan sekitar industri pertambangan nikel berpotensi disebabkan oleh nikel. Hal ini dimungkinkan dengan peningkatan kekeruhan pada perairan pesisir di lokasi pertambangan nikel. Perairan pesisir dengan potensi kandungan logam berat nikelnya pada akhirnya masuk ke petakan tambak ikan bandeng bersamaan dengan pasang air laut atau melalui pemompaan.
Penelitian ini bertujuan untuk mengetahui potensi toksisitas akut nikel yang diekspresikan oleh nilai LC50 nikel dan mengkaji pengaruh toksisitas nikel terhadap tingkat konsumsi oksigen, kondisi hematologi, histopatologi dan stres sekunder juvenil ikan bandeng. Penelitian ini dilaksanakan atas tiga tahap, yaitu: uji nilai kisaran, uji akut, dan uji sub-kronik. Ikan uji yang digunakan adalah ikan bandeng ukuran 6-7 cm, sedangkan logam berat nikel yang digunakan sebagai sumber toksikan dalam penelitian adalah nikel klorida (NiCl2
Hasil penelitian menunjukkan bahwa nikel memiliki sifat toksik yang tinggi terhadap juvenil ikan bandeng dengan nilai LC
). Wadah penelitian berupa akuarium berukuran 20 x 20 x 30 cm, yang diisi air laut dengan salinitas 15 ‰ sebanyak 10 liter. Analisis kadar nikel pada media percobaan menggunakan Atomic Absorption Spectroscopy (AAS). Pada uji akut, digunakan 5 taraf konsentrasi yaitu tanpa nikel (A); 8,89 ppm (B); 15,81 ppm (C); 28,12 ppm (D) dan 50,01 ppm (E). Selanjutnya pada uji sub-kronis, digunakan 5 taraf konsentrasi yaitu 0 ppm; 0,12 ppm; 0,59 ppm; 1,19 ppm dan 3,56 ppm.
v ikan uji menjadi kaku. Sedangkan akumulasi pada neuromusculer akan mengakibatkan kontraksi otot yang diikuti dengan kelemahan, hilangnya refleks dan paralisis. Toksisitas nikel berdampak merusak jaringan insang. Kerusakan insang disebabkan oleh berreaksinya ion Ni2+
Pada pengukuran parameter kualitas air, meskipun pada beberapa parameter terdapat perbedaan range, tetapi nilai tersebut masih memperlihatkan nilai kisaran yang layak untuk kehidupan ikan bandeng. Hal tersebut menunjukkan bahwa parameter kualitas air dalam penelitian ini bukan sebagai faktor pembatas yang mempengaruhi kehidupan ikan bandeng.
dengan lendir insang yang menyebabkan insang diselimuti oleh lendir yang mengandung nikel dan merusak struktur lamella. Toksisitas nikel juga berdampak menurunkan konsumsi oksigen dan menyebapkan penyimpangan hematologi. Pada konsentrasi 0,12 ppm, nikel menurunkan prosentase hematokrit, hemoglobin dan meningkatkan jumlah leukosit dan mulai pada konsentrasi 0,59 ppm menurunkan eritrosit dan meningkatkan rasio netrofil-limfosit serta mulai konsentrasi 1,19 ppm nikel meningkatkan kadar glukosa darah juvenil ikan bandeng.
vi © Hak cipta milik IPB, tahun 2010
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
vii
STUDI TOKSISITAS NIKEL (Ni) TERHADAP KONSUMSI
OKSIGEN, KONDISI HEMATOLOGI, HISTOPATOLOGI
DAN STRES SEKUNDER JUVENIL IKAN BANDENG
Chanos chanos
Forsskal
KADIR SABILU
Tesis
Sebagai salah satu syarat untuk untuk memperoleh gelar Magister Sains pada
Mayor Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
viii Judul Tesis : Studi Toksisitas Nikel (Ni) terhadap Konsumsi Oksigen,
Kondisi Hematologi, Histopatologi dan Stres Sekunder Juvenil Ikan Bandeng Chanos chanos Forsskal
Nama : Kadir Sabilu
NIM : C151080031
Disetujui Komisi Pembimbing
Dr.Ir. Eddy Supriyono, M.Sc
Ketua Anggota
Dr. Ir. Sukenda, M.Sc
Diketahui,
Ketua Mayor Dekan Sekolah Pascasarjana Ilmu Akuakultur
Prof. Dr. Enang Harris, M.S Prof.Dr.Ir. Khairil A. Notodiputro, M.S
ix KATA PENGANTAR
Sesunguhnya atas berkat dan karunia Allah SWT, sehingga proses perkuliahan dan penyusunan tesis dengan judul “Studi Toksisitas Nikel terhadap Konsumsi Oksigen, Kondisi Hematologi, Histopatologi dan Stres Sekunder Juvenil Ikan Bandeng Chanos chanos Forssk”, dapat terselesaikan dengan baik.
Ucapan terima kasih disampaikan kepada seluruh pihak yang telah memberikan doa, bantuan, motivasi dan dorongan untuk melakukan tugas belajar pada Program Magister Mayor Ilmu Akuakultur Institut Pertanian Bogor. Oleh karena itu, pada kesempatan ini penulis ingin menyampaikan terimakasih dan penghargaan yang tulus kepada :
1. Yth. Bapak Dr. Ir. Eddy Supriyono, M.Sc dan Bapak Dr. Ir. Sukenda, M.Sc sebagai komisi pembimbing, atas curahan waktu, perhatian, motivasi dan pikiran dalam penyusunan tesis ini
2. Yth. Bapak Prof. Dr. Enang Harris, M.S selaku penguji luar komisi dan selaku Ketua Mayor Ilmu Akuakultur atas saran dan masukan untuk kesempurnaan tesis ini.
3. Terimakasih pada istriku Wa Ode Jumiarni Manginsi, S.Si dan anakku Alya Fadilah atas segala doa, dukungan dan motifasi yang telah diberikan
4. Terimakasih yang tak terhingga kepada ayahanda La Sabilu dan ibunda Wa Enso, bapak mertua Amir dan ibu mertua Wa Ode Sitti Asmini dan semua keluarga atas segala doa, dukungan dan motivasi selama penulis menempuh studi.
5. BPPS-Direktorat Jendral Pendidikan Tinggi, Departemen Pendidikan Nasional Republik Indonesia, sebagai sponsor pendidikan penulis.
6. Rekan-rekan mahasiswa pascasarjana mayor Ilmu Akuakultur angkatan 2008 atas kebersamaan dan kerjasamanya
Penulis mohon maaf jika terdapat kekurangan di dalam tesis ini. Akhirnya, semoga karya ini dapat bermanfaat dan hanya kepada Allah SWT kita berserah diri, semoga amal dan ibadah kita senantiasa mendapat ridho-Nya, Amin.
x RIWAYAT HIDUP
Penulis dilahirkan di Sumpuo Kecamatan Tongkuno Kabupaten Muna Provinsi Sulawesi Tenggara pada tanggal 28 Agustus 1978 dari pasangan Bapak La Sabilu dan Ibu Wa Enso. Penulis merupakan anak kelima dari delapan bersaudara.
Pendidikan Sekolah Dasar diselesaikan penulis di SD Negeri No.1 Tongkuno, lulus tahun 1990, SMP Negeri Wakuru lulus tahun 1993 dan SMAN 1 Tongkuno lulus tahun 1996. Semuanya berada di Kabupaten Muna, Provinsi Sulawesi Tenggara. Pada tahun 1996, penulis diterima sebagai mahasiswa pada program studi Budidaya Perairan Jurusan Perikanan Fakultas Pertanian, Universitas Haluoleo melalui jalur Program Penelusuran Minat dan Bakat (PPMB). Selama studi di Unhalu, penulis mendapatkan beasiswa dari yayasan supersemar dan beasiswa berprestasi Asian Developement Bank (ADB). Penulis tamat dari Universitas Haluleo pada tahun 2002.
xi
2.1 Klasifikasi dan Morfologi ikan Bandeng ... 5
2.2 Logam Berat Nikel ... 6
2.3 Toksisitas Logam Berat ... 7
2.4 Toksisitas Logam Berat Nikel ... 9
2.5 Sistem Pernapasan Ikan ... 11
2.6 Pengaruh Toksisitas Nikel Terhadap Tingkat Konsumsi Oksigen ... 12
2.7 Pengaruh Toksisitas Nikel Terhadap Histopatologi ... 13
2.8 Pengaruh Toksisitas Nikel Terhadap Kondisi Hematologi Ikan.. 15
xii
3.7 Histologi Jaringan Insang dan Hati ... 30
3.8 Tingkat Kelangsungan Hidup ... 30
3.9 Laju Pertumbuhan ... 30
3.10 Parameter Kualitas Air ... 31
3.11 Analisis data ... 31
IV. HASIL DAN PEMBAHASAN ... 32
4.1 Hasil ... 32
4.2 Pembahasan Umum ... 56
V. KESIMPULAN DAN SARAN ... 64
5.1 Kesimpulan ... 64
5.2 Saran ... 64
DAFTAR PUSTAKA ... 65
xiii DAFTAR TABEL
Halaman 1 Sifat toksisitas nikel pada beberapa jenis ikan ... 11 2 Nilai kadar glukosa darah sebelum dan setelah diberi perlakuan stres
pada beberapa jenis ikan ... 21 3 Persentase tingkat kematian kumulatif juvenil ikan bandeng selama
uji nilai kisaranpemaparan nikel ... 32 4 Konsumsi oksigen juvenil ikan bandeng selama 30 hari pemaparan
nikel ... 37 5 Rata-rata hematokrit, hemoglobin, eritrosit, leuko sit dan N-L rasio
juvenil ikan bandeng setelah 30 hari pemaparan nikel ... 39 6 Perubahan histologi pada insang juvenil ikan bandeng selama 30 hari
pemaparan nikel ... 49 7 Perubahan histologi pada hati juvenil ikan bandeng selama 30 hari
pemaparan nikel ... 53 8 Pengaruh perbedaan konsentrasi terhadap variabel penelitian setelah
xiv DAFTAR GAMBAR
Halaman
1 Morfologi ikan bandeng ... 5 2 Bagian-bagian lamella insang ... 13 3 Ciri komponen leuko sit ... 19 4 Persentase tingkat kelangsungan hidup juvenil ikan bandeng selama
uji akut pemaparan nikel ... 33 5 Nilai LC-50 juvenil ikan bandengselama uji akut pemaparan nikel ... 35 6 Rata-rata frekuwensi pergerakan operculum juvenil ikan bandeng
selama uji akut pemaparan nikel ... 36 7 Konsumsi oksigen juvenil ikan bandengselama 30 hari pemaparan nikel ... 38 8 Rata-rata hematokrit juvenil ikan bandeng selama 30 hari pemaparan nikel 40 9 Rata-rata kadar haemoglobin juvenil ikan bandeng selama 30 hari
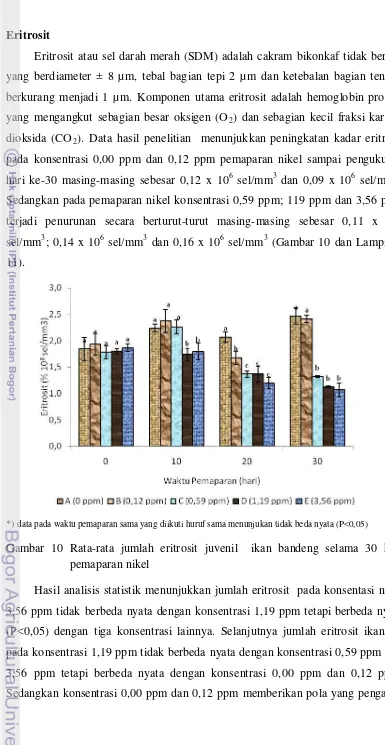
pemaparan nikel ... 41 10 Rata-rata jumlah eritrosit juvenil ikan bandeng selama 30 hari pemaparan
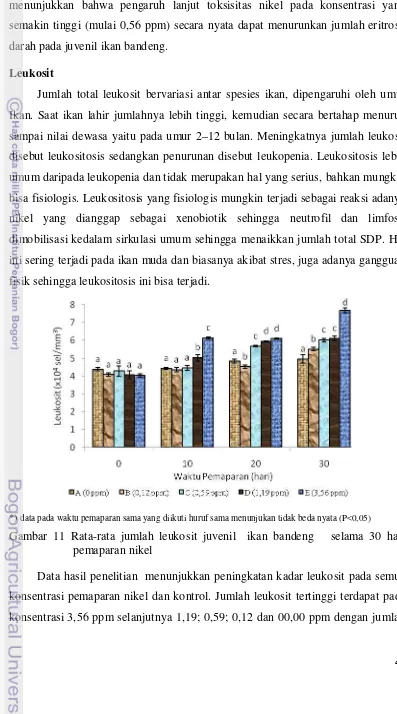
nikel ... 42 11 Rata-rata jumlah leukosit juvenil ikan bandeng selama 30 hari pemaparan
nikel ... 43 12 N-L rasio juvenil ikan bandeng selama 30 hari pemaparan nikel ... 44 13 Rata-rata kadar glukosa darah juvenil ikan bandeng selama 30 hari
pemaparan nikel ... 46 14 Pathologi insang : a) pengamatan hari ke-15, konsentrasi nikel 0 ppm
b) pengamatan hari ke-30, konsentrasi nikel 0 ppm ... 47 15 Pathologi insang : a) pengamatan hari ke-15, konsentrasi nikel 0,12 ppm;
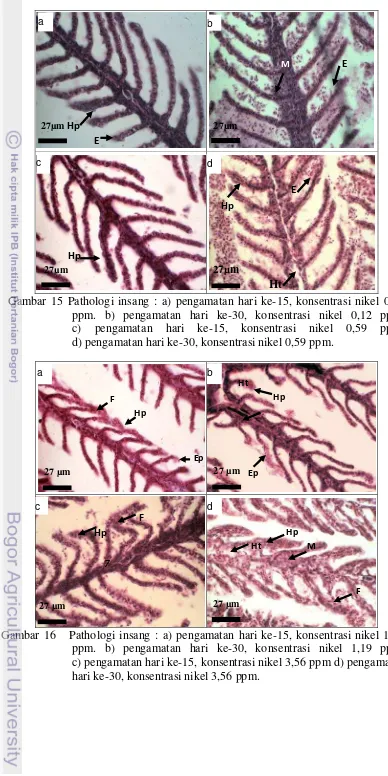
b) pengamatan hari ke-30, konsentrasi nikel 0,12 ppm; c) pengamatan hari ke-15, konsentrasi nikel 0,12 ppm; d) pengamatan hari ke-30, konsentrasi nikel 0,56 ppm ... 48 16 Pathologi insang : a) pengamatan hari ke-15, konsentrasi nikel 1,19 ppm;
b) pengamatan hari ke-30, konsentrasi nikel 1,19 ppm; c) pengamatan hari ke-15, konsentrasi nikel 3,56 ppm; d) pengamatan hari ke-30, konsentrasi nikel 3,56 ppm. ... 48 17 Pathologi hati : a) pengamatan hari ke-15, konsentrasi nikel 0 ppm;
xv
18 Pathologi hati : a) pengamatan hari ke-15, konsentrasi nikel 0,12 ppm; b) pengamatan hari ke-30, konsentrasi nikel 0,12 ppm; c) pengamatan hari ke-15, konsentrasi nikel 0,56 ppm; d) pengamatan hari ke-30, konsentrasi nikel 0,56 ppm ... 51 19 Pathologi hati : a) pengamatan hari ke-15, konsentrasi nikel 1,19 ppm;
b) pengamatan hari ke-30, konsentrasi nikel 1,19 ppm; c) pengamatan hari ke-15, konsentrasi nikel 3,56 ppm; d) pengamatan hari ke-30, konsentrasi nikel 3,56 ppm. ... 52 20 Pertumbuhan panjang juvenil ikan bandengselama 30 hari pemaparan
nikel ... 53 15 Laju pertumbuhan spesifik juvenil ikan bandeng selama 30 hari
pemaparan nikel ... 54 16 Tingkat kelangsungan hidup juvenil ikan bandengselama 30 hari
xvi DAFTAR LAMPIRAN
Halaman
1 Data mortalitas ikan pada uji nilai kisaran ... 73
2 Data mortalitas ikan pada uji akut ... 74
3 Out put analisis probit LC50-24 jam ... 75
4 Out put analisis probit LC50-48 jam ... 77
5 Output analisis probit LC50-72 jam ... 79
6 Output analisis probit LC50-96 jam ... 81
7 Rata-rata frekuwensi gerak operculum juvenil ikan bandeng selama uji akut pemaparan nikel ... 83
8 Analisis sidik ragam konsumsi oksigen juvenil ikan bandeng selama 30 hari pemaparan nikel ... 85
9 Analisis sidik ragam kadar hematokrit juvenil ikan bandeng selama 30 hari pemaparan nikel ... 87
10 Analisis sidik ragam kadar haemoglobin juvenil ikan bandeng selama 30 hari pemaparan nikel ... 89
11 Analisis sidik ragam jumlah eritrosit juvenil ikan bandeng selama 30 hari pemaparan nikel ... 91
12 Analisis sidik ragam jumlah leukosit juvenil ikan bandeng selama 30 hari pemaparan nikel ... 93
13 Analisis sidik ragam N-L rasio juvenil ikan bendengselama 30 hari pemaparan nikel ... 95
14 Analisis sidik ragam kadar glukosa darah juvenil ikan bandeng selama 30 hari pemaparan nikel ... 97
15 Analisis sidik ragam pertumbuhan panjang rata-rata juvenil ikan bandeng selama 30 hari pemaparan nikel ... 99
16 Analisis sidik ragam laju pertumbuhan spesifik juvenil ikan bandeng selama 30 hari pemaparan nikel ... 102
1
I. PENDAHULUAN
1.1.Latar Belakang
Indonesia dikenal sebagai negara pengekspor nikel dunia dan memiliki cadangan nikel mencapai 3,2 miliar ton atau lima persen dari cadangan nikel seluruh dunia. Pada tahun 2009 produksi ferronikel indonesia yaitu 12.550 metrik ton, dan produksi biji nikel 6,52 juta metrik ton. Sedangkan, produksi ferronikel dunia adalah 1,38 juta ton, dan konsumsinya adalah sebesar 1,3 juta ton. Produksi dan konsumsi nikel dunia meningkat dari tahun ke tahun, mencapai 2,4% pertahun (International Nickel Study Group 2009).
Nikel merupakan salah satu jenis logam berat yang memiliki sifat toksik. Logam berat nikel dapat meracuni darah, menganggu sistem pernapasan, merusak jaringan, selaput lendir, dan mengubah sistem sel. Pengaruh logam berat terhadap perubahan tingkah laku dan penyimpangan fisiologis tubuh organisme telah lama diketahui. Perubahan pola tingkah laku diekspresikan sebagai respon stres dan penyimpangan fisiologis akan menyebabkan fungsi jaringan tubuh terganggu dan komponen-komponen darah berubah. Oleh karena itu sejak tahun 2006, masyarakat Uni Eropa telah mengusulkan ke WTO untuk menetapkan nikel sebagai dangerous subtances (Abraham 2009). Sementara itu, berkaitan dengan sifat toksik nikel, pemerintah Indonesia melalui Surat Keputusan Menteri Negara Lingkungan Hidup nomor 09 tahun 2006, kemudian direvisi dengan Peraturan Menteri Negara Lingkungan Hidup nomor 03 tahun 2010 telah menetapkan baku mutu konsentrasi nikel di perairan pada kegiatan industri pertambangan nikel adalah 0,5 ppm.
Pengambilan awal logam berat oleh organisme air dapat melalui empat proses utama yakni melalui alat pernafasan, permukaan tubuh, mekanisme osmoregulasi dan melalui sistem pencernaan (Lawrence 2003). Beberapa hasil penelitian menunjukkan bahwa kematian ikan akibat logam berat (seperti : merkury, timbal, seng dan tembaga) terjadi karena bereaksinya kation logam berat dengan oksigen dan fraksi tertentu dari lendir, menganggu proses biokimia dalam darah dan merusak jaringan.
2 kurangnya jaminan penggunaan instalasi pengolahan air limbah yang sesuai dengan standar keselamatan lingkungan, terdapat sisa-sisa nikel di daerah pertambangan yang terbawa air hujan pada muara aliran sungai dan timbunan tanah mengandung biji nikel dan limbah tailing yang ditimbun di sekitar pesisir pantai. Hamzah (2009) menyatakan bahwa dampak yang dapat dilihat langsung akibat kegiatan pertambangan nikel adalah meningkatnya kekeruhan perairan pesisir di sekitar daerah penambangan, selanjutnya peningkatan kekeruhan tersebut berpotensi meningkatkan konsentrasi nikel dalam air tersebut. karena nikel memiliki sifat toksik, maka kehadiran nikel dalam perairan pada konsentrasi tertentu dapat menimbulkan efek toksik bagi ikan.
Penelitian tentang kandungan logam berat dalam tubuh ikan telah sering dilakukan. merkury (Hg), timbal (Pb), seng (Zn), tembaga (Cu) dan nikel (Ni) merupakan jenis-jenis logam berat yang telah teridentifikasi ditemukan dalam tubuh ikan bandeng (Purnomo dan Muhyiddin 2007; Fatahuddin dkk. 2003; Eva 2006). Peneliti di beberapa negara dunia seperti USA, Kanada, Belgia dan Nigeria, telah banyak melakukan penelitian tentang uji toksisitas logam berat nikel terhadap organisme perairan. Tetapi, penelitian tentang toksisitas logam berat nikel terhadap konsumsi oksigen dan perubahan biokimia dalam darah masih kurang atau belum pernah dilakukan. Oleh karena itu, perlu dilakukan penelitian untuk mengetahui pengaruh toksisitas nikel terhadap konsumsi oksigen, kondisi hematologi dan stres sekunder juvenil ikan bandeng (Chanos chanos
Forsskal).
1.2.Kerangka Pemikiran
3 limbah yang sesuai dengan standar keselamatan lingkungan, terdapat sisa-sisa nikel di daerah pertambangan yang terbawa air hujan pada muara aliran sungai dan timbunan tanah mengandung biji nikel dan limbah tailing yang ditimbun di sekitar pesisir pantai. Dampak yang dapat dilihat langsung adalah peningkatan kekeruhan pada perairan pesisir di lokasi pertambangan nikel (Hamzah 2009). Perairan pesisir dengan potensi kandungan logam berat nikelnya pada akhirnya masuk ke petakan tambak ikan bandeng bersamaan dengan pasang air laut atau melalui pemompaan. Pengambilan awal logam berat nikel oleh ikan bandeng dapat melalui empat proses utama yakni melalui alat pernafasan, permukaan tubuh, mekanisme osmoregulasi dan melalui sistem pencernaan. Karena sifat toksik nikel dapat meracuni darah, menganggu sistem pernapasan, merusak jaringan dan mengubah sistem sel, oleh karena itu kegagalan produksi pada kegiatan budidaya perikanan yang terjadi di sekitar kawasan penambangan nikel berpotensi disebabkan oleh logam berat ini. Dalam konsentrasi tertentu nikel dapat menyebabkan dampak toksisitas bagi ikan. Akumulasi logam berat dalam jaringan tubuh menyebabkan perubahan pola tingkah laku dan penyimpangan fisiologis tubuh. Oleh karena itu, dalam penelitian ini setelah didapatkan nilai LC50
1.3.Tujuan dan Manfaat
, dilanjutkan dengan uji sub-kronis untuk mengetahui pengaruh toksisitas nikel terhadap tingkat konsumsi oksigen, kondisi hematologi dan stres sekunder ikan uji.
Penelitian ini bertujuan untuk mengetahui potensi toksisitas akut nikel yang diekspresikan oleh nilai LC50
Penelitian diharapkan memberikan suatu hasil yang bermanfaat tentang tingkat toksisitas akut nikel, pengaruh sub-kronik yaitu tingkat konsumsi oksigen, kondisi hematologi, histologis dan stres sekunder juvenil ikan bandeng akibat peningkatan konsentrasi nikel dalam media. Lebih jauh dalam jangka panjang diharapkan dapat dimanfaatkan sebagai salah satu bahan literatur untuk manajemen pengelolaan air limbah pada perusahaan yang mengeksplorasi nikel alam.
4
1.4.Hipotesis
5
II. TINJAUAN PUSTAKA
2.1. Klasifikasi dan Morfologi Ikan Bandeng
Pengembangan budidaya bandeng memiliki keunggulan komparatif dibandingkan dengan ikan lainnya, yaitu: teknik pembenihannya telah dikuasai sehingga pasokan benih tidak tergantung dari alam, teknologi budi dayanya relatif mudah, bersifat euryhaline, bersifat herbivorous dan tanggap terhadap pakan buatan, tidak bersifat kanibal, dapat dibudidayakan secara polikultur, rasanya lezat dan dapat digunakan sebagai umpan bagi industri penangkapan tuna (Rachmansyah et al. 1997).
Klasifikasi ikan bandeng menurut Saanin (1984) adalah :
Gambar 1. Morfologi ikan Bandeng Kingdom : Animalia
Class
Ordo
Familia : Chanidae Genus : Chanos
Spesies : Chanos chanos Forsskal
Menurut Djuhanda (1981), ikan bandeng mempunyai tubuh yang ramping dan ditutupi oleh sisik dengan jari-jari yang lunak, sirip ekor yang panjang dan bercagak, mulut sedang dengan posisi mulut satu garis dengan sisi bawah bola mata dan tidak memiliki sungut.
6 operculum, suboperculum dan radii branhiostegi, semua tertutup selaput membran branhiostegi. Sirip dada terletak di belakang tutup insang, sirip perut terletak di bawah perut, Sirip dubur terletak dekat anus. Linea lateralis terletak memanjang dari belakang tutup insang dan berakhir pada bagian tengah sirip ekor. Ikan bandeng dapat hidup di daerah air tawar, air payau, dan air laut. Induk bandeng baru bisa memijah setelah mencapai umur 5 tahun dengan ukuran panjang 0,5-1,5 m dan berat badan 3-12 kg. Jumlah telur yang dikeluarkan induk bandeng berkisar 0,5-1,0 juta butir tiap kg berat badan. Pertumbuhan ikan bandeng relatif cepat, yaitu 1,1-1,7 % bobot badan/hari. Pada tahap pendederan ikan bandeng, penambahan bobot per hari berkisar 40-50 mg. Ikan bandeng dengan bobot awal 1-2 gr membutuhkan waktu 2 bulan untuk mencapai bobot 40 gr (Ahmad 1998).
2.2 Logam Berat Nikel
Nikel merupakan simbol Ni dengan ditemukan oleh A. F. Cronstedt pada tahun 1751, merupakan logam berwarna putih keperak-perakan yang berkilat, keras dan mulur, tergolong dalam logam peralihan, sifat tidak berubah bila terkena udara, tahan terhadap oksidasi dan kemampuan mempertahankan sifat aslinya di bawah suhu yang ekstrim (Cotton
and Wilkinson 1989).
Di perairan nikel ditemukan dalam bentuk koloid. Garam-garam nikel misalnya nikel amonium sulfat, nikel nitrat, dan nikel klorida bersifat larut dalam air. Pada kondisi aerob dan pH < 9, nikel membentuk senyawa kompleks dengan hidroksida, karbonat, dan sulfat dan selanjutnya mengalami presipitasi. Demikian juga pada kondisi anaerob, nikel bersifat tidak larut (Moore 1990 dalam Effendi 2003). Nikel digunakan dalam berbagai aplikasi komersial dan industri, seperti : pelindung baja (stainless steel), pelindung tembaga, industri baterai, elektronik, aplikasi industri pesawat terbang, industri tekstil, turbin pembangkit listrik bertenaga gas, pembuat magnet kuat, pembuatan alat-alat laboratorium (nikrom), kawat lampu listrik, katalisator lemak, pupuk pertanian, dan berbagai fungsi lain (Gerberding 2005).
7 tinggi selanjutnya diambil dengan menggunakan alat mekanis atau non mekanis dan diangkut untuk diolah di pabrik dan sebagaian ditimbun di sekitar wilayah perairan pesisir untuk selanjutnya dalam bentuk mentah di ekspor keluar negeri. Nikel terbentuk bersama dengan belerang dalam millerite (NiS), dengan arsenik dalam galian nikolit (NiAs), dan dengan arsenik dan belerang dalam (nikel glance). Nikel juga terbentuk bersama-sama dengan chrom dan platina dalam batuan ultrabasa. Terdapat dua jenis endapan nikel, yaitu sebagai hasil konsentrasi residu silika dan pada proses pelapukan batuan beku ultrabasa serta sebagai endapan nikel-tembaga sulfida, yang biasanya berasosiasi dengan pirit, pirotit, dan kalkopirit (Handayani 2002).
2.3 Toksisitas Logam Berat
Logam berat adalah istilah yang digunakan secara umum untuk kelompok logam berat dan metaloid yang densitasnya lebih besar dari 5 gr/cm3 (Hutagalung
dan Razak 1992). Logam berat adalah unsur-unsur kimia dengan bobot jenis lebih besar dari 5 gr/cm3
Di perairan, logam berat dapat ditemukan dalam bentuk terlarut dan tidak terlarut. Logam berat terlarut adalah logam yang membentuk senyawa kompleks dengan senyawa organik dan anorganik, sedangkan logam berat yang tidak terlarut merupakan partikel-partikel yang berbentuk koloid dan senyawa kelompok metal yang teradsorbsi pada partikel-partikel yang tersuspensi (Connel
and Miller 1995).
, terletak di sudut kanan bawah sistem periodik, mempunyai afinitas yang tinggi terhadap unsur S dan biasanya bernomor atom 22 sampai 92 dari perioda 4 sampai 7 (Mittinen 1977). Afinitas yang tinggi terhadap unsur S menyebabkan logam ini menyerang ikatan belerang dalam enzim, sehingga enzim bersangkutan menjadi tak aktif. Gugus karboksilat (-COOH) dan amina (-NH2) juga bereaksi dengan logam berat. Kadmium, timbal, dan tembaga terikat pada sel-sel membran yang menghambat proses transformasi melalui dinding sel (Manahan 1977).
8 organisme hidup, namun dalam jumlah yang berlebihan dapat menimbulkan efek racun. Contoh logam berat ini adalah Zn, Ni, Cu, Fe, Co, Mn dan lain sebagainya. Sedangkan jenis kedua, logam berat tidak esensial atau beracun, di mana keberadaannya dalam tubuh masih belum diketahui manfaatnya atau bahkan dapat bersifat racun, seperti Hg, Cd, Pb, Cr dan lain-lain (Connel and Miller 1995).
Logam berat umumnya ditemukan dalam bentuk persenyawaan dengan unsur lain, dan sangat jarang ditemukan dalam elemen tunggal. Unsur ini dalam kondisi suhu kamar tidak selalu berbentuk padat melainkan ada yang berbentuk cair. Logam berat di perairan memiliki sifat konservatif dan nonkonservatif. Sifat konservatif menunjukan kestabilan konsentrasi suatu komponen, hal ini berarti bahwa konsentrasi suatu komponen cenderung tetap dan tidak terpengaruh dengan proses-proses fisik dan biologi yang ada di perairan, ditunjukkan dengan proses pergerakan, peningkatan konsentrasi, dan pergerakan sekaligus peningkatan konsetrasi (Hutagalung dan Razak 1992).
Sebagian dari logam berat bersifat essensial bagi organisme air untuk pertumbuhan dan perkembangan hidupnya, antara lain dalam pembentukan haemosianin dalam sistem darah dan enzimatik pada biota (Darmono 1995). Berdasarkan sifat kimia dan fisikanya, maka tingkat atau daya racun logam berat terhadap hewan air dapat diurutkan (dari tinggi ke rendah) sebagai berikut merkuri (Hg), kadmium (Cd), seng (Zn), timah hitam (Pb), krom (Cr), nikel (Ni), dan kobalt (Co) (Sutamihardja 1982). Menurut Darmono (1995) daftar urutan toksisitas logam paling tinggi ke paling rendah terhadap manusia yang mengkomsumsi ikan adalah sebagai berikut Hg2+ > Cd2+ >Ag2+ > Ni2+ > Pb2+ > As2+ > Cr2+ Sn2+ > Zn2+
a. Bersifat toksik tinggi (Hg, Cd, Pb, Cu, dan Zn)
. Sedangkan menurut Kementrian Negara Kependudukan dan Lingkungan Hidup (1990) sifat toksisitas logam berat dapat dikelompokkan ke dalam 3 kelompok, yaitu :
b. Bersifat toksik sedang (Cr, Ni, dan Co) c. Bersifat tosik rendah (Mn dan Fe).
9 1. Sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan dan
keberadaannya secara alami sulit terurai
2. Dapat terakumulasi dalam organisme termasuk kerang dan ikan, dan akan membahayakan kesehatan manusia yang mengkomsumsi organisme tersebut 3. Mudah terakumulasi di sedimen, sehingga konsentrasinya selalu lebih tinggi
dari konsentrasi logam dalam air
4. Mudah tersuspensi karena pergerakan masa air yang akan melarutkan kembali logam yang dikandungnya ke dalam air, sehingga sedimen menjadi sumber pencemar potensial dalam skala waktu tertentu
Walaupun terjadi peningkatan sumber logam berat, namun konsentrasinya dalam air dapat berubah setiap saat. Hal ini terkait dengan berbagai macam proses yang dialami oleh senyawa tersebut selama dalam kolom air. Parameter yang mempengaruhi konsentrasi logam berat di perairan adalah suhu, salinitas, arus, pH dan padatan tersuspensi total atau seston (Nanty 1999).
Fungsi-fungsi perilaku secara umum akan lemah akibat adanya zat-pencemar, dan ikan sering kali memperlihatkan tanggapan ini pertama ketika terekspos polutan (Little et al 1993). Perubahan tingkah laku seperti gerakan vertikal terjadi karena hilangnya keseimbangan. Pada toksisitas yang tinggi membuat gerakan ikan kacau balau dan akhirnya mati. Aktifitas renang merupakan indikator sensitif akan hadirnya senyawa berracun diperairan (Rose. et al. 1993). Toksisitas cadmium menyebabkan gerakan operculum yang tidak beraturan dan hilangnya keseimbangan pada Tilapia mossambica (Ghatak dan Konar 1990).
2.4Toksisitas Logam Berat Nikel
10 kanker prostat, merusak fungsi ginjal, meyebabkan kehilangan keseimbangan, menyebabkan kegagalan respirasi, kelahiran cacat, menyebabkan penyekit asma dan bronkitis kronis serta merusak hati.
Nikel terdapat di dalam air sebagai Ni2+ dan kadang-kadang sebagai NiCO3
Gerberding (2005) melaporkan bahwa dalam konsentrasi tinggi nikel di tanah berpasir merusak tanaman dan di permukaan air dapat mengurangi tingkat pertumbuhan algae. Lebih lanjut dikatakan bahwa nikel juga dapat menghambat pertumbuhan mikroorganisme, tetapi mereka biasanya mengembangkan perlawanan terhadap nikel setelah beberapa saat. Ketoksikan nikel pada kehidupan akuatik bergantung pada spesies, pH, kesadahan dan faktor lingkungan lain (Blaylock and Frank 1979).
. Kadar nikel di perairan tawar alami adalah 0,1-0,3 ppb, sedangkan pada perairan laut berkisar antara 0,5 – 2 ppb (Lawrence 2003). Phytoplankton mengandung 1-10 ppb nikel, alga (air tawar dan air asin) mengandung 0,2 - 84 ppb nikel, Lobsters mengandung 0,14-60 ppb nikel, molusca 0,1-850 ppb, dan ikan antara 0,1 dan 11 ppb (Conard 2005). Garam-garam nikel misalnya nikel amonium sulfat, nikel nitrat, dan nikel klorida bersifat larut dalam air. Pada kondisi aerob dan pH < 9, nikel membentuk senyawa kompleks dengan hidroksida, karbonat, dan sulfat dan selanjutnya mengalami presipitasi. Demikian juga pada kondisi anaerob, nikel bersifat tidak larut (Moore 1990 dalam Effendi 2003). Di muara sungai, nikel menunjukan konsentrasi yang semakin meningkat dengan peningkatan kekeruhan. Peningkatan konsentrasi nikel terlarut pada tingkat kekeruhan yang tinggi terjadi karena proses desorpsi dari partikel-partikel yang ada di muara sungai dan proses resuspensi.
Beberapa faktor-faktor telah dihubungkan dengan tingkah laku abnormal pada ikan lele akibat toksisitas logam berat Ni, termasuk kerusakan saraf karena terganggunya transmisi antara sistem saraf dan berbagai lokasi-lokasi efektor, kelumpuhan dan gangguan sistem pernapasan karena kelainan fungsi enzim tubuh, dan penyalahgunaan energi yang mengakibatkan penghabisan energi (Isaac 2009).
11 Setelah 72 jam, ikan yang hidup di dalam konsentrasi nikel 8,0-12,0 ppm menyebabkan kulit akan rusak dan tubuh luka-luka sebagai indikasi dari tekanan pH (Isaac 2009). Nebeker et al. (1985), ketika konsetrasi nikel lebih tinggi dibandingkan logam yang lain, nikel dinyatakan sebagai logam beracun. Tingkat toleransi beberapa jenis ikan terhadap nikel, sebagai berikut :
Tabel 1. Sifat toksisitas nikel pada beberapa jenis ikan
No Uraian Nilai Sumber
Isaac A. Ololade, 2009
5. Daphnia hyaline LC50 – 48 jam 1.9 ppm Chapman. Et al. 1980
6. Daphnia magna LC50 – 48 jam 30-150 ppb Chapman. Et al. 1980
2.5Sistem Pernapasan Ikan
Pernapasan adalah proses pengikatan oksigen dan pengeluaran karbondioksida oleh darah melalui permukaan alat pernapasan. Proses pengikatan oksigen selain dipengaruhi struktur alat pernapasan juga dipengaruhi oleh perbedaan tekanan parsial O2
Insang merupakan komponen penting dalam proses pertukaran gas. Insang terbentuk dari lengkungan tulang rawan yang mengeras dengan beberapa filamen insang didalamnya. Tiap-tiap filamen insang terdiri atas banyak lamella yang merupakan tempat pertukaran gas. Tugas ini ditunjang oleh struktur lamella yang tersusun atas sel-sel epitel yang tipis pada bagian luar, membran dasar dan sel-sel tiang sebagai penyangga pada bagian dalam. Pinggiran lamella yang tidak menempel pada lengkung insang ditutupi oleh epitelium dan mengandung jaringan pembuluh darah kapiler (Harder 1975 dalam Funjaya 2004).
antara perairan dengan darah. Perbedaan tekanan tersebut menyebabkan gas-gas berdifusi kedalam darah atau keluar melalui alat pernapasan (Funjaya 2004).
12 darah insang disebabkan oleh adanya perbedaan tekanan dari tempat pertama ketempat lainnya. Karena tekanan oksigen (PO2) didalam insang lebih besar dari pada PO2 kapiler darah insang maka oksigen berdifusi dari insang ke kapiler darah insang kemudian darah insang ditranspor melalui sirkulasi ke jaringan perifer. Pada jaringan perifer, PO2 sel lebih rendah dari pada PO2 darah arteri yang memasuki kapiler. Tekanan oksigen
2.6Pengaruh Toksisitas Nikel terhadap Tingkat Konsumsi Oksigen
yang jauh lebih tinggi di dalam kapiler menyebabkan oksigen berdifusi keluar dari kapiler melalui ruang intertistial ke sel. Sebaliknya bila oksigen dimetabolisasi dengan bahan makanan dalam sel akan membentuk karbondioksida, sehingga CO2 dalam sel akan meningkat. Keadaan ini menyebabkan CO2 berdifusi kedalam kapiler jaringan. Setelah berada dalam darah, karbon dioksida ditranspor ke kapiler insang dan keluar melalui insang (Funjaya 2004).
Kebutuhan oksigen biologi didefinisikan sebagai banyaknya oksigen yang diperlukan oleh organisme pada saat pemecahan bahan organik, pada kondisi aerobik. Pemecahan bahan organik diartikan bahwa bahan organik ini digunakan oleh organisme sebagai bahan makanan dan energinya diperoleh dari proses oksidasi (Pescod 1973). Banyaknya oksigen yang dikonsumsi oleh biota akuatik dalam waktu tertentu berhubungan linear dengan banyaknya oksigen terlarut di perairan tersebut (Evans and Chaiborne 2005).
Tingkat kebutuhan oksigen pada ikan berbeda-beda tergantung pada spesies, ukuran (stadia), aktifitas, jenis kelamin, saat reproduksi, tingkat konsumsi pakan, dan suhu. Kebutuhan oksigen untuk ikan dalam keadaan diam relatif lebih sedikit dibandingkan dengan ikan pada saat bergerak atau memijah (Vernberg and
Vernberg 1972).
13 yang cepat terakumulasi logam berat. Jika proses pertukaran ion-ion dan gas-gas melalui insang terganggu, dapat meyebabkan ikan mati lemas (Wardoyo 1975)
Semakin tinggi konsentrasi timbal yang dipaparkan maka konsumsi oksigen juvenil ikan bandeng dari hari ke hari akan semakin rendah. Hal tersebut disebabkan karena pada jaringan insang juvenil bandeng terjadi kerusakan akibat terakumulasinya logam timbal pada jaringan tersebut, sehingga pertukaran oksigen dan gas-gas yang melalui insang menjadi terganggu (Ghalib dkk. 2002).
2.7Pengaruh Toksisitas Nikel terhadap Histopatologis
Tingkat konsumsi oksigen pada dasarnya menunjukkan tingkat metabolisme. Konsumsi oksigen adalah indikator respirasi yang juga menunjukkan metabolisme energetik (Funjaya 2004). Kematian ikan yang disebabkan oleh bahan pencemar, umumnya terjadi karena kerusakan pada bagian insang dan organ-organ yang berhubungan dengan insang. Insang terletak di luar dan berhubungan langsung dengan air sebagai media hidupnya. Insang merupakan organ yang pertama kali mendapat pengaruh apabila lingkungan air tercemar oleh bahan pencemar, baik terlarut maupun tersuspensi (Siahaan 2003).
Insang terdiri dari sepasang filamen insang, di mana setiap filamen terdiri dari serat melintang yang tertutup epithelium yang tipis disebut lamella. Lamella merupakan penyusun filamen. Sebuah rangkaian lamella pada satu sisi dari septum interbranchiale disebut hemibranchium. Dua hemibranchium dan septum interbranchia membentuk insang lengkap disebut holobranchia (Lagler et al.
1977).
Keterangan: 1. Eritrosit 2. Epitelium 3. Sel pillar 4. Lumen kapiler 5. Lamella
6. Sel sel interlamella 7. Sel mukus
8. Tulang rawan penopang
14 Keberhasilan ikan dalam mendapatkan oksigen ditentukan oleh kemampuan fungsi insang untuk menangkap oksigen dalam perairan. Proses penyerapan oksigen dalam jaringan insang dilakukan oleh darah yang mengalir ke dalam filamen-filamen insang dan akibat adanya perbedaan tekanan gas antara darah dan filamen dengan air sehingga terjadi difusi gas. Rusaknya jaringan insang akibat adanya pengaruh benda asing atau racun, menyebabkan ikan mengalami gangguan pernafasan atau lebih lanjut dapat mengakibatkan kematian pada ikan (Lagler et al. 1977).
Hasil uji histologi yang dilakukan oleh Ghalib dkk. (2002) menunjukkan bahwa Pb dapat menyebabkan kerusakan pada jaringan insang khususnya pada lamella primer dan lamella sekunder sehingga insang tidak dapat berfungsi dengan baik. Sejalan dengan laporan Casarett and Doult (1975) bahwa pada konsentrasi yang cukup tinggi daya konsentrasi insang juga menurun akibat adanya reaksi antara logam berat timbal dengan protein dan lendir insang yang membentuk methallotionin dimana struktur ini dapat menghambat kerja enzim pernapasan.
Vernberg and Vernberg (1972) menyatakan bahwa oksigen terlarut dibutuhkan oleh semua jasad hidup untuk pernapasan, proses metabolisme atau pertukaran zat yang kemudian menghasilkan energi untuk pertumbuhan dan pembiakan, jika ikan berada pada medium dengan tekanan parsial oksigennya lebih rendah dari lingkungan (ambien), maka untuk mencukupi kebutuhan oksigenya ikan akan melakukan pemompaan air yang lebih besar melalui peningkatan frekuensi pergerakan operculum. Selanjutnya dikatakan bahwa meningkatnya CO2 lebih menstimulir respon meningkatnya frekuensi gerakan operculum dalam respirasi dari pada penurunan kandungan oksigen.
15 duodenal; 3) Senyawa asing yang dimetabolisme oleh hati sebagian dilokalisir di dalam hati. Dengan demikian hati merupakan organ yang banyak berhubungan dengan senyawa kimia sehingga mudah terkena efek toksik (Loomis 1978 dalam
Siahaan 2003).
Kerusakan hepatosit menurut Robert (2001) dapat dibagi menjadi dua yaitu taksohepatik dan trofohepatik. Kerusakan akibat taksopatik disebabkan oleh pengaruh langsung dari agen yang toksik, baik berupa zat kimia maupun kuman. Kerusakan akibat trofopatik disebabkan adanya kekurangan faktor-faktor penting untuk kehidupan sel seperti oksigen atau zat makanan, baik secara langsung maupun tidak langsung. Darmono (1995) mengatakan bahwa hati ikan yang tercemar logam timbal, kadmium, copper, merkuri mengalami kerusakan berupa pembendungan, hemoragi dan degenerasi vakuola. Degenerasi vakuola atau pembekakan sel merupakan salah satu indikasi terjadinya perlemakan hati, pada keadaan ini sel hati tampak membesar. Menurut Ressang (1984), perlemakan yang berlangsung lama dapat menyebabkan terjadinya kerusakan hati yaitu kongesti. Kongesti adalah terjadinya pembendungan darah pada hati yang disebabkan adanya gangguan sirkulasi yang dapat mengakibatkan kekurangan oksigen dan zat gizi.
2.8Pengaruh Toksisitas Nikel Terhadap Kondisi Hematologi Ikan
Gambaran darah suatu organisme dapat digunakan untuk mengetahui kondisi kesehatan yang sedang dialami oleh organisme tersebut. Penyimpangan fisiologis ikan akan menyebabkan komponen-komponen darah juga mengalami perubahan. Perubahan gambaran darah dan kimia darah, baik secara kualitatif maupun kuantitatif, dapat menentukan kondisi kesehatannya. Fungsi vital darah di dalam tubuh antara lain sebagai pengangkut zat-zat kimia seperti hormon, pengangkut zat buangan hasil metabolisme tubuh, dan pengangkut oksigen dan karbondioksida (Ganong 1983).
16 serta imunoglobulin adalah unsur penting dari protein plasma total (Bastiawan
dkk. 2001)
Fungsi utama sel darah merah adalah mengikat haemoglobin untuk transport oksigen, sedangkan sel darah putih peran utamanya ialah dalam pertahanan tubuh terhadap infeksi mikrobial. Imunoglobulin merupakan unsur penting dari
humoran immune response yang dibentuk untuk menghambat/mencegah ikan dari
agen infeksi (Ganong 1983; Tortora dan Anagnostakos 1990).
Hasil penelitian Narayanan (2008), menunjukkan terjadi peningkatan secara signifikan konsentrasi sel darah putih, gula darah dan kolesterol Cyprinus carpio
pada media yang dicemari oleh logam berat kadmium (Cd), Cromium (Cr) dan Timbal (Pb).
2.8.1 Eritrosit
Eritrosit membawa hemoglobin dalam sirkulasi. Eritrosit dibentuk dalam sumsum tulang, terutama dari tulang pendek, pipih dan tak beraturan. Perkembangan eritrosit dalam sumsum tulang melalui berbagai tahap: mula-mula besar dan berisi nukleus tetapi tidak ada hemoglobin; kemudian dimuati hemoglobin dan akhirnya kehilangan nukleusnya dan baru diedarkan ke dalam sirkulasi darah. Jumlah eritrosit normal pada ikan teleost berkisar antara 1,05 juta – 3 juta sel/mm3
Eritrosit merupakan sel yang paling banyak jumlahnya. Inti sel eritrosit terletak sentral dengan sitoplasma dan akan terlihat jernih kebiruan dengan pewarnaan Giemsa (Chinabut et al 1991 dalam Mulyani 2006). Seperti halnya pada hematokrit, jumlah eritrosit yang rendah menunjukkan terjadinya anemia. Sedangkan jumlah tinggi menandakan bahwa ikan dalam keadaan stres (Wedemeyer dan Yasutake 1977 dalam Taufik 2005).
(Robert 2001).
2.8.2 Leukosit
Leukosit (SDP, WBC) warnanya bening, bentuknya lebih besar dibandingkan dengan eritosit, tetapi jumlahnya lebih sedikit. Leukosit dibuat pada sumsum tulang dan berisi sebuah inti yang berbelah banyak dan protoplasmanya berbulir karena itu disebut sel berbulir granulosit (Tortora dan Anagnostakos 1990).
17 hematologi yang berguna untuk evaluasi respon inang terhadap infeksi mikroba dan untuk diagnosis leukemia serta penyakit lainnya. Dalam evaluasi sebuah leukogram, amat perlu diketahui bahwa tidak hanya total SDP dan diferensiasinya, tetapi untuk menetapkan adanya perubahan morfologi SDP maka informasi tentang komponen darah lainnya harus ada. Juga protein plasma total dan konsentrasi fibrinogen, parameter darah merah (HCT, HB, SDM) dan SDM berinti serta jumlah retikulosit secara tak langsung membantu dalam interpretasi leukogram. Jumlah total leukosit bervariasi antar spesies ikan dan hal ini dipengaruhi oleh umur ikan. Saat ikan lahir jumlahnya lebih tinggi, kemudian secara bertahap menurun sampai nilai dewasa yaitu pada umur 2–12 bulan. Meningkatnya jumlah leukosit disebut leukositosis sedangkan penurunan disebut leukopenia. Leukositosis lebih umum daripada leukopenia dan tidak merupakan hal yang serius, bahkan mungkin bisa fisiologis. Leukositosis yang fisiologis mungkin terjadi sebagai reaksi “ephinephrine” dimana neutrofil dan limfosit dimobilisasi kedalam sirkulasi umum sehingga menaikkan jumlah total SDP. Hal ini sering terjadi pada ikan muda dan biasanya akibat stres, juga adanya gangguan fisik sehingga leukositosis ini bisa terjadi dalam keadaan sehat ataupun sakit dan bisa bersifat fisiologis maupun patologis. Sedangkan leukopenia umumnya berhubungan dengan infeksi bakterial atau viral (Dierauf 1990 dalam Aliambar 1999).
2.8.3 Hematokrit
Hematokrit (HCT; PCV) merupakan persentase volume eritrosit dalam darah ikan. Hasil pemeriksaan terhadap hematokrit dapat dijadikan sebagai salah satu patokan untuk menentukan keadaan kesehatan ikan, nilai hematokrit kurang dari 22% menunjukkan terjadinya anemia. Kadar hematokrit bervariasi tergantung pada faktor nutrisi, umur ikan, jenis kelamin, ukuran tubuh dan masa pemijahan. Nilai hematokrit sebesar 40% berarti dalam darah mengandung 40% sel darah merah (Kuswardani 2006). Persentase nilai hematokrit ikan lele normal berkisar antara 30,8%-45,5% (Angka dkk. 1985).
18 atas. Jumlah sel-selnya adalah 45% dari volume darah total, dan nilai ini dinamakan packed cell volume (PCV) atau hematokrit (HCT), yang dinyatakan dalam persen.
Perhitungan nilai hematokrit lebih sering ditentukan berdasarkan metode mikrohematokrit. Kekuatan dan lama putaran amatlah perlu untuk mengurangi plasma yang melekat pada dinding tabung (Tortora dan Anagnostakos 1990). Pada kambing dan domba, metode hematokrit membutuhkan waktu centrifuse yang lebih lama (10–20 menit), sedangkan spesies lainnya (termasuk ikan), waktu centrifuse dilakukan dalam waktu kurang lebih 5 menit. Perbedaan nilai hematokrit dapat terjadi akibat kesalahan teknik terutama yang disebabkan oleh metode pengambilan darah, tipe dan konsentrasi antikoagulan serta metode yang dipakai untuk determinasi perhitungan SDM dan SDP, konsentrasi HB dan HCT (Aliambar 1999).
Nilai hematokrit juga berbeda berdasarkan ketinggian, individu yang tinggal di pegunungan memiliki nilai hematokrit yang lebih tinggi bila dibandingkan dengan individu yang tinggal di tepi pantai (Tortora dan Anagnostakos 1990).
2.8.4 Hemoglobin
Hemoglobin (Hb) adalah pigmen merah pembawa oksigen dalam sel darah merah vertebrata, yang merupakan suatu protein yang kaya akan zat besi. Hemoglobin (Hb) sangat penting untuk mempertahankan kehidupan sebab ia membawa dan mengirim oksigen ke jaringan-jaringan. Sekitar 400 juta molekul hemoglobin ada dalam sel darah merah dan meliputi 95% dari berat keringnya. Sedangkan sintesis hemoglobin dan proses destruksinya seimbang dalam kondisi fisiologis dan adanya gangguan pada salah satunya dapat menimbulkan gangguan hematologis yang nyata (Tortora dan Anagnostakos 1990; Aliambar 1999).
19
2.8.5 Rasio Netrofil-Limfosit
Pertahanan tubuh melawan infeksi adalah peran utama leukosit. Jenis sel darah putih yang sudah teridentifikasi dalam darah perifer adalah limfosit, neutrofil, monosit dan trombosit. Kadar limfosit pada ikan kerapu normal adalah 72% dari total leukositnya, sedangkan pada ikan kerapu yang diberi perlakuan hormon hormon steroid LHRHa dosis 50 mg/kg bobot badan yaitu 54,5% (Fris
dkk. 2003). Limfosit merupakan jenis sel leukosit yang paling dominan dalam leukosit ikan dengan kepadatan 48.000 sel/mm3, dengan kisaran normal 71,1-82,88% dari total leukosit (Rostagi 1997).
Gambar 3. Ciri komponen leuko sit
Peningkatan jumlah limfosit di dalam sirkulasi darah disebut limfositosis sedangkan penurunannya disebut leukopenia. Jumlah limfosit yang tinggi dalam sirkulasi darah akan diimbangi dengan jumlah netrofil yang rendah dan sebaliknya. Penurunan jumlah limfosit dalam darah perifer terjadi karena sebagian besar limfosit dari sirkulasi dan berkosentrasi dalam jaringan dimana terjadi peradangan (Jawad et al. 1993).
2.9 Kadar Glukosa Darah
20 saraf yang diawali oleh otak dalam menanggapi apa yang kita butuhkan. Stres pada ikan bisa disebabkan oleh faktor lingkungan (pH, tinggi amoniak, rendahnya kadar oksigen, pencemaran, dsb), kepadatan, penanganan dan lain-lain. Salah satu pendekatan yang bisa dilihat pada tubuh ikan saat stres adalah perubahan naik turunnya kadar glukosa darah. Mekanisme terjadinya perubahan kadar glukosa darah selama stres dimulai dari diterimanya informasi penyebab faktor stres oleh organ reseptor. Selanjutnya informasi tersebut disampaikan ke otak bagian hipotalamus melalui sistem syaraf. Hipotalamus memerintahkan sel kromafin untuk mensekresikan hormon katekolamin melalui serabut syaraf simpatik. Adanya katekolamin ini akan mengaktivasi enzim-enzim yang terlibat dalam katabolisme simpanan glikogen, sehingga kadar glukosa darah mengalami peningkatan.
Naik turunnya kadar glukosa dalam darah ikan mengindikasikan bahwa ikan sedang lapar atau sedang kenyang. Naiknya glukosa darah menandakan bahwa ikan sedang kenyang, artinya nafsu makan berkurang karena energi yang dibutuhkan oleh tubuh terpenuhi. Sebaliknya, pada saat kadar glukosa darah turun, maka ikan akan merasa lapar sehingga diperlukan makanan untuk memenuhi kebutuhan energinya. Pada saat ikan stres menyebabkan kadar glukosa dalam darah terus naik yang diperlukan untuk mengatasi homeostasis dan insulin akan menurun. Dengan tingginya kadar glukosa di dalam darah tersebut maka sinyal dari pusat syaraf menandakan bahwa ikan merasa kenyang, dan ikan tidak mau makan (Marcel et al. 2009)
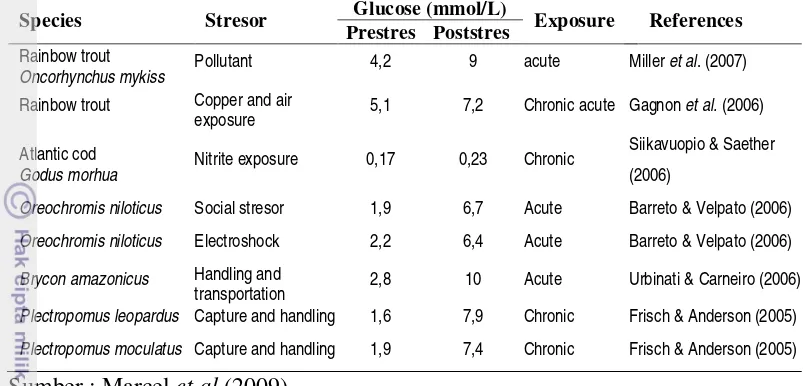
21 Tabel 2 Nilai kadar glukosa darah sebelum dan setelah diberi perlakuan stres pada
beberapa jenis ikan
Species Stresor Glucose (mmol/L) Exposure References Prestres Poststres
Rainbow trout
Oncorhynchus mykiss Pollutant 4,2 9 acute Miller et al. (2007)
Rainbow trout Copper and air
exposure 5,1 7,2 Chronic acute Gagnon et al. (2006)
Atlantic cod
Godus morhua Nitrite exposure 0,17 0,23 Chronic
Siikavuopio & Saether
(2006)
Oreochromis niloticus Social stresor 1,9 6,7 Acute Barreto & Velpato (2006)
Oreochromis niloticus Electroshock 2,2 6,4 Acute Barreto & Velpato (2006)
Brycon amazonicus Handling and
transportation 2,8 10 Acute Urbinati & Carneiro (2006)
Plectropomus leopardus Capture and handling 1,6 7,9 Chronic Frisch & Anderson (2005)
Plectropomus moculatus Capture and handling 1,9 7,4 Chronic Frisch & Anderson (2005)
Sumber : Marcel et al (2009)
2.9 Studi Bioassay
Ikan merupakan indikator biologik dalam pencemaran air, sedangkan kematian merupakan tolok ukur toksisitas akut pencemar air pada ikan. Pengaruh pencemar air dapat menyebabkan :
1. Merusak insang : gangguan respiratorik dan sirkulatorik, anoksemia dan gangguan fungsi ekskretorik insang
2. Membunuh ikan setelah Absorpsi lewat permukaan mulut, insang dan kulit 3. Membunuh ikan setelah Absorpsi lewat permukaan saluran pencemaan
Study bioassay dilakukan sebagai test spesifik untuk menentukan dampak dari polutan dan faktor lingkungan pada biota akuatik dalam keadaan tertentu dan waktu tertentu (APHA 1979). Sanusi (2009), terdapat dua tipe dari keracunan akibat logam berat, yaitu :
1. Efek akut, biasanya letal dimana biota akan lansung menderita sesaat setelah dimasukan kedalam media yang terdapat konsentrasi yang tinggi dari polutan dan biasanya berlanjut pada kematian.
2. Efek kronis, biota akan mengalami efek yang lebih lama, biasanya akan berdampak pada pertumbuhan, reproduksi dan pola tigkah laku. Efek dari kronis dapat berupa lethal ataupun sublethal.
22 1. Lethal Concentration (LC)
LC ditentukan pada saat mortalitas mencapai >50% dan terjadi setelah 24 jam, 48 jam, atau 96 jam setelah dimasukan kedalam media.
2. Effectif Concentration (EC)
EC ditentukan dimana konsentrasi dapat menyebabkan efek berbahaya seperti perbedaan pola tingkah laku biota dan ketidakseimbangan pada 50% populasi biota akuatik.
3. Incipent Letal Concentration (ILC)
ILC ditentukan pada saat paling tidak 50% dari populasi yang bertahan. 4. Save Concentartion (SC)
Konsentrasi tertinggi yang paling aman bagi biota akuatik 5. Maksimum Allowable Toxicant Concentration (MATC)
Konsentrasi tertinggi yang diperbolehkan ada diperairan yang tidak akan menyebabkan bahaya apapun bagi organisme akuatik.
Dari harga LC50
sangat tinggi : < 1 mg/L
, selanjutnya potensi ketoksikan akut senyawa uji dapat digolongkan menjadi :
tinggi : 1 -50 mg/L
sedang : 50 – 500 mg/L
sedikit toksit : 500 – 5000 mg/L hampir tidak toksit : 5 – 15 g/L
relatif tidak berbahaya : > 15 g/L, (Balazs T, 1970)
2.10 Kualitas Air
Kelarutan logam dalam air dikontrol oleh pH air. Kenaikan pH menurunkan kelarutan logam dalam air, karena kenaikan pH mengubah kestabilan dari bentuk karbonat menjadi hidroksida yang membentuk ikatan dengan partikel pada badan air, sehingga akan mengendap membentuk lumpur (Palar 2004).
23 Kandungan oksigen terlarut minimum ini sudah cukup mendukung kehidupan organisme (Swingle 1968).
Kenaikan suhu air dan penurunan pH akan mengurangi adsorpsi senyawa logam berat pada partikulat. Suhu air yang lebih dingin akan meningkatkan adsorpsi logam berat ke partikulat untuk mengendap di dasar. Sementara saat suhu air naik, senyawa logam berat akan melarut di air karena penurunan laju adsorpsi ke dalam partikulat. Logam yang memiliki kelarutan yang kecil akan ditemukan di permukaan air selanjutnya dengan perpindahan dan waktu tertentu akan mengendap hingga ke dasar, artinya logam tersebut hanya akan berada di dekat permukaan air dalam waktu yang sesaat saja untuk kemudian mengendap lagi. Hal ini ditentukan antara lain oleh massa jenis air, viskositas air, temperatur air, arus serta faktor-faktor lainnya (Palar 2004).
Daya larut logam berat dapat menjadi lebih tinggi atau lebih rendah tergantung pada kondisi lingkungan perairan. Pada daerah yang kekurangan oksigen, misalnya akibat kontaminasi bahan-bahan organik, daya larut logam berat akan menjadi lebih rendah dan mudah mengendap (Lawrence 2003).
Kandungan logam berat pada sedimen umumnya rendah pada musim kemarau dan tinggi pada musim penghujan. Penyebab tingginya kadar logam berat dalam sedimen pada musim penghujan kemungkinan disebabkan oleh tingginya laju erosi pada permukaan tanah yang terbawa ke dalam badan sungai, sehingga sedimen dalam sungai yang diduga mengandung logam berat akan terbawa oleh arus sungai menuju muara (Bryan 1976).
Persyaratan lokasi untuk pemeliharaan bandeng adalah Suhu air 26,5-31,00C, pH 6,5-8,5, Oksigen larut 3,0-8,5 ppm dan salinitas 10–18 ppm (Idel
24
III. METODE PENELITIAN
3.1Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Desember 2009 sampai Maret 2010. Lokasi pelaksanaan penelitian, yaitu : Laboratorium Lingkungan Departemen Budidaya Perairan, Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Laboratorium Nutrisi Ikan Departemen Budidaya Perairan, dan Laboratorium Pengujian Departemen Teknologi Industri Pertanian, Institut Pertanian Bogor.
3.2Pelaksanaan Penelitian
Penelitian ini dilaksanakan atas tiga tahap, yaitu: uji nilai kisaran, uji akut, dan uji sub-kronik. Ikan uji yang digunakan adalah ikan bandeng ukuran 6-7 cm, diperoleh dari Balai Layanan Usaha Produksi Perikanan Budidaya Karawang. Sedangkan, logam berat nikel yang digunakan sebagai sumber toksisitas dalam penelitian adalah nikel klorida (NiCl2
3.3Uji Nilai Kisaran
). Wadah yang digunakan dalam penelitian berupa akuarium berukuran 20 x 20 x 30 cm, yang diisi air laut dengan salinitas 15 ‰ sebanyak 10 liter. Analisis kadar nikel pada media percobaan menggunakan
Atomic Absorption Spectroscopy (AAS).
Uji nilai kisaran bertujuan untuk mengetahui batas bawah dan batas atas konsentrasi nikel. Batas atas merupakan konsentrasi yang menyebabkan dampak kematian ikan bandeng 100 % dalam waktu 24 jam, sedangkan batas bawah adalah konsentrasi nikel dimana 100% ikan bandeng yang dicobakan masih dapat hidup setelah 48 jam pemaparan. Tahap uji ini menggunakan 150 ekor Ikan uji, kepadatan 1 ekor/L yang dibagi menjadi 4 taraf yaitu 5 ; 50 ; 100 ; dan 150 ppm dan 1 perlakuan kontrol negatif dengan 3 ulangan. Penentuan konsentrasi nikel pada perlakuan dilakukan dengan membuat stock solution 1000 ppm dan selanjutnya dikonversi menggunakan rumus pengenceran, sebagai berikut:
N1 V1 = N2 V2 Keterangan :
……….. (1)
N1 V
25 N2
V
= Konsentrasi Ni yang diinginkan (ppm) 2
Tingkat kematian ikan bandeng dihitung pada jam ke-0, 2, 4, 6, 8, 10, 12, 14, 16 18, 20, 22, dan jam ke-24. Perhitungan berikutnya dilakukan setiap 6 jam sampai jam ke-48. Berdasarkan uji nilai kisaran diperoleh nilai ambang bawah yaitu 5 ppm dan nilai ambang atas yaitu 50 ppm.
= Volume larutan standar yang digunakan (liter)
3.4Uji Akut
Penghitungan konsentrasi yang digunakan dalam uji akut dengan menggunakan rumus Wardoyo (1981), sebagai berikut:
Log (N/n) = k (log a / log n) ……….. (2) Dengan ketentuan :
a/n = b/a = c/b = d/c = … = N/d ………… (3) Keterangan :
N = nilai konsentrasi ambang atas (ppm) n = nilai konsentrasi ambang bawah (ppm) k = jumlah interval konsentrasi yang di uji (k=4)
a = konsentrasi terkecil dalam deret konsentrasi yang ditentukan (ppm)
Dengan menggunakan persamaan (2) ditentukan konsentrasi terkecil dan dengan persamaan (3) ditentukan nilai konsentrasi untuk uji akut sebanyak 4 perlakuan, sehingga didapatkan konsentrasi 8,89 ppm untuk perlakuan B, konsentrasi 15,81 ppm untuk perlakuan C, konsentrasi 28,12 ppm untuk perlakuan D, dan konsentrasi 50,01 ppm untuk perlakuan E. Setiap perlakuan dilakukan dengan 3 ulangan dan 1 perlakuan kontrol negatif (perlakuan A).
26 kehilangan gerak refleks) dan perubahan warna sisik. Penghitungan gerak operculum dimulai 30 menit setelah pemberian bahan uji, penghitungan dilakukan selama 1 menit dan diulangi setiap 10 menit sampai menit ke 30 dan selanjutnya dibandingkan dengan kontrol.
Pengukuran kualitas air media pada setiap unit percobaan, dilakukan pada jam ke-0, 24, 48, 72 dan ke-96.
3.5Uji Sub-Kronik
Penelitian ini bertujuan untuk mengetahui pengaruh toksisitas nikel terhadap tingkat konsumsi oksigen, kondisi hematologi dan stres sekunder ikan uji. Uji sub-kronik ini dilakukan dengan 3 perlakuan dan 3 ulangan yaitu : perlakuan A (tanpa nikel) sebagai kontrol, perlakuan B (1% dari LC50-96 jam), perlakuan C (5% dari LC50-96 jam), perlakuan D (10% dari LC50-96 jam) dan perlakuan E (30% dari LC50
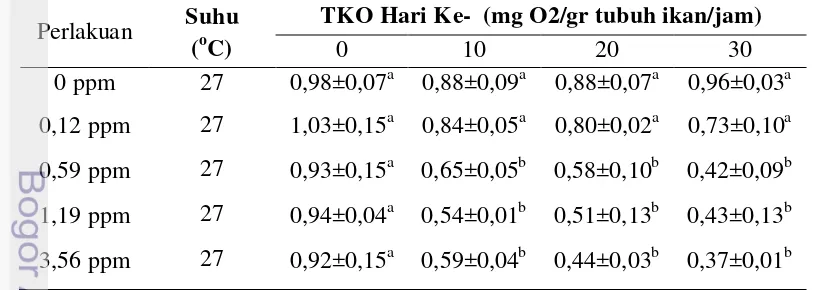
3.5.1 Tingkat Konsumsi Oksigen
-96 jam). Pada tahap ini, digunakan ikan uji sebanyak 180 ekor dengan masing-masing unit sebanyak 20 ekor. Percobaan dirancang mengikuti Rancangan Acak Lengkap (RAL). Uji sub-kronik dilakukan selama 32 hari. Variabel yang diamati, sebagai berikut :
Tingkat konsumsi oksigen diukur dengan menghitung rasio oksigen terlarut pada awal dan akhir penelitian persatuan waktu. Botol respirasi yang digunakan diisi air sampai penuh, selanjutnya diaerasi dengan kuat (bubling) selama 2 hari agar kandungan oksigenya bertambah. Setelah diaerasi air media dibiarkan selama setengah jam, kemudian dilakukan pengukuran oksigen terlarut. Oksigen terlarut diukur dengan menggunakan DO-meter terkalibrasi. Ikan ditimbang kemudian dimasukkan kedalam botol respirasi, diukur DO awal, kemudian ditutup selama 1 jam kemudian diukur DO akhir, maka akan didapatkan tingkat konsumsi oksigen menggunakan rumus dibawah ini (Liao dan Huang 1975) :
TKO = {(DOawal – Doakhir)/W x t} x V……….(4) Keterangan :
TKO = Tingkat Konsumsi oksigen (mg O2/ gr tubuh /jam) DOawal = Oksigen terlarut pada awal pengamatan (ppm) DOakhir = Oksigen terlarut pada akhir pengamatan (ppm) W = berat ikan uji (gr)
t = periode pengamatan (jam)
27 Pengukuran konsumsi oksigen dilakukan sebanyak 4 kali yaitu pada hari ke-0, 8, 16, 24, dan 32.
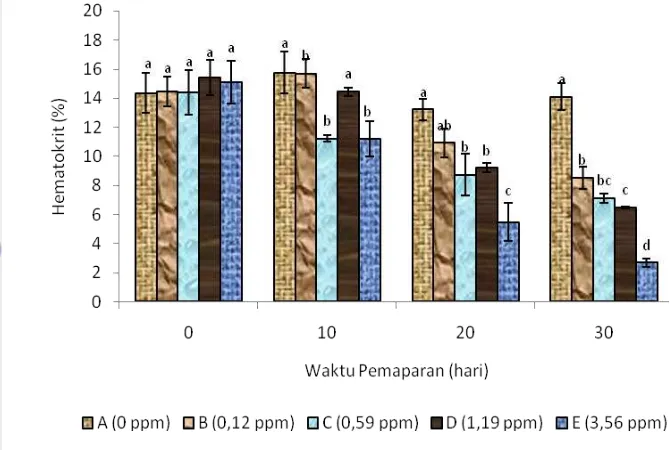
3.5.2 Kadar Hematokrit (Ht)
Pengukuran hematokrit menggunakan Microhematocrit method. Ujung mikrohematokrit/mikrokapiler berheparin (yang dapat mencegah pembekuan darah dalam tabung) ditempelkan pada tetesan darah dan dibiarkan mengalir sendiri memasuki ruangan sampai volume darah mencapai ¾ bagian tabung kemudian salah satu ujung tabung disumbat dengan crestaseal. Darah disentrifuge pada kecepatan 5000 rpm selama 5 menit. Setelah itu akan terbentuk lapisan-lapisan yang terdiri dari lapisan-lapisan plasma yang jernih di bagian atas, kemudian lapisan putih abu-abu (buffy coat) yang merupakan trombosit dan leukosit dan lapisan eritrosit yang berwarna merah. Nilai hematokrit ditentukan dengan mengukur persentase volume eritrosit dari darah dengan menggunakan alat baca mikrohematokrit dan dinyatakan dalam persentase (% Ht).
3.5.3 Kadar Hemoglobin (Hb)
Pengukuran kadar hemoglobin pada prinsipnya adalah mengkonversikan hemoglobin dalam darah ke dalam bentuk asam hematin oleh asam klorida. Mula-mula darah diisap menggunakan pipet sahli hingga skala 20 mm3
3.5.4 Eritrosit
. kemudian dipindahkan ke dalam tabung Hb yang berisi HCl 0.1 N sampai skala 10 (kuning). Didiamkan selama 3–5 menit agar Hb bereaksi dengan HCl membentuk asam hematin, kemudian diaduk dan ditambahkan aquadestila (sedikit demi sedikit) hingga warnanya sama dengan standar. Pembacaan skala dilakukan dengan melihat tinggi permukaan larutan yang dikocok dengan skala lajur g% yang menunjukkan banyaknya Hb dalam gram setiap 100 ml darah dan dinyatakan dalam persentase (% Hb).
28 skala 101 menggunakan pipet yang sama. Pipet dikocok selama 3 menit dengan hati-hati sehingga darah tercampur merata pada bagian yang bertanda 1–101. Larutan pada ujung pipet yang tidak tercampur dibuang dengan menggunakan tissue. Darah yang teraduk diteteskan ke dalam hemocytomer yang dilengkapi dengan gelas penutup hingga memenuhi seluruh permukaan yang berskala. Selanjutnya dilakukan penghitungan di bawah mikroskop.
Untuk menghitung jumlah eritrosit digunakan 5 kotak kecil yang terletak di bagian tengah kamar hitung yaitu empat kotak di sudut-sudutnya dan satu kotak ditengah-tengah. Satu kotak kecil luasnya adalah 0.2 x 0.2 mm = 0.04 mm2, sehingga 5 kotak itu luasnya 5 x 0.04 mm2 = 0.2 mm2. Kedalaman kamar hitung adalah 0.1 mm, sehingga volume cairan di dalam kamar hitung yang diamati adalah 0.2 mm2 x 0.1 mm = 0.02 mm3 atau 2/100 mm3. Dengan demikian jumlah eritrosit per mm3 darah dapat diketahui yaitu 100/2 = 50 a butir. Karena menggunakan pengencer 0.5:100 atau 1:200, maka jumlah eritrosit di dalam mm3 darah dapat diketahui yaitu 50 x 200 x a butir atau a x 104
3.5.5 Leukosit
butir eritrosit.
Sampel darah diencerkan dengan larutan Turks untuk menghanculkan sel darah merah agar jumlah sel darah putih dapat dihitung. Untuk mengencerkan leukosit digunakan pipet berskala maksimum 11 yang dilengkapi pengaduk. Mula-mula darah diisap dengan pipet hingga skala 1.0, ujung pipet dibersihkan dengan kertas tissue kemudian larutan Turks diisap dengan cepat dan hati-hati hingga skala 11 menggunakan pipet yang sama. Pencampuran dilakukan dengan menggoyang pipet selama 3 menit agar darah tercampur dengan homogen.
29
3.5.6 Rasio Netrofil-limfosit
Dari satu tetes darah kemudian dibuat preparat darah ulas tipis pada gelas objek, kemudian segera dikeringkan dengan cara mengibas-ngibaskan di udara. Setelah kering kemudian dilakukan fiksasi dalam larutan metanol selama 5 menit. Selanjutnya dilakukan perendaman dalam larutan gyemsa selama 15 menit. Kemudian dibilas dengan akuades dan dikeringkan selama satu hari. Setelah kering kemudian direndam dalam xylol selama 5 menit, dan ditutup dengan menggunakan bioleit. Sediaan diamati pada mikroskop dengan pembesaran 1000x dan dilakukan perhitungan masing-masing jenis leukosit hingga mencapai 100 sel leukosit (Aqualex, 2008).
3.6Kadar Glukosa Darah
Pemeriksaan kadar glukosa dalam darah ikan uji dilakukan sebagai indikator stres sekunder akibat toksisitas nikel. Pengukuran kadar glukosa dalam darah dilakukan pada awal dan akhir penelitian. Sebelum pengambilan darah, ikan dipuasakan selama 24 jam. Pengambilan sampel darah diupayakan dilakukan dalam waktu yang sama. Prosedur pengukuran glukosa dalam darah yaitu : plasma darah diambil dengan cara disentrifuge, selanjutnya 0,05 ml plasma darah, glukosa standar dan akuades dimasukan kedalam masing-masing tabung reaksi yang telah berisi 3,5 ml color reagent (perbandingan asam asetat dan ortotoluidine = 94 : 6). Setelah itu dipanaskan dalam water bath tertutup selama 10 menit pada suhu 100 0
……….(5)
C. Selanjutnya setelah didinginkan pada suhu kamar, lalu dibaca dengan menggunakan spektrofotometer pada panjang gelombang 635 nm. Selanjutnya dihitung dengan menggunakan rumus, sebagai berikut :
Keterangan : GD = glukusa darah (mg/100ml) Au = absorbansi sampel
30
3.7Histologi Jaringan Insang dan Hati
Pengamatan kerusakan jaringan dilakukan dengan membuat preparat histologi insang dan hati. Pengamatan dilakukan sebanyak 2 kali yaitu pada hari ke-15 dan hari ke-30 (akhir penelitian). Metode yang digunakan adalah Metode Histoteknik. Tahapan kerja dari metode ini adalah pengambilan sampel, fiksasi, dehidrasi, penjernihan, infiltrasi, penanaman, proses pemotongan, penempelan sayatan pada gelas objek, deparafinisasi, dan pewarnaan (Kiernan, 1990). Preparat yang dibuat selanjutnya diamati di bawah mikroskop, menggunakan mikroskop digital dengan perbesaran 40 kali.
3.8Tingkat Kelangsungan Hidup
Kelangsungan hidup merupakan presentase dari perbandingan antara jumlah ikan yang hidup diakhir perlakuan dengan jumlah ikan yang ditebar dalam akuarium diawal perlakuan. Tingkat kelangsungan hidup dihitung berdasarkan persamaan berikut :
X 100% ………..……(6)
Keterangan : SR = kelangsungan hidup ikan
Nt = Jumlah ikan pada akhir penelitian No = Jumlah ikan pada awal pemeliharan
3.9Laju Pertumbuhan
Pertumbuhan ikan yang diukur meliputi pertambahan berat (g) dengan menggunakan neraca digital dan pertambahan panjang (cm) dengan menggunakan
milimeter block. Pengukuran ini dilakukan untuk mengetahui pengaruh kadar
nickel terhadap laju pertumbuhan juvenil ikan bandeng, mengunakan rumus berikut :
X 100% ……….(7)
Keterangan :
Wt = Rerata bobot individu pada akhir peneliitian (g) Wo = Rerata bobot individu pada awal pemeliharaan (g) t = Waktu pemeliharaan (hari)
31
3.10 Parameter Kualitas Air
Parameter kualitas air yang diukur meliputi : suhu, salinitas, pH, kesadahan, alkalinitas, karbondioksida, oksigen terlarut dan total amoniak nitrogen. Pengukuran suhu, salinitas, pH dan oksigen terlarut dilakukan setiap hari, sedangkan pengukuran karbondioksida, kesadahan, alkalinitas dan total amoniak nitrogen dilakukan setiap minggu.
3.11 Analisis Data
32 IV. HASIL DAN PEMBAHASAN
4.1 Hasil
Uji Nilai Kisaran
Respon ikan uji terhadap deretan konsentrasi pada uji penentuan kisaran
konsentrasi lethal menunjukkan kepekaan mortalitas yang tinggi terhadap daya
toksik nikel. Pada konsentrasi 50 ppm, mortalitas ikan uji mencapai 70 % setelah
24 jam pemaparan dan mencapai 100 % setelah 42 jam pemaparan. Sedangkan
pada konsentrasi 5 ppm, mortalitas ikan uji sebesar 0 % sampai dengan 96 jam
pemaparan (Tabel 3).
Tabel 3 Persentase tingkat kematian kumulatif juvenil ikan bandeng selama uji nilai kisaranpemaparan nikel
Perlakuan Persentase ikan yang mati pada pengamatan jam ke- (%)
6 12 18 24 30 36 42 48 54 60 66 72 84 96
A (0 ppm) 0 0 0 0 0 0 0 0 0 0 0 0 3,3 3,3
B (5 ppm) 0 0 0 0 0 0 0 0 0 0 0 0 0 0
C (50 ppm) 23,3 53,3 63,3 70 83,3 93,3 100 100 100 100 100 100 100 100
D (100 ppm) 76,7 100 100 100 100 100 100 100 100 100 100 100 100 100
E (150 ppm) 86,7 100 100 100 100 100 100 100 100 100 100 100 100 100
Berdasarkan nilai mortalitas selama uji nilai kisaran, ditetapkan nilai
ambang atas yaitu 50 ppm dan nilai ambang bawah yaitu 5 ppm. Pada perlakuan
kontrol negatif, setelah jam ke-96 mortalitas ikan uji mencapai 3,3%. Hal ini
menunjukkan bahwa kualitas media pemeliharaan dan vitalitas ikan selama
pengujian dalam kondisi yang baik.
Uji Akut
Berdasarkan konsentrasi batas bawah dan batas atas, maka uji akut
dilakukan pada konsentrasi nikel sebesar : 8,89 ppm, 15,81 ppm, 28,12 ppm dan
33
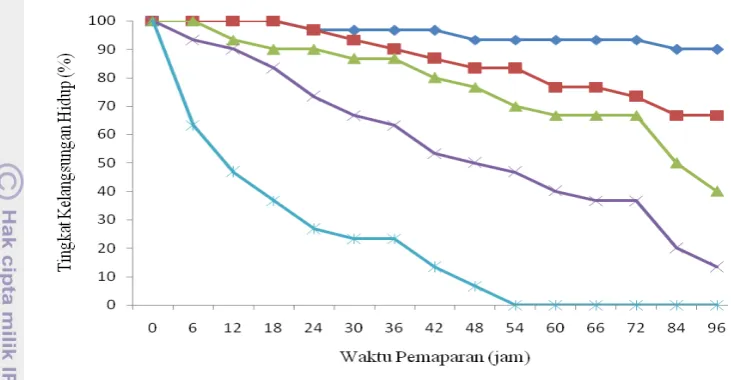
Respon ikan uji terhadap deretan konsentrasi pada uji akut menunjukkan
kepekaan mortalitas yang tinggi terhadap daya toksik nikel (Gambar 4).
Gambar 4 Persentase tingkat kelangsungan hidup juvenil ikan bandeng selama uji akut pemaparan nikel
Pada konsentrasi 50,01 ppm, mortalitas ikan uji mencapai 73 % setelah 24
jam, 93,3% setelah 48 jam dan mencapai 100 % setelah 72 jam pemaparan.
Sedangkan pada konsentrasi 8,87 ppm, mortalitas ikan uji mencapai 3,3 % setelah
24 jam pemaparan, 16,7 % setelah 48 jam, 26,7 % setelah 72 jam dan 33,3 %
setelah 96 jam pemaparan. Pada kontrol, mortalitas ikan uji sampai jam ke-96
setelah pemaparan nikel yaitu 10% (lampiran 2). Hal ini menunjukkan bahwa
kualitas media pemeliharaan dan vitalitas ikan selama pengujian dalam kondisi
yang baik.
Toksisitas akut nikel yang tinggi terhadap juvenil ikan bandeng, diduga
karena kecilnya kemampuan adaptasi ikan bandeng untuk memperkecil pengaruh
biokimia yang ditimbulkan nikel yang masuk kedalam tubuh, menyebabkan
turunnya kemapuan menyerap oksigen dari lingkungan. Sementara saat ikan
dalam kondisi stres, metabolisme tubuhnya akan meningkat dan kebutuhan
oksigen akan meningkat pula yang diperlukan dalam mempertahankan
homeostatis. Gerberding (2005) melaporkan bahwa meskipun organisme biasanya
mengembangkan perlawanan setelah beberapa saat terpapar oleh nikel akan tetapi
kemampuan mengembangkan perlawanan tersebut ditentukan oleh spesies dan