TOKSISITAS AKUT BUAH SIRIH HUTAN (Piper aduncum)
TERHADAP LARVA UDANG (Artemia salina) DAN
EMBRIO IKAN ZEBRA (Danio rerio)
ANDHIKA GUSTI HERIYANTO
DEPARTEMEN KIMA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Toksisitas Akut Buah Sirih Hutan (Piper aduncum) terhadap Larva Udang (Artemia salina) dan Embrio Ikan Zebra (Danio rerio) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ANDHIKA GUSTI HERIYANTO. Toksisitas Akut Buah Sirih Hutan (Piper aduncum) terhadap Larva Udang (Artemia salina) dan Embrio Ikan Zebra (Danio rerio). Dibimbing oleh GUSTINI SYAHBIRIN dan KUSDIANTORO MOHAMAD.
Piper aduncum, yang dikenal sebagai tanaman sirih hutan di Indonesia, telah digunakan oleh masyarakat Indonesia sebagai obat tradisional. Penelitian ini bertujuan menguji toksisitas minyak atsiri dan ekstrak n-heksana buah sirih hutan terhadap larva udang (Artemia salina) dan embrio ikan zebra (Danio rerio). Ekstrak n-heksana menghasilkan toksisitas yang lebih tinggi, dengan nilai konsentrasi letal 50% (LC50) sebesar 20 ppm terhadap larva udang dan 16 ppm terhadap embrio ikan zebra pada 96 jam pascafertilisasi. Pemberian ekstrak n-heksana dan minyak atsiri menunjukkan malformasi mayor pada kantung kuning telur, jantung, dan sirkulasi darah embrio ikan zebra berdasarkan uji in vivo yang dilakukan. Berdasarkan hasil analisis kromatografi gas-spektrometri massa, komponen utama dalam minyak atsiri dan ekstrak n-heksana adalah dilapiol (1-alil-2,3-dimetoksi-4,5-(metilenadioksi)benzena).
Kata kunci: dilapiol, Piper aduncum, toksisitas akut
ABSTRACT
ANDHIKA GUSTI HERIYANTO. Acute Toxicity of Sirih Hutan (Piper aduncum) Fruit against Brine Shrimp (Artemia salina) and Zebrafish (Danio rerio) Embryo. Supervised by GUSTINI SYAHBIRIN and KUSDIANTORO MOHAMAD.
Piper aduncum, known as sirih hutan in Indonesia, is an herb traditionally used in Indonesian community. This study is to evaluate the toxicity of essential oil and n-hexane extract of P. aduncum fruit against brine shrimp (Artemia salina) and zebrafish (Danio rerio) embryo. The n-hexane extract showed higher toxicity, with 50% lethal concentration (LC50)of 20 ppm against A. salina and 16 ppm against D.
rerio embryo for 96 hours post fertilization. The in vivo test indicated that the n -hexane extract and the essential oil caused major malformation on yolk sac, heart, and blood circulation in D. rerio embryo. Based on gas chromatography-mass spectrometry analysis, the main component in the essential oil and n-hexane extract was dillapiole (1-allyl-2,3-dimethoxy-4,5-(methylenedioxy)benzene).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
TOKSISITAS AKUT BUAH SIRIH HUTAN (Piper aduncum)
TERHADAP LARVA UDANG (Artemia salina) DAN
EMBRIO IKAN ZEBRA (Danio rerio)
ANDHIKA GUSTI HERIYANTO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Toksisitas Akut Buah Sirih Hutan (Piper aduncum) terhadap Larva Udang (Artemia salina) dan Embrio Ikan Zebra (Danio rerio) Nama : Andhika Gusti Heriyanto
NIM : G44090085
Disetujui oleh
Dr Gustini Syahbirin, MS Pembimbing I
drh Kusdiantoro Mohamad, MSi, PAVet Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga karya ilmiah yang berjudul “Toksisitas Akut Buah Sirih Hutan (Piper aduncum) terhadap Larva Udang (Artemia salina) dan Embrio Ikan Zebra (Danio rerio)” berhasil diselesaikan. Karya ilmiah ini dilaksanakan dari bulan Oktober 2013 hingga April 2014 di Laboratorium Kimia Organik, Departemen Kimia, FMIPA dan Laboratorium Embriologi, Departemen Anatomi, Fisiologi, dan Farmakologi, Fakultas Kedokteran Hewan, IPB.
Penulis mengucapkan terima kasih kepada Dr Gustini Syahbirin, MS dan drh Kusdiantoro Mohamad, MSi, PAVet selaku pembimbing yang telah memberikan arahan, saran, nasihat, dan semangat selama penelitian. Di samping itu, penghargaan penulis sampaikan kepada Bapak Budi Arifin SSi, MSi atas dukungan dan segala bantuan sebagai Komisi Pendidikan, Bapak Sabur atas nasihat dan pengalaman laboratoriumnya, Kak Wahyu Hendana dan Astari (KIM 44) atas bantuan informasi terkait ikan zebra, Bapak Jaswanto yang membantu analisis GC-MS, dan seluruh staf Laboratorium Kimia Organik dan Embriologi atas segala bantuan dan dukungannya. Ungkapan terima kasih juga disampaikan kepada kedua orang tua dan keluarga penulis atas doa, kasih sayang, bantuan moral dan materi untuk kelancaran kuliah dan tugas akhir. Rasa terima kasih juga disampaikan untuk Padjri, Sigit, DC boys, Ajeng Herpianti, Wahyu, Ichsan, rekan penelitian Mella Yanti, Yugo, dan Kurnia atas semangat dan kebersamaannya. Tidak lupa pula, kepada teman-teman Kimia 46 atas doa, motivasi, bantuan, kebersamaan, dan segala dukungan yang telah diberikan, serta berbagai pihak yang telah ikut berkontribusi dalam penulisan karya ilmiah ini. Semoga Allah SWT membalas kebaikan semua. Amin.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Metode Penelitian 2
HASIL DAN PEMBAHASAN 5
Hasil Determinasi Tumbuhan, Kadar Air, Minyak, dan Rendemen
Ekstrak 5
Fitokimia Ekstrak n-Heksana 6
Identitas Komponen Minyak Atsiri dan Ekstrak n-Heksana berdasarkan
Kromatogram GC-MS 6
Toksisitas terhadap Larva Udang 8
Toksisitas terhadap Embrio Ikan Zebra 9
Efek Teratogenik pada Embrio Ikan Zebra 11
SIMPULAN DAN SARAN 14
DAFTAR PUSTAKA 14
LAMPIRAN 18
1 Fitokimia ekstrak n-heksana 6 2 Nilai LC50 minyak atsiri dan ekstrak n-heksana terhadap embrio ikan zebra 9 3 Persentase embrio yang hidup normal, hidup abnormal, mati, dan menetas
pada perlakuan dengan minyak atsiri 10
4 Persentase embrio yang hidup normal, hidup abnormal, mati, dan menetas
pada perlakuan dengan ekstrak n-heksana 10
5 Efek teratogenik pada embrio ikan zebra akibat paparan minyak atsiri dan
ekstrak n-heksana 12
DAFTAR GAMBAR
1 Kromatogram GC-MS minyak atsiri 7
2 Kromatogram GC-MS ekstrak n-heksana 7
3 Senyawa dominan dalam minyak atsiri dan ekstrak n-heksana buah sirih
hutan 8
4 Morfologi embrio ikan zebra normal pada kontrol dan beberapa abnormalitas
pada perlakuan 13
DAFTAR LAMPIRAN
1 Diagram alir penelitian 18
2 Hasil determinasi tanaman sirih hutan 19
3 Kadar air serbuk dan rendemen buah sirih hutan 20 4 Hasil GC-MS minyak atsiri dan ekstrak n-heksana 21
5 Spektrum MS senyawa dilapiol 23
6 Hasil uji BSLT dan analisis probit 25
7 Hasil uji ZFET dan analisis probit 28
PENDAHULUAN
Pencarian obat dari bahan alami masih terus dilakukan sampai saat ini, baik yang bersumber dari daratan maupun perairan. Salah satu tumbuhan yang berpotensi sebagai obat adalah genus Piper dari famili Piperaceae. Tumbuhan Piperaceae sebagian besar tersebar di daerah tropis dan subtropis, terutama banyak terdapat di zona tropis Amerika (700 spesies), diikuti oleh Asia Selatan dan Oseania (300 spesies) (Diaz et al. 2012). Genus Piper secara luas digunakan sebagai obat tradisional di Amerika Latin dan India Barat untuk menyembuhkan luka, mengurangi pembengkakan dan iritasi kulit, serta mengobati gejala leishmaniasis kulit (Estevez et al. 2007). Salah satu jenisnya adalah sirih hutan (Piper aduncum) yang memiliki berbagai aktivitas biologis.
Sirih hutan merupakan salah satu jenis tumbuhan dari famili Piperaceae yang telah tersebar luas di berbagai daerah di Indonesia dan dikenal dengan beberapa nama daerah seperti sedah (Jawa), ranul (Lampung), base (Bali), bida (Maluku), nahi (Bima), dan seuseureuhan atau gedebong (Sunda). Secara tradisional, tumbuhan ini digunakan oleh masyarakat Indonesia untuk mengatasi sakit perut, penyembuh luka, demam, sakit gigi, rematik, kencing nanah (gonore), dan penolak serangga (Jamal et al. 2003). Minyak atsiri sirih hutan memiliki aktivitas sebagai molusida, insektisida, dan antibakteri (Pohlit et al. 2006). Sirih hutan banyak diaplikasikan sebagai insektisida nabati. Bernard et al. (1995) melaporkan bahwa perlakuan ekstrak etanol daun sirih hutan 0.4% dapat menghambat perkembangan larva Ostrinia nubilis hingga 90%, sementara pada konsentrasi 0.1 ppm menyebabkan kematian larva nyamuk Aedes atropalpus sebesar 92%. Selain itu, perlakuan dengan ekstrak n-heksana buah sirih hutan dapat mengakibatkan kematian larva Crocidolomia pavonana sampai 95.6% dengan konsentrasi letal 50% (LC50) 365 ppm (Hasyim 2011).
Sirih hutan kaya akan senyawa metabolit sekunder, di antaranya golongan alkaloid, terpenoid, flavonoid, benzenoid, turunan asam karboksilat, fenilpropanoid, terpena, neolignan, tanin, kromena, dan flavon (Parmar et al. 1997; Braga et al. 2007). Sudrajat et al. (2011) menyatakan bahwa ekstrak kasar etanol daun dan batang sirih hutan mengandung senyawa saponin, steroid, dan alkaloid. Parmar et al. (1997) juga melaporkan bahwa daun sirih hutan mengandung senyawa-senyawa golongan flavonoid, yaitu asebogenin, adunktin A‒E, metillindaretin, dan piperadunsin A‒C. Metillindaretin memperlihatkan sifat sitotoksik melawan sel karsinoma nasofaring dengan nilai dosis efektif 50% (ED50) 6 μg/mL. Adunktin B‒D dan metillindaretin juga aktif sebagai antibakteri terhadap Micrococcus luteus (Orjala et al. 1993). Ekstrak kasar petroleum eter daun sirih hutan mengandung seskuiterpena, yaitu viridiflorol, kubebol, spatulenol, dan kariofilenol II yang memperlihatkan aktivitas molusida yang tinggi terhadap Biomphalaria glabrata (Orjala et al. 1993).
761/MENKES/SK/IX/1992, uji toksisitas akut merupakan prasyarat formal keamanan calon fitofarmaka (obat) untuk pemakaian pada manusia (Depkes RI 1992). Pada penelitian ini dilakukan uji toksisitas akut pada hewan uji larva udang dan embrio ikan zebra.
Uji letalitas larva udang (BSLT) merupakan salah satu metode pendahuluan untuk mengetahui daya sitotoksik suatu ekstrak atau senyawa. Metode ini menggunakan larva udang (Artemia salina) sebagai bioindikator. Hasil uji toksisitas dengan metode ini telah terbukti memiliki korelasi positif dengan daya sitotoksik senyawa antikanker. Larva udang merupakan agen biota laut yang sangat kecil dan mempunyai kepekaan yang cukup tinggi terhadap toksikan (Carballo et al. 2002). Uji toksisitas embrio ikan zebra(ZFET) merupakan metode yang sedang berkembang pesat di dunia saat ini sebagai uji untuk penelitian toksikologi. Hasil uji toksisitas pada embrio ikan zebra telah terbukti berkorelasi positif dengan hasil uji toksisitas pada mamalia (Ma et al. 2007). Pengujian senyawa antikanker secara in vivo pada embrio ikan zebra juga telah dilakukan oleh Berghmans et al. (2005), Moore et al. (2006), Nicoli dan Presta (2007), dan Hsu et al. (2007). Penelitian secara khusus mengenai toksisitas minyak atsiri dan ekstrak n-heksana buah sirih hutan dengan metode BSLT dan ZFET belum pernah dilakukan. Hal tersebut yang mendasari dilakukannya penelitian ini untuk menguji toksisitas akut minyak atsiri dan ekstrak n-heksana buah sirih hutan.
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan yang digunakan adalah buah sirih hutan, akuades, dimetil sulfoksida (DMSO), n-heksana, Na2SO4 anhidrat, HCl pekat, n-amil alkohol, pereaksi Liebermann-Buchard, pereaksi Meyer, pereaksi Dragendorf, pereaksi Wagner, serbuk Mg, kloroform-amoniak, FeCl3 1%, NaOH 10%, H2SO4 2 M, larva udang, embrio ikan zebra, air tawar, dan air laut. Alat yang digunakan ialah peralatan kaca, oven, radas distilasi, GC-MS, aerator, 96-well plate, dan mikroskop terbalik (Olympus, Jepang).
Metode Penelitian
Penelitian ini terdiri atas beberapa tahap, yaitu determinasi tumbuhan sirih hutan, penyiapan sampel, ekstraksi maserasi, uji fitokimia, isolasi minyak atsiri, identifikasi komponen aktif dengan kromatografi gas-spektrometer massa (GC-MS), serta uji toksisitas dengan larva udang dan embrio ikan zebra. Bagan alir penelitian ditunjukkan pada Lampiran 1.
Determinasi Tumbuhan
ini kemudian dideterminasi di Herbarium Laboratorium Biologi, LIPI, Cibinong, Bogor.
Penentuan Kadar Air (AOAC 2006)
Cawan porselen dikeringkan di dalam oven dengan suhu 105 oC selama 30 menit. Kemudian cawan didinginkan dalam eksikator dan ditimbang bobot kosongnya. Sampel sebanyak 3 g dimasukkan ke dalam cawan tersebut dan dipanaskan di dalam oven bersuhu 105 oC selama 3 jam. Setelah itu, cawan didinginkan dalam eksikator dan ditimbang sampai diperoleh bobot konstan. Kadar air ditentukan sebanyak 3 kali ulangan (triplo).
Kadar air (%) =A - AB ×100%
A: Bobot sampel sebelum dikeringkan (g) B: Bobot sampel setelah dikeringkan (g) Preparasi dan Ekstraksi
Buah sirih hutan dibersihkan dan dipotong kecil-kecil (±2 cm), kemudian dikeringudarakan. Setelah kering, buah tersebut dihaluskan hingga diperoleh serbuk. Sampel serbuk sebanyak 500.25 g diekstraksi dengan cara maserasi menggunakan pelarut n-heksana (1:10 b/v). Hasil perendaman disaring untuk memisahkan filtrat dan residunya. Filtrat kemudian dipekatkan dengan menggunakan penguap putar sehingga didapatkan ekstrak pekat n-heksana. Ekstrak pekat tersebut dapat langsung digunakan atau disimpan dalam lemari es (≤ 4 oC) hingga saat digunakan.
Uji Fitokimia (Harborne 1987)
Uji alkaloid dilakukan dengan cara mengekstraksi 0.1 g ekstrak dengan sedikit kloroform, lalu ditambahkan 10 mL kloroform-amoniak dan disaring. Filtrat yang diperoleh ditetesi dengan H2SO4 2 M dan dikocok hingga terbentuk 2 lapisan. Lapisan asam (tidak berwarna) dipisahkan ke dalam 3 tabung reaksi, masing-masing ditambahkan beberapa tetes pereaksi Mayer, Wagner, dan Dragendorf. Uji positif alkaloid berturut-turut ditunjukkan dengan terbentuknya endapan putih kekuningan, endapan cokelat, dan endapan jingga.
Uji fenol dan flavonoid dilakukan dengan cara menambahkan 0.1 g ekstrak dengan 1 mL kloroform dan 1 mL air, kemudian dikocok dan didiamkan hingga terbentuk 2 lapisan. Uji fenol positif apabila terbentuk warna hijau, biru, atau ungu pada lapisan atas setelah ditambahkan FeCl3 1%. Uji flavonoid positif apabila terbentuk warna kuning atau jingga pada lapisan atas setelah ditambahkan 0.1 g serbuk Mg, 1 mL HCl pekat, dan 1 mL n-amil alkohol.
Uji saponin dilakukan dengan cara menambahkan 0.1 g ekstrak dengan 10 mL akuades panas, kemudian dipanaskan selama 5 menit. Filtrat sebanyak 10 mL dikocok selama 10 menit dalam keadaan tertutup. Ekstrak yang mengandung saponin akan membentuk buih yang stabil selama 10 menit.
Uji triterpenoid dan steroid dilakukan dengan cara melarutkan 0.1 g ekstrak dengan 25 mL etanol (50 oC), lalu disaring. Ke dalam filtrat ditambahkan 3 tetes anhidrida asetat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan terbentuknya warna merah atau ungu untuk triterpenoid serta hijau atau biru untuk steroid. Isolasi Minyak Atsiri dengan Distilasi
Buah segar sirih hutan didistilasi air selama ±4 jam. Minyak atsiri dan air tidak saling melarutkan, maka minyak distilat dapat dipisahkan dari lapisan air berdasarkan perbedaan bobot jenis dan kemudian dikeringkan dengan Na2SO4 anhidrat.
% Minyak atsiri =Bobot awal terkoreksi (bahan)Bobot akhir minyak × %
Identifikasi Komponen dengan GC-MS
Analisis GC-MS dilakukan di Pusat Laboratorium Forensik (Puslabfor), Mabes Polri, Jakarta. Sampel diinjeksikan ke dalam GC-MS Agilent 5975C TAD dengan kolom kapiler HP-5MS berukuran 30 m × 0.25 mm × 0.25 µm dan gas pembawa helium dengan laju alir 1.0 mL/menit. Suhu maksimum kolom 325 oC, suhu oven 100 oC (5 menit) hingga 290 oC pada laju 15 oC/menit, dan waktu proses 37.667 menit. Suhu injektor split 290 oC dengan laju alir 104 mL/menit, tekanan 34.575 psi, volume injeksi 1 µL, energi ionisasi 69.922 eV, dan kisaran bobot molekul 35‒800 m/z. Identifikasi senyawa dilakukan dengan membandingkan puncak spektrum massa dengan pangkalan data Wiley 7N dan Wiley 9N.
Uji Toksisitas Akut Metode BSLT (Meyer et al. 1982)
Penetasan Telur A. salina. Telur A. salina diperoleh dari toko ikan Terang di daerah Jembatan Merah, Bogor. Telur ditetaskan dalam wadah berisi air laut yang telah disaring dan diaerasi. Penetasan dilakukan selama 48 jam dengan kondisi cukup cahaya. Larva yang menetas selanjutnya digunakan untuk pengujian.
Uji Toksisitas Akut Metode ZFET (Ali dan Legler 2011; OECD 2013)
Penyiapan Embrio Ikan Zebra. Telur ikan zebra diperoleh dari peternak ikan lokal di daerah Pakansari, Cibinong, Kabupaten Bogor. Telur yang didapat diseleksi dengan kriteria fertil, kondisi telur yang baik, bebas dari jamur, dan tahap perkembangan embrio yang seragam.
Uji Toksisitas. Larutan induk ekstrak dibuat dalam konsentrasi 2000 ppm. Ekstrak ditambahkan DMSO apabila sulit larut dalam air laut. Uji toksisitas dilakukan pada larutan kontrol (0 ppm) serta larutan uji 50, 250, 500, 750, dan 1000 ppm yang dibuat dari larutan standar 2000 ppm. Embrio dimasukkan ke dalam 96-well plate dan tiap sumur diisi sebanyak 1 embrio. Ulangan dilakukan sebanyak 3 kali. Nilai LC50 ditentukan dengan metode probit menggunakan perangkat lunak Minitab 16 dengan selang kepercayaan 95%. Embrio ikan zebra yang telah terpapar oleh ekstrak aktif selama 24, 48, 72, 96, dan 120 jam pascafertilisasi (jpf) diamati morfologinya, yaitu pigmentasi, sumbu tubuh, kepala, mata, otolit, somit, sirip, sirkulasi darah, jantung, kantung kuning telur, dan ekor dengan menggunakan mikroskop terbalik di Laboratorium Embriologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Analisis ragam Anova 1-arah dilanjutkan dengan uji Duncan dilakukan dengan perangkat lunak SPSS 20, pada data hasil pengujian.
HASIL DAN PEMBAHASAN
Hasil Determinasi Tumbuhan, Kadar Air, Minyak, dan Rendemen Ekstrak
Buah yang digunakan terbukti merupakan sirih hutan (Piper aduncum) berdasarkan hasil determinasi (Lampiran 2). Kadar air digunakan untuk mengoreksi rendemen, menentukan bobot buah yang diperlukan, dan mengindikasikan ketahanan sampel selama proses penyimpanan. Sampel memiliki ketahanan simpan yang baik jika kadar airnya kurang dari 10% (Winarno 1992). Berdasarkan hasil analisis, kadar air dalam sampel kering buah sirih hutan sebesar 5.75% (Lampiran 3) sehingga kemungkinan mikroorganisme untuk tumbuh selama penyimpanan sangat kecil.
Fitokimia Ekstrak n-Heksana
Hasil uji fitokimia (Tabel 1) menunjukkan bahwa ekstrak n-heksana buah sirih hutan mengandung senyawa metabolit sekunder golongan alkaloid, fenolik, flavonoid, saponin, tanin, dan steroid. Sudrajat (2010) melaporkan bahwa ekstrak n-heksana daun dan batang sirih hutan dari Samarinda hanya mengandung senyawa dari golongan steroid. Ekstrak n-heksana daun sirih hutan yang berasal dari Peru mengandung senyawa dari golongan fenolik dan flavonoid (Arroyo et al. 2013).
Tabel 1 Fitokimia ekstrak n-heksana
Golongan Hasil
Perbedaan senyawa metabolit sekunder dari suatu tumbuhan dapat disebabkan oleh keragaman sifat genetika dan umur tumbuhan. Kondisi tanah dan vegetasi di sekitar lokasi tumbuhan sumber, serta kondisi musim saat pengambilan bahan tumbuhan juga berpengaruh (Kaufman et al. 2006).
Identitas Komponen Minyak Atsiri dan Ekstrak n-Heksana berdasarkan Kromatogram GC-MS
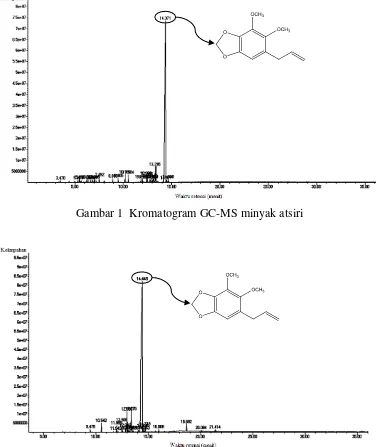
hutanyang berasal dari wilayah Amazon berkisar 31.5‒97.3%, sedangkan minyak atsiri buah sirih hutan yang berasal dari Kutai (Kalimantan Timur) memiliki 63 komponen kimia dengan apiol (51.03%) sebagai komponen utamanya dan tidak terdeteksi adanya senyawa dilapiol (Jamal et al. 2003). Struktur senyawa dominan yang terkandung dalam minyak atsiri dan ekstrak n-heksana ditunjukkan pada Gambar 3.
Gambar 1 Kromatogram GC-MS minyak atsiri
Gambar 3 Senyawa dominan dalam minyak atsiri dan ekstrak n-heksana buah sirih hutan
Toksisitas terhadap Larva Udang
Uji BSLT menggunakan hewan uji A. salina merupakan uji pendahuluan yang sederhana untuk mengetahui sitotoksisitas akut suatu senyawa, dengan cara menentukan nilai LC50 dari komponen aktif suatu simplisia atau ekstrak tanaman (Frank 1995). Nilai LC50 ditentukan dengan menggunakan metode analisis probit pada selang kepercayaan 95%. Nilai probit digunakan dalam toksikologi untuk menentukan toksisitas relatif bahan kimia terhadap organisme hidup dengan respons berupa kematian organisme tersebut. Apabila nilai LC50 hasil pengujian di bawah 1000 ppm, maka ekstrak yang diujikan memiliki sifat toksik dan berpotensi sebagai antikanker (Meyer et al. 1982).
Nilai LC50 yang diperoleh menunjukkan bahwa ekstrak n-heksana lebih toksik daripada minyak atsiri. Minyak atsiri dan ekstrak n-heksana memiliki nilai LC50 masing-masing 51.45 dan 20.21 ppm (Lampiran 6). Ekstrak n-heksana selain mengandung lemak, juga mengandung sebagian besar komponen organik nonpolar (Lampiran 4). Hasil uji fitokimia ekstrak ini menunjukkan kandungan senyawa bioaktif dari golongan alkaloid, fenolik, flavonoid, saponin, tanin, dan steroid. Sifat toksik senyawaan metabolit sekunder tersebut diduga menyebabkan ekstrak n -heksana mempunyai nilai LC50 lebih kecil dan lebih toksik dibandingkan dengan minyak atsiri. Nilai LC50 ekstrak n-heksana buah sirih hutan hasil penelitian ini tidak jauh berbeda dengan hasil penelitian Sudrajat et al. (2011) yang melaporkan bahwa ekstrak kasar n-heksana batang dan daun sirih hutan asal Samarinda berturut-turut sebesar 11.8 dan 19.5 ppm.
Hasil uji BSLT memiliki korelasi yang positif dengan toksisitas dan sitotoksisitas pada sel leukemia dan sel tumor (Colegate dan Molyneux 2008).
-Terpinena Piperiton n
1,3-Benzodioksol Germakrena-D
Menurut National Cancer Institute (NCI) Amerika, nilai standar efektivitas komponen bioaktif untuk melawan sel kanker adalah ≤30 ppm (Albuntana et al. 2011).……….
Toksisitas terhadap Embrio Ikan Zebra
Ikan zebra (D. rerio) lazim digunakan dalam penelitian ekotoksikologi karena kesesuaian sifat biologis dan reproduksinya (selang generasi pendek, selang pemijahan singkat, dan telur transparan) (Meinelt et al. 1999). Saat ini telah dikembangkan uji toksisitas pada embrio ikan zebra untuk penemuan obat-obatan terbaru dari senyawa bahan alam, termasuk uji toksisitas akut (Kari et al. 2007). Uji toksisitas akut dengan menggunakan embrio ikan zebra merupakan uji lanjutan terhadap ekstrak buah sirih hutan untuk melihat potensinya sebagai antikanker. Jika ekstrak yang diberikan bersifat toksik, maka perkembangan embrio akan terhambat dan dapat menyebabkan kematian.
Nilai LC50 minyak atsiri dan ekstrak n-heksana ditunjukkan pada Tabel 2. Nilai LC50 ditentukan pada waktu 48 dan 96 jam pascafertilisasi (jpf) (Lampiran 7). Baik minyak atsiri maupun ekstrak n-heksana memiliki nilai LC50 kurang dari 1000 ppm, yang mengindikasikan keduanya bersifat toksik berdasarkan uji ZFET. Hasil yang diperoleh sebanding dengan hasil uji BSLT untuk ekstrak n-heksana, tetapi untuk minyak atsiri, nilai LC50 hasil uji ZFET jauh lebih besar. Hal ini mungkin disebabkan oleh sifat atsiri minyak, sehingga lama waktu uji yang mencapai 4 hari dapat menyebabkan komponen di dalam minyak atsiri menjadi tidak stabil. Selain itu, ikan zebra merupakan organisme yang lebih kompleks daripada larva udang, sehingga memiliki ketahanan tubuh yang lebih baik terhadap senyawa toksik yang diujikan. Meskipun demikian, dalam uji dengan embrio ikan zebra, nilai LC50 ekstrak n-heksana tetap lebih rendah.
Tabel 2 Nilai LC50 minyak atsiri dan ekstrak n-heksana terhadap embrio ikan zebra Sampel Waktu pengamatan (jpf) LC50
Minyak atsiri 48 154.08
96 143.09
n-Heksana 48 16.81
96 16.10
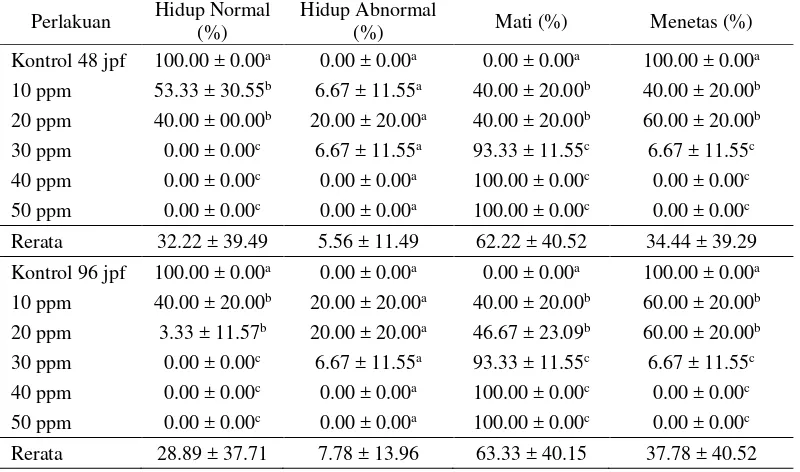
Tabel 3 Persentase embrio yang hidup normal, hidup abnormal, mati, dan menetas
Keterangan: huruf tikatas yang berbeda pada kolom yang sama menyatakan perbedaan yang nyata (p < 0.05).
Semua konsentrasi ekstrak n-heksana yang diujikan memberikan pengaruh terhadap hidup normal, mati, dan menetas embrio (p < 0.05) pada 48 dan 96 jpf (Tabel 4). Hasil analisis Anova dan uji lanjut Duncan menunjukkan perbedaan yang nyata dengan kontrol pada ketiga parameter tersebut, tetapi tidak didapat pengaruh pada hidup abnormal embrio.
Tabel 4 Persentase embrio yang hidup normal, hidup abnormal, mati, dan menetas pada perlakuan dengan ekstrak n-heksana
Perlakuan Hidup Normal
Efek Teratogenik pada Embrio Ikan Zebra
Ikan zebratelah digunakan secara luas dalam bidang biologi, teratologi, dan genetika molekular. Saat ini ikan zebra juga telah dipakai dalam bidang toksikologi dan dikembangkan untuk studi penapisan obat baru. Ikan zebra sangat ideal untuk studi proses perkembangan embrio karena embriogenesisnya sangat mirip dengan vertebrata tingkat tinggi, termasuk manusia (Chakraborty et al. 2009; Brannen et al. 2010). Ikan zebra memiliki beberapa karakteristik yang menyebabkan spesies ini cocok sebagai model dalam bidang toksikologi, di antaranya 1) embrio memiliki lapisan korion yang transparan sehingga sel, jaringan, dan organ dalam tubuh dapat diamati dengan jelas; 2) betina dewasa dapat menghasilkan 200‒250 embrio dalam sekali pemijahan; 3) proses embriogenesis cepat; 4) memiliki kesamaan gen dengan manusia sampai 75%; 5) organ dalam memiliki kesamaan dengan mamalia pada sistem kardiovaskular, syaraf, dan pencernaan; 6) embrio dapat bertahan di dalam multiwell selama beberapa hari tanpa diberi tambahan asupan nutrisi; 7) tidak membutuhkan biaya yang besar dalam pemeliharaannya; serta 8) dapat dijadikan model untuk penyakit kanker, diabetes, epilepsi, dan inflamasi (Berghmans et al. 2005; Hill et al. 2005; Moore et al. 2006; Hsu et al. 2007; Chakraborty et al. 2009). Hasil pengamatan, menunjukkan bahwa baik minyak atsiri maupun ekstrak n-heksana memberikan efek teratogenik pada organ dan jaringan embrio ikan zebra (Tabel 5). Malformasi mayor (≥ 50%) teridentifikasi pada kantung kuning telur, jantung, dan sirkulasi darah, sedangkan malformasi minor (< 50%) teridentifikasi pada sumbu tubuh, somit, sirip pektoral, mulut, dan gelembung renang. Tidak teridentifikasi efek teratogenik pada otak, ekor, mata, rahang, otolit, dan pigmentasi embrio. Hasil pengamatan embrio kontrol dan beberapa abnormalitas yang teramati setelah perlakuan dapat dilihat pada Gambar 4.
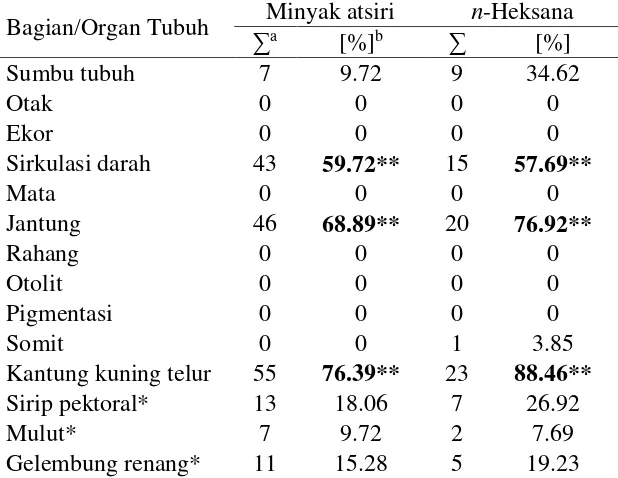
Organ yang paling besar terkena efek teratogenik dari kedua perlakuan adalah kantung kuning telur. Perlakuan minyak atsiri dan ekstrak n-heksana memberikan efek teratogenik pada kantung kuning telur embrio masing-masing sebesar 76 dan 88%. Kantung kuning telur merupakan membran yang berfungsi menyediakan nutrisi bagi embrio. Pembesaran kantung kuning telur merupakan salah satu indikasi nutrisi tidak terserap sempurna oleh embrio. Hal tersebut akan menyebabkan kekurangan nutrisi pada embrio dan dapat mengakibatkan kematian embrio (Bie 2001).
Jantung merupakan organ yang pertama kali terbentuk pada ikan zebra dan memiliki kemiripan dengan embriogenesis pada manusia. Perkembangan jantung 24 jpf pada ikan zebra sebanding dengan usia 3 minggu intrauterin pada manusia (Denvir et al. 2008). Kelainan yang banyak ditemukan pada organ jantung embrio ikan zebra ialah edema perikardial. Masuknya senyawa aktif dari minyak atsiri dan ekstrak n-heksana ke dalam kantung perikardial kemungkinan mengiritasi sel sehingga membengkak.
Tabel 5 Efek teratogenik pada embrio ikan zebra akibat paparan minyak atsiri dan ekstrak n-heksana
Bagian/Organ Tubuh Minyak atsiri n-Heksana
∑a [%]b ∑ [%] aJumlah embrio yang terkena efek teratogenik dalam semua percobaan
bJumlah embrio yang terkena efek teratogenik/jumlah embrio abnormal pada seluruh konsentrasi dan waktu perlakuan
*Hanya pada 120 jam pascafertilisasi **Malformasi mayor (≥ 50%)
Satu embrio dapat memiliki lebih dari satu malformasi.
Akumulasi perlakuan minyak atsiri dan ekstrak n-heksana akan mengganggu kerja organel-organel sel, termasuk mitokondria sebagai lokasi respirasi aerob. Pembentukan ATP akan diperlambat atau berhenti, sehingga terjadi kegagalan selaput aktif pompa natrium, penimbunan natrium intrasel, dan difusi kalium ke luar, yang bila terus berlanjut akan mematikan sel. Sel yang membengkak terus-menerus akan mengalami lisis pada dinding sel sehingga seluruh organel sel keluar atau disebut juga nekrosis (Kumar et al. 1997). Anggraeni et al. (2014) melaporkan, pemaparan genistein (fitoestrogen) pada embrio ikan zebra menurunkan frekuensi denyut jantung dan menyebabkan edema perikardial. Genistein yang merupakan inhibitor tirosina kinase juga dapat memengaruhi aktivitas berbagai kanal ion baik melalui proses fosforilasi maupun ikatan langsung (Kim et al. 2009). Menurut Chen (2013), setiap senyawa memiliki proses tertentu yang dapat menyebabkan edema perikardial pada embrio ikan zebra.
Gambar 4 Morfologi embrio ikan zebra normal pada kontrol dan beberapa abnormalitas pada perlakuan: kontrol 24 jpf (A), kontrol 48 jpf (B), kontrol 72 jpf (C), kontrol 96 jpf (D), kontrol 120 jpf (E), perlakuan 24 jpf (MA, 100 ppm) (F), perlakuan 48 jpf (MA, 80 ppm) (G), perlakuan 72 jpf (MA, 20 ppm) (H), perlakuan 96 jpf (nH, 20 ppm) (I), perlakuan 120 jpf (nH, 30 ppm) (J). MA: minyak atsri, nH: ekstrak n-heksana, ek: edema kantung kuning telur, kd: koagulasi darah, ep: edema perikardial, st: sumbu tumbuh melengkung, jpf: jam pascafertilisasi, bar = 300 µm.
Minyak atsiri maupun ekstrak n-heksana buah sirih hutan diduga bersifat anti-angiogenesis berdasarkan hasil penelitian. Namun, diperlukan dilakukan penelitian lebih lanjut untuk mengetahui kinerja spesifik anti-angiogenesis tersebut. Serbedzija et al. (2000) melaporkan senyawa SU5416 (inhibitor angiogenesis) sebesar 2 µM dapat menghambat vaskulogenesis dan angiogenesis pada embrio ikan zebra.
Namun, dimungkinkan pula adanya efek sinergis dilapiol dengan senyawa lain. Dilapiol memiliki gugus metilenadioksifenil dalam strukturnya yang merupakan ciri berbagai senyawa sinergis yang dapat menghambat aktivitas enzim sitokrom P450 (Scott et al. 2008). Beberapa penelitian telah menjelaskan aktivitas biologis senyawa dilapiol. Bernard et al. (1990) melaporkan bahwa dilapiol dapat menghambat aktivitas enzim sitokrom P450 dalam sediaan mikrosom sel-sel saluran pencernaan ulat Ostrinia nubialis, sehingga enzim pemetabolisme senyawa asing tersebut tidak dapat menguraikan bahan aktif insektisida yang dicampurkan. Dilapiol memberikan efek sitotoksik pada sel kanker payudara MDA-MB-231 yang melibatkan induksi apoptosis melalui jalur mitokondria. Hal ini karena sifat farmakokinetik yang baik dari dilapiol, terutama karena sifat hidrofobiknya, sehingga dapat memfasilitasi difusi melalui membran sel tumor (Ferreira et al. 2014).
SIMPULAN DAN SARAN
Simpulan
Hasil uji fitokimia ekstrak n-heksana buah sirih hutan menunjukkan kandungan senyawa alkaloid, fenolik, flavonoid, saponin, tanin, dan steroid. Hasil GC-MS menunjukkan dilapiol (1-alil-2,3-dimetoksi-4,5-(metilenadioksi)benzena) sebagai senyawa yang dominan. Minyak atsiri maupun ekstrak n-heksana buah sirih hutan bersifat toksik terhadap larva udang dan embrio ikan zebra, tetapi ekstrak n -heksana lebih aktif. Malformasi mayor kantung kuning telur, jantung, dan sirkulasi darah embrio ikan zebra, teramati pada kedua perlakuan dan diduga minyak atsiri dan ekstrak n-heksana bersifat anti-angiogenesis.
Saran
Perlu dilakukan penelitian lebih lanjut untuk memfraksionasi ekstrak n -heksana buah sirih hutan, menganalisis kinerja spesifik antikanker, dan mengelusidasi struktur senyawa yang diisolasi.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2006. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington (US): AOAC Int.
Ali TES, Legler J. 2011. Developmental toxicity of nonylphenol in zebrafish (Danio rerio) embryos. Indian J Mar Sci. 40(4):509-515.
Anggraeni D, Aurora H, Lyrawati D. 2014. Efek waktu paparan genistein terhadap pembentukan jantung embrio zebrafish. J Kedokteran Brawijaya. 28(1):22-25.
Arroyo J, Bonilla P, Exebio LM, Ronceros G, Tomas G, Huaman J, Raez E, Quino M, Calzado JR. 2013. Gastroprotective and antisecretory effect of a phytochemical made from matico leaves (Piper aduncum). Rev Peru Med Exp Salud Publica. 30(4):608-615.
Berghmans S, Jette C, Langenau D, Hsu K, Stewart R, Look T, Kanki JP. 2005. Making waves in cancer research: new model in the zebrafish. Biotechniques. 39(2):227-237.
Bernard CB, Arnason JT, Philogene BJR, Lam J, Waddell T. 1990. In vivo effect of mixtures of allelochemicals on the life cycle of the European corn borer, Ostrina nubialis. Entomol Exp Appl. 57:17-22.
Bernard CB, Krishnamurty HG, Chauret D, Durst T, Philogene BJR, Sanchez-Vindas P, Hasbun C, Poveda L, San Roman L, Arnason JT. 1995. Insecticidal defenses of Piperaceae from the neotropics. J Chem Ecol. 21(6):801-814. Bie GVD. 2001. Embryology: Early Development from a Phenomenological Point
of View. Driebergen (NL): Louis Bolk Institute.
Braga FG, Bouzada MLM, Fabri RL, Matos M, Moreira FO, Scio E, Coimbra ES. 2007. Antileishmanial and antifungal activity of plants used in traditional medicine in Brazil. J Ethnopharmacol. 111:396-402.
Brannen KC, Panzica–Kelly JM, Danberry TL, Augustine-Rauch KA. 2010. Development of a zebrafish embryo teratogenecity assay and quantitative prediction model. Birth Defects Res Part B: Dev Reprod Toxicol. 89:66-77. Carballo JL, Hernandez-Inda ZL, Perez P, Garcia-Gravalos MD. 2002. A
comparison between two brine shrimp assays to detect in vitro cytotoxicity in marine natural products. BMC Biotechnol. 2(17):1-5.
Chakraborty C, Hsu CH, Wen ZH, Lin CS, Agoramoorthy G. 2009. Zebrafish: a complete animal model for in vivo drug discovery and development. Curr Drug Metabolism. 10(2):116-124.
Chen J. 2013. Impaired cardiovascular function caused by different stressors elicits a common pathological and transcriptional responses in zebrafish embryos. Zebrafish. 10(3):389-400.
Colegate SM, Molyneux RJ. 2008. Bioactive Natural Products: Detection, Isolation, and Structural Determination. California (US): CRC Pr.
Denvir MA, Tucker CS, Mullias JJ. 2008. Systolic and diastolic ventricular function in zebrafish embryos: influence of norepinephrine, MS-222, and temperature. Biomed Central. 21:1-8.
[Depkes RI] Departemen Kesehatan RI. 1992. Pedoman Fitofarmaka. Jakarta (ID): Departemen Kesehatan RI.
Diaz LE, Munoz DR, Prieto RE, Cuervo SA, Gonzalez DL, Guzman JD, Bhakta S. 2012. Antioxidant, antitubercular and cytotoxic activities of Piper imperiale. Molecules. 17(4):4142-4147.
Ferreira AK, de-Sa-Junior PL, Pasqualoto KF, de Azevedo RA, Camara DA, Costa AS, Fiqueiredo CR, Matsuo AL, Massaoka MH, Auada AV et al. 2014. Cytotoxic effects of dillapiole on MDA-MB-231 cells involve the induction of apoptosis through the mitochondrial pathway by inducing an oxidative stress while altering the cystoskeleton network. Biochimie. 99:195-207. Frank CL. 1995. Toksikologi Dasar. Edi, penerjemah. Jakarta (ID): UI Pr.
Terjemahan dari: Basic of Toxicology.
Harborne JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah; Sofia M, editor. Bandung (ID): Institut Teknologi Bandung. Terjemahan dari: Phytochemical Methods.
Hasyim DM. 2011. Potensi buah sirih hutan (Piper aduncum) sebagai insektisida botani terhadap larva Crocidolomia pavonana [tesis]. Bogor (ID): Institut Pertanian Bogor.
Hill AJ, Teraoka H, Heideman W, and Peterson RE. 2005. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicol Sci. 86:6-19.
Hsu CH, Wen ZH, Lin CS, Chakraborty C. 2007. The zebrafish model: use in studying cellular mechanism for a spectrum of clinical disease entities. Curr Neurovascular Res. 4:111-120.
Jamal Y, Agusta A, Praptiwi. 2003. Komposisi kimia dan efek antibakteri minyak atsiri buah gedebong (Piper aduncum L.). Maj Farm Indones. 14:284-289. Kari G, Rodeck U, Dicker AP. 2007. Zebrafish: an emerging model system for
human disease and drug discovery. Clin Pharmacol Therapeutics. 82:70-80. Kaufman PB, Kirakosyan A, McKenzie M, Dayanandan P, Hoyt JE, Li C. 2006.
The uses of plant natural products by humans and risks associated with their use. Di dalam: Cseke LJ, Kirakosyan A, Kaufman PB, Warber SL, Duke JA, Brielman HL, editor. Natural Products from Plants. Boca Raton (US): CRC Pr. hlm 441-473.
Kim DJ, Seok SH, Baek MW, Lee HY, Na YR, Park SH, Lee HK, Dutta NK, Kawakami K, Park JH. 2009. Developmental toxicity and brain aromatase induction by high genistein concentrations in zebrafish embryos. Toxicol Mechanisms and Methods. 19(3):251-256.
Kumar V, Cotran RS, Robbins SL. 1997. Basic Pathology.6th Edition. Philadelphia (US): WB Saunders.
Ma C, Pang C, Seng WL, Zhang C, Willet C, Mc Grath P. 2007. Zebrafish, an in vivo model for drug screening. Drug Discovery. 6:38-45.
Maia JGS, Zohhbi MGB, Andrade EHA, Santos AS, da Silva MHL, Luz AIR, Bastos CN. 1998. Constituents of the essential oil of Piper aduncum L. growing wild in the Amazon region. Flavour Fragr J. 13:269-272.
Meinelt T, Schulz C, Wirth M, Kurzinger H, Steinberg T. 1999. Dietary fatty acid composition influences the fertilization of zebrafish (Danio rerio). J Appl Ichthyol. 15:19-23.
Meyer BN, Ferrigni NR, Putman JE, Jacobson LB, Nichol DE, McLaughlin JL. 1982. Brine shrimps: a convenient general bioassay for active plant constituent. Planta Med. 45:31-34.
Moore JL, Rush LM, Breneman C, Mohideen MAPK, Cheng KCL. 2006. Zebrafish genomic instability mutants and cancer susceptibility. Genetics. 10:1-33. Nicoli S, Presta M. 2007. The zebrafish/tumor xenografit angiogenesis assay.
[OECD] The Organization for Economic Co-operation and Development. 2013. OECD Guidelines for The Testing of Chemicals No. 236. Fish Embryo Acute Toxicity (FET) Test. Paris (FR): OECD.
Orjala J, Erdelmeier CAJ, Wright AD, Rali T, Sitcher O. 1993. Five new prenylated hydroxybenzoic acid derivatives with antimicrobial and moluscicidal activity from Piper aduncum leaves. Planta Med. 59(6):546-551.
Parmar VS, Jain SC, Bisht KS, Jain R, Taneja P, Jha A, Tyagi OD, Prasad AK, Wengel J, Olsen CE et al. 1997. Phytochemistry of the genus Piper. Phytochemistry. 46:597-673.
Pohlit AM, Pinto ACS, Mause R. 2006. Piper aduncum L: pluripotente plant and important phytochemical substance source. Revista Fitos. 2:7-18.
Rali T, Wossa SW, Leach DN, Waterman PG. 2007. Volatile chemical constituents of Piper aduncum L. and Piper gibbilimbum C. DC (Piperaceae) from Papua New Guinea. Molecules. 12:389-394.
Scott IM, Jensen HR, Philogene BJR, Arnason JT. 2008. A review of Piper spp. (Piperaceae): phytochemistry, insecticidal activity, and mode of action. Phytochem Rev. 7:65-75.
Serbedzija GN, Flynn E, Willett CE. 2000. Zebrafish angiogenesis: a new model for drug screening. Angiogenesis. 3:353-359.
Sudrajat. 2010. Bioprospeksi tumbuhan sirih hutan (Piper aduncum L.) sebagai sumber bahan baku obat larvasida nyamuk Aedes aegypti. Bioprospek. 7(2):35-40.
Sudrajat, Susanto D, Mintargo D. 2011. Bioekologi dan potensi senyawa bioaktif sirih hutan (Piper aduncum L.) sebagai sumber bahan baku larvasida nyamuk Aedes aegypti. Mulawarman Scientifie. 10:63-74.
Lampiran 1 Diagram alir penelitian
Sampel
Segar Kering
Minyak Atsiri Ekstrak
Kasar
GC-MS BSLT & ZFET Uji Fitokimia Uji
Toksisitas Identifikasi
Distilasi Maserasi
Lampiran 3 Kadar air serbuk dan rendemen buah sirih hutan
Lampiran 4 Hasil GC-MS minyak atsiri dan ekstrak n-heksana
No Senyawa
lanjutan Lampiran 4
No Senyawa
Minyak atsiri Ekstrak n-heksana Waktu
retensi (menit)
Area
(%) Kemiripan
Waktu retensi (menit)
Area
(%) Kemiripan 38 Asam
heksadekanoat
- - - 16.547 0.1 96
39 Dokosena - - - 16.718 0.03 98
40 Eikosana - - - 17.384 0.08 92
41 (Z,Z)-9,12-Asam oktadekadienoat
- - - 17.735 0.27 96
42 Nonadekana - - - 17.957 0.29 95
43 Triakontana - - - 27.805 0.08 95
44 α-Tokoferol - - - 29.301 0.09 96
45 -Sitosterol - - - 35.362 0.29 96
Lampiran 5 Spektrum MS senyawa dilapiol
Analisis fragmentasi senyawa dilapiol
m/z Struktur senyawa Fragmen yang hilang
222 -
207
195
lanjutan lampiran 5
m/z Struktur senyawa Fragmen yang hilang
149
121
Lampiran 6 Hasil uji BSLT dan analisis probit
Probit Analysis: Kematian, n versus Konsentrasi Minyak Atsiri
lanjutan Lampiran 6
Probit Analysis: Jumlah larva mati, n versus Konsentrasi n-Heksana
Distribution: Normal
Response Information
lanjutan Lampiran 7
Contoh analisis probit ekstrak n-heksana pada 96 jpf
Probit Analysis: Kematian, n versus Konsentrasi, Pengamatan
lanjutan Lampiran 7
Table of Percentiles
Standard 95.0% Fiducial CI Percent Percentile Error Lower Upper 1 -12.4521 4.02959 -21.9269 -5.60607 2 -9.10596 3.76131 -17.8967 -2.67706 3 -6.98297 3.59684 -15.3512 -0.807188 4 -5.38593 3.47652 -13.4432 0.606286 5 -4.08686 3.38105 -11.8960 1.76086 6 -2.98114 3.30163 -10.5828 2.74731 7 -2.01165 3.23351 -9.43437 3.61526 8 -1.14358 3.17378 -8.40868 4.39497 9 -0.354107 3.12056 -7.47809 5.10631 10 0.372604 3.07254 -6.62345 5.76308 20 5.77266 2.74978 -0.341923 10.7125 30 9.66648 2.56275 4.09417 14.3747 40 12.9936 2.44102 7.80634 17.5823
50 16.1034 2.36414 11.1998 20.6566
Lampiran 8 Analisis Anova dan uji lanjut Duncan Contoh analisis pada perlakuan n-heksana 96 jpf
lanjutan Lampiran 8
ANOVA
Sum of Squares df Mean Square F Sig.
Mati
Between Groups 25266.667 5 5053.333 28.425 .000
Within Groups 2133.333 12 177.778
Total 27400.000 17
Within Groups 1866.667 12 155.556
Total 3311.111 17
Menetas
Between Groups 26044.444 5 5208.889 33.486 .000
Within Groups 1866.667 12 155.556
Total 27911.111 17
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3.000.
Hidup_Normal
lanjutan Lampiran 8
Menetas
Duncan
Perlakuan N Subset for alpha = 0.05
1 2 3
40 ppm 3 .00
50 ppm 3 .00
30 ppm 3 6.67
10 ppm 3 60.00
20 ppm 3 60.00
kontrol 3 100.00
Sig. .545 1.000 1.000
Means for groups in homogeneous subsets are displayed.
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, 6 Januari 1992 dari pasangan Sawung Hermanto dan Yani Suhartati. Penulis merupakan anak pertama dari 3 bersaudara. Tahun 2009, penulis lulus dari SMA Negeri 3 Bogor dan pada tahun yang sama diterima di Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) melalui jalur Ujian Talenta Masuk IPB (UTMI).