UJI TOKSISITAS AKUT EKSTRAK METANOL DAUN
MAHKOTA DEWA (Phaleria macrocarpa [Scheff.] Boerl.)
TERHADAP LARVA Artemia salina Leach DENGAN
METODE BRINE SHRIMP LETHALITY TEST (BSLT)
Laporan Penelitian ini ditulis sebagai salah satu syarat untuk memperoleh gelar SARJANA KEDOKTERAN
OLEH:
Feby Wulandari
NIM: 1111103000010
PROGRAM STUDI PENDIDIKAN DOKTER
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI
SYARIF HIDAYATULLAH
JAKARTA
ii
LEMBAR PERNYATAAN KEASLIAN KARYA
Dengan ini saya menyatakan bahwa:
1. Laporan penelitian ini merupakan hasil karya asli saya yang diajukan untuk memenuhi salah satu persyaratan memperoleh gelar strata 1 di UIN Syarif Hidayatullah Jakarta.
2. Semua sumber yang saya gunakan dalam penulisan ini telah saya cantumkan sesuai dengan ketentuan yang berlaku di UIN Syarif Hidayatullah Jakarta.
3. Jika dikemudian hari terbukti bahwa karya ini bukan karya asli saya atau merupakan hasil jiplakan dari karya orang lain, maka saya bersedia menerima sa
Ciputat, 10 September 2014
iii
UJI TOKSISITAS AKUT EKSTRAK METANOL DAUN MAHKOTA DEWA
(Phaleria macrocarpa [Scheff.] Boerl.) TERHADAP LARVA Artemia salina
Leach DENGAN METODE BRINE SHRIMP LETHALITY TEST (BSLT)
Laporan Penelitian
Diajukan kepada Program Studi Pendidikan Dokter, Fakultas Kedokteran dan Ilmu Kesehatan untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran
(S.Ked)
Oleh
Feby Wulandari
NIM: 1111103000010
Pembimbing 1 Pembimbing 2
dr. Nurul Hiedayati, Ph.D Zilhadia, M.Si, Apt
NIDN: 2028027101 NIDN: 2022087303
PROGRAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
iv
PENGESAHAN PANITIA UJIAN
Laporan Penelitian ini berjudul UJI TOKSISITAS AKUT EKSTRAK METANOL DAUN MAHKOTA DEWA (Phaleria macrocarpa [Scheff.] Boerl.) TERHADAP LARVA Artemia salina Leach DENGAN METODE BRINE
SHRIMP LETHALITY TEST (BSLT) yang diajukan oleh Feby Wulandari (NIM:
1111103000010), telah diujikan dalam sidang di Fakultas Kedokteran dan Ilmu Kesehatan pada 10 September 2014. Laporan penelitian ini telah diterima sebagai salah satu syarat memperoleh gelar Sarjana Kedokeran (S.Ked) pada Program Studi Pendidikan Dokter.
Jakarta, 10 September 2014
DEWAN PENGUJI
Ketua Sidang Pembimbing 1 Pembimbing 2
dr. Nurul Hiedayati, Ph.D dr. Nurul Hiedayati, Ph.D Zilhadia, M.Si, Apt NIDN: 2028027101 NIDN: 2028027101 NIDN: 2022087303
Penguji 1 Penguji 2
dr. Flori Ratna Sari, Ph.D drg. Laifa Annisa Hendarmin, Ph.D
NIP: 197707272006042001 NIDN: 2002047801
PIMPINAN FAKULTAS
Dekan FKIK UIN Kaprodi PSPD FKIK UIN
v
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan nikmat iman, nikmat sehat dan nikmat Islam sehingga penulis dapat menyelesaikan laporan penelitian ini. Shalawat dan salam semoga selalu tercurahkan kepada Nabi Muhammad SAW. Penelitian ini dapat berjalan lancar dan terselesaikan pada waktunya karena adanya bimbingan, bantuan dan dukungan dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Prof. Dr (hc). dr. MK Tadjudin, Sp.And selaku Dekan FKIK UIN Syarif Hidayatullah Jakarta.
2. dr. Witri Ardini, M.Gizi, Sp.GK selaku Ketua Program Studi Pendidikan Dokter FKIK UIN Syarif Hidayatullah Jakarta.
3. dr. Nurul Hiedayati, Ph.D selaku pembimbing 1 yang telah banyak meluangkan waktu, pikiran dan tenaga untuk membimbing penulis dalam melakukan penelitian dan menyusun laporan penelitian serta memberikan masukan judul penelitian dan memberikan izin penggunaan Laboratorium Farmakologi untuk kepentingan penelitian.
4. Ibu Zilhadia, M.Si, Apt selaku pembimbing 2 yang telah banyak meluangkan waktu, pikiran dan tenaga untuk membimbing penulis dalam melakukan penelitian dan menyusun laporan penelitian.
5. dr. Flori Ratna Sari, Ph.D selaku penanggung jawab modul riset yang selalu membimbing penulis selama modul riset berlangsung dan mengingatkan penulis untuk segera menyelesaikan penelitian.
vi
7. Bapak Adrial dan Ibu Mariana selaku kedua orangtua penulis yang selalu mendoakan dan memberikan dukungan dalam bentuk materil atau non materil kepada penulis. Terima kasih atas segala kebaikan dan pelajaran hidup yang luar biasa hingga kini penulis beranjak dewasa.
8. Linda Hayani, S.ST, Hengki Ramiko, SE dan Muhammad Daffa Abu Hanif selaku saudara kandung penulis yang selalu mendoakan dan memberikan dukungan kepada penulis.
9. Mas Pandji, Mas Rachmadi, Mbak Ai, Mbak Rani dan Mbak Suryani selaku laboran yang telah membantu penulis dalam pengambilan data.
10. Akbar Sepada, Ayu Reskianingsih, Nur Zaki Hanifah dan Nurul Khafidz Subekti selaku teman satu kelompok penelitian penulis yang selalu bekerja sama dan saling memberikan dukungan selama melakukan penelitian.
11. Teman-teman di PSPD dan teman-teman lainnya yang penulis kenal namun tidak bisa penulis sebutkan satu persatu.
Ciputat, 10 September 2014
vii
ABSTRAK
Feby Wulandari. Program Studi Pendidikan Dokter. Uji Toksisitas Akut Ekstrak Metanol Daun Mahkota Dewa (Phaleria macrocarpa [Scheff.] Boerl.) Terhadap Larva Artemia salina Leach Dengan Metode Brine Shrimp Lethality Test (BSLT). 2014.
Phaleria macrocarpa [Scheff.] Boerl. merupakan tanaman dari famili Thymeleceae yang digunakan sebagai obat herbal di Indonesia. Daun ini mengandung falerin dan asam galat. Tujuan penelitian ini adalah untuk mengetahui potensi aktivitas sitotoksik ekstrak metanol daun mahkota dewa (Phaleria macrocarpa) terhadap larva Artemia salina Leach dengan metode Brine Shrimp Lethality Test (BSLT) yang ditunjukkan dengan nilai LC50. Penelitian eksperimental ini menggunakan 150 larva Artemia salina Leach untuk setiap kali perlakuan yang dibagi menjadi empat konsentrasi ekstrak dan satu kontrol negatif, masing-masing terdiri dari 10 larva dengan tiga kali replikasi. Konsentrasi ekstrak berurut-turut adalah 17,5 ppm, 12,5 ppm, 5 ppm dan 2,5 ppm. Dihitung total larva yang mati setelah 24 jam. Hasil dari analisis probit menunjukkan nilai LC50 ekstrak metanol daun Phaleria macrocarpa adalah 7,0550 µg/ml. Hal ini menunjukkan bahwa ekstrak metanol daun Phaleria macrocarpa memiliki potensi toksisitas akut terhadap larva Artemia salina Leach karena memiliki nilai LC50 <1000 ppm.
Kata kunci: Phaleria macrocarpa, Artemia salina, uji toksisitas akut, BSLT, LC50
ABSTRACT
Feby Wulandari. Medical Education Study Program. Acute Toxicity Test Of Methanol Leaf Extract from Mahkota Dewa (Phaleria macrocarpa [Scheff.] Boerl.) Towards The Artemia salina Leach Larva Using The Brine Shrimp Lethality Test (BSLT) Method. 2014.
Phaleria macrocarpa [Scheff.] Boerl. is a plant that includes in the Thymeleceae family which is known for its uses as the herbal medicine in Indonesia. The leaf of this plant contains phalerin and gallic acid. The purpose of this research is to know the cytotoxic activity of the methanol extract of the leaves from the mahkota dewa potential (Phaleria macrocarpa) towards Artemia salina Leach larva using the Brine Shrimp Lethality Test (BSLT) method with the score LC50. This experimental research uses 150 Artemia salina Leach larva for each session that is divided into four concentration extract and one negative control, it consists of 10 larva's each with 3 times replication. The extract concentration are 17,5 ppm, 12,5 ppm, 5 ppm and 2,5 ppm. The dead larva are counted after 24 hours. The result from the probit analysis shows score LC50 of methanol extract Phaleria macrocarpa leaf is 7,0550 µg/ml. It means that Phaleria macrocarpa methanol leaf extract does have the acute toxicity potential toward Artemia salina Leach larva due to having the score LC50 <1000 ppm.
viii
DAFTAR ISI
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN KEASLIAN KARYA ... ii
LEMBAR PERSETUJUAN PEMBIMBING ... iii
LEMBAR PENGESAHAN ... iv
KATA PENGANTAR ... v
ABSTRAK ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiv
BAB 1 PENDAHULUAN 1.1. Latar belakang ... 1
1.2. Rumusan masalah ... 2
1.3. Tujuan penelitian 1.3.1.Tujuan umum ... 2
1.3.2.Tujuan khusus ... 3
1.4. Manfaat penelitian 1.4.1.Bagi peneliti ... 3
1.4.2.Bagi institusi ... 3
1.4.3.Bagi masyarakat ... 3
BAB 2 TINJAUAN PUSTAKA 2.1. Landasan teori ... 4
2.1.1.Obat tradisional Indonesia ... 4
2.1.2.Tanaman Phaleria macrocarpa [Scheff.] Boerl. ... 6
2.1.2.1. Deskripsi tanaman ... 6
2.1.2.2. Studi fitokimia ... 7
ix
... ...
2.1.2.2.2. Kuantifikasi isolasi fitokonstituen ... 8
2.1.2.3. Bioaktivitas (aktivitas antikanker) ... 9
2.1.2.4. Uji toksisitas dan bioassay kanker ... 12
2.1.3.Toksikologi ... 14
2.1.3.1. Kondisi efek toksik ... 15
2.1.3.2. Mekanisme efek toksik ... 15
2.1.3.3. Sifat efek toksik ... 16
2.1.3.4. Uji toksikologi ... 16
2.1.4.Simplisia ... 18
2.1.4.1. Jenis simplisia ... 18
2.1.4.2. Tahapan pembuatan ... 19
2.1.5.Ekstraksi tanaman ... 20
2.1.5.1. Metode ekstraksi ... 20
2.1.5.2. Tahapan pembuatan ... 21
2.1.6.Brine shrimp lethality test ... 22
2.1.6.1. Artemia salina Leach ... 23
2.1.6.1.1. Spesies ekologi 24 2.1.6.1.2. Siklus hidup 25 2.1.6.2. Nilai LC50 ... 28
2.1.6.3. Pelarut metanol ... 29
2.1.6.4. Analisis probit ... 30
2.2. Kerangka konsep ... 31
2.3. Definisi operasional ... 32
BAB 3 METODE PENELITIAN 3.1. Desain penelitian ... 33
3.2. Lokasi dan waktu penelitian ... 33
3.3. Populasi dan sampel ... 33
3.3.1.Populasi ... 33
3.3.2.Sampel ... 33
3.3.2.1. Kriteria inklusi ... 33
3.3.2.2. Kriteria ekslusi ... 33
3.3.2.3. Besar sampel ... 33
3.3.2.4. Cara pengambilan sampel ... 33
3.4. Alat dan bahan penelitian ... 34
3.4.1.Alat penelitian ... 34
3.4.2.Bahan penelitian ... 34
3.5. Cara kerja penelitian ... 34
3.5.1.Determinasi tanaman dan proses pembuatan simplisia ... 34
3.5.2.Ekstraksi daun Phaleria macrocarpa [Scheff.] Boerl. dengan metode maserasi ... 34
3.5.3.Penyiapan larva Artemia salina Leach ... 35
3.5.4.Pembuatan konsentrasi ekstrak yang akan diuji ... 35
3.5.5.Uji toksisitas akut dengan metode bslt ... 36
x
3.7. Pengolahan dan analisis data ... 38
BAB 4 HASIL DAN PEMBAHASAN 4.1. Determinasi tanaman dan proses pembuatan simplisia ... 39
4.2. Ekstraksi daun Phaleria macrocarpa [Scheff.] Boerl. dengan metode maserasi ... 39
4.3. Uji toksisitas akut dengan metode bslt ... 41
BAB 5 SIMPULAN DAN SARAN 5.1. Simpulan ... 48
5.2. Saran ... 48
DAFTAR PUSTAKA ... 49
xi
DAFTAR TABEL
Tabel 2.1. Perbedaan obat tradisional/ obat herbal dengan obat modern ... 4
Tabel 2.2. Modalitas reproduksi Artemia salina ... 25
Tabel 2.3. Tingkat nilai toksisitas LC50 ... 28
Tabel 2.4. Sifat fisika dan kimia metanol ... 30
Tabel 4.1. Pengaruh berbagai konsentrasi ekstrak metanol daun Phaleria macrocarpa [Scheff.] Boerl. terhadap kematian larva Artemia salina Leach ... 42
Tabel 4.2. Perhitungan nilai LC50 ekstrak metanol daun Phaleria macrocrpa [Scheff.] Boerl. menggunakan analisis probit ... 43
xii
DAFTAR GAMBAR
Gambar 2.1. Strategi untuk posisi pengembangan produk ... 5
Gambar 2.2. Deskripsi tanaman dari Phaleria macrocarpa menunjukkan (a) kuncup bunga, (b) daun berwarna hijau dengan bentuk runcing, (c) buah berwarna hijau yang belum matang dan (d) buah berwarna merah yang sudah matang ... 7
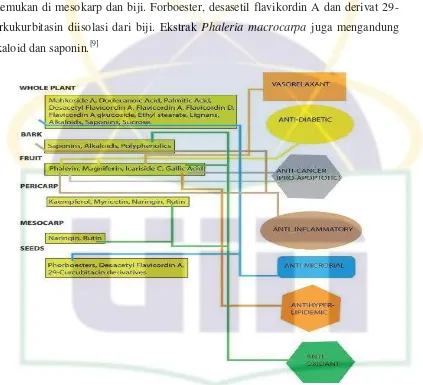
Gambar 2.3. Fitokonstituen diisolasi dari Phaleria macrocarpa dengan masing-masing aktivitas biologis ... 8
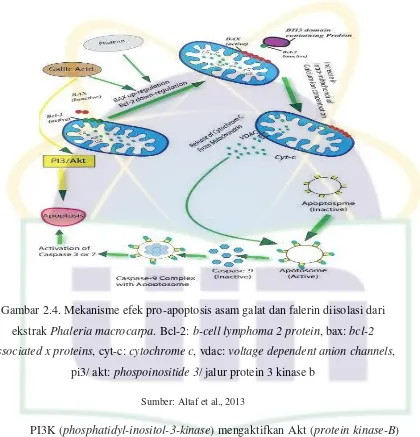
Gambar 2.4. Mekanisme efek pro-apoptosis asam galat dan falerin diisolasi dari ekstrak Phaleria macrocarpa. bcl-2: b-cell lymphoma 2 protein, bax: bcl-2 associated x proteins, cyt-c: cytochrome c, vdac: voltage dependent anion channels, pi3/ akt: phospoinositide 3/ jalur protein 3 kinase b ... 11
Gambar 2.5. Individu dari Artemia salina ... 24
Gambar 2.6. Siklus hidup Artemia salina ... 26
Gambar 2.7. Karakteristik anatomi nauplia dari Artemia salina ... 27
Gambar 2.8. Karakteristik anatomi dari Artemia salina dewasa ... 28
Gambar 4.1. Grafik pengaruh berbagai konsentrasi ekstrak metanol daun Phaleria macrocarpa [Scheff.] Boerl. terhadap kematian larva Artemia salina Leach ... 42
Gambar 4.2. Grafik regresi linier konsentrasi ekstrak metanol daun Phaleria macrocarpa [Scheff.] Boerl. terhadap nilai probit .... 45
Gambar 6.1. Hasil determinasi daun Phaleria macrocapa [Scheff.] Boerl. .. 57
Gambar 6.2. Sebanyak 1 kg serbuk simplisia halus daun Phaleria macrocarpa [Scheff.] Boerl. ... 57
Gambar 6.3. Telur Artemia salina Leach ... 57
xiii
Gambar 6.5. Maserasi menggunakan pelarut metanol ... 57 Gambar 6.6. Filtrat yang dipisahkan dari ampasnya ... 58 Gambar 6.7. Evaporasi menggunakan rotatory evaporator ... 58 Gambar 6.8. Sebanyak 169,7650 g ekstrak kental metanol daun Phaleria
macrocarpa [Scheff.] Boerl. ... 58 Gambar 6.9. Sebanyak 2000 mg ekstrak kental daun Phaleria macrocarpa
[Scheff.] Boerl. ditimbang menggunakan neraca analitik ... 58 Gambar 6.10. Larutan induk konsentrasi 20000 ppm dihomogenkan
menggunakan hot plate stirrer ... 59 Gambar 6.11. Larutan uji konsentrasi 35 ppm, 25 ppm, 10 ppm dan 5 ppm
ekstrak metanol daun Phaleria macrocarpa [Scheff.] Boerl. .. 59 Gambar 6.12. Mengukur pH air laut menggunakan pH indicator paper ... 59 Gambar 6.13. Penetasan larva Artemia salina Leach ... 59 Gambar 6.14. Hasil uji toksisitas akut dengan metode bslt ... 60 Gambar 6.15. Menghitung kematian larva menggunakan digital colony
counter ... 60 Gambar 6.16. Hasil determinasi larva Artemia salina Leach menggunakan
xiv
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan konsentrasi ekstrak metanol daun Phaleria
1
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Kanker merupakan salah satu penyebab utama kematian di seluruh dunia, dilaporkan 8,2 juta kematian pada tahun 2012. Lebih dari 60% dari total kasus baru tahunan di dunia terjadi di Afrika, Asia, Amerika Tengah dan Amerika Selatan. Wilayah tersebut menyumbang 70% dari kematian akibat kanker di dunia.[1] Kanker menempati urutan keenam penyebab kematian terbesar di Indonesia.[2] Saat ini usaha penyembuhan menggunakan obat kanker kurang memuaskan karena memiliki efek samping yang besar, harga yang mahal dan sulit diperoleh. Hal tersebut mendorong dilakukannya pencarian sumber baru senyawa antikanker dari alam.[3]
Pengobatan herbal adalah penggunaan biji, buah, akar, daun, kulit batang, atau bunga tanaman untuk tujuan pengobatan.[7] Pengobatan herbal telah digunakan selama berabad-abad untuk mengobati berbagai kondisi kesehatan yang berbeda-beda. Pengobatan herbal merupakan salah satu yang paling umum digunakan untuk terapi komplementer dan alternatif oleh orang dengan kanker. Beberapa penelitian telah menunjukkan bahwa 6 dari 10 orang dengan kanker menggunakan obat herbal bersama pengobatan kanker konvensional.[8]
Berdasarkan uji toksisitas terhadap Artemia salina Leach, ekstrak etanol buah Phaleria macrocarpa memiliki nilai LC50 (lethal concentration) 30,42 ppm dan ekstrak etanol biji buah Phaleria macrocarpa memiliki nilai LC50 1,6 x 10-2 ppm.[3]
Untuk uji toksisitas akut digunakan metode Brine Shrimp Lethality Test (BSLT) karena cukup praktis, cepat, mudah, murah dan akurat. Metode
BSLT menggunakan hewan uji larva udang Artemia salina untuk pencarian senyawa antikanker baru yang berasal dari tanaman.[3] Artemia salina digunakan karena merupakan organisme zoologi invertebrata yang sederhana.[31] Media yang digunakan yaitu air laut[3] dan pelarut yang digunakan yaitu metanol.Metode ini dilakukan dengan menentukan besarnya LC50 selama 24 jam.[3] Penelitian ini bertujuan sebagai uji pendahuluan aktivitas antikanker daun Phaleria macrocarpa dari daerah Ciputat. Dengan demikian dilakukan uji toksisitas akut ekstrak metanol daun Phaleria macrocarpa dengan metode BSLT.
1.2. Rumusan Masalah
Apakah ekstrak metanol daun mahkota dewa (Phaleria macrocarpa [Scheff.] Boerl.) memiliki toksisitas akut terhadap larva Artemia salina Leach dengan metode Brine Shrimp Lethality Test (BSLT)?
1.3. Tujuan Penelitian
1.3.1. Tujuan Umum
1.3.2. Tujuan Khusus
a. Diketahuinya persentase kematian larva Artemia salina Leach setelah pemberian ekstrak metanol daun mahkota dewa (Phaleria macrocarpa [Scheff.] Boerl.).
b. Diketahuinya nilai LC50 ekstrak metanol daun mahkota dewa (Phaleria macrocarpa [Scheff.] Boerl.) dengan metode Brine Shrimp Lethality Test
(BSLT).
1.4. Manfaat Penelitian
1.4.1. Bagi Peneliti
a. Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran di Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
b. Memperoleh pengalaman di bidang penelitian eksperimental terutama di bidang kesehatan.
1.4.2. Bagi Institusi
a. Menambah jumlah dan jenis penelitian yang telah dilakukan di Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
b. Menambah referensi penelitian untuk melakukan penelitian lebih lanjut bagi peneliti yang lain.
1.4.3. Bagi Masyarakat
4
BAB 2
TINJAUAN PUSTAKA
2.1. Landasan Teori
2.1.1. Obat Tradisional Indonesia
Saat ini obat tradisional cukup banyak digunakan oleh masyarakat untuk mengobati diri sendiri (self-medication), namun profesi kesehatan atau dokter umumnya masih enggan untuk meresepkan atau menggunakannya karena bukti ilmiah mengenai khasiat dan keamanan obat tradisional pada manusia masih kurang.[13] Alasan masyarakat menggunakan obat tradisional yaitu lebih terjangkau, sesuai ideologi, meredakan kekhawatiran tentang efek samping obat kimia (sintetis) dan keinginan untuk perawatan kesehatan yang lebih personal. Penggunaan obat tradisional meningkat ketika pengobatan konvensional tidak efektif dalam mengobati penyakit, seperti kanker dan penyakit menular.[14]
Tabel 2.1. Perbedaan obat tradisional/ obat herbal dengan obat modern
Obat modern Obat tradisional
Kandungan senyawa kimia Satu atau beberapa dimurnikan atau sintetik
Campuran banyak senyawa alami
Zak aktif Jelas Sering tidak diketahui/ tidak pasti Kendali mutu Relatif mudah Sangat sulit
Efektivitas dan keamanan Ada bukti ilmiah, uji klinik Umumnya belum ada bukti ilmiah/ uji klinik
Sumber: Dewoto, 2007
Pengobatan tradisional merupakan istilah komprehensif yang digunakan untuk sistem pengobatan tradisional seperti pengobatan tradisional Cina, Indian Aryuveda, pengobatan unani Arab dan berbagai bentuk pengobatan tradisional lainnya. Terapi pengobatan tradisional meliputi terapi medikasi (menggunakan obat-obatan herbal, hewan dan/ atau mineral) dan terapi nonmedikasi (tanpa menggunakan obat-obatan, seperti pada akupuntur, terapi manual dan terapi spiritual). Di negara dengan sistem pelayanan kesehatan yang berdasarkan pada obat allophatic, atau di mana obat tradisional belum dimasukkan ke dalam sistem pelayanan kesehatan nasional, pengobatatan tradisional disebut pengobatan “komplementer”, “alternatif”
tradisional adalah bahan atau ramuan bahan yang berupa bahan tumbuhan, bahan hewan, bahan mineral, sedian sarian (galenik), atau campuran dari bahan tersebut yang secara turun temurun telah digunakan untuk pengobatan dan dapat diterapkan sesuai dengan norma yang berlaku di masyarakat.[16]
Penggunaan obat tradisional di Indonesia merupakan bagian dari budidaya nasional dan telah di mulai berabad-abad yang lalu. Salah satu obat tradisional Indonesia adalah jamu, telah dinyatakan sebagai brand Indonesia oleh Susilo Bambang Yudhoyono, Presiden Republik Indonesia pada 27 Mei 2007 di Jakarta.[17] Jamu, umumnya campuran obat herbal, yaitu obat yang berasal dari tanaman. Bagian tanaman yang digunakan berupa akar, batang, daun, umbi atau seluruh bagian tanaman. Indonesia memiliki sekitar 25000-30000 spesies tanaman yang merupakan 80% dari jenis tanaman di dunia dan 90% dari jenis tanaman di Asia.[13] Di antara 30000 spesies tanaman di kepulauan Indonesia, diketahui sekurang-kurangnya 9600 spesies tanaman berkhasiat sebagai obat dan kurang lebih 300 spesies digunakan sebagai bahan obat tradisional oleh industri obat tradisional.[18]
Berdasarkan tingkat pembuktian khasiat, persyaratan bahan baku yang digunakan dan pemanfaatannya, obat bahan alam Indonesia dikelompokkan menjadi jamu, obat herbal terstandar dan fitofarmaka.[13] Obat tradisional yang didasarkan
pada “warisan” dan pendekatan empiris disebut jamu (obat herbal), sedangkan yang dihasilkan dari pendekatan ilmiah melalui uji pre-klinis disebut herbal terstandar. Bagi yang telah lulus uji klinis disebut fitofarmaka.[17]
2.1.2. Tanaman Phaleria macrocarpa (Scheff.) Boerl.
2.1.2.1. Deskripsi Tanaman
Phaleria macrocarpa (Scheff.) Boerl., umumnya dikenal sebagai God’s crown, mahkota dewa atau pau merupakan tanaman dari famili Thymeleceae yang
tumbuh di daerah tropis pulau Papua. Phaleria macrocarpa merupakan tanaman yang sempurna, termasuk batang, daun, bunga dan buah (Gambar 2.2). Tinggi Phaleria macrocarpa sekitar 1-18 m dengan panjang akar 1 m, kulit kayu berwarna
hijau kecoklatan dan kayu berwarna putih. Phaleria macrocarpa tumbuh 10-1200 m di atas permukaan laut dengan usia produktif sekitar 10-20 tahun. Daunnya berwarna hijau dan bentuknya lonjong dengan panjang 7-10 cm dan lebar 3-5 cm. Bunga Phaleria macrocarpa tersusun dari 2-4, berwarna hijau hingga merah marun. Bentuk
bijinya bulat dan berwarna putih serta beracun. Buah berbentuk gerhana dengan diameter 3 cm, berwarna hijau saat belum matang dan menjadi merah saat matang. Benih 1-2 per buah, berwarna coklat, ovoid dan anatropous. Ekstrak Phaleria macrocarpa memiliki sejumlah aktivitas farmakologi yaitu sebagai antitumor,
antihiperglikemia, antiinflamasi, antidiare, antioksidan, antivirus, antibakteri, antijamur dan vasodilator. Batangnya digunakan untuk mengobati kanker tulang; kulit dari benihnya untuk mengobati kanker payudara, kanker serviks, penyakit paru, hati dan jantung; daunnya untuk mengobati impotensi, penyakit darah, alergi, diabetes mellitus dan tumor.[9]
Taksonomi tanaman Phaleria macrocarpa (Hutapea et al., 1999; Winarto et al., 2003):[19]
Kingdom : Plantae
Divisi : Spermathophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Thymelaeales
Suku : Thymelaeaceae
Genus : Phaleria
Gambar 2.2. Deskripsi tanaman dari Phaleria macrocarpa menunjukkan (a) kuncup bunga, (b) daun berwarna hijau dengan bentuk runcing, (c) buah berwarna hijau yang
belum matang dan (d) buah berwarna merah yang sudah matang Sumber: Altaf et al., 2013
2.1.2.2. Studi Fitokimia
2.1.2.2.1. Studi Fitokimia Kualitatif
Berbagai kandungan kimia ditemukan pada Phaleria macrocarpa dengan berbagai konsentrasi yaitu mahkosida A, asam dodekanoik, asam palmitat, desasetil flavikordin A, flavikordin A, flavikordin D, flavikordin A glukosida, etil stearat, lignan dan sukrosa. Yang et al. mengisolasi mahkosida A untuk pertama kali dari biji Phaleria macrocarpa bersama dengan enam senyawa lainnya yaitu magniferin,
kaempferol-3-o-β-D-glukosida, asam dodekanoik, asam palmitat, etil stearat dan sukrosa. Lignan diisolasi dari bagian berbeda Phaleria macrocarpa, ketika mengalami chiral column analysis, ditemukan pinoresinol, larikiresinol dan matairesinol. Kulit kayu dan buahnya kaya akan saponin, alkaloid, polifenol, fenol, flavonoid, lignan dan tanin. Senyawa yang diisolasi dari buah termasuk ikarisida C3, magniferin dan asam galat. Falerin pertama kali diisolasi dari daun Phaleria macrocarpa sebagai glikosida benzofenon (3,4,5,
buah mengandung kaempferol, mirisetin, naringin dan rutin. Naringin dan quersitin ditemukan di mesokarp dan biji. Forboester, desasetil flavikordin A dan derivat 29-norkukurbitasin diisolasi dari biji. Ekstrak Phaleria macrocarpa juga mengandung alkaloid dan saponin.[9]
Gambar 2.3. Fitokonstituen diisolasi dari Phaleria macrocarpa dengan masing-masing aktivitas biologis
Sumber: Altaf et al., 2013
2.1.2.2.2. Kuantifikasi Isolasi Fitokonstituen
terdiri dari 9,1% mahkosida A, 0,21% kaempferol dan 0,1% magniferin, sedangkan 60% dari pasta kasar terdiri dari sukrosa.[9]
Total kandungan fenolik dari mesokarp, perikarp dan biji masing-masing 60,5 ± 0,17, 59,2 ± 0,04 dan 47,7 ± 1,04 mg GAE/gDW (galic acid equivalent/gram of dry weight). Total kandungan flavonoid dari perikarp ditemukan maksimum (161,3 ± 1,58 mg RE (rutin equivalent)/gDW) ketika dibandingkan dengan mesokarp dan biji (masing-masing 131,7 ± 1,66 dan 35,9 ± 2,47 mg RE/gDW).[9]
2.1.2.3. Bioaktivitas (Aktivitas Antikanker)
Daun dan buah Phaleria macrocarpa digunakan untuk mengobati berbagai jenis kanker terutama kanker payudara dan tumor otak. Suplementasi Phaleria macrocarpa dengan AC (adriamycin cyclosphamide) dapat mengurangi pertumbuhan tumor pada sel payudara dengan menginduksi apoptosis, juga melindungi kerusakan hati dan ginjal yang disebabkan oleh AC. Falerin dan asam galat berkontribusi besar untuk sifat sitotoksiknya.[9]
Ekstrak semipolar metanol Phaleria macrocarpa (sebagai DLBS1425) bertindak sebagai antiproliferasi, antiangiogenik dan menginduksi apoptosis pada sel kanker payudara.Ekstrak ini mengandung 20,26% falerin dan menginduksi apoptosis oleh fragmentasi DNA, aktivasi kaspase-9 dan diregulasi oleh Bcl-2 (B-cell lymphoma 2 protein) dan BAX (Bcl-2 associated X protein) pada tingkat mRNA.
domain WD-40 dari C-terminus dari APAF-1 (apoptotic protease activating factor-1) dan penghentian autoinhibisi domain ini, sementara dua domain lainnya dari
APAF-1 sebagai CARD (caspase activation and recruitment domain) dan NB-ARC (nucleotide binding adaptor shared by APAF-1, R and CED-4) domain ATPase (adenosine tri phosphatase) tetap dalam keadaan autoinhibisi. Cyt-c mengikat APAF-1 memicu pengikatan stabil dari ATP/ dATP pada nucleotide binding site dari APAF-1. Di hadapan tujuh molekul Cyt-c dan tujuh protein APAF-1, oligomerisasi dari APAF-1 ke dalam wheel-like heptagonal structure terjadi dan menyebabkan aktivasi apoptosom. Apoptosom menyebabkan pembelahan dan perekrutan APAF-3 (inactive procaspase-9) untuk mengaktifkan molekul kaspase-9. Kaspase merupakan sistein-aspartat-protease yang terdiri dari kaspase inisiator seperti 2, 8, 9, 10 dan kaspase efektor seperti 3, 6 dan 7. Aktivasi kaspase-9 inisiator selanjutnya mengaktifkan kaspase efektor, yang memicu kaskade kaspase 3, 6 dan 7. Hal ini mengaktifkan DNAase untuk menyebabkan fragmentasi DNA sehingga menginduksi apoptosis.[9]
DLBS1425 juga menekan ekspresi COX-2 (cyclo-oxygenase 2) mRNA dan ekspresi VGEF-C (vascular endothelial growth factor-C) mRNA sehingga menurunkan permeabilitas pembuluh darah yang selanjutnya mengurangi proliferasi dan migrasi sel endotel, sehingga menjadi antiangiogenesis. Protein kinase C juga dihambat oleh ekstrak ini menyebabkan penurunan regulasi faktor transkripsi sebagai activator protein-1, memberikan kontribusi lebih lanjut untuk aktivitas
Gambar 2.4. Mekanisme efek pro-apoptosis asam galat dan falerin diisolasi dari ekstrak Phaleria macrocarpa. Bcl-2: b-cell lymphoma 2 protein, bax: bcl-2 associated x proteins, cyt-c: cytochrome c, vdac: voltage dependent anion channels,
pi3/ akt: phospoinositide 3/ jalur protein 3 kinase b Sumber: Altaf et al., 2013
PI3K (phosphatidyl-inositol-3-kinase) mengaktifkan Akt (protein kinase-B) yang meregulasi kelangsungan hidup sel. Hal ini selanjutnya mengaktifkan mTOR, yang meregulasi pertumbuhan sel dan proliferasi. Pada sel kanker, jalur ini menjadi terlalu aktif dan mengurangi apoptosis, yang memungkinkan proliferasi. Asam galat menggunakan efek antiproliferasinya dengan menurunkan regulasi kelangsungan hidup Akt/ mTOR. Asam galat juga menurunkan regulasi fosforilasi dari aktivasi Ras/ mitogen jalur protein kinase, sehingga menekan ADAM (a disintegrin and mettalloproteinase)-metallopeptidase domain 17 (tumor necrosis factor alpha
converting enzyme), menurunkan invasi dan proliferasi sel. Asam galat berinteraksi
HeLa (human cervical cell line) dan HUVEC (human umbilical vein endothelial cell) in vitro dengan nilai IC50 (median inhibitory concentration) 80 μM untuk HeLa dan
400 μM untuk HUVEC.[9]
Ekstrak etanol daun Phaleria macrocarpa meningkatkan ekspresi NKG2D (type-II integral membran protein) dan CD-122 (subunit dari interleukin-2), molekul permukaan yang meningkatkan aktivitas killer triggering receptor pada NKC (natural killer cell) dari limpa sehingga meningkatkan aktivitas membunuh mereka. Hal ini meningkatkan produksi interferon-gamma, yang merupakan glikoprotein yang mengaktifkan sel imun, makrofag dan NKC, akhirnya meningkatkan pengenalan dari infeksi atau tumor dengan meningkatkan regulasi limfosit T.[9]
2.1.2.4. Uji Toksisitas dan Bioassay Kanker
Meskipun sejumlah sifat obat diklaim dalam pengobatan tradisional untuk ekstrak Phaleria macrocarpa, diketahui ada kecenderungan beracun dari ekstrak Phaleria macrocarpa.[20] Memakan buah matang Phaleria macrocarpa dapat menyebabkan ulkus oral,[9] mati rasa di lidah, mabuk dan keracunan.[20] Konsumsi Phaleria macrocarpa pada dosis yang lebih tinggi (27 mg/kg) menunjukkan
fetotoksisitas embrio pada tikus betina. Ekstrak butanol buah matang yang diberikan kepada tikus pada dosis yang lebih tinggi dari 85 mg/kg intraperitoneal menyebabkan nekrosis ringan tubulus konvoltus proksimal pada ginjal tikus. Ekstrak etanol Phaleria macrocarpa yang diberikan kepada burung puyuh Jawa pada dosis 50, 100
dan 200 mg/kg selama dua bulan menyebabkan hipertrofi hati ringan dan peningkatan aktivitas serum glutamat piruvat transaminase pada dosis 100 mg/kg. Literatur yang tersedia hingga saat ini tidak cukup untuk mengevaluasi profil beracun dari berbagai ekstrak tanaman obat ini sehingga menyebabkan keraguan tentang keberhasilan menggunakan ekstrak Phaleria macrocarpa dalam mengobati penyakit yang berbeda.[9]
HeLa, HM3KO (melanoma skin cancer cell) dan MCF-7 (human breast cancer cell line) dengan nilai IC50 masing-masing 40,2 ppm, 62,9 ppm dan 70,8 ppm.Selain itu, ekstrak etil asetat kulit kayu Phaleria macrocarpa menunjukkan aktivitas sitotoksik yang kuat terhadap L1210 (mouse leukemia cell) dengan nilai IC50 10,2 ppm. Uji sitotoksisitas pada ekstrak etil asetat dan metanol daun Phaleria macrocarpa menunjukkan bahwa ekstrak tersebut memiliki efek sitotoksik rendah terhadap HepG2 (human hepatoma cell line) dengan nilai IC50 masing-masing 32,5 ppm dan 40 ppm. Semua bagian dari buah Phaleria macrocarpa memperlihatkan sifat sitotoksik yang kuat terhadap MCF-7 dan HeLa dengan nilai IC50 20-40 ppm.[21]
Purwantini et al. menyatakan bahwa uji BSLT ekstrak etanol buah dan biji Phaleria macrocarpa masing-masing menunjukkan nilai LC50 30,42 ppm dan 1,6 x 10-2 ppm, kedua ekstrak bersifat toksik karena memiliki nilai LC50 kurang dari 1000 ppm.[22] Ekstrak metanol daun Phaleria macrocarpa memiliki nilai LC50 63,16 ppm.[10]
Lisdayati melakukan uji ketoksikan terhadap ekstrak n-heksan, etil asetat dan metanol masing-masing menghasilkan nilai IC50 11,83 ppm, 10,99 ppm dan 2,46 ppm. Nilai ini dianggap toksik karena nilai IC50 <10 ppm bersifat sitotoksik terhadap sel kanker. Penelitian lebih lanjut, Lisdayati melakukan uji bioassay in vitro dengan sel leukemia L1210 dan dosis yang diuji adalah 12, 10, 5 dan 0 ppm. Ekstrak n-heksan, etil asetat dan metanol masing-masing menghasilkan nilai IC50 5,35 ppm, 5,76 ppm dan 5,80 ppm. Dengan nilai IC50 <10 ppm, maka dapat menghambat pertumbuhan kanker 50% setelah inkubasi 48 jam.[22]
Uji bioassay dilakukan terhadap HeLa oleh Sumastuti dan Sonlimar. Dosis ekstrak buah/ daun 1; 5; 10; 50; 100 dan 200 mg/ml dibandingkan dengan doksorubisin 0,5; 1; 5; 10; 20 dan 50 mg/ml menunjukkan bahwa ekstrak air buah Phaleria macrocarpa dapat menghambat pertumbuhan HeLa setelah inkubasi 24
Pusparanti melakukan uji sitotoksik dari infus kulit batang Phaleria macrocarpa pada HeLa dengan menghitung persen kematian sel menggunakan biru
tripan (0,5%), diperoleh nilai LC50 40,12 mg/ml dan dapat disimpulkan bahan uji ini tidak memiliki daya sitotoksik terhadap HeLa karena nilainya lebih besar dari 1000 ppm.[22]
2.1.3.Toksikologi
Toksikologi adalah ilmu tentang aksi berbahaya zat kimia atas jaringan biologi dan dampaknya. Hal ini berarti bahwa dalam kondisi tertentu dalam jaringan biologi (tubuh), zat kimia dapat berinteraksi menimbulkan efek berbahaya dengan wujud dan sifat tertentu. Sedangkan ketoksikan atau toksisitas adalah kapasitas suatu zat kimia/ beracun (xenobiotik) untuk menimbulkan efek toksik tertentu pada manusia.[27]
Menurut bapak toksikologi, Paracelcus, dosis dapat membedakan antara obat dengan racun atau zat yang bukan racun dengan racun. Hal ini berarti bahwa obat bukan racun karena penggunaan obat diberikan berdasarkan aturan dosis tertentu yang umumnya tidak menimbulkan efek toksik atau manfaatnya jauh lebih besar daripada efek yang merugikan.[27]
sedangkan pada dosis maksimal sering timbul efek merugikan. Pada dosis yang sangat tinggi (over dosis) dapat timbul efek toksik yang berakibat fatal.[27]
2.1.3.1. Kondisi Efek Toksik
Masuknya zat kimia dalam tubuh diawali melalui intravaskular (injeksi IV, intrakardial, intraarteri) atau ekstravaskular (oral, inhalasi, injeksi intramuskular, rektal), kemudian zat tersebut masuk ke dalam sirkulasi sistemik dan didistribusikan keseluruh tubuh. Proses distribusi ini memungkinkan zat atau metabolitnya sampai pada tempat kerjanya (reseptor). Efek toksik dapat terjadi akibat interaksi zat kimia atau metabolitnya yang berlebihan. Selain itu, zat kimia dapat menjadi senyawa non aktif dan diekskresikan (eliminasi) sehingga dapat mengurangi jumlah zat kimia dalam sel sasarannya. Dengan demikian, timbulnya efek toksik dipengaruhi juga oleh selisih antara absorbsi dan distribusi, metabolisme dan ekskresinya.[27]
2.1.3.2. Mekanisme Efek Toksik
2.1.3.3. Sifat Efek Toksik
Jenis sifat efek toksik, yaitu:[27] a. Terbalikkan (reversibel)
Efek toksik cepat kembali ke normal.
Reseptor kembali semula bila kadar racun dalam reseptor habis.
Ketoksikan tergantung dosis, kecepatan absorpsi, distribusi dan eleminasi zat racun.
b. Tidak terbalikkan (irreversibel)
Kerusakan permanen.
Akumulasi efek toksik.
Paparan takaran kecil jangka panjang sama dengan takaran besar jangka pendek.
2.1.3.4. Uji Toksikologi
Serangkaian uji harus dilakukan sebelum obat beredar dipasaran sehingga keamanan, efektivitas dan mutu obat terjamin. Uji tersebut dimulai dari skrining untuk mencari senyawa aktif, dilanjutkan uji efektivitas atau selektivitas dan mekanisme kerjanya pada hewan uji atau mikroba. Setelah diketahui memiliki aktivitas farmakologi, akan dilakukan serangkaian uji keamanan pada hewan uji, meliputi:[27]
a. Uji toksisitas akut: Merupakan efek berbahaya yang terjadi setelah terpapar dosis tunggal atau berulang dalam waktu 24 jam untuk menentukan dosis letal median (LD50, LC50) dan dosis maksimal yang masih dapat ditoleransi hewan uji, lalu hasilnya akan ditransformasi pada manusia. Tujuan uji toksisitas akut, yaitu:
Menentukan interval dosis untuk uji berikutnya (uji farmakologi, toksisitas subakut dan toksisitas jangka panjang).
Mengklasifikasikan zat uji termasuk kategori toksik atau tidak toksik.
Mengetahui hubungan antara dosis dengan timbulnya efek seperti perubahan perilaku, koma atau kematian.
Mengetahui gejala toksisitas akut untuk membantu diagnosis kasus keracunan.
Memenuhi persyaratan regulasi jika zat uji dikembangkan menjadi obat.
Mencari zat yang berpotensi sebagai antikanker.
Keperluan evaluasi bahaya suatu zat melalui data seperti nilai slope dari grafik hubungan antara log dosis versus respon.
Mengetahui pengaruh usia, jenis kelamin, cara pemberian dan faktor lingkungan terhadap toksisitas suatu zat.
Mengetahui variasi respon antar spesies dan antar strain (hewan, mikroba) serta menginformasikan reaktivitas suatu populasi hewan.
b. Uji toksisitas subakut: Untuk menentukan organ sasaran (organ yang rentan) atau tempat kerjanya. Umumnya menggunakan tiga dosis, dilakukan selama 4 minggu hingga 3 bulan dan menggunakan dua spesies berbeda.
c. Uji toksisitas kronik: Untuk memantau obat yang akan digunakan dalam waktu yang cukup lama. Tujuannya hampir sama dengan uji toksisitas subakut. Menggunakan hewan rodent dan non rodent (anjing) selama 6 bulan atau lebih. d. Uji efek pada organ reproduksi: Untuk melihat perilaku yang berkaitan dengan
reproduksi (perilaku kawin), perkembangan janin, kelainan janin, proses kelahiran dan perkembangan setelah dilahirkan.
e. Uji karsinogenik: Untuk mengetahui zat yang dipakai dalam jangka panjang akan menimbulkan kanker atau tidak. Dilakukan selama 2 tahun pada dua spesies hewan.
Uji formulasi dilakukan jika zat pada obat dikatakan aman setelah dilakukan serangkaian uji keamanan, selanjutnya dilakukan uji klinik pada manusia, meliputi:[27]
a. Uji klinik fase I: Dilakukan pada orang yang sehat untuk mengetahui keamanan zat aktif pada manusia, rentang dosis yang aman dan profil farmakokinetiknya. b. Uji klinik fase II: Dilakukan pada orang yang sakit dalam jumlah sedikit untuk
c. Uji klinik fase III: Dilakukan pada pasien dalam jumlah relatif besar secara random control dan double blind untuk melihat efektivitasnya dan kemungkinan
timbul efek yang tidak diinginkan.
d. Uji klinik fase IV: Post marketing surveillance untuk mengetahui efektivitasnya dan melihat efek yang tidak diinginkan setelah digunakan secara masal (pasien tidak ditentukan kriterianya) yang tidak terdeteksi pada uji klinik fase II. Dilakukan setelah obat mendapatkan izin edar sementara.
2.1.4. Simplisia
Simplisia merupakan bahan yang belum mengalami perubahan apapun kecuali bahan alam yang dikeringkan. Sumber simplisia dapat diperoleh dari tanaman liar dan tanaman hasil budidaya (kultivasi). Mutu yang dihasilkan dari tanaman liar kurang baik untuk dijadikan sumber simplisia dibandingkan dengan tanaman hasil budidaya karena usia atau bagian tanaman yang diproses tidak tepat, jenis atau spesies tanaman yang dipanen tidak sama dan tempat tumbuh yang berbeda (kualitas tanah, kadar air, sinar matahari) sehingga menyebabkan perbedaan kandungan senyawa aktif. Faktor yang mempengaruhi kualitas simplisia yaitu bahan simplisia dan cara penanganannya, proses pengolahan simplisia serta cara pengemasan dan penyimpanan simplisia.[28]
2.1.4.1. Jenis Simplisia
Simplisia dibedakan menjadi:[28]
a. Simplisia nabati: Simplisia berupa tanaman utuh, bagian tanaman atau eksudat tanaman.
b. Simplisia hewani: Simplisia berupa hewan utuh, bagian hewan atau zat berguna bukan berupa zat kimia murni yang dihasilkan hewan.
2.1.4.2. Tahapan pembuatan
Proses pembuatan simplisia melalui beberapa tahap, yaitu:[28]
a. Pengambilan bahan baku: Kadar bahan aktif dalam simplisia bergantung pada bagian tanaman yang digunakan, usia atau bagian tanaman saat panen, waktu panen dan lingkungan tumbuh. Misalnya daun, pengambilan dilakukan pada saat tanaman mengalami perubahan pertumbuhan dari vegetatif ke generatif karena pada saat itu penumpukan senyawa aktif berada dalam kondisi optimal sehingga memiliki mutu terbaik; atau dipetik satu per satu dari pucuk yang sudah tua atau muda.
b. Sortasi basah: Untuk memisahkan bahan simplisia dari kotoran/ bahan asing lain. c. Pencucian: Dilakukan dengan air bersih yang bersumber dari sumur, PAM atau
mata air. Pencucian dilakukan sesingkat mungkin jika simplisia mengandung zat yang mudah larut dalam air mengalir.
d. Perajangan: Untuk menurunkan ukuran atau menghaluskan bahan tanaman secara mekanik dan mempermudah proses pengeringan, pengepakan dan penggilingan. Perajangan dapat dilakukan dengan pisau atau mesin perajang khusus (penggiling palu untuk memecah bongkahan bahan yang rapuh, penggiling geligi untuk menggiling biji-biji yang keras atau bahan yang sudah dipotong, dll).
e. Pengeringan: Untuk menurunkan kadar air sehingga menghentikan reaksi enzimatik dan mencegah terjadinya penurunan mutu atau perusakan simplisia sehingga simplisia dapat disimpan dalam jangka waktu lama. Sebaiknya pengeringan dilakukan secara cepat pada suhu tidak terlalu tinggi (antara 30-90°C, terbaik 60°C) agar tidak terjadi perubahan kimia kandungan senyawa aktif atau pengeringan menggunakan microwave untuk jangka pendek. Risiko kontaminasi mikrobiologi atau debu terjadi akibat pengeringan dengan panas matahari di alam terbuka, sedangkan tumbuhnya kapang pada simplisia terjadi akibat pengeringan dalam jangka panjang.
f. Sortasi kering: Dilakukan sebelum pengemasan simplisia untuk memisahkan simplisia dari benda asing.
ketahanan simplisia. Simplisia dapat rusak atau berubah mutunya karena sinar dengan panjang gelombang tertentu (menimbulkan perubahan kimia pada simplisia), pengaruh oksigen udara (terjadi oksidasi pada senyawa tertentu dalam simplisia), reaksi oleh enzim, kelembaban udara lebih rendah dari kadar air simplisia (simplisia kehilangan air sehingga menjadi keriput) dan pengotoran simplisia (debu, cangkang telur, kapang, dll).
h. Pemeriksaan mutu: Dilakukan dengan membandingkan mutu simplisia saat masa panen atau pembelian dari pedagang dengan simplisia pembanding.
2.1.5. Ekstraksi Tanaman
Ekstraksi adalah proses pemisahan kandungan kimia yang dapat larut dengan pelarut cair sehingga terpisah dari bahan yang tidak dapat larut, sedangkan ekstrak adalah sediaan kental hasil ekstraksi senyawa aktif dari simplisia nabati atau hewani. Faktor yang mempengaruhi pembuatan ekstrak yaitu jumlah simplisia, derajat kehalusan simplisia, pelarut yang digunakan, suhu dan lama waktu penyari serta proses ekstraksi.[29]
2.1.5.1. Metode Ekstraksi
Ekstraksi menggunakan pelarut dibedakan menjadi: a. Cara dingin
Maserasi: Proses ekstraksi simplisia dengan merendam serbuk simplisia menggunakan pelarut dengan beberapa kali pengadukan pada suhu kamar dan terlindung dari cahaya, lalu ekstrak dikeluarkan dan ampas hasil ekstraksi dicuci dengan pelarut yang segar sampai didapat berat yang sesuai. Cara ini merupakan cara penyarian sederhana dengan menggunakan peralatan yang sederhana tetapi waktu untuk mengekstraksi sampel cukup lama dan cairan penyari yang digunakan lebih banyak (Dinda, 2008) serta tidak begitu sempurna dalam menarik zat berkhasiat dari tanaman. Remaserasi merupakan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dst.[28,29,30]
terdiri dari tahap pengembangan bahan, maserasi antara dan perkolasi sebenarnya hingga diperoleh perkolat (ekstrak) yang jumlahnya 1-5 kali bahan.[28, 29]
b. Cara panas
Refluks: Proses ekstraksi dengan pelarut pada suhu titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.[29]
Soxhlet: Proses ekstraksi menggunakan pelarut yang selalu baru dan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.[29]
Digesti: Proses maserasi kinetik (pengadukan terus-menerus) pada suhu 40-50°C.[29]
Infus: Proses ekstraksi dengan pelarut air pada suhu penangas air (bejana infus dicelupkan dalam penangas air dengan suhu 96-98°C) selama 15-20 menit.[29]
Dekok: Proses infus dengan waktu yang lebih lama (≥30°C) dan suhu sampai
titik didih air.[29]
2.1.5.2. Tahapan Pembuatan
Proses pembuatan ekstrak melalui beberapa tahap, yaitu:[29]
a. Pembuatan serbuk simplisia kering: Proses ekstraksi semakin efektif dan efisien jika serbuk simplisia semakin halus.
b. Cairan pelarut: Sebaiknya menggunakan pelarut yang optimal untuk memisahkan senyawa kandungan berkhasiat dari senyawa kandungan lain. Pelarut yang dibolehkan yaitu air dan alkohol (eter) serta campurannya, sedangkan pelarut yang umumnya digunakan untuk tahap separasi dan fraksinasi (pemurnian) yaitu metanol, heksana, toluen, kloroform dan aseton. Faktor yang dipertimbangkan dalam pemilihan cairan penyari yaitu selektivitas, kemudahan bekerja dan proses dengan cairan tersebut, ekonomis, ramah lingkungan dan aman.
d. Pemekatan/ penguapan (vaporasi dan evaporasi): Untuk meningkatkan jumlah senyawa terlarut secara penguapan pelarut tanpa sampai menjadi kering (ekstrak menjadi kental/ pekat).
e. Pengeringan ekstrak: Untuk mengilangkan pelarut dari bahan sehingga menghasilkan serbuk dengan cara pengeringan evaporasi, vaporasi, sublimasi, konveksi, kontak, radiasi atau dielektrik.
f. Rendemen: Membandingkan ekstrak yang diperoleh dengan simplisia awal.
2.1.6. Brine Shrimp Lethality Test
Brine Shrimp Lethality Test (BSLT) merupakan bioassay spektrum luas
yang mampu mendeteksi adanya efek sitotoksisitas dan senyawa bioaktif yang terdapat dalam ekstrak. Uji ini menggunakan larva Artemia salina Leach sebagai hewan uji karena merupakan organisme zoologi invertebrata yang sederhana. Pelarut yang umumnya digunakan untuk melarutkan bahan uji yaitu metanol, DMSO (dimetil sulfoksida), Tween 20, air dan etanol.[31] Selain itu, sebagai media uji digunakan air laut murni atau air laut buatan dengan melarutkan garam tidak beryodium ke dalam air.[32] Uji toksisitas dengan metode BSLT merupakan uji toksisitas akut, dimana efek toksik dari suatu senyawa ditentukan dalam waktu 24 jam setelah dosis uji diberikan.[33]
Uji ini dilakukan dengan menentukan nilai LC50 setelah 24 jam masa inkubasi. Hewan uji dianggap mati jika tidak ada gerakan yang terdeteksi selama 10 detik pengamatan. Nilai LC50 dihitung menggunakan analisis probit.[31] Ekstrak bersifat toksik jika nilai LC50 <1000 ppm, sehingga dapat dilakukan penelitian lebih lanjut untuk mengisolasi senyawa sitotoksik tanaman sebagai upaya mengembangkan obat alternatif antikanker.[34] Sedangkan, bila nilai LC50 >1000 ppm, maka ekstrak tersebut bersifat tidak toksik, sehingga dapat dilakukan penelitian lebih lanjut untuk mengetahui khasiat lainnya dengan menggunakan hewan uji seperti mencit atau tikus secara in vivo.[33]
Metode BSLT memiliki beberapa keuntungan, yaitu:
b. Cepat waktu ujinya, sederhana (tanpa membutuhkan teknik aseptik), jumlah organisme banyak dan membutuhkan sedikit sampel uji.[32]
c. Metode yang telah teruji hasilnya dengan tingkat kepercayaan 95% untuk mengamati toksisitas suatu senyawa di dalam ekstrak kasar tanaman.[35]
d. Sering digunakan dalam tahap awal isolasi senyawa toksik yang terkandung di dalam ekstrak kasar tanaman.[35]
e. Sering dikaitkan sebagai metode penapisan untuk penyarian senyawa antikanker dari tanaman.[35]
f. Dapat mengevaluasi toksisitas logam berat, pestisida dan obat-obatan (terutama ekstrak tanaman alami).[30]
2.1.6.1. Artemia salina Leach
Artemia salina Leach adalah arthropoda primitif air (danau garam) dari
famili Artemiidae (Gambar 2.5). Ditemukan oleh seorang ahli geografi Iran untuk pertama kalinya pada tahun 982 di danau Urmia (Asem, 2008), lalu diberi nama Cýncer salinus oleh Linny (1758) dan diubah menjadi Artemia salina oleh Leach
(1819).[11]
Taksonomi Artemia salina:[11]
Kingdom : Animalia
Filum : Arthropoda
Subfilum : Crustacea
Kelas : Branchiopoda
Ordo : Anostraca
Famili : Artemiidae
Genus : Artemia
Spesies : Artemia salina (Linnaeus, 1758)
Spesies Artemia salina merupakan salah satu organisme yang sesuai untuk mengetahui bioaktivitas senyawa melalui uji toksisitas karena:
misalnya tipe DNA-dependent RNA polymerase pada Artemia salina serupa dengan ouabaine-sensitive Na+ dan K+ dependent ATPase pada mamalia (Solis et al., 1993). Jika RNA polymerase dihambat, maka DNA tidak dapat mensintesis RNA, akibatnya sintesis protein terhambat sehingga mengganggu metabolisme sel dan menyebabkan kematian sel.[42]
b. Telur Artemia salina dapat hidup dalam kondisi kering selama beberapa tahun dan mudah menetas dalam 48 jam sehingga dihasilkan larva Artemia salina dalam jumlah banyak untuk diuji.[43]
c. Larva Artemia salina memiliki toleransi yang tinggi terhadap selang salinitas air tawar hingga air yang memiliki garam jenuh,[44] mampu mengatasi perubahan tekanan osmotik dan regulasi ionik yang tinggi,[25] serta memiliki membran kulit yang tipis sehingga kematian larva akibat efek sitotoksik dari senyawa bioaktif dianalogikan dengan kematian sel dalam organisme.[24]
Gambar 2.5. Individu dari Artemia salina Sumber: Dumitrascu, 2011
2.1.6.1.1. Spesies Ekologi
Artemia salina hanya hidup di danau dan kolam dengan salinitas tinggi
salinitas yang ekstrim (Croghan, 1957). Artemia salina dapat bertahan hidup di air dengan defisiensi oksigen yang tinggi. Konsentrasi minimum oksigen untuk Artemia salina dewasa sangat rendah (0,5 mg/l) dan untuk nauplia <0,3 mg/l.[11]
2.1.6.1.2. Siklus Hidup
Perkembangbiakan Artemia salina terbagi menjadi ovipar dan ovovivipar. Faktor lingkungan yang mempengaruhi cara reproduksi Artemia salina yaitu konsentrasi oksigen dalam air dan fluktuasinya, jenis makanan, salinitas, dll (Tabel 2.2).[11]
Tabel 2.2. Modalitas reproduksi Artemia salina Perkembangbiakan
Ovipar Ovovivipar
Konten oksigen rendah (salinitas tinggi antara 150-200 ppt)
Konten oksigen tinggi (salinitas rendah <150 ppt)
Oksigen kuat-fluktuasi Oksigen minor-fluktuasi
Tinggi makanan Fe (seperti ganggang hijau) Rendah makanan Fe (seperti debris organik) Sumber: Dumitrascu, 2011
Pada perkembangbiakan ovipar, setelah kopulasi, telur (siste) yang dibuahi berkembang menjadi gastrula yang dikelilingi lapisan kulit keras berwarna coklat atau cangkang yang terdiri dari kitin, lipoprotein, dll[11] untuk melindungi dari pengaruh kekeringan, benturan keras, sinar ultraviolet dan mempermudah pengapungan.[42] Kista yang terbentuk dilepaskan ke dalam air. Kista menjadi larva bebas ketika proses pengeringan awal terjadi.[11]
Gambar 2.6. Siklus hidup Artemia salina Sumber: Dumitrascu, 2011
Kista dapat bertahan hidup pada kondisi ekstrim hingga 80°C, kondisi kering selama bertahun-tahun, kontak dengan cairan agresif, kekurangan oksigen dan pengaruh pestisida. Kista terhidrasi (berukuran 200-270 mikron dan berat 3,5 µg) mati pada suhu dibawah 0°C dan di atas 40°C. Kista tidak akan menetas jika salinitas tinggi dari 70 ppt (parts per thousand) karena gradien osmotik terlalu tinggi, sedangkan kista akan menetas pada salinitas <5 ppt tetapi hasil nauplia akan cepat mati.[11]
memiliki saluran pencernaan yang sudah terbentuk lengkap. Nauplia hanya memiliki satu mata (fotoreseptor) yang kemudian berkembang menjadi 3 mata,[11] selain itu berangsung-angsur tumbuh tunas pada kakinya (torakopoda). Pada instar XV, nauplia memiliki 11 pasang kaki (Mudjiman, 1989).[42]
Gambar 2.7. Karakteristik anatomi nauplia dari Artemia salina Sumber: Dumitrascu, 2011
Artemia salina dewasa memiliki bentuk sempurna menyerupai udang[42] dan tidak bersifat fototaksis. Selain itu, Artemia salina dewasa memiliki satu mata dibagian tengah disertai dua mata dibagian lateral, panjang jantan 8-10 mm dan panjang betina 10-12 mm serta memiliki warna yang bervariasi tergantung pada konsentrasi garam dalam air dari green tored (merah pada konsentrasi tinggi). Darahnya mengandung pigmen hemoglobin.[11] Antena I pada Artemia salina dewasa jantan dan betina tetap berfungsi sebagai alat peraba. Antena II pada Artemia salina dewasa jantan berubah menjadi alat penjepit yang membesar dan berotot untuk berpegangan pada betina menjelang perkawinan, sedangkan antena II pada betina mengalami penyusutan sehingga menjadi alat peraba. Dibelakang kaki torakopoda pada Artemia salina dewasa jantan terdapat 2 organ reproduksi, sedangkan dibagian ventral pada betina memiliki 1 uterus yang mengandung hingga 200 telur.[11]
Gambar 2.8. Karakteristik anatomi dari Artemia salina dewasa Sumber: Dumitrascu, 2011
2.1.6.2. Nilai LC50
Nilai LC (lethal concentration) mengacu pada konsentrasi bahan kimia di udara atau dalam air.[36] Konsentrasi yang diberikan sekali (tunggal) atau beberapa kali dalam 24 jam dari suatu zat yang secara statistik dapat mematikan 50% hewan uji disebut LC50.[27] LC50 digunakan untuk perlakuan secara inhalasi atau uji toksisitas dalam media air (Klaassen, 1986). Konsentrasi ini memiliki satuan yaitu ppm (parts per million), mg/m3 [36] atau µg/ml. Uji toksisitas dengan larva Artemia salina Leach yang hasilnya dihitung menggunakan metode LC50 yang mana kematian hewan uji terjadi setelah 6 jam pemaparan disebut LC50 akut, sedangkan kematian hewan uji setelah 24 jam pemaparan disebut LC50 kronis. Namun LC50 setelah 24 jam lebih sering digunakan karena ekstrak yang sukar larut membutuhkan waktu yang lebih lama untuk larut. Nilai LC50 dapat ditentukan dengan cara menggunakan grafik probit log konsentrasi atau perhitungan secara matematik.[30] Tabel 2.3. Tingkat nilai toksisitas LC50
Nilai LC50 (ppm) Tingkat toksisitas
0-250 Sangat toksik
250-500 Toksik
500-750 Sedang
750-1000 Tidak toksik
2.1.6.3. Pelarut Metanol
Pelarut memiliki peran yang penting pada uji toksisitas dengan metode BSLT. Pelarut yang digunakan dapat memberikan hasil positif palsu pada uji yang dilakukan karena toksisitas pelarut itu sendiri.[38] Pelarut seperti DMSO (dimetil sulfoksida), metanol, etanol dan Tween 20 sering digunakan pada uji antimikrobial, aktivitas sitotoksisitas dan BSLT.[31]
Nilai LC50 untuk DMSO, metanol, etanol dan Tween 20 masing-masing yaitu 8,5%, 6,4%, 3,4% dan 2,5%. Tingkat toksisitas pelarut diurutkan sebagai berikut: Tween 20 > etanol > metanol > DMSO. Hal ini menunjukkan bahwa DMSO memiliki efek sitotoksisitas terendah terhadap Artemia salina Leach, sedangkan Tween 20 memiliki efek sitotoksisitas tertinggi. Masing-masing pelarut memiliki konsentrasi toleransi maksimum untuk melarutkan sampel uji yaitu 1,25% untuk DMSO, metanol dan etanol serta 0,16% untuk Tween 20. Hal ini menunjukkan bahwa bekerja pada atau di bawah konsentrasi toleransi maksimum dengan pelarut tersebut tidak memberikan hasil positif palsu.[31]
DMSO digunakan untuk melarutkan ekstrak tanaman,[31] senyawa polar dan non polar.[32] Tween 20 merupakan deterjen yang digunakan untuk melarutkan minyak esensial dan zat minyak lainnya pada ekstrak tanaman. Deterjen memiliki rantai alkil panjang yang mampu melarutkan senyawa hidrofobik sehingga disebut surface-acting agent. Tween 20 bersama deterjen lainnya (sodium dodecyl sulfate
dan CHAPS) dapat mendenaturasi protein dan menghambat proses biologis. Oleh karena itu, Nikkol dapat digunakan sebagai pengganti Tween 20. Nikkol merupakan deterjen nonionik dengan toksisitas rendah.[38] Metanol dan etanol digunakan untuk melarutkan sejumlah besar kandungan kimia dalam produk alami, kecuali albumin, karet, lilin, sukrosa, lemak dan fixed oil.[31]
dengan bantuan sinar matahari. Dari proses tersebut diperoleh reaksi kimia metanol: 2 CH3OH + 3 O2→ 2 CO2 + 4 H2O.[39]
Di dalam tubuh, metanol akan dimetabolisme di hati menjadi formaldehid oleh enzim alkohol dehidrogenase, lalu formaldehid yang terbentuk sangat cepat (waktu paruh 1-2 menit) akan diubah menjadi asam format oleh enzim formaldehid dehidrogenase. Selanjutnya diperlukan waktu kurang lebih 20 jam untuk mengoksidasi asam format menjadi karbondioksida dan air oleh enzim F-THF-S (10 formil tetrahidrofolat sintetase). Formaldehid dan asam format merupakan zat beracun bagi tubuh.[41]
Tabel 2.4. Sifat fisika dan kimia metanol
Penampilan Cair, jernih, tidak berwarna
Bau Karakteristik bau alkohol sedang
pH -
Tekanan uap 12,8 kPa @ 20°C
Kelarutan Larut sepenuhnya
Densitas uap 1,105 @ 15°C
Titik beku -98,7°C
Berat molekul 32,04 g/ mol
Titik didih 64,7°C @ 101,3 kPa
Suhu kritis 239,4°C
Kelarutan dalam cairan lain Larut dalam semua alkohol, ester, keton, eter dan sebagian besar pelarut organik lainnya
Sumber : Material Safety Data Sheet
2.1.6.4. Analisis Probit
Analisis probit merupakan tipe regresi yang digunakan untuk menganalisis berbagai jenis dosis-respon atau respon binomial eksperimen pada berbagai bidang. Pada toksikologi, analisis probit umumnya digunakan untuk menentukan toksisitas relatif bahan kimia terhadap organisme hidup dengan menguji respon dari organisme pada berbagai konsentrasi bahan kimia. Variabel respon binomial mengacu pada dua hasil, misalnya mati atau tidak mati. Analisis probit dapat dilakukan menggunakan tabel probit, perhitungan tangan, koefisien regresi, interval keyakinan atau aplikasi statistik seperti SPSS.[23]
hubungan antara log dosis versus respon akan membentuk kurva sigmoid (∫) yang disebut kurva hubungan dosis-respon. Kurva sigmoid dapat dibuat linier dengan cara memprobitkan persen respon. Bagian yang relatif tidak lurus (respon kurang dari 16% atau lebih dari 84%) dapat diluruskan dengan memprobitkan. Bagian tengah kurva (16-84% respon) cukup proporsional (lurus) untuk memperkirakan efek hubungan dosis versus respon. Suatu zat relatif berbahaya jika zat tersebut membentuk kurva dosis-respon linier yang slopenya besar (relatif tegak) karena perubahan dosis yang kecil sudah dapat menimbulkan peningkatan respon toksik yang relatif besar.[27]
Persamaan garis lurus hubungan antara nilai probit dengan log dosis yaitu Y = mX+ b. Dimana m dan b merupakan konstanta atau koefisien regresi linier sederhana atau parameter garis regresi linier sederhana, m sebagai slope coefficient yang menunjukkan kemiringan garis regresi terhadap sumbu X, b sebagai intercept coefficient yang menunjukkan jarak titik asal dengan titik potong garis regresi
dengan sumbu Y.[6] Regresi bertujuan untuk membandingkan hubungan antara variabel respon atau variabel terikat (Y) dengan variabel bebas (X).[23]
2.2. Kerangka Konsep
Ekstrak metanol daun Phaleria macrocarpa (Scheff.) Boerl. Mengandung senyawa bioaktif
Uji toksisitas akut dengan metode Brine Shrimp Lethality Test (BSLT)
33
BAB 3
METODE PENELITIAN
3.1. Desain penelitian
Penelitian ini adalah penelitian eksperimental.
3.2. Lokasi dan Waktu Penelitian
Penelitian ini dilakukan pada Februari hingga Agustus 2014 di Laboratorium Penelitian 1, Laboratorium Farmakognosi dan Fitofarmaka serta Laboratorium Farmakologi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3.3. Populasi dan Sampel
3.3.1. Populasi
Populasi pada penelitian ini adalah larva Artemia salina Leach.
3.3.2. Sampel
3.3.2.1. Kriteria Inklusi
Kriteria inklusi pada penelitian ini adalah larva Artemia salina Leach yang berusia 48 jam.
3.3.2.2. Kriteria Ekslusi
Kriteria ekslusi pada penelitian ini adalah larva Artemia salina Leach yang tidak menunjukkan aktivitas pergerakan sebelum perlakuan.
3.3.2.3. Besar Sampel
Jumlah larva Artemia salina Leach yang digunakan adalah 10 larva untuk setiap konsentrasi ekstrak metanol daun Phaleria macrocarpa [Scheff.] Boerl. Pada penelitian ini terdapat empat konsentrasi dan satu kontrol negatif. Kemudian dilakukan tiga kali replikasi untuk setiap konsentrasi dan kontrol negatif. Jadi, jumlah total sampel yang diperlukan adalah 150 larva Artemia salina Leach untuk setiap kali perlakuan.
3.3.2.4. Cara Pengambilan Sampel
dan cara penyediaan yang sama memiliki kesempatan yang sama untuk diseleksi sebagai sampel.[4]
3.4. Alat dan Bahan Penelitian
3.4.1. Alat Penelitian
Alat yang digunakan pada penelitian ini adalah aerator, aluminium foil, baskom kecil, batang pengaduk, bejana kaca maserasi, cawan penguap, corong kaca, digital colony counter, erlenmeyer, gelas beker, gunting, hot plate stirrer, labu ukur, lakban hitam, lampu, mikropipet, neraca analitik,
oven, pH indicator paper, pipet tetes, tabung reaksi, spatula, refrigerator, rotary evaporator, sterofoam, wadah plastik dan well plate.
3.4.2. Bahan Penelitian
Bahan yang digunakan pada penelitian ini adalah air laut, aquades, kertas saring, pelarut metanol, serbuk simplisia daun Phaleria macrocarpa [Scheff.] Boerl. dan telur Artemia salina Leach.
3.5. Cara Kerja Penelitian
3.5.1. Determinasi Tanaman dan Proses Pembuatan Simplisia
Determinasi tanaman dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi-LIPI Bogor (Lampiran 2).
Penyiapan daun Phaleria macrocarpa [Scheff.] Boerl. dilakukan dengan memetik satu per satu daun muda dan daun tua yang diperoleh dari kebun rumah warga di daerah Ciputat hingga mencapai 6 kg, kemudian daun dipisahkan dari kotoran/ bahan asing. Pencucian dan perajangan simplisia hingga menjadi 1 kg serbuk simplisia halus serta sortasi kering dan pengepakan dilakukan di Balai Penelitian Tanaman Obat dan Aromatik (Balitro), Bogor. Selanjutnya serbuk simplisia disimpan pada suhu kamar (15-30°C).
3.5.2. Ekstraksi Daun Phaleria macrocarpa [Scheff.] Boerl. Dengan Metode
Maserasi
maserasi, lalu direndam menggunakan pelarut metanol yang telah di destilasi dengan rotatory evaporator. Dilakukan beberapa kali pengadukan dan didiamkan selama 24 jam.[34] Setelah 24 jam, rendaman disaring menggunakan kertas saring sehingga diperoleh filtrat (maserat) yang terpisah dari ampasnya. Kemudian filtrat dipekatkan menggunakan rotary evaporator pada suhu 45°C sehingga diperoleh ekstrak kental metanol daun Phaleria macrocarpa. Ekstrak kental dituang ke dalam cawan penguap dan diuapkan
di dalam oven, lalu ditimbang menggunakan neraca analitik. Ampas hasil ekstraksi di remaserasi sehingga diperoleh filtrat ke-2, dst.[37] Ekstrak kental metanol daun Phaleria macrocarpa yang diperoleh dari 5 kali proses maserasi sebanyak 169,7650 g.
3.5.3. Penyiapan Larva Artemia salina Leach
Penetasan telur Artemia salina Leach dilakukan dalam wadah plastik berisi air laut yang dipasang aerator.[34] Wadah plastik terbagi menjadi dua ruang, yaitu ruang gelap dan ruang terang yang dipisahkan oleh sekat. Sekat terbuat dari sterofoam yang dibagian bawahnya dibuat lubang dengan diameter 1 cm untuk jalan keluar telur yang telah menetas menuju ruang sebelahnya. Sebanyak 1 L air laut terlebih dahulu diukur pH-nya menggunakan pH indicator paper, diperoleh pH 8-9.[4] Air laut dimasukkan ke dalam wadah plastik hingga lubang pada sterofoam terendam. Kemudian 1 g telur Artemia salina dimasukkan ke dalam satu ruang, lalu sekeliling ruang tersebut ditutup menggunakan aluminium foil dan lakban hitam. Ruang lainnya dibiarkan terbuka dan disinari lampu selama 48 jam. Setelah 24 jam, telur akan menetas menjadi larva dan bergerak menuju ruang terang. Larva yang berusia 24 jam dipindahkan ke dalam wadah plastik lain hingga berusia 48 jam dan dipasang aerator. Larva yang berusia 48 jam digunakan sebagai hewan uji.
3.5.4. Pembuatan Konsentrasi Ekstrak yang Akan Diuji
ditimbang menggunakan neraca analitik hingga mencapai 2000 mg, lalu dilakukan pengenceran dengan aquades hingga mencapai 100 ml. Larutan uji dihomogenkan menggunakan hot plate stirrer. Kemudian membuat larutan induk dengan konsentrasi 20000 ppm. Selanjutnya dilakukan pengenceran untuk membuat larutan uji dengan konsentrasi 35 ppm, 25 ppm, 10 ppm dan 5 ppm menggunakan rumus V1M1=V2M2. Setiap larutan uji dilakukan tiga kali replikasi.
3.5.5. Uji Toksisitas Akut Dengan Metode BSLT
3.6. Alur Penelitian
Determinasi tanaman
1 kg serbuk halus simplisia daun Phaleria macrocarpa
5 kali maserasi dengan pelarut metanol yang telah di destilasi
169,7650 g ekstrak kental metanol daun Phaleria macrocarpa 6 kg daun Phaleria macrocarpa [Scheff.] Boerl.
Larutan induk konsentrasi 20000 ppm ekstrak metanol daun Phaleria macrocarpa
Larutan uji konsentrasi 35 ppm, 25 ppm, 10 ppm, dan 5 ppm
1 ml larutan uji dimasukkan ke dalam well plate dengan tiga kali replikasi
10 larva Artemia salina Leach berusia 48 jam dan 1 ml air laut dimasukkan ke dalam setiap well
Total larva yang mati dalam setiap well plate dihitung setelah 24 jam
Persentase kematian larva dihitung pada setiap konsentrasi
Nilai LC50 dihitung menggunakan analisis probit
Uji orientasi dengan rentang dosis 10-90% yang mematikan hewan uji Pengenceran 2000 mg ekstrak kental metanol daun Phaleria