BIOSENSOR H
2O
2MENGGUNAKAN HORSERADISH PEROKSIDASE
TERAMOBILISASI DENGAN GLUTARALDEHID PADA KOMPOSIT
KARBON-NANOSERAT POLIANILIN
RIZARULLAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul biosensor H2O2 menggunakan
horseradish peroksidase teramobilisasi dengan glutaraldehid pada komposit karbon-nanoserat polianilin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Rizarullah
RINGKASAN
RIZARULLAH. Biosensor H2O2 menggunakan horseradish peroksidase
teramobilisasi dengan glutaraldehid pada komposit karbon-nanoserat polianilin. Dibimbing oleh SURYANI, LAKSMI AMBARSARI dan AKHIRUDDIN MADDU.
Hidrogen peroksida merupakan salah satu senyawa radikal bebas yang banyak diaplikasikan di berbagai bidang. Biosensor hidrogen peroksida menjadi alternatif untuk mendeteksi keberadaan hidrogen peroksida. Tujuan penelitian ini adalah untuk mengetahui karakteristik biosensor menggunakan enzim horseradish peroksidase teramobil dengan glutaraldehid pada komposit karbon-polianilin nanoserat (HRP/GA/PANI). Enzim horseradish peroksidase (HRP) diamobil dengan glutaraldehid secara cross linking. Elektroda pasta karbon (EPK) menghasilkan arus yang lebih kecil dibangdingkan elektroda pasta karbon termodifikasi (EPKT) dengan arus EPK adalah 0.0851 mA pada tegangan 0.108 V dan arus EPKT 0.2306 mA pada tegangan 0.188 V. Hal tersebut menunjukkan bahwa penambahan polianilin dapat membantu proses transfer elektron.
Perkembangan biosensor dengan pemanfaatan enzim HRP sebagai bioreseptor sangat penting untuk menkonversi reaksi redoks menjadi energi listrik sebagai sinyal. Kinerja elektroda HRP/GA/PANI dipengaruhi oleh pH untuk dapat menghasilkan performa maksimum sebagai biosensor. pH optimum elektroda HRP/GA/PANI berada pada pH 7 yang menghasilkan arus pada puncak reduksi sebesar 0.96 mA. Selain pH, kinerja elektroda HRP/GA/PANI juga dipengaruhi oleh suhu. Hasil pengamatan menjelaskan bahwa suhu optimum elektroda HRP/GA/PANI yaitu pada suhu 50oC. Energi aktivasi enzim pada suhu optimum menjadi lebih rendah yang menyebabkan reaksi pembentukan produk terjadi lebih cepat. Pada suhu dibawah 50oC, arus yang dihasilkan semakin meningkat yang
disebabkan oleh meningkatnya tumbukan yang terjadi antara substrat dan enzim. Pada suhu di atas 50oC, arus yang dihasilkan semakin menurun yang disebabkan oleh terdenaturasinya enzim sehingga kompleks enzim dan substrat yang terbentuk akan berkurang.
Konsentrasi hidrogen peroksida sangat menentukan kinerja elektroda HRP/GA/PANI sebagai biosensor. Hasil pengamatan pengaruh konsentrasi hidrogen peroksida sebagai substrat didapatkan linieritas konsentrasi H2O2 sebesar
0.1 mM – 0.5 mM dengan nilai Km dan Imax yang dihasilkan elektroda secara
berturut-turut sebesar 1.71 mM dan 0.29 mA. Elektroda HRP/GA/PANI memiliki nilai sensitifitas 12.14 mA/mMcm2. Besarnya jumlah substrat yang dapat terabsorbsi ke dalam elektroda dijalaskan oleh nilai konsentrasi permukaan elektroda. Nilai konsentrasi permukaan yang dihasilkan yaitu sebesar 7.136 x 10-9 mol/cm2.
SUMMARY
RIZARULLAH. Biosensor H2O2 by Used Immobilized Horseradish Peroxidase
Glutaraldehyde on Carbon Polyaniline Nanofiber Composite. Supervised by SURYANI, LAKSMI AMBARSARI and AKHIRUDDIN MADDU.
Hydrogen peroxide is one of the many free radicals compounds was applied in different fields. Hydrogen peroxide Biosensor into an altrnatif to detect its presence. The purpose of this research is to make biosensor by used the horseradish peroxidase enzyme immobilized with glutaraldehyde on carbon-polyaniline nanofiber composite (HRP/GA/PANI). The horseradish peroxidase enzyme (HRP) with glutaraldehyde for cross linking. Carbon paste electrodes (CPE) produced currents smaller than modified carbon electrodes (MCPE) with a current CPE is 0.0851 mA at a voltage 0.108 V and MCPE 0.2306 mA at 0.188 V voltage. It shows that the addition of the polyaniline can help the process of electron transfer.
Development of biosensor with HRP enzyme utilization as bioreceptor is very important for the convert redox reaction into electrical energy as a signal. Performance of HRP/GA/PANI electrode is affected by the pH for maximum performance can be produced as a biosensor. The optimum pH of HRP/GA/PANI electrode at a pH 7 which resulted in the reduction of peak current in 0.96 mA. In addition to pH, performance of HRP/GA/PANI electrode is also affected by temperature. The observations explain that optimum temperature electrode HRP/GA/PANI which is at a temperature of 50oC. The activation energy of the enzyme at optimum temperature being lower that caused the formation of reaction products is faster. At temperature below 50oC, the resulting increased current caused by the increased collisions between substrate and enzyme. At temperature over 50oC, currents produced declining caused by denaturation of
enzymes thus formed complex enzyme and substrate will be reduced.
The concentration of hydrogen peroxide is very decisive of performance HRP/GA/PANI electrodes as biosensor. The observations influence the concentration of hydrogen peroxide was obtained linierity concentration of H2O2 as
a substrate at 0.1 mM-0.5 mM with a value of Km and Imax the resulting of electrodes
amounted to 1.71 mA and 0.29 mM, respectively. HRP/GA/PANI electrode has a sensitivity value 12.14 mA/mMcm2. The amount of substrate that can
be absorbed into the electrode was explained by value of surface concentrations. The value of the resulting surface concentration i.e. by .7.136 x 10-9 mol/cm2. Keywords: biosensor, hydrogen peroxide, horseradish peroxidase, glutaraldehyde,
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
BIOSENSOR H
2O
2MENGGUNAKAN HORSERADISH PEROKSIDASE
TERAMOBILISASI DENGAN GLUTARALDEHID PADA KOMPOSIT
KARBON-NANOSERAT POLIANILIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Biosensor H2O2 menggunakan horseradish peroksidase
teramobilisasi dengan glutaraldehid pada komposit karbon-nanoserat polianilin Nama : Rizarullah
NIM : G851130091
Disetujui oleh Komisi Pembimbing
Dr Suryani, MSc Ketua
Dr Laksmi Ambarsari, MS Anggota
Dr Akhiruddin Maddu, MSi Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat, berkah, dan karunia-Nya sehingga penulis dapat menyelesaikan tesis ini. Penelitian ini berjudul: Biosensor H2O2 menggunakan horseradish peroksidase teramobilisasi
dengan glutaraldehid pada komposit karbon-nanoserat polianilin. Penelitian ini merupakan salah satu persyaratan dalam menyelesaikan studi di Program Pascasarjana Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Suryani, M.Sc, Dr. Laksmi Ambarsari, MS dan Dr. Akhiruddin Maddu, M.Si sebagai komisi pembimbing yang banyak memberi bimbingan dan arahan kepada penulis dalam menyelesaikan penelitian dan karya penelitian ini. Terima kasih juga penulis sampaikan kepada seluruh staf Program Studi Biokimia dan semua pihak yang telah ikut membantu dan berkontribusi dalam berbagai hal selama penyelesaian penelitian dan karya ilmiah. Terima kasih pula kepada teman-teman Biokimia atas bantuan dan kebersamaannya, kepada pihak-pihak lainnya yang tidak dapat penulis sebutkan satu persatu. Penulis menyampaikan terima kasih dan rasa hormat setinggi-tingginya kepada orang tua dan keluarga besar tercinta atas doa, pengorbanan, pengertian dan dukungan moril yang tidak ternilai selama ini.
Akhirnya, semoga karya ilmiah ini dapat memberikan manfaat bagi penulis, civitas akademika, peneliti, pemerintah dan semua pihak yang terkait, sehingga mampu memperkaya hasanah keilmuan di masa mendatang.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 2
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 METODE 3
Bahan 3
Alat 3
Prosedur Penelitian 3
3 HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 10
4 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 23
DAFTAR GAMBAR
1 Rangkaian elektroda EPK dan EPKT 3
2 Voltamogram siklik EPK dan EPKT 6
3 Voltamogram siklik elektroda HRP/GA/PANI terhadap pengaruh pH bufer fosfat 0.1 M dengan laju pemayaran 100 mV/s 7 4 Kurva pengaruh pH terhadap kinerja elektroda HRP/GA/PANI 7 5 Voltamogram siklik elektroda HRP/GA/PANI terhadap pengaruh suhu
dengan laju pemayaran 100 mV/s 8
6 Kurva pengaruh suhu terhadap kinerja elektroda HRP/GA/PANI 8 7 Voltamogram siklik pengaruh konsentrasi H2O2 terhadap arus elektroda
HRP/GA/PANI pada bufer fosfat 0.1 M dengan laju pemayaran 100
mV/s 10
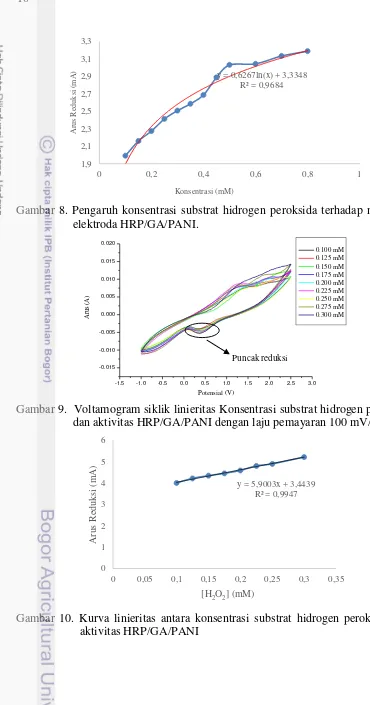
8 Pengaruh konsentrasi substrat hidrogen peroksida terhadap nilai arus
elektroda HRP/GA/PANI 10
9 Voltamogram siklik linieritas Konsentrasi substrat hidrogen peroksida dan aktivitas HRP/GA/PANI dengan laju pemayaran 100 mV/s 10 10 Kurva linieritas antara konsentrasi substrat hidrogen peroksida dan
aktivitas HRP/GA/PANI 11
11 Kurva Lineweaver-Burk dalam penentuan parameter kinetika
HRP/GA/PANI 11
12 Arah aliran elektron, elektrode kerja (W), elektrode pembanding (R) dan
elektroda pembantu (C) 13
13 Reaksi Redoks H2O2 yang terjadi pada elektroda 14
14 Interaksi residu asam amino dengan protoporfirin IX pada enzim
horseradish peroksidase (1H58) 15
15 Struktur 3D enzim Horseradish Peroksidase (1H58) 16
DAFTAR LAMPIRAN
1 Bagan Alir Penelitian 25
2 Nilai arus reduksi hidrogen peroksida oleh elektroda HRP/GA/PANI
terhadap pengaruh pH 25
3 Nilai arus reduksi hidrogen peroksida oleh elektroda HRP/GA/PANI
terhadap pengaruh suhu 26
4 Nilai arus reduksi hidrogen peroksida oleh elektroda HRP/GA/PANI
terhadap variasi konsentrasi H2O2 26
5 Nilai arus kurva linieritas reduksi hidrogen peroksida oleh elektroda HRP/GA/PANI terhadap variasi konsentrasi H2O2 26
6 Nilai Arus kurva Lineweaver-Burk reduksi hidrogen peroksida oleh elektroda HRP/GA/PANI terhadap variasi konsentrasi H2O2 27
1
PENDAHULUAN
Latar Belakang
Hidrogen peroksida merupakan salah satu molekul yang termasuk dalam spesies oksigen reaktif. Spesies oksigen reaktif ini banyak digunakan dalam bidang pangan, farmasi dan medis. Hidrogen peroksida banyak dihasilkan sebagai produk dari hasil katalisis enzim glukosa oksidase, kolesterol oksidase, xantin oksidase, alkohol oksidase, diamin oksidase dan urikase yang diaplikasikan untuk mengukur kadar glukosa, kolesterol, santin, alkohol, histamin dan asam urat. Keunggulan pemanfaatan biomolekul pada biosensor yaitu sifat selektifitas biomolekul yang berinteraksi dengan substrat tertentu.
Ada beberapa senyawa biomolekul yang dapat digunakan untuk pengembangan biosensor diantaranya katalase (Ortega et al. 2013), kolesterol oksidase (Umar et al. 2014), mioglobin (Safavi et al. 2010), glukosa oksidase (Pahurkar et al. 2015), bilirubin oksidase (Pita et al. 2013) lakase (Rawal et al. 2012) dan lain sebagainya. Horseradish peoksidase merupakan salah satu enzim yang banyak dimanfaatkan dalam elektrokimia baik sebagai biosensor (Periasamy
et al. 2011) maupun biofuel cell (Agnes et al, 2013).
Enzim horseradish peroksidase (HRP) (1.11.1.7) termasuk enzim oksidoreduktase yang dapat digunakan sebagai biosensor. HRP tergolong dalam kelompok enzim peroksidase yang terdapat pada tanaman lobak yang dapat mereduksi hydrogen peroksida (H2O2) menjadi air (H2O). Enzim HRP dapat
disolasi dari beberapa organisme seperti pada akar tanaman lobak, E.coli, sel mamalia dan yeast (Spadiut dan Herwig, 2013). Selain pemanfaatannya sebagai biosensor dan biofuel cell, HRP juga dapat dimanfaatkan sebagai decolorisasi (Abdel-Aty et al. 2013), immunoassay (Farzamfar et al. 2007), biodegradasi (Xu et al. 2013) dan sintesis polianilin (Jin et al. 2001).
Salah satu aspek yang menjadi pertimbangan dalam pembuatan biosensor yaitu tahapan transfer elektron. Proses transfer elektron dengan menggunakan logam lebih efesien, namun logam memiliki harga yang mahal sehingga perlu dicari alternatif lain sebagai pengganti logam. Senyawa lain yang dapat digunakan untuk proses transfer elektron yaitu polianilin yang memiliki sifat unik yaitu doping dedoping atau protonasi deprotonasi (Maddu et al. 2008). Polianilin merupakan polimer yang memiliki sifat konduktif yang dijadikan solusi pada proses transfer elektron. Polianilin juga dapat digunakan sebagai matrik untuk amobilisasi enzim yang bertujuan untuk mengikat enzim bebas sehingga enzim lebih stabil sebagai biosensor.
Polianilin (PANI) merupakan polimer yang memiliki sifat konduktivitas yang baik. Sifat konduktif PANI menjadi perhatian untuk pengembangannya dalam bidang elektrokimia. Penelitian sebelumnya telah dilakukan pembuatan biofuel cell
2
doping-dedoping atau protonasi-deprotonasi sehingga sangat potensial dimanfaatkan untuk berbagai aplikasi.
Kinerja HRP yang tinggi sebagai biosensor dengan PANI sebagai material dipengaruhi oleh sifat elektrokimia untuk mentranfer elektron antara elektroda dan sisi aktif enzim (Solanki et al. 2011). Kitosan merupakan salah satu egen amobil enzim yang paling umum digunakan. Pada penelitian sebelumnya telah dilakukan penelitian amobilisasi biosensor hidrogen peroksida dengan menggunakan enzim horseradish peroksidase teramobil pada komposit NiFe4O2-kitosan (Yalciner et al.
2011). Namun, amobilisasi enzim horseradih peroksidase menggunakan glutaraldehid sebagai agen amobil dan PANI sebagai fasilitator transfer elektron belum dilakukan. Glutaraldehid dan kitosan memiliki dua fungsi yang dapat berperan sebagai agen cross-linking dan agen pengaktifasi (Crescenzi et al. 2003). Dua agen amobil diharapkan dapat menjaga kestabilan enzim sebagai biosensor hidrogen peroksida.
Perumusan Masalah
Penggunaan hidrogen peroksida yang tergolong sebagai senyawa oksigen reaktif sangat berbahaya. Pemanfaatan enzim horseradish peroksidase yang dapat mengkatalisis hidrogen peroksida dapat digunakan sebagai biosensor untuk mendekteksi hidrogen peroksida sangat diperlukan baik di bidang makanan, medis dan farmasi. Penggunaan teknik amobil HRP secara cross-linking dengan glutaraldehid pada komposit karbon-nanoserat polianilin diharapkan mampu sebagai biosensor hidrogen peroksida.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui karakteristik biosensor hidrogen peroksida menggunakan horseradish peroksidase teramobilisasi pada komposit karbon-nanopartikel polianilin sehingga dapat mendeteksi keberadaan hidrogen peroksida pada konsentrasi tertentu.
Manfaat Penelitian
Penelitian ini diharapkan dapat dimanfaatkan sebagai teknologi biosensor hidrogen peroksida dengan pemanfaatan enzim horseradish peroksidase yang teramobil dengan glutaraldehid pada komposit karbon-nanoserat polianilin.
Ruang Lingkup Penelitian
3
2
METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah polianilin nanoserat, kalium klorida, aquades, enzim Horseradish peroksidase, glutaraldehid, bovine serum albumin (BSA), bufer fosfat, grafit, parafin, K3Fe(CN)6, K4Fe(CN)6,kawat
tembaga, tabung teflon dan tabung kaca.
Alat
Peralatan yang digunakan antara lain alat-alat gelas, neraca analitik, tabung sentrifus, eDAQ potensiostat-galvanostat yang dilengkapi perangkat lunak Echem v2.1.0., kertas membran, kain nilon, pipet mikro, pipet volumetrik, mortar, parafilm, desikator, pH meter (HANNA pH 21 pH/Mv meter), termometer, dan penangas air.
Prosedur Penelitian
Pembuatan Elektrode EPK dan EPKT (Colak et al. 2012)
Elektrode pasta karbon (EPK) dibuat dengan mencampurkan 0.15 gr grafit
dan 100 μL parafin. Campuran grafit dan parafin dipersiapkan menggunakan mortal dan diaduk selama 30 menit hingga membentuk pasta karbon yang homogen. Sebuah tabung gelas yang terbuat dari kaca (diameter 0.8 cm dan panjang 3 cm) digunakan sebagai badan elektrode, selanjutnya dihubungkan dengan kawat tembaga sebagai penghubung elektrode dengan sumber arus listrik dimasukkan ke dalam tabung hingga tersisa ruang kosong sekitar 0.7 cm pada ujung tabung. Pasta dimasukkan ke ujung tabung hingga penuh dan padat. Permukaan elektrode dihaluskan dengan menggunakan kertas pasir halus dan kertas minyak hingga licin. Sedangkan pembuatan elektrode pasta karbon termodifikasi (EPKT) polianilin dibuat dengan cara dicampurkan 0.15 gr karbon dan 100 μL parafin dengan 2 mg polianilin dalam mortal. Kemudian campuran tersebut diisi dalam tabung elektroda yang terbuat dari kaca (diameter 0.8 cm dan panjang 3 cm) sebagai badan elektrode yang telah dihubungkan dengan kawat tembaga sebagai penghubung antara elektrode.
4
Amobilisasi Enzim HRP
Amobilisasi enzim HRP dilakukan berdasarkan Yang et al (2004) dengan metode ikatan silang (crosslinking) menggunakan pereaksi glutaraldehid.
Amobilisasi enzim dilakukan dengan mencampurkan 20 μL enzim HRP (5000 U/mL), 0.4 mg Bovin serum albumin (BSA), 10 μL (2.5% w/v) glutaraldehid dan
20 μL bufer fosfat dengan variasi pH (pH=6-8, dengan rentang 0.5). Semua larutan tersebut dicampurkan dalam tabung Eppendorf dan dihomogenisasi. Seluruh
larutan enzim amobil sebanyak 50 μL dimasukkan ke dalam elektroda pasta karbon
teramobilisasi (EPKT), dikeringkan pada suhu 4oC hingga larutan enzim teramobil terjerap dalam pasta karbon-nanopartikel polianilin. Elektode HRP/EPKT dicuci dengan aquades untuk menentukan jumlah enzim yang teramobil.
Pengukuran Elektrokimia
Metode voltametri siklik dilakukan mengacu pada Colak et al. (2012). Pada pengukuran elektrokimia digunakan tiga elektroda yaitu elektroda pembantu (Pt), elektroda Pembanding (Ag/AgCl) dan elektroda kerja (HRP/GA/PANI). Penentuan hidrogen peroksida dilakukan secara reaksi elektrokimia melalui reaksi enzimatis yang menghasilkan H2O dan O2. Ketiga elektroda tersebut dimasukkan ke dalam
larutan bufer fosfat 0.1 M dan K3Fe(CN)6/K4Fe(CN)6 0.1 M sebagai larutan
elektrolit. Hidrogen peroksida ditambahkan ke dalam wadah sebagai subtrat enzim HRP.
Penentuan pH Optimum pada Kinerja Elektroda HRP/GA/PANI
Penentuan pH optimum dilakukan secara elektrokimia (Colak et al. 2012). Sebanyak 1 mL larutan bufer fosfat dengan pH yang bervariasi yang akan diuji (pH 6 hingga pH 8, dengan rentang 0.5) dan 180 µ L H2O2 0.5 mM sebagai larutan
elektrolit dimasukkan ke dalam sel elektrokimia. Elektroda HRP/GA/PANI, Pt dan Ag/AgCl dimasukkan ke dalam sel elektrokimia dan diamati valtamogram siklik yang terbentuk.
Penentuan Suhu Optimum pada Kinerja Elektroda HRP/GA/PANI
Penentuan suhu optimum dilakukan secara elektrokimia seperti pengukuran aktivitas pH optimum (Colak et al. 2012). Penentuan suhu optimum tersebut dilakukan pada kondisi pH optimum yang telah diketahui dari penentuan pH optimum sebelumnya. Sebanyak 1 mL larutan bufer fosfat dengan pH optimum dan 180 µL H2O2 0.5 mM ditambahkan ke dalam sel elektrokimia, lalu diukur
aktivitasnya pada variasi suhu 30oC, 40oC, 50oC, 60oC, 70oC, dan 80oC. Suhu diatur
dengan memanaskan campuran larutan pada penangas yang terus diamati melalui termometer. Elektroda HRP/EPKT, Pt, dan Ag/AgCl dimasukkan ke dalam sel elektrokimia tersebut diamati voltamogram siklik yang terbentuk.
Penentuan Parameter Kinetika
Penentuan parameter kinetika enzim ditentukan dengan penentuan aktivitas enzim pada variasi konsentrasi substrat, dan pH optimum serta suhu optimum yang telah diketahui. Larutan elektrolit yang digunakan yaitu H2O2 sebagai substrat.
5 pengaruhnya terhadap aktivitas enzim HRP secara elektrokimia. Sebanyak 1 mL larutan H2O2, ditambah 1 mL bufer fosfat dengan pH otimum dan suhu optimum
dimasukkan ke dalam sel elektrokimia. Elektroda Pt dan Ag/AgCl juga digunakan sebagai elektroda pembantu dan pembanding. Voltamogram siklik yang terbentuk kemudian diamati dan dibuat kurva hubungan antara konsentrasi H2O2 dan arus
6
3
HASIL DAN PEMBAHASAN
Hasil
Voltamogram Siklik Elektroda Pasta karbon (EPK) dan Elektroda Pasta Karbon Termodifikasi (EPKT)
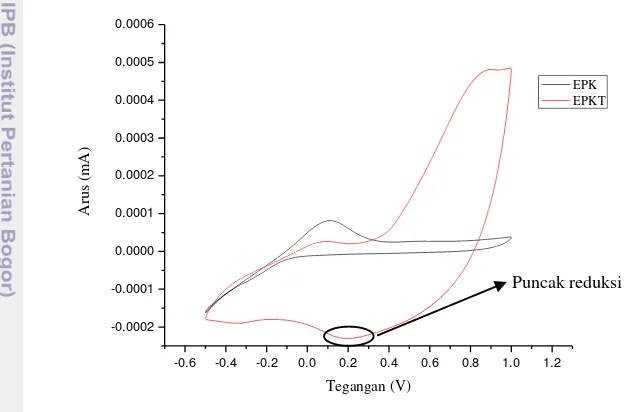
Pengukuran voltamogram siklik elektroda pasta karbon (EPK) dan elektroda pasta karbon termodifikasi (EPKT) bertujuan untuk mengetahui perbedaan kinerja elektroda yang didasarkan pada reaksi redoks yang terjadi di permukaan elektroda. Modifikasi elektroda dilakukan dengan penambahan polianilin (PANI) untuk meningkatkan proses transfer elektron. Penambahan polianilin dapat meningkatkan proses transfer elektron yang ditandai dengan meningkatnya puncak reduksi dibandingkan dengan EPK yang tanpa penambahan polianilin yang ditunjukkan pada Gambar 2.
Gambar 2. Voltamogram siklik EPK dan EPKT.
pH Optimum elektroda EPKT
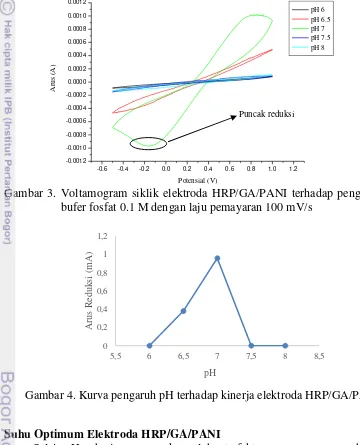
Salah satu faktor yang mempengaruhi kestabilan enzim yaitu pH. Penentuan pH optimum bertujuan untuk mengetahui aktivitas enzim pada keadaan pH tertentu sehingga menghasilkan kinerja enzim yang terbaik. Pengujian pH optimum dilakukan dengan metode voltametri siklik menggunakan elektroda Pt sebagai pembantu dan elektroda Ag/AgCl sebagai elektroda pembanding. Kinerja elektroda HRP/GA/PANI diuji pada pH 6-8 (dengan rentang 0.5) menggunakan bufer fosfat 0.1 M.
Pengaruh pH terhadap kinerja elektroda HRP/GA/PANI dengan variasi pH 6 hingga 8 terlihat dari voltamogram siklik (Gambar 3) terjadi perbedaan voltamogram siklik pada setiap pH. Berdasarkan optimasi pH, diperoleh pH optimum yang ditandai dengan adanya puncak yang menunjukkan terjadinya reaksi oksidasi dan reduksi. Reaksi reduksi H2O2 menjadi H2O ditandai dengan adanya
puncak bagian bawah. Semakin baik kinerja elektroda semakin besar puncak yang dihasilkan pada voltamogram siklik. Berdasarkan hasil pengukaran pH optimum
7 dengan voltametri siklik diperoleh kinerja optimum elektroda HRP/GA/PANI pada pH 7 yang ditandai oleh tingginya puncak reduksi tertinggi (Gambar 4).
Nilai arus reduksi yang dihasilkan elektroda HRP/GA/PANI sebesar 0.969 mA pada potensial -0.614 V. Nilai arus yang tertinggi yang dihasilkan pada pH 7 menandakan bahwa kinerja elektroda HRP/GA/PANI dapat menghasilkan arus optimum pada pH 7 dibandingkan dengan pH lainnya. Pada pH 6, 6.5, 7.5 dan 8 tidak terbentuk puncak reduksi maupun puncak oksidasi yang menandakan terjadinya reaksi oksidasi dan reduksi.
Gambar 3. Voltamogram siklik elektroda HRP/GA/PANI terhadap pengaruh pH bufer fosfat 0.1 M dengan laju pemayaran 100 mV/s
Gambar 4. Kurva pengaruh pH terhadap kinerja elektroda HRP/GA/PANI
Suhu Optimum Elektroda HRP/GA/PANI
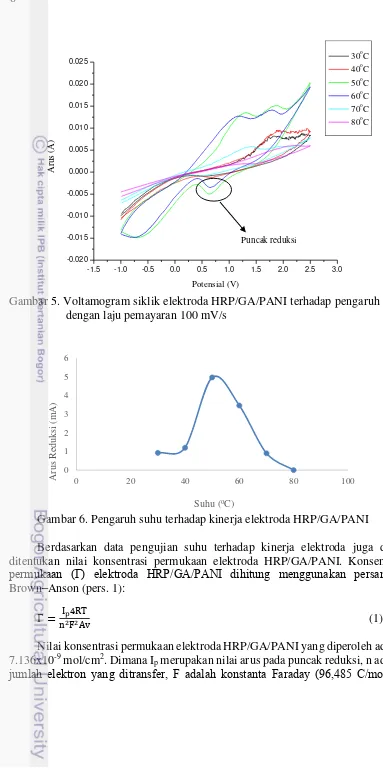
Selain pH, suhu juga merupakan salah satu faktor yang mempengaruhi tingkat aktivitas enzim. Metode voltametri siklik digunakan untuk menentukan suhu optimum. Variasi suhu dilakukan untuk mengetahui kondisi optimum elektroda HRP/GA/PANI yaitu 30oC, 40oC, 50oC, 60oC, 70oC, dan 80oC. Pengaruh suhu terhadap kinerja elektroda HRP/GA/PANI menghasilkan perbedaan puncak arus voltamogram siklik (Gambar 5). Penentuan suhu optimum dilakukan pada keaadaan pH optimum yaitu pH 7. Berdasarkan hasil pengujian voltametri siklik, diperoleh suhu optimum yang dihasilkan pada suhu 50oC (Gambar 6).
8
Gambar 5. Voltamogram siklik elektroda HRP/GA/PANI terhadap pengaruh suhu dengan laju pemayaran 100 mV/s
Gambar 6. Pengaruh suhu terhadap kinerja elektroda HRP/GA/PANI
Berdasarkan data pengujian suhu terhadap kinerja elektroda juga dapat ditentukan nilai konsentrasi permukaan elektroda HRP/GA/PANI. Konsentrasi
permukaan (Γ) elektroda HRP/GA/PANI dihitung menggunakan persamaan
Brown–Anson (pers. 1):
Γ = Ip4RT
n2F2Av (1)
9 adalah konsentrasi permukaan elektroda HRP/GA/PANI (mol/cm2), A adalah luas
permukaan elektroda (cm2), v adalah laju pemayaran (mV/s), R adalah tetapan gas (8.314 J/molK), dan T adalah temperatur (K).
Parameter Kinetika Enzim HRP
Penentuan parameter kinetika enzim horseradih peroksidase dilakukan untuk mengetahui karakteristik bioelektroda yang dirancang untuk keperluan pengembangan elektroda baik sebagai biosensor maupun sebagai biokatoda. Nilai Km dan Imax diperoleh dari penentuan paarameter kinetika yang dilakukan
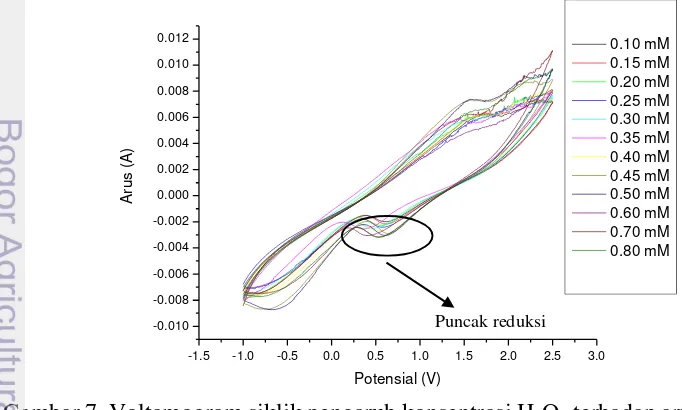
menggunakan metode voltametri siklik. Variasi konsentrasi yang diuji yaitu pada rentang 0.1 mM – 0.8 mM pada kondisi pH optimum (pH 7). Voltamogram siklik yang dihasilkan pada penentuan parameter kinetika enzim ditunjukkan pada Gambar 10 terlihat perbedaan nilai puncak arus reduksi dari setiap konsentrasi hidrogen peroksida.
Voltamogram siklik menghasilkan puncak reduksi yang menandakan adanya reaksi reduksi hidrogen peroksida menjadi air. Puncak yang terbentuk dapat memberikan informasi nilai arus yang dihasilkan dari setiap konsentrasi. Tingkat kejenuhan kosentrasi substrat terhadap elektroda HRP/GA/PANI terlihat dari kurva Michaelis-Menten (Gambar 8) yaitu pada konsentrasi 0.5 mM, sedangkan pada konsentrasi dibawah 0.5 mM nilai arus yang dihasilkan meningkat secara signifikan dengan meningkatnya konsentrasi hidrogen peroksida.
Kurva linieritas kinerja elektroda HRP/GA/PANI terhadap konsentrasi hidrogen peroksida diperoleh dari daerah linier kurva Michaelis-Menten (Gambar 13). Nilai Km dan Imax diperoleh dari kurva Lineweaver-Burk (Gambar 11) dengan
nilai R2 yaitu 0.9947. Berdasarkan persamaan kurva Lineweaver-Burk diperoleh
nilai Km dan Imax secara berturut-turut yaitu sebesar 1.71 mM dan 0.29 mA. Selain
nilai Km dan Imax yang dihasilkan, dari kurva Lineweaver-Burk juga dihasilkan nilai
sensitifitas elektroda HRP/GA/PANI sebesar 12.14 mA/mMcm2. Nilai Km dan Imax
serta nilai sensitifitas yang diperoleh dapat dijadikan informasi untuk pengembangan elektroda sebagai biokatoda atau biosensor selanjutnya.
Gambar 7. Voltamogram siklik pengaruh konsentrasi H2O2 terhadap arus elektroda
10
Gambar 8. Pengaruh konsentrasi substrat hidrogen peroksida terhadap nilai arus elektroda HRP/GA/PANI.
Gambar 9. Voltamogram siklik linieritas Konsentrasi substrat hidrogen peroksida dan aktivitas HRP/GA/PANI dengan laju pemayaran 100 mV/s
11
Gambar 11. Kurva Lineweaver-Burk dalam penentuan parameter kinetika HRP/GA/PANI
Pembahasan
Voltametri Siklik EPK dan EPKT
Perbedaan arus yang dihasilkan oleh elektroda EPK dan EPKT seperti yang terlihat pada Gambar 2 dipengaruhi oleh penambahan polianilin pada elektroda EPKT. Elektroda EPK memiliki puncak yang lebih rendah dibandingkan dengan elektroda EPKT yang berarti bahwa arus yang dihasilkan elektroda EPKT jauh lebih tinggi daripada elektroda EPK. Peningkatan arus yang dihasilkan disebabkan adanya modifikasi elektroda dengan penambahan nanoserat polianilin yang memiliki sifat konduktif. Selain sifat konduktif dari polianilin, kinerja elektroda juga dipengaruhi oleh luas permukaan elektroda. Semakin luas permukaan elektroda semakin sering terjadi reaksi antara elektroda dan larutan elektrolit (Virji
et al. 2009). Luas permukaan karbon lebih kecil yang hanya mencapai 16.30 m2/g,
sedangkan luas permukaan elektroda pasta karbon dengan modifikasi polianilin mencapai 29.26 m2/g (Zhu et al. 2012). Oleh karena itu, elektroda EPKT lebih
efektif pada proses transfer elektron sehingga dapat digunakan sebagai biosensor. Elektroda EPK terdapat puncak oksidasi dengan arus yang dihasilkan sebesar 0.0851 mA pada tegangan 0.108 V, sedangkan puncak reduksi tidak dihasilkan. Dibandingkan dengan EPK, EPKT menghasilkan arus pada puncak reduksi lebih tinggi sebesar 0.2306 mA pada tegangan 0.188 V. Perbedaan arus yang dihasilkan dipengaruhi oleh adanya polimer konduktif yaitu nanoserat polianilin. Tahap preparasi elektroda juga mempengaruhi proses transfer elektron. Semakin padat elektroda, semakin baik transfer elektron.
Pada penelitian ini, polianilin diperoleh dari Kunarsih (2014) dengan ukuran 100-120 nm. Polianilin merupakan salah satu polimer dari monomer anilin yang memiliki sifat konduktif. Polimer polianilin (PANI) yang disintesis dengan metode polimerisasi antar permukaan (interfacial) memiliki beberapa keuntungan yaitu proses sintesis yang mudah dan relatif murah (Maddu, 2008). PANI memiliki beberapa bentuk yaitu leucomeraldine base (LB) yang tereduksi penuh, emeraldine base (EB) yang teroksidasi setengah dan pernigraniline base (PB) yang teroksidasi penuh. Namun, dari ketiga bentuk PANI yang paling stabil yaitu EB dengan nilai
12
konduktifitas mencapai 1.15x10-4-2.2x10-4 S/cm (Zhang et al. 2012). Selain PANI,
ada beberapa polimer lain yang dapat memfasilitasi proses trasfer elektron yang dapat digunakan sebagai biosensor antara lain polypyrrole (PPY), polythiophene (PT), polyaniline (PANi), poly(3,4-ethylenedioxythiophene) (PEDOT), and poly(p-phenylene vinylene) (PPV) (Nalwa, 1997). Namun, pemilihan PANI sebagai polimer konduktif pada penelitian ini karena proses sintesis PANI yang mudah dan biaya yang murah (Maddu et al. 2008)
Suhu merupakan salah satu faktor yang menyebabkan konduktifitas PANI menurun. Penurunan aktivitas elektrokimia PANI terjadi pada suhu diatas 35oC yang disebabkan oleh terjadinya reaksi oksidasi berlebih sehingga merusak struktur terkonjugasi PANI (Tang et al. 2014). Jenis asam yang ditambahkan sebagai proses protonisasi juga mempengaruhi tingkat kestabilan PANI. Penambahan H2SO4 lebih
termostabil daripada penambahan HCl sebagai asam protonik (Ansari, 2006). Pengujian kinerja elektroda pasta karbon (EPK) dan elektroda pasta karbon termodifikasi (EPKT) dengan menggunakan larutan elektrolit KCl bertujuan untuk mengetahui perbedaan kedua elektroda tersebut. Data voltamogram siklik (Gambar 2), EPK menghasilkan puncak oksidasi dan tidak menghasilkan puncak reduksi. Hal tersebut dapat diartikan bahwa adanya pengotor pada EPK sehingga menimbulkan puncak oksidasi. Voltamogram siklik EPKT menghasilkan puncak oksidasi dan reduksi yang berarti polianilin pada EPKT terjadi proses protonasi dan deprotonasi.
Hal lain yang dapat mempengaruhi performa biosensor yaitu luas permukaan elektroda kerja dan elektroda pembantu. Menurut Stojek (2010) elektroda kerja yang lebih besar dibandingkan dengan elektroda pembantu akan berefek pada pengukuran arus yang berhubungan dengan deaktivasi, pasifasi dan penghambatan permukaan elektroda. Namun, pada penilitian ini menggunakan elektroda kerja yang lebih besar dibandingkan dengan elektroda pembantu sehingga pengukuran arus kurang efektif. Potensial elektroda kerja dikontrol oleh elektroda pembanding (Ag/AgCl). Pengontrol potensial yang terjadi pada dua elektroda dapat dianggap sebagai sinyal eksitasi. Sinyal eksitasi untuk voltametri siklik adalah pemayaran potensial dengan kecepatan 100 mV/s. Scan rate atau laju pemayaran merupakan laju transfer elektron antar elektroda.
13
Gambar 12. Arah aliran elektron, elektrode kerja (W), elektrode pembanding (R) dan elektroda pembantu (C)
pH Optimum Elektroda HRP/GA/PANI
Enzim horseradih peroksidase terlebih dahulu diamobilisasi dengan menggunakan glutaraldehid (GA) sebelum dijerap ke dalam elektroda. Enzim HRP diamobilisasi dengan metode ikatan silang (cross linking) untuk membuat enzim tetap stabil pada kondisi tertentu dalam elektroda. Amobilisasi enzim diharapkan dapat meningkatkan kestabilan yang baik selama kinerja enzim. Selain itu, tahap amobilisasi juga bertujuan untuk menjaga keberadaan enzim tetap dalam elektroda dengan adanya ikatan kovalen antara enzim dan agen pengamobil. Enzim HRP teramobilisasi melalui interaksi antara gugus karboksil dari glutaraldehid dan gugus amina dari enzim HRP. Pada penelitian ini terjadi multi-amobilisasi antara glutaraldehid/HRP dan HRP/PANI. Interaksi antara enzim HRP dan PANI terjadi melalui interaksi gugus karboksil dari enzim HRP dan gugus amina dari PANI. Adanya multi agen ikatan silang (cross linking) menyebabkan enzim HRP akan lebih terikat kuat dan tetap berada pada elektroda.
Enzim horseradish peroksidase merupakan salah satu enzim yang dapat mereduksi hidrogen peroksida (H2O2) dengan air sebagai produk akhir seperti
14
Oksidasi : H2O2 → 2H+ + O2 + 2e
Reduksi : H2O2 + 2e → 2 OH−
2H2O2 → 2H+ + 2OH- +O2
2H2O2 → 2H2O + O2
Gambar 13. Reaksi redoks H2O2 yang terjadi pada elektroda
Setiap enzim memiliki pH optimum tertentu. Tingkat keasaman (pH) akan mempengaruhi konformasi enzim dan substrat. Semakin asam suatu sistem, maka akan semakin banyak konsentrasi ion H+. Peningkatan dan penurunan pH akan merubah konsentrasi ion H+ yang akan menyebabkan perubahan konformasi enzim dan substrat. Perubahan konsentrasi ion H+ akan merusak ikatan membentuk ikatan
baru yang menyebabkan enzim terdenaturasi. Sisi aktif enzim horseradish peroksidase akan mengalami gangguan dengan terjadinya perubahan konformasi dari enzim sehingga pembentukan kompleks enzim-substrat (ES) tidak akan tercapai dengan baik dan kinerja enzim HRP akan menurun.
Asam amino penyusun suatu enzim akan mempengaruhi pH optimum untuk menghasilkan kinerja yang maksimal. Enzim horseradish peroksidase adalah glikoprotein globular yang memiliki berat molekul 44 kDa dengan bobot protein 34 kDa dan selebihnya merupakan gugus prostetik dan ion kalsium (Ahirwal dan Mitra, 2009). Asam amino penyusun enzim HRP merupakan asam amino bermuatan sebesar 17% seperti yang dilihat pada Lampiran 8. Arginin merupakan salah satu asam amino bermuatan yang juga termasuk sisi aktif enzim HRP yaitu Arg38 seperti yang terlihat pada Gambar 8. Perubahan pH akan mengubah muatan enzim yang mengakibatkan perubahan struktur, bentuk dan ionisasi enzim HRP. Perubahan struktur terutama perubahan sisi aktif enzim akan mempengaruhi aktivitas enzim untuk membentuk kompleks enzim-substrat. Selain mengubah konformasi enzim, perubahan pH juga dapat merubah muatan substrat yang berpengaruh terhadap interaksi antara enzim dan substrat dan pada akhirnya akan menurunkan aktivitas enzim. Kondisi utama yang mempengaruhi denaturasi protein yaitu suhu, pH, kekuatan ionik, dan polaritas pelarut (Dissanayake et al. 2013).
Muatan lingkungan juga dapat mempengaruhi muatan asam amino penyusun enzim yang menyebabkan perubahan konformasi enzim. Pada elektroda HRP/GA/PANI digunakan polianilin sebagai polimer konduktif dan juga sebagai agen amobil enzim HRP. Penggunaan polimer polianin juga dapat mempengaruhi konsentrasi ion H+ dalam sistem yang dapat merusak konformasi enzim. Ion H+ yang berasal dari polianilin dapat mengimbangi muatan sistem lingkungan elektroda untuk mencapai kondisi optimum. Namun, apabila jumlah ion H+ dalam sistem terlalu banyak maka akan dapat mempengaruhi ikatan hidrogen enzim. Perubahan ikatan hidrogen enzim akan menyebabkan perubahan konformasi enzim. Selain itu, pH juga dapat menyebabkan enzim terdenaturasi yang dikarenakan perubahan muatan residu penyusun enzim.
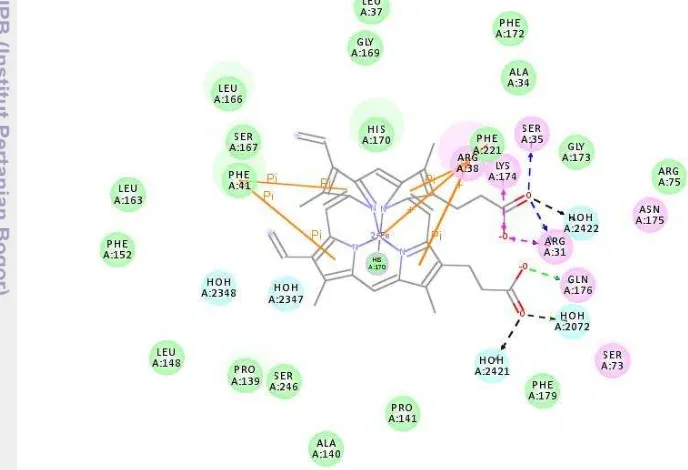
Enzim horseradish peroksidase memiliki sisi aktif untuk mengikat hidrogen peroksida yaitu pada Arg38, His170, dan Phe41 (Torres dan Ayala, 2010). Selain asam amino tersebut, enzim horseradish peroksidase juga memiliki gugus protoporfirin IX yang mengandung besi sebagai pusat katalis. Interaksi yang terjadi antara sisi aktif enzim dan ligan (protoporfirin) seperti yang pada Gambar 15. Ikatan yang terjadi antara Phe41, His170 dan Arg38 adalah ikatan π melalui interaksi Van Der Wall. Ada dua residu penting yang berperan pada tahap reduksi hidrogen
15 peroksida yaitu His42 dan Arg38. Mekanisme yang terjadi pada kondisi asam dan basa berbeda dimana akan mempengaruhi muatan dari residu His42 (Lopez et al. 2001). Namun, residu His42 tidak berinteraksi langsung dengan gugus heme sebagai ligan dari enzim horseradih peroksidase. Ada dua tahap penting dalam mekanisme pembentukan zat intermediet senyawa I pada keadaan yaitu katalisis asam atau basa oleh His42 dan stabilisasi muatan komplek prekorsor enzim-substrat oleh Arg38. Perubahan pH larutan tersebut akan mempengaruhi sisi aktif enzim horseradish yang akan menyebabkan interaksi terhadap substrat.
Menurut Chang dan Tang (2014) enzim dalam bentuk bebas memiliki pH optimum yang lebih rendah dibandingkan dengan enzim yang teramobilisasi. Perbedaan pH optimum tersebut disebabkan oleh perubahan status disosiasi enzim dan perubahan konformasi enzim sehingga mempengaruhi kapasitas mengikat substrat. pH optimum yang dihasilkan dalam penelitian ini sesuai dengan penelitian sebelumnya yang menghasilkan pH optimum enzim HRP amobil pada pH 7 (Temocin dan Yigitoglu, 2009).
Gambar 14. Interaksi residu asam amino dengan protoporfirin IX pada enzim horseradish peroksidase (1H58).
Suhu Optimum Elektroda HRP/GA/PANI
Suhu juga merupakan faktor yang dapat mempengaruhi aktivitas enzim HRP selain pH. Penentuan suhu optimum dilakukan dengan metode yang sama dengan penentuan pH optimum yaitu dengan metode voltametri siklik. Dari hasil penelitian diperoleh suhu optimum elektroda HRP/EPKT 50oC yang menunjukkan nilai arus terbesar antara suhu 30oC-80oC. Pada penelitian sebelumnya suhu optimum enzim HRP berada pada suhu 40oC yang diamobilisasi dengan glutaraldehid pada
nanopartikel magnetik Fe3O4/SiO2 (Chang dan Tang, 2014).
16
aktivitas enzim. Pergerakan molekul tersebut dipengaruhi oleh meningkatnya energi kinetik enzim dan substrat yang akan menyebabkan kemungkinan substrat bertumbukan dengan enzim akan semakin sering. Peningkatan energi kinetik sama atau lebih besar dari energi akativasi akan mempermudah substrat dan enzim memnentuk komplek enzim-substrat lebih cepat sehingga laju reaksi berlangsung cepat. Energi aktivasi merupakan energi minimum yang diperlukan suatu molekul untuk mencapai kompleks teraktivasi.
Setiap enzim memiliki suhu optimum masing-masing untuk menghasilkan produk maksimum. Pada saat suhu enzim dinaikkan melebihi suhu optimum dapat menyebabkan aktivitas enzim menurun dikarenakan enzim perubahan konformasi struktur enzim, dengan kata lain enzim telah terdenaturasi. Peningkatan suhu akan menyebabkan terputusnya beberapa ikatan hidrogen dan ikatan sulfida pada enzim sehingga akan merusak konformasi enzim. Enzim horseradish peroksidase memiliki 308 residu asam amino, gugus prostetik, dua ion kalsium dalam setiap molekul dengan empat jembatan sulfida (Cys11-Cys91, Cys44-Cys49, Cys97-Cys301, dan Cys177-Cys209) dan N-linked rantai karbohidrat dengan struktur 3D seperti yang terlihat pada Gambar 13 (Chattopadhyay et al. 2000). Meningkatnya suhu akan menjadikan energi kinetik enzim bertambah besar yang akan menyebabkan terputusnya ikatan hidrogen dan ikatan sulfida. Denaturasi enzim juga disebabkan oleh perubahan entalpi dalam sistem. Hal tersebut ditandai dengan menurunnya arus yang dihasilkan pada suhu diatas 50oC yang merupakan suhu optimum.
Gambar 15. Struktur 3D enzim Horseradish Peroksidase (1H58) Dari hasil pengujian dapat dihitung nilai konsentrasi permukaan dengan menggunakan persamaan (1). Konsentrasi permukaan adalah jumlah substrat yang dapat terserap pada permukaan suatu elektroda. Semakin besar nilai konsentrasi permukaan suatu elektroda maka akan semakin baik elektroda sebagai biosensor. Nilai konsentrasi permukaan yang dihasilkan oleh elektroda HRP/GA/PANI yaitu sebesar 7.136 x 10-9 mol/cm2. Konsentrasi permukaan elektroda HRP/GA/PANI dihasilkan sebesar 7.136 x 10-9 mol/cm2 yang lebih besar dibandingkan dengan elektroda HRP-PANI-ClO4/ITO 5.81 x 10-9 mol/cm2 (Solanki et al. 2013).
Kinerja Elektroda HRP/GA/PANI
17 dengan perbandingan 1:1 dan buffer fosfat 0.1 M serta H2O2 sebagai zat yang akan
direduksi. Laju reaksi reduksi H2O2 oleh enzim HRP dijelaskan dengan produk
yang dihasilkan yaitu berupa arus yang terukur dengan voltamogram siklik. Pembentukan komplek enzim-substrat menentukan produk yang dihasilkan. Semakin banyak kompleks enzim-substrat yang terbentuk maka semakin banyak produk yang dihasilkan yang berarti laju reaksi berjalan cepat. Tahap laju reaksi reduksi H2O2 terjadi dalam tiga keadaan. Pada keadaan awal dengan [S] rendah,
jumlah enzim yang berada dalam keadaan bebas lebih besar daripada kompleks enzim-substrat sehingga laju pembentukan produk berlangsung lambat maka perubahan konsentrasi hidrogen peroksida akan linier dengan kecepatan reaksi. Lambatnya pembentukan produk berupa nilai arus yang rendah seperti pada Gambar 5.
Pada konsentrasi substrat menengah selanjutnya, peningkatan konsentrasi hidrogen peroksida yang semakin tinggi, laju reaksi semakin cepat untuk menghasilkan produk berupa arus yang semakin besar. Pada keadaan statis atau keadaan akhir, peningkatan konsentrasi hidrogen peroksida yang semakin tinggi menyebabkan seluruh enzim berada pada keadaan komplek enzim-substrat. Pada saat seluruh enzim berada pada keadaan enzim-substrat sehingga laju reaksi mencapai titik maksimum karena enzim berada pada kondisi jenuh yang ditandai dengan arus yang dihasilkan tidak meningkat secara signifikan.
Kinetika aktivitas enzim melebihi nilai konsentrasi substrat maka akan terbentuk kurva hiperbola atau sering disebut dengan kurva Michaelis-Menten pada Gambar 8 menjelaskan ketiga fase tersebut sebagai efek dari konsentrasi hidrogen peroksida terhadap elektroda HRP/GA/PANI. Pada konsentrasi hidrogen peroksida 0.1 mM, arus yang dihasilkan semakin meningkat seiring dengan meningkatnya konsentrasi hidrogen peroksida. Hal tersebut dikarenakan konsentrasi substrat lebih kecil dibandingkan dengan enzim bebas. Namun, pada konsentrasi hidrogen peroksida lebih besar dari 0.5 mM arus yang dihasilkan tidak meningkat secara signifikan yang dikarenakan enzim HRP berada pada kondisi jenuh. Dengan kata lain laju reaksi mencapai titik maksimum.
Penentuan Km dan Imax dihitung menggunakan kurva linieritas yang diperoleh
dari kurva Michaelis-Menten. Kurva linieritas diplot
���� yang dinamakan dengan
kurva Lineweaver-Burk. Dari kurva tersebut diperoleh nilai Km dan Imax secara
berurutan sebesar 1.71 mM dan 0.29 mA. Nilai Km yang dihasilkan elektroda
HRP/GA/PANI lebih kecil dibandingkan dengan nilai Km yang dihasikan dari
elektroda HRP-PANI-ClO-4/ITO yaitu sebesar 1.984 mM (Solanki et al. 2011). Km merupakan konsentrasi substrat yang diperlukan untuk mencapai setengah
kecepatan reaksi maksimum. Nilai Km yang besar menjelaskan affinitas komplek
enzim-substrat rendah, sedangkan bila nila Km kecil menjelaskan affinitas
subtrat-enzim tinggi. Nilai Km elektroda HRP/Chi-GAD/RuNPs (Periamasi et al. 2011)
sebesar 5.06 mM lebih kecil Dibandingkan dengan nilai Km pada penelitian ini
sebesar 1.71 mM. Ditinjau dari nilai Imax, penelitian ini menghasilkan nilai Imax yang
lebih besar senilai 0.29 mA dibandingkan dengan HRP/Chi-GAD/RuNPs sebesar 1.7999 µA.
Kinerja elektroda HRP/GA/PANI sebagai biosensor juga dapat ditinjau dari nilai sensitifitas. Nilai sensitifitas elektroda HRP/GA/PANI pada penelitian ini sebesar 12.14 mA/mMcm2 seperti pada Lampiran 4. Pada penelitian sebelumnya,
18
HO-(aq) NH4+(aq) H+(aq) Cl-(aq)
sensitifitas 0.5638 mA/mMcm2. Hal tersebut menjelaskan bahwa nilai sensitifitas
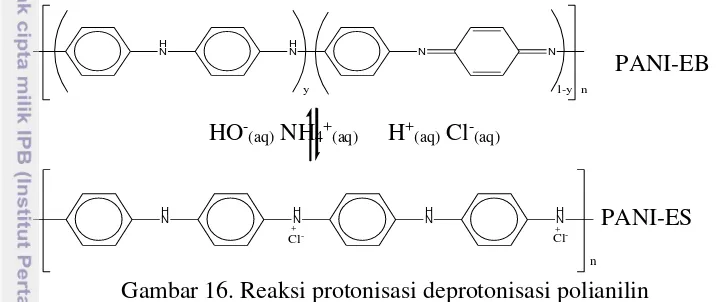
elektroda HRP/GA/PANI lebih besar dibandingkan dengan elektroda HRP-PANI-ClO-4/ITO. Berdasarkan hasil penelitian tersebut, kinerja elektroda pada penelitian ini lebih baik yang menghasilkan arus sebesar 12.14 mA pada setiap 1 mM hidrogen peroksida. Besarnya nilai arus yang dihasilkan dari elektroda tersebut dipengaruhi oleh konduktifitas PANI dalam bentuk emeraldine salt (ES) yang dapat melakukan reaksi oksidasi dengan asam-asam protonik seperti HCl, sebaliknya bentuk ES dapat dikembalikan menjadi bentuk EB melalui reaksi reduksi dengan agen reduktan seperti NH4OH, seperti ditunjukkan pada Gambar 14.
H
Gambar 16. Reaksi protonisasi deprotonisasi polianilin
Untuk mencapai setengah dari laju reaksi maksimum enzim terhadap substrat diperlukan kosntentrasi substrat tertentu yang akan menjelaskan nilai Km. Laju
reaksi maksimum enzim HRP terhadap substrat yang dianalogikan dengan Imax
Nilai Km dan Imax yang dihasilkan dapat mempresentasikan kinetika enzim
horseradish peroksidase. Nilai arus yang dihasilkan mempresentasikan laju reaksi katalis enzim HRP terhadap H2O2. Pembentukan kompleks enzim-subtrat menjadi
penentu laju reaksi yang terjadi. Semakin banyak kompleks enzim-substrat (ES) yang terbentuk, semakin cepat reaksi dan produk yang dihasilkan. Pada konsentrasi substrat yang rendah, kecepatan reaksi lebih tinggi sehingga akan menghasilkan linieritas terhadap substrat. Namun pada konsentrasi subtrat yang tinggi perubahan produk yang dihasilkan tidak terlalu signifikan dikarenakan enzim berada pada kondisi kompleks enzim-substrat yang merupakan laju reaksi maksimum (Vmax).
Berdasarkan kurva Michaelis-Menten diketahui pada konsentrasi 0.5 mM arus yang dihasilkan tidak signifikan yang menandakan enzim berada pada kejenuhan atau mencapai laju reaksi maksimum.
PANI-EB
19 Tabel 1. Perbandingan Hasil Penelitian
Elektroda Km Imax Sensitifitas Linieritas Konsentrasi Permukaan Referensi
HRP/Chi-Dibandingkan dengan penelitian sebelumnya, nilai Km yang diperoleh dalam
penelitian ini sedikit lebih rendah dibandingkan dengan biosensor Solanki et al.
(2011) yaitu sebesar 1.984 mM. Hal ini menunjukkan bahwa elektroda HRP/GA/PANI memiliki nilai affinitas yang baik. Ditinjau dari nilai Imax yang
dihasilkan, elektroda HRP/GA/PANI menghasilkan nilai Imax yang paling tinggi dibandingkan dengan penilitian sebelumnya. Nilai Imax yang tinggi menujukkan
20
4
SIMPULAN DAN SARAN
Simpulan
Penggunaan nanoserat polianilin yang memiliki sifat konduktif dapat meningkatkan kinerja transfer elektron biosensor. Enzim HRP diamobilisasi dengan menggunakan glutaraldehid secara ikatan silang (cross linking) dapat menjaga kestabilan konformasi enzim. Kinerja optimum elektroda HRP/GA/PANI berada pada kondisi pH 7 bufer fosfat 0.1 M dan suhu 50oC. Berdasarkan kurva Michaelis-Menten, kinerja elektroda HRP/GA/PANI berada pada daerah linear 0.1–0.5 mM. Elektroda HRP/GA/PANI memiliki nilai Km dan secara berturut-turut
sebesar 1.71 mM dan 0.29 mA dengan nilai sensitifitas sebesar 12.14 mA/mMcm2. Elektroda HRP/GA/PANI memiliki konsentrasi permukaan sebesar 7.136 x 10-9 mol/cm2.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui pengaruh konsentrasi enzim terhadap kinerja biosensor HRP/GA/PANI, serta penentuan respon time
sebagai biosensor hidrogen peroksida. Selain itu, recovery concentration hidrogen peroksida juga perlu dilakukan untuk menentukan tingkat ketepatan pendeteksian hidrogen peroksida menggunakan elektroda HRP/GA/PANI sebagai biosensor.
Ucapan Terima Kasih
21
DAFTAR PUSTAKA
Abdel-Aty A.M., Hamed M.B., Fahmy A.S., Mohamed S.A. 2013. Comparison of the potential of Ficus sycomorus latex and horseradish peroxidases in the decolorization of synthetic and natural dyes. Journal of Genetic Engineering and Biotechnology. 11: 95–102.
Agnès C., Reuillard B., Goff A.L., Holzinger M., Cosnier S. 2013. A double-walled carbon nanotube-based glucose/H2O2 biofuel cell operating under
physiological conditions.AElectrochemistry Communications. 34: 105–108. Ahirwal G.K., Mitra C.K. 2009. Direct Electrochemistry of Horseradish Peroxidase-Gold Nanoparticles Conjugate. Sensors. 9:881-894: DOI:10.3390/s90200881.
Ansari R., Keivani M.B. 2006. Polyaniline Conducting Electroactive Polymers: Thermal and Environmental Stability Studies. E-Journal of Chemistry. 3: 202-217.
Bakhshi A.K., Bhalla G. 2004. Electrically conducting polymers: Materials of the twentyfirst century. Journal of Scientific and Industrial Research. 63: 715-728.
Chang Q., Tang H. 2014. Immobilization of Horseradish Peroxidase on NH2
-Modified Magnetic Fe3O4/SiO2 Particles and Its Application in Removal of
2,4-Dichlorophenol. Molecules 19: 15768-15782.
Chattopadhyay K., Mazumdar S. 2000. Structural and Conformational Stability of Horseradish Peroxidase: Effect of Temperature and pH. Biochemistry. 39: 263-270.
Colak O., Arslan H., Zengin H., Zengin G. 2012. Amperometric Detection of Glucose by Polyaniline-Activated Carbon Composite Carbon Paste Electrode.
International Journal of Electrochemical Science. 7: 6988 – 6997.
Crescenzi V., Francescangeli A., Taglienti A., Capitani D., Mannina L. 2003. Synthesis and Partial Characterization of Hydrogels Obtained viaGlutaraldehyde Crosslinking of Acetylated Chitosan and of Hyaluronan Derivatives. Biomacromolecules. 4 (4): 1045–1054
Dissanayakea M., Ramchandran L., Donkor O.N, Vasiljevic T. 2013. Denaturation of whey proteins as a function of heat, pH and protein concentration.
International Dairy Journal. 31: 93-99.
Fang K.C., Hsu C.P., Kang Y.W., Fang J.Y., Huang C.C., Hsu C.H., Huang Y.F., Chen C.C., Li S.S., Yeh J.A., Yao D.J., Wang Y.L. 2014. Realization of an ultra-sensitive hydrogen peroxide sensor with conductance change of horseradish peroxidase-immobilized polyaniline and investigation of the sensing mechanism. Biosensors and Bioelectronics. 55: 294–300.
Farzamfara B., Bayanolhagh S., Mahboudi F., Zahrai M. 2007. The Effect of Different Stabilizers on Stability of Horseradish PeroxidaseBovine Serum Albumin-Aflatoxin B1, a Conjugated Tracer for Detection of Aflatoxin B1 in Immunoassay-Based Methods. Iranian Journal of
Pharmaceutical Research. 6: 179-184.
Hemalatha T., Maheswari T.U., Krithiga G., Sankaranarayanan P., Puvanakrishnan R. 2013. Enzymes in clinical medicine: An overview. Indian Journal of
22
Jin Z., Su Y., Duan Y. 2001. A Novel Method for Polyaniline Synthesis With The Immobilized Horseradish Peroxidase Enzyme. Synthetic Metal. 122: 237-242. Lopez J.N.R, Lowe D.J., Ruiz J.H., Hiner A.N.P., Canovas F.G., Thorneley R.N.F.
2001. Mechanism of Reaction of Hydrogen Peroxide with Horseradish Peroxidase: Identification of Intermediates in the Catalytic Cycle. J.
American Chemical Society. 123:11838-11847
Maddu A., Wahyudi S.T., Kurniati M. 2008. Sintesis dan Karakterisasi Nanoserat Polianilin. Jurnal Nanosains & Nanoteknologi. 1: 74-78.
Marken F., Neudeck A., Bond A.M. 2010. Electroanalytical Methods, 2nd ed:
Cyclic Voltammetry. Springer-Verlag Berlin Heidelberg. United Kingdom.
Nalwa H.S. 1997. Handbook of Organic Conductive Molecules and Polymers: John Wiley & Sons. New York.
Ortega E., Marcos S.D., Galban J. 2013. Fluorometric enzymatic autoindicating biosensor for H2O2 determination based on modified catalase. Biosensors and
Bioelectronics. 41:150–156.
Pahurkar V.G., Tamgadge Y.S., Gambhire A.B., Muley G.G. 2015. Glucose oxidase immobilized PANI cladding modified fiber optic intrinsic biosensor for detection of glucose. Sensors and Actuators B: Chemical. 210: 362–368. Palanisamy S., Unnikrishnan B., Chen S.M. 2012. An Amperometric Biosensor
Based on Direct Immobilization of Horseradish Peroxidase on Electrochemically Reduced Graphene Oxide Modified Screen Printed Carbon Electrode. International Journal of Electrochemical Science. 7: 7935-7947. Periasamy A.P., Ting S.W., Chen S.M. 2011. Amperometric and Impedimetric
H2O2 Biosensor Based on Horseradish Peroxidase Covalently Immobilized at
Ruthenium Oxide Nanoparticles Modified Electrode. International Journal of Electrochemical Science. 6: 2688 – 2709.
Pita M., Sanchez C.G., Toscano M.D., Shleev S., Lacey A.L.D. 2013. Oxygen biosensor based on bilirubin oxidase immobilized on a nanostructured gold electrode. Bioelectrochemistry. 94: 69–74.
Rawal R., Chawla S., Devender, Pundir C.S. 2012. An amperometric biosensor based on laccase immobilized onto Fe3O4NPs/cMWCNT/PANI/Au electrode
for determination of phenolic content in tea leaves extract. Enzyme and
Microbial Technology. 51: 179–185.
Safavi A., Farjami F. 2010. Hydrogen peroxide biosensor based on a myoglobin/hydrophilic room temperature ionic liquid film. Analytical Biochemistry. 402: 20–25.
Solanki P.R., Kaushik A., Ansari A.A., Sumana G., Malhotra B.D. 2011. Horse radish peroxidase immobilized polyaniline for hydrogen peroxide sensor.
Polymer Advanced Technologies. 22: 903–908.
Song M.J., Hwang S.W., Whang W. 2010. Amperometric hydrogen peroxide biosensor based on a modified gold electrode with silver nanowires. J Appl
Electrochem. DOI 10.1007/s10800-010-0191-x.
23 Stojek Z. 2010. Electroanalytical Methods: Experimental Setup. E-Book. Springer.
Verlag Berlin Heidelberg.
Tang H., Ding Y., Zang C., Gu J., Shen Q., Kan J. 2014. Effect of Temperature on Electrochemical Degradation of Polyaniline. International Journal of
Electrochemical Science. 9: 7239-7252.
Temocin Z., Yigitoglu M. 2009. Studies on the activity and stability of immobilized horseradish peroxidase on poly(ethylene terephthalate) grafted acrylamide fiber. Bioprocess Biosyst Eng. 32: 467–474.
Torres E., Ayala M. 2010. Biocatalysis Based on Heme Peroxidases: Peroxidases
as Potential Industrial Biocatalysts. E-Book. Springer Heidelberg Dordrecht
London New York.
Umar A., Ahmad R., Hwang S.W., Kim S.H., Al-Hajry A., Hahn Y.B. 2014. Development of Highly Sensitive and Selective Cholesterol Biosensor Based on Cholesterol Oxidase Co-Immobilized with α-Fe2O3 Micro-Pine Shaped
Hierarchical Structures.Electrochimica Acta. 136: 396–403.
Virji S., Kojima R., Fowler J.D., Villanueva J.G., Kaner R.B., Weiller B.H. 2009. Polyaniline Nanofiber Composites with Amines: Novel Materials for Phosgene Detection. Nano Res. 2: 135-142.
Wang X., Eerola P.S., Immonen K., Bobacka J., Bergelin M. 2011. Immobilization of Trametes hirsuta laccase into poly(3,4-ethylenedioxythiophene) and polyaniline polymer-matrices. Journal of Power Sources. 196: 4957–4964 Xu R., Chi C., Li F., Zhang B. 2013. Immobilization of horseradish peroxidase on
electrospun microfibrous membranes for biodegradation and adsorption of bisphenol A.Bioresource Technology. 149: 111–116
Yalcıner F., Cevik E., Senel M., Baykal A. 2011. Development of an Amperometric
Hydrogen Peroxide Biosensor based on the Immobilization of Horseradish Peroxidase onto Nickel Ferrite Nanoparticle-Chitosan Composite. Nano-Micro Lett. 3: 91-98.
Yang Y., Yang M., Wang H., Jiang J., Shen G., Yu R. 2004. An amperometric horseradish peroxidase inhibition biosensor based on a cysteamine self-assembled monolayer for the determination of sulfides. Sensors and Actuators B. 102: 162–168.
Zhang X., Zhu J., Haldolaarachchige N., Ryu J., Young D.P., Wei S., Guo Z. 2012. Synthetic process engineered polyaniline nanostructures with tunable morphology and physical properties. Polymer. 53: 2109-2120.
24
25 Lampiran 1. Bagan Alir Penelitian
Lampiran 2. Nilai arus reduksi hidrogen peroksida oleh elektroda HRP/GA/PANI terhadap pengaruh pH
pH Arus (mA)
6 0
6.5 0.38
7 0.96
7.5 0
8 0
Pembuatan EPK dan EPKT Amobilisasi Enzim HRP
Elektroda HRP/GA/PANI
Optimasi pH elektroda HRP/GA/PANI
Optimasi suhu elektroda HRP/GA/PANI
Parameter Kinetika elektroda HRP/GA/PANI pH 6-8 (rentang 0.5)
26
Lampiran 3. Nilai arus reduksi hidrogen peroksida oleh elektroda HRP/GA/PANI terhadap pengaruh suhu
Lampiran 4. Nilai arus reduksi hidrogen peroksida oleh elektroda HRP/GA/PANI terhadap variasi konsentrasi H2O2
[H2O2] (mM) Arus (mA)
Lampiran 5. Nilai arus kurva linieritas reduksi hidrogen peroksida oleh elektroda HRP/GA/PANI terhadap variasi konsentrasi H2O2
27 Lampiran 6. Nilai Arus kurva Lineweaver-Burk reduksi hidrogen peroksida oleh
elektroda HRP/GA/PANI terhadap variasi konsentrasi H2O2
[H2O2] (mM) Arus (mA) 1/[H2O2] 1/I
0.1 4.007 10.0 0.250
0.125 4.221 8.0 0.237
0.15 4.347 6.667 0.230
0.175 4.456 5.714 0.224
0.2 4.591 5.0 0.218
0.225 4.806 4.444 0.208
0.25 4.899 4.0 0.204
0.3 5.222 3.333 0.191
Lampiran 7. Perhitungan nilai sensitifitas elektroda HRP/GA/PANI
Nilai arus dan konsentrasi hidrogen peroksida diambil dari kurva linieritas pada Lampiran 5
Sensitifitas = (It rt n − It r n a )
([S]t rt n − [S]t r n a ) × luas permukaan elektroda
Sensitifitas = . − .
. − . × .
Sensitifitas = . mA/mMcm
Lampiran 8. Perhitungan nilai konsentrasi permukan elektroda HRP/GA/PANI
Ip =n F ΓAVRT
Γ =n F AVIp RT
Γ = ×. × .× . × ×
28
Lampiran 9. Asam Amino Penyusun Enzim Horseradish Peroksidase (1H58)
Asam Amino
Kode
Jumlah Persentasi
(%) Sifat 3 Huruf 1 Huruf
Aspartat Asp D 21 6.82% Bermuatan
Glutamat Glu E 7 2.27% Bermuatan
Lisin Lys K 6 1.95% Bermuatan
Arginin Arg R 21 6.82% Bermuatan
Total Asam amino bermuatan 55 17.86%
Sistein Cys C 8 2.60% Polar
Histidin His H 3 0.97% Polar
Metionin Met M 4 1.30% Polar
Asparagin Asn N 27 8.77% Polar
Glutamin Gln Q 13 4.22% Polar
Serin Ser S 25 8.12% Polar
Treonin Thr T 25 8.12% Polar
Triptofan Trp W 1 0.32% Polar
Tirosin Tyr Y 5 1.62% Polar
Total Asam amino polar 111 36.04%
Alanin Ala A 23 7.47% Non polar
Fenilalanin Phe F 20 6.49% Non polar
Glisin Gly G 17 5.52% Non polar
Isolusin Ile I 13 4.22% Non polar
Leusin Leu L 35 11.36% Non polar
Prolin Pro P 17 5.52% Non polar
Valin Val V 17 5.52% Non polar
Total Asam amino non-polar 142 46.10%
29
RIWAYAT HIDUP
Penulis dilahirkan di Banda Aceh pada tanggal 29 Agustus 1989 dari ayah bernama Aiyub dan ibu bernama Nurhayati. Penulis merupakan anak kedua dari enam bersaudara. Pada tahun 2004 penulis diterima pada Madrasah Aliyah Jeumala Amal dan lulus tahun 2007. Pada tahun yang sama, penulis diterima di perguruan tinggi negeri Aceh Universitas Syiah Kuala melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan diterima pada Jurusan Pendidikan Kimia, Fakultas Keguruan dan Ilmu Pendidikan. Pada tahun 2010 penulis ikut berpartisipasi dalam Program Kreatifitas Mahasiswa Penelitian (PKM-P) dengan judul “Pemanfaatan Ekstrak Limbah Kulit Buah Kakao (Theobroma cacao) Sebagai Biopestisida Antifeedant Terhadap Hama Tanaman Sawi (Plutella xylostella)” yang
diselenggarakan oleh DIKTI. Pada tahun 2011 penulis lulus dari Universitas Syiah Kuala. Pada tahun 2013 penulis diterima di Sekolah Pasca Sarjana Departemen Biokimia dan mendapatkan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) DIKTI. Penulis telah mensubmit artikel dengan judul “Biosensor H2O2
By Using Immobilized Horseradish Peroxidase Glutaraldehyde On Carbon
Polyaniline Nanofiber Composite” di jurnal American Journal of Sensor