PRODUKSI ANTIBODI ANTI-Coxiella burnetii
UNTUK DETEKSI Q FEVER PADA RUMINANSIA
DENGAN METODE IMUNOHISTOKIMIA
NINA HERLINA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Produksi Antibodi Anti-Coxiella burnetii untuk Deteksi Q Fever pada Ruminansia dengan Metode Imunohistokimia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NINA HERLINA. Produksi Antibodi Anti-Coxiella burnetii untuk Deteksi Q Fever pada Ruminansia dengan Metode Imunohistokimia. Dibimbing oleh AGUS SETIYONO, VETNIZAH JUNIANTITO dan SYAHRUDDIN SAID.
Q fever merupakan penyakit zoonosis yang disebabkan oleh bakteri gram negatif Coxiella burnetii dan terdistribusi luas di seluruh dunia. Gejala klinis pada hewan ternak bersifat tidak konsisten dan tidak spesifik. Teknik diagnosa yang baik merupakan salah satu langkah pencegahan dan pengendalian penyakit Q fever. Salah satu komponen penting untuk diagnosa adalah antibodi. Produksi antibodi anti-C. burnetii dapat dilakukan untuk menunjang diagnosa baik secara serologis (ELISA, Western blot), immunochromatographic strip (imunostrip) maupun imunohistokimia.
Penelitian ini bertujuan memproduksi antibodi poliklonal anti-C. burnetii dan mengkarakterisasinya. Antibodi tersebut kemudian digunakan untuk mendeteksi antigen dengan metode imunohistokimia. Antibodi poliklonal diperoleh dari induksi isolat C. burnetii pada kelinci. Antibodi ini diharapkan mampu mengikat antigen isolat lapang pada organ limpa, paru-paru dan hati sapi dari Rumah Potong Hewan (RPH) di Medan yang sebelumnya telah dikonfirmasi positif C. burnetii.
Produksi antibodi poliklonal dilakukan pada dua ekor kelinci New Zealand White (NZW) jantan berumur 10-16 minggu. Kelinci tersebut diinduksi dengan imunogen C. burnetii strain Nine Mile (NM) II. Imunisasi pertama dilakukan dengan mengemulsikan imunogen dengan Complete Freund’s Adjuvant (CFA) untuk menginduksi antibodi secara perlahan. Boosting dilakukan menggunakan imunogen yang sama dan penambahan Incomplete Freund’s Adjuvant (IFA) yang dilakukan pada hari ke-14 pasca induksi. Pemanenan serum dilakukan pada hari ke-24 pasca induksi. Antibodi terhadap C. burnetii dianalisis menggunakan teknik Dot Blot yang menunjukkan adanya reaksi positif warna keunguan dengan penambahan substrat Tetramethylbenzidine (TMB) mengindikasikan bahwa IgG telah terbentuk.
Serum yang diperoleh dipurifikasi menggunakan metode presipitasi dengan amonium sulfat saturasi 35 %. Setelah dialisis dengan PBS pH 7.4 dilakukan filtrasi gel dengan matriks Sephadex G-75. Hasil konsentrasi akhir protein yaitu sebesar 11.3 µg µl-1. Profil protein imunogen dan antibodi yang dihasilkan dilihat menggunakan Sodium Dodecyl Sulfate Poly Acrylamide Gel Electrophoresis (SDS PAGE). Pewarnaan Coomassie blue menunjukkan pita pada berat molekul 170 kDa, 100 kDa, 65 kDa, 50 kDa dan 25 kDa. Pita 170 kDa merupakan fragmen IgG yang tidak terdenaturasi, sedangkan pita dengan bobot molekul 50 kDa merupakan antibodi heavy chain (rantai berat) dan bobot molekul 25 kDa sebagai light chain (rantai ringan).
protein NM II sedangkan 58.284 kDa sebagai chaperonin (Grol) soluble protein NM II (Kowalczewska et al. 2011).
Pengujian antibodi dilakukan dengan terlebih dahulu melakukan preparasi sampel organ limpa yang telah difiksasi dalam formalin. Isolasi protein dilakukan dengan menginkubasi sampel dalam larutan lisis buffer yang mengandung 2% sodium dodecyl sulfat (SDS) pada suhu 100 oC selama 20 menit dilanjutkan dengan inkubasi pada suhu 60 oC selama 2 jam. Hasil isolasi kemudian dianalisa dengan Dot Blot. Hasil menunjukkan adanya warna keunguan akibat adanya reaksi antara antibodi dan antigen C. burnetii. Pemeriksaan dilanjutkan dengan melakukan SDS PAGE dan Western Blot. Selain itu dilakukan juga pemeriksaan dengan metode imunohistokimia. Sampel yang digunakan berupa limpa, paru-paru dan hati sapi asal Rumah Potong Hewan (RPH) Kota Medan yang sebelumnya telah dikonfirmasi positif Q Fever oleh Nasution et al. (2014). Hasil menunjukkan bahwa sebanyak 90 % limpa, 100 % paru dan 100 % hati bersifat imunoreaktif.
Antibodi yang telah dipurifikasi tersebut mampu mendeteksi antigen C. burnetii pada ruminansia bahkan pada hewan yang asimptomatik Q Fever.
SUMMARY
NINA HERLINA. Production of Anti-Coxiella burnetii Antibody for Q Fever Diagnosis in Ruminants using Immunohistochemistry Method. Supervised by AGUS SETIYONO, VETNIZAH JUNIANTITO and SYAHRUDDIN SAID.
Q fever is a widespread zoonosis due to gram negative bacterium Coxiella burnetii infection. The symptoms of disease described in domestic animals have so far been inconsistent and not specific. Antibody as a major component of diagnostic can be used to confirm diagnosis through serologic (ELISA, Western blot), immunochromatographic strip or immunohistochemistry method. The research activities were conducted to produce polyclonal anti-C. burnetii antibody, characterize the antibody using Dot Blot, SDS PAGE and Western Blot. The antibody then immunohistochemically applied in detecting antigen within various cattle organs such as spleen, lung and liver from slaughterhouse in Medan which previously immunohistochemically positive against C.burnetii.
C. burnetii Nine Mile (NM) strain and Complete Freund’s Adjuvant (CFA) were used to induce antibodies in two 10-16-week-old male New Zealand White (NZW) rabbits. Boosting has been done with the same immunogen and
Incomplete Freund’s Adjuvant (IFA) at 14 days post induction. Terminal bleeding has been done at 24 days post induction. Serum was analyzed with Dot blot and immunoreactive result shows purple colour dot after adding TMB substrate as manifestation of antibody forming. Antibody consentration of each step was measured by nanofotometer at 280 nm.
Ammonium sulphate saturation 35 % was used to precipitate serum. After dialysis in PBS PH 7.4, the precipitate was filtrated with Sephadex G-75. The purified antibody concentration measured by nanofotometer was obtained 11.3 µg µl-1. Immunogen and antibody profile were analyzed with SDS PAGE. Coomassie staining showed molecular weight on size 170 kDa, 100 kDa, 65 kDa, 50 kDa and 25 kDa. Band 170 kDa was IgG undenaturated fragment while 50 kDa was heavy chain and 25 kDa was light chain fragment.
Antigen and antibody compatibility was identified with Western Blot. Immunoreactive shown by purple band that indicated produced serum positively bind C. burnetii antigen. The molecular weights consist of 35.5 kDa, 51.4 kDa and 58.284 kDa which indicated outer membrane protein of NM II, hypothetical membrane protein NM II, and Chaperonin (Grol) soluble protein NM II (Kowalczewska et al. 2011).
Sample preparation from formaline-fixed spleen tissue was done to apply the antibody anti-C. burnetii by Dot Blot and Western Blot analysis. Protein was extracted by incubating the tissue in lysis buffer containing 2 % sodium dodecyl sulfate (SDS) at 100 oC for 20 minute followed by incubation at 60 oC for 2 hour (Ikeda et al. 1998) and analyzed by Dot Blot. The result showed purple spot indicated reaction of antibody and antigen C. burnetii. SDS PAGE and Western Blot showed no bands indicated small amount that can not be detected.
lung and liver conclusively. Immunohistochemical detection using purified antibodies is able to detect antigens of C. burnetii in asymptomatic ruminants. Keywords: Q fever, Cattle, Coxiella burnetii, Polyclonal antibody,
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Biomedis Hewan
PRODUKSI ANTIBODI ANTI-Coxiella burnetii
UNTUK DETEKSI Q FEVER PADA RUMINANSIA
DENGAN METODE IMUNOHISTOKIMIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
Judul Tesis : Produksi Antibodi Anti-Coxiella bunetii untuk Deteksi Q Fever
pada Ruminansia dengan Metode Imunohistokimia Nama
NIM
: Nina Herlina
: B3511 40031
ProfdrhA
Disetujui oleh
drh Vetnizah PhD APVet Anggota
in Said A Sc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Biomedis Hewan
Prof Dr Dra Ietje Wientarsih, Apt MSc
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan November 2015 ini berjudul Produksi Antibodi Anti-Coxiella burnetii untuk Deteksi Q Fever pada Ruminansia dengan Metode Imunohistokimia, diajukan sebagai salah satu syarat untuk menyelesaikan pendidikan program Magister pada program studi Ilmu Biomedis Hewan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Prof drh Agus Setiyono MS PhD APVet, drh Vetnizah Juniantito PhD APVet dan Dr Ir Syahruddin Said MAgrSc selaku pembimbing atas waktu dan bimbingannya.
Ungkapan terima kasih juga disampaikan kepada Prof Dr Dra Ietje Wientarsih Apt MSc selaku ketua program studi Ilmu Biomedis Hewan, Dr drh Sus Derthi Widhyari MSi selaku sekretaris program studi Ilmu Biomedis Hewan dan dosen penguji Prof Dr drh I Wayan Teguh Wibawan yang telah memberikan saran dan masukan untuk perbaikan tesis ini. Selain itu, penulis juga mengucapkan terima kasih kepada seluruh dosen di program studi Ilmu Biomedis Hewan dan Biologi Reproduksi, staf administrasi serta laboran di bagian patologi Departemen Klinik, Reproduksi dan Patologi FKH IPB. Ungkapan terima kasih tak terhingga penulis ucapkan untuk Kementerian Riset, Teknologi dan Perguruan Tinggi yang telah memberikan kesempatan untuk melanjutkan jenjang magister melalui beasiswa pasca sarjana dalam negeri.
Terima kasih untuk rekan-rekan seperjuangan di Ilmu Biomedis Hewan dan Biologi Reproduksi 2014 atas semangat persaudaraannya. Ungkapan terima kasih tak terhingga untuk bapak, ibu, suami, anak-anak serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Pembuatan Preparat Histopatologi dan Pewarnaan Hematoksilin Eosin 14
Pewarnaan Imunohistokimia 15
Analisis Data 15
4 HASIL DAN PEMBAHASAN 15
Produksi Antibodi anti-C.burnetii 15
Purifikasi Antibodi anti-C. burnetii 16
Isolasi Protein Sampel Limpa terfiksasi BNF 17
Aplikasi Antibodi Anti-C. burnetii dengan Imunohistokimia 18
Pembahasan 20
5 SIMPULAN DAN SARAN 25
Simpulan 25
Saran 26
LAMPIRAN 31
DAFTAR TABEL
1 Hasil pengukuran konsentrasi serum darah kelinci NZW 16 2 Hasil pengukuran konsentrasi antibodi anti-C. burnetii setelah
purifikasi 16
3 Hasil pewarnaan imunohistokimia dengan antibodi anti-C. burnetii 20
DAFTAR GAMBAR
1 C. burnetii dengan mikroskop elektron memperlihatkan membran sel
serupa bakteri gram negatif 3
2 Fagositosis C. burnetii dalam makrofag 5
3 C. burnetii dalam makrofag 6
4 Patofisiologi dari C. burnetii 7
5 Struktur gambaran molekul antibodi 9
6 Analisis keberadaan antibodi anti C. burnetii dengan Dot blot 16 7 Hasil SDS PAGE dan Western blot antibodi anti-C. burnetii 17 8 Hasil Dot blot isolasi protein sampel limpa terfiksasi BNF 18 9 Hasil SDS PAGE dan Western blot isolasi protein sampel limpa
terfiksasi BNF 18
10 Hasil pewarnaan HE dan imunohistokimia pada limpa 19 11 Hasil pewarnaan HE dan imunohistokimia pada paru-paru 19 12 Hasil pewarnaan HE dan imunohistokimia pada hati 20
DAFTAR LAMPIRAN
1 PENDAHULUAN
Q fever (Query fever) merupakan penyakit yang disebabkan oleh bakteri gram negatif bersifat obligat intraseluler Coxiella burnetii (Angelakis dan Raoult 2010, Cremoux et al. 2011). Q fever bersifat zoonosis (Jones et al. 2011; Wielders et al. 2015). Penyakit ini pertama kali diketahui terjadi pada pekerja rumah potong hewan di Brisbane Australia (Derrick 1937; Maurin dan Raoult 1999), kemudian menyebar ke seluruh dunia kecuali Antartika dan Selandia Baru (Raoult et al. 2005; Jones et al. 2011). Australia sebagai negara pengimpor sapi terbesar untuk Indonesia masih belum bebas dari penyakit ini. Hal tersebut ditunjukkan dari hasil kajian seroprevalensi terhadap sapi potong di Queensland dengan 16.8% sampel serum yang diperiksa seropositif terhadap bakteri ini (Cooper et al. 2011). Pada tahun 2007-2010, outbreak terjadi di Belanda dengan >4000 orang terinfeksi Q fever dan tingkat mortalitas mencapai 15.8% pada kejadian kronis (Kampschreur et al. 2012). Bakteri penyebab penyakit ini dapat bertindak sebagai agen bioterorisme seperti halnya Antraks ataupun Brucella (CDC 2008). Keputusan Menteri Pertanian No.4026/Kpts./OT.140/3/2013 menyatakan bahwa Q fever termasuk ke dalam daftar jenis penyakit hewan menular strategis (PHMS) yang perlu mendapat perhatian (KEMENTAN 2013).
Manifestasi klinis Q fever pada hewan umumnya tidak menciri sehingga sulit didiagnosa secara klinis. Namun yang dikhawatirkan adalah terjadinya subfertilitas, infertilitas, metritis, endometritis, retensi plasenta, stillbirth, dan keguguran pada trimester akhir kebuntingan (Arricau-Bouvery dan Rodolakis 2005; Brom dan Vellema 2009; Rodolakis 2014). Metode untuk identifikasi C. burnetii antara lain dengan isolasi dan identifikasi bakteri, molekuler, uji serologis dan imunohistokimia (Angelakis dan Raoult 2010). Beberapa penelitian terbaru mengenai deteksi keberadaan patogen ini menggunakan Polymerase Chain Reaction (PCR), Enzyme Linked Immunosorbent Assay (ELISA) dan teknik imunohistokimia mendapatkan hasil positif pada sejumlah sampel ternak di Indonesia (Mahatmi et al. 2007; Setiyono dan Subangkit 2014; Nasution et al. 2014). Teknik imunohistokimia banyak digunakan untuk mendeteksi keberadaan antigen penyebab Q fever pada organ hewan seperti plasenta kambing, domba dan sapi (Bildfell et al. 2000; Hansen et al. 2011). Teknik diagnosa yang baik dan akurat merupakan salah satu landasan untuk pencegahan dan pengendalian penyebaran penyakit ini di lapangan. Salah satu komponen penting untuk diagnostik penyakit adalah antibodi. Antibodi tergolong sebagai protein imunoglobulin yang dapat berikatan spesifik dengan antigen tertentu. Salah satu faktor penentu keberhasilan sensitivitas dan spesifisitas produksi antibodi adalah imunogen yang digunakan. Strain NM merupakan isolat C. burnetii yang bersifat
2
Saat ini sebagian besar antibodi yang digunakan untuk diagnostik berasal dari produsen asing dengan harga yang tergolong mahal. Oleh karena itu, produksi antibodi untuk tujuan deteksi penyakit Q Fever merupakan peluang.
Latar Belakang
Q fever merupakan penyakit asal hewan ruminansia yang bersifat zoonosis. Penyakit ini dapat bersifat akut, kronis ataupun subklinis dengan gejala yang tidak menciri. Bakteri ini menyebabkan terjadinya penurunan produksi ternak. Selain itu, melalui urin, feses, susu ataupun plasenta serta cairan amnion ternak terinfeksi dapat mengkontaminasi lingkungan. Teknik imunohistokimia merupakan teknik yang tepat dan akurat untuk melihat jejak antigen pada organ atau jaringan. Metode ini dapat digunakan untuk melihat keamanan pangan asal ternak dan mengantisipasi tidak tersedianya fasilitas Bio Safety Level 3 (BSL 3) untuk isolasi agen. Komponen penting untuk deteksi secara imunohistokimia yaitu antibodi. Antibodi poliklonal dapat diproduksi menggunakan hewan coba secara konvensional.
Perumusan Masalah
Q fever merupakan penyakit bakterial bersifat zoonosis yang mampu menurunkan produktifitas ternak ruminansia. Ketersediaan informasi mengenai distribusi penyakit ini di Indonesia masih terbatas. Hal yang dapat mendukung pencegahan serta pengendalian penyakit ini diantaranya adalah teknik diagnosa yang akurat. Beberapa metode diagnosa yang berkembang seperti uji serologis maupun imunohistokimia membutuhkan komponen antibodi. Antibodi poliklonal anti-C. burnetii dapat diproduksi secara konvensional. Antibodi tersebut juga dapat dikembangkan menjadi komponen penunjang untuk diagnostik secara imunohistokimia. Deteksi melalui teknik imunohistokimia dilakukan untuk mengetahui penyebaran penyakit ini pada ternak sapi yang masuk ke RPH.
Tujuan Penelitian
Penelitian ini bertujuan memproduksi antibodi poliklonal anti-C. burnetii dan mengkarakterisasinya. Antibodi tersebut kemudian digunakan untuk mendeteksi antigen dengan metode imunohistokimia.
Manfaat Penelitian
3
2 TINJAUAN PUSTAKA
Penyakit Q fever
Morfologi dan Karakteristik C. burnetii
C. burnetii merupakan bakteri Gram negatif bersifat obligat intraseluler berbentuk batang pleomorphik dengan panjang 0.4-1.0 µm dan lebar 0.2-0.4 µm (Maurin dan Raoult 1999; Angelakis dan Raoult 2010). Meskipun memiliki membran yang serupa dengan bakteri gram negatif lainnya, namun pewarnaan Gram tidak mampu mendeteksi bakteri ini. C. burnetii bersifat tahan asam sehingga dapat dilakukan pewarnaan menggunakan metode Stamp, Gimenez, Macchiavello, Giemsa dan modifikasi Koster (Maurin dan Raoult 1999; Samuel dan Hendrix 2009; OIE 2010). Bakteri ini dapat berbentuk small cell variant (SCV) ataupun large cell variant (LCV) dilihat dengan mikroskop elektron (Parker et al. 2006; Angelakis dan Raoult 2010). SCV akan mengalami diferensiasi sporogenik yang membuat bakteri ini lebih resisten di lingkungan (Angelakis dan Raoult 2010; Horigan et al. 2011) sedangkan LCV akan bermultiplikasi pada monosit atau makrofag inang (Parker et al. 2006).
Gambar 1. C. burnetii dengan mikroskop elektron memperlihatkan membran sel serupa bakteri gram negatif (Fournier et al. 1998)
4
determinan virulensi utama dari bakteri ini. Jika dibandingkan dengan fase I, struktur LPS pada fase II bersifat kasar, lebih pendek dengan sel protein permukaan lebih sedikit (Maurin dan Raoult 1999). Amano et al. (1987) menyatakan bahwa fase II dari bakteri ini kehilangan komponen LPS galactosaminuonyl-α-(l-6)-glucosamine, virenose dan dihydrohydroxystreptose. Modifikasi LPS ini membuat protein permukaan dapat diakses oleh antibodi (Fournier et al. 1998; Arricau-Bouvery dan Rodolakis 2005; Angelakis dan Raoult 2010; Porter et al. 2011).
Keragaman genetik antar strain C. burnetii menggunakan metode restriction fragment length polymorphism (RFLP) dibagi menjadi 6 grup. Grup I, II dan III dihubungkan dengan hewan, caplak atau isolat dari manusia yang terinfeksi akut, sedangkan grup IV dan V diasosiasikan dengan kejadian kronis yang menyebabkan endokarditis pada manusia sementara grup VI diperoleh dari rodensia dengan patogenitas yang belum diketahui (Maurin dan Raoult 1999). C. burnetii strain Nine Mile merupakan isolat pertama asal Amerika yang diisolasi dari caplak (Angelakis dan Raoult 2011). Ukuran dari genom C. burnetii strain Nine Mile yaitu 1.995.275 bp (Seshadri et al. 2003). Strain yang berbeda memiliki ukuran bervariasi antara 1.5-2.4 Mb (Willems et al. 1998). Strain ini merupakan antigenik fase I yang dapat mengalami perubahan menjadi fase II. Hal tersebut dikarenakan adanya delesi kromosom yang meliputi gen penambahan inti oligosakarida dan gen sintesa virenosa (Miller et al. 2004; Raoult et al. 2005). Raoult et al. (2005) menyebutkan bahwa C. burnetii memiliki kromosom sirkular dan plasmid fakultatif. Ada 4 tipe plasmid yang telah diidentifikasi walaupun tidak semua strain memiliki plasmid. Plasmid tersebut diantaranya QpH (32 kb), QpRS (39 kb), QpDG (42 kb) dan QpDV (33 kb). Pada penelitian dengan hewan lab, terdapat korelasi antara fase LPS, tipe plasmid dan manifestasi klinis yang ditimbulkan (Beare et al. 2006).
Epidemiologi Q Fever
Q fever merupakan penyakit zoonosis dengan reservoir yang sangat luas. Berbagai hewan seperti hewan domestikasi, satwa primata, rodensia liar, mamalia kecil, satwa liar dan non mamalia seperti reptil, amfibi, burung, ikan dan arthropoda dapat menjadi reservoir penyakit ini (McQuiston dan Childs 2002; Parker et al. 2006; Angelakis dan Raoult 2010). Domba, kambing dan sapi merupakan reservoir utama dari C. burnetii (Maurin dan Raoult 1999). Kebanyakan kasus yang terjadi pada manusia merupakan transmisi akibat kontak langsung dengan hewan tersebut, terutama pada peternak, dokter hewan maupun pekerja rumah potong hewan (Van den Brom dan Vellema 2009; Rodolakis 2014). Q fever juga diketahui dapat menginfeksi melalui udara dan makanan (airborne and foodborne diseases) serta melalui perantaraan vektor (Angelakis dan Raoult 2005).
5 ditunjukkan dari hasil kajian seroprevalensi terhadap sapi potong di Queensland dimana 16.8% sampel serum yang diperiksa seropositif terhadap bakteri ini (Cooper et al. 2011). Kejadian penyakit ini pada manusia telah dilaporkan di Belanda dimana pada tahun 2007 dan 2010 terjadi outbreak dengan >40.000 individu terinfeksi dan >250 pasien menderita Q fever kronis (Kampschreur et al. 2012; Van der Hoek et al. 2012). Di Indonesia, Q fever pertama kali ditemukan pada tahun 1953 dimana hasil Complement Fixation Test (CFT) 188 serum sapi menunjukkan hasil positif terhadap Coxiella burnetii (Kaplan dan Bertagna 1955). Penelitian Mahatmi et al. (2007) berhasil mendeteksi agen penyakit ini pada 6,68 % sampel organ Sapi Brahman Cross, 5,7 % pada organ domba yang diperoleh di Bogor, serta 4,29 % pada organ Sapi Bali yang diperoleh di rumah potong hewan di Bali dengan metode Polymerase Chain Reaction (PCR).
Patogenesis Q Fever
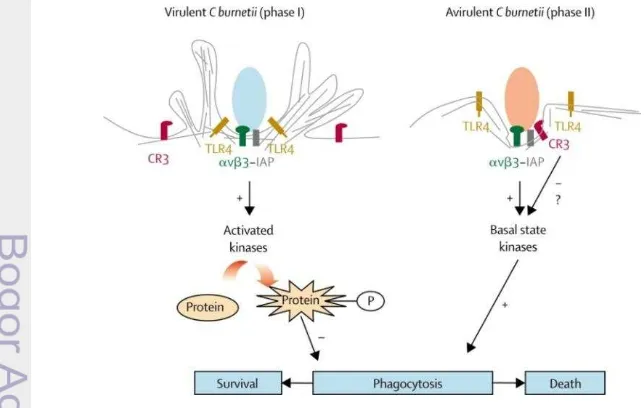
C. burnetii memilliki dua tahap perkembangan sel yaitu small cell variant (SCV) dan large cell variant (LCV). Small cell variant merupakan bentuk ekstraselular dari bakteri. SCV dianggap secara metabolisme inaktif dan mampu bertahan pada kondisi ekstrim seperti terhadap panas, desikasi, pH rendah atau tinggi, desinfektan, produk kimia, tekanan osmotik, dan sinar ultraviolet. Kondisi ini menyebabkan bakteri ini mampu bertahan lama pada lingkungan walaupun tidak terdapat induk semang yang cocok. SCV dari C. burnetii bersifat irreversibel (Maurin dan Raoult 1999; Porter et al. 2011). Bentuk SCV ekstraseluler ini dapat bertahan hingga 150 hari dan tetap bersifat infeksius dimana 1 bakteri saja dapat bersifat infeksius (Woldehiwet 2004; Arricau-Bouvery 2005). Jika SCV yang terdapat pada partikel debu di lingkungan terhisap maka akan menempel pada membran sel dan kemudian masuk ke dalam sel induk semang. Gambar 2 menunjukkan perlekatan bakteri fase I pada membran sel yang hanya dimediasi oleh αvβ3 integrin, sedangkan bakteri fase II dimediasi oleh
αvβ3 integrin dan reseptor CR3 (Capo et al. 1999; Raoult et al. 2005; Angelakis dan Raoult 2010).
6
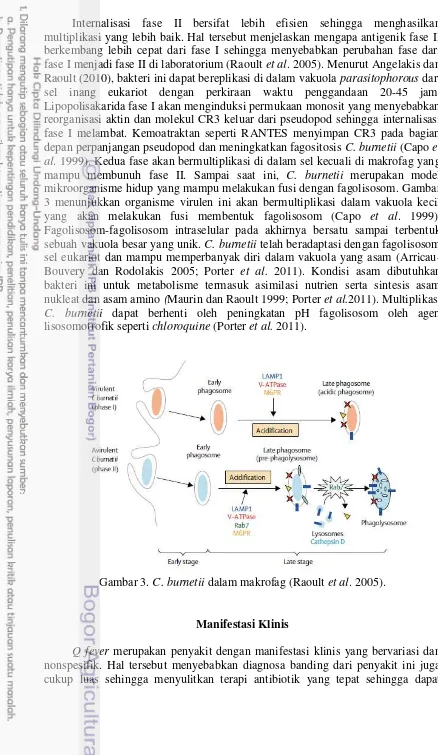
Internalisasi fase II bersifat lebih efisien sehingga menghasilkan multiplikasi yang lebih baik. Hal tersebut menjelaskan mengapa antigenik fase II berkembang lebih cepat dari fase I sehingga menyebabkan perubahan fase dari fase I menjadi fase II di laboratorium (Raoult et al. 2005). Menurut Angelakis dan Raoult (2010), bakteri ini dapat bereplikasi di dalam vakuola parasitophorous dari sel inang eukariot dengan perkiraan waktu penggandaan 20-45 jam. Lipopolisakarida fase I akan menginduksi permukaan monosit yang menyebabkan reorganisasi aktin dan molekul CR3 keluar dari pseudopod sehingga internalisasi fase I melambat. Kemoatraktan seperti RANTES menyimpan CR3 pada bagian depan perpanjangan pseudopod dan meningkatkan fagositosis C. burnetii (Capo et al. 1999). Kedua fase akan bermultiplikasi di dalam sel kecuali di makrofag yang mampu membunuh fase II. Sampai saat ini, C. burnetii merupakan model mikroorganisme hidup yang mampu melakukan fusi dengan fagolisosom. Gambar 3 menunjukkan organisme virulen ini akan bermultiplikasi dalam vakuola kecil yang akan melakukan fusi membentuk fagolisosom (Capo et al. 1999). Fagolisosom-fagolisosom intraselular pada akhirnya bersatu sampai terbentuk sebuah vakuola besar yang unik. C. burnetii telah beradaptasi dengan fagolisosom sel eukariot dan mampu memperbanyak diri dalam vakuola yang asam (Arricau-Bouvery dan Rodolakis 2005; Porter et al. 2011). Kondisi asam dibutuhkan bakteri ini untuk metabolisme termasuk asimilasi nutrien serta sintesis asam nukleat dan asam amino (Maurin dan Raoult 1999; Porter et al.2011). Multiplikasi C. burnetii dapat berhenti oleh peningkatan pH fagolisosom oleh agen lisosomotrofik seperti chloroquine (Porter et al. 2011).
Gambar 3. C. burnetii dalam makrofag (Raoult et al. 2005).
Manifestasi Klinis
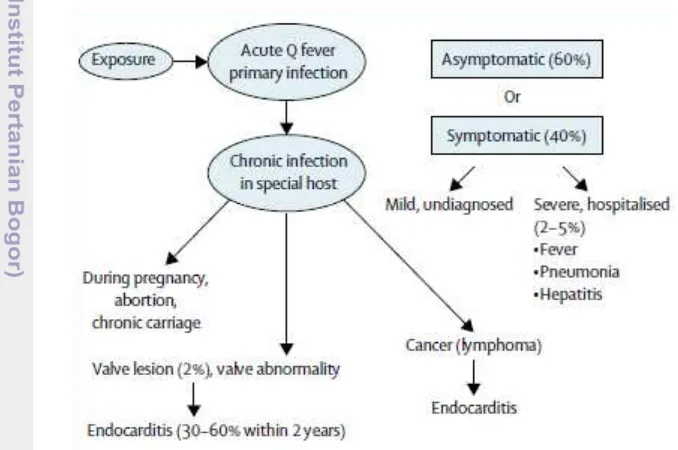
7 menimbulkan komplikasi dan menjadi kronis serta berakibat fatal (OIE 2010). Menurut Raoult et al. (2005), sebanyak 60% paparan Coxiella burnetii pada manusia yang belum divaksin akan menimbulkan infeksi primer yang asimptomatik (Gambar 4). Infeksi tersebut diikuti respon kekebalan tubuh sebagai tanda adanya multiplikasi bakteri. Antibodi yang muncul merupakan bentuk perlawanan terhadap antigen fase II. DNA C. burnetii terdeteksi pada serum selama fase awal infeksi. Saat antibodi mencapai titer tertinggi, DNA bakteri tidak dapat lagi terdeteksi oleh PCR (Fournier et al. 2003). Sampel biopsi dari organ terinfeksi dapat memperlihatkan adanya granuloma (Maurin dan Raoult 1999).
Manifestasi klinis utama diantaranya demam, pneumonia dan hepatitis granulomatus pada kasus akut serta endokarditis pada kejadian kronis (Maurin dan Raoult 1999). Pada kasus berat ditemukan adanya meningoencephalitis, myocarditis, endocarditis dan sindrom fatigue kronis (Wildman et al. 2002) bahkan dapat memicu komplikasi serius yang menimbulkan kematian (Maurin dan Raoult 1999). Gejala klinis Q fever pada manusia sering digambarkan seperti flu, akan tetapi gambaran penyakitnya dapat terlihat mulai dari demam tidak spesifik yang berhenti dengan sendirinya, sampai dengan pneumonia atipikal dan endokarditis. Selain itu, pada wanita hamil, penyakit ini dapat menyebabkan terjadinya plasentitis, kelahiran prematur, gangguan pertumbuhan, abortus spontan maupun kematian janin (OIE 2010).
Gambar 4. Patofisiologi dari C. burnetii (Raoult et al. 2005)
8
dan hewan lainnya (Woldehiwet 2004), namun pada sapi perah jarang walaupun gangguan reproduksi, subfertilitas dan metritis dapat terjadi (To et al. 1998; Porter et al. 2011). Pada ruminansia kecil, infeksi dapat menyebabkan keguguran, lahir mati, retensi membran fetus, endometritis dan infertilitas, dimana keguguran biasanya terjadi pada akhir kebuntingan seperti halnya Brucellosis (Arricau-Bouvery dan Rodolakis 2005; Van den Brom dan Vellema 2009). Frekuensi kejadian keguguran pada kambing lebih sering dibandingkan dengan domba (Porter et al. 2011)
Teknik Diagnosa C. burnetii
Q fever merupakan penyakit dengan gejala yang tidak khas sehingga memerlukan teknik diagnosa yang akurat (Arricau-Bouvery dan Rodolakis 2005). Teknik diagnosa diperlukan karena C. burnetii merupakan agen yang sangat infeksius dan bersifat zoonosis sehingga koleksi atau penanganan spesimen perlu dilakukan dengan sangat hati-hati (Maurin dan Raoult 1999). Fournier et al. (1998) menyatakan bahwa hanya personil yang berpengalaman yang diperbolehkan melakukan manipulasi spesimen yang terkontaminasi agen ini dan menumbuhkan mikroorganisme ini dari sampel klinis laboratorium di fasilitas biosafety level 3 (BSL3). Bakteri ini dapat dideteksi dengan berbagai cara tergantung dari jenis sampel maupun tujuan diagnosa (Samuel dan Hendrix 2009). Menurut OIE (2010), ada dua teknik diagnosa yang dapat dilakukan pada kasus Q fever diantaranya adalah identifikasi agen dan uji serologis.
Identifikasi agen dapat dilakukan dengan cara isolasi langsung melalui inokulasi suspensi bakteri pada telur embrio tertunas ataupun pada sel kultur. Selain itu dapat dilakukan teknik pewarnaan menggunakan beberapa metode seperti Stamp, Gimenez, Macchiavello, Giemsa ataupun modifikasi Koster (Samuel dan Hendrix 2009). Deteksi C. burnetii pada sampel juga dapat dilakukan menggunakan immunodeteksi spesifik (immunohistokimia), in-situ hybridization ataupun amplifikasi DNA (Jensen et al. 2007).
Penggunaan uji serologi untuk diagnosa Q fever sering dilakukan karena metode kultur dan teknik biologi molekuler memiliki sensitivitas yang rendah dan memerlukan laboratorium khusus. Uji serologis mudah dilakukan walaupun antibodi umumnya terdeteksi pada 2-3 minggu post infeksi (Maurin dan Raoult 1999). Ada beberapa metode yang dapat dilakukan untuk pemeriksaan serologis Q fever diantaranya adalah mikroagglutinasi, complement fixation test (CFT), radio immunoassay (RIA), indirect immunofluorescence assay (IFA), indirect hemolysis test, ELISA, enzyme linked immunofluorescence assay (ELIFA), dot immunoblotting dan western blotting (Maurin dan Raoult 1999). Namun yang umum digunakan adalah CFT, IFA, ELISA dan mikroagglutinasi. Menurut Setiyono et al. (2004), ELISA yang didukung dengan IFA memiliki akurasi yang baik untuk diagnosa Q fever. Namun hal tersebut sangat dipengaruhi oleh antigen standar yang dipakai. Teknik immunohistokimia dapat dijadikan sebagai uji konfirmasi untuk diagnosa bakteri ini.
9 Antibodi Poliklonal
Antibodi merupakan protein yang disekresi oleh sel plasma limfosit B akibat stimulasi molekul asing (antigen) pada reseptor antigen limfosit B. Antibodi ini bersifat spesifik terhadap antigen yang memicunya. Antibodi dikenal sebagai molekul-molekul glikoprotein IgA, IgD, IgM, IgE dan IgG (Kumagi dan Kohei 2001). Bentuk klasik dari molekul antibodi digambarkan sebagai huruf “Y” yang tersusun dari asam amino tertentu yang tidak dimiliki oleh protein lain. Gambar 5 menunjukkan struktur immunoglobulin yang terdiri dari 2 fragmen yaitu fragmen antigen binding site (Fab) dan fragmen crystallizable (Fc) Imunoglobulin dibentuk oleh 4 rantai polipeptida dasar yang identik, terdiri dari 2 rantai berat (heavy chain) dengan berat molekul masing-masing 50 kDa dan 2 rantai ringan (light chain) dengan berat molekul masing-masing 25 kDa. Setiap rantai ringan terikat dengan rantai berat oleh ikatan disulfida (Wibawan dan Soejoedono 2013).
Gambar 5. Struktur gambaran molekul antibodi (Tizard 2001)
IgM merupakan antibodi primer yang pertama kali muncul apabila tubuh terpapar antigen. Kerja dari IgM diperantarai oleh Sel B mediated immunity. IgM merupakan imunoglobulin dengan berat molekul terbesar yang juga sebagai petunjuk adanya infeksi akut. IgM akan menghasilkan kemokin untuk menangani reaksi peradangan yang kemudian menginduksi produksi IgG. Keberadaan IgM dalam sirkulasi terus berlangsung hingga keberadaan IgG cukup. IgG mempunyai dua fungsi terpisah dalam menanggapi reaksi peradangan oleh suatu protein, pertama yaitu untuk mengikat patogen yang telah diekspresikan oleh sistem tanggap kebal dan kedua, merespon tanggap kebal tersebut dengan memanggil sel dan molekul lain untuk merusak antigen. IgG dan IgM merupakan komponen penting yang banyak berperan dalam proses serologis maupun imunohistokimia (Wibawan dan Soejodono 2013).
10
rekombinan dibuat melalui rangkaian proses PCR, seleksi dan ekspresi antibodi. Antibodi rekombinan bersifat sangat spesifik, karena antibodi ini hanya mengenali epitope tertentu dari suatu antigen. Antibodi poliklonal memiliki bermacam-macam molekul antibodi. Satu molekul antibodi, biasanya mengenali satu bermacam-macam epitope, sehingga larutan poliklonal antibodi mengenali lebih dari satu epitope.
Antibodi poliklonal merupakan antibodi yang terbentuk dari zat asing (antigen) yang masuk ke dalam tubuh dan menyebabkan rangsangan kekebalan (imun). Respon imun dapat terjadi apabila sudah ada sel memori sebelumnya, menghasilkan antibodi dengan afinitas dan aviditas tinggi (Goldsby et al. 2000). Hewan yang sering digunakan sebagai produksi antibodi poliklonal diantaranya kambing, kuda, marmut, kelinci, hamster, tikus, domba dan ayam. Kelinci dan mencit merupakan hewan laboratorium yang paling umum digunakan untuk produksi antibodi. Peningkatan respon imun pada hewan coba dapat dipacu dengan menambahkan adjuvan pada antigen sebelum disuntikkan. Complete
Freund’s Adjuvant (CFA) yang mengandung Mycobacterium tubercolosum merupakan adjuvan yang digunakan pada imunisasi pertama. Keberadaan Mycobacterium tubercolosum akan menstimulasi dan mempertinggi respon imun yang spesifik terhadap antigen. Imunisasi kedua menggunakan Incomplete
Freund’s Adjuvant (IFA) yang tidak mengandung Mycobacterium tubercolosum untuk menghindari reaksi hipersensitivitas.
Imunohistokimia
Imunohistokimia merupakan salah satu metode deteksi keberadaan suatu antigen dalam jaringan menggunakan antibodi yang spesifik terhadap antigen tersebut (Santos et al. 2009). Ikatan antara antigen dan antibodi akan memperlihatkan reaksi warna histokimia yang akan terlihat dengan mikroskop cahaya biasa atau dengan fluorokrom dengan cahaya ultraviolet. Imunohistokimia telah menjadi sebuah metode yang kuat dan handal baik untuk diagnosa rutin dan penelitian dalam bidang kedokteran hewan (Ramos-Vara 2005). Imunohistokimia mulai dikenal pada tahun 1980an, dimana kegunaannya sering dikaitkan dengan deteksi dan menentukan prognosa dari suatu kejadian tumor (Coindre 2003). Imunohistokimia juga memiliki nilai lebih dibandingkan metode lainnya, seperti Western Blot, ELISA ataupun PCR. Hal tersebut dikarenakan metode ini mampu mendeteksi agen secara insitu, yaitu dapat menentukan lokasi protein yang diidentifikasi (Santos et al. 2009).
11 Penggunaan teknik imunohistokimia di dunia veteriner telah banyak digunakan untuk mendeteksi agen penyakit seperti C. burnetii. Teknik imunohistokimia dilakukan pada plasenta kambing, domba dan sapi yang telah diembeding mampu mendeteksi keberadaan dan distribusi agen ini (Dilbeck dan McElwain 1994; Hansen et al. 2011).
3
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan November 2015 sampai dengan November 2016 di Rumah Sakit Hewan Pendidikan (RSHP) Fakultas Kedokteran Hewan IPB, Bagian Patologi Departemen Klinik, Reproduksi dan Patologi FKH IPB dan Pusat Penelitian Bioteknologi LIPI. Semua metode yang dilakukan dalam penelitian ini telah mendapatkan persetujuan atas perlakuan etik dari Komisi Pengawasan Kesejahteraan dan Penggunaan Hewan Percobaan, Rumah Sakit Hewan Pendidikan FKH-IPB, Nomor 16-2015 RSHP FKH-IPB. Penelitian ini terbagi menjadi tiga tahapan, yaitu tahap produksi antibodi anti-C. burnetii, tahap purifikasi antibodi anti-C. burnetii dan tahap aplikasi antibodi anti-C. burnetii.
Bahan
Bahan-bahan yang digunakan pada penelitian ini antara lain kelinci jantan strain NZW berumur 10-16 minggu sebanyak dua ekor dengan bobot badan 2.5 kg (Balai Penelitian Peternakan Bogor, Indonesia), isolat C. burnetii strain NM II dari sel kultur Vero untuk induksi antibodi (National Institute of Infectious Disease, Jepang) dan sampel organ limpa, paru-paru dan hati sapi positif C. burnetii diperoleh dari sapi sehat asal Rumah Potong Hewan (RPH) Kota Medan koleksi Sangkot Sayuti Nasution (Balai Veteriner Medan, Indonesia).
Alat
Peralatan yang digunakan pada penelitian ini adalah spuit luer lock, alat nekropsi, paraffin embedding console, Sakura Tek®automatic tissue processor, inkubator, mikrotom, mikroskop Carl Zeiss® beserta satu set komputer untuk pengambilan gambar jaringan. Peralatan lain yang digunakan seperti alat pembuatan SDS PAGE (Bio Rad) dan Western Blot (Bio Rad) dan nanofotometer (Implen).
Prosedur Kerja
Produksi Antibodi Anti-C. burnetii
12
antibiotik dan anthelmintik. Kelinci kemudian disuntik dengan imunogen C. burnetii isolat standar NM (Bank Isolate, NIID, Jepang) melalui sub kutan. Imunogen dengan konsentrasi 250 µg dalam Phosphate Buffer Saline (PBS) ditambahkan dengan CFA (Sigma, USA) dengan volume 0.5 ml untuk induksi. Boosting dilakukan pada hari ke-14 pasca induksi imunogen menggunakan imunogen NM dan IFA (Sigma, USA) dengan volume yang sama. Pada akhir masa produksi antibodi yaitu hari ke-24 pasca induksi, dilakukan pemanenan (terminal bleeding) dengan cara mengambil darah secara intracardial ketika kelinci sudah teranaestesi dengan campuran ketamin (dosis 35 mg kg-1 BB) dan xylazine (dosis 5 mg kg-1 BB) yang diaplikasikan secara parenteral intramuscular pada otot semitendinosus. Darah yang sudah terkumpul kemudian disimpan pada suhu ruang (± 25 oC) selama dua jam dan dilanjutkan penyimpanan pada suhu 4 o
C selama satu malam (overnight). Serum yang diperoleh dipisahkan secara manual dengan aspirasi dan disempurnakan dengan sentrifugasi pada 10.000 xg selama 15 menit. Serum yang diambil disentrifugasi kembali pada 10.000 xg selama 10 menit. Selanjutnya, serum yang diperoleh disimpan pada suhu -20 oC untuk proses purifikasi. Pengukuran konsentrasi antibodi masing-masing perlakuan dilakukan dengan menggunakan nanofotometer (Implen, USA).
Analisis Dot Blot digunakan untuk mengetahui adanya antibodi anti-C.burnetii pada serum yang dihasilkan. Sebanyak 2 ul antigen C. burnetii diteteskan pada membran nitroselulosa, kemudian dikering anginkan. Membran yang telah kering direndam dan digoyang dalam larutan blocking selama 60 menit, kemudian dicuci dengan larutan pencuci (TBS + 0,1% tween) sebanyak 3 kali (15 menit; 5 menit; 5 menit). Membran ditetesi sebanyak 2 ul serum yang dimasukkan ke dalam larutan blocking dengan nisbah 1:100 selama 60 menit dan dicuci seperti sebelumnya. Tahap selanjutnya membran direndam dan digoyang dalam antibodi sekunder (HRPO conjugated goat anti rabbit IgG (Promega, USA) yang dimasukkan ke dalam larutan blocking dengan nisbah 1:3000 selama 60 menit yang dilanjutkan dengan pencucian seperti sebelumnya. Pita protein divisualisasi dengan merendam membran dalam reagen Tetramethylbenzidine (Ausubel et al. 1992).
Purifikasi Antibodi
13 Western Blot. Konsentrasi antibodi sebelum dan sesudah purifikasi diukur dengan menggunakan nanofotometer (Implen, USA).
Analisis SDS-PAGE (Sodium Dodecyl Sulfate Poly Acrylamide Gel Electrophoresis) dilakukan dengan pewarnaan Comassie Brilliant Blue (CBB). Sampel antibodi yang dihasilkan dianalisis dengan metode SDS-PAGE (Ausubel et al. 2003) menggunakan konsentrasi poliakrilamid 12 % untuk separating gel dan 3 % untuk stacking gel (Sambrook dan Russel 2001). Sampel antibodi (15 µl)
ditambahkan dengan 5 μl buffer sampel (mengandung Tris/SDS, bromophenol
blue, DTT dan gliserol) kemudian dipanaskan pada suhu 95 oC selama lima menit untuk mendenaturasi protein. Sebanyak 15 μl sampel antibodi dan 5 μl marka protein (PageRuler Prestained Protein Ladder, Thermo Scientific, USA) digunakan. Pemisahan protein dilakukan dengan elektroforesis pada tegangan 90 V selama 120 menit. Gel hasil elektroforesis diwarnai dengan CBB selama 30 menit yang dilanjutkan dengan penambahan destaining solution selama 24 jam.
Analisis kompatibilitas antibodi dengan antigen Western Blot dilakukan untuk melihat kompatibilitas antara antigen dan antibodi yang diproduksi (Sambrook dan Russel 2001) dengan sedikit modifikasi. Gel dengan sampel isolat NM hasil elektroforesis yang tidak diwarnai CBB ditransfer ke dalam membran nitroselulosa 0.22 µ (Biorad, USA) yang sebelumnya telah dibasahi buffer elektrotransfer. Sandwich yang terbentuk dimasukkan ke dalam tangki electroblotting, kemudian dilakukan proses transfer dengan tegangan konstan 30 V overnight pada suhu 4 oC. Membran yang sudah ditransfer direndam dan digoyang dalam larutan blocking (5 % susu skim dalam TBS 1x) selama 60 menit, kemudian dicuci dengan larutan pencuci (TBS + 0.05 % Tween 20) sebanyak tiga kali (15 menit; 5 menit; 5 menit) dan diinkubasi pada suhu ruang dengan antibodi primer produksi yang diencerkan dalam 3 % susu skim dalam TBS-T 1:100 selama satu jam. Kemudian membran dicuci tiga kali dengan TBS-T dan ditambahkan antibodi sekunder HRPO conjugated goat anti rabbit IgG (Promega, USA) dalam TBS-T 1:3000, dan membran diinkubasi lagi selama satu jam pada suhu ruang. Pencucian blot dilakukan tiga sampai lima kali selama 5 menit dengan TBS-T dan membran diinkubasi lagi selama satu jam pada temperatur kamar. Blot kemudian dikembangkan dengan larutan substrat Tetramethylbenzidine (Merck, USA) sampai terbentuk warna biru keunguan.
Isolasi Protein Sampel Limpa
Sampel limpa yang telah terfiksasi dalam 10 % BNF dipotong 0.5 gr kemudian direndam dalam alkohol 95 % selama 48 jam. Larutan alkohol diganti dengan PBS pH 7.4 selama 48 jam. Selanjutnya dilakukan homogenisasi dan penambahan lisis buffer yang mengandung 2 % sodium dodecyl sulfate (SDS) pada 100 oC selama 20 menit dan dilanjutkan dengan inkubasi pada suhu 60 oC selama 2 jam (Ikeda et al. 1998).
14
menit). Membran direndam dan digoyang dalam antibodi primer (rabbit anti-C. burnetii) yang dimasukkan ke dalam larutan blocking dengan nisbah 1:100 selama 60 menit dan dicuci seperti sebelumnya. Tahap selanjutnya membran direndam dan digoyang dalam antibodi sekunder (HRPO conjugated goat anti rabbit IgG (Promega, USA) yang dimasukkan ke dalam larutan blocking dengan nisbah 1:3000 selama 60 menit yang dilanjutkan dengan pencucian seperti sebelumnya. Pita protein divisualisasi dengan merendam membran dalam reagen TMB (Ausubel et al. 2003). Selain itu, dilakukan analisis protein antigen dengan SDS PAGE dan Western blotting (Sambrook dan Russel 2001).
Pembuatan Preparat Histopatologi dan Pewarnaan Hematoksilin Eosin (HE)
Proses pembuatan preparat histopatologi dan pewarnaan rutin HE dilakukan sesuai Day (2014). Sampel organ limpa, paru-paru dan hati dipotong (trimming) dengan ketebalan ± 5 mm dengan menggunakan cutter kemudian dimasukkan ke dalam tissue cassette dan diproses dalam automatic tissue processor (Sakura Tek, Jepang) untuk proses dehidrasi, penjernihan (clearing) dan infiltrasi. Proses dehidrasi dilakukan dengan perendaman dalam larutan alkohol 70 %, alkohol 80 %, alkohol 90 %, alkohol 95 % I, alkohol 95 % II, etanol absolut I, etanol absolut II dan etanol absolut III. Proses clearing dilakukan pada larutan silol I dan silol II. Infiltrasi dilakukan pada parafin I dan parafin II dengan suhu 58 oC. Proses perendaman setiap perlakuan dilakukan selama ± 2 jam. Pencetakan (embeding) dilakukan dengan memasukkan sediaan ke dalam alat pencetak paraffin embedding console (Sakura Tek, Jepang) berisi parafin cair. Potongan organ diletakkan ditengah cetakan kemudian ditambahkan parafin cair hingga cetakan penuh dan blok mengeras. Tahapan selanjutnya yaitu pengirisan blok parafin dengan menggunakan mikrotom putar. Hasil irisan diletakkan pada waterbath bersuhu ± 45 oC. Hasil potongan diangkat menggunakan gelas objek dan dimasukkan ke dalam inkubator suhu 60 oC selama 1 hari.
15 Pewarnaan Imunohistokimia
Pewarnaan imunohistokimia dilakukan sesuai Ramos-Vara (2005) dengan sedikit modifikasi menggunakan kit imunohistokimia (EnvisionTM Dual Link Systems DAKO, USA). Proses deparafinasi dilakukan terlebih dahulu dilanjutkan pembilasan dengan PBS sebanyak tiga kali. Selanjutnya dilakukan proses antigen retrieval untuk membuka epitop dari antigen yang akan dideteksi dengan pemanasan menggunakan bufer sitrat selama 20 menit menggunakan microwave lalu didinginkan dan dibilas dengan PBST 3x5 menit. Blocking normal serum dilakukan dengan menggunakan susu skim 5 % dan dicuci menggunakan PBST 3x5 menit. Inkubasi dengan antibodi primer (antibodi Rabbit anti C. burnetii) dilakukan pada pengenceran 1:500 lalu disimpan pada suhu 4 oC selama semalam (overnight) dan dicuci dengan PBST 3x5 menit. Selanjutnya dilakukan blocking endogenous enzyme selama 60 menit lalu dicuci PBST 3x5 menit. Inkubasi dengan antibodi sekunder yang telah dilabel HRP dilakukan selama 60 menit lalu dicuci dengan PBST 3x5 menit. Selanjutnya diberi substrat (chromogen) DAB selama ± 10 detik sambil diamati dibawah mikroskop lalu cuci dengan air mengalir yang dilanjutkan counter staining menggunakan hematoksilin (± 10 detik) dan cuci dengan air mengalir lalu destilated water (DW). Selanjutnya dilakukan dehidrasi dan dilakukan mounting. Hasil imunoreaktif ditunjukkan oleh adanya warna coklat spesifik pada jaringan.
Analisis Data
Data dianalisis secara deskriptif melalui tabel hasil pengukuran konsentrasi protein dan tabel hasil pengujian imunohistokimia. Selanjutnya ditampilkan gambar deskripsi SDS PAGE, Western blot, Dot blot, lesio histopatologi yang ditemukan pada pewarnaan HE serta distribusi antigen C. burnetii pada pewarnaan imunohistokimia.
4
HASIL DAN PEMBAHASAN
Produksi Antibodi anti-C. burnetii
16
reaksi antara C. burnetii yang dilapis pada membran nitroselulosa dengan serum kelinci membentuk spot keunguan. Hasil ini merupakan uji pendahuluan sebelum dilakukan pemanenan serum dan proses purifikasi lanjut.
Gambar 6. Analisis keberadaan antibodi anti-C. burnetii dengan Dot Blot. Serum kelinci 1 hari ke-0, pasca induksi dan pasca boosting (1, 4, 7); Serum kelinci 2 hari ke-0, pasca induksi dan pasca boosting (2, 5, 8); Kontrol negatif (3).
Data konsentrasi serum darah kelinci NZW pasca induksi dan pasca boosting antigen yang diukur menggunakan nanofotometer ditunjukkan pada Tabel 1. Hasil penelitian memperlihatkan adanya peningkatan konsentrasi antibodi pasca boosting pertama. Kondisi ini merupakan kondisi yang cukup optimal untuk pemanenan serum sehingga tidak dilakukan boosting ulangan.
Tabel 1. Hasil pengukuran konsentrasi serum darah kelinci NZW
Tahapan Konsentrasi (µg µl
-1 )
Kelinci 1 Kelinci 2
Pasca induksi Antigen 1.200 1.366
Pasca boosting Antigen 1.633 2.042
Purifikasi Antibodi Anti-C. burnetii
Volume dan konsentrasi antibodi dalam berbagai tahapan pemurnian ditunjukkan pada tabel 2. Volume darah awal dikonsentrat menggunakan amonium sulfat dan Sephadex G-75 menjadi 3 % dari volume awal serum yang diperoleh. Total serum sejumlah 38.9 ml dipurifikasi menggunakan metode presipitasi dan filtrasi gel. Hasil perhitungan menggunakan nanofotometer, diperoleh konsentrat protein senilai 4 µg µl-1.
Tabel 2. Hasil pengukuran konsentrasi antibodi anti-C. burnetii setelah purifikasi
Fraksi Volume Konsentrasi Antibodi
Total Darah 113 ml -
Total Serum 38.9 ml 2.1 µg µl-1
17 Proses dialisis meningkatkan konsentrasi menjadi 5 µg µl-1. Tahapan selanjutnya yaitu purifikasi dengan menggunakan kolom filtrasi gel terbuka dengan matriks Sephadex G-75. Metode ini menghasilkan konsentrasi akhir menjadi 11.3 µg µl-1.
Visualisasi antibodi sebelum dan sesudah purifikasi dengan SDS PAGE ditunjukkan pada Gambar 8 (kiri). Hasil SDS PAGE menunjukkan adanya beberapa pita yaitu pada berat molekul 170 kDa, 100 kDa, 65 kDa, 50 kDa dan 25 kDa. Pita teratas dengan bobot molekul 170 kDa merupakan fragmen IgG yang tidak terdenaturasi, sedangkan pita dengan bobot molekul 25 kDa merupakan antibodi light chain (rantai ringan) dan heavy chain (rantai berat) dengan bobot molekul50 kDa.
Gambar 7. (Kiri) Profil SDS-PAGE antibodi poliklonal anti-C. burnetii sebelum purifikasi dan pasca filtrasi Sephadex G-75. Marka protein (M); Serum (lajur 1); Antibodi presipitasi amonium sulfat (lajur 2,3); Antibodi hasil dialisis (lajur 4); Fraksi hasil filtrasi dengan Sephadex G-75 (lajur 5); Antibodi komersil (lajur 6). Lajur 7 merupakan profil antigen C. burnetii NM II.
(Kanan) Hasil imunoreaktif Western blot pada 35.5 kDa, 51.4 kDa dan 58.284 kDa.
Uji kompatibilitas antibodi dilakukan dengan menggunakan Western blot. Western imunoblot dinyatakan positif bila serum mengenal protein dari antigen yang diinfeksikan. Gambar 8 (kanan) menunjukkan adanya warna biru keunguan pada berat molekul 35.5 kDa, 51.4 kDa dan 58.284 kDa.
Isolasi Protein Sampel Limpa
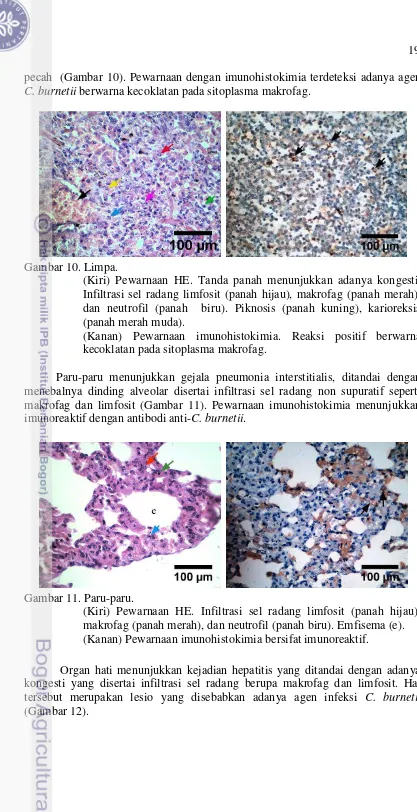
19 pecah (Gambar 10). Pewarnaan dengan imunohistokimia terdeteksi adanya agen C. burnetii berwarna kecoklatan pada sitoplasma makrofag.
Gambar 10. Limpa.
(Kiri) Pewarnaan HE. Tanda panah menunjukkan adanya kongesti. Infiltrasi sel radang limfosit (panah hijau), makrofag (panah merah), dan neutrofil (panah biru). Piknosis (panah kuning), karioreksis (panah merah muda).
(Kanan) Pewarnaan imunohistokimia. Reaksi positif berwarna kecoklatan pada sitoplasma makrofag.
Paru-paru menunjukkan gejala pneumonia interstitialis, ditandai dengan menebalnya dinding alveolar disertai infiltrasi sel radang non supuratif seperti makrofag dan limfosit (Gambar 11). Pewarnaan imunohistokimia menunjukkan imunoreaktif dengan antibodi anti-C. burnetii.
Gambar 11. Paru-paru.
(Kiri) Pewarnaan HE. Infiltrasi sel radang limfosit (panah hijau), makrofag (panah merah), dan neutrofil (panah biru). Emfisema (e). (Kanan) Pewarnaan imunohistokimia bersifat imunoreaktif.
20
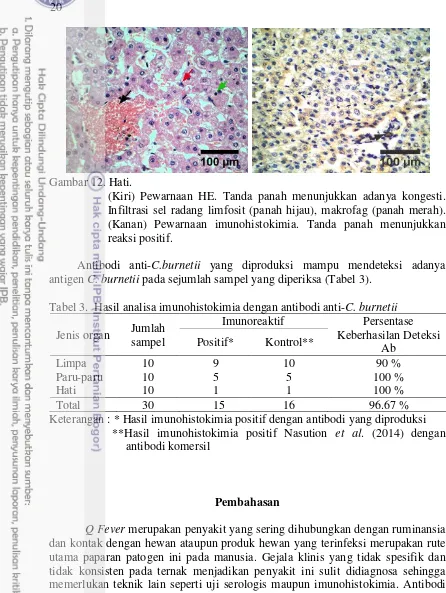
Gambar 12. Hati.
(Kiri) Pewarnaan HE. Tanda panah menunjukkan adanya kongesti. Infiltrasi sel radang limfosit (panah hijau), makrofag (panah merah). (Kanan) Pewarnaan imunohistokimia. Tanda panah menunjukkan reaksi positif.
Antibodi anti-C.burnetii yang diproduksi mampu mendeteksi adanya antigen C. burnetii pada sejumlah sampel yang diperiksa (Tabel 3).
Tabel 3. Hasil analisa imunohistokimia dengan antibodi anti-C. burnetii Jenis organ Jumlah
sampel
Imunoreaktif Persentase
Keberhasilan Deteksi Ab
Positif* Kontrol**
Limpa 10 9 10 90 %
Paru-paru 10 5 5 100 %
Hati 10 1 1 100 %
Total 30 15 16 96.67 %
Keterangan : * Hasil imunohistokimia positif dengan antibodi yang diproduksi **Hasil imunohistokimia positif Nasution et al. (2014) dengan
antibodi komersil
Pembahasan
21 dikarenakan tidak adanya hormon 17β-estradiol seperti pada betina yang mampu berperan mempengaruhi proses infeksi dengan menekan pembentukan infeksi jaringan dan pembentukan granuloma (Leone et al. 2004).
Produksi antibodi dilakukan dengan menyuntikkan antigen untuk menginduksi sistem imun. Beberapa faktor yang dapat mempengaruhi proses pembentukan antibodi antara lain imunogenesitas, kualitas, bentuk kelarutan, stimulan, spesies hewan, rute imunisasi dan sensitivitas assay yang digunakan (Reverberi dan Reverberi 2007). Pemilihan antigen C. burnetii strain Nine Mile II dilakukan karena strain ini bersifat inaktif yang telah melalui pasase berulang sehingga tidak bersifat virulen namun masih memiliki imunogenesitas. Penyuntikan antigen C. burnetii strain NM dilakukan sebanyak dua kali pada daerah sub kutan di daerah atas scapula kanan dan kiri serta daerah persendian coxio-femoral. Imunisasi pertama bertujuan memperkenalkan antigen pada sel B dan imunisasi kedua sebagai booster atau ulangan dilakukan untuk meningkatkan produksi antibodi oleh sel B (Leenaars et al. 2005). Penggunaan CFA yang mengandung minyak pengemulsi dilengkapi Mycobacterium yang dilemahkan bertujuan untuk pembentukan radang granuloma agar pelepasan imunogen berlangsung perlahan dan bertahap sehingga merangsang fungsi makrofag (Baratawidjaja, 2004). Selain itu CFA juga berfungsi untuk meningkatkan imunorespon dan memberikan isyarat kepada tubuh untuk membentuk antibodi apabila ada benda asing atau mikroorganisme yang masuk ke dalam tubuh. Pada proses boosting, adjuvan yang digunakan yaitu IFA, yang merupakan adjuvan murni berupa minyak jagung. Adjuvan jenis ini digunakan untuk menjaga pelepasan imunogen berlangsung perlahan.
22
Purifikasi antibodi dilakukan dengan menggunakan dua metode purifikasi yaitu presipitasi dan filtrasi. Pemilihan amonium sulfat untuk presipitasi serum dilakukan karena merupakan metode mudah dan ekonomis pengkelat IgG. Presipitasi merupakan pengendapan yang terjadi karena berkurangnya kelarutan protein akibat penambahan bahan kimia seperti amonium sulfat. Amonium sulfat menggunakan prinsip salting out, yaitu mempresipitasi protein dari larutan serum. Protein dicegah untuk membentuk ikatan hidrogen dengan air dan garam ammonium sulfat memfasilitasinya untuk membentuk agregasi sehingga mempresipitasi keluar dari larutan (Oliver dan Jamur 2010). Ketika garam amonium sulfat ditambahkan ke dalam serum, maka sebagian besar molekul dalam serum akan berikatan dengan ion garam selanjutnya akan menurunkan jumlah serum yang tersedia untuk berikatan dengan protein sehingga imunoglobulin akan mengendap (Seidman dan Mowery 2006). Proses presipitasi dengan amonium sulfat juga merupakan salah satu metode yang dapat menghilangkan karbohidrat, lipid dan lipoprotein lain yang terdapat dalam serum (Ko dan Ahn 2007). Menurut Oliver dan Jamur (2010), amonium sulfat saturasi 35 % mampu menghasilkan recovery 80-90 % pada kelinci dan domba. Berdasarkan hal tersebut maka penggunaan saturasi 35 % diharapkan mampu mempresipitasi IgG dengan jumlah optimum. Serum hasil presipitasi kemudian dilakukan dialisis dalam larutan PBS pH 7.4 selama 24 jam pada suhu 4 oC yang bertujuan untuk menghilangkan garam-garam amonium sulfat pada tahap presipitasi. Tahapan selanjutnya yaitu proses filtrasi dengan matriks Sephadex G-75. Sephadex G-75 merupakan matriks berbasis dextran yang akan memisahkan molekul-molekul berdasarkan berat molekul protein. Umumnya metode kromatografi dipilih karena resolusi yang dihasilkan tinggi namun perlu adanya kromatografi tambahan dan/atau tahapan lain yang diperlukan untuk mengatasi volume yang cukup besar dan adanya kontaminasi protein (Hjorth 1997). Penggunaan matriks ini juga berfungsi untuk pemekatan konsentrasi protein, mereduksi volume protein dan memisahkan protein yang diinginkan dari kontaminan atau protein lain yang tidak dikehendaki (Rosenberg 2005).
Antibodi yang dihasilkan kemudian dikarakterisasi menggunakan analisis SDS PAGE dan Western blot. SDS PAGE dapat memberikan informasi mengenai bobot molekul protein dengan cara membandingkannya dengan marker atau penanda komersil yang terukur dalam satuan kilo Dalton (kDa). Hasil memperlihatkan adanya beberapa pita protein dengan bobot molekul 170 kDa yang merupakan fragmen IgG yang tidak terdenaturasi, sedangkan pita dengan bobot molekul 25kDa merupakan antibodi light chain (rantai ringan) dan heavy chain (rantai berat) dengan bobot molekul50 kDa (Gambar 7).
23 inkubasi dengan antibodi sekunder yang telah terkonjugasi HRP. Penambahan substrat TMB mengikat kromogen dan menghasilkan warna ungu pada pita 35.5 kDa, pita 51.4 kDa dan 58.284 kDa (Gambar 7) . Menurut Kowalczewska et al. (2011), outer membrane protein (OMP) dari fraksi C. burnetii strain NM II memiliki berat molekul 35.5 kDa, pita 51.4 kDa merupakan hypothetical membrane protein NM II sedangkan 58.284 kDa sebagai chaperonin (Grol) soluble protein NM II. Hal tersebut sesuai dengan profil imunogen berdasarkan SDS PAGE dan memastikan bahwa serum tersebut mengandung antibodi yang mampu mengikat imunogen yang diinfeksikan.
Aplikasi antibodi dilakukan pada sampel berupa organ limpa yang telah terfiksasi BNF menggunakan teknik Dot blot dan Western blot dan sediaan preparat histopatologi berupa organ limpa, paru-paru dan hati menggunakan metode imunohistokimia. Preparasi sediaan organ limpa terfiksasi BNF terlebih dahulu dilakukan dengan merendam organ menggunakan etanol 90% selama 48 jam untuk menghilangkan kadar formalin dilanjutkan dengan perendaman menggunakan PBS pH 7.4 selama 48 jam untuk menghilangkan kadar etanol dan mengembalikan organ pada keadaan fisiologis. Prosedur selanjutnya sesuai dengan Ikeda et al. (1998) yang merupakan metode sederhana untuk mengetahui level ekspresi protein asal organ atau jaringan yang telah terfiksasi BNF dalam waktu lama. Penelitian menunjukkan hasil konsentrasi protein lebih rendah dari konsentrasi imunogen yang digunakan (Gambar 8). Hal ini terlihat dari kepekatannya yang lebih rendah dibandingkan dengan konsentrasi C. burnetii strain Nine Mile II. Hal tersebut dikarenakan imunogen merupakan strain yang telah dimurnikan dan dipasase berulang pada kutur sel Vero sehingga merupakan galur murni tanpa kontaminan sedangkan isolat limpa terfiksasi masih terkontaminasi protein lain sehingga perlu dilakukan propagasi terlebih dahulu pada hewan coba kemudian dimurnikan melalui kultur sel. Berdasarkan hasil Dot blot terdapat 1 sampel yang tidak menimbulkan warna ungu (Gambar 9) dengan konsentrasi yang lebih rendah dibandingkan sampel lainnya (Lampiran 2).
Pengujian dilanjutkan dengan melakukan SDS PAGE untuk melihat profil protein yang telah diisolasi dari organ limpa terfiksasi BNF. Pita tipis pada bobot molekul ~35 kDa dan ~50 kDa terlihat dihampir semua sampel. Namun hal tersebut tidak dapat terdeteksi oleh Western blot. Hal ini dapat dikarenakan protein yang terlihat pada SDS PAGE bukan merupakan protein yang diharapkan (antigen C. burnetii isolat lapang) atau karena konsentrasi protein yang terlalu rendah sehingga memerlukan pengujian Western blot dengan deteksi menggunakan Blue Fluorescence/Chemiluminescence yang lebih sensitif.
24
selanjutnya yaitu karioreksis yang merupakan kerusakan fragmen inti sel yang diikuti oleh kariolisis atau kematian sel akibat lisisnya inti sel. Sel nekrosis sering dihubungkan dengan kondisi patologis akibat kondisi iskemia, trauma, paparan toksin, rangsang kimia dan neurodegenerative disorders (Zamzani dan Kroemer 1999).
Kelainan yang diperlihatkan pada gambaran mikroskopis limpa tersebut dapat disebabkan oleh adanya infeksi C. burnetii ataupun hal lainnya. Menurut Nasution et al. (2014), lesio yang dapat ditemukan pada infeksi Q fever diantaranya populasi sel-sel radang makrofag dan neutrofil pada pulpa merah, kongesti, pigmen hemosiderin serta deplesi folikel limfoid. Beberapa lesio yang dapat terjadi pada limpa antara lain deplesi pulpa putih, kongesti pulpa merah, adanya sel radang, neutrofil dan limfosit (Setiyono 2014). Limpa merupakan organ limfoid sekunder terbesar yang tersusun oleh limfosit dan eritrosit dan secara fungsional membentuk pulpa merah dan pulpa putih dan berfungsi sebagai organ penyimpan darah (Kuper et al. 2002). Sistem limfoid berfungsi untuk melindungi tubuh dari kerusakan akibat zat asing. Limpa juga berperan dalam respon imun dan selular terhadap infeksi dan inflamasi. Fungsi limpa sebagai filter material asing dan mikroorganisme serta membuang eritrosit yang sudah tua dan rusak, menyebabkan organ ini mudah terinfeksi dan dapat menunjukkan keberadaan antigen (Fry dan McGavin 2006). Selain itu, limpa mengakumulasi limfosit dan makrofag, degradasi eritrosit, tempat cadangan darah, dan sebagai organ pertahanan terhadap infeksi partikel asing yang masuk ke dalam darah. C. burnetii merupakan bakteri intraseluler makrofag sehingga keberadaan bakteri ini akan terakumulasi lebih banyak pada organ ini. Deteksi keberadaan C. burnetii pada Gambar 10 menunjukkan adanya hasil imunoreaktif berwarna coklat di sitoplasma makrofag. Hal tersebut sesuai dengan C. burnetii sebagai mikroba obligat intraseluler yang dapat ditemukan di dalam makrofag (Angelakis dan Raoult 2011).
25 burnetii menunjukkan hasil imunoreaktif (Gambar 11). Hal tersebut membuktikan lesio yang terjadi merupakan salah satu manifestasi dari Q fever.
Respon imun pada kejadian Q fever dihubungkan dengan adanya reaksi peradangan yang dapat menimbulkan pembentukan granuloma yang umumnya dapat ditemui di paru-paru, hati ataupun sumsum tulang (Fournier et al. 1998). Pada pemeriksaan sampel, tidak ditemukan adanya granuloma pada paru-paru maupun hati (Gambar 11 dan 12). Namun infiltrasi sel radang seperti makrofag ataupun limfosit dan fokus nekrosa ditemukan pada organ hati (Gambar 12).
Lesio hati pada kasus akut dan kronis akan berbeda. Pada kasus akut ditemui adanya lesio granuloma yang berbentuk seperti donut dan terdiri dari cincin fibrin yang mengelilingi vakuola lipid (Aguilar-Olivos et al. 2013). Pada kasus kronis, temuan patologis bersifat nonspesifik antara lain infiltrasi limfosit dan adanya fokus nekrosa (Fournier et al. 1998). Pada kasus yang ditemui, infeksi berjalan kronis. Perubahan histopatologi yang bisa ditemui berupa nekrosis sel-sel hepatosit yang bersifat fokal, dan infiltrasi sel-sel radang yang terdiri dari makrofag, limfosit dan neutrofil dengan hasil imunoreaktif terhadap C.burnetii. Pada sampel yang diperiksa sebanyak 90 % agen Q fever ditemukan pada limpa, 100 % pada paru-paru dan 100 % di hati (Tabel 3). Angka ini cukup baik dengan persentase keberhasilan deteksi mencapai 96.67 % dibandingkan dengan deteksi menggunakan antibodi komersil. Limpa sebagai salah satu organ pertahanan merupakan organ yang bersifat imunoreaktif terhadap hasil imunohistokimia dibandingkan paru-paru dan hati. Perbedaan distribusi C. burnetii pada berbagai organ dapat disebabkan oleh rute transmisi dari patogen tersebut. Rute utama penularan C. burnetii yaitu melalui aerosol. Beberapa rute infeksi lainnya antara lain rute oral, perkutan, kontak langsung ataupun transmisi seksual (Angelakis dan Raoult 2010). Menurut Stein et al. (2005), infeksi secara aerosol selain menyebabkan lesio pada paru-paru juga dapat menyebabkan lesio pada organ hati dan limpa. Menurut Woldehiwet (2004), setelah bermultiplikasi pada limfonodus regional, 5-7 hari berikutnya terjadi bakterimia dan lokalisasi pada kelenjar mammae dan plasenta hewan bunting. Jalur hematogen mengakibatkan C. burnetii dapat ditemukan pada hati, ginjal, limpa, sumsum tulang, saluran reproduksi dan organ lainnya.
Penelitian ini menunjukkan bahwa metode produksi antibodi anti-C. burnetii cukup baik untuk memperoleh kuantitas dan kualitas afinitas antibodi yang cukup tinggi. Namun perlu dilakukan optimasi lebih lanjut mengenai konsentrasi antibodi minimum untuk dapat mendeteksi antigen C. burnetii sehingga menjadi efisien dan ekonomis.
5
SIMPULAN DAN SARAN
Simpulan
26
dijadikan acuan untuk proses sampling. Proses produksi antibodi dapat diadopsi untuk produksi antibodi penyakit-penyakit lain pada hewan.
Saran
Saran yang dapat diberikan berdasarkan hasil penelitian ini adalah perlunya penelitian lanjutan hasil imunohistokimia positif dengan isolasi dan propagasi isolat guna pengembangan kit diagnostic uji cepat Q Fever di lapangan.
DAFTAR PUSTAKA
Aguilar-Olivos N, Manzano-Robleda MC, Gutierrez-Grobe Y, Chable-Montero F, Albores-Saavedra J, Lopez-Mendez E. 2013. Granulomatous hepatitis caused by q fever: a differential diagnosisof fever of unknown origin. Annals of Hepatol. 12(1):138-141.
Amano KI, Williams JC, Missler SR, Reinhold VN. 1987. Structure and biological relationships of Coxiella burnetii Lipopolysaccharides. J Biol Chem. 262(10):4740-4747.
Angelakis E, Raoult D. 2010. Q fever. Vet Microbiol. 140:297-309.
Angelakis E, Raoult D. 2011. Emergence of Q fever. Iranian J Publ Health. 40(3):1-18.
Arricau-Bouvery N, Rodolakis A. 2005. Is Q fever an emerging or re-emerging zoonosis?. Vet. Res. 36:327–349.
Ausubel FM, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, Struhl K. 2003. Current potocols in molecular biology. New York (US): John Willey & Sons.
Baratawidjaja KG. 2004. Imunologi dasar. 6th ed. Jakarta (ID): FKUI.
Beare PA, Samuel JE, Howe D, Virtaneva K, Porcella SF, Heinzen RA. 2006. Genetic diversity of the Q fever agent, Coxiella burnetii, assessed by microarray-based whole-genom comparisons. J Bacteriol. 188(7):2309-2324. Bildfell RJ, Thomson GW, Halness DM, McEwen BJ, Smart N. 2000. Coxiella
burnetii infection is associated with placentitis in cases of bovine abortion. J Vet Diagn Invest. 12(5):419-425.
Brom R, Vellema P. 2009. Q fever outbreaks in small ruminants and people in the Netherlands. Small Rum Res. 86:74-79.