EKSPRESI FRAGMEN ANTIBODI UNTAI TUNGGAL (SCFV)
ANTI-EGFRvIII PADA PERMUKAAN SEL PICHIA PASTORIS
PRATIKA VIOGENTA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Ekspresi Fragmen Antibodi Untai Tunggal (scFv) Anti-EGFRvIII pada Permukaan Sel Pichia pastoris adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia.
RINGKASAN
PRATIKA VIOGENTA. Ekspresi Fragmen Antibodi Untai Tunggal (scFv) Anti-EGFRvIII pada Permukaan Sel Pichia pastoris. Dibimbing oleh SUHARSONO dan ASRUL MUHAMAD FUAD.
Sistem tampilan permukaan khamir telah menjadi teknik yang semakin popular untuk rekayasa protein dan seleksi pembuatan pustaka protein. Sistem ini membutuhkan suatu protein permukaan agar protein target bisa berada di permukaan sel. α-agglutinin merupakan salah satu protein yang ditemukan dipermukaan sel Saccharomyces cerevisiae dan bisa dimanfaatkan untuk tampilan permukaan sel khamir lainnya seperti Pichia pastoris. Pada C-terminal α -agglutinin terdapat gugus glycosylphosphatidylinositol (GPI) yang akan berikatan secara kovalen dengan penyusun komponen dinding sel khamir, yaitu glukan. Sistem ini dapat digunakan untuk mengekspresikan suatu protein antibodi rekombinan pada permukaan sel khamir. Antibodi pada penelitian ini merupakan fragmen antibodi untai tunggal (scFv) yang dapat mengenali antigen EGFRvIII (Epidermal Growth Factor Receptor variant III). EGFRvIII merupakan salah satu varian mutan EGFR yang mengalami delesi pada ekson ke 2 hingga ekson ke 7 di bagian domain ekstraseluler. EGFRvIII berperan penting dalam pertumbuhan dan proliferasi sel kanker. P. pastoris merupakan salah satu khamir metilotropik yang dapat menggunakan metanol sebagai sumber karbon. Kelebihan utama yang dimiliki oleh P. pastoris dibandingkan sel prokariot adalah sel ini mampu melakukan modifikasi protein pascatranslasi seperti pelipatan protein, glikosilasi, dan pembentukan ikatan disulfida. Proses glikosilasi pada P. pastoris tidak mengalami hiperglikosilasi seperti yang sering ditemukan pada S. cerevicae. Penelitian ini bertujuan untuk mengekspresikan fragmen antibodi untai tunggal (scFv) anti EGFRvIII pada permukaan sel P. pastoris. Gen scFv diamplifikasi dari plasmid pJ201-scFv dengan metode PCR (Polymerase Chain Reaction) dan difusi dengan separuh bagian ujung-C gen AGα dalam vektor ekspresi pJ912-Agα-RFP. TagRFP (Tag Red Fluorescent Protein) adalah gen reporter penyandi protein fluoresen merah yang disisipkan di antara gen scFv dengan gen AGα. Konstruk gen tersebut disubklon terfusi dengan sinyal sekresi MF-α (mating factor-α) dan di bawah regulasi promoter indusibel AOX1 ( PAOX1 ). Ekspresi protein terjadi apabila dilakukan induksi dengan menggunakan metanol dan MF-α mengarahkan protein disekresikan keluar sel. Vektor rekombinan diintroduksikan ke dalam P. pastoris SMD1168H melalui rekombinasi homolog. Seleksi transforman P. pastoris dilakukan menggunakan media seleksi mengandung zeocin. Analisis ekspresi protein rekombinan dilakukan, antara lain melalui pengamatan sel dengan mikroskop fluoresense, analisis SDS-PAGE, hibridisasi Western blot, dan analisis interaksi antibodi-antigen dengan bantuan manik magnet.
melalui seleksi pada media zeocin hingga konsentrasi 1000 µg/mL. Pengamatan menggunakan mikroskop fluoresen membuktikan bahwa sel-sel transforman berhasil memancarkan fluoresensi berwarna merah yang berasal dari protein fungsional TagRFP. Adanya pita protein yang terdeteksi pada hasil hibridisasi Western blot menunjukkan bahwa sel P. pastoris berhasil mengekspresikan protein target (scFv) yang terfusi dengan protein TagRFP dan α-agglutinin. Eksperimen dengan menggunakan manik magnet yang diselimuti dengan protein rekombinan antigen EGFRvIII menunjukkan bahwa sel transforman P. pastoris yang terdapat antibodi anti EGFRvIII pada permukaan sel dapat melekat pada permukaan manik magnet yang membuktikan bahwa terjadi interaksi antara antibodi (pada permukaan sel) dengan antigen (pada permukaan manik magnet). Hasil ini juga meyakinkan bahwa fusi protein antibodi ini telah berhasil diekspresikan pada permukaan sel P. pastoris dengan struktur yang fungsional. Kata kunci: Sistem tampilan permukaan sel, Pichia pastoris, scFv anti-EGFRvIII,
SUMMARY
PRATIKA VIOGENTA. Expression of Anti-EGFRvIII Single Chain Variable Fragment (scFv) on the Surface of Pichia pastoris. Supervised by SUHARSONO and ASRUL MUHAMAD FUAD.
Yeast surface display has become an increasingly popular tool for protein engineering and protein library screening applications. This system requires a surface protein that could display target protein on the cell surface. α-agglutinin is a protein found on the surface of Saccharomyces cerevisiae and can be used in yeast surface display system on other yeast strain, such as Pichia pastoris. The C-terminal of α-agglutinin comprises a glycosylphosphatidylinositol (GPI) anchor attachment domain as found on most native surface proteins. Glycosylphosphatidyl inositol (GPI)-dependent cell wall proteins are linked to -1,6-glucan. This system can be used to express recombinant antibodies on yeast cell surface. Antibody molecule used in this study is a single chain fragment antibody (scFv) that recognizes the EGFRvIII (Epidermal Growth Factor Receptor variant III) as antigen. EGFRvIII is a mutant variant of EGFR having deletion of exon 2 through exon 7 in extracellular domain. EGFRvIII plays a key role in the growth and proliferation of cancer cells. P. pastoris is a methylotropic yeast that can use methanol as carbon source. A main advantage possessed by P. pastoris over prokaryotic cells is that the cell could proceed post translation modifications of proteins such as protein folding, glycosylation and disulfide-bond formation. Glycosylation in P. pastoris is not as extensive as it is found in S. cerevisiae . This study aims to construct a yeast display system that express an anti-EGFRvIII recombination. Selection of P. pastoris transformants was performed using medium containing zeocin. Analyses of recombinant proteins were performed including cells observation under a fluorescence microscope, SDS-PAGE and Western blot hybridisation analyses, as well as antibody-antigen interaction analysis using magnetic beads.
the Western blot hybridisation analysis results showed that P. pastoris transformants have succesfully expressed the target protein (scFv) fused with TagRFP and α-agglutinin. Experiment using magnetic beads covered by recombinant EGFRvIII antigen showed that transformed P. pastoris cells are found to be well attached on the surface of magnetic beads. It proves that there is interaction between antibody (on cell surface) and antigen (on magnetic bead surface). Thus, it demonstrates that fusion protein was successfully expressed on the P.pastoris cell surface and structurally functional.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
EKSPRESI FRAGMEN ANTIBODI UNTAI TUNGGAL (SCFV)
ANTI-EGFRvIII PADA PERMUKAAN SEL PICHIA PASTORIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Ekspresi Fragmen Antibodi Untai Tunggal (scFv) Anti-EGFRvIII pada Permukaan Sel Pichia pastoris
Nama : Pratika Viogenta NIM : P051110041
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Suharsono, DEA Ketua
Dr Asrul Muhamad Fuad Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah subhanahu wa ta’ala karena berkat Rahmat dan Hidayah-Nya penulis dapat menyelesaikan penelitian yang dilaksanakan sejak April 2013 dengan judul “Ekspresi Fragmen Untai Tunggal (scFv) Anti-EGFRvIII pada Permukaan Sel Pichia pastoris “. Tesis ini merupakan hasil penelitian yang dilakukan di Laboratorium Protein Rekombinan dan Sistem Penghantaran Terarah, Pusat Penelitian Bioteknologi-LIPI dan dibiayai oleh DIPA Pusat Penelitian Bioteknologi LIPI tahun 2013. Sebagian dari hasil penelitian ini sedang dalam penelaahan untuk dipublikasikan pada Journal of Microbiology, Biotechnology and Food Sciences (JMBFS) dan telah dipresentasikan secara Poster presentation pada The 1st International Conference on Pharmaceutics & Pharmaceutical Sciences yang diselenggarakan oleh Universitas Airlangga pada bulan November tahun 2014.
Terima kasih penulis ucapkan kepada Bapak Prof. Dr. Ir Suharsono, DEA dan Bapak Dr. Asrul Muhamad Fuad, M.Si selaku dosen pembimbing yang telah memberikan bimbingan dan arahan selama penelitian hingga penyusunan tesis ini. Penulis juga tidak lupa berterima kasih kepada Bapak Dr. I Made Artika, M.App.Sc selaku penguji di luar komisi pembimbing pada sidang tesis yang telah memberikan kritik dan saran dalam penulisan. Di samping itu, penghargaan penulis sampaikan kepada Kepala beserta seluruh staf Laboratorium Protein Rekombinan dan Sistem Pengantaran Terarah, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI). Ungkapan terima kasih juga tidak lupa disampaikan kepada kedua orang tua dan kakak yang telah memberikan begitu banyak perhatian, dukungan, dan do’anya kepada penulis serta sahabat dan teman-teman Bioteknologi IPB 2011 atas segala perhatian, kerja sama dan waktu luang kepada penulis.
Semoga karya ilmiah ini dapat bermanfaat bagi para pembaca dan terutama pengembangan ilmu penulis.
DAFTAR ISI
DAFTAR GAMBAR v
DAFTAR LAMPIRAN v
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
EGFR (Epidermal Growth Factor Receptor) 3
Fragmen Antibodi Untai Tunggal (scFv) 6
Sistem Tampilan Permukaan Khamir 7
Pichia pastoris 10
Protein Fluoresen Merah 11
3 METODE 12
Waktu dan Tempat 12
Bahan 12
Metode Penelitian 13
4 HASIL DAN PEMBAHASAN 18
Subklon Gen scFv Anti EGFRvIII ke dalam pJ912-AGα-RFP 18 Transformasi Pichia pastoris dengan Plasmid Rekombinan 23
Seleksi Transforman Pichia pastoris 24
Ekspresi Protein Rekombinan 25
Analisis Interaksi Antibodi Anti-EGFRvIII dengan Antigen EGFRvIII 30
5 SIMPULAN DAN SARAN 35
Simpulan 35
Saran 35
DAFTAR PUSTAKA 35
LAMPIRAN 41
DAFTAR GAMBAR
1. Skema struktur protein EGFR natural dan varian mutan EGFR 5 2. Struktur antibodi utuh dan varasi tipe fragmen antibodi 6 3. Sistem tampilan protein heterologus pada permukaan sel khamir 9 4. Desain molekular untuk tampilan protein heterologus pada permukaan
sel khamir dengan menggunakan α-agglutinin 9
5. Diagram vektor pJ912-AGα-RFP 13
6. Posisi penempelan beberapa primer pada vektor ekspresi 14 7. Hasil amplifikasi gen scFv anti-EGFRvIII dan hasil isolasi plasmid
pJ912-AGα-RFP 18
8. Analisis gen scFv pada sel transforman E. coli TOP10F’ menggunakan
PCR koloni 19
9. Analisis orientasi gen scFv di dalam vektor rekombinan 19 10.Analisis potong plasmid rekombinan dari 4 klon E. coli transforman
dengan enzim Sal I 20
11.Mutasi gen scFv anti-EGFRvIII pada plasmid rekombinan 21 12.Analisis blast IgG fragmen untai ringan (VL) pada plasmid
pJ201-scFv dan pJ912-AGα-RFP::scFv 22
13.Hasil transformasi P. pastoris SMD1168H 23
14.Analisis stabilitas genetik koloni P. pastoris transforman dan non transforman di media YPD agar dengan beberapa konsentrasi zeocin 24 15.Analisis gen scFv pada sel P. pastoris transforman dan
non-transforman menggunakan PCR koloni 25
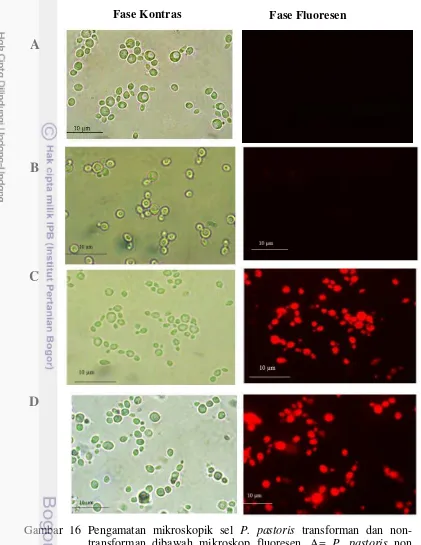
16.Pengamatan mikroskopik sel P. pastoris transforman dan non
transforman dibawah mikroskop fluoresen 26
17.Lisis sel P. pastoris menggunakan glass bead 27 18.Analisis protein rekombinan dengan SDS PAGE dan hibridisasi
Western blot 28
19.Komponen penyusun dinding sel khamir 29
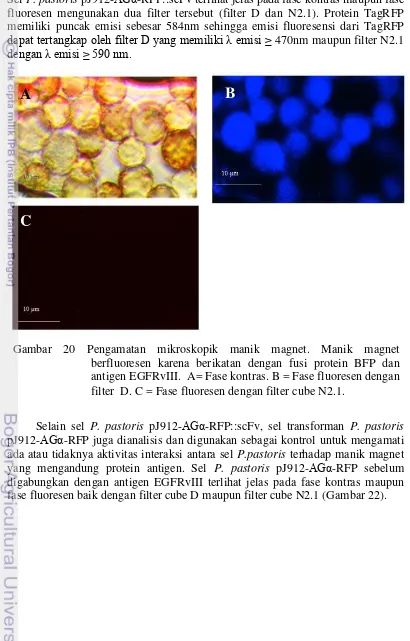
20.Pengamatan mikroskopik manik magnet 31
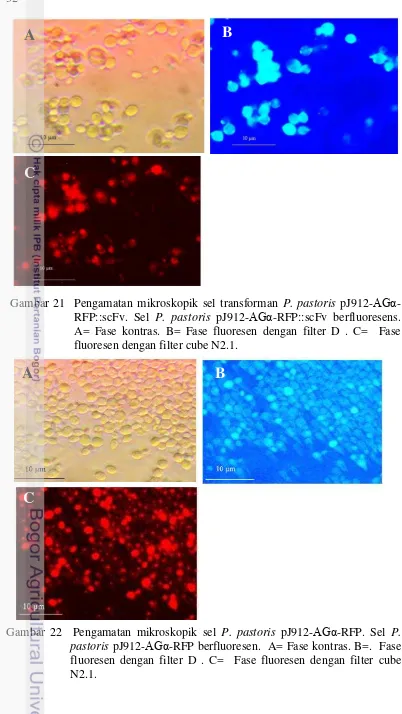
21.Pengamatan mikroskopik sel P. pastoris pJ912-AGα-RFP::scFv 32 22.Pengamatan mikroskopik sel P. pastoris pJ912-AGα-RFP 32 23.Pengamatan mikroskopik interaksi antibodi-antigen antara ikatan
EGFRvIII pada manik magnet terhadap antibodi anti EGFRvIII pada
permukaan sel P. pastoris. 34
DAFTAR LAMPIRAN
1. Analisis urutan DNA plasmid pJ201-scFv dengan primer VH101-F 41 2. Analisis urutan DNA plasmid pJ912-AGα-RFP::scFv dengan primer
AOX1-F 43
3. Analisis urutan DNA plasmid pJ912-AGα-RFP::scFv dengan primer
VL101-F 45
4. Komposisi larutan dan media yang digunakan beserta cara
pembuatannya 47
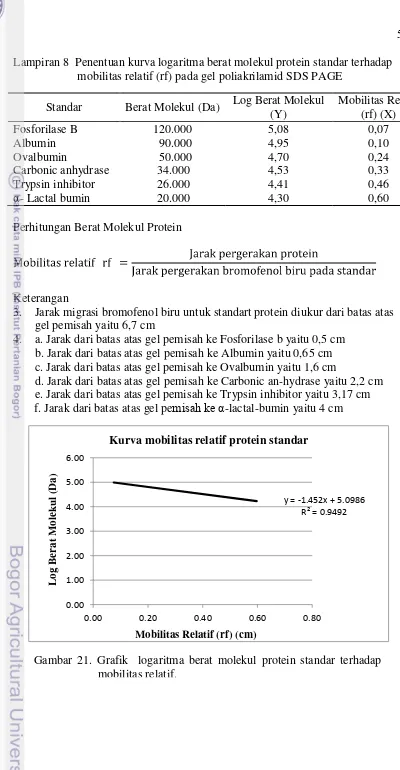
6. Penetuan kurva logaritma berat molekul protein standar terhadap mobilitas relatif (rf) pada gel poliakrilamid untuk Western blot 53 7. Penetuan berat molekul protein rekombinan terhadap mobilitas relatif
(rf) pada gel poliakrilamid untuk Western blot 54 8. Penetuan kurva logaritma berat molekul protein standar terhadap
mobilitas relatif (rf) pada gel poliakrilamid untuk SDS PAGE 55 9. Penetuan berat molekul protein rekombinan terhadap mobilitas relatif
1
PENDAHULUAN
Latar Belakang
Sistem tampilan permukaan pada sel khamir merupakan suatu teknik rekayasa yang memungkinkan protein heterolog diekspresikan pada bagian permukaan eksternal atau dinding sel khamir (Lim et al. 2011). Sistem ini telah menjadi alat yang semakin populer untuk rekayasa protein dan aplikasi pembuatan pustaka protein (Pepper et al. 2008). Khamir memiliki beberapa keunggulan sebagai sel inang untuk produksi protein heterolog dibandingkan dengan bakteri. Sel khamir memungkinkan terjadinya modifikasi protein pada tahap pasca translasi. Pembentukan ikatan disulfida dan pelipatan protein yang benar meningkatkan ketahanan protein terhadap degradasi protease dan memiliki aktivitas biologis jauh lebih baik. Sel eukariot seperti khamir memiliki kemampuan untuk melakukan proses glikosilasi pada protein melalui penambahan residu gula pada asparagin (N-glikosilasi) atau serin / treonin (O-glikosilasi). Struktur protein pascatranslasi yang terjadi di dalam khamir dapat membentuk protein rekombinan yang aktif secara biologis (Cho et al. 1998).
Pichia pastoris merupakan khamir yang dikembangkan untuk sistem ekspresi protein rekombinan setelah Saccharomyces cereviciae. P. pastoris merupakan khamir metilotropik yang mampu memanfaatkan metanol sebagai sumber karbon. Adaptasi P. pastoris untuk menggunakan metanol dalam pertumbuhannya berkaitan dengan gen alkohol oksidase (AOX). Sebagai sel eukariot, P. pastoris memiliki kemampuan variasi modifikasi pasca-translasi seperti glikosilasi, isomerisasi disulfida, proses proteolitik dan pelipatan protein. P. pastoris dapat tumbuh di media metanol hingga densitas sel sangat tinggi di dalam bioreaktor dengan kontrol oksigen yang baik. Kelebihan lainnya yang dimiliki P. pastoris melingkupi manipulasi genetik yang cenderung mudah, ekspresinya stabil, pertumbuhan sel cepat, tidak ada resiko kontaminasi dari virus patogenik manusia (Chen et al. 2012; Fickers 2014; Li et al. 2007). P. pastoris tidak mengalami proses hiperglikosilasi pada saat modifikasi pascatranslasi seperti yang umumnya dijumpai pada S. cereviciae. Panjang rantai glikoprotein yang diekspresikan P. pastoris sekitar 8-15 residu mannosa sedangkan S. cereviciae mencapai 40-150 residu mannosa (Li et al. 2007).
2
Domain yang kaya serin dan treonin bertindak sebagai spacer karena konformasinya seperti batang akibat proses dari O-glikosilasi yang terjadi (Schreuder et al. 1996).
Dua alternatif sistem tampilan permukaan sel masing-masing menggunakan α-agglutinin dan Flo1p (FS) telah berhasil mengekspresikan protein fungsional Candida antarctica lipase B (CALB) dipermukaan sel Pichia pastoris. Aktivitas sintetik CALB yang berfusi dengan α-agglutinin pada P. pastoris tiga kali lebih tinggi dibandingkan dengan protein fusi FS bila diterapkan pada sintesis etil caproate (Su et al. β010). Protein α-galaktosidase (Schreuder et al. 1996) dan protein fluoresens Ds-red (Kuroda et al. 2009) berhasil diekspresikan dipermukaan khamir dengan α-agglutinin sebagai protein permukaan yang membantu protein rekombinan berada di permukaan sel.
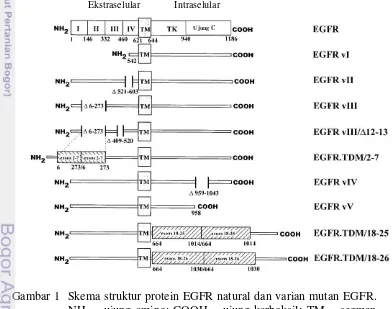
Epidermal Growth Factor Receptor variant III (EGFRvIII) merupakan varian mutan dari reseptor natural EGFR yang terekspresi secara berlebih pada beberapa jenis kanker termasuk glioblastoma (50-60%) (Heimberger et al. 2005), kanker payudara (67,8%) (Hong et al. 2002), non-small cell lung cancer (30-ekstraselular dari EGFR. Pada saat translasi protein terbentuk residu glisin baru yang menghubungkan ekson 1 dan ekson 8 akibat proses penyambungan pada pembentukan mRNA (Frederick et al. 2000). Secara natural EGFR normal akan berikatan dengan ligan naturalnya (EGF, TGF- ) terlebih dahulu, kemudian berdimerisasi dan berada pada posisi aktif menyampaikan sinyal ke dalam sel. Namun, EGFRvIII selalu berada dalam posisi aktif dan dapat berdimerisasi dengan molekul EGFR lain meskipun tidak berikatan dengan ligan. Sifat yang konstitutif aktif ini menyebabkan pertumbuhan, kelangsungan hidup, invasi, dan angiogenesis sel menjadi tidak teratur (Gupta et al. 2010).
3 pustaka protein. Sebagai contoh, protein scFv terhadap molekul kecil dan protein target yang berbeda berhasil diisolasi dari antara 1 109 molekul pada pustaka scFv yang terdiri dari gen rantai berat (VH) dan rantai ringan (VL) (Pepper et al. 2008).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengekspresikan fragmen antibodi untai tunggal (scFv) anti EGFRvIII pada permukaan sel P. pastoris.
Manfaat Penelitian
Fragmen antibodi untai tunggal (scFv) anti EGFRvIII yang diekspesikan dipermukaan sel P. pastoris dapat dimanfaatkan untuk proses seleksi pustaka protein antibodi sehingga diperoleh keragaman pustaka antibodi yang memiliki aktivitas pengikat antigen EGFRvIII lebih tinggi.
2
TINJAUAN PUSTAKA
EGFR (Epidermal Growth Factor Receptor)
4
dapat berinteraksi (heterodimerization), contoh pada kanker ovarium ditemukan interaksi antara EGFR dan c-erbB-2 (Kuan et al. 2001). Dimerisasi EGFR merupakan langkah awal aktivasi tirosin kinase. Konsekuensi awal aktivasi kinase adalah fosforilasi residu tirosin sendiri (autofosforilasi). Autofosforilasi ini menginisiasi tranduksi signal intraseluler melalui jalur RAS/RAF/MAPK, PI3K/AKT dan STATs sehingga terjadi aktivasi transkripsi yang mengarah ke mitogenesis (Pereira et al. 2008 ; Kuan et al. 2001).
Ekspresi berlebihan dari reseptor ini menjadi faktor penting dalam perkembangan onkogen dan perkembangan tumor yang menjadi target menarik untuk pengobatan kanker (Castillo et al. 2004). Hiperaktivitas sinyal EGFR pada tumor terjadi melalui mekanisme yang berbeda, antara lain ekspresi reseptor EGFR berlebihan, autokrin produksi ligan berlebih terutama EGF dan TGFα, dan mutasi EGFR terutama varian III yang mempertahankan jalur sinyal EGFR. Efek aktivasi EGFR pada sel tumor menyebabkan multiple dan konvergen sehingga mendukung pertumbuhan sel yang tidak terkendali dengan peningkatan mobilitas sel dan proliferasi sel, penurunan kemampuan apoptosis dan merangsang angiogenesis (Castillo et al. 2004).
EGFR yang mengalami perubahan struktur gen akan menghasilkan varian-varian yang memicu timbulnya sel kanker. Kebanyakan kasus, varian-varian EGFR dihasilkan melalui proses delesi pada genom. Sebagian besar varian yang diakibatkan dari delesi pada domain ekstraseluler EGFR berkorelasi dengan prognosis yang buruk. Umumnya varian ini bersifat konstitutif dan aktif pada jalur transduksi sinyal yang berbeda meskipun sudah berkurang kapasitas pengikatan ligan, sehingga memberikan kesempatan sel-sel kanker berkembang dan meningkatkan potensi keganasan (Wang et al. 2011).
Varian-varian mutan EGFR yang telah diketahui, antara lain EGFRvI dengan pemotongan N-terminal mirip dengan gen virus ErbB-1 yang menyebabkan transformasi malignant dan berpotensi teraktivasi reseptor secara terus menerus. Mutan EGFRvII terjadi karena adanya delesi 83 asam amino pada domain IV daerah ekstraseluler (ekson 14 dan 15). EGFR varian IV dan V membawa mutan delesi dalam domain intraseluler, varian IV reseptor terpotong pada asam amino 958 dan varian V reseptor terpotong pada asam amino 959-1.030 (Kuan et al. 2001).
Varian mutan EGFR tidak hanya terjadi akibat adanya delesi ekson EGFR akan tetapi adanya duplikasi tandem pada daerah ekstraseluler maupun intraseluler gen EGFR juga menyebabkan varian mutan. EGFR.TDM/18-25 dan EGFR.TDM/18-26 mengalami tendem duplikasi pada daerah intraselular yang menyandikan domain tirosin kinase dan sebagian dari domain internalisasi molekul kalsium. EGFR.TDM/18-25 mengandung duplikasi tandem dari ekson 18-25 sedangkan EGFR.TDM/18-26 pada ekson 18-26. EGFR.TDM/2-7 adalah mutan EGFR yang mengalami duplikasi tendem ekson 2-7 di daerah ekstraselular. Mutan EGFR.TDM/2-7 memiliki masa molekul 180 kDa dan mengandung residu unik yaitu leusin sebagai akibat dari bergabungnya ujung γ’ ekson 7 dengan ujung 5’ ekson β (Kuan et al. 2001).
5 terjadi karena adanya pengurangan genom EGFR pada ekson ke 2 sampai ke 7 (801 bp) sehingga pada domain ligan ekstraselular EGFR mengalami pengurangan 6 sampai 273 asam amino pada saat sintesis protein (Frederick et al. 2000). Selain itu, terjadi pembentukan residu glisin antara ekson 1 dan ekson 8. Jika dibandingkan dengan EGFR normal yang memiliki berat molekul 170 kDa, EGFRvIII memiliki berat molekul 145 kDa (Gupta et al. 2010).
EGFRvIII aktif secara konstitutif meskipun tidak berikatan dengan ligan sehingga menyebabkan pertumbuhan, kelangsungan hidup, invasi, dan angiogenesis sel tidak teratur (Gupta et al. 2010). EGFRvIII telah ditemukan secara konstitutif terkait dengan sinyal adaptor protein Shc dan Grb2 yang terlibat dalam sinyal Ras pada reseptor yang telah diaktifkan, bahkan jika dimerisasi tidak terjadi. EGFRvIII konstitutif aktif meningkatkan pertumbuhan sel-sel glioblastoma melalui kegiatan peningkatan Ras-GTP. Selain itu, sel yang positif EGFRvIII ditemukan jalur aktivitas phosphatidylinositol (PI) 3-kinase terus diaktifkan. Oleh karena itu, PI 3-kinase memainkan peran penting dalam transformasi EGFRvIII. Jalur c-Jun N-terminal kinase (JNK) ditemukan konstitutif aktif dengan konsentrasi tinggi di sel-sel yang positif EGFRvIII sedangkan sel dengan ekspresi berlebihan EGFR normal tidak ditemukan jalur JNK diaktifkan secara konstitutif (Kuan et al. 2001).
Gambar 1 Skema struktur protein EGFR natural dan varian mutan EGFR. NH2 = ujung amino; COOH = ujung karboksil; TM = segmen transmembran; TK = domain tirosin kinase (Kuan et al. 2001).
Ekstraselular Intraselular
6
Fragmen Antibodi Untai Tunggal (scFv )
Antibodi merupakan protein yang diproduksi oleh sel limfosit B sebagai salah satu sistem kekebalan tubuh dalam menanggapi adanya antigen (protein atau polisakarida yang dapat berikatan dengan antibodi). Imunoglobulin secara alami menjadi antibodi yang terdiri dari dua untai polipeptida berukuran besar (untai berat) dan dua untai polipeptida berukuran kecil (untai ringan). Dua untai berat saling dihubungkan oleh ikatan disulfida dan antara satu untai berat dengan untai ringan juga saling dihubungkan dengan ikatan disulfida. Masing-masing untai berat dan untai ringan memiliki daerah konstan dan daerah variabel. Daerah konstan berfungsi sebagai efektor untuk antibodi sedangkan daerah variable berfungsi untuk mengikat antigen (Aracama 2007; Emantoko 2001). Bagian variabel merupakan bagian yang mempunyai perbedaan dalam urutan asam amino. Antibodi yang memiliki urutan asam amino yang berbeda pada daerah variabel akan merespon antigen yang berbeda meskipun dari jenis antibodi yang sama. Bagian variabel dapat dibagi menjadi enam bagian yang berupa bagian framework (FR) dan complementarity determining region (CDR) yang terletak berselingan. Sebagai contoh satu fragmen antibodi (Fab) akan mempunyai urutan sebagai berikut FR1-CDR1-FR2-CDR2-FR3-CDR3. CDR merupakan daerah yang sangat beragam antar antibodi dibandingkan FR (Emantoko 2001). Single chain fragment variable (scFv) adalah unit kecil dari molekul imunoglobulin dengan fungsi mengikat antigen. Antibodi scFv tersusun atas daerah variabel untai berat (VH) dan untai ringan (VL) yang dihubungkan dengan suatu peptida yang fleksibel (linker) dan mudah diekspresikan dalam bentuk fungsional (Gambar 2).
Panjang linker DNA yang fleksibel digunakan untuk menghubungkan kedua daerah variabel sangat penting dalam menghasilkan lipatan yang benar dari rantai
7 polipeptida. Peptida penghubung (linker) diperkirakan memiliki jarak 3,5 nm (35°A) antara ujung karboksil dari daerah variabel dan ujung amino dari daerah variabel lainnya tanpa mempengaruhi lipatan dan bentuk situs pengikat antigen. Selain jarak, komposisi residu asam amino juga memainkan peran penting dalam merancang sebuah peptida linker. Urutan hidrofilik untuk menghindari interkalasi peptida dalam atau antar daerah variabel seluruh pelipatan protein perlu diperhatikan. Saat ini, urutan desain yang paling banyak digunakan terdiri dari residu glisin dan serin untuk fleksibilitas dan atau bersama-sama diselingi dengan residu seperti glutamin dan lisin untuk meningkatkan kelarutan (Ahmad et al. 2012). Linker yang paling umum digunakan mengandung 15 kombinasi residu glisin dan serin (GGGGS)3 (Wang et al. 2011). Konstruksi scFv dapat berupa VH -linker-VL atau VL-linker-VH. Kedua orientasi telah diterapkan meskipun sebagian besar scFv dikonstruksi dengan orientasi VH-linker-VL (Ahmad et al. 2012).
Penggunaan scFv untuk mendeteksi antigen memiliki beberapa keunggulan. Pertama, scFv tetap memiliki afinitas khusus untuk antigen, meskipun biasanya lebih rendah dari antibodi aslinya. Kedua, scFv dapat diproduksi dalam jumlah besar dalam sistem ekspresi bakteri dengan biaya murah. Ketiga, mudah untuk dimanipulasi untuk setiap aplikasi yang berbeda, misalnya fusi dengan protein obat untuk mentargetkan dan membunuh patogen atau dengan molekul penanda untuk tujuan deteksi. Keempat, protein scFv yang dikombinasikan dengan toksik atau radioisotop lebih baik untuk terapi kanker dibanding pendekatan lain karena ukurannya yang kecil memungkinkan penetrasi terhadap tumor lebih besar dan tingkat clearance lebih cepat (Aracama 2007). ScFv digunakan dalam beberapa aplikasi termasuk pengenalan target tumor secara in vivo, pengujian serum HIV, pemilihan antibodi terhadap antigen toksik, antibodi microarray, identifikasi reseptor seluler yang tidak diketahui, deteksi infeksi dan berpotensi menghalangi patogenesis serta sebagai pengantar obat ke sel target (Aracama 2007).
Sistem Tampilan Permukaan Khamir
Perkembangan sistem ekspresi protein heterolog fungsional yang ditampilkan pada permukaan bakteri, fage dan khamir mengalami kemajuan beberapa tahun terakhir. Sistem tampilan permukaan khamir merupakan suatu metode untuk mengekpresikan protein fungsional pada permukaan sel. Metode ini dapat meningkatkan afinitas, spesifisitas dan stabilitas protein yang diekspresikan. Keunggulan utama sistem tampilan khamir dari sistem tampilan lain adalah khamir mampu melakukan modifikasi protein pasca translasi yang menghasilkan protein fungsional dengan kualitas baik. Protein asing dalam sistem ini dapat ditampilkan pada permukaan sel khamir dalam bentuk fusi dengan protein penahan (Su et al. 2010).
8
Beberapa jenis protein permukaan yang dapat digunakan untuk ekspresi protein asing pada permukaan sel khamir, antara lain Agα1, Aga1, Flo1, Sed1, Cwp1, Cwp2, Tip1, Tir1/Srp1. Protein permukaan tersebut memiliki sistem penahan GPI (glycosylphosphatidylinositol) yang berperan penting dalam ekspresi protein permukaan sel dan sangat penting untuk kelangsungan hidup khamir. Gugus glycophospholipid secara kovalen melekat pada daerah C-terminal protein permukaan dan fungsi utama GPI adalah untuk menstabilkan assosiasi protein dengan membran. Protein yang memiliki sistem penahan GPI mengandung peptida hidrofobik pada C-terminal mereka (Teparić et al. 2010).
Khamir memiliki dinding sel yang kaku dengan ketebalan 200 nm dari membran plasma. Dinding sel khamir memiliki struktur bilayer terdiri dari lapisan luar yang di dominasi oleh mannoprotein berbentuk seperti fibril atau sisir dan lapisan dalam yang terdapat -glukan ( -1-3-glukosa dan -1-6-glukosa) sebagai kerangkanya. Ada 2 jenis mannoprotein dinding sel yaitu mannoprotein yang berikatan non kovalen dan mannoprotein yang berikatan kovalen dengan -1-3- glukan dan -1-6-glukan. Protein agglutinin merupakan salah satu mannoprotein yang berikatan dengan glukan (Lipke & Ovalle 1998). Agglutinin merupakan komponen dinding sel yang terletak pada permukaan terluar dan berperan memediasi adhesi sel pada saat reproduksi seksual antara tipe mating sel yang berbeda. Tipe mating a dan α masing-masing mengekspresikan a-agglutinin dan α-agglutinin. A-agglutinin terdiri dari subunit Aga1p yang dihubungkan ke subunit yang lebih kecil yaitu AG2p melalui ikatan disulfida. Aga1p dikode oleh gen AGA1 dan Aga2p dikode oleh gen AGA2. α-agglutinin dikodekan oleh gen
AGα1 dan berinteraksi dengan subunit AG2p pada tipe sel mating a. Struktur dari α-agglutinin dan subunit Aga1p tersusun atas daerah sinyal sekresi, daerah aktif, daerah pendukung yang banyak mengandung serin dan treonin , dan penahan GPI (Lipke et al. 1989). Kemampuan penahan α-agglutinin diberikan oleh setengah C-terminal protein yang mengandung 320 asam amino yang kaya akan residu serin dan treonin dan memiliki ekor hidrofobik di C-terminal. Domain yang banyak mengandung serin dan treonin berperan sebagai spacer yang membentuk konformasi seperti batang yang merupakan hasil dari perluasan O-glikosilasi (Schreuder et al. 1996).
9 ditransfer ke permukaan terluar dinding sel. Di dinding sel, penahan GPI α -agglutinin berikatan dengan -1,6-glukan melalui ikatan glikosidik (Ueda & Tanaka 2000).
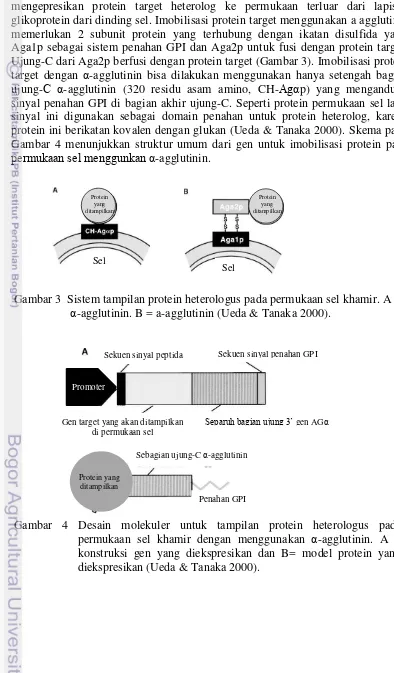
Protein Aga2p dari a-agglutinin dan α-agglutinin telah diketahui dapat mengepresikan protein target heterolog ke permukaan terluar dari lapisan glikoprotein dari dinding sel. Imobilisasi protein target menggunakan a agglutinin memerlukan 2 subunit protein yang terhubung dengan ikatan disulfida yaitu Aga1p sebagai sistem penahan GPI dan Aga2p untuk fusi dengan protein target. Ujung-C dari Aga2p berfusi dengan protein target (Gambar 3). Imobilisasi protein target dengan α-agglutinin bisa dilakukan menggunakan hanya setengah bagian ujung-C α-agglutinin (320 residu asam amino, CH-Agαp) yang mengandung sinyal penahan GPI di bagian akhir ujung-C. Seperti protein permukaan sel lain, sinyal ini digunakan sebagai domain penahan untuk protein heterolog, karena protein ini berikatan kovalen dengan glukan (Ueda & Tanaka 2000). Skema pada Gambar 4 menunjukkan struktur umum dari gen untuk imobilisasi protein pada permukaan sel menggunkan α-agglutinin.
Sekuen sinyal peptida Sekuen sinyal penahan GPI
Gen target yang akan ditampilkan
Gambar 4 Desain molekuler untuk tampilan protein heterologus pada permukaan sel khamir dengan menggunakan α-agglutinin. A = konstruksi gen yang diekspresikan dan B= model protein yang diekspresikan (Ueda & Tanaka 2000).
Protein yang ditampilkan
Gambar 3 Sistem tampilan protein heterologus pada permukaan sel khamir. A = α-agglutinin. B = a-agglutinin (Ueda & Tanaka 2000).
10
Pichia pastoris
Sebagai organisme eukariotik, Pichia pastoris memiliki banyak keuntungan lebih dalam hal sistem ekspresi protein terutama modifikasi pasca-translasi seperti penambahan residu gula, pelipatan protein dan sekresi protein ke dalam media yang kemudian memfasilitasi purifikasi. Selain itu, manipulasi P. pastoris semudah seperti pada manipulasi Escherichia coli atau S. cerevisiae. Sistem ekspresi dengan P. pastoris lebih cepat, mudah dan murah untuk digunakan bila dibandingkan dengan sistem ekspresi lainnya seperti Baculovirus atau sistem mamalia. P. pastoris menggunakan beberapa manipulasi fitur molekuler dan genetik dari Saccharomyces sehingga menambahkan keuntungan tingkat ekspresi yang lebih tinggi. Fitur dengan perawatan yang mudah, scale-up dan persyaratan pertumbuhan murah membuat P. pastoris sebagai sistem ekspresi protein yang sangat berguna. Proses ini dapat ditingkatkan ke tingkat ekspresi, yaitu 10-100 kali lebih tinggi daripada E. coli. (Balamurugan et al. 2007).
Dasar konsep sistem ekspresi P. pastoris berasal dari beberapa enzim yang diperlukan untuk metabolisme metanol. Studi biokimia menunjukkan bahwa pemanfaatan metanol membutuhkan jalur metabolisme yang melibatkan beberapa enzim. Enzim alkohol oksidase (AOX) mengkatalisis pada tahapan pertama di jalur metabolisme metanol. Berada di dalam periksisom, AOX mengoksidasi metanol menjadi formaldehid dan hidrogen peroksida (Cereghino & Cregg 2000). Ada dua gen yang menyandikan alkohol oksidase dalam P. pastoris yaitu AOX1 dan AOX2. AOX1 bertanggung jawab sebagian besar aktivitas alkohol oksidase dalam sel. AOX2 memiliki sekitar 97% homologi dengan AOX1 (Balamurugan et al. 2007).
Ekspresi gen AOX1 dikendalikan pada tingkat transkripsi (≈ 5% poli (A)+ RNA AOX1) dari sel yang tumbuh di media metanol. Namun, sel yang tumbuh pada sumber karbon lainnya, poli (A)+ RNA AOX1 tidak terdeteksi. Pengaturan gen AOX1 melibatkan dua mekanisme yaitu mekanisme represi / derepresi dan mekanisme induksi yang mirip dengan regulasi gen GAL1 S. cerevisiae. Berbeda dengan regulasi GAL1, AOX1 menghasilkan transkripsi RNA dengan jumlah yang besar. Hal ini disebabkan tidak adanya faktor pembatas sumber karbon seperti glukosa dalam medium. Kehadiran metanol sangat penting untuk mendorong tingkat transkripsi dengan konsentrasi tinggi (Cereghino & Cregg 2000).
Ada tiga fenotipe strain inang P. pastoris berkaitan dengan pemanfaatan metanol. Mut+ terjadi karena kedua gen AOX1 dan AOX2 utuh dan aktif sehingga sel dapat tumbuh pada metanol dengan konsentrasi tinggi dalam skala besar fermentasi. MutS terjadi karena gen AOX1 mengalami knocked out. Sel-sel itu bergantung pada AOX2 yang lemah untuk metabolisme metanol sehingga sel tumbuh lebih lambat dan pemanfaatan metanol lebih lambat. Mut- menyebabkan sel tidak dapat tumbuh pada metanol karena kedua gen AOX dihilangkan. Salah satu keuntungan dari fenotip ini adalah bahwa tingkat pertumbuhan yang rendah mungkin diinginkan untuk produksi produk rekombinan tertentu. Saat ini, sebagian besar peneliti menggunakan fenotipe Mut+, meskipun beberapa peneliti juga menggunakan fenotipe MutS (Macauley-Patrick et al. 2005; Krainer et al. 2012).
11 untuk menghasilkan plasmid episomal stabil. Komponen yang umum di vektor ekspresi P. pastoris meliputi fragmen promoter 5’ gen AOX1, beberapa situs kloning untuk penyisipan urutan DNA asing dan fragmen γ’ gen AOX1 diperlukan untuk terminasi transkripsi. Sekuen peptida sinyal dapat berasal dari P. pastoris yaitu asam fosfatase (pho1p) atau α-faktor dari S. cerevisiae untuk menghasilkan fusi gen pada vektor. Peptida sinyal ini digunakan untuk mensekresikan protein heterolog keluar sel. Vektor juga mengandung titik awal replikasi (ori) untuk perbanyakan plasmid pada E.coli dan penanda untuk seleksi koloni transforman (Papakonstantinou et al. 2009).
Gen penanda biasanya berasal dari salah satu kelompok penanda auksotrofik dan atau kelompok resisten antibiotik. Beberapa vektor memiliki penanda auksotrofik seperti arginin, adenin, histidin, urasil dan jalur biosintesis metionin pada P. pastoris. Namun, vektor yang menggunakan penanda auksotrofik ini memerlukan penanda lainnya untuk proses seleksi transforman. Penggunaan vektor yang mengandung penanda dominan resistensi antibiotik mengatasi keterbatasan ini. Gen penanda yang paling umum digunakan adalah gen Sh ble dari Streptoalloteichus hinustanus yang mengkode resistensi zeocin dan gen BSD dari Aspergillus terreus yang mengkode resistensi blastisidin. Penanda lain yang bisa digunakan dalam P. pastoris adalah sistem sorR, berdasarkan enzim asetil-CoA karboksilase dari Sorangium cellulosum. Enzim ini memberi perlawanan terhadap makrosiklik poliketida soraphen A (Papakonstantinou et al. 2009).
Spesies dari genus Pichia memiliki keunggulan dalam hal proses glikosilasi protein karena Pichia tidak mengalami hiperglikosisasi. S. cerevisiae dan P. pastoris memiliki mayoritas N glikosilasi jenis mannose. Rantai oligosakarida ditambahkan pada saat pasca translasi protein pada P. pastoris (residu mannose rata-rata 8-14 per rantai samping) jauh lebih pendek daripada yang ditambahkan ke protein pada S. cerevisiae (50-150 residu mannose). P. pastoris juga sangat sedikit memilki O glikosilasi. Selain itu, inti oligosakarida di S. cerevisiae memiliki ikatan 1,3 glikan terminal sedangkan P. pastoris tidak memiliki (Balamurugan et al. 2007).
Protein Fluoresen Merah
Protein fluoresens (FP) telah menjadi alat yang sangat populer untuk menggambarkan bagian in vivo dari sel terutama mempelajari lokalisasi, pergerakan, dan interaksi protein di dalam sel hidup. Protein fluoresens merah merupakan salah satu jenis protein fluoresens yang memiliki kekhususan yang menarik. Protein flouresens ini dapat memperpanjang palet warna dan menggambarkan fluorescence resonance energy transfer (FRET) serta dapat mengurangi hamburan panjang gelombang cahaya yang panjang sehingga membuat protein ini sangat menarik sebagai penanda bagian dalam dari sel (Kredel et al. 2009).
12
protein target. TagRFP merupakan protein fluoresen monomer berwarna merah. Protein ini memiliki kecerahan tinggi (134% jika dibandingkan dengan kecerahan DsREd), puncak eksitasi 555 nm, puncak emisi 584 nm, nilai kuantum 0,48, koefisien ekstinsi 100.000M-1cm-1, pematangan kromofor lengkap, fluoresensi yang bertahan lama (phase/ modulation lifetime 2,2/2,3 ns (n=20)) dan pH stabilitas tinggi (pKa <4,0). Kelebihan ini membuat TagRFP merupakan protein fluoresens yang sangat baik untuk studi lokalisasi protein dan aplikasi fluoresensi resonansi transfer energi (fret) (Merzlyak et al. 2007).
TagRFP merupakan hasil pengembangan protein fluourensen merah eqFP578 dan eqFP611 yang berasal dari Entacmaea quadricolor. Kedua protein ini memiliki kemiripan 76 % dalam urutan asam amino. Karakteristik yang dimiliki eqFP578 dan eqFP611 meliputi kecerahan fluoresens tinggi, pematangan kromofor lengkap, dan yang terpenting kecendrungan untuk membentuk oligomer berkurang. Komponen ini membuat protein fluoresen dari E. quadricolor menarik menjadi generasi monomer protein fluoresen merah terang (Merzlyak et al. 2007). .
3
METODE
Waktu dan Tempat
Penelitian ini dilakukan dari bulan April 2013 hingga Juni 2014 di Laboratorium Protein Rekombinan dan Sistem Pengantaran Terarah, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Bogor.
Bahan
Gen scFv anti-EGFRvIII diamplifikasi dari plasmid pJ201-scFv (DNA2.0) dengan primer VH101-Sal-F dan VL101-Sal-R. Gen scFv anti-EGFRvIII dibuat secara sintetik dan dioptimasi dengan kodon preferensi Pichia pastoris pada penelitian terdahulu (Hertati, 2013). Vektor ekspresi yang digunakan adalah pJ912-AGα-RFP (DNA2.0). Plasmid ini telah mengandung gen AG dan gen reporter TagRFP (red fluorescent protein) (Gambar 5).
13
Media yang digunakan dalam penelitian ini antara lain, low salt luria bertani (LSLB), terrific broth (TB), yeast peptone dextrose (YPD), yeast peptone dextrose sorbitol (YPDS), buffered glycerol- complex medium (BMGY) dan buffered methanol- complex medium) (BMMY). Komposisi dapat dilihat di dalam Lampiran 4.
Metode Penelitian
Subklon Gen scFv ke dalam Vektor Ekspresi
Gen scFv anti-EGFRvIII diamplifikasi dan diisolasi dengan teknik PCR menggunakan pasangan primer VH101-Sal-F dan VL101-Sal-R, serta plasmid pJ201-scFvI sebagai cetakan. Pada gen scFv ditambahkan situs restriksi SalI. Isolasi plasmid dilakukan menggunakaan metode alkali lisis (Sambrook & Russell 2001) .
Gen scFv hasil amplifikasi dan plasmid pJ912-AGα-RFP hasil isolasi dipotong dengan enzim restriksi SalI. Fragmen scFv dan plasmid yang terpotong dianlisis dengan elektroforesis 1% gel agarosa. Hasil potong fragmen scFv dan plasmid dipurifikasi menggunakan Gel DNA Extraction Kit (GeneAid). Gen scFv diligasi dengan plasmid pJ912-AGα-RFP yang telah dipotong dengan SalI. Hasil ligasi diintroduksikan ke dalam E. coli TOP10F’ dengan metode kejut panas (heat shock) dan E. coli tersebut ditumbuhkan pada media seleksi LSLB agar (Low Salt Luria Bertani) yang mengandung zeocin (25 g/mL).
Analisis plasmid rekombinan dilakukan dengan teknik PCR koloni terhadap sel E. coli yang tumbuh pada medium seleksi menggunakan pasangan primer VH101-Sal-F dan VL101-Sal-R. Analisis orientasi gen scFv pada plasmid dilakukan menggunakan pasangan primer AOX1-F dan VH101-R. Terhadap plasmid rekombinan juga dilakukan analisis potong menggunakan enzim SalI. Hanya plasmid rekombinan yang terpotong dengan baik dilanjutkan Gambar 5 Diagram vektor pJ912-AGα-RFP. 5’AOX1= promoter AOX1. α faktor =
14
dengan analisis sekuen DNA menggunakan primer AOX1-F dan VL101-F.
Transformasi P. pastoris dengan Vektor Rekombinan
Transformasi sel khamir dilakukan dengan metode elektroporasi menggunakan protokol dari Invitrogen (2008). Vektor rekombinan pJ912-AGα -RFP::scFv dan pJ912-AGα-RFP yang akan ditransformasi ke dalam sel P. pastoris SMD1168H terlebih dahulu dipotong menjadi bentuk linear. Sejumlah 0,5 µg DNA dipotong dengan SacI pada daerah promoter AOX1. Plasmid yang telah terpotong dipurifikasi menggunakan Gel DNA Extraction Kit (GeneAid). Koloni tunggal P. pastoris SMD1168H ditumbuhkan dalam 5 mL medium YPD pada suhu 30°C, 250 rpm selama semalam. Sebanyak 100 µL biakan diresuspensi kembali dalam 200 µL 1M sorbitol dingin steril.
Sebanyak 70 µL sel kompeten P. pastoris dicampurkan dengan 0,5 μg plasmid yang linier. Sel kompeten dan plasmid diinkubasi terlebih dahulu pada suhu 0°C selama 10 menit. Sel kompeten dan plasmid dimasukkan ke dalam kuvet elektroporasi (2 mm gap) yang telah didinginkan. Kuvet yang mengandung sel kompeten dan plasmid diinkubasi pada suhu 0°C (dalam es) selama 5 menit. Elektroporasi dilakukan dengan kondisi β kV, β5 µF 400 Ω pada elektroporator Gene Pulser Xcell Electroporation System (Biorad). Sebanyak 150 μL 1M sorbitol dingin segera ditambahkan ke dalam kuvet tersebut. Isi kuvet ditransfer ke dalam mikrotube steril dan diinkubasi di dalam es selama 1-2 jam. Untuk perbaikan sel pasca elektroporasi, sebanyak 100 μL YPD ditambahkan ke dalam mikrotube dan diinkubasi pada suhu 30°C selama 1-2 jam. Sel hasil transformasi disebar pada media agar YPDS (Yeast Potato Dexstrose Sorbitol) yang mengandung zeocin
A
B
C
15 dengan konsentrasi 100 µg/mL dan diinkubasi selama 3-4 hari pada suhu 30°C sampai terbentuk koloni.
Seleksi Koloni P. pastoris Transforman
Koloni yang tumbuh pada media seleksi yang mengandung 100 µg/mL zeocin ditumbuhkan kembali pada media segar YPD agar dengan berbagai tingkat konsentrasi zeocin (100 s.d. 1000 µg/mL) secara bertahap. Seleksi ini bertujuan untuk memperoleh koloni transforman yang memiliki stabilitas genetik yang tinggi serta koloni dengan salinan gen multikopi. Koloni transforman juga ditumbuhkan pada media YPD agar tanpa zeocin sebagai kontrol. Seleksi dilakukan dengan menggoreskan koloni transforman pada media seleksi YPD agar dengan konsentrasi zeocin 100 µg/mL dan diinkubasi selama 1-2 hari pada suhu 30°C. Koloni yang tumbuh digoreskan kembali pada media YPD agar dengan zeocin 200 µg/mL. Koloni yang tumbuh pada medium tersebut digoreskan lagi pada media dengan konsentrasi zeocin lebih tinggi, yaitu 500 µg/mL dan 1000 µg/mL. Koloni yang hidup pada media dengan konsentrasi zeocin tertinggi digunakan untuk ekspresi protein skala kecil.
Analisis integrasi gen scFv ke dalam genom P. pastoris dilakukan menggunakan teknik PCR koloni. Sebelum dilakukan PCR, koloni khamir transforman diberi perlakuan terlebih dahulu. Koloni khamir dicuplik dengan tusuk gigi steril dan diresuspensikan ke dalam 50 L 0,04M NaOH. Suspensi tersebut diinkubasi selama ≥ 5 menit pada suhu 37°C. Suspensi ini digunakan sebagai sumber DNA dan pasangan primer VH101-F dan VL101-R digunakan pada proses PCR. Kondisi PCR yang digunakan adalah 40 siklus dengan kondisi denaturasi pada suhu 95°C selama 30 detik, penempelan primer pada suhu 56°C selama 30 detik dan perpanjangan pada suhu 72°C selama 1 menit. Sebelum siklus PCR, dilakukan denaturasi awal selama 8 menit 95°C dan perpanjangan akhir selama 5 menit 72°C pada akhir siklus.
Ekspresi Protein Rekombinan
16
waktu induksi pertama dan densitas sel (OD600nm) diukur. Biakan dipanen dengan cara sentrifugasi pada suhu 4°C, 3000g selama 10 menit.
Analisis Ekspresi Protein Rekombinan dengan Mikroskop Fluoresens
Ekspresi protein reporter TagRFP yang terfusi dengan scFv dapat digunakan untuk mengamati ekspresi protein fusi rekombinan tersebut dibawah mikroskop fluorensen. Pengamatan terhadap sel dilakukan setelah biakan P. pastoris (transforman dan non-transforman) diinduksi dengan metanol. Sel P. pastoris diamati dengan mikroskop fluoresen Leica DM1000 dengan filter cube N2.1. Ekstraksi Protein Rekombinan dari Dinding Sel P. pastoris
Protein rekombinan diekstraksi dengan menggunakan metode Jo et al
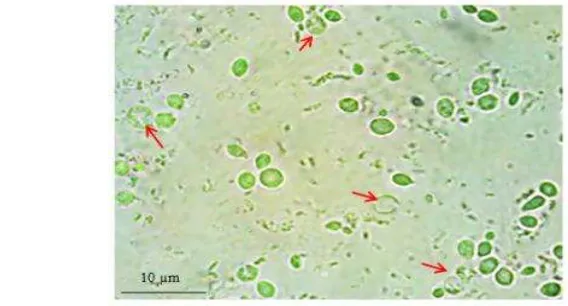
(2011) dan Ye et al. (2000) modifikasi. Biakan transforman yang diinduksi metanol selama 72 jam (OD600= ~20) dipanen dengan cara disentrifuse 4000 g selama 5 menit. Endapan sel dibersihkan sebanyak dua kali dengan akuades dingin steril dan sekali dengan Buffer A pada suhu 4°C. Sel disuspensi dengan Buffer A yang mengandung 1 mM phenylmethyl sulfonylfluoride (PMSF). Sel dilisis dengan menggunakan glass bead dengan perbandingan 1:2:1 (sel : bufer :
glass bead, v/v/v). Sel divortex hingga lisis dengan interval vortex dan pendinginan di dalam es selama 1 menit. Hasil lisis diamati dengan mikroskop fase kontras untuk mengkonfirmasi sel telah lisis. Hasil lisis sel disentrifuse dengan kecepatan 250 g selama 5 menit pada suhu 4°C. Supernatan disimpan dan dianalisis dengan SDS PAGE dan Western blot.
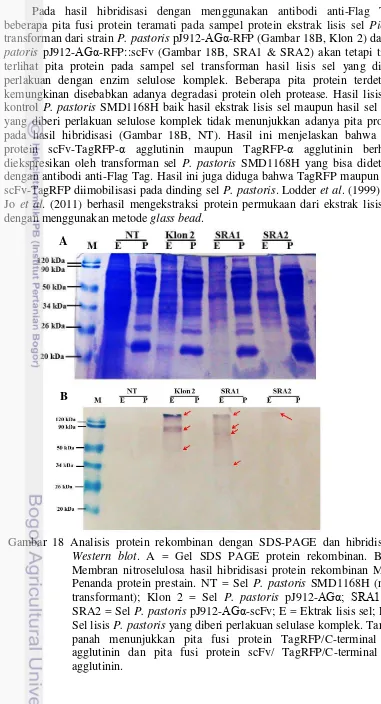
Endapan hasil lisis sel dibersihkan sebanyak dua kali dengan buffer A yang mengandung 1 mM PMSF. Endapan ini diberi perlakuan dengan Cellic® Ctec2 (Novozymes) di dalam 100 mM bufer natrium asetat (pH 5.2) yang mengandung 1 mM PMSF untuk mengekstrak fusi protein scFv anti EGFRvIII- TagRFP-α agglutinin dari dinding sel. Cellic® Ctec2 digunakan sebagai sumber selulase komplek. Reaksi dilakukan selama 4 jam pada suhu 37°C dengan penambahan 3% selulase komplek (w/w). Ekstrak enzim diperoleh dengan cara sentrifugasi pada 15,000 g selama 10 menit. Ekstrak ini dianalisis dengan SDS PAGE dan Western blot.
Analisis SDS PAGE dan Hibridisasi Western Blot
Protein rekombinan hasil lisis sel dianalisis menggunakan SDS-PAGE (konsentrasi poliakrilamid 15%) dan hibridisasi. Prosedur SDS-PAGE dilakukan sesuai metode dari Ausubel et al (2002) dengan pewarnaan coomassie blue. SDS-PAGE dimulai dengan pembuatan gel poliakrilamid 15% yang terdiri dari stacking gel dan separating gel (Lampiran 5). Sampel yang dianalisis merupakan supernatan hasil lisis sel dan supernatan dari endapan lisis sel yang diberi perlakuan dengan enzim selulase komplek.
17 lagi dengan buffer elektrotransfer. Blotter ditutup kuat-kuat dan dilakukan running 90 Volt, 40 mA selama dua jam
Tahapan hibridisasi diawali dengan membran nitroselulosa direndam dan digoyang dengan larutan blocking (0,5% susu bebas lemak di dalam bufer TBS) selama 1 jam. Membran lalu dicuci dengan larutan washing (bufer TBST) sebanyak 3 kali masing-masing selama 15, 5 dan 5 menit. Membran kemudian direndam dan digoyang dengan antibodi primer OctA-probe (H5) (Santa Cruz, USA) yang dicampur dengan larutan blocking dengan perbandingan 1:2000 selama semalam lalu dicuci seperti pada langkah sebelumnya. Membran lalu direndam dan digoyang lagi dengan antibodi sekunder goat anti-mouse IgG-AP conjugate (Santa Cruz, USA) di dalam larutan blocking dengan perbandingan 1:3500 selama 2 jam. Membran kemudian dicuci lagi sesuai dengan langkah sebelumnya dan ditambahkan developer yaitu Western Blue Stabilized Substrate for Alkaline Phosphatase (Promega, USA).
Analisis Interaksi Antibodi Anti-EGFRvIII dengan Antigen EGFRvIII Interaksi antibodi-antigen dilakukan dengan menggunakan Pure
18
disuspensi dengan 20 µL binding buffer dan diamati di bawah mikroskop fluoresen Leica DM1000 dengan filter cube N2.1 dan filter cube D.
4
HASIL DAN PEMBAHASAN
Subklon Gen scFv anti EGFRvIII ke dalam plasmid pJ912-AGα-RFP
Gen scFv anti EGFRvIII dibuat secara sintetik dan diklon dalam plasmid pJ201 di DNA 2.0 Inc USA berdasarkan sekuen protein anti-EGFRvIII. Sekuen gen scFv anti-EGFRvIII ini telah dioptimasi dengan kodon preferensi P. pastoris ( Hertati 2013). Gen ini diamplifikasi dan ditambah situs restriksi SalI dengan teknik PCR. Hasil PCR dengan primer VH101-SalI-F dan VL101-SalI-R menghasilkan amplifikasi dengan ukuran 750 pb yang merupakan gen scFv (Gambar 7). Plasmid pJ912-AGα-RFP merupakan vektor ekspresi yang mengandung beberapa perangkat gen penting untuk mengekspresikan protein scFv, yaitu promoter AOX1 sebagai promoter indusibel metanol, gen MF- (mating factor- ) sebagai gen penyandi peptida signal supaya protein dapat disekresikan keluar sel, gen she ble
sebagai gen penyandi resisten terhadap antibiotik zeocin untuk menyeleksi transforman, pUC ORI sebagai titik awal replikasi plasmid pada E.coli, gen
TagRFP sebagai gen penyandi protein reporter protein fluoresens berwarna merah, γ’-terminal genAGα1 merupakan gen penyandi ujung C dari α agglutinin. Pada daerah C-terminal α agglutinin terdapat glycosylphosphatidylinositol (GPI) yang berfungsi sebagai protein penahan pada permukaan sel. Plasmid diperbanyak di dalam sel E.coli TOP10F’ dan diperoleh dengan cara isolasi menggunakan teknik alkali lisis (Gambar 7).
Gen scFv anti-EGFRvIII telah berhasil disisipkan ke dalam situs SalI dari plasmid pJ912-AGα1-RFP dan terfusi diantara sinyal sekresi MF- (mating factor- ) pada ujung-5’ dan TagRFP pada ujung-γ’. Konfirmasi gen scFv di dalam plasmid rekombinan dilakukan dengan analisis PCR koloni, analisis orientasi gen dalam vektor, analisis pemotongan dengan enzim restriksi (SalI) dan analisis urutan DNA dari fusi gen rekombinan. Analisis PCR koloni dengan primer VH101-Sal-F dan VL101-Sal-R menunjukkan bahwa semua koloni yang
1000 pb 750 pb. B= Hasil isolasi plasmid pJ912-AGα-RFP
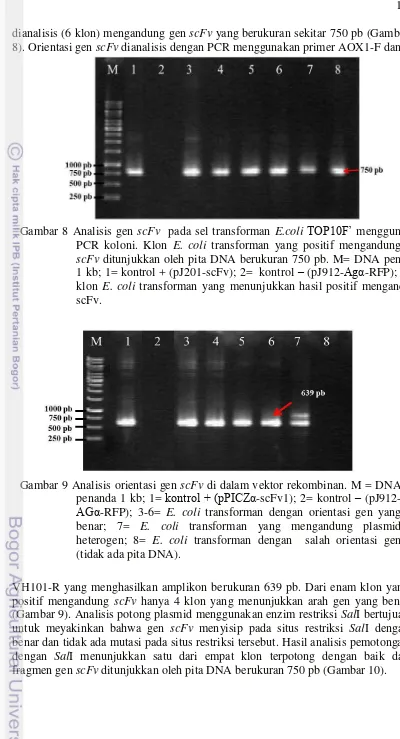
19 dianalisis (6 klon) mengandung gen scFv yang berukuran sekitar 750 pb (Gambar 8). Orientasi gen scFv dianalisis dengan PCR menggunakan primer AOX1-F dan
VH101-R yang menghasilkan amplikon berukuran 639 pb. Dari enam klon yang positif mengandung scFv hanya 4 klon yang menunjukkan arah gen yang benar (Gambar 9). Analisis potong plasmid menggunakan enzim restriksi SalI bertujuan untuk meyakinkan bahwa gen scFv menyisip pada situs restriksi SalI dengan benar dan tidak ada mutasi pada situs restriksi tersebut. Hasil analisis pemotongan dengan SalI menunjukkan satu dari empat klon terpotong dengan baik dan fragmen gen scFv ditunjukkan oleh pita DNA berukuran 750 pb (Gambar 10).
Gambar 8 Analisis gen scFv pada sel transforman E.coli TOP10F’ menggunakan PCR koloni. Klon E. coli transforman yang positif mengandung gen
scFv ditunjukkan oleh pita DNA berukuran 750 pb. M= DNA penanda 1 kb; 1= kontrol + (pJ201-scFv); 2= kontrol – (pJ912-Agα-RFP); 3-8= klon E. coli transforman yang menunjukkan hasil positif mengandung scFv.
Gambar 9 Analisis orientasi gen scFv di dalam vektor rekombinan. M = DNA penanda 1 kb; 1= kontrol + (pPICZα-scFv1); 2= kontrol –
20
Banyak faktor yang berpotensi mempengaruhi efisiensi transformasi, di antaranya kondisi inkubasi, konsentrasi plasmid, kondisi relatif sel kompeten dan kehadiran DNA kontaminan. (Classen et al. 2002). Faktor efisiensi ligasi juga turut mempengaruhi keberhasilan insersi gen ke dalam plasmid. Efisiensi ligasi dapat dipengaruhi oleh berbagai faktor seperti posisi situs restriksi, jenis situs restriksi dan urutannya, dan jenis enzim yang memotong situs restriksi (Dhesi 2005). Berbagai enzim restriksi telah diteliti untuk menentukan pengaruh konten nukleotida G-C dan / atau panjang nukloetida yang menggantung yang mungkin menjadi faktor dalam ligasi oleh T4 DNA ligase. Hasil penelitian Bola (2005) menunjukkan bahwa ujung kohesif kaya G,C-nukleotida memiliki efisiensi ligasi terbaik dibandingkan dengan ujung kohesif lainnya. Efisiensi ligasi ujung kohesif yang mengandung nukleotida A,T,G,C akan lebih tinggi jika daerah nukleotida yang menggantung lebih panjang dibandingkan nuleotida yang menggantung ukuranya pendek. Ujung kohesif kaya A,T nukleotida memiliki efisiensi ligasi yang paling rendah.
Plasmid rekombinan yang menunjukkan adanya sisipan gen scFv dengan orientasi yang benar dan telah terkonfirmasi dengan analisis potong plasmid, dikonfirmasi lebih lanjut dengan analisis urutan DNA. Hasil analisis urutan DNA menunjukkan bahwa ujung-5’ dari gen scFv telah terfusi dengan tepat dengan sekuen sinyal peptida MF- pada situs SalI (Lampiran 2). Sementara itu ujung-γ’ dari gen scFv tersebut juga telah terfusi dengan tepat dengan ujung-5’ dari gen TagRFP pada situs SalI (Lampiran 3). Namun demikian, hasil analisis sekuen DNA diketahui bahwa telah terjadi dua buah mutasi titik di dalam gen scFv pada plasmid rekombinan yang dihasilkan tersebut. Mutasi terjadi pada sekuen DNA dari rantai berat (VH) dan rantai ringan (VL), masing-masing satu mutasi titik (Gambar 11). Mutasi yang terjadi pada fragmen rantai berat maupun rantai ringan mengubah nukleotida adenin menjadi guanin. Mutasi pada fragmen rantai berat (VH) terjadi pada posisi ketiga dari kodon asam amino, yaitu GCA menjadi GCG. Kedua kodon tersebut menyandi asam amino yang sama, yaitu alanin (Ala), sehingga mutasi tersebut tidak mengubah asam amino yang disandi (mutasi diam ). Namun, mutasi pada fragmen rantai ringan (VL) terjadi pada posisi pertama dari kodon asam amino yaitu AAC menjadi GAC, sehingga mutasi
21 tersebut mengakibatkan perubahan kodon asam amino dari asparagin (Asn) menjadi asam aspartat (Asp). Mutasi tersebut dapat terjadi dikarenakan penggunaan enzim Taq DNA polimerase yang memiliki akurasi terbatas, yaitu hanya memiliki aktivitas 5’-γ’ polimerase dan 5’-γ’ eksonuklease tetapi tidak memiliki aktivitas γ’-5’ eksonuklease (proofreading). DNA polimerase ini memiliki tingkat kesalahan 1 per 1,7x105. Ketelitian DNA polimerase meningkat 10 hingga 100 kali lipat dengan adanya aktivitas γ’-5’ eksonuklease (Garcia-Diaz & Bebenek 2007). Ketelitian DNA polimerase pada saat replikasi DNA didapatkan karena adanya proses pemeriksaan secara akurat setiap nukleotida yang disintesis dan jika terjadi kesalahan, nukleotida yang salah akan dihilangkan sebelum proses ekstensi primer lebih lanjut terjadi. Pada proses koreksi, primer harus dipisahkan dari untai cetakan dan ditransfer dari polimerase ke pusat aktif eksonuklease dimana terjadi reaksi eksisi. Kemudian, primer yang telah dipotong dikembalikan ke pusat aktif polimerase. Dengan demikian, terjadi proses pergantian aktivitas polimerase ke eksonuklease dan eksonuklease ke polimerase (Silva & Reha-Krantz 2007)
Untuk melihat posisi relatif mutasi scFv anti EGFRvIII pada fragment untai ringan, sekuen asam amino scFv pada fragmen untai ringan di blast IgG menggunakan situs http://www.ncbi.nlm.nih.gov/igblast/igblast.cgi. Hasil blast IgG dapat dilihat bahwa posisisi relatif mutasi perubahan asam amino asparagin menjadi asam aspartat terjadi pada framework region ketiga (FR3) (Gambar 12). Untuk mengetahui pengaruh mutasi ini terhadap afinitas pengikatan antibodi-antigen masih perlu dianalisis lanjut menggunakan antibodi-antigen EGFRvIII dan bisa menjadi salah satu varian pustaka antibodi.
Setiap scFv tersusun dari daerah framework (FR) yang sangat dilestarikan susunan asam aminonya dan enam daerah complementarity determining regions (CDRs) yang telah diketahui sebagai daerah hipervariabel. Enam CDR (tiga di rantai ringan (L1,L2,L3) dan tiga di rantai berat (H1,H2,H3) bertanggung jawab Gambar 11 Mutasi gen scFv anti-EGFRvIII pada plasmid rekombinan. A =
22
terhadap sebagian besar interaksi antibodi-antigen (Pantazes & Maranas 2010). Mutasi pada gen daerah variable telah diketahui sebagai cara untuk meningkatkan afinitas antibodi. Namun, mutasi di FR lebih cenderung untuk menimbulkan respon imun yang tidak diinginkan (Kunik et al. 2012). FR penting dalam mempertahankan struktur CDR sehingga terjadi perubahan FR mempengaruhi struktur situs penggabungan antibodi-antigen dan dapat merubah afinitas antibodi (Holmes et al. 2001). Riechmann et al. (1988) menegaskan dari temuannya bahwa kontruk anti-CD52 dari manusia memiliki aviditas lemah akan tetapi setelah dilakukan perbaikan mutasi tunggal Ser menjadi Phe pada daerah framework H274 menjadikan aviditas lebih baik.
Antibodi dapat mengenali antigen melalui interaksi yang melibatkan daerah CDRs sehingga pustaka antibodi dapat dibuat hanya melibatkan mutasi di daerah CDRs. Rajpal et al. (2005) memilih dan memasukkan sembilan jenis asam amino sebagai perwakilan dari setiap gugus fungsi kimia dari asam amino. Mutasi tunggal masing-masing terjadi di setiap CDR dari enam CDRs (57 asam amino). Hasil diperoleh terdapat 38 mutasi substitusi di 21 posisi CDR (VH&VL) diidentifikasi menghasilkan afinitas pengikatan α-TNF tinggi. Varian ini memperlihatkan afinitas meningkat antara 500 - 870 kali lipat. Seleksi pustaka antibodi dengan sistem tampilan permukaan khamir merupakan metode yang efisien dan sangat sensitif untuk mengidentifikasi pengikatan antibodi-antigen.
A
B
23 Benatuil et al. (2010) menghasilkan 1,4 x1010 pustaka antibodi limfa manusia dengan efisiensi transformasi 1-1,5 x 108 transforman/mg vektor DNA.
Transformasi P. pastoris dengan Plasmid Rekombinan
Dua konstruk plasmid rekombinan, yaitu pJ912-AGα-RFP dan pJ912-AGα -RFP-scFv, telah berhasil diintroduksikan ke dalam genom P. pastoris SMD1168H. Plasmid rekombinan ini menyisip ke dalam genom P. pastoris melalui mekanisme rekombinasi homologus dengan memanfaatkan kemiripan sekuen promoter AOX1 yang terdapat pada genom P. pastoris dan vektor pJ912. Transforman P. pastoris AGα-RFP berhasil diperoleh sebanyak 12 klon sedangkan transforman P. pastoris AGα-RFP::scFv diperoleh sebanyak 4 klon (Gambar 13). Vektor dirancang untuk berintegrasi ke dalam genom P. pastoris sehingga memungkinkan ekspresi protein menjadi stabil, akan tetapi efisiensi transformasi menjadi sangat rendah. Efisiensi transformasi P. pastoris rendah karena plasmid tidak hanya masuk ke dalam sel tetapi juga harus berintegrasi ke dalam genom. Efisiensi transformasi yang rendah biasanya terjadi karena situs integrasi yang tidak efisien, DNA sisipan yang sulit dan kondisi transformasi tidak optimal (Wu & Letchworth 2004). Konsentrasi dan jumlah DNA, kepadatan sel kompeten, situs integrasi vektor ke dalam genom P. pastoris dan kondisi elektroporasi seperti voltase, kapasitas dan resistan pada saat transformasi mempengaruhi tingkat efisiensi transformasi pada P. pastoris (Wu & Letchworth 2004). Jumlah plasmid DNA yang digunakan untuk transformasi P. pastoris pada penelitian ini hanya 0,5 µg per reaksi transformasi, sedangkan jumlah plasmid DNA yang disarankan untuk memperoleh hasil yang baik per reaksi transformasi adalah sebanyak 5-10 µg plasmid (Invitrogen 2008). Dengan jumlah DNA 5-10 µg disebutkan dapat diperoleh sedikitnya 1x103 sampai 1x104 koloni transforman dengan kondisi transformasi yang optimal.
A
B
24
Seleksi Transforman P. pastoris
Vektor telah dirancang mengandung gen penyandi resistensi zeocin, yaitu gen Sh ble dari Streptoalloteichus hindustanus. Proses seleksi transforman di media seleksi zeocin bertujuan untuk memperoleh transforman yeng memiliki ketabilan genetik dan memiliki beberapa salinan gen. Konsentrasi zeocin yang digunakan 0 µg/mL, 100 µg/mL, 200 µg/mL, 500 µg/mL, dan 1000 µg/mL. P. pastoris galur non transforman disertakan untuk melihat efektifitas zeocin untuk membunuh sel yang tidak terintegrasi dengan gen target. Semua transforman P. pastoris AGα-RFP dan P. pastoris AGα-RFP::scFv mampu tumbuh pada media seleksi zeocin hingga konsentrasi 1000 µg/mL sementara galur non-transforman P. pastoris tidak mampu tumbuh pada media mengandung zeocin (Gambar 14). Tingkat resistensi zeocin secara tidak langsung mencerminkan jumlah gen rekombinan dimasukkan ke dalam genom P. pastoris. Norden et al (2011) memerlukan minimal 17 salinan plasmid yang terintegrasi pada genom. Peningkatan jumlah gen yang terintegrasi di dalam genom dapat meningkatkan ekspresi protein heterolog (Vassileva et al, 2001;. Mansur et al, 2005.).
P. pastoris menghasilkan transforman stabil secara genetik melalui
rekombinasi homologus antara kemiripan sekuen promoter AOX1 terhadap vektor ekspresi dengan genom P. pastoris. Proses integrasi diawali dengan vektor dipotong dengan SacI pada promoter AOX1. DNA vektor yang berbentuk linier menstimulasi proses terjadinya rekombinasi homologus di lokus yang terpotong melalui pristiwa pindah silang tunggal. Fragmen DNA linier yang dihasilkan mengandung cassetteekspresi dan gen penanda (zeocin) yang diapit oleh 5’dan γ’
AOX1. Kondisi ini merangsang peristiwa penggantian gen pada AOX1 genom sehingga menyebabkan gen AOX1 digantikan oleh cassette ekspresi berserta gen penanda (Li et al. 2007).
Gambar 14 Analisis stabilitas genetik koloni P. pastoris transforman dan non transforman di media YPD agar dengan beberapa konsentrasi zeocin. 1 = 0 g/mL; 2 = 100 g/mL; 3 = β00 g/mL; 4 = 500 g/mL; dan 1000 g/mL. A = Transforman P. pastoris AGα-RFP. B= Transforman P. pastoris AGα-RFP::scFv.
A
1 2 3 4 5
25 Analisis gen scFv anti-EGFRvIII pada genom diperlukan untuk membuktikan bahwa gen target telah terintegrasi pada genom P. pastoris. Hasil analisis PCR koloni dari 4 galur transforman P. pastoris AGα-RFP::scFv yang diperoleh menunjukkan bahwa gen scFv telah terintegrasi ke dalam genom pada 4 galur transforman P. pastoris tersebut. Galur transforman P. pastoris yang positif mengandung gen scFv anti-EGFRvIII pada genom akan menghasilkan pita DNA berukuran 750 pb (Gambar 15). P.pastoris AGα-RFP tidak menghasilkan pita DNA berukuran 750 pb disebabkan karena pada vektor yang diintegrasikan kedalam genom tidak terdapat gen scFv begitu juga pada kontrol sel P. pastoris non transforman tidak muncul pita DNA disebabkan karena tidak ada vektor ekspresi yang diintegrasikan ke dalam genom.
Ekspresi Protein Rekombinan
Protein scFv rekombinan ini terfusi dengan protein TagRFP. Protein fusi ini disekresikan keluar dari sel dengan bantuan sinyal peptida faktor-α. Namun, karena protein ini juga difusikan dengan α agglutinin yang mengandung domain penahan glycosylphosphatidylinositol (GPI) (GPI-anchor) menyebabkan protein fusi antibodi ini tidak sepenuhnya tersekresi keluar sel atau ke dalam media, akan tetapi protein tersebut tertahan pada permukaan sel. Aplikasi yang paling populer dari protein fluorensen adalah sebagai penanda ekspresi protein rekombinan karena ekspresi protein ini mudah diamati secara visual menggunakan mikroskop fluorensen. Ekspresi dari protein fluorensen dapat menunjukkan ekspresi, lokalisasi, translokasi, interaksi antar protein atau degradasi dari protein fusi tersebut di dalam sel. Protein fluoresen monomer seperti TagRFP umumnya dapat berfungsi dengan baik meski telah difusi dengan protein lain (Chudakov et al. 2010). Pengamatan sel P. pastoris transforman dan non-transforman dapat diamati di bawah mikroskop fluoresen pada fase kontras dan fase fluoresen
26
A
B
C
D
Fase Fluoresen Fase Kontras