EKSPLORASI POTENSI BAKTERI SIMBION LAMUN
SEBAGAI ALGASIDA UNTUK MARAK ALGA (
ALGAL
BLOOMS
) DI TELUK PEGAMETAN BULELENG BALI
GEDE IWAN SETIABUDI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul Ekplorasi Potensi Bakteri Simbion Lamun sebagai Algasida untuk Marak Alga (Algal Blooms) di Teluk Pegametan Buleleng Bali adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
GEDE IWAN SETIABUDI. Ekplorasi Potensi Bakteri Simbion Lamun sebagai Algasida untuk Marak Alga (Alga Blooms) di Teluk Pegametan Buleleng Bali. Dibimbing oleh DIETRIECH GEOFFREY BENGEN, HEFNI EFFENDI dan OCKY KARNA RADJASA.
Marak alga (algal blooms) adalah proliferasi alga planktonik dengan konsentrasi lebih dari 104 sel.L-1. Secara umum, kejadian tersebut menguntungkan pada industri perikanan budidaya maupun penangkapan. Pada beberapa kasus bisa berakibat negatif karena menyebabkan kerugian ekonomi, kerusakan lingkungan dan berpengaruh pada kesehatan manusia.
Sebagai sebuah ekosistem yang kaya bahan organik pada lingkungannya, menyebabkan lamun berpotensi untuk bersimbiosis dengan beragam jenis bakteri. Bentuk simbiosis lamun dan bakteri antara lain endosimbion dan episimbion. Bakteri simbion berperanan dalam dinamika perkembangan lamun dan pengambilan berbagai jenis nutrisi seperti karbon, nitrogen dan fosforus dari lingkungan. Dinamika komunitas bakteri pada lamun lebih banyak diketahui dari bakteri yang diisolasi dari episimbion, terutama bakteri di bagian lapisan atas dan bawah sedimen. Bakteri memiliki kemampuan memproduksi metabolit sekunder yang memiliki beragam potensi seperti antikanker, antibakteri, antifouling sampai antialga.
Penelitian ini bertujuan untuk: 1. mengetahui struktur komunitas plankton di Teluk Pegametan dan kaitannya dengan karakteristik lingkungan, 2. mengeksplorasi potensi bakteri endosimbion lamun Enhalus acoroides dan Thalassia hemprichii dari Teluk Pegametan Buleleng Bali yang memiliki kemampuan sebagai algasida dan 3. mengeksplorasi potensi bakteri episimbion lamun E. acoroides dan T. hemprichii dari Teluk Pegametan Buleleng Bali yang memiliki kemampuan sebagai algasida.
Struktur komunitas plankton dalam hal ini komposisi dan kelimpahannya di Teluk Pegametan dipengaruhi oleh karakteristik lingkungan yang semi-tertutup dan aktivitas budidaya perikanan. Di kawasan tersebut berhasil diindentifikasi 27 spesies plankton yang terbagi atas tiga kelompok. Kelompok plankton litoral terdiri atas duapuluh satu spesies. Kelimpahan diatom litoral mencapai 74.56% (18 spesies). Kelompok non-litoral teridentifikasi sebanyak enam spesies dengan kelimpahan 23.35%. Kelompok dinoflagelata litoral hanya ditemukan tiga spesies dengan kelimpahan 2.09%.
Kelimpahan plankton yang lebih dari 104 sel.L-1 ditemukan pada dua kelompok yaitu diatom litoral dan non-litoral. Pada kelompok diatom litoral terdiri dari enam spesies yaitu Nitzschia sp., Thalassiosira sp., Chaetoceros sp., Flagillaria sp., Thalassiothrix sp. dan Melosira sp. Pada kelompok non-litoral terdiri dari Oscillatoria sp. dan Spirogyra sp. Kelimpahan spesies-spesies tersebut mengindikasikan pertumbuhan yang tinggi dan terindikasi marak alga. Dinophysis sp. tergolong alga beracun juga teridentifikasi di Teluk Pegametan.
endosimbion lamun pada kelompok dinoflagelata sangat baik dan baik. Kinerja aktivitas algasida pada kelompok diatom relatif efektif pada Nitzschia sp. berkisar pada nilai 44.9% dan 52.6%, tetapi pada diatom lain masih sangat rendah. Hal tersebut menunjukkan bahwa endosimbion E. acoroides dan T. hemprichii bisa dipergunakan sebagai sumber algasida.
Secara umum aktivitas algasida konsorsium bakteri endosimbion isolat E. acoroides lebih kuat dibandingkan dengan T. hemprichii, dengan target kelompok dinoflagelata. Hal tersebut memungkinkan konsorsium bakteri endosimbion lamun tersebut bisa dijadikan sebagai algasida untuk menanggulangi fenomena marak alga dari kelompok dinoflagelata, terutama Porphyridium sp. dan kultur BG.
Konsorsium bakteri episimbion EhEp pada konsentrasi 2%, dengan kepadatan bakteri 106 sel.mL-1, belum mampu menghambat pertumbuhan plankton kelompok dinoflagelata maupun diatom target. Aktivitas algasida relatif rendah dengan persentase <40%. Konsorsium bakteri episimbion ThEp pada semua plankton target aktivitas algasidanya rendah, kecuali pada Nitzschia sp. (46.3%). Hal tersebut menunjukkan bahwa episimbion T. hemprichii memungkinkan digunakan sebagai sumber algasida untuk diatom, khususnya Nitzschia sp.
Karakteristik lingkungan bisa menggambarkan aktivitas algasida pada lingkungan alami. Karakteristik lingkungan yang mempengaruhi kinerjanya adalah DOC, DO dan salinitas. Karakterisitik lingkungan seperti ORP, suhu, pH dan COD memberikan petunjuk kelompok bakteri simbion apa yang bekerja lebih baik sebagai algasida pada kondisi alami di Teluk Pegametan.
SUMMARY
GEDE IWAN SETIABUDI. Exploration of the Potential of The Bacteria of Seagrass Symbiont as Algalcide for Algal Blooms at Pegametan Bay, Buleleng Bali. Supervised by DIETRIECH GEOFFREY BENGEN, HEFNI EFFENDI and OCKY KARNA RADJASA.
Algal Bloom is the proliferation of the planktonic algae with a concentration of more than 104 cells.L-1. In general, such a phenomenon contributes to the industry of fishery and the quantity of the fish which can be caught. However, in several cases, such a phenomenon may lead to economic loss and environmental damage and worsen the human health.
Seagreass has the potential to live in symbiosis with various kinds of bacteria. The forms of symbiosis of seagrass and bacteria are endosymbiont and epysimbiont. Symbiont bacteria has role in seagrass development dynamic and the intake of varous kinds of nutritions, such as carbon, nitrogen and phosphor from the environment. The dynamic of bacteria community on seagrass is mostly known from the bacteria isolated from the epysimbiont, particularly on the upper and lower layer of the sediment. Bacteria is known to have the ability to produce secondary metabolites which have various potentials, namely anticancer, antibacteria, antifouling and antialgae.
The objectives of this study are 1. to find out the structure of plankton community at Pegametan Bay and its relationship with the environmental characteristics, 2. to explore the potential of the endosymbiont bacteria of the Enhalus acorides and Thalassia hemprichii at Pegametan Bay Buleleng Bali which has the ability as algalcide, and 3. to explore the potential of the episymbiont bacteria of the E.acoroides and T. Hemprichii at Pegametan Bay Buleleng Bali which has ability as algalcide.
The structure of plankton community, in this case its composition and abundance, at Pegametan Bay was affected by the characteristic of the bay which was semi-closed with fisheries activities. In that area, 27 plankton species were identified which could be classified into two groups. The litoral plankton group consisted of 21 species with an abundance of 74.56% (diatome) and three species were found belonging to the litoral dinoflagellate group with a 2.09% abundance. Six species were identified belonging to the non-litoral group, with a 23.35% abundance.
An abundance of plankton that was greater than 104 cells.L-1 was found in two groups, namely the diatom litoral and non-litoral groups. The diatom litoral group consisted of 6 species, namely Nitzschia sp., Thalassiosira sp., Chaetoceros sp., Flagillaria sp., Thalassiothrix sp. and Melosira sp and the non-litoral group consisted of 2 species, namely Oscillatoria sp. and Spirogyra sp. The abundance of those species indicated high growth and algal bloom. Dinophysis sp. was also identified, which was toxic algae.
the values were smaller, 57.1% and 48.6%. This proved that the effectivity of algalcidal activity performance of the endosymbiont bacterial concortium of the seagrass was excelent and intermediate. The performance of algalcidal activity on diatom group was relatively effective on Nitzschia sp. The value ranged from 44.9% and 52.6%. However, it was relatively low on other diatoms. This showed that endosymbiont E. acoroides and T. hemprichii could be used as sources of algalcide.
In general, the algalcidal activity of bacterial consortium of isolate E. acoroides was stronger than T. hemprichii, with group of dinoflagellates as target. This allowed endosymbiont bacterial consortium of the seagrass to be used as algalcide to overcome the pheomenon of algal bloom from the group of dinoflagellates, especially Porphyridium sp.and BG culture.
The episymbiont bacterial consortium at a concentration of 2% and a bacterial density of 106 cells.mL-1, was not yet able to impede the growth of plankton be it the group of dinoflagellates or the target diatom. The algalcidal activity was relatively low with a percentage of <40%. The algalcidal activity of the bacterial concortium of the epysimbiont on all planktons was relatively low, except on Nitzschia sp. (46.3%). This showed that epysimbiont of T. hemprichii has the potential to be used as source of algalcide for diatoms, especially Nitzschia sp.
The characteristics of the environment could describe the algalcide activity in natural environment. The characteristics which ifluenced its performance were DOC, DO and salinity. Environmental characteristics such as ORP, temperature, pH and COD gave clue on the bacterial group of which symbiont worked better as algalcide in natural condition at Pegametan Bay.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor Sains
pada
Program Studi Ilmu Kelautan
EKSPLORASI POTENSI BAKTERI SIMBION LAMUN
SEBAGAI ALGASIDA UNTUK MARAK ALGA (
ALGAL
BLOOMS
) DI TELUK PEGAMETAN BULELENG BALI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Penguji Luar Komisi pada Ujian Tertutup : 1. Dr Ir Neviaty P. Zamani, MSc 2. Dr Ir Yusli Wardiatno, MSc
Penguji Luar Komisi pada Sidang Promosi : 1. Dr Ir Yusli Wardiatno, MSc
Judul Disertasi : Eksplorasi Potensi Bakteri Simbion Lamun sebagai Algasida untuk Marak Alga (Algal Blooms) di Teluk Pegametan Buleleng Bali.
Nama : Gede Iwan Setiabudi
NIM : C651110031
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Dietriech Geoffrey Bengen, DEA Ketua
Dr Ir Hefni Effendi, MPhil Prof Ocky Karna Radjasa, PhD
Anggota Anggota
Diketahui oleh Ketua Program Studi
Ilmu Kelautan
Dr Ir Neviaty P. Zamani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian Tertutup: 15 Agustus 2016 Tanggal Sidang Promosi: 1 September 2016
PRAKATA
Puji syukur penulis persembahkan kepada Tuhan Yang Maha Kuasa. Ungkapan rasa syukur ini penulis sampaikan atas segala karunia-Nya sehingga disertasi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian adalah mikrobiologi laut pada lamun, dengan judul Eksplorasi Potensi Bakteri Simbion Lamun sebagai Algasida untuk Marak Alga (Algal Blooms) di Teluk Pegametan Buleleng Bali.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Dietriech Geoffrey Bengen, DEA, Bapak Dr Ir Hefni Effendi, MPhil dan Bapak Prof Ocky Karna Radjasa, PhD selaku pembimbing yang telah banyak membantu dan memberi masukan dari awal penentuan judul, pembuatan proposal, proses penelitian, penulisan hingga tersusunnya disertasi ini.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Neviaty P. Zamani, M.Sc
Penghargaan dan ucapan terima kasih juga penulis sampaikan kepada Kepala Laboratorium Perikanan Jurusan Budidaya Kelautan Universitas Pendidikan Ganesha, Kepala Laboratorium Analis Kimia Universitas Pendidikan Ganesha, Laboratorium Pendidikan Kimia Universitas Pendidikan Ganesha, Laboratorium Proling IPB, Laboratorium InaCC LIPI, Laboratorium Plankton P2O LIPI dan Laboratorium Kultur Plankton P2O LIPI yang telah membantu pada proses penelitian sehingga disertasi ini dapat disusun dan diselesaikan. Terima kasih kepada seluruh jajaran IPB, Rektor, Dekan Pascasarjana, Dekan FPIK dan seluruh dosen IPB yang telah memberi kesempatan kepada penulis untuk menimba ilmu di instansi ini.
Terima kasih kepada Rektor Universitas Pendidikan Ganesha, Dekan FMIPA, Ketua Jurusan Budidaya Kelautan dan seluruh rekan-rekan dosen beserta staf atas bantuan dan dukunganya selama ini. Penghargaan dan terima kasih juga penulis sampaikan kepada rekan-rekan seperjuangan di IPB. Semoga ilmu yang kita dapatkan bermanfaat bagi masyarakat dan untuk kita semua.
DAFTAR ISI
2 STRUKTUR KOMUNITAS PLANKTON DI EKOSISTEM LAMUN DAN KETERKAITANNYA DENGAN KARAKTERISTIK
3 POTENSI ALGASIDA BAKTERI ENDOSIMBION LAMUN E. acoroides DAN T. hemprichii DARI TELUK PEGAMETAN BULELENG BALI
4 POTENSI ALGASIDA BAKTERI EPISIMBION LAMUN E. acoroides DAN T. hemprichii DARI TELUK PEGAMETAN BULELENG BALI
DAFTAR TABEL
1 Roadmap penelitian tentang bakteri yang memiliki kemampuan algasida
4 2 Alat yang digunakan dalam pengukuran kualitas air dan nutrien 9 3 Alat dan bahan identifikasi lamun dan pengambilan data plankton 10 4 Karakteristik fisik-kimia perairan di Teluk Pegametan 16 5 Kelimpahan dan komposisi komunitas Plankton di Teluk Pegametan 19 6 Aktivitas algasida konsorsium bakteri endosimbion E. acoroides dan T.
hemprichii pada plankton target.
32 7 Matrik similaritas aktivitas algasida konsorsium bakteri endosimbion 33 8 Rekapitulasi hasil uji t-student pada taraf nyata (α: 0.05) terhadap
kepadatan plankton kontrol dan perlakuan (kelompok dinoflagelata litoral)
33
9 Rekapitulasi hasil uji t-student pada taraf nyata (α: 0.05) terhadap kepadatan plankton kontrol dan perlakuan (kelompok diatom litoral)
33 10 Aktivitas algasida konsorsium bakteri episimbion EhEp dan ThEp pada
plankton target.
45 11 Rekapitulasi hasil uji t-student pada taraf nyata (α: 0.05) terhadap
kepadatan plankton kontrol dan perlakuan
49 12 Matrik similaritas aktivitas algasida antar isolat konsorsium bakteri 52
DAFTAR GAMBAR
1 Kerangka pikir penelitian ekplorasi potensi bakteri simbion lamun sebagai algasida
6 2 Lokasi pengambilan sampel di kawasan budidaya Teluk Pegametan,
Buleleng Bali
9 3 Bagan alir kegiatan penelitian struktur komunitas plankton Teluk
Pegametan
13 4 Deskripsi Enhalus acoroides yang dikategorikan genus monotifik 14
5 Deskripsi Thalassia hemprichii 15
6 Deskripsi Halophila ovale 15
7 Konsentrasi Total Nitrogen (N-tot) pada setiap stasiun pengamatan 16 8 Konsentrasi Total Fosforus (P-tot) pada setiap stasiun pengamatan 16 9 Konsentrasi karbon organik terlarut atau dissolved oragnic carbon
(DOC) pada setiap stasiun pengamatan
17 10 Hasil analisis komponen utama pada sumbu 1 (F1) dan sumbu 2 (F2)
tentang hubungan antara karakteristik fisik kimia perairan dengan stasiun pengamatan.
18
11 Dendrogram similaritas antar stasiun berdasarkan karakteristik lingkungan teluk
stasiun pengamatan pada sumbu 1 (F1) dan sumbu 2 (F2).
17 Dendrogram similaritas stasiun terhadap komposisi dan kelimpahan spesies plankton teridentifikasi di Teluk Pegametan
23
18 Mikrograf kondisi media dan sel plankton 34
19 Perkembangan pertumbuhan plankton (dinoflagelata) kontrol dan plankton dengan perlakuan EhEd dan ThEd selama lima hari pengamatan
35
20 Perkembangan pertumbuhan plankton (diatom) kontrol dan plankton dengan perlakuan EhEd dan ThEd selama lima hari pengamatan.
36 21 Hasil PCA antara aktivitas algasida konsorsium bakteri endosimbion
dengan karakteristik lingkungan pada sumbu 1 (F1) dan sumbu 2 (F2).
37
22 Mikrograf sel Nitzschia sp. 46
23 Perkembangan pertumbuhan plankton (dinoflagelata) kontrol dan plankton dengan perlakuan EhEd dan ThEd selama lima hari pengamatan.
46
24 Perkembangan pertumbuhan plankton (diatom) kontrol dan plankton dengan perlakuan EhEp dan ThEp selama lima hari pengamatan.
47 25 Hasil analisis PCA antara aktivitas algasida konsorsium bakteri
episimbion dengan karakteristik lingkungan pada sumbu 1 (F1) dan sumbu 2 (F2)
48
DAFTAR LAMPIRAN
1 Data komposisi dan kelimpahan plankton 67
2 PCA korelasi antar parameter lingkungan 68
3 Indeks similaritas antar stasiun berdasarkan karakteristik lingkungan menggunakan Jarak Euclidian
71 4 CA struktur komunitas plankton dengan lingkungan 72 5 Indeks similaritas antar stasiun berdasarkan struktur komunitas plankton
menggunakan jarak euclidian
74
6 Media pertumbuhan plankton 75
7 Media pertumbuhan bakteri 76
8 Kondisi stasiun 77
9 Pengambilan data 79
10 Uji aktivitas algasida 81
11 Disimilaritas antar aktivitas algasida 84
12 PCA aktivitas algasida dengan karakteristik lingkungan 85
1
PENDAHULUAN
Latar Belakang
Marak alga (algal blooms) adalah proliferasi alga planktonik dengan konsentrasi lebih dari 104 sel.L-1. Panggabean (1994) menyatakan bahwa pada saat terjadi ledakan populasi, kepadatan alga dapat mencapai 103 – 104 sel.L-1untuk ukuran besar dan 105 – 106 sel.L-1 untuk ukuran kecil. Ledakan populasi tersebut biasanya hanya terdiri dari satu jenis mikroalga atau jumlah jenisnya sangat sedikit. Belum ada ambang batas yang jelas tentang jumlah alga pada saat terjadi marak alga. Sebagian besar penelitian menyatakan bahwa marak alga akan terjadi jika konsentrasi alga lebih dari 104 sel.L-1 (Hallegraeff 1995). Pada saat terjadi marak alga warna perairan dapat berubah menjadi hijau, coklat kekuning-kuningan, atau merah tergantung dari alga plankton penyebabnya (Sutomo 1993; Mohamed & Mesaad 2007; Munir et al. 2013). Secara umum kejadian tersebut menguntungkan bagi industri perikanan budidaya maupun penangkapan. Pada beberapa kasus bisa berakibat negatif karena menyebabkan kerugian ekonomi, kerusakan lingkungan dan berpengaruh pada kesehatan manusia (Hallegraeff 2003; Anderson 2005).
Laporan secara global menyebutkan kejadian marak alga menyebabkan kerugian mencapai $38 juta/tahun pada usaha perikanan komersial di Amerika Serikat (Moore et al. 2011), terutama oleh plankton penghasil toksin. Lewitus et al. (2012) melaporkan bahwa di sepanjang pesisir Pasifik bagian Amerika Utara, dari Alaska sampai Meksiko, kejadian marak alga menyebabkan terjadinya kerusakan sumberdaya alam, masalah perekonomian, menyebabkan sakit bahkan meninggal pada manusia selama dekade terakhir.
Lamun adalah salah satu ekosistem penting di wilayah pesisir tropis. Degradasi ekosistem lamun biasanya diikuti oleh adanya marak alga (Kennish 2010). Kelimpahan alga planktonik di ekosistem lamun cenderung rendah berkisar 5.5 x 104 sel.L-1, walaupun konsentrasi nutrisinya cenderung tinggi. Hal itu terjadi karena kemampuan asimilasi ekosistem lamun sangat tinggi, sehingga nutrisi di kolom air telah habis dimanfaatkan. Penelitian menunjukkan bahwa biomassa dan produktivitas primer alga planktonik di ekosistem lamun berbanding terbalik dengan pH, konsentrasi nitrat, temperatur dan parameter hidrobiologi lainnya (Sridhar et al. 2010).
Terjadi interaksi yang kompleks antara populasi alga planktonik dengan lamun spesies Zostera noltii. Laporan penelitian menyebutkan bahwa ada substansi allelopatik yang diperkirakan berasal dari ekosistem lamun tersebut bisa menghambat pertumbuhan alga planktonik. Substansi tersebut belum jelas dihasilkan oleh lamun atau organisme lain, misalnya organisme simbion. Pemasukan nutrien dalam jumlah banyak, aktivitas grazing dan interaksi aliran kolom air dan sedimen menjadi faktor yang mempengaruhi pertumbuhan alga planktonik (de Witt et al. 2012).
2
berbagai jenis nutrisi seperti karbon, nitrogen dan fosfor dari lingkungan. Dinamika komunitas bakteri pada lamun lebih banyak diketahui dari bakteri yang diisolasi dari episimbion, terutama bakteri di bagian lapisan atas dan bawah sedimen (Garcia-Martinez et al. 2009; Garcias-Bonet et al. 2012).
Sidabutar (2006) mencatat kejadian marak alga dari kelompok harmful algal blooms (HABs) di perairan Indonesia sebanyak 16 kejadian pada kurun waktu 1983 sampai 2005. Penyebab marak algaumumnya dari kelompok Dinoflagelata, dan beberapa dari kelompok Diatomae dan Cyanophyta. Di pesisir Sumatera Selatan dan muara sungai Banyuasin juga berpotensi terjadi marak alga berbahaya. Berdasarkan hasil penelitian ditemukan beberapa spesies alga berbahaya yaitu
Ceratium sp., Pseudonitzschia sp., Gonyaulax sp., Skeletonema sp., Dinophysis, Gymnodinium dan Pyrodinium (Aryawati et al. 2005; Isnaini et al. 2011; Surbakti
et al. 2011).
Muawanah et al. (2012) melaporkan bahwa telah terjadi marak alga
Cochlodinium sp. di Teluk Hurun Lampung. Ledakan pertumbuhan jenis alga tersebut juga pernah dilaporkan terjadi di kawasan Illigan Bay Filipina (Vicente et al. 2002). Adam et al. (2011) melaporkan distribusi temporal dan spasial spesies tersebut di pesisir kota Kinabalu Sabah Malaysia. Secara umum, Cochlodinium
mampu menghasilkan neurotoksin, hemolitik, hemaglunatif dan Paralytic
Shellfish Poisoning (PSP). Senyawa-senyawa tersebut bisa menyebabkan
keracunan pada manusia melalui konsumsi makanan laut terutama kekerangan yang telah terkontaminasi (Onoue and Nozawa, 1989).
Metode penanggulangan marak alga yang sudah dilakukan di Jepang dan Korea adalah menggunakan clay sprayer. Metode tersebut menyemprotkan lumpur halus (montmorillonite, kaolinite dan yellow loess) pada perairan yang mengalami blooming alga. Lumpur halus tersebut akan berfungsi sebagai koagulan bagi plankton, dan mengakibatkan fenomena marine snow. Koagulasi tersebut menyebabkan agregasi dan mempercepat penenggelaman plankton (Sengcon & Anderson 2004; Beaulieu et al. 2005). Permasalahan metode tersebut adalah menimbulkan sedimentasi dan meningkatkan turbiditas perairan, dan merugikan organisme lain, misalnya ekosistem karang. Imai et al. (2015) menyatakan bahwa banyak bakteri asosiatif blooming alga yang telah diisolasi dan berpotensi sebagai algasida. Pada uji laboratorium aktivitas algasida bakteri tersebut sangat baik mencapai 90%. Permasalahannya kinerja bakteri dan senyawa metabolitnya belum teruji di lapangan, jadi memerlukan periode yang panjang untuk membuktikan efektifitasnya.
Garcias-Bonet et al. (2012) mengemukakan bahwa dibandingkan dengan kelompok bakteri episimbion, bakteri endosimbion masih jarang dieksplorasi. Inang bakteri bisa memanfaatkan metabolit sekunder bakteri untuk keperluan metabolismenya. Metabolit sekunder tersebut memiliki beragam potensi seperti antikanker, antibakteri, antifouling sampai antialga. Marhaeni et al. (2011) berhasil mengisolasi bakteri simbion (endo dan epi-simbion) lamun yang memiliki kemampuan sebagai antibiofouling.
3
Perumusan Masalah
Fenomena pertumbuhan plankton yang tidak terkendali dan sangat banyak (blooming alga) merugikan secara ekonomi, menyebabkan kerusakan pada lingkungan dan kematian bagi organisme lain termasuk manusia. Kerugian yang ditimbulkan cukup banyak dan bersifat masif. Frekuensi terjadinya blooming alga semakin sering terjadi, seiring dengan laju pencemaran di ekosistem laut (Glibert
et al. 2005; Sidabutar 2006; Anderson 2008). Beberapa metode seperti clay sprayer sudah coba digunakan untuk menanggulangi fenomena tersebut, namun memiliki efek samping pada ekosistem perairan.
Sejak tahun 2001 dilakukan penelitian-penelitian untuk mencari organisme yang bisa menghambat pertumbuhan plankton. Dasar dari penelitian tersebut adalah keseimbangan ekologi yang terjadi secara alami dan fenomena blooming alga yang tidak terjadi dalam jangka waktu panjang. Hasil-hasil penelitian tersebut berhasil mengisolasi berbagai jenis bakteri, terutama dari perairan Jepang dan Korea, yang memiliki kemampuan sebagai algasida. Umumnya bakteri yang memiliki kemampuan tersebut diisolasi dari kejadian blooming alga (Imai 2015). Penelitian ini mencoba mencari algasida terutama bakteri simbion lamun yang memiliki kemampuan sebagai inhibitor perkembangan plankton. Hasil penelitian ini juga akan memberikan bukti mengenai manfaat lain dari ekosistem lamun pada ekosistem pesisir secara umum.
Kawasan Teluk Pegametan Buleleng Bali adalah lokasi budidaya perikanan yang intensif. Kegiatan yang berlangsung disana selain budidaya juga merupakan lokasi penelitian lapangan bagi Balai Besar Penelitian dan Pengembangan Budidaya Laut (BBPPBL) Gondol. Usaha budidaya utama di Teluk Pegametan adalah keramba jaring apung (KJA), jumlahnya cukup banyak dan umumnya diusahakan secara intensif. Pada bagian barat teluk, yang merupakan pembatas dengan Teluk Kaping, merupakan kawasan dangkal yang banyak ditumbuhi oleh lamun secara alami. Pada pembatas tersebut secara umum memiliki karakteristik yang sama, karena dipengaruhi oleh kedua teluk (Kaping dan Pegametan).
Kegiatan budidaya yang berhubungan langsung dengan ekosistem laut dalam hal ini Teluk Pegametan, berpotensi memberi masukan bahan-bahan organik maupun non-organik ke dalam sistem perairan. Aktivitas budidaya dan dan residu yang dihasilkan secara langsung maupun tidak memberi pengaruh terhadap perubahan kualitas lingkungan teluk secara menyeluruh, keberadaan organisme alami (lamun, karang dan ikan) dan bakteri pada ekosistem lamun. Setiabudi (2011) menemukan enam genus bakteri yang diisolasi dari sedimen di pembatas Teluk Kaping dan Teluk Pegametan yaitu Enterobacter sp., Bacillus sp.,
4
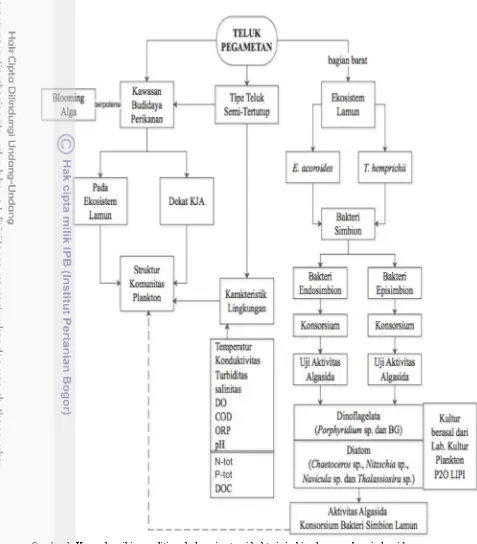
Berdasarkan pengamatan selama penelitian terlihat bahwa kondisi perairan Teluk Pegametan hampir selalu berwarna hijau, kemungkinan disebabkan oleh tingginya kelimpahan plankton. Hal tersebut didukung juga dengan bentuk pesisirnya yang berupa teluk yang tertutup oleh karang penghalang pada bagian depan dan barat teluk. Berbeda pada hamparan lamun perairannya cenderung lebih jernih. Berdasarkan fakta tersebut maka ada kemungkinan bahwa bakteri simbion pada lamun di kawasan Teluk Pegametan berpengaruh pada pertumbuhan plankton. Kerangka pikir dalam penelitian ini disajikan pada Gambar 1.
Tujuan Penelitian
Penelitian ini bertujuan untuk: 1. mengetahui struktur komunitas plankton di Teluk Pegametan dan kaitannya dengan karakteristik lingkungan, 2. mengeksplorasi potensi bakteri endosimbion lamun dari Teluk Pegametan Buleleng Bali yang memiliki kemampuan sebagai algasida dan 3. mengeksplorasi potensi bakteri episimbion lamun dari Teluk Pegametan Buleleng Bali yang memiliki kemampuan sebagai algasida.
Manfaat Penelitian
Hasil penelitian ini bisa menjadi alternatif penanganan masalah marak alga di lingkungan laut alami maupun usaha budidaya laut.
Ruang Lingkup Penelitian
Penelitian ini dilaksanakan di kawasan pesisir Teluk Pegametan Buleleng Bali. Target penelitian ini adalah struktur komunitas plankton di kawasan budidaya dan ekosistem lamun, konsorsium bakteri simbion pada ekosistem lamun yang mempunyai kemampuan sebagai algasida. Kondisi lingkungan juga diukur sebagai data pendukung. Keberadaan data pendukung tersebut dipakai untuk mengetahui apakah faktor-faktor lingkungan baik plankton, fisik dan kimia lingkungan perairan berpengaruh pada aktivitas bakteri terhadap plankton target. Status terkini penelitian tentang bakteri yang memiliki kemampuan algasida disajikan pada Tabel 1.
Tabel 1 Artikel publikasi tentang bakteri yang memiliki kemampuan algasida
Peneliti Topik Kebaruan kepulauan Seto Jepang, pada saat blooming alga Chattonella spp.
Bakteri yang diisolasi pada saat blooming plankton Cochlodiniumpolykrikoides dari Teluk Masan Korea diketahui memiliki kemampuan menghasilkan metabolit
Bacillamide yang bersifat algasida.
5
et al. 2003 motility of Saprospira sp. SS98-5 pesisir barat daya Jepang yang mampu menghambat pertumbuhan Chattonella
Menemukan bakteri strain E8 dan E9 yang diisolasi dari lamun Zostera marina yang memiliki aktivitas algasida kuat terhadap
Alexandrium tamarense. Selain itu, bisa juga menghambat perkembangan
Chattonella antiqua dan Heterosigma akashiwo (red tide), Heterocapsa
6
2
STRUKTUR KOMUNITAS PLANKTON DI EKOSISTEM
LAMUN DAN KETERKAITANNYA DENGAN
KARAKTERISTIK LINGKUNGAN
Latar Belakang
Lamun adalah salah satu ekosistem penting di kawasan pesisir tropis. Degradasi ekosistem lamun selalu diikuti oleh adanya marak alga (Kennish 2010). Tetapi, bila kondisinya cenderung baik maka kelimpahan alga planktonik rendah. Kelimpahan alga planktonik hanya berkisar 5.5 x 104 sel.L-1, walaupun konsentrasi nutrisinya cenderung tinggi. Hal itu terjadi karena kemampuan asimilasi ekosistem lamun sangat tinggi, sehingga nutrisi di kolom air telah habis dimanfaatkan. Penelitian menunjukkan bahwa biomassa dan produktivitas primer alga planktonik di ekosistem lamun berbanding terbalik dengan pH, konsentrasi nitrat, temperatur dan parameter hidrobiologi lainnya (Sridhar et al. 2010). Granger & Iizumi (2001) menyatakan bahwa kondisi eutrofikasi dan konsentrasi nutrien yang tinggi pada ekosistem lamun menyebabkan ledakan pertumbuhan epifit, plankton dan makroalga.
de Witt et al. (2012) menyatakan bahwa potensi pertumbuhan plankton di ekosistem lamun dipengaruhi oleh keberadaan nutrien. Data penelitiannya menunjukkan interaksi bentik pelagik bersifat kompleks dan menyebabkan fenomena interaksi ekologis yang sulit diprediksi. Pemasukan nutrien dalam jumlah banyak, aktivitas grazing dan interaksi aliran kolom air dan sedimen juga menjadi faktor yang mempengaruhi pertumbuhan alga planktonik.
Teluk Pegametan adalah kawasan budidaya laut, di bagian barat kabupaten Buleleng Bali. Bentuk kawasannya adalah teluk yang tertutup oleh karang penghalang di bagian utara dan gosong pasir di bagian barat, sedangkan bagian timur relatif terbuka. Aktivitas budidaya yang berlangsung adalah keramba jaring apung, keramba tancap dan seacages. Komoditas yang dibudidayakan berupa kerapu, baramundi, rumput laut dan karantina ikan hias. Model usaha yang dikembangkan sebagian besar adalah pembesaran (Setiabudi et al. 2011; Hanafi 2004).
Topografinya yang tertutup merupakan lokasi yang ideal untuk budidaya di tengah laut. Keberadaan terumbu karang dan gosong pasir yang bisa menahan gelombang dan arus. Hal tersebut menyebabkan perairan menjadi relatif tenang. Kerugian akibat rusaknya keramba menjadi kecil, hal tersebut menjadi pertimbangan yang utama dalam usaha perikanan laut (Hanafi 2004).
8
menunjukkan turbiditas yang tinggi, sebagai akibat kelimpahan plankton yang tinggi. Di area yang kerapatan lamunnya tinggi turbiditas cenderung rendah.
Ekosistem padang lamun bisa mempengaruhi kelimpahan plankton di kolom air. Dengan tingkat penyerapannya yang relatif tinggi terhadap nutrisi membuat lamun menjadi kompetitor bagi plankton di perairan. Heminga dan Duarte (2000) menyatakan bahwa bagian daun lamun bisa menyerap 49% nitrogen dari lingkungan. Kondisi Teluk Pegametan yang relatif tertutup bisa menyebabkan waktu paruh nutrisi terlarut menjadi panjang. Fenomena yang khusus menjadikan kawasan Teluk Pegametan menjadi spesial, terutama untuk melihat struktur komunitas plankton dan hubungannya dengan kondisi fisik kimia perairan.
Ruang Lingkup Penelitian
Penelitian ini dilaksanakan di kawasan budidaya perikanan Teluk Pegametan, Buleleng Bali. Pengambilan data dilakukan pada bulan Juni 2014. Ruang lingkup penelitian ini mencakup tiga bagian yaitu karakteristik lingkungan, struktur komunitas plankton di kolom air dan pengaruh lingkungan terhadap struktur komunitas plankton di Teluk Pegametan.
METODE
Lokasi Penelitian
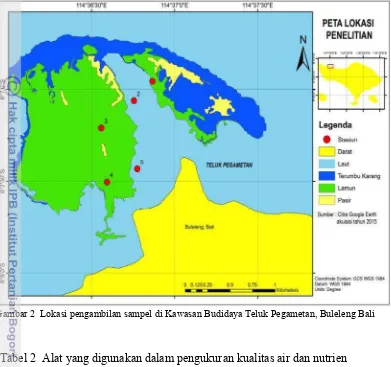
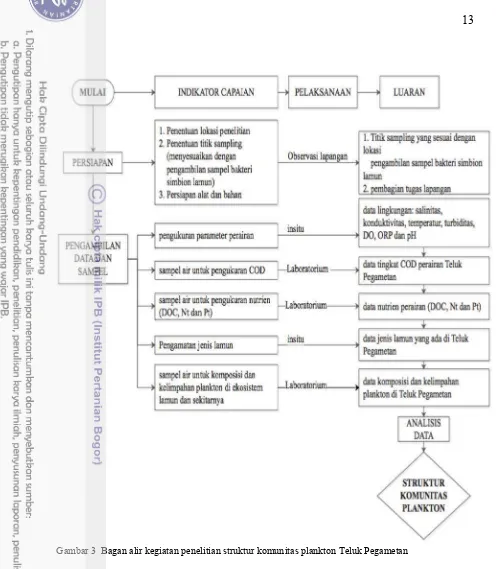
Lokasi penelitian berada di Teluk Pegametan, Kecamatan Gerokgak, Kabupaten Buleleng Bali (Gambar 2). Waktu pengambilan data pada bulan Juni 2014. Kawasan tersebut berupa teluk dengan aktivitas budidaya perikanan tinggi. Hal tersebut ditandai dengan banyaknya keramba-keramba untuk pembesaran ikan komersial. Pada bagian barat dari teluk terdapat gosong pasir dengan perairan yang cukup dangkal berkisar 0 – 5 meter. Pengambilan sampel menggunakan metode purposive sampling dan dilakukan di lima stasiun penelitian. Lokasi penyebaran lamun berdasarkan observasi berada di dekat gugusan karang penghalang, dekat keramba jaring apung dan di gosong pasir. Penelitian ini terdiri dari beberapa tahapan terstruktur (Gambar 3).
Alat dan Bahan Penelitian
Alat dan bahan pada penelitian ini digunakan untuk beberapa tahapan pengambilan data yaitu identifikasi spesies lamun, pengambilan data kualitas air, analisis data nutrien dan penangambilan data plankton. Jenis alat dan bahan yang diperlukan disajikan pada Tabel 2 dan 3.
Identifikasi Spesies Lamun
9
data (Burdick & Kendrick, 2006). Katalog morfologi dan kunci identifikasi yang digunakan untuk pengambilan sampel dan identifikasi lamun mengacu pada panduan Seagrass Taxonomy and Identification Keys (Kuo & den Hartog, 2001). Alat dan bahan yang digunakan dalam proses tersebut disajikan pada Tabel 3.
Gambar 2 Lokasi pengambilan sampel di Kawasan Budidaya Teluk Pegametan, Buleleng Bali
Tabel 2 Alat yang digunakan dalam pengukuran kualitas air dan nutrien
Parameter fisik kimia Satuan Alat
Temperatur ºC Water Quality Checker HANNA HI 9829 Konduktivitas mS.cm-1 Water Quality Checker HANNA HI 9829 Turbiditas FNU Water Quality Checker HANNA HI 9829 Salinitas PSU Water Quality Checker HANNA HI 9829
DO ppm Water Quality Checker HANNA HI 9829
COD mg.L-1 Spektrofotometer
ORP mV Water Quality Checker HANNA HI 9829
pH - Water Quality Checker HANNA HI 9829
N-tot mg.L-1 Spektrofotometer P-tot mg.L-1 Spektrofotometer
10
Pengambilan Data Kualitas Air
Pengukuran kualitas air dilakukan pada lima titik pengamatan, yang mengacu pada metode purposive sampling. Parameter yang diukur secara insitu meliputi salinitas, temperatur, turbiditas, konduktivitas, kelarutan oksigen atau
dissolved oxygen (DO), potensial redoks atau oxidation-reduction potential (ORP) dan pH. Pengukuran parameter kebutuhan oksigen kimiawi atau chemical oxygen demand (COD) dilakukan dengan mengambil sampel air laut sebanyak 500 mL. Sampel tersebut dianalisis di Laboratorium Kimia Universitas Pendidikan Ganesha menggunakan metode spektrometri refluks tertutup. Alat yang digunakan dalam pengukuran parameter kualitas air ditampilkan pada Tabel 2.
Analisis Data Nutrien
Jenis nutrien yang diukur adalah total N (N-tot), total P (P-tot) dan senyawa karbon organik terlarut atau dissolved organic carbon (DOC). Pengukuran dilakukan dengan mengambil sampel air di bawah permukaan (30 cm). Alat yang digunakan adalah water sampler dengan volume 1 L. Sampel dipreparasi menggunakan H2SO4 sebanyak 1 mL.L-1 sampel. Metode yang digunakan pada
analisis konsentrasi N-tot adalah APHA 2012 4500 N-C. Metode yang digunakan pada analisis P-tot adalah APHA 2012 4500 P-E. Kedua analisis tersebut dilakukan di Laboratorium ProLing IPB. Pada analisis konsentrasi DOC metode yang digunakan berdasarkan panduan dari Shimadzu TOC-L Analyzer dengan lima kali pengulangan dan dilakukan di Laboratorium Jurusan Analis Kimia Universitas Pendidikan Ganesha. Alat yang digunakan dalam pengukuran parameter kualitas air ditampilkan pada Tabel 2.
Tabel 3 Alat dan bahan identifikasi lamun dan pengambilan data plankton
Nama Alat dan Bahan Keterangan
Kamera Dokumentasi lokasi dan lamun
Panduan morfologi dan kunci identifikasi lamun
Identifikasi lamun
Planktonet Pengambilan sampel plankton Botol HDPE steril Penampung sampel air
Formalin 4% Pengawet
Kotak pendingin Penyimpanan sampel
Perahu Transportasi
Gelas counting chamber Identifikasi dan penghitungan kelimpahan plankton
Buku panduan Yamaji (1982) Identifikasi plankton
11
Pengambilan data Plankton
Pengamatan terhadap komposisi dan kelimpahan plankton pada ekosistem lamun dilakukan dengan mengambil sampel air laut di bawah permukaan. Sampel air berasal dari 5 stasiun yang dipilih secara purposive sampling. Sebarannya dari sekitar gugusan karang sampai hamparan padang lamun dan di sekitar aktivitas budidaya perikanan. Alat yang dipakai adalah Planktonet dengan diameter bukaan 30 cm, mesh size 30 µm. Planktonet ditenggelamkan sampai bukaan mulutnya berada 10-30 cm di bawah permukaan air, selanjutnya ditarik sejauh 30 m. Penenggelaman dilakukan karena pengambilan dilakukan pada siang hari antara pukul 11.00-14.00. Pada waktu tersebut untuk menghindari intensitas cahaya matahari dan suhu air terlalu tinggi, plankton akan mengapung di bawah permukaan air. Penarikan atau penyeretan dilakukan untuk mengumpulkan plankton pada areal yang lebih luas dan meningkatkan peluang pengumpulan berbagai spesies plankton. Sampel air bilasan ditampung dalam botol pengumpul pada bagian bawah planktonet. Sampel disimpan pada botol high density polyethilene (HDPE) dan diberi pengawet formalin 4% sebanyak 6 tetes pada setiap 100 mL sampel, dan disimpan dalam wadah kedap cahaya dan suhu yang rendah sampai saat identifikasi.
Proses identifikasi dan perhitungan jumlah plankton pada sampel dilakukan di Laboratorium Plankton P2O LIPI. Panduan yang digunakan untuk proses identifikasi adalah Yamaji (1982). Pada tahap persiapan sampel air dihomogenisasi selama 30 menit pada shaker. Kemudian diambil air sebanyak 1 mL secara acak, diteteskan pada gelas Counting Chamber. Pada proses identifikasi pembesaran yang digunakan berkisar antara 100x-400x. Pengamatan diulang sebanyak 3 kali sebagai konfirmasi jumlah. Kelimpahan adalah jumlah individu plankton pervolume air. Penentuan kelimpahan plankton dilakukan berdasarkan metode sapuan di atas gelas Counting Chamber. Kelimpahan plankton dihitung berdasarkan persamaan sebagai berikut (APHA 1989):
�= � � !" !" �
!
!" (1)
Analisis Data
Data yang dianalisis adalah struktur komunitas plankton dan kaitanya dengan karakteristik biofisik lingkungan. Alat analisis yang digunakan adalah analisis komponen utama atau principle component analysis (PCA), analisis
Dimana:
N = Jumlah sel (sel.L-1)
n = Jumlah sel yang teridentifikasi Vr = Volume air tersaring
Vo = Volume air yang diamati di Counting chamber
12
koresponden atau correspondence analysis (CA) dan analisis kelompok (cluster analysis).
PCA digunakan untuk menyederhanakan suatu data. Tehnik tersebut mentransformasikan data secara linier sehingga membentuk suatu sistem koordinat baru dengan varian maksimum. Hasil analisis digunakan untuk menunjukkan korelasi antar parameter salinitas, temperatur, turbiditas, konduktivitas, ORP, pH, COD dan nutrien. Hasil analisis juga memperlihatkan pengelompokan habitat yang mendeterminasi sumbu-sumbu optimum tempat variabel-variabel yang diukur diproyeksikan. Bengen (2000) menyatakan bahwa PCA bisa digunakan untuk mengasosiasikan peran deskriptif dalam batasan kuantitatif dan kualitatif. Analisis kelompok jarak Euclidean untuk mengetahui pengelompokan stasiun berdasarkan karakteristik lingkungan. Hasil analisis tersebut menggambarkan penciri kondisi lingkungan pada setiap stasiun.
13
14
HASIL DAN PEMBAHASAN
Hasil
Jenis Lamun Teridentifikasi
Ditemukan tiga jenis lamun di Teluk Pegametan yaitu: Enhalus acoroides,
Thalassia hemprichii dan Halophila ovalis (Gambar 4, 5 dan 6). Ketiga spesies tersebut merupakan famili Hydrocharitaceae. Hal tersebut berarti ketiganya merupakan kelompok lamun yang sepenuhnya hidup di dalam perairan. dari Secara umum lamun ditemukan di di stasiun 1, 3, 4 dan 5. E. acoroides ditemukan di seluruh stasiun tersebut, sedangkan T. hemprichii dan H. ovalis hanya ditemukan di stasiun 3 dan 4. Ketiga lamun tersebut bisa diklasifikasi sebagai berikut.
Kingdom : Plantae
Divisio : Magnoliophyta (Angiosperms) Class : Liliopsida
Sub-class : Alismatidae Order : Alismatales
Family : Hydrocharitaceae Genus : Enhalus
Species : Enhalus acoroides
Genus : Thalassia
Species : Thalassia hemprichii
Genus : Halophila
Species : Halophila ovalis
Gambar 4 Deskripsi Enhalus acoroides yang dikategorikan genus monotifik (den Hartog 2006 (A dan B; foto penelitian (C))
15
Karakteristik Fisik Kimia Perairan
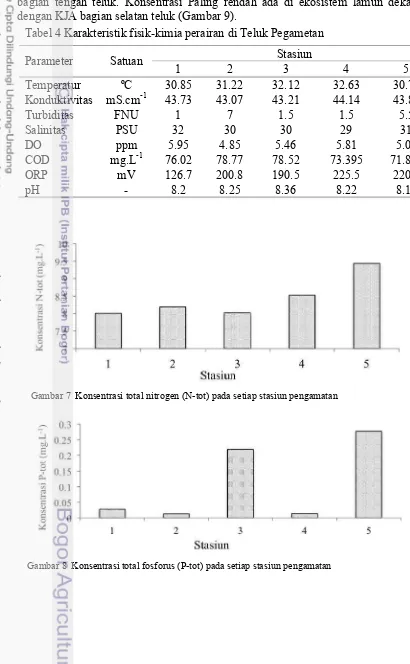
Teluk Pegametan adalah teluk yang semi tertutup dengan aktivitas budidaya perikanan yang tinggi. Pada bagian utaranya dibatasi oleh gugusan terumbu karang penghalang yang memanjang dari timur ke barat. Pada bagian baratnya terbentuk gosong pasir yang cukup luas. Membentang dari utara ke selatan sampai terhubung dengan daratan. Struktur tersebut pada bagian utara tersambung dengan gugusan terumbu karang di utara. Hal tersebut menyebabkan teluk berbentuk huruf C, karena bagian timur tidak ada penghalang. Karakteristik lingkungan perairan teluk ditandai dengan parameter fisik dan kimia (Tabel 4).
Konsentrasi Nutrien Perairan
Keberadaan nutrien diukur dari N-tot, P-tot dan DOC. N-tot cenderung merata konsentrasinya di semua stasiun, baik yang ada di areal lamun (stasiun 3, 4, 5), maupun di dekat karang (stasiun 1) dan perairan relatif dalam (stasiun 2). Konsentrasi tertinggi ada di stasiun 5 yang merupakan lokasi dekat keramba dengan substrat ditumbuhi lamun yang rapat (Gambar 7). Konsentrasi P-tot
Gambar 5 Deskripsi Thalassia hemprichii (den Hartog 2006 (A dan B); foto penelitian(C)).
A B C
Gambar 6 Deskripsi Halophila ovalis (den Hartog 2006 (A); SW 2015 (B); foto penelitian(C))
16
Gambar 7 Konsentrasi total nitrogen (N-tot) pada setiap stasiun pengamatan
Gambar 8 Konsentrasi total fosforus (P-tot) pada setiap stasiun pengamatan
bersifat fluktuatif, cenderung rendah (<0.05 mg.L-1) stasiun 1, 2 dan 4 dan tinggi di stasiun 3 dan 5 (Gambar 8).
Konsentrasi DOC stasiun 1 dan 2 lebih tinggi bila dibandingkan dengan stasiun 3, 4 dan 5. Paling tinggi di perairan relatif dalam dekat dengan KJA, bagian tengah teluk. Konsentrasi Paling rendah ada di ekosistem lamun dekat dengan KJA bagian selatan teluk (Gambar 9).
Tabel 4 Karakteristik fisik-kimia perairan di Teluk Pegametan
Parameter Satuan Stasiun
1 2 3 4 5
Temperatur ºC 30.85 31.22 32.12 32.63 30.72 Konduktivitas mS.cm-1 43.73 43.07 43.21 44.14 43.81
Turbiditas FNU 1 7 1.5 1.5 5.5
Salinitas PSU 32 30 30 29 31
DO ppm 5.95 4.85 5.46 5.81 5.06
COD mg.L-1 76.02 78.77 78.52 73.395 71.895
ORP mV 126.7 200.8 190.5 225.5 220.6
17
Gambar 9 Konsentrasi karbon organik terlarut atau dissolved oragnic carbon (DOC) pada setiap stasiun pengamatan
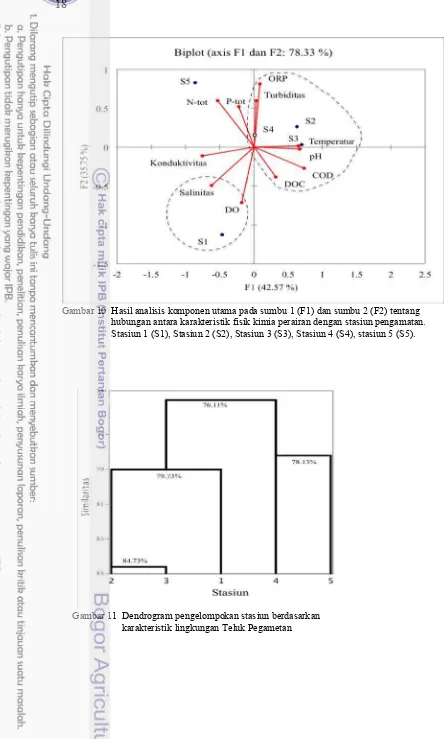
Hasil PCA menunjukkan hubungan antara karakteristik parameter fisik kimia dengan stasiun pengamatan. Hasil analisis terpusat pada dua sumbu utama dengan akar ciri kumulatif 78.33%. Nilai persentase tersebut menggambarkan nilai informasi yang bisa diperoleh. Gambar 10 menunjukkan terbentuk tiga kelompok keterkaitan antara parameter lingkungan dengan stasiun pengamatan. Kelompok pertama terdiri dari stasiun 2, 3 dan 4 yang terletak berdekatan dengan hamparan lamun dan KJA kluster besar. Kelompok tersebut dicirikan oleh nilai temperatur, COD, ORP dan pH yang tinggi. Penciri khusus pada kelompok ini seperti stasiun 2 ditandai dengan konsentrasi tinggi pada DOC dan turbiditas. Stasiun 3 dicirikan dengan konsentrasi fosforus yang tinggi. Konduktivitas stasiun 4 paling tinggi dibandingkan dengan stasiun yang lain.
Kelompok kedua berdasarkan karakteristik stasiun 1, dicirikan oleh DO dan salinitas yang tinggi. Stasiun berada di sebelah utara teluk, berdekatan dengan gugusan terumbu karang, substratnya pasir berwarna putih dan ditumbuhi oleh lamun. Kelompok ketiga berdasarkan karakteristik stasiun 5 dicirikan oleh konsentrasi N-tot dan P-tot yang tinggi. Lokasinya berada di sebelah selatan teluk dengan kedalaman 2-5 m dan dan dekat dengan KJA.
18
Gambar 10 Hasil analisis komponen utama pada sumbu 1 (F1) dan sumbu 2 (F2) tentang hubungan antara karakteristik fisik kimia perairan dengan stasiun pengamatan. Stasiun 1 (S1), Stasiun 2 (S2), Stasiun 3 (S3), Stasiun 4 (S4), stasiun 5 (S5).
19
Tabel 5 Kelimpahan dan komposisi komunitas plankton di Teluk Pegametan
Parameter Litoral Non-litoral
Dinoflagelata Diatom
Kelimpahan (%) 2.09 74.56 23.35
Jumlah Spesies 3 18 6
Kelimpahan dan Komposisi Plankton
Terdapat dua kelompok plankton yang teridentifikasi yaitu litoral dan non-litoral. Kelompok litoral didominasi oleh diatom dengan persentase mencapai 74.56%. Paling rendah kelimpahannya adalah kelompok dinoflagelata hanya 2.09%. Dominasi kelompok diatom tidak hanya dari kelimpahan juga dari jumlah spesies (Tabel 5). Persentase kelimpahan kelompok non-litoral mencapai 23.35%. Kelompok litoral terdiri dari kelas Chlorophyceae (Ankistrodesmus sp.,
Closterium sp. dan Spirogyra sp.), diatom (Synedra sp. dan Licmophora sp.) dan sianobakteria (Oscillatoria sp.). Berdasarkan habitat asalnya, kelompok tersebut bisa dikategorikan menjadi dua yaitu habitat laut lepas (Ankistrodesmus sp. dan
Licmophora sp.) dan habitat air tawar (Closterium sp., Oscillatoria sp.,
Closterium sp. dan Spirogyra sp.)
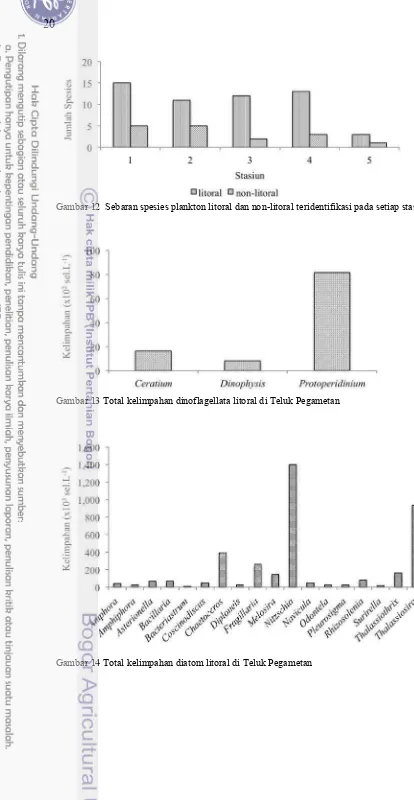
Teridentifikasi 27 spesies plankton litoral dan non-litoral di Teluk Pegametan, dan tersebar pada lima stasiun pengamatan (Gambar 12). Keragaman plankton teridentifikasi paling tinggi ada di stasiun 1 dengan 20 spesies. Kemudian berturut-turut stasiun 2 dan 4 (20 spesies), stasiun 3 (14 spesies) dan paling rendah di stasiun 5 (3 spesies).
Kelompok plankton dinoflagelata litoral di Teluk Pegametan hanya teridentifikasi 3 spesies yaitu Ceratium sp., Dinophysis sp. dan Protoperidinium
sp. Kelimpahannya kelompok tersebut tergolong rendah kecuali Protoperidinium
sp. (Gambar 13). Bahkan pada stasiun 5 sama sekali tidak ditemukan spesies dari kelompok tersebut. Ceratium sp. hanya ditemukan di staisun 1 dan 2 stasiun, sedangkan Dinophysis sp. hanya teridentifikasi di stasiun 3.
Kelompok diatom litoral teridentifikasi sebanyak 18 spesies, dengan kelimpahan tertinggi pada Nitzschia sp. (Gambar 14). Penyebaran kelompok ini merata dan ditemukan di seluruh stasiun pengamatan. Terdapat 6 spesies diatom yang kelimpahannya lebih dari 104 sel.L-1.
20
Gambar 14 Total kelimpahan diatom litoral di Teluk Pegametan Gambar 13 Total kelimpahan dinoflagellata litoral di Teluk Pegametan
Gambar 12 Sebaran spesies plankton litoral dan non-litoral teridentifikasi pada setiap stasiun
21
Gambar 15 Total kelimpahan plankton non-litoral di Teluk Pegametan
Hubungan antara karakteristik lingkungan dengan komposisi dan kelimpahan plankton
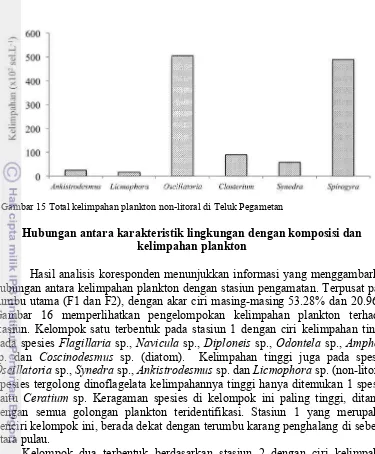
Hasil analisis koresponden menunjukkan informasi yang menggambarkan hubungan antara kelimpahan plankton dengan stasiun pengamatan. Terpusat pada sumbu utama (F1 dan F2), dengan akar ciri masing-masing 53.28% dan 20.96%. Gambar 16 memperlihatkan pengelompokan kelimpahan plankton terhadap stasiun. Kelompok satu terbentuk pada stasiun 1 dengan ciri kelimpahan tinggi pada spesies Flagillaria sp., Navicula sp., Diploneis sp., Odontela sp., Amphora
sp. dan Coscinodesmus sp. (diatom). Kelimpahan tinggi juga pada spesies
Oscillatoria sp., Synedra sp., Ankistrodesmus sp. dan Licmophora sp. (non-litoral). Spesies tergolong dinoflagelata kelimpahannya tinggi hanya ditemukan 1 spesies yaitu Ceratium sp. Keragaman spesies di kelompok ini paling tinggi, ditandai dengan semua golongan plankton teridentifikasi. Stasiun 1 yang merupakan penciri kelompok ini, berada dekat dengan terumbu karang penghalang di sebelah utara pulau.
Kelompok dua terbentuk berdasarkan stasiun 2 dengan ciri kelimpahan tinggi dari spesies Thalassiosira sp., Melosira sp., Asterionella sp., Coscinodiscus
sp., Pleurosigma sp. dan Surirella sp. (diatom). Kelimpahan tinggi juga ada pada spesies Spirogyra sp. dan Closterium sp. (non-litoral). Kelompok ini berada dekat dengan KJA besar tempat budidaya baramundi dan kerapu. Perairannya cukup dalam berkisar antara 15-20 m.
Kelompok tiga berdasarkan stasiun 3 dan 4 dengan ciri kelimpahan tinggi dari spesies Nitzschia sp., Chaetoceros sp., Thalassiothrix sp., Ampiphora sp.,
Bacteriastrum sp. dan Bacillaria sp. (diatom). Penciri kelimpahan tinggi juga pada spesies Dinophysis sp. dan Protoperidinium sp. Kelompok ketiga ini dicirikan oleh stasiun 4 dan stasiun 5. Kondisi lingkungannya dangkal, berpasir putih dan padang lamun yang tumbuh rapat. Kedua stasiun ini berada dekat dengan gosong pasir di sebelah barat teluk. Kelompok keempat berdasarkan karakter stasiun 5 yang dicirikan dengan kelimpahan tinggi dari spesies
22
Gambar 16 Analisis koresponden hubungan antara kelimpahan plankton dengan stasiun pengamatan pada sumbu 1 (F1) dan sumbu 2 (F2). Kode stasiun (S1 s/d S5),
Ceratium sp. (F1), Dinophysis sp. (F2), Protoperidinium (F3), Amphora sp. (Di1),
Amphiphora sp. (Di2), Asterionella sp. (Di3), Bacillaria sp. (Di4), Bacteriastrum sp. (Di5), Coscinodiscus sp. (Di6), Chaetoceros sp. (Di7), Diploneis sp. (Di8),
Fragillaria sp. (Di9), Melosira sp. (Di10), Nitzschia sp. (Di11), Navicula sp. (Di12),
Odontela sp. (Di13), Pleurosigma sp. (Di14), Rhizosolenia sp. (Di15), Surirella sp. (Di16), Thalassiothrix sp. (Di17), Thalassiosira sp. (Di18), Ankistrodesmus sp. (NL1), Licmophora sp. (NL2), Oscillatoria sp. (NL3), Closterium sp. (NL3), Synedra
sp. (NL4), Spirogyra sp. (NL6)
karakteristik perairan relatif dalam (2 - 5 m), dekat dengan KJA dan substrat yang ditumbuhi oleh lamun.
23
Pembahasan
Teluk Pegametan adalah kawasan yang topografinya semi-tertutup dan ada aktivitas budidaya yang intensif. Perairan di sebelah barat teluk cenderung dangkal karena ada gosong pasir. Lamun yang tumbuh pada lokasi tersebut dari jenis E. acoroides (dominan), T. hemprichii dan H. ovalis. Habitat seperti itu sangat baik untuk pertumbuhan berbagai jenis plankton, termasuk kelompok yang epifit. Borowitzka et al. (2006) menyatakan bahwa organisme yang kelimpahannya tinggi dan berasosiasi dengan ekosistem lamun adalah plankton.
Faktor utama yang mempengaruhi biomassa plankton di ekosistem lamun adalah keberadaan nutrien dan karakteristik lingkungan perairan. Pola peningkatan dan penurunan biomassanya sejalan dengan pola yang ditunjukkan oleh biomassa lamun (Burkholder et al. 2007). Karakteristik lingkungan yang diwakili oleh berbagai parameter terukur menunjukkan bahwa kualitas perairan teluk masih cukup baik, terutama untuk aktivitas budidaya. Tingkat ORP sebagai salah satu metode utama penentuan peruntukan kualitas air menunjukkan bahwa masih layak untuk kegiatan budidaya perikanan. Vasudevan & Kumar (2015) menyatakan nilai ORP berkisar antara 150 – 250 mV termasuk ke dalam peruntukan akuakultur. Keberadaan aktivitas budidaya menyumbang peningkatan kadar nutrien lingkungan, hasilnya terjadi peningkatan jumlah plankton di perairan (Wang et al. 2006b; Price et al. 2015).
Baden et al. (2010) menyatakan bahwa hamparan lamun yang mengalami kondisi eutrofikasi menyebabkan perubahan struktur plankton epifit. Sara et al.
(2011) menemukan bukti bahwa aktivitas budidaya perikanan menyumbang Gambar 17 Dendrogram pengelompokan stasiun berdasarkan
24
kenaikan konsentrasi N dan P di perairan dengan radius 1-10 km. Kenaikan konsentrasi kedua unsur tersebut menjadi penyebab peningkatan konsentrasi klorofil di perairan secara signifikan. Hal tersebut berpotensi merubah struktur komunitas plankton di ekosistem perairan.
Perbandingan hasil perhitungan menunjukkan variabilitas plankton terkait erat dengan karakteristik lingkungan. Secara geografis stasiun 3, 4, dan 5 lokasinya berdekatan dengan penciri utama ditumbuhi oleh lamun dan berada di bagian barat dan selatan teluk. Stasiun 1 berada di gugusan terumbu karang yang substratnya ditumbuhi juga oleh lamun. Pada stasiun 2 adalah perairan yang dalam dan dekat dengan aktivitas budidaya.
Komposisi plankton litoral di lokasi penelitian didominasi oleh diatom, dan kemudian dinoflagelata. Hal tersebut juga terjadi pada setiap stasiun pengamatan. Hal tersebut disebabkan kondisi lingkungan yang semi tertutup dan banyak aktivitas budidaya ikan. Ketersediaan ruang hidup yang terbatas, pergantian air tidak lancar dan masuknya bahan organik sisa budidaya menjadikan lingkungan Teluk Pegametan selektif bagi pertumbuhan spesies-spesies plankton. Faktor-faktor tersebut memicu terjadinya perubahan lingkungan dan secara langsung mempengaruhi variabilitas plankton (Xu et al. 2010; Sridhar et al. 2010; de Wit et al. 2012; Riniatsih et al. 2013).
Kelimpahan spesies plankton di ekosistem lamun Teluk Pegametan di dominasi oleh diatom litoral, plankton non-litoral dan dinoflagelata litoral. Dominasi diatom litoral sangat tinggi di kawasan ini, jauh lebih tinggi dibandingkan kelompok yang lain. Tingginya kelimpahan dan komposisi berkaitan dengan kondisi lokasi penelitian. Bentuk teluk yang semi tertutup menyebabkan karakteristik perairannya relatif seragam. Karakteristik seperti itu menyebabkan dominasi kelompok diatom (Ikpi et al. 2013; Akter et al. 2015).
Kelimpahan dinoflagelata litoral didominasi oleh Protoperidinium sp., sedangkan Ceratium sp. dan Dinophysis sp. cenderung lebih rendah. Toha (2004) juga berhasil mengdentifikasi ketiga spesies tersebut di pesisir Bangka Belitung dan Laut China Selatan, meskipun kelimpahannya relatif rendah. Gribble et al.
(2007) menemukan bahwa berbagai spesies Protoperidinium sp. memang banyak ditemukan di kawasan dekat pantai. Hal tersebut juga ditemukan pada penelitian ini. Kelimpahan paling tinggi ditemukan di stasiun 1 dan stasiun 4, dimana keduanya berada dekat dengan pantai. Runyan (2014) menemukan ada korelasi yang signifikan diantara ketiga spesies tersebut di perairan Puget Sound, Amerika Serikat. Faktor lingkungan yang berpengaruh adalah temperatur, nutrien dan intensitas matahari yang tinggi.
25
predator di sekitar mangsa. Fakta tersebut menyebabkan spesies tersebut mampu menemukan mangsa dengan efektif dan efisien (Amsler & Iken 2001).
Dinophysis sp. adalah salah satu plankton yang termasuk golongan HABs. Spesies ini hanya ditemukan di stasiun 3, dengan kelimpahan yang relatif kecil (815 sel.L-1). Keberadaannya pada stasiun tersebut disebabkan konsetrasi nutrien yang tinggi, yaitu P-tot (0.22 mg.L-1) dan DOC (22.98 mg.L-1). Kedua nutrien tersebut menjadi sumber energi untuk bertahan hidup dan berkembangbiak.
Dinophysis sp. Memiliki kemampuan untuk memproduksi metabolit Dendrotoksin
(DTX) dan asam okadaik atau okadaic acid (OA). DTX adalah toksin yang masuk dalam golongan neurotoksin. Senyawa tersebut sesuai dengan karakter plankton yang memiliki perilaku fagotrofi. Perilaku tersebut melisiskan sel untuk membunuh mangsa, predator dan kompetitor. Senyawa OA dalam jumlah banyak menyebabkan DSP (diarrethic shellfish poisoning) pada organisme yang lebih besar (Ignatiades & Gotsis-Scretas 2010). Wang et al. (2006a) menemukan spesies ini sering ditemukan di otot moluska dan menyebabkan DSP pada manusia. Berdasarkan pengamatan di lokasi penelitian dan informasi nelayan mengkonfirmasi bahwa stasiun 3 merupakan lokasi pencarian utama berbagai jenis kerang.
Kelompok diatom yang kelimpahannya lebih dari 104 sel.L-1 terdiri dari enam spesies yaitu Nitzschia sp., Thalassiosira sp., Chaetoceros sp., Flagillaria
sp., Thalassiothrix sp. dan Melosira sp. Spesies-spesies tersebut secara umum mendominasi kawasan pesisir, terutama daerah-daerah yang ada aktivitas budidaya (Garrido et al. 2014; George and Atakpa 2015; Akter et al. 2015). Konsentrasi nutrisi dan intensitas matahari menjadi faktor yang mendukung ketahanan hidup diatom di kawasan pesisir (Xu et al. 2010; Akter et al. 2015).
Morfologi diatom yang dilindungi oleh dinding sel menjadi faktor penting untuk bisa toleran terhadap perubahan lingkungan. Faktor itu juga yang menyebabkan diatom mampu unggul dalam menempati ruang hidup dan mendapatkan nutrisi. Diatom daerah tropis memiliki struktur (spikula, seta, dinding sel yang keras) dan pertahanan kimia yang berguna untuk bisa tetap bertahan hidup pada lingkungan yang banyak predator. Pertahanan kimia digunakan untuk bertahan dari predator yang lebih kecil, sedangkan pertahanan struktural dari predator yang lebih besar. Bahkan struktur dinding selnya mampu menyerap 30% radiasi UVB, sehingga bisa bertahan pada paparan sinar matahari yang tinggi (McClintock et al. 2001; Paul et al. 2001; Karentz 2001). Kemampuan menyerap radiasi UV disebabkan oleh kandungan senyawa
mycrosporin-like amino acids (MAAs) dalam sel plankton. Pada beberapa genus
Thalassiosira di antartika dan Thalassiosira sp. pada umumnya diketahui memiliki kemampuan menghasilkan senyawa tersebut. Senyawa tersebut mampu menyerap semua spektrum panjang gelombang UV. Semakin tinggi paparan UV dari sinar matahari maka produksi senyawa tersebut semakin meningkat (Karentz 2001).
Keberadaan plankton non-litoral yang tinggi juga berkaitan dengan aktivitas budidaya di dalam teluk. Dari enam jenis yang teridentifikasi terdapat dua spesies habitat dengan habitat asli di laut lepas (Ankistrodesmus sp. dan
Licmophora sp.), tiga spesies plankton air tawar (Closterium sp., Synedra sp. dan
26
klasifikasi morfologi keenam spesies tersebut termasuk dalam diatom (Licmophora sp. dan Synedra sp.), Chlorophyceae (Ankistrodesmus sp.,
Closterium sp. dan Spirogyra sp.) dan sianobacteria (Oscillatoria sp.).
Berdasarkan analisis kuantitatif memperlihatkan adanya hubungan yang erat dengan konsentrasi DOC, salinitas dan DO. Ketiga faktor tersebut menyebabkan plankton mampu menyesuaikan diri pada lingkungan yang kurang sesuai. DOC sebagai sumber nutrisi yang bisa langsung dimanfaatkan oleh plankton. Konsentrasi nutrisi yang tinggi menjadi sumber energi untuk hidup dan berkembangbiak. Karentz (2001) menemukan bahwa Ankistrodesmus sp. memiliki kemampuan memproduksi MAAs sebagai pelindung dari radiasi UV, seperti halnya Thalassiosira sp.
Oscillatoria sp. termasuk kedalam sianobakter, bakteri yang mampu berfotosintetik. Morfologinya berbentuk filamen dengan habitat asli air tawar, tetapi genera ini bersifat kosmopolitan. Bentuk seperti itu berkorelasi dengan kelimpahan di kawasan perairan yang relatif tenang. Diatom, koralit dan alga filamen mendominasi di kawasan dengan kondisi gelombang yang tenang. Memiliki toleransi yang luas terhadap kondisi lingkungan sehingga bisa hidup dimana saja, termasuk di ekosistem lamun (Kendrick and Burt 1997; Pinckney and Micheli 1998; Koch et al. 2006). Hamisi et al. (2004) menemukan kelimpahan yang tinggi spesies ini pada hamparan lamun pesisir Tanzania. Konsentrasi DOC, DO dan intensitas cahaya yang tinggi menjadi faktor penting bagi keberadaan spesies tersebut. Banyak laporan juga menyebutkan kelimpahan spesies ini cenderung tinggi pada kawasan-kawasan budidaya (Yang et al. 2014; George and Atakpa 2015; Akter et al. 2015). Kombinasi yang tepat antara ekosistem lamun, kawasan budidaya perikanan dan kondisi perairan yang tenang di Teluk Pegametan menyebabkan kelimpahan Oscillatoria sp. menjadi tinggi.
Famili Oscillatoriaceae diketahui sebagai sumber yang kaya dengan berbagai metabolit sekunder, termasuk senyawa lipid yang bersifat antibiotik.
Oscillatoria sp. kelimpahannya paling tinggi di stasiun 1 dan 4. Hasil overlay
analisis CA dan PCA memperlihatkan konsentrasi DO paling tinggi di kedua stasiun tersebut. Hal tersebut berkaitan dengan sifat dari Oscillatoria sp. yang atraktif terhadap DO tinggi. Amsler & Iken (2001) menyatakan bahwa atraktan dari spesies tersebut adalah karbondioksida, oksigen dan bikarbonat. Hal tersebut mengkonfirmasi bahwa kelimpahan Oscillatoria sp. berkorelasi positif dengan konsentrasi DO di perairan. Diketahui pula bahwa spesies ini mampu bertahan pada radiasi UV yang tinggi, karena mampu membentuk senyawa metabolit sekunder bernama biopterin glucoside (BG). Metabolit tersebut diproduksi banyak seiring dengan bertambahnya paparan sinar matahari (Karentz 2001).
27
Kelompok plankton non-litoral sebagai non-indigenous spesies menandakan bahwa semua aktivitas budidaya perikanan memberikan tekanan terhadap lingkungan teluk. Penambahan berbagai nutrien sebagai konsenkuensi budidaya dan aktivitas kapal untuk pengangkutan membuat kelimpahan plankton-plankton non-litoral menjadi tinggi. Hal tersebut membuat struktur komunitas plankton mengalami perubahan. Helsinki Commision (2009) dalam laporannya menyebutkan bahwa aktivitas perikanan dan penunjangnya memberikan tekanan terhadap lingkungan. Beragam aspek yang timbul adalah perubahan kualitas air, perubahan komunitas organisme, biotopik dan kehadiran spesies non-indigenous.
SIMPULAN DAN SARAN
Simpulan
Aktivitas budidaya dan kondisi teluk yang semi-tertutup menyebabkan terjadi perubahan karakteristik lingkungan. Hal tersebut mempengaruhi struktur komunitas plankton di Teluk Pegametan. Struktur komunitas plankton terdiri dari 27 spesies plankton, dengan kategori berdasarkan asalnya kelompok litoral dan non-litoral. Plankton litoral terdiri dari dua kelompok yaitu diatom dan dinoflagelata. Plankton non-litoral yang teridentifikasi di Teluk Pegametan berasal dari habitat laut lepas dan air tawar, termasuk kedalam tiga kelompok yaitu Chlorophyceae, diatom dan sianobacteria. Hasil penelitian ini menunjukkan karakteristik lingkungan yang berpengaruh besar terhadap struktur komunitas plankton di lingkungan seperti itu adalah ORP, pH, COD, DO dan salinitas. DOC sebagai sumber karbon dominan mempengaruhi kehadiran plankton non-litoral. Pengaruh karakteristik seperti itu memberikan tekanan terhadap lingkungan perairan dan menyebabkan perubahan struktur komunitas plankton. Ditandai dengan dominasi diatom yang tinggi, rendahnya komposisi dan kelimpahan dinoflagelata dan hadirnya spesies plankton non-litoral.
Saran
28
3
POTENSI ALGASIDA BAKTERI ENDOSIMBION LAMUN
E. acoroides
DAN
T. hemprichii
DARI TELUK PEGAMETAN
BULELENG BALI
Latar Belakang
Enhalus acoroides adalah spesies lamun dengan karakter habitat
sepenuhnya di laut. Termasuk kedalam salah satu genera yang berkembang di kawasan tropis. Pada semua habitat hidupnya hanya ditemukan satu spesies, sehingga tergolong kedalam genera monotifik (den Hartog, 2006; Waycott et al.
2006). Daunnya termasuk kedalam golongan lamun yang tidak memiliki struktur penegak, sehingga cenderung terkulai dan rebah. Ultrastrukturnya memperlihatkan lapisan kutikulanya hampir tidak ada atau sangat tipis (Kuo & den Hartog, 2006). Hal tersebut yang memungkinkan proses penyerapan nutrisi secara langsung dari perairan, dan interaksi yang sangat intens dengan berbagai mikroorganisme.
Habitat E. acoroides tersebar merata di kawasan-kawasan pesisir Indonesia. Terutama di daerah yang berpasir atau berlumpur dan bioturbasi tinggi. Persyaratan lain hidup spesies ini adalah memerlukan salinitas cenderung tinggi, sublitoral atas, antara air surut rata-rata perbani dan air surut rata-rata purnama. Daya tahan spesies tersebut cukup tinggi dengan tingkat kematian yang sangat rendah, tetapi tingkat pertumbuhannya juga sangat rendah. Hal tersebut bisa dilihat dari pertumbuhan rizomanya yang sangat lambat, hanya 3 cm/tahun. Dibandingkan dengan H. ovalis yang pertambahan panjang rizomanya mencapai 356 cm/tahun (Duarte et al. 2006). van Tussenbroek et al. (2006) menyatakan bahwa fase hidup Enhalus bisa mencapai 100 hari. Perilaku hidup spesies ini bukan sebagai pioner, tetapi tumbuh paling belakang dan kemudian mendominasi kawasan.
Thalassia hemprichii adalah spesies lamun dengan karakter habitat sepenuhnya di laut. Penyebarannya selalu berasosiasi dengan E. acoroides dan H.
ovalis. Termasuk kedalam salah satu genera yang berkembang di kawasan tropis. (den Hartog, 2006; Waycott et al. 2006; Orth et al. 2006). Daunnya termasuk kedalam golongan lamun memiliki struktur penegak. Morfologi seperti itu memungkinkan karena karakter asosiasinya dengan lamun yang lebih besar. Mikromorfologinya memperlihatkan lapisan kutikulanya hampir tidak ada atau sangat tipis (Kuo & den Hartog, 2006). Karakteristik seperti itu menyebabkan bisa menyerap nutrisi langsung dari perairan dan berinteraksi dengan mikroorganisme. Glumac & Curran (2016) menyatakan bahwa akar spesies tersebut sangat kuat, karena mampu menembus hingga 80 cm ke dalam sedimen. Hal tersebut menyebabkan mampu bertahan dari berbagai gangguan.