PENGARUH GRANULOCYTE-MACROPHAGE COLONY STIMULATING FACTOR DAN STEROID TERHADAP PERTUMBUHAN KERATINOSIT
SERTA NEOVASKULARISASI PADA PROSES PENYEMBUHAN LUKA
TESIS
Peneliti
ZAINUL NAÍM
Untuk Memenuhi Salah Satu Syarat Guna Memperoleh Gelar Spesialis Bedah Program Pendidikan Dokter Spesialis-1
DEPARTEMEN ILMU BEDAH FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA
Tesis : PENGARUH GRANULOCYTE
MACROPHAGE COLONY STIMULATING FACTOR DAN STEROID TERHADAP PERTUMBUHAN KERATINOSIT SERTA NEOVASKULARISASI PADA PROSES PENYEMBUHAN LUKA
Nama PPDS : Zainul Naím
Nomor CHS : 17414
Bidang Ilmu : Kedokteran/ Ilmu Bedah
Kategori : Bedah Plastik
TESIS INI TELAH DIPERIKSA DAN DISETUJUI OLEH
Pembimbing :
Dr. Eddy Sutrisno, SpBP Dr. Frank Bietra Buchari, SpBP NIP : 140 201 785 NIP: 140 377 549
Ketua Departemen Ilmu Bedah, Ketua Program Studi Ilmu Bedah,
Dr. Emir T Pasaribu, SpB(K) Onk Dr. Marshal, SpB. SpBTKV. NIP: 195 203 041 980 021 00 NIP: 196 103 161 986 111 001
SURAT KETERANGAN
Sudah diperiksa tesis penelitian
JUDUL PENGARUH GRANULOCYTE MACROPHAGE
COLONY STIMULATING FACTOR DAN STEROID TERHADAP PERTUMBUHAN KERATINOSIT SERTA NEOVASKULARISASI PADA PROSES PENYEMBUHAN LUKA
PENELITI : Dr. ZAINUL NAIM
DEPARTEMEN : ILMU BEDAH
INSTITUSI : FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN, SEPTEMBER 2011 KONSULTAN METODOLOGI PENELITIAN FAKULTAS KEDOKTERAN USU
TESIS PENELITIAN
JUDUL : PENGARUH GRANULOCYTE COLONY
STIMULATING FACTOR DAN STEROID TERHADAP PERTUMBUHAN KERATINOSIT SERTA NEOVASKULARISASI PADA PROSES PENYEMBUHAN LUKA
PENELITI : Dr. ZAINUL NAIM
NO. CHS : 17414
DEPARTEMEN : ILMU BEDAH
INSTITUSI : FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN, SEPTEMBER 2011 SEKSI ILMIAH DEPARTEMEN ILMU BEDAH USU
UCAPAN TERIMAKASIH
In order to be effective truth must penetrate
like an arrow---and that is likely to hurt....( Wei Wu Wei)
Segala Puji Bagi Allah SWT atas segala limpahan rezeki dan rahmatNya serta shalawat dan salam atas Rasulullah SAW, sehingga saya dapat menyelesaikan tesis ini, sebagai salah satu syarat dalam Program Pendidikan Dokter Spesialis bidang Ilmu Bedah di Fakultas Kedokteran Universitas Sumatera Utara Medan.
Rasa terimakasih saya sampaikan kepada semua pihak yang telah dengan tulus ikhlas membantu saya selama menjalani pendidikan dibidang ilmu bedah.
Kepada Ayahanda dan Bunda, Na’imuddin DP dan Salmiah Lubis, terimakasih dan hormat ananda persembahkan, atas limpahan kasih sayang, kesabaran, pengorbanan, didikan, nasehat, inspirasi dan doá tiada henti buat ananda. Buat Ayah dan Ibu mertua, H. Darwis dan Hj. Asiar ,serta Abangda Ir. H. Mohd. Hidayat, terimakasih atas pengertian dan segala bantuannya.
Kepada Abangda Dr. Frank Bietra Buchari. Sp.BP selaku pembimbing dalam tesis ini, terimakasih atas dukungan, masukan, bimbingan, nasehat dan kesabarannya selama saya belajar dan mengerjakan tesis ini.
Kepada Dr. Edy Sutrisno, SpBP selaku pembimbing, saya ucapkan terima kasih atas kesediaannya sehingga saya dapat melaksanakan penelitian ini.
Buat Dr. Utama A. Tarigan, Sp.BP, terima kasih atas masukan teknik pelaksanaan penelitian dan juga buat diskusinya. Ucapan terimakasih untuk Dr. M. Djailani, Sp.BP---yang mengatakan pada saya,” dalam mencoba sesuatu hal, jangan takut gagal”---terimakasih atas dorongan moril dan semangat selama saya menjalani pendidikan.
Kepada yang terhormat Prof. Dr. H. Aznan Lelo, PhD, SpFK sebagai pembimbing dan konsultan statistik serta Dr. H. Soekimin, Sp.PA (K) sebagai pembimbing dan konsultan bidang histopatologi, saya ucapkan terima kasih atas bimbingan dan segala dukungan.
Herman Hariman PhD, SpPK dan Prof. Dr. H. Achmad Effendi, AAI terima kasih atas pelajaran dan perhatiannya. Semoga di hari depan kita bisa lebih sukses dalam mengerjakan prosedur stem cell transplantasi ini, suatu kehormatan bagi saya mengenal dan belajar dari Dokter sekalian.
Rasa hormat dan terima kasih saya sampaikan kepada para guru saya ; Prof. Dr. Bachtiar Surya SpB.KBD. Dr. Syahbudin Harahap SpB. Prof. Dr. Hafas Hanafiah SpB, SpOT(K), FICS. Prof. DR. Dr. Iskandar Djapardy SpBS. Prof. Dr. Gofar Sastrodiningrat SpB,SpBS. Prof. Dr. Nazar Moesbar SpB, SpOT(K). Dr. Asmui Yosodihardjo SpB,SpBA. Dr. Harry Soedjatmiko SpB,SpBTKV. Prof. Dr. Adril Arsyad Hakim SpBS(K), SpS. Dr. Bungaran Sihombing SpU. Dr. Djafar Tarigan SpB.KBD. Dr. Azwarto Lubis SpB. Dr. Ramotan Purba SpB, Dr. Mahyono SpB,SpBA. Dr. Suhelmi SpB. Dr. M. Manan SpOT, Dr. Liberti Sirait SpB,KBD. Dr. Adi Muradi Muhar SpB.KBD. Prof. Dr. Usul M Sinaga SpB (alm), Prof. Dr. Buchari Kasim SpB,SpBP (alm). Dr. Djeni Bijantoro SpB,SpBA. Dr. A. Rasjidi Siregar SpB. Dr. Riahsyah Damanik SpB(K)Onk. DR. Dr. Humala Hutagalung SpB(K)Onk. Dr.Gerhard ST Panjaitan SpB(K)Onk, Dr.Suyatno SpB(K)Onk. Dr. Otman Siregar, SpOT(K)spine. Dr.Chairiandi Siregar SpOT. Dr. Albiner Simarmata SpB(K)Onk. Dr. Doddy Prabisma SpBTKV. Dr. Ridha Dharmajaya SpBS Dr. Syah Mirsya Warli SpU. Dr. Budi Irwan SpB.KBD. Dr. Aswadi Tanjung SpB.SpBV. Dr. Suzy Sp.BS dan lain-lain yang tidak dapat saya sebutkan satu persatu, yang telah memberikan koreksi dan bimbingan selama saya menjalani pendidikan.
Saya ucapkan terima kasih kepada yang terhormat Dr. Emir Taris Pasaribu SpB(K)Onk selaku Kepala Bagian Departemen Ilmu Bedah FK USU/RS HAM. Dr Marshal SpB. SpB TKV selaku Ketua Program Pendidikan Dokter Spesialis Ilmu Bedah FK USU/RS HAM. Dr. Erjan Fikri SpB. SpBA selaku Sekretaris Departemen Ilmu Bedah FK USU/RS HAM. Dr. Asrul Simangunsong SpB.KBD selaku Sekretaris Program pendidikan Dokter Spesialis Ilmu Bedah FK USU/RS HAM.
Kepada sahabat ‗seperjuangan‘ Dr. Samson Sembiring, Dr. Bambang
Kepada seluruh dokter, dokter muda dan para medik di instalasi bedah RSUP. H. Adam Malik Medan, RSU. Dr. Pirngadi Medan, RSUD Sipirok, RSUD Panyabungan dan RSUD Blangkejeren, saya ucapkan terimakasih atas kerjasamanya demikian pula staf SMF Bedah RSUP. HAM/RSPM dan laboratorium Patologi Anatomi FK USU, saya ucapkan terima kasih.
Untuk kesabaran, pengorbanan, kesetiaan, pengertian dan segenap rasa cinta dari yang terkasih ..., istriku Dr. Siti Chadijah,---so much thank you for saving all your love for me, with your hand resting in mine, I feel the power so divine...---rasa syukur dan terima kasih yang tak terhingga ku ucapkan. Demikian pula buat dua putri kecil ku, Nawan---Sayangku, demikian bangganya Ayah karena mempunyai putri sepertimu---dan Sophie--- apapun adanya dirimu Sayangku, dengan segenap jiwa, Ayah sangat mencintaimu, ini dari Ayah,....untuk Sophie...---ku ucapkan terima kasih, untuk segalanya.
Tak lupa pula untuk kedua adikku Khairun Na’im S.H dan Hafizah Na’im SPd, ku ucapkan terima kasih atas dorongan semangat yang diberikan.
Akhirnya, kepada semua pihak yang telah membantu saya, yang tak dapat saya sebutkan, saya mengucapkan terima kasih. Semoga Allah memberikan limpahan rahmatNya. Insya Allah.
Medan, September 2011
DAFTAR SINGKATAN
AP : Activator protein. C : Complement.
CD : Cluster differentiated. DNA : Deoxyribonucleic acid. EGF : Epidermal growth factor. FGF : Fibroblast growth factor.
G-CSF : Granulocyte-colony stimulating factor.
GM-CSF : Granulocyte-macrophage colony stimulating factor. HE : Hematoxyllin-eosin.
IFN : Interferon.
IGF : Insulin like growth factor. IL : Interleukin.
M-CSF : Macrophage-colony stimulating factor. MMPs : Metallomatrixproteinase.
mRNA : Mesenger Ribonucleic acid. NF : Nuclear factor.
PDGF : Platelet derived growth factor. rh : Recombinant human.
STAT : Signal transduction and activation of transcription. TGF : Transforming growth factor.
DAFTAR ISI
Halaman
LEMBAR PENGESAHAN TESIS ... i
LEMBAR PERNYATAAN ... iv
UCAPAN TERIMAKASIH ... v
DAFTAR SINGKATAN ... viii
DAFTAR ISI ---- ... ix
DAFTAR GAMBAR ... xi
ABSTRAK --- ... xii
BAB 1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Kontribusi Penelitian ... 4
BAB 2. TINJAUAN PUSTAKA ... 5
2.1 Luka ... 5
2.2 Penyembuhan Luka ... 5
2.3 Tahapan Penyembuhan Luka ... 5
2.4 Peranan Sitokin ... 7
2.5 GM-CSF ... 9
2.6 Keratinosit dan Proses Penyembuhan Luka ... 10
2.7 Inhibitor GM-CSF ... 12
BAB 3. METODOLOGI PENELITIAN ... 15
3.1 Rancangan Penelitian ... 15
3.2 Lokasi dan Waktu Penelitian ... 15
3.3 Objek Penelitian ... 15
3.4 Kriteria Inklusi, Ekslusi dan Drop out ... 16
3.5 Identifikasi Variabel Penelitian ... 16
3.6 Pelaksanaan Penelitian ... 17
3.7 Besar Sampel ... 19
3.8 Analisa Data ... 19
3.9 Definisi Operasional ... 19
3.10 Kerangka Konsep ... 20
3.11 Alur Penelitian ... 20
BAB 4. HASIL PENELITIAN ... 21
4.1 Pertumbuhan Keratinosit ... 21
4.2 Pertumbuhan Pembuluh Darah ... 22
BAB 6. KESIMPULAN DAN SARAN ... 37
6.1. Kesimpulan ... 37
6.2 Saran ... 37
DAFTAR GAMBAR
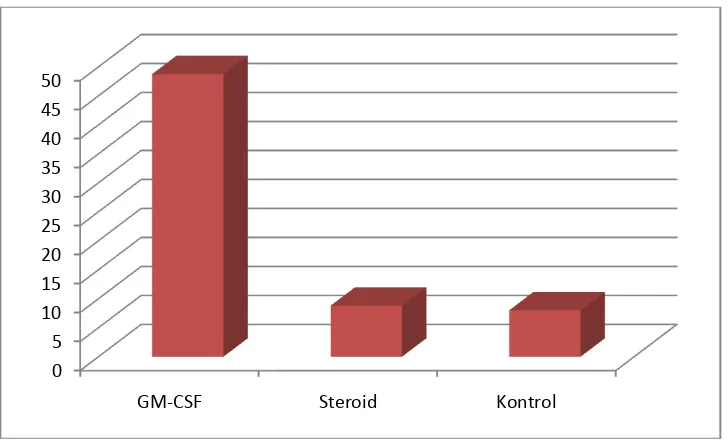
Gambar 1. Grafik rata-rata pertumbuhan keratinosit antar kelompok ... 21
Gambar 2. Grafik rata-rata pertumbuhan neovaskular antar kelompok ... 22
Gambar 3. Gambar histologi keratinosit pada kelompok rhGM-CSF ... 23
Gambar 4. Gambar histologi keratinosit pada kelompok dexamethasone ... 24
Gambar 5. Gambar histologi keratinosit pada kelompok kontrol ... 25
Gambar 6. Gambar histologi neovaskular pada kelompok rhGM-CSF ... 26
Gambar 7. Gambar histologi neovaskular pada kelompok dexamethasone ... 27
ABSTRAK
Latar belakang : Granulocyte-macrophage colony stimulating factor adalah faktor pertumbuhan multipoten yang memainkan peranan penting dalam proses penyembuhan luka. Merupakan kelompok sitokin yang berperan dalam regulasi proliferasi, komunikasi dan diferensiasi berbagai sel agar mempunyai kapasitas dan fungsi terspesialisasi, GM-CSF bertanggung jawab atas proliferasi granulosit dan makrofag yang mengawali proses penyembuhan luka.
Objektif : Tujuan dari penelitian ini adalah untuk melihat pengaruh pemberian rhGM-CSF perilesi pada luka artifisial guna mengakselerasi kecepatan penyembuhan luka dengan pembanding dexamethason dan kelompok kontrol.
Metode : Mencit (Mus musculus) dengan luka artifisial full thickness dibagi dalam 3 kelompok: A (n=4) menerima rhGM-CSF 10µg/kg, B (n=4) menerima dexamethason 10 mg/kg dan C (n=5) sebagai kontrol. Rekombinan GM-CSF dan dexamethason diberikan selama 6 hari,dan pada hari ke 7 kesemua hewan coba dieuthanasia. Luka dieksisi pada batas 4 mm dari pinggir luka kemudian dilakukan pemeriksaan histologis untuk perhitungan keratinosit dan neovaskular.
Hasil : Data yang didapat menunjukkan hasil pengaruh positif pemberian rhGM-CSF peri lesi subkutan terhadap pertumbuhan keratinosit dan neovaskular (p=0.001) dibanding dexamethason dan kontrol. Tidak didapat perbedaan signifikan antara kelompok dexamethason dan kontrol dalam pertumbuhan keratinosit (p=0,085) serta pertumbuhan neovaskular (p=0,935).
Kesimpulan : Terdapat pertumbuhan keratinosit dan neovaskular yang lebih nyata pasca penyuntikan rhGM-CSF dibanding pasca penyuntikan dexamethason dan kontrol serta tidak dijumpai perbedaan pertumbuhan keratinosit dan neovaskular pada kelompok dexamethason dan kontrol.
ABSTRACT
Background: The granulocyte-macrophage colony stimulating factor is a multipotent growth factor that plays an important role in wound healing process. It is a group of cytokines that play a role in the regulation of proliferation, and differentiation of various cell communication in order to have the capacity and specialized functions, GM-CSF is responsible for the proliferation of granulocytes and macrophages that initiate the wound healing process.
Objective: The purpose of this study was to see the effect of rhGM-CSF perilesion subcutaneously on artificial wounds in order to accelerate the speed of wound healing by comparison dexamethason and control groups.
Methods: Mice (Mus musculus) with artificial wounds full thickness divided into 3 groups: A (n = 4) received rhGM-CSF 10μg/kg, B (n = 4) received dexamethason 10 mg / kg and C (n = 5) as control. Recombinant GM-CSF and dexamethason given for 6 days, and at day 7 all these animal euthanized. Wounds excised at 4 mm from the edge of the wound was then performed for histologic examination and calculation neovascular and keratinocytes.
Results: The data obtained showed a positive effect of rhGM-CSF on the growth neovascular and keratinocytes (p = 0.001) than dexamethason and control. Not obtained significant differences between dexamethason and control groups in growth of keratinocytes (p = 0.085) and neovascular (p = 0.935).
Conclusion: There is growth of keratinocytes and neovascular more tangible after the injection of rhGM-CSF compared to post-injection dexamethason and control and found no difference in the growth of keratinocytes and neovascular on dexamethason and control groups.
ABSTRAK
Latar belakang : Granulocyte-macrophage colony stimulating factor adalah faktor pertumbuhan multipoten yang memainkan peranan penting dalam proses penyembuhan luka. Merupakan kelompok sitokin yang berperan dalam regulasi proliferasi, komunikasi dan diferensiasi berbagai sel agar mempunyai kapasitas dan fungsi terspesialisasi, GM-CSF bertanggung jawab atas proliferasi granulosit dan makrofag yang mengawali proses penyembuhan luka.
Objektif : Tujuan dari penelitian ini adalah untuk melihat pengaruh pemberian rhGM-CSF perilesi pada luka artifisial guna mengakselerasi kecepatan penyembuhan luka dengan pembanding dexamethason dan kelompok kontrol.
Metode : Mencit (Mus musculus) dengan luka artifisial full thickness dibagi dalam 3 kelompok: A (n=4) menerima rhGM-CSF 10µg/kg, B (n=4) menerima dexamethason 10 mg/kg dan C (n=5) sebagai kontrol. Rekombinan GM-CSF dan dexamethason diberikan selama 6 hari,dan pada hari ke 7 kesemua hewan coba dieuthanasia. Luka dieksisi pada batas 4 mm dari pinggir luka kemudian dilakukan pemeriksaan histologis untuk perhitungan keratinosit dan neovaskular.
Hasil : Data yang didapat menunjukkan hasil pengaruh positif pemberian rhGM-CSF peri lesi subkutan terhadap pertumbuhan keratinosit dan neovaskular (p=0.001) dibanding dexamethason dan kontrol. Tidak didapat perbedaan signifikan antara kelompok dexamethason dan kontrol dalam pertumbuhan keratinosit (p=0,085) serta pertumbuhan neovaskular (p=0,935).
Kesimpulan : Terdapat pertumbuhan keratinosit dan neovaskular yang lebih nyata pasca penyuntikan rhGM-CSF dibanding pasca penyuntikan dexamethason dan kontrol serta tidak dijumpai perbedaan pertumbuhan keratinosit dan neovaskular pada kelompok dexamethason dan kontrol.
ABSTRACT
Background: The granulocyte-macrophage colony stimulating factor is a multipotent growth factor that plays an important role in wound healing process. It is a group of cytokines that play a role in the regulation of proliferation, and differentiation of various cell communication in order to have the capacity and specialized functions, GM-CSF is responsible for the proliferation of granulocytes and macrophages that initiate the wound healing process.
Objective: The purpose of this study was to see the effect of rhGM-CSF perilesion subcutaneously on artificial wounds in order to accelerate the speed of wound healing by comparison dexamethason and control groups.
Methods: Mice (Mus musculus) with artificial wounds full thickness divided into 3 groups: A (n = 4) received rhGM-CSF 10μg/kg, B (n = 4) received dexamethason 10 mg / kg and C (n = 5) as control. Recombinant GM-CSF and dexamethason given for 6 days, and at day 7 all these animal euthanized. Wounds excised at 4 mm from the edge of the wound was then performed for histologic examination and calculation neovascular and keratinocytes.
Results: The data obtained showed a positive effect of rhGM-CSF on the growth neovascular and keratinocytes (p = 0.001) than dexamethason and control. Not obtained significant differences between dexamethason and control groups in growth of keratinocytes (p = 0.085) and neovascular (p = 0.935).
Conclusion: There is growth of keratinocytes and neovascular more tangible after the injection of rhGM-CSF compared to post-injection dexamethason and control and found no difference in the growth of keratinocytes and neovascular on dexamethason and control groups.
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Luka yang tidak sembuh dalam waktu yang lama, dengan berbagai etiologi merupakan masalah yang sering ditemukan dalam berbagai disiplin ilmu kedokteran. Kejadian ini salah satu sumber utama morbiditas, meningkatkan angka mortalitas, penyebab kerusakan psikologis bagi para penderita, meningkatkan anggaran biaya pengobatan, kehilangan jam kerja pada penderita dalam usia produktif.
Penyembuhan luka secara perdefinisi adalah perbaikan atau penyusunan kembali jaringan/organ yang rusak, terutama kulit. Adanya luka akan mengaktifkan proses sistemik yang merubah fungsi fisiologi yang dapat melampaui kondisi lokal pada daerah yang mengalami luka.
Penyembuhan luka pada kulit merupakan kondisi yang kompleks, mencakup berbagai respon terhadap cedera. Secara umum penyembuhan luka menunjukkan respon organisme terhadap kerusakan fisik jaringan /organ serta usaha pengembalian kondisi homeostasis sehingga tercapai kestabilan fisiologi jaringan atau organ yang ditandai dengan terbentuknya epitel yang fungsional diatas daerah luka. (Gurtner,2007; Mann .dkk.,2001).
penyusunan kembali jaringan yang cedera. Diawali dari serangkaian proses penting yaitu koagulasi, inflamasi, proliferasi dan migrasi sel, angiogenesis, sintesis matriks, remodeling dan kontraksi luka (Martin 1997, Stadelmann dkk.,1998; Baker Leaper, 2000; Mann .dkk 2006).
Berbagai sel terlibat dalam penyembuhan luka yaitu makrofag, limfosit, fibroblas, sel endotelial, dan sel dendritik yang mensintesis granulocyte-macrophage colony stimulating factor (GM-CSF). GM-CSF merupakan sitokin dan faktor
pertumbuhan multipoten yang berperan penting selama proses penyembuhan luka, memberikan pengaruh pada tahap inflamasi, reepitelisasi, dan neovaskularisasi. Kegagalan pada salah satu proses ini akan mengakibatkan kegagalan penyembuhan luka (Gurtner., 2007, Hunt .,2003; Mann . dkk.,2001;Mann .,2006). Stagno (1999) menunjukkan GM-CSF memberi efek yang menguntungkan ketika diberikan pada ulkus kronik. Kaplan (1992) melaporkan pemberian GM-CSF intradermal pada penderita lepra dengan lesi kulit memberi efek percepatan penyembuhan luka dan meningkatkan jumlah lapisan keratinosit. Amrit Mann (2006) melaporkan efek positif GM-CSF pada tikus trans genik.
(1999) mendapatkan bahwa fluticasone propionate dan budesonid adalah inhibitor yang lebih poten dari dexamethason dalam menghambat GM-CSF.
1.2. Perumusan Masalah
Apakah penyembuhan luka dapat dipengaruhi dengan pemberian injeksi perilesi sediaan rhGM-CSF dan dexamethasone pada hewan percobaan tikus yang dibuat luka artifisial dan dapat menghambatnya?
1.3. Hipotesis
Pemberian injeksi perilesi sediaan rhGM-CSF dapat mempercepat penyembuhan luka dengan menggalakkan pertumbuhan keratinosit dan neovaskularisasi, sedang dexamethason dapat menghambat penyembuhan pada hewan percobaan tikus.
1.4. Tujuan Penelitian
Untuk melihat perbedaan kecepatan penyembuhan pada luka yang diberikan injeksi perilesi sediaan rhGM-CSF dengan yang tidak diberikan.
1.5. Kontribusi Penelitian
BAB II
TINJAUAN KEPUSTAKAAN
2.1. Luka
Luka adalah terputusnya kontinuitas atau hubungan anatomis jaringan sebagai akibat dari ruda paksa. Luka dapat merupakan luka yang sengaja dibuat untuk tujuan tertentu, seperti luka insisi pada operasi atau luka akibat trauma seperti luka akibat kecelakaan (Hunt,2003; Mann ,2001).
2.2. Penyembuhan luka
Respon organisme terhadap kerusakan jaringan/organ serta usaha pengembalian kondisi homeostasis sehingga dicapai kestabilan fisiologis jaringan atau organ yang pada kulit terjadi penyusunan kembali jaringan kulit ditandai dengan terbentuknya epitel fungsional yang menutupi luka (Regauer,Compton; 1990, Stricklin dkk,1994).
2.3. Tahapan penyembuhan luka
Tanpa memandang penyebab, tahapan penyembuhan luka terbagi atas : Fase koagulasi : setelah luka terjadi, terjadi perdarahan pada daerah luka yang diikuti dengan aktifasi kaskade pembekuan darah sehingga terbentuk klot hematoma. Proses ini diikuti oleh proses selanjutnya yaitu fase inflamasi.
degranulasi, melepaskan faktor pertumbuhan seperti platelet derived growth factor (PDGF) dan transforming growth factor ß(βTGF), granulocyte colony stimulating factor (G-CSF), C5a, TNFα, IL-1 dan IL-8. Leukosit bermigrasi menuju daerah luka.
Terjadi deposit matriks fibrin yang mengawali proses penutupan luka. Proses ini terjadi pada hari 2-4.
Fase proliperatif : Fase proliperatif terjadi dari hari ke 4-21 setelah trauma. Keratinosit disekitar luka mengalami perubahan fenotif. Regresi hubungan desmosomal antara keratinosit pada membran basal menyebabkan sel keratin bermigrasi kearah lateral. Keratinosit bergerak melalui interaksi dengan matriks protein ekstraselular (fibronectin,vitronectin dan kolagen tipe I). Faktor proangiogenik dilepaskan oleh makrofag, vascular endothelial growth factor (VEGF) sehingga terjadi neovaskularisasi dan pembentukan jaringan granulasi.
2.4. Peranan Sitokin.
Sel-sel yang bersirkulasi dalam darah manusia mempunyai masa hidup yang pendek dan memerlukan proses pergantian yang terus menerus. Proses pembentukan sel dalam darah yang dinamakan hematopoiesis melibatkan proses yang sangat kompleks dikarenakan berbagai macam jenis sel yang harus dibentuk. Hematopoiesis juga mempunyai kemampuan penyesuaian yang sangat cepat dalam pengaturan campuran komposisi sub-set selular yang beredar dalam darah manakala tubuh berhadapan dengan berbagai kondisi seperti infeksi, kondisi sitotoksik akibat efek samping obat-obatan dan lain sebagainya. Kesemua berbagai jenis sel ini muncul dari sekumpulan kecil sel induk pluripoten yang bereaksi terhadap rangsangan spesifik. Proses diferensiasi sel induk menjadi berbagai jenis sel yang mempunyai fungsi terspesialisasi mempunyai ketepatan dan kontrol selular multipoint yang sangat tinggi dan bekerja secara tumpang tindih. Gangguan pada mekanisme ini mengakibatkan berbagai kondisi klinis dari anemia hingga leukemia.
Sel induk pluripoten yang bereaksi terhadap berbagai rangsangan spesifik, akan membelah, berdiferensiasi dan mengalami proses kematangan menjadi sub set sel dewasa dengan kemampuan yang terspesialistik. Berbagai bahan yang bekerja untuk stimulasi dibentuk oleh sel dibawah pengaruh berbagai situasi dan kondisi stress untuk mempertahankan kondisi homeostasis dalam sistem imunitas. Bahan
ini untuk memproduksi fungsi yang diinginkan—seperti interleukin yang bekerja mempengaruhi leukosit dan limfokin yang disekresi oleh limfosit dan monokin yang berhubungan dengan monosit dan makrofag.
Aksi sitokin sangat luas dalam mengatur intensitas dan durasi respon imunitas dengan cara aktivasi dan inhibisi, proliferasi dan/atau diferensiasi sel yang terlibat dalam pembentukan respon imunitas dan juga dalam proses sekresi antibodi ataupun jenis sitokin lainnya.
Sitokin yang membantu pertumbuhan dan proliferasi koloni sel hematopoietik dalam sel-sel darah dinamakan colony stimulating factor (CSF). CSF adalah glikoprotein asidik dan telah diklasifikasikan berdasar tipe sel matur yang dihasilkan koloni, yaitu :
a. Interleukin 3 (IL-3)—menstimulasi stem sel untuk memproduksi semua bentuk sel hematopoietik.
b. Macrophage colony stimulating factor (M-CSF)—beraksi pada jalur sel makrofag.
c. Granulocyte colony stimulating factor (G-CSF)---beraksi pada jalur sel granulosit.
d. Granulocyte-Macrophage colony stimulating factor (GM-CSF)
Rentang masa hidup kebanyakan sel-sel darah sangat singkat. Apabila tubuh tidak dapat membentuk sel darah baru yang sehat pada kecepatan yang dibutuhkan, infeksi yang mengancam jiwa, perdarahan atau anemia berat dapat terjadi. Kondisi seperti ini dapat juga terjadi akibat kemoradiasi kanker, transplantasi sum-sum tulang maupun kondisi buruk lainnya. Aktifitas dari berbagai faktor stimulasi pertumbuhan ini akan menjadi lebih luas bila berinteraksi dengan faktor lainnya.(Ghosh,K.P.,2007).
2.5. GM-CSF
Merupakan faktor pertumbuhan berupa polipeptida dengan berat 20 kDa yang pada mulanya diidentifikasi sebagai regulator penting pada proliferasi, maturasi, dan aktifasi fungsional granulosit neutrofilik. Diproduksi secara luas oleh berbagai jenis sel seperti monosit, sel vaskular endotelial, fibroblas dan sel mesotel. Pada orang dewasa yang sehat, kadar GM-CSF yang bersirkulasi < 30 pg/ml. Bagaimanapun pada keadaan stress biologi seperti infeksi sistemik GM-CSF mencapai kadar 2000 pg/ml. Rekombinan GM-CSF sekarang secara rutin digunakan bagi kepentingan klinik untuk meningkatkan jumlah leukosit yang bersirkulasi setelah kemoterapi atau memobilisasi sel progenitor pada transplantasi sum-sum tulang (Brem,dkk;2000., Ting dkk;2008)
intradermal pada penderita lepra dengan lesi kulit memberi efek percepatan penyembuhan luka dan meningkatkan jumlah dan lapisan keratinosit (Kaplan dkk,1992). Efek yang menguntungkan dari aplikasi GM-CSF adalah peningkatan proliferasi keratinosit. Amrit Mann dkk (2006), menunjukkan efek positif GM-CSF pada tikus trans genik yang diberikan GM-CSF (Kaplan dkk;1992,Gurtner,2007; Hunt,2003, Mann. dkk,2001). Ure (1998) menyatakan GM-CSF tidak memberikan efek yang menguntungkan ketika diberikan pada luka yang menunjukkan penyembuhan normal.
2.6. Keratinosit dan proses penyembuhan luka
Keratinosit adalah sel epitel bertanduk. Terdapat pada stratum korneum kulit. Stratum korneum mengandung sel-sel tanduk pipih tanpa inti yang sitoplasmanya
terisi oleh skleroprotein filamentosa ―birefringent‖ keratin. Protein ini terdiri atas
α (TGF-α), superfamili TGF-ß, superfamili fibroblast growth factor , interleukin
(ILs), chemokine, dan reseptor-reseptornya.
Platelet-derived growth factor sangat sedikit digunakan pada setting klinik. Hal ini sangat berbeda pada GM-CSF yang telah menunjukkan efek yang menguntungkan ketika diaplikasi pada ulkus kronik dengan berbagai etiologinya. Ketika terjadi aktifasi pada epidermis akibat luka, GM-CSF mRNA terkumpul dalam keratinosit dalam beberapa jam. GM-CSF karenanya merupakan respon awal dari aktifitas gen dan mengakibatkan terjadinya serangkaian proses yang pada akhirnya menutupi luka dan remodeling jaringan. GM-CSF merupakan mitogen yang poten untuk keratinosit pada konsentrasi nanogram permilliliter, dan secara langsung menstimulasi migrasi dan proliferasi sel-sel endotel serta perkembangan sel keratinosit manusia secara in vitro (Hancock dkk,1998; Bussolino dkk,1989 dalam MannA dkk,2001). Sebagai tambahan, telah diduga bahwa GM-CSF mempengaruhi proliferasi, maturasi, dan rekrutmen sel seperti keratinosit, fibroblas, sel endotel, monosit, makrofag, dan sel-sel dendritik setidaknya dengan cara modulasi pelepasan
sitokin seperti IL-1, IL-6, tumor necrosis factor α (TNF-α), TGF-ß, interferon-γ
(IFN-γ) dan M-CSF dimana yang pada gilirannya mempengaruhi proses penyembuhan luka.
(EGF) yang telah diketahui menstimulasi migrasi keratinosit dan ekspansi maksimal pada kultur keratinosit manusia.
Neovaskularisasi luka merupakan hal yang sangat penting bagi pengiriman komponen vital yang diperlukan untuk proses penyembuhan. Peningkatan neovaskularisasi pada tikus dengan overekspresi GM-CSF berkorelasi dengan peningkatan penyembuhan luka. (Mann dkk.,2001). Pada hewan percobaan dengan overekspresi antagonis GM-CSF terjadi penurunan jumlah pembuluh darah mikro dan peningkatan kegagalan penyembuhan luka, sehingga dapat diduga hubungan langsung antara GM-CSF dan neovaskularisasi. Aktifasi enzim IκB yang tergantung
GM-CSF mengakibatkan aktifasi selanjutnya dari NFκB yang merupakan faktor
penting bagi proliferasi sel endotelial. Defisiensi GM-CSF mengakibatkan perubahan komposisi matriks kolagen vaskular yang berguna bagi integritas dinding pembuluh darah dan daya tahannya.
2.7. Inhibitor GM-CSF
Berbagai sitokin, seperti IL- 1ß, tumor necrosis factor-α (TNF-α) dan
GM-CSF, di lepaskan secara terkoordinasi dan memainkan peranan penting pada inflamasi kronik. Pola-pola ekspresi sitokin secara luas menentukan sifat ilmiah dan persistensi respon inflamasi. Sitokin memproduksi efek selularnya dengan aktifasi dari berbagai faktor transkripsi seperti protein aktifator-1 (AP-1), nuclear factor –κB (NF-κB), dan
Peningkatan ekspresi beberapa faktor ini mungkin bertanggung jawab atas pemanjangan inflamasi. AP-1 dan NF-κB dapat diinduksi oleh berbagai mediator
seperti NO, histamine dan eicosanoid.
Glukokortikoid telah lama dikenal mempunyai efek anti inflamasi yang paling efektif. Reseptor glukokortikoid secara predominan terletak pada epithel dan endothel, karenanya menjadi lokasi aksi anti inflamasi steroid. Secara klasik glukokortikoid berikatan pada, dan mengaktifasi sitosolik reseptor glukokortikoid. Setelah teraktifasi, reseptor glukokortikoid mengalami dimerisasi untuk selanjutnya terjadi translokasi pada inti sel. Dalam inti, reseptor glukokortikoid berikatan pada elemen spesifik DNA dalam promoter dari gen yang responsif (transaktifasi) atau inhibisi aktifitas faktor-faktor transkripsi seperti AP-1 dan NF-κB (transrepresi).
Glukokortikoid mempunyai kemampuan inhibisi pelepasan GM-CSF yang diinduksi IL-1ß. Adcock dkk (1999), menunjukkan efek inhibisi glukokortikoid terhadap ekspresi GM-CSF yang diinduksi IL-1ß, dan aktifitas NF-κB. Fluticason
propionate dan budesonid tampak sebagai inhibitor yang lebih poten dibanding dexamethason. Meskipun kesemua ligan ini mempunyai aksi pada reseptor yang sama, fluticasone propionate dan budesonid kira-kira 5 kali lebih poten pada target reseptor dari afinitas ikatan yang diperkirakan. Kemampuan fluticason propionate, budesonid dan dexamethason untuk menginhibisi κB reseptor berhubungan dengan
BAB III
METODOLOGI PENELITIAN
3.1. Rancangan Penelitian
Penelitian ini adalah penelitian eksperimental pada hewan percobaan mencit (Mus musculus) yang dibagi atas 3 kelompok, 2 kelompok perlakuan dan 1 kelompok kontrol.
3.2. Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di bagian bedah FK USU pada bulan Desember dan Januari 2010.
3.3. Objek Penelitian
Sampel : Hewan percobaan yang digunakan adalah mencit (Mus musculus) dengan berat 40-60 gram. Dibagi atas 3 kelompok dengan 2 kelompok perlakuan dan 1 kelompok kontrol. Kelompok I diberikan injeksi perilesi sediaan GM-CSF, kelompok II diberikan steroid dan kelompok III tidak diberi perlakuan sebagai kontrol.
3.4. Kriteria inklusi, ekslusi dan drop out
Kriteria inklusi : Mencit jantan dengan berat 40-60 g dan sehat. Kriteria eksklusi : Sampel dengan berat kurang dari 40 g dan
3.5. Identifikasi Variabel Penelitian
Variabel bebas : Granulocyt Macrophage – Colony Stimulating Factor
Steroid
Perlukaan artifisial.
Variabel tergantung : Pertumbuhan keratinosit secara mikroskopis Pertumbuhan neovaskularisasi secara
mikroskopis
3.6. Pelaksanaan Penelitian 3.6.1. BAHAN DAN ALAT 3.6.1.1. Bahan :
1. GM-CSF (filgastrim, rHuG-CSF) 33.6x106 IU 263 microgram
( Leucogyn(R)Kalbe Farma,no batch :2127,fab/mfg :12 09, exp : 11 11) 2. Dexamethasone injeksi.
3. Ketamin 4. Alkohol 70%
5. Povidone iodine 10 %
3.6.1.2. Alat :
3. Syringe 1 cc 4. Syringe 10 cc
3.6.2. Cara kerja :
1. Lima belas ekor mencit dibagi atas 3 kelompok dipersiapkan 1 minggu sebelumnya untuk beradaptasi dalam kandang berukuran 30x30x30 cm. Kandang ditempatkan dalam suhu kamar dan cahaya menggunakan sinar matahari secara tidak langsung. Makanan diberikan ad libitum.
2. Sebelum perlakuan tikus ditimbang berat badannya.
3. Dilakukan narkose dengan ketamin 0,05mg untuk setiap 20mgBB transperitoneal. Dilakukan pencukuran bulu.
4. Desinfeksi dengan iodine 10% dan alkohol 70%
5. Dilakukan perlukaan pada daerah punggung para vertebra diameter 5 mm, full thickness dengan menggunakan skalpel.
6. Luka dirawat terbuka
7. Kelompok I diberikan injeksi GM-CSF peri lesional 10 mikrogram/kg BB pada hari 1-6.
8. Kelompok II diberikan dexamethasone 0,5/kg BB injeksi sebagai inhibitor GM-CSF.
10.Mencit dieuthanasia dan sampel kulit masing-masing kelompok diambil pada hari ke 7 dengan cara yang sama, dan sampel kulit di awetkan dalam formaldehid 10%.
11. Sampel dibenamkan dalam blok paraffin dan dilakukan pemotongan secara
longitudinal ,untuk selanjutnya dilakukan pewarnaan prefarat dengan pewarna hematoxyllin-eosin.
12.Jumlah keratinosit dihitung dengan menggunakan handy taller dibawah
mikroskop cahaya dengan pembesaran 400x oleh ‗blind‘ pathologis.
13.Selanjutnya dilakukan analisa data dengan perangkat komputer SPSS dengan uji statistik one way ANOVA untuk memperlihatkan kemaknaan antar kelompok.
3.7. Besar Sampel
Besar sampel dihitung menurut rumus Feederer : (np-1)-(p-1) p2. Dari perhitungan didapat besar sampel masing-masing kelompok adalah 4 ekor.
3.8. Analisa Data
Data yang terkumpul akan diolah dan dianalisa dengan perangkat SPSS, untuk analisa besar perbedaan statistik antar kelompok digunakan uji one way ANOVA . Nilai P<0,05 dipertimbangkan bermakna. (Mann .dkk;2006).
a. GM-CSF adalah rekombinan faktor stimulasi granulosit-makrofag yang diberikan peri lesi dari hari pertama hingga hari ke enam setiap hari dengan dosis 10 mikrogram/kg BB.
b. Steroid adalah inhibitor GM-CSF, dengan preparat dexamethasone yang diinjeksi peri lesi pada dosis 0,5 mg/kg BB dari hari pertama, setiap hari hingga ke enam.
c. Pertumbuhan keratinosit adalah jumlah sel keratinosit yang dihitung secara mikroskopik.
d. Neovaskularisasi adalah pertumbuhan struktur pembuluh darah yang dihitung secara mikroskopis.
e. Perlukaan artifisial adalah luka buatan pada kulit hewan percobaan dengan ketebalan penuh (full thickness)
3.10. Kerangka konsep
Perlukaan kulit secara artifisial
Pemberian : I. GM-CSF. II. Dexamethason.
III. Kontrol.
Jumlah keratinosit dan
struktur mikrovaskular
Jumlah keratinosit pada kelompok
3.11. Alur penelitian
Sampel dibagi 3 kelompok
Perlukaan kulit artifisial
Kelompok I. injeksi GM-CSF. Kelompok II. injeksi dexamethason. Kelompok III. kontrol.
Eksisi kulit pada hari ke 7 dan di lakukan pemeriksaan mikroskopik keratinosit dan struktur mikrovaskular
BAB 4
HASIL PENELITIAN
Subjek penelitian berupa 15 ekor mencit jantan wildtype yang dibagi atas 3 kelompok. Selama masa penelitian 2 ekor mencit mati, 1 ekor dari kelompok yang diberikan GM-CSF dan 1 ekor dari kelompok kontrol. Keseluruhan mencit yang hidup selama penelitian berlangsung menjadi objek penelitian.
Tiga belas ekor mencit yang diberi luka artifisial terbagi atas 3 kelompok, 4 ekor diberikan injeksi peri lesi GM-CSF, 4 ekor diberi injeksi peri lesi dexamethason dan 5 ekor kelompok kontrol.
4.1 . Pertumbuhan Keratinosit
Rata-rata jumlah pertumbuhan keratinosit pada kelompok GM-CSF menunjukkan nilai 186 (± 50) sel perlapangan pandang besar, sedang pada kelompok
dexamethason dan kontrol menunjukkan nilai 25 (±10) dan 47 (±16) sel perlapangan
Gambar 1. Grafik rata-rata pertumbuhan keratinosit antar kelompok Grafik diatas menunjukkan pertumbuhan keratinosit yang bermakna antara pemberian rhGM-CSF dibanding kelompok dexamethason dan kontrol.
4.2. Pertumbuhan Pembuluh Darah
Pada pertumbuhan struktur neovaskular didapati hasil rata-rata 48 (±17)
pembuluh darah perlapangan pandang besar pada kelompok GM-CSF sedang pada kelompok dexamethason dan kontrol didapati jumlah 8 (±6) dan 7 (±5) pembuluh
darah perlapangan pandang besar. Uji kemaknaan one way ANOVA antar masing-masing kelompok menunjukkan pemberian injeksi perilesi sediaan GM-CSF menunjukkan pertumbuhan pembuluh darah yang bermakna (p=0.001) dibandingkan pemberian steroid dan kelompok kontrol. Sedangkan pada kelompok steroid dibandingkan kelompok kontrol tidak dijumpai pertumbuhan pembuluh darah yang bermakna (p= 0.935)
0 20 40 60 80 100 120 140 160 180 200
Gambar 2. Grafik rata-rata pertumbuhan neovaskular antar kelompok
Grafik diatas menunjukkan rata-rata pertumbuhan struktur neovaskular antara pemberian rhGM-CSF dibanding dexamethason dan kontrol.
0 5 10 15 20 25 30 35 40 45 50
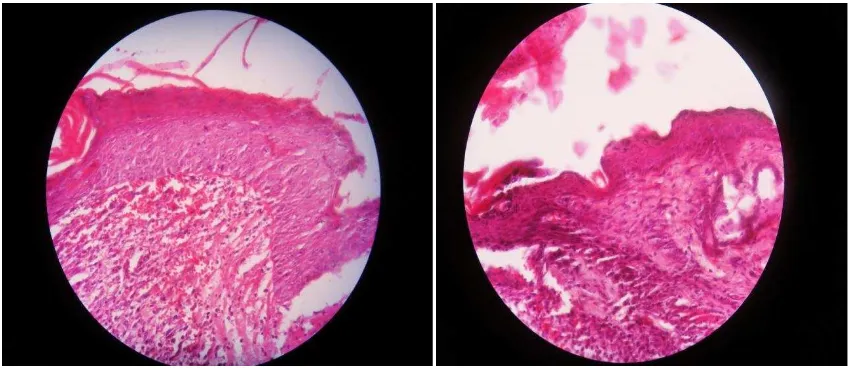
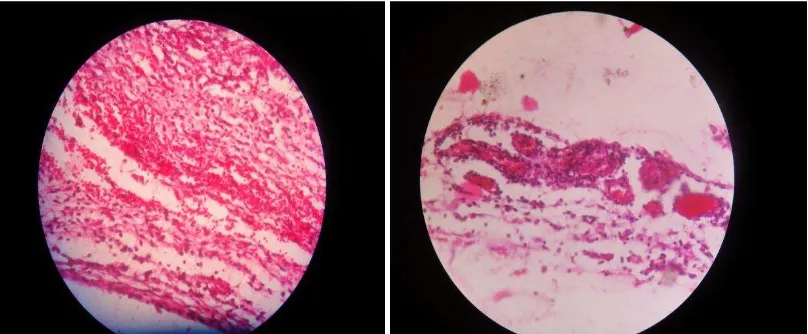
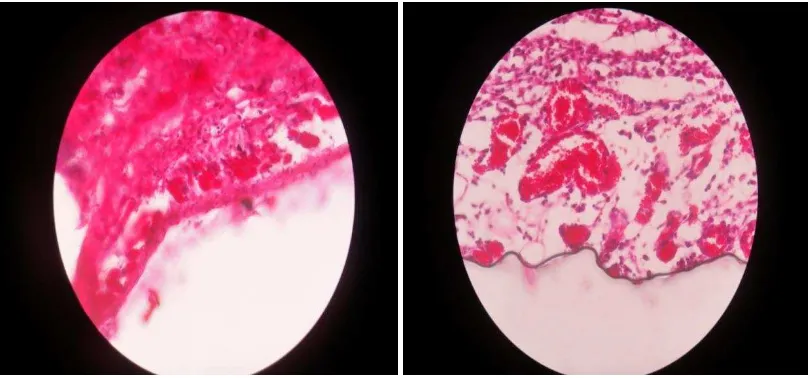
[image:36.612.114.540.438.630.2]Gambar 3. Gambar histologi keratinosit pada kelompok rhGM-CSF.
Gambar 4. Gambar histologi keratinosit pada kelompok dexamethasone.
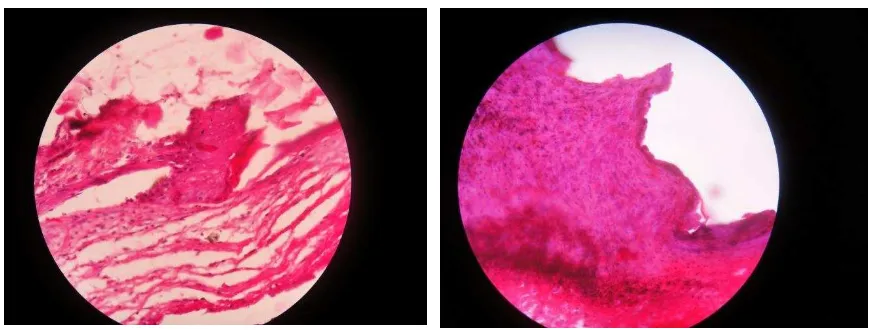
[image:38.612.99.535.483.648.2]Gambar 5. Gambar histologi keratinosit pada kelompok kontrol
[image:39.612.113.518.454.623.2]Gambar 6. Gambar histologi neovaskular pada kelompok rhGM-CSF .
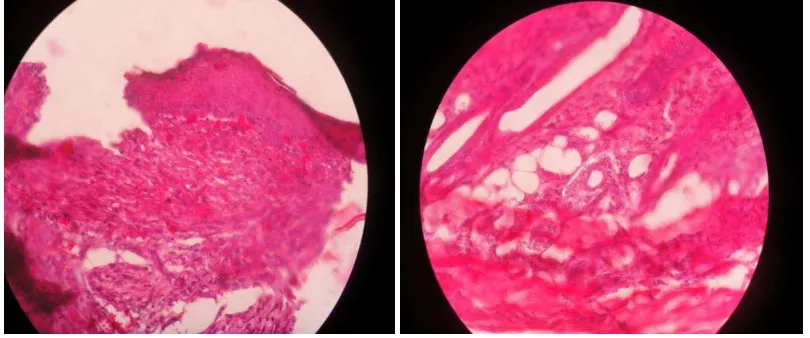
[image:40.612.115.519.437.604.2]Gambar 8. Gambar histologi neovaskular pada kelompok kontrol.
BAB 5 PEMBAHASAN
Granulocyte Macrophage Colony Stimulating Factor merupakan salah satu
faktor pertumbuhan dalam proses hematopoiesis yang paling banyak diteliti untuk kepentingan terapeutik. Berperan dalam proses proliferasi dan diferensiasi sel-sel progenitor myeloid sum-sum tulang, GM-CSF diketahui menggalakkan fungsi makrofag matur yang menginduksi sekresi berbagai sitokin termasuk IL-6 dan TNF-α
dalam darah. GM-CSF merupakan adjuvan yang efisien dan mempunyai profil toksisitas yang rendah. Untuk pengobatan kanker, GM-CSF meningkatkan jumlah monosit dan makrofag dan menunjukkan kemampuan melisiskan tumor. Penggunaan GM-CSF dan erythropoietin pasca hepatectomy juga memungkinkan akselerasi regenerasi liver pada hewan coba.(Ghosh.dkk; 2007., Vassilou.dkk;2010).
terapi sitokin mengalami penurunan volume ulkus dibanding plasebo setelah hari ke-35 pengobatan.
Recombinant human GM-CSF (rhGM-CSF) adalah satu produk agen biologik
yang paling sukses diterapkan untuk kepentingan klinis. Penggunaan sargamogastrim (rhGM-CSF yang diturunkan dari jamur) dan Molgramostim (rhGM-CSF yang diturunkan dari bakteria) telah dipakai untuk mengatasi kondisi neutrophenia akibat induksi kemoterapi dalam acute myelogenous leukemia (AML) untuk mempercepat pemulihan netrofil dan menurunkan insiden kondisi yang mengancam jiwa akibat infeksi. Penggunaan rhGM-CSF juga memberi efek menguntungkan pada pasien-pasien yang menjalani transplantasi sum-sum tulang secara autologus maupun allogenik dan juga berperan dalam memobilisasi serta membantu proses engrafment pasca transplantasi sel-sel progenitor darah.
Pada penelitian ini, kami memberikan rhGM-CSF dan dexamethason yang diadministrasi secara subkutan dengan kontrol pada hewan coba mencit yang dilakukan perlukaan artifisial. Recombinant human GM-CSF dan dexamethason diberikan dari hari ke-1 hingga hari ke-6. Dosis rhGM-CSF dan dexamethason masing-masing adalah 10µg/kgBB dan 10 mgBB, dilakukan titrasi dosis dengan aquabidest untuk menyesuaikan dosis dengan berat badan masing-masing hewan coba. Dosis rhGM-CSF 10µg/kgBB secara subkutan dapat memobilisasi sel progenitor granulosit (cells bearing CD 34+) dari sum-sum tulang ke darah perifer dari hari ke-4 sampai hari ke-7 penyuntikan dan dosis dexamethason 10 mg/kg BB memberikan efek inhibisi terhadap GM-CSF. (Lane.A.Thomas;2000,Adcock dkk;1999). Jumlah keratinosit dan stuktur neovaskular dinilai secara histologis dengan pewarnaan hematoxylin-eosin dan dihitung dibawah mikroskop cahaya (pembesaran 400x) dengan handy taller. Keratinosit ditandai dengan struktur sel keratin yang mempunyai inti, tampak berwarna biru gelap pada inti dengan pewarnaan H.E, struktur neovaskular dikenali secara tidak langsung melalui sel-sel eritrosit yang terperangkap dalam lumen pembuluh darah. Untuk membedakannya dengan struktur pembuluh darah dewasa struktur neovaskular tidak menunjukkan struktur endotel yang nyata.
Jumlah rata-rata keratinosit pada hewan coba yang diberikan rhGM-CSF 186 (±50) sel perlapangan pandang besar dan dibawah 25 (±10) dan 47 (±16) sel
kelompok kontrol. Penelitian lebih lanjut dengan menggunakan hewan coba transgenic dan teknik pewarnaan immunohistokimia serta perhitungan penanda mitosis dapat mengkonfirmasi hasil penelitian ini.
Migrasi dan proliferasi keratinosit dari daerah pinggir luka bersamaan dengan peningkatan sintesis metallomatrixproteinase (MMPs) akan mengakibatkan migrasi keratinosit lebih jauh menutupi seluruh permulaan luka. Manakala keratinosit yang bermigrasi telah saling bertemu, kecepatan proliferasi epitelial menurun hingga tiga sampai empat kali kecepatan normal untuk selanjutnya sel-sel epidermal akan kembali pada fungsi dan morfologi normal. Pengekalan ekspresi faktor pertumbuhan bersamaan dengan lingkungan luka yang abnormal seperti penurunan kelembaban, iskemia dan trauma berulang, akan mengakibatkan aktifasi sel-sel proinflamasi secara terus menerus. Infiltrasi neutrofil yang eksesif diikuti dengan melimpahnya sel makrofag akan mencetuskan ekspresi TNFα dan IL-1β. Sitokin-sitokin ini adalah
kemoattraktan bagi fibroblas dan sel inflamasi yang mengekalkan protein metallomatrix, inhibisi MMPs akibat penurunan tissue inhibitor matrix protein (TIMPs) yang mendegradasi matriks selular, faktor pertumbuhan dan penurunan reseptor faktor pertumbuhan sehingga keterlambatan ataupun kegagalan penyembuhan terjadi ( Cornelissen L.H.2004 )
dexamethason dan kontrol adalah 8 (±6) dan 7 (±5) pembuluh darah perlapangan
pandang besar. Perbedaan yang bermakna antara kelompok rhGM-CSF dibanding kedua kelompok lainnya menyokong efek positif rhGM-CSF bagi proses penyembuhan luka. Diketahui GM-CSF merupakan faktor penting dalam proses proliferasi endotel (Mann. A,2001, Ebner dkk,2003). Plenz dkk (2003) menunjukkan defisiensi GM-CSF mengakibatkan perubahan komposisi matriks kolagen vaskular yang mendukung faktor penting GM-CSF dalam hal mempertahankan integritas dan daya tahan struktur pembuluh darah. Akan tetapi, ekspresi berbagai macam sitokin terjadi pasca perlukaan dan overekspresi satu jenis sitokin akan merangsang ekspresi jenis sitokin lainnya baik secara parakrin maupun autokrin. Efek sinergistik sitokin-sitokin ini akan memainkan peranan dalam proses penyembuhan luka. Vascular endothelial growth factor (VEGF) merupakan stimulator poten bagi proses
angiogenesis dan trauma menginduksi ekspresi gen VEGF dengan makrofag serta keratinosit sebagai produser utama. Reduksi VEGF akan menggagalkan penyembuhan luka. Demikian pula faktor pertumbuhan lainnya seperti platelet derived growth factor yang mengontrol pembentukan fibroblas yang tergantung koloni makrofag bersama transforming growth factor beta (bTGF), fibroblast growth factor (FGF) dan insulin like growth factor (IGF) (Cornelissen L.H,2004). Kurangnya
merupakan inhibitor bagi VEGF,bTGF, PDGF,IGF dan FGF -- yang kesemuanya merupakan faktor pertumbuhan yang terlibat dalam proses penyembuhan luka. Perkiraan efek antagonistik dexamethason terhadap pertumbuhan struktur neovaskular pada proses penyembuhan luka ini memerlukan penelitian lebih lanjut.
Sebagai tambahan, kemungkinan peningkatan jumlah sel progenitor (cells bearing CD 34+) pasca induksi rhGM-CSF dalam darah perifer yang dapat diisolasi dan dimurnikan (purified cells bearing CD 34+ ) membuka peluang investigasi mengenai kemampuan sel progenitor darah tepi yang dapat digunakan bagi terapi target sel (cells targeted therapy)—karena sifat unik sel ini ; differentiate and self renewal---bagi beberapa kondisi klinis tertentu seperti chronic skin ulcers, unhealing
wound, atau kondisi penyakit kulit inherited seperti epidermolysis bulosa. Kesemua kemungkinan ini membutuhkan penelitian lebih lanjut.
BAB 6
KESIMPULAN DAN SARAN 6.1. KESIMPULAN
1. Terdapat pertumbuhan keratinosit dan neovaskular yang bermakna dengan penyuntikan rhGM-CSF dibandingkan pertumbuhan keratinosit dengan penyuntikan dexamethason dan kontrol.
2. Tidak terdapat pertumbuhan keratinosit dan neovaskular yang bermakna pada kelompok mencit dengan penyuntikan dexamethason dibanding kelompok kontrol.
6.2. SARAN
1. Perlu dilakukan penelitian lanjutan mengenai peranan rhGM-CSF dalam proses penyembuhan luka dengan menggunakan mencit transgenic dan teknik pewarnaan immunohistokimia.
DAFTAR PUSTAKA
Adcock M Ian, Nasuhara Y, Stevens AD, Barnes JP. Ligand-induced differentiation of glucocorticoid receptor (GR) trans-repression and transactivation: preferential targeting of NF-κB and lack of I-κB involvement. British Journal of Pharmacology. 1999;127,1003-1011.
Al Homsi AS . Cytokine Modulation of Hematopoietic Stem Cell Phenotype. In: Ho Anthony D, Haas R, Champlin ER,editors. Hematopoietic Stem Cell Transplantation., New York-Basel: Marcel Dekker. 2000; p47-61.
Baker EA, Leaper DJ. Proteinases, their inhibitors, and cytokines profiles in acute wound fluid. Wound Repair Regen. 2000; 8:392-8
Brem H, Balledux J, Bloom T, Kerstein MD, Hollier L. Healing of Diabetic Foot and Pressures Ulcers With Human Skin Equivalent. Arch Surg. 2000;135:627-634
Cornelissen LH. Wich Molecules of Initial Phase of Wound Healing may be Used as Markers for Early Detection of Skin Damage? Eindhoven: Technische Universiteit. 2004; p9-16.
Ebner K, Bandion A, Binder BR, de Martin R, Schmid JA. GM-CSF activates NF-kappaB via Direct Interaction of the GM-CSF receptor with INF-kappaB kinase beta. Blood. 2003; 102:192-9
Gurtner CG. Wound Healing : Normal and Abnormal. In: Thorn HC et al. Grabb Plastic Surgery. 6th Ed., Wolters Kluwer-Lippincot William and Wilkins, Philadelphia. 2007; p15-22
Ghosh K.P.,Bhardwaj D, Karnik R. Human Granulocyte-Macrophage Colony Stimulating Factor: The Proteins and Its Current and Emerging Applications. Indian Journal of Biotechnology. 2007; vol 6, pp 435-448
Hunt KT. Wound Healing. In: Doherty MG. Current Surgical Diagnosis and Treatment. 12th Ed., McGraw-Hills, USA. 2003; p75-87
Kaplan G: Recent Advance in Cytokine Therapy in Leprosy. J Infect Dis.1993; 167:S18-S22
Lane A.T., Law P. Mobilization of Pheripheral Blood Stem Cells from Normal Donors In: Ho Anthony D, Haas R,Champlin ER. Hematopoietic Stem Cell Transplantation., Marcel Dekker, New York-Basel. 2000; p333-351
Mann A, Breuhahn K, Schirmacher P, Blessing M. Keratinocyte-Drived Granulocyte-Macrophage Colony Stimulating Factor Accelerates Wound Healing: Stimulation of Keratinocyte Proliferation, Granulation Tissue Formation, and Vascularization. J Invest Dermatol.2001; 117:1382-1390
Mann A, Niekisch K, Schirmacher P, Blessing M. Granulocyte-Macrophage Colony-Stimulating Factor Is Essential for Normal Wound Healing. Sj.Jjdsymp.2006; 5650013, 11, 87-92. doi:10.1038
Martin P. Wound healing – aiming for perfect skin regeneration. Science.1997; 276:75-81
Plenz G, Eschert H, Beissert S, Arps V, Sindermann JR, Robenek H et al. Alteration in the Vascular Extracellular Matrix of Granulocyte Macrophage-Colony Stimulating Factor (GM-CSF) Defficient Mice. FASEB J.2003; 17:1451-7
Regauer S, Compton CC . Cultured Keratinocyte Sheet Enhance Spontaneous Re-Epithelization in a Dermal Explant Model of Partial-Thickness Wound Healing. J Invest Dermatol.1990; 95:341-346
Robson M.C., Hill D.P., Smith P.D., Wang X, Meyer-Siegler K, Ko F, Vandeberg J.S., Payne W.G., Ochs D, Robson LE. Sequential Cytokine Theraphy for Pressure Ulcer: clinical and mechanistic respons. Ann. Surg.2000; 231(4):600-611
Stadelmann WK, Digenis AG, Tobin GR. Impediment to wound healing. Am J Surg.1998; 176:39S-47S
Stricklin PG, Li L, Nanney BL. Localization of mRNAs Representing Interstitial Collagenase, 72-kDa Gelatinase, and TIMP in Healing Porcin Burn Wounds. J Invest Dermatol.1994; 103:352-358
Ting EA, Mays RW, Frey RM, Hof vW, Madicetty S, Deans R . Therapeutic Pathway of Adult Stem Cells Repair. Critical Review in Oncology and Hematology., Elsevier, Ireland.2008; p.81-93
Ure I, Partsch B, Wolff K, Petzelbauer P: Granulocyte/Macrophage colony stimulating factor increased wound-fluid interleukin 8 in normal subjects but does not accelerate wound healing. Br J Dermatol.1998; 138:277-282
Lampiran
Analisis statistik data pertumbuhan keratinosit dan neovascular dengan SPSS 17 1. Analisis data pertumbuhan keratinosit
ANOVA
Keratinosit
Sum of Squares df Mean Square F Sig.
Between Groups 67564.464 2 33782.232 165.360 .000
Within Groups 2247.250 11 204.295
Total 69811.714 13
Multiple Comparisons Dependent Variable:keratinosit (I) bahan (J) bahan Mean Difference
(I-J) Std. Error Sig.
95% Confidence Interval
Lower Bound Upper Bound
Tukey HSD GMCSF Steroid 161.250* 9.226 .000 136.33 186.17
Kontrol 139.250* 10.107 .000 111.95 166.55
steroid GMCSF -161.250* 9.226 .000 -186.17 -136.33
Kontrol -22.000 9.226 .085 -46.92 2.92
kontrol GMCSF -139.250* 10.107 .000 -166.55 -111.95
Steroid 22.000 9.226 .085 -2.92 46.92
Scheffe GMCSF Steroid 161.250* 9.226 .000 135.21 187.29
kontrol 139.250* 10.107 .000 110.73 167.77
steroid GMCSF -161.250* 9.226 .000 -187.29 -135.21
kontrol -22.000 9.226 .101 -48.04 4.04
kontrol GMCSF -139.250* 10.107 .000 -167.77 -110.73
steroid 22.000 9.226 .101 -4.04 48.04
Keratinosit
bahan N
Subset for alpha = 0.05
1 2
Tukey HSDa,,b steroid 6 25.50
kontrol 4 47.50
GMCSF 4 186.75
Sig. .096 1.000
Scheffea,,b steroid 6 25.50
kontrol 4 47.50
GMCSF 4 186.75
Sig. .114 1.000
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 4.500.
b. The group sizes are unequal. The harmonic mean of the group sizes is used. Type I error levels are not guaranteed.
Statistics
GMCSF Steroid Kontrol
N Valid 4 6 4
Missing 10 8 10
Mean 186.7500 25.5000 47.5000
Median 191.5000 25.0000 46.0000
Std. Deviation 25.27680 5.04975 8.22598
Variance 638.917 25.500 67.667
Skewness -.904 1.573 .701
Std. Error of Skewness 1.014 .845 1.014
Kurtosis .172 3.546 -1.653
Std. Error of Kurtosis 2.619 1.741 2.619
Range 58.00 15.00 18.00
Minimum 153.00 20.00 40.00
Pembuluh Darah
ANOVA
pembuluh darah
Sum of Squares df Mean Square F Sig.
Between Groups 4552.219 2 2276.110 81.713 .000
Within Groups 278.550 10 27.855
Total 4830.769 12
Multiple Comparisons
Dependent Variable:pembuluh darah
(I) bahan (J) bahan
Mean Difference
(I-J) Std. Error Sig.
95% Confidence Interval
Lower Bound Upper Bound
Tukey HSD GMCE steroid 39.950* 3.540 .000 30.24 49.66
kontrol 41.250* 3.732 .000 31.02 51.48
steroid GMCE -39.950* 3.540 .000 -49.66 -30.24
kontrol 1.300 3.540 .929 -8.41 11.01
kontrol GMCE -41.250* 3.732 .000 -51.48 -31.02
steroid -1.300 3.540 .929 -11.01 8.41
Scheffe GMCE steroid 39.950* 3.540 .000 29.81 50.09
kontrol 41.250* 3.732 .000 30.56 51.94
steroid GMCE -39.950* 3.540 .000 -50.09 -29.81
kontrol 1.300 3.540 .935 -8.84 11.44
kontrol GMCE -41.250* 3.732 .000 -51.94 -30.56
steroid -1.300 3.540 .935 -11.44 8.84
pembuluh darah
Bahan N
Subset for alpha = 0.05
1 2
Tukey HSDa,,b Kontrol 4 7.50
Steroid 5 8.80
GMCE 4 48.75
Sig. .931 1.000
Scheffea,,b Kontrol 4 7.50
Steroid 5 8.80
GMCE 4 48.75
Sig. .937 1.000
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 4.286.
b. The group sizes are unequal. The harmonic mean of the group sizes is used. Type I error levels are not guaranteed.
Statistics
GMCSF Steroid Kontrol
N Valid 4 5 4
Missing 9 8 9
Mean 48.7500 8.8000 7.5000
Std. Error of Mean 4.26956 1.39284 1.32288
Median 47.5000 10.0000 7.0000
Mode 40.00a 5.00a 5.00a
Std. Deviation 8.53913 3.11448 2.64575
Variance 72.917 9.700 7.000
Range 20.00 7.00 6.00
Minimum 40.00 5.00 5.00
Maximum 60.00 12.00 11.00
Sum 195.00 44.00 30.00