STUDI PEMANFAATAN EKSTRAK KULIT UBI JALAR
(Ipomoea batatas Poir) SEBAGAI INDIKATOR
PADA TITRASI ASAM BASA
SKRIPSI
FERDINAND RICARDO HUTABARAT
040802048
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
STUDI PEMANFAATAN EKSTRAK KULIT UBI JALAR
(Ipomoea batatas Poir) SEBAGAI INDIKATOR
PADA TITRASI ASAM BASA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
FERDINAND RICARDO HUTABARAT
040802048
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : STUDI PEMANFAATAN EKSTRAK KULIT
UBI JALAR (Ipomoea batatas Poir) SEBAGAI INDIKATOR PADA TITRASI ASAM BASA
Kategori : SKRIPSI
Nama : FERDINAND RICARDO HUTABARAT
Nomor Induk Mahasiswa : 040802048
Program Studi : SARJANA ( S1 ) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM ( FMIPA ) UNIVERSITAS SUMATERA UTARA
Disetujui di, Medan, Januari 2010 Komisi Pembimbing :
Pembimbing II Pembimbing I
Drs. A. Darwin Bangun, M.Sc Drs. Barita L. Tobing
NIP. 130 872 296 NIP. 130 538 366
Diketahui/Disetujui oleh :
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
STUDI PEMANFAATAN EKSTRAK KULIT UBI JALAR (Ipomoea batatas Poir) SEBAGAI INDIKATOR
PADA TITRASI ASAM BASA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2010
PENGHARGAAN
Segala puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus, berkat kasih dan karunia-Nya dalam setiap pimpinan-Nya setiap saat. Dalam masa-masa tersulit maupun berat Tuhan tetap teguhkan penulis hingga akhirnya penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini.
ABSTRAK
A Study On The Application Of The Extract Of Sweet Potatoes Fruit Shell As An Indicator In Acid Base Titration
ABSTRACT
DAFTAR ISI
Halaman
Persetujuan iii
Pernyataan iv
Penghargaan v
Abstrak vi
Abstract vii
Daftar Isi viii
Daftar Tabel x
Daftar Gambar xi
BAB 1. PENDAHULUAN
1.1. Latar Belakang 1
1.2. Permasalahan 2
1.3. Pembatasan Masalah 2
1.4. Tujuan Penelitian 3
1.5. Manfaat Penelitian 3
1.6. Lokasi Penelitian 3
1.7. Metodologi Penelitian 3
BAB 2. TINJAUAN PUSTAKA
2.1. Tanaman Ubi Jalar 5
2.1.1. Klasifikasi tanaman Ubi Jalar 5
2.1.2. Kandungan tanaman Ubi Jalar 6
2.2. Antosianin 7
2.2.1. Stabilitas Antosianin 8
2.3. Teori Indikator 9
2.3.1. Teori Ion Indikator Menurut Ostwald 9
2.3.2. Gugus Khromofor 10
2.4. Indikator Asam Basa 10
2.4.1. Trayek pH 13
2.5. Analisis Titrimetri 15
2.5.1. Titrasi Asam Basa 17
2.5.2. Kurva Titrasi Asam Basa 18
BAB 3. METODE PENELITIAN
3.1. Alat-alat 22
3.2. Bahan-bahan 22
3.3. Prosedur Penelitian 23
3.3.1. Pembuatan Pereaksi 23
3.3.2. Perlakuan terhadap sampel 25
3.4. Bagan Penelitian 28
BAB 4. HASIL DAN PENELITIAN
4.1. Hasil Penelitian 32
4.2. Pengolahan Data 34
4.2.1. Langkah-langkah Perhitungan Rancangan Acak Lengkap
dari Data Penelitian 34
4.2.2. Rancangan Acak Lengkap Untuk Data Penelitian 35
4.3. Pembahasan 38
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 40
5.2. Saran 40
DAFTAR PUSTAKA 41
DAFTAR TABEL
Halaman
Tabel 3.1. Alat-alat 22
Tabel 3.2. Bahan-bahan 22
Tabel 4.1. Data Hasil Pengukuran Absorbansi Ekstrak Kulit Ubi Jalar 43 Tabel 4.2. Data perubahan warna ekstrak kulit ubi jalar 43 Tabel 4.3. Hasil titrasi H2C2O4 0,1 N dengan NaOH 0,0993 N 28
Tabel 4.4 Hasil titrasi NaOH 0,0993 N dengan HCl 0,0997 N 28 Tabel 4.5. Hasil titrasi HCl 0,0997 N dengan Na2CO3 0,1 N 29
Tabel 4.6. Data Hasil Perhitungan pH Titik Akhir Titrasi 44
Tabel 4.7. Data Hasil Konsentrasi Titrasi 44
Tabel 4.8. Data Persen Kesalahan Hasil Titrasi (Konsentrasi) 33
Tabel 4.9. Anava, Volume Titrasi 36
Tabel 6. Nilai Kritik Sebaran F 45
DAFTAR GAMBAR
ABSTRAK
A Study On The Application Of The Extract Of Sweet Potatoes Fruit Shell As An Indicator In Acid Base Titration
ABSTRACT
BAB 1
PENDAHULUAN
1.1.Latar belakang
Ubi jalar merupakan tanaman tropis, tetapi dapat beradaptasi dan tumbuh baik di daerah subtropis. Di Indonesia, 89% produksi ubi jalar digunakan sebagai bahan pangan dengan tingkat konsumsi 7,9 kg/kapita/tahun, sedangkan sisanya dimanfaatkan untuk bahan baku industri, terutama saus, dan pakan ternak.
Kulit ubi jalar dibedakan menjadi dua tipe yaitu tebal dan tipis, demikian pula kandungan getahnya, ada varietas yang bergetah banyak dan sedikit. Ubi jalar memiliki warna batang yang bervariasi antara hijau dan ungu. Ubi yang berwarna ungu ini merupakan tanaman yang merambat, dengan batang tidak berkayu, berbentuk bulat dan bagian tengah terdiri dari gabus. Pada tiap ruas (buku) tumbuh daun, akar, dan tunas cabang. ( Setyono,A. 1995 )
Penelitian tentang pemanfaatan zat warna dari berbagai jenis tumbuhan telah banyak dilakukan. Menurut Rosida Nainggolan (2005), ekstrak kulit jengkol yang juga mengandung antosianin dapat digunakan sebagai indikator pada titrasi asam basa. Indikator asam-basa merupakan zat organik yang berubah warna didalam larutan sesuai dengan pH larutannya misalnya indikator fenolftalein, jingga metil, biru bromotimol dan lain-lain. Indikator asam-basa digunakan sebagai petunjuk kapan suatu titrasi harus diakhiri. Titrasi itu sendiri merupakan suatu metode kimia yang dilakukan untuk menentukan kuantitas atau kadar suatu unsur/senyawa dari suatu perwakilan sampel.
Berbagai jenis tumbuhan yang tersebar di alam masih banyak yang perlu dimanfaatkan kandungannya, seperti halnya antosianin yang dalam daging buah dan kulit ubi jalar. Pemanfaatan indikator asam-basa dalam perindustrian di Indonesia masih sangat signifikan. Hal ini dibuktikan dengan masih banyaknya industri yang bergerak dalam bidang kimia menggunakan metode titrasi untuk penentuan bilangan asam, bilangan penyabunan serta beberapa parameter lain yang diperlukan.
Disamping harga indikator yang tergolong cukup mahal dengan penggunaannya yang masih tinggi, persamaan kandungan dan sifat zat warna antara ekstrak kulit ubi jalar dengan ekstrak kulit jengkol mendorong penulis tertarik untuk melakukan penelitian, apakah ekstrak kulit ubi jalar dapat digunakan sebagai indikator didalam titrasi asam basa seperti halnya indikator fenolftalein, jingga metil, biru bromotimol dan yang lainnya.
1.2.Permasalahan
Apakah zat warna ekstrak kulit ubi jalar dapat digunakan sebagai indikator pada titrasi asam basa.
1.3.Pembatasan Masalah
2. Sampel kulit ubi jalar diambil secara acak dari Pasar V Padang Bulan tanpa mempersoalkan tingkat kematangan ubi jalar.
1.4.Tujuan Penelitian
Penelitian ini bertujuan memanfaatkan kulit ubi jalar sebagai indikator pada titrasi asam-basa dengan melihat :
1. Perbandingan persen hasil dan kesalahan antara indikator fenolftalein dan ekstrak kulit ubi jalar pada titrasi asam lemah dengan basa kuat. 2. Perbandingan persen hasil dan kesalahan antara indikator biru
bromotimol dan ekstrak kulit ubi jalar pada titrasi asam kuat dengan basa kuat.
3. Perbandingan persen hasil dan kesalahan antara indikator jingga metil dan ekstrak kulit ubi jalar pada titrasi basa lemah dengan asam kuat.
1.5.Manfaat Penelitian
Hasil yang diperoleh dari penelitian ini diharapkan dapat menjadi salah satu informasi ilmiah yang berharga terutama dalam usaha pemanfaatan zat warna yang terkandung dalam kulit ubi jalar sebagai indikator titrasi asam-basa.
1.6.Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
1.7.Metodologi Penelitian
Penelitian ini dilakukan secara eksperimen laboratorium Adapun langkah-langkah yang dilakukan sebagai berikut :
1. Sampel kulit ubi jalar yang segar.
2. Ekstrak kulit ubi jalar diperoleh dengan melarutkannya didalam pelarut etanol – 1%HCl selama 24 jam.
4. Diamati perubahan warna daripada ekstrak pekat ubi jalar pada larutan pH asam dan basa.
BAB 2
TINJAUAN PUSTAKA
2.1. Tanaman Ubi Jalar
2.1.1. Klasifikasi tanaman Ubi Jalar
Menurut ilmu taksonomi, tanaman ubi jalar berwarna violet dimasukkan dalam klasifikasi sebagai berikut :
Kingdo m: Plantae (Tumbuhan)
Subkingdo m: Tracheobionta (Tumbuhan berpembuluh) Super Divisi: Spermatophyta (Menghasilkan biji) Divisi: Magnoliophyta (Tumbuhan berbunga) Kelas: Magnoliopsida (berkeping dua / dikotil) Sub Kelas: Asteridae
Ordo: Solanales
Famili Genus:
Spesies: Ipomoea batatas Poir
Ubi jalar atau ketela rambat atau “sweet potato” diduga berasal dari Benua Amerika. Para ahli botani dan pertanian memperkirakan daerah asal tanaman ubi jalar adalah Selandia Baru, Polinesia, dan Amerika bagian tengah. Nikolai Ivanovich Vavilov, seorang ahli botani Soviet, memastikan daerah sentrum primer asal tanaman ubi jalar adalah Amerika Tengah. Ubi jalar mulai menyebar ke seluruh dunia, terutama negara-negara beriklim tropika pada abad ke-16. Orang-orang Spanyol menyebarkan ubi jalar ke kawasan Asia, terutama Filipina, Jepang dan Indonesia.
atau varietas ubi jalar berumur pendek (genjah) dipanen pada umur 3-3,5 bulan.
2.1.2. Kandungan tanaman Ubi Jalar
Ubi jalar ungu merupakan bahan pangan sumber energi dalam bentuk gula dan karbohidrat. Umbi ini mengandung vitamin dan mineral yang dibutuhkan oleh tubuh, seperti, kalsium, zat besi, vitamin A maupun C. Tidak hanya itu juga, ubi jalar ungu sangat banyak mengandung zat warna, terutama pigmen antosianin.
Antosianin ini merupakan antioksidan alami yang dapat mencegah penyakit kanker, jantung, tekanan darah tinggi, katarak, dan bahkan dapat menghaluskan kulit. Namun demikian, janganlah berlebihan dalam mengkonsumsi antosianin ini karena dapat menyebabkan keracunan. Berdasarkan ADI (Acceptable Daily Intake), konsumsi maksimum antosianin yang diperbolehkan per hari sebesar 0,25 mg/kg berat badan kita.
Kandungan antosianin (zat warna pada tanaman) dari ubi jalar ungu ini berkisar antara 14,68 – 210 mg/100 gram bahan. Besar kandungan antosianin dalam ubi jalar ungu tergantung pada intensitas warna pada umbi tersebut. Semakin ungu warna umbinya, maka kandungan antosianinnya semakin tinggi.
2.2. Antosianin
yang terbentuk bila antosianin dihidrolisis dengan asam. Antosianidin terdapat enam jenis secara umum, yaitu : sianidin, pelargonidin, peonidin, petunidin, malvidin dan delfinidin.
Pelargonidin
(Harborne, J.B, 1987)
Antosianidin adalah senyawa flavonoid secara struktur termasuk kelompok flavon. Glikosida antosianidin dikenal sebagai antosianin. Nama ini berasal dari bahasa Yunani antho-, bunga dan kyanos-, biru. Senyawa ini tergolong pigmen dan pembentuk warna pada tanaman yang ditentukan oleh pH dari lingkungannya. Senyawa paling umum adalah antosianidin, sianidin yang terjadi dalam sekitar 80 persen dari pigmen daun tumbuhan, 69 persen dari buah-buahan dan 50 persen dari bunga. ( Edward T. dan George, 1983 )
Kebanyakan warna bunga merah dan biru disebabkan antosianin. Bagian bukan gula dari glukosida itu disebut suatu antosianidin dan merupakan suatu tipe garam flavilium. Warna tertentu yang diberikan oleh suatu antosianin, sebagian bergantung pada pH bunga. Warna biru bunga cornflower dan warna merah bunga mawar disebabkan oleh antosianin yang sama, yakni sianin. Dalam sekuntum mawar merah, sianin berada dalam bentuk fenol. Dalam cornflower biru, sianin berada dalam bentuk anionnya, dengan hilangnya sebuah proton dari salah satu gugus fenolnya. Dalam hal ini, sianin serupa dengan indikator asam-basa.
HO
hilangnya proton ini mengubah warna dari merah ke biru
Istilah garam flavilium berasal dari nama untuk flavon, yang merupakan senyawa tidak berwarna. Adisi gugus hidroksil menghasilkan flavonol, yang berwarna kuning.
(Fessenden dan Fessenden, 1986)
Dalam pengidentifikasian antosianin atau flavonoid yang kepolarannya rendah, daun segar atau daun bunga jangan dikeringkan tetapi harus digerus dengan MeOH. Ekstraksi hampir segera terjadi seperti terbukti dari warna larutan. Flavonoid yang kepolarannya rendah dan yang kadang-kadang terdapat pada bagian luar tumbuhan, paling baik diisolasi hanya dengan merendam bahan tumbuhan segar dalam heksana atau eter selama beberapa menit. ( Markham, K.R, 1988 )
2.2.1. Stabilitas Antosianin
Antosianin secara umum mempunyai stabilitas yang rendah. Pada pemanasan yang tinggi, kestabilan dan ketahanan zat warna antosianin akan berubah dan mengakibatkan kerusakan. Selain mempengaruhi warna antosianin, pH juga mempengaruhi stabilitasnya, dimana dalam suasana asam akan berwarna merah dan suasana basa berwarna biru. Antosianin lebih stabil dalam suasana asam daripada dalam suasana alkalis ataupun netral. Zat warna ini juga tidak stabil dengan adanya oksigen dan asam askorbat. Asam askorbat kadang melindungi antosianin tetapi ketika antosianin menyerap oksigen, asam askorbat akan menghalangi terjadinya oksidasi. Pada kasus lain, jika enzim menyerang asam askorbat yang akan menghasilkan hydrogen peroksida yang mengoksidasi sehingga antosianin mengalami perubahan warna. ( Walford, John, 1989)
Warna pigmen antosianin merah, biru, violet, dan biasanya dijumpai pada bunga, buah-buahan dan sayur-sayuran. Dalam tanaman terdapat dalam bentuk
O
O
C6H5
flavon
tak berwarna
O
O
C6H5
flavon
glikosida yaitu membentuk ester dengan monosakarida (glukosa, galaktosa, ramnosa dan kadang-kadang pentosa). Sewaktu pemanasan dalam asam mineral pekat, antosianin pecah menjadi antosianidin dan gula. Pada pH rendah (asam) pigmen ini berwarna merah dan pada pH tinggi berubah menjadi violet dan kemudian menjadi biru. Pada umumnya, zat-zat warna distabilkan dengan penambahan larutan buffer yang sesuai. Jika zat warna tersebut memiliki pH sekitar 4 maka perlu ditambahkan larutan buffer asetat, demikian pula zat warna yang memiliki pH yang berbeda maka harus dilakukan penyesuaian larutan buffer.
Warna merah bunga mawar dan biru pada bunga jagung terdiri dari pigmen yang sama yaitu sianin. Perbedaannya adalah bila pada bunga mawar pigmennya berupa garam asam sedangkan pada bunga jagung berupa garam netral. Konsentrasi pigmen juga sangat berperan dalam menentukan warna. Pada konsentrasi yang encer antosianin berwarna biru, sebaliknya pada konsentrasi pekat berwarna merah dan konsentrasi biasa berwarna ungu. Adanya tanin akan banyak mengubah warna antosianin. Dalam pengolahan sayur-sayuran adanya antosianin dan keasaman larutan banyak menentukan warna produk tersebut. Misalnya pada pemasakan bit atau kubis merah. Bila air pemasaknya mempunyai pH 8 atau lebih (dengan penambahan soda) maka warna menjadi kelabu violet tetapi bila ditambahkan cuka warna akan mejadi merah terang kembali. Tetapi jarang makanan mempunyai pH yang sangat tinggi. Dengan ion logam, antosianin membentuk senyawa kompleks yang berwarna abu-abu violet. Karena itu pada pengalengan bahan yang mengandung antosianin, kalengnya perlu mendapat lapisan khusus (lacquer). ( Winarno, F.G, 2004 )
2.3. TEORI INDIKATOR
2.3.1. Teori Ion Indikator Menurut Ostwald
HIn H+ + In -dan InOH OH- + In+
warna warna tak ter- ter- ionisasi ionisasi
Dalam larutan asam, dengan adanya ion H+ berlebih, ionisasi akan tertekan (efek ion-sekutu) dan konsentrasi In- akan sangat kecil maka warna akan merupakan warna dari bentuk yang tidak terionisasi. Jika suasana basa, penurunan [H+] akan mengakibatkan ionisasi lebih lanjut, [In-] naik dan warna dari bentuk terionisasi menjadi nampak.
2.3.2. Gugus Kromofor
Warna dari suatu persenyawaan organik dipengaruhi oleh gugus kromofor. Gugus kromofor merupakan suatu persenyawaan organik yang dapat berwarna karena didalam molekulnya berisi suatu kumpulan atau gugus atom yang radikal ataupun kumpulan ikatan rangkap. Selain itu, warna senyawa organik juga dipengaruhi oleh suatu gugus lain yang disebut gugus auksokrom. Akan tetapi, gugus auksokrom dapat mempengaruhi warna persenyawan organik bilamana pada persenyawaan organik tersebut juga mengandung gugus kromofor. Perubahan warna dari suatu indikator adalah disebabkan perubahan intra molekuler dari struktur molekul indikator tersebut, dan perubahan intra molekuler tersebut berupa terbentuknya isomer yang baru. Jika terbentuk isomer yang baru yang berisi gugusan kromofor atau auksokrom, maka warna indikator itu akan berubah. Proses pembentukan isomer baru tersebut adalah reversibel. Sifat isomer yang dapat balik itu disebut dengan tautometri. Menurut teori kromofor ini setiap indikator berisi paling sedikit dua bentuk tautomer yang berbeda dalam bentuk maupun warnanya dan keduanya berada dalam keadaan setimbang. (Vogel, 1994)
2.4. Indikator Asam Basa
dalam larutan bersifat asam dan berwarna biru dalam larutan yang bersifat basa. Indikator asam-basa biasanya merupakan asam atau basa lemah, atau secara umum dapat dikatakan protolit lemah. Kesetimbangan asam-basa indikator yang berupa asam lemah dalam air dirumuskan sebagai berikut :
Ο
Disini In menunjukkan basa pasangan dari HIn (indikator asam lemah). Seperti terlihat dari persamaan diatas, asam dan basa pasangannya mempunyai warna yang berbeda. Itulah sebabnya warna larutan berubah dengan berubahnya pH larutan. Dalam larutan yang bersifat asam, bentuk yang banyak jumlahnya adalah bentuk yang terikat proton HIn, sedangkan dalam larutan yang bersifat basa bentuk yang bentuk yang tidak berproton In-.
Bila persamaan ini disusun ulang dan diselesaikan dengan mengambil logaritma negatifnya, maka diperoleh rumus sebagai berikut :
[ ][
]
Berdasarkan persamaan diatas dapat diramalkan apakah indikator berada dalam bentuk asam atau basanya, tergantung pada pH larutan. Suku terakhir dari persamaan itu adalah nisbah kepekatan antara bentuk basa dan bentuk asam indikator. Dengan demikian suku terakhir ini menentukan warna larutannya.
adalah bahwa untuk campuran dua warna pelengkap, mata hanya dapat mengenali perbahan rona warna bila nisbah kepekatan kedua bentuk indikator itu berkisar antara 10/1 dan 1/10. Misalnya, untuk bentuk basa berwarna biru dan bentuk asam berwarna merah, jika larutan mula-mula berwarna biru dan pH diturunkan dengan menambahkan asam, maka tidak akan terlihat perubahan warna sampai nisbah bentuk biru dan bentuk merah lebih kecil daripada 10/1. Kemudian warna berangsur-angsur berubah mulai dari ungu muda sampai akhirnya timbul warna merah bila nisbah kepekatan itu mencapai 1/10. Perubahan selanjutnya tidak terlihat lagi oleh mata. Bila kedua nisbah pembatas tersebut dimasukkan kedalam persamaan diatas, maka diperoleh selang peralihan warna indikator asam-basa, sebagai berikut :
Untuk [In-]/[HIn] = 10/1, diperoleh :
Gabungan kedua persamaan diatas adalah 1
± = HIn alih pK
pH
Jelas bahwa selang peralihan warna ini menunjukkan daerah pH tempat terjadinya perubahan warna indikator. Karena itu, dua kesimpulan penting dapat ditarik :
(a) Peralihan warna terletak dalam daerah pH yang tergantung pada tetapan protolisis indikator.
(b) Perubahan warna yang jelas terjadi pada kisaran pH yang tidak lebih dari dua satuan pH.
Dengan demikian, ika tersedia indikator yang mempunyai harga pKHIn yang
Menurut teori Bronsted-Lowry, suatu protolit dapat berperan sebagai indikator asam-basa tanpa memperhatikan muatannya. Karena itu indikator asam-basa bisa berupa senyawa netral, bermuatan positif atau negatif. Ada pula indikator yang mempunyai hanya satu warna saja. Ada beberapa perbedaan mendasar antara selang peralihan warna indikator dua warna dengan indikator satu warna. Untuk indikator dua warna, selang peralihannya tidak dipengaruhi oleh kepekatan indikator itu sendiri, kecuali mata lebih peka terhadap perubahan warna jika warna itu kurang kuat. Sebaliknya, dengan indikator satu warna, penampakan warna tergantung bukan hanya pada pH tetapi juga pada kepekatan indikator itu. Misalnya, fenolftalein adalah indikator satu warna dengan selang peralihannya pada pH = 8,0 – 9,8 (dari mula-mula timbulnya warna sapai tidak terjadi perubahan warna lagi). Bentuk asamnya tak berwarna dan bentuk basanya berwara merah.
Tetapi dalam larutan yang bersifat sangat basa, bentuk tak berwarna muncul lagi. Selang peralihan ini ditentukan dengan sejulah volume tertentu larutan indikator 0,1%. Jika jumlah volume yang sama larutan indikator 1% digunakan, munculnya warna merah pertama akan berada pada satu satuan pH lebih rendah, misalnya pada pH = 7,0. Alasan lain menjaga kepekatan yang ditetapkan adalah karena semua indikator adalah asam atau basa dan jika digunakan dengan kepekatan tinggi maka indikator ini dapat mempengaruhi kesetimbangan asam-basa keseluruhan. Untunglah indikator-indikator yang sering digunakan begitu kuat warnanya sehigga pengaruh-pengaruh peralihan mudah kelihatan dengan kepekatan 10-4 – 10-5 M. Pada kepekatan serendah itu indikator-indikator ini tidak akan mempengaruhi kesetimbangan asam-basa sistem. ( Rivai, H, 1995 )
2.4.1. Trayek pH
basa berarti pH lebih besar dari trayek indikator atau trayek perubahan warna yang bersangkutan. Biru bromotimol mempunyai trayek indikator (atau trayek pH) dari pH 6,0 sampai 7,6; maka warna asam ialah warnanya bila pH larutan kurang dari 6,0 dan warna basa tampak bila pH larutan lebih dari 7,6. Berapapun pH-nya warna akan biru asal pH ≥ 7,6; tidak ada beda warna antara pH 8 dan 11 atau 13,5. Lain halnya bila pH terletak di dalam trayek pH. Pada tiap pH yang berbeda akan tampak warna yang lain pula; untuk biru bromotimol warna itu suatu campuran antara kuning dan biru, dan lebih banyak kuning bila mendekati 6,0 demikian sebaliknya.
Jadi, di luar trayek pH, indikator hanya menampakkan warna asam atau warna basa tanpa tergantung dari pH sesungguhnya, sedang di dalam trayek terlihat warna yang berbeda-beda sesuai dengan pH sebenarnya. Dengan perkataan lain kita dapat menentukan pH suatu bahan berdasar warna indikator asal nilainya terletak dalam trayek pH indikator yang dipakai. ( Harjadi, W, 1986 )
2.4.2. Pemilihan Indikator Yang Sesuai
Untuk mudahnya, mari kita beri nama suatu indikator asam sebagai HIn, dan indikator basa sebagai In. Persamaan penguraiannya adalah
−
Tetapan penguraian dari asam adalah
[ ][ ]
Dalam bentuk logaritmanya, ini menjadi
[ ]
ber-pH tinggi, In- akan menonjol dan warnanya akan berubah menjadi kuning. Pada nilai pH menengah, dimana kedua bentuk berada dalam konsentrasi yang hampir sama,
warnanya mungkin oranye.
Perubahan pH minimum yang dibutuhkan untuk perubahan warna ini diacu sebagai rentang indikator.
pH LARUTAN RASIO
Oranye Rentang Kuning
Kuning Kuning
Dalam contoh diatas, rentangnya adalah dari 4 sampai 6. Pada nilai pH menengah, warna yang ditunjukkan oleh indikator bukan merah maupun kuning tetapi mendekati oranye. Pada pH 5, yakni pKa dari HIn, kedua bentuk yang berwarna tersebut memiliki konsentrasi yang sama; artinya, HIn separuh ternetralkan. Ini berarti bahwa pKa dari indikator adalah 5, dan rentangnya kira-kira dari pH 4 sampai 6. Dan didalam pemilihan indikator yang sesuai, haruslah dipilih indikator yang berubah warna di sekitar titik ekivalen dari titrasi. ( Underwood, A.L, 1990 )
2.5. Analisis Titrimetri
titrant yang ditambakan tampak telah ekivalen, maka penambahan titrant harus dihentikan; saat ini dinamakan titik akhir titrasi. Larutan yang ditambahkan dari buret disebut titrant, sedangkan larutan yang ditambah titrant itu disebut titrat. Dengan jalan ini, volume/berat titrant dapat diukur dengan teliti dan bila konsentrasi titrant juga diketahui, maka jumlah mol titrant dapat dihitung. Karena jumlah titrat ekivalen dengan jumlah titrant, maka jumlah mol titrat dapat diketahui pula berdasar persamaan reaksi dan koefisiennya.
Tidak semua reaksi dapat digunakan sebagai reaksi titrasi. Untuk itu reaksi harus memenuhi syarat-syarat berikut :
1. Berlangsung sempurna, tunggal dan menurut persamaan yang jelas (dasar teoritis). 2. Cepat dan reversible (dasar praktis). Bila tidak cepat, titrasi akan memakan waktu
terlalu banyak.
3. Ada penunjuk akhir titrasi (indikator). Penunjuk itu dapat :
- Timbul dari reaksi itu sendiri, misalnya : titrasi campuran asam oksalat dan asam sulfat oleh KMnO4
- Berasal dari luar, dan dapat berupa suatu zat (atau suatu alat) yang dimasukkan ke dalam titrat. Zat itu disebut indikator and menunjukkan akhir titrasi, karena (a) menyebabkan perubahan warna titrat atau (b) menimbulkan perubahan kekeruhan dalam titrat
4. Larutan baku yang direaksikan dengan analat harus mudah didapat dan sederhana menggunakannya; juga harus stabil sehingga konsentrasinya tidak mudah berubah bila disimpan.
Macam-macam titrasi dapat dibedakan menjadi :
A. Titrasi berdasarkan reaksi-reaksi metatetik, yaitu reaksi pertukaran ion. Disini tidak ada unsur yang berubah tingkat oksidasinya. Pembagian titrasi jenis ini :
1. Titrasi Asidimetri-Alkalimetri, yaitu titrasi yang menyangkut asam dan/atau basa. Dalam titrasi ini perubahan terpenting yang mendasari penentuan titik akhir dan cara perhitungan ialah peruahan pH titrat.
2. Titrasi Presipitimetri, yaitu titrasi dimana terbentuk endapan. Semakin kecil kelarutan endapan, semakin sempurna reaksinya.
B. Titrasi berdasarkan reaksi redoks, yaitu perpindahan elektron; disini terdapat unsur-unsur yang mengalami perubahan tingkat oksidasi.
Agar memenuhi syarat reaksi sempurna, maka dalam titrasi redoks, titrat dan titrant harus berbeda besar dalam kekuatan oksidasi-reduksinya. (Harjadi, W, 1990)
2.5.1. Titrasi Asam Basa
Titrasi asam-basa sering disebut asidimetri-alkalimetri, sedang untuk titrasi atau pengukuran lain-lain sering juga dipakai akhiran –ometri menggantkan –imetri. Kata metri berasal dari bahaas Yunani yang berarti ilmu, jadi asidimetri dapat diartikan pengukuran jumlah asam ataupun pengukuran dengan asam (yang diukur jumlah basa atau garam). Secara tersirat diutarakan sebelumnya bahwa titrasi asidimetri-alkalimetri menyangkut reaksi dengan asam dan/atau basa, diantaranya :
1. asam kuat – basa kuat 2. asam kuat – basa lemah 3. asam lemah – basa kuat
4. asam kuat – garam dari asam lemah 5. basa kuat – garam dari basa lemah
2.5.2. Kurva Titrasi Asam Basa
Larutan yang dititrasi dalam asidimetri-alkalimetri mengalami perubahan pH. Misalnya bila larutan asam dititrasi dengan basa, maka pH larutan mula-mula rendah dan selama titrasi terus-menerus naik. Bila pH ini diukur dengan pengukur pH (pH meter) pada awal titrasi (yakni sebelum ditambah basa) pada waktu-waktu tertentu setelah titrasi dimulai, maka kalau pH larutan dialurkan lawan volume titrant, kita peroleh grafik yang disebut kurva titrasi.
Pada gambar ( I ) diambil contoh asam hidroklorida dan natrium hidroksida sebagai asam kuat dan basa kuat.
Dapat terlihat bahwa pH hanya menurun dalam jumlah yang sangat sedikit sekali sampai mendekati titik ekivalen. Kemudian kurva tersebu melonjak turun dengan sangat curam. Gambar ( II ) dimisalkan asam hidroklorida sebagai asam kuat dan larutan amonia sebagai basa lemah.
( I ) ( II )
Pada bagian permulaan kurva, pH menurun dengan cepat seiring dengan penambahan asam, tetapi kemudian kurva segera berubah dengan tingkat kecuraman yang berkurang. Hal ini karena terbentuk kelebihan amonia dan pembentukan amonium klorida. Sedangkan Gambar ( III ) dengan mengambil asam etanoat dan natrium hidroksida sebagai asam lemah dan basa kuat.
Untuk bagian pertama dari gambar, diperoleh kelebihan natrium hidroksida. Sekali saja ada kelebihan asam, maka akan terjadi suatu hal yang berbeda. Setelah titik ekivalen diperoleh larutan penyangga yang mengandung natrium etanoat dan asam etanoat. Larutan penyangga ini menahan penurunan pH yang drastis. Berbeda pada gambar ( IV ) contoh yang biasa untuk kurva titrasi asam lemah dan basa lemah adalah asam etanoat dan amonia.
Hal ini juga terjadi karena keduanya bersifat lemah – pada kasus tersebut, titik ekivalen kira-kira terletak pada pH 7. Terlihat bahwa kurva tersebut sedikit tidak curam pada gambar ini. Lebih lagi, terdapat sesuatu yang dikenal dengan "titik infleksi". Kecuraman yang berkurang berarti bahwa sulit melakukan titrasi antara asam lemah vs basa lemah. 2009 )
Langkah pertama untuk dapat memahami dan menginterpretasikan proses titrasi kedalam kurva titrasi adalah menuliskan reaksi kimia antara titrant dan analit. Kemudian reaksi tersebut digunakan untuk menghitung komposisi dan pH setelah setiap penambahan titrant. Sebagai contoh, 50 mL KOH 0,020 M dititrasi dengan HBr 0,100 M. Persamaan reaksi antara titrant dan analit adalah
H + + OH - H2O
Karena konstanta kesetimbangan untuk reaksi ini adalah 1/Kw = 1014, dapat dikatakan
stoikiometri oleh sejumlah OH -. Perhitungan jumlah volume HBr diperlukan untuk mendapatkan titik ekivalen (Ve).
(Ve (mL))(0,100 M) = (50,00 mL)(0,020 M) Ve = 10,00 mL mmol HBr (titik ekivalen) mmol OH – yang dititrasi
Terlihat bahwa saat penambahan 10,00 mL HBr, titrasi sebenarnya telah selesai. Dalam titrasi basakuat dengan asam kuat, ada tiga bagian dari kurva titrasi yang dapat ditampilkan :
1. Sebelum mencapai titik ekivalen, pH ditentukan dengan kelebihan OH – dalam larutan
2. Pada titik ekivalen, H + tepat bereaksi dengan OH - membentuk H2O. Harga
pH ditentukan oleh derajat disosiasi air.
3. Setelah titik ekivalen, pH ditentukan oleh kelebihan H + dalam larutan.
( Harris, Daniel C, 1982 ) Dalam menentukan harga pKa indikator, ditarik garis tegak lurus terhadap titik yang bersinggungan dengan titik curam kurva, yang ditunjukkan oleh garis putus-putus diatas. Demikian juga halnya dalam penentuan pKa indikator yang lain. Akan tetapi dengan memperhatikan volume titrasi dari titrant yang digunakan pada berbagai jenis titrasi yang dilakukan.
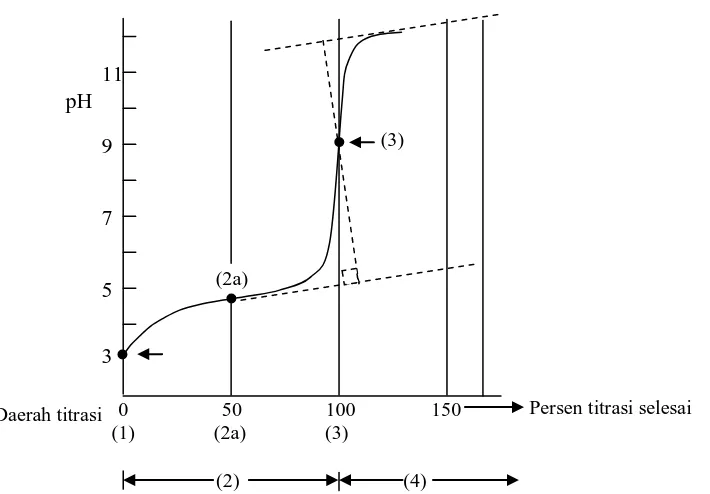
Pada dasarnya kurva juga dapat kita peroleh dengan menghitung pH larutan secara teori. Untuk itu dibedakan empat daerah titrasi :
1. Titik awal, yakni sebelum titrasi dimulai (0% titrant), pH disini adalah pH titrat.
2. Daerah sebelum titik ekivalen. Larutan berisi sisa titrat dan haisl reaksi antara titrat dan titrant; pH ialah pH larutan campuran tersebut; (2a): titik tengah (50% selesai).
4. Daerah setelah titik ekivalen. Larutan berisi hasil titrasi dan kelebihan titrant; pH ialah pH larutan campuran ini.
Gambar pembagian kurva titrasi menjadi daerah-daerah titrasi.
( Harjadi, W, 1986 )
(4) (2)
Persen titrasi selesai Daerah titrasi
(3) (2a)
(1)
pH
(3)
(2a)
3 5 7 9 11
BAB 3
BAHAN DAN METODE PENELITIAN
3.1. Alat-alat
Nama Alat Merek
Rotary Evaporator Buchi B-480 Timbangan Elektrik Mettler PM400
Buret Pyrex
Statif dan Klem - Peralatan gelas Pyrex
pH Meter WTW 330i
Botol vial -
Kertas saring Whatman
Spectronic 20 Milton Roy
3.2. Bahan-bahan
Nama Bahan Merek
Etanol (pa) E. Merck
NaOH pellet E. Merck
H2C2O4.2H2O E. Merck
Na2CO3(pa) E. Merck
HCl(p) E. Merck
FeCl3.6H2O(pa) E. Merck
Indikator Universal E. Merck Indikator Fenolftalein E. Merck Indikator Biru Bromotimol E. Merck Indikator Jingga Metil E. Merck
Akuades -
3.3. Prosedur Penelitian
3.3.1. Pembuatan Pereaksi
a. Larutan asam oksalat H2C2O4.2H2O 0,1 N
Sebanyak 3,150 gram kristal H2C2O4.2H2O ditimbang secara kuantitatif,
dimasukkan kedalam labu takar 500 mL, dilarutkan dengan akuades secukupnya. Kemudian diencerkan dengan akuades sampai garis tanda pada labu takar.
b. Larutan NaOH 0,1 N
Sebanyak 2,000 gram kristal NaOH ditimbang secara kuantitatif, dimasukkan kedalam labu takar 500 mL, dilarutkan dengan akuades secukupnya. Kemudian diencerkan dengan akuades sampai garis tanda pada labu takar.
Pembakuan larutan NaOH
- Dipipet dengan tepat 5 mL larutan NaOH kedalam labu erlenmeyer 100 mL. - Kemudian kedalam larutan ini ditambahkan 3 tetes indikator fenolftalein dan
dititrasi dengan larutan baku primer H2C2O4.2H2O 0,1 N sampai larutan tidak
berwarna
- Dicatat volume H2C2O4.2H2O 0,1 N dan titrasi diulangi sebanyak tiga kali
c. Larutan HCl 0,1 N
Sebanyak 4,14 mL larutan HCl 37% dipipet menggunakan pipet ukur, dimasukkan kedalam labu takar 500 mL yang telah berisi akuades secara perlahan-lahan. Kemudian diencerkan dengan akuades hingga garis tanda pada labu takar. Pembakuan larutan HCl
- Dipipet dengan tepat 5 mL larutan baku sekunder HCl kedalam labu erlenmeyer 100 mL.
- Kemudian kedalam larutan ini ditambahkan 3 tetes indikator jingga metil dan dititrasi dengan larutan Na2CO3 0,1 N sampai terbentuk warna kuning
- Dicatat volume Na2CO3 0,1 N dan titrasi diulangi sebanyak 3 kali.
Perhitungan normalitas HCl sesungguhnya : Volume Na2CO3 0,1 N = 4,98 mL
Sebanyak 1,325 gram kristal Na2CO3 ditimbang secara kuantitatif, dimasukkan
kedalam labu takar 250 mL, dilarutkan dengan akuades secukupnya. Kemudian diencerkan dengan akuades sampai garis tanda pada labu takar.
e. Larutan Fenolftalein 1%
f. Larutan Biru Bromotimol 1%
Sebanyak 1,000 gram biru bromotimol ditimbang secara kuantitatif, dimasukkan kedalam labu takar 100 mL. Dilarutkan dengan 1,60 mL NaOH 0,1 N. Kemudian diencerkan dengan akuades sampai garis tanda pada labu takar.
g. Larutan Jingga Metil 1%
Sebanyak 1,000 gram jingga metil ditimbang secara kuantitatif, dimasukkan kedalam labu takar 100 mL. Dilarutkan dengan akuades. Kemudian diencerkan dengan akuades sampai garis tanda pada labu takar dan disaring jika ada endapan.
h. Larutan FeCl3 1%
Sebanyak 1,000 gram kristal FeCl3 ditimbang secara kuantitatif, dimasukkan
kedalam labu takar 100 mL. Dilarutkan dengan akuades. Ditambahkan beberapa tetes HCl pekat sampai seluruh kristal larut. Kemudian diencerkan dengan akuades sampai garis tanda pada labu takar.
i. Larutan Ekstrak Pekat Kulit Ubi Jalar Segar
Sebanyak 100,000 gram kulit ubi jalar segar direndam dengan menggunakan alkohol, lalu disaring, kemudian ekstrak dipekatkan pada rotary evaporator pada tekanan rendah sampai volumenya menjadi kira-kira seperlima volume awal.
3.3.2. Perlakuan terhadap sampel
a. Pembuatan Ekstrak Pekat Kulit Ubi Jalar Segar
- Sampel kulit ubi jalar yang segar ditimbang sebanyak 100,000 gram dengan menggunakan timbangan elektrik.
- Kemudian dihaluskan dan dimasukkan ke dalam beaker glass.
- Kedalam beaker glass yang berisi sampel kulit ubi jalar segar ditambahkan pelarut Etanol – 1%HCl serta dibiarkan selama satu malam sampai sebagian besar zat warna larut dalam pelarut dan didekantasi untuk memperoleh ekstrak.
- Ekstrak yang diperoleh dipekatkan dengan menggunakan rotary evaporator sampai volumenya menjadi kira-kira seperlima volume ekstrak awal.
b. Uji Kualitatif Senyawa Fenol
- dimasukkan ekstrak kulit ubi jalar ke dalam tabung reaksi - ditambahkan larutan besi (III) klorida 1%
- diamati, jika ekstrak mengandung senyawa fenol akan diperoleh larutan berwarna hijau, merah ungu, biru atau hitam yang kuat.
c. Uji Kualitatif Antosianin
- dimasukkan ekstrak kulit ubi jalar ke dalam kuvet
- diukur %T-nya pada panjang gelombang 500 nm, 505 nm, 510 nm sampai 550 nm - dihitung nilai absorbansi yang diperoleh dari %T pada tiap panjang gelombang, jika ekstrak mengandung antosianin jenis pelargonidin akan diperoleh absorbansi
maksimum pada panjang gelombang 520 nm
d. Uji Warna Ekstrak Kulit Ubi Jalar pada Berbagai Larutan pH
- ditambahkan 3 tetes ekstrak kulit ubi jalar masing-masing ke dalam larutan pH 1–14 - diamati perubahan warna yang terjadi
e. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Zat Warna
Ekstrak Pekat Kulit Ubi Jalar
- Dipipet dengan tepat sebanyak 5 ml H2C2O4.2H2O 0,1 N ke dalam erlenmeyer 250
mL.
- Kemudian kedalam larutan ini ditambahkan 3 tetes indikator zat warna ekstrak pekat kulit ubi jalar dan dititrasi dengan larutan NaOH 0,0993 N sampai terbentuk
warna hijau
- Dicatat volume NaOH dan titrasi diulangi sebanyak 5 kali
f. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Fenolftalein
- Dipipet dengan tepat sebanyak 5 mL larutan H2C2O4.2H2O 0,1 N kedalam
erlenmeyer 250 mL.
- Kemudian kedalam larutan ini ditambahkan 3 tetes indikator fenolftalein dan dititrasi dengan larutan NaOH 0,0993 N sampai terbentuk warna merah lembayung.
g. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Jingga Metil.
- Dipipet dengan tepat sebanyak 5 mL larutan Na2CO3 0,1 N kedalam erlenmeyer
250 mL.
- Kemudian kedalam larutan ini ditambahkan 3 tetes indikator jingga metil dan dititrasi dengan larutan HCl 0,0997 N sampai terbentuk warna merah.
- Dicatat volume HCl dan titrasi diulangi sebanyak 5 kali.
h. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Zat Warna
Ekstrak Pekat Kulit Ubi Jalar
- Dipipet dengan tepat sebanyak 5 mL larutan Na2CO3 0,1 N kedalam erlenmeyer
250 mL.
- Kemudian kedalam larutan ini ditambahkan 3 tetes indikator zat warna ekstrak pekat kulit ubi jalar dan dititrasi dengan larutan HCl 0,0997 N sampai terbentuk warna merah ros.
- Dicatat volume HCl dan titrasi diulangi sebanyak 5 kali.
i. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Biru
Bromotimol
- Dipipet dengan tepat sebanyak 5 mL larutan HCl 0,0997 N kedalam erlenmeyer 250 mL.
- Kemudian kedalam larutan ini ditambahkan 3 tetes indikator biru bromotimol dan dititrasi dengan larutan NaOH 0,0993 N sampai terbentuk warna hijau-kebiruan. - Dicatat volume HCl dan titrasi diulangi sebanyak 5 kali.
j. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Zat Warna
Ekstrak Pekat Kulit Ubi Jalar
- Dipipet dengan tepat sebanyak 5 mL larutan HCl 0,0997 N kedalam erlenmeyer 250 mL.
- Kemudian kedalam larutan ini ditambahkan 3 tetes indikator zat warna ekstrak pekat kulit ubi jalar dan dititrasi dengan larutan NaOH 0,0993 N sampai terbentuk larutan tidak berwarna.
3.4. Bagan Penelitian
a. Pembuatan Ekstrak Kulit Ubi Jalar
dihaluskan
direndam dengan alkohol – 1% HCl selama 24 jam disaring
Dipekatkan dengan rotary evaporator sampai volumenya 1/5 volume awal
b. Uji Kualitatif Senyawa Fenol
Dimasukkan ke dalam tabung reaksi Ditambahkan FeCl3 1%
Diamati
c. Uji Kualitatif Antosianin
diukur %T-nya pada panjang gelombang 500 nm, 505 nm, 510 nm sampai 550 nm
dihitung absorbansi pada masing-masing panjang gelombang 100gr Kulit Ubi Jalar Segar
Filtrat Residu (dibuang)
Ekstrak kulit ubi jalar
Hasil
Ekstrak kulit ubi jalar Filtrat Pekat
d. Perubahan Warna Ekstrak Kulit Ubi Jalar oleh pH Larutan
Diamati perubahan warnanya pada pH 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14
e. Perlakuan Titrasi Asam Basa dengan menggunakan Indikator Fenolftalein
Ditambah 3 tetes indikator Fenolftalein Dititrasi dengan NaOH 0,0993 N
Titrasi diakhiri sampai larutan merah lembayung
f. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Zat Warna
Ekstrak Kulit Ubi Jalar
Ditambah 3 tetes zat warna ekstrak kulit ubi jalar Dititrasi dengan NaOH 0,0993 N
Titrasi diakhiri sampai larutan hijau Larutan Ekstrak Pekat Kulit Ubi Jalar
Warna Ekstrak Pekat Kulit Ubi Jalar pada pH asam dan pH basa
H2C2O4 0,1 N
Hasil
H2C2O4 0,1 N
g. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Jingga
Metil
Ditambah 3 tetes indikator jingga metil Dititrasi dengan HCl 0,0997 N
Titrasi diakhiri sampai larutan merah
h. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Zat Warna
Ekstrak Pekat Kulit Ubi Jalar
Ditambah 3 tetes zat warna ekstrak kulit ubi jalar Dititrasi dengan HCl 0,0997 N
Titrasi diakhiri sampai larutan merah ros
i. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Biru
Bromotimol
Ditambah 3 tetes indikator biru bromotimol Dititrasi dengan NaOH 0,0993 N
Titrasi diakhiri sampai larutan hijau kebiruan Na2CO3 0,1 N
Hasil
Na2CO3 0,1 N
Hasil
HCl 0,0997 N
j. Perlakuan Titrasi Asam-basa dengan menggunakan Indikator Zat Warna
Ekstrak Kulit Ubi Jalar
Ditambah 3 tetes zat warna ekstrak pekat kulit ubi jalar Dititrasi dengan NaOH 0,0993 N
Titrasi diakhiri sampai larutan tidak berwarna HCl 0,0997 N
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Data hasil percobaan yang diperoleh menunjukkan pada tabel sebagai berikut :
Tabel 4.3. Hasil Titrasi H2C2O4 0,1 N dengan NaOH 0,0993 N
Perulangan
INDIKATOR
Fenolftalein Ekstrak Kulit Ubi
1 5,04 mL 5,08 mL
2 5,04 mL 5,06 mL
3 5,06 mL 5,08 mL
4 5,04 mL 5,08 mL
5 5,06 mL 5,06 mL
Rata-rata 5,048 mL 5,072 mL
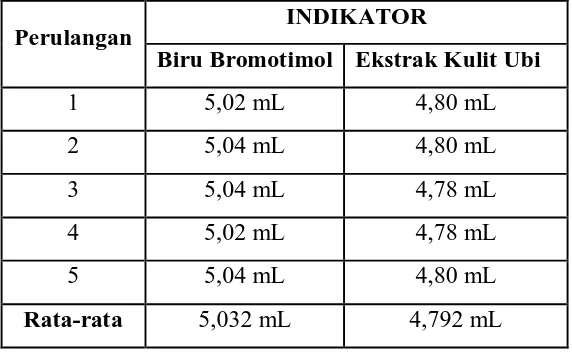
Tabel 4.4. Hasil Titrasi HCl 0,0997 N dengan NaOH 0,0993 N
Perulangan INDIKATOR
Biru Bromotimol Ekstrak Kulit Ubi
1 5,02 mL 4,80 mL
2 5,04 mL 4,80 mL
3 5,04 mL 4,78 mL
4 5,02 mL 4,78 mL
5 5,04 mL 4,80 mL
Tabel 4. 5. Hasil Titrasi Na2CO3 0,1 N dengan HCl 0,0997 N
Perulangan
INDIKATOR
Jingga Metil Ekstrak Kulit Ubi
1 4,96 mL 4,90 mL
2 4,96 mL 4,90 mL
3 4,98 mL 4,88 mL
4 4,98 mL 4,90 mL
5 4,96 mL 4,88 mL
Rata-rata 4,968 mL 4,892 mL
Tabel 4.8. Data Persen Kesalahan Hasil Titrasi (Konsentrasi)
Perlakuan Indikator Persen
Kesalahan Indikator
Persen
Kesalahan
Titrasi H2C2O4 dengan NaOH
Phenolphtalein 0,2 % Ekstrak Kulit Ubi Jalar
0,7 %
Titrasi NaOH dengan HCl
Bromtimol Blue 0,2 % Ekstrak Kulit Ubi Jalar
4,6 %
Titrasi Na2CO3 dengan HCl
Metil Orange 1 % Ekstrak Kulit Ubi Jalar
4.2. Pengolahan Data
4.2.1. Langkah-langkah Perhitungan Rancangan Acak Lengkap dari Data
Penelitian
Hipotesa :
Ho = Apabila ekstrak kulit ubi jalar tidak dapat dimanfaatkan sebagai indikator pada titrasi asam basa.
Hi = Apabila ekstrak kulit ubi jalar dapat dimanfaatkan sebagai indikator pada titrasi asam basa.
Langkah-langkah perhitungan : Correction Factor (CF) =
n
Samsquare antarperlakuan (SSP) = CF
2
Meansquare antarperlakuan (MSP) =
= 0,0001
Harga F pada tabel adalah
F0,05 ; 1,8 = 5,32
besar perbedaan antara indikator fenolftalein dengan ekstrak kulit ubi jalar digunakan pengujian dengan mencari Leat Significance Difference (LSD).
LSD0,05 antara
Χ dicari sebagai berikut :
LSD0,05 = t0,05 ; df = n – k
Nilai LSD0,05 dibandingkan dengan beda mean dari masing-masing perlakuan
sehingga diperoleh:
Beda mean antara Besar beda mean LSD0,05 Kesimpulan
Ind. FF vs Ind. Ekstrak 0,024 0,0504 Beda tidak signifikan
Dengan menggunakan perhitungan yang sama untuk indikator biru bromotimol dan jingga metil maka dilakukan pengujian LSD0,05 yang menunjukkan perbedaan sebagai
berikut :
Beda mean antara Besar beda mean LSD0,05 Kesimpulan
4.3. Pembahasan
Dari hasil penelitian yang dilakukan ada beberapa hal yang perlu dikemukakan:
Analisis variansi untuk mengetahui pengaruh indikator fenolftalein pada titrasi H2C2O4 0,1 N dengan NaOH 0,0993 N menunjukkan bahwa rata-rata volume titrasi
indikator fenolftalein dengan ekstrak kulit ubi jalar sebesar 0,024. Lebih kecil dibandingkan dengan harga LSD0,05 sebesar 0,0504. Oleh karena itu pemanfaatannya
berbeda tidak signifikan.
Analisis variansi untuk mengetahui pengaruh indikator biru bromotimol pada titrasi NaOH 0,0993 N dengan HCl 0,0997 N menunjukkan bahwa rata-rata volume titrasi indikator biru bromotimol dengan ekstrak kulit ubi jalar sebesar 0,256. Lebih besar dibandingkan dengan harga LSD0,05 sebesar 0,0504. Oleh karena itu
pemanfaatannya berbeda signifikan.
Analisis variansi untuk mengetahui pengaruh indikator jingga metil pada titrasi Na2CO3 0,1 N dengan HCl 0,0997 N menunjukkan bahwa rata-rata volume titrasi
indikator jingga metil dengan ekstrak kulit ubi jalar sebesar 0,076. Lebih besar dibandingkan dengan harga LSD0,05 sebesar 0,0504. Oleh karena itu pemanfaatannya
berbeda signifikan.
Persen kesalahan hasil titrasi H2C2O4 0,1 N dengan NaOH 0,0993 N dengan
menggunakan indikator fenolftalein diperoleh sebesar 0,2% sedangkan dengan menggunakan indikator ekstrak kulit ubi jalar diperoleh 0,7%. Oleh karena itu perbandingan persen kesalahannya sebesar 0,5%.
Persen kesalahan hasil titrasi Na2CO3 0,1 N dengan HCl 0,0997 N dengan
menggunakan indikator jingga metil diperoleh sebesar 1% sedangkan dengan menggunakan indikator ekstrak kulit ubi jalar diperoleh 2,5%. Oleh karena itu perbandingan persen kesalahannya sebesar 1,5%.
Dari hasil penelitian yang dilakukan diperoleh perubahan warna yang terjadi dari ekstrak kulit ubi jalar sebagai berikut : pada pH 1-6 berwarna merah ros; pada pH 7-8 tidak berwarna; pada pH 9-10 merah ros; pada pH 11 - 13 berwarna hijau; pada pH 14 berwarna kuning.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang dilakukan dapat diambil kesimpulan bahwa ekstrak pekat kulit ubi jalar dapat digunakan sebagai indikator basa khususnya pada titrasi asam lemah dengan basa kuat. Hasil yang diperoleh pada titrasi asam lemah dengan basa kuat menggunakan indikator fenolftalein menunjukkkan persen kesalahan yang berbeda tetapi perbedaannya tidak signifikan (berbeda sebesar 0,5%) dengan menggunakan indikator ekstrak kulit ubi jalar pada titrasi yang sama.
5.2. Saran
DAFTAR PUSTAKA
Badan Penelitian dan Pengembangan Pertanian.2009. Bithilo, Camilan Lezat Bergizi Dari Ubi Jalar Ungu.
2009.
Clark, Jim.2007.Kurva pH (Titrasi).
http://www.chem-is-try.org/Kurva pH (Titrasi). Diakses tanggal 8 Agustus 2009.
Day, IR, R.A, and Underwood, A. L. 1980. Analisis Kimia Kuantitatif. Edisi Keempat. Jakarta : Penerbit Erlangga.
Deputi Menegristek Bidang Pendayagunaan dan Pemasyarakatan Ilmu Pengetahuan dan Teknologi. 2009. Budidaya Ubi Jalar.
Agustus 2009.
Edward T, George, William C, Evans. 1983. Pharmacognosy. Twelveth Edition. London : Bailliere Tindall.
Fessenden dan Fessenden. 1986. Kimia Organik. Terjemahan Aloysius Hadyana P., Edisi Ketiga. Jilid 2. Jakarta : Penerbit Erlangga.
Harborne, J.B. 1987. Metode Fitokimia. Bandung : Penerbit ITB.
Harris, Daniel C. 1982. Quantitative Chemical Analysis. USA : W.H. Freeman and Company.
Harjadi, W. 1986. Ilmu Kimia Analitik Dasar. Edisi Pertama. Jakarta : Penerbit PT Gramedia.
Markham, K.R. 1988. Cara Mengidentifikasi Flavonoid. Bandung : Penerbit ITB Plantamor. Ubi Jalar.
2009.
Rivai, H. 1995..Asas Pemeriksaan Kimia. Jakarta : Penerbit Universitas Indonesia. Setyono, Agus, Suparyono. 1995. Teknik Budidaya Dan Penanganan Pasca Panen
Stavin.General Anthocyanin Structure
Vogel. 1994. Kimia Analisis Kuantitatif Anorganik. Edisi Keempat. Jakarta : Penerbit
Buku Kedokteran EGC.
Walford, J. 1989. Developments In Fod Colours-2. London : Elsevier Applied Science Publishers.
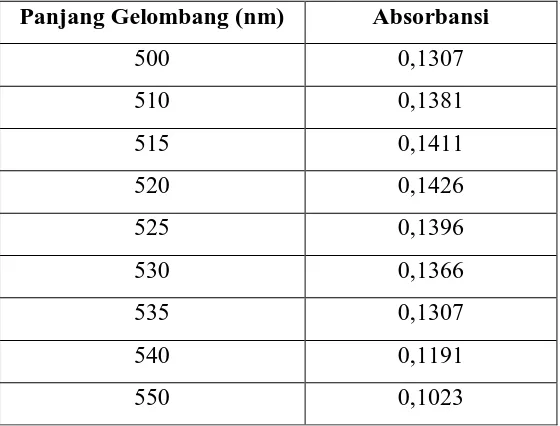
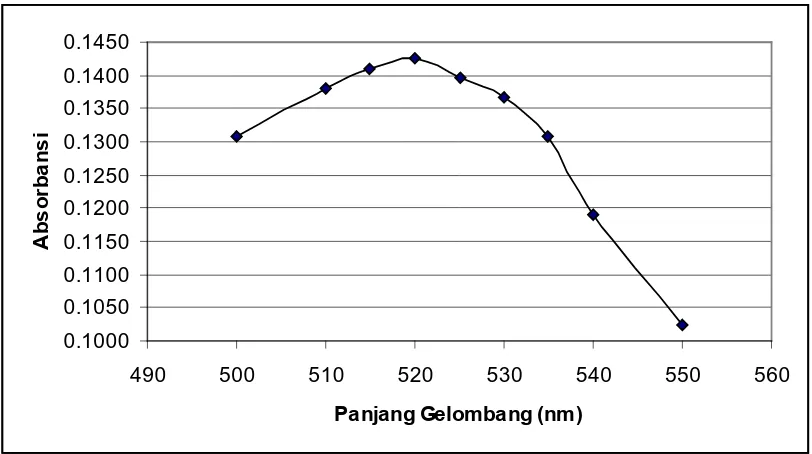
Tabel 1. Data Hasil Pengukuran Absorbansi Ekstrak Kulit Ubi Jalar
Panjang Gelombang (nm) Absorbansi
500 0,1307
510 0,1381
515 0,1411
520 0,1426
525 0,1396
530 0,1366
535 0,1307
540 0,1191
550 0,1023
Tabel 2. Data perubahan warna ekstrak kulit ubi jalar
Kisaran pH Perubahan Warna
1 Merah ros
2 Merah ros
3 Merah ros
4 Merah ros
5 Merah ros
6 Merah ros
7 Tak Berwarna
8 Tak Berwarna
9 Merah ros
10 Merah ros
11 Hijau Kebiruan
12 Hijau
13 Hijau
0.1000
490 500 510 520 530 540 550 560
Panjang Gelombang (nm)
Gambar 1. Kurva Absorbansi Ekstrak Kulit Ubi Jalar
Tabel 4.6. Data Hasil Perhitungan pH Titik Akhir Titrasi
Perlakuan Indikator pH Indikator pH
Titrasi H2C2O4 dengan NaOH
Phenolphtalein 10,07 Ekstrak Kulit Ubi Jalar
10,55
Titrasi NaOH dengan HCl
Bromtimol Blue 10,03 Ekstrak Kulit Ubi Jalar
2,64
Titrasi Na2CO3 dengan HCl
Metil Orange 5,66 Ekstrak Kulit Ubi Jalar
5,23
Tabel 4.7. Data Hasil Konsentrasi Titrasi
Perlakuan Indikator Konsentrasi Indikator Konsentrasi
Titrasi H2C2O4 dengan NaOH
Phenolphtalein 0,1002 N Ekstrak Kulit Ubi Jalar
0,1007 N
Titrasi NaOH dengan HCl
Bromtimol Blue 0,0999 N Ekstrak Kulit Ubi Jalar
0,0951 N
Titrasi Na2CO3 dengan HCl
Metil Orange 0,0990 N Ekstrak Kulit Ubi Jalar