1 PENGGUNAAN UBI JALAR UNGU (Ipomoea batatas L.) SEBAGAI INDIKATOR
ALAMI DALAM TITRASI ASAM BASA
Syarif Hamdani1, Cynthia Vinawati1, Adang Firmansyah1 1Sekolah Tinggi Farmasi Indonesia, Bandung
ABSTRAK
Ubi jalar ungu memiliki warna ungu disebabkan kandungan zat warna antosianin. Antosianin merupakan zat warna yang tersebar luas dalam tanaman dan termasuk golongan flavonoid. Beberapa tanaman yang mengandung zat warna antosianin dapat digunakan untuk membedakan larutan asam dan basa pada larutan. Penelitian dilakukan untuk mengkaji kemungkinan penggunaan zat warna dalam ubi jalar ungu sebagai indikator alami dalam titrasi asam basa dengan menentukan pelarut yang baik untuk proses ekstraksi, menentukan trayek pH, mengetahui kestabilan ekstrak, dan aplikasinya dalam titrasi asam basa. Ekstraksi ubi jalar ungu dilakukan dengan metode ekstraksi bertingkat menggunakan pelarut n-heksan, etil asetat, etanol 95% dan aquadest. Ekstrak cair etanol memberikan hasil terbaik ditunjukkan dengan warna yang berbeda dalam lingkungan asam dan basa pada trayek pH 6,0-7,0 dengan perubahan warna dari merah jambu menjadi hijau muda. Ekstrak etanol merupakan ekstrak yang paling stabil. Ekstrak etanol lebih stabil pada pH rendah, sehingga untuk penyimpanan sebaiknya pada suhu dingin, tanpa cahaya, dan tanpa pengaruh udara. Indikator ekstrak etanol ubi jalar ungu menunjukkan hasil analisis yang hamper sama pada titrasi asam basa dibandingkan dengan indikator fenolftalein pada titrasi asam kuat (HCl) dengan basa kuat (NaOH) dan titrasi asam lemah (CH3COOH) dengan basa kuat (NaOH). Dari data hasil pengamatan, ekstrak etanol ubi
jalar ungu dapat digunakan sebagai indikator dalam titrasi asam basa.
Kata kunci : ubi jalar ungu, Ipomoea batatas L., antosianin, zat warna, indicator, asam basa.
ABSTRACT
Purple sweet potato has a purple color due its contains anthocyanin pigment. Anthocyanins are pigment that are widespread in plants and include group of flavonoid. Some plants that contain anthocyanin pigments can be used to distinguish between acid and alkaline solutions. This study was conducted to examine the possible use of purple sweet potato’s pigment as a natural indicator in acid-base titration. Study include determine the best solvent for extraction, determine a range of pH, knowing the stability of extracts and the application in acid-base titration. Purple sweet potato extracted by stratifieds extraction method used n-hexane, ethyl acetate, ethanol 95% and distilled water. Liquid ethanol extract showed as the best to gives different colors in acid and alkali environment with range of pH 6.0 to 7.0 and give a color changes from pink to light green. Ethanol extract also showed as the most stabil than other extracts. Ethanol extract has good stability at low pH and storage better in a cold temperatures, without light, and without influence of air. Indicators of purple sweet potato ethanol extract showed a similar analytical results on acid-base titration compared with phenolphthalein indicator to the titration of strong acid (HCl) with strong base (NaOH) and the titration of weak acid (CH3COOH) with a strong base (NaOH). From the data of observation, the ethanol extract of purple sweet potato can be used as an indicator in acid-base titration. Keywords : purple sweet potato (Ipomoea batatas L.), anthocyanins, pigment extract,
2 1. Pendahuluan
Analisis titrimetri yaitu penentuan secara kuantitatif dengan mengukur volume, sejumlah zat yang diselidiki direaksikan dengan larutan baku (standar) yang kadar (konsentrasi)-nya telah diketahui secara teliti dan reaksinya berlangsung secara kuantitatif (Ibnu Gholib, 2009). Proses analisis dapat dilakukan dengan bantuan indikator yang berubah warna pada suasana yang berbeda. Salah satu titrimetri adalah titrasi asam basa yang dibagi menjadi dua yaitu asidimetri dan alkalimetri. Dalam penentuan asidi-alkalimetri, indikator yang digunakan harus dapat berubah warna dengan perubahan pH larutan.
Indikator yang selama ini banyak digunakan dan beredar luas di masyarakat adalah indikator kimia. Sementara indikator dari bahan alam masih jarang digunakan padahal sumber daya alam Indonesia begitu berlimpah dan memungkinkan terdapat beberapa yang dapat bertindak sebagai indicator dalam proses titrasi.
Ubi jalar ungu merupakan bahan pangan sumber energi dalam bentuk gula dan karbohidrat. Umbi ini mengandung vitamin dan mineral yang dibutuhkan oleh tubuh, seperti, kalsium, zat besi, vitamin A maupun C. Selain hal tersebut, ubi jalar ungu sangat banyak mengandung zat warna, terutama pigmen antosianin.
Antosianin merupakan senyawa yang paling penting dan tersebar luas dalam tanaman. Antosianin merupakan golongan flavonoid. Kandungan antosianin (zat warna pada tanaman) dari ubi jalar ungu ini berkisar antara 14,68 – 210 mg/100 gram bahan. Besar kandungan antosianin dalam ubi jalar ungu tergantung pada intensitas warna pada umbi tersebut. Semakin ungu warna umbinya, maka kandungan antosianinnya semakin tinggi. (Litbang Dep. Pertanian).
Antosianin terdapat dalam jumlah besar dalam ubi jalar ungu maka dari itu, ekstrak zat warna ubi jalar ungu akan diuji penggunaan dan pemanfaatannya sebagai indikator asam basa.
2. Tinjauan Pustaka 2.1.Antosianin
Ada beberapa jenis ubi jalar yang dikenal, yang paling umum adalah ubi jalar putih, ubi jalar merah, dan ubi jalar ungu. Ubi jalar putih mengandung 260 mg (869 SI) β-karoten per 100 g, ubi jalar yang berwarna kuning 2.900 mg (9.657 SI) β-β-karoten, ubi jalar ungu atau merah mengandung 9.900 mg (32.967 SI) β-karoten. Selain β-karoten,
3 ubi jalar ungu juga mengandung antosianin yang kadarnya dapat mencapai 110,15 mg/100g bahan. Kandungan kimia yang terdapat dalam ubi jalar ungu adalah antosianin sedangkan untuk ubi jalar kuning dan ubi Jepang terdapat senyawa lutein, zeaxantin, dan β-karoten yang merupakan pasangan antioksidan karotenoid. Keduanya merupakan pigmen warna berjenis klorofil, yang merupakan bahan pembentuk vitamin A. Lutein dan zeaxantin merupakan senyawa aktif yang memiliki peran penting dalam menghalangi proses perusakan sel.
Ubi jalar ungu mengandung zat warna yaitu antosianin. Antosianin adalah kelompok pigmen yang berwarna merah sampai biru yang tersebar dalam tanaman. Antosianin terdapat dalam sel epidermal dari buah, akar, dan daun pada buah tua dan masak (Eskin, 1979). Pada beberapa buah-buahan, sayuran, dan bunga memperlihatkan warna-warna yang menarik, antosianin termasuk komponen warna yang bersifat larut dalam air dan terdapat dalam cairan sel tumbuhan (Fennema, 1976).
Pigmen antosianin terdapat dalam cairan sel tumbuhan, senyawa ini berbentuk glikosida dan menimbulkan warna merah, biru, dan violet yang banyak terdapat pada buah dan sayur. Sebagian besar, antosianin mengalami perubahan selama penyimpanan dan pengolahan. (De Man, 1997). Beberapa studi mengatakan bahwa warna kuning, orange atau merah yang disebabkan oleh pigmen karotenoid ini terdapat dalam jumlah kecil (0,005-0,008% berat bahan segar) bersama-sama klorofil. Disamping itu, karotenoid terdapat pada jaringan yang tidak hijau sebagai kristal-kristal kecil dalam sitoplasma atau dalam membran yang membatasi kromoplas. Karotenoid yang terdapat pada bagian selain kloroplas dalam hal tertentu dapat terakumulasi sampai kurang lebih 0,1% berat bahan segar (Tranggono, 1990).
O
+O
H
OH
OH
3'
5'
4 Substitusi cincin pada struktur antosianin ditunjukkan pada tabel 1.
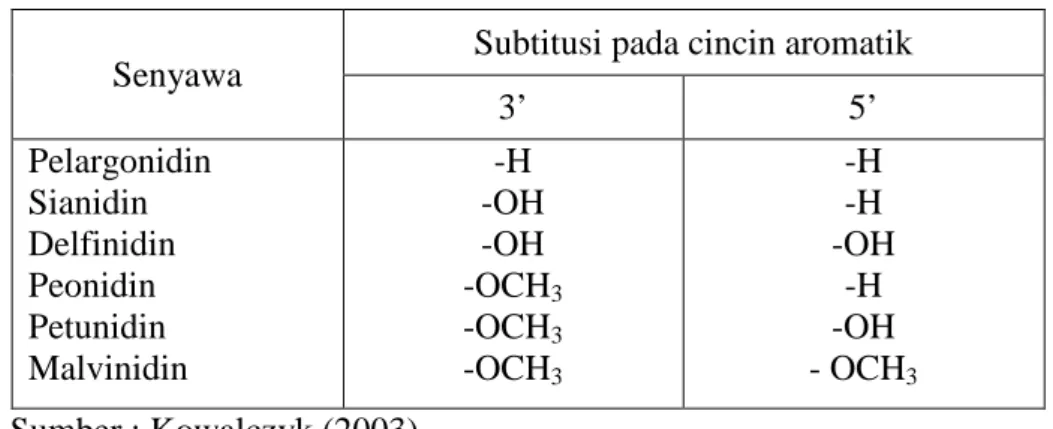
Tabel 1. Subtitusi Pada Cincin Aromatis Senyawa Antosianin
Senyawa Subtitusi pada cincin aromatik
3’ 5’ Pelargonidin Sianidin Delfinidin Peonidin Petunidin Malvinidin -H -OH -OH -OCH3 -OCH3 -OCH3 -H -H -OH -H -OH - OCH3 Sumber : Kowalczyk (2003)
Antosianin memiliki panjang gelombang maksimum antara 475-560 nm. Masing-masing jenis antosianin memiliki absorbansi maksimal berbeda –beda seperti contohnya antosianin yang memberikan warna merah yaitu jenis pelargonidin pada 520 nm, warna merah lembayung yaitu jenis sianidin pada 535 nm dan peonidin pada 532 nm, warna lembayung yaitu jenis delphidin pada 546 nm, petunidin pada 543 nm, dan malvidin pada 542 nm (Harborne, 1987).
2.2.Indikator Titrasi Volumetri
Indikator adalah suatu senyawa kimia yang ditambahkan dalam proses titrasi untuk membantu menetapkan titik akhir titrasi. Indikator akan berubah warna jika terdapat titrant berlebih. Perubahan warna ini idealnya terjadi tepat pada titik ekivalen atau sedekat mungkin dengan titik ekivalen.
Indikator asam-basa adalah senyawa organik yang warnanya dapat berubah dalam larutan sesuai dengan pH larutan. Contohnya adalah lakmus yang berwarna merah dalam larutan yang bersifat asam dan berwarna biru dalam larutan yang bersifat basa. Indikator asam-basa biasanya merupakan asam atau basa lemah, atau secara umum dapat dikatakan protolit lemah. Kesetimbangan asam-basa indikator yang berupa asam lemah dalam air dirumuskan sebagai berikut :
HIn + H2O ⇔ H3O+ + In
-warna warna
5 Berdasarkan senyawa yang menyusunnya, indikator asam - basa diklasifikasikan dalam 3 golongan yaitu :
a. Indikator Ftalein dan Indikator Sulfoftalein
Indikator ftalein dibuat dengan kondensasi anhidrida ftalein (anhidrida ftalat) dengan fenol yaitu terbentuk fenolftalein. Pada pH 8,0 – 9,8 berubah warnanya menjadi merah. Anggota-anggota lainnya ialah –Naftolftalein-o-cresolftalein, Thymolftalein. Indikator sulfoftalein dibuat dari kondensasi anhidrida ftalein dan sulfonat. Yang termasuk dalam kelas ini adalah Thymol blue, m-cresol purple, Chlorofenolred, Bromofenolred,
Bromofenolblue, Bromocresolred, dan sebagainya. b. Indikator Azo
Indikator azo diperoleh dari reaksi amina aromatik dengan garam diazonium, misalnya Methyl yellow atau p-dimetil amino azo benzene. Methyl Orange, methyl Red dan Tropaelino termasuk dalam golongan ini. Indikator azo menunjukkan kenaikan disosiasi bila temperatur naik. Proton ditarik dari ion amonium tersier meninggalkan suatu residu tak bermuatan.
c. Indikator Trifenilmetana
Indikator Trifenil metana seperti Malachite Green, Methyl violet dan Kristal violet merupakan indikator yang memiliki 3 gugus fenol yang dirangkai oleh gugus metana.
3. Metode Penelitian 3.1. Bahan dan Alat
Bahan tanaman yang digunakan adalah ubi jalar ungu yang diperoleh dari daerah Banjaran – Jawa Barat.
Bahan kimia yang digunakan adalah n-heksan, etil asetat, etanol 95%, larutan dapar pH 1-13, larutan dapar pH 6,1-6,9, aquadest, asam klorida, natrium klorida, natrium hidroksida, asam asetat, natrium tetraborat, fenoftalein, metil jingga.
Alat yang digunakan adalah timbangan analitik, maserator, tabung reaksi, gelas kimia, blender, botol coklat, batang pengaduk, buret, statip, klem, pipet volum, pipet tetes, erlenmeyer, spektrofotometer, dan cawan penguap.
6 3.2.Prosedur Penelitian
a. Analisis Pendahuluan
Ubi jalar ungu sebanyak 100 gram dihancurkan dan dilarutkan dalam aquadest kemudian ditambah larutan asam klorida (HCl 1 N) sampai pH 1, diaduk dan dimasukkan ke dalam corong pisah, ditambah kloroform sama banyak, kocok kuat dan keluarkan fasa air dan lakukan pengujian pada larutan asam dan basa. Kloroform yang tersisa ditambah larutan basa (NaOH 1 N), kocok kuat dan keluarkan fasa air dan lakukan pengujian pada larutan asam dan basa.
b. Ekstraksi Dengan Berbagai Pelarut
Ekstraksi ubi jalar ungu dilakukan dengan cara maserasi. Ubi jalar ungu ditimbang sebanyak 600 g dan diblender sampai hancur, lalu diekstrak menggunakan n-heksan dengan metode maserasi hingga diperoleh ekstrak n-heksan dan residu. Residu yang didapat diekstrak menggunakan etil asetat hingga diperoleh ekstrak etil asetat dan residu. Dilanjutkan dengan cara yang sama berturut-turut menggunakan pelarut etanol dan air. Masing-masing ekstrak yang didapat diuji pada larutan asam, netral, dan basa. Ekstrak dengan perubahan warna yang baik dipakai untuk pengujian selanjutnya.
c. Skrining Fitokimia Tanaman dan Ekstrak
Penapisan fitokimia dilakukan sesuai dengan cara MMI meliputi golongan alkaloid, fenolat, tanin, flavonoid, monoterpen dan seskuiterpen, steroid dan triterpenoid, kuinon, dan saponin.
d. Penentuan Trayek pH dengan Variasi pH
Larutan dapar pH 1-13 sebanyak 1 ml ditambahkan dengan beberapa tetes ekstrak ubi jalar ungu dalam tabung reaksi, diamati masing-masing warna yang terjadi.
e. Kestabilan, Batas Deteksi, dan Selektivitas Ekstrak Ubi Jalar Ungu
Ekstrak ubi jalar ungu diuji kestabilannya terhadap pH yang diamati secara visual, terhadap temperatur, cahaya, dan oksigen dengan mengukur absorbansinya pada panjang gelombang maksimum.
Pengaruh pH terhadap kestabilan warna ekstrak ubi ungu diuji berdasarkan pengujian trayek pH.
7 Pengaruh temperatur terhadap kestabilan warna ekstrak ubi ungu diuji dengan dua perlakuan yaitu pada suhu kamar (26-28oC) dan suhu dingin (0-8oC).
Pengaruh cahaya terhadap kestabilan warna ekstrak ubi ungu diuji dengan tiga perlakuan, yaitu tanpa cahaya, dengan pengaruh cahaya matahari, dengan pengaruh sinar lampu.
Pengaruh udara (oksigen) terhadap kestabilan warna ekstrak ubi ungu dilakukan diuji dengan dua perlakuan yaitu tanpa udara dan dengan pengaruh udara.
f. Batas Deteksi Ekstrak Ubi Ungu
Pengujian batas deteksi atau Limit of Detection (LOD) ekstrak ubi ungu dilakukan dengan mengencerkan ekstrak dengan perbandingan tertentu lalu diuji pada larutan dapar pH 1, 7, dan 13, pengenceran dilakukan sampai batas yang tidak memberikan perubahan warna lagi dengan pengamatan secara visual.
g. Selektivitas Ekstrak Ubi Ungu
Ekstrak ubi jalar ungu diuji selektivitasnya dengan menggunakan beberapa larutan obat yang mengandung gugus karboksilat seperti acetosal, asam benzoat, dan asam salisilat; gugus benzen, ikatan rangkap terkonjugasi, keton, seperti parasetamol; gugus amina seperti chlorpheniramini maleat; dan gugus sulfa seperti sulfanilamida, kemudian diamati perubahan warnanya
h. Aplikasi Indikator Dalam Titrasi Asam Basa Titrasi Asam Kuat dengan Basa Kuat
Titrasi larutan asam kuat (HCl) dengan basa kuat (NaOH) menggunakan indikator phenoftalein, dilakukan kembali hal yang sama menggunakan ekstrak ubi ungu sebagai indikator.
Titrasi Asam Lemah dengan Basa Kuat
Titrasi larutan asam lemah (CH3COOH) dengan basa kuat (NaOH) menggunakan indikator phenoftalein, dilakukan kembali hal yang sama menggunakan ekstrak ubi ungu sebagai indikator.
Titrasi Basa Lemah dengan Asam Kuat
Titrasi larutan basa lemah (Na2B4O7.10H2O) dengan asam kuat (HCl) menggunakan indikator metil jingga, dilakukan kembali hal yang sama menggunakan ekstrak ubi ungu sebagai indikator.
8 i. Analisis Data
Data hasil titrasi dianalisis dengan membandingkan akurasi dan presisi hasil titrasi antara penggunaan indikator fenofltalein dan metil jingga dengan ekstrak ubi jalar ungu.
4. Hasil dan Pembahasan 4.1.Analisis pendahuluan
Pada awal penelitian ini dilakukan ekstraksi cair-cair menggunakan kloroform. Fasa air yang diuji dalam larutan asam menghasilkan warna merah jambu muda. Fasa air yang diuji dalam larutan basa menghasilkan warna kuning keemasan. Hal ini menunjukkan bahwa zat warna ubi jalar ungu dapat digunakan sebagai indikator karena zat warnanya dapat larut dan memberikan perubahan warna dalam larutan asam maupun basa.
4.2.Ekstraksi dengan Berbagai Pelarut
Ekstraksi dengan berbagai pelarut dimulai dari pelarut non polar yaitu n-heksan, semi polar yaitu etil asetat, polar yaitu etanol 95%, dan paling polar yaitu aquadest. Ekstraksi bertingkat dilakukan dengan tujuan memisahkan zat-zat non polar, semi polar, dan polar. Ekstraksi dimulai dari pelarut non polar agar zat-zat non polar yang terkandung dalam ubi tidak ikut terekstraksi dalam pelarut yang polar. Ekstrak n-heksan dan etil asetat menghasilkan warna kuning keemasan. Ekstrak etanol menghasilkan warna ungu muda dan ekstrak aquadest menghasilkan warna ungu tua.
Ekstrak etanol ubi jalar ungu yang didapat sebanyak 700 ml, 25 ml ekstrak diuapkan dan diperoleh ekstrak kental sebanyak 0,5444 g / 25 ml ekstrak atau sama dengan 15,2432 g / 700 ml ekstrak, sehingga persentase rendemennya.
% rendemen berat ekstrak
berat simplisiax 100 %
% rendemen = 15,2432 g
600 g x 100%
2,54 %
Rendemen ubi jalar ungu sebesar 2,54 %.
Ekstrak n-heksan dan etil asetat tidak dapat bercampur dengan larutan uji (HCl 0,1 N, NaCl 0,1 N, dan NaOH 0,1 N) karena larutan uji bersifat polar sehingga ekstrak tersebut tidak dapat digunakan sebagai indikator asam basa, tetapi pengujian tersebut
9 tetap dilakukan karena tidak semua zat warna bersifat polar. Ekstrak etanol dan aquadest menghasilkan warna berbeda ketika diuji pada larutan asam, netral, dan basa, yaitu merah jambu pada larutan asam, hijau muda pada larutan netral, dan kuning pada larutan basa. Ekstrak aquadest tidak digunakan pada pengujian selanjutnya karena mudah ditumbuhi jamur.
4.3.Skrining Fitokimia Tanaman dan Ekstrak
Hasil skrining fitokimia simplisia dan ekstrak menunjukkan bahwa ubi jalar ungu mengandung fenolat, flavonoid, kuinon, dan saponin. Zat warna ubi jalar ungu yang berperan sebagai indikator termasuk dalam golongan flavonoid yaitu antosianin.
4.4.Penentuan Trayek pH dengan Variasi pH
Penentuan trayek pH Indikator dilakukan dengan rentang satu satuan pH menghasilkan perubahan warna yang signifikan dengan pengamatan secara visual. Ekstrak etanol ubi jalar ungu dalam larutan dapar pH 1-6 berwarna merah jambu dengan kepekatan warna yang berbeda, pH semakin kecil warna merah jambu semakin tua. Pada pH 7-10 berwarna hijau muda dengan kepekatan warna yang berbeda, pH lebih kecil warna hijau muda semakin pudar. Pada pH 11-12 menghasilkan warna hijau kekuningan, pH lebih besar warna kuning semakin jelas dan menjadi kuning pada pH 13 seperti telihat pada tabel 2.
Trayek pH ekstrak etanol ubi jalar ungu adalah 6,0-7,0 dengan perubahan warna merah jambu menjadi hijau muda. Pengujian trayek pH dilakukan kembali antara pH 6,0-7,0 dengan rentang 0,1 satuan pH. Pengamatan secara visual ekstrak etanol ubi jalar ungu menghasilkan warna merah jambu pada pH 6,1-6,9, semakin besar pH warna merah jambu semakin pudar dan menjadi hijau muda pada pH 7,0 seperti terlihat pada tabel 3.
Ekstrak etanol ubi jalar ungu dapat digunakan sebagai indikator alami titrasi asam basa karena didasarkan pada perubahan warna di setiap perubahan pH. Pada pH yang lebih rendah menghasilkan warna merah jambu dan pH yang lebih tinggi menghasilkan warna hijau muda, hijau kekuningan hingga kuning.
10 Tabel 2. Perubahan warna ekstrak ubi jalar ungu dalam larutan dapar pH 1-13
Larutan Dapar Pengamatan Warna Secara Visual pH 1 pH 2 pH 3 pH 4 pH 5 pH 6 pH 7 pH 8 pH 9 pH 10 pH 11 pH 12 pH 13 Merah jambu +++ Merah jambu +++ Merah jambu +++ Merah jambu ++ Merah jambu + Merah jambu + Hijau muda + Hijau muda ++ Hijau muda +++ Hijau muda +++ Hijau kekuningan + Hijau kekuningan ++ Kuning +++
Tabel 3. Perubahan warna ekstrak ubi jalar ungu dalam larutan dapar pH 6,1-7,0 Larutan Dapar Pengamatan Warna Secara Visual
pH 6,1 pH 6,2 pH 6,3 pH 6,4 pH 6,5 pH 6,6 pH 6,7 pH 6,8 pH 6,9 pH 7,0 Merah jambu +++ Merah jambu +++ Merah jambu +++ Merah jambu +++ Merah jambu ++ Merah jambu ++ Merah jambu ++ Merah jambu ++ Merah jambu + Hijau muda + + : menunjukkan kepekatan warna
4.5.Kestabilan, Batas Deteksi, dan Selektivitas Ekstrak Ubi Jalar Ungu
Ekstrak aquadest ditumbuhi jamur pada suhu kamar maupun suhu dingin dalam waktu ± 3 hari, ini menunjukkan ekstrak aquadest tidak stabil. Aquadest dan ubi merupakan media pertumbuhan bakteri yang baik.
Ekstrak etanol ubi jalar ungu diuji kestabilannya terhadap pH yang diamati secara visual dan terhadap temperatur, cahaya dan oksigen dengan mengukur absorbansinya pada panjang gelombang maksimum. Ekstrak etanol ubi jalar ungu lebih stabil pada pH rendah. Kestabilan ekstrak terhadap suhu, cahaya, dan udara diukur secara kuantitatif dengan alat spektrofotometer. Hasil pengukuran panjang gelombang maksimum ekstrak etanol ubi jalar ungu adalah 532 nanometer, hasil tersebut sesuai dengan panjang gelombang maksimum antosianin yaitu antara 475-560 nm (Harborne, 1987).
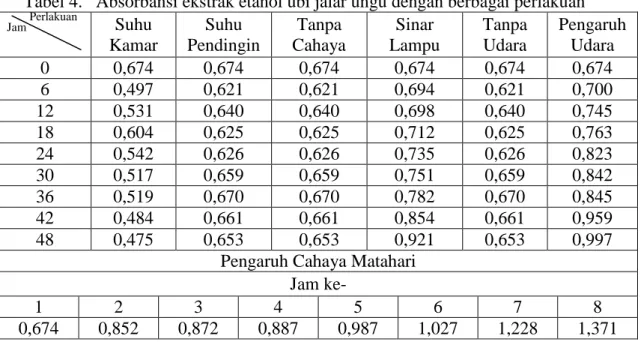
11 Kestastabilan ekstrak dilihat dari nilai absorbansi yang diukur pada panjang gelombang maksimum pada waktu tertentu seperti terlihat pada tabel 3.
Kestabilan yang lebih baik ditunjukkan dengan nilai absorbansi yang lebih stabil pada pengukuran dalam waktu tertentu. Penyimpanan pada suhu dingin menunjukkan kestabilan lebih tinggi daripada suhu kamar. Penyimpanan tanpa pengaruh cahaya menunjukkan kestabilan lebih tinggi daripada dengan pengaruh cahaya lampu dan cahaya matahari. Penyimpanan tanpa pengaruh udara menunjukkan kestabilan lebih tinggi daripada dengan pengaruh udara.
Ekstrak etanol ubi jalar ungu cenderung stabil pada pH asam, suhu pendingin, tanpa cahaya, dan tanpa pengaruh udara.
Ekstrak etanol ubi ungu yang diencerkan dengan perbandingan 1: 100 hampir tidak memberikan perubahan warna pada larutan dapar pH 1, 7 dan 13 tetapi masih dapat dideteksi secara visual. Pada pengenceran ekstrak 1 : 105, perubahan warna pada pH 1, 7, dan 13 sudah tidak dapat dideteksi secara visual. Batas deteksi ekstrak etanol ubi ungu adalah 1 : 100 yang setara dengan 857, 14 mg ubi ungu dalam 100 ml air.
Ekstrak etanol ubi ungu diuji pada beberapa obat yang mengandung gugus-gugus tertentu. Ekstrak etanol menghasilkan perubahan warna sesuai dengan pH obat tersebut. Perubahan warna antosianin tidak dipengaruhi oleh gugus-gugus tertentu tetapi hanya
dipengaruhi oleh perubahan pH.
Tabel 4. Absorbansi ekstrak etanol ubi jalar ungu dengan berbagai perlakuan Jam Perlakuan Suhu
Kamar Suhu Pendingin Tanpa Cahaya Sinar Lampu Tanpa Udara Pengaruh Udara 0 0,674 0,674 0,674 0,674 0,674 0,674 6 0,497 0,621 0,621 0,694 0,621 0,700 12 0,531 0,640 0,640 0,698 0,640 0,745 18 0,604 0,625 0,625 0,712 0,625 0,763 24 0,542 0,626 0,626 0,735 0,626 0,823 30 0,517 0,659 0,659 0,751 0,659 0,842 36 0,519 0,670 0,670 0,782 0,670 0,845 42 0,484 0,661 0,661 0,854 0,661 0,959 48 0,475 0,653 0,653 0,921 0,653 0,997
Pengaruh Cahaya Matahari Jam ke-
1 2 3 4 5 6 7 8
12 4.6. Aplikasi Indikator Dalam Titrasi Asam Basa
Pengujian pada masing-masing titrasi dilakukan menggunakan tiga tetes ekstrak yang dibuat dari 600 g ubi / 700 ml ekstrak yang setara dengan 128,6 mg ubi / 3 tetes. Indikator fenolftalein dibuat dengan melarutkan 1 g zat dalam 100 ml etanol (FI IV) yang setara dengan 1,5 mg zat / 3 tetes. Indikator metil jingga dibuat dengan melarutkan 100 mg zat dalam 100 ml air (FI IV) yang setara dengan 0,15 mg zat / 3 tetes.
Titrasi asam kuat dengan basa kuat dan asam lemah dengan basa kuat dengan larutan asam sebagai sampel mengalami perubahan warna dari warna merah jambu menjadi hijau muda, sebaliknya titrasi basa lemah dengan asam kuat dengan larutan basa lemah sebagai sampel mengalami perubahan warna dari hijau muda menjadi merah jambu.
Titrasi asam kuat dengan basa kuat dan asam lemah dengan basa kuat menggunakan indikator ekstrak ubi ungu menunjukkan rata-rata kadar yang hampir sama dengan titrasi menggunakan indikator fenolftalein seperti terlihat tabel 5 dan tabel 6. Perubahan warna indikator phenoftlaein selama titrasi adalah dari tidak berwarna menjadi merah jambu dengan trayek pH 8,3-10,0, sedangkan ekstrak ubi jalar ungu mengalami perubahan warna dari merah muda menjadi hijau muda.
Titrasi basa lemah dengan asam kuat menggunakan indikator ekstrak ubi ungu menunjukkan rata-rata kadar cukup jauh berbeda dibanding menggunakan indikator metil jingga seperti terlihat pada dan tabel 7. Perubahan warna indikator metil jingga selama titrasi adalah dari jingga menjadi merah dengan trayek pH 3,1-4,4, sedangkan ekstrak ubi jalar ungu mengalami perubahan warna dari hijau muda menjadi merah muda pada. Ekstrak ubi jalar ungu dapat diaplikasikan dalam titrasi asam kuat dengan basa kuat dan asam lemah dengan basa kuat.
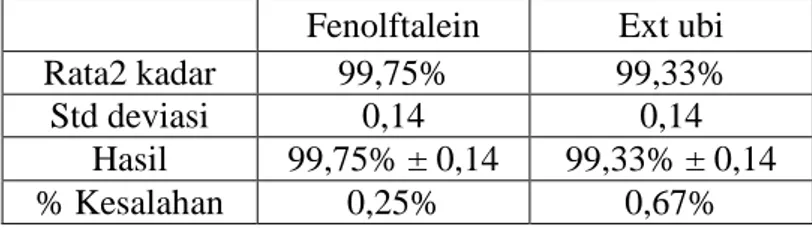
Tabel 5. Rangkuman hasil titrasi asam kuat dengan basa kuat Fenolftalein Ext ubi
Rata2 kadar 99,75% 99,33%
Std deviasi 0,14 0,14
Hasil 99,75% ± 0,14 99,33% ± 0,14
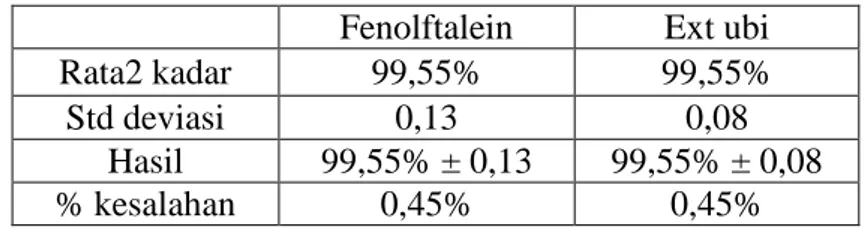
13 Tabel 6. Rangkuman hasil titrasi asam lemah dengan basa kuat
Fenolftalein Ext ubi
Rata2 kadar 99,55% 99,55%
Std deviasi 0,13 0,08
Hasil 99,55% ± 0,13 99,55% ± 0,08
% kesalahan 0,45% 0,45%
Tabel 7. Rangkuman hasil titrasi basa lemah dengan asam kuat
Metil Jingga Ext ubi
Rata2 kadar 100,63% 91,4 %
Std deviasi 0,13 0,21
Hasil 100,63% ± 0,13 91,49% ± 0,21
% Kesalahan 0,63% 8,51%
4.7.Analisis Data
Hasil perhitungan kadar sampel dalam titrasi asam kuat dengan basa kuat adalah 99,75% ± 0,14 untuk fenolftalein dengan persentase kesalahan 0,25% dan 99,33% ± 0,14 untuk ekstrak ubi ungu dengan persentase kesalahan 0,67%. Perbedaan persentase kesalahan ekstrak ubi ungu dibandingkan dengan indikator fenofltalein adalah sebesar 0,43% dan standar deviasi yang sama dengan dengan fenofltalein yaitu 0,14 seperti terlihat pada tabel 4.
Hasil perhitungan kadar sampel dalam titrasi asam lemah dengan basa kuat adalah 99,55% ± 0,13 untuk fenolftalein dengan persentase kesalahan 0,45% dan 99,55% ± 0,08 untuk ekstrak ubi ungu dengan persentase kesalahan 0,45%. Standar deviasi ekstrak ubi lebih kecil dari fenofltalein yaitu 0,08 seperti terlihat pada tabel 5.
Hasil perhitungan kadar sampel dalam titrasi basa lemah dengan asam kuat adalah 100,63% ± 0,13 untuk metil jingga dengan persentase kesalahan 0,63% dan 91,49% ± 0,21 untuk ekstrak ubi ungu. Syarat persentase natrii tetraborat adalah antara 95-105% (FI IV). Titrasi dengan menggunakan indikator metil jingga memenuhi persyaratan tersebut, sedangkan dengan indikator ekstrak ubi ungu tidak memenuhi syarat. Persentase kesalahan ekstrak ubi ungu adalah sebesar 8,51% dengan standar deviasi ekstrak lebih besar dari metil jingga yaitu 0,21 seperti terlihat pada tabel 6.
Salah satu syarat indikator asam basa yang baik adalah memberikan warna yang berbeda pada lingkungan pH yang lebih rendah atau lebih tinggi dimana perubahan warna tidak tejadi sekaligus tetapi berjalan dalam suatu interval pH tertentu dan
14 memiliki kestabilan selama penyimpanan (Basset, J., 1994). Dari penelitian yang telah dilakukan menunjukkan ekstrak etanol ubi jalar ungu dapat digunakan sebagai indikator alami dalam titrasi asam basa.
5. Simpulan
Dari hasil penelitian ini diperoleh data bahwa ekstrak etanol ubi jalar ungu memberikan perubahan warna yang signifikan pada kondisi pH berbeda yaitu merah jambu pada pH 1-6, hijau muda pada pH 7-10, hijau kekuningan pada pH 11-12, dan kuning pada pH 13. Pada pH 6,0-7,0 dengan rentang 0,1 satuan pH menghasilkan warna merah jambu muda pada pH 6,0-6,9 dan hijau muda pada pH 7,0. Trayek pH ekstrak etanol ubi jalar ungu adalah 6,0-7,0.
Pada uji kestabilan ekstrak terhadap pH, cahaya, temperatur, dan udara didapat data bahwa ekstrak etanol ubi jalar ungu cenderung stabil dengan kondisi penyimpanan pada pH rendah, kondisi suhu dingin, tanpa cahaya, dan tanpa pengaruh udara. Hasil uji selektivitas menunjukkan ekstrak etanol ubi ungu hanya berubah warna dengan adanya perubahan pH dan perubahan warna tidak dipengaruhi oleh gugus-gugus tertentu. Batas deteksi ekstrak ubi ungu adalah 1:100 yang setara dengan 857, 14 mg ubi ungu dalam 100 ml air.
Pada titrasi asam kuat dengan basa kuat menggunakan indikator fenolftalein diperoleh kadar sampel 99,75%, persentase kesalahan 0,25%, dan standar deviasi 0,14, dengan menggunakan indikator ekstrak etanol ubi ungu diperoleh kadar sampel 99,33%, persentase kesalahan 0,67%, dan standar deviasi 0,14. Pada titrasi asam lemah dengan basa kuat diperoleh kadar yang sama yaitu 99,55%, persentase kesalahan 0,45%. Standar deviasi indikator fenolftalein 0,13, indikator ekstrak etanol ubi ungu 0,08. Pada titrasi basa lemah dengan asam kuat menggunakan indikator metil jingga diperoleh kadar sampel 100,63%, persentase kesalahan 0,63%, dan standar deviasi 0,13, dengan menggunakan indikator ekstrak etanol ubi ungu diperoleh kadar sampel 91,49%, persentase kesalahan 8,51%, dan standar deviasi 0,21.
Dari hasil penelitian ini menunjukkan bahwa ekstrak etanol ubi jalar ungu dapat digunakan sebagai indikator asam basa pada titrasi asam kuat dengan basa kuat dan asam lemah dengan basa kuat.
15 6. Daftar Pustaka
Antarlina, S.S. 1991. Pengaruh Umur Panen dan Klon Terhadap Beberapa Sifat Sensoris, Fisik dan Kimiawi Tepung Ubi Jalar. Tesis. Fakultas Pasca Sarjana. Universitas Gadjah Mada, Yogyakarta.
Basset, J., et al. 1994. Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik, Penerjemah Hadyana P. Penerbit Buku Kedokteran EGC, Jakarta.
Cabrita L. 1999. Analysis and Stability of Anthocianins. Dissertation. University of Bergen. Department of Chemistry, Bergen.
Day, RA dan Underwood. 1999. Analisis Kimia kuantitatif. Penerjemah Pujaatmaka, A.H. Edisi Kelima. Erlangga, Jakarta.
De Man, J. M. 1989. Principle of Food Chemistry, Penerjemah Kosasih. Van Norstand Reinhold. A Division of Wadswort., Inc., New York.
Departemen Kesehatan Republik Indonesia. 1979. Materia Medika Indonesia, Jilid III, Jakarta.
Duell BR. 1992. Consumption and utilization of sweet potato in Japan. In: Sweet potato cultures of Asia and South
Pacific, Proc.2nd UPWARD Int. Conference: Pp.469- 475. User'as Perspective with AgriculSural Researchy and Developemnt (UPWARD). CIP. Los Banos. Philippines
Eskin, N. A. M. 1979. Plant Pigments, Flavors and Tekstures. The Chemistry and Biochemistry of Selected Compounds. Academic Press, London.
Fennema, O. R. 1996. Food Chemistry. Marcel Dekker, inc, New York.
Harborne, J.B., 1987, Metode Fitokimia, Penerjemah Kosasih dan Iwang. Penerbit ITB, Bandung.
Harijadi, W. 1990. Ilmu Kimia Analitik Dasar. Penerbit Gramedia, Jakarta.
Ibnu Gholib Gandjar dan Abdul Rohman. 2009. Kimia Farmasi Analisis. Pustaka Pelajar, Yogyakarta.
Juanda D dan Cahyono. 2000. Ubi Jalar, Budidaya Dan Analisis Usaha Tani, Penerbit Kanisius, Yogyakarta.
Kowalczyk, Edward. 2003. Anthocyanins in Medicine. Department of Human Physiology and Biophysics, Medical University in Lodz, Hallera I, Iodz Poland. Rivai, H. 1995. Asas Pemeriksaan Kimia. UI-Press, Jakarta.
Tranggono. 1990. Kimia, Nutrisi dan Makanan. PAU Pangan dan Gizi. UGM-Press, Yogyakarta.
16 Voigt, R. 1995. Buku Pelajaran Teknologi Farmasi, edisi ke-5. UGM Press, Yogyakarta.