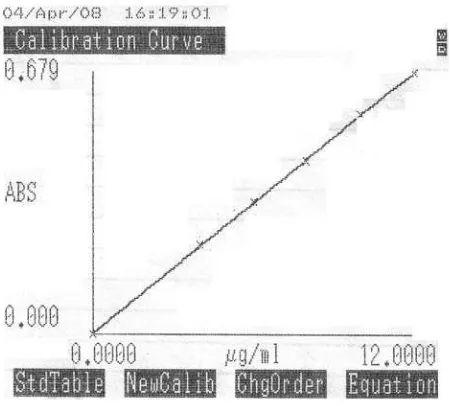
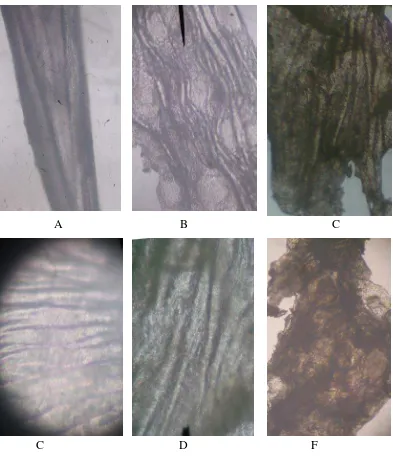
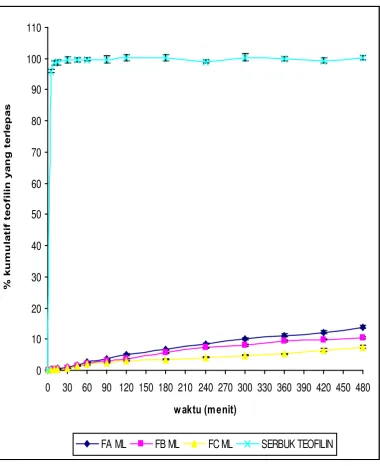
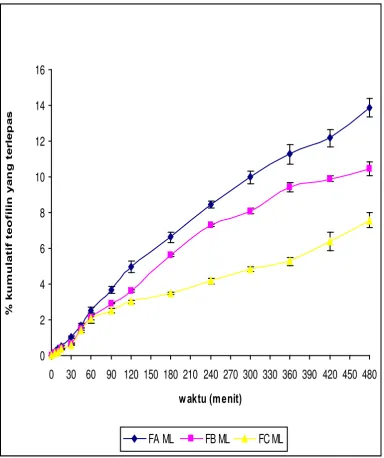
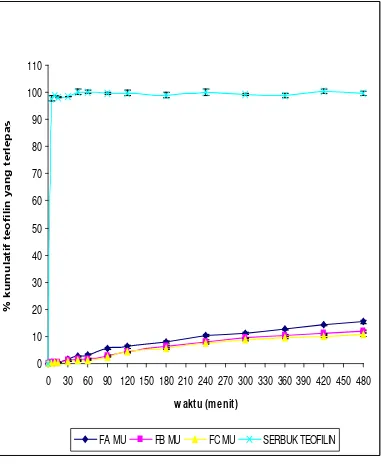
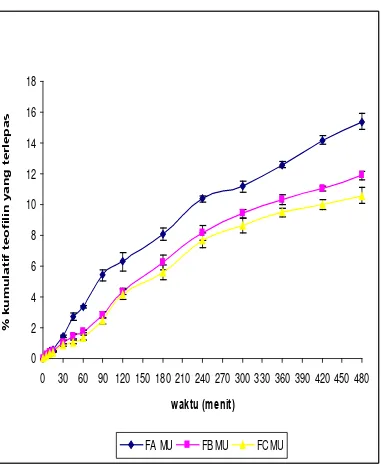
Uji Pelepasan Teofilin Dari Membran Nata De Coco Yang Dipanen Dengan Waktu Yang Berbeda Dengan Menggunakan Sistem Penyampaian Obat Secara Terapung
Teks penuh
Gambar
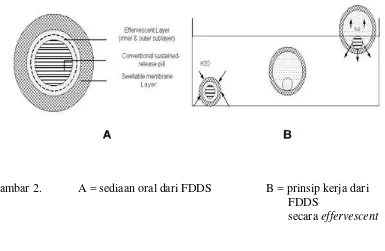
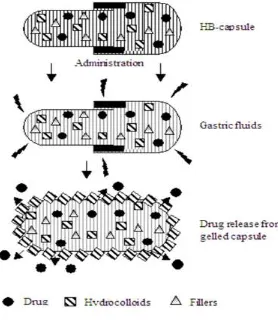
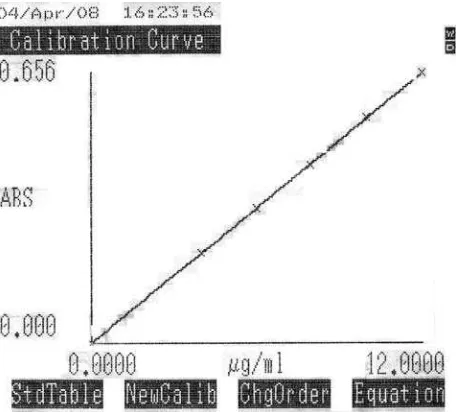
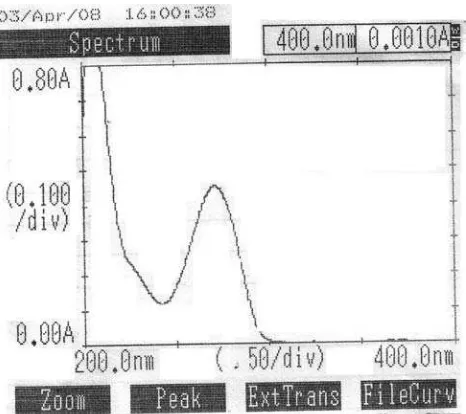
Dokumen terkait
Positioning yang ingin dicapai dari usaha VeeOwnism Arte ini adalah sebagai penyedia barang yang unik untuk dapat diberikan sebagai hadiah dan tidak dimiliki oleh
Oleh karena itu, perancangan interior Wedding House ini akan menyediakan seluruh kebutuhan pesta pernikahan mulai dari undangan, souvenir, dekorasi, wedding cake,
mendapat perhatian di rumahnya, karena ia hanya tinggal bersama neneknya.. Kondisi ini sangat berpengaruh pada kegiatan belajarnya. Dapat terlihat dari nilai yang
Rancangan Karya Inovasi Pembelajaran Proses suatu pembelajaran dibutuhkan media untuk lebih mudah diterima oleh peserta didik dalam memahami materi pembelajaran. Dalam
Variabel bebas berfungsi untuk mengetahui pengaruhnya terhadap variabel lain, variabel tergantung berfungsi untuk mengetahui pengaruh dari variabel bebas,
Laporan hasil pengujian dituangkan dalam formulir ”Hasil Pengujian Ukuran dan Gramatur Arsip Kertas Dalam Bentuk Lembaran seperti contoh berikut:..
Kondisi oklusi gigi geligi juga harus dievaluasi (Nazruddin, 2002). Beberapa otot-otot penting sistem pengunyahan dapat dipalpasi untuk mengetahui adanya rasa sakit dan
Bagaimana peran program pelatihan (training), Keselamatan dan Kesehatan Kerja, dan Total Quality Control dalam meningkatkan kualitas produk di PT..